Термическое разложение соединений — Справочник химика 21
К реакциям внутримолекулярного окисления — восстановления относятся процессы, при которых степени окисления изменяют разные элементы одной и той же молекулы. По механизму внутримолекулярного окисления — восстановлен ня протекают, в частности, реакции термического разложения соединений, например [c.248]Реакции окислительно-восстановительного распада веществ, при которых степени окисления изменяют атомы разных элементов одного и того же вещества. По такому механизму протекают реакции термического разложения соединений, например [c.218]
Классификация катализаторов. Основными технологическими операциями в производстве гетерогенных катализаторов различных типов являются осаждение, пропитка, фильтрация, промывка осадка, сушка, прокалка, формовка. Наиболее распространены из них две 1) осаждение активной части катализатора в виде кристаллического осадка или геля при взаимодействии водных растворов двух или нескольких химических соединений 2) пропитка каталитически неактивного твердого вещества — носителя — раствором (обычно водным) активных соединений.
Термическое разложение соединений используют для получения особо чистых простых веществ. Часто применяют так называемый иодидный метод очистки металлов. [c.195]
Окислительно-восстановительные процессы можно осуществлять либо химическим, либо электрохимическим способом, а также термическим разложением соединений. [c.242]
Окисление — восстановление осуществляется при термическом разложении соединений [c.243]
В химических печах осуществляются следующие типы химических реакций термическое разложение, соединение, обменные, окислительно-восстановительные реакции. [c.18] Внутримолекулярное окисление — восстановление осуществляется при термическом разложении соединений [c. 266]
266]
На получении и последующем термическом разложении соединений основана очистка простых веществ. Часто применяемым способом очистки металлов (главным образом -элементов) до очень высокой [c.266]
Термическое разложение соединений [c.585]
Для идентификации высокомолекулярных соединений применяют реакции термического разложения соединений (300—1000°С) без доступа воздуха в инертной среде — пиролиз. Пиролитическая газовая хроматография широко применяется для идентификации нелетучих и неустойчивых соединений. Идентификацию проводят путем сравнения хроматограмм пиролиза исследуемых соединений (пирограмм) с соответствующими пирограммами эталонных веществ.
Под температурой разложения условно подразумевается такая температура, при которой термическое разложение соединения протекает с заметной скоростью. [c.13]
Уголь —черное вещество, содержащее углерод в виде измельченного графита. Уголь образуется при термическом разложении соединений, содержащих углерод. Например, при термической обработке без доступа воздуха природного каменного угля образуется кокс — разновидность угля. Массовая доля углерода в коксе составляет 96—98 % При нагревании древесины в условиях недостатка кислорода получается древесный уголь. [c.169]
Уголь образуется при термическом разложении соединений, содержащих углерод. Например, при термической обработке без доступа воздуха природного каменного угля образуется кокс — разновидность угля. Массовая доля углерода в коксе составляет 96—98 % При нагревании древесины в условиях недостатка кислорода получается древесный уголь. [c.169]
Металлы наиболее часто получают восстановлением их оксидов, поэтому многие соединения металлов на стадии переработки руд переводят в оксидный концентрат путем обжига. При обжиге происходит окисление или термическое разложение соединений металлов, например [c.192]
ЭГз — термическое разложение соединений Э (V) с галогенами [c.329]
Частицы малых размеров могут быть получены либо измельчением вещества, либо объединением очень мелких частиц (атомов, молекул и др.). Как показывает опыт, путем механического измельчения не удается уменьшить средний размер частиц ниже 0,01 мкм. Более высокодисперсные частицы удается получить методом термического разложения соединения или химического восстановления соединения. В качестве восстановителя используются водород, боргидриды металлов, формальдегид, гидразин и другие. Удельная площадь поверхности частиц, полученных этим методом, колеблется в широких пределах, от 10 до 10 м /г [10]. Более высокую степень дисперсности удается достичь при восстановлении оксидов металлов.
В качестве восстановителя используются водород, боргидриды металлов, формальдегид, гидразин и другие. Удельная площадь поверхности частиц, полученных этим методом, колеблется в широких пределах, от 10 до 10 м /г [10]. Более высокую степень дисперсности удается достичь при восстановлении оксидов металлов.
В технике калий получают натрийтермическим методом из расплав- ленного гидроксида или хлорида, рубидий и цезий — методами метал-лоте 1МИИ и термическим разложением соединений. Калий и его ана- [c.491]
Поскольку актиноиды химически высоко активны, их получают электролизом расплавленных соединений, металлотермически, а также термическим разложением соединений прн высоком вакууме и высокой температуре. Так, и и ТН выделяют электролизом их расплавленных комплексных фторидов (обычно КЭР ) ТЬ, Мр, Ри, Ат, Ст — восстановлением фторидов парами бария или натрия [c.650]
Получение простых веществ термическим разложением соединений. Как видно из рисунка 101, при незначительном повышении температуры меняется знак значения энергии Гиббса образования оксидов ртути НдО и серебра АкаО при низких температурах ДО имеет отрицательное значение, а при высоких — положительное. Следовательно, эти оксиды уже при незначительном нагревании распадаются на простые вещества
[c.195]
Как видно из рисунка 101, при незначительном повышении температуры меняется знак значения энергии Гиббса образования оксидов ртути НдО и серебра АкаО при низких температурах ДО имеет отрицательное значение, а при высоких — положительное. Следовательно, эти оксиды уже при незначительном нагревании распадаются на простые вещества
[c.195]
Опыт 7, Получение оксида кадмия термическим разложением соединений (ТЯГА ). Несколько кристаллов Сб(ЫОз)2 или СбСОз прокалите в фарфоровом тигле в пламени паяльной горелки до прекращения выделения газа. [c.171]
В промышленности азот получают фракционированной перегонкой жидкого воздуха, в лаборатории — термическим разложением соединений, чаще всего Nh5NO2 [c.390]
В технике калий получают натрийтермическим методом из расплавленного гидроксида или хлорида, рубидий и цезий — методами металлотермии и термическим разложением соединений. Калий и его аналоги хранят в запаянных сосудах. Калий, кроме того, можно сохранять в керосине.
Калий, кроме того, можно сохранять в керосине.
Укажите Ч хя ги5мы, с помощью которых можно объяснить образование каждого продуктов, образующихся прн термическом разложения соединения (18) [c.501]
Возможно и другое объяснение. Известно об удержании остаточной воды в соединениях (формиатах, гидроксидах, карбонатах, оксалатах), выделенных в негидратной форме из водных растворов или полученных термическим разложением синтезированных гидратов [6, 88]. Эта остаточная вода не удаляется при температурах ниже температуры разложения соединения. Микропримеси воды (порядка долей процента и меньше) могут существовать в виде молекул или ионов типа ОН , НдО», (Н20) -Нд0 и играют исключительно важную роль в процессах термического разложения соединений, считающихся безводными [7]. [c.40]
Влияние удаления от положения равновесия. Известно, что при термическом разложении соединений процесс может идти не через равновесные фазы, а через кинетически заторможенные промежуточные (правило ступеней Оствальда [43, 44, 99]).
При термическом разложении соединения (2.396, Е = СМ) обра- зуется 2-метильный аналог изоиндолиден-1-малонодинитрила (2.394, К = СМ). Реакцию бромидов (2.389), (2.392) и (2.395) с азид-ионом можно объяснить как внутримолекулярное [2 + 3]-циклоприсоеди-. нение у промежуточных продуктов типа (2.390). Роль 1,2-диполя здесь выполняет поляризованная двойная связь [423].
Урок по химии «Окислительно-восстановительные реакции»
« Кто-то теряет, а кто-то находит…»
«Чтобы что-то узнать, нужно уже что-то знать“ Станислав Лем
Классификация химических реакций Химические реакции По числу исходных и конечных в-в По направлению По использо- ванию катализатора По агрегатному состоянию в-в По тепловому эффекту Реакции соединения Реакции разложения Реакции замещения Реакции обмена Обратимые Необратимые Катали- тические Некатали- тические Гомогенные Гетерогенные Экзо- термические Эндо- термические
Дайте характеристику реакциям по всем известным признакам классификации.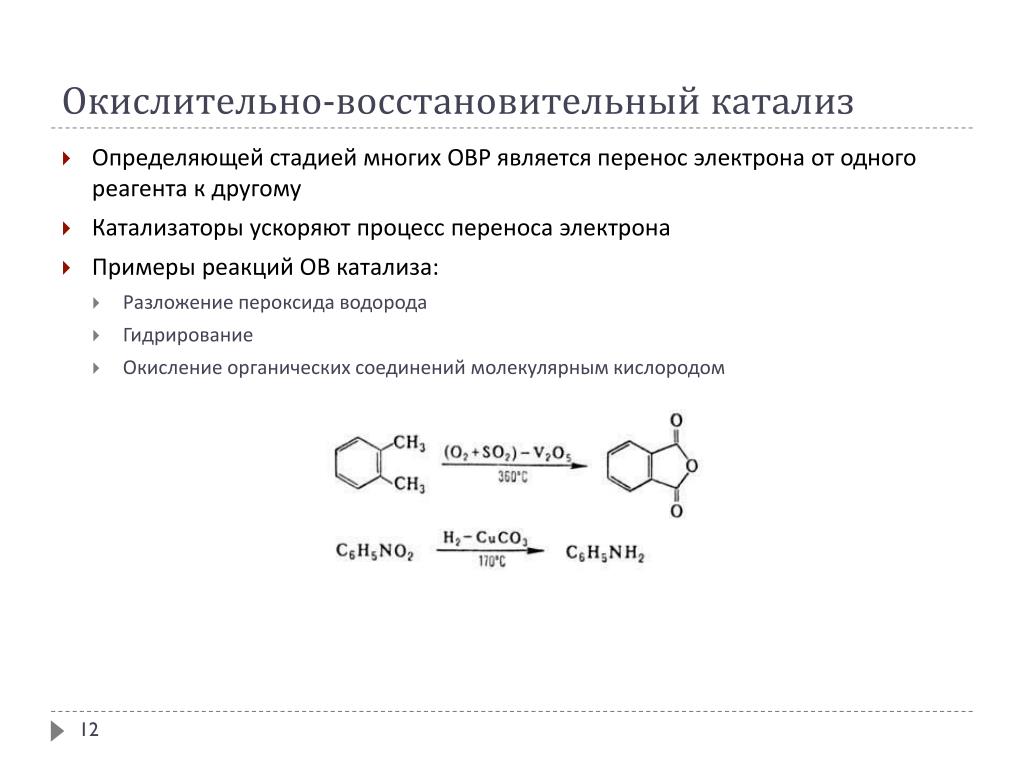
Тема урока: «Окислительно-восстановительные реакции»
Определите степень окисления элементов в веществах, формулы которых: HNO3, Mg(NO3)2, Zn, h3SO4, Br2, h4PO4, Cu2O, O3, NaNO2, КMnO4
Лабораторный опыт Проведите реакции между раствором сульфата меди (II) и: раствором гидроксида натрия, железной кнопкой. Укажите признаки химических реакций, запишите молекулярные уравнения и определите степень окисления каждого элемента.
Классификация химических реакций Химические реакции По числу исходных и конечных в-в По направлению По использо- ванию катализатора По фазовому составу По тепловому эффекту Реакции соединения Реакции разложения Реакции замещения Реакции обмена Обратимые Необратимые Катали- тические Некатали- тические Гомогенные Гетерогенные Экзо- термические Эндо- термические По изменению СО атомов элементов ОВР Без изменения СО
ОВР – это такие реакции, при которых
происходит изменение СО элементов. Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями.
«Окислитель как отъявленный злодей, Как пират, бандит, агрессор, Бармалей, Отнимает электроны — и ОК! Потерпев урон, восстановитель Восклицает: «Вот я, помогите! Электроны мне мои верните!»… Но никто не помогает и ущерб Не возмещает…» Запомните! Отдать электроны – окислиться, взять электроны – восстановиться
Какие из приведенных схем уравнений можно отнести к ОВР? Определите типы реакций. 1) СаСО3 → СаО + СО2 2) 2KMnO4 → K2MnО4 + MnО2 + О2↑ 3) N2 + 3Н2 → 2NН3 4) N2O5 + h3O → 2HNO3 5) Mg + 2HCl → MgCl2 + h3↑ 6) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl 7) 2CuS + 3О2 → 2СuО + 2SО2↑
Вывод:
К окислительно-восстановительным реакциям относятся:
все реакции замещения;
только те реакции соединения и разложения,
в которых участвует хотя бы одно простое
вещество;
реакции горения. Все реакции ионного обмена не будут являться окислительно-восстановительными!
Все реакции ионного обмена не будут являться окислительно-восстановительными!
Многообразие окислительно-восстановительных реакций
Тестовое задание Задание № 1. I вариант К ОВР не относится реакция, представленная схемой: А) N2 + 3Н2 → 2NН3 Б) Mg + 2HCl → MgCl2 + h3↑ В) MgCO3 → MgO + CO2 ↑ Г) 2CuO → 2Cu + O2↑ Задание № 1. II вариант К ОВР относится реакция, представленная схемой: А) h3O + CaO → Ca(OH)2 Б) h3O + N2O5 → 2HNO3 В) Na2CO3 +2HCl →2NaCl+ h3O+CO2 Г) CuO + h3 → Cu + h3O
Тестовое задание Задание № 2. I вариант В каком соединении степени окисления элементов равны -3 и +1 А) NF3 Б) Cl2O3 В) Nh4 Г) AlCl3 Задание № 2. II вариант В каком соединении степени окисления элементов равны +3 и -2 А) NF3 Б) Cl2O3 В) Nh4 Г) AlCl3
Тестовое задание
Задание № 3. I вариант
Схема Na0 → Na+1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Задание № 3.
II вариант
Схема Сl0 → Сl-1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
I вариант
Схема Na0 → Na+1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Задание № 3.
II вариант
Схема Сl0 → Сl-1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Тестовое задание Задание № 4. I вариант Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются Задание № 4. II вариант Окислительные свойства простых веществ, образованных элементами седьмой группы главной подгруппы с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются
Ответы I вариант 1 — В 2 — В 3 — А 4 — А II вариант 1 — Г 2 — Б 3 — Б 4 — А
1.
 Какое уравнение соответствует реакции разложения? 1) 2) 3) 4) 3. Какое уравнение соответствует реакции замещения?
Какое уравнение соответствует реакции разложения? 1) 2) 3) 4) 3. Какое уравнение соответствует реакции замещения?
Химические свойства оснований и кислот
Химические свойства оснований и кислот 1. В реакцию с раствором гидроксида калия вступает 2. Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
ПодробнееЗачет по теме «Химическая связь» 11класс
Зачет по теме «Химическая связь» 11класс 1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая
Подробнее1.
 Дана схема превращений:
Дана схема превращений:
Задание 22 1. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение
ПодробнееЗадание 31 ЕГЭ по химии
Верное решение задания 31 должно содержать уравнения четырёх За верную запись каждого уравнения реакции можно получить 1 балл. Максимально за выполнение этого задания можно получить 4 балла. Каждое верное
ПодробнееБанк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
ПодробнееІX класс, XІ (ХII) классы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ «РЕСПУБЛИКАНСКИЙ ЦЕНТР РАЗВИТИЯ ОБРАЗОВАНИЯ»
ПодробнееID_590 1/7 neznaika.
 pro
pro
Вариант 2 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
ПодробнееРЕЗУЛЬТАТЫ ОСВОЕНИЯ КУРСА «ХИМИЯ 8 КЛАСС»
РЕЗУЛЬТАТЫ ОСВОЕНИЯ КУРСА «ХИМИЯ 8 КЛАСС» В результате изучения химии ученик должен знать/понимать химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа по химии для 8 класса составлена в соответствии с федеральным компонентом государственного образовательного стандарта основного общего образования, программой курса
Подробнее9 класс.
 Практическая работа 1. I вариант.
Практическая работа 1. I вариант.
9 класс. Практическая работа 1. Решение экспериментальных задач по теме: «Основные классы неорганических соединений». I вариант. Цель работы: выполняя экспериментальные задачи, повторить свойства оксидов,
ПодробнееБанк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
ПодробнееТЕМА 1. Щелочные металлы и их соединения
ТЕМА 1. Щелочные металлы Тренировочные задания 1. Верны ли следующие суждения? А. Семейство щелочных металлов расположено в IА группе Периодической системы химических элементов Д.И. Менделеева. Б. Максимальная
Подробнее
Элементы IА и IIА подгруппы 1. 8. 9. 2. 10. 11. 3. 4. 12. 5. 13. 14. 6. 7. 15. 16. 1 17. 26. 18. 27. 19. 28. 20. 21. 29. 22. 23. 30. 24. 31. 25. 32. 2 33. 39. Взаимодействие оксида кальция с водой относится
8. 9. 2. 10. 11. 3. 4. 12. 5. 13. 14. 6. 7. 15. 16. 1 17. 26. 18. 27. 19. 28. 20. 21. 29. 22. 23. 30. 24. 31. 25. 32. 2 33. 39. Взаимодействие оксида кальция с водой относится
СБОРНИК ТЕСТОВЫХ ЗАДАНИЙ ПО ХИМИИ
НАЧАЛЬНОЕ И СРЕДНЕЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ Ю.М.ЕРОХИН СБОРНИК ТЕСТОВЫХ ЗАДАНИЙ ПО ХИМИИ Рекомендовано Федеральным государственным автономным учреждением «Федеральный институт развития образования»
ПодробнееID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
ПодробнееЭкзаменационная работа
Экзаменационная работа для проведения государственной (итоговой) аттестации выпускников IX классов общеобразовательных учреждений 2008 года (в новой форме) по ХИМИИ Демонстрационный вариант 2008 года Район
ПодробнееРАБОЧАЯ ПРОГРАММА по химии для 8-9 классов
Муниципальное бюджетное общеобразовательное учреждение города Абакана «Средняя общеобразовательная школа 1» РАБОЧАЯ ПРОГРАММА по химии для 8-9 классов. Рабочая программа по химии для 8-9 классов является
Рабочая программа по химии для 8-9 классов является
Химическая реакция.
Химическая реакция.
Условия и признаки протекания химических реакций. Химические уравнения.
1. Какое уравнение соответствует реакции разложения?
1)
2)
3)
4)
2. Какое уравнение соответствует реакции обмена
1)
2)
3)
4)
3. Какое уравнение соответствует реакции замещения?
1)
2)
3)
4)
4. В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1)
2)
3)
4)
5. В реакцию замещения вступают между собой
1) и
2) и
3) и
4) и
6. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
7. Взаимодействие
раствора сульфата меди(II) с железом относится к реакциям
Взаимодействие
раствора сульфата меди(II) с железом относится к реакциям
1) замещения
2) соединения
3) обмена
4) разложения
8. К окислительно-восстановительным относится реакция термического разложения
1)
2)
3)
4)
9. В реакцию разложения, протекающую без изменения степени окисления, вступает
1)
2)
3)
4)
10. В реакцию разложения, протекающую без изменения степени окисления, вступает
1)
2)
3)
4)
11. Признаком протекания химической реакции между растворами нитрата серебра и хлорида кальция является
1) выделение газа
2) образование осадка
3) растворение осадка
4) появление запаха
12. Признаком протекания химической реакции между растворами нитрата меди(II) и гидроксида натрия является
1) появление запаха
2) растворение осадка
3) выделение газа
4) образование осадка
13. Признаком
протекания химической реакции между растворами нитрата железа(III)
и гидроксида бария является
Признаком
протекания химической реакции между растворами нитрата железа(III)
и гидроксида бария является
1) образование осадка
2) выделение газа
3) растворение осадка
4) появление запаха
14. К химическим явлениям относится процесс
1) кипения спирта
2) плавления серы
3) испарения воды
4) горения серы
15. Горение сероводорода
является реакцией
1) окислительно-восстановительной, некаталитической, экзотермической
2) окислительно-восстановительной, каталитической, эндотермической
3) замещения, некаталитической, эндотермической
4) обмена, некаталитической, экзотермической
16. Реакция, уравнение которой
,
относится к реакциям
1) разложения
2) соединения
3) замещения
4) обмена
17. Взаимодействие алюминия с оксидом железа(III) относится к реакциям
1) соединения
2) обмена
3) окислительно-восстановительным
4) нейтрализации
18. Признаком химической реакции между растворами сульфата меди (II) и гидроксида калия является
1) выделение газа
2) выпадение осадка
3) появление запаха
4) поглощение теплоты
19. Водород массой 2 г полностью про взаимодействовал с 16 г кислорода. На основании закона сохранения массы можно утверждать, что масса полученной при этом воды равна
1) 2 г
2) 16 г
3) 18 г
4) 14 г
20. Реакция, уравнение которой
,
относится к реакциям
1) разложения
2) соединения
3) замещения
4) обмена
21. Если в бесцветный раствор хлорида ртути(II) поместить кусочек меди красного цвета, то произойдет реакция:
1) обмена
2) соединения
3) разложения
4) замещения
22. К химическим явлениям не относится процесс
1) возгонки иода
2) горения спирта
3) брожения глюкозы
4) горения ацетилена
23. Признаком химической реакции не является
1) выделение теплоты
2) изменение окраски
3) образование осадка
4) изменение объёма
24. Реакция замещения с участием оксида меди(II):
1)
2)
3)
4)
25. Реакция обмена с участием оксида кальция:
1)
2)
3)
4)
26. Выделение газа — признак химической реакции между
1) и
2) и
3) и
4) и
27. Изменение цвета — признак химической реакции между
1) растворами и
2) и раствором
3) и раствором
4) и
28. С изменением степени окисления элементов протекает химическая реакция
1)
2)
3)
4)
29. Без изменения степени окисления элементов протекает химическая реакция
1)
2)
3)
4)
30. Признаком протекания химической реакции между оксидом меди и водородом является
1) появление запаха
2) изменение цвета
3) выпадение осадка
4) выделение газа
31. Взаимодействие между оксидом магния и соляной кислотой — это реакция
1) замещения
2) разложения
3) соединения
4) обмена
32. Взаимодействие между оксидом меди(II) и водородом при нагревании – это
реакция
1) разложения
2) замещения
3) соединения
4) обмена
33. Пример реакции замещения:
1)
2)
3)
4)
34. Пример реакции обмена:
1)
2)
3)
4)
35. Оксид меди(II) вступает в окислительно-восстановительную реакцию с
1)
2)
3)
4)
36. Оксид железа(III) вступает в окислительно-восстановительную реакцию с
1)
2)
3)
4)
37. Оксид меди(II) вступает в реакцию замещения с
1)
2)
3)
4)
38. Серная кислота вступает в реакцию замещения с
1)
2)
3)
4)
39. Железо вступает в реакцию замещения с
1) соляной кислотой
2) хлором
3) кислородом
4) серой
40. Углерод вступает в реакцию замещения с
1) оксидом железа(III)
2) кислородом
3) фтором
4) серной кислотой
4) выделение газа
КИМ ОГЭ для переводных экзаменов по химии, 8 класс
Контрольно-измерительный материал по химии
для проведения переводного экзамена в 8 классе
2018/2019 учебный год
Инструкция по выполнению работы
Экзаменационная работа включает в себя 10 заданий. На выполнение работы отводится 2 часа (120 минут). Ответы к заданиям записываются в виде цифры или последовательности цифр. Все бланки заполняются черной гелевой ручкой.
Вариант 1
Часть 1
1. Химическому элементу, степень окисления которого в высшем оксиде +6, соответствует схема распределения электронов в атоме:
1) 2, 8, 6
2) 2, 8, 8, 2
3) 2, 8, 3
4) 2, 6
2. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
3. В каком из соединений степень окисления азота равна −3?
1)
2)
3)
4)
4. К окислительно-восстановительным относится реакция термического разложения
1)
2)
3)
4)
5. Наибольшее число анионов образуется при полной диссоциации 1 моль
1) фосфата калия
2) нитрата натрия
3) сульфата меди(II)
4) хлорида железа(III)
6. Верны ли следующие суждения об обращении с растворами щелочей?
А. При попадании раствора щелочи на кожу рук его надо смыть водой.
Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. На диаграмме изображено распределение массовых долей водорода, азота и кислорода в некотором веществе.
Какому веществу оно соответствует?
1)
2)
3)
4)
8. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов происходит уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
Часть 2
9. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель.
10. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
Спецификация
Максимальный балл за работу в целом – 15.
Задания 1-8, оцениваемые одним баллом, считаются выполненными верно, если указан номер верного ответа или записана соответствующая последовательность цифр.
Задание 9 оценивается в 3 балла, если верно написано уравнение реакции и расставлены коэффициенты, и определена степень окисления.
Задание 10 оценивается в 4 балла и считается выполненным верно, если обучающийся выбрал правильный путь решения, из письменной записи решения понятен ход его рассуждений, получен верный ответ.
0 – 4 балла – оценка «2»
5 — 8 баллов – оценка «3»
8 – 11 баллов – оценка «4»
12 — 15 баллов – оценка «5».
Газификация угля — Что такое Газификация угля?
Газификация угля — это физико-химический процесс превращения угля в горючий газ с помощью кислорода или других газов.
Актуальность газификации угля
Уголь — самый насыщенный углеродом вид ископаемого топлива.При сжигании угля на тепловых электростанциях (ТЭС) образуется в 2 раза больше СО2, чем в процессе сжигания природного газа.
В связи с декарбонизацией мировой экономики предполагается отказаться от использования угля в качестве энергоресурса из-за превышения допустимого уровня выбросов в атмосферу твердых углеродных частиц, окислов азота.
Газификации угля позволяет его использовать в переходный период декарбонизации и снижать выбросы в атмосферу.
Технология газификации угля
Реакция газификации угля является высокотемпературным процессом взаимодействия углерода из топлива с окислителями.Этот процесс необходим для того, чтобы получить горючие газы (Н2, СО, СН4).
В зависимости от применяемого сырья и вида конверсии (водяным паром или нестехиометрическим количеством О2) соотношение компонентов в газовой смеси изменяется в широких пределах:
- СН4 + Н2О : СО + 3Н2
- СН4 + ½O2 : СО + 2Н2
- -СН2-+ Н2О : СО + 2Н2
- -СН2-+ ½O2 : СО + Н2
- кислород (или обогащенный им воздух),
- водяной пар,
- диоксид углерода (СО2)
- или комбинации перечисленных веществ.
- С + 1/2 O2 : СО,
- С + СO2 : 2 СO2,
- С + Н2О : СО + Н2
Сопутствующие газификации угля продукты его термического разложения:
- диоксид углерода,
- вода,
- водород,
- продукты полукоксования (углеводороды), которые также могут взаимодействовать с раскаленным углеродом.
Температура — высокая, при которой образование высших углеводородов практически исключается.
Угольная сера — нежелательная примесь, переводится в сероводород и сероуглерод.
В 1950х гг. впервые в США началась газификация угля с целью получения горючего газа в условиях дефицита природного газа.
Состав и теплота сгорания полученного в результате газификации газа различны и зависят от его использования:
- горючий газ (для технологического и энергетического сжигания) — наличие большего объема метана и отсутствие нежелательных продуктов полукоксования угля: масла, смолы, фенолы,
- синтез-газ ( химсырье для производства метанола, аммиака, использование в процессе Фишера-Тропша для производства жидкого топлива) — определенное соотношения СО:Н2 и Н2*2, что достигается подбором условий техпроцесса и выбором состава газифицирующего агента( состав: кислород и водяной пар).
- восстановительный газ (в металлургической промышленности) — для прямого восстановления железной руды и др..
По состоянию топлива в газогенераторе:
- газификация в неподвижном слое;
- газификация в медленно опускающемся слое твердого топлива;
- газификация в кипящем слое;
- газификация в потоке пылевидного топлива.
- автотермический, необходимое для газификации тепло, получают путем сжигания части введенного топлива в присутствии кислородсодержащих газифицирующих агентов,
- аллотермический, тепло подводится извне с помощью твердого или газообразного теплоносителя.
По принципу организации потока. Мелкозернистый или пылевидный уголь газифицируют при подаче в одном направлении угля и газообразного газифицирующего агента.
Это техническое решение имеет ряд преимуществ по сравнению с процессами газификации в неподвижном слое:
— более низкую стоимость мелкозернистого топлива по сравнению с кусковым;
— возможность применения сырья любой степени газификации, прежде всего любой спекаемости;
— отсутствие побочных продуктов — смолы, масла, фенолов и др.
— если газификацию проводят при повышенном давлении, значение этих факторов еще более возрастает, так как производительность генератора увеличивается пропорционально давлению.
В настоящее время:
- совершенствуются существующие технологии газификации под давлением,
- разрабатываются принципиально новых технологических процессов под давлением,
- разрабатываются технологии повышения реакционной температуры,
- разрабатываются технологии без использования дорогостоящей кислородной установки.
- позволяет увеличить производительность, что повышает концентрация газифицирующего агента.
- влияет на равновесие в процессе газификации.
- благоприятно отражается на габаритных размерах газогенератора и скрубберов,
- дает экономию затрат на компрессию, так как производимый газ занимает больший объем, чем газифицирующий агент.
- делает возможным применение физических способов очистки газа, которые неэффективны при атмосферном давлении, экономить стоимость чистящего агента, снижать его потребления .
- увеличивает производительность газификатора;
- уменьшает удельный объем газификатора,
- снижает выход смол или нежелательных углеводородов,
- за счет смещения равновесия при высоких температурах выходит газ с более высоким восстановительным потенциалом вследствие низкого содержания СО2 и более глубокого разложения водяного пара.
Отсутствие кислородной установки:
- означает не использование кислорода, полученного из воздуха путем сжижения и низкотемпературной ректификации,
- означает разделение нагрева и паровой газификации угля путем использования воздуха.
Задания A6. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения
1. A 6 № 28. Какое уравнение соответствует реакции разложения?
1)
2)
3)
4)
2. A 6 № 50. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
3. A 6 № 72. Какое уравнение соответствует реакции замещения?
1)
2)
3)
4)
4. A 6 № 94. В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1)
2)
3)
4)
5. A 6 № 116. В реакцию замещения вступают между собой
1) и
2) и
3) и
4) и
6. A 6 № 138. Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
7. A 6 № 160. Взаимодействие раствора сульфата меди(II) с железом относится к реакциям
1) замещения
2) соединения
3) обмена
4) разложения
8. A 6 № 182. К окислительно-восстановительным относится реакция термического разложения
1)
2)
3)
4)
9. A 6 № 204. В реакцию разложения, протекающую без изменения степени окисления, вступает
1)
2)
3)
4)
10. A 6 № 226. В реакцию разложения, протекающую без изменения степени окисления, вступает
1)
2)
3)
4)
11. A 6 № 248. Признаком протекания химической реакции между растворами нитрата серебра и хлорида кальция является
1) выделение газа
2) образование осадка
3) растворение осадка
4) появление запаха
12. A 6 № 270. Признаком протекания химической реакции между растворами нитрата меди(II) и гидроксида натрия является
1) появление запаха
2) растворение осадка
3) выделение газа
4) образование осадка
13. A 6 № 292. Признаком протекания химической реакции между растворами нитрата железа(III) и гидроксида бария является
1) образование осадка
2) выделение газа
3) растворение осадка
4) появление запаха
14. A 6 № 314. К химическим явлениям относится процесс
1) кипения спирта
2) плавления серы
3) испарения воды
4) горения серы
15. A 6 № 336. Горение сероводорода
является реакцией
1) окислительно-восстановительной, некаталитической, экзотермической
2) окислительно-восстановительной, каталитической, эндотермической
3) замещения, некаталитической, эндотермической
4) обмена, некаталитической, экзотермической
16. A 6 № 358. Реакция, уравнение которой
,
относится к реакциям
1) разложения
2) соединения
3) замещения
4) обмена
17. A 6 № 380. Взаимодействие алюминия с оксидом железа(III) относится к реакциям
1) соединения
2) обмена
3) окислительно-восстановительным
4) нейтрализации
18. A 6 № 402. Признаком химической реакции между растворами сульфата меди (II) и гидроксида калия является
1) выделение газа
2) выпадение осадка
3) появление запаха
4) поглощение теплоты
19. A 6 № 424. Водород массой 2 г полностью провзаимодействовал с 16 г кислорода. На основании закона сохранения массы можно утверждать, что масса полученной при этом воды равна
1) 2 г
2) 16 г
3) 18 г
4) 14 г
20. A 6 № 446. Реакция, уравнение которой
,
относится к реакциям
1) разложения
2) соединения
3) замещения
4) обмена
21. A 6 № 469. Если в бесцветный раствор хлорида ртути(II) поместить кусочек меди красного цвета, то произойдет реакция:
1) обмена
2) соединения
3) разложения
4) замещения
22. A 6 № 492. К химическим явлениям не относится процесс
1) возгонки иода
2) горения спирта
3) брожения глюкозы
4) горения ацетилена
23. A 6 № 514. Признаком химической реакции не является
1) выделение теплоты
2) изменение окраски
3) образование осадка
4) изменение объёма
24. A 6 № 537. Реакция замещения с участием оксида меди(II):
1)
2)
3)
4)
25. A 6 № 562. Реакция обмена с участием оксида кальция:
1)
2)
3)
4)
26. A 6 № 586. Выделение газа — признак химической реакции между
1) и
2) и
3) и
4) и
27. A 6 № 609. Изменение цвета — признак химической реакции между
1) растворами и
2) и раствором
3) и раствором
4) и
28. A 6 № 631. С изменением степени окисления элементов протекает химическая реакция
1)
2)
3)
4)
29. A 6 № 653. Без изменения степени окисления элементов протекает химическая реакция
1)
2)
3)
4)
30. A 6 № 697. Признаком протекания химической реакции между оксидом меди и водородом является
1) появление запаха
2) изменение цвета
3) выпадение осадка
4) выделение газа
31. A 6 № 799. Взаимодействие между оксидом магния и соляной кислотой — это реакция
1) замещения
2) разложения
3) соединения
4) обмена
32. A 6 № 821. Взаимодействие между оксидом меди(II) и водородом при нагревании – это
реакция
1) разложения
2) замещения
3) соединения
4) обмена
33. A 6 № 843. Пример реакции замещения:
1)
2)
3)
4)
34. A 6 № 865. Пример реакции обмена:
1)
2)
3)
4)
35. A 6 № 899. Оксид меди(II) вступает в окислительно-восстановительную реакцию с
1)
2)
3)
4)
36. A 6 № 921. Оксид железа(III) вступает в окислительно-восстановительную реакцию с
1)
2)
3)
4)
37. A 6 № 943. Оксид меди(II) вступает в реакцию замещения с
1)
2)
3)
4)
38. A 6 № 965. Серная кислота вступает в реакцию замещения с
1)
2)
3)
4)
39. A 6 № 987. Железо вступает в реакцию замещения с
1) соляной кислотой
2) хлором
3) кислородом
4) серой
40. A 6 № 1009. Углерод вступает в реакцию замещения с
1) оксидом железа(III)
2) кислородом
3) фтором
4) серной кислотой
41. A 6 № 1034. Признаком протекания химической реакции между оксидом меди(II) и водородом является
1) появление запаха
2) изменение цвета
3) выпадение осадка
4) выделение газа
типов окислительно-восстановительных реакций | Введение в химию
Цель обучения
- Объясните процессы, участвующие в окислительно-восстановительной реакции, и опишите, что происходит с их различными компонентами.
Ключевые моменты
- В комбинированных реакциях объединяются два элемента. [латекс] A + B \ rightarrow AB [/ латекс].
- В реакциях разложения соединение распадается на составные части.[латекс] AB \ rightarrow A + B [/ латекс].
- В реакциях замещения один или несколько атомов заменяются другим. [латекс] AB + C \ rightarrow A + CB [/ латекс].
- В реакциях горения соединение реагирует с кислородом с образованием диоксида углерода, воды и тепла.
- В реакциях диспропорционирования молекула восстанавливается и окисляется; эти типы реакций редки.
Условия
- горение: процесс, в котором топливо соединяется с кислородом, обычно при высокой температуре, выделяя CO 2 , H 2 O и тепло .
- сокращенный термин редокса, обозначающий «восстановление-окисление», два метода переноса электрона, которые всегда происходят вместе
Редокс-реакции происходят повсюду.Фактически, большая часть наших технологий, от огня до аккумуляторов для ноутбуков, в значительной степени основана на окислительно-восстановительных реакциях. Окислительно-восстановительные реакции (окислительно-восстановительные) — это реакции, при которых изменяется степень окисления реагентов. Это происходит потому, что в таких реакциях электроны всегда передаются между частицами. Окислительно-восстановительные реакции протекают либо посредством простого процесса, такого как сжигание углерода в кислороде с образованием диоксида углерода (CO 2 ), либо посредством более сложного процесса, такого как окисление глюкозы (C 6 H 12 O 6 ) в человеческом теле через ряд процессов переноса электронов.
Термин «окислительно-восстановительный потенциал» происходит от двух концепций, связанных с переносом электронов: восстановления и окисления. Эти процессы определены следующим образом:
- Окисление — это потеря электронов или увеличение степени окисления молекулой, атомом или ионом.
- Восстановление — это увеличение количества электронов или уменьшение степени окисления молекулой, атомом или ионом.
Простая мнемоника для запоминания этих процессов — «НЕФТЯНАЯ ШКАФА» — окисление теряется (электроны), восстановление увеличивается (электроны).
Окислительно-восстановительные реакции — это согласованные наборы: если в ходе реакции окисляется один вид, другой должен быть восстановлен. Помните об этом, когда мы рассмотрим пять основных типов окислительно-восстановительных реакций: комбинация, разложение, смещение, горение и диспропорция.
Комбинация
Комбинированные реакции «объединяют» элементы в химическое соединение. Обычно окисление и восстановление происходят вместе.
Общее уравнение: [латекс] A + B \ rightarrow AB [/ латекс]
Образец 1.уравнение: 2 H 2 + O 2 → 2 H 2 O
Сумма степеней окисления реагентов равна сумме степеней окисления продуктов: 0 + 0 → (2) (+ 1) + (-2)
В этом уравнении и H 2 , и O 2 являются молекулярными формами своих соответствующих элементов, и поэтому их степень окисления равна 0. Продукт представляет собой H 2 O: степень окисления составляет -2 для кислорода и + 1 для водорода.
Разложение
Реакции разложения противоположны реакциям комбинации, то есть они представляют собой разложение химического соединения на составляющие его элементы.
Общее уравнение: AB → A + B
Пример 2. Уравнение: 2 H 2 O → 2 H 2 + O 2
Расчет: (2) (+ 1) + (-2) = 0 → 0 + 0
В этом уравнении вода «разлагается» на водород и кислород, оба из которых нейтральны. Подобно предыдущему примеру, H 2 O имеет общую степень окисления 0, при этом каждый H принимает состояние +1, а O a -2; таким образом, разложение окисляет кислород от -2 до 0 и восстанавливает водород от +1 до 0.
Рабочий объем
Реакции замещения, также известные как реакции замещения, включают соединения и «замену» элементов. Они протекают как реакции одинарного и двойного замещения.
Общее уравнение (одинарное перемещение): A + BC → AB + CA
Однократная реакция замещения «заменяет» элемент в реагентах на другой элемент в продуктах.
Образец 3. Уравнение: Cl 2 + 2 NaBr → 2 NaCl + Br 2
Расчет: 0 + [(+1) + (-1) = 0] [латекс] \ rightarrow [/ latex] [(+1) + (-1) = 0] + 0
В этом уравнении Cl восстанавливается и замещает Br, а Br окисляется.
Общее уравнение (двойное смещение): AB + CD → AD + CB
Реакция двойного замещения аналогична реакции одиночного замещения, но включает «замену» двух элементов в реагентах двумя элементами в продуктах.
Образец 4. уравнение: Fe 2 O 3 + 6 HCl → 2 FeCl 3 + 3 H 2 O
В этом уравнении местами заменяются Fe и H, а также O и Cl.
Горение
В реакциях горения всегда участвует кислород и органическое топливо.На следующем изображении мы видим, как метан сгорает с выделением энергии.
Реакция горения метана Это пример реакции горения, окислительно-восстановительного процесса. Метан ([латекс] \ text {CH} _4 [/ latex]) реагирует с кислородом ([латекс] \ text {O} _2 [/ latex]) с образованием диоксида углерода ([латекс] \ text {CO} _2 [ / latex]) и две молекулы воды ([латекс] 2 \ text {H} _2 \ text {O} [/ latex]).Общее уравнение реакции горения:
[латекс] \ text {C} _x \ text {H} _y + \ left (x + \ dfrac {y} {4} \ right) \ text {O} _2 \ rightarrow x \ text {CO} _2 + \ dfrac {y} {2} \ text {H} _2 \ text {O} [/ latex]
Диспропорционирование
В некоторых окислительно-восстановительных реакциях вещества могут как окисляться, так и восстанавливаться.Они известны как реакции диспропорционирования. Одним из реальных примеров такого процесса является реакция перекиси водорода H 2 O 2 , когда она заливается на рану. Сначала это может показаться простой реакцией разложения, потому что перекись водорода распадается с образованием кислорода и воды:
2 H 2 O 2 (водн.) → 2 H 2 O (л) + O 2 (г)
Однако ключ к этой реакции лежит в степени окисления кислорода.Обратите внимание, что кислород присутствует в реагенте, и оба продукта . В H 2 O 2 кислород имеет степень окисления -1. В H 2 O его степень окисления -2, и он был восстановлен. Однако в O 2 его степень окисления равна 0, и он был окислен. Кислород в реакции окисляется и восстанавливается, что делает ее реакцией диспропорционирования. Общая форма этой реакции следующая:
2A → A ’+ A”
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
окислительно-восстановительных реакций | Безграничная химия
Окислительные состояния
Состояние окисления — это гипотетический заряд атома, если все его связи с другими атомами были полностью ионными.
Цели обучения
Предскажите степени окисления обычных элементов по номеру их группы.
Основные выводы
Ключевые моменты
- Степень окисления чистого элемента всегда равна нулю.
- Степень окисления чистого иона эквивалентна его ионному заряду.
- Обычно водород имеет степень окисления +1, а кислород — степень окисления -2.
- Сумма степеней окисления всех атомов нейтральной молекулы должна равняться нулю.
Ключевые термины
- восстановление : усиление электронов, которое вызывает снижение степени окисления
- окисление : потеря электронов, которая вызывает повышение степени окисления
Степень окисления указывает степень окисления атома в химическом соединении; это гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были полностью ионными.Состояния окисления обычно представлены целыми числами, которые могут быть положительными, отрицательными или нулевыми. В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Наивысшая известная степень окисления +8 у тетроксидов рутения, ксенона, осмия, иридия, гассия и некоторых комплексов с участием плутония; самая низкая известная степень окисления -4 для некоторых элементов углеродной группы.
Степени окисления плутония : Здесь плутоний различается по цвету в зависимости от степени окисления.
Повышение степени окисления атома в результате химической реакции называется окислением, и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением и связано с увеличением количества электронов.
Общие правила, касающиеся состояний окисления
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Для простого (одноатомного) иона степень окисления равна чистому заряду иона. Например, Cl — имеет степень окисления -1.
- Когда он присутствует в большинстве соединений, водород имеет степень окисления +1, а кислород — степень окисления −2. Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1 / 2 в супероксидах (например, KO).
- Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю. В ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду иона.
Прогнозирование состояний окисления
Как правило, степень окисления большинства обычных элементов может быть определена по номеру их группы в периодической таблице. Это показано на следующей диаграмме:
Типичные степени окисления наиболее распространенных элементов по группе : Переходные металлы не включены, поскольку они имеют тенденцию проявлять различные степени окисления.
Из приведенной выше таблицы можно сделать вывод, что бор (элемент III группы) обычно имеет степень окисления +3, а азот (элемент V группы) — степень окисления -3.Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо установленных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Как указано в правиле номер четыре выше, сумма степеней окисления для всех атомов в молекуле или многоатомном ионе равна заряду молекулы или иона. Это помогает определить степень окисления любого элемента в данной молекуле или ионе, предполагая, что мы знаем общие степени окисления всех других элементов.Например, в сульфит-ионе (SO 3 2- ) общий заряд иона равен 2-, и предполагается, что каждый кислород находится в своей обычной степени окисления -2. Поскольку в сульфите три атома кислорода, кислород вносит [латекс] 3 \ times-2 = -6 [/ latex] в общий заряд. Следовательно, сера должна иметь степень окисления +4, чтобы общий заряд сульфита составлял 2-: [латекс] (+ 4-6 = -2). [/ Latex]
Не путайте формальный заряд атома с его формальной степенью окисления, поскольку они могут быть разными (а часто и разными в многоатомных ионах).Например, заряд атома азота в ионе аммония NH 4 + равен 1+, но формальная степень окисления -3 — такая же, как у азота в аммиаке. В случае между аммиаком и аммиаком формальный заряд атома N изменяется, а его степень окисления — нет.
Типы окислительно-восстановительных реакций
Пять основных типов окислительно-восстановительных реакций — это комбинация, разложение, вытеснение, горение и диспропорционирование.
Цели обучения
Объясните процессы, участвующие в окислительно-восстановительной реакции, и опишите, что происходит с их различными компонентами.
Основные выводы
Ключевые моменты
- В комбинированных реакциях объединяются два элемента. [латекс] A + B \ rightarrow AB [/ латекс].
- В реакциях разложения соединение распадается на составные части. [латекс] AB \ rightarrow A + B [/ латекс].
- В реакциях замещения один или несколько атомов заменяются другим. [латекс] AB + C \ rightarrow A + CB [/ латекс].
- В реакциях горения соединение реагирует с кислородом с образованием диоксида углерода, воды и тепла.
- В реакциях диспропорционирования молекула восстанавливается и окисляется; эти типы реакций редки.
Ключевые термины
- редокс : сокращенное название «восстановление-окисление», два метода переноса электрона, которые всегда происходят вместе
- горение : процесс, в котором топливо соединяется с кислородом, обычно при высокой температуре, выделяя CO2, h3O и тепло
Редокс-реакции происходят повсюду.Фактически, большая часть наших технологий, от огня до аккумуляторов для ноутбуков, в значительной степени основана на окислительно-восстановительных реакциях. Окислительно-восстановительные реакции (восстановление — окисление) — это реакции, при которых изменяется степень окисления реагентов. Это происходит потому, что в таких реакциях электроны всегда передаются между частицами. Окислительно-восстановительные реакции протекают либо посредством простого процесса, такого как сжигание углерода в кислороде с образованием диоксида углерода (CO 2 ), либо посредством более сложного процесса, такого как окисление глюкозы (C 6 H 12 O 6 ) в человеческом теле через ряд процессов переноса электронов.
Термин «окислительно-восстановительный потенциал» происходит от двух концепций, связанных с переносом электронов: восстановления и окисления. Эти процессы определены следующим образом:
- Окисление — это потеря электронов или увеличение степени окисления молекулой, атомом или ионом.
- Восстановление — это увеличение количества электронов или уменьшение степени окисления молекулой, атомом или ионом.
Простая мнемоника для запоминания этих процессов — «НЕФТЯНАЯ ШКАФА» — окисление теряется (электроны), восстановление увеличивается (электроны).
Окислительно-восстановительные реакции — это согласованные наборы: если в ходе реакции окисляется один вид, другой должен быть восстановлен. Помните об этом, когда мы рассмотрим пять основных типов окислительно-восстановительных реакций: комбинация, разложение, смещение, горение и диспропорция.
Комбинация
Комбинированные реакции «объединяют» элементы в химическое соединение. Обычно окисление и восстановление происходят вместе.
Общее уравнение: [латекс] A + B \ rightarrow AB [/ латекс]
Образец 1.уравнение: 2 H 2 + O 2 → 2 H 2 O
Сумма степеней окисления реагентов равна сумме степеней окисления продуктов: 0 + 0 → (2) (+ 1) + (-2)
В этом уравнении и H 2 , и O 2 являются молекулярными формами своих соответствующих элементов, и поэтому их степень окисления равна 0. Продукт представляет собой H 2 O: степень окисления составляет -2 для кислорода и + 1 для водорода.
Разложение
Реакции разложения противоположны реакциям комбинации, то есть они представляют собой разложение химического соединения на составляющие его элементы.
Общее уравнение: AB → A + B
Пример 2. Уравнение: 2 H 2 O → 2 H 2 + O 2
Расчет: (2) (+ 1) + (-2) = 0 → 0 + 0
В этом уравнении вода «разлагается» на водород и кислород, оба из которых нейтральны. Подобно предыдущему примеру, H 2 O имеет общую степень окисления 0, при этом каждый H принимает состояние +1, а O a -2; таким образом, разложение окисляет кислород от -2 до 0 и восстанавливает водород от +1 до 0.
Рабочий объем
Реакции замещения, также известные как реакции замещения, включают соединения и «замену» элементов. Они протекают как реакции одинарного и двойного замещения.
Общее уравнение (одинарное перемещение): A + BC → AB + CA
Однократная реакция замещения «заменяет» элемент в реагентах на другой элемент в продуктах.
Образец 3. Уравнение: Cl 2 + 2 NaBr → 2 NaCl + Br 2
Расчет: 0 + [(+1) + (-1) = 0] [латекс] \ rightarrow [/ latex] [(+1) + (-1) = 0] + 0
В этом уравнении Cl восстанавливается и замещает Br, а Br окисляется.
Общее уравнение (двойное смещение): AB + CD → AD + CB
Реакция двойного замещения аналогична реакции одиночного замещения, но включает «замену» двух элементов в реагентах двумя элементами в продуктах.
Образец 4. уравнение: Fe 2 O 3 + 6 HCl → 2 FeCl 3 + 3 H 2 O
В этом уравнении местами заменяются Fe и H, а также O и Cl.
Сгорание
В реакциях горения всегда участвует кислород и органическое топливо.На следующем изображении мы видим, как метан сгорает с выделением энергии.
Реакция горения метана : Это пример реакции горения, окислительно-восстановительного процесса. Метан ([латекс] \ text {CH} _4 [/ latex]) реагирует с кислородом ([латекс] \ text {O} _2 [/ latex]) с образованием диоксида углерода ([латекс] \ text {CO} _2 [ / latex]) и две молекулы воды ([латекс] 2 \ text {H} _2 \ text {O} [/ latex]).
Общее уравнение реакции горения:
[латекс] \ text {C} _x \ text {H} _y + \ left (x + \ dfrac {y} {4} \ right) \ text {O} _2 \ rightarrow x \ text {CO} _2 + \ dfrac {y} {2} \ text {H} _2 \ text {O} [/ latex]
Диспропорционирование
В некоторых окислительно-восстановительных реакциях вещества могут как окисляться, так и восстанавливаться.Они известны как реакции диспропорционирования. Одним из реальных примеров такого процесса является реакция перекиси водорода H 2 O 2 , когда она заливается на рану. Сначала это может показаться простой реакцией разложения, потому что перекись водорода распадается с образованием кислорода и воды:
2 H 2 O 2 (водн.) → 2 H 2 O (л) + O 2 (г)
Однако ключ к этой реакции лежит в степени окисления кислорода.Обратите внимание, что кислород присутствует в реагенте, и оба продукта . В H 2 O 2 кислород имеет степень окисления -1. В H 2 O его степень окисления -2, и он был восстановлен. Однако в O 2 его степень окисления равна 0, и он был окислен. Кислород в реакции окисляется и восстанавливается, что делает ее реакцией диспропорционирования. Общая форма этой реакции следующая:
2A → A ’+ A”
Балансировка уравнений окислительно-восстановительного потенциала
Уравновешивание окислительно-восстановительных реакций включает разделение реакции на две половинные реакции.
Цели обучения
Сформулируйте сбалансированную окислительно-восстановительную реакцию на основе двух полуреакций.
Основные выводы
Ключевые моменты
- Восстановители окисляются и, следовательно, теряют электроны.
- Окислители восстанавливаются и, следовательно, приобретают электроны.
- Вспомните мнемоническое устройство OIL RIG — «Окисление влечет за собой потери» и «Уменьшение предполагает усиление», чтобы различать окислители и восстановители.
Ключевые термины
- окисление : реакция, в которой атомы элемента теряют электроны и его степень окисления увеличивается
- восстановление : реакция, в которой приобретаются электроны и снижается степень окисления, часто за счет удаления кислорода или добавления водорода
- полуреакции : одна из двух составных частей любой окислительно-восстановительной реакции, в которой показано только окисление или восстановление
Каждая сбалансированная окислительно-восстановительная реакция состоит из двух полуреакций: полуреакции окисления и полуреакции восстановления.{-}} \ end {array} [/ latex]
Добавление двух половин окислительно-восстановительной реакции : Эти две половины реакции могут быть добавлены, как любое другое химическое уравнение. Как только уравнения добавлены, электроны с каждой стороны сокращаются.
Обратите внимание, что два электрона на каждой стороне уравнения сокращаются. Это очень важно, потому что окончательное сбалансированное уравнение любой окислительно-восстановительной реакции никогда не должно содержать никаких электронов.
Электроны, движущиеся от одного полюса батареи через цепь и обратно через другой полюс батареи, являются примером применяемой окислительно-восстановительной реакции.
Уравновешивание окислительно-восстановительных уравнений в кислотном растворе: основные правила
Если реакция происходит в кислой среде, уравнение окислительно-восстановительного потенциала можно сбалансировать следующим образом:
- Запишите полуреакции окисления и восстановления, включая все соединение, участвующее в реакции, а не только восстанавливаемый или окисляемый элемент. — (aq) [/ latex]
Во-первых, нам нужно разделить эту реакцию на две половинные реакции.- (водн.) [/ латекс]
Обратите внимание, что окончательное уравнение сбалансировано по массе, а также по заряду (каждая сторона уравнения имеет чистый заряд +3).
Хотя этот пример кажется устрашающим, балансировка окислительно-восстановительных реакций в кислотном растворе становится намного проще при осторожной практике.
Пример: балансировка окислительно-восстановительных реакций в основном растворе
Если в щелочном растворе происходит окислительно-восстановительная реакция, мы действуем так же, как и выше, с одним незначительным отличием: после того, как мы добавили H + ( водн. ), чтобы уравновесить атомы водорода, мы просто добавляем одинаковое количество гидроксидов с обеих сторон. уравнения.- (aq) + \ text {H} _2 \ text {O} (l) [/ latex]
Эта полуреакция теперь уравновешена по массе в основном растворе. Отсюда мы действуем так же, как и выше в кислотном растворе: уравновешиваем заряд, добавляя соответствующее количество электронов.
Балансировка уравнений окислительно-восстановительного потенциала, безусловно, может быть сложной и трудоемкой, поэтому разумно применять их на практике.
Баланс окислительно-восстановительной реакции (КИСЛОТНЫЙ раствор) : отличное пошаговое руководство о том, как сбалансировать окислительно-восстановительную реакцию в кислотном растворе.
Баланс окислительно-восстановительной реакции (ОСНОВНОЙ раствор) : отличное пошаговое руководство о том, как сбалансировать окислительно-восстановительную реакцию в основном растворе.
Окислительно-восстановительное титрование
Редокс-титрование определяет концентрацию аналита, содержащего окислитель или восстановитель.
Цели обучения
Рассчитайте концентрацию неизвестного аналита, выполнив окислительно-восстановительное титрование.
Основные выводы
Ключевые моменты
- Титрант — стандартизованный раствор; аналит — это анализируемое вещество.
- При окислительно-восстановительном титровании определяется концентрация неизвестного раствора (аналита), содержащего окислитель или восстановитель.
- Не для всех титров требуется внешний индикатор. Некоторые титранты могут служить собственными индикаторами, например, при титровании перманганата калия против бесцветного аналита.
Ключевые термины
- титрование : метод, в котором известные количества титранта добавляются к аналиту до тех пор, пока реакция не достигнет конечной точки
- аналит : любое вещество, подлежащее анализу
- титрант : стандартизованный раствор, используемый при титровании; раствор известной концентрации
Определение концентрации аналита
Как и в случае кислотно-основного титрования, окислительно-восстановительное титрование (также называемое окислительно-восстановительным титрованием) может точно определить концентрацию неизвестного аналита, измерив ее по стандартизованному титранту.{2 +} (водн.) +4 \ text {H} _2 \ text {O} (l) [/ latex]
В этом случае использование KMnO 4 в качестве титранта особенно полезно, поскольку он может действовать как собственный индикатор; это связано с тем, что раствор KMnO 4 имеет ярко-фиолетовый цвет, а раствор Fe 2+ — бесцветный. Таким образом, можно увидеть, когда титрование достигнет своей конечной точки, потому что раствор останется слегка пурпурным по сравнению с непрореагировавшим KMnO 4 .
Конечная точка перманганатного титрования : окислительно-восстановительное титрование с использованием перманганата калия в качестве титранта.Из-за своего ярко-фиолетового цвета KMnO4 служит отдельным индикатором. Обратите внимание, как достигается конечная точка, когда раствор остается слегка фиолетовым.
Пример: пример расчета на основе экспериментальных данных
Стандартизованный 4 М раствор KMnO4 титруют 100 мл образца неизвестного аналита, содержащего Fe 2+ . Студент проводит окислительно-восстановительное титрование и достигает конечной точки после добавления 25 мл титранта. Какая концентрация аналита?
Из приведенного выше сбалансированного уравнения мы знаем, что перманганат и железо реагируют в мольном соотношении 1: 5.{2 +} [/ латекс]
Теперь, когда мы знаем количество молей железа, присутствующего в образце, мы можем рассчитать концентрацию аналита:
[латекс] \ text {M} = \ frac {\ text {mol}} {\ text {L}} = \ frac {0.5 \ text {mol}} {0.100 \ text {L}} = 5 \ text { M} [/ латекс]
Другие типы окислительно-восстановительного титрования
Существуют различные другие типы окислительно-восстановительного титрования, которые могут быть очень полезными. Например, вина можно анализировать на диоксид серы, используя стандартизированный раствор йода в качестве титранта.В этом случае крахмал используется как индикатор; синий крахмал-йодный комплекс образуется в присутствии избытка йода, сигнализируя о конечной точке.
Другой пример — восстановление йода (I 2 ) до йодида (I —) тиосульфатом (S 2 O 3 2-), опять же с использованием крахмала в качестве индикатора. По сути, это обратное титрование того, что было только что описано; здесь, когда весь йод был уменьшен, синий цвет исчезает. Это называется йодометрическим титрованием.
Чаще всего восстановление йода до йодида является последней стадией в серии реакций, в которых начальные реакции используются для преобразования неизвестного количества аналита в эквивалентное количество йода, которое затем можно титровать. Иногда в промежуточных реакциях используются галогены (или органические соединения, содержащие галогены), отличные от йода, поскольку они доступны в виде стандартных растворов, которые лучше поддаются измерению, или они легче реагируют с аналитом. Хотя эти дополнительные этапы значительно усложняют иодометрическое титрование, они часто бывают полезными, потому что точка эквивалентности с участием ярко-синего комплекса йод-крахмал более точна, чем другие аналитические методы.
окислительно-восстановительных реакций | Протокол
Окисление и восстановление
Некоторые химические реакции можно классифицировать как реакции окисления-восстановления или окислительно-восстановительные реакции. Окисление — это процесс потери атомом одного или нескольких электронов, а восстановление — это процесс приобретения атомом одного или нескольких электронов.
Окислительные состояния
Каждый атом в молекуле имеет свою степень окисления или степень окисления. Степень окисления описывает степень окисления молекулы по отношению к ее свободной элементной форме.Степень окисления выражается как заряд, который имел бы атом, если бы каждая из его связей с другими элементами была чисто ионной. Это означает, что электроны в связи относятся к более электроотрицательному атому. Степень окисления атома в его свободной элементной форме определяется как 0.
Есть несколько правил, которым следуют для определения степени окисления. Элементы в группе I и группе II обычно имеют степень окисления +1 и +2 соответственно. Водород и кислород обычно имеют степень окисления +1 и -2 соответственно, а галогены обычно имеют степень окисления -1.Кроме того, степени окисления атомов в молекуле всегда увеличивают заряд молекулы. Таким образом, часто можно определить степень окисления атома, не указанного выше. Например, рассмотрим диоксид углерода (CO 2 ), который является нейтральной молекулой. Если каждая из двух молекул кислорода вносит -2, степень окисления углерода должна быть +4, чтобы компенсировать -4 у кислорода.
Для более общего подхода нарисуйте структуру Льюиса молекулы, определите связи между различными атомами и назначьте каждую связь более электроотрицательному атому.Затем подсчитайте количество электронов на каждом атоме, при этом каждая связь дает два электрона. Вычтите количество электронов, которые в настоящее время находятся на атоме, из стандартного количества валентных электронов для этого атома, чтобы получить степень окисления.
Снова рассмотрим углекислый газ. Каждый кислород имеет две неподеленные пары электронов и связан с центральным углеродом двойной связью. Кислород более электроотрицателен, чем углерод, поэтому каждая связь C = O, на которую приходится четыре электрона, связана с его кислородом.Таким образом, каждому кислороду приписывается всего восемь электронов (четыре от неподеленной пары и четыре от двойной связи), а углероду не присваивается ни одного. По умолчанию количество валентных электронов для кислорода равно шести, поэтому степень окисления для каждого кислорода составляет 6-8 = -2. По умолчанию количество валентных электронов углерода равно четырем, поэтому степень окисления углерода составляет 4-0 = +4.
Окислительно-восстановительные реакции
Не все химические реакции классифицируются как окислительно-восстановительные. Окислительно-восстановительная реакция — это любая реакция, в которой происходит изменение степени окисления атома.Таким образом, чтобы проверить, является ли реакция окислительно-восстановительной реакцией, определите степени окисления каждого атома в реагентах и продуктах и обратите внимание на любые изменения.
Многие окислительно-восстановительные реакции включают перенос электронов непосредственно от одной молекулы к другой. В этих реакциях, если одна молекула получает электрон, другая молекула должна потерять электрон. Один простой способ запомнить определения окисления и восстановления — использовать фразу OIL-RIG, которая означает: O xidation I s L osing — R eduction I s G aining.
Молекула, получающая электрон, восстанавливается, но ее называют окислителем или окислителем , потому что он окисляет другую молекулу. Точно так же молекула, которая теряет электрон, окисляется, но ее называют восстановителем или восстановителем , потому что он восстанавливает другую молекулу.
Существует четыре основных типа реакций, которые обычно включают окислительно-восстановительные процессы.
- Реакция одинарного замещения: Атом вытесняет другой атом, который является частью соединения, и замещает его.
- Реакция горения: Соединение восстанавливается сильным окислителем, обычно газообразным кислородом. Реакции горения, которые происходят между углеводородами и органическими соединениями, обычно приводят к образованию диоксида углерода и воды.
- Реакция синтеза: Два реагента образуют единый продукт.
- Реакция разложения: Один реагент распадается на два или более продукта.
Список литературы
1. Харрис, Д. К. (2015). Количественный химический анализ .Нью-Йорк, штат Нью-Йорк: В. Х. Фриман и компания.
Окисление-восстановление — обзор | Темы ScienceDirect
2.1.5 Окислительно-восстановительные реакции
Хотя многие окислительно-восстановительные (окислительно-восстановительные) реакции обратимы, они включены сюда, потому что многие окислительно-восстановительные реакции, влияющие на судьбу токсикантов, необратимы во временных и пространственных масштабах, что важно к токсичности.
Окисление — это потеря электронов — окислители являются электрофилами и, таким образом, приобретают электроны в результате реакции.Реакция окисления может привести к увеличению степени окисления химического вещества, так как окисление металлов или окисление может включать кислород в молекулу. Типичные органические химические окислительные реакции включают деалкилирование, эпоксидирование, расщепление ароматического кольца и гидроксилирование.
Термин «автоокисление» или «выветривание» обычно используется для описания общего окислительного разложения химического вещества (или химической смеси, например, нефти) под воздействием воздуха. Химические вещества могут абиотически реагировать как в воде, так и в воздухе с кислородом, озоном, пероксидами, свободными радикалами и синглетным кислородом.Последние два являются обычными промежуточными реагентами при непрямом фотолизе.
Известно, что минеральные поверхности катализируют многие окислительные реакции. Глинистые минералы и минералы, состоящие из оксидов кремния, алюминия, железа и марганца, могут обеспечивать поверхностно-активные центры, которые увеличивают скорость окисления. С этим катализом связано множество сложных механизмов, поэтому трудно предсказать каталитическую активность почв и отложений в природе.
С другой стороны, восстановление химического вещества происходит, когда донор электронов (восстановитель) передает электроны акцептору электронов (окислителю).Органические химические вещества обычно действуют как окислители, а абиотические восстановители, включая сульфидные минералы, восстанавливают металлы или соединения серы, а также природные органические вещества. Существуют также внеклеточные биохимические восстановители, такие как порфирины, корриноиды и металлсодержащие коферменты. Большинство этих восстановителей присутствует только в анаэробной среде, где анаэробные бактерии сами занимаются восстановлением химических веществ. Таким образом, различить биотические и абиотические восстановительные процессы в природе обычно очень сложно.Многие абиотические восстановительные превращения могут быть важны в окружающей среде, включая дегалогенирование, деалкилирование и восстановление производных хинона, нитрозамина, азоароматических, нитроароматических и сульфоксидных производных. Функциональные группы (таблицы 10.8 и 10.9), устойчивые к восстановлению (и, следовательно, к восстановительным процессам восстановления), включают альдегид, кетон, карбоновую кислоту (и сложноэфирные производные), амиды, алкены и производные ароматических углеводородов. Каждый тип химического вещества функциональной группы будет иметь определенную реакцию в окружающей среде и требует определенного процесса восстановления для очистки.
Таблица 10.8. Функциональные группы в органических химических веществах
Функциональная группа Тип Соединение Пример Название IUPAC Общее название CC 2 алк869 HCl Двойная связь 2Этен Этилен CC Тройная связь алкин HCCH Этин Ацетилен 868 -OH Метанол Метиловый спирт –O– Oxy эфир H 3 COCH 3 Метоксиметан Метиловый эфир Углерод и альд H 2 CO Метаналь Формальдегид e & gt; CO Карбонил кетон CH 3 COCH 3 Пропанон Ацетон −CO2− HCV карбоксилатная кислотаМуравьиная кислота −CO2- Карбоксил сложный эфир HCOOCH 2 CH 3 Этилметаноат Этилформиат 32 амин CH 3 NH 2 Аминометан Метиламин –CN Циано нитрил CH 3 CN галогеналкан CH 3 Cl Хлорметан M этилхлорид Таблица 10.9. Возможные реакции органических функциональных групп в окружающей среде
Функциональная группа Взаимодействие Карбоновая кислота, –COOH Ионный обмен, комплексообразование фенол 8 Спирт Водородная связь, комплексообразование Карбонил,> CO Восстановление-окисление Углеводород, [–CH 2 -] n Гидрофобные реакции окисления) — это реакции, в которых один из реагентов восстанавливается, а другой реагент окисляется.Следовательно, степень окисления вовлеченных частиц должна измениться. Слово сокращение первоначально относилось к потере веса при нагревании металлической руды, такой как оксид металла, для извлечения металла — руда была восстановлена до металла . Однако значение редукции стало обобщенным, чтобы включить все процессы, связанные с усилением электронов. Таким образом, в окислительно-восстановительных реакциях один вид окисляется, а другой восстанавливается за счет чистого переноса электрона от одного к другому.Как и следовало ожидать, изменение степени окисления окисленных частиц должно уравновешиваться любыми изменениями в восстановленных частицах. Например, производство железа из железооксидной руды:
Fe 2 O 3 + 3CO → 2Fe + 3CO 2
Чтобы еще больше усложнить ситуацию, окислитель и восстановитель могут быть одним и тем же элементом. или химический, как в случае диспропорционирования реакционноспособных частиц. Например:
2A → (A + n ) + (A — n )
В этом уравнении n — это количество перенесенных электронов.Реакции диспропорционирования не обязательно должны начинаться с нейтральной молекулы и могут включать более двух соединений с разными степенями окисления.
В окислительно-восстановительных реакциях всегда должна происходить пара реакций, то есть реакция восстановления должна сопровождаться процессом окисления, поскольку электроны передаются от одного вещества к другому. Каждая из сингулярных реакций в этой паре называется полуреакцией, в которую явно включены потерянные или полученные электроны, что позволяет также учитывать баланс электронов.Две стороны реакции, представленные полуреакциями, должны быть соответственно уравновешены. Дополнительная терминология исходит из определения, что в окислительно-восстановительных процессах восстановитель передает один электрон или несколько электронов окислителю; следовательно, восстановитель (восстановитель) теряет электроны и окисляется, в то время как окислитель (окислитель) приобретает электроны и восстанавливается.
Редокс-реакции важны для ряда приложений, включая устройства хранения энергии (батареи), обработку фотографий, а также производство и использование энергии в живых системах, включая человека.Например, реакция восстановления — это реакция, в которой атом приобретает электрон и, следовательно, уменьшает (или снижает его степень окисления). В результате снижается положительный характер вида. С другой стороны, реакция окисления — это реакция, в которой атом теряет электрон и, следовательно, увеличивает степень его окисления. В результате положительный характер вида увеличивается.
Хотя реакции окисления обычно связаны с образованием оксидов из молекул кислорода, это лишь частные примеры более общей концепции реакций, включающих перенос электрона.Редокс-реакции представляют собой согласованный набор, то есть не может быть реакции окисления без одновременной реакции восстановления. Реакция окисления и реакция восстановления всегда протекают вместе, образуя целостную реакцию. Хотя окисление и восстановление правильно относятся к как изменение степени окисления , фактический перенос электронов может никогда не произойти. Степень окисления атома — это фиктивный заряд, который атом имел бы, если бы все связи между атомами различных элементов были на 100% ионными.Таким образом, окисление лучше всего определяется как увеличение на степени окисления , а восстановление как уменьшение на степени окисления . На практике перенос электронов всегда вызывает изменение степени окисления, но есть много реакций, которые классифицируются как окислительно-восстановительные реакции, даже если перенос электронов не происходит (например, с участием ковалентных связей).
Ключ к идентификации окислительно-восстановительных реакций — это распознать, когда химическая реакция приводит к изменению степени окисления одного или нескольких атомов.
Реакция окисления-восстановления — обзор
Основные ферменты, ответственные за метаболизм (биотрансформацию)
Большинство реакций окисления, восстановления и гидролиза осуществляется ферментами цитохрома P 450 (CYP), которые отвечают за биотрансформацию большое количество эндогенных соединений, фармакологических агентов и химикатов окружающей среды. Суперсемейство CYP включает по крайней мере 74 семейства гемсодержащих ферментов, 12 из которых, как было показано, существуют у всех млекопитающих.В целом, биотрансформация ксенобиотиков осуществляется только ограниченным количеством ферментов у млекопитающих, которые обладают широкой субстратной специфичностью, например, три CYP, CYP2C, CYP2D и CYP3A отвечают за метаболизм более половины лекарств и химических веществ окружающей среды, которым мы подвергаемся. . Основная часть CYP находится в печени с низкой, но значительной экспрессией и функциональной активностью в других тканях (например, слизистой оболочке желудочно-кишечного тракта, легких, почках, коже и головном мозге).
Члены семейства CYP1 (CYP1A1, CYP1A2 и CYP1B1) участвуют в метаболизме полициклических и галогенированных ароматических углеводородов, ароматических аминов и эстрадиола / стероидов.CYP2 — это самое разнообразное семейство CYP, биотрансформирующее несколько важных терапевтических средств, включая анестетики, органические растворители и химические вещества, относящиеся к окружающей среде. Ферменты CYP3A (например, CYP3A4, CYP3A5, CYP3A7 и CYP3A43) являются наиболее часто (в среднем 30-40%), обнаруживаемыми CYP в печени и ответственными за метаболизм широкого спектра терапевтических средств (~ 50% наиболее часто встречающихся). использованные лекарства) и экологические химикаты. CYP4 — это основное семейство ферментов, которое катализирует ω-гидроксилирование жирных кислот и состоит по крайней мере из пяти подсемейств.Он также катаболизирует арахидоновую кислоту и ее производные (например, лейкотриены и простаноиды), а также может метаболизировать ксенобиотики, включая терапевтические препараты.
Другие биотрансформирующие ферменты, ответственные за окисление, восстановление и гидролиз, включают флавинсодержащие монооксигеназы (FMO), семейство генов из шести членов, эпоксидгидролазы, эстеразы, амидазы, алкоголь и альдегиддегидрогеназы, альдегид / кетонредуктазы, параоксоназы (PON) , и другие (таблица 1). Ферменты FMO катализируют НАДФН-зависимые реакции окисления широкого спектра химических веществ, содержащих нуклеофильный азот, серу, селен и / или фосфор.Эпоксидгидролаза является важным гидролитическим ферментом, обнаруженным во многих тканях, и катализирует гидролиз ареноксидов и алифатических эпоксидов до их соответствующих транс-1,2-дигидродиолов. Ткани млекопитающих содержат большое количество эстераз и амидаз, которые могут гидролизовать сложноэфирные и амидные связи химических веществ. В реакциях окисления-восстановления спирта, альдегида и кетона участвуют алкогольдегидрогеназы, альдегидредуктаза, кетонредуктаза и различные ферменты, окисляющие альдегид (например, альдегиддегидрогеназа и альдегидоксидаза).Помимо эндогенной роли PON в метаболизме и удалении окисленных липидов, защищающих человека от сосудистых заболеваний, он также участвует в метаболизме ряда фосфорорганических соединений. Они выражены в печени, почках, толстой кишке и крови. Некоторые семейства PON экспрессируются более повсеместно в тканях и обнаруживаются внутри и на поверхности клеток (Таблица 1).
Реакции конъюгации образуют конъюгаты ксенобиотиков с молекулами органических доноров с малой молекулярной массой (например,g., глутатион, уридин-5′-дифосфо-α-d-глюкуроновая кислота, ацетилкофермент A). Эти реакции обычно приводят к инактивации / детоксикации ксенобиотиков; хотя в редких случаях также происходит биоактивация ксенобиотиков при конъюгации. Реакции конъюгации катализируются множеством ферментов (например, глутатион S -трансферазы, глюкуронозилтрансферазы, сульфотрансферазы, ариламин N -ацетилтрансферазы и метилтрансферазы).
Глутатион, тиолсодержащий трипептид, играет ключевую роль в детоксикации, способствуя устранению большого количества электрофилов путем конъюгации.Многие из реакционноспособных групп, конъюгированных с глутатионом, образуются в клеточных окислительных реакциях, катализируемых CYP и другими оксидазами. Конъюгация глутатиона с электрофилами катализируется 13 различными глутатион-S-трансферазами (GST) с перекрывающейся субстратной специфичностью. Уридин-5′-дифосфоглюкуронозилтрансфераза (UGT), семейство из 16 различных UGT, глюкуронидат сотен гидрофобных эндогенных молекул (например, билирубина, желчных кислот, тироксина и стероидов) и экзогенных химических веществ, включая потенциально канцерогенные или тератогенные соединения, попадающие в организм диета или воздух.Сульфотрансферазы (SULT) состоят по крайней мере из 11 различных изоформ, которые катализируют сульфатную конъюгацию различных эндогенных и экзогенных химических веществ с использованием 3′-фосфоаденозин-5′-фосфосульфата (PAPS) в качестве донора. Сульфатирование обычно приводит к снижению биологической активности эндогенных и / или экзогенных химических веществ, оно играет ключевую роль в биосинтезе стероидных гормонов, метаболизме катехоламинов и гомеостазе гормонов щитовидной железы. Группа из N -ацетилтрансфераз (NAT), биотрансформирующих ферментов, метаболизирует ароматические аминовые или гидразиновые группы до ароматических амидов и гидразидов с использованием кофактора ацетил-КоА.Тиопурин S -метилтрансфераза (TPMT) представляет собой цитозольный фермент, который катализирует метилирование S ароматических и гетероциклических серосодержащих соединений. NAT — один из первых ферментов, обладающих генетическим полиморфизмом, который резко влияет на кинетику его субстратов, что приводит к разделению общей популяции на быстрые и медленные ацетилирующие вещества.
Реакции окисления-восстановления
Реакции окисления-восстановления
Процесс открытия: окисление и Редукция
Первый шаг к теории химических реакций был сделан Георгом Эрнстом Шталем в 1697, когда он предложил теорию флогистона , которая была основана на следующих наблюдения.
- Металлы имеют много общих свойств.
- Металлы при нагревании часто образуют «накипь». (Термин calx определяется как рассыпчатый осадок, оставшийся после обжига минерала или металла.)
- Эти окалины не такие плотные, как металлы, из которых они сделаны.
- Некоторые из этих окалинов образуют металлы при нагревании древесным углем.
- За редким исключением, калькс встречается в природе, а не в металле.
Эти наблюдения привели Шталь к следующим выводам.
- Флогистон (от греч. phlogistos , «сжигать»). всякий раз, когда что-то горит.
- Древесина и древесный уголь особенно богаты флогистоном, так как оставляют очень мало золы. когда они горят. (Свечи должны быть почти из чистого флогистона, потому что они не оставляют золы.)
- Так как кальки встречаются в природе, они должны быть проще металлов.
- Металлы образуют окалину, выделяя флогистон.
Калкс + флогистон
- Металлы можно получить, добавляя флогистон к известняку.
Calx + флогистон, металл
- Поскольку древесный уголь богат флогистоном, нагревание кальция в присутствии древесного угля иногда производит металлы.
Эта модель оказалась на удивление успешной. Это объяснило, почему металлы обладают схожими свойствами: все они содержат флогистон.Это объяснили взаимосвязь между металлами и их кальцием: они связаны с увеличением или уменьшением флогистона. Это даже объяснил, почему свеча гаснет, когда в колпаке воздух со временем насыщается флогистоном.
С теорией флогистона была только одна проблема. Еще в 1630 году Жан Рей отмечал это олово набирает вес, когда образует окалину. (Кальк примерно на 25% тяжелее, чем металл.) С нашей точки зрения, это фатальный недостаток: если флогистон выделяется Когда металл образует окалину, почему окалина весит больше, чем металл? Это наблюдение не беспокоил сторонников теории флогистона.Шталь объяснил это, предположив, что вес увеличился, потому что воздух проник в металл, чтобы заполнить вакуум, оставшийся после флогистон уцелел.
Теория флогистона была основой химических исследований на протяжении большей части 18-го века. век. Лишь в 1772 году Антуан Лавуазье заметил, что неметаллы становятся все более популярными. количество веса при сжигании на воздухе. (Вес фосфора, например, увеличивается на примерно в 2,3 раза). Величина этого изменения привела Лавуазье к выводу, что фосфор должен соединиться с чем-то на воздухе при горении.Этот вывод был подкрепленные наблюдением, что объем воздуха уменьшается в 1/5 раза, когда фосфор горит в ограниченном количестве воздуха.
Лавуазье предложил название кислород (буквально «кислотообразующий») для вещество, абсорбируемое из воздуха при горении соединения. Он выбрал это имя, потому что продукты сгорания неметаллов, таких как фосфор, являются кислотами, когда они растворяются в вода.
P 4 ( s ) + 5 O 2 ( g ) P 4 O 10 ( s ) P 4 O 10 ( s ) + 6 H 2 O ( l ) 4 H 3 PO 4 ( водн. Кислородная теория горения Лавуазье была в конечном итоге принята, и химики начали описывают любую реакцию между элементом или соединением и кислородом как окисление .Например, реакция между металлическим магнием и кислородом включает окисление магний.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
К началу 20-го века казалось, что все реакции окисления имеют одно в обычном окислении всегда казалось, связано с потерей электронов. Поэтому химики разработали модель этих реакции, которые сосредоточены на переносе электронов. Металлический магний, например, был Считается, что он теряет электроны с образованием ионов Mg 2+ при взаимодействии с кислородом.От Обычно считается, что элемент или соединение, которое приобрело эти электроны, подверглось восстановлению . В этом случае говорят, что молекулы O 2 восстанавливаются с образованием ионов O 2-.
Классическая демонстрация окислительно-восстановительных реакций включает размещение кусочка медную проволоку в водный раствор иона Ag + . Реакция включает чистый перенос электронов от металлической меди к ионам Ag + с образованием вискеров металлическое серебро, которое вырастает из медной проволоки, и ионы Cu 2+ .
Cu ( с ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с )
Ионы Cu 2+ , образующиеся в этой реакции, ответственны за голубой цвет раствора. Их наличие можно подтвердить, добавив в этот раствор аммиак. с образованием темно-синего комплексного иона Cu (NH 3 ) 4 2+ .
Химики со временем поняли, что окислительно-восстановительные реакции не всегда включают перенос электронов.Нет изменений в количестве валентных электронов ни на одном из атомы, когда CO 2 реагирует с H 2 , например,
CO 2 ( г ) + H 2 ( г ) CO ( г ) + H 2 O ( г )
, как показано следующими структурами Льюиса:
Поэтому химики разработали концепцию степени окисления , чтобы расширить идея окисления и восстановления до реакций, в которых электроны на самом деле не приобретаются или потеряли.Наиболее мощная модель окислительно-восстановительных реакций основана на следующие определения.
Окисление включает увеличение степени окисления атома.
Восстановление происходит, когда степень окисления атома уменьшается .
Согласно этой модели, CO 2 восстанавливается, когда он реагирует с водородом, потому что степень окисления углерода снижается с +4 до +2. Водород окисляется в этом реакция, потому что его степень окисления увеличивается от 0 до +1.
Реакции окисления-восстановления
Мы находим примеры окислительно-восстановительных или окислительно-восстановительных реакций почти каждый раз мы анализируем реакции, используемые как источники тепла или работы. Когда естественно газовые ожоги, например, происходит окислительно-восстановительная реакция, в результате которой выделяется более 800 кДж / моль энергии.
CH 4 ( г ) + 2 O 2 ( г ) CO 2 ( г ) + 2 H 2 O ( г )
В нашем организме последовательность окислительно-восстановительных реакций используется для сжигания сахаров, такие как глюкоза (C 6 H 12 O 6 ) и жирные кислоты в жирах мы едим.
C 6 H 12 O 6 ( водн. ) + 6 O 2 ( г ) 6 CO 2 ( г ) + 6 H 2 O ( л ) CH 3 (CH 2 ) 16 CO 2 H ( водн. ) + 26 O 2 ( г ) 18 CO 2 ( г ) + 18 H 2 O ( л ) Нам не нужно ограничиваться реакциями, которые могут быть использованы как источник энергии, однако, чтобы найти примеры окислительно-восстановительных реакций.Серебряный металл, для например, окисляется при контакте со следовыми количествами H 2 S или SO 2 в атмосфере или пищевых продуктах, таких как яйца, которые богаты серой соединения.
4 Ag ( г ) + 2 H 2 S ( г ) + O 2 ( г ) 2 Ag 2 S ( с ) + 2 H 2 O ( г )
К счастью, пленка Ag 2 S, которая собирается на поверхности металла, образует защитное покрытие, замедляющее дальнейшее окисление металлического серебра.
Потускнение серебра — лишь один пример широкого класса окислительно-восстановительных реакции, которые подпадают под общую рубрику коррозия . Другой Примером может служить серия реакций, которые происходят, когда железо или сталь ржавеют. При нагревании утюг реагирует с кислородом с образованием смеси оксидов железа (II) и железа (III).
2 Fe ( с ) + O 2 ( г ) 2 FeO ( с ) 2 Fe ( с ) + 3 O 2 ( г ) 2 Fe 2 O 3 ( с ) Расплавленное железо реагирует даже с водой с образованием водного раствора ионов Fe 2+ и газ H 2 .
Fe ( л ) + 2 H 2 O ( л ) Fe 2+ ( водн. ) + 2 OH — ( водн. ) + H 2 ( г )
Однако при комнатной температуре все три реакции настолько медленны, что могут игнорируется.
Железо коррозирует только при комнатной температуре в присутствии кислорода и воды. в В ходе этой реакции железо окисляется с образованием гидратированной формы оксида железа (II).
2 Fe ( с ) + O 2 ( водн. ) + 2 H 2 O ( л ) 2 FeO H 2 O ( с )
Поскольку это соединение имеет ту же эмпирическую формулу, что и Fe (OH) 2 , оно часто ошибочно называют гидроксидом железа (II) или двухвалентного железа. FeO H 2 O, образовавшийся в эта реакция далее окисляется O 2 , растворенным в воде, с образованием гидратированного форма железа (III) или оксида трехвалентного железа.
4 FeO H 2 O ( с ) + O 2 ( водн. ) + 2 H 2 O ( л ) 2 Fe 2 O 3 3 H 2 O ( с )
Чтобы еще больше усложнить ситуацию, на поверхности металла образовался FeO H 2 O соединяется с Fe 2 O 3 3 H 2 O с образованием гидратированной формы магнитный оксид железа (Fe 3 O 4 ).
FeO H 2 O ( s ) + Fe 2 O 3 3 H 2 O ( s ) Fe 3 O 4 n H 2 O ( s )
Поскольку эти реакции происходят только в присутствии воды и кислорода, автомобили имеют тенденцию ржаветь в местах скопления воды.Кроме того, поскольку самый простой способ предотвратить железо от ржавчины покрывать металл таким образом, чтобы он не контактировал с водой, автомобили были изначально красили только по одной причине, чтобы замедлить образование ржавчины.
Присвоение номеров окисления
Ключом к идентификации окислительно-восстановительных реакций является определение того, когда химическое реакция приводит к изменению степени окисления одного или нескольких атомов.Следовательно, это Хорошая идея — еще раз взглянуть на правила определения степеней окисления. От По определению, степень окисления атома равна заряду, который должен присутствовать на атом, если соединение состоит из ионов. Если предположить, что CH 4 содержит ионы C 4- и H + , например, степени окисления атомы углерода и водорода были бы -4 и +1.
Обратите внимание, что не имеет значения, действительно ли соединение содержит ионы.Окисление число — это заряд, который имел бы атом, если бы соединение было ионным. Концепция чего-либо степень окисления — это не что иное, как система бухгалтерского учета, используемая для отслеживания электронов в химических реакциях. Эта система основана на ряде правил, кратко изложенных в таблице. ниже.
Правила присвоения номеров окисления - Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы только один элемент.Таким образом, атомы в O 2 , O 3 , P 4 , S 8 , и металлический алюминий имеют степень окисления 0.
- Степень окисления одноатомных ионов равна заряду иона. Окисление количество натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
- Степень окисления водорода равна +1, когда он сочетается с неметаллом .Следовательно, водород находится в степени окисления +1 в CH 4 , NH 3 , H 2 O, и HCl.
- Степень окисления водорода составляет -1, когда он сочетается с металлом . Следовательно, водород находится в степени окисления -1 в LiH, NaH, CaH 2 и LiAlH 4 .
- Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S) в атом металла находится в степени окисления +1.
- Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ) в котором атом металла находится в степени окисления +2.
- Кислород обычно имеет степень окисления -2. Исключения включают молекулы и многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 , и ион O 2 2-.
- Неметаллы в группе VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ) в котором неметалл находится в степени окисления -1.
- Сумма степеней окисления атомов в молекуле равна заряду на молекула.
- Самый электроотрицательный элемент в соединении имеет отрицательную степень окисления.
Любой набор правил, каким бы хорошим он ни был, поможет вам только до определенного момента. Тогда вам придется полагаться на сочетании здравого смысла и предшествующих знаний. Вопросы, которые нужно иметь в виду, пока Присвоение степеней окисления включает следующее: Есть ли какие-либо распознаваемые ионы, скрытые в молекуле? Имеет ли смысл степень окисления в с точки зрения известной электронной конфигурации атома?
Распознавание окисления-восстановления Реакция
Химические реакции часто делятся на две категории: окислительно-восстановительные и реакции метатезиса. Реакции метатезиса включают кислотно-основные реакции которые включают перенос иона H + от кислоты Бренстеда к кислоте Бренстеда. база.
CH 3 CO 2 H ( водн. ) + ОН — ( водн. ) CH 3 CO 2 — ( водн. ) + H 2 O ( л ) Кислота Бренстеда База Brnsted База Brnsted Кислота Бренстеда Они также могут включать разделение пары электронов донором электронной пары. (Основание Льюиса) и акцептор электронной пары (кислота Льюиса).
Co 3+ ( водн. ) + 6 НЕТ 2 — ( водн. ) Co (НЕТ 2 ) 6 3- ( водн. ) Кислота Льюиса База Льюиса окислительно-восстановительные реакции или окислительно-восстановительные реакции банка включают перенос одного или нескольких электронов.
Cu ( с ) + 2 Ag + ( водн. ) Cu 2+ ( водн. ) + 2 Ag ( с )
Они также могут возникать при переносе атомов кислорода, водорода или галогена.
CO 2 ( г ) + H 2 ( г ) CO ( г ) + H 2 O ( г ) SF 4 ( г ) + F 2 ( г ) SF 6 ( г ) К счастью, существует почти надежный метод различения метатезиса. и окислительно-восстановительные реакции.Реакции, в которых ни один из атомов не претерпевает изменений в окислении число метатезиса реакций. Нет изменений в окислении количество любого атома, например, в любой из реакций метатезиса.
Слово метатезис буквально означает «обмен» или «транспозиция», и он используется для описания изменений, которые происходят в порядке буквы или звуки в слове по мере развития языка. Метатезис происходил, например, когда Старое английское слово brid превратилось в bird .В химии используется метатезис для описания реакций обмена атомами или группами атомов между молекулами.
Когда хотя бы один атом претерпевает изменение в степени окисления, реакция является окислительно-восстановительная реакция. Таким образом, каждая из реакций на рисунке ниже является пример окислительно-восстановительной реакции.
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов.Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горениеПолено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу.
© chrispecoraro / iStock.comПопулярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии.Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару. Аммиак — пример основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции.Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы. Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстановителя к окислителю.Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и, по сути, самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение и изготовление вина и сыра — вот многие из многих примеров деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий.Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, происходящих во всех живых системах.
Следует отличать химические реакции от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода.Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
тающий ледТающий лед, водопад Нижнее Чистилище, на притоке реки Сухеган между Мон-Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-ГэмпшираИсторический обзор
Концепция химической реакции возникла около 250 лет назад.Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы. Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПервые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли.Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, который подтвердил важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом.Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Еще одним событием, имеющим историческое значение в отношении химических реакций, было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который в начале XIX века постулировал свою атомную теорию. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ.Такой взгляд на химические реакции точно определяет текущую тему. Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
