Конус нарастания растения
Конус нарастания растения
Внутри
почки
заключена
меристематическая
верхушка
побега
— его апекс, основная часть которого представляет собой конус нарастания.
Деятельность конуса нарастания обеспечивает формирование всех тканей и
частей побега, т.е. его органогенез и гистогенез. Конус нарастания не
обязательно имеет геометрическую форму конуса, нередко это плоская или даже
вогнутая вершинная часть апекса, сложенная особыми клетками —
инициалями
верхушечной
меристемы
и ближайшими их производными. В результате меристематической активности
апекса образуются зачатки листьев (
листовые примордии
), зачаточные
узлы
и
междоузлия
. В пазухах зачаточных
листьев
обычно располагаются зачатки почек следующего порядка. Ритм появления
зачаточных листьев характерен для каждого растения и в известной мере
определяет характер листорасположения взрослого побега.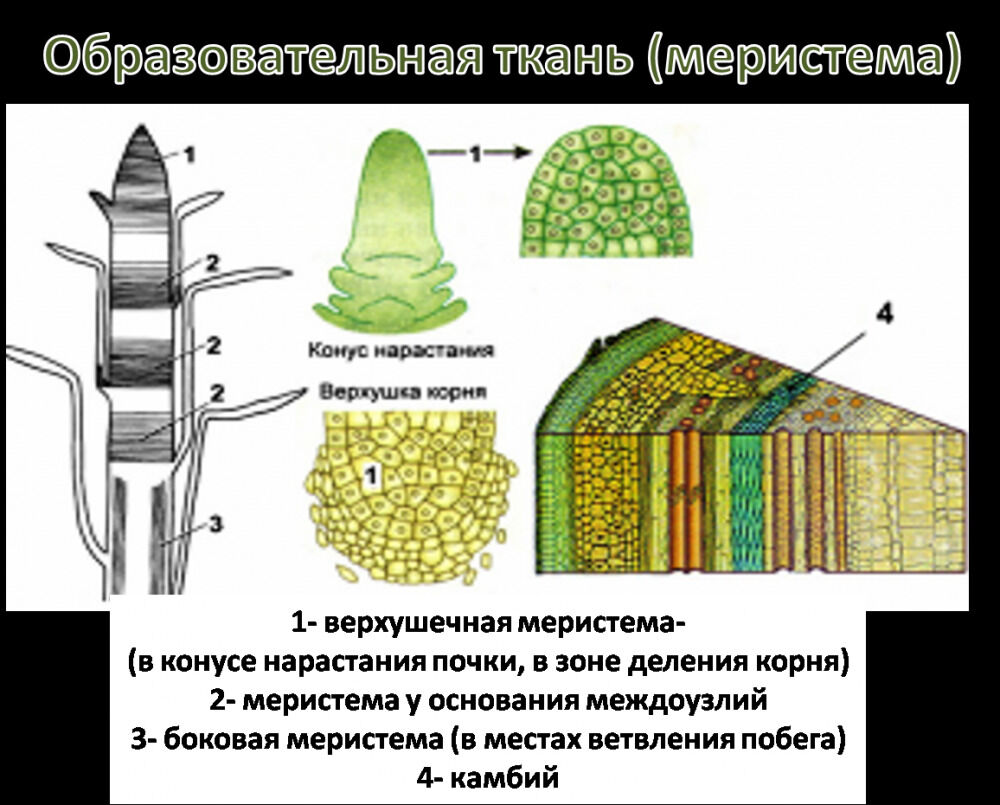
Меристематическая активность конуса нарастания в разных его частях
неодинакова. Существует ряд теорий, объясняющих неодинаковый характер
деятельности его разных зон, в частности, теория
«туники-корпуса», сформулированная немецким ботаником А.Шмидтом.
Согласно этой теории конус нарастания у
покрытосеменных
и части
голосеменных
состоит из двух гистологически разных частей, обладающих различной
меристематической активностью
. Наружная часть конуса нарастания получила название туники, а внутренняя
— корпуса. Самые наружные клетки туники — клетки
протодермы
— образуют первичную покровную ткань —
эпидерму
, а лежащие глубже — внутренние ткани
листа
и первичную кору
стебля
. Клетки корпуса делятся во всех направлениях и обеспечивают объемный рост
апекса. На границе туники и корпуса на уровне листовых зачатков
закладывается так называемая периферическая меристема, или инициальное
кольцо. Именно здесь в этой меристеме закладываются тяжи относительно узких
и длинных, продольно делящихся клеток
прокамбия
, дающих начало
проводящим пучкам
.
Ссылки:
Найдите три ошибки в тексте «Растительные ткани». Укажите номера предложений, в которых сделаны ошибки, исправьте их.( 1)Образовательная ткань состоит из живых тонкостенных клеток, способных к постоянному делению, и обеспечивает рост растения. (2)Клетки первичной образовательной ткани располагаются между древесиной и лубом и обеспечивают рост стебля и корня в толщину, а клетки вторичной образовательной ткани находятся в конусе нарастания побега, кончике корня, основании листовой пластинки, междоузлиях злаковых растений и обеспечивают рост органов в длину. (3)Клетки основной ткани живые, тонкостенные; обеспечивают жизнедеятельность растения. (4)К основным тканям относят ассимиляционную, запасающую, воздухоносную, водоносную и пробку.
 (5) Проводящая ткань бывает двух типов: древесина (флоэма) и луб (ксилема). (6)Основные элементы проводящей ткани
2363. Найдите три ошибки в тексте «Растительные ткани». Укажите номера предложений, в которых сделаны ошибки, исправьте их.
(5) Проводящая ткань бывает двух типов: древесина (флоэма) и луб (ксилема). (6)Основные элементы проводящей ткани
2363. Найдите три ошибки в тексте «Растительные ткани». Укажите номера предложений, в которых сделаны ошибки, исправьте их.(1)Образовательная ткань состоит из живых тонкостенных клеток, способных к постоянному делению, и обеспечивает рост растения. (2)Клетки первичной образовательной ткани располагаются между древесиной и лубом и обеспечивают рост стебля и корня в толщину, а клетки вторичной образовательной ткани находятся в конусе нарастания побега, кончике корня, основании листовой пластинки, междоузлиях злаковых растений и обеспечивают рост органов в длину. (3)Клетки основной ткани живые, тонкостенные; обеспечивают жизнедеятельность растения. (4)К основным тканям относят ассимиляционную, запасающую, воздухоносную, водоносную и пробку. (5) Проводящая ткань бывает двух типов: древесина (флоэма) и луб (ксилема). (6)Основные элементы проводящей ткани — сосуды и ситовидные трубки, которые обеспечивают проведение растворов минеральных и органических веществ, то есть восходящий и нисходящий ток веществ.
Показать подсказку
Ошибки допущены в предложениях 2, 4, 5:
2) Клетки первичной образовательной ткани имеют следующую локализацию: конус нарастания побега, зона деления корня, основание листовой пластинки, междоузлия злаковых растения. Образовательная ткань обеспечивает рост органов в длину, а клетки вторичной образовательной ткани локализуются между древесиной и лубом, обеспечивают рост стебля и корня в толщину
4) В группу основных тканей включаются: ассимиляционная (хлоренхима), водоносная, запасающая, воздухоносная (аэренхима)
5) Проводящая ткань бывает двух типов: древесина (ксилема) и луб (флоэма)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 2363.
Конус нарастания — Справочник химика 21
Отечественными биологами в последние годы был разработан и рекомендован для практического использования метод биологического контроля за развитием и ростом растений. Этот метод предусматривает фенологические наблюдения и регулярные учеты состояния конусов нарастания, а также определение этапов органогенеза органов размножения растений.Перед анализом восстанавливают эластичность растений и нормальную форму конуса нарастания. Используется способность протоплазмы клеток к обратимой гидратации (поглощение воды клетками). Упругость тканей восстанавливают кипятком. Засушенные растения перед самым анализом бросают в кипящую воду и кипятят около 10—15 минут, вынимают из воды и анализируют. Растение перестает быть ломким, и становится возможным определить фазу, число и разм ы развития органов. Конус нарастания особенно хорошо сохраняет упругость тканей и свою истинную форму.
 [c.6]
[c.6]Почки и конусы нарастания крупных размеров можно фиксировать в кусочках марли мелкие органы помещают в маленькие пробирки минутки — объемом 3—5 мл. В пробирки наливают фиксатор, закрывают плотно ватным тампоном и ставят вместе с другими пробирками в банку с притертой пробкой, наполненную тем же фиксатором. [c.7]
В основаниях черешков товые побеги З — конус нарастания [c.113]
Для анатомических и гистохимических анализов растения консервируют в жидких фиксаторах. Лучшим фиксатором конусов нарастания у растений на I—VI этапах органогенеза является смесь из 6,5 части уксусной, а лучше пропионовой кислоты, 10 частей 40-процентного формалина и 83,5 части этилового 70-процентного спирта. [c.6]
Развитие генеративных органов растения у злаковых определяют по этапу органогенеза конуса нарастания главного побега.
С этой целью конус нарастания побега отделяют от растения и рассматривают на предметном стекле под бинокулярной лупой или микроскопом. На I—V этапах органогенеза конус можно рассматривать целиком на сухом предметном стекле и без покровного стекла при малых увеличениях. [c.8]
На I—V этапах органогенеза конус можно рассматривать целиком на сухом предметном стекле и без покровного стекла при малых увеличениях. [c.8]
Микрофотографирование — удобный способ документации единичных факторов и последовательного процесса органогенеза типов повреждения конусов нарастания растений насекомыми, морозами и другими факторами самих вредителей растений и т. д. [c.12]
Отрицательное влияние на размеры будущего колоса может оказать недостаток питательных веществ и влаги в почве, недостаток света и воздушная засуха. Все эти факторы могут вызвать недостаточное развитие колосковых бугорков в верхней части конуса нарастания. [c.14]
I этап органогенеза представлен в виде недифференцированного конуса нарастания — бугорка в 0,2—0,3 мм величиной, основание которого несколько шире, чем у пшеницы. Первый этап совпадает с фазой всходов (рис. 2). [c.16]
II этап начинается при развертывании третьего настоящего листа. В это же время у озимой ржи наступает фаза кущения. На этом этапе конус нарастания несколько вытягивается в длину и начинается дифференциация укороченного стебля на узлы и междоузлия. [c.16]
В это же время у озимой ржи наступает фаза кущения. На этом этапе конус нарастания несколько вытягивается в длину и начинается дифференциация укороченного стебля на узлы и междоузлия. [c.16]
У конуса нарастания вытягивается в длину верхняя часть и усиленно дифференцируется его нижняя часть на отдельные сегменты — будущие междоузлия, формируются листовые валики. [c.16]
IV этап наступает при переходе ржи к фазе трубкования. На конусе нарастания начинают закладываться в виде бугорков зачаточные колоски этот процесс начинается ранней весной. Формирование колосков идет снизу вверх, то есть сначала они закладываются в нижней части конуса нарастания, затем в средней и позже — в верхней.
I этап органогенеза у ячменя наблюдается в фазу всходов. Конус нарастания на этом этапе представляет собой бугорок величиной от 0,25 до 0,5 мм. [c.18]
На II этапе органогенеза конус нарастания незначительно удлиняется, у его основания формируются зачаточные узлы, обычно их бывает 5—6. Этот этап совпадает с фазой третьего листа. [c.18]
Этот этап совпадает с фазой третьего листа. [c.18]
На III этапе органогенеза вытягивается верхняя часть конуса нарастания, а нижняя часть его дифференцируется на отдельные сегменты — зачаточные узлы стебля, одновременно формируются зачаточные листовые образования, которые впоследствии не развиваются. По времени этот этап органогенеза совпадает с фазой кущения. [c.18]
VI этап органогенеза тоже проходит в фазу трубкования. На конусе нарастания идет дальнейшее формирование генеративных элементов цветков — тычинок и пестика. В тканях пыльников образуются сначала тетрады, а затем одноядерная пыльца. [c.19]
На I этапе органогенеза конус нарастания представляет собой бугорок размером не более 0,3 мм. Этот этап совпадает с фазой всходов. [c.19]
Конус нарастания несколько вытягивается. В это время происходит дифференциация зачаточных стеблевых органов на узлы и междоузлия, которые в этот период бывают вплотную сдвинуты друг к другу. Избыточное азотное питание может вызвать преждевременный рост междоузлий, отчего снижается устойчивость растений к полеганию. Полегать они могут и от избыточного загущения посевов. Калийные и фосфорные удобрения, внесенные до посева или при ранней подкормке, задерживают вытягивание междоузлий и предотвращают полегание растений.
Избыточное азотное питание может вызвать преждевременный рост междоузлий, отчего снижается устойчивость растений к полеганию. Полегать они могут и от избыточного загущения посевов. Калийные и фосфорные удобрения, внесенные до посева или при ранней подкормке, задерживают вытягивание междоузлий и предотвращают полегание растений.
I этап — конус нарастания недифференцирован и состоит в основном из эмбриональной ткани. В фазу всходов он представлен бугорком с широким основанием. У основания видны зачатки листьев. [c.22]
II этап — формируются междоузлия и узлы зачаточного конуса нарастания. [c.22]
III этап характеризуется ростом длины конуса нарастания, сегментацией его средней части и началом закладки бугорков первичных валиков в его нижней части, которые затем не развиваются. Этот этап проходит быстро — в течение 1—4 дней. [c.22]
IV этап характеризуется формированием соцветия — конусов нарастания, дающих начало веточкам второго порядка, и колосковых лопастей происходит усиленный рост конуса нарастания. Из каждой лопасти образуется два колосковых бугорка, а потом и сами колоски. В нижней части колоскового бугорка возникает складка, из нее развиваются колосковые чешуи. [c.23]
Из каждой лопасти образуется два колосковых бугорка, а потом и сами колоски. В нижней части колоскового бугорка возникает складка, из нее развиваются колосковые чешуи. [c.23]
I этап — конус нарастания недифференцирован, его основание широкое, поверхность гладкая. [c.23]
II этап — конус нарастания начинает несколько вытягиваться и происходит заложение сильно сближенных узлов и обертки початка. [c.23]
III этап — продолжается вытягивание в длину конуса нарастания, сегментация основания и образование валиков, внешне похожих на настоящие зачаточные валики листьев валики эти впоследствии редуцируются. Продолжительность III этапа не более 3—5 дней. [c.23]
IV этап — у конуса нарастания развиваются лопасти, из которых образуется по два колоска. В свою очередь у основания колоскового бугорка образуется складка, которая превращается в колосковую чешую. [c.23]
Темпы роста и развития конусов нарастания генеративных побегов и их устойчивость к злаковым мухам существенно за- [c. 25]
25]
Понижение освещенности на 30—50% от естественной за счет исключения дневного освещения задерживало развитие пшениц на первых этапах органогенеза и способствовало уничтожению конусов нарастания у всходов личинками мухи. [c.26]
В 1949 г. было выяснено, что клетки меристематических тканей растений обычно не содержат вирусов. В 1952 г. Дж. Мораль и Г. Мартин предложили, используя культивирование меристем, получать здоровые, избавленные от вирусной инфекции растения. Они обнаружили, что при выращивании верхушки побега, состоящей из конуса нарастания и 2—3 листовых зачатков, на ней образуются сферические образования — протокормы. Протокормы можно делить, и каждую часть культивировать до образования корней и листовых примордиев, получая в большом количестве генетически однородные безвирусные растения. В настоящий момент культивирование меристем побега — наиболее эффективный способ оздоровления растительного материала от вирусов, вироидов и микоплазм. Однако при этом способе требуется соблюдать определенные правила. Как уже говорилось, чем меньше размер мери-стематического экспланта, тем труднее вызвать в нем морфогенез. [c.198]
Однако при этом способе требуется соблюдать определенные правила. Как уже говорилось, чем меньше размер мери-стематического экспланта, тем труднее вызвать в нем морфогенез. [c.198]
Чем больше размер экспланта, тем легче идет морфогенез, в результате которого получается целое растение, но тем больше вероятность присутствия вирусов в экспланте. У многих видов и сортов растений зона, свободная от вирусных частиц, различна. Так, при клонировании апикальной меристемы картофеля размером 0,2 мм (конус нарастания с одним листовым зачатком) 70 % полученных растений были свободны от У-вируса картофеля, но только 10 % — от Х-вируса. В некоторых случаях не удается найти оптимальное соотношение между размером меристематического экспланта и морфогенезом в нем, и при этом избавиться от вирусной инфекцрш. Приходится дополнять метод культуры меристем термо- или(и) хемитерапией. Так, предварительная термотерапия исходных растений позволяет получать свободные от вирусов растения-регенеранты из меристемных эксплантов размером от 0,3 мм до 0,8 мм. Вместе с тем этот прием может вызвать отставание растений в росте, деформацию органов, увеличение латентных (скрытых) инфекций. [c.199]
Вместе с тем этот прием может вызвать отставание растений в росте, деформацию органов, увеличение латентных (скрытых) инфекций. [c.199]
В образцах из -пирамиды, ориентированных параллельно зонам роста, после отжига выявляются центры молочно-белой окраски, которые декорируют акцессорный рельеф поверхности базиса (см. рис, 28, б). Вследствие тиндалевского рассеяния аналогичные явления наблюдаются и в неотожженных образцах при интенсивном боковом освещении. Плотность окраски понижается к вершинам куполовидных акцессорий, что может быть вызвано оттеснением примеси к границам конусов нарастания акцессорий. О возможности такого процесса свидетельствуют также результаты съемок кварцевых препаратов методом теневой проекции. На фотографиях отчетливо выявляется ячеистое распределение неструктурной примеси. Участки, обогащенные примесью, обнаруживаются при визуальном просмотре в поляризованном свете пластин, ориентированных перпендикулярно к оптической оси.
 В отожженных кристаллах молочно-белые пленки нередко возникают непосредственно на поверхности базиса. [c.116]
В отожженных кристаллах молочно-белые пленки нередко возникают непосредственно на поверхности базиса. [c.116]Культура меристем побега — выращивание in vitro на питательной среде изолированного из верхзгшки или паззш1ной почки побега конуса нарастания с одним или двумя листовыми примор-диями, с первоначальным размером менее 0,1 мм в длину. [c.495]
У молодых растений личинки повреждают пять—семь листьев, обычно начиная со второго. Шведская муха вызывает на кукурузе четыре типа повреждений на листьях округлые сквозные отверстия, листья разорваны продольно, растения отстают в росте центральный стебель поврежден растения образуют боковые стебли — пасынки центральный стебель поврежден, растения погибают. При раннем поврелпазушные почки целы, развиваются боковые побеги, но уролзеленой массы в этом случае снижается на 54—84%. [c.49]
До V этапа растения можно консервировать целиком, если они не слишком большие, а с VI этапа органогенеза крупные Цветки отделяют от оси конуса нарастания и фиксируют отдельно. Начиная с VIII этапа органогенеза отдельно фиксируют тычинки и пестики. [c.7]
Начиная с VIII этапа органогенеза отдельно фиксируют тычинки и пестики. [c.7]
Конус нарастания нельзя долго рассматривать в воздушной среде он начинает подсыхать и деформироваться. В таких случаях его нужно помещать в разные среды для приготовления временных препаратов, лучшими из которых являются глицериновый гель и лактофенол. [c.9]
На предметное стекло стеклянной палочкой наносят 1 каплю геля или лактофенола, в нее помещают конус нарастания, или отдельные цветки, или его части и накрывают покровным стеклом. Для просветления тканей препарат выдерживают в глицериновом геле или лактофеноле под стеклянным колпаком или в коробке для препаратов от нескольких часов до нескольких дней. [c.9]
Если нет геля и лактофенола, конус нарастания рассматривают в капле дистиллированной или кипяченой воды. Но водный препарат менее удобен, им нужно пользоваться сразу, он долго не хранится. [c.9]
I этап представлен недиффереьщированным конусом нарастания. Совпадает он с фазой всходов и может продолжаться в течение всей осени, а иногда вплоть до весны, хотя в нормальных условиях развития озимые уходят на зимовку на II этапе органогенеза. [c.14]
Совпадает он с фазой всходов и может продолжаться в течение всей осени, а иногда вплоть до весны, хотя в нормальных условиях развития озимые уходят на зимовку на II этапе органогенеза. [c.14]
На III этапе происходит дифференциация осей соцветия. В нижней части конуса нарастания становятся заметными от-дельнью сегменты — зачатки будущих члеников стержня колоса чем их больше формируется на III этапе органогенеза, тем будет больше члеников колосового стержня и тем длиннее станет колос. Обеспеченность элементами питания на этом этапе органогенеза чрезвычайно важна для нормального процесса сегментации конуса нарастания. Хорошая заправка почвы под основную вспашку и ранневесенняя подкормка озимых растений азотными и фосфорнокалийными удобрениями способствует увеличению числа колосков в колосе. Эффективность подкормки озимых весной по таломерзлой почве объясняется ранним наступлением вегетации у растений, когда они сразу переходят к третьему этапу органогенеза, а в холодных почвах бывают еще ослаблены микробиологические процессы. [c.14]
[c.14]
V этап органогенеза проходит в фазу трубкования. На конусе нарастания начинают формироваться цветки в колосках и закладываются колосковью чешуи. Продолжительность этого этапа обычно не менее 5—7 дней. [c.19]
IV этап органогенеза у яровой пшеницы наступает при переходе в фазу трубкования. На конусе нарастания закладываются колосковые лопасти — зачатки будущих колосков. На разреженных посевах при избыточном боковом освещении процесс формирования зачаточных колосков может задерживаться, и можно видеть израстание зачаточного колоса и другие аномалии в развитии растения. [c.20]
Биологический контроль помог нашим ученым определить, что устойчивость злаков к скрытностеблевым вредителям в равной мере зависит как от биологии насекомых, так и от развития конусов нарастания генеративных органов растений. [c.24]
На темпы роста и развития конусов нарастания генеративных побегов и на совпадение критических для повреждений периодов развития зерновых хлебов со временем лёта злаковых мух оказывают влияние сроки сева. В центрально-черно-земной зоне яровые хлеба ранних сроков сева меньше повреждаются шведской мухой. Запаздывание с севом на одну-две недели приводит к изреженности посевов. При позднем посеве появление всходов пшеницы, ячменя, овса совпадает с массовым лётом первого поколения шведской мухи. Озимые хлеба, наоборот, при ранних августовских сроках сева дают всходы ко времени наибольшей численности, а следовательно, и наибольшей вредоносности шведской и гессенской мух. [c.25]
В центрально-черно-земной зоне яровые хлеба ранних сроков сева меньше повреждаются шведской мухой. Запаздывание с севом на одну-две недели приводит к изреженности посевов. При позднем посеве появление всходов пшеницы, ячменя, овса совпадает с массовым лётом первого поколения шведской мухи. Озимые хлеба, наоборот, при ранних августовских сроках сева дают всходы ко времени наибольшей численности, а следовательно, и наибольшей вредоносности шведской и гессенской мух. [c.25]
Тест на тему: Растительные ткани.
Тест. Растительные ткани.
Выберите по каждому вопросу один правильный ответ из числа предложенных и запишите его букву. Проверьте правильность ответов.
К проводящим тканям относится…
а) флоэма;
б) меристема;
в) пробка;
г) кожица.
Где находится апикальная меристема?
а) на верхушке побега и кончике корня;
б) в основании листа;
в) в центре стебля;
г) между флоэмой и ксилемой.
Ситовидные трубки выполняют следующую функцию:
а) проводят раствор органических веществ;
б) проводят раствор минеральных солей;
в) запасают органические вещества;
г) обеспечивают рост побега в длину.
Назовите ткань, к которой относят древесину:
а) покровная;
б) образовательная;
в) проводящая;
г) механическая.
Назовите ткань, к которой относят камбий
а) покровная;
б) образовательная;
в) проводящая;
г) механическая.
Что из перечисленного ниже является наиболее характерным для клеток образовательной ткани цветковых растений?
а) деление;
б) запасание питательных веществ;
в) фотосинтез и образование углеводов;
г) проведение химических соединений в другие ткани.
Назовите ткань кончика молодого корня, расположенную под корневым чехликом.

а) покровная;
б) образовательная;
в) проводящая;
г) механическая.
Назовите ткань, образованную, в основном, мертвыми клетками.
а) кожица;
б) луб;
в) древесина;
г) камбий;
Назовите ткань, из клеток которой состоит конус нарастания побега цветкового растения.
а) покровная;
б) проводящая;
в) образовательная;
г) механическая.
Округлые прозрачные клетки расположены рыхло, они не соединены друг с другом, каждая клетка имеет двухконтурную прозрачную оболочку.
а) клетки водного растения элодеи
б) клетки кожицы чешуи лука
в) клетки зоны размножения корня
г) клетки мякоти яблока
Критерии оценки:
«5» — 100 – 90% правильных ответов
«4» — 89 — 80% правильных ответов
«3» — 79 – 70% правильных ответов
«2» — 69% и менее правильных ответов
Почки растений — урок.
 Биология, Бактерии. Грибы. Растения (5–6 класс).
Биология, Бактерии. Грибы. Растения (5–6 класс).На вершине побега находится верхушечная почка. С помощью верхушечных почек побеги нарастают в длину.
Пазушные почки находятся на стебле, в пазухах листьев. Из них развиваются боковые побеги, обеспечивающие ветвление. Эти почки располагаются на стебле в том же порядке, что и листья.
Рис. \(1\). Расположение почек
Почки могут развиваться и на других частях растения. Бывают почки на междоузлиях, на корнях и даже на листьях. Это придаточные почки.
После листопада на стеблях сохраняются листовые рубцы. Над ними находятся пазушные почки.
При развитии побега из почки её наружные чешуи вскоре опадают. На месте почечных чешуй остаются рубцы, образующие почечное кольцо. На ветке каждый год образуется такое кольцо и по их числу можно узнать возраст ветки или молодого дерева.
Не все почки на следующий год после образования распускаются. Часть из них может оставаться в состоянии покоя несколько лет. Такие почки называют спящими.
Такие почки называют спящими.
Спящие почки начинают развиваться при повреждении верхушки стебля или пазушных почек. Из этих почек могут появляться побеги на пнях и на старых стволах деревьев.
Рис. \(2\). Спящие почки
Способность спящих почек пробуждаться широко используют при выращивании комнатных, декоративных и плодовых растений. Растения подвергают обрезке, которая вызывает развитие спящих почек. Используя обрезку, можно формировать кроны растений и омолаживать старые деревья.
Строение почек
Наружный слой почки образован почечными чешуями, которые защищают внутренние части почки от высыхания и резких перепадов температуры.
Центральная часть почки представлена зачаточным стеблем. На верхушке стебля находится образовательная ткань, составляющая конус нарастания.
На зачаточном стебле расположены очень мелкие зачаточные листья. В их пазухах с помощью лупы можно увидеть зачаточные почки.
Обрати внимание!
Почка — это зачаточный побег.
Рис. \(3\). Виды и строение почек
Почки бывают вегетативные и генеративные. Вегетативная (листовая) почка состоит из зачаточного стебля и зачаточных листьев. Из такой почки развивается вегетативный побег.
В генеративной (цветочной) почке находятся зачаточные цветки или соцветия. Цветочные почки более крупные.
Источники:
Рис. 1. Расположение почек. © ЯКласс
Рис. 2. Спящие почки. © ЯКласс
Рис. 3. Виды и строение почек. © ЯКласс
Конус роста – обзор
5.2 Актин и микротрубочки в филоподиях Наведение конуса роста
Наведение конуса роста в ответ на внеклеточные сигналы требует как актиновых филаментов, так и микротрубочек. Структуры на основе актиновых филаментов (филоподии и/или ламеллиподии) обычно считаются необходимыми для расширяющегося конуса роста, чтобы пробовать окружающую среду и реагировать соответствующим образом. Реакции одного филоподия на положительный/аттрактантный направляющий сигнал достаточно, чтобы переориентировать конус роста.Однако для того, чтобы ведение произошло, филоподий должен быть пронизан одной или несколькими микротрубочками (Gallo and Letourneau, 2000; Dent and Gertler, 2003), которые обеспечивают структурную поддержку для развития нового сегмента ствола аксона в направлении аксона. сигнал. Микротрубочки также позволяют органеллам в центральном домене конуса роста подвергаться векторному перераспределению в сторону сигнала (Lin and Forscher, 1993).
Реакции одного филоподия на положительный/аттрактантный направляющий сигнал достаточно, чтобы переориентировать конус роста.Однако для того, чтобы ведение произошло, филоподий должен быть пронизан одной или несколькими микротрубочками (Gallo and Letourneau, 2000; Dent and Gertler, 2003), которые обеспечивают структурную поддержку для развития нового сегмента ствола аксона в направлении аксона. сигнал. Микротрубочки также позволяют органеллам в центральном домене конуса роста подвергаться векторному перераспределению в сторону сигнала (Lin and Forscher, 1993).
Микротрубочки могут проникать в отдельные филоподии конусов роста (рис.3.6, стрелки) и аналогично аксональные филоподии (рис. 3.6, стрелки). Когда аксоны подвергаются растяжению в отсутствие сигналов наведения, проникновение микротрубочек в филоподии, вероятно, случайным образом распределяется по периметру конуса роста. Однако отдельные филоподии, которые вступают в контакт с источником управляющего сигнала (например, с поверхностью клетки), инвазируются одной или несколькими микротрубочками и сохраняют микротрубочки (микротрубочки), пока конус роста переориентируется. Таким образом, в этом процессе могут быть два основных регуляторных механизма: (i) регуляция поступления микротрубочек в филоподии и (ii) удержание/стабилизация микротрубочек в филоподиях.Оба эти механизма, вероятно, влияют на динамическую нестабильность кончиков микротрубочек, которые в противном случае демонстрируют циклы полимеризации и деполимеризации, происходящие в гораздо меньших временных масштабах (несколько десятков секунд), чем переориентация конуса роста (от минут до десятков минут).
Таким образом, в этом процессе могут быть два основных регуляторных механизма: (i) регуляция поступления микротрубочек в филоподии и (ii) удержание/стабилизация микротрубочек в филоподиях.Оба эти механизма, вероятно, влияют на динамическую нестабильность кончиков микротрубочек, которые в противном случае демонстрируют циклы полимеризации и деполимеризации, происходящие в гораздо меньших временных масштабах (несколько десятков секунд), чем переориентация конуса роста (от минут до десятков минут).
Рисунок 3.6. Микротрубочки входят в филоподии нейронов. Пример культивированного сенсорного аксона, окрашенного для выявления актиновых филаментов (красный) и микротрубочек (зеленый) после комбинированной фиксации и экстракции, протокол, который удаляет растворимый тубулин, но сохраняет тубулин в полимерной форме (т.е. микротрубочки) (Gallo and Letourneau, 1999). Микротрубочки обнаруживаются в подмножествах филоподий как в конусе роста (указаны стрелки), так и вдоль ствола аксона (стрелка). Для интерпретации ссылок на цвет в легенде к этому рисунку читатель может обратиться к онлайн-версии этой книги.
Для интерпретации ссылок на цвет в легенде к этому рисунку читатель может обратиться к онлайн-версии этой книги.
Молекулы, которые физически или функционально связывают актин и цитоскелет микротрубочек, были идентифицированы и предполагается, что они играют роль в ведении конусов роста (Vitriol and Zheng, 2012). Однако прямой анализ роли этих белков или сигнальных механизмов в динамике цитоскелета, лежащей в основе филоподий-опосредованного управления конусами роста, минимален.Удивительно, но очень мало известно о том, как кончики микротрубочек нацеливаются и сохраняются в филоподиях. Т.о., понимание механизмов, которые регулируют нацеливание или удержание микротрубочек в филоподиях во время наведения, остается на переднем крае. Еще меньше известно о том, отрицательно ли регулируются микротрубочки в конусах роста во время наведения в ответ на репеллентные сигналы.
Бентли и др. установил фундаментальную последовательность событий, лежащих в основе поворота конуса роста к аттрактантам посредством единичного филоподиального контакта (Sabry et al. , 1991; О’Коннор и Бентли, 1993 год; Бентли и О’Коннор, 1994). В серии статей они использовали подходы к живой визуализации для описания реорганизации цитоскелета (актина и микротрубочек), лежащей в основе управления пионерными конусами роста Ti1 кузнечика в развивающихся зачатках конечностей. Это событие наведения инициируется и опосредуется как филоподиальный контакт со специфическими клетками ориентира. В филоподиях, которые контактируют с мишенями, актиновые филаменты первоначально накапливаются у основания филоподия, а также в некоторой степени подвергаются ретроградному току по направлению к телу конуса роста.Наряду с обеспечивающими изменениями в филоподиальном актиновом цитоскелете микротрубочки, как наблюдали, совершают экскурсии в филоподии и из них, а также задерживаются в филоподиях, что определяет будущее направление расширения конуса роста. Сходная последовательность реорганизации цитоскелета была описана в конусах роста сенсорных нейронов, направляющихся к источнику фактора роста нервов (Gallo and Letourneau, 2000).
, 1991; О’Коннор и Бентли, 1993 год; Бентли и О’Коннор, 1994). В серии статей они использовали подходы к живой визуализации для описания реорганизации цитоскелета (актина и микротрубочек), лежащей в основе управления пионерными конусами роста Ti1 кузнечика в развивающихся зачатках конечностей. Это событие наведения инициируется и опосредуется как филоподиальный контакт со специфическими клетками ориентира. В филоподиях, которые контактируют с мишенями, актиновые филаменты первоначально накапливаются у основания филоподия, а также в некоторой степени подвергаются ретроградному току по направлению к телу конуса роста.Наряду с обеспечивающими изменениями в филоподиальном актиновом цитоскелете микротрубочки, как наблюдали, совершают экскурсии в филоподии и из них, а также задерживаются в филоподиях, что определяет будущее направление расширения конуса роста. Сходная последовательность реорганизации цитоскелета была описана в конусах роста сенсорных нейронов, направляющихся к источнику фактора роста нервов (Gallo and Letourneau, 2000).
Используя конусы роста нейронов мешковидных клеток Aplysia , Forscher et al.предоставили дополнительную информацию о взаимодействиях между актиновыми филаментами в филоподиях и микротрубочками конуса роста во время наблюдения, опять же с помощью подходов к визуализации в реальном времени. В этих конусах роста микротрубочки часто выравниваются с пучками филоподиальных актиновых филаментов. Микротрубочки выстраиваются и полимеризуются вдоль филоподиальных пучков актина, но также вовлекают ретроградный поток актина и, в свою очередь, очищаются от периферического домена (Schaefer et al., 2002). Специфическое истощение филоподиальных актиновых пучков приводило к увеличению проникновения кончиков микротрубочек в периферический домен конуса роста и уменьшению ретроградного потока микротрубочек к центральному домену (Burnette et al., 2007). Ретроградный поток актиновых филаментов частично обеспечивается миозином II (Lin et al., 1996). Следовательно, ингибирование myosin II увеличивает расстояние, на которое микротрубочки проникают в филоподии (Ketschek et al. , 2007). Наконец, миозин II необходим для поворота конуса роста на границах субстрата и в ответ на фактор роста нервов (Turney and Bridgman, 2005; Loudon et al., 2006), хотя отсутствие контроля может также быть связано с более общей ролью миозина II в поддержании конуса роста поляризованным.Как обсуждается далее в Разделе 5.3, септин 7 локализуется в основании аксональных филоподий и способствует локализации микротрубочек в филоподиях, а септин 7 связывает как микротрубочки, так и актиновые филаменты (Hu et al., 2012). Интересно, что septin 7 также обнаруживается в основании филоподий конусов роста, указывая на то, что он может играть аналогичную роль в захвате микротрубочек во время наведения (Fig. 3.7). В совокупности эти исследования подтверждают, что локализованная регуляция myosin II во время наведения конуса роста может служить механизмом контроля инвазии филоподий микротрубочками, которые могут захватываться септинами.
, 2007). Наконец, миозин II необходим для поворота конуса роста на границах субстрата и в ответ на фактор роста нервов (Turney and Bridgman, 2005; Loudon et al., 2006), хотя отсутствие контроля может также быть связано с более общей ролью миозина II в поддержании конуса роста поляризованным.Как обсуждается далее в Разделе 5.3, септин 7 локализуется в основании аксональных филоподий и способствует локализации микротрубочек в филоподиях, а септин 7 связывает как микротрубочки, так и актиновые филаменты (Hu et al., 2012). Интересно, что septin 7 также обнаруживается в основании филоподий конусов роста, указывая на то, что он может играть аналогичную роль в захвате микротрубочек во время наведения (Fig. 3.7). В совокупности эти исследования подтверждают, что локализованная регуляция myosin II во время наведения конуса роста может служить механизмом контроля инвазии филоподий микротрубочками, которые могут захватываться септинами.
Рисунок 3.7. Иммунолокализация септина 7 (SEPT7) в сенсорных аксонах. SEPT7 нацелен на основание филоподий как вдоль ствола аксона (левая панель), так и в конусы роста (средняя панель). Скопления SEPT7 на боковых сторонах основания филоподий обозначены зелеными стрелками. SEPT7 также обнаружен у основания установленных боковых ветвей (правая панель), что указывает на то, что он сохраняется там после того, как филоподий превратился в ветвь.
SEPT7 нацелен на основание филоподий как вдоль ствола аксона (левая панель), так и в конусы роста (средняя панель). Скопления SEPT7 на боковых сторонах основания филоподий обозначены зелеными стрелками. SEPT7 также обнаружен у основания установленных боковых ветвей (правая панель), что указывает на то, что он сохраняется там после того, как филоподий превратился в ветвь.
Моторы микротрубочек могут также играть роль в регуляции взаимодействий между актином и цитоскелетом микротрубочек во время наведения, опосредованного конусами роста. Мотор микротрубочек dynein может действовать противоположно основанному на миозине II ретроградному потоку, тем самым позволяя микротрубочкам проникать в филоподии (Myers et al., 2006). Кинезин 12 регулирует аспекты взаимодействия между микротрубочками и филоподиальными пучками актина (Liu et al. , 2010). Сходным образом, kinesin 5 негативно регулирует продвижение кончиков микротрубочек в филоподии конуса роста и способствует установлению асимметрии микротрубочек поперек конуса роста при повороте к шарикам, покрытым фактором роста нервов (Nadar et al., 2008). Конусы роста также обращаются к источнику фармакологического ингибитора kinesin 5 (Nadar et al., 2012), хотя специфическая роль инвазии микротрубочек в филоподии не рассматривалась.
, 2010). Сходным образом, kinesin 5 негативно регулирует продвижение кончиков микротрубочек в филоподии конуса роста и способствует установлению асимметрии микротрубочек поперек конуса роста при повороте к шарикам, покрытым фактором роста нервов (Nadar et al., 2008). Конусы роста также обращаются к источнику фармакологического ингибитора kinesin 5 (Nadar et al., 2012), хотя специфическая роль инвазии микротрубочек в филоподии не рассматривалась.
Идентификация молекулы как необходимой для наведения сама по себе не проливает свет на лежащий в основе механизм, она просто вовлекает ее в наведение.В конечном счете, необходимо понять, где и когда специфические молекулы действуют в конусе роста, чтобы координировать последовательность локализованных сигнальных и цитоскелетных событий, которые приводят к соединению цитоскелета, основанного на актине и микротрубочках. По техническим причинам многие исследования основаны на выводах о последствиях истощения или сверхэкспрессии интересующей молекулы в нейронах в течение длительных периодов времени. Интерпретация этих типов экспериментов явно требует многих оговорок, поскольку молекулы часто играют несколько ролей в разных доменах нейрона.Например, хроническое истощение моторного белка, вероятно, оказывает воздействие на всю клетку и влияет на несколько клеточных систем, что, в свою очередь, может генерировать нерелевантные эффекты при анализе в субклеточных компартментах, таких как филоподии. Эксперименты, предназначенные для непосредственного решения проблем наведения, потребуют исследований с визуализацией с высоким пространственно-временным разрешением, чтобы определить, как динамика цитоскелета влияет во время наведения в условиях, когда интересующая молекула резко ингибируется или активируется (Nadar et al., 2012).
Интерпретация этих типов экспериментов явно требует многих оговорок, поскольку молекулы часто играют несколько ролей в разных доменах нейрона.Например, хроническое истощение моторного белка, вероятно, оказывает воздействие на всю клетку и влияет на несколько клеточных систем, что, в свою очередь, может генерировать нерелевантные эффекты при анализе в субклеточных компартментах, таких как филоподии. Эксперименты, предназначенные для непосредственного решения проблем наведения, потребуют исследований с визуализацией с высоким пространственно-временным разрешением, чтобы определить, как динамика цитоскелета влияет во время наведения в условиях, когда интересующая молекула резко ингибируется или активируется (Nadar et al., 2012).
Конус роста аксонов — неврология
Среди многих необычных особенностей развития нервной системы одной из самых захватывающих является способность растущих аксонов перемещаться по сложной клеточной эмбриональной поверхности, чтобы найти подходящих синаптических партнеров, которые могут быть миллиметрами или даже сантиметров. В 1910 г. Росс Г. Харрисон, впервые наблюдавший отрастание аксонов у живого головастика in vitro, отметил: из клеток нервной трубки.Но в настоящее время мы находимся в неведении относительно условий, направляющих их к определенным точкам.
В 1910 г. Росс Г. Харрисон, впервые наблюдавший отрастание аксонов у живого головастика in vitro, отметил: из клеток нервной трубки.Но в настоящее время мы находимся в неведении относительно условий, направляющих их к определенным точкам.
Наблюдения Харрисона указывают на центральные признаки роста аксонов. Во-первых, энергия и мощность растущих аксонов отражают клеточные свойства конуса роста, специализированной структуры на кончике расширяющегося аксона. Конусы роста представляют собой высокоподвижные структуры, которые исследуют внеклеточную среду, определяют направление роста, а затем направляют расширение аксона в этом направлении.Первичной морфологической характеристикой конуса роста является листовидное расширение растущего аксона на его кончике, называемое ламеллоподием . При исследовании in vitro многочисленные тонкие отростки, называемые филоподиями , быстро формируются и исчезают из конечного расширения, подобно пальцам, тянущимся, чтобы осязать или ощутить окружающую среду (). Клеточные механизмы, лежащие в основе этих сложных поисковых движений, стали предметом клеточно-биологических исследований роста и направления аксонов. Такие движения, как полагают, отражают быструю, контролируемую перестройку элементов цитоскелета, особенно молекул, связанных с актиновым цитоскелетом, которые модулируют изменения формы конуса роста и, в конечном итоге, его прохождения через развивающиеся ткани.
Клеточные механизмы, лежащие в основе этих сложных поисковых движений, стали предметом клеточно-биологических исследований роста и направления аксонов. Такие движения, как полагают, отражают быструю, контролируемую перестройку элементов цитоскелета, особенно молекул, связанных с актиновым цитоскелетом, которые модулируют изменения формы конуса роста и, в конечном итоге, его прохождения через развивающиеся ткани.
Рис. 23.1
Микрофотография конуса роста на кончике аксона сенсорной ганглиозной клетки, расширяющегося в культуре ткани. Ламеллаподии (плоские листообразные выступы) и филоподии (длинные пальцевидные отростки) можно увидеть отходящими от конуса роста. Эти высоко (подробнее…)
Сантьяго Рамон-и-Кахал, современник Харрисона, отметил, что, когда конусы роста движутся по установленному пути, впервые проложенному другими аксонами, они обычно имеют простую форму. Напротив, когда растущий аксон сначала расширяется в новом направлении или достигает области, где должен быть сделан выбор относительно направления движения, структура (и, предположительно, подвижность) его конуса роста претерпевает драматические изменения. Конус роста уплощается и расширяет многочисленные филоподии, как это происходит в чашке для культивирования, что указывает на активный поиск подходящих сигналов для направления последующего роста. Эти изменения формы конуса роста в «точках принятия решения» наблюдались как в периферической, так и в центральной нервной системе. На периферии конусы роста мотонейронов претерпевают изменения формы по мере того, как они входят в зачатки мышц в незрелых конечностях, предположительно ища соответствующие мишени в развивающейся мускулатуре. В центральной нервной системе конусы роста в развивающихся обонятельных и зрительных нервах также меняют форму, когда они достигают критических точек на своих траекториях.Особое функциональное значение имеет решение, принимаемое подгруппами аксонов сетчатки в перекресте зрительных нервов. Конусы роста аксонов сетчатки замедляются и приобретают сложную форму по мере того, как они «выбирают» пересекать или не пересекать среднюю линию.
Конус роста уплощается и расширяет многочисленные филоподии, как это происходит в чашке для культивирования, что указывает на активный поиск подходящих сигналов для направления последующего роста. Эти изменения формы конуса роста в «точках принятия решения» наблюдались как в периферической, так и в центральной нервной системе. На периферии конусы роста мотонейронов претерпевают изменения формы по мере того, как они входят в зачатки мышц в незрелых конечностях, предположительно ища соответствующие мишени в развивающейся мускулатуре. В центральной нервной системе конусы роста в развивающихся обонятельных и зрительных нервах также меняют форму, когда они достигают критических точек на своих траекториях.Особое функциональное значение имеет решение, принимаемое подгруппами аксонов сетчатки в перекресте зрительных нервов. Конусы роста аксонов сетчатки замедляются и приобретают сложную форму по мере того, как они «выбирают» пересекать или не пересекать среднюю линию.
Рисунок 23.2
Поведение конуса роста в точке принятия решения (в данном случае перекрест зрительных нервов).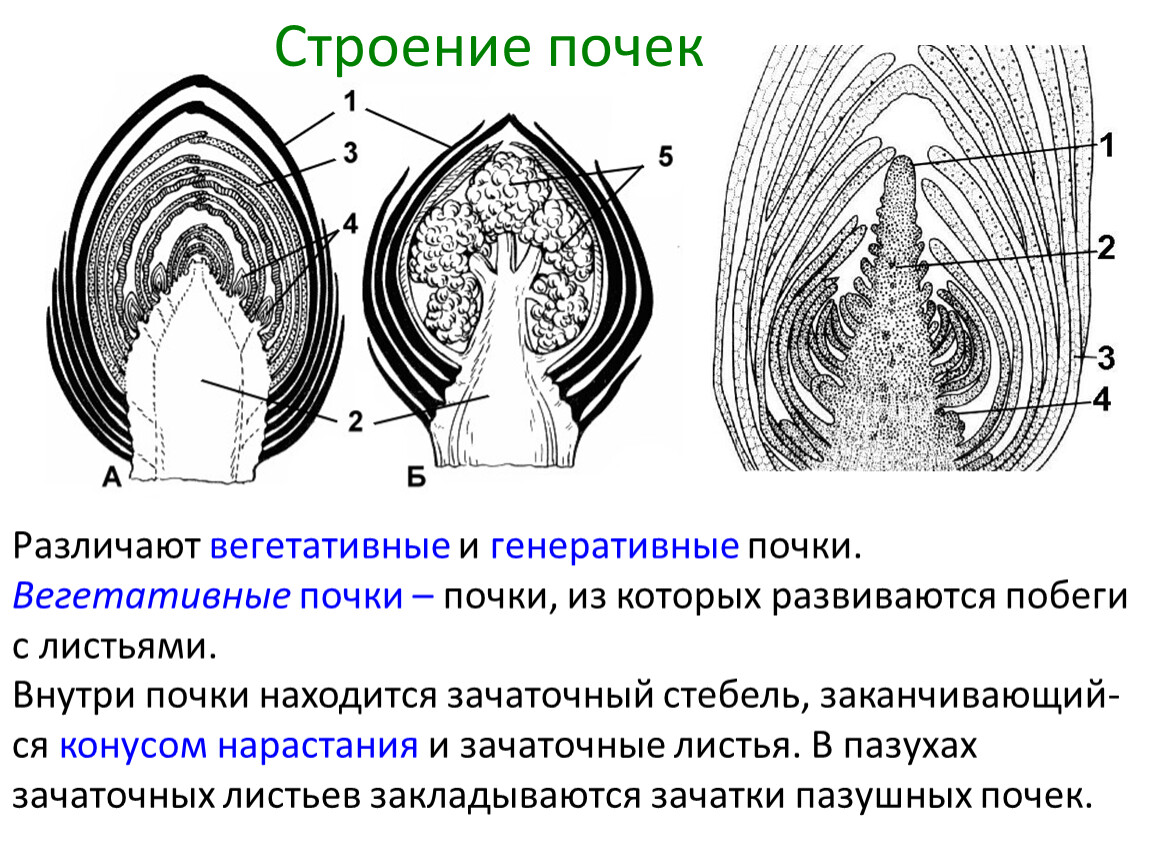 (A) В зрительной системе эмбриона мыши растущие аксоны ганглиозных клеток сетчатки достигают перекреста зрительных нервов примерно на 12–13 день эмбрионального развития; несколько височных аксонов от каждого (больше…)
(A) В зрительной системе эмбриона мыши растущие аксоны ганглиозных клеток сетчатки достигают перекреста зрительных нервов примерно на 12–13 день эмбрионального развития; несколько височных аксонов от каждого (больше…)
Реорганизация микротрубочек обязательна для поворота конуса роста
Чтобы изучить роль микротрубочек в повороте конуса роста, мы имеем
сравнили организацию микротрубочек в конусах роста, продвигающихся по
однородные ламининовые субстраты с их организацией в конусах роста
поворот на границе ламинин-тенасцин. Большая часть (82%) роста
колбочки на ламинине имели симметричную организацию микротрубочек, в которой
микротрубочки, входящие в конус роста, расширяются к
периферии конуса роста.Конусы роста на границах тенасцина имели
симметрично расположенные микротрубочки только в 34% случаев, тогда как в
В большинстве случаев микротрубочки были смещены наполовину.
конуса роста, предположительно стабилизировавшегося в направлении разворота
вдоль границы тенасцина.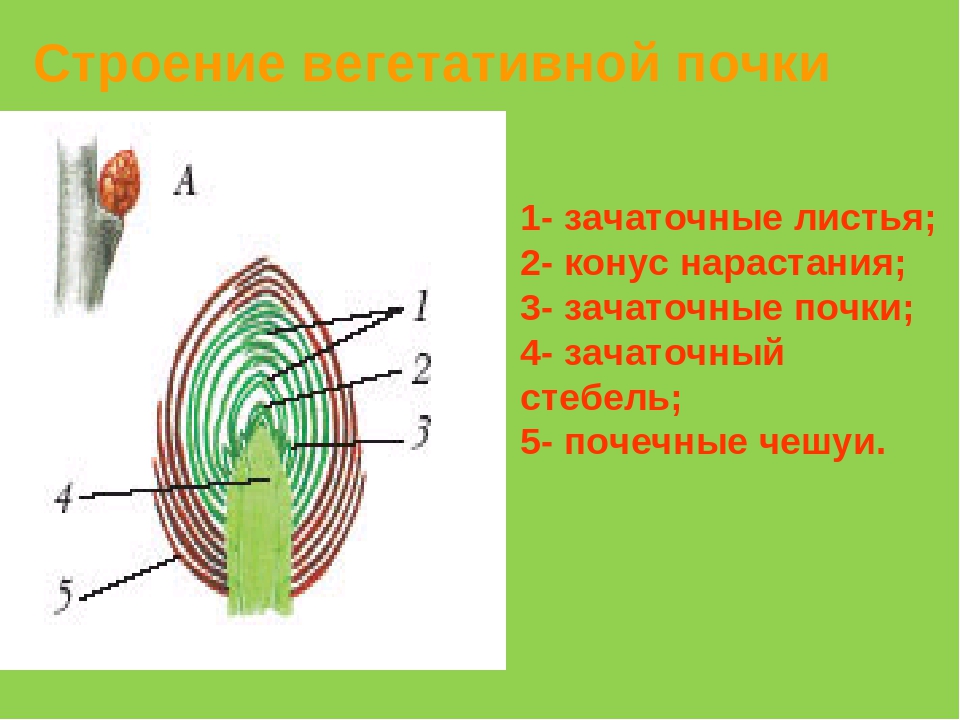 Эти результаты свидетельствуют о том, что реорганизация
микротрубочки могут лежать в основе поворота конуса роста. Дополнительные доказательства
участие перестройки микротрубочек в повороте конуса роста было
предоставлено экспериментами, в которых конусы роста приблизились к тенасцину
границы в присутствии наномолярных концентраций микротрубочек
стабилизирующее соединение, таксол.Таксол изменил организацию
микротрубочки в конусах роста, растущих на ламинине, ограничивая их
распространение на проксимальные области конуса роста и увеличение
их комплектация. Таксол не останавливал продвижение конуса роста по ламинину. Когда
при росте в присутствии таксола конусы роста на границах тенасцина были
не способен поворачиваться и расти вдоль ламинин-тенасциновой границы, и
поэтому остановились на границе. Конусы роста были арестованы в
границы до тех пор, пока присутствует таксол (до 6 ч) без
наличие каких-либо признаков отравления наркотиками.Эти эффекты таксола были
обратимый. В совокупности эти результаты позволяют предположить, что микротрубочки
реорганизация в конусах роста является необходимым событием в конусе роста
превращение.
Эти результаты свидетельствуют о том, что реорганизация
микротрубочки могут лежать в основе поворота конуса роста. Дополнительные доказательства
участие перестройки микротрубочек в повороте конуса роста было
предоставлено экспериментами, в которых конусы роста приблизились к тенасцину
границы в присутствии наномолярных концентраций микротрубочек
стабилизирующее соединение, таксол.Таксол изменил организацию
микротрубочки в конусах роста, растущих на ламинине, ограничивая их
распространение на проксимальные области конуса роста и увеличение
их комплектация. Таксол не останавливал продвижение конуса роста по ламинину. Когда
при росте в присутствии таксола конусы роста на границах тенасцина были
не способен поворачиваться и расти вдоль ламинин-тенасциновой границы, и
поэтому остановились на границе. Конусы роста были арестованы в
границы до тех пор, пока присутствует таксол (до 6 ч) без
наличие каких-либо признаков отравления наркотиками.Эти эффекты таксола были
обратимый. В совокупности эти результаты позволяют предположить, что микротрубочки
реорганизация в конусах роста является необходимым событием в конусе роста
превращение.
Нервное развитие в решающей степени зависит от способности роста колбочек, чтобы точно ориентироваться в эмбрионе и распознавать соответствующие клетки-мишени. Конусы роста чувствительны к внешним направляющие сигналы, такие как хемотропные факторы, клеточная адгезия гликопротеины и молекулы внеклеточного матрикса, влияющие на направление роста аксона (1–4).Эти сигналы взаимодействуют с конусом роста мембранных рецепторов и через внутриклеточные сигнальные события приводят к изменения в цитоскелете конуса роста и, следовательно, в направленности подвижность. Несмотря на значительные усилия по выявлению и характеристике направляющих молекул, у нас есть лишь зачаточные знания о том, как они регулируют цитоскелет конуса роста.
Мы показали ранее в in vitro «анализ выбора»
что конусы роста ганглиев задних корешков (DRG) кур поворачиваются, когда
сталкиваясь с резкой границей субстрата между пермиссивной (ламинином) и
непермиссивный (тенасцин) субстрат (5, 6). На границе рост
шишки делают повороты и растут вдоль ламининной стороны. Тенасцин (тенасцин-С,
см. исх. 7) является членом семейства внеклеточных матриксов
гликопротеины, которые могут участвовать в развитии нервной
системы (но см. ссылку 8). Особое внимание было уделено
возможная роль тенасцина в ведении аксонов из-за его присутствия в
границы ткани во время развития (9) и его активация во время
период регенерации периферических нервов после травмы (10).Несколько исследований in vitro указали на способность
тенасцин для стимулирования роста нейритов, когда предлагается в виде униформы
субстрат (11–15). Мы и другие показали, что тенасцин может действовать как
барьер для конусов роста, продвигающихся по пермиссивным субстратам, когда он
предлагается в качестве границы субстрата (6, 16). В отличие от других молекул
показано, что они отталкивают или тормозят продвижение конусов роста, это
не связано с коллапсом конуса роста и ретракцией нейритов.
Вместо этого конусы роста, приближающиеся к границам тенасцина, меняют свою форму.
На границе рост
шишки делают повороты и растут вдоль ламининной стороны. Тенасцин (тенасцин-С,
см. исх. 7) является членом семейства внеклеточных матриксов
гликопротеины, которые могут участвовать в развитии нервной
системы (но см. ссылку 8). Особое внимание было уделено
возможная роль тенасцина в ведении аксонов из-за его присутствия в
границы ткани во время развития (9) и его активация во время
период регенерации периферических нервов после травмы (10).Несколько исследований in vitro указали на способность
тенасцин для стимулирования роста нейритов, когда предлагается в виде униформы
субстрат (11–15). Мы и другие показали, что тенасцин может действовать как
барьер для конусов роста, продвигающихся по пермиссивным субстратам, когда он
предлагается в качестве границы субстрата (6, 16). В отличие от других молекул
показано, что они отталкивают или тормозят продвижение конусов роста, это
не связано с коллапсом конуса роста и ретракцией нейритов.
Вместо этого конусы роста, приближающиеся к границам тенасцина, меняют свою форму. направлении роста, чтобы избежать проникновения в тенасцин-содержащую
территория.Эти исследования подтверждают идею о том, что тенасцин может направлять
конусы роста с помощью отталкивающих или тормозящих механизмов, как это было
предложено для множества других молекул, обнаруженных в развивающихся
и взрослой нервной системы (17, 18). Отклик конуса роста в
поворот на границе явно включает внутриклеточные сигнальные события
что в конечном итоге приводит к изменению цитоскелета конуса роста, что
лежит в основе поворотного события. В описанных здесь экспериментах мы имеем
пытались понять, что эти изменения могут
быть.
направлении роста, чтобы избежать проникновения в тенасцин-содержащую
территория.Эти исследования подтверждают идею о том, что тенасцин может направлять
конусы роста с помощью отталкивающих или тормозящих механизмов, как это было
предложено для множества других молекул, обнаруженных в развивающихся
и взрослой нервной системы (17, 18). Отклик конуса роста в
поворот на границе явно включает внутриклеточные сигнальные события
что в конечном итоге приводит к изменению цитоскелета конуса роста, что
лежит в основе поворотного события. В описанных здесь экспериментах мы имеем
пытались понять, что эти изменения могут
быть.
Основными компонентами цитоскелета конусов роста являются
микротрубочки и микрофиламенты (19–21). Микротрубочки занимают видное место в
центральный домен, тогда как микрофиламенты сосредоточены в
периферические, подвижные области. В аксоне микротрубочки обеспечивают
субстрат для быстрого транспорта аксонов и необходимы для
удлинение. Функция микротрубочек в конусах роста менее ясна. тогда как микрофиламенты участвуют в подвижности конусов роста (22). В
стержня аксона микротрубочки собраны в пучки, но растопырены
при входе в проксимальную область конуса роста (23–25).Иногда некоторые из этих микротрубочек распространяются в дистальные,
подвижный домен филоподий и ламеллиподий и может даже проникать
филоподии (26, 27), где они лежат рядом с филоподиальным актином
пучок филаментов, предполагающий специфическое взаимодействие (28).
тогда как микрофиламенты участвуют в подвижности конусов роста (22). В
стержня аксона микротрубочки собраны в пучки, но растопырены
при входе в проксимальную область конуса роста (23–25).Иногда некоторые из этих микротрубочек распространяются в дистальные,
подвижный домен филоподий и ламеллиподий и может даже проникать
филоподии (26, 27), где они лежат рядом с филоподиальным актином
пучок филаментов, предполагающий специфическое взаимодействие (28).
Микротрубочки в этих дистальных отделах вытягиваются и втягиваются,
либо путем скольжения полимера, либо путем полимеризации и деполимеризации
(29, 30). Мы предположили, что пучки актиновых филаментов в этих
филоподии, взаимодействующие с внешними сигналами управления, могут захватывать
удлиняя микротрубочки и стабилизируя их (26, 30).В нашей модели
активация филоподиальных мембранных рецепторов внешними сигналами наведения
может влиять на динамику актиновых филаментов как непосредственно, так и через
промежуточные белки. Это может изменить стабильность актиновых филаментов и
следовательно, время жизни филоподий и вероятность захвата микротрубочек.
Такой механизм может лежать в основе векторного роста, потому что он позволит
материал, продвигающийся в конус роста по захваченным микротрубочкам,
дифференцированно встраиваются в конкретную область роста
конус.Чтобы проверить эту гипотезу, мы использовали наш in vitro .
анализ выбора.
Это может изменить стабильность актиновых филаментов и
следовательно, время жизни филоподий и вероятность захвата микротрубочек.
Такой механизм может лежать в основе векторного роста, потому что он позволит
материал, продвигающийся в конус роста по захваченным микротрубочкам,
дифференцированно встраиваются в конкретную область роста
конус.Чтобы проверить эту гипотезу, мы использовали наш in vitro .
анализ выбора.
Если наша гипотеза верна, мы можем ожидать поворота роста
колбочек на границах тенасцина, опосредованных реорганизацией
цитоскелет на основе микротрубочек. Мы обнаружили, что наиболее очевидным изменением
в конусах роста цитоскетон в конусах роста на границах тенасцина был
асимметричное расположение микротрубочек по сравнению с более
равномерно распределенное веерообразное расположение микротрубочек в росте
шишки на ламинине.Проверить функциональную роль микротрубочек в росте
при точении конуса использовались субстехиометрические (наномолярные) концентрации
Таксол, который может обратимо блокировать динамику микротрубочек в клетках без
меняя их номера (20, 31, 32). Мы обнаружили, что конусы роста в
наличие таксола не могли поворачиваться и расти вдоль границ тенасцина,
поддерживая идею о том, что динамическая неустойчивость и перестройка
Микротрубочки конуса роста важны для поворота конуса роста.
Мы обнаружили, что конусы роста в
наличие таксола не могли поворачиваться и расти вдоль границ тенасцина,
поддерживая идею о том, что динамическая неустойчивость и перестройка
Микротрубочки конуса роста важны для поворота конуса роста.
МАТЕРИАЛЫ И МЕТОДЫ
Подготовка белков для покрытия субстрата.
Тенасцин был получают из мозга мышей в возрасте от 1 до 15 дней иммуноаффинным методом. хроматография (11, 33). Ламинин был приобретен у Boehringer Mannheim. или Сигма. Коллоидный меченный золотом бычий сывороточный альбумин (БСА) был приготовлен, как описано (5, 6).
Подготовка основания.
Подготовка острой подложки
границы ламинина и тенасцина подробно описаны в другом месте.
(5, 6). Вкратце, меченный коллоидным золотом BSA наносили на среднюю часть тела.
покровных стекол, инкубируют при 37°С в течение 30 мин и смывают
с Ca 2+ — и Mg 2+ — без PBS. Это произвело
видимое пятно при фазово-контрастной микроскопии. Тенасцин (50 мкг/мл)
или, в качестве контроля, термоинактивированный БСА, не содержащий жирных кислот (Boehringer
Мангейм; 50 мкг/мл в PBS) наносили непосредственно поверх
пятно BSA, меченное коллоидным золотом. Через 2 ч при 37°С тенасцин
пятно, покрытое БСА, промывали PBS, после чего весь
покровное стекло покрывали ламинином (20 мкг/мл в PBS) при 37°С в течение
2 ч. Покровные стекла промывали с помощью Ham’s F-14 или DMEM, а затем оставляли.
в инкубаторе СО 2 , покрытом питательной средой (см.
ниже) до использования.
Это произвело
видимое пятно при фазово-контрастной микроскопии. Тенасцин (50 мкг/мл)
или, в качестве контроля, термоинактивированный БСА, не содержащий жирных кислот (Boehringer
Мангейм; 50 мкг/мл в PBS) наносили непосредственно поверх
пятно BSA, меченное коллоидным золотом. Через 2 ч при 37°С тенасцин
пятно, покрытое БСА, промывали PBS, после чего весь
покровное стекло покрывали ламинином (20 мкг/мл в PBS) при 37°С в течение
2 ч. Покровные стекла промывали с помощью Ham’s F-14 или DMEM, а затем оставляли.
в инкубаторе СО 2 , покрытом питательной средой (см.
ниже) до использования.
Культура тканей.
Из пояснично-крестцового отдела выделено ДРГ.
области 7- или 8-дневных куриных эмбрионов и эксплантированных примерно на 1 мм от
граница. После прикрепления эксплантов к субстрату их
заливают культуральной средой (DMEM; GIBCO) с добавлением 10% эмбрионального
телячья сыворотка (GIBCO), пенициллин (100 ЕД/мл), стрептомицин (100
мкг/мл) и фактор роста нервов 7S (50 нг/мл; Boehringer
Мангейм). Культуры выдерживали в течение 8–24 ч до фиксации (см.
ниже), после чего конусы роста достигли тенасцина
граница.В некоторых экспериментах культуры поддерживали в присутствии
таксола в концентрациях от 10 до 75 нМ. Таксол хранился в
-20°C в виде маточного раствора в диметилсульфоксиде (ДМСО). Для каждого
В эксперименте к некоторым культурам в качестве контроля добавляли ДМСО.
Культуры выдерживали в течение 8–24 ч до фиксации (см.
ниже), после чего конусы роста достигли тенасцина
граница.В некоторых экспериментах культуры поддерживали в присутствии
таксола в концентрациях от 10 до 75 нМ. Таксол хранился в
-20°C в виде маточного раствора в диметилсульфоксиде (ДМСО). Для каждого
В эксперименте к некоторым культурам в качестве контроля добавляли ДМСО.
Интервальная видеомикроскопия.
Видео цейтраферная микроскопия была
используется для записи поведения конуса роста. Конусы роста считались
достигли границы, когда более одного филоподия контактировали с
тенасцин.Культуры просматривали под инвертированным микроскопом (Axiovert;
Zeiss), оснащенный масляным иммерсионным объективом (×100) и поддерживаемый при
37°C во влажном воздухе, содержащем 5% CO 2 внутри
климатизированный бокс вокруг предметного столика микроскопа (Zeiss). Изображения были
Записано с помощью видеокамеры с кремниевым усилением (SIT) в определенные
интервалы (обычно одно изображение каждые 2–3 секунды), которые определялись
средства кардиостимулятора (создан в лаборатории Ф. Бонхёффера,
Тюбинген, Германия). После обработки изображения на арифметическом кадре
граббер (перевод данных, Мальборо, Массачусетс) с использованием оптотехнологии
программное обеспечение, изображения сохранялись на видеопленку с помощью Grundig
(Фюрт, Германия) видеомагнитофон, модифицированный для покадровой видеосъемки.
запись.В некоторых экспериментах культуры фотографировали на Илфорде.
Пленка HP5.
Бонхёффера,
Тюбинген, Германия). После обработки изображения на арифметическом кадре
граббер (перевод данных, Мальборо, Массачусетс) с использованием оптотехнологии
программное обеспечение, изображения сохранялись на видеопленку с помощью Grundig
(Фюрт, Германия) видеомагнитофон, модифицированный для покадровой видеосъемки.
запись.В некоторых экспериментах культуры фотографировали на Илфорде.
Пленка HP5.
Антитела.
Крысиные mAb YL 1/2, специфичные к С-концу
тирозинированный α-тубулин (34, 35) был приобретен в Sera-Lab (Crawley
Даун, Сассекс, Великобритания). Кроличья антисыворотка против детирозинированного α-тубулина
(SUP GLU; ссылка 36) был подарен Дж. К. Булински (Колумбийский университет,
Нью-Йорк). Антитело к актину (N350) и антитело к α-тубулину
(N356) были куплены у Amersham.Вторичные антитела (флуоресцеин
или родамин против крыс и против кроликов) были приобретены у Sigma или
Milan Analytical (LaRoche, Швейцария). Родамин или
меченный флуоресцеином фаллоидин был приобретен у Molecular Probes.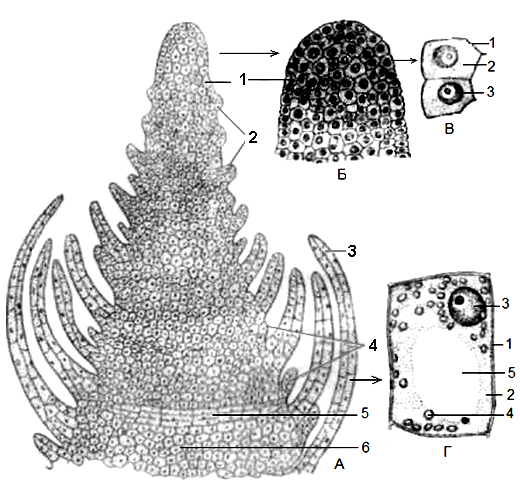
Фиксация и двойное мечение тубулина и F-актина.
После
8–14 ч культивирования или после цейтраферной видеомикроскопии культивирования
были зафиксированы путем удаления большей части культуральной среды при сохранении
культуры при 37°C и заменив его 3% (масса/объем) формальдегида,
0.2% (об./об.) глутарового альдегида, 0,2% Triton X-100 и 10 мМ EGTA в
PBS (26) при 37°С в течение 15 мин. Культуры пятикратно промывали
PBS, инкубированный в блокирующем буфере (5% лошадиной и козьей сыворотки/50 мМ
l-лизин/0,2% Triton X-100 в PBS), в течение 1 ч,
затем YL 1/2 (1:2), SUP GLU (1:1000), N350 (1:300) или N356
(1:300) по отдельности или в комбинации в блокирующем буфере в течение 2 часов, промытые
с PBS и инкубировали с соответствующим вторичным антителом (1:100)
и родамин или флуоресцеин-конъюгированный фаллоидин (5 мкг/мл) в
блокирующий буфер на 30 мин.В контрольной группе отсутствовало первичное антитело или
два вторичных антитела были заменены, чтобы получить неподходящее
комбинация.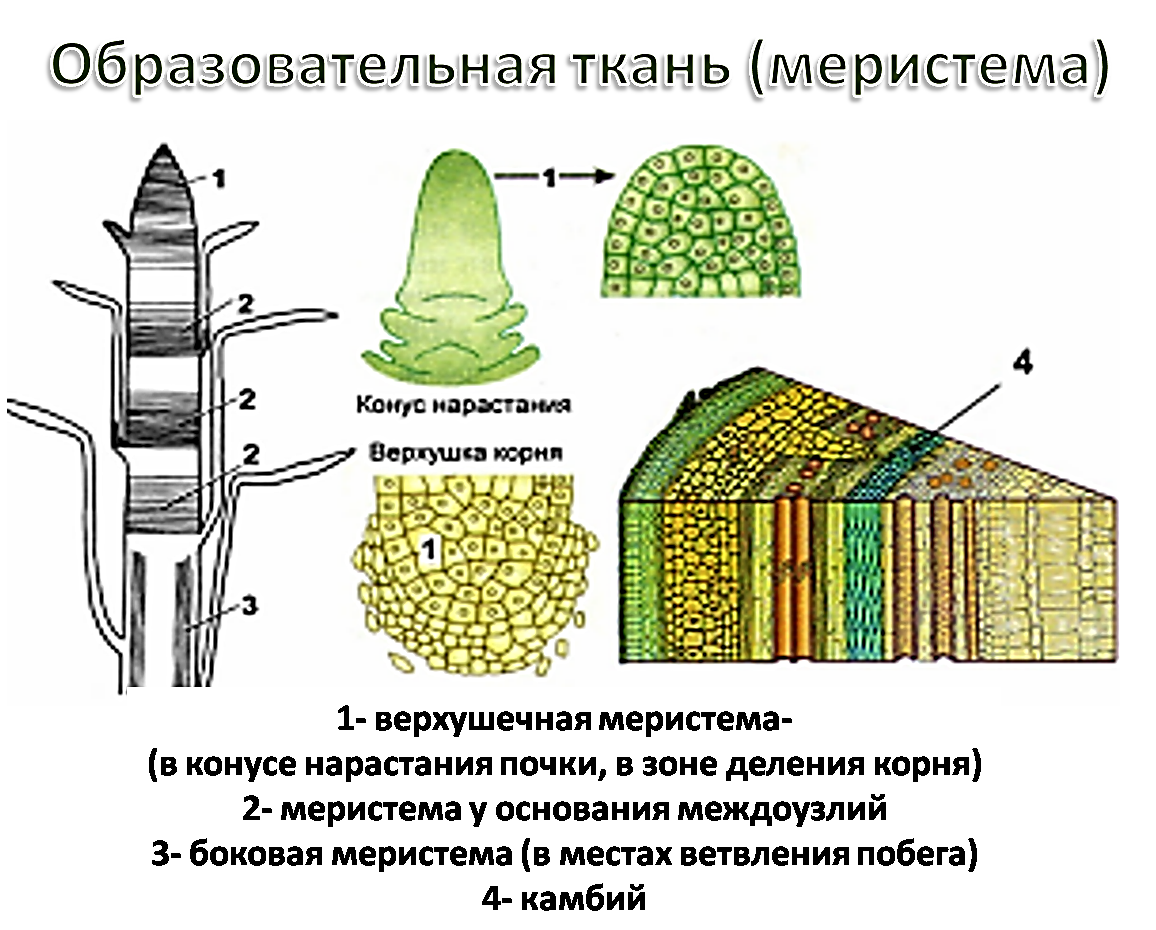 Все контроли были отрицательными. Покровные стекла помещали в
Citifluor (Городской университет, Лондон) и просмотр с фазовым контрастом или
флуоресцентную оптику с помощью микроскопа Olympus BX50 и сфотографировали
на пленке Kodak T-Max 400.
Все контроли были отрицательными. Покровные стекла помещали в
Citifluor (Городской университет, Лондон) и просмотр с фазовым контрастом или
флуоресцентную оптику с помощью микроскопа Olympus BX50 и сфотографировали
на пленке Kodak T-Max 400.
Анализ изображений.
Для количественной оценки расположения микротрубочек внутри конусов роста, конусов роста, которые были зафиксированы и окрашены для актин и тубулин были разделены пополам прямой линией, которая разделяла площадь конуса роста на две равные половины с помощью система анализа изображений ibas (Kontron Instruments, Цюрих).Количество микротрубочек, оканчивающихся в каждой половине конуса роста были засчитаны. Асимметричное распределение микротрубочек внутри конус роста оценивали, когда >60% микротрубочек оканчивались в одну половина конуса роста.
РЕЗУЛЬТАТЫ
Поведение конуса роста на ламинине и на границах тенасцина.
конуса роста кур DRG были исследованы с помощью покадровой видеомикроскопии. оценивать свое поведение перед фиксацией и следить за фиксацией
процесс.Конусы роста на ламинине, не дошедшие до тенасцина
границы, имели сходный морфологический вид и поведение с
описано ранее (6). Они были хорошо разбросаны и демонстрировали заметные
ламеллиподии и несколько филоподий (от 5 до 20 на конус роста)
который расширялся и втягивался от края конуса роста. Среднее
скорость продвижения конуса роста по ламинину, измеренная в живых культурах, была
55,2 ± 5,6 мкм/ч (среднее ± стандартное отклонение, n = 5).
После добавления в культуры фиксатора подвижность конусов роста прекращалась.
в течение нескольких секунд, а морфология конуса роста оставалась относительно
не изменялся в течение периода фиксации (данные не показаны; это в
соглашение с исх.21).
оценивать свое поведение перед фиксацией и следить за фиксацией
процесс.Конусы роста на ламинине, не дошедшие до тенасцина
границы, имели сходный морфологический вид и поведение с
описано ранее (6). Они были хорошо разбросаны и демонстрировали заметные
ламеллиподии и несколько филоподий (от 5 до 20 на конус роста)
который расширялся и втягивался от края конуса роста. Среднее
скорость продвижения конуса роста по ламинину, измеренная в живых культурах, была
55,2 ± 5,6 мкм/ч (среднее ± стандартное отклонение, n = 5).
После добавления в культуры фиксатора подвижность конусов роста прекращалась.
в течение нескольких секунд, а морфология конуса роста оставалась относительно
не изменялся в течение периода фиксации (данные не показаны; это в
соглашение с исх.21).
Конусы роста на границах тенасцина развивались гораздо медленнее, чем
на гомогенных ламининовых субстратах. В большинстве случаев (≈90%),
конусы роста не пересекали территорию, содержащую тенасцин, и
Филоподии конусов роста быстро удалялись в течение нескольких секунд.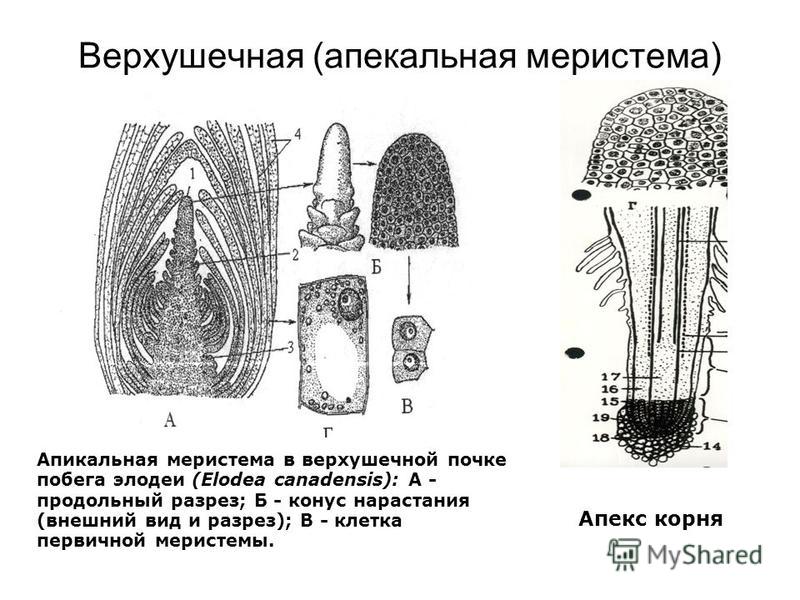 Ламеллоподии конусов роста на границах тенасцина имеют тенденцию к спаду.
от границы (6). Однако в некоторых случаях морфология
конусы роста на границах тенасцина мало отличались от таковых на
ламинин.
Ламеллоподии конусов роста на границах тенасцина имеют тенденцию к спаду.
от границы (6). Однако в некоторых случаях морфология
конусы роста на границах тенасцина мало отличались от таковых на
ламинин.
Организация микротрубочек в конусах роста на ламинине и тенасцине Границы.
Организация микротрубочек в конусах роста была
контролируется путем мечения фиксированных конусов роста антителами к тубулину. Мы
использовали mAb YL 1/2, которое распознает С-концевой тирозин
α-тубулин, потому что эта форма тубулина является основной формой роста
конусы (37, 38). Организация микротрубочек при росте кур DRG
колбочки на ламинине, выявленные при окрашивании mAb YL 1/2, были сходными
описанному ранее (26).Микротрубочки собраны в пучки
аксона, но при входе в конус роста они расширяются в центральном
домен. В некоторых случаях микротрубочки достигали периферического домена.
конуса нарастания, иногда заходя в филоподии (рис.
1 A и B ) (26).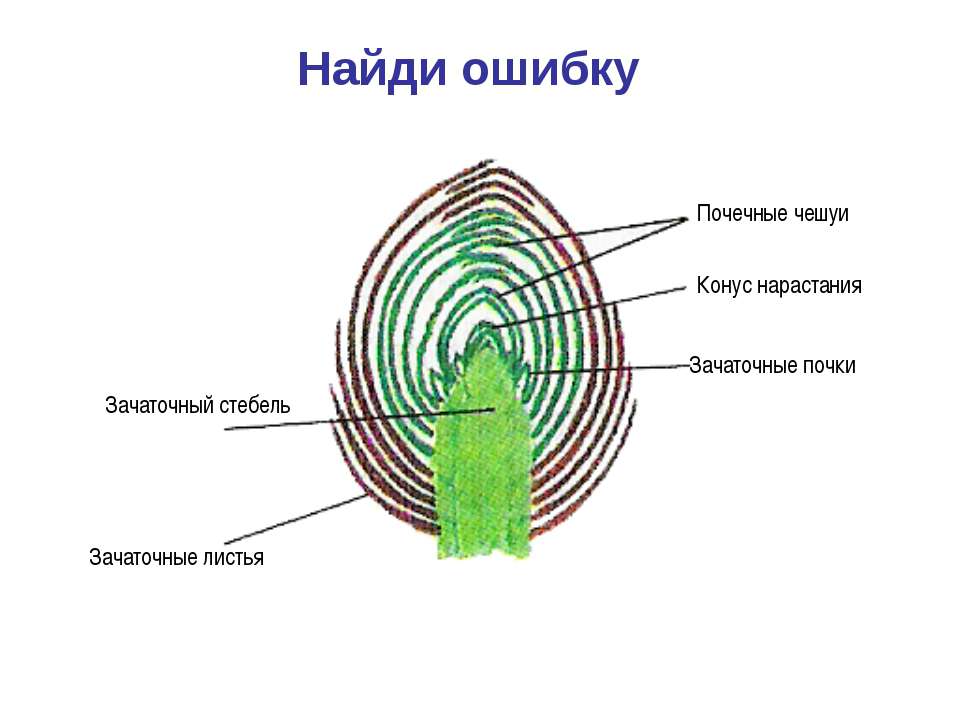
Микротрубочки переориентируются в конусах роста при
границы тенасцина. Фазово-контрастные и иммунофлуоресцентные микрофотографии
конусы роста, иммуноокрашенные mAb YL 1/2, которые окрашивают микротрубочки
( A , C и E ) и mAb
N350, окрашивающий актин ( B и D ).( F ) Фазово-контрастное изображение конуса живого роста, показанное на
Е . В конусах роста, растущих на ламинине ( A
и B ), микротрубочки растопырены в центральной
домен и расширяться, индивидуально, далеко в периферийный домен и
иногда вставляются в филоподии (стрелки на A ). В
этого конуса роста 52% микротрубочек имели окончания в
левой области конуса роста и, следовательно, по определению
дано в Материалы и методы , распределение
симметричный.Однако в конусах роста на границе ламинина и тенасцина
микротрубочки становятся асимметрично распределенными ( C и
Е ). В C и D актин
окрашивание ( D ) выявляет морфологию конуса роста, которая
предполагает, что аксон подошел к границе под небольшим углом и что
правая сторона конуса роста коснулась границы,
обозначено прерывистой линией. Микротрубочки в этом конусе роста
( C ) распределены асимметрично (65% микротрубочек
заканчиваются в правой половине).На микрофотографиях E и
F конус роста явно повернулся вправо и
асимметрия микротрубочек очевидна (стрелка E ).
Стрелки у E и F одинаковые
место расположения. Граница ламинин-тенасцин визуализируется коллоидным раствором.
золото (наконечники стрел).
В C и D актин
окрашивание ( D ) выявляет морфологию конуса роста, которая
предполагает, что аксон подошел к границе под небольшим углом и что
правая сторона конуса роста коснулась границы,
обозначено прерывистой линией. Микротрубочки в этом конусе роста
( C ) распределены асимметрично (65% микротрубочек
заканчиваются в правой половине).На микрофотографиях E и
F конус роста явно повернулся вправо и
асимметрия микротрубочек очевидна (стрелка E ).
Стрелки у E и F одинаковые
место расположения. Граница ламинин-тенасцин визуализируется коллоидным раствором.
золото (наконечники стрел).
В конусах роста на границах тенасцина произошла реорганизация микротрубочек
так что их дистальные окончания больше не были симметричными
распределяется внутри конуса роста (рис.1 C – F ).
Мы обнаружили примеры асимметричного расположения микротрубочек (рис. 1 C ), и конус роста, по-видимому, инициировал поворот,
судя по фазово-контрастной микроскопии и тому факту, что актин
окрашивание указывало на неравномерность массы конуса роста.
распределенный (рис. 1 D ). Мы не нашли четкого
примеры, когда микротрубочки были распределены асимметрично, но
конус роста был симметричным. Однако, возможно, мы пропустили такое событие.
потому что конусы роста становятся асимметричными вскоре после контакта с границами.В других случаях конус роста явно поворачивался, что видно по фазе.
контрастная микроскопия (рис. 1 Е и F ). Однако в
фиксированные культуры, прогнозирование поведения конусов роста на границах,
в какую сторону повернется конус роста, не
всегда возможно. Кроме того, у нас нет прямого способа точно
определение момента, когда конус роста решил развернуться. По этим причинам
мы не можем сказать, предшествует ли реорганизация микротрубочек конусу роста
превращение.
1 C ), и конус роста, по-видимому, инициировал поворот,
судя по фазово-контрастной микроскопии и тому факту, что актин
окрашивание указывало на неравномерность массы конуса роста.
распределенный (рис. 1 D ). Мы не нашли четкого
примеры, когда микротрубочки были распределены асимметрично, но
конус роста был симметричным. Однако, возможно, мы пропустили такое событие.
потому что конусы роста становятся асимметричными вскоре после контакта с границами.В других случаях конус роста явно поворачивался, что видно по фазе.
контрастная микроскопия (рис. 1 Е и F ). Однако в
фиксированные культуры, прогнозирование поведения конусов роста на границах,
в какую сторону повернется конус роста, не
всегда возможно. Кроме того, у нас нет прямого способа точно
определение момента, когда конус роста решил развернуться. По этим причинам
мы не можем сказать, предшествует ли реорганизация микротрубочек конусу роста
превращение.
Количественная оценка расположения микротрубочек внутри конусов роста
по ламинину показало, что подавляющее большинство (82%; 37/45 конусов роста
проанализированы) показали симметричное расположение микротрубочек. В
напротив, в конусах роста на границах тенасцина только 34% (24/70
проанализированные конусы роста) показали симметричное расположение микротрубочек.
В этом анализе мы насчитали от 10 до 40 микротрубочек на рост.
конус на ламинине и на границе. Эти результаты свидетельствуют о том, что в жизни
конусы роста поворачиваются на границе тенасцина, существует корреляция с
реорганизация микротрубочек в фиксированные конусы роста, которые отображают
признаки поворота.
В
напротив, в конусах роста на границах тенасцина только 34% (24/70
проанализированные конусы роста) показали симметричное расположение микротрубочек.
В этом анализе мы насчитали от 10 до 40 микротрубочек на рост.
конус на ламинине и на границе. Эти результаты свидетельствуют о том, что в жизни
конусы роста поворачиваются на границе тенасцина, существует корреляция с
реорганизация микротрубочек в фиксированные конусы роста, которые отображают
признаки поворота.
Поведение конуса роста во время лечения таксолом.
Результаты
описанные выше предполагают, что реорганизация микротрубочек в конусах роста
на границах тенасцина может быть ранним следствием конуса роста
контактируют с тенасцином и, следовательно, лежат в основе поворота конуса роста. Тестировать
этой гипотезы мы исследовали поведение конусов роста при тенасцине
границы в присутствии соединения, стабилизирующего микротрубочки, таксола.
Предыдущая работа показала, что стехиометрические концентрации (микромолярные)
Таксол ингибирует рост аксонов и увеличивает массу микротрубочек и
связывание в конусы роста (20, 38–43).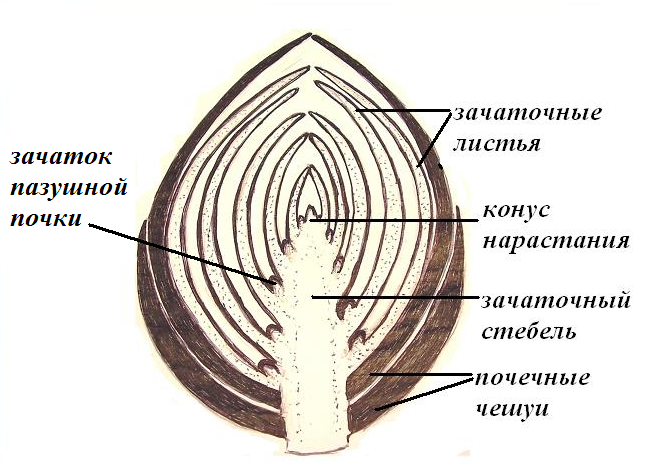 Более поздняя работа с
субстехиометрических концентрациях (наномолярных) таксола выявила более
тонкие эффекты в ненейрональных клетках; в основном снижение динамики
нестабильность без заметного увеличения массы полимера (31, 32).
Мы задались вопросом, могут ли субстехиометрические концентрации таксола
оказались полезными для исследования функции микротрубочек в конусах роста, поворачивающихся в
границы тенасцина.
Более поздняя работа с
субстехиометрических концентрациях (наномолярных) таксола выявила более
тонкие эффекты в ненейрональных клетках; в основном снижение динамики
нестабильность без заметного увеличения массы полимера (31, 32).
Мы задались вопросом, могут ли субстехиометрические концентрации таксола
оказались полезными для исследования функции микротрубочек в конусах роста, поворачивающихся в
границы тенасцина.
Сначала мы определили влияние низких концентраций таксола на
организация микротрубочек в конусах роста, растущих на ламинине и на
границы тенасцина (рис.2). Для этого мы добавили
таксола в концентрациях 10 и 75 нМ в культуры DRG и приготовленные
их для иммунофлуоресценции в разное время после воздействия
препарат, средство, медикамент. Поскольку известно, что таксол в высоких концентрациях стабилизирует
микротрубочек, что связано с увеличением доли
микротрубочек, содержащих детирозинированный α-тубулин в конусах роста
(43), мы использовали антитело (SUP GLU), которое распознает эту форму
α-тубулин, а также mAb YL 1/2, распознающее тирозиновые
α-тубулин.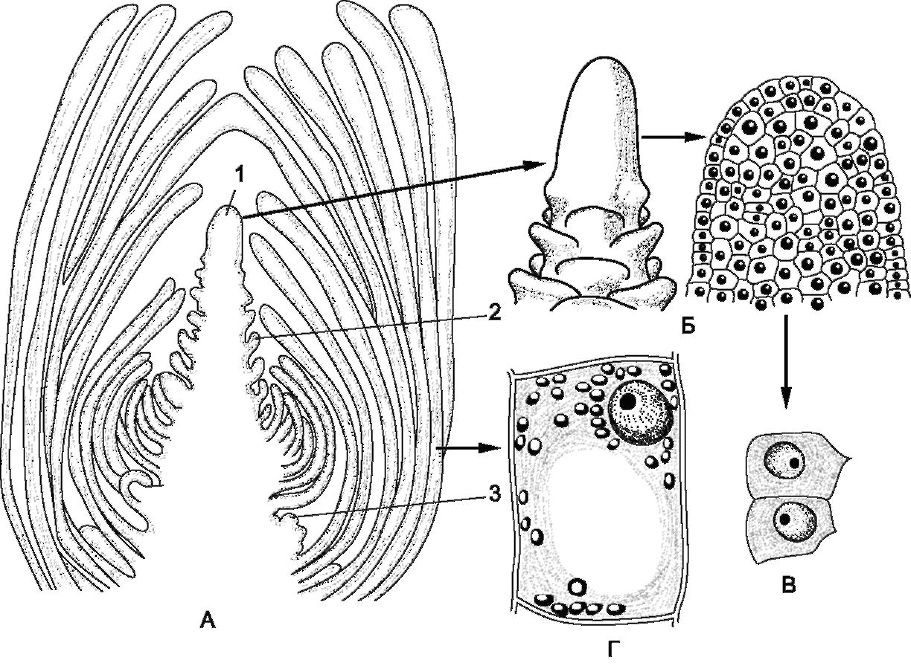 Такой подход гарантировал, что все микротрубочки в росте
наблюдались конусы. В контрольных культурах большинство
микротрубочки в конусах роста содержали тирозинированный α-тубулин (т.е.
были YL 1/2 + ), что подтверждает предыдущие наблюдения (рис.
2 А ; исх. 26 и 44). Имеется набор микротрубочек
который содержал детирозинированный α-тубулин (SUP GLU + ), но
их было меньше, они располагались проксимальнее в конусе роста
и, как правило, были сильно изогнуты, часто напоминая петли шпильки (рис.2 В ). После обработки таксолом
микротрубочек было меньше, они не простирались так далеко дистально (рис.
2 C и D ), как обычно
культур (рис. 1 A и B и рис. 2 A
и B ) и были плотно связаны (рис. 2 D ,
E и G ). В конусах роста, обработанных таксолом,
детирозинированные микротрубочки были либо сильно изогнуты, либо, что чаще,
туго связаны и вытянуты вперед до тирозинированного
микротрубочки (ср.
Такой подход гарантировал, что все микротрубочки в росте
наблюдались конусы. В контрольных культурах большинство
микротрубочки в конусах роста содержали тирозинированный α-тубулин (т.е.
были YL 1/2 + ), что подтверждает предыдущие наблюдения (рис.
2 А ; исх. 26 и 44). Имеется набор микротрубочек
который содержал детирозинированный α-тубулин (SUP GLU + ), но
их было меньше, они располагались проксимальнее в конусе роста
и, как правило, были сильно изогнуты, часто напоминая петли шпильки (рис.2 В ). После обработки таксолом
микротрубочек было меньше, они не простирались так далеко дистально (рис.
2 C и D ), как обычно
культур (рис. 1 A и B и рис. 2 A
и B ) и были плотно связаны (рис. 2 D ,
E и G ). В конусах роста, обработанных таксолом,
детирозинированные микротрубочки были либо сильно изогнуты, либо, что чаще,
туго связаны и вытянуты вперед до тирозинированного
микротрубочки (ср. 2 F и H с
E и G ). Кроме того, их количество было
увеличилась (рис. 2 F и H по сравнению с рис.
1 В ). Чтобы количественно оценить эффект таксола на связывание микротрубочек,
мы измерили латеральное распространение микротрубочек в конусах роста от
микрофотографии. В контрольных конусах роста, растущих на ламинине,
распространение микротрубочек составило 21,07 ± 9,97 мкм (среднее значение ± стандартное отклонение,
n = 10), тогда как после таксола (75 нМ) она составляла 5 ±
2.28 мкм (среднее ± стандартное отклонение, n = 18). Эти эффекты
Таксол на конусах роста наблюдался с разной выраженностью в зависимости от
используемая концентрация таксола. Чтобы подтвердить, что комбинация YL
Двойная маркировка 1/2 и SUP GLU выявила все помеченные нами микротрубочки.
некоторые культуры с антителом против α-тубулина (N356), которое распознает
всех форм тубулина и подтвердили действие таксола на микротрубочки в
конусы роста (не показаны).
2 F и H с
E и G ). Кроме того, их количество было
увеличилась (рис. 2 F и H по сравнению с рис.
1 В ). Чтобы количественно оценить эффект таксола на связывание микротрубочек,
мы измерили латеральное распространение микротрубочек в конусах роста от
микрофотографии. В контрольных конусах роста, растущих на ламинине,
распространение микротрубочек составило 21,07 ± 9,97 мкм (среднее значение ± стандартное отклонение,
n = 10), тогда как после таксола (75 нМ) она составляла 5 ±
2.28 мкм (среднее ± стандартное отклонение, n = 18). Эти эффекты
Таксол на конусах роста наблюдался с разной выраженностью в зависимости от
используемая концентрация таксола. Чтобы подтвердить, что комбинация YL
Двойная маркировка 1/2 и SUP GLU выявила все помеченные нами микротрубочки.
некоторые культуры с антителом против α-тубулина (N356), которое распознает
всех форм тубулина и подтвердили действие таксола на микротрубочки в
конусы роста (не показаны).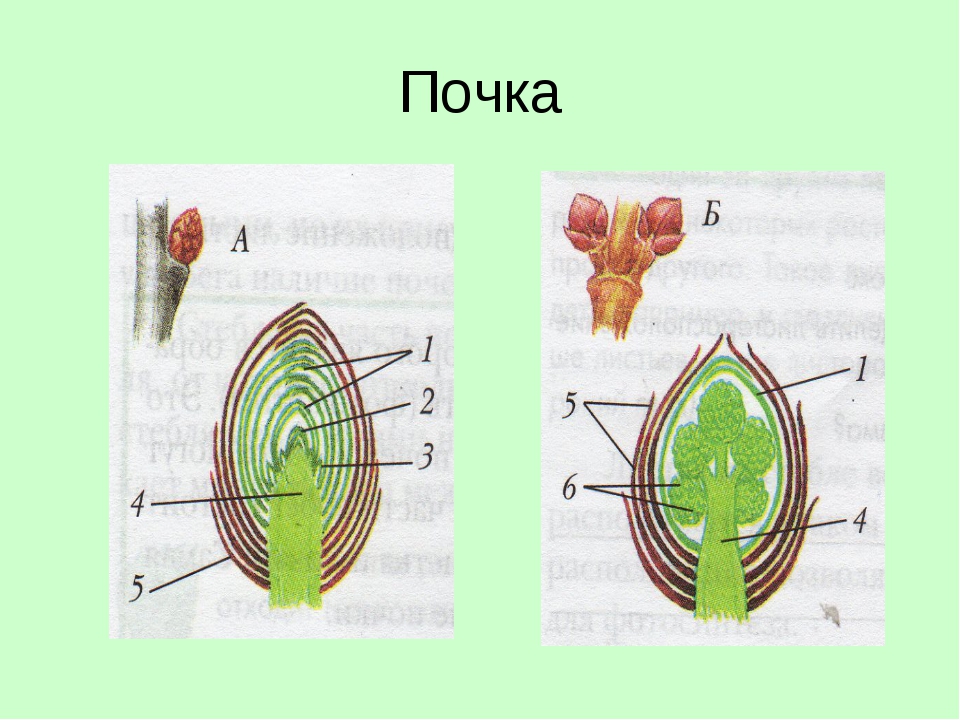
Субстехиометрические концентрации таксола
стабилизирует и связывает микротрубочки.Иммунофлуоресцентные микрофотографии
конусы роста, выращенные на ламинине ( A – H ) и
на границе тенасцина ( I и J ) в
отсутствие ( А и В ) и присутствие таксола
( С , D , I , и
Дж , 75 нМ; E – H , 10 нМ).
Культуры иммуноокрашивали mAb YL 1/2, которые окрашивают тирозинсодержащие
α-тубулин ( А , D , Е ,
G и J ), SUP GLU (SG в
F и H ), который окрашивает детирозинат
α-тубулин ( B , F и H ),
и mAb N350, окрашивающие актин ( C и
я ).Микротрубочки в конусах роста, растущих на ламинине
в контрольных культурах преобладают YL 1/2 + , т.е.
содержат тирозинированный α-тубулин ( A ), тогда как SUP
Микротрубочки GLU + образуют небольшую отдельную группу,
часто сильно изогнуты и расположены более проксимально ( B ). в
присутствие таксола микротрубочки в конусах роста становятся более связанными
и не распространяются так далеко дистально, как обычно ( C и
Д ; I и J ; видеть
А ).Кроме того, пропорция SUP GLU +
микротрубочек увеличивается ( F и H по сравнению с
E и G ). На границах ламинин-тенасцин,
конусы роста, растущие в таксоле, останавливаются, и их микротрубочки
остаются связанными и располагаются проксимально ( I и
J ). Положение границы обозначено
пунктирная линия. (Увеличение в E – H равно
в Б .)
в
присутствие таксола микротрубочки в конусах роста становятся более связанными
и не распространяются так далеко дистально, как обычно ( C и
Д ; I и J ; видеть
А ).Кроме того, пропорция SUP GLU +
микротрубочек увеличивается ( F и H по сравнению с
E и G ). На границах ламинин-тенасцин,
конусы роста, растущие в таксоле, останавливаются, и их микротрубочки
остаются связанными и располагаются проксимально ( I и
J ). Положение границы обозначено
пунктирная линия. (Увеличение в E – H равно
в Б .)
При концентрациях таксола 10 и 75 нМ аксоны все еще были способны
простираются от эксплантатов DRG, хотя и с меньшей скоростью.В присутствии
10 нМ таксола, скорость в живых культурах составила 23,8 ± 4,6
мкм/ч (среднее ± стандартное отклонение, n = 5), т.е.
значительно отличается ( P < 0,001) от контроля
культур (см. выше; рис. 3 и
4). Мы также определили влияние таксола на
длина аксона в фиксированных культурах. В контрольных культурах аксоны имели
средняя длина 144,12 ± 31,03 мкм (среднее значение ± стандартное отклонение,
n = 100), тогда как после 75 нМ таксола средний аксон
длина уменьшилась до 57,71 ± 17,32 мкм (среднее ± стандартное отклонение,
н = 100).Мы также заметили, что аксоны стали толще и
не разветвлялись в присутствии таксола (см. также ссылку 40). Под контролем
культуры 12,26% аксонов были разветвленными ( n = 302),
тогда как после 75 нМ таксола доля аксонов с ответвлениями уменьшилась.
снижается до 0,82% ( n = 491). Замедленная съемка видео
микроскопия конусов роста показала, что имел место транзиторный (10–15
мин) ответ на таксол, при котором ламеллоподии частично разрушаются
и филоподии стали длиннее (рис. 4 B ).
выше; рис. 3 и
4). Мы также определили влияние таксола на
длина аксона в фиксированных культурах. В контрольных культурах аксоны имели
средняя длина 144,12 ± 31,03 мкм (среднее значение ± стандартное отклонение,
n = 100), тогда как после 75 нМ таксола средний аксон
длина уменьшилась до 57,71 ± 17,32 мкм (среднее ± стандартное отклонение,
н = 100).Мы также заметили, что аксоны стали толще и
не разветвлялись в присутствии таксола (см. также ссылку 40). Под контролем
культуры 12,26% аксонов были разветвленными ( n = 302),
тогда как после 75 нМ таксола доля аксонов с ответвлениями уменьшилась.
снижается до 0,82% ( n = 491). Замедленная съемка видео
микроскопия конусов роста показала, что имел место транзиторный (10–15
мин) ответ на таксол, при котором ламеллоподии частично разрушаются
и филоподии стали длиннее (рис. 4 B ).
Фазово-контрастные микрофотографии эксплантатов DRG
на границах тенасцина, выращенные только в присутствии ДМСО ( A )
или в таксоле (75 нМ) в ДМСО ( В ). Добавляли таксол или ДМСО.
во время эксплантации и культуры оставляли на ночь. То
область тенасцина, отмеченная коллоидным золотом, представляет собой темную область с
резкая граница в нижней половине микрофотографий. Как правило, в
контрольная культура ( A ), большинство конусов роста повернулись и росли вдоль
граница тенасцина.Небольшая доля конусов роста, особенно
те, что подошли к границе перпендикулярно, перешли ее. В
наличие Таксола ( В ), конусов роста, приближавшихся к
граница под небольшим углом поворачивалась и росла вдоль границы, но те
подходившие перпендикулярно к границе тенасцина, не поворачивались или
Пересекать. Некоторые из этих последних групп конусов роста находились в контакте с
границы не менее 5 часов. Обратите внимание, что в таксоле ( B )
скорость удлинения аксона замедляется, а разрастание аксона меньше
обильное, по сравнению с контролем (см. A ).
Добавляли таксол или ДМСО.
во время эксплантации и культуры оставляли на ночь. То
область тенасцина, отмеченная коллоидным золотом, представляет собой темную область с
резкая граница в нижней половине микрофотографий. Как правило, в
контрольная культура ( A ), большинство конусов роста повернулись и росли вдоль
граница тенасцина.Небольшая доля конусов роста, особенно
те, что подошли к границе перпендикулярно, перешли ее. В
наличие Таксола ( В ), конусов роста, приближавшихся к
граница под небольшим углом поворачивалась и росла вдоль границы, но те
подходившие перпендикулярно к границе тенасцина, не поворачивались или
Пересекать. Некоторые из этих последних групп конусов роста находились в контакте с
границы не менее 5 часов. Обратите внимание, что в таксоле ( B )
скорость удлинения аксона замедляется, а разрастание аксона меньше
обильное, по сравнению с контролем (см. A ).
Таксол не может заблокировать продвижение конуса роста на
ламинин, но обратимо блокирует поворот конуса роста на границах тенасцина. Первая последовательность цейтраферных фазово-контрастных видеоизображений
( A – C ) демонстрирует действие таксола (10 нМ)
по конусу роста, наступающему на ламинин. Цифры указывают время в
минут. Таксол добавляли вскоре после времени 0 мин ( А ). Там
временное увеличение длины филоподий и частичное
ламеллоподиальный коллапс в течение 10 минут после добавления таксола
( B ), но продвижение конуса роста не тормозится; Обратите внимание
неподвижный фрагмент мусора на покровном стекле (стрелки).Во-вторых
последовательности ( D – G ), вскоре был добавлен таксол
через время 0 мин и заменяют свежей средой, без таксола, через
60 мин. На границе тенасцина конус роста останавливается.
после добавления таксола ( E и F ; примечание
стационарные обломки, обозначенные стрелками), но возобновляется
поворот по границе после удаления таксолсодержащей среды
( Г ). В этой последовательности конус роста также расширяется на несколько
длинные филоподии в течение 10 минут после добавления таксола ( E )
но это явление временное ( F ).
Первая последовательность цейтраферных фазово-контрастных видеоизображений
( A – C ) демонстрирует действие таксола (10 нМ)
по конусу роста, наступающему на ламинин. Цифры указывают время в
минут. Таксол добавляли вскоре после времени 0 мин ( А ). Там
временное увеличение длины филоподий и частичное
ламеллоподиальный коллапс в течение 10 минут после добавления таксола
( B ), но продвижение конуса роста не тормозится; Обратите внимание
неподвижный фрагмент мусора на покровном стекле (стрелки).Во-вторых
последовательности ( D – G ), вскоре был добавлен таксол
через время 0 мин и заменяют свежей средой, без таксола, через
60 мин. На границе тенасцина конус роста останавливается.
после добавления таксола ( E и F ; примечание
стационарные обломки, обозначенные стрелками), но возобновляется
поворот по границе после удаления таксолсодержащей среды
( Г ). В этой последовательности конус роста также расширяется на несколько
длинные филоподии в течение 10 минут после добавления таксола ( E )
но это явление временное ( F ). (Бар в
A = 10 мкм.) Область, покрытая тенасцином, отмечена
коллоидным золотом, которое кажется более темным на фазовом контрасте
( D – G ).
(Бар в
A = 10 мкм.) Область, покрытая тенасцином, отмечена
коллоидным золотом, которое кажется более темным на фазовом контрасте
( D – G ).
В то время как в отсутствие таксола большинство конусов роста, контактировавшие границы тенасцина повернулись к росту вдоль границы (рис. 3), в Культуры, обработанные таксолом, многие из конусов роста, границы не могли повернуть, особенно если подход был перпендикулярно (рис. 3 и 4). Мы культивировали 16 эксплантатов DRG в норме. среду и обнаружили, что все культуры имели примеры поворота конусов роста на границах тенасцина, тогда как в 25 эксплантатах DRG, культивируемых в присутствии 75 нМ таксола конусы роста не поворачивались на границе в все случаи.Только у двух из этих эксплантов были обнаружены конусы роста, повернулся. Из 307 аксонов, достигших границы, 23 повернулся.
Шишки роста, достигшие границы тенасцина в присутствии
Таксола арестовали заранее, и он остался стоять на месте. границы, хотя они продолжали расширять и втягивать филоподии и
ламеллиподия. Те конусы роста, которые подошли к границе тенасцина
под небольшими углами, однако, иногда могли расти вдоль
граница (рис.3). Когда конусы роста не могли повернуться к тенасцину
границы в присутствии таксола, они оставались на границе до
Таксол был удален. Мы наблюдали отдельные конусы роста, остановившиеся на
границы тенасцина более 6 часов (наблюдаются три конуса роста),
тогда как обычно они проводят на границе от 30 до 60 минут
(семь конусов роста рассчитаны по времени). Таким образом, уменьшенная скорость конуса роста, наблюдаемая на
ламинина в присутствии таксола (см. выше) недостаточно для
объяснить увеличение времени, в течение которого задержанные конусы роста проводят в
граница.Микротрубочки в конусах роста останавливаются на тенасцине.
границы оставались плотно пучками и располагались проксимально, как на ламинине
отдельно (рис. 2 I и J ). Когда Таксол был промыт
из, максимум через 6 ч в культуральной среде, и заменены на
свежая среда, конусы роста, ранее задержанные на границе
снова смогли поворачиваться и расти вдоль ламининовой стороны
граница (рис.
границы, хотя они продолжали расширять и втягивать филоподии и
ламеллиподия. Те конусы роста, которые подошли к границе тенасцина
под небольшими углами, однако, иногда могли расти вдоль
граница (рис.3). Когда конусы роста не могли повернуться к тенасцину
границы в присутствии таксола, они оставались на границе до
Таксол был удален. Мы наблюдали отдельные конусы роста, остановившиеся на
границы тенасцина более 6 часов (наблюдаются три конуса роста),
тогда как обычно они проводят на границе от 30 до 60 минут
(семь конусов роста рассчитаны по времени). Таким образом, уменьшенная скорость конуса роста, наблюдаемая на
ламинина в присутствии таксола (см. выше) недостаточно для
объяснить увеличение времени, в течение которого задержанные конусы роста проводят в
граница.Микротрубочки в конусах роста останавливаются на тенасцине.
границы оставались плотно пучками и располагались проксимально, как на ламинине
отдельно (рис. 2 I и J ). Когда Таксол был промыт
из, максимум через 6 ч в культуральной среде, и заменены на
свежая среда, конусы роста, ранее задержанные на границе
снова смогли поворачиваться и расти вдоль ламининовой стороны
граница (рис. 4).
4).
ОБСУЖДЕНИЕ
Ранее мы охарактеризовали событие поворота конуса роста в какие конусы роста DRG кур реагируют на резкую границу субстрата между белками внеклеточного матрикса ламинином и тенасцином в витро (5, 6).На границе конусы роста поворачиваются и растут вдоль ламининная сторона границы. Поворот конуса роста — фундаментальное событие наблюдается во время поиска пути конуса роста, например, в оптическом перекрест (45). Наш выбор теста предоставил нам идеальную возможность исследовать основную роль цитоскелета в конусе роста превращение.
Здесь мы показываем, что микротрубочки конусов роста реорганизуются в процессе роста.
конусы с морфологическими признаками поворота на границах тенасцина. То
реорганизация принимает форму перераспределения дистальных
окончаний микротрубочек в половину конуса роста.Мы
нельзя быть полностью уверенным в том, что реорганизация предсказывает
направление поворота конуса роста, потому что мы смотрели на фиксированные культуры. Недавние эксперименты Танаки и Киршнера (46) с живыми ростовыми конусами.
также указывают на то, что микротрубочки реорганизуются во время поворота.
Однако они также не смогли сказать, являются ли микротрубочки
реорганизация предшествует повороту конуса роста или является его следствием.
Недавние эксперименты Танаки и Киршнера (46) с живыми ростовыми конусами.
также указывают на то, что микротрубочки реорганизуются во время поворота.
Однако они также не смогли сказать, являются ли микротрубочки
реорганизация предшествует повороту конуса роста или является его следствием.
Для проверки роли реорганизации микротрубочек в повороте конуса роста
мы наносили таксол, соединение, стабилизирующее микротрубочки, на конусы роста.Предыдущая работа показала, что микромолярные концентрации таксола ингибируют
рост аксонов и увеличение массы микротрубочек и их связывание в конусы роста
(20, 38–43). Более поздняя работа с наномолярными концентрациями таксола.
выявил более тонкие эффекты в ненейрональных клетках; главным образом
снижение динамической нестабильности без увеличения массы полимера
(31, 32). Мы обнаружили, что наномолярные концентрации таксола увеличиваются.
связывание микротрубочек и ограничение распределения микротрубочек в
конусы роста.Стабильность микротрубочек в конусах роста также была повышена,
судя по увеличению количества детирозинированного α-тубулина,
маркер стабильности микротрубочек (47, 48).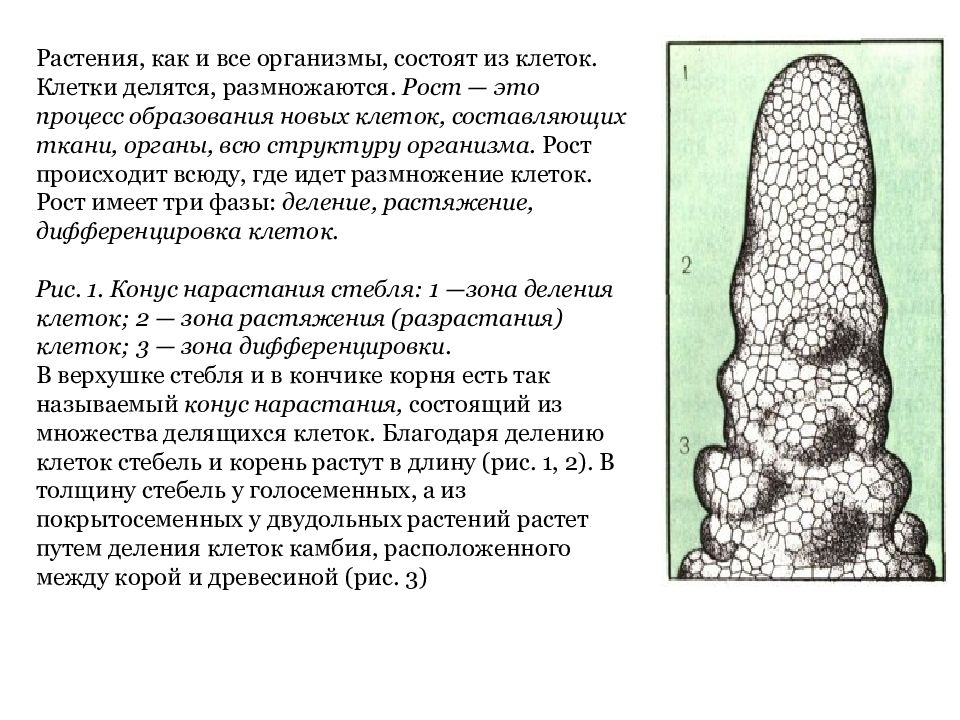 Несмотря на эти драматические
изменения в организации микротрубочек в конусах роста, аксонах
продолжал удлиняться, хотя и с меньшей скоростью. это в отмеченном
в отличие от предыдущих экспериментов с высокими концентрациями таксола — и
препараты, которые деполимеризуют микротрубочки, в которых удлинение аксонов было
заторможенные (20, 40, 41, 43, 49). Доказано, что конусы роста
основное место действия этих препаратов, и было высказано предположение, что
полимеризация микротрубочек в конусе роста необходима для
удлинение аксона (49).При высоких концентрациях таксола или микротрубочек
деполимеризации лекарств, вполне вероятно, что микротрубочки либо
препятствуют расширению вперед в конус роста из-за скольжения или
полимеризации, либо полностью теряются из конуса роста. В нашем
эксперименты с наномолярными концентрациями таксола, хотя
микротрубочки все еще присутствуют в конусах роста, микротрубочки
полимеризация, вероятно, сильно снижается или даже прекращается (31).
Поскольку удлинение аксонов продолжалось в таких условиях, вероятно,
что удлинение не полностью зависит от микротрубочек
полимеризация, как предполагалось изначально (49).
Несмотря на эти драматические
изменения в организации микротрубочек в конусах роста, аксонах
продолжал удлиняться, хотя и с меньшей скоростью. это в отмеченном
в отличие от предыдущих экспериментов с высокими концентрациями таксола — и
препараты, которые деполимеризуют микротрубочки, в которых удлинение аксонов было
заторможенные (20, 40, 41, 43, 49). Доказано, что конусы роста
основное место действия этих препаратов, и было высказано предположение, что
полимеризация микротрубочек в конусе роста необходима для
удлинение аксона (49).При высоких концентрациях таксола или микротрубочек
деполимеризации лекарств, вполне вероятно, что микротрубочки либо
препятствуют расширению вперед в конус роста из-за скольжения или
полимеризации, либо полностью теряются из конуса роста. В нашем
эксперименты с наномолярными концентрациями таксола, хотя
микротрубочки все еще присутствуют в конусах роста, микротрубочки
полимеризация, вероятно, сильно снижается или даже прекращается (31).
Поскольку удлинение аксонов продолжалось в таких условиях, вероятно,
что удлинение не полностью зависит от микротрубочек
полимеризация, как предполагалось изначально (49). Альтернативно, аксон
удлинение может поддерживаться как микротрубочками, простирающимися в
конус роста за счет скольжения полимера и за счет полимеризации (50).
Альтернативно, аксон
удлинение может поддерживаться как микротрубочками, простирающимися в
конус роста за счет скольжения полимера и за счет полимеризации (50).
При выращивании в присутствии таксола конусы роста на границах тенасцина
не могли поворачиваться и расти вдоль ламинин-тенасциновой границы, и
следовательно, остановили их продвижение. Конусы роста были арестованы в
границы до тех пор, пока присутствует таксол (до 6 ч), и их
микротрубочки оставались связанными и располагались проксимально. Эти эффекты
таксола были полностью обратимы.В совокупности эти результаты свидетельствуют о том, что
реорганизация микротрубочек в конусы роста является необходимым событием в
поворот конуса роста. Микротрубочки могут функционировать в этом важном аспекте.
поведения конуса роста, чтобы стабилизировать поворот, а также направить
перемещение органелл путем быстрого аксонального транспорта в соответствующие
области конуса роста. Мы также наблюдали, что таксол отменяет
разветвления аксонов, и поскольку это обычно происходит по конусу роста
расщепления в культурах кур DRG (25, 40), этот эффект может быть связан
к тому, что конусы роста не поворачиваются на границах в присутствии
Таксол.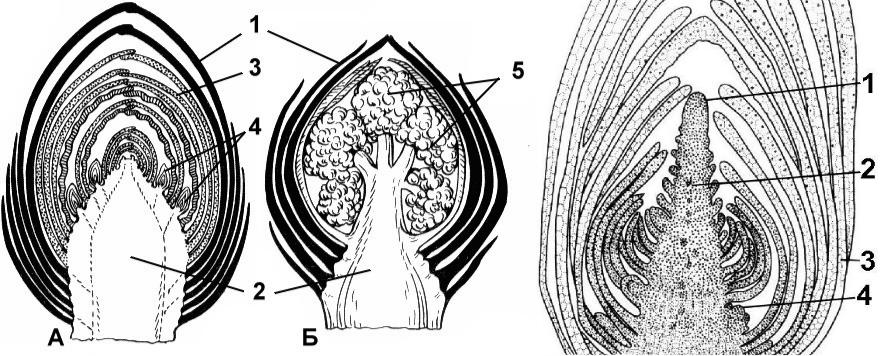
Эксперименты на эмбрионах кузнечиков, в которых нейроны Ti1 были
микроинъекции конъюгатов флуоресцентного тубулина свидетельствуют о том, что
микротрубочки могут быть либо селективно стабилизированы, либо полимеризованы в
области конуса роста, которые станут новым аксоном (51). В этих
экспериментах микротрубочки избирательно внедрялись в ветви, которые развились
из стабилизированных филоподий и в конечном итоге превратились в новые нейриты. Рост
колбочки, которые контактируют с сигналами наведения, накапливают F-актин в этих локальных местах.
точки контакта и микротрубочки перераспределяются в сторону этих
регионы впоследствии (46, 52, 53).В некоторых случаях микротрубочки
реорганизация произошла до того, как масса конуса роста стала неравномерной
распределяется во время поворота, предполагая, что реорганизация микротрубочек
может предшествовать повороту. Локальная стабилизация F-актина может передавать
информация о наведении в пределах конуса роста, возможно, путем захвата и
стабилизация микротрубочек белками, ассоциированными с микротрубочками.
Какие механизмы передачи сигнала задействованы в конусе роста? изменение поведения на границах тенасцина? Внутриклеточные изменения Ca 2+ (54) и гетеротримерные G-белки (55) были показано, что они участвуют в полном коллапсе конуса роста (56).Эти события, однако, отличаются от частичного коллапса конуса роста видны на границах тенасцина (6). Рецепторы клеточной поверхности при росте конус, опосредующий эти разные поведения, еще предстоит идентифицировать. Вероятные кандидаты включают интегрины (57–59) и F3/11. молекула адгезии суперсемейства иммуноглобулинов (60, 61). Знание рецепторы и механизмы передачи сигнала, лежащие в основе конуса роста превращение, вызванное тенасцином, послужит основой для дальнейшего понимание участия цитоскелета в ответ на внешние направляющие сигналы.
Благодарности
Мы благодарим Дж. К. Булински за антитела SUP GLU и Элли Танаку за
очень полезные комментарии к рукописи. Т.В. был поддержан
Студенчество Совета по науке и инженерным исследованиям и европейский
Стипендия организации молекулярной биологии. Национальный Рак
Институт щедро предоставил таксол.
Национальный Рак
Институт щедро предоставил таксол.
Сноски
-
↵ Текущий адрес: Институт Людвига, CMM-East, 9500 Gilman. Драйв, Калифорнийский университет в Сан-Диего, Ла-Хойя, Калифорния
- -0660.
-
↵ Кому следует направлять запросы на перепечатку.
-
↵ Текущий адрес: Eisai London Research Laboratories Ltd., Здание Бернарда Каца, Университетский колледж Лондона, Гауэр-стрит, Лондон WC1E 6BT, Великобритания
-
Томас С. Риз, Национальный институт неврологии Заболевания и инсульт, Bethesda, MD
-
Сокращения: ДМСО, диметилсульфоксид; ДРГ, задний корень ганглий.
- Получено 7 февраля 1996 г.
- Принято 17 октября 1996 г.

- по соединению субстрат-цитоскелет | Журнал клеточной биологии
apCAM очищали иммуноаффинным выделением, как сообщалось (Keller and Schacher, 1990). Ганглии нервной системы Aplysia и связанные с ними коннекторы гомогенизировали в охлажденном льдом растворе, содержащем 250 мМ сахарозы и 25 мМ Трис, рН 7,4, 3 мМ ЭДТА, 1 мМ ЭГТА и 0,5 мМ Пефаблок (Boehringer Mannheim Biochemicals, Индианаполис, Индиана). ингибиторы протеаз. После центрифугирования гомогената при 1600 g в течение 10 мин для удаления ядер и соединительного дебриса супернатант центрифугировали при 150 000 g в течение 2 ч при 4°С. Осажденные мембраны солюбилизировали в 2.5% Тритон Х-100, 25 мМ Трис, рН 7,4, 150 мМ NaCl, содержащий 1 мг/мл БСА и 0,5 мМ Пефаблок, в течение ночи при 4°С. Экстрагированные мембраны центрифугировали при 150 000 g в течение 1 ч, а супернатант загружали при 4°C на аффинную колонку, которую готовили путем связывания IgG моноклонального антитела против apCAM 4E8 (распознает внеклеточный эпитоп во всех трех описанных случаях).
 изоформ apCAM; Keller and Schacher, 1990; Mayford et al., 1992) в активируемую бромцианом сефарозу 4B (Sigma Chemical Co., Сент-Луис, Миссури) по данным производителя. Колонку промывали 10 объемами следующих буферов: 50 мМ Трис, рН 7,4, 0,5 М NaCl, 1 мМ ЭДТА, 0,5% Тритон Х-100; 50 мМ Трис, рН 7,4, 150 мМ NaCl, 1% Тритон Х-100; 50 мМ Трис, рН 7,4, 150 мМ NaCl и 1% β-октилглюкозида (Sigma Chemical Co.). арСАМ элюировали 100 мМ глицина, рН 2,6, 150 мМ NaCl, 3 мМ ЭДТА, 1 мМ ЭГТА, 1% β-октилглюкозида. Фракции объемом 1,5 мл немедленно нейтрализовали 50 мкл 1 М Трис, рН 9,5. Фракции анализировали по 7.5% SDS-PAGE с последующим окрашиванием серебром (Heukeshoven and Dernick, 1988) и иммуноблоттингом с 4E8 (Thompson et al., 1996). Затем очищенный apCAM подвергали диализу против PBS и концентрировали с Centripreps (Amicon Corp., Danvers, MA) до 150–250 мкг/мл. Определение белка проводили с использованием микроанализа BCA (Pierce Chemical Co., Rockford, IL) в соответствии с инструкциями производителя.
изоформ apCAM; Keller and Schacher, 1990; Mayford et al., 1992) в активируемую бромцианом сефарозу 4B (Sigma Chemical Co., Сент-Луис, Миссури) по данным производителя. Колонку промывали 10 объемами следующих буферов: 50 мМ Трис, рН 7,4, 0,5 М NaCl, 1 мМ ЭДТА, 0,5% Тритон Х-100; 50 мМ Трис, рН 7,4, 150 мМ NaCl, 1% Тритон Х-100; 50 мМ Трис, рН 7,4, 150 мМ NaCl и 1% β-октилглюкозида (Sigma Chemical Co.). арСАМ элюировали 100 мМ глицина, рН 2,6, 150 мМ NaCl, 3 мМ ЭДТА, 1 мМ ЭГТА, 1% β-октилглюкозида. Фракции объемом 1,5 мл немедленно нейтрализовали 50 мкл 1 М Трис, рН 9,5. Фракции анализировали по 7.5% SDS-PAGE с последующим окрашиванием серебром (Heukeshoven and Dernick, 1988) и иммуноблоттингом с 4E8 (Thompson et al., 1996). Затем очищенный apCAM подвергали диализу против PBS и концентрировали с Centripreps (Amicon Corp., Danvers, MA) до 150–250 мкг/мл. Определение белка проводили с использованием микроанализа BCA (Pierce Chemical Co., Rockford, IL) в соответствии с инструкциями производителя. Средний выход apCAM составлял ~100 мкг, начиная с шести животных.
Средний выход apCAM составлял ~100 мкг, начиная с шести животных. Формирование, выживание и устранение синапсов (раздел 1, глава 9) Нейронаука онлайн: электронный учебник по неврологии | Кафедра нейробиологии и анатомии
9.1 Введение
Пожалуй, наиболее примечательной особенностью нервной системы является точность ее синаптических связей. Сети цепей, образованные взаимодействием нейронов, ответственны за формирование поведения. Образование синапсов тонко регулируется. Он включает процессы на клеточном и субклеточном уровнях, в результате которых: аксоны находят подходящие цели из множества вариантов; синапсы формируются на правильном клеточном компартменте; формирование пре- и постсинаптических специализаций, обеспечивающих эффективную передачу информации.
Мы обсудим следующие темы:
- Axon Pathfinding – как аксоны находят путь к определенным мишеням.
-
а. силы наведения — силы, создаваемые молекулами наведения.

б. молекулы наведения — белки, которые помогают направлять аксоны. - Распознавание цели – как аксоны «узнают», что нашли правильную цель?
Одним из общих свойств нейронов является то, что они мигрируют из мест, где они начинают дифференцироваться, в свое окончательное место жительства в нервной системе.
- Некоторые нейроны мигрируют в эти конечные положения до того, как они расширят отростки (например, двигательные нейроны).
- Другие нейроны удлиняют аксоны по мере миграции (например, гранулярные нейроны мозжечка).
Клетки-зерна в развивающемся мозжечке мигрируют на большие расстояния по отросткам клеток радиальной глии; эта миграция начинается во внешнем слое гранул и заканчивается в слое клеток гранул. Например, эпителиальные клетки на люминальной поверхности нервной трубки пролиферируют, давая начало нейробластам; некоторые нейробласты становятся радиальными глиальными клетками и расширяют свои отростки от люминальной до пиальной поверхности.
 В процессе развития мозжечка нейроны-зерна мигрируют через молекулярный слой по отросткам клеток радиальной глии. Ряд неврологических мутантов предоставил бесценную информацию о миграции нейронов. Например, у мыши-мутанта Weaver генетический дефект находится в гранулярных нейронах, а не в радиальной глии. У ткача гранулярные клетки не способны мигрировать в свое нормальное положение ниже слоя клеток Пуркинье. Этот дефект приводит к аномальной синаптической схеме и нарушению двигательного поведения.
В процессе развития мозжечка нейроны-зерна мигрируют через молекулярный слой по отросткам клеток радиальной глии. Ряд неврологических мутантов предоставил бесценную информацию о миграции нейронов. Например, у мыши-мутанта Weaver генетический дефект находится в гранулярных нейронах, а не в радиальной глии. У ткача гранулярные клетки не способны мигрировать в свое нормальное положение ниже слоя клеток Пуркинье. Этот дефект приводит к аномальной синаптической схеме и нарушению двигательного поведения.
Как только нейроны мигрируют в свое окончательное положение, а иногда и раньше, они начинают расширять аксоны. Нейроны расширяют аксоны из-за специальной структуры на концах аксонов, называемой конусами роста. Клетки-зерна в развивающемся мозжечке мигрируют на большие расстояния по отросткам клеток радиальной глии. Эта миграция начинается во внешнем слое гранул и заканчивается в слое гранулярных клеток.
9.2 Поиск пути аксона
Рис.
 9.2
9.2
Развивающийся нейрон расширяет несколько дендритов и один аксон.Нейроны дифференцируются из мультипотентных стволовых клеток и мигрируют в свое окончательное место жительства в нервной системе. Когда эти нейроны достигают своего места жительства, они расширяют аксон и дендриты, чтобы отправлять и получать (соответственно) информацию от других нейронов. В общем, дендриты остаются относительно близко к телу клетки нейрона, тогда как аксоны могут перемещаться на большие расстояния, чтобы обеспечить межнейронную коммуникацию.
Так как аксоны могут перемещаться на большие расстояния и должны искать свою цель среди многих возможностей, растущий конец аксона, или рост конус , должен иметь механизм для восприятия своего окружения.
Рисунок 9.3
Одиночный аксон вырастает из клетки с конусом роста на конце (центральная рамка) и в конечном итоге образует синапс с клеткой-мишенью. Щелкните левое поле, чтобы увидеть увеличенное изображение, соответствующее разрастанию аксонов, центральное поле, чтобы увидеть, как аксон находится под влиянием окружающей среды во время поиска пути, и правое поле, чтобы увидеть взаимодействие аксона с целью, приводящее к образованию синапса.
Щелкните левое поле, чтобы увидеть увеличенное изображение, соответствующее разрастанию аксонов, центральное поле, чтобы увидеть, как аксон находится под влиянием окружающей среды во время поиска пути, и правое поле, чтобы увидеть взаимодействие аксона с целью, приводящее к образованию синапса.Дистальный кончик растущего аксона называется конусом роста . Актин высоко сконцентрирован как в ламеллоподиях , так и в пальцевидных отростках ( филоподий ). Хотя на направление движения конуса роста влияет внеклеточная среда, сам конус роста обладает внутренними механизмами, которые делают возможным движение вперед. Актин полимеризуется на переднем крае конуса роста и перемещается к задней части, где он деполимеризуется.Это непрерывное циклическое движение полимеризованного актина от переднего края к заднему и движение мономера актина к переднему краю снова создает движение типа «танк-гусеница».
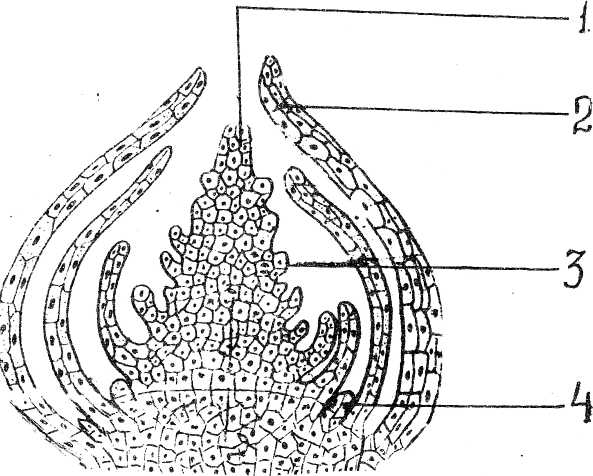 Если это движение, основанное на актине, связано с субстратом, по которому движется конус роста, движение «танк-гусеница» наделено тягой, и возникает движение конуса роста.
Если это движение, основанное на актине, связано с субстратом, по которому движется конус роста, движение «танк-гусеница» наделено тягой, и возникает движение конуса роста. Рисунок 9.4
Анатомия конуса роста.Рамон-и-Кахаль впервые описал конусы роста и заметил, что они движутся окольными путями к своим целям. Это наблюдение предполагает, что конусы роста играют активную роль в процессе поиска пути. Позже Роджер Сперри показал, что после повреждения зрительного нерва у лягушки ретинотектальные аксоны регенерируют, находят свои цели и с точностью устанавливают синаптические связи. Основываясь на этих наблюдениях, Сперри предположил существование поверхностных маркеров, которые используются конусами роста для распознавания путей и целей.Более поздние исследования эмбрионов кузнечиков, Drosophila , цыплят и рыбок данио показали, что конусы роста следуют определенным путям у различных видов.
 Поскольку нахождение пути аксонов сходно у разных видов, механизмы, лежащие в основе наведения аксонов, вероятно, законсервированы. Понимание клеточных и молекулярных механизмов, которые определяют направление растущих аксонов, важно, потому что оно лежит в основе начальной проводки нервной системы, а также потому, что оно необходимо для восстановления функции после повреждения.
Поскольку нахождение пути аксонов сходно у разных видов, механизмы, лежащие в основе наведения аксонов, вероятно, законсервированы. Понимание клеточных и молекулярных механизмов, которые определяют направление растущих аксонов, важно, потому что оно лежит в основе начальной проводки нервной системы, а также потому, что оно необходимо для восстановления функции после повреждения.9.3 Источники руководящей информации
Рисунок 9.5
Клетки направляющих выступов действуют как промежуточные мишени, помогая направлять конусы роста к их конечным мишеням.Конусы роста аксонов служат для восприятия сигналов окружающей среды и направления движения аксонов в их стремлении создать синапсы со своими мишенями. Направляющие сигналы необходимы для контроля роста аксонов на большие расстояния до точных пунктов назначения.Молекулярные механизмы, с помощью которых действуют эти сигналы, вероятно, включают изменение скорости или места полимеризации актина путем воздействия на рецепторы на поверхности конусов роста, которые связаны с внутриклеточными сигнальными каскадами.

9.4 Ячейки направляющих
Траектории аксонов кажутся разбитыми на серию более мелких движений. Аксон находит промежуточные цели, которые действуют как точки выбора. Аксоны замедляются и трансформируют свою морфологию в этих точках и, по-видимому, ищут другой круг направлений. Новаторские ростовые конусы (конусы роста на начальных аксонах, к которым позже присоединяются другие аксоны для создания большого пучка аксонов), как полагают, находятся под влиянием этих промежуточных мишеней (называемых направляющими клетками у насекомых) . На первоначальные конусы роста также влияют другие сигналы, так что промежуточные мишени оказывают только одно из ряда влияний на пути растущих аксонов.
9.5 Фасцикуляция
Рис. 9.6
Фасцикуляция аксона. Аксон-первопроходец (синий) служит основой для роста нового аксона из другой клетки (фиолетовый).
Объединение аксонов в пучки называется фасцикуляцией . Аксональная фасцикуляция также является ориентиром, поскольку сегменты некоторых аксональных траекторий мигрируют вдоль ранее существовавших аксональных трактов. Таким образом, аксоны могут следовать по путям, проложенным первыми аксонами, хотя и существует некоторая избирательность.Аксон может проходить через ряд аксонных трактов и делать конкретный выбор, за каким из этих аксонных трактов следовать. Пока неясно, абсолютно ли необходимы клетки-первопроходцы для поиска пути в ячейках-последователях. Если клетки-первопроходцы отсутствуют, клетки-последователи более склонны к ошибкам поиска пути, хотя эти ошибки в значительной степени исправляются, и аксоны находят свои цели.
9.6 Направляющие силы
- Местные и дальние
- Притяжение vs.отвращение
- Целевые сигналы
Направляющие клетки и ранее существовавшие аксоны могут влиять на рост развивающихся аксонов.
 В дополнение к этим влияниям аксоны также получают информацию дальнего действия. Эта информация наведения на короткие или большие расстояния может быть привлекательной или отталкивающей и служит для толкания или притягивания конуса роста в правильном направлении к его цели.
В дополнение к этим влияниям аксоны также получают информацию дальнего действия. Эта информация наведения на короткие или большие расстояния может быть привлекательной или отталкивающей и служит для толкания или притягивания конуса роста в правильном направлении к его цели. Механизмы наведения ближнего действия, такие как взаимодействие с клетками направляющих столбов и фасцикуляция, включают контактно-опосредованное обнаружение филоподиями конусов роста.Этот контакт может быть привлекательным или отталкивающим. Факторы дальнего действия, способные распространяться, также могут влиять на ведение аксонов за счет как притяжения, так и отталкивания. Вполне вероятно, что на аксоны действуют как локальные, так и дальнодействующие силы, действующие одновременно.
Рисунок 9.7
Силы притяжения, создаваемые факторами диффузии, служат для направления аксонов к их соответствующим мишеням.
Рисунок 9.8
Отталкивающие сигналы в виде градиентов концентрации растворимых белков помогают направить аксоны в сторону от неправильных направлений.9.7 Распознавание целей — топографические карты
Проекции аксонов часто топографически организованы, так что соседние нейроны в области происхождения проецируются на соседние нейроны в области-мишени (например,g., ганглиозные клетки сетчатки топографически проецируются на нейроны в верхнем двухолмии). Эта организация представляет дополнительную сложность для правил роста аксонов и поднимает вопрос о том, как кодируется топографическая информация. Первоначальные эксперименты Роджера Сперри и более поздние работы многих других лабораторий привели к представлению о том, что позиционная информация находится на уровне целевой области. Что это за позиционная информация? Одна из возможностей заключается в том, что каждый аксон имеет метку, которая соответствует идентичной метке на соответствующей мишени, что обеспечивает специфичность соединений.
 Это кажется непрактичным; должно быть очень большое количество меток, и нет четкого механизма нацеливания на аксоны. Более вероятный вариант был предложен Сперри в его Chemoaffinity Hypothesis , который предполагает, что позиционная информация кодируется в виде градиентов сигнальных молекул на мишени, которые будут обнаруживаться комплементарными градиентами рецепторов на аксонах. Эта модель подразумевает, что позиционная информация может быть закодирована небольшим числом молекул и что эта информация может быть «прочитана» аксонами, когда они маневрируют в области-мишени.Это хемотропное направление аксонов под действием диффундирующих факторов, секретируемых клетками, может включать силы притяжения или отталкивания.
Это кажется непрактичным; должно быть очень большое количество меток, и нет четкого механизма нацеливания на аксоны. Более вероятный вариант был предложен Сперри в его Chemoaffinity Hypothesis , который предполагает, что позиционная информация кодируется в виде градиентов сигнальных молекул на мишени, которые будут обнаруживаться комплементарными градиентами рецепторов на аксонах. Эта модель подразумевает, что позиционная информация может быть закодирована небольшим числом молекул и что эта информация может быть «прочитана» аксонами, когда они маневрируют в области-мишени.Это хемотропное направление аксонов под действием диффундирующих факторов, секретируемых клетками, может включать силы притяжения или отталкивания. 9.8 Молекулы, участвующие в росте аксонов
Сигналы ближнего и дальнего действия управляют ростом аксонов. Эти направляющие эффекты могут быть привлекательными или отталкивающими. Аксоны могут использовать несколько или все эти силы для управления отдельными сегментами движения.
 Например, репеллент сзади будет «толкать» аксон в коридор, отмеченный разрешающими локальными сигналами и ограниченный отталкивающими факторами, в то время как аттрактант в конце коридора может «притянуть» аксон к своей цели.После того, как стало ясно, что эти типы сил работают, чтобы направлять рост аксонов, внимание было обращено на идентификацию молекул, которые опосредуют эти эффекты управления.
Например, репеллент сзади будет «толкать» аксон в коридор, отмеченный разрешающими локальными сигналами и ограниченный отталкивающими факторами, в то время как аттрактант в конце коридора может «притянуть» аксон к своей цели.После того, как стало ясно, что эти типы сил работают, чтобы направлять рост аксонов, внимание было обращено на идентификацию молекул, которые опосредуют эти эффекты управления.
9.9 Молекулы клеточной адгезии и молекулы внеклеточного матрикса
За последние десять лет были идентифицированы некоторые молекулы на поверхности нейронов и субстратах, на которых они растут. Многие из молекул ответственны за общие адгезионные взаимодействия между конусом роста и его окружением, а другие помогают в выборе поверхностей, на которых растут аксоны.
Многие молекулы, участвующие в адгезии, являются гликопротеинами и принадлежат к трем основным семействам белков:
- Суперсемейство иммуноглобулинов (Ig) ; одним из основных членов этого семейства являются молекулы адгезии нейронных клеток или N-CAM (их адгезионные свойства не зависят от Ca 2+ ).
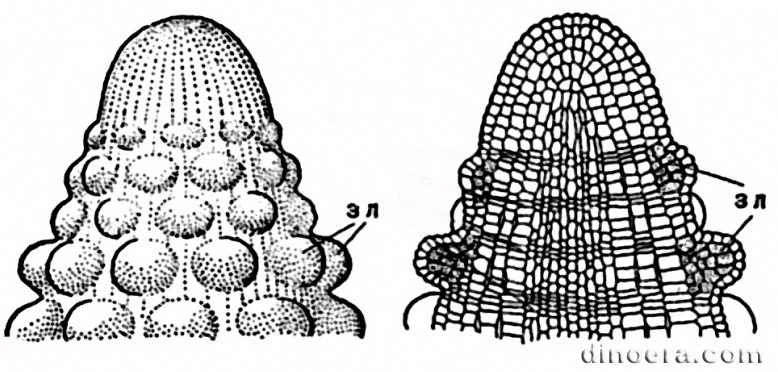 У млекопитающих насчитывается не менее 50 САМ.
У млекопитающих насчитывается не менее 50 САМ.
-
N-CAM (молекулы адгезии нейронов): N-CAM были впервые обнаружены из-за их роли в развитии нейронов сетчатки.Каждая N-CAM связывается с другой N-CAM, что называется гомофильным связыванием .
- Кадгерины (их адгезионные свойства зависят от Ca 2+ )
-
КАДГЕРИНЫ: существует много кадгеринов, основной тип которых обнаружен в мозге, [N-кадгерин], присутствует в большинстве нейронов и экспрессируется на очень ранних стадиях развития. Адгезия между отдельными кадгеринами осуществляется за счет гомофильного связывания и является Ca 2+ -зависимой.Большинство нейронов экспрессируют как N-CAM, так и N-кадгерин.
- Интегрины; они опосредуют взаимодействие между клеточной поверхностью и внеклеточным матриксом (ECM)
-
ИНТЕГРИНЫ: Интегрины представляют собой трансмембранные белки, участвующие в адгезии между клеточными поверхностями и компонентами внеклеточного матрикса; Адгезивные взаимодействия между интегринами и другими макромолекулами осуществляются посредством гетерофильного связывания .
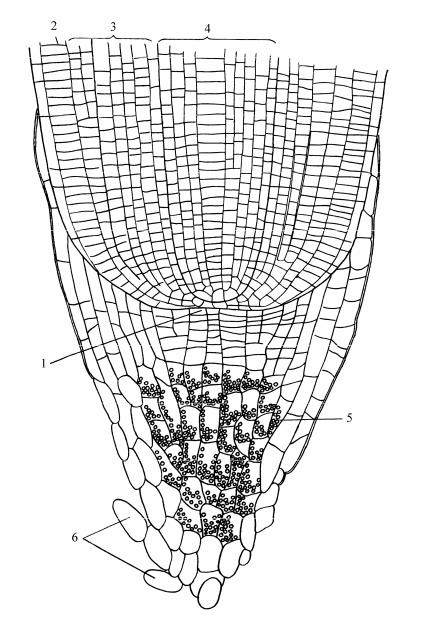 Экспрессия различных комбинаций интегринов на разных клетках определяет, какие молекулы ВКМ они связывают.
Экспрессия различных комбинаций интегринов на разных клетках определяет, какие молекулы ВКМ они связывают.
Компоненты внеклеточного матрикса, связывающие интегрины, включают:
- Фибронектин (секретируется фибробластами и обнаруживается в периферической нервной системе [ПНС])
- Ламинин (включает базальную мембрану ненейрональных клеток и базальную мембрану клеток ПНС; по-видимому, существует семейство ламининов)
Локальные сигналы управления обеспечиваются белками клеточной поверхности, которые воздействуют на растущий аксон, когда он движется к своей возможной цели.
Гомофильное взаимодействие CAM предполагает их роль в опосредовании фасцикуляции аксонов и адгезии аксонов к клеткам и/или путям аксонов.
Другие сигналы ближнего действия:
Вентральная средняя линия нервной системы действует как важная промежуточная мишень для аксонов. Конусы роста способны ощущать определенные сигналы на средней линии, которые влияют на их решение пересекать или не пересекать.
 В дополнение к тому, что вентральная срединная линия является источником аттрактантов и репеллентов, она также способна изменять способность аксона реагировать на эти сигналы.Например, после пересечения пластинки дна аксоны, которые реагировали на хемоаттрактант Netrin 1 до пересечения, после пересечения больше не способны реагировать на этот сигнал.
В дополнение к тому, что вентральная срединная линия является источником аттрактантов и репеллентов, она также способна изменять способность аксона реагировать на эти сигналы.Например, после пересечения пластинки дна аксоны, которые реагировали на хемоаттрактант Netrin 1 до пересечения, после пересечения больше не способны реагировать на этот сигнал. Рост одиночных сенсорных аксонов в системе in vitro привел к выявлению активности в экстрактах эмбрионального спинного мозга, постнатального и взрослого головного мозга, которая способствует удлинению и образованию этими аксонами обширных ветвей. Биохимическая очистка активности привела к идентификации амино-концевого фрагмента Slit2 в качестве основного активного компонента.Т.о., белки Slit могут функционировать как позитивные регуляторы образования коллатералей аксонов во время установления или ремоделирования нейронных цепей. Рецептор slit присутствует на конусах роста аксонов и был идентифицирован как белок Roundabout (Robo).

Рисунок 9.14
Средняя линия может управлять свойствами конуса роста. Рецептор Roundabout (Robo) подавляется при пересечении аксонов по средней линии.После пересечения средней линии Robo снова специфически активируется, что гарантирует, что эти аксоны не будут повторно пересекаться.9.10 Дополнительные молекулы, участвующие в управлении аксонами
Рецепторные тирозинкиназы, молекулы внеклеточного матрикса и нетрины, семафорины и их рецепторы также участвуют в ведении аксонов. Функции каждого поясняются ниже.
9.11 Рецепторные тирозинкиназы
Рецепторные тирозинкиназы могут модулировать или направлять рост аксонов.Обычно эти рецепторы обнаруживаются на развивающихся аксонах и позволяют аксонам реагировать на различные факторы роста в локальной среде. Например, один тип рецептора фактора роста фибробластов (FGFr, тирозинкиназа) необходим для роста нейритов, индуцированного FGF или N-CAM.
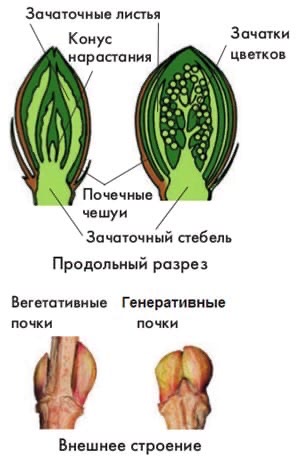 Нейротрофины, NGF, BDNF, NT-3 и NT-4/5, обычно считаются факторами выживания нейронов, хотя эти факторы роста могут также способствовать росту аксонов, позволять аксонам вторгаться в области-мишени и стимулировать окончание аксона. арборизация.
Нейротрофины, NGF, BDNF, NT-3 и NT-4/5, обычно считаются факторами выживания нейронов, хотя эти факторы роста могут также способствовать росту аксонов, позволять аксонам вторгаться в области-мишени и стимулировать окончание аксона. арборизация.
9.12 Молекулы внеклеточного матрикса
Молекулы внеклеточного матрикса (ECM) могут стимулировать или ингибировать рост нейритов. Предполагается, что ламинин, тенасцин, коллаген, фибронектин и ряд протеогликанов модулируют рост аксонов. Например, ламинин может способствовать, а тенасцин может ингибировать удлинение нейритов. Рецепторы для молекул ECM включают интегрины, а также членов семейства Ig.
Семейство ламининов и его рецепторы являются одним из наиболее хорошо изученных примеров молекул ECM в отношении развития нейронов.Существует по крайней мере десять различных изоформ ламининов, которые оказывают стимулирующее или ингибирующее действие на рост различных типов клеток. Аксональными рецепторами ламининов являются интегрины.
 Интегрины представляют собой гетеродимеры, состав субъединиц которых определяет специфичность связывания по отношению к ламининам. Интегрины связывают сигналы ECM с цитоскелетом и различными путями передачи сигналов. Роль ламининов и других молекул ECM в развитии нейронов заключается в том, чтобы влиять на ведение аксонов.
Интегрины представляют собой гетеродимеры, состав субъединиц которых определяет специфичность связывания по отношению к ламининам. Интегрины связывают сигналы ECM с цитоскелетом и различными путями передачи сигналов. Роль ламининов и других молекул ECM в развитии нейронов заключается в том, чтобы влиять на ведение аксонов. Рис. 9.15
Аксоны либо притягиваются, либо отталкиваются от градиента нетрина в развивающейся пластинке дна в зависимости от типа рецепторов нетрина, которыми они обладают. Те аксоны, у которых есть рецепторы DCC/UNC40, будут притягиваться к нетрину, а те, у которых есть рецепторы UNC5, будут отталкиваться. Механизмы, с помощью которых эти рецепторы вызывают дифференциальные ответы, еще предстоит открыть.
9.13 Нетрины, семафорины и их рецепторы
Нетрины представляют собой семейство секретируемых белков, сходных по последовательности с ламининами.
 Они являются как способными к диффузии, так и связанными с клетками.Нетрины были идентифицированы с использованием двух подходов. Генетический анализ нематод выявил мутантный ген, который привел к дефектам миграции клеток и направления аксонов, а анализ in vitro с использованием экстрактов клеток нижней пластинки цыплят выявил фактор, который приводит к росту и направлению аксонов спинного мозга. Нетрины хорошо сохраняются от нематод до человека и кодируются только одним или двумя генами у большинства видов. Нетрин связывается с двумя типами аксональных рецепторов (DCC/UNC-40 и UNC-5), которые определяют, являются ли действия нетрина привлекательными или отталкивающими.
Они являются как способными к диффузии, так и связанными с клетками.Нетрины были идентифицированы с использованием двух подходов. Генетический анализ нематод выявил мутантный ген, который привел к дефектам миграции клеток и направления аксонов, а анализ in vitro с использованием экстрактов клеток нижней пластинки цыплят выявил фактор, который приводит к росту и направлению аксонов спинного мозга. Нетрины хорошо сохраняются от нематод до человека и кодируются только одним или двумя генами у большинства видов. Нетрин связывается с двумя типами аксональных рецепторов (DCC/UNC-40 и UNC-5), которые определяют, являются ли действия нетрина привлекательными или отталкивающими.
Рисунок 9.16
Притяжение или отталкивание от градиента семафорина III в вентральной части спинного мозга.Аксоны первичных афферентов направляются в зоны терминации в спинномозговых пластинках с помощью градиента семафорина III, который привлекает аксоны, реагирующие на NT-3 (синие), и отталкивает аксоны, реагирующие на NGF (зеленые), и не оказывает влияния на некоторые аксоны (красные).
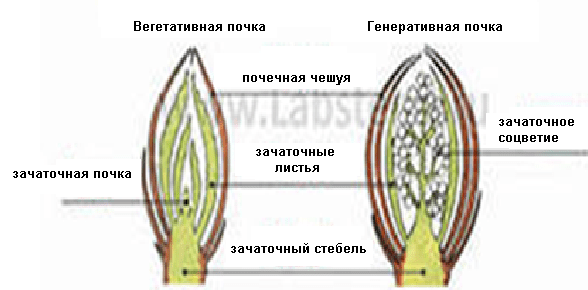 которые, по-видимому, получают сигналы направления из других источников.
которые, по-видимому, получают сигналы направления из других источников.Семафорины представляют собой большое семейство белков клеточной поверхности или секретируемых белков, которые опосредуют схлопывание конусов роста, управление аксонами, ветвление аксонов и терминальное разветвление аксонов. У человека обнаружено по крайней мере десять семафоринов, и они, по-видимому, функционируют преимущественно как тормозящие (отталкивающие) факторы для направления аксонов. Нейропилины служат рецепторами для секретируемых семафоринов, тогда как члены семейства плексинов являются рецепторами для других семафоринов.Секретируемые семафорины не связываются напрямую с плексинами, но плексины могут связываться с нейропилинами. Т.о., плексины являются рецепторами для множественных классов семафоринов, либо отдельно, либо в комбинации с нейропилинами, и запускают путь передачи сигнала, контролирующий наведение аксонов.
Резюме
Рисунок 9.
 17
17
Сигналы ближнего и дальнего действия управляют ростом аксонов.Эти направляющие эффекты могут быть привлекательными или отталкивающими. Аксоны могут использовать несколько или все эти силы для управления отдельными сегментами движения. Например, репеллент сзади будет «толкать» аксон в коридор, отмеченный разрешительными локальными сигналами и ограниченный отталкивающими факторами, тогда как аттрактант в конце коридора может «притянуть» аксон к своей цели (фиолетовой клетке). Кроме того, контактное притяжение или фасцикуляция аксонов (например, фиолетовый аксон использует синий аксон в качестве ориентира) помогают в поиске пути аксона.
Рост развивающихся аксонов зависит от:
- Физические ориентиры, такие как направляющие клетки и пионерные аксоны.
- Локальные и дальнодействующие молекулы, участвующие в притяжении и отталкивании развивающихся аксонов (наличие которых подтверждает гипотезу хемоаффинности Сперри).

- Наличие рецепторов на развивающихся аксонах, позволяющих регулировать рост факторами окружающей среды.
Установление синаптических связей и их поддержание зависит от взаимодействия аксонов и их мишеней. Эти взаимодействия ответственны за стабилизацию синапсов и выживание нейронов. Синаптическая передача зависит от ассоциации пре- и постсинаптических элементов. Пре- и постсинаптические области клеток являются узкоспециализированными по архитектуре, что обеспечивает эффективную передачу информации. Архитектура синапса формируется в процессе развития и может меняться в зависимости от активности.
9.14 Молекулярные механизмы пресинаптической дифференцировки
Рисунок 9.18
Конус роста созревает в пресинаптическое окончание аксона. По мере того, как аксон растет к своей цели, его конус роста играет роль в «ощущении» сил притяжения и отталкивания в его локальном окружении. После того, как аксон достигает своей цели, окончание созревает, изменяя свою форму, локализацию везикул и белковый механизм, необходимый для регулируемой и конститутивной, а не только конститутивной секреции.Эти резкие изменения позволяют окончаниям аксонов обеспечивать эффективную синаптическую передачу.
После того, как аксон достигает своей цели, окончание созревает, изменяя свою форму, локализацию везикул и белковый механизм, необходимый для регулируемой и конститутивной, а не только конститутивной секреции.Эти резкие изменения позволяют окончаниям аксонов обеспечивать эффективную синаптическую передачу. Пресинаптическое нервное окончание созревает из конуса роста и становится высокоспециализированным для выполнения функций, необходимых для химической нейротрансмиссии. Пресинаптическое нервное окончание содержит митохондрии и эндосомы, хотя наиболее ярким аспектом этой структуры является наличие многочисленных синаптических пузырьков, содержащих нейротрансмиттеры.Относительно мало известно о молекулярных механизмах, лежащих в основе дифференцировки пресинаптических нервных окончаний. Известно, что переключение между конститутивным циклом пузырьков, происходящим в конусе роста, и регулируемой секрецией из зрелого пресинаптического окончания представляет собой резкое изменение функции.

9.15 Молекулярные механизмы постсинаптической дифференцировки
Рис. 9.19
Каркас, присутствующий на пресинаптической и постсинаптической сторонах синапса, способствует созреванию и выравниванию пре- и постсинаптических элементов. Например, нейролигин взаимодействует с нейрексином, чтобы закрепить вместе пре- и постсинаптические элементы. Кроме того, присутствие нейролигина делает возможным кластеризацию синаптических везикул, указывая на то, что этот белок участвует в пресинаптической дифференцировке. На постсинаптической стороне рецепторы и некоторые из их белков, передающих сигнал, закрепляются на месте посредством прямого и косвенного (через связывание с белками, связывающими цитоскелет) взаимодействий с актиновым цитоскелетом.Для эффективного приема нейротрансмиттерного сигнала рецепторы на постсинаптической клетке группируются в местах, противоположных пресинаптической активной зоне.
 Кластеризация постсинаптических рецепторов представляет собой адаптивное поведение, которое было подробно изучено с использованием нервно-мышечного соединения в качестве модельной системы. Никотиновый ацетилхолиновый рецептор (AChR) представляет собой управляемый лигандом ионный канал , который отвечает на сигнал, обеспечиваемый нейротрансмиттером ацетилхолином, передатчиком, используемым в нервно-мышечном соединении .(Дополнительную информацию об ацетилхолине можно найти в главе 11.) АХР обнаруживаются в постсинаптической мембране с плотностью 10 000–20 000/мкм 2 , тогда как во внесинаптиче- ских участках имеется около 10/мкм 2 . Чрезвычайная концентрация AChR в синапсе предполагает, что мышца обладает способностью закреплять эти рецепторы, в то время как их присутствие в прямой оппозиции к пресинаптической активной зоне предполагает, что нерв играет роль в организации постсинаптической мембраны.
Кластеризация постсинаптических рецепторов представляет собой адаптивное поведение, которое было подробно изучено с использованием нервно-мышечного соединения в качестве модельной системы. Никотиновый ацетилхолиновый рецептор (AChR) представляет собой управляемый лигандом ионный канал , который отвечает на сигнал, обеспечиваемый нейротрансмиттером ацетилхолином, передатчиком, используемым в нервно-мышечном соединении .(Дополнительную информацию об ацетилхолине можно найти в главе 11.) АХР обнаруживаются в постсинаптической мембране с плотностью 10 000–20 000/мкм 2 , тогда как во внесинаптиче- ских участках имеется около 10/мкм 2 . Чрезвычайная концентрация AChR в синапсе предполагает, что мышца обладает способностью закреплять эти рецепторы, в то время как их присутствие в прямой оппозиции к пресинаптической активной зоне предполагает, что нерв играет роль в организации постсинаптической мембраны.Рисунок 9.
 20
20
Дифференцировка синапса включает изменения как пре-, так и постсинаптических участков. Пресинаптическое окончание должно выровняться с постсинаптической поверхностью и начать экспрессировать регулируемые формы секреции нейромедиаторов. Постсинаптический сайт должен сгруппировать рецепторы и молекулы передачи сигнала для эффективной синаптической передачи.Щель, разделяющая пре- и постсинаптические мембраны, содержит базальную пластинку , которая покрывает все мышечное волокно и состоит из коллагенов, протеогликанов и других молекул внеклеточного матрикса, включая ламинин, а также молекул нервного происхождения, таких как агрин (см. главу 9 часть 6).Базальная пластинка играет важную роль в сборке постсинаптической мембраны.
9.16 Агрин
Большая часть наших знаний о формировании синапсов получена из исследований регенерации нервов и мышц. Участки базальной пластинки, которые контактируют с поврежденной мышечной тканью, индуцируют регенерирующие мышечные трубки к формированию постсинаптической специализации.
 Эти исследования предположили, что в базальной мембране есть агент, образующий кластеры AChR. Из экстрактов базальной пластинки был выделен агрин как молекула, способная индуцировать образование кластеров АХР на мышечных трубочках.Дальнейшее исследование показало, что агрин присутствует в мотонейронах, транспортируется вниз по аксонам мотонейронов и сохраняется в синаптической базальной пластинке. Антитела против агрина ингибируют кластеризацию AChR. Мыши с дефицитом агрина имеют дезорганизованные нервно-мышечные соединения и уменьшенное количество, размер и плотность AChR в нервно-мышечных соединениях. Таким образом, агрин, по-видимому, является нервным фактором, который организует постсинаптическую дифференцировку. Агрин может связываться с несколькими рецепторами-кандидатами, включая альфа-дистрогликан, протеогликаны гепарансульфата и специфичную для мышц тирозинкиназу (MUSK), чтобы оказывать свое действие.
Эти исследования предположили, что в базальной мембране есть агент, образующий кластеры AChR. Из экстрактов базальной пластинки был выделен агрин как молекула, способная индуцировать образование кластеров АХР на мышечных трубочках.Дальнейшее исследование показало, что агрин присутствует в мотонейронах, транспортируется вниз по аксонам мотонейронов и сохраняется в синаптической базальной пластинке. Антитела против агрина ингибируют кластеризацию AChR. Мыши с дефицитом агрина имеют дезорганизованные нервно-мышечные соединения и уменьшенное количество, размер и плотность AChR в нервно-мышечных соединениях. Таким образом, агрин, по-видимому, является нервным фактором, который организует постсинаптическую дифференцировку. Агрин может связываться с несколькими рецепторами-кандидатами, включая альфа-дистрогликан, протеогликаны гепарансульфата и специфичную для мышц тирозинкиназу (MUSK), чтобы оказывать свое действие.Синаптическая базальная пластинка содержит белки, которые участвуют в пре- и постсинаптической дифференцировке.
 Поперечное сечение нормальной мышцы, содержащей нервное окончание, расположенное прямо напротив AChR на соединительной складке мышцы, показано на рисунках 9.21-9.22. Базальная пластинка (BL) покрывает миофибриллы, а синаптическая базальная пластинка окружает синаптический участок.BL служит каркасом для регенерации миофибрилл. В показанном эксперименте аксоны, иннервирующие мышцу, были повреждены и препятствовали регенерации, и мышца была повреждена. Новые миофибриллы регенерируют внутри BL исходного миофибрилла в отсутствие нерва. Кроме того, кластеры AChR несмотря на отсутствие нерва. Этот результат показывает, что синаптический BL содержит сигналы для кластеризации AChR (постсинаптическая дифференцировка). Если двигательный аксон и мышца повреждены и мышца не может регенерировать, аксоны регенерируют в исходном синаптическом участке в отсутствие своих целей.Таким образом, синаптический БС содержит сигналы для пресинаптической дифференцировки.
Поперечное сечение нормальной мышцы, содержащей нервное окончание, расположенное прямо напротив AChR на соединительной складке мышцы, показано на рисунках 9.21-9.22. Базальная пластинка (BL) покрывает миофибриллы, а синаптическая базальная пластинка окружает синаптический участок.BL служит каркасом для регенерации миофибрилл. В показанном эксперименте аксоны, иннервирующие мышцу, были повреждены и препятствовали регенерации, и мышца была повреждена. Новые миофибриллы регенерируют внутри BL исходного миофибрилла в отсутствие нерва. Кроме того, кластеры AChR несмотря на отсутствие нерва. Этот результат показывает, что синаптический BL содержит сигналы для кластеризации AChR (постсинаптическая дифференцировка). Если двигательный аксон и мышца повреждены и мышца не может регенерировать, аксоны регенерируют в исходном синаптическом участке в отсутствие своих целей.Таким образом, синаптический БС содержит сигналы для пресинаптической дифференцировки.
Плазматическая мембрана мышц имеет на своей поверхности АХР, которые равномерно распределяются до появления конуса роста двигательного нерва.
 Вскоре после иннервации распределение внеузловых рецепторов уменьшается, а плотность рецепторов во вновь формирующемся нервно-мышечном синапсе резко возрастает. Этот эффект возникает именно в том месте, где конус роста высвобождает АХ.Эти изменения происходят за счет перераспределения существующих рецепторов и синтеза и введения новых рецепторов в синапсах.
Вскоре после иннервации распределение внеузловых рецепторов уменьшается, а плотность рецепторов во вновь формирующемся нервно-мышечном синапсе резко возрастает. Этот эффект возникает именно в том месте, где конус роста высвобождает АХ.Эти изменения происходят за счет перераспределения существующих рецепторов и синтеза и введения новых рецепторов в синапсах. Аксон мотонейрона индуцирует скопление рецепторов АХ на мышечных волокнах. По мере приближения аксона к мышечному волокну большая часть АХР диффузно распределяется по его поверхности. Когда аксон начинает устанавливать синаптическую передачу, распределение AChR начинает меняться. АХР начинают группироваться у вновь образованного синаптического контакта, а внесинаптические рецепторы резко уменьшаются.
Какие факторы ответственны за изменение плотности АХР при нервно-мышечном формировании? Это НЕ высвобождение АХ из нервных окончаний. Повышенная плотность AChR во время формирования нервно-мышечного соединения является результатом высвобождения молекул из окончаний двигательных нервов, в том числе AChR-индуцирующей активности (ARIA), молекулы, которая способствует увеличению общего количества AChR и кластеров рецепторов, и Agrin, белка, который индуцирует кластеризацию ранее существовавших AChR и другие компоненты NMJ.
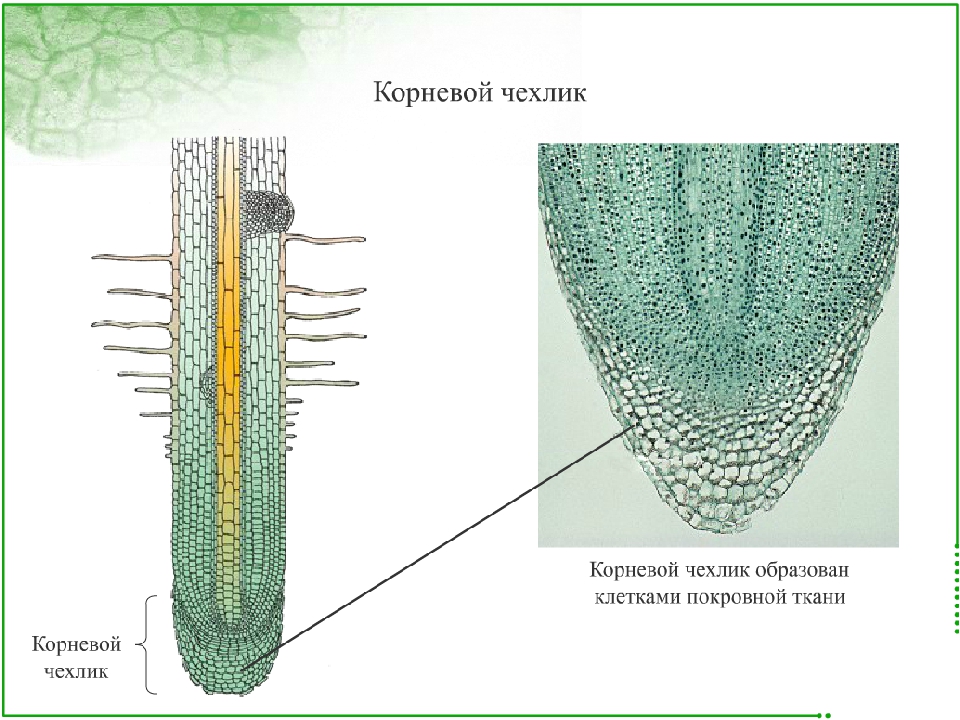
При формировании нервно-мышечного синапса эти биологические свойства АХР изменяются после иннервации:
- Скорость оборота рецепторов снижается.
- Их проводимость увеличивается.
- Время открытия рецептора уменьшается.
- Состав субъединиц отдельных рецепторов в СНС меняется в процессе развития.
9.17 Выживание нейронов/элиминация синапсов
В нервно-мышечном соединении синапсы конкурируют за иннервацию мышечного волокна. Хотя эта конкуренция приводит к уменьшению количества синаптических входов в мышцу, сложность каждого синаптического входа увеличивается, а сила каждого синапса увеличивается.
Некоторые синапсы удаляются во время разработки
Элиминация синапсов в нервно-мышечном соединении включает потерю AChR и удаление пресинаптического окончания. Конкуренция между двигательными аксонами, зависящая от активности, способствует более активным входам. Прямая конкуренция между нервными волокнами благоприятствует аксонам, способным конкурировать за трофические факторы, поставляемые клеткой-мишенью.
 Косвенная конкуренция позволяет мышце выбрать предпочтительный аксон. Дополнительная стратегия элиминации синапсов может заключаться в том, что элиминация провоцируется ретроградным мессенджером.Дополнительную информацию о ретроградной сигнализации можно найти в главе 14, часть 3.
Косвенная конкуренция позволяет мышце выбрать предпочтительный аксон. Дополнительная стратегия элиминации синапсов может заключаться в том, что элиминация провоцируется ретроградным мессенджером.Дополнительную информацию о ретроградной сигнализации можно найти в главе 14, часть 3. У взрослого человека почти все мышечные волокна иннервируются одним мотонейроном. Однако на ранних стадиях развития многие постсинаптические мишени иннервируются множественными нервными окончаниями (это верно для скелетных мышц). Во время созревания синапсов многие нервные окончания исчезают. Считается, что элиминация синапсов происходит за счет удаления пресинаптических окончаний. Хотя количество различных синаптических входов для данной мишени во время этого процесса уменьшается, сложность отдельных оставшихся окончаний на самом деле увеличивается (отдельные синапсы становятся больше и имеют более сложную структуру).Конечным результатом этого процесса является увеличение общей силы отдельных синапсов.
 Этот процесс устранения и перестройки синапсов играет важную роль в формировании схемы нервной системы и точной настройке отдельных синаптических контактов.
Этот процесс устранения и перестройки синапсов играет важную роль в формировании схемы нервной системы и точной настройке отдельных синаптических контактов. Развитие связности в центральной нервной системе требует инициации синаптических контактов и поддержания правильного количества синапсов. Непонятно почему, но кажется, что создается больше синапсов, чем в конечном итоге требуется для правильного функционирования нейронов.В этих условиях некоторые синапсы элиминируются. Процесс устранения синапсов допускает «зависимую от использования» форму дарвинизма; те синапсы, которые необходимы, сохраняются, а те, которые просто избыточны, удаляются. Нервно-мышечное соединение и зрительная система использовались в качестве моделей для понимания молекулярных механизмов, лежащих в основе элиминации синапсов.
Элиминация синапсов может быть результатом зависящих от активности сигналов в постсинаптических клетках.

Рисунок 9.25
Активация постсинаптических рецепторов активными нейронными входами приводит к стабилизации множественных входов. Таким образом, когда все рецепторы активируются одновременно и задействованы их сигнальные процессы (облако), потери рецепторов (серые) из синапса не происходит.Рисунок 9.26
Когда два входа активируются по-разному, активные рецепторы защищены, а неактивные — нет, что приводит к потере неактивных рецепторов и связанных с ними пресинаптических элементов.Рисунок 9.27
Когда все рецепторы молчат, каждый синапс получает равномерный вход, что не приводит к потере синапса.Резюме
- Способность нейрона достигать своей цели необходима для его выживания.
- Во время развития существует связь между количеством пресинаптических нейронов и размером их мишеней.
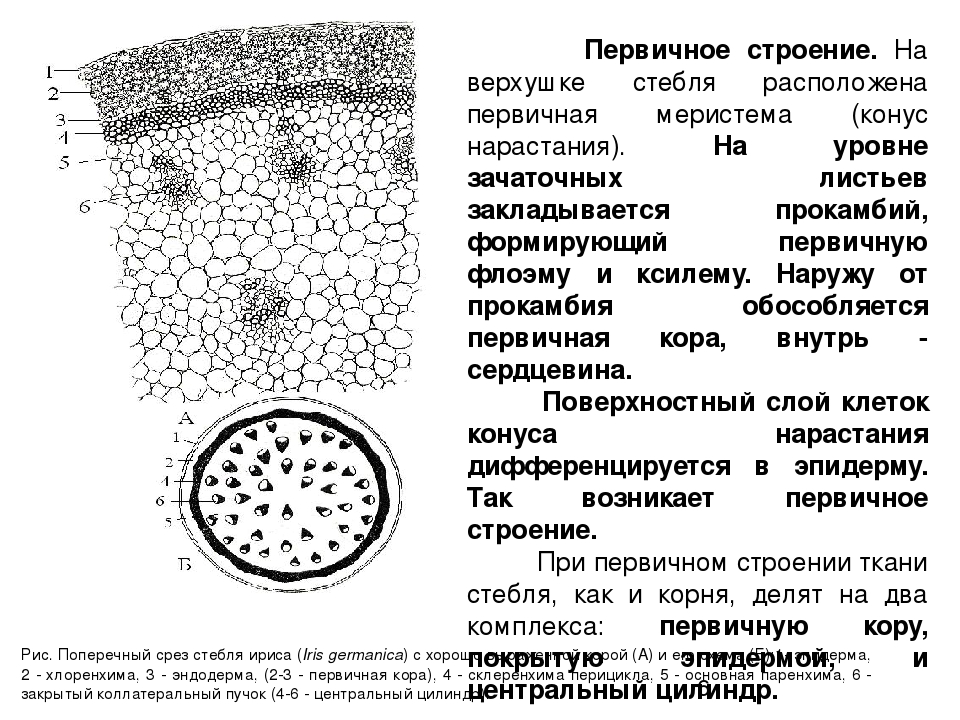
- Формирование синапсов — сложный и постепенный процесс.
- Специфические молекулы нейронов и мышц играют важную роль в формировании синапсов и в регенерации (например, агрин).
- Наконец, элиминация и перестройка синапсов приводят к тонкой настройке нейронных цепей и укреплению синапсов в нервной системе.
9.18 Гибель клеток, повреждение/регенерация и трофические факторы
В большинстве развивающихся тканей во время развития происходит значительная гибель клеток.Один тип гибели клеток происходит в зависимости от активности и связан с элиминацией синапсов (см. выше). Было высказано предположение, что гибель клеток является путем по умолчанию для всех клеток, и ускользающие клетки делают это, получая соответствующую трофическую поддержку. С растущим осознанием того, что патологическая гибель клеток имеет общие черты с гибелью клеток, которая происходит во время развития, лучшее понимание гибели клеток в процессе развития может выявить потенциальные терапевтические стратегии для лечения нейродегенеративных расстройств и травм.

Формирование синаптических связей между пресинаптическим нейроном и его мишенью часто имеет решающее значение для выживания пресинаптического нейрона. Во многих случаях, если синапс не сформирован или создан неправильный синапс, пресинаптический нейрон в конечном итоге погибает. Выживание нейронов часто зависит от трофических факторов, продуцируемых тканью-мишенью. Трофические факторы необходимы для выживания нейронов; их функция заключается в содействии росту клеток. (Примечание: трофические факторы не следует путать с хемотропными факторами, привлекающими клетки.)
9.19 Выживание некоторых нейронов зависит от NGF
Рисунок 9.28
Фактор роста нервов был очищен на основании его способности индуцировать рост нейритов. Кроме того, было показано, что NGF необходим для выживания симпатических нейронов. Эти ранние исследования предположили, что запас эндогенного фактора ограничивает выживание и рост зависимых клеточных популяций.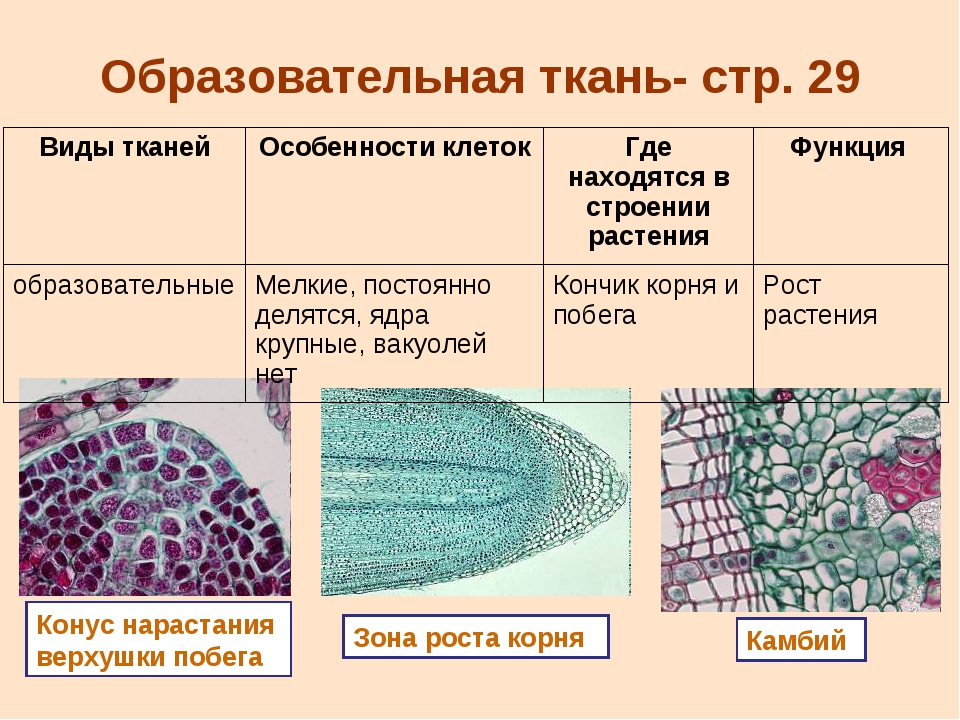
Ранние исследования культивируемых сенсорных и симпатических нейронов показали, что для их выживания им требуется целевой фактор (фактор роста нервов , NGF ). Конкуренция за NGF возникает, когда несколько аксонов иннервируют одну мишень с ограниченным количеством NGF. Иннервирующие аксоны обладают рецепторами NGF, которые связывают, интернализуют и ретроградно транспортируют NGF. Биохимический каскад, продуцируемый интернализацией и транспортом NGF, приводит к сигналам, предотвращающим гибель клеток.
Прототипом трофического фактора является NGF; очищенный NGF представляет собой комплекс из трех белковых субъединиц (альфа, бета, гамма):
альфа: этот субблок имеет неизвестную функцию
бета: этот компонент обладает биологической активностью (димер)
гамма: эта субъединица обладает протеолитической активностьюОдной из первых физиологических ролей, которая была обнаружена для NGF, была его важность в выживании сенсорных и симпатических нейронов.
 Если антитела против NGF вводят новорожденным животным для «нейтрализации» действия NGF, выживаемость симпатических нейронов значительно снижается.
Если антитела против NGF вводят новорожденным животным для «нейтрализации» действия NGF, выживаемость симпатических нейронов значительно снижается. Рис. 9.29
Фактор роста нервов является ретроградным фактором выживания. NGF (красные точки) связывается с рецепторами синей клетки и ретроградно транспортируется вниз по ее аксону к телу клетки, где он влияет на клеточный рост, дифференцировку и транскрипцию других генов.Рисунок 9.30
NGF секретируется клетками-мишенями и связывается рецепторами зависимой клетки. После связывания комплекс рецептор/лиганд интернализуется в пузырьке внутри окончания аксона. Эти эндоцитарные везикулы транспортируются на микротрубочках к телу клетки, где NGF диссоциирует от своего рецептора и может влиять на механизм транскрипции и клеточную дифференцировку.Рис.
 9.31
9.31
Клеточные действия факторов роста (NGF, BDNF, NT-3, NT-4) опосредуются специфическими рецепторами клеточной поверхности. См. текст ниже для получения дополнительной информации.Для развивающихся нейронов в верхнем шейном ганглии естественный источник NGF может быть заблокирован ежедневными инъекциями антител против NGF новорожденным животным. Это лечение приводит к преждевременной гибели этих нейронов. Напротив, если новорожденным животным вводят сам NGF, добавленный NGF фактически предотвращает естественную гибель определенных типов нейронов.
Клеточные действия факторов роста (NGF, BDNF, NT-3, NT-4) опосредуются специфическими рецепторами клеточной поверхности. Рецептор NGF с высоким сродством представляет собой тирозинкиназу, которая придает биологическую активность NGF клеткам, действуя посредством нижестоящих сигнальных процессов, которые в конечном итоге включают изменения в транскрипции генов.
 Эта киназа известна как trkA. Другие факторы роста связываются с другими рецепторными тирозинкиназами. Например, TrkB специфически активируется низкими концентрациями BDNF и NT-4/5 и может активироваться высокими концентрациями NT-3.TrkC родственен trkA, но наиболее эффективно активируется NT-3; все trks являются трансмембранными белками, которые содержат внеклеточный лиганд-связывающий домен и внутриклеточный (цитозольный) тирозинкиназный домен. Когда trks активируются соответствующим лигандом (например, NGF или BDNF), они инициируют серию внутриклеточных сигнальных каскадов.
Эта киназа известна как trkA. Другие факторы роста связываются с другими рецепторными тирозинкиназами. Например, TrkB специфически активируется низкими концентрациями BDNF и NT-4/5 и может активироваться высокими концентрациями NT-3.TrkC родственен trkA, но наиболее эффективно активируется NT-3; все trks являются трансмембранными белками, которые содержат внеклеточный лиганд-связывающий домен и внутриклеточный (цитозольный) тирозинкиназный домен. Когда trks активируются соответствующим лигандом (например, NGF или BDNF), они инициируют серию внутриклеточных сигнальных каскадов. Рис. 9.32
Возможные последствия депривации NGF в клетках. Изъятие NGF из зависимых клеток приводит к инициации сигнальных процессов, которые в конечном итоге приводят к гибели клеток. Конкретные клеточные события показаны черным цветом на континууме от сигнальных процессов до расщепления ДНК. Возможные цели для терапевтического вмешательства выделены красным цветом.
Возможные цели для терапевтического вмешательства выделены красным цветом. Рисунок 9.33
Источники трофического обеспечения двигательных нейронов спинного мозга.Моторные нейроны (фиолетовые/синие) получают трофическую поддержку из ряда источников. Терминалы аксонов получают от мышц диффундирующие (1) или связанные с матриксом (2) факторы. Шванновские клетки (3) и глиальные клетки (4), включая астроциты и олигодендроциты, также могут обеспечивать трофическую поддержку. Афференты от DRG (5) и аутокринных (6), паракринных (6) или циркулирующих факторов также могут влиять на выживаемость мотонейронов.NGF связан с другими трофическими факторами, такими как BDNF , NT-3 , NT-4 и CNTF .Эти факторы структурно связаны с NGF и являются факторами выживания для нейронов, которые не реагируют на NGF.
 Трофические сигналы, продуцируемые некоторыми из этих молекул, не все являются производными от мишеней, как NGF. Нейроны могут получать трофические сигналы от молекул внеклеточного матрикса, от глии аутокринным или паракринным образом. Удаление этих факторов приводит к гибели клеток популяций нейронов, которые зависят от этих факторов.
Трофические сигналы, продуцируемые некоторыми из этих молекул, не все являются производными от мишеней, как NGF. Нейроны могут получать трофические сигналы от молекул внеклеточного матрикса, от глии аутокринным или паракринным образом. Удаление этих факторов приводит к гибели клеток популяций нейронов, которые зависят от этих факторов. Нарушение различных генов нейротрофинов у мышей позволило проанализировать роль этих факторов в сенсомоторных путях.Ганглии задних корешков (DRG) мышей дикого типа содержат мелкие (красные), средние (зеленые) и крупные (синие) клетки. Маленькие клетки, которые несут информацию о боли и температуре, теряются, когда отсутствует NGF или его высокоаффинный рецептор trkA. Крупные клетки, иннервирующие мышечные веретена, теряются при отсутствии NT-3 или TrkC. Эти данные подчеркивают важность различных нейротрофинов в поддержке развития различных клеточных популяций.
9.20 Нейроны периферической нервной системы могут регенерировать свои аксоны
Способность нейронов ПНС регенерировать свои аксоны резко контрастирует с поврежденными нейронами в ЦНС.
 Это различие в значительной степени связано с ролью трофических факторов, которые предотвращают дегенерацию периферических нейронов после аксотомии. Недавние открытия показали, что некоторые из тех же самых молекул, которые необходимы для развития и выживания незрелых нейронов, также участвуют в выживании взрослых нейронов после повреждения. Что происходит, когда перерезаются аксоны взрослых симпатических нейронов?
Это различие в значительной степени связано с ролью трофических факторов, которые предотвращают дегенерацию периферических нейронов после аксотомии. Недавние открытия показали, что некоторые из тех же самых молекул, которые необходимы для развития и выживания незрелых нейронов, также участвуют в выживании взрослых нейронов после повреждения. Что происходит, когда перерезаются аксоны взрослых симпатических нейронов? - Если перерезать аксоны постсинаптических нейронов, то пресинаптические нейроны отдергивают окончания своих аксонов.
- При добавлении экзогенного ФРН происходит регенерация и реиннервация.
- С другой стороны, если для нейтрализации NGF добавляют антитела против NGF, то регенерация блокируется.
- Более того, если колхицин (который деполимеризует микротрубочки) добавляется для блокирования ретроградного транспорта NGF из клетки-мишени в тело поврежденной симпатической клетки, то регенерация ингибируется.
Реакции симпатических нейронов на повреждение:
Рис.
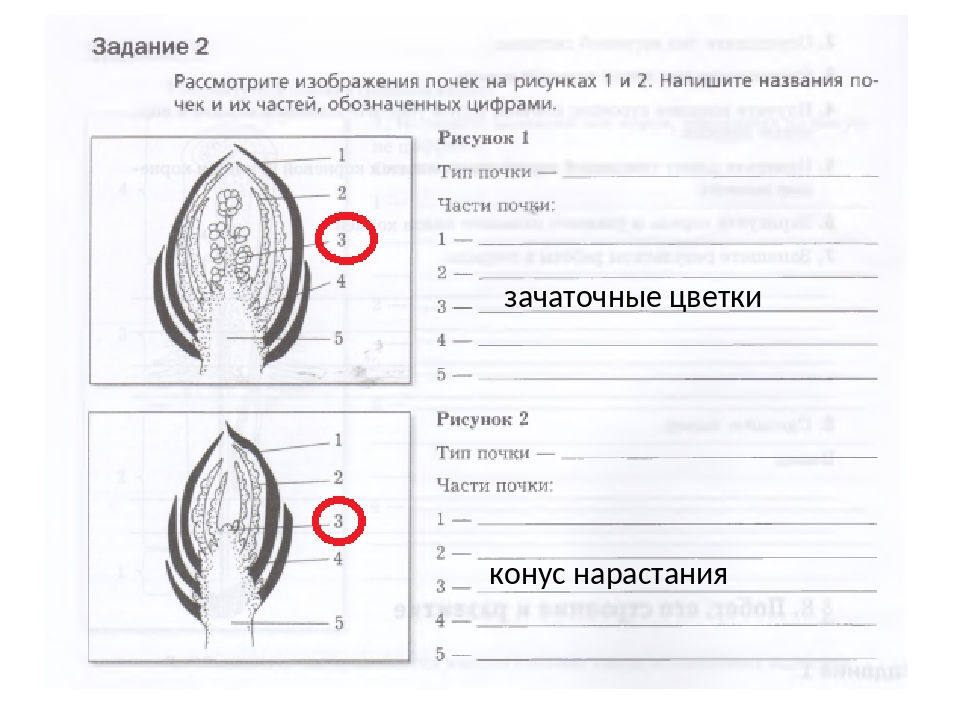 9.35
9.35
Нормальные анатомические взаимоотношения вегетативных пресинаптических и симпатических постсинаптических нейронов с тканью-мишенью; последний обеспечивает необходимые трофические факторы (например, NGF).Рисунок 9.36
При повреждении аксонов постсинаптических нейронов происходит ретракция пресинаптических окончаний.Рисунок 9.37
Если поступает экзогенный NGF, пресинаптические окончания сохраняются.Рисунок 9.38
Если нейтрализующие антитела против NGF добавляются рядом с тканью-мишенью, поступление NGF блокируется и пресинаптические окончания втягиваются.Рисунок 9.39
NGF доставляется в тело клетки за счет аксоплазматического транспорта, зависящего от микротрубочек; если это блокируется колхицином, пресинаптические окончания втягиваются.
9.21 Регенерация нейронов
В этом разделе основное внимание уделяется серьезным и часто необратимым повреждениям центральной и периферической нервной системы, вызванным повреждением нейронов. Почти в каждом случае нейроны вышли из митотического цикла и, следовательно, больше не могут делиться, чтобы произвести новые нейроны для замены поврежденных клеток. Следовательно, потеря нейронов из-за травмы имеет серьезные последствия, поскольку потеря пораженных путей необратимо изменит функциональную схему нервной системы. В тех случаях, когда нейроны действительно регенерируют после повреждения, механизмы, которые способствуют регенерации, по-видимому, очень сходны с событиями, которые способствуют росту аксонов и образованию синапсов во время развития.Несколько общих правил регулируют реакцию нейронов на травму:
- Регенерация у млекопитающих значительно хуже, чем у низших позвоночных.
- Регенерация в ЦНС гораздо менее вероятна, чем в ПНС.
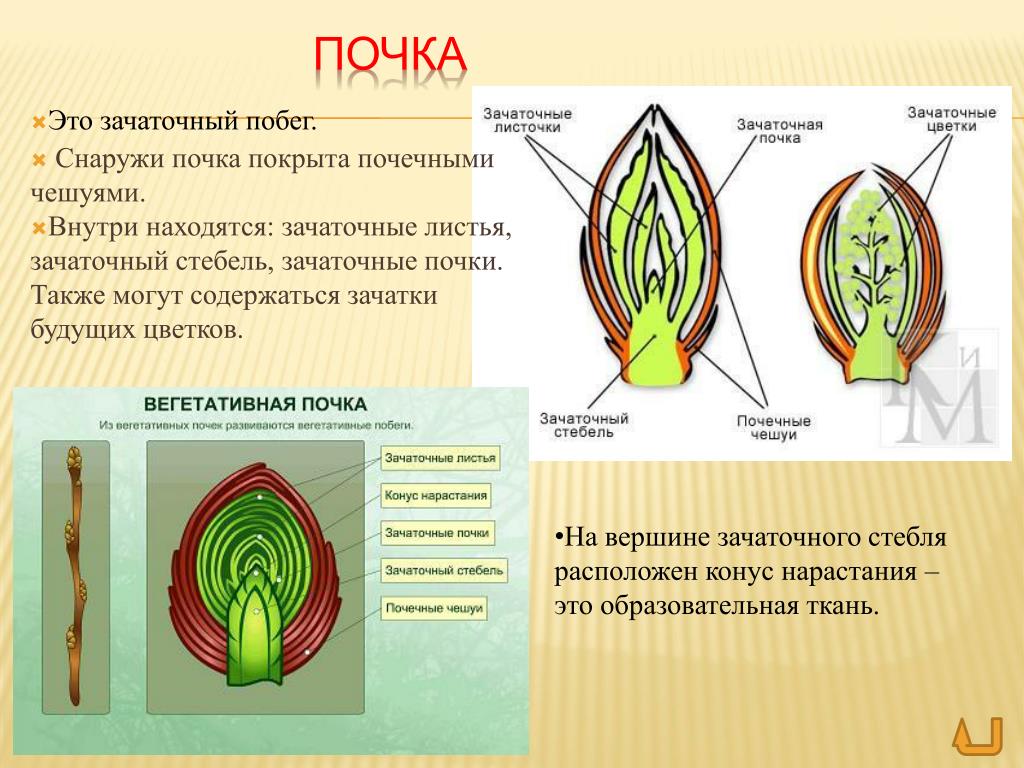
- Трофические факторы играют важную роль в регенерации нейронов.
Нейроны периферической нервной системы могут регенерировать свои аксоны. Это контрастирует с общей неспособностью поврежденных нейронов ЦНС к регенерации.Регенерация периферических нейронов в значительной степени обусловлена ролью трофических факторов, которые обеспечивают важную функцию предотвращения их дегенерации после аксотомии. Некоторые из тех же молекул, которые необходимы для развития и выживания незрелых нейронов, также участвуют в выживании взрослых нейронов после повреждения. Например, если перерезать аксоны взрослого симпатического нейрона, окончания аксонов афферентных нейронов удаляют окончания своих аксонов. Однако при добавлении экзогенного NGF происходит регенерация и реиннервация.Если для нейтрализации NGF добавляют антитела против NGF, то регенерация блокируется. Блокирование ретроградного транспорта NGF из клетки-мишени в тело клетки поврежденного симпатического нейрона также ингибирует регенерацию.
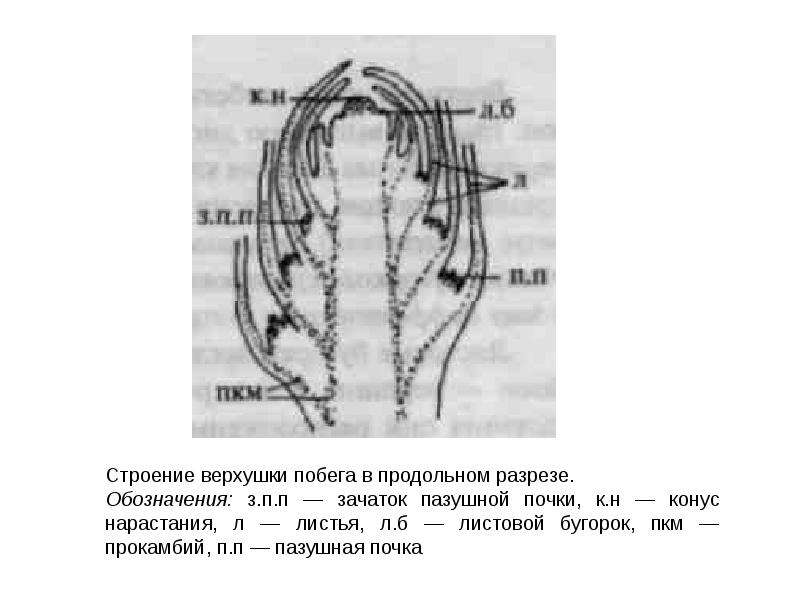 Таким образом, NGF необходим для регенерации и поддержания периферических синаптических связей во взрослой ПНС.
Таким образом, NGF необходим для регенерации и поддержания периферических синаптических связей во взрослой ПНС. Шванновские клетки также способствуют регенерации периферических аксонов. При повреждении и регенерации аксонов макрофаги активируются и внедряются в поврежденные участки.Они секретируют митогенные факторы, стимулирующие пролиферацию шванновских клеток. Пролиферация глиальных клеток приводит к увеличению секреции молекул внеклеточного матрикса и способствует адгезии между регенерирующими аксонами и оставшимися опорными клетками. Синтез и секреция NGF также стимулируются в этих условиях и обеспечивают важные краткосрочные условия для регенерации. Таким образом, NGF играет другую роль в регенерации, поскольку он продуцируется компонентами периферической нервной системы, которые сами по себе не являются постсинаптическими мишенями.
9.22 Нейроны ЦНС имеют очень ограниченную способность к регенерации
Повреждение нейронов ЦНС часто бывает необратимым.
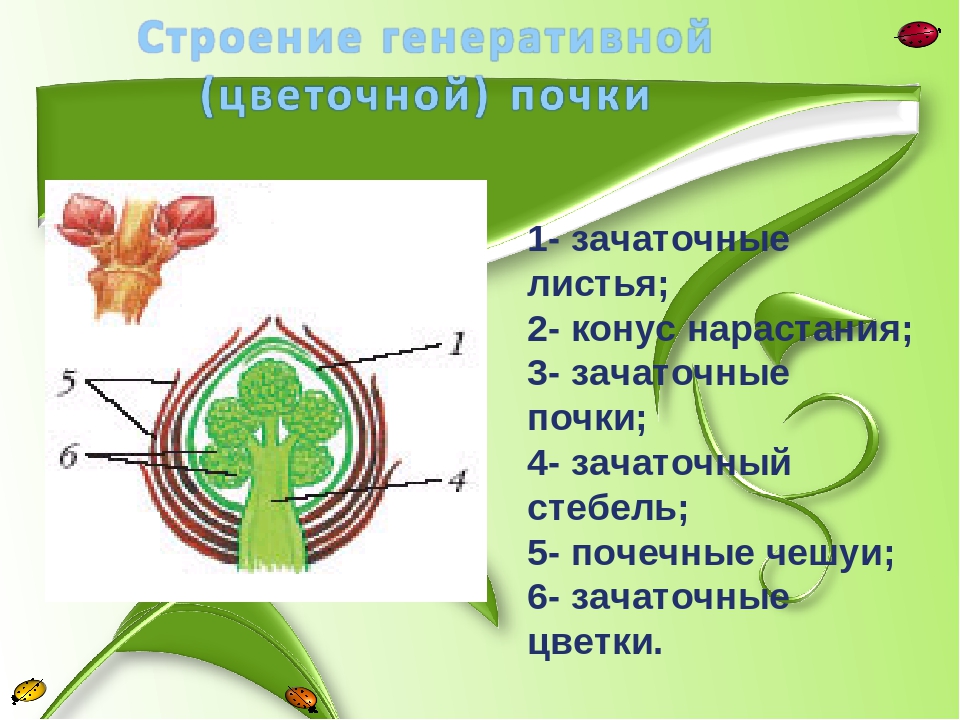 Почему в этом отношении нейроны ЦНС отличаются от периферических нейронов? Во взрослом мозге важные молекулы ECM, такие как ламинин и фибронектин, больше не экспрессируются, и поэтому важные молекулы адгезии отсутствуют в регенерирующей среде. Кроме того, олигодендроглии (миелинизирующие клетки ЦНС) экспрессируют ингибирующие рост молекулы у взрослых, которые блокируют повторный рост аксонов.
Почему в этом отношении нейроны ЦНС отличаются от периферических нейронов? Во взрослом мозге важные молекулы ECM, такие как ламинин и фибронектин, больше не экспрессируются, и поэтому важные молекулы адгезии отсутствуют в регенерирующей среде. Кроме того, олигодендроглии (миелинизирующие клетки ЦНС) экспрессируют ингибирующие рост молекулы у взрослых, которые блокируют повторный рост аксонов.Как обсуждалось выше, окружающая среда и свойства периферических нервов гораздо больше способствуют процессу регенерации. Например, шванновские клетки секретируют NGF, ECM и другие адгезивные молекулы, которые имеют решающее значение для выживания нейронов и регенерации аксонов. Кроме того, шванновские клетки не экспрессируют молекулы, ингибирующие рост аксонов, как олигодендроглии в ЦНС. Использование трансплантатов периферических нервов для стимуляции регенерации поврежденных нервов в ЦНС является одним из возможных способов преодоления ограниченного потенциала регенерации нейронов ЦНС.

Например, после перерезки зрительного нерва, если часть периферического нерва прикрепить к перерезанному концу зрительного нерва, а другой его конец вставить в верхнее двухолмие, может произойти регенерация зрительного нерва. Доказательства, подтверждающие функциональную регенерацию перерезанных зрительных нервов, включают:
- Аксоны ганглиев сетчатки регенерировали и реиннервировали верхнее двухолмие.
- Образуются новые синапсы, которые существуют не менее одного года.
- Эти новые синапсы функционируют; если нейроны сетчатки активируются светом, то реагируют постсинаптические нейроны в холмиках (они реагируют и на прямую электрическую стимуляцию нейронов сетчатки).
- Подопытные с трансплантатами нерва ПНС частично восстановили поведение избегания света.
- Введение факторов роста во время трансплантации нервов может усилить регенерацию.
NGF, по-видимому, также играет важную роль в выживании холинергических нейронов базальных отделов переднего мозга, где нейроны дегенерируют при болезни Альцгеймера.

Рисунок 9.40
Общие отношения между пре- и постсинаптическими нейронами при повреждении и регенерации.После повреждения аксона путем разрезания во время дегенерации происходит ряд изменений. При определенных условиях может происходить как ретроградная, так и антероградная транснейронная дегенерация.
- Разрезание аксона делит его на проксимальный и дистальный сегменты
- Сразу после травмы аксоны начинают закупоривать, однако Ca 2+ проникает в поврежденные аксональные элементы и активирует Ca 2+ -зависимые протеазы
- Быстрое нарушение синаптической передачи происходит в течение нескольких часов (в зависимости от того, где аксон разрезается относительно дистально-проксимальной оси; метаболический и белково-синтетический аппарат остается в теле клетки)
- В течение нескольких дней пресинаптические окончания начинают дегенерировать, и примерно через 1 неделю внедрившаяся глия разрушает и фагоцитирует синаптические контакты
- Дистальный сегмент дегенерирует медленно и может занять до 1 месяца; потеря дистальных сегментов называется Валлеровской дегенерацией
- Существуют также серьезные изменения, происходящие в теле нейронной клетки во время дегенерации; через несколько дней после аксотомии в соме начинается процесс хроматолиза:
- RER (шероховатый эндоплазматический ретикулум) разрушается и перемещается на периферию тела клетки (или сомы).

- Наблюдается увеличение количества свободных полирибосом, транскрипция мРНК и синтез белка (реакция поврежденного нейрона на повреждение заключается в усилении его метаболического восстановления).
- Успех поврежденного нейрона в регенерации связан с его способностью находить подходящую мишень для реиннервации; отсутствие контакта с мишенью обычно приводит к гибели клеток.
- RER (шероховатый эндоплазматический ретикулум) разрушается и перемещается на периферию тела клетки (или сомы).
Если поврежденный нейрон выживает (а это часто зависит от наличия соответствующих трофических факторов), начинается процесс реиннервации:
- Проксимальный сегмент аксона образует отростки и начинается процесс отрастания.
- Отростки аксонов мигрируют в канал, образованный остаточной эндоневральной оболочкой, окружающей предыдущий аксон.
- Отростки аксонов мигрируют в поисках цели; если подходящая мишень найдена, нейрон выживает; в противном случае нейрон умирает.
Клеточные повреждения не ограничиваются поврежденными нейронами; дегенерация часто бывает транснейрональной или транссинаптической.
 В зрительном пути повреждение нейронов ганглия сетчатки часто приводит к дегенерации нижестоящих нейронов-мишеней в латеральном коленчатом теле и даже нейронов в зрительной коре.Это называется транссинаптической антероградной дегенерацией. Этот процесс может происходить и в обратном направлении (т. е. повреждение нейронов зрительной коры может привести к дегенерации коленчатых, а затем нейронов сетчатки) и называется транссинаптической ретроградной дегенерацией.
В зрительном пути повреждение нейронов ганглия сетчатки часто приводит к дегенерации нижестоящих нейронов-мишеней в латеральном коленчатом теле и даже нейронов в зрительной коре.Это называется транссинаптической антероградной дегенерацией. Этот процесс может происходить и в обратном направлении (т. е. повреждение нейронов зрительной коры может привести к дегенерации коленчатых, а затем нейронов сетчатки) и называется транссинаптической ретроградной дегенерацией. Травматическое повреждение нейронов часто бывает необратимым. Однако в тех случаях, когда нейроны действительно регенерируют после повреждения, механизмы, которые способствуют регенерации, сходны с теми событиями, которые способствуют росту аксонов и образованию синапсов во время развития.
При нормальном развитии образование синапсов представляет собой постепенный процесс, в результате которого одно мышечное волокно иннервируется одним двигательным аксоном. После аксотомии на поверхности мышечного волокна остаются постсинаптические структуры, называемые синаптическими желобами.

Во время реиннервации нерв формирует новые синаптические контакты в старых синаптических желобах: связь один к одному между нервом и мышечным волокном сохраняется.
9.23 Новые рубежи — трансплантация тканей/клеток
Большое количество калечащих неврологических состояний возникает в результате потери определенных клеточных популяций из нервной системы в результате болезни или травмы, и эти клетки не заменяются естественным образом.Замена истощенных клеточных популяций трансплантацией может быть функционально полезной при многих таких заболеваниях. Разнообразные клеточные популяции уязвимы, и потеря определенных популяций приводит к ограниченному дефициту в различных условиях. Это разнообразие представляет серьезную проблему, если заместительная клеточная терапия должна стать широко применимой в клинической области, потому что каждое состояние имеет специфические требования к фенотипу, стадии развития и количеству необходимых клеток.
Новые открытия позволили использовать иммортализованные клеточные линии для замены или дополнения сниженных или утраченных функций поврежденных тканей нервной системы.
 Также были достигнуты ограниченные успехи в области трансплантации с использованием тканей плода (однако этот подход является спорным с этической точки зрения). Области, в которых были опробованы эти новые подходы, включают:
Также были достигнуты ограниченные успехи в области трансплантации с использованием тканей плода (однако этот подход является спорным с этической точки зрения). Области, в которых были опробованы эти новые подходы, включают: - Синтез и секреция катехоламинов у больных болезнью Паркинсона
- синтез и секреция факторов роста/трофики (e.г., NGF) у пациентов с болезнью Альцгеймера
- синтез и секреция ВКМ и адгезивных молекул для стимуляции регенерации у пациентов с поврежденными тканями ЦНС или ПНС
Эти подходы технически сложны как на клеточном, так и на молекулярном уровне. Одна из проблем, с которыми приходится сталкиваться, заключается в том, что, хотя трансплантация тканей или клеток, по-видимому, имеет положительные краткосрочные преимущества, их долгосрочные эффекты ограничены.
9.24 Стволовые клетки
Идеальная клетка для универсального применения в заместительной клеточной терапии должна обладать несколькими ключевыми свойствами: она должна быть высокопролиферативной, позволяющей производить ex vivo большое количество клеток из минимального донорского материала; он также останется незрелым и фенотипически пластичным, так что он сможет дифференцироваться в соответствующие типы нервных и глиальных клеток во время или до трансплантации.
 Критически важно, чтобы и пролиферация, и дифференцировка были контролируемыми. Нервные стволовые клетки существуют не только в развивающейся нервной системе млекопитающих, но и во взрослой нервной системе всех организмов млекопитающих, включая человека. Нервные стволовые клетки также могут быть получены из более примитивных эмбриональных стволовых клеток. Клетки могут быть размножены, установлены в непрерывные клеточные линии и дифференцированы в три классических фенотипа нейронов (нейроны, астроциты и олигодендроциты). Механизмы, регулирующие эндогенные стволовые клетки, плохо изучены.Потенциальное использование стволовых клеток для восстановления включает трансплантацию для восстановления отсутствующих клеток и активацию эндогенных клеток для обеспечения «самовосстановления». Прежде чем можно будет реализовать весь потенциал нервных стволовых клеток, мы должны понять, что контролирует их пролиферацию, а также различные пути дифференцировки, доступные их дочерним клеткам.
Критически важно, чтобы и пролиферация, и дифференцировка были контролируемыми. Нервные стволовые клетки существуют не только в развивающейся нервной системе млекопитающих, но и во взрослой нервной системе всех организмов млекопитающих, включая человека. Нервные стволовые клетки также могут быть получены из более примитивных эмбриональных стволовых клеток. Клетки могут быть размножены, установлены в непрерывные клеточные линии и дифференцированы в три классических фенотипа нейронов (нейроны, астроциты и олигодендроциты). Механизмы, регулирующие эндогенные стволовые клетки, плохо изучены.Потенциальное использование стволовых клеток для восстановления включает трансплантацию для восстановления отсутствующих клеток и активацию эндогенных клеток для обеспечения «самовосстановления». Прежде чем можно будет реализовать весь потенциал нервных стволовых клеток, мы должны понять, что контролирует их пролиферацию, а также различные пути дифференцировки, доступные их дочерним клеткам. 9.25 Резюме
Постсинаптические мишени поставляют важные нейротрофические факторы.
- В дополнение к NGF было идентифицировано несколько нейротрофических факторов (например,г., BDNF и нейротрофин 3).
- Реакции нейронов на повреждение могут сильно различаться; нейроны обычно выживают, если в процессе регенерации образуются функциональные связи.
- Хотя регенерация возможна в ПНС, регенерация в ЦНС плохая или отсутствует.
Будущие биомедицинские исследования продолжат активно использовать подходы к восстановлению функции поврежденных нейронных тканей. Будущее понимания важных молекул и механизмов, лежащих в основе регенерации, связано с фундаментальными нейробиологическими исследованиями.Области, на которые следует обратить внимание, включают:
- Идентификация новых молекул клеточной поверхности и внеклеточного матрикса, которые способствуют росту и регенерации аксонов.
- Идентификация и производство новых трофических факторов, необходимых для выживания и роста клеток.
- Исследование потенциального использования эмбриональных стволовых клеток для функциональной замены утраченных нейронов.
- Кроме того, будут продолжены исследования трансплантации тканей и трансплантатов периферических нервов, поскольку они представляют собой один из наиболее жизнеспособных подходов к регенерации ЦНС.
Проверьте свои знания
Все нижеперечисленное является ориентиром для роста аксонов и поиска пути, ЗА ИСКЛЮЧЕНИЕМ:
A. Молекулы адгезии клеточной поверхности
B. Сигналы направления от ячеек указателей
C. Пионерские аксоны
Д. Филоподия
Э.Молекулы внеклеточного матрикса
Все нижеперечисленное является ориентиром для роста аксонов и поиска пути, ЗА ИСКЛЮЧЕНИЕМ:
A. Молекулы адгезии на клеточной поверхности Это НЕВЕРНЫЙ ответ.
Молекулы адгезии на клеточной поверхности дают сигналы для роста аксонов.
B. Сигналы направления от ячеек указателей
С.Аксоны Pioneer
Д. Филоподия
E. Молекулы внеклеточного матрикса
Все нижеперечисленное является ориентиром для роста аксонов и поиска пути, ЗА ИСКЛЮЧЕНИЕМ:
A. Молекулы адгезии клеточной поверхности
B. Подсказки направления от ячеек указателя Этот ответ НЕВЕРЕН.
Направленные сигналы от клеток направляющих столбов действительно дают сигналы для роста аксонов.
C. Пионерские аксоны
Д. Филоподия
E. Молекулы внеклеточного матрикса
Все нижеперечисленное является ориентиром для роста аксонов и поиска пути, ЗА ИСКЛЮЧЕНИЕМ:
A. Молекулы адгезии клеточной поверхности
B. Сигналы направления от ячеек указателей
С.Первые аксоны Этот ответ НЕВЕРНЫЙ.
Первые аксоны дают сигналы для роста аксонов.
Д. Филоподия
E. Молекулы внеклеточного матрикса
Все нижеперечисленное является ориентиром для роста аксонов и поиска пути, ЗА ИСКЛЮЧЕНИЕМ:
A. Молекулы адгезии клеточной поверхности
Б.Указатели направления из ячеек направляющих
C. Пионерские аксоны
Д. Филоподия Это ПРАВИЛЬНЫЙ ответ.
Филоподии представляют собой пальцевидные отростки, обнаруживаемые на конусе роста (см. рис. 9.4), участвующие в собственном движении аксонов, но сами по себе они не дают ориентира.
E. Молекулы внеклеточного матрикса
Все нижеперечисленное является ориентиром для роста аксонов и поиска пути, ЗА ИСКЛЮЧЕНИЕМ:
А.Молекулы адгезии клеточной поверхности
B. Сигналы направления от ячеек указателей
C. Пионерские аксоны
Д. Филоподия
E. Молекулы внеклеточного матрикса Ответ НЕВЕРНЫЙ.
Молекулы внеклеточного матрикса дают сигналы для роста аксоновАгрин:
А.Захватывается нервным окончанием и перемещается ретроградным транспортом в тело клетки
B. Важен для выживания всех нейронов
C. Является мышечным фактором
D. Фактор нервного происхождения
E. Связывается с ацетилхолиновыми рецепторами
Агрин:
А.Захватывается нервным окончанием и перемещается ретроградным транспортом в тело клетки. Это НЕВЕРНЫЙ ответ.
Агрин – фактор нервного происхождения.B. Важен для выживания всех нейронов
C. Является мышечным фактором
D. Фактор нервного происхождения
E. Связывается с ацетилхолиновыми рецепторами
Агрин:
А.Захватывается нервным окончанием и перемещается ретроградным транспортом в тело клетки
B. Важен для выживания всех нейронов. Это НЕВЕРНЫЙ ответ.
Агрин – фактор нервного происхождения.
C. Является мышечным фактором
D. Фактор нервного происхождения
E. Связывается с ацетилхолиновыми рецепторами
Агрин:
А.Захватывается нервным окончанием и перемещается ретроградным транспортом в тело клетки
B. Важен для выживания всех нейронов
C. Фактор, производный от мышц. Этот ответ НЕВЕРЕН.
Агрин – фактор нервного происхождения.D. Фактор нервного происхождения
E. Связывается с ацетилхолиновыми рецепторами
Агрин:
А.Захватывается нервным окончанием и перемещается ретроградным транспортом в тело клетки
B. Важен для выживания всех нейронов
C. Является мышечным фактором
D. Является нервным фактором. Ответ ПРАВИЛЬНЫЙ!
Агрин – фактор нервного происхождения.
E. Связывается с ацетилхолиновыми рецепторами
Агрин:
А.Захватывается нервным окончанием и перемещается ретроградным транспортом в тело клетки
B. Важен для выживания всех нейронов
C. Является мышечным фактором
D. Фактор нервного происхождения
E. Связывается с ацетилхолиновыми рецепторами. Это НЕВЕРНЫЙ ответ.
Агрин – фактор нервного происхождения.Что из следующего является ориентиром для аксонального роста и поиска пути?
А.Актин
B. Стволовые клетки
C. Фасцикуляция
Д. Филоподиум
Е. Ламеллиподиум
Что из следующего является ориентиром для аксонального роста и поиска пути?
A. Актин Это НЕВЕРНЫЙ ответ.
B. Стволовые клетки
С.Фасцикуляция
Д. Филоподиум
Е. Ламеллиподиум
Что из следующего является ориентиром для аксонального роста и поиска пути?
А. Актин
B. Стволовые клетки Это НЕВЕРНЫЙ ответ.
C. Фасцикуляция
Д.Филоподий
Е. Ламеллоподиум
Что из следующего является ориентиром для аксонального роста и поиска пути?
А. Актин
B. Стволовые клетки
C. Фасцикуляция Это ПРАВИЛЬНЫЙ ответ!
Д. Филоподиум
Э.Ламеллоподиум
Что из следующего является ориентиром для аксонального роста и поиска пути?
А. Актин
B. Стволовые клетки
C. Фасцикуляция
D. Filopodium Это НЕВЕРНЫЙ ответ.
Е. Ламеллоподиум
Что из следующего является ориентиром для аксонального роста и поиска пути?
А.Актин
B. Стволовые клетки
C. Фасцикуляция
Д. Филоподиум
E. Lamellopodium Этот ответ НЕВЕРЕН.
синапсов…
A. … стабилизируются путем отмены фактора роста.
B. … стабилизируются химиоаттракцией.
C. … элиминируются олигодендроцитами.
D. … исключаются, если они не активны.
Э. … устранены агрин.
синапсов…
A. … стабилизируются путем отмены фактора роста. Этот ответ НЕВЕРНЫЙ.
B. … стабилизируются химиоаттракцией.
C. … элиминируются олигодендроцитами.
D. … исключаются, если они не активны.
Э. … устранены агрин.
синапсов…
A. … стабилизируются путем отмены фактора роста.
B. … стабилизируются химиоаттракцией. Этот ответ НЕВЕРНЫЙ.
C. … элиминируются олигодендроцитами.
D. … исключаются, если они не активны.
Э. … устранены агрин.
синапсов…
A. … стабилизируются путем отмены фактора роста.
B. … стабилизируются химиоаттракцией.
C. … элиминируются олигодендроцитами. Этот ответ НЕВЕРНЫЙ.
D. … исключаются, если они не активны.
Э. … устранены агрин.
синапсов…
A. … стабилизируются путем отмены фактора роста.
B. … стабилизируются химиоаттракцией.
C. … элиминируются олигодендроцитами.
D. … исключаются, если они не активны. Этот ответ ПРАВИЛЬНЫЙ!
Э. … устранены агрин.
синапсов…
A. … стабилизируются путем отмены фактора роста.
B. … стабилизируются химиоаттракцией.
C. … элиминируются олигодендроцитами.
D. … исключаются, если они не активны.
Э. … устранены агрин. Этот ответ НЕВЕРНЫЙ.
Различные способы коллапса конуса роста в клетках NG 108-15
- Axon Pathfinding – как аксоны находят путь к определенным мишеням.
-
Ahmad FJ, Hughey J, Wittmann T, Hyman A, Greaser M, Baas PW (2000) Моторные белки регулируют силовые взаимодействия между микротрубочками и микрофиламентами в аксоне.Nat Cell Biol 2:276–280
PubMed Статья КАС Google Scholar
-
Andersen SSL (2005) Поиск и основная гипотеза поворота конуса роста. Bioessays 27:86–90
PubMed Статья КАС Google Scholar
-
Baas PW, Ahmad FJ (2001) Генерация силы цитоскелетными моторными белками как регулятор удлинения и ретракции аксонов.Trends Cell Biol 11:244–249
PubMed Статья КАС Google Scholar
-
Bentley D, Toroian-Raymond A (1986) Дезориентированный поиск пути с помощью конусов роста пионерных нейронов, лишенных филоподий при лечении цитохалазином. Природа 323: 712–715. дои: 10.1038/323712a0
ПабМед Статья КАС Google Scholar
-
Betz T, Koch D, Lim D, Käs JA (2009)Стохастическая полимеризация актина и устойчивый ретроградный поток определяют продвижение конуса роста.Biophys J 96:5130–5138
PubMed Статья КАС Google Scholar
-
Брандт Р. (1998) Цитоскелетные механизмы роста аксонов и поиск пути. Cell Tissue Res 292:181–189
PubMed Статья КАС Google Scholar
-
Bridgman PC (2002) Конусы роста содержат массивы биполярных филаментов миозина II. Cell Motil Cytoskeleton 52:91–96
PubMed Статья КАС Google Scholar
-
Brown JA, Wysolmerski RB, Bridgman PC (2009) Нейроны спинномозговых ганглиев реагируют на применение семафорина 3A двухфазным ответом, который требует множественных изоформ миозина II.Mol Biol Cell 20:1167–1179
PubMed Статья КАС Google Scholar
-
Castelo L, Jay DG (1999) Радиксин участвует в ламеллоподиальной стабильности во время подвижности конусов роста нервов. Mol Biol Cell 10:1511–1520
PubMed Статья КАС Google Scholar
-
Dent EW, Gertler FB (2003) Цитоскелетная динамика и транспорт в подвижности конусов роста и ведении аксонов.Нейрон 40:209–227
PubMed Статья КАС Google Scholar
-
Dent EW, Kalil K (2001) Ветвление аксонов требует взаимодействия между динамическими микротрубочками и актиновыми филаментами. J Neurosci 21:9757–9769
PubMed КАС Google Scholar
-
Диксон Б.Дж. (2002) Молекулярные механизмы направления аксонов. Science 298:1959–1964
PubMed Статья КАС Google Scholar
-
Ertürk A, Hellal F, Enes J, Bradke F (2007) Дезорганизованные микротрубочки лежат в основе образования ретракционных луковиц и нарушения регенерации аксонов.J Neurosci 27:9169–9180
PubMed Статья Google Scholar
-
Fan J, Mansfield SG, Redmond T, Gordon-Weeks PR, Raper JA (1993)Организация F-актина и микротрубочек в конусах роста, подвергающихся воздействию разрушающего фактора головного мозга. J Cell Biol 121:867–878
PubMed Статья КАС Google Scholar
-
Finnegan SG, Lemmon VP, Koenig E (1992) Характеристика ретракции аксонов ганглиозных клеток сетчатки золотой рыбки, индуцированной моноклональным антителом 8A2 in vitro.Cell Motil Cytoskelet 23:279–301
Статья КАС Google Scholar
-
Gallo G (2006) RhoA-киназа координирует организацию F-актина и активность миозина II во время индуцированной семафорином-3A ретракции аксона. J Cell Sci 119:3413–3423
PubMed Статья КАС Google Scholar
-
Gallo G, Letourneau PC (2004) Регуляция актиновых филаментов конуса роста с помощью сигналов управления.J Нейробиол 58:92–102
PubMed Статья КАС Google Scholar
-
Geraldo S, Gordon-Weeks PR (2009) Динамика цитоскелета при управлении конусом роста. J Cell Sci 122:3595–3604
PubMed Статья КАС Google Scholar
-
Goshima Y, Ohsako S, Yamauchi T (1993)Сверхэкспрессия Ca2+/кальмодулин-зависимой протеинкиназы II в клеточных линиях нейробластомы Neuro2a и NG108-15 способствует росту нейритов и подвижности ростовых конусов.J Neurosci 13: 559–567
PubMed КАС Google Scholar
-
Halloran M, Kalil K (1994) Динамическое поведение конусов роста в мозолистом теле живых срезов коры головного мозга, наблюдаемое с помощью видеомикроскопии. J Neurosci 14:2161–2177
PubMed КАС Google Scholar
-
Hamprecht B (1977) Структурные, электрофизиологические, биохимические и фармакологические свойства гибридов клеток нейробластомы-глиомы в клеточной культуре.В: Bourne GH (ed) Международный обзор цитологии [Academic Press], стр. 99–171
-
He Y, Yu W, Baas PW (2002) Реконфигурация микротрубочек во время ретракции аксонов, вызванная оксидом азота. J Neurosci 22: 5982–5991
PubMed КАС Google Scholar
-
Hendricks M, Jesuthasan S (2009) PHR регулирует остановку конуса роста на промежуточных мишенях посредством разборки микротрубочек. J Neurosci 29:6593–6598
PubMed Статья КАС Google Scholar
-
Kalil K, Dent EW (2005) Прикоснись и иди: направляющие сигналы сигнализируют цитоскелету конуса роста.Curr Opin Neurobiol 15:521–526
PubMed Статья КАС Google Scholar
-
Kalil K, Szebenyi G, Dent EW (2000) Общие механизмы, лежащие в основе направления конусов роста и ветвления аксонов. J Neurobiol 44:145–158
PubMed Статья КАС Google Scholar
-
Kapfhammer JP, Raper JA (1987) Коллапс структуры конуса роста при контакте со специфическими нейритами в культуре.J Neurosci 7: 201–212
PubMed КАС Google Scholar
-
Knorr M, Koch D, Fuhs T, Behn U, Käs JA (2011)Стохастическая динамика актина в ламеллоподиях раскрывает пространство параметров для классификации типов клеток. Soft Matter 7:3192
Артикул КАС Google Scholar
-
Kolega J (2006)Роль моторной активности миозина II в асимметричном распределении миозина и связывании протрузионной активности с транслокацией клеток.Mol Biol Cell 17:4435–4445
PubMed Статья КАС Google Scholar
-
Lin CH, Espreafico EM, Mooseker MS, Forscher P (1996) Миозин управляет ретроградным потоком F-актина в конусах роста нейронов. Нейрон 16:769–782
PubMed Статья КАС Google Scholar
-
Lockerbie RO (1987) Конус роста нейронов: обзор его локомоторных, навигационных способностей и возможностей распознавания целей.Неврология 20:719–729
PubMed Статья КАС Google Scholar
-
Лоури Л.А., Ван Вактор Д. (2009) Путь подсказки: понимание механизма конуса роста. Nat Rev Mol Cell Biol 10:332–343
PubMed Статья КАС Google Scholar
-
Lu M, Witke W, Kwiatkowski DJ, Kosik KS (1997) Замедленная ретракция филоподий у мышей с отсутствием гельсолина.J Cell Biol 138:1279–1287
PubMed Статья КАС Google Scholar
-
Luo L, O’Leary DDM (2005) Ретракция и дегенерация аксонов в развитии и болезни. Annu Rev Neurosci 28:127–156
PubMed Статья КАС Google Scholar
-
Marsh L, Letourneau PC (1984) Рост нейритов без филоподиальной или ламеллоподиальной активности в присутствии цитохалазина B.J Cell Biol 99:2041–2047
PubMed Статья КАС Google Scholar
-
Маттила П.К., Лаппалайнен П. (2008) Филоподии: молекулярная архитектура и клеточные функции. Nat Rev Mol Cell Biol 9:446–454
PubMed Статья КАС Google Scholar
-
Mortimer D, Fothergill T, Pujic Z, Richards LJ, Goodhill GJ (2008) Хемотаксис конуса роста. Trends Neurosci 31:90–98
PubMed Статья КАС Google Scholar
-
Myers K, Tint I, Nadar CV, He Y, Black MM, Baas PW (2006) Антагонистические силы, генерируемые цитоплазматическим динеином и миозином-II во время поворота конуса роста и ретракции аксонов.Traffic 7:1333–1351
PubMed Статья КАС Google Scholar
-
Obara Y, Ueno S, Yanagihata Y, Nakahata N (2011) Лизофосфатидилинозитол вызывает ретракцию нейритов через GPR55, G13 и RhoA в клетках PC12. PLoS ONE 6(8):e24284
PubMed Статья КАС Google Scholar
-
Oldenbourg R, Katoh K, Danuser G (2000) Механизм латерального движения филоподий и радиальных пучков актина через конусы роста нейронов.Biophys J 78:1176–1182
PubMed Статья КАС Google Scholar
-
Паттерсон П.Х. (1988) О важности подавления или отказа от конусов роста. Нейрон 1:263–267
PubMed Статья КАС Google Scholar
-
Rauch P, Heine P, Goettgens B, Käs J (2013) Силы сзади: деформированные микротрубочки в конусах роста нейронов влияют на ретроградный поток и продвижение.Нью-Джерси, физика 15:015007. дои: 10.1088/1367-2630/15/1/015007
-
Sato Y, Mita S, Fukushima N, Fujisawa H, Saga Y, Hirata T (2011) Индукция остановки роста аксонов без коллапса конуса роста через N-концевую область четырехтрансмембранного гликопротеина M6a. Dev Neurobiol 71: 733–746
PubMed Статья КАС Google Scholar
-
Шобер Ю.М., Комарова Ю.А., Чага О.Ю., Ахманова А., Борисый Г.Г. (2007) Реорганизация филоподий, зависимая от нацеливания на микротрубочки.J Cell Sci 120:1235–1244
PubMed Статья КАС Google Scholar
-
Smalheiser NR (1991) Роль ламинина в стимуляции быстроразвивающихся нейритов в клетках NG108-15: относительный вклад реакций прикрепления и подвижности. Dev Brain Res 62:81–89
Статья КАС Google Scholar
-
Свиткина Т.М., Сургучева И.Г., Верховский А.Б., Гельфанд В.И., Муреманс М., Де Мей Дж. (1989) Прямая визуализация биполярных миозиновых филаментов в стрессовых волокнах культивируемых фибробластов.Cell Motil Cytoskelet 12:150–156
Статья КАС Google Scholar
-
Танака Э.М. (1991)Поведение микротрубочек в конусах роста живых нейронов во время удлинения аксона. J Cell Biol 115:345–363
PubMed Статья КАС Google Scholar
-
Tanaka J, Kira M, Sobue K (1993) Gelsolin локализуется в конусах роста нейронов. Dev Brain Res 76: 268–271
Статья КАС Google Scholar
-
Tessier-Lavigne M, Goodman CS (1996) Молекулярная биология управления аксонами.Science 274:1123–1133
PubMed Статья КАС Google Scholar
-
Torreano PJ, Waterman-Storer CM, Cohan CS (2005)Влияние факторов коллапса на содержание F-актина и распределение микротрубочек конусов роста Helisoma. Cell Motil Cytoskelet 60:166–179
Статья КАС Google Scholar
-
Tsuji T, Higashida C, Yoshida Y, Islam MS, Dohmoto M, Koizumi K, Higashida H (2011) Ect2, ортолог гальки дрозофилы, отрицательно регулирует рост нейритов в клетках нейробластомы × глиомы гибрида NG108-15.Cell Mol Neurobiol 31:663–668
PubMed Статья КАС Google Scholar
-
Wylie SR, Chantler PD (2003) Миозин IIA управляет ретракцией нейритов. Mol Biol Cell 14:4654–4666
PubMed Статья КАС Google Scholar
-
Zhang X-F, Schaefer AW, Burnette DT, Schoonderwoert VT, Forscher P (2003) Rho-зависимые сократительные ответы в конусе роста нейронов не зависят от классического периферического ретроградного тока актина.Нейрон 40:931–944
PubMed Статья КАС Google Scholar
-
Zhou F-Q, Cohan CS (2004) Как актиновые филаменты и микротрубочки направляют ростовые конусы к своим мишеням. J Neurobiol 58:84–91
PubMed Статья КАС Google Scholar
-
Zhou F-Q, Waterman-Storer CM, Cohan CS (2002) Очаговая потеря пучков актина вызывает перераспределение микротрубочек и поворот конуса роста.J Cell Biol 157:839–849
PubMed Статья КАС Google Scholar
Нервная система высших животных ошеломительно сложна
Нервная система высших животных ошеломительно сложнаНаведение аксонов
(д-р М. Фруттигер)Последнее обновление 24 февраля 2003 г.
Проблема
Во время развития новообразованные нейроны дифференцируются в разные типы нейронов и приобретают определенные черты, прежде чем они установят какие-либо связи.Например, сенсорные нейроны «знают», что они являются сенсорными нейронами и что они должны нацеливаться, скажем, на кожу, а не на мышцы. Таким образом, в зависимости от их идентичности разные нейроны будут посылать отростки к соответствующим мишеням по мере развития эмбриона. Как эти отрастающие отростки перемещаются по эмбриональному телу? Нужно ли каждому нейрону «знать» весь путь к цели и как такое огромное количество информации могло быть закодировано в геноме?
Общие принципы
Есть два основных принципа, которые упрощают описанную выше проблему:
1) Промежуточные цели:
Растущие аксоны могут использовать промежуточные цели (ступеньки), к которым они приближаются путем относительно простого линейного роста.Как только они достигли промежуточной цели, они должны «сделать выбор», прежде чем нацеливаться на следующую промежуточную цель. Это разбивает весь путь на более короткие, более управляемые сегменты.
2) Селективная фасцикуляция:
Большинство растущих аксонов сталкивается с окружением, уже заполненным другими нейронными отростками, за которыми они могут просто следовать, образуя пучки аксонов (пучки). Развивающийся аксон также может переключаться с одного пучка на другой в определенных точках выбора.Эта избирательная фасцикуляция упрощает навигационные проблемы, с которыми сталкивается растущий аксон.
Однако основная проблема остается: как первые аксоны (пионерные аксоны) находят свою цель и как аксоны находят путь между промежуточными целями?
Ответ заключается в том, что растущие аксоны реагируют на направляющие сигналы, присутствующие в эмбрионе. Текущие исследования выявляют все больше и больше таких сигналов. Они делятся на две категории: отталкивающие и привлекательные сигналы. В зависимости от того, насколько легко они могут диффундировать через ткани, проводится дальнейшее различие: сигналы дальнего действия и сигналы ближнего действия.Сигналы дальнего действия, как правило, представляют собой диффундирующие молекулы, секретируемые клетками, тогда как сигналы ближнего действия не являются диффундирующими и связаны с клеточными поверхностями или внеклеточным матриксом (ECM). Растущий кончик аксона является ключевой структурой, необходимой для интерпретации этих различных сигналов, и называется «конусом роста». Он состоит из центральной области (c-области), филоподий и ламеллоподий и очень подвижен. По форме напоминающий руку, он «ощупывает» путь через откладывающий эмбрион
вниз по аксону.Столкнувшись с различными сигналами, конус роста адаптирует направление своего роста (от источника сигнала или к нему) или может просто схлопнуться при контакте с отталкивающим сигналом. Это поведение основано на рецепторных молекулах на поверхности конуса роста, передающих сигналы «двигательному механизму» внутри конуса роста. Филоподии двигаются, как пальцы, «исследуя» свое окружение. Эти движения основаны на полимеризации и деполимеризации актина. В филоподиях актиновые филаменты организованы в пучки, тогда как в с-области и в ламеллоподиях они образуют сложную сеть.Основным белком цитоскелета аксонов является тубулин, полимеризованный в микротрубочки. В стволе аксона эти микротрубочки образуют стабильный сшитый пучок, тогда как в конусе роста они сплайсируются и становятся нестабильными, вытягиваясь и втягиваясь вдоль актиновых пучков. Благодаря дифференцированной стабилизации актиновых филаментов и микротрубочек конусы роста могут продвигаться вперед, останавливаться, втягиваться или поворачиваться. Однако точные молекулярные механизмы, которые контролируют цитоскелет конуса роста, еще недостаточно изучены.
Как можно изучать молекулы наведения аксонов?
Культура клеток и генетические исследования до сих пор были очень успешными в изучении молекул, участвующих в ведении аксонов.В культуре реакцию живых конусов роста можно изучать, когда они сталкиваются с определенной молекулой в определенной, хотя и несколько искусственной среде. Генетические эксперименты (например, нокаутные мыши) изучают, как конкретный ген влияет на обнаружение пути аксона в «реальной среде», но интерпретация конкретного фенотипа осложняется множеством неизвестных, неконтролируемых переменных. В сочетании эти два подхода выявили идентичность мириадов сигнальных молекул наведения аксонов.Их можно сгруппировать в разные категории:
Молекулы клеточной адгезии (например, N-CAM, L1 или фасциклины)
Молекулы ЕСМ и их рецепторы (например, коллаген, ламинин или интегрины)
Рецепторные тирозинкиназы и их лиганды (trk-рецепторы, нейротрофины, Eph-рецепторы и эфрины)
Нетрины и их рецепторы
Семафорины и их рецепторы
Ретинально-тектальная проекция
Аксоны, проецирующиеся из нейронов сетчатки в мозг, представляют топографию их сетчатки на тектуме (их целевая область аксонов сетчатки у рыб, лягушек и цыплят), что приводит к пространственному (обратному) представлению сетчатки на тектуме.Нейроны, расположенные в височной области сетчатки, прекращают свой рост в передней части тектума, тогда как нейроны носовой части сетчатки распространяются через переднюю часть в заднюю часть тектума. Это поведение можно воссоздать в клеточной культуре, выделяя мембраны из передней и задней части тектума и нанося их на предметное стекло в виде чередующихся полос. Нейроны височной сетчатки растут только на передних мембранах и отталкиваются задними мембранами, тогда как нейроны носовой сетчатки растут на препаратах любой мембраны.Фактор этого отталкивающего действия передней части тектума был идентифицирован как RAGS (отталкивающий сигнал наведения аксонов, известный сегодня как эфрин А5) и выражается в возрастающем градиенте (от переднего к заднему) в тектуме (эфрины являются лигандами для рецепторов Eph). и необычны тем, что они связаны с мембраной). Нейроны сетчатки экспрессируют Eph A3 (рецептор эфрина A5) также в виде градиента (от носового к височному). Это означает, что нейроны носовой сетчатки, экспрессирующие небольшое количество рецептора Eph A3, нечувствительны к эфрину A5 и прорастают в области с высокой концентрацией эфрина A5.Однако нейроны височной сетчатки, экспрессирующие высокие уровни рецептора Eph A3, чувствительны к относительно низким концентрациям эфрина A5 и перестают расти в передней части тектума.
Комиссуральные аксоны
Нейроны, соединяющие две стороны билатеральных животных, с точки зрения эволюции являются древней особенностью. Аксоны комиссуральных нейронов пересекают пластина дна (у позвоночных) или срединная линия (у эмбрионов дрозофилы ), затем меняют направление и растут продольно (например,г. по направлению к мозгу). Удивительно, однако, что сигнальные молекулы, участвующие в направлении комиссуральных аксонов, сильно различаются между собой.
сохраняется во всем царстве животных (черви, мухи, позвоночные). Прежде чем комиссуральные аксоны пересекают напольная плита/средняя линия, они должны к ней притягиваться. После пересечения их конусы нарастания нужно отталкивать от средней линии, чтобы предотвратить обратное пересечение. Нетрин и его рецептор (фразл у мух и DCC у позвоночных) ответственны за изначально привлекательные свойства средней линии.У мышей с «нокаутом» Комиссуральные аксоны гена нетрина не пересекают пластинку дна, и многие комиссуральные структуры (например, мозолистое тело) отсутствуют. Щель и ее рецептор robo (карусель) опосредуют отталкивающие свойства средней линии. У мух отсутствующие роботизированные аксоны пересекают среднюю линию назад и вперед, двигаясь «по кругу». То продукт бескомиссурного ( comm ) ингибирует robo до того, как аксоны пересекают среднюю линию, но не после. Как это достигается, пока точно не известно, но известно, что каким-то образом коммуникация не позволяет роботу достичь клеточной поверхности до того, как аксоны пересекают срединную линию.У мух с пропажей comm гена комиссуральные связи не образуются, потому что неингибированная robo-активность предотвращает рост аксонов по направлению к средней линии. После успешного пересечения комиссуральные аксоны присоединяются к одному из трех положительных пучков фасциклина II. Нейроны, экспрессирующие только robo1 присоединяются к пучку, ближайшему (медиальному) к средней линии, нейроны с robo1 и robo3 присоединяются к следующему (промежуточному) пучку, а нейроны с robo1, 2 и 3 присоединяются к третьему (латеральному) пучку.Таким образом, чем больше роборецепторов экспрессирует нейрон, тем более он чувствителен к щели и тем дальше он будет отрастать от средней линии, секретирующей щель. Обратите внимание, что, как и в тектальных проекциях сетчатки, количество рецепторов на растущем аксоне будет определять, насколько далеко он будет расти в градиенте репеллентной сигнальной молекулы. Таким образом, конусы роста реагируют не только на различные направляющие молекулы, но также могут использовать для навигации градиенты отдельных направляющих молекул.
Дополнительный уровень контроля находится внутри самого конуса роста.Недавно выяснилось, что привлекательные направляющие молекулы, такие как нетрин, могут стать отталкивающими при определенных условиях, этот эффект называется «преобразованием реакции». Имеются доказательства того, что уровень цАМФ (молекулы внутриклеточного вторичного мессенджера) внутри конуса роста отвечает за то, является ли конкретный сигнал наведения отталкивающим или привлекательным.
Дальнейшее чтение:
Учебники:
Гилберт, глава 13, стр. 425–439 (шестое издание).
Кандель, Шварц и Джессел, глава 54, стр. 1063-1086 (четвертое издание).
Вольперт, стр. 352-360.
Альбертс и др., Молекулярная биология клетки (четвертое издание), стр. 1228-38
Обзорные статьи:
Диксон Б. Дж. (2002) Молекулярные механизмы управления аксонами. Наука 298: 1959-1964
Ю Т.В. и Баргманн С.И. (2001)Динамическая регуляция направления аксонов. Nature Neuroscience 4: Приложение: 1169-1176.
Тессье-Лавин М. и Гудман К. С. (1996) Молекулярная биология управления аксонами. Наука 274: 1123-1133.
.