Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения
PPTX / 133.59 Кб
Химическое равновесие и способы его смещения
PPTX / 133.59 Кб
Тема: Химическое равновесие и способы его смещения
Учебные вопросы:
Обратимые реакции.
Необратимые реакции.
Химическое равновесие.
Смещение равновесия. Принцип Ле-Шателье.
Все химические реакции можно разделить на реакции обратимые и необратимые.
Обратимые реакции.
Обратимыми называют реакции, продукты которых могут между собой взаимодействовать с образованием исходных веществ.
Примером обратимой реакции может служить взаимодействие водорода с парами иода:
Н2 + I2 ↔ 2HI
Обратимость реакции обозначают двумя противоположно направленными стрелками. Реакцию, протекающую согласно записи слева направо, называют прямой, а справа налево — обратной.
Реакцию, протекающую согласно записи слева направо, называют прямой, а справа налево — обратной.
2. Необратимые реакции.
В тех случаях, когда обратная реакция выражена чрезвычайно слабо, такие реакции считают практически необратимыми. Обычно к ним относят те реакции, при протекании которых один из образующихся продуктов уходит из сферы реакции, т. е. выпадает в виде осадка или выделяется в виде газа; когда образуется малодиссоциированное соединение (например, вода), когда реакция сопровождается большим выделением энергии. Примеры практически необратимых реакций:
AgNO3 + NaCl = AgCl ↓ + NaNO3
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
HCl + NaOH = NaCl + H2O
2Mg + O2 = 2MgO; ∆H = — 601,92 кДж/моль
3. Химическое равновесие.
Химическое равновесие.
Состояние химического равновесия свойственно лишь для обратимых реакций. В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем снижается вследствие уменьшения концентрации исходных веществ, расходующихся на образование продуктов реакции. Обратная реакция в начальный момент имеет минимальную скорость, которая растет по мере увеличения концентраций продуктов реакции. Таким образом, скорость прямой реакции уменьшается, а обратной увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными. Такое состояние обратимой химической реакции называется химическим равновесием.
4.Смещение равновесия. Принцип Ле-Шателье.
Химическое равновесие при неизменных условиях может сохраняться сколь угодно долго до тех пор, пока неизменными сохраняются условия его существования (концентрации, давлений, температура). При изменении одного из этих условий равновесие нарушается и концентрации всех реагирующих веществ изменяются, после чего устанавливается новое состояние равновесия, но уже при иных значениях равновесных концентраций.
При изменении одного из этих условий равновесие нарушается и концентрации всех реагирующих веществ изменяются, после чего устанавливается новое состояние равновесия, но уже при иных значениях равновесных концентраций.
Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением или сдвигом химического равновесия. Если при изменении условий увеличивается концентрация продуктов реакции, то говорят о смещении — равновесия в сторону прямой реакции. Если же увеличивается концентрация исходных веществ, то это означает смещение равновесия в сторону обратной реакции.
Направление смещения химического равновесия при изменениях концентрации, температуры и давления определяется правилом, известным под названием принципа Ле Шателье, или принципа подвижного равновесия.
Согласно этому принципу если на систему, находящуюся в равновесии, производится воздействие (изменяется концентрация, температура или давление), то в системе происходит сдвиг в направлении той из двух противоположно направленных реакций, которая ослабляет это воздействие.
Рассмотрим отдельно влияние изменения температуры, давления и концентрации на состояние химического равновесия.
Влияние изменения температуры.
Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта реакции. Степень смещения равновесия зависит от величины теплового эффекта: чем больше ∆Н реакции, тем значительнее влияние температуры, наоборот, если ∆Н близка к нулю, то температура практически не влияет на равновесие. Рассмотрим обратимую реакцию синтеза аммиака из водорода и азота:
ЗН2 + N2 ↔ 2NH3; ∆Н = — 92 кДж (22 ккал)
Из уравнения реакции видим, что процесс образования аммиака из водорода и азота является экзотермическим, а обратный процесс — разложение аммиака — эндотермическим. Поэтому при повышении температуры равновесие этой реакции смещается в сторону обратной реакции, т. е. в направлении реакции разложения аммиака, которая проходит с поглощением теплоты. Это вполне согласуется с принципом Ле Шателье, так как повышение температуры (внешнее воздействие) ослабляется поглощением тепла за счет усиления эндотермической реакции.
е. в направлении реакции разложения аммиака, которая проходит с поглощением теплоты. Это вполне согласуется с принципом Ле Шателье, так как повышение температуры (внешнее воздействие) ослабляется поглощением тепла за счет усиления эндотермической реакции.
Сдвиг равновесия в сторону обратной реакции означает уменьшение выхода аммиака. И действительно, если при постоянном давлении температуру смеси повысить от 400 до 700° С, то выход аммиака уменьшается с 80 до 13%.
Если температуру равновесной системы понижать, это вызовет смещение равновесия данной реакции в сторону усиления прямой реакции, так как эта реакция идет с выделением теплоты и тем ослабляет внешнее воздействие (охлаждение). Смещение равновесия в сторону усиления прямой реакции означает в данном случае повышение выхода продукта реакции Nh4.
Отсюда можно сделать вывод: повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение — в сторону экзотермической реакции.
Влияние изменения давления.
Синтез аммиака из водорода и азота сопровождается уменьшением объема, так как из 4 молей исходных веществ в результате реакции образуется только 2 моля аммиака. Очевидно, в закрытом сосуде при постоянной температуре продукты этой реакции создают меньшее давление, чем создавали исходные вещества. Значит, прямая реакция — синтез аммиака — сопровождается уменьшением давления, а обратная реакция — его разложение — повышением давления. При повышении давления в сосуде с реакционной смесью равновесие этой реакции сместится в сторону прямой реакции, идущей с уменьшением давления, чем и достигается ослабление внешнего воздействия—повышения давления. Смещение равновесия в сторону прямой редакции означает повышение выхода продукта реакции — аммиака. На самом деле, если при постоянной температуре (400° С) давление в системе повысить от 50 до 1000 атм (от 5∙106 до 1∙1О8 Па), то выход аммиака повышается от 15 до 80%.
Вывод: повышение давления смещает равновесие в сторону реакции, идущей с образованием меньшего количества молей газообразных веществ. Понижение давления смещает равновесие в сторону реакции, идущей с образованием большего числа молей газообразных веществ.
Необходимо отметить, что равновесие под влиянием изменения давления смещается лишь в том случае, когда в реакции принимают участие газообразные вещества и реакция сопровождается изменением числа молей газообразных веществ.
Если же число молей газообразных веществ в ходе обратимой реакции не изменяется, то изменение давления не влияет на состояние равновесия такой реакции.
Например, в реакции
N2 + О2 ↔ 2NO
число молей исходных газообразных веществ равно числу молей образующихся газообразных веществ. Очевидно, эта равновесная система может быть примером, когда изменение давления не вызовет смещения химического равновесия. Это надо помнить.
Это надо помнить.
Влияние изменения концентрации.
Если в равновесной системе увеличить концентрацию одного из реагирующих веществ (исходных веществ или продуктов реакции), то равновесие сместится в направлении той реакции, при которой количество этого вещества уменьшается. Например, при введении дополнительного количества азота равновесие реакции синтеза аммиака сместится в сторону прямой реакции — в направлении уменьшения концентрации азота и увеличения выхода аммиака.
Наоборот, уменьшение концентрации одного из компонентов равновесной системы приводит к смещению равновесия в сторону реакции образования этого компонента. Очевидно, что если уменьшить концентрацию азота, то равновесие реакции синтеза аммиака сместится в сторону обратной реакции — в направлении увеличения концентрации азота и уменьшения выхода аммиака.
Таким образом, согласно принципу Ле Шателье, увеличение концентрации одного из исходных веществ или уменьшение концентрации одного из продуктов реакции смещает равновесие в сторону прямой реакции. Уменьшение концентрации одного из исходных веществ или увеличение концентрации одного из продуктов реакции смещает равновесие в сторону обратной реакции.
Уменьшение концентрации одного из исходных веществ или увеличение концентрации одного из продуктов реакции смещает равновесие в сторону обратной реакции.
Применение принципа Ле Шателье к обратимым химическим реакциям открывает путь к управлению химическими процессами. В промышленности обратимые реакции, как правило, невыгодны. Поэтому различными методами химическое равновесие смещают в сторону образования конечных продуктов, повышая их выход, и обратимая реакция становится практически необратимой.
В заключение заметим, что катализаторы одинаково ускоряют, как прямую, так и обратную реакции и поэтому на смещение равновесия они не оказывают влияния. Однако они способствуют более быстрому достижению состояния равновесия, что также имеет немаловажное значение.
Глоссарий к теме «Химическое равновесие и способы его смещения»
Экзотермическая реакция | Реакция идущая с выделением тепла |
Эндотермическая реакция | Реакция идущая с поглащением тепла |
Химическое равновесие | Скорость прямой реакции равна скорсти обратной рекции |
Прямая реакция | Это реакция, которая идет в сторону образования продуктов реакции |
Обратная реакция | Это реакция, которая идет в сторону образования исходных веществ. |
Контрольные вопросы для повторения и самопроверки к лекции «Химическое равновесие и способы его смещения».
Какие реакции называются обратимыми?
Что такое химическое равновесие?
С помощью, каких параметров можно сместить химическое равновесие?
Сформулируйте принцип Ле-Шателье.
Когда можно применять давление для смещения равновесия?
§16. Обратимость химической реакции. Химическое равновесие и способы его смещения
§16. Обратимость химической реакции. Химическое равновесие и способы его смещения
1. Какие реакции называют необратимыми? Приведите примеры таких реакций из органической и неорганической химии, запишите их уравнения.
Необратимыми называются химические реакции, в результате которых исходные вещества полностью превращаются в конечные продукты (например, реакции горения или обмена, протекающие в соответствии с правилом Бертолле):
2. Какие реакции называют обратимыми? Что такое химическое равновесие? Как его сместить?
Какие реакции называют обратимыми? Что такое химическое равновесие? Как его сместить?
Обратимыми называются химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном. Состояние обратимого процесса, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием. Сместить равновесие можно, если изменить температуру, давление или равновесную концентрацию веществ.
3. Дайте характеристику реакции синтеза оксида серы (VI) из оксида серы (IV) и кислорода. Рассмотрите, как нужно измерить концентрацию веществ, давление и температуру, чтобы сместить равновесие вправо.
4. Для смещения равновесия в реакции синтеза аммиака вправо необходимо понизить температуру. Почему же на производстве этот процесс проводят при достаточно высокой температуре 500 — 550°С?
Согласно правилу Вант-Гоффа, если проводить реакцию при низкой температуре, то ее скорость уменьшается. Поэтому при синтезе аммиака была выбрана оптимальная температура, чтобы поддерживать и скорость и сместить равновесие.
Поэтому при синтезе аммиака была выбрана оптимальная температура, чтобы поддерживать и скорость и сместить равновесие.
5. Как нужно изменить концентрацию веществ, температуру и давление синтеза йодоводорода: , чтобы сместить равновесие вправо?
Увеличивать концентрацию водорода и йода, давление никак не влияет (из 2 молей смеси получается 2 моль продукта), температуру необходимо уменьшить.
6. Выберите уравнения обратимых реакций, в которых изменение давления не вызовет смещения химического равновесия:
Б) (нет газообразных веществ) и В) (4 моля водяного пара и 4 моля водорода, т.е. объем газообразных исходных веществ равен объему продуктов).
7. Что служит сырьем для синтеза аммиака? Назовите источники этого сырья.
8. Используя свои знания по биологии и неорганической химии, охарактеризуйте народнохозяйственное значение аммиака.
Химическое равновесие смещение — Справочник химика 21
Смещение химического равновесия. Состояние химического равновесия сохраняется при данных условиях любое время. При изменении же условий равновесие нарушается. Влияние, оказываемое на равновесную систему каким-либо внешним воздействием (изменение концентрации реагентов, давления, температуры), можно предсказать, пользуясь принципом Ле Шателье. Согласно этому принципу, если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия. При нагревании равновесие смещается в сторону эндотермического процесса, при повышении давления — в сторону процесса, идущего с уменьшением объема.
Состояние химического равновесия сохраняется при данных условиях любое время. При изменении же условий равновесие нарушается. Влияние, оказываемое на равновесную систему каким-либо внешним воздействием (изменение концентрации реагентов, давления, температуры), можно предсказать, пользуясь принципом Ле Шателье. Согласно этому принципу, если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия. При нагревании равновесие смещается в сторону эндотермического процесса, при повышении давления — в сторону процесса, идущего с уменьшением объема. Применение метода абсорбционной спектроскопии не ограничивается только определением концентраций веществ. В результате поглощения излучения энергия систем з1 меняется настолько незначительно, что это не приводит обычно к нарушению целостности молекул поглощающего вещества.
 Однако в результате смещения химического равновесия в растворе под влиянием различных факторов его поглощающие свойства могут изменяться весьма значительно. На этом основано применение метода абсорбционной спектроскопии для изучения равновесий в растворах, реакций гидролиза и полимеризации, определения состава комплексных соединений, их констант устойчивости и т. п. . В данной главе рассматривается только метод абсорбционной спектроскопии как один из методов количественного анализа. [c.458]
Однако в результате смещения химического равновесия в растворе под влиянием различных факторов его поглощающие свойства могут изменяться весьма значительно. На этом основано применение метода абсорбционной спектроскопии для изучения равновесий в растворах, реакций гидролиза и полимеризации, определения состава комплексных соединений, их констант устойчивости и т. п. . В данной главе рассматривается только метод абсорбционной спектроскопии как один из методов количественного анализа. [c.458]Определение направления смещения химического равновесия и вычисление равновесных концентраций после смещения равновесия [c.18]
Смещение химического равновесия. Принцип Ле Шателье. Еслн система находится в состоянии равновесия, то она будет пре бывать в нем до тех пор, пока внешние условия сохраняются пО стоянными. Если же условия изменятся, то спстема выйдет из равновесия — скорости прямого н обратного процессов изменятся неодинаково — будет протекать реакция.
Смещение химического равновесия при изменении внешних условий проведения реакции (давления и температуры) [c.138]
Смещение ионных равновесий. Равновесие в растворах электролитов, как и всякое химическое равновесие, сохраняется неизменным, пока определяющие его условия не меняются изменение условий влечет за собой нарушение равновесия. [c.253]
Смещение химического равновесия. Принцип Ле Шателье 187 [c.187]
Принцип Ле Шателье распространяется ие только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов как кипение, кристаллизация, растворение происходит в соответствии с принципом Ле Шателье. [c.190]
Изучение химического равновесия имеет большое значение как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. При окончательном выборе условий проведения процесса учитывают также их влияние на скорость процесса. Необходимы такие условия, чтобы достигался максимально возможный выход продукта (смещение химического равновесия) при наибольшей скорости процесса его образования. [c.181]
Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. При окончательном выборе условий проведения процесса учитывают также их влияние на скорость процесса. Необходимы такие условия, чтобы достигался максимально возможный выход продукта (смещение химического равновесия) при наибольшей скорости процесса его образования. [c.181]
Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта. Степень смещения равновесия определяется в е л и ч и н о й теплового эффекта чем больше ДЯ, тем значительное влияние температуры наоборот, если ДЯ близко к нулю, то температура практически не влияет на равновесие. Хотя, как уже отмечалось, тепловые эффекты с температурой меняются незначительно, но для химического равновесия в очень широком интервале температур следует принимать во внимание возможное изменение ДЯ.

Как известно, при постоянных внешних условиях (концентрация, температура и давление) химическое динамическое равновесие может сохраняться как угодно долго. Изменение хотя бы одного из указанных факторов немедленно ведет к нарушению равновесия, смещая его в ту или иную сторону. В опытах 44 и 45 демонстрируется смещение химического равновесия под влиянием температуры, в опыте 46 показано влияние концентрации вещества на состояние химического равновесия. Смещение химического равновесия под влиянием освещения представлено в опыте 47. [c.101]
Скорость химической реакции и влияние на нее концентрации и температуры, Необратимые и обратимые реакции. Концентрация и действующая масса. Закон действия масс. Константа химического равновесия. Смещение химического равновесия в зависимости от различных факторов. Принцип Ле-Шателье Скорость гетерогенных реакций и влияние поверхности твердой фазы. Катализ. [c.66]
Смещение химического равновесия в зависимости от различных факторов. Принцип Ле-Шателье Скорость гетерогенных реакций и влияние поверхности твердой фазы. Катализ. [c.66]
Пользуясь принципом подвижного равновесия (см. стр. 155), нетрудно установить качественное правило смещения химического равновесня с изменением температуры. В соответствии с этим принципом при повышении температуры ЬТ смещение равновесия должно сопровождаться увеличением энтропии так как (8Т)р(А5)т.>0, т. е. химическое равновесие при повышении температуры должно сместиться в сторону эндотермической реакции (в том направлении, в котором протекает эндотермическая реакция), а при понижении температур ы—в том направлении, в котором протекает экзотермическая реакция.
Переход системы из одного равновесного состояния в другое, наступающее вследствие изменения условий, называется смещением химического равновесия. Смещение равновесия в зависимости от изменения концентрации реагирующих веществ, температуры, давления (в случае газовых реакций) подчиняется принципу Ле Шатал ь е если изменить одно из условий, при котором система находится в равновесии, например температуру, давление, концентрацию, то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению, т.
Вопросы химической термодинамики 185—210, 379, 522, 621, 645, 786, 868, 906, 961, 962, 965, 986. Равновесие, смещение равновесия, константа равновесия 105, 106, 125, 211—276, 306—333, 345, 346, 360—362, 373-379, 394, 401—406, 411, 492—510, [c.180]
Это смещение равновесия и ослабит влияние произведенного воздействия. В самом деле, если газовая смесь находится в условиях, когда к ней применимы законы идеальных газов, то при отсутствии смещения химического равновесия для повышения давления в два раза требовалось бы уменьшить объем тоже в два раза. Однако при образовании аммиака общее число молей газа сокращается, и поэтому уменьшение объема в два раза приводит к повышению давления не в два раза, а в меньшей степени. [c.238]
Энергетика химических превращений. Внутренняя энергия. Энтальпия. Энтальпия образования. Закон Гесса. Термохимические расчеты. Направление химических реакций.
Эти же качественные выводы о влиянии температуры на химическое равновесие могут быть получены из общего принципа смещения равновесия, сформулированного Ле Шателье и Брауном. Если на систему, находящуюся в устойчивом равновесии, оказывать воздействие извне, изменяя какое-нибудь из условий, определяющих положение равновесия, например температуру, то в системе усилится то из направлений процесса, протекание которого ослабляет влияние произведенного воздействия. [c.256]
Выделяется этап в развитии химии, который характеризуется возникновением (конец XIX в.) и развитием учения о химическом процессе — о его принципиальной возможности и условиях протекания. Это было вызвано резким возрастанием потребностей и масштабов производства продуктов химической переработки нефтяного сырья. Учение о химическом процессе рассматривает энергетику химических процессов, химическое равновесие и условия его смещения, кинетику и механизмы реакций и т. д. [c.6]
Это было вызвано резким возрастанием потребностей и масштабов производства продуктов химической переработки нефтяного сырья. Учение о химическом процессе рассматривает энергетику химических процессов, химическое равновесие и условия его смещения, кинетику и механизмы реакций и т. д. [c.6]
Смещение. химического равновесия при изменении температуры удобнее всего проанализировать, рассмотрев температурную зависимость константы химического равиовесия (на примере константы Кр). [c.146]
Вторая причина непостоянства е связана со смещением химического равновесия (например, с диссоциацией комплексного соединения), и именно потому можно использовать спектрофотометрические методы.для изучения равновесий в растворах. [c.48]
Переход системы из одного равновесного состояния в другое, отличающееся от первого концентрациями участвующих в реакции веществ и скоростями реакций, называется сдвигом (смещением) химического равновесия. [c.12]
[c.12]
Изменение степет1 превращения водяного пара в рассматриваемой реакции очевидным образом зависит от состояния равновесия реакционной системы сдвиг равновесия вправо (увеличение доли, приходящейся на СО и ГЬ н равновесной газовой смеси) повыщает степень превращения, сд[ иг влево (увеличение доли Н2О) понижает ее. Следов зтелыю, выбранный Вами ответ означает, что одновременное возрастание температуры н снижение давления сопровождаются смещением химического равновесия влево. [c.158]
В результате смещения химического равновесия вправо концентрации всех веществ изменяются. В состоянии нового равновесия концентрации продуктов реакции увеличатся, а исходных веществ уменьшатся по сравнению со значениями концентраций соответствующих веществ в состоянии первоначального равновесия. [c.19]
Реакции без изменения состояния окисления элементов чаще всего протекают в газовых и жидких растворах с участием ионов. Как известно, ионные реакции обратимы, и теоретически каждой системе ионов при данных условиях отвечает определенное состояние равновесия. Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
Смещение химического равновесия (иногда практически нацело) происходит при уменьшении концентрации каких-либо ионов за счет образования относительно мало ионизирующихся молекул или комплексных ионов малорастворимых или летучих соединений правило Бертолле). Так, в реакции нейтрализации ионное равновесие смещается в сторону образования мало ионизирующихся молекул растворителя, например в водном растворе [c.207]
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается, В результате преимущественного протекания реакции в одном из возможных направлений устананливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения нодчиняется принципу Ле Шателье [c. 97]
97]
В развитии термодинамической теории равновесий, в частности равновесий в химических реакциях (гомогенных и гетерогенных), выдающаяся роль принадлежит работам В. Гиббса (1873—1878) и Ле-П1ателье, который открыл (1885) общий принцип смещения равновесий при изменении внешних условий. Термодинамическая теория химических равновесий получила развитие в работах Вант-Гоффа. Им же была разработана количественная теория разбавленных растворов (1886). [c.17]
Уравнение изобары химической реакции позволяе» выявить характер влияния xeMnqiaTypbi иа величину и иа направление смещения химического равновесия [c.35]
Закономерности, которые наблюдаются при смещении химических равновесий, охватываются общим принципом, называемым принципом Ле Шателье. Этот прннцип, распространяющийся также и н фазовые и вообш,е на любые равнозесня, формулируется следующим образом [c.103]
На какой реакции основано удаление бромида серебра при закреплении изображений на фотоматериале Объясните растворение соли, используя преук тавление о произведении растворимости и смещении химического равновесия. « [c.147]
« [c.147]
Смещение химического равновесия – методическая разработка для учителей, Сидоренко Инна Игоревна
|
Цель урока: |
Все учащиеся смогут сформулировать принцип Ле Шателье–Брауна. Большинство учащихся смогут объяснить смещение химического равновесия при изменениях температуры, концентрации и давления в системе. Некоторые учащиеся решат экономические задачи на основе принципа Ле Шателье. |
|
Критерии оценки: |
· Смогут объяснить смысл принципа химического равновесия. · Перечислят условия смещения химического равновесия. · Применят принцип для решения экономических задач. |
|
Языковые цели: |
Понятийный словарь «Атомы. — устно объяснить, что атом является мельчайшей частицей химического элемента. |
|
Привитие ценностей: |
— умение работать и уважение друг к другу при групповой работе; — развивать умение сравнивать, сопоставлять и обобщать; — учиться проявлять самостоятельность в разных видах деятельности; — честность, умение аргументировать и открытость при оценивании работы учащихся. |
|
Межпредметная связь: |
Экономика, физика. |
|
Предшествующие знания: |
Скорость (Физика, 7 класс). |
Ход урока
|
Запланированные этапы урока |
Запланированная деятельность на уроке |
Ресурсы |
|
Начало урока 2 мин
6 мин |
Приветствие класса. Позитивный настрой, создание благоприятного психологического климата в стратегии «Круг радости» 1. Повторение пройденного материала: Чтобы проверить, как вы усвоили материал прошлого урока «химическое равновесие», мы с вами сыграем в лотерею. У меня в коробке лежат лотереи с вопросами (разного цвета для дальнейшего деления на группы), вы должны выбрать себе один и ответить на вопрос. За правильный ответ – 1 балл. Если вы считаете, что не справитесь с ответом, можете передать свой вопрос другому, но берете следующий (зеленый – вопросы на знание и понимание, желтый – применение, красный – анализ и синтез, синий – творческие вопросы) Приложение 1. Посмотрите на бутылку с газированной водой. Наблюдаем ли мы признаки каких-либо химических процессов, пока бутылка закрыта? Нет. А что же на самом деле происходит? (Опережающее задание для одного учащегося – сообщение) Приложение 2. Что произойдет, когда мы начнем открывать бутылку? Нарушили ли мы равновесие? Скорость какой реакции возросла? Какие факторы влияют на смещение равновесия? В случае возникновения затруднений учитель помогает учащимся вспомнить факторы, влияющие на скорость химической реакции. Какова тема нашего урока? (тему и цели учащиеся формулируют самостоятельно). Далее учитель нацеливает учащихся на «открытие»: смещение равновесия подчиняется общей закономерности, которую можете установить. Форма деятельности (фронтальная беседа) |
Лотереи разного цвета
Бутылка газировки |
|
Середина урока
7 минут
10 мин
8 мин |
2. Форма деятельности: (групповая работа). Оценивание (комментарий учителя)
Сейчас каждая пара (группа) получает задание: изучить влияние одного из факторов на смещение равновесия. В распоряжении группы учебная литература, таблица (приложение 3), химические реактивы и «виртуальная лаборатория». На выполнение работы 5–7 минут и 2–3 минуты на выступление спикера групп или пар (приложение 4) Задание для 1 группы (желтый) Влияние изменения температуры. 1. Прочитайте раздел: «Влияние изменения температуры» параграфа «Химическое равновесие» и ответьте на вопросы: В какую сторону смещается химическое равновесие при увеличении температуры в экзотермической реакции? В какую сторону смещается химическое равновесие при уменьшении температуры в экзотермической реакции? В какую сторону смещается химическое равновесие при увеличении температуры в эндотермической реакции? В какую сторону смещается химическое равновесие при уменьшении температуры в эндотермической реакции? 2. В пробирку с крахмальным клейстером добавьте 2–3 капли раствора йода. Что наблюдаете? Нагрейте пробирку. Что вы наблюдаете? Охладите пробирку. Что вы наблюдаете? (С6Н10О5)n + mJ2 = (C6H10O5)*mJ2 + Q Крахмал синий цвет Что вы наблюдаете при нагревании? В какую сторону сместится равновесие? Что вы наблюдаете при охлаждении? В какую сторону сместится равновесие? Сформулируйте вывод. Задание для 2 группы (зеленый) Влияние изменения давления. 1. Прочитайте раздел «Влияние изменения давления» параграфа «Химическое равновесие» и ответьте на вопросы: В какую сторону смещается химическое равновесие при увеличении давления? В какую сторону смещается химическое равновесие при уменьшении давления? 2. 3H2+ N2 2NH3 Что вы наблюдаете при увеличении давления? В какую сторону смещается равновесие? Что вы наблюдаете при уменьшении давления? В какую сторону смещается равновесие? Сформулируйте вывод. Задание для 3 группы (красный) Влияние изменения концентрации веществ. 1. Прочитайте раздел «Влияние изменения концентрации веществ» параграфа «Химическое равновесие» и ответьте на вопросы: В какую сторону смещается химическое равновесие при увеличении концентрации реагирующих веществ? В какую сторону смещается химическое равновесие при увеличении продуктов реакции? С реагента прямой реакции, где это вещество расход. 2. При помощи компьютерной программы «Виртуальная лаборатория» bilimland.kz смоделируйте химическую реакцию: синтеза аммиака. Рассмотрите влияние концентрации на смещение химического равновесия. Задание для 4 группы (синий) Решение экономических задач. 1. В нормально действующей экономике должно существовать равновесие между общей суммой находящихся в обращении денег и товаром, который можно купить на эти деньги. Если денег напечатано больше, что произойдет? (Предполагаемый ответ: В строгом соответствии с принципом Ле Шателье, равновесие между товаром и деньгами будет смещаться таким образом, чтобы ослабить удовольствие граждан от обладания большим количеством денег. А именно, цены на товары и услуги вырастут, и тем самым будет достигнуто новое равновесие) 2. В Ижевске было решено избавиться от постоянных пробок путем расширения магистралей и строительства транспортных развязок. (Предполагаемый ответ: В соответствии с принципом Ле Шателье, равновесие между машинами и магистралью будет смещаться таким образом, что количество машин на этих развязках начнет увеличиваться и тем самым будет достигнуто новое равновесие, увеличение магистралей – увеличение машин) Отчет каждой группы или пары.
Применение новых знаний и умений на практике. Лабораторный опыт №4 Выполните лабораторный опыт по инструкции: 3КСNS + FeCI3 = Fe(CNS)3+ 3KCI Бесц. Желт. Крас. Бесц. В стаканчик с 30 мл воды добавьте 2 капли концентрированных растворов роданида калия и хлорида железа(3) Что наблюдаете? Разлейте раствор в 4 пробирки. Добавьте: В 1-ю пробирку 1–2 капли раствора КСNS Раствор становится _________ Равновесие смещается________ В 2-ю пробирку 1–2 капли раствора FeCI3 Раствор становится_________ Равновесие сместилось________ В 3-ю пробирку – кристалл КCI Раствор становится_______ Равновесие смещается________
Фронтальна проверка (1 балл за правильный ответ – 6 баллов всего) Выполнение задания по материалам сайта, урок «химическое равновесие». Задания индивидуальны для каждого учащегося. За правильный ответ – 1 балл, всего 4 балла за задание. Задания индивидуальны для каждого учащегося. За правильный ответ – 1 балл, всего 3 балла за задание. Выводы по уроку. Итог урока для каждого ученика, оценочный лист и соответствие баллов с оценкой. (приложение 5). |
Оборудование и реактивы для лабораторной работы
https://bilimland.kz/ru/courses/simulyaczii/ximiya/lesson/princzip_le_shatele_ smeshenie_ximicheskogo_ravnovesiya_na_primere_sinteza_ammiaka
https://bilimland. smeshenie_ximicheskogo_ravnovesiya_na_primere_sinteza_ammiaka
Оборудование и реактивы для лабораторной работы
Для учащихся затрудняющихся в выполнении лабораторного опыта воспользоваться https://bilimland.kz/ru/courses/chemistry-ru/obshaya-ximiya/osnovnye-zakonomernosti-protekaniya-ximicheskix-reakczii/ximicheskoe-ravnovesie/lesson/faktory-vliyayushie-na-ximicheskoe-ravnovesie для анализа видео и выводов
https://bilimland.
|
|
Конец урока 5 мин |
Рефлексия. В заключении я предлагаю осмыслить пройденный путь, свою деятельность на уроке. Каков результат? Как вы к нему пришли? Если вы столкнетесь с проблемами, что вы будете делать? Довольны ли вы сегодня своей работой? Что в следующий раз будете делать по-другому? Домашнее задание: (по выбору учащегося) параграф 3.11, стр .106, упр.5 Эссе: Какие равновесные процессы в природе уже нарушены и какие меры необходимо предпринять для их восстановления? Экономическая задача (приложение 6) Заключение Поняв всю ценность полученных знаний о равновесии и условиях его смещения, вы сможете использовать их во благо. А мне остается пожелать вам душевного равновесия! Для выявления эмоционального состояния учащихся используются смайлики. |
|
Приложение 1.
Вопросы для лотереи «Химическое равновесие»
Знание и понимание (зеленый)
- Какие реакции называются обратимыми?
- Какие реакции называются необратимыми?
- Когда возникает химическое равновесие?
- Что такое химическое равновесие?
- Дайте определение константы химического равновесия.
Применение (желтый)
- Какие параметры могут быть равны при установлении химического равновесия в обратимых реакциях?
- По каким признакам вы определите, что реакция необратима?
- Какой раздел химии изучает скорость и механизм химических реакций?
- Как влияет природа реагирующих веществ на скорость реакций? Приведите пример.

- От каких факторов зависит скорость химической реакции?
Анализ (красный)
- Проанализировать, где на практике могут быть вами использованы знания законов химической кинетики.
- Зависит ли скорость реакции твердых тел между собой от концентрации?
- Сравнить зависимость константы равновесия от природы реагирующих веществ и от концентрации (не зависит от концентрации).
- Придумайте задачу по теме «химическое равновесие».
- Сравните зависимость константы равновесия от температуры и от катализатора (не зависит от катализатора).
Творческий (Синий)
- Для чего нужны холодильники (ответить в свете знаний о скорости реакции)?
- Изобразите состояние химического равновесия пантомимой.
- Сравните движение машин в свете химической кинетики.
- Предложите способы лучшего усвоения темы «химическое равновесие и скорости химической реакции».

Приложение 2.
На самом деле одновременно идут как минимум 2 химических процесса, протекающих на микроуровне:
- CO2+ H2O H2CO3 СО2 + Н2О Н2СО3
- H2CO3 CO2+ H2O
V1 = k1c(CO2) (H2O) по закону действующих масс
V2 = k2c(H2CO3) V1 = V2
Состояние равновесия характеризуется константой равновесия.
Крав = к1 = [В]
к2 [А] [Б]
[А], [B], [Б] – равновесные концентрации веществ А, Б, В.
Константа равновесия – величина постоянная для данной обратимой реакции. Она показывает соотношение между концентрациями продуктов реакции и исходных веществ, которое устанавливается при равновесии.
Химическое равновесие отличается от механического, оно является динамичным (подвижным). При его наступлении реакции не прекращаются, неизменными остаются лишь концентрации компонентов, то есть за единицу времени образуется такое же количество продуктов реакции, какое превращается в исходные вещества. Если изменение условий не происходит, то состояние равновесия может продолжаться бесконечно долго.
Приложение 3
Приложение 4
Задание для 1 группы (желтый)
Влияние изменения температуры.
- Прочитайте раздел: «Влияние изменения температуры» параграфа «Химическое равновесие» и ответьте на вопросы:
В какую сторону смещается химическое равновесие при увеличении температуры в экзотермической реакции?
В какую сторону смещается химическое равновесие при уменьшении температуры в экзотермической реакции?
В какую сторону смещается химическое равновесие при увеличении температуры в эндотермической реакции?
В какую сторону смещается химическое равновесие при уменьшении температуры в эндотермической реакции?
- Выполните лабораторный опыт по инструкции.

В пробирку с крахмальным клейстером добавьте 2–3 капли раствора йода.
Что наблюдаете?
Нагрейте пробирку. Что вы наблюдаете?
Охладите пробирку. Что вы наблюдаете?
(С6Н10О5)n + mJ2= (C6H10O5)*mJ2 + Q
Крахмал синий цвет
Что вы наблюдаете при нагревании? В какую сторону сместиться равновесие?
Что вы наблюдаете при охлаждении? В какую сторону сместиться равновесие?
Сформулируйте вывод.
Задание для 2 группы (зеленый)
Влияние изменения давления.
- Прочитайте раздел «Влияние изменения давления» параграфа «Химическое равновесие» и ответьте на вопросы:
В какую сторону смещается химическое равновесие при увеличении давления?
В какую сторону смещается химическое равновесие при уменьшении давления
- При помощи компьютерной программы «Виртуальная лаборатория» смоделируйте химическую реакцию:
Что вы наблюдаете при увеличении давления? В какую сторону смещается равновесие?
Что вы наблюдаете при уменьшении давления? В какую сторону смещается равновесие?
Сформулируйте вывод.
Задание для 3 группы (красный)
Влияние изменения концентрации веществ.
- Прочитайте раздел «Влияние изменения концентрации веществ» параграфа «Химическое равновесие» и ответьте на вопросы:
В какую сторону смещается химическое равновесие при увеличении концентрации реагирующих веществ?
В какую сторону смещается химическое равновесие при увеличении продуктов реакции?
С реагента прямой реакции, где это вещество расход.
- При помощи компьютерной программы «Виртуальная лаборатория» смоделируйте химическую реакцию: синтез аммиака. Рассмотрите влияние концентрации на смещение химического равновесия.
Задание для 4 группы (синий)
Решение экономических задач.
- В нормально действующей экономике должно существовать равновесие между общей суммой находящихся в обращении денег товаром, который можно купить на эти деньги.
 Если денег напечатано больше, что произойдет?
Если денег напечатано больше, что произойдет? - В Ижевске было решено избавиться от постоянных пробок путем расширения магистралей и строительства транспортных развязок. На некоторое время это помогло. Но что произошло впоследствии?
Приложение 5. Оценочный лист.
|
Этапы урока |
Баллы — max |
итог |
оценка |
|
Лотерея |
1 балл |
|
17–15 баллов «5» 14–11 баллов «4» 10–8 баллов «3» 7 баллов и менее «2» |
|
Групповая работа |
3 балла |
|
|
|
Лабораторная работа |
6 балла |
|
|
|
Смещение от концентрации |
4 балла |
|
|
|
Смещение от температуре |
3 балла |
|
Приложение 6.
Экономическая задача Д.З.
Объяснить динамический характер химического равновесия. Воспользуйтесь для этого методом аналогий.
Представим себе крупный супермаркет, занимающий двухэтажное здание. В нижнем этаже находятся служебные помещения, автостоянка и камера хранения. На втором этаже – торговый зал. Оба этажа связаны эскалаторами. Поскольку главный процесс – покупка – происходит на втором этаже, то уподобим поток покупателей по эскалатору, работающему на подъем, прямой реакции, а возвращение по второму эскалатору – обратной реакции.
Начало рабочего дня. Первые покупатели поднимаются в торговый зал, поток их все увеличивается, но обратного движения пока нет, поскольку никто еще не успел сделать покупки. Аналогия: в начале обратимой реакции идет прямой процесс, а обратный – практически нет. Со временем обратный поток покупателей начинает увеличиваться, и к середине рабочего дня потоки покупателей по обоим эскалаторам выравниваются. Устанавливается своего рода равновесие: численность покупателей в торговом зале практически не меняется, хотя ежеминутно происходит обновление. Этот пример убедительно показывает, что равновесие не означает прекращения процесса, ведь оба эскалатора работают бесперебойно.
Этот пример убедительно показывает, что равновесие не означает прекращения процесса, ведь оба эскалатора работают бесперебойно.
Покажем с помощью этой модели, как влияют на равновесие внешние условия. Допустим, что в торговом зале на втором этаже объявили распродажу с большими скидками. Это сразу же привлечет множество новых покупателей, которые ринутся вверх по эскалатору. Концентрация покупателей в торговом зале резко увеличится. Однако через какое-то время все они начнут возвращаться обратно, и постепенно потоки по обоим эскалаторам (т. е. скорости прямой и обратной реакций) вновь выровняются. Вновь наступит равновесие, и концентрация покупателей в торговом зале снова станет стабильной, но большей, чем до объявления распродажи.
Таким образом, состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях. Как только эти условия изменяются, система переходит из одного состояния равновесия в другое.
Учебное задание на тему «Химическое равновесие.
 Условия его смещения»
Условия его смещения»
Химическое равновесие. Условия его смещения
1. Дано уравнение обратимой химической реакции: С4Н10(тв.) ↔ С4Н6(г.) + 2Н2(г.) – Q
В какую сторону будет смещаться химическое равновесие при: а) понижении температуры; б) уменьшении давления; в) уменьшении концентрации водорода?
2. Метанол получают по уравнению:
СО(г.) + 2Н2(г.) ↔ СН3ОН(г.) + Q
Можно ли получить метанол, если реакцию вести при пониженном давлении и высокой температуре? Какие условия для проведения этой реакции предложите вы? Поясните ответ.
3. Дано уравнение обратимой
химической реакции: С2Н4(г. ) + Н2О(г.) ↔
С2Н5ОН(г.) + Q
) + Н2О(г.) ↔
С2Н5ОН(г.) + Q
Укажите условия, которые вызывают смещение химического равновесия в сторону реакции образования спирта. Поясните ответ.
4. Как повлияет повышение температуры и понижение давления на равновесие в следующих реакциях? а) 2NO(г.) + Cl2(г.) ↔ 2NOCl(г.) + Q
б) N2O4(г.) ↔ 2NO2(г.) – Q
5. Каким образом можно нарушить равновесие и сместить его в сторону образования продуктов реакции в данном процессе:
3H2(г.) + N2(г.) ↔ 2NH3(г.) + 92,4 кДж
6. Реакция, в которой повышение давления смещает равновесие вправо, — это:
а) CO2(г.) + 2SO2(г.) ↔ CS2(г.) + 4O2(г. )
)
б) 2NO(г.) ↔ N2(г.) + O2(г.)
в) C2H2(г.) ↔ 2C(т.) + H2(г.)
г) 4FeS2(т.) + 11O2(г.) ↔ 2Fe2O3(т.) + 8SO2(г.)
7. Выход продукта реакции СО2(г.) + С(т.)↔ 2СО(г.) – Q можно увеличить: а) добавлением углерода; б) нагреванием; в) введением катализатора; г) повышением давления
Химическое равновесие | himiyaklas.ru
Обратимые реакции – это реакции, протекающие одновременно при одинаковых условиях и в прямом и в обратном направлении.
Например, взаимодействие азота и водорода:
И при этих же условиях идет реакция распада аммиака:
Это обратимая реакция. Для обозначения обратимости реакции ставят две реакционные стрелки в противоположенных направлениях:
У обратимых реакций есть свои особенности. Рассмотрим на этом же примере: синтезе аммиака.
В самом начале синтеза скорость прямой реакции максимальна. Так как концентрация исходных веществ (N2 и H2) максимальна. Но параллельно с этим, по мере образования продукта (NH3), начинает возрастать скорость обратной реакции, ведь концентрация аммиака все больше и больше.
Концентрации исходных веществ падают, концентрация продукта растет. Скорость прямой реакции снижается, скорость обратной реакции повышается. И рано или поздно «они догонят друг друга». Рано или поздно скорость прямой реакции станет равной скорости обратной реакции:
За одно и то же время образуется столько же продукта, сколько его распадается. Потому что скорость синтеза равна скорости распада. И ничего не прибавляется, и не убавляется. Такое состояние называется химическим равновесием.
Потому что скорость синтеза равна скорости распада. И ничего не прибавляется, и не убавляется. Такое состояние называется химическим равновесием.
В состоянии химического равновесия концентрации веществ не меняются: исходных веществ затрачивается столько же, сколько образуется при распаде. И то же самое с продуктами реакции.
Поэтому обратимые реакции никогда не идут до конца. Но в промышленности такое никуда не годится, необходимо добиться как можно большего выхода продуктов. И есть способы смещения химического равновесия.
Все эти способы работают по одному принципу. И принцип этот носит имя его открывателя: Анри Луи Ле Шателье.
Принцип Ле Шателье гласит: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в сторону, компенсирующую это воздействие.
Звучит, может быть, сложно, но на самом деле эта тема – самое легкое, что есть в школьном курсе химии. Нужно только один раз разобраться.
- Изменение концентрации веществ.

Система находится в равновесии. И тут мы, например, добавляем туда исходное вещество: система будет стараться сохранить равновесие. Поэтому увеличивается скорость реакции, уменьшающая концентрацию этого вещества:
Если увеличиваем концентрации исходных веществ (H2 и N2), то увеличивается скорость прямой реакции, так как она понижает их концентрацию (чтобы равновесие поддерживалось).
Если увеличить концентрацию продукта (NH3), то увеличится скорость обратной реакции, чтобы понизить концентрацию продукта.
Для повышения скорости прямой реакции нужно:
- Повышать концентрацию исходных веществ.
- Понижать концентрацию продуктов (удаляя их из системы).
- Изменение температуры.
Прямая и обратная реакции всегда противоположены по тепловому эффекту. Если одна идет с выделением тепла (+Q)? называется экзотермической – экзо: наружу, то обратная обязательно протекает с поглощением тепла (– Q), называется эндотермической – эндо: внутрь.
Это вполне логично, что в одну сторону реакция забирает тепло, а в другую отдает его обратно.
При повышении температуры будет увеличиваться скорость эндотермической реакции. Нагреваем систему, нужно охладить. Запускается «охлаждающая» эндотермическая реакция, поглощающая тепло.
При понижении температуры увеличивается скорость экзотермической реакции, систему охладили, запускается «согревающая» экзотермическая реакция.
- При повышении температуры, равновесие смещается в сторону эндотермической реакции.
- При понижении температуры, равновесие смещается в сторону экзотермической реакции.
- Изменение давления.
Изменение давление может повлиять на химическое равновесие только в том случае, если соблюдаются оба следующих условия:
- Хотя бы один из участников химического процесса – газ.
- В ходе реакции изменяется объем газовой фазы.
Мы знаем, что 1 моль любого газа при одинаковых условиях занимает один и тот же объем (при нормальных условиях это 22,4л). А коэффициенты в уравнении показывают соотношение молей реагирующих веществ.
А коэффициенты в уравнении показывают соотношение молей реагирующих веществ.
По реакции мы видим, что газообразные исходные вещества (азот и водород) занимают объем 1 + 3 = 4 единиц объема. А газообразный продукт реакции (аммиак) занимает две единицы объема.
Повысим давление, и равновесие сместится в ту сторону, которая его понизит: то есть где меньше объемов газа. В нашем случае в сторону продуктов.
Понизим давление, равновесие сместится в сторону, повышающую давление, то есть увеличивающую объем газообразной фазы, в нашем случае в сторону исходных веществ.
- При повышении давления равновесие будет смещаться в ту сторону, где объем газообразной фазы меньше.
- При понижении давления равновесие вместится туда, где объемов газа меньше.
Важно помнить, что в расчет нужно брать только газообразные вещества. В реакции:
Изменение давление никак не повлияет на химическое равновесие, потому что слева столько же объемов газа, сколько и справа. То есть объем в ходе реакции не меняется.
То есть объем в ходе реакции не меняется.
- Катализатор не влияет на химическое равновесие.
Как было сказано в предыдущем параграфе, если реакция обратима, то катализатор ускоряет как прямую, так и обратную реакцию. Соответственно, присутствие катализатора не смещает химическое равновесие, он лишь может ускорить время наступления равновесие.
Примеры.
Реакция:
| Чтобы сместить равновесие в сторону продуктов нужно: | Чтобы сместить равновесие в сторону исходных веществ нужно: |
| 1. Повысить концентрацию исходных веществ (азота и водорода). 2. Понизить концентрацию продукта (аммиака) удалением его из реакционной смеси. 3. Понизить температуру. 4. Повысить давление. | 1. Повысить концентрацию продукта (аммиака). 2. Понизить концентрацию исходных веществ (азота и водорода). 3. Повысить температуру. 4. Понизить давление. |
Реакция.
| Чтобы сместить равновесие в сторону продуктов нужно: | Чтобы сместить равновесие в сторону исходных веществ нужно: |
| 1. Повысить концентрацию исходных веществ (железной окалины и угарного газа). 2. Понизить концентрацию продуктов (FeO и углекислого газа). 3. Понизить температуру. | 1. Повысить концентрацию продуктов (FeO и углекислого газа). 2. Понизить концентрацию исходных веществ (железной окалины и угарного газа). 3. Понизить температуру. |
Реакция.
| Чтобы сместить равновесие в сторону продуктов нужно: | Чтобы сместить равновесие в сторону исходных веществ нужно: |
| 1. Повысить концентрацию исходного вещества (COCl2) 2. Понизить концентрацию продуктов (угарного газа и хлора). 3. Повысить температуру. 4. Понизить давление. | 1. Повысить концентрацию продуктов. 2. Понизить концентрацию исходных веществ. 3. Понизить температуру. 4. Повысить давление. |
Реакция.
| Чтобы сместить равновесие в сторону продуктов нужно: | Чтобы сместить равновесие в сторону исходных веществ нужно: |
| 1. Повысить концентрацию исходных веществ. 2. Понизить концентрацию продукта (удаляя его из реакционной смеси). 3. Понизить температуру. | 1. Повысить концентрацию продукта. 2. Понизить концентрацию исходных веществ. 3. Повысить температуру. |
Переподготовка работников образования — Документ
Ульяновский институт повышения квалификации и
переподготовка
работников образования.
Кафедра естествознания
Авторская работа
Тема: “Обратимые и необратимые реакции.
Химическое равновесие. Принцип Ле Шателье.
Работу выполнила:
Слушатель группы Х – 1
учитель химии МОУ СОШ №6
г. Димитровграда
Ульяновской области
Лепихова Татьяна Васильевна.
Научный руководитель:
Заведующий кафедрой
естествознания
Ахметов Марат Анварович
Ульяновск 2009
Обратимые и необратимые химические реакции.
Химическое равновесие.
Принцип Ле
Шателье.
Цель работы: 1) Изучение особенностей и закономерностей течения химических реакций, как продолжение формирования представлений о различных типах химичеких реакций по признаку обратимости.
2) Обобщение и конкретизация знаний о закономерностях химических реакций, формирование умений и навыков определять, объяснять особенности и, вытекающие из них условия, необходимые для протекания той или иной реакции. 3) Расширить и углубить знания о многообразии химических процессов, научить учащихся сравнивать, анализировать, объяснять, делать выводы и обобщения. 4) Рассмотреть этот раздел химической науки как важнейший в прикладном аспекте и рассмотреть представления о химическом равновесии-как частном случае единого закона природного равновесия, стремления к компенсации, устойчивости равновесия в единстве с основной формой существования материи, движении, динамики.
Задачи.
Рассмотреть тему: “Обратимые и необратимые реакции” на конкретных примерах, используя предшествующие представления о скорости химических реакций.

Продолжить изучение особенностей обратимых химических реакций и формирование представлений о химическом равновесии как динамичном состоянии реагирующей системы.
Изучить принципы смещения химического равновесия и научить учащихся определять условия смещения химического равновесия.
Дать представления учащимся о значении данной темы не только для химического производства, но и для нормального функционирования живого организма и природы в целом.
В природе, в
организмах живых существ, в процессе
физиологической деятельности человека,
в его действиях по созданию условий
различного уровня: бытовых, оборонных,
производственных, технических,
экологических и других-происходят или
осуществляются тысячи, миллионы
совершенно разных реакций, которые
можно рассматривать с разных точек
зрения и классификаций. Мы рассмотрим
химические реакции с точки зрения
обратимости и необратимости их.
Трудно переоценить значение этих понятий: сколько существует человек-человек думающий, столько же и бьётся человеческая мысль об обратимости и необратимости процессов, происхожящих в его организме, вечная проблема о продлении жизни человека, проблема о необратимости последствий его жизнедеятельности, бездумного отношения к природе.
Я хочу рассмотеть понятие обратимости и необратимости химических реакций, понятие о химическом равновесии и условиях его сдвига в “полезном” направлении. Представить теоретическую основу с последующей проверкой, самопроверкой знаний по этой теме, используя тестирования различной типологии. Предпологаю, что “пройдя путь” от простых к более сложным заданиям, учащиеся будут иметь чёткие, хорошие знания не только по этой теме, но и углубят знания по химии.
Химические
реакции-это явления, при которых одно
(или одни) вещества превращаются в
другие, доказательством этого являются
видимые и невидимые изменения. Видимые:
изменени цвета, запаха, вкуса, выпадение
осадка, изменение окраски индикатора,
поглощение и выделение тепла. Невидимые:
изменение состава вещества, которое
можно определить с помощью качественных
и аналитческих реакций. Все эти реакции
можно подразделить на два типа: обратимые
и необратимые реакции.
Невидимые:
изменение состава вещества, которое
можно определить с помощью качественных
и аналитческих реакций. Все эти реакции
можно подразделить на два типа: обратимые
и необратимые реакции.
Необратимые реакции. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много.
Если слить растворы кислоты и щелочи, образуется соль и вода, например,
HCl
+ NaOH = NaCl + H2O,
и если вещества были взяты в нужных
пропорциях, раствор имеет нейтральную
реакцию и в нем не остается даже следов
соляной кислоты и гидроксида натрия.
Если попытаться провести реакцию в
растворе между образовавшимися веществами
– хлоридом натрия и водой, то никаких
изменений не обнаружится. В подобных
случаях говорят, что реакция кислоты
со щелочью необратима, т.е. обратная
реакция не идет. Практически необратимы
при комнатной температуре очень многие
реакции, например,
В подобных
случаях говорят, что реакция кислоты
со щелочью необратима, т.е. обратная
реакция не идет. Практически необратимы
при комнатной температуре очень многие
реакции, например,
H2 + Cl2 = 2HCl, 2H2 + O2 = 2H2O и др.
Обратимые реакции. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Большинство реакций являются обратимыми. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
,
∆H = -46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В
уравнениях необратимых реакций между
левой и правой частями ставится знак
равенства или стрелка.
Многие реакции обратимы уже в обычных условиях, это означает, что в заметной степени протекает обратная реакция. Например, если попытаться нейтрализовать щелочью водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция нейтрализации до конца не идет и раствор имеет сильнощелочную среду. Это означает, что реакция HClO + NaOH NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением): RCOOH + R’OH RCOOR’ + H2O, многие другие процессы.
Как
и многие другие понятия в химии, понятие
обратимости во многом условно. Обычно
необратимой считают реакцию, после
завершения которой концентрации исходных
веществ настолько малы, что их не удается
обнаружить (конечно, это зависит от
чувствительности методов анализа). При
изменении внешних условий (прежде всего
температуры и давления) необратимая
реакция может стать обратимой и наоборот. Так, при атмосферном давлении и
температурах ниже 1000° С реакцию 2Н2
+ О2
= 2Н2О
еще можно считать необратимой, тогда
как при температуре 2500° С и выше вода
диссоциирует на водород и кислород
примерно на 4%, а при температуре 3000° С
– уже на 20%.
Так, при атмосферном давлении и
температурах ниже 1000° С реакцию 2Н2
+ О2
= 2Н2О
еще можно считать необратимой, тогда
как при температуре 2500° С и выше вода
диссоциирует на водород и кислород
примерно на 4%, а при температуре 3000° С
– уже на 20%.
В конце 19 в. немецкий физикохимик Макс Боденштейн (1871–1942) детально изучил процессы образования и термической диссоциации иодоводорода: H2 + I22HI. Изменяя температуру, он мог добиться преимущественного протекания только прямой или только обратной реакции, но в общем случае обе реакции шли одновременно в противоположных направлениях. Подобных примеров множество. Один из самых известных – реакция синтеза аммиака 3H2 + N22NH3; обратимы и многие другие реакции, например, окисление диоксида серы 2SO2 + O22SO3, реакции органических кислот со спиртами и т.д.
Реакцию
называют обратимой, если её направление
зависит от концентраций веществ —
участников реакции. Например, в случае
гетерогенно-каталитической реакции N2
+ 3h4 = 2Nh5 (1) при малой концентрации аммиака
в газовой си и больших концентрациях
азота и водорода происходит образование
аммиака; напротив, при большой концентрации
аммиака он разлагается, реакция идёт в
обратном направлении. По завершении
обратимой реакции, т. е. при достижении
равновесия химического, система содержит
как исходные вещества, так и продукты
реакции. Реакцию называют необратимой,
если она может происходить только в
одном направлении и завершается полным
превращением исходных веществ в продукты;
пример — разложение взрывчатых веществ.
Одна и та же реакция в зависимости от
условий (от температуры, давления) может
быть существенно обратима или практически
необратима. Простая (одностадийная)
обратимая реакция состоит из двух
происходящих одновременно элементарных
реакций, которые отличаются одна от
другой лишь направлением химического
превращения. Направление доступной
непосредственному наблюдению итоговой
реакции определяется тем, какая из этих
взаимно-обратных реакций имеет большую
скорость.
Например, в случае
гетерогенно-каталитической реакции N2
+ 3h4 = 2Nh5 (1) при малой концентрации аммиака
в газовой си и больших концентрациях
азота и водорода происходит образование
аммиака; напротив, при большой концентрации
аммиака он разлагается, реакция идёт в
обратном направлении. По завершении
обратимой реакции, т. е. при достижении
равновесия химического, система содержит
как исходные вещества, так и продукты
реакции. Реакцию называют необратимой,
если она может происходить только в
одном направлении и завершается полным
превращением исходных веществ в продукты;
пример — разложение взрывчатых веществ.
Одна и та же реакция в зависимости от
условий (от температуры, давления) может
быть существенно обратима или практически
необратима. Простая (одностадийная)
обратимая реакция состоит из двух
происходящих одновременно элементарных
реакций, которые отличаются одна от
другой лишь направлением химического
превращения. Направление доступной
непосредственному наблюдению итоговой
реакции определяется тем, какая из этих
взаимно-обратных реакций имеет большую
скорость. Например, простая реакция
N2O4 Û 2NO2 (2) складывается из элементарных
реакций N2O4?2NO2 и 2NO2 ?N2O4.Для обратимости
сложной (многостадийной) реакции,
например реакции (1), необходимо, чтобы
были обратимы все составляющие её
стадии.? М. И. Тёмкин.
Например, простая реакция
N2O4 Û 2NO2 (2) складывается из элементарных
реакций N2O4?2NO2 и 2NO2 ?N2O4.Для обратимости
сложной (многостадийной) реакции,
например реакции (1), необходимо, чтобы
были обратимы все составляющие её
стадии.? М. И. Тёмкин.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Химическое равновесие — состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа
равновесия зависит от температуры и
природы реагирующих веществ. Чем больше
константа равновесия, тем больше
равновесие сдвинуто в сторону образования
продуктов прямой реакции.
В состоянии равновесия молекулы не
перестают испытывать соударения, и
между ними не прекращается взаимодействие,
но концентрации веществ остаются
постоянными. Эти концентрации называются
равновесными.
Чем больше
константа равновесия, тем больше
равновесие сдвинуто в сторону образования
продуктов прямой реакции.
В состоянии равновесия молекулы не
перестают испытывать соударения, и
между ними не прекращается взаимодействие,
но концентрации веществ остаются
постоянными. Эти концентрации называются
равновесными.
|
Равновесная концентрация — концентрация вещества, участвующего в обратимой химической реакции, достигшей состояния равновесия. |
Равновесная концентрация обозначается формулой вещества, взятой в квадратные скобки, например:
сравновесная (Н2) = [H2] или равновесная(HI) = [HI].
Как
и любая другая концентрация, равновесная
концентрация измеряется в молях на
литр.
Если бы в рассмотренных нами
примерах мы взяли другие концентрации
исходных веществ, то после достижения
равновесия получили бы другие значения
равновесных концентраций. Эти новые
значения (обозначим их звездочками)
будут связаны со старыми следующим
образом:
Эти новые
значения (обозначим их звездочками)
будут связаны со старыми следующим
образом:
.
В общем случае для обратимой реакции
aA + bB dD + fF
в состоянии равновесия при постоянной температуре соблюдается соотношение
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
Постоянная
величина (КС)
называется константой
равновесия
данной реакции. Индекс » с» в
обозначении этой величины показывает,
что для расчета константы использовались
концентрации.
Если константа равновесия
велика, то равновесие сдвинуто в сторону
продуктов прямой реакции, если мала, то
— в сторону исходных веществ. Если
константа равновесия очень велика, то
говорят, что реакция » практически
необратима»,
если константа равновесия очень мала,
то реакция » практически
не идет».
Если
константа равновесия очень велика, то
говорят, что реакция » практически
необратима»,
если константа равновесия очень мала,
то реакция » практически
не идет».
Константа
равновесия — для каждой обратимой реакции
величина постоянная только при постоянной
температуре. Для одной и той же реакции
при разных температурах константа
равновесия принимает разные
значения.
Приведенное выражение для
закона действующих масс справедливо
только для реакций, все участники которых
представляют собой либо газы, либо
растворенные вещества. В других случаях
уравнение для константы равновесия
несколько меняется.
Например, в
протекающей при высокой температуре
обратимой реакции
С (гр) + СО2 2СО (г)
участвует твердый графит С (гр). Формально, пользуясь законом действующих масс, запишем выражение для константы равновесия этой реакции, обозначив ее К’:
Твердый
графит, лежащий на дне реактора, реагирует
только с поверхности, и его »
концентрация» не зависит от массы
графита и постоянна при любом соотношении
веществ в газовой смеси.
Умножим правую
и левую части уравнения на эту постоянную
величину:
Получившаяся величина и есть константа равновесия этой реакции:
Аналогичным образом, для равновесия другой обратимой реакции, протекающей также при высокой температуре,
CaCO3(кр) СаО (кр) + СО2(г),
получим константу равновесия
КС = [CO2].
В
этом случае она просто равна равновесной
концентрации углекислого газа.
С
метрологической точки зрения константа
равновесия не является одной физической
величиной. Это группа величин с различными
единицами измерений, зависящими от
конкретного выражения константы через
равновесные концентрации. Например,
для обратимой реакции графита с углекислым
газом [Kc]
= 1 моль/л, такая же единица измерений и
у константы равновесия реакции
термического разложения карбоната
кальция, а константа равновесия реакции
синтеза йодоводорода — величина
безразмерная. В общем случае [Kc]
= 1 (моль/л)n.
В общем случае [Kc]
= 1 (моль/л)n.
Смещение химического равновесия. Принцип Ле Шателье
Перевод
равновесной химической системы из
одного состояния равновесия в другое
называется смещением
(сдвигом) химического равновесия,
которое осуществляется изменением
термодинамических параметров системы
—
температуры, концентрации, давления
При смещении равновесия в
прямом направлении достигается увеличение
выхода продуктов, а при смещении в
обратном направлении —
уменьшение степени превращения реагента.
И то, и другое может оказаться полезным
в химической технологии.
Так как
почти все реакции в той или иной степени
обратимы, в промышленности и лабораторной
практике возникают две проблемы: как
получить продукт » полезной» реакции
с максимальным выходом и как уменьшить
выход продуктов » вредной» реакции.
И в том, и в другом случае возникает
необходимость сместить равновесие либо
в сторону продуктов реакции, либо в
сторону исходных веществ. Чтобы научиться
это делать, надо знать, от чего зависит
положение равновесия любой обратимой
реакции.
Чтобы научиться
это делать, надо знать, от чего зависит
положение равновесия любой обратимой
реакции.
Положение
равновесия зависит:
1) от значения
константы равновесия (то есть от природы
реагирующих веществ и температуры),
2)
от концентрации веществ, участвующих
в реакции и
3) от давления (для газовых
систем оно пропорционально концентрациям
веществ).
Для качественной оценки
влияния на химическое равновесие всех
этих очень разных факторов используют
универсальный по своей сути принцип
Ле Шателье
(французский физикохимик и металловед
Анри Луи Ле Шателье сформулировал его
в 1884 году), который применим к любым
равновесным системам, не только
химическим.
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в направлении, в котором происходит частичная компенсация этого воздействия.
В качестве примера влияния на положение равновесия концентраций веществ-участников реакции рассмотрим обратимую реакцию получения йодоводорода
H2(г)
+ I2(г)
2HI(г).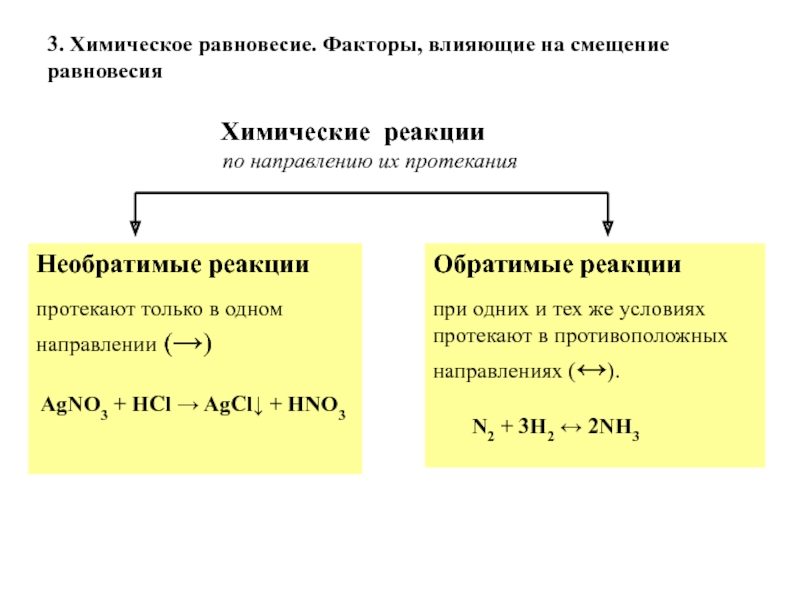
По закону действующих масс в состоянии равновесия
.
Пусть в реакторе объемом 1 литр при некоторой постоянной температуре установилось равновесие, при котором концентрации всех участников реакции одинаковы и равны 1 моль/л ([H2] = 1 моль/л; [I2] = 1 моль/л; [HI] = 1 моль/л). Следовательно, при этой температуре КС = 1. Так как объем реактора 1 литр, n(H2) = 1 моль, n(I2) = 1 моль и n(HI) = 1 моль. В момент времени t 1 введем в реактор еще 1 моль HI, его концентрация станет равной 2 моль/л. Но, чтобы КС оставалась постоянной, должны увеличиться концентрации водорода и йода, а это возможно только за счет разложения части йодоводорода по уравнению
2HI(г) = H2(г) + I2(г).
Пусть
к моменту достижения нового состояния
равновесия t 2
разложилось x
моль HI и, следовательно, образовалось
дополнительно по 0,5x
моль H2
и I2. Новые равновесные концентрации участников
реакции: [H2]
= (1 + 0,5x)
моль/л; [I2]
= (1 + 0,5x)
моль/л; [HI] = (2 — x)
моль/л. Подставив числовые значения
величин в выражение закона действующих
масс, получим уравнение
Новые равновесные концентрации участников
реакции: [H2]
= (1 + 0,5x)
моль/л; [I2]
= (1 + 0,5x)
моль/л; [HI] = (2 — x)
моль/л. Подставив числовые значения
величин в выражение закона действующих
масс, получим уравнение
.
Откуда x = 0,667. Следовательно, [H2] = 1,333 моль/л; [I2] = 1,333 моль/л; [HI] = 1,333 моль/л.
Скорость реакции и равновесие.
Пусть
есть обратимая реакция A + B
C
+ D. Если предположить, что прямая и
обратная реакция проходят в одну стадию,
то скорости этих реакций будут прямо
пропорциональны концентрациям реагентов:
скорость прямой реакции v1
= k1[A][B],
скорость обратной реакции v2
= k2[C][D]
(квадратными скобками обозначены
молярные концентрации реагентов). Видно,
что по мере протекания прямой реакции
концентрации исходных веществ А и В
снижаются, соответственно, уменьшается
и скорость прямой реакции. Скорость же
обратной реакции, которая в начальный
момент равна нулю (нет продуктов C и D),
постепенно увеличивается. Рано или
поздно наступит момент, когда скорости
прямой и обратной реакций сравняются.
После этого концентрации всех веществ
– А, В, С и D не изменяются со временем.
Это значит, что реакция достигла положения
равновесия, а не изменяющиеся со временем
концентрации веществ называются
равновесными. Но, в отличие от механического
равновесия, при котором всякое движение
прекращается, при химическом равновесии
обе реакции – и прямая, и обратная –
продолжают идти, однако их скорости
равны и поэтому кажется, что никаких
изменений в системе не происходит.
Доказать протекание прямой и обратной
реакций после достижения равновесия
можно множеством способов. Например,
если в смесь водорода, азота и аммиака,
находящуюся в положении равновесия,
ввести немного изотопа водорода –
дейтерия D2,
то чувствительный анализ сразу обнаружит
присутствие атомов дейтерия в молекулах
аммиака.
Скорость же
обратной реакции, которая в начальный
момент равна нулю (нет продуктов C и D),
постепенно увеличивается. Рано или
поздно наступит момент, когда скорости
прямой и обратной реакций сравняются.
После этого концентрации всех веществ
– А, В, С и D не изменяются со временем.
Это значит, что реакция достигла положения
равновесия, а не изменяющиеся со временем
концентрации веществ называются
равновесными. Но, в отличие от механического
равновесия, при котором всякое движение
прекращается, при химическом равновесии
обе реакции – и прямая, и обратная –
продолжают идти, однако их скорости
равны и поэтому кажется, что никаких
изменений в системе не происходит.
Доказать протекание прямой и обратной
реакций после достижения равновесия
можно множеством способов. Например,
если в смесь водорода, азота и аммиака,
находящуюся в положении равновесия,
ввести немного изотопа водорода –
дейтерия D2,
то чувствительный анализ сразу обнаружит
присутствие атомов дейтерия в молекулах
аммиака.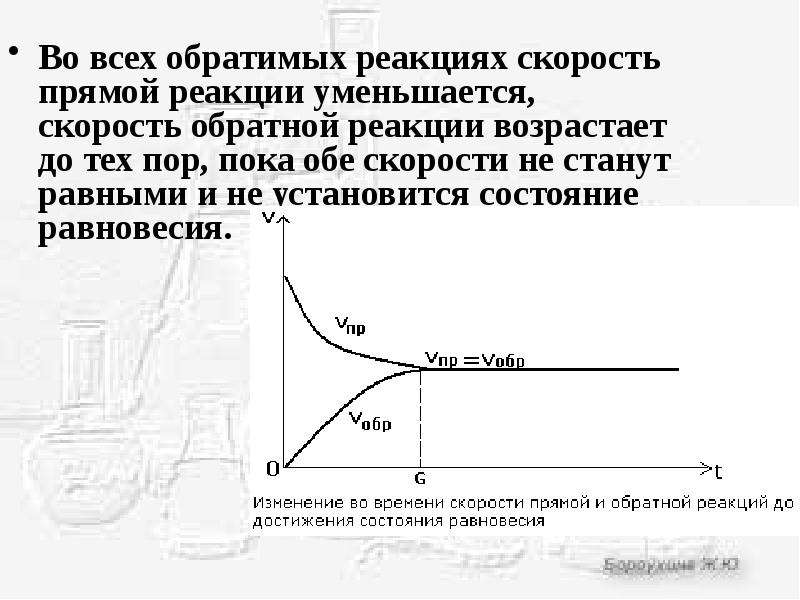 И наоборот, если ввести в систему
немного дейтерированного аммиака NH2D,
то дейтерий тут же появится в исходных
веществах в виде молекул HD и D2.
Другой эффектный опыт был проведен на
химическом факультете МГУ. Серебряную
пластинку поместили в раствор нитрата
серебра, при этом никаких изменений не
наблюдалось. Затем в раствор ввели
ничтожное количество ионов радиоактивного
серебра, после чего серебряная пластинка
стала радиоактивной. Эту радиоактивность
не могло «смыть» ни споласкивание
пластинки водой, ни промывание ее соляной
кислотой. Только травление азотной
кислотой или механическая обработка
поверхности мелкой наждачной бумагой
сделало ее неактивной. Объяснить этот
эксперимент можно единственным образом:
между металлом и раствором непрерывно
происходит обмен атомами серебра, т.е.
в системе идет обратимая реакция Ag(тв)
– е–
= Ag+.
Поэтому добавление радиоактивных ионов
Ag+
к раствору приводило к их «внедрению»
в пластинку в виде электронейтральных,
но по-прежнему радиоактивных атомов.
И наоборот, если ввести в систему
немного дейтерированного аммиака NH2D,
то дейтерий тут же появится в исходных
веществах в виде молекул HD и D2.
Другой эффектный опыт был проведен на
химическом факультете МГУ. Серебряную
пластинку поместили в раствор нитрата
серебра, при этом никаких изменений не
наблюдалось. Затем в раствор ввели
ничтожное количество ионов радиоактивного
серебра, после чего серебряная пластинка
стала радиоактивной. Эту радиоактивность
не могло «смыть» ни споласкивание
пластинки водой, ни промывание ее соляной
кислотой. Только травление азотной
кислотой или механическая обработка
поверхности мелкой наждачной бумагой
сделало ее неактивной. Объяснить этот
эксперимент можно единственным образом:
между металлом и раствором непрерывно
происходит обмен атомами серебра, т.е.
в системе идет обратимая реакция Ag(тв)
– е–
= Ag+.
Поэтому добавление радиоактивных ионов
Ag+
к раствору приводило к их «внедрению»
в пластинку в виде электронейтральных,
но по-прежнему радиоактивных атомов. Таким образом, равновесными бывают не
только химические реакции между газами
или растворами, но и процессы растворения
металлов, осадков. Например, твердое
вещество быстрее всего растворяется,
если его поместить в чистый растворитель,
когда система далека от равновесия, в
данном случае – от насыщенного раствора.
Постепенно скорость растворения
снижается, и одновременно увеличивается
скорость обратного процесса – перехода
вещества из раствора в кристаллический
осадок. Когда раствор становится
насыщенным, система достигает состояния
равновесия, при этом скорости растворения
и кристаллизации равны, а масса осадка
со временем не меняется. Как система
может «противодействовать» изменению
внешних условий? Если, например,
температуру равновесной смеси повышают
нагреванием, сама система, конечно, не
может «ослабить» внешний нагрев, однако
равновесие в ней смещается таким образом,
что для нагревания реакционной системы
до определенной температуры требуется
уже большее количество теплоты, чем в
том случае, если бы равновесие не
смещалось.
Таким образом, равновесными бывают не
только химические реакции между газами
или растворами, но и процессы растворения
металлов, осадков. Например, твердое
вещество быстрее всего растворяется,
если его поместить в чистый растворитель,
когда система далека от равновесия, в
данном случае – от насыщенного раствора.
Постепенно скорость растворения
снижается, и одновременно увеличивается
скорость обратного процесса – перехода
вещества из раствора в кристаллический
осадок. Когда раствор становится
насыщенным, система достигает состояния
равновесия, при этом скорости растворения
и кристаллизации равны, а масса осадка
со временем не меняется. Как система
может «противодействовать» изменению
внешних условий? Если, например,
температуру равновесной смеси повышают
нагреванием, сама система, конечно, не
может «ослабить» внешний нагрев, однако
равновесие в ней смещается таким образом,
что для нагревания реакционной системы
до определенной температуры требуется
уже большее количество теплоты, чем в
том случае, если бы равновесие не
смещалось. При этом равновесие смещается
так, чтобы теплота поглощалась, т.е. в
сторону эндотермической реакции. Это
и можно трактовать, как «стремление
системы ослабить внешнее воздействие».
С другой стороны, если в левой и правой
частях уравнения имеется неодинаковое
число газообразных молекул, то равновесие
в такой системе можно сместить и путем
изменения давления. При повышении
давления равновесие смещается в ту
сторону, где число газообразных молекул
меньше (и таким способом как бы
«противодействует» внешнему давлению).
Если же число газообразных молекул в
ходе реакции не меняется
При этом равновесие смещается
так, чтобы теплота поглощалась, т.е. в
сторону эндотермической реакции. Это
и можно трактовать, как «стремление
системы ослабить внешнее воздействие».
С другой стороны, если в левой и правой
частях уравнения имеется неодинаковое
число газообразных молекул, то равновесие
в такой системе можно сместить и путем
изменения давления. При повышении
давления равновесие смещается в ту
сторону, где число газообразных молекул
меньше (и таким способом как бы
«противодействует» внешнему давлению).
Если же число газообразных молекул в
ходе реакции не меняется
(H2 + Br2(г) 2HBr, СО + Н2О (г) СО2 + Н2), то давление не влияет на положение равновесия. Следует отметить, что при изменении температуры изменяется и константа равновесия реакции, тогда как при изменении только давления она остается постоянной.
Несколько
примеров использования принципа Ле
Шателье для предсказания смещения
химического равновесия. Реакция 2SO2
+ O22SO3(г)
экзотермична. Если повысить температуру,
преимущество получит эндотермическая
реакция разложения SО3
и равновесие сместится влево. Если же
понизить температуру, равновесие
сместится вправо. Так, смесь SО2
и О2,
взятых в стехиометрическом соотношении
2:1 (см.
СТЕХИОМЕРИЯ),
при температуре 400° С и атмосферном
давлении превращается в SО3
с выходом около 95%, т.е. состояние
равновесия в этих условиях почти
полностью смещено в сторону SО3.
При 600° С равновесная смесь содержит
уже 76% SО3,
а при 800° С – только 25%. Именно поэтому
при сжигании серы на воздухе образуется
в основном SО2
и лишь около 4% SО3.
Из уравнения реакции следует также, что
повышение общего давления в системе
будет сдвигать равновесие вправо, а при
понижении давления равновесие будет
смещаться влево.
Реакция 2SO2
+ O22SO3(г)
экзотермична. Если повысить температуру,
преимущество получит эндотермическая
реакция разложения SО3
и равновесие сместится влево. Если же
понизить температуру, равновесие
сместится вправо. Так, смесь SО2
и О2,
взятых в стехиометрическом соотношении
2:1 (см.
СТЕХИОМЕРИЯ),
при температуре 400° С и атмосферном
давлении превращается в SО3
с выходом около 95%, т.е. состояние
равновесия в этих условиях почти
полностью смещено в сторону SО3.
При 600° С равновесная смесь содержит
уже 76% SО3,
а при 800° С – только 25%. Именно поэтому
при сжигании серы на воздухе образуется
в основном SО2
и лишь около 4% SО3.
Из уравнения реакции следует также, что
повышение общего давления в системе
будет сдвигать равновесие вправо, а при
понижении давления равновесие будет
смещаться влево.
Реакцию отщепления водорода от циклогексана с образованием бензола
С6Н12С6Н6
+ 3Н2
проводят газовой фазе, также в присутствии
катализатора. Реакция эта идет с затратой
энергии (эндотермическая), но с увеличением
числа молекул. Поэтому влияние температуры
и давления на нее будет прямо противоположным
тому, которое наблюдается в случае
синтеза аммиака. А именно: увеличению
равновесной концентрации бензола в
смеси способствует повышение температуры
и понижение давления, поэтому реакцию
проводят в промышленности при невысоких
давлениях (2–3 атм) и высоких температурах
(450–500° С). Здесь повышение температуры
«дважды благоприятно»: оно не только
увеличивает скорость реакции, но и
способствует сдвигу равновесия в сторону
образования целевого продукта. Конечно,
еще большее снижение давления (например,
до 0,1 атм) вызвало бы дальнейшее смещение
равновесия вправо, однако при этом в
реакторе будет находиться слишком мало
вещества, уменьшится и скорость реакции,
так что общая производительность не
повысится, а понизится. Этот пример еще
раз показывает, что экономически
обоснованный промышленный синтез –
это удачное лавирование между «Сциллой
и Харибдой».
Реакция эта идет с затратой
энергии (эндотермическая), но с увеличением
числа молекул. Поэтому влияние температуры
и давления на нее будет прямо противоположным
тому, которое наблюдается в случае
синтеза аммиака. А именно: увеличению
равновесной концентрации бензола в
смеси способствует повышение температуры
и понижение давления, поэтому реакцию
проводят в промышленности при невысоких
давлениях (2–3 атм) и высоких температурах
(450–500° С). Здесь повышение температуры
«дважды благоприятно»: оно не только
увеличивает скорость реакции, но и
способствует сдвигу равновесия в сторону
образования целевого продукта. Конечно,
еще большее снижение давления (например,
до 0,1 атм) вызвало бы дальнейшее смещение
равновесия вправо, однако при этом в
реакторе будет находиться слишком мало
вещества, уменьшится и скорость реакции,
так что общая производительность не
повысится, а понизится. Этот пример еще
раз показывает, что экономически
обоснованный промышленный синтез –
это удачное лавирование между «Сциллой
и Харибдой».
Принцип Ле Шателье «работает» и в так называемом галогенном цикле, который используют для получения титана, никеля, гафния, ванадия, ниобия, тантала и других металлов высокой чистоты. Реакция металла с галогеном, например, Ti + 2I2TiI4 идет с выделением теплоты и потому при повышение температуры равновесие смещается влево. Так, при 600° С титан легко образует летучий иодид (равновесие смещено вправо), а при 110° С иодид распадается (равновесие смещено влево) с выделением очень чистого металла. Такой цикл работает и в галогенных лампах, где испарившийся со спирали и осевший на более холодных стенках вольфрам образует с галогенами летучие соединения, которые на раскаленной спирали вновь распадаются, и вольфрам оказывается перенесенным на прежнее место.
Кроме изменения температуры и давления существует еще один действенный способ влиять на положение равновесия. Представим, что из равновесной смеси
А
+ В
C
+ D выводится какое-либо вещество. В
соответствии с принципом Ле Шателье,
система тут же «отзовется» на такое
воздействие: равновесие начнет смещаться
так, чтобы скомпенсировать потерю
данного вещества. Например, если из зоны
реакции выводить вещество С или D (или
оба сразу), равновесие будет смещаться
вправо, а если выводить вещества А или
В – влево. Введение какого-либо вещества
в систему также будет смещать равновесие,
но уже в другую сторону.
В
соответствии с принципом Ле Шателье,
система тут же «отзовется» на такое
воздействие: равновесие начнет смещаться
так, чтобы скомпенсировать потерю
данного вещества. Например, если из зоны
реакции выводить вещество С или D (или
оба сразу), равновесие будет смещаться
вправо, а если выводить вещества А или
В – влево. Введение какого-либо вещества
в систему также будет смещать равновесие,
но уже в другую сторону.
Удалять вещества из зоны реакции можно разными способами. Например, если в плотно закрытом сосуде с водой есть сернистый газ, установится равновесие между газообразным, растворенным и прореагировавшим диоксидом серы:
О2(г)
SО2(р)
+ Н2О
H2SO3.
Если сосуд открыть, сернистый газ
постепенно начнет улетучиваться и
больше не сможет участвовать в процессе
– равновесие начнет смещаться влево,
вплоть до полного разложения сернистой
кислоты. Аналогичный процесс можно
наблюдать каждый раз при открывании
бутылки с лимонадом или минеральной
водой: равновесие СО2(г)
СО2(р)
+ Н2О
Н2СО3
по мере улетучивания СО2
смещается влево.
Вывод реагента из системы возможен не только при образовании газообразных веществ, но и путем связывания того или иного реагента с образованием нерастворимого соединения, выпадающего в осадок. Например, если в водный раствор СО2 ввести избыток соли кальция, то ионы Са2+ будут образовывать осадок СаСО3, реагируя с угольной кислотой; равновесие СО2(р) + Н2О Н2СО3 будет смещаться вправо, пока в воде не останется растворенного газа.
Равновесие можно сместить и добавлением реагента. Так, при сливании разбавленных растворов FeCl3 и KSCN появляется красновато-оранжевая окраска в результате образования тиоцианата (роданида) железа:
FeCl3
+ 3KSCN
Fe(SCN)3
+ 3KCl. Если
в раствор внести дополнительно FeCl3
или KSCN, окраска раствора усилится, что
свидетельствует о смещении равновесия
вправо (как бы ослабляя внешнее
воздействие). Если же добавить к раствору
избыток KCl, то равновесие сместится
влево с ослаблением окраски до
светло-желтой.
В
формулировке принципа Ле Шателье недаром
указывается, что предсказывать результаты
внешнего воздействия можно только для
систем, находящихся в состоянии
равновесия. Если этим указанием
пренебречь, легко прийти к совершенно
неверным выводам. Например, известно,
что твердые щелочи (KOH, NaOH) растворяются
в воде с выделением большого количества
теплоты – раствор разогревается почти
так же сильно, как и при смешении с водой
концентрированной серной кислоты. Если
забыть, что принцип применим только к
равновесным системам, можно сделать
неверный вывод о том, что при повышении
температуры растворимость КОН в воде
должна снижаться, так как именно такое
смещение равновесия между осадком и
насыщенным раствором приводит к
«ослаблению внешнего воздействия».
Однако процесс растворения КОН в воде
– вовсе не равновесный, поскольку в нем
участвует безводная щелочь, тогда как
осадок, находящийся в равновесии с
насыщенным раствором, представляет
собой гидраты КОН (в основном KOH·2H2O). Переход же этого гидрата из осадка в
раствор является эндотермическим
процессом, т.е. сопровождается не
нагреванием, а охлаждением раствора,
так что принцип Ле Шателье для равновесного
процесса выполняется и в этом случае.
Точно так же при растворении безводных
солей – CaCl2,
CuSO4
и др. в воде раствор нагревается, а при
растворении кристаллогидратов CuSO4·5H2O,
CaCl2·6H2O
– охлаждается.
Переход же этого гидрата из осадка в
раствор является эндотермическим
процессом, т.е. сопровождается не
нагреванием, а охлаждением раствора,
так что принцип Ле Шателье для равновесного
процесса выполняется и в этом случае.
Точно так же при растворении безводных
солей – CaCl2,
CuSO4
и др. в воде раствор нагревается, а при
растворении кристаллогидратов CuSO4·5H2O,
CaCl2·6H2O
– охлаждается.
В
учебниках и популярной литературе можно
найти еще один интересный и поучительный
пример ошибочного использования принципа
Ле Шателье. Если в прозрачный газовый
шприц поместить равновесную смесь
бурого диоксида азота NO2
и бесцветного тетраоксида N2O4,
а потом с помощью поршня быстро сжать
газ, то интенсивность окраски сразу же
усилится, а через некоторое время
(десятки секунд) вновь ослабится, хотя
и не достигнет первоначальной. Этот
опыт обычно объясняют так. Быстрое
сжатие смеси приводит к увеличению
давления и, следовательно, концентрации
обоих компонентов, поэтому смесь
становится более темной. Но повышение
давления, в соответствии с принципом
Ле Шателье, сдвигает равновесие в системе
2NO2N2O4
в сторону бесцветного N2O4
(уменьшается число молекул), поэтому
смесь постепенно светлеет, приближаясь
к новому положению равновесия, которое
соответствует повышенному давлению.
Но повышение
давления, в соответствии с принципом
Ле Шателье, сдвигает равновесие в системе
2NO2N2O4
в сторону бесцветного N2O4
(уменьшается число молекул), поэтому
смесь постепенно светлеет, приближаясь
к новому положению равновесия, которое
соответствует повышенному давлению.
Ошибочность
такого объяснения следует из того, что
обе реакции – диссоциация N2O4
и димеризация NO2
– происходят чрезвычайно быстро, так
что равновесие в любом случае
устанавливается за миллионные доли
секунды, поэтому невозможно вдвинуть
поршень настолько быстро, чтобы нарушить
равновесие. Объясняется этот опыт иначе:
сжатие газа вызывает значительно
повышение температуры (с этим явлением
знаком каждый, кому приходилось накачивать
шину велосипедным насосом). И в соответствии
с тем же принципом Ле Шателье, равновесие
мгновенно сдвигается в сторону
эндотермической реакции, идущей с
поглощением теплоты, т.е. в сторону
диссоциации N2O4
– смесь темнеет. Затем газы в шприце
медленно остывают до комнатной
температуры, и равновесие снова сдвигается
в сторону тетраоксида – смесь светлеет.
Затем газы в шприце
медленно остывают до комнатной
температуры, и равновесие снова сдвигается
в сторону тетраоксида – смесь светлеет.
Принцип
Ле Шателье прекрасно действует и в тех
случаях, которые не имеют никакого
отношения к химии. В нормально действующей
экономике общая сумма находящихся в
обращении денег находится в равновесии
с теми товарами, которые можно на эти
деньги купить. Что будет, если «внешним
воздействием» окажется желание
правительства напечатать денег побольше,
чтобы рассчитаться с долгами? В строгом
соответствии с принципом Ле Шателье,
равновесие между товаром и деньгами
будет смещаться таким образом, чтобы
ослабить удовольствие граждан от
обладания большим количеством денег.
А именно, цены на товары и услуги вырастут,
и таким путем будет достигнуто новое
равновесие. Другой пример. В одном из
городов США было решено избавиться от
постоянных пробок путем расширения
магистралей и строительства транспортных
развязок. На некоторое время это помогло,
но затем обрадованные жители начали
покупать больше автомобилей, так что
вскоре пробки возникли вновь, – но при
новом «положении равновесия» между
дорогами и бóльшим числом автомобилей.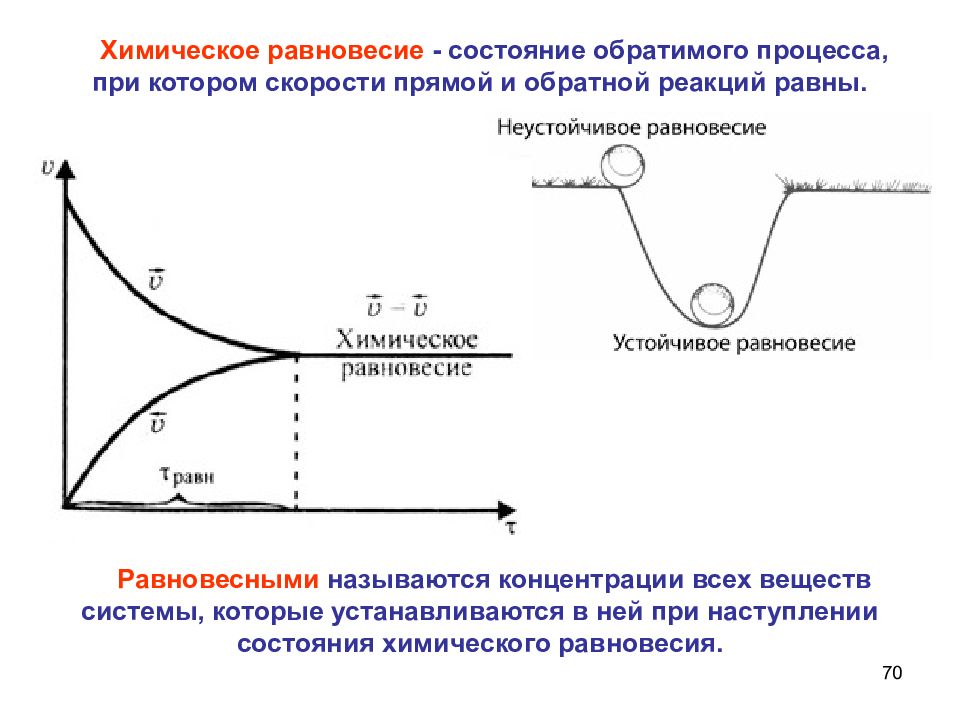
Итак, сделаем основные выводы способов смещения химического равновесия.
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
|
|
V1 |
|
|
A + Б |
|
В |
|
|
V2 |
|
1.
Давление. Увеличение давления (для
газов) смещает равновесие в сторону
реакции, ведущей к уменьшению объема
(т.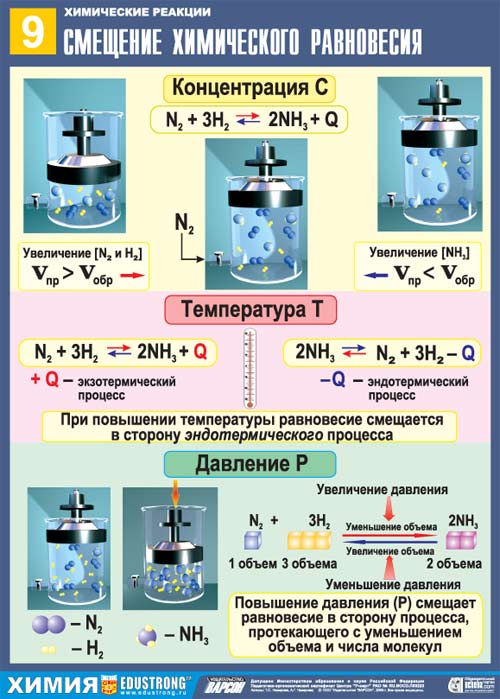 е. к образованию меньшего числа
молекул).
е. к образованию меньшего числа
молекул).
|
|
V1 |
|
|
|
A + Б |
|
В |
; увеличение P приводит к V1 > V2 |
|
|
V2 |
|
|
|
2 |
|
1 |
|
2. Увеличение температуры смещает положение
равновесия в сторону эндотермической
реакции (т.е. в сторону реакции, протекающей
с поглощением теплоты)
Увеличение температуры смещает положение
равновесия в сторону эндотермической
реакции (т.е. в сторону реакции, протекающей
с поглощением теплоты)
|
|
V1 |
|
|
A + Б |
|
В + Q, то увеличение tC приводит к V2 > V1 |
|
|
V2 |
|
|
|
V1 |
|
|
A + Б |
|
В — Q, то увеличение tC приводит к V1 > V2 |
|
|
V2 |
|
3. Увеличение концентрации исходных
веществ и удаление продуктов из сферы
реакции смещает равновесие в сторону
прямой реакции. Увеличение концентраций
исходных веществ [A]
или [Б] или [А] и [Б]: V1
> V2.
Увеличение концентрации исходных
веществ и удаление продуктов из сферы
реакции смещает равновесие в сторону
прямой реакции. Увеличение концентраций
исходных веществ [A]
или [Б] или [А] и [Б]: V1
> V2.
Катализаторы не влияют на положение равновесия.
Принцип Ле Шателье в природе.
При изучении
данной темы всегда хочется привести
пример стремления всего живого к
равновесию, компенсации. Например:
изменение численности популяции
мышей-ореховый год-корма для мышей
много, популяция мышей быстро растёт.
С ростом численности мышей уменьшается
количество пищи, в результате скопления
грызунов начинается рост различных
инфекционных заболеваний среди мышей,
поэтому происходит постепенное уменьшение
численности популяции грызунов. Через
какой-то период времени наступает
динамическое равновесие численности
рождающихся и погибающих мышей, сдвиг
этого равновесия может произойти в ту
или другую сторону под влиянием внешних,
благоприятных или неблагоприятных
условий.
В человеческом организме протекают биохимические процессы, которое также могут регулироваться по принципу Ле Шателье. Порой в результате такой реакции в организме начинают вырабатываться вещества-яды, вызывающие то или иное заболевание. Как воспрепятствовать этому процессу?
Вспомним такой метод лечения, как гомеопатия. Метод заключается в применении очень малых доз тех лекарств, которые в больших дозах вызывают у здорового человека признаки какого-нибудь заболевания. Как же в данном случае действует лекарство-яд? В организм вводят продукт не желаемой реакции, и по принципу Ле Шателье равновесие смещается в сторону исходных веществ. Процесс вызывающий болезненные нарушения в организме угасает.
Практическая часть.Контроль
уровня усвоения изученной темы проводится
в виде тестов. Тест-система лаконично
и точно сформулированных и стандаотизированных
заданий, не которые необходимо дать в
течение ограниченного времени краткие
и точные ответы, оцениваемые по системе
баллов. При составлении тестов я
ориентировалась на следующие уровни:
При составлении тестов я
ориентировалась на следующие уровни:
Репродуктивный-выполнеие учащимися этого уровня происходит, в основном, опираясь на память.
Продуктивный-достижения этого уровня предполагает у учащихся понимание изученных формулировок, понятий, законов, умение устанавливать взаимосвязь между ними.
Творческий-умение прогнозировать на основе имеющихся знаний, проектировать, анализировать, делать выводы, сравнения, обобщения.
Тесты закрытого типа или тесты, в которых испытуемому необходимо выбрать правильный ответ из предложенных вариантов.
А) Репродуктивный уровень: тесты с альтернативными ответами, в которых испытуемый должен ответить да или нет. Оценка 1балл.
Реакция горения фосфора-
это обратимая реакция
а) да б) нет
Реакция разложения
карбоната кальция-это
обратимая реакция
а) да б) нет
Увеличение температуры
способствует разложению
оксида ртути II на ртуть
и кислород
а) да б) нет
В живых системах
происходят обратимые
и необратимые процессы
а)
да б) нет.
Тесты с выбором одного правильного ответа
В какой системе при повышении давления химическое равновесие сместится вправо?
2HI(г)↔h4(г)+I2(г)
С (тв)+S2(г)↔CS2(г)
C3H6(г)+h4(г)↔С3H8(г)
h4(г)+F2(г)↔2HF(г) 1балл
Химическое равновесие в системе
CO2(г)+C(тв)↔2СO(г)-173кдж смещается в сторону продукта реакции при
повышении давления
повышении температуры
использовании катализатора
понижении температуры; 1балл
На состояние химического равновесия в системе
h4(г)+J2(г)↔2HJ(г)-Q
не влияет
увеличение давления
увеличение концентрации йода
увеличение температуры
уменьшение температуры; 1балл
В какой системе увеличение концентрации водорода смещает химическое равновесие влево?
C(тв)+2h4(г)↔СH5(г)
2Nh5(г)↔N2(г)+3h4(г)
2h4(г)+O2(г)↔2h4O(г)
FeO(тв)+h4(г)↔Fe+h4O(г) 1балл
В какой системе повышение давления не влияет на смещение химического равновесия?
h4(г)+J2(г)↔2HJ(г)
SO2(г)+h4O(ж)↔h4SO3(г)
CH5(г)+h4O(г)↔CO(г)+3h4(г)
4HCl(г)+O2(г)↔2h4O(г)+2Сl2(г) 1балл
На химическое равновесие в системе
N2+3h4↔2Nh5+Q
не оказывает влияние
повышение температуры
повышение давления
удаление аммиака из зоны реакции
применение катализатора 1балл
Химическое равновесие в системе
2NO+O2↔2NO2+Q
смещается в сторону образования продукта реакции при
повышении давления
повышении температуры
понижении давления
применения катализатора 1балл
В производстве серной кислоты на стадии окисления SO2 в SO3 для увеличения выхода продукта
повышают концентрацию кислорода
увеличивают температуру
понижают давление
вводят катализатор; 1,5балла
pt
Алкен + h4 ↔ алкан
(разрыв пи-связи 65ккал/моль, разрыв H-H связи 104ккал/моль) образование двух связей C-H 98+98=196ккал/моль
при нагревании реакционной смеси
равновесие сместится вправо
равновесие сместится влево
равновесие будет протекать в обе стороны с одинаковой вероятностью
эти вещества не находятся в состоянии равновесия в указанных условиях; 1,5балла
Химическое равновесие в системе
2NO2↔2NO+O2-Q
смещается в сторону образования исходных веществ
1) повышении давления
повышении температуры
понижении давления
применения катализатора; 1балл
На смещение равновесия вправо в системе
2Nh5↔N2+3h4-Q
оказывает влияние
понижение температуры
повышение давления
использование катализатора
повышение температуры; 1балл
Необратимой реакции соответствует уравнение
азот+водород=аммиак
ацетилен+кислород=углекислый газ+вода
водород+йод=йодоводород
сернистый газ+кислород=серный ангидрид; 1,5балла
Тесты
с множественным выбором правильного
ответа, при выполнении
которых испытуемому необходимо выбрать
1-2 правильных ответа, или сопоставить
2 предложенных условия при выборе ответа.
В какой системе химическое равновесие сместится в сторону продуктов реакции как при повышении давления, как и при понижении температуры?
N2+O2↔2NO-Q
N2+3h4↔2Nh5+Q
h4+CL2↔2HCL+Q
C2h4↔2C(тв)+h4-Q 1,5балла
Химическое равновесие в системе
+ —
Nh5+h4O↔NH5+OH
сместится в сторону образования аммиака при добавлении к водному раствору аммиака
хлорида натрия
гидроксида натрия
соляной кислоты
хлорида алюминия; 1,5балла
h4SO4
19) Реакция гидратации этилена Ch4=Ch4+h4O ↔ имеет большое практическое значение, но она обратима, для смещения равновесия реакции вправо необходимо
повысить температуру (>280градусов С)
уменьшить количество воды в реакционной смеси
повысить давление (больше 80 атмосфер)
заменить кислотный катализатор на платину; 1балл
Реакция дегидрирования бутана эндотермична.
 Для смещения равновесия реакции вправо
необходимо
Для смещения равновесия реакции вправо
необходимо
использовать более активный катализатор, например платину
понизить температуру
повысить давление
повысить температуру; 1балл
Для реакции взаимодействия уксусной кислоты с метанолом с образованием эфира и воды смещению равновесия влево будет способствовать
соответствующий катализатор
добавление концентрированной серной кислоты
использование обезвоженных исходных веществ
добавление эфира; 1,5балла
Тесты на исключение лишнего (встретил лишнее-убери)
На смещение равновесия влияет
изменение давления
использование катализатора
изменение концентраций веществ, участвующих в реакции
изменение температуры; 1балл
Повышение или понижение давления влияет на смещение химического равновесия в реакциях
идущих с выделением тепла
реакциях с участием газообразных веществ
реакциях идущих с уменьшением объёма
реакциях идущих с увеличением объёма; 1,5балла
Необратимой является реакция
горения угля
горения фосфора
синтез аммиака из азота и водорода
горения метана; 1,5балла
Тесты группирования включают перечень предложенных формул, уравнений, терминов, которые следует распределить по заданным признакам
При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
h4(г)+S(г)↔h4S(г)+Q
2SO2(г)+O2(г)↔2SO3(г)+Q
2Nh5(г)↔N2(г)+3h4(г)-Q
2HCL(г)↔h4(г)+СL2(г)-Q; 2балла
Реакция гидрирование пропена экзотермическая.
 Для смещения химического равновесия
вправо необходимо
Для смещения химического равновесия
вправо необходимо
понижение температуры
увеличение давления
уменьшение концентрации водорода
уменьшение концентрации пропена; 1балл
Задания на соответствие.
При выполнении тестов испытуемому предлагается установить соответствие элементов двух списков, с несколькими возможными ответами.
Равновесие реакции смещается вправо. Привести в соответствие.
А) CO+CL2↔COCL2(г)+Q 1) При повышении давления
Б) N2+3h4↔2Nh5+Q 2) При повышении температуры
В) CO2+C(тв)↔2CO-Q 3) При понижении давления
Г) N2O(г)+S(т)↔2N2(г) 4) При увеличении площади соприкосновения; 2балла
Равновесие реакции смещается в сторону образования продуктов реакции. Привести в соответствие.
А) CH5↔C+2h4-Q 1)При увеличении концентрации водорода
Б) 2h4+O2↔2h4O(г)+Q 2)При повышении температуры
В) Ch5OH+Ch5COOH↔Ch5COOCh5 3)При уменьшении давления
Г) N2+O2↔2NO-Q 4) При добавлении эфира
5) При добавлении спирта; 2балла
Тесты
открытого типа или тесты со свободными
ответами, в которых испытуемому
необходимо дописать понятия определения
уравнения или предложить самостоятельное
суждение в доказательном плане.
Задания этого типа составляют заключительною, наиболее высоко оцениваемою часть тестов ЕГЭ по химии.
Задания дополнения.
Испытуемый должен сформулировать ответы с учетом предусмотренных в задании ограничений.
Допишите уравнение реакций, относящиеся к обратимым и одновременно к экзотермическим
А) Гидроксид натрия + Азотная кислота
Б) Водород + Йод
В) Азот + Водород
Г) Сернистый газ + Кислород
Д) Углекислый газ + Углерод 2балла
Напишите уравнение реакций по схеме, из них выберите те обратимые реакции, в которых повышение температуры вызовет смещение равновесия вправо:
1 2 3 4
N2 → NO→ NO2→ HNO3→ NH5NO3 2балла
Тесты задания свободного изложения.
Испытуемый
должен самостоятельно сформулировать
ответы, ибо никаких ограничений на них
в задании не накладываются.
31) Перечислите факторы, смещающие равновесие вправо в системе:
CO + 2h4↔ Ch5OH(г)+Q 2балла
32) Перечислите факторы, смещающие равновесие в сторону образования исходных веществ в системе:
С (тв) + 2h4(г)↔CH5(г) + Q 2балла
Ответы к тестам.
№ теста Правильный ответ
Б
А
А
А
3
2
1
2
1,2
4
1
1
2
1
4
2
2
2
1,3
3,4
4
2
1
3
3
1,2
27 А-1
Б-1
В-2,3,4
Г-3,4
А-2,3
Б-1
В-4
Г-2
В- N2+3h4↔2Nh5+Q
Г-2SO2+O2↔2SO3+Q
1) N2+O2↔2NO-Q
2) 2NO+O2↔2NO2+Q
3) 4NO2+2h4O+O2↔4HNO3+Q
4) Nh5+HNO3=NH5NO3
реакция первая
CO+2h4↔Ch5OH+Q
Равновесие вправо смещается при:
уменьшении температуры
увеличении давления
увеличения концентрации CO
увеличения концентрации h4
уменьшение концентрации спирта
C+2h4↔CH5+Q
Равновесие реакции смещается в сторону исходных веществ при: 1) повышении температуры
2) понижении давления
3) понижении концентрации водорода
4) повышении
концентрации метана.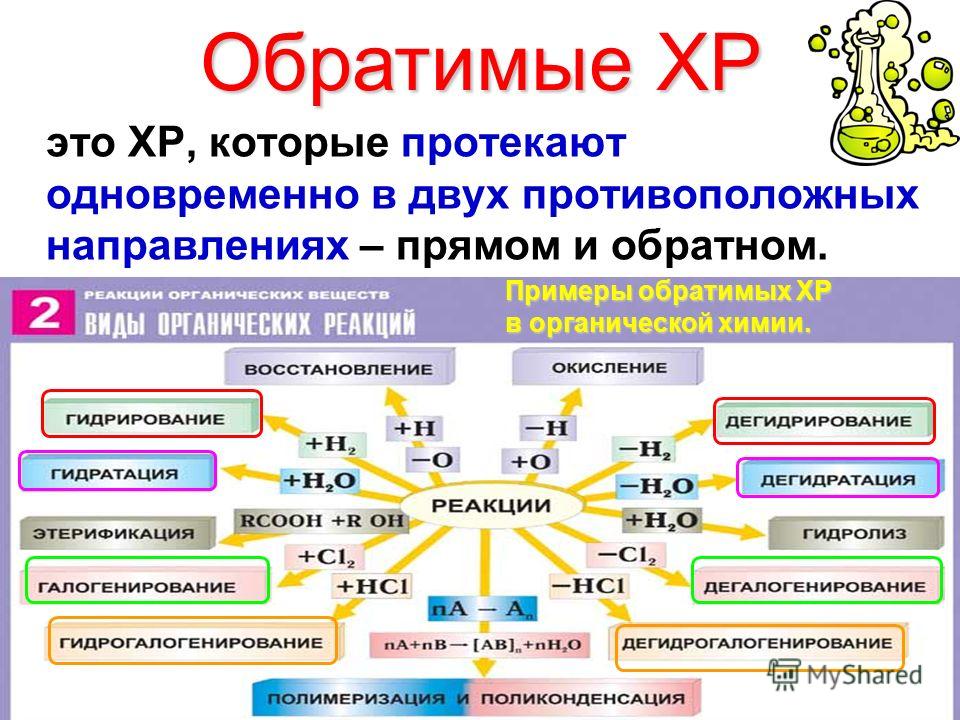
Список литературы
Ахметов, М.А.Система заданий и упражнений по органической химии в тестовой форме [ Текст] /М.А.Ахметов, И.Н.Прохоров.-Ульяновск: ИПКПРО, 2004.
Габриелян,О.С. Современная дидактика школьной химии, лекция №6 [ Текст] /О.С.Габриелян, В.Г.Краснова, С.Т.Сладков.// Газета для учителей химии и естествознания (Издательский дом «Первое сентября»)-2007.- №22.-с.4-13.
Каверина, А.А. Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия [ Текст] /А.А.Каверина и др.-М.: Интеллект центр, 2004.-160с.
Каверина, А.А. Единый государственный экзамен 2009.Химия [Текст] /А.А.Каверина, А.С.Корощенко, Д.Ю.Добротин /ФИПИ.-М.: Интеллект центр, 2009.-272 с.
Леенсон, И.А. Химические реакции, тепловой эффект, равновесие, скорость [ Текст] /И.А.Леенсон.М.: Астрель, 2002.-190с.
Радецкий, А.
 М. Проверочные работы
по химии в 8-11классе: пособие для учителя
[ Текст] / А.М.Радецкий. М.: Просвещение,
2009.-272с.
М. Проверочные работы
по химии в 8-11классе: пособие для учителя
[ Текст] / А.М.Радецкий. М.: Просвещение,
2009.-272с.Рябинина, О.А. Демонстрация действия принципа Ле Шателье [ Текст] /О.О.Рябинина, А.Илларионов// Химия в школе.-2008.-№7.-с.64-67.
Тушина.Е.Н. Принцип Ле Шателье и некоторые методы лечения [Текст ] /Е.Н.Тушина.// Химия в школе.-1993. №2.-с.54.
Шелинский, Г.И.Основы теории химических процессов [ Текст ] /Г.И.Шелинский. М.: Просвещение , 1989.-234с.
Штремплер, Г.И. Предпрофильная подготовка по химии [Текст ]
/ Г.И.Штремплер. М.: Дрофа, 2007.-253с.
13.4: Смещение равновесия — принцип Ле Шателье
Цели обучения
- Дайте определение Принцип Ле Шателье .
- Предсказать направление сдвига равновесия при нагрузке.
Как только установится равновесие, реакция закончится, верно? Не совсем. Экспериментатор имеет некоторую возможность влиять на равновесие.
Экспериментатор имеет некоторую возможность влиять на равновесие.
Химическое равновесие можно сдвинуть, изменив условия, в которых находится система.Мы говорим, что «напрягаем» равновесие. Когда мы подчеркиваем равновесие, химическая реакция больше не находится в равновесии, и реакция начинает двигаться обратно к равновесию таким образом, чтобы уменьшить напряжение. Формальное утверждение называется принципом Ле Шателье : если равновесие подвергается стрессу, то реакция смещается в сторону уменьшения напряжения.
Существует несколько способов подчеркнуть равновесие. Один из способов заключается в добавлении или удалении продукта или реагента в равновесной химической реакции.Когда добавляется дополнительный реагент, равновесие смещается, чтобы уменьшить это напряжение: получается больше продукта. Когда добавляется дополнительный продукт, равновесие смещается в сторону реагентов, чтобы уменьшить напряжение. Если реагент или продукт удаляются, равновесие смещается в сторону образования большего количества реагента или продукта, соответственно, чтобы компенсировать потерю.
Пример \(\PageIndex{1}\):
Учитывая эту реакцию в равновесии:
\[N_{2}+3H_{2}\rightleftharpoons 2NH_{3}\номер \]
В каком направлении — к реагентам или к продуктам — смещается реакция, если равновесие нарушается каждым изменением?
- H 2 добавлен.
- NH 3 добавлен.
- NH 3 удален.
Раствор
- Если добавить H 2 , реагента будет больше, поэтому реакция сместится в сторону продуктов, чтобы уменьшить добавленный H 2 .
- Если добавить NH 3 , то теперь будет больше продукта, поэтому реакция сместится в сторону реагентов, чтобы уменьшить добавленный NH 3 .
- Если удалить NH 3 , продукта будет меньше, поэтому реакция сместится в сторону продуктов, которые заменят удаленный продукт.
Упражнение \(\PageIndex{1}\)
Учитывая эту реакцию в равновесии:
\[CO(g)+Br_{2}(g)\rightleftharpoons COBr_{2}(g)\без номера \]
В каком направлении — к реагентам или к продуктам — смещается реакция, если равновесие нарушается каждым изменением?
- Br 2 удален.

- COBr 2 добавлен.
Ответы
- по отношению к реагентам
- по отношению к реагентам
Стоит отметить, что при добавлении или удалении реагентов или продуктов значение K eq не изменяется .Химическая реакция просто смещается предсказуемым образом, чтобы восстановить концентрации, так что выражение K eq возвращается к правильному значению.
Как равновесие реагирует на изменение давления? Изменения давления не оказывают заметного влияния на твердую или жидкую фазы. Однако давление сильно влияет на газовую фазу. Из принципа Ле Шателье следует, что повышение давления смещает равновесие в сторону реакции с меньшим числом молей газа, а понижение давления смещает равновесие в сторону реакции с большим числом молей газа.Если количество молей газа одинаково на обеих сторонах реакции, давление не имеет значения.
Пример \(\PageIndex{2}\):
Как изменится это равновесие, если увеличить давление?
\[N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)\без номера \]
Раствор
Согласно принципу Ле Шателье, если давление увеличить, то равновесие сместится в сторону с меньшим числом молей газа. Эта конкретная реакция показывает в общей сложности 4 моля газа в качестве реагентов и 2 моля газа в качестве продуктов, поэтому реакция смещается в сторону продуктов.
Эта конкретная реакция показывает в общей сложности 4 моля газа в качестве реагентов и 2 моля газа в качестве продуктов, поэтому реакция смещается в сторону продуктов.
Упражнение \(\PageIndex{2}\)
Как изменится это равновесие, если давление уменьшится?
\[3O_{2}(g)\rightleftharpoons 2O_{3}(g)\без номера \]
- Ответить
-
Реакция смещается в сторону реагентов.
Как влияет изменение температуры на равновесие? Это зависит от того, является ли реакция эндотермической или экзотермической. Напомним, что эндотермический означает, что энергия поглощается химической реакцией, а экзотермический означает, что энергия выделяется в результате реакции.Таким образом, энергию можно рассматривать как реагент или продукт, соответственно, реакции:
эндотермические: энергия + реагенты → продукты экзотермические: реагенты → продукты + энергия
Поскольку температура является мерой энергии системы, повышение температуры можно рассматривать как добавление энергии. Реакция будет протекать так, как будто добавляется реагент или продукт, и будет действовать соответственно, смещаясь в другую сторону. Например, если температура повышается для эндотермической реакции, по существу добавляется реагент, поэтому равновесие смещается в сторону продуктов.Снижение температуры эквивалентно уменьшению количества реагента (для эндотермических реакций) или продукта (для экзотермических реакций), и соответственно смещается равновесие.
Реакция будет протекать так, как будто добавляется реагент или продукт, и будет действовать соответственно, смещаясь в другую сторону. Например, если температура повышается для эндотермической реакции, по существу добавляется реагент, поэтому равновесие смещается в сторону продуктов.Снижение температуры эквивалентно уменьшению количества реагента (для эндотермических реакций) или продукта (для экзотермических реакций), и соответственно смещается равновесие.
Пример \(\PageIndex{3}\):
Предскажите влияние повышения температуры на это равновесие.
\[PCl_{3}+Cl_{2}\rightleftharpoons PCl_{5}+60kJ\номер\]
Раствор
Поскольку энергия указана как продукт, она производится, поэтому реакция является экзотермической.Если температура повышается, продукт добавляется к равновесию, поэтому равновесие смещается, чтобы свести к минимуму добавление дополнительного продукта: оно смещается обратно в сторону реагентов.
Упражнение \(\PageIndex{3}\)
Предскажите влияние понижения температуры на это равновесие.
\[N_{2}O_{4}+57кДж\rightleftгарпуны 2NO_{2}\номер\]
- Ответить
-
Равновесие смещается в сторону реагентов.
В случае температуры значение равновесия изменилось, потому что K eq зависит от температуры.Вот почему равновесия смещаются при изменении температуры.
Катализатор — это вещество, которое увеличивает скорость реакции. В целом катализатор не является реагентом и не расходуется, но все же влияет на скорость протекания реакции. Однако катализатор не влияет на степень или положение реакции в равновесии. Это помогает реакции быстрее достичь равновесия.
Химия повсюду: равновесие в саду
Гортензии – распространенные цветковые растения по всему миру.Хотя многие гортензии белые, есть один распространенный вид ( Hydrangea macrophylla ), цветы которого могут быть красными или синими, как показано на прилагаемом рисунке. Как получается, что у растения могут быть такие разноцветные цветы?
Как получается, что у растения могут быть такие разноцветные цветы?
Интересно, что цвет цветков обусловлен кислотностью почвы, в которую посажена гортензия.Проницательный садовник может отрегулировать pH почвы и фактически изменить цвет цветов. Однако на окраску цветков влияют не ионы H + или OH − . Скорее, именно присутствие алюминия вызывает изменение цвета.
Растворимость алюминия в почве и способность растений поглощать его зависят от кислотности почвы. Если почва относительно кислая, алюминий лучше растворяется, и растения легче его усваивают.В этих условиях цветки гортензии голубые, так как ионы Al взаимодействуют с антоциановыми пигментами в растении. В более основных почвах алюминий растворяется хуже, и в этих условиях цветки гортензии красные. Садоводы, которые меняют рН своих почв, чтобы изменить цвет цветков гортензии, таким образом, используют принцип Ле Шателье: количество кислоты в почве изменяет равновесие растворимости алюминия, что, в свою очередь, влияет на цвет цветов.
Ключевые выводы
- Принцип Ле Шателье описывает, как смещается равновесие при изменении условий равновесия.
- Направление сдвига можно предсказать по изменениям концентрации, температуры или давления.
- Катализаторы не влияют на положение равновесия; они помогают реакциям быстрее прийти к равновесию.
Упражнение \(\PageIndex{1}\)
- Дайте определение Принцип Ле Шателье .
- Что понимается под стрессом? Какими способами может быть нарушено равновесие?
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения.\[H_{2}(g)+I_{2}(s)+53kJ\rightleftharpoons 2HI(g)\nonumber \]
- пониженная температура
- повышенное давление
- удаление HI
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения. \[H_{2}(g)+F_{2}(g)\rightleftharpoons 2HF(g)+546kJ\nonumber \]
- повышенная температура
- дополнение H 2
- пониженное давление
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения.
 \[2SO_{2}(g)+O_{2}(g)\rightleftharpoons 2SO_{3}(g)+196kJ\nonnumber \]
\[2SO_{2}(g)+O_{2}(g)\rightleftharpoons 2SO_{3}(g)+196kJ\nonnumber \]
- удаление SO 3
- добавление O 2
- пониженная температура
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения. \[CO_{2}(g)+C(s)+171kJ\rightleftharpoons 2CO(g)\nonnumber \]
- добавление CO
- повышенное давление
- добавление катализатора
- Синтез NH 3 использует эту химическую реакцию.\[N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)+92kJ\nonumber \]
Определите три напряжения, которые можно приложить к равновесию, чтобы максимизировать количество NH 3 . - Синтез CaCO 3 использует эту химическую реакцию. \[CaO(s)+CO_{2}(g)\rightleftharpoons CaCO_{3}(s)+180kJ\nonumber \]
Определите три напряжения, которые можно наложить на равновесие, чтобы максимизировать количество CaCO 3 .
Ответы
- Когда равновесие нарушается, равновесие смещается, чтобы минимизировать это напряжение.
-
-
-
по отношению к реагентам
-
по отношению к реагентам
-
к продуктам
-
-
-
-
к продуктам
-
к продуктам
-
к продуктам
-
-
-
повышенное давление, пониженная температура, удаление NH 3
13.
 3 Сдвигающиеся равновесия: принцип Ле Шателье — химия 2e
3 Сдвигающиеся равновесия: принцип Ле Шателье — химия 2e Цели обучения
К концу этого раздела вы сможете:
- Описывать способы воздействия на равновесную систему
- Предсказать реакцию равновесия в напряженном состоянии, используя принцип Ле Шателье
Равновесная система находится в состоянии динамического равновесия, при этом прямая и обратная реакции протекают с одинаковой скоростью. Если в равновесной системе изменить условия, по-разному влияющие на скорость этих реакций (напряжение ), то скорости перестанут быть равными, и система не будет находиться в равновесии.Впоследствии в системе произойдет результирующая реакция в направлении большей скорости (сдвиг ), которая восстановит равновесие. Это явление резюмируется принципом Ле Шателье: если равновесная система подвергается стрессу, в ответ на стресс система испытывает сдвиг, который восстанавливает равновесие .
На скорость реакции в первую очередь влияют концентрации, как описано в законе скорости реакции, и температура, как описано в уравнении Аррениуса.Следовательно, изменения концентрации и температуры являются двумя стрессами, которые могут сместить равновесие.
Эффект изменения концентрации
Если в равновесной системе изменить концентрацию реагента или продукта, скорость прямой или обратной реакции изменится. В качестве примера рассмотрим равновесную реакцию
h3(г)+I2(г)⇌2HI(г)Kc=50,0при 400°CCh3(г)+I2(г)⇌2HI(г)Kc=50,0при 400°CЗаконы скоростей прямой и обратной реакции
впередh3(g)+I2(g)→2HI(g)ratef=kf[h3]m[I2]nreverse2HI(g)→h3(g)+I2(g)rater=kr[HI]xforwardh3(g)+I2 (g)→2HI(g)ratef=kf[h3]m[I2]nreverse2HI(g)→h3(g)+I2(g)rater=kr[HI]xКогда эта система находится в равновесии, скорости прямой и обратной реакции равны.
Если система подвергается стрессу путем добавления реагента, H 2 или I 2 , результирующее увеличение концентрации приводит к увеличению скорости прямой реакции, превышающей скорость обратной реакции:
В системе произойдет временная результирующая реакция в прямом направлении для восстановления равновесия ( равновесие сместится вправо ).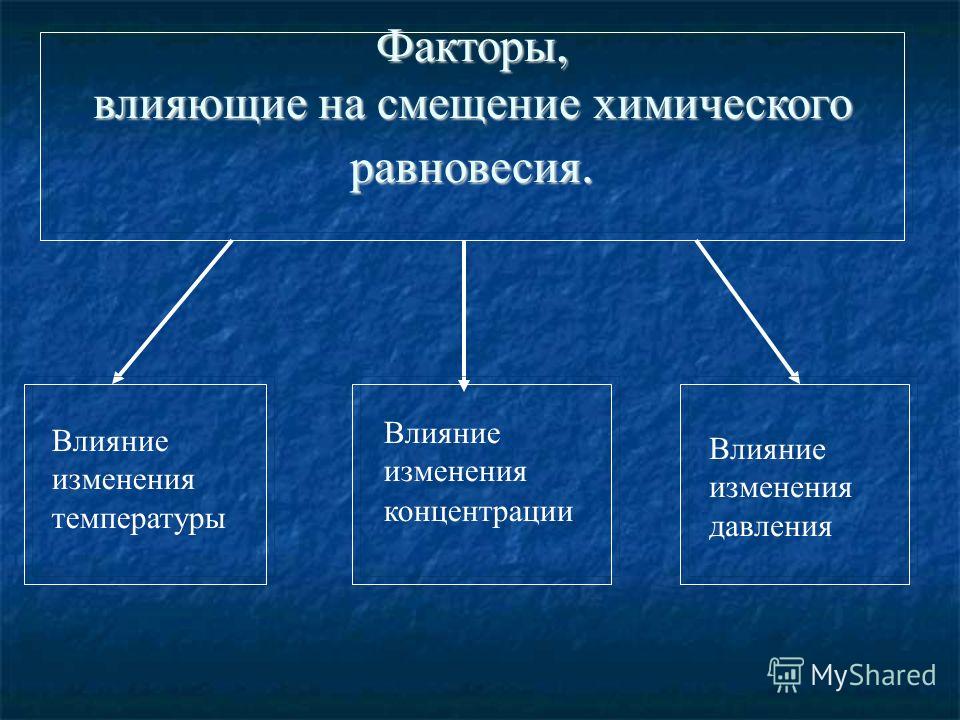 Такой же сдвиг произойдет, если из системы будет удален какой-то продукт HI, что уменьшит скорость обратной реакции, что опять-таки приведет к тому же дисбалансу скоростей.
Такой же сдвиг произойдет, если из системы будет удален какой-то продукт HI, что уменьшит скорость обратной реакции, что опять-таки приведет к тому же дисбалансу скоростей.
Та же самая логика может быть использована для объяснения сдвига влево, который является результатом либо удаления реагента, либо добавления продукта в равновесную систему. Оба эти напряжения приводят к увеличению скорости обратной реакции
и временная результирующая реакция в обратном направлении для восстановления равновесия.
В качестве альтернативы этой кинетической интерпретации влияние изменений концентрации на равновесие можно рационализировать с точки зрения коэффициентов реакции. Когда система находится в равновесии,
Qc=[HI]2[h3][I2]=KcQc=[HI]2[h3][I2]=Kc Если добавить реагент (увеличив знаменатель реакции) или удалить продукт (уменьшив числитель), то Q c < K c и равновесие сместится вправо. Обратите внимание, что три различных способа создания этого напряжения приводят к трем различным изменениям в составе равновесной смеси. Если добавить H 2 , правый сдвиг будет потреблять I 2 и производить HI по мере восстановления равновесия, давая смесь с большей концентрацией H 2 и HI и меньшей концентрацией I 2 . чем присутствовал раньше. Если добавить I 2 , новая равновесная смесь будет иметь более высокие концентрации I 2 и HI и меньшую концентрацию H 2 .Наконец, если удалить HI, концентрации всех трех видов будут ниже, когда равновесие будет восстановлено. Несмотря на эти различия в составе, значение константы равновесия после напряжения будет таким же, как и до (согласно закону действующих масс). Та же логика может быть применена к напряжениям, связанным с удалением реагентов или добавлением продукта, и в этом случае Q c > K c и равновесие сдвинется влево.
Обратите внимание, что три различных способа создания этого напряжения приводят к трем различным изменениям в составе равновесной смеси. Если добавить H 2 , правый сдвиг будет потреблять I 2 и производить HI по мере восстановления равновесия, давая смесь с большей концентрацией H 2 и HI и меньшей концентрацией I 2 . чем присутствовал раньше. Если добавить I 2 , новая равновесная смесь будет иметь более высокие концентрации I 2 и HI и меньшую концентрацию H 2 .Наконец, если удалить HI, концентрации всех трех видов будут ниже, когда равновесие будет восстановлено. Несмотря на эти различия в составе, значение константы равновесия после напряжения будет таким же, как и до (согласно закону действующих масс). Та же логика может быть применена к напряжениям, связанным с удалением реагентов или добавлением продукта, и в этом случае Q c > K c и равновесие сдвинется влево.
Для таких газофазных равновесий, как это, заслуживают упоминания некоторые дополнительные перспективы изменения концентраций реагентов и продуктов.Парциальное давление P идеального газа пропорционально его молярной концентрации M ,
и, таким образом, изменения парциального давления любого реагента или продукта, по существу, являются изменениями концентрации и, таким образом, оказывают такое же влияние на равновесие. Помимо добавления или удаления реагента или продукта, давления (концентрации) частиц в газофазном равновесии также можно изменить, изменив объем, занимаемый системой . Поскольку все виды газофазного равновесия занимают один и тот же объем, данное изменение объема вызовет одинаковое изменение концентрации как реагентов, так и продуктов.Чтобы определить, какой сдвиг, если таковой имеется, этот тип стресса вызовет стехиометрию реакции, необходимо учитывать стехиометрию реакции.
В равновесии реакция H 2 ( г ) + I 2 ( г ) ⇌ 2HI( г ) описывается соотношением реакции
QP=PHI2Ph3PI2=KpQP=PHI2Ph3PI2=KpЕсли объем, занимаемый равновесной смесью этих частиц, уменьшить в 3 раза, то парциальные давления всех трех частиц увеличатся в 3 раза:
Qp’=(3PHI)23Ph33PI2=9PHI29Ph3PI2=PHI2Ph3PI2=QP=KPQP’=QP=KPQp’=(3PHI)23Ph33PI2=9PHI29Ph3PI2=PHI2Ph3PI2=QP=KPQP’=QP=KPИтак, изменение объема этой газофазной равновесной смеси не приводит к сдвигу равновесия.
Аналогичная обработка другой системы, 2NO 2 ( г ) ⇌ 2 NO( г ) + O 2 ( г ), однако дает другой результат:
QP=PNO2PO2PNO22QP’=(3PNO)23PO2(3PNO2)2=9PNO23PO29PNO22=27PNO2PO29PNO22=3QP>KPQP’=3QP>KPQP=PNO2PO2PNO22QP’=(3PNO)23PO2(3PNO2)2=9PNO23PO29PNO2PO2=27PNO2PO2=27PNO2PO2 КП В этом случае изменение объема приводит к тому, что коэффициент реакции превышает константу равновесия, поэтому равновесие сместится влево.
Эти результаты иллюстрируют взаимосвязь между стехиометрией газофазного равновесия и эффектом изменения давления (концентрации), вызванного объемом. Если суммарные молярные количества реагентов и продуктов равны, как в первом примере, изменение объема не смещает равновесие. Если молярные количества реагентов и продуктов различны, изменение объема сдвинет равновесие в сторону, которая лучше «приспосабливается» к изменению объема. Во втором примере два моля реагента (NO 2 ) дают три моля продукта (2NO + O 2 ), поэтому уменьшение объема системы приводит к смещению равновесия влево, поскольку обратная реакция дает меньше газа (2 моль), чем прямая реакция (3 моль).И наоборот, увеличение объема этой равновесной системы приведет к сдвигу в сторону продуктов.
Ссылка на обучение
Перейдите по этой ссылке, чтобы увидеть наглядную демонстрацию того, как равновесие меняется при изменении давления.
Химия в повседневной жизни
Равновесие и безалкогольные напитки
Связь между химией и газированными безалкогольными напитками восходит к 1767 году, когда Джозеф Пристли (1733–1804) разработал метод насыщения воды углекислым газом для получения газированной воды. Подход Пристли включал производство двуокиси углерода путем взаимодействия масла купороса (серной кислоты) с мелом (карбонатом кальция).
Подход Пристли включал производство двуокиси углерода путем взаимодействия масла купороса (серной кислоты) с мелом (карбонатом кальция).
Затем диоксид углерода растворяли в воде, реагируя с образованием гидрокарбоната, слабой кислоты, которая впоследствии ионизировалась с образованием бикарбоната и ионов водорода:
растворениеCO2(г)⇌CO2(вод)гидролизCO2(вод)+h3O(ж)⇌h3CO3(вод)ионизацияh3CO3(вод)⇌HCO3-(вод)+H+(вод)растворениеCO2(г)⇌CO2(вод)гидролизCO2(вод) )+h3O(ж)⇌h3CO3(вод)ионизацияh3CO3(вод)⇌HCO3-(вод)+H+(вод) Те же равновесные реакции лежат в основе современного процесса газирования безалкогольных напитков.Напитки подвергаются воздействию высокого давления газообразного диоксида углерода во время процесса, чтобы сместить первое равновесие вверху вправо, что приводит к желаемым высоким концентрациям растворенного диоксида углерода и, в соответствии с аналогичными сдвигами в двух других равновесиях, его продуктов гидролиза и ионизации. Бутылка или банка затем почти заполняется газированным напитком, оставляя относительно небольшой объем воздуха в контейнере над поверхностью напитка ( свободное пространство ) до того, как он будет запечатан. Давление двуокиси углерода в свободном пространстве контейнера очень низкое сразу после герметизации, но оно повышается по мере восстановления равновесия растворения за счет смещения влево. Поскольку объем напитка значительно превышает объем свободного пространства, в свободное пространство теряется лишь относительно небольшое количество растворенного диоксида углерода.
Давление двуокиси углерода в свободном пространстве контейнера очень низкое сразу после герметизации, но оно повышается по мере восстановления равновесия растворения за счет смещения влево. Поскольку объем напитка значительно превышает объем свободного пространства, в свободное пространство теряется лишь относительно небольшое количество растворенного диоксида углерода.
Когда контейнер с газированным напитком открывается, слышен шипящий звук, когда сжатый CO 2 выходит из свободного пространства.Это вызывает сдвиг равновесия растворения влево, что приводит к уменьшению концентрации растворенного CO 2 и последующему сдвигу влево равновесий гидролиза и ионизации. К счастью для потребителя, равновесие растворения обычно восстанавливается медленно, поэтому напитком можно наслаждаться, пока концентрация растворенного в нем углекислого газа остается приемлемо высокой. После восстановления равновесия концентрация CO 2 ( aq ) будет значительно снижена, и напиток приобретет характерный вкус, называемый «плоским».
Фигура 13,7 Открытие бутылки с безалкогольным напитком снижает давление CO 2 над напитком, сдвигая равновесие растворения и высвобождая растворенный CO 2 из напитка. (кредит: модификация работы «D Coetzee»/Flickr)
Влияние изменения температуры
В соответствии с законом действующих масс равновесие, нарушаемое изменением концентрации, сместится, чтобы восстановить равновесие без какого-либо изменения значения константы равновесия, K .Однако когда равновесие смещается в ответ на изменение температуры, оно восстанавливается с другим относительным составом, который показывает другое значение константы равновесия.
Чтобы понять это явление, рассмотрим элементарную реакцию
Поскольку это элементарная реакция, законы скоростей для прямого и обратного хода могут быть выведены непосредственно из стехиометрии сбалансированного уравнения:
ratef=kf[A]rater=kr[B]ratef=kf[A]rater=kr[B]Когда система находится в равновесии,
. Подстановка законов скорости в это равенство и перестановка дает
Подстановка законов скорости в это равенство и перестановка дает
Видно, что константа равновесия является математической функцией констант скоростей прямой и обратной реакций.Поскольку константы скорости изменяются в зависимости от температуры, как описывается уравнением Аррениуса, само собой разумеющееся, что константа равновесия будет также изменяться в зависимости от температуры (при условии, что на константы скорости в разной степени влияет изменение температуры). Для более сложных реакций, включающих многоступенчатые механизмы реакции, существует аналогичная, но более сложная математическая связь между константой равновесия и константами скорости стадий механизма. Независимо от того, насколько сложной может быть реакция, зависимость ее константы равновесия от температуры сохраняется.
Предсказание смещения равновесия в ответ на изменение температуры удобнее всего выполнять, рассматривая изменение энтальпии реакции. Например, разложение четырехокиси диазота является эндотермическим (теплоемким) процессом:
Например, разложение четырехокиси диазота является эндотермическим (теплоемким) процессом:
В целях применения принципа Ле Шателье теплота ( q ) может рассматриваться как реагент:
тепло+N2O4(г)⇌2NO2(г)тепло+N2O4(г)⇌2NO2(г)Повышение температуры системы сродни увеличению количества реагента, поэтому равновесие сдвинется вправо.Понижение температуры системы также приведет к смещению равновесия влево. Для экзотермических процессов тепло рассматривается как продукт реакции, поэтому наблюдается обратная температурная зависимость.
Эффект катализатора
В главе, посвященной кинетике этого текста, катализатор определяется как вещество, позволяющее реакции протекать по другому механизму с повышенной скоростью. Механизм катализируемой реакции включает переходное состояние с более низкой энергией, чем некатализируемая реакция, что приводит к более низкой энергии активации, E a , и, соответственно, большей константе скорости.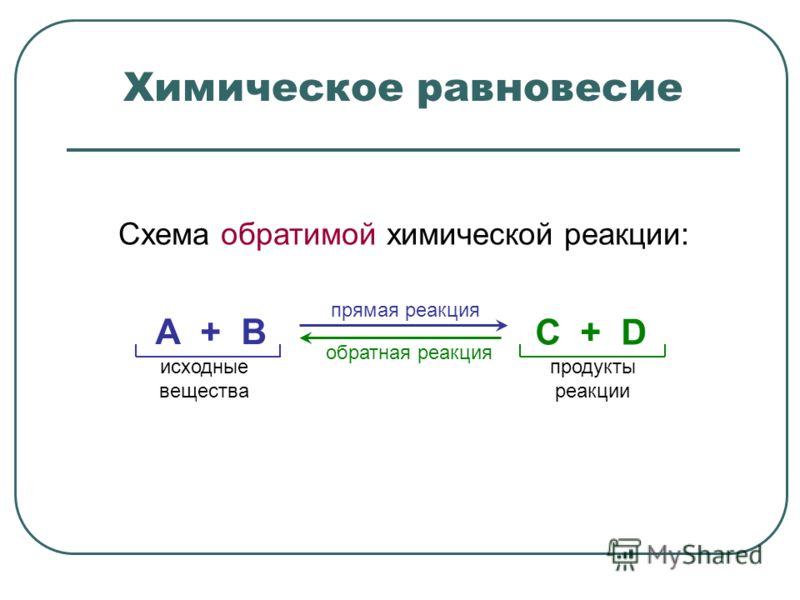
Чтобы понять влияние катализа на равновесную систему, рассмотрите диаграмму простой одностадийной (элементарной) реакции, показанную на рис. 13.8. Пониженная энергия переходного состояния катализируемой реакции приводит к пониженной энергии активации как прямой, так и обратной реакции. Следовательно, и прямая, и обратная реакции ускоряются, и равновесие достигается быстрее , но без изменения константы равновесия .
Фигура 13.8 Диаграммы реакции для элементарного процесса в отсутствие (красный) и в присутствии (синий) катализатора. Наличие катализатора снижает энергию активации как прямой, так и обратной реакции, но не влияет на значение константы равновесия.
Интересным примером, иллюстрирующим эти концепции равновесия, является промышленное производство аммиака, NH 3 . Это вещество входит в «десятку лучших» промышленных химикатов с точки зрения производства, ежегодно в США производится около двух миллиардов фунтов. Аммиак используется в качестве химического сырья для синтеза широкого спектра коммерчески полезных соединений, включая удобрения, пластмассы, красители и взрывчатые вещества.
Аммиак используется в качестве химического сырья для синтеза широкого спектра коммерчески полезных соединений, включая удобрения, пластмассы, красители и взрывчатые вещества.
В большинстве случаев промышленного производства аммиака используется процесс Габера-Боша , основанный на следующей равновесной реакции:
N2(г)+3h3(г)⇌2Nh4(г)ΔH=-92,2кJN2(г)+3h3(г)⇌2Nh4(г)ΔH=-92,2кДжОсобенности этой реакции создают проблемы для ее использования в эффективном промышленном процессе. Константа равновесия относительно мала ( K p порядка 10 -5 при 25 ° C), что означает, что в равновесной смеси присутствует очень мало аммиака.Кроме того, скорость этой реакции относительно низкая при низких температурах. Чтобы увеличить выход аммиака, промышленный процесс разработан так, чтобы он работал в условиях, благоприятствующих образованию продукта:
- Применяются высокие давления (концентрации) реагентов, ~150-250 атм, для смещения равновесия вправо, способствующего образованию продуктов.
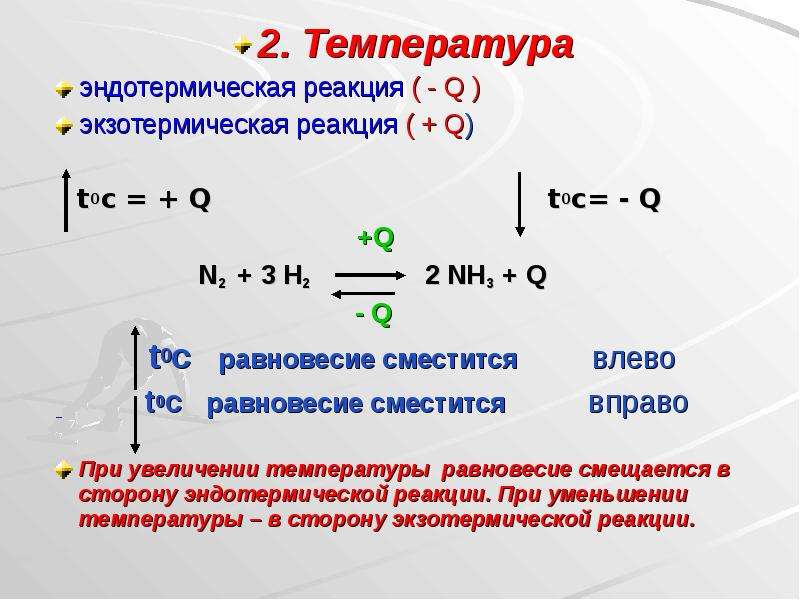
- Аммиак постоянно удаляется (собирается) из равновесной смеси во время процесса, понижая его концентрацию, а также сдвигая равновесие вправо.
- Хотя низкие температуры благоприятствуют образованию продуктов для этого экзотермического процесса, скорость реакции при низких температурах неэффективно низкая. Катализатор используется для ускорения реакции до разумных скоростей при относительно умеренных температурах (400–500 ° C).
Схема, иллюстрирующая типичную промышленную установку для производства аммиака с помощью процесса Габера-Боша, показана на рис. 13.9.
Фигура 13,9 На рисунке показана типичная промышленная установка для коммерческого производства аммиака по процессу Габера-Боша.Процесс протекает в условиях, которые напрягают химическое равновесие, чтобы способствовать образованию продукта.
Равновесие и принцип Ле-Шателье — История вопроса
Равновесие и принцип Ле-Шателье — Предыстория
Принцип Ле-Шателье — изменение концентрации |
Система находится в равновесии, если скорости прямой и обратной реакции равны. При добавлении дополнительного реагента скорость прямой реакции увеличивается.Поскольку скорость обратной реакции изначально неизменна, равновесие, по-видимому, смещается в сторону продукта или правой части уравнения. По мере расходования дополнительного реагента скорость подачи замедляется. Когда скорости прямой и обратной реакций снова сравняются, система вернется в равновесие. Удобно думать об этом как о смещении системы вправо для удаления добавленного реагента.
При добавлении дополнительного реагента скорость прямой реакции увеличивается.Поскольку скорость обратной реакции изначально неизменна, равновесие, по-видимому, смещается в сторону продукта или правой части уравнения. По мере расходования дополнительного реагента скорость подачи замедляется. Когда скорости прямой и обратной реакций снова сравняются, система вернется в равновесие. Удобно думать об этом как о смещении системы вправо для удаления добавленного реагента.
Хотя нарушенная система вернется к равновесию, это не совсем то же самое равновесие, которое существовало до приложения нагрузки.Одно различие будет заключаться в концентрациях реагентов и продуктов. Рассмотрим систему ниже:
H 2 + I 2 2 HI Если мы добавим немного водорода в систему, находящуюся в равновесии, система сдвинется вправо в попытке удалить лишний водород. Можно показать математически, что он не сможет удалить все это. Следовательно, новая равновесная концентрация водорода будет выше, чем она была в исходном равновесии. Единственный способ, которым система должна удалить водород, — это реакция с йодом.Следовательно, новая равновесная концентрация йода будет ниже, чем она была при исходном равновесии. Когда водород и йод реагируют, они образуют йодистый водород, поэтому концентрация йодистого водорода будет выше, чем в исходных равновесных условиях. Мы могли бы обобщить эффекты в таблице, подобной приведенной ниже, в которой скобки используются для представления концентраций.
Единственный способ, которым система должна удалить водород, — это реакция с йодом.Следовательно, новая равновесная концентрация йода будет ниже, чем она была при исходном равновесии. Когда водород и йод реагируют, они образуют йодистый водород, поэтому концентрация йодистого водорода будет выше, чем в исходных равновесных условиях. Мы могли бы обобщить эффекты в таблице, подобной приведенной ниже, в которой скобки используются для представления концентраций.
| прикладное напряжение | направление смены | эффект на [H 2 ] | влияет на [I 2 ] | эффект на [HI] |
| H 2 добавлен | справа | увеличилось | уменьшилось | увеличилось |
Если бы водород был удален из системы, равновесие сместилось бы влево в попытке сделать его больше.Мы могли бы математически доказать, что он не сможет пополнить его полностью и что новая равновесная концентрация водорода будет ниже, чем при исходном равновесии. Чтобы произвести больше водорода, система должна израсходовать йодистый водород, в результате чего его новая равновесная концентрация станет ниже, чем она была в исходном равновесии. При разложении йодистого водорода образуется и водорода и йода. Новая равновесная концентрация йода будет выше, чем она была при исходном равновесии.
Чтобы произвести больше водорода, система должна израсходовать йодистый водород, в результате чего его новая равновесная концентрация станет ниже, чем она была в исходном равновесии. При разложении йодистого водорода образуется и водорода и йода. Новая равновесная концентрация йода будет выше, чем она была при исходном равновесии.
| прикладное напряжение | направление смены | эффект на [H 2 ] | влияет на [I 2 ] | эффект на [HI] |
| H 2 снято | осталось | уменьшилось | увеличилось | уменьшилось |
Попрактикуйтесь в использовании принципа Ле-Шателье, предсказав, что должно произойти, если (1) йод добавить в систему, находящуюся в равновесии, (2) йод удалить из системы, находящейся в равновесии, (3) йодистый водород добавить в систему, находящуюся в равновесии, и (4) ) иодистый водород удаляется из системы при равновесии. Когда закончите, проверьте свои ответы.
Когда закончите, проверьте свои ответы.
Продолжайте использовать изменения температуры в качестве равновесного напряжения.
Химическое равновесие
Показания для этого раздела
Петруччи: Глава 15
- Часто (в наших стехиометрических расчетах) мы считаем, что реакции доходят до завершения, т.е. , что один или несколько из реагенты полностью израсходованы.
- Это предположение не всегда верно и в действительности никогда не 100% правда.
- В этом мире нет ничего стопроцентного. Не существует «чистого» вещества, нет «полной» реакции в закрытом контейнере, но мы часто можем сделать такое предположение практически без дополнительных неопределенность.
- Любая химическая система в закрытом контейнере всегда достичь состояния равновесия . Иногда это равновесие состояние может быть таким, что в контейнере почти нет продуктов или почти нет реагентов, но это все еще равновесие.
- В открытой системе некоторые реакции могут завершиться, если
устроен так, что продукт покидает систему как есть
произведено.
 Например, жидкая реакционная смесь, в которой один из
продукция представляет собой газ. Если контейнер открыт, а газ
дали сдуть, обратной реакции быть не может
поскольку этот конкретный компонент исчезнет.
Например, жидкая реакционная смесь, в которой один из
продукция представляет собой газ. Если контейнер открыт, а газ
дали сдуть, обратной реакции быть не может
поскольку этот конкретный компонент исчезнет.
Мы будем исследовать более общие случаи, когда имеет место равновесие. Равновесия могут возникать в твердом, жидком или газообразном состоянии. Начнем с газовой фазы равновесия как простой тип реакции, но общие принципы, которые мы исследуем здесь будет продолжаться и в других фазах.
Рассмотрим химическую систему в газовой фазе, представленную следующим химическим уравнение:
2 НЕТ 2 (ж) N 2 О 4 (ж)
Реактивы красновато-коричневые, продукты бесцветные. И температура, и
давление влияет на это равновесие.Более высокое давление (за счет сжатия контейнера
содержащий реакционную смесь) будет способствовать получению продукта
(бесцветный) за счет количества реагента (окрашенный) следовательно,
можно наблюдать изменение равновесия при сжатии реакционного сосуда или
расширенный (как в поршне, движущемся вверх и вниз в стеклянном цилиндре. )
)
- Определение: Равновесие:
- Применительно к химической реакционной системе: Состояние реакционной смеси при котором скорость прямой реакции равна скорости обратной реакции.
Обратите внимание, что нет ссылок на количества реагентов, необходимых для достичь этого состояния. Это означает, что некоторые равновесные системы могут иметь в основном реагенты, другие, в основном продукты и в редких случаях такое же количество реагенты и продукты. Не сумма является решающим фактором. Как правило, чем больше количество реагента или продукта, тем быстрее будет скорость, с которой происходит прямая или обратная реакция. То Зависимость между количеством вещества и скоростью реакции приведена в раздел о кинетике далее в этих примечаниях. Достаточно сказать, что в большинстве случаев, если концентрация реагентов повышается, увеличивается и скорость превращения этих реагентов в продукты.
Давайте рассмотрим простой пример:
Равновесие между реагентом А и продуктом В:
А Б
Если изначально В нет, то и обратной реакции быть не может. То
Кинетическая молекулярная теория говорит нам, что скорость реакции в некоторой степени зависит от
частота столкновений и что частота столкновений молекул A с
друг друга зависит от того, сколько молекул находится в контейнере.Это кажется
придавать смысл. Следовательно, по мере уменьшения количества А по сравнению с начальным
ситуации (израсходованной в прямой реакции) прямая скорость упадет.
Точно так же, когда количество B увеличивается из-за прямой реакции, тогда
обратная ставка будет увеличиваться с нуля. в конце концов, будет достигнута точка, где
прямая и обратная скорости равны. В этот момент и до некоторых
на систему действует напряжение, реагенты А образуются и расходуются при
одинаковые ставки, как и продукты B.Таким образом, хотя реакция продолжается
не ослабевает, мы не видим общих изменений в количестве ни A, ни B.
То
Кинетическая молекулярная теория говорит нам, что скорость реакции в некоторой степени зависит от
частота столкновений и что частота столкновений молекул A с
друг друга зависит от того, сколько молекул находится в контейнере.Это кажется
придавать смысл. Следовательно, по мере уменьшения количества А по сравнению с начальным
ситуации (израсходованной в прямой реакции) прямая скорость упадет.
Точно так же, когда количество B увеличивается из-за прямой реакции, тогда
обратная ставка будет увеличиваться с нуля. в конце концов, будет достигнута точка, где
прямая и обратная скорости равны. В этот момент и до некоторых
на систему действует напряжение, реагенты А образуются и расходуются при
одинаковые ставки, как и продукты B.Таким образом, хотя реакция продолжается
не ослабевает, мы не видим общих изменений в количестве ни A, ни B.
Рис. 1: показывает измеряемые физические параметры системы по мере ее приближения к
равновесие, начиная с условий только реагентов и нет продуктов.
Верхний график представляет собой сравнение величин скоростей прямого и
обратные реакции в системе по мере ее приближения к равновесию. В начале
реакции идет только прямая реакция, так как нет продуктов
еще реагировать.С течением времени величина форвардного курса уменьшается
а скорость обратной увеличивается. В конце концов (только через бесконечное время)
две величины равны, и химическая система достигла равновесия.
Обратите внимание, что здесь я использовал величины. Это связано с тем, что по определению
форвардный курс должен быть отрицательным значением обратного курса в состоянии равновесия. За
В иллюстративных целях я показываю здесь только величину ставок.
Нижний график показывает количество Реагентов и Продуктов одного и того же
системы по мере ее приближения к равновесию.Изначально есть только реагенты
но с течением времени образуются продукты и расходуются реагенты.
Согласно этому графику, когда достигается равновесие, количество
реагенты и продукты больше не меняются, но не обязательно равны каждому
разное. {(l+m)-(j+k)},\]
{(l+m)-(j+k)},\]
в расчете на отдельные единицы давления кПа.
Для реакции, в которой существует особое условие l+m = j+k . Неважно, какие единицы измерения мы используем (давление или концентрация), поскольку единицы измерения будут все отменяется для однофазной реакции. Для систем, где все блоки отменить, мы видим, что K c = K p = K независимо от того, какие единицы измерения мы используем.
Не все реакционные системы являются однофазными. Например,
реакции с участием давления паров некоторых химических веществ и концентраций жидкости
в реакционной смеси др.Такие константы равновесия
протекают в двухфазных реакциях. Для такого примера мы не можем вычислить
либо K c , либо K p , поскольку блоки
не все давление или вся концентрация. Более общая форма – это
константа термодинамического равновесия, K .
Нам нужно лучшее описание способности химических веществ привлекать
себя в реакции, чем концентрация или давление. Это больше
общая мера называется активностью химического вещества.
Это больше
общая мера называется активностью химического вещества.
Виды деятельности
True Константы термодинамического равновесия рассчитываются с использованием Мероприятия компонентов реакции. Мы будем использовать упрощенное определение, называемое относительная активность вещества, которая связана с некоторой стандартной мерой (концентрация, давление и т. д.) этого вещества через
Относительная активность (a) = мера/стандартная мера.
Например, если используются концентрации, единицами измерения будут моль/л.То
Стандартная концентрация водного раствора составляет 1 M . Таким образом, вещество А с
концентрация [A] (в M ) будет иметь относительную активность a A
= [А] / 1 М
(обратите внимание, что в этом случае единицы были просто аннулированы этим процессом) .
Аналогично, если парциальное давление газообразного вещества А равно p A
тогда относительная активность равна a A = p A / p A
где p A = 100 кПа. к}\]
к}\]
Поскольку отдельные виды деятельности безразмерны, то же самое и с K постоянный. Вот такая константа K нам нужна в термодинамические уравнения, такие как мы увидим в термодинамике раздел позже. Как правило, это хорошая привычка, чтобы начать использовать этот вид K постоянный исключительно.
Вернуться к началу
Пример: процесс Хабера
. Рассмотрим процесс превращение водорода и азота в аммиак.3 \times a_{\mathrm{N}_2}}\]
При комнатной температуре скорость этой реакции очень мала. Это будет казаться случайному наблюдателю, что никакой реакции не происходит. На более высоких температурах реакции ускоряются и равновесие достигается быстрее.
Пример: При 127°С были получены 3 следующих набора равновесных концентраций. измеряется для конкретной реакционной смеси. Что такое равновесие постоянная К?
P NH 3 = 103 KPA 78 P N 2 N 2 = 2830 KPA
P H 2 = 10.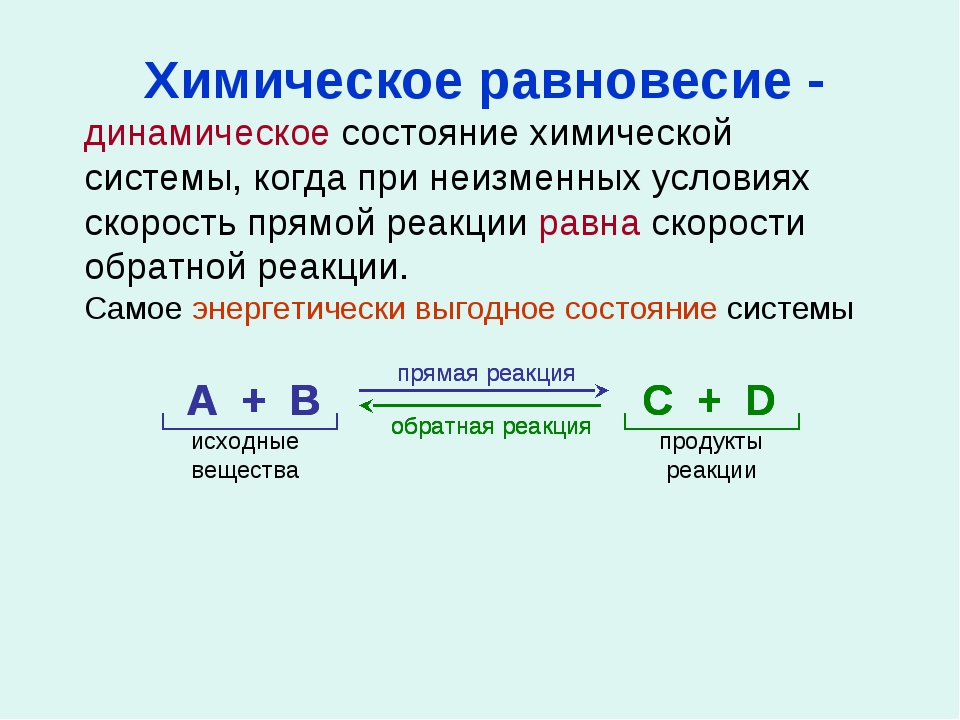 3 кПа
3 кПа
A NH 3 = 103 KPA / 100 кПа = 1.03
78 A N 2 = 2830 KPA / 100 KPA = 28,3
Таким образом, нам нужно позаботиться о том, чтобы связать конкретную константу равновесия
значение с правильным связанным выражением равновесия. То
Однако константы равновесия различных форм одного и того же уравнения равны
связанные, Например, если мы удвоим коэффициенты сбалансированного
химическое уравнение, мы удваиваем показатели активности, т.е. , мы
возводим в квадрат активности, и, следовательно, мы возводим в квадрат константу равновесия; если
мы уменьшаем вдвое коэффициенты, затем уменьшаем вдвое показатели степени (квадратный корень) и т. д.
Если мы перевернем уравнение, мы возьмем обратную величину константы K (умножить
показатели на -1).
д.
Если мы перевернем уравнение, мы возьмем обратную величину константы K (умножить
показатели на -1).
Вернуться к началу
В прошлой лекции я упомянул, что некоторые равновесия могут включать материалы в разные фазы. Мы обсудим здесь, как обращаться с некоторыми из этих случаев.
Рассмотрим случай разложения карбоната кальция на известь и углерод. диоксид:
СаСО 3 (с) CaO(т) + CO 2 (г)
Выражение константы равновесия:
\[K=\frac{a_{CaO}\times a_{CO_2}}{a_{CaCO_3}}\]
Однако концентрации твердых веществ карбоната кальция и извести не влияют на равновесие.Активность чистого твердого тела (или жидкости) всегда близки к единице, поэтому их можно исключить из уравнения с никаких изменений в результате.
К = a СО 2 .
Ваш собственный опыт также может подсказать вам это. Вы когда-нибудь добавляли
сахар в напиток (скажем, coolaid), чтобы подсластить его. Если вы похожи на большинство людей,
было время, когда нравилось только сладкое (детство).В этом
случае, вы добавили столько сахара, сколько могли, прежде чем ваша мать или отец съели
обратно в дозатор сахара, и всегда оставался немного сахара
нерастворенный на дне стакана. Неважно, сколько сахара вы добавили,
только определенное его количество действительно растворилось. Хотя это скорее
физический процесс, чем химический процесс, идея та же. Количество
сахар в растворе (концентрация) не зависел от добавления большего количества твердого сахара,
его активность равна просто 1, поэтому на значение K это не влияет.
Если вы похожи на большинство людей,
было время, когда нравилось только сладкое (детство).В этом
случае, вы добавили столько сахара, сколько могли, прежде чем ваша мать или отец съели
обратно в дозатор сахара, и всегда оставался немного сахара
нерастворенный на дне стакана. Неважно, сколько сахара вы добавили,
только определенное его количество действительно растворилось. Хотя это скорее
физический процесс, чем химический процесс, идея та же. Количество
сахар в растворе (концентрация) не зависел от добавления большего количества твердого сахара,
его активность равна просто 1, поэтому на значение K это не влияет.
Другой пример с твердыми телами и газами:
НХ 4 ГС ( с ) NH 3 (г) + H 2 S (г)
дает нам
\[K = \ frac {a _ {\ mathrm {NH} _3} \ times a _ {\ mathrm {H} _2 \ mathrm {S}}} {a _ {\ mathrm {NH} _4 \ mathrm {HS}}} \ ]
Мы можем упростить это выражение, поскольку активность чистого NH 4 HS
твердый 1. +}} {a _ {\ mathrm {HF}}} \]
+}} {a _ {\ mathrm {HF}}} \]
Обратите внимание, что мы не учитывали активность растворителя, т.к. вода, т.е.o_{\mathrm{вода}})$ будет ~1.
Вернуться к началу
Константы равновесия можно свести в таблицу и использовать по мере необходимости.
Мы можем, например, решить, будет ли конкретная реакционная система реагировать почти полностью (очень большое K) или почти совсем не завершено (очень маленькое K) или где-то между. Чем больше значение К, тем больше будет реакция. перейти вправо (больше продуктов). Чем меньше значение К, тем больше реакция найдет равновесие слева (больше реагентов).мы рассмотрим эту концепцию далее в последующих лекциях.
Коэффициент реакции
В условиях, когда система не находится в равновесии или мы не уверены,
система находится в равновесии, мы не можем использовать измеренные действия для определения
константа равновесия. Мы все еще можем использовать тот же формализм для вычисления
параметр, называемый коэффициентом реакции, Q . Коэффициент реакции — это параметр, который говорит нам о мгновенном
состояния системы независимо от того, находится ли она в равновесии или нет.Под
особых условиях, когда система находится в равновесии, то наш новый параметр,
Q = К .
Коэффициент реакции — это параметр, который говорит нам о мгновенном
состояния системы независимо от того, находится ли она в равновесии или нет.Под
особых условиях, когда система находится в равновесии, то наш новый параметр,
Q = К .
Для химической системы, независимо от того, находится она в равновесии или нет, мы можем рассчитать величина, определяемая законом действующих масс. Только если система находится в равновесии, это значение будет константой равновесия. В общем случае мы называем это значение коэффициент реакции Q . Снова принимая равновесие Габера, мы можем записать коэффициент реакции системы в любой момент времени.3 \times a_{\mathrm{N}_2}}\]
В этом случае мы не обязательно используем равновесные концентрации и следовательно, мы рассчитали не константу равновесия K , а реакцию частное Q . Теперь мы можем сравнить два значения следующим образом:
Q < K : Это означает, что реакция не
в равновесии и что реакция должна протекать до
право (сделать больше продуктов), чтобы добраться до равновесия.
Q = K : на данный момент количество продуктов и реагентов как раз подходит для удовлетворения равновесия условия.
Q > K : подразумевает, что их слишком много продукты. Реакция пойдет влево в производить больше реагента (и снижать количество продукта) до Q = К .
ПРИМЕЧАНИЕ: если вы не используете относительную активность для расчета Q и K , вы должны сравнить Q c с K c , a Q p с K p и т. д. .
Пример
Рассмотрим равновесие Габера при 500С. К = 3,5 10 -7 . Предсказывать в какую сторону сместится равновесие в каждом из следующих случаев.
| р NH 3 | р Н 2 | р Н 2 | |
а. |
4,16 кПа | 8,3 кПа | 403,5 кПа |
| б. | 0,83 кПа | 1470 кПа | 6,20 кПа |
| г. | 0,416 кПа | 416 кПа | 2,08 ?10 4 кПа |
Раствор
а.{-3}\]
Так как Q < K реакция пойдет на прямо до равновесия.
Расчет равновесных давлений и концентраций:
Обычно нас просят найти равновесные концентрации (или давления)
заданные начальные значения. Основной метод решения этих проблем всегда
то же. Я попытаюсь познакомить вас с соответствующими шагами. Заметьте, однако
что точное выполнение шагов может варьироваться от проблемы к проблеме. В
в целом этот метод называется методом таблицы ICE, где инициалы
I,C,E обозначают Initial, Change и Equilibrium соответственно. Смысл
этого метода заключается в определении равновесных значений или выражений, которые мы можем
затем подставить в выражение константы равновесия.
В
в целом этот метод называется методом таблицы ICE, где инициалы
I,C,E обозначают Initial, Change и Equilibrium соответственно. Смысл
этого метода заключается в определении равновесных значений или выражений, которые мы можем
затем подставить в выражение константы равновесия.
- Определите сбалансированное химическое уравнение для рассматриваемого равновесия. Убедитесь, что вы использовали правильную формулу (например, константа K представить уравнение, где есть один моль продуктов и т. д. …)
- Устанавливать условия (количество присутствующих реагентов и продуктов) нельзя. принимая во внимание сам процесс равновесия, т.е. , представьте, что вы можно искусственно отключить равновесную реакцию, пока вы не будете готовы.
- Теперь включите равновесие. количество x будет реагировать с использованием реагентов и производящие продукты. В одних задачах х задано, в других должно быть определенный.
- Выполните вычисления, чтобы найти неизвестное, подставив в
выражение константы равновесия для сбалансированной химической реакции, которую вы написали
на шаге 1.

Я проиллюстрирую эти шаги решением следующей задачи.
Реакция образования газообразного фтористого водорода из водорода и фтор имеет константу равновесия K , равную 1,15 10 2 . 200,0 кПа каждого соединения в день добавляют в колбу на 1,5 л. Рассчитать равновесие парциальные давления всех видов.
Для этого мы используем метод, называемый расчетом таблицы ICE. В этого метода, мы табулируем процесс вычислений таким образом, что столбцы соответствуют каждому из видов в сбалансированной химической реакции, а строки соответствуют шагам расчетов.Это: (I) начальный действия, (C) изменения в этих действиях, которые необходимы для достижения равновесие и, наконец, (Е) равновесная деятельность.
| Сбалансированное химическое уравнение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H 2 (2) + F 2 (g) | 2 ВЧ (г) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Начальная относительная активность (I). |
2.000 2.000 | 2.000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Никаких других подготовительных расчетов не требуется. Мы
можно позволить реакции протекать до равновесия. Пусть x быть общее количество реакции, выраженное как относительная активность. То индивидуальные изменения можно определить из стехиометрии следующим образом. Обратите внимание, что реагенты израсходованы, поэтому изменение отрицательное. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изменение для достижения равновесия (C) | -х -х | +2x | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Равновесная деятельность (I + C = E) | 2.2} = \frac{(2.000+2x)}{(2.000-x)}=10,7\]
После некоторых вычислений получаем х = 1,528. Таким образом теперь можно рассчитать равновесные относительные активности:
Теперь переведите относительную активность обратно в давление, умножив на стандартное давление.
сокращаются в выражении константы равновесия и, следовательно, K c = K p = K. Таким образом, мы могли бы использовать парциальные давления или концентрации непосредственно в выражении равновесия, чтобы прийти к одному и тому же числовой ответ. Как правило, вам следует использовать действия, если вы не видите явные единицы по константе равновесия. Мы можем выполнить проверку, пересчитав K из этих расчетных давлений.
чтобы убедиться, что определено правильное значение (оно есть). Этот пример было просто решить только потому, что мы случайно выбрали начальный количеств реагентов, что позволило упростить выражение с помощью квадратный корень из всего уравнения. Во многих случаях эти расчеты требуют использование формулы квадрата для получения решения. Системы с малыми константами KВ некоторых случаях мы можем воспользоваться определенными условиями, чтобы сделать некоторые предположения об ответе, что, в свою очередь, облегчит вычисление отвечать.Мы всегда должны проверять любые предположения, которые мы делаем, расчетами. я буду проиллюстрируйте это следующим примером Газообразный NOCl разлагается не полностью с образованием газов NO и Cl 2 . Первоначально учитывая, что 1,0 моль NOCl вводят в емкость объемом 2,0 л при 300 K без присутствия NO или Cl 2 , каковы равновесные давления? \[PV=nRT\] \[P=\frac{nRT}{V}\] \[P=\frac{10\times 8.3\; \mathrm{кПа}\]
a NOCl = 1,210 3 /100 = 12 Сбалансированное химическое уравнение:
, поэтому мы можем подставить эти равновесные действия в равновесные выражение:
\[К=4. Поскольку значение K по крайней мере на два порядка меньше, чем деятельности 12, мы можем попробовать следующее предположение. Мы предполагаем, что степень реакции мала (поскольку К мало), и, следовательно, х маленький. Предположим, что x настолько мало, что знаменатель (12-2 x ) можно аппроксимировать формулой (12). (или по-другому: предположим, что 2 x << 0.{-3}\] Теперь проверим справедливость нашего предположения.
0,01198 отличается от 0,012 на 0,17%. Произвольное отсечение для этих типов расчетов составляет около 5%, так что это хорошее предположение. Теперь мы можем рассчитать равновесную активность.
Опять же, мы можем проверить правильность нашей работы, заменив эти в выражение равновесия, чтобы увидеть, получим ли мы правильное значение для K (мы делаем, в пределах примерно 5%). Этот метод предположения о том, что произошла реакция (маленький x )
из-за небольшого значения K решить проблему немного проще. Системы с большими константами KКогда константа K велика, мы можем упростить расчеты, добавив один дополнительный шаг перед использованием ледяного стола.Так как K велико, почти 100% реакция протекает до достижения равновесия. В этом случае количество реакции (выполненной обычным способом) было бы почти точно таким же, как количества (предельного) реагента, и наши расчеты были бы очень трудными. Если мы сначала притворимся, что реакция завершается, а затем позволим ей обратимся к равновесию, мы получим результаты, с которыми легче работать.
Рассмотрим реакцию горения 100 кПа метана в избытке кислорода.
(80 кПа) для производства окиси углерода и газообразного водорода. CH 4 (ж) + 1/2 O 2 (ж) $\rightarrow$ CO (г) + 2 H 2 (ж) К = 1,410 15 Сначала сделаем это обычным способом.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


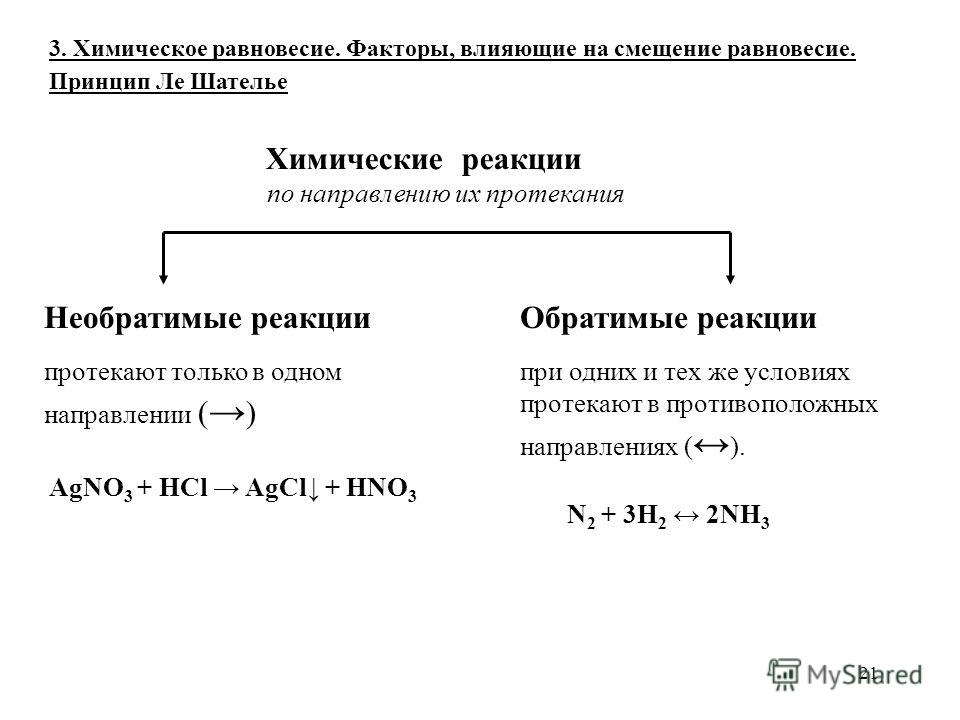 Молекулы», ученики могут:
Молекулы», ученики могут:
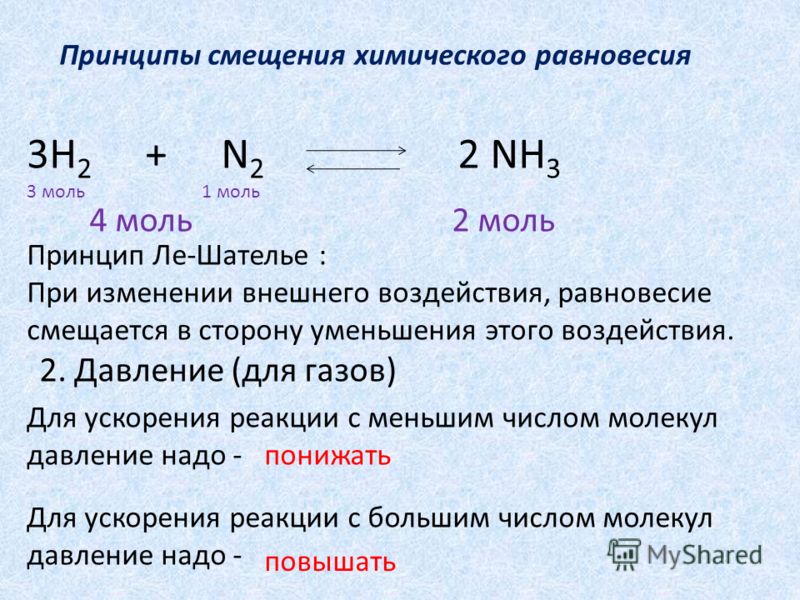
 Ознакомление с новым материалом.
Ознакомление с новым материалом. Выполните лабораторный опыт по инструкции.
Выполните лабораторный опыт по инструкции. При помощи компьютерной программы «Виртуальная лаборатория» bilimland.kz смоделируйте химическую реакцию:
При помощи компьютерной программы «Виртуальная лаборатория» bilimland.kz смоделируйте химическую реакцию:
 На некоторое время это помогло. Но что произошло впоследствии?
На некоторое время это помогло. Но что произошло впоследствии?

 kz/ru/courses/simulyaczii/ximiya/lesson/princzip_le_shatele_
kz/ru/courses/simulyaczii/ximiya/lesson/princzip_le_shatele_ kz/ru/courses/chemistry-ru/obshaya-ximiya/osnovnye-zakonomernosti-protekaniya-ximicheskix-reakczii/ximicheskoe-ravnovesie
kz/ru/courses/chemistry-ru/obshaya-ximiya/osnovnye-zakonomernosti-protekaniya-ximicheskix-reakczii/ximicheskoe-ravnovesie


 000 + 21.528
000 + 21.528 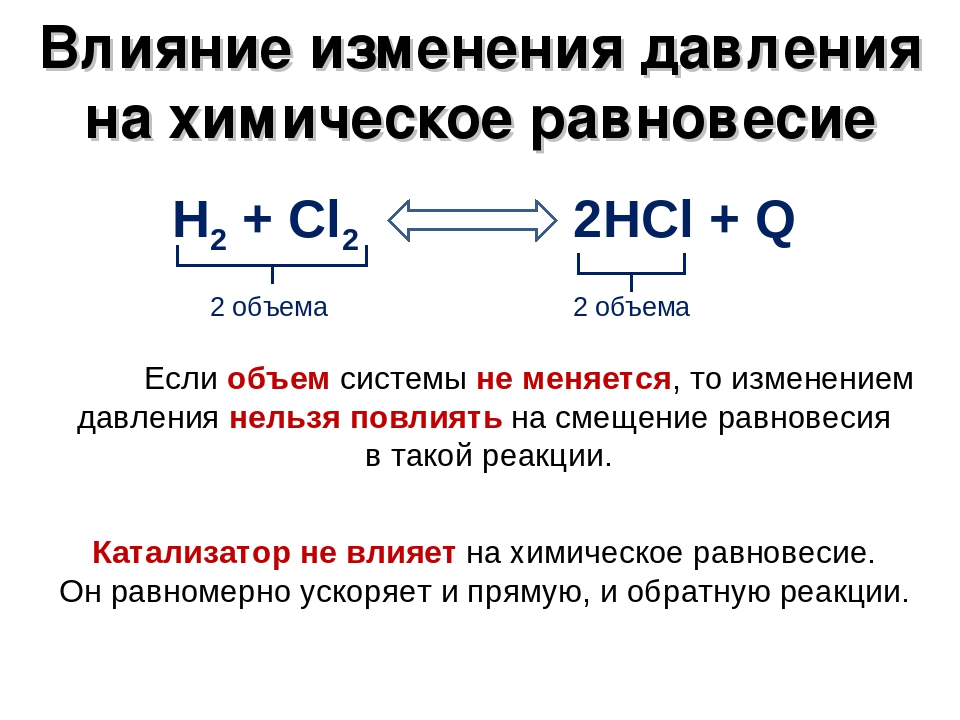
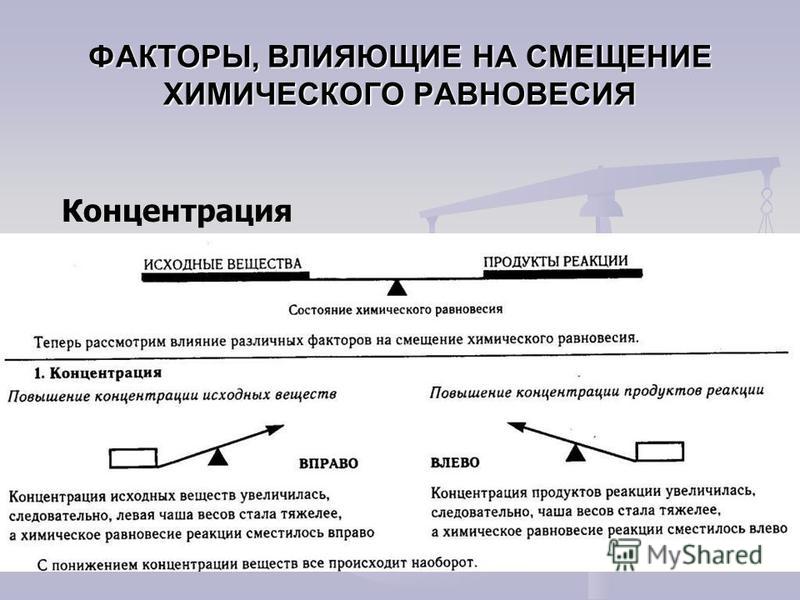 Вы всегда должны переводить все свои единицы в СИ, чтобы гарантировать
что вы получите правильный числовой ответ в конце. я не конвертировал
от длины до метра 3 . Почему это сработало?
Вы всегда должны переводить все свои единицы в СИ, чтобы гарантировать
что вы получите правильный числовой ответ в конце. я не конвертировал
от длины до метра 3 . Почему это сработало?  2}\]
2}\]

 Это
действителен большую часть времени, если константа K составляет не менее двух порядков величины
меньше, чем деятельности. Вы можете видеть, что в этом случае мы были на грани.
Наши ответы были точными примерно до 2 сиг. инжир Если бы нам нужно было больше точности на
наши числовые ответы, мы не могли сделать предположение.
Это
действителен большую часть времени, если константа K составляет не менее двух порядков величины
меньше, чем деятельности. Вы можете видеть, что в этом случае мы были на грани.
Наши ответы были точными примерно до 2 сиг. инжир Если бы нам нужно было больше точности на
наши числовые ответы, мы не могли сделать предположение. 
 {1/2}}\]
{1/2}}\]
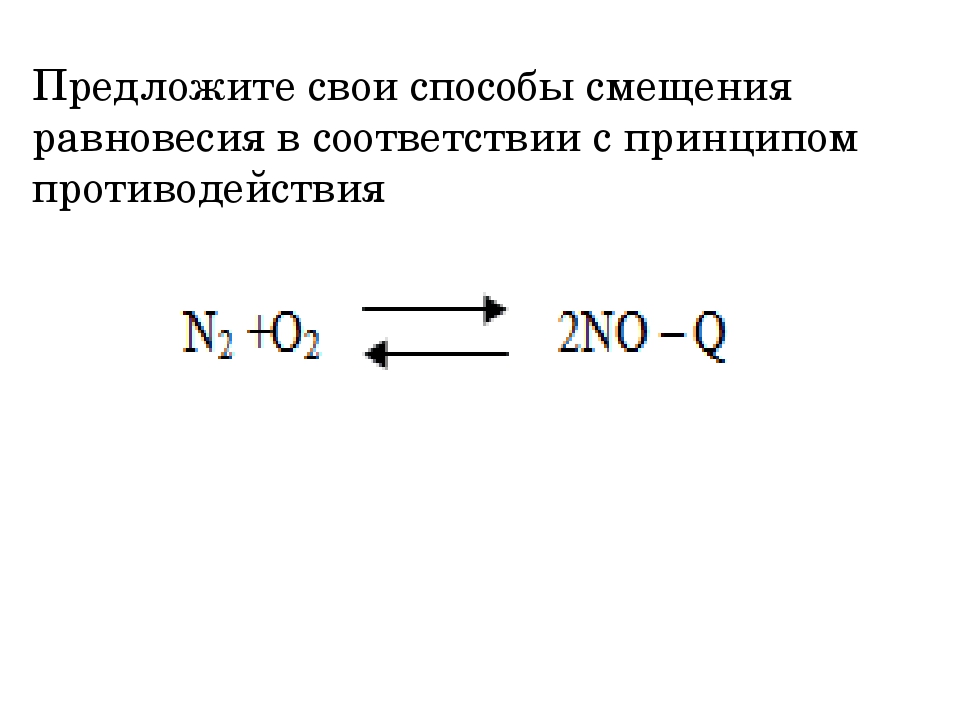 )
) 


 {-2}\]
{-2}\]
 отзыв n i /V
= P i /RT . Если n i есть
постоянна, то при изменении объема V концентрация ( n i /V )
изменится и P i .
отзыв n i /V
= P i /RT . Если n i есть
постоянна, то при изменении объема V концентрация ( n i /V )
изменится и P i . Если мы сожмем сосуд так, чтобы увеличить
давления (каждого парциального давления) мы изменим равновесие. LP предсказывает
что равновесие сместится вправо, чтобы уменьшить дополнительное давление. То
новое равновесие будет достигнуто при наличии большего количества продуктов, чем раньше.
Если мы сожмем сосуд так, чтобы увеличить
давления (каждого парциального давления) мы изменим равновесие. LP предсказывает
что равновесие сместится вправо, чтобы уменьшить дополнительное давление. То
новое равновесие будет достигнуто при наличии большего количества продуктов, чем раньше. Думать об этом
используя ЛП, нужно помнить, что все реакции связаны с разрывом связей
(поглощение энергии) и/или образование новых (выделение энергии). Это
чрезвычайно редко можно найти химическую реакцию, в которой поглощаемая энергия
точно равна выделяемой энергии. В общем можно предположить, что есть
всегда некоторое чистое изменение энергии, связанное с химической реакцией.Нам надо
рассматривайте это чистое изменение как реагент или продукт для использования LP.
Думать об этом
используя ЛП, нужно помнить, что все реакции связаны с разрывом связей
(поглощение энергии) и/или образование новых (выделение энергии). Это
чрезвычайно редко можно найти химическую реакцию, в которой поглощаемая энергия
точно равна выделяемой энергии. В общем можно предположить, что есть
всегда некоторое чистое изменение энергии, связанное с химической реакцией.Нам надо
рассматривайте это чистое изменение как реагент или продукт для использования LP.  Поскольку
в новом равновесии продуктов меньше, чем в старом, новая константа K будет равна
меньше, чем старый (с ростом T K падает).
Поскольку
в новом равновесии продуктов меньше, чем в старом, новая константа K будет равна
меньше, чем старый (с ростом T K падает). 
 {набл.})} \]
{набл.})} \]
 710 -4
710 -4  Его исследования привели его к следующему заключению:
Его исследования привели его к следующему заключению: 

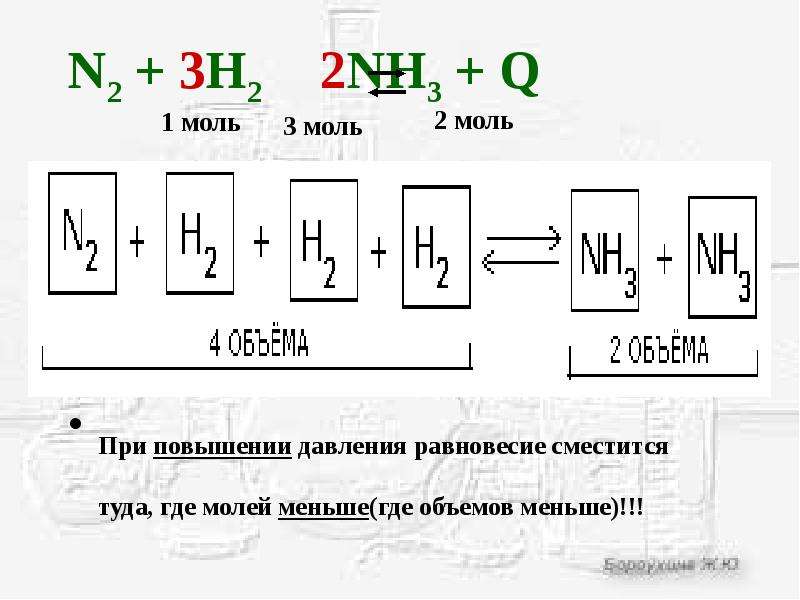 Дополнительное давление может быть уменьшено, если молекулы могут реагировать и уменьшать общее количество присутствующих молекул.
Дополнительное давление может быть уменьшено, если молекулы могут реагировать и уменьшать общее количество присутствующих молекул. Если по обе стороны уравнения находится одинаковое количество молекул газа, изменение давления не повлияет на равновесие.
Если по обе стороны уравнения находится одинаковое количество молекул газа, изменение давления не повлияет на равновесие.
 Химическое равновесие является примером динамического
баланс между противодействующими силами прямой и обратной реакции
не
статический баланс.
Химическое равновесие является примером динамического
баланс между противодействующими силами прямой и обратной реакции
не
статический баланс. 
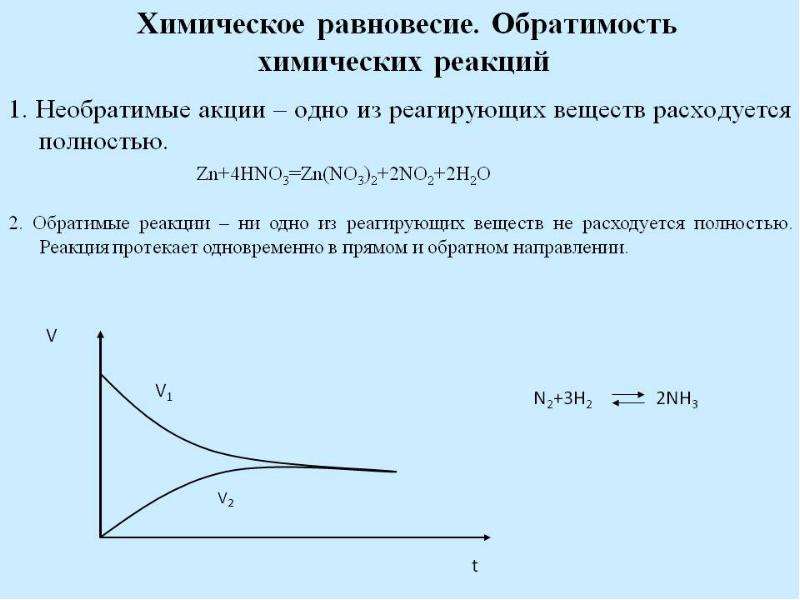
 Когда реакция достигает равновесия,
зависимость между концентрациями реагентов и
продукты, описываемые выражением константы равновесия, будут
всегда быть одинаковым. При 25 o С эта реакция всегда
достигает равновесия, когда отношение этих концентраций равно 1,3
х 10 4 .
Когда реакция достигает равновесия,
зависимость между концентрациями реагентов и
продукты, описываемые выражением константы равновесия, будут
всегда быть одинаковым. При 25 o С эта реакция всегда
достигает равновесия, когда отношение этих концентраций равно 1,3
х 10 4 .  »
» 

 Предположим, например, что мы знаем равновесие
константы следующих газофазных реакций при 200 o С.
Предположим, например, что мы знаем равновесие
константы следующих газофазных реакций при 200 o С.

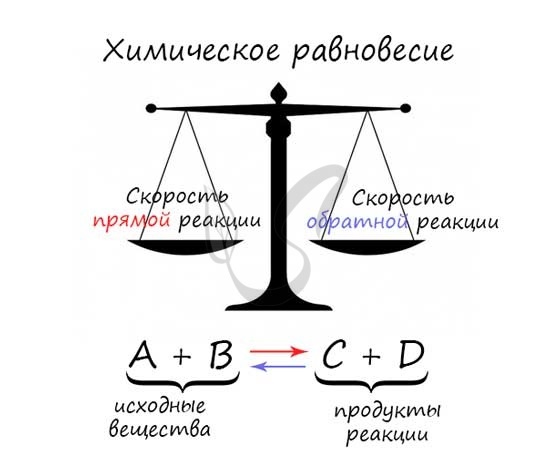

 Таким образом, реакция должна превратить часть реагентов в
продукты приходят в равновесие.
Таким образом, реакция должна превратить часть реагентов в
продукты приходят в равновесие.
 Если это не так, относительный размер Q c
и K c сообщите нам направление в
которые должна сместить реакция, чтобы достичь равновесия. Теперь нам нужен
способ предсказать, как далеко должна зайти реакция, чтобы достичь
равновесие. Предположим, вы столкнулись со следующим
проблема.
Если это не так, относительный размер Q c
и K c сообщите нам направление в
которые должна сместить реакция, чтобы достичь равновесия. Теперь нам нужен
способ предсказать, как далеко должна зайти реакция, чтобы достичь
равновесие. Предположим, вы столкнулись со следующим
проблема.  100 молей
за литр и отсутствует PCl 3 или Cl 2
в системе, когда мы начинаем, давайте рассчитаем
концентрации PCl 5 , PCl 3 и
Cl 2 в равновесии.
100 молей
за литр и отсутствует PCl 3 или Cl 2
в системе, когда мы начинаем, давайте рассчитаем
концентрации PCl 5 , PCl 3 и
Cl 2 в равновесии. 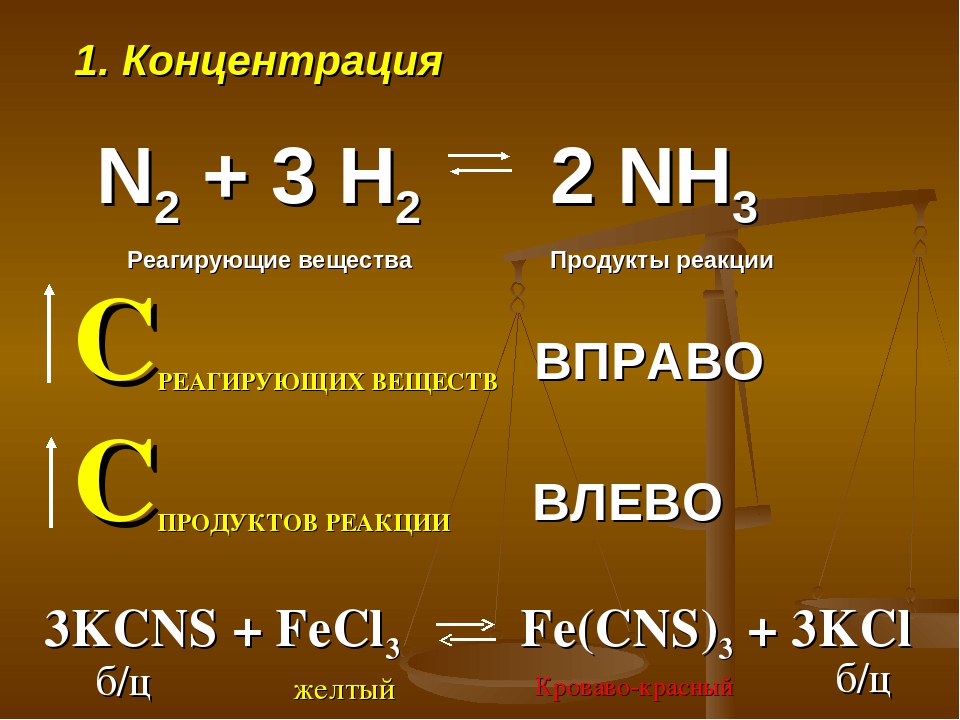 030
030  Первоначально в колбе содержится 0,100 моль/л.
литр PCl 5 и без PCl 3 или Cl 2 .
Наша цель – рассчитать равновесные концентрации этих
три вещества.
Первоначально в колбе содержится 0,100 моль/л.
литр PCl 5 и без PCl 3 или Cl 2 .
Наша цель – рассчитать равновесные концентрации этих
три вещества.  Поскольку
реакция должна сместиться вправо, чтобы достичь равновесия, PCl 5
концентрация станет меньше, а PCl 3 и
Концентрация Cl 2 станет больше.
Поскольку
реакция должна сместиться вправо, чтобы достичь равновесия, PCl 5
концентрация станет меньше, а PCl 3 и
Концентрация Cl 2 станет больше.  042 моля на литр.
042 моля на литр.  Мы можем определить
(ПКл 5 ),
например, как величина изменения концентрации
PCl 5 , который возникает при разложении этого соединения до
формы PCl 3 и Cl 2 .
Мы можем определить
(ПКл 5 ),
например, как величина изменения концентрации
PCl 5 , который возникает при разложении этого соединения до
формы PCl 3 и Cl 2 . 
 То
концентрации обоих этих веществ при равновесии будут
превышает их первоначальную концентрацию.
То
концентрации обоих этих веществ при равновесии будут
превышает их первоначальную концентрацию. 
 100 М
100 М 

 проблема.
проблема. 

 Потому что в два раза больше молей SO 2
в виде молей O 2 , изменение
концентрация SO 2 по мере того, как реакция доходит до
равновесия должно быть в два раза больше, чем изменение
концентрация O 2 . Потому что два моля SO 3
потребляются на каждый произведенный моль O 2 , изменение
в SO 3 концентрация должна быть в два раза больше, чем
изменение концентрации O 2 .
Потому что в два раза больше молей SO 2
в виде молей O 2 , изменение
концентрация SO 2 по мере того, как реакция доходит до
равновесия должно быть в два раза больше, чем изменение
концентрация O 2 . Потому что два моля SO 3
потребляются на каждый произведенный моль O 2 , изменение
в SO 3 концентрация должна быть в два раза больше, чем
изменение концентрации O 2 .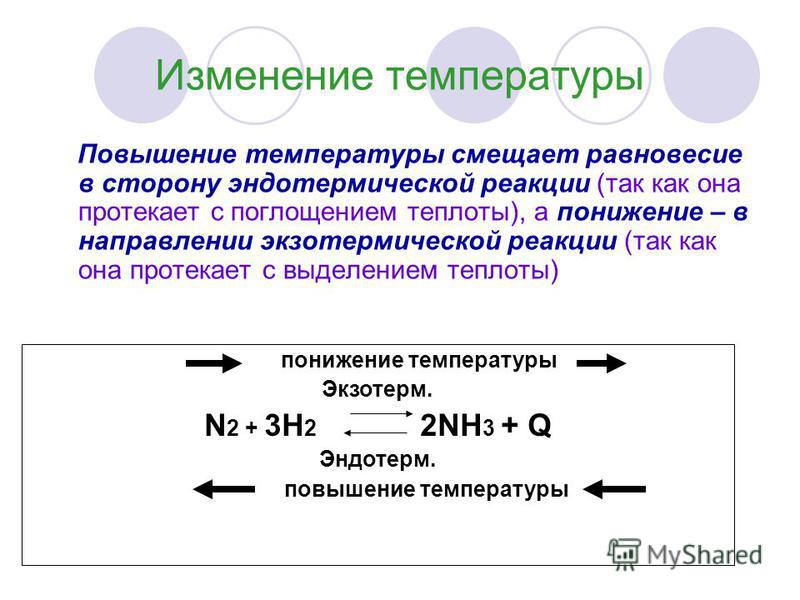 Эти проблемы решаются
с общей стратегией, которая состоит из предположения или
приближение, которое превращает их в более простые задачи. То
следующие общие правила будут направлять наше обсуждение методов
приближение.
Эти проблемы решаются
с общей стратегией, которая состоит из предположения или
приближение, которое превращает их в более простые задачи. То
следующие общие правила будут направлять наше обсуждение методов
приближение. 


 обеспечивает.
обеспечивает. 
 050 молей на литр и начальная концентрация
H 2 составляет 0,100 моль на литр. Рассчитать
равновесные концентрации трех компонентов
эта реакция при 500 o С, если равновесие
константа реакции при этой температуре равна 0,040.
050 молей на литр и начальная концентрация
H 2 составляет 0,100 моль на литр. Рассчитать
равновесные концентрации трех компонентов
эта реакция при 500 o С, если равновесие
константа реакции при этой температуре равна 0,040.  Рассмотрим следующую задачу,
Например.
Рассмотрим следующую задачу,
Например.  Давайте посчитаем
концентрация трех
компоненты этой реакции при
равновесие.
Давайте посчитаем
концентрация трех
компоненты этой реакции при
равновесие.  100 М
100 М 
 Это предположение справедливо только при Q c
того же порядка, что и K c .(Когда Q c и K c
оба много больше 1 или намного меньше 1.) Мы можем решить
проблемы, для которых Q c не подходит
K c путем переопределения начального
условия так, что Q c становится близким
до K c (см. рис. ниже).
Это предположение справедливо только при Q c
того же порядка, что и K c .(Когда Q c и K c
оба много больше 1 или намного меньше 1.) Мы можем решить
проблемы, для которых Q c не подходит
K c путем переопределения начального
условия так, что Q c становится близким
до K c (см. рис. ниже).  Поэтому давайте определим
промежуточный набор условий, которые соответствуют тому, что
произойдет, если мы сдвинем реакцию как можно дальше вправо.
Поэтому давайте определим
промежуточный набор условий, которые соответствуют тому, что
произойдет, если мы сдвинем реакцию как можно дальше вправо. 100 М
100 М  Другими словами, мы предполагаем, что 2 C равно
небольшая по сравнению со средней концентрацией NO 2
и вывести следующее приближенное уравнение.
Другими словами, мы предполагаем, что 2 C равно
небольшая по сравнению со средней концентрацией NO 2
и вывести следующее приближенное уравнение. 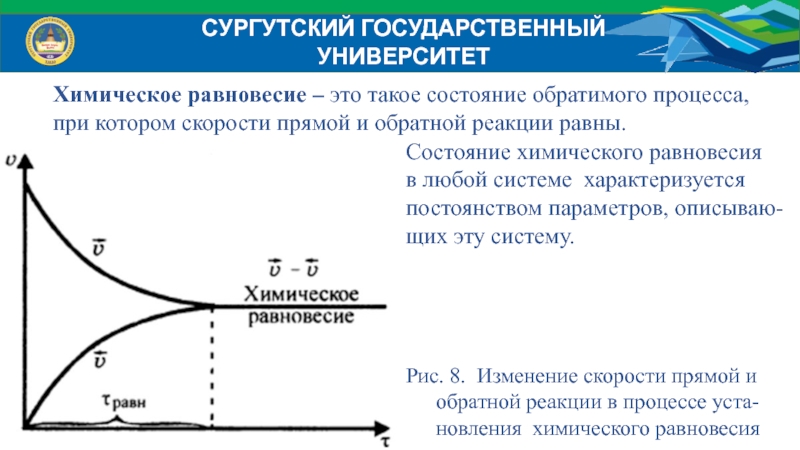
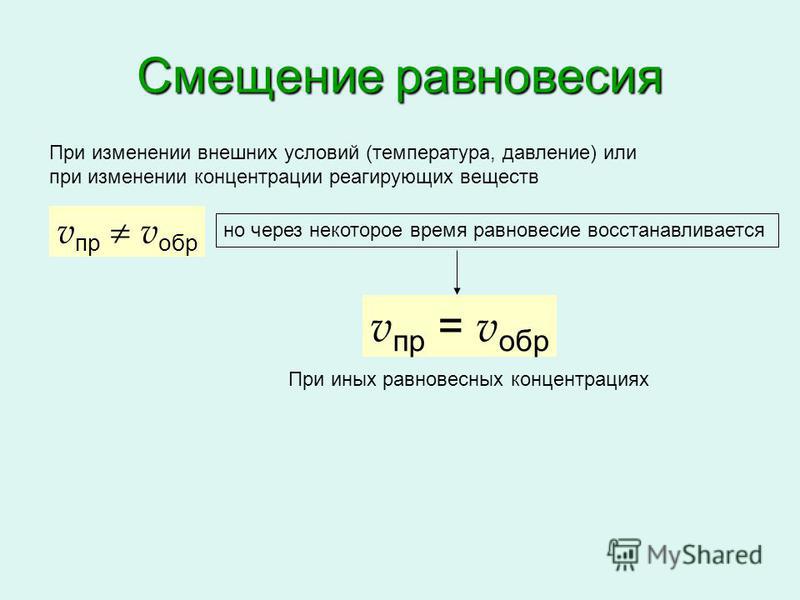


 Когда мы охлаждаем запечатанный тюбик, содержащий NO 2
в бане с сухим льдом/ацетоном при -78 90–191 o 90–192 С интенсивность
коричневая окраска газа NO 2 значительно уменьшается. Если
прогреваем пробирку на водяной бане, коричневый цвет становится
интенсивнее, чем при комнатной температуре.
Когда мы охлаждаем запечатанный тюбик, содержащий NO 2
в бане с сухим льдом/ацетоном при -78 90–191 o 90–192 С интенсивность
коричневая окраска газа NO 2 значительно уменьшается. Если
прогреваем пробирку на водяной бане, коричневый цвет становится
интенсивнее, чем при комнатной температуре.  067
067  Повышение температуры вызывает сдвиг равновесия вправо в сторону более высокой концентрации пара, но если систему поддерживать при этой более высокой температуре, равновесие снова установится.
Повышение температуры вызывает сдвиг равновесия вправо в сторону более высокой концентрации пара, но если систему поддерживать при этой более высокой температуре, равновесие снова установится.