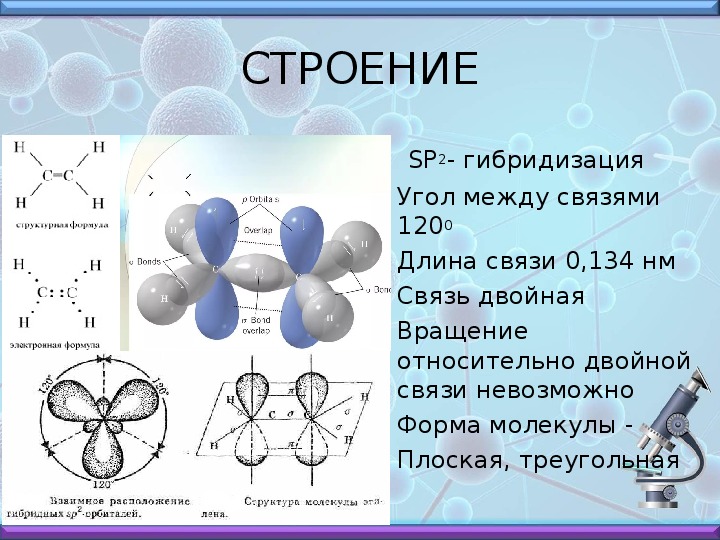
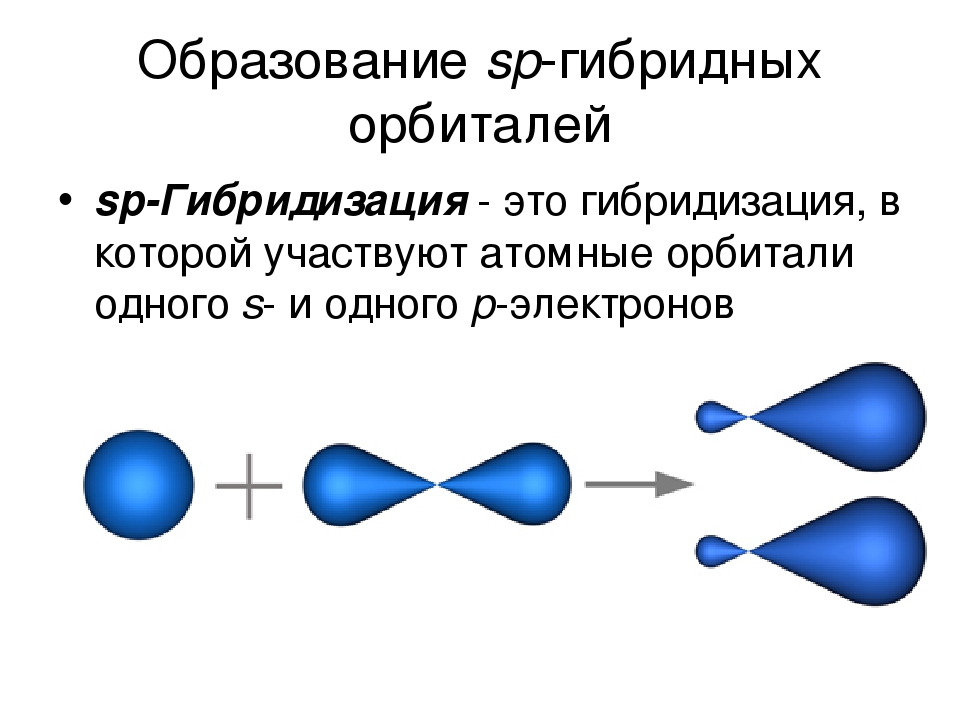
Химия — 8
Задача 1. На основе таблицы определите X, Y и Z.
Решение: Для решения задачи следует определить состояние гибридизации атома углерода в каждом соединении.
Задача 2. На основе таблицы определите X, Y и Z.
Решение: Надо написать над атомами углерода формы гибридизации и сложить гибридные орбитали. При sp3 — имеются — 4, при sp2— — 3, при sр— 2 гибридные орбитали. В таком случае:
| Углеводороды | Число гибридных орбиталей одного атома углерода, участвующих в образовании сигма-связей |
|---|---|
| H3C-CH3 этан | X |
| H2C=CH2 этилен | Y |
| HC≡CH ацетилен | Z |
| Углеводороды | Число гибридных орбиталей в молекуле |
|---|---|
| H3C-CH3 | X |
| H2C=CH2 | Y |
| HC≡CH | Z |
Число негибридизированных орбиталей, участвующих в образовании связей в углеводородах типа CxHy , равно двухкратной сумме количества водорода в его молекуле и π- связей.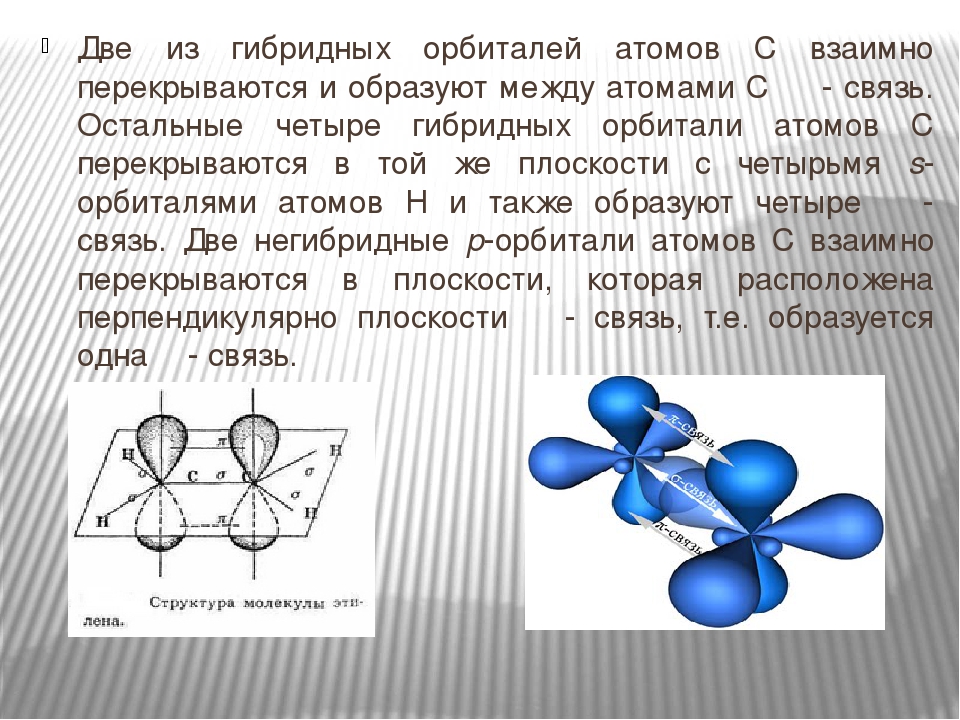 Потому что каждую π- связей образуют две негибридизированные р- орбитали.
Потому что каждую π- связей образуют две негибридизированные р- орбитали.
Задача 3. На основе таблицы определите X, Y и Z.
Решение: Как мы знаем, число негибридизированных орбиталей, участвующих в образовании связей, вычисляется по формуле.
N(негибр.орб)=N(H)+N(π)·2. ТогдаX=N(H)=6
Y=N(H)+1(π)·2=4+2=6;
Z=N(H)+2(π)·2=2+4=6
| Углеводороды | Число негибридизированных орбиталей, участвующих в образовании связей |
|---|---|
| H3C-CH3 | X |
| H2C=CH2 | Y |
| HC≡CH | Z |
Таким образом, теория гибридизации орбиталей атома способствует правильному пониманию структуры неорганических и органических соединений, а также направленности ковалентной связи.
Энергия 2в- орбитали меньше энергии 2р- орбитали. Вот почему чем больше доля в-орбитали в гибридной орбитали, тем меньше будет энергия гибридной орбитали и эта орбиталь будет более стабильной: Э(sр)<Э(sр2) <Э(sр3)
BВследствие этого, если связь образуется за счет перекрывания двух гибридных, например, sp3-sp2, sp3-sp орбиталей, в таком случае происходит смещение электронной плотности от орбитали с высокой энер — гией к орбитали с низкой энергией.
Например:
Орбитали гибридные — Энциклопедия по машиностроению XXL
При взаимодействии атомов углерода один из 25-электронов переходит в свободную 2р-ячейку, и уже у углерода на внешних оболочках получается четыре неспаренных электрона. В результате взаимного возбуждения все четыре электрона сместились со своих орбит и находятся на смешанных, или гибридных, орбитах. Это явление называется гибридизацией s- и р-электронов. [c.81]
[c.81]| Рис. 5.9. Объединение одной s-орбитали и трех р-орбиталей одного атома в четыре гибридные sp орбитали |
Так возникло представление о смешанных или гибридных связях [4]. В случае метана смешанная связь должна, очевидно, содержать одну s-орбиту и три уз-орбиты ее называют гибридизацией sjD -типа. Таких типов гибридизации может быть много. Основным преимуществом гибридной орбиты является высокая степень направленности, позволяющая осуществить более полное перекрывание и, следовательно, образовать более прочную связь. Одно из главных условий эффективной гибридизации заключается в близости энергий соответствующих атомных орбит. Как уже было указано, у тяжелых элементов орбиты с -типа часто весьма близки по энергии к s- и р-орбитам следующего слоя. В никеле, например, энергии уровней 3d, 4s и 4р различаются менее чем на 6,4-10- дж (4 эв).

Для понимания природы сил связи в металлах, особенно переходных, можно использовать представления о гибридных орбитах s—р, S — d, S—р—d) или резонансе связи [5, с. 81]. [c.26]
В аспекте квантовой химии электронное строение включает симметрию волновых функций, описывающих распределение электронов в атомах и форму электронных орбиталей, перекрывание которых ведет к образованию связей, обусловливающих геометрию молекул и ковалентных кристаллов [20—22]. Для объяснения природы металлической связи предположили [23], что внешние электроны металлов образуют резонирующие гибридные связи, однако флуктуирующие в произвольных направлениях гибридные орбитали не определяют ни числа, ни направленности связей, приводящих к конкретной структуре металлического кристалла.
Если рассмотреть линейные комбинации (гибридные функции) орбитали 2s не со всеми орбиталями 2рх, 2ру и 2р , а только с орбиталями 2рх и 2р , пе затрагивая орбиталь 2pz (sp -гибридизация), то получим три эквивалентные (нормированные) орбитали, локализованные в плоскости ху и направленные к вершинам а, Ь vi с равностороннего треугольника. Подобно равенствам (1П,18), в данном случае будем иметь [c.314]
В ряде случаев — р-гибридные орбитали можно использовать вместо Рх- И р,у-орбиталей, введенных выше при рассмотрении молекул типа ХУ2, т. е. подобных молекуле Н2О. В частности, в равенствах (111,16) вместо орбиталей (О 2рх) и (О 2рц) можно использовать следующие орбитали (опуская нормировочный множитель -Ь Х )
Функции г]) (2р,) и 1] были показаны выше, на фиг. 119. Теперь можно использовать четыре гибридные орбитали (111,76) точно таким же способом, как и орбитали р , Ру и рг, для образования связей в том случае, когда к атому углерода приближаются четыре одновалентных атома.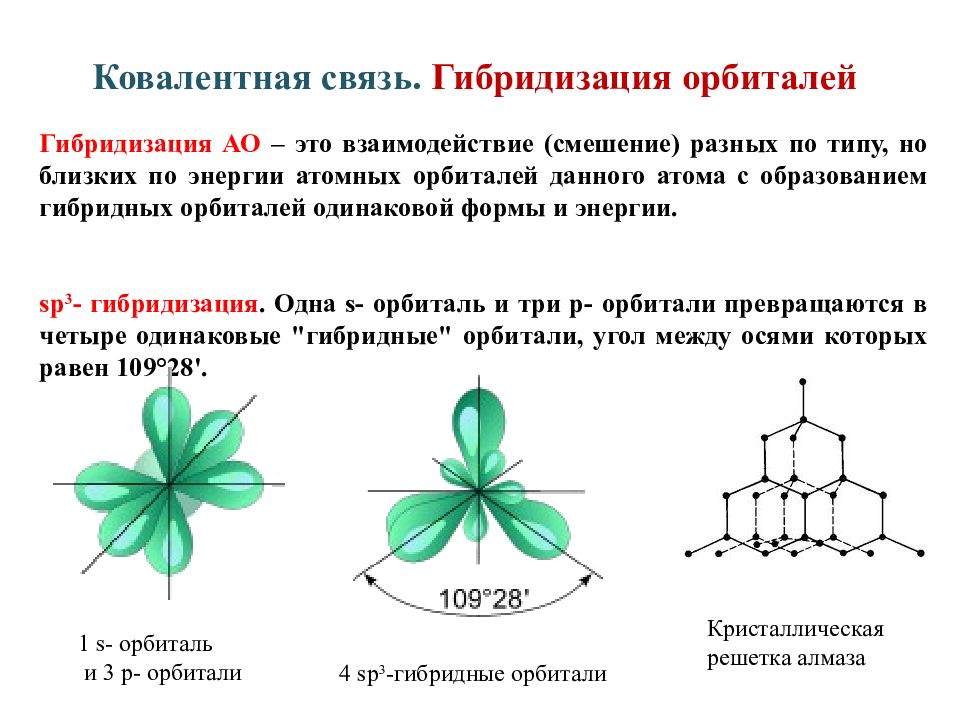 Сразу же при этом получаем, что четыре связи будут направлены к вершинам правильного тетраэдра. Кроме того, форма гибридных орбиталей отличается большей вытянутостью по одну сторону от атома углерода, чем по другую (фиг. 119, а и 119, б), а поэтому орбитали дают большее перекрывание, т.е. большее значение обменного интеграла и, следовательно, гораздо большую прочность связей, чем в случае чистых р-связей. Увеличение прочности связей при переходе к гибридным тетраэдрическим орбиталям от негибридных орбиталей компенсирует затрату энергии на возбуждение атома С в конфигурацию 5р . В этом причина высокой устойчивости соединений четырехвалентного углерода.
[c.372]
Сразу же при этом получаем, что четыре связи будут направлены к вершинам правильного тетраэдра. Кроме того, форма гибридных орбиталей отличается большей вытянутостью по одну сторону от атома углерода, чем по другую (фиг. 119, а и 119, б), а поэтому орбитали дают большее перекрывание, т.е. большее значение обменного интеграла и, следовательно, гораздо большую прочность связей, чем в случае чистых р-связей. Увеличение прочности связей при переходе к гибридным тетраэдрическим орбиталям от негибридных орбиталей компенсирует затрату энергии на возбуждение атома С в конфигурацию 5р . В этом причина высокой устойчивости соединений четырехвалентного углерода.
[c.372]
| Рис.5.3. Гибридные орбитали атома 51 на грани- Б — двукратно заполнение кремний-вакуум [18] состояния приближаются к 5-орбиталям. В-состояния — пустые зр -орбитали. Состав |
 В последнем случае возникают смещанные, так называемые гибридные орбитали.
[c.38]
В последнем случае возникают смещанные, так называемые гибридные орбитали.
[c.38]Создание окислительной среды без восстановления до чистого Ti широко применяется в сварочной технике (рутиловые электроды). Солеобразование диоксида титана в основном напоминает солеобразование диоксида кремния, но Ti — элемент 4 периода периодической системы Д. И. Менделеева, его гибридные орбитали менее устойчивы и способность образовывать комплексные ионы [Ti04] выражена тоже значительно слабее. Типичными солями для него будут метатитанаты
Ковалентные связи являются направленными, причем углы между связями зависят от числа и типа электронов, принимающих участие в образовании связи. Так, у элементов IVB подгруппы (С, Si, Ge) электронные оболочки s-орбиталей имеют сферическую форму, а электронные оболочки трех р-орбиталей вытянуты в трех взаимно перпендикулярных направлениях. Образующиеся в кристаллической рещетке этих элементов гибридные sp-орбитали имеют одинаковую форму и направлены к вершинам правильного тетраэдра. У элементов подгруппы VB только три неспаренных электрона каждый атом связан ковалентными связями только с тремя ближайшими соседями (рис. 3,6), при этом образуются двух-
[c.8]
У элементов подгруппы VB только три неспаренных электрона каждый атом связан ковалентными связями только с тремя ближайшими соседями (рис. 3,6), при этом образуются двух-
[c.8]
Третий способ гибридизации s- и рч>рбиталей состоит в ком нирова-нии лишь одной S-орбитали и одной р-орбитали, при этом две р-орбита-ли остаются невозмущенными. Это так называемая дигональная, или sp-гибридизация, в результате которой получаются две гибридные орбитали, направленные в противоположные друг от друга стороны вдоль линии, перпендикулярной направлениям невозмущенных р-орбит (рис. 4, г) sp-орбитали еще менее вытянуты в направлении своего максимального значения. [c.40]
ОЦК структуру металлов IV—VI групп пытались объяснить [44, 45] возникновением четырех гибридных dV-орбиталей, образующих связи вдоль направлений между ближайшими атомами по углам ОЦК ячейки. Оставшиеся йгг и dx y, орбитали, направленные вдоль , могли бы осуществить связи между атомами второй координационной сферы.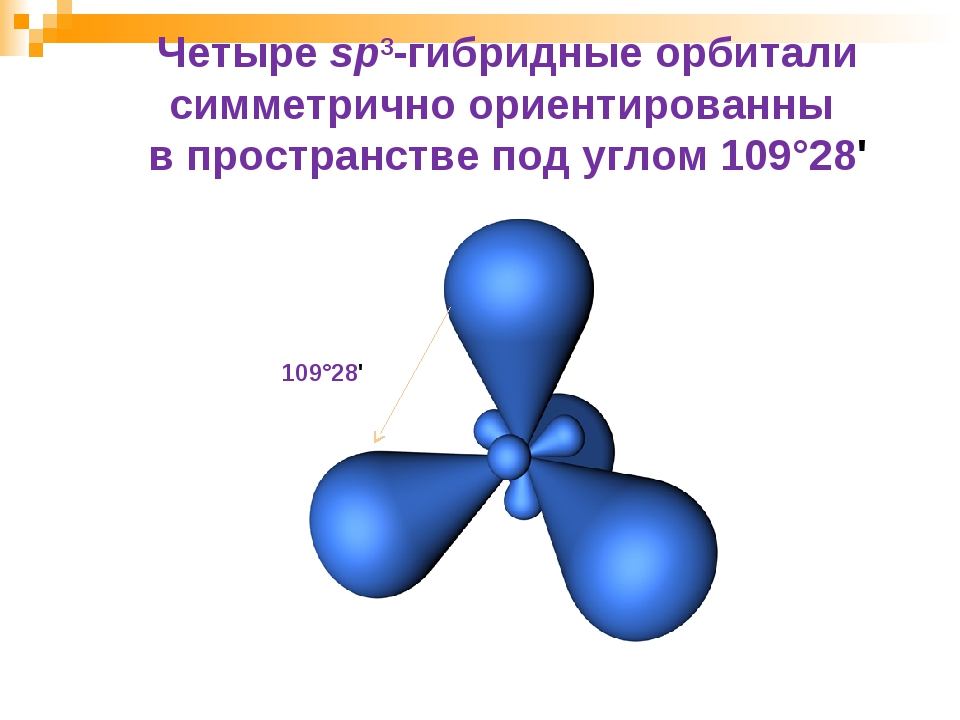
Локализованы на атомах, не образуют связей Локализованы на атомах орбитали образуют гибридные связи Коллективизированы электронный газЪзаимодейству-ет «с остовами Неметаллического атома 2рТпереходят в d-полосу атома металла [c.87]
Электронные структуры элементов, представленные в табл. 2, присущи изолированным шля свободным атомам, у которых орбитали имеют дискретные значения энергии. Однако при сближении атомов элемента значения энергии внешних орбиталей не остаются дискретными, а размываются в определенный интервал энергий, известный под названием энергетической зоны (см.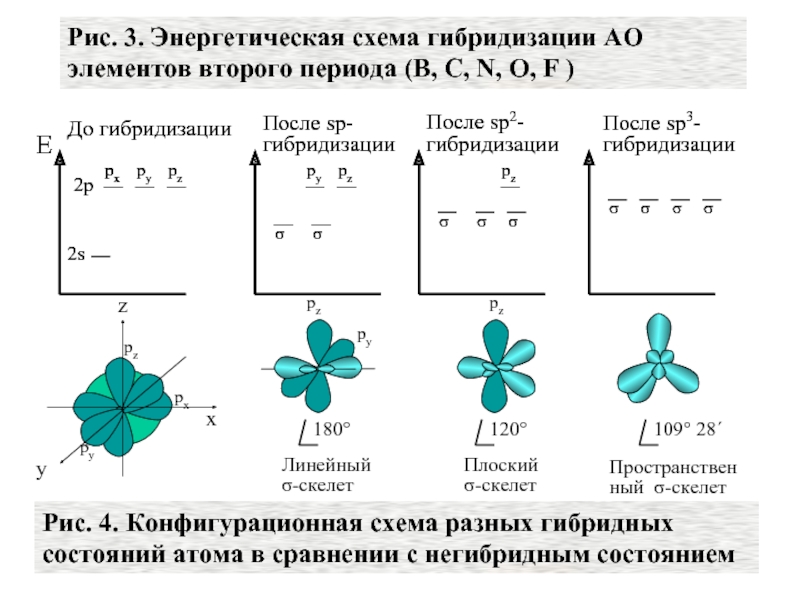 гл. II). Когда атомы какого-либо элемента приводятся в очень тесное соприкосновение, как, например, в кристалле, то энергетические зоны, связанные с различными орбиталями, могут оказаться настолько широкими, что при этом некоторые из них будут перекрываться, в результате чего возможно образование гибридных орбиталей. Например , ns- и ир-орбитали могут в результате гибридизации давать sp-гибридные орбитали, а ns-, пр-и (п — 1) (i-орбитали могут образовывать sjD -гибридные орбитали. Эти гибридные орбитали вносят определенный вклад в силы межатомного взаимодействия в кристалле.
[c.19]
гл. II). Когда атомы какого-либо элемента приводятся в очень тесное соприкосновение, как, например, в кристалле, то энергетические зоны, связанные с различными орбиталями, могут оказаться настолько широкими, что при этом некоторые из них будут перекрываться, в результате чего возможно образование гибридных орбиталей. Например , ns- и ир-орбитали могут в результате гибридизации давать sp-гибридные орбитали, а ns-, пр-и (п — 1) (i-орбитали могут образовывать sjD -гибридные орбитали. Эти гибридные орбитали вносят определенный вклад в силы межатомного взаимодействия в кристалле.
[c.19]
Ковалентная связь отличается от ионной тем, что все ковалентные связи, исходящие от данного атома, жестко связывают его с каждым другим атомом, т. е., иными словами, ковалентные связи являются пространственно нап рае ленными. Точные угловые соотношения между связями зависят как от числа, так и от типа электронов, принимающих участие в образовании связи. Например, известно, что электронные облака s-орбиталей являются сферически симметричными, электронные облака трех р-орбиталей вытянуты в трех взаимно перпендикулярных направлениях, d- и /-орбитали имеют еще более сложное строение электронного облака.
 Однако у большинства кристаллов в образовании связей принимают участие электроны, располагающиеся на гибридных орбиталях. При этом пространственное расположение связей зависит от того, какие из орбиталей играют доминирующую роль. Например, принято считать, что в случае алмаза один S -электрон может перейти на / -орбиталь, в результате чего все четыре внешних электрона оказываются неспаренными. При этом, если в случае чистых s- и р-орбиталей три р-орбитали располагаются под прямыми углами друг к другу, а s-орбиталь является ненаправленно.й, в алмазе образуются четыре гибридные sp-орби-тали, которые направлены к вершинам правильного тетраэдра (см. фиг. 6, г).
[c.23]
Однако у большинства кристаллов в образовании связей принимают участие электроны, располагающиеся на гибридных орбиталях. При этом пространственное расположение связей зависит от того, какие из орбиталей играют доминирующую роль. Например, принято считать, что в случае алмаза один S -электрон может перейти на / -орбиталь, в результате чего все четыре внешних электрона оказываются неспаренными. При этом, если в случае чистых s- и р-орбиталей три р-орбитали располагаются под прямыми углами друг к другу, а s-орбиталь является ненаправленно.й, в алмазе образуются четыре гибридные sp-орби-тали, которые направлены к вершинам правильного тетраэдра (см. фиг. 6, г).
[c.23]Увеличение прочности связей при переходе от подгруппы IA к подгруппе IVB связано с ростом вклада р-уровнеи в гибридные sp-орбитали и соответствующим изменением природы межатомной связи от чисто металлической у элементов подгруппы IA до чисто ковалентной у элементов подгруппы IVB. Чрезвычайно высокая температура плавления, низкое значение сжимаемости и малый атомный радиус у алмаза свидетельствуют о значительно большей прочности ковалентной связи по сравнению с металлической, осуществляемой при помощи свободных электронов.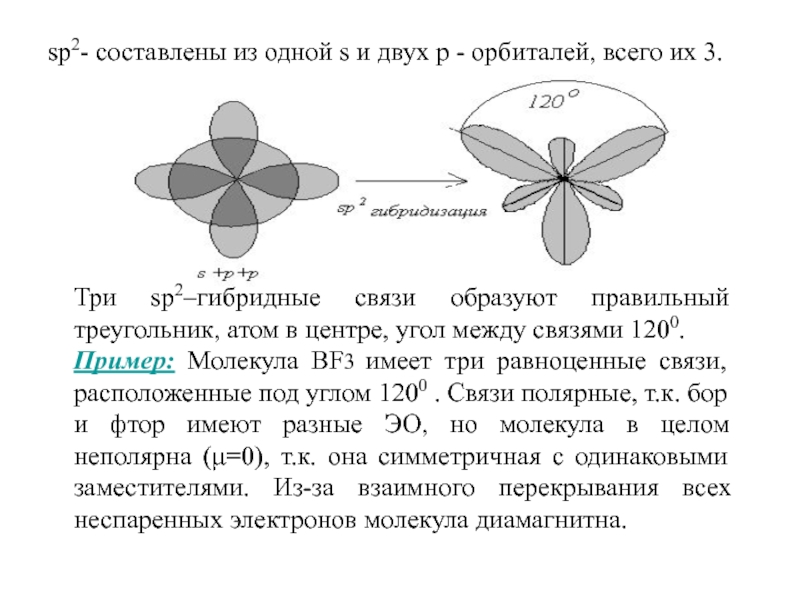 Уменьшение прочности связи в кристаллах при переходе от подгруппы IVB к нулевой подтверждается увеличением сжимаемости и атомных радиусов у фосфора (VB) и серы (VIB), а также чрезвычайно низкими значениями температур плавления у твер дых двухатомных и инертных газов. Это не означает, что у элементов подгрупп VB — VI IB ковалентные связи становятся слабее.
[c.48]
Уменьшение прочности связи в кристаллах при переходе от подгруппы IVB к нулевой подтверждается увеличением сжимаемости и атомных радиусов у фосфора (VB) и серы (VIB), а также чрезвычайно низкими значениями температур плавления у твер дых двухатомных и инертных газов. Это не означает, что у элементов подгрупп VB — VI IB ковалентные связи становятся слабее.
[c.48]
Гибридные орбитали или гибридные волновые функции электронов получаются путем линейной комбинации двух или более индивидуальны волновых функций электронов. Например, dsp-гибридная орбиталь нолу-чается из волновых функций соответственно d-, s- и р-типа (Пелдавг [87]) [c.259]
Опзагера соотношение 102 Орбитали 16, 17, 22, 23. 27, 49, 50, 53 гибридные 19, 259, 264 Ортогонализованных плоских волн метод 96, 113 [c.325]
Рис. 64. Образование гибридных р-орбитапей между атомами металла (1) и «опасной» примеси рбит лью (в) и появление ослабленных связей (показаны пунктиром) между атомами металла, ближайшими к примеси и более удаленными, на границе зерен А и Б 6) (1861. Переход -электронов со сферической -орбитали металла на направленные зрюрбитали (показан стрелками) Переход -электронов со сферической -орбитали металла на направленные зрюрбитали (показан стрелками)
|
Эти орбитали или их комбинации с орбиталями присоединяющихся атомов носят название дигоналъных гибридных орбиталей. [c.314]
Следующий важный тип хемосорбции — образование химической связи с молекулами, обладающими сопряженными связями, включающими в себя делокализованные л-электроны (двойные и тройные связи). Возьмем для примера молекулу бензола. Помимо локализованных о-связей, образованных 5/Р-гибридными орбиталями атомов углерода, в образовании связи принимают участие / . -орбитали, ориентированные нормально к плоскости молекулы (тс-связи). Благодаря делокализации тс-электронов, расчеты их взаимодействий с адсорбционным центром требуют многоэлектронного подхода.
[c.214]
-орбитали, ориентированные нормально к плоскости молекулы (тс-связи). Благодаря делокализации тс-электронов, расчеты их взаимодействий с адсорбционным центром требуют многоэлектронного подхода.
[c.214]
И в этом случае можио исходить из любого приближенного метода МО плп УВ. Однако нрежде чем рассматривать этот вопрос, расширим множество пробных функций, добавив к атомным орбиталям так называемые гибридные функции. В основе того, что до сих пор в качестве пробных функции использовались атомные орбитали, лежали физические соображения. В иринциие пет фундаментальных доводов против использования любой другой функции координат электрона. Одной из возможностей было бы, например, использование в (1.6)-н (1,8) вместо отдельных атомных орбиталей линейной комбинации атомных орбиталей одного атома с выбираемыми позже коэффициентами. В случае двухатомной молекулы для этого не было никаких побуждающих причин. Если же рассматривать одновременно связи атома со всеми его блияхайшими соседями, то в качестве следующего аспекта, который необходимо учесть, выступает пространственная симметрия упорядочения. В этом сл5 чае удобно использовать в пробной функции комбинации атомных орбиталей, которые согласуются с симметрией упорядоченпя ближайших соседей относительно определенного атома. Наиболее известным примером являются р -гибридные функции атома углерода в решетке алмаза. Из 2 -орбитали и трех 2р-орбиталей строятся следующие четыре линейные комбинации
[c.21]
Химическая связь атома кремния с другими атомами осуществляется за счет гибридных 8р -орбиталей, когда один З -электрон атома кремния возбуждается при сближении с химически взаимодействующим атомом и переходит в незаполненное Зр-состояние. В результате этого образуется три р-орбитали и одна 3 -орбиталь с неспареннымк электронами. При образовании кристаллической структуры, например кремния, каждый атом, взаимодействуя с соседними, образует спин-связанные. 5 и р-орбитали с восемью электронами, которые обусловливают образование четверной координации с ковалентной связью и кристаллической решеткой типа алмаза.
 [c.7]
[c.7]В приближении, развитом первоначально Полингом, предполагается, что в кристаллах переходных металлов атомы удерживаются вместе в результате образования резонансных гибридных орбит spd, возникающих из ns-, пр- и (п — 1)с -состоя ний свободных атомов (например, 4s4p3 для случая металлов первого большого периода). Весьма важ.ным моментом гипотезы Полинга является предположение о том, что в кристаллах переходных металлов d-электроны свободных атомов разделяются на два класса 1) атомные d-орбиты, электроны которых связаны с индивидуальными атомами и не являются связующими. Именно эти электроны определяют магнитные свойства 2) связующие -орбиты, которые взаимодействуют с s- и р-ор-битами и образуют гибридные связующ.ие орбиты spd. Полинг не рассматривал различия в поведении между элементами первого и последующих больших периодов и считал, что разрыв 118 [c.118]
Прочность химической связи зависит от степени перекрытия орбита-лей валентных электронов чем больше перекрытие, тем прочнее связь. Расчеты показывают, что перекрытие электронных оболочек соединяющихся атомов в случае гибридных 5р -орбиталей оказывается существенно больше, чем в случае негибридных 5- и р-орбиталей. Хотя гибриди-зованным состояниям соответствует более высокая энергия электронов в атоме, чем негибридизованным, тем не менее полная энергия кристалла оказывается ниже в случае образования связи из 5р -гибридов, поэтому гибридизация и оказывается энергетически выгодной.
[c.39]
Расчеты показывают, что перекрытие электронных оболочек соединяющихся атомов в случае гибридных 5р -орбиталей оказывается существенно больше, чем в случае негибридных 5- и р-орбиталей. Хотя гибриди-зованным состояниям соответствует более высокая энергия электронов в атоме, чем негибридизованным, тем не менее полная энергия кристалла оказывается ниже в случае образования связи из 5р -гибридов, поэтому гибридизация и оказывается энергетически выгодной.
[c.39]
В образовании ковалентной связи могут принимать участие 5-, р-, с1 и /-орбитали. Если происходит гибридизация при образовании связи, то в зависимости от того, сколько и каких орбит гибридизуется, различают зр-, зр -, 5р -, зр — и 5р -гибридные орбитали (рис. 2.11). [c.39]
Нормальный ковалентный радиус атома отвечает случаю, когда атом образует столько ковалентных связей, сколько соответствует его месту в периодической таблице для углерода — 2, для азота — 3 и т. д. При этом получаются разные значения нормальных радиусов в зависимости от кратности (порядка) связи (единичная связь, двойная, тройная).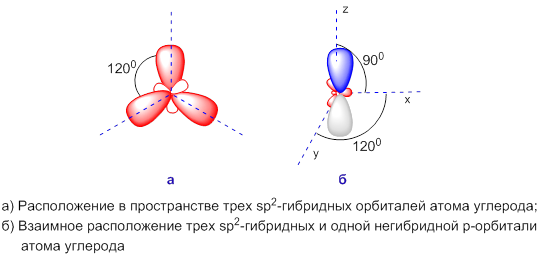 Если связь образуется при перекрытии гибридных электронных облаков, то говорят о тетраэдрических (Zk = 4, sp -гибридные орбитали), октаэдрических (Zk = 6, ii sp -гибридные орбитали), квадратичных (Zk = 4, iisp -гибридные орбитали), линейных (Zk = 2, sp-гибридные орбитали) ковалентных радиусах.
[c.53]
Если связь образуется при перекрытии гибридных электронных облаков, то говорят о тетраэдрических (Zk = 4, sp -гибридные орбитали), октаэдрических (Zk = 6, ii sp -гибридные орбитали), квадратичных (Zk = 4, iisp -гибридные орбитали), линейных (Zk = 2, sp-гибридные орбитали) ковалентных радиусах.
[c.53]
Одна из схем образования связей предполагает, что внутри пятислойного пакета существуют рй -гибридные связи, которые являются резонансными. Они испытывают поворотный резонанс между шестью положениями в случае -Тец-В1- (кратность связи равна 1/3) и между тремя положениями в случае -Те1-В1- (кратность связи равна 2/3) для этого используются 6й -орбитали атомов висмута (рис. 2.30). Далее было обнаружено, что расстояние между атомами Тв1 соседних пакетов (-Те1-Те1-) оказывается меньше, чем это вытекает из предположения о связи только с помощью ван-дер-ваальсовых сил. Схема, приведенная на рис. 2.30 показывает возможность возникновения ковалентной связи между пакетами происходит гибридизация 5р- и 5й -орбиталей атомов Теь один из р-электронов переходит на -орбиталь и связь между пакетами осуществляется за счет резонирующих гибридных рй -связей кратность связи и 2/3. Таким образом, химические связи в В12Тез образуются в результате суммирования двух предложенных схем образования ковалентных связей.
[c.83]
Таким образом, химические связи в В12Тез образуются в результате суммирования двух предложенных схем образования ковалентных связей.
[c.83]
Типы гибридизации атома углерода в органических соединениях. Основные понятия органической химии
Гибридизация АО — это выравнивание валентных АО по форме и энергии в процессе образования химической связи .
1. В гибридизации могут участвовать только те АО, энергия которых достаточно близка (например, 2s- и 2р-атомные орбитали).
2. В гибридизации могут участвовать вакантные (свободные) АО, орбитали с неспаренными электронами и неподеленными электронными парами.
3. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов электронные пары оказались максимально удаленными друг от друга. Такое состояние молекулы отвечает минимуму энергии в силу максимального отталкивания одноименно заряженных электронов.
4. Вид гибридизации (число АО, подвергающихся гибридизации), определяется числом «атакующих» данный атом атомов и числом неподеленных электронных пар в данном атоме .
Пример. ВF 3 . В момент образования связи происходит перестройка АО атома В, переходящего в возбужденное состояние: В 1s 2 2s 2 2p 1 ® B* 1s 2 2s 1 2p 2 .
Гибридные АО располагаются под углом 120 о. Молекула имеет форму правильного треугольника (плоская, треугольная):
3. sp 3 -гибридизация. Такой вид гибридизации характерен для атомов 4-ой группы (например, углерода, кремния, германия ) в молекулах типа ЭХ 4 , а также для атома С в алмазе, молекулах алканов, для атома N в молекуле NH 3 , NH 4 + , атома О в молекуле Н 2 О и т.д.
Пример 1. СН 4 . В момент образования связи происходит перестройка АО атома С, переходящего в возбужденное состояние: С 1s 2 2s 2 2p 2 ® С* 1s 2 2s 1 2p 3 .
Гибридные АО располагаются под углом 109 о 28″.
Пример 2.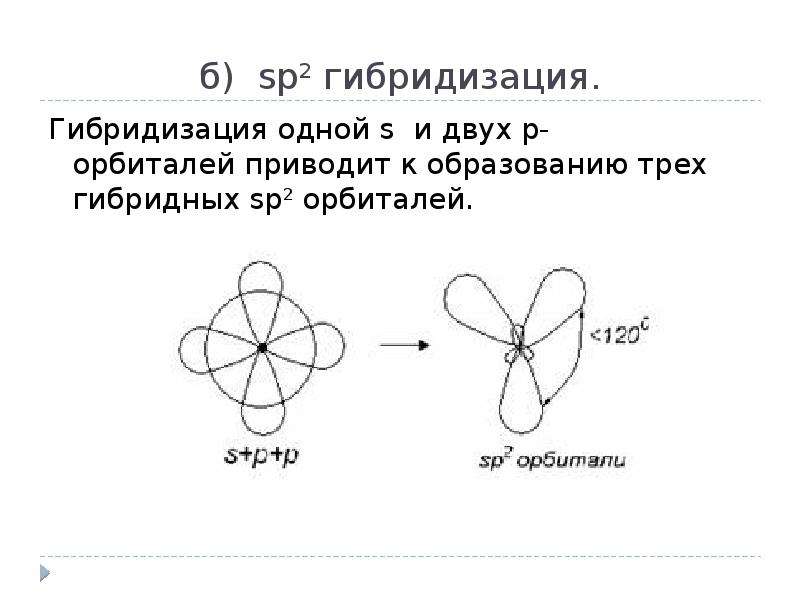 NН 3 и NН 4 + .
NН 3 и NН 4 + .
Электронная структура атома N: 1s 2 2s 2 2p 3 . Гибридизации подвергаются 3 АО, содержащие неспаренные электроны, и 1 АО, содержащая неподеленную электронную пару. В силу более сильного отталкивания неподеленной электронной пары от электронных пар s-связей угол связи в молекуле аммиака составляет 107,3 о (ближе к тетраэдрическому, а не к прямому).
Молекула имеет форму тригональной пирамиды :
Представления об sp 3 -гибридизации позволяют объяснить возможность образования иона аммония и равноценность связей в нем.
Пример 3. Н 2 О.
Электронная структура атома О 1s 2 2s 2 2p 4 . Гибридизации подвергаются 2 АО, содержащие неспаренные электроны, и 2 АО, содержащие неподеленные электронные пары. Угол связи в молекуле воды составляет 104,5 о (также ближе к тетраэдрическому, а не к прямому).
Молекула имеет угловую форму :
Представления об sp 3 -гибридизации позволяют объяснить возможность образования иона оксония (гидроксония) и образование каждой молекулой 4-х водородных связей в структуре льда.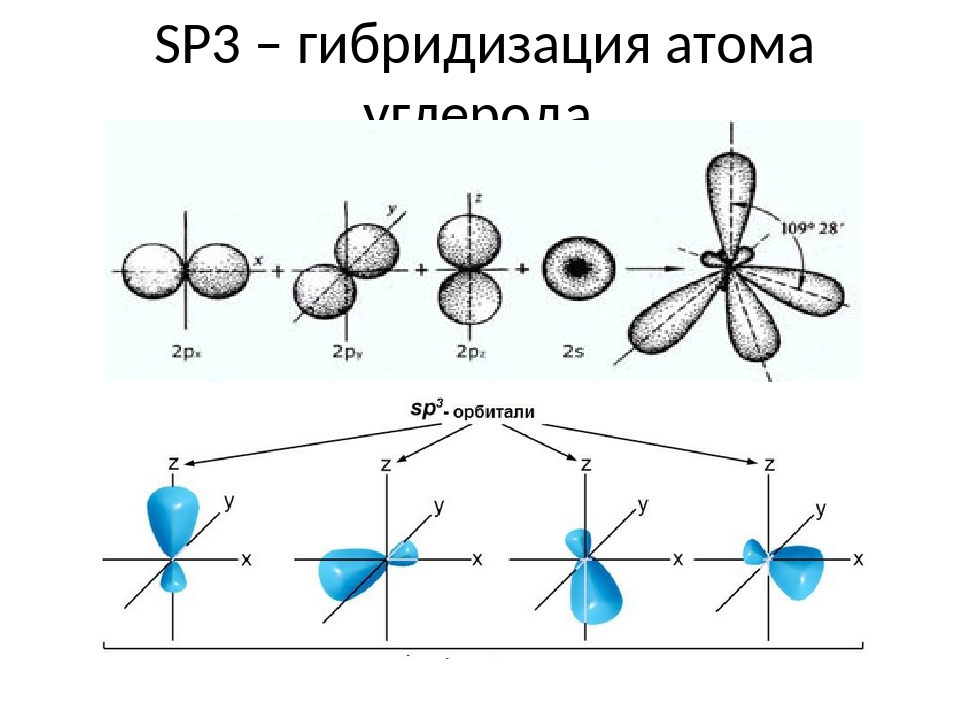
4. sp 3 d-гибридизация. Такой вид гибридизации характерен для атомов элементов 5-ой группы (начиная с Р) в молекулах типа ЭХ 5 .
Пример. РСl 5 . Электронная структура атома Р в основном и возбужденном состояниях: Р 1s 2 2s 2 2p 6 3s 2 3p 3 ® P* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 1 . Форма молекулы — гексаэдр (точнее — тригональная бипирамида) :
5. sp 3 d 2 -гибридизация. Такой вид гибридизации характерен для атомов элементов 6-ой группы (начиная с S) в молекулах типа ЭХ 6 .
Пример. SF 6 . Электронная структура атома S в основном и возбужденном состояниях: S 1s 2 2s 2 2p 6 3s 2 3p 4 ® P* 1s 2 2s 2 2p 6 3s 1 3p 3 3d 2 .
Форма молекулы — октаэдр :
6. sp 3 d 3 -гибридизация. Такой вид гибридизации характерен для атомов элементов 7 группы (начиная с Cl) в молекулах типа ЭХ 7 .
Пример. IF 7 . Электронная структура атома F в основном и возбужденном состояниях: I 5s 2 3p 5
® I* 5s 1 3p 3 3d 3
. Форма молекулы — декаэдр (точнее
— пентагональная бипирамида)
:
Форма молекулы — декаэдр (точнее
— пентагональная бипирамида)
:
7. sp 3 d 4 -гибридизация. Такой вид гибридизации характерен для атомов элементов 8 группы (кроме Не и Ne) в молекулах типа ЭХ 8 .
Пример. ХеF 8 . Электронная структура атома Хе в основном и возбужденном состояниях: Хе 5s 2 3p 6 ® Хе* 5s 1 3p 3 3d 4 .
Форма молекулы — додекаэдр :
Могут быть и другие виды гибридизации АО.
Для объяснения фактов, когда атом образует большее число связей, чем число неспаренных электронов в его основном состоянии (например, атом углерода), используется постулат о гибридизации близких по энергии атомных орбиталей. Гибридизация АО происходит при образовании ковалентной связи , если при этом достигается более эффективное перекрывание орбиталей. Гибридизация атома углерода сопровождается его возбуждением и переносом электрона с 2s — на 2р -АО:
Основное и возбужденное состояния атома углерода.
Гибридизация АО — это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.
Например, смешение 2s-АО с 2p -АО дает две гибридные 2sp -АО:
АО с большой разницей в энергии (например, 1s и 2р ) в гибридизацию не вступают. В зависимости от числа участвующих в гибридизации p -АО возможны следующие виды гибридизации:
для атомов углерода и азота — sp 3 , sp 2 и sp ;
для атома кислорода — sp 3 , sp 2 ;
для галогенов — sp 3 .
Гибридная АО асимметрична и сильно вытянута в одну сторону от ядра (форма неправильной восьмерки).
В отличие от негибридных s
— или р
-АО, она имеет одну большую долю, которая хорошо образует химическую связь, и малую долю, которую обычно даже не изображают. Гибридизованные АО при взаимодействии с орбиталями различных типов (s
-, р
— или гибридными АО) других атомов обычно дают s-МО, т. е. образуют s-связи. Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
е. образуют s-связи. Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
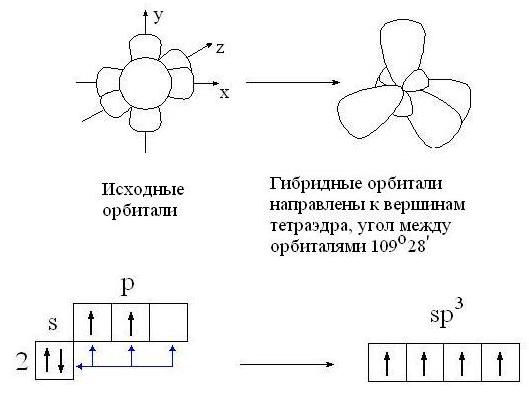
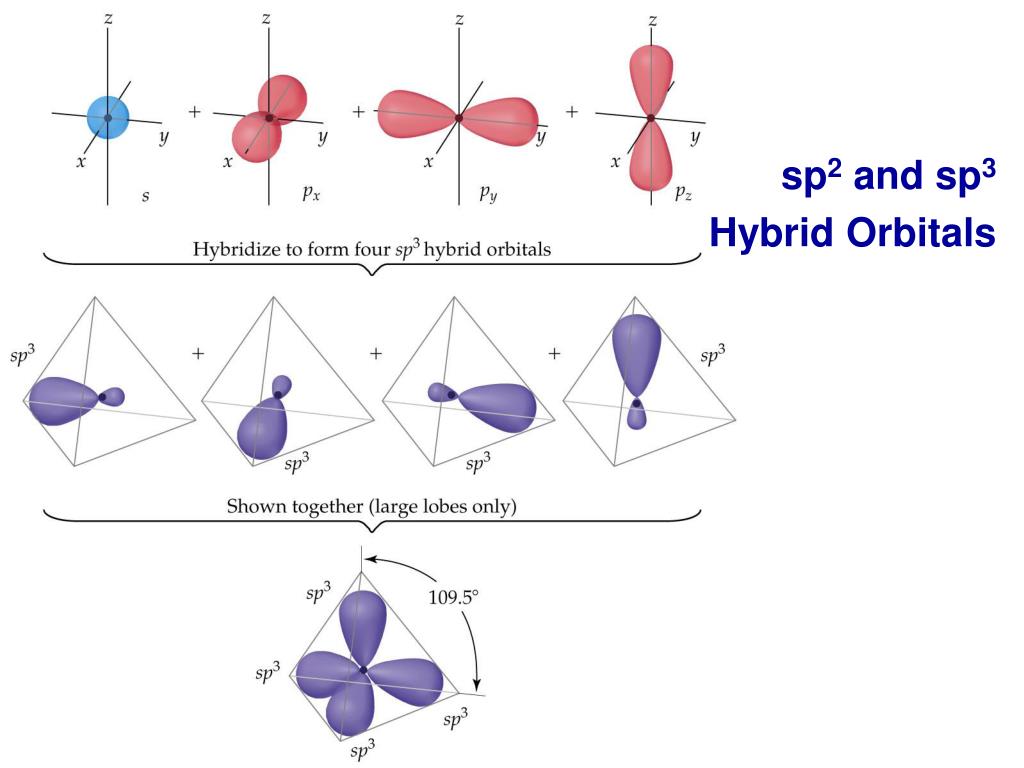
3.3.1. sp 3 -Гибридизация (тетраэдрическая).
Одна s — и три р четыре равноценные по форме и энергии sp 3 -гибридные орбитали.
Орбитальная модель атома в sp 3 -гибридизованном состоянии.
Для атома углерода и других элементов 2-го периода этот процесс происходит по схеме:
2s + 2p x + 2p y + 2p z = 4 (2sp 3)
Схема sp 3 -гибридизации атомных орбиталей.
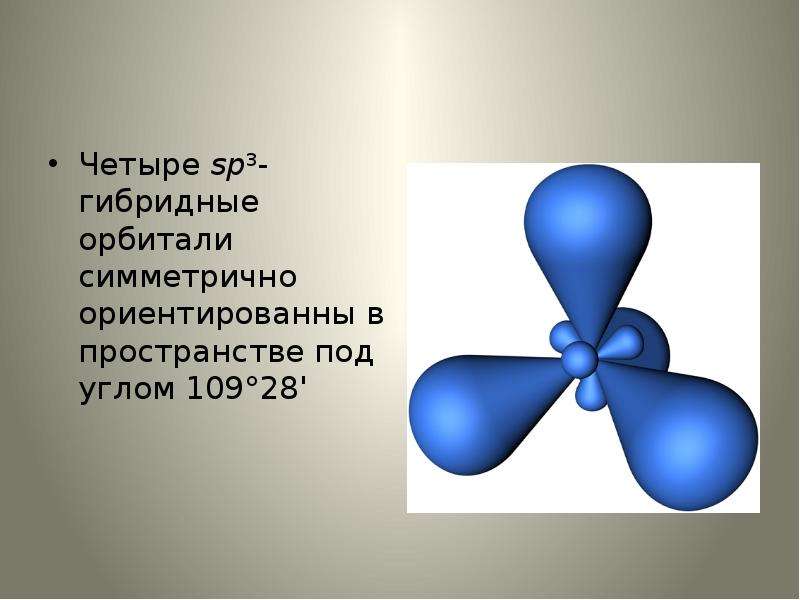
Оси sp 3 -гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28″, что соответствует наименьшей энергии отталкивания электронов.
Впервые идею о направленности единиц сродства (валентностей) атома углерода по углам тетраэдра независимо друг от друга выдвинули в 1874 г. Вант-Гофф и Ле Бель.
sp 3 -Орбитали могут образовывать четыре s-связи с другими атомами или заполняться неподеленными парами электронов.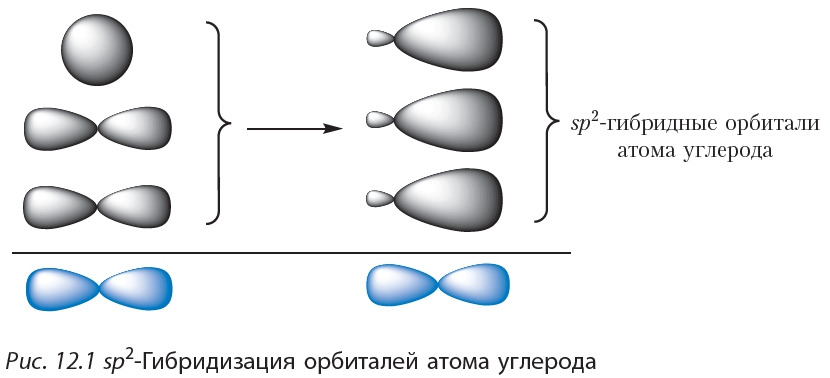
А как наглядно изобразить пространственное строение атома в sp 3 -состоянии на рисунке?
В этом случае sp 3 -гибридные орбитали изображают не электронными облаками, а прямыми линиями или клиньями в зависимости от пространственной ориентации орбитали. Такое схематическое изображение используется при написании стереохимических (пространственных) формул молекул.
Переход от орбитальной модели (а) к пространственной формуле (б).
На примере молекулы метана показаны объемные модели и пространственная (стереохимическая) формула молекулы с sp 3 -углеродным атомом.
Модель молекулы метана
sp 3 -Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 4.
Углерод в sp 3 -гибридном состоянии встречается в простом веществе — алмазе. Это состояние характерно для атомов С, N, O и др., соединенных с другими атомами одинарными связями (sp 3 -атомы выделены красным цветом):
С H 4 , RC H 3 , N H 3 , RN H 2 , H 2 O , RO H, R 2 O ;
а также анионам типа:
R 3 C
: — , RO
— .
Следствием тетраэдрического строения sp 3 -атома является возможность существования двух оптических стереоизомеров у соединения, содержащего такой атом с четырьмя разными заместителями (Вант-Гофф, Ле Бель, 1874).
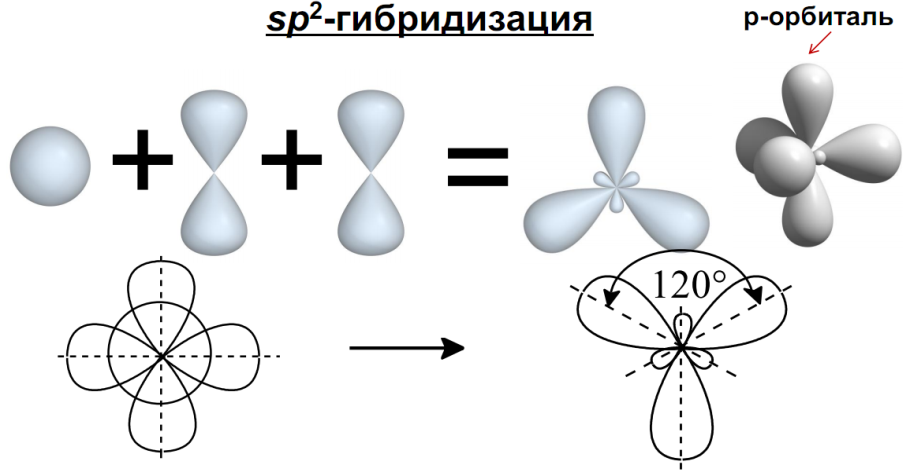
3.3.2. sp 2 -Гибридизация (плоскостно-тригональная).
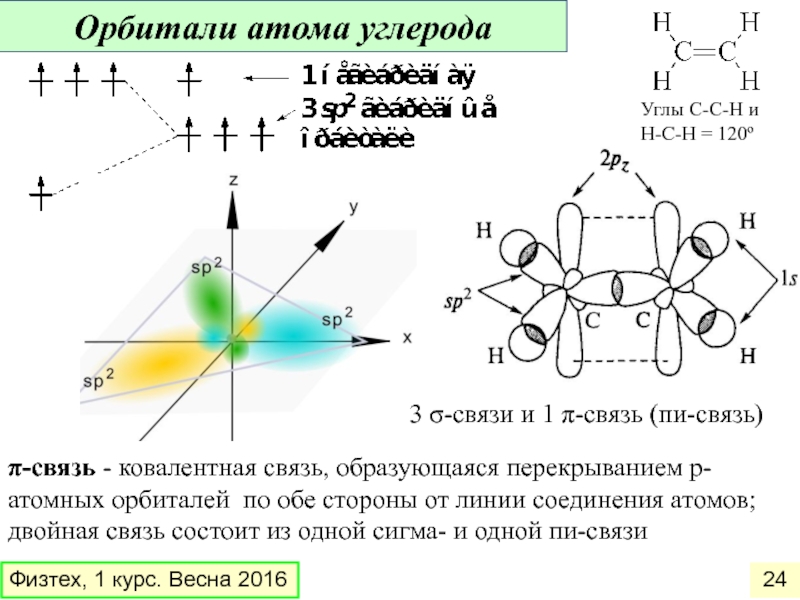
Одна s — и две p -орбитали смешиваются, и образуются три равноценные sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120° (выделены синим цветом). Они могут образовывать три s-связи. Третья р -орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р -АО участвует в образовании p-связи.
Для элементов 2-го периода процесс sp 2 -гибридизации происходит по схеме:
2s + 2p x + 2p y = 3 (2sp 2) 2p z -АО в гибридизации не участвует.
Для изображения пространственного строения атомов в sp 2 -состоянии используются те же приемы, что и в случае sp 3 -атомов:
Переход от орбитальной модели атома в sp 2 -гибридизированном состоянии (а) к пространственной формуле (б). Строение молекул с sp 2 -атомами отражают их модели:
Строение молекул с sp 2 -атомами отражают их модели:
Модели молекулы этилена
sp 2 -Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 3
Углерод в sp 2 -гибридном состоянии образует простое вещество графит. Это состояние характерно для атомов С, N, O и др. с двойной связью (sp 2 -атомы выделены красным цветом):
H 2 C =C H 2 , H 2 C =C HR, R 2 C =N R, R-N =N -R, R 2 C =O , R-N =O ,
а также для катионов типа
R 3 C + и свободных радикалов R 3 C · .
Концепция гибридизации
Концепция гибридизации валентных атомных орбиталей
была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.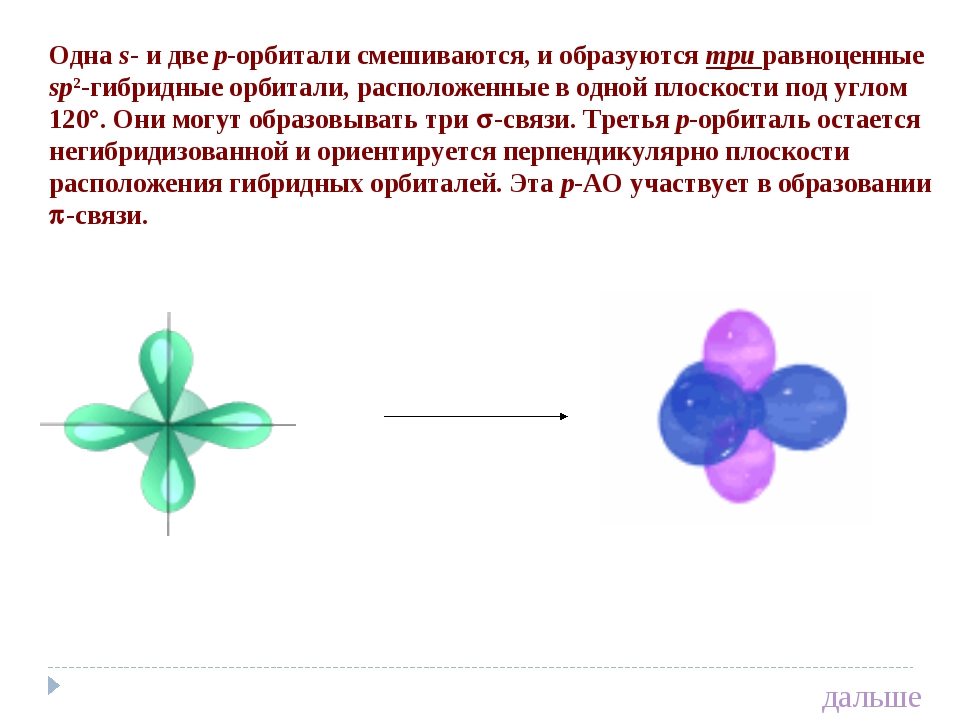
Представления о гибридизации занимают центральное место в методе валентных связей . Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи , в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии .
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
«Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.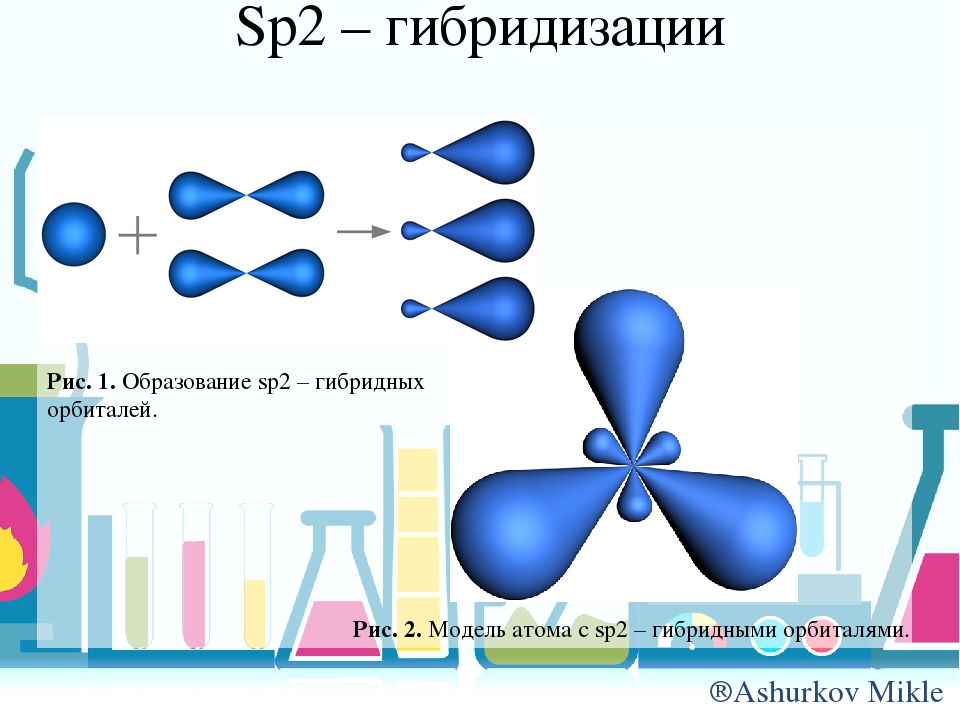 е электронные пары ведут себя так, как если бы они взаимно отталкивались» .
е электронные пары ведут себя так, как если бы они взаимно отталкивались» .
Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра» .
Виды гибридизации
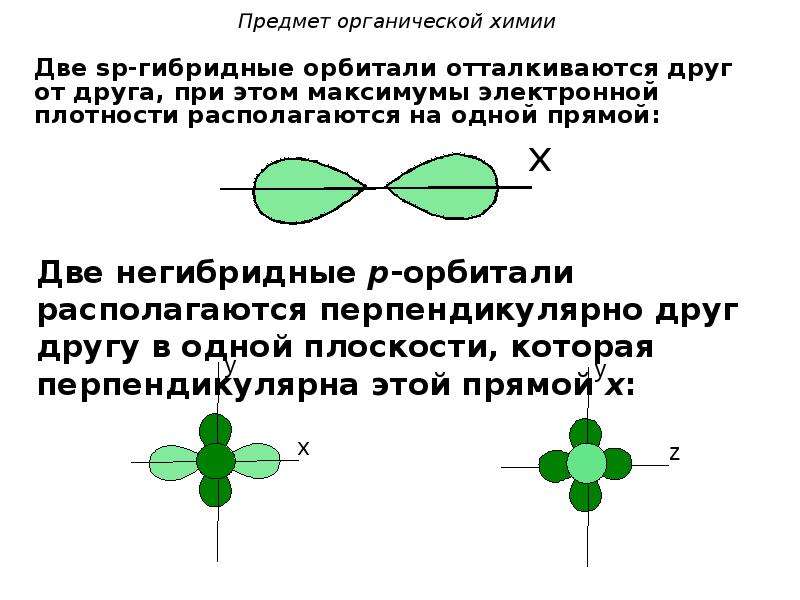
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp 2 -гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp 3 -гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали.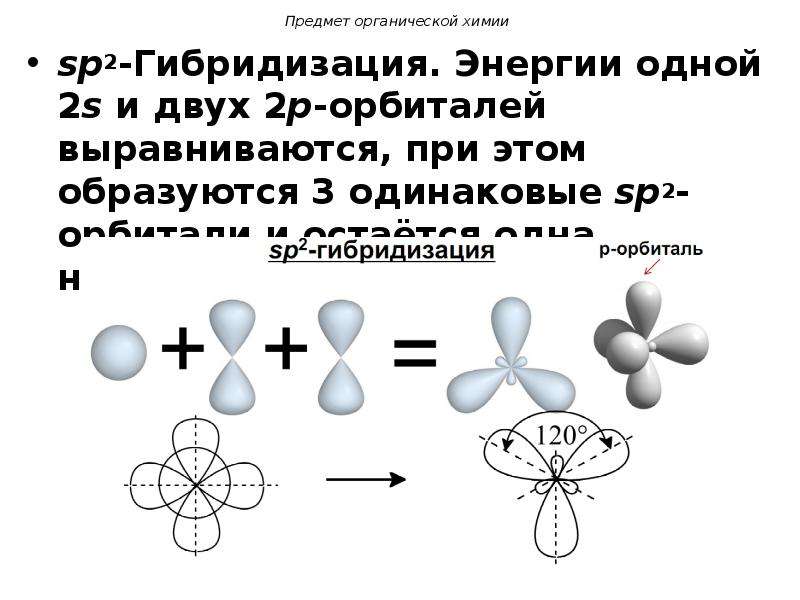 Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28″, что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма . Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары) .
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная | BeF 2 , CO 2 , NO 2 + | |
| sp 2 | 3 | Треугольная | BF 3 , NO 3 — , CO 3 2- | |
| sp 3 | 4 | Тетраэдрическая | CH 4 , ClO 4 — , SO 4 2- , NH 4 + | |
| dsp 2 | 4 | Плоскоквадратная | Ni(CO) 4 , XeF 4 | |
| sp 3 d | 5 | Гексаэдрическая | PCl 5 , AsF 5 | |
| sp 3 d 2 | 6 | Октаэдрическая | SF 6 , Fe(CN) 6 3- , CoF 6 3- |
Ссылки
Литература
- Паулинг Л.
 Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М .: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М .: Мир, 1975. — 278 с.
См. также
Примечания
Wikimedia Foundation . 2010 .
Чаще всего встречаются гибридизации sp, sp 2 , sp 3 и sp 3 d 2 . Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества.
sp-Гибридизация
. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º (рис. 22).
22).
Рис. 22. Схема sp-гибридизации
При sp-гибридизации образуются линейные трехатомные молекулы типа АВ 2 , где А – центральный атом, у которого происходит гибридизация, а В – присоединенные атомы, у которых гибридизация не происходит. Такие молекулы образуются атомами бериллия, магния, а также атомами углерода в ацетилене (С 2 Н 2) и в углекислом газе (СО 2).
Пример 5. Объясните химическую связь в молекулах ВеН 2 и ВеF 2 и строение этих молекул.
Решение. Атомы бериллия в нормальном состоянии не образуют химических связей, т.к. не имеют неспаренных электронов (2s 2). В возбужденном состоянии (2s 1 2p 1) электроны находятся на разных орбиталях, поэтому при образовании связей происходит sp-гибридизация по схеме, приведенной на рис. 22. К двум гибридным орбиталям присоединяются два атома водорода или фтора, как показано на рис. 23.
1) 2)
Рис. 23. Схема образования молекул ВеН 2 (1) и ВеF 2 (2)
Образующиеся молекулы – линейные, валентный угол 180º.
Пример 6. По экспериментальным данным молекула СО 2 – линейная, причём, обе связи углерода с кислородом одинаковы по длине (0,116 нм) и энергии (800 кДж/моль). Как объясняются эти данные?
Решение . Эти данные о молекуле диоксида углерода объясняет следующая модель ее образования.
Атом углерода образует связи в возбужденном состоянии, при котором он имеет четыре неспаренных электрона: 2s 1 2p 3 . При образовании связей происходит sp-гибридизация орбиталей. Гибридные орбитали направлены по прямой линии в противоположные стороны от ядра атома, а оставшиеся две чистые (негибридные) p-орбитали располагаются перпендикулярно друг к другу и к гибридным орбиталям. Все орбитали (гибридные и негибридные) содержат по одному неспаренному электрону.
Каждый атом кислорода, имеющий два неспаренных электрона на двух взаимно перпендикулярных p-орбиталях, присоединяется к атому углерода s-связью и p-связью: s-связь образуется с участием гибридной орбитали углерода, а p-связь образуется перекрыванием чистых p-орбиталей атомов углерода и кислорода.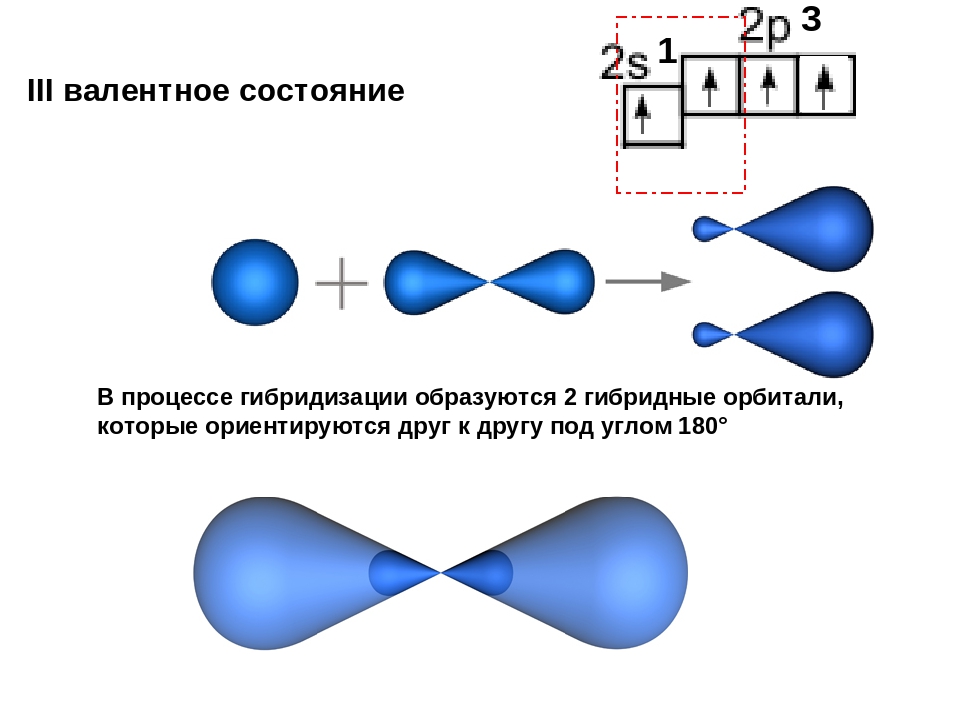 Образование связей в молекуле СО 2 показано на рис. 24.
Образование связей в молекуле СО 2 показано на рис. 24.
Рис. 24. Схема образования молекулы СО 2
Кратность связи, равная двум, объясняет большую прочность связи, а sp-гибридизация – линейное строение молекулы.
Смешивание одной s- и двух p-орбиталей называется sp 2 -гибридизацией . При этой гибридизации получаются три равноценные q-орбитали, расположенные в одной плоскости под углом 120º (рис. 25).
Рис. 25. Схема sp 2 -гибридизации
Образующиеся при этой гибридизации молекулы типа АВ 3 имеют форму плоского правильного треугольника с атомами А в центре и атомами В в его вершинах. Такая гибридизация происходит в атомах бора и других элементов третьей группы и в атомах углерода в молекуле С 2 Н 4 и в ионе СО 3 2- .
Пример 7. Объясните образование химических связей в молекуле ВН 3 и ее строение.
Решение.
Экспериментальные исследования свидетельствуют о том, что в молекуле ВН 3 все три связи В–Н расположены в одной плоскости, углы между связями равны 120º. Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s 1 2p 2) и он образует связи sp 2 -гибридными орбиталями. Схема молекулы ВН 3 приведена на рис. 26.
Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s 1 2p 2) и он образует связи sp 2 -гибридными орбиталями. Схема молекулы ВН 3 приведена на рис. 26.
Рис. 26. Схема образования молекулы ВН 3
Если в гибридизации участвуют одна s- и три p-орбитали (sp 3 -гибридизация ), то в результате образуются четыре гибридные орбитали, направленне к вершинам тетраэдра, т.е. ориентированные под углами 109º28 ¢ (~109,5º) друг к другу. Образующиеся молекулы имеют тетраэдрическое строение. Гибридизацией этого типа объясняется строение предельных углеводородов, соединений углерода с галогенами, многих соединений кремния, катиона аммония NH 4 + и др. Классическим примером этой гибридизации является молекула метана CH 4 (рис. 27)
Рис. 27. Схема образования химических связей в молекуле СН 4
Если в гибридизации участвуют одна s-, три p- и две d-орбитали (sp 3 d 2 — гибридизация
), то возникают шесть гибридных орбиталей, напрвленных к вершинам октаэдра, т.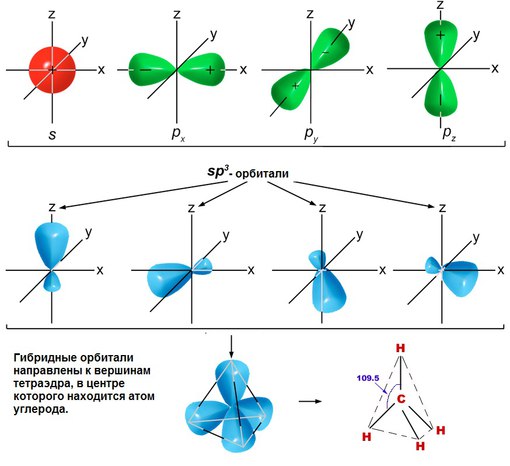 е. ориентированных под углами 90º друг к другу. Образующиеся молекулы имеют октаэдрическое строение. Гибридизацией этого типа объясняется строение соединений серы, селена и теллура с галогенами, например SF 6 и SeF 6 , и многих комплексных ионов: 2– , 3– и т.д. На рис. 28 показано образование молекулы гексафторида серы.
е. ориентированных под углами 90º друг к другу. Образующиеся молекулы имеют октаэдрическое строение. Гибридизацией этого типа объясняется строение соединений серы, селена и теллура с галогенами, например SF 6 и SeF 6 , и многих комплексных ионов: 2– , 3– и т.д. На рис. 28 показано образование молекулы гексафторида серы.
Рис. 28. Схема молекулы SF 6
Химические связи с участием гибридных орбиталей отличаются большой прочностью. Если энергию s-связи, образованную «чистыми» s-орбиталями, принять за единицу, то энергия связи при sp-гибридизации будет равна 1,43, при sp 2 -гибридизации 1,99, при sp 3 -гибридизации 2,00, а при sp 3 d 2 -гибридизации 2,92. Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Кроме рассмотренных типов гибридизации, в химических соединениях встречаются гибридизации sp 2 d, sp 3 d, sp 3 d 3 , sp 3 d 3 и другие. При sp 2 d-гибридизации молекулы и ионы имеют квадратную форму, при sp 3 d-гибридизации – форму тригональной бипирамиды и при sp 3 d 3 -гибридизации – пентагональной бипирамиды.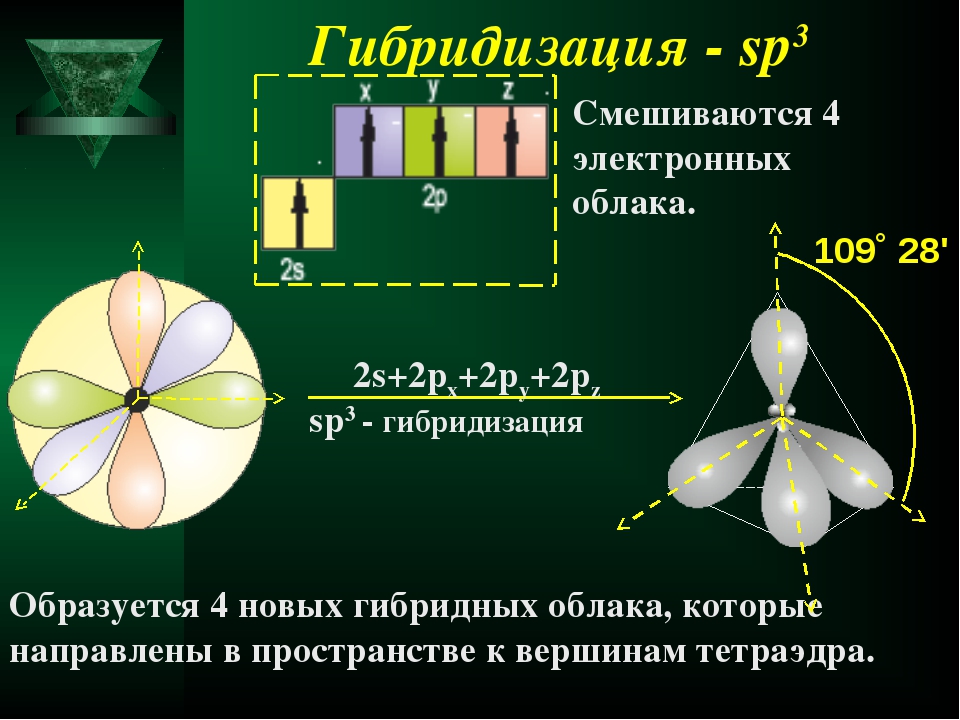 Другие типы гибридизации встречаются редко.
Другие типы гибридизации встречаются редко.
Пример 8. Приведены уравнения двух похожих реакций:
1) CF 4 + 2HF = H 2 CF 6 ; 2) SiF 4 + 2HF = H 2 SiF 6
Какая из них невозможна с точки зрения образования химических связей?
Решение. Для образования H 2 CF 6 необходима sp 3 d 2 -гибридизация, но в атоме углерода валентные электроны находятся на втором энергетическом уровне, на котором нет d-орбиталей. Поэтому первая реакция в принципе невозможна. Вторая реакция возможна, так как sp 3 d 2 -гибридизация у кремния возможна.
О гибридах нам говорят много. О них повествуют и фильмы, и книги, а также их рассматривает наука. В первых двух источниках гибриды являются очень опасными существами. Они могут принести уж очень много зла. Но далеко не всегда гибридизация — это плохое явление. Достаточно часто оно бывает хорошим.
Пример гибридизации — это каждый человек. Все мы являемся гибридами двух людей — отца и матери. Так, слияние яйцеклетки и сперматозоида также является своего рода гибридизацией. Именно данный механизм позволяет двигать эволюцию. При этом бывает и гибридизация с отрицательным знаком. Давайте рассмотрим данное явление в целом.
Именно данный механизм позволяет двигать эволюцию. При этом бывает и гибридизация с отрицательным знаком. Давайте рассмотрим данное явление в целом.
Общее представление о гибридизации
Впрочем, не только биология включает данное понятие. И пусть во вступлении был рассмотрен пример с гибридами как полноценными особями непонятного биологического вида. При этом данное понятие может использоваться и в других науках. И значение данного термина будет несколько отличаться. Но при этом кое-что общее все же есть. Это слово «объединение», которое объединяет все возможные значения данного термина.
Где существует данное понятие?
Термин «гибридизация» используется в ряде наук. А поскольку большая часть существующих ныне дисциплин пересекается, то можно смело говорить об использовании каждого значения данного термина в любой науке, так или иначе связанной с естественными исследовательскими отраслями. При этом наиболее активно данный термин используется в:
- Биологии.
 Отсюда пошло понятие гибрида. Хотя, как всегда, при перемещении из науки в повседневную жизнь произошло некоторое искажение фактов. Мы под гибридом понимаем особь, получившуюся в процессе скрещивания двух других видов. Хотя так бывает не всегда.
Отсюда пошло понятие гибрида. Хотя, как всегда, при перемещении из науки в повседневную жизнь произошло некоторое искажение фактов. Мы под гибридом понимаем особь, получившуюся в процессе скрещивания двух других видов. Хотя так бывает не всегда. - Химии. Данное понятие означает смешивание нескольких орбиталей — своеобразных путей движения электронов.
- Биохимии. Здесь ключевым понятием является гибридизация ДНК.
Как видим, третий пункт находится на стыке двух наук. И это абсолютно нормальная практика. Один и тот же термин может образовывать на стыке двух наук абсолютно другое значение. Давайте более детально рассмотрим понятие гибридизации в этих науках.
Что такое гибрид?
Гибрид — это существо, которое получилось в процессе гибридизации. Данное понятие относится к биологии. Гибриды могут получаться как случайно, так и специально. В первом случае это могут получиться животные, которые создаются в процессе спаривания двух разновидовых существ.
Например, рассказывают о том, что появляются у кошек и собак дети, которые не являются ни одними из них. Иногда гибриды создаются специально. Например, когда к абрикосу прикрепляют вишню, мы имеем дело как раз с специальной гибридизацией.
Гибридизация в биологии
Биология — интересная наука. И понятие гибридизации в ней не менее увлекательное. Под данным термином подразумевается объединение генетического материала разных клеток в одной. Это могут быть как представители одного вида, так и нескольких. Соответственно, происходит деление на такие разновидности гибридизации.
- Внутривидовая гибридизация. Это когда две особи одного вида создают потомка. Примером внутривидовой гибридизации можно считать человека. Он получился в процессе слияния половых клеток представителей одного биологического вида.
- Межвидовая гибридизация. Это когда скрещиваются похожие, но принадлежащие к разным видам, животные. Например, гибрид коня и зебры.
- Отдаленная гибридизация.
 Это когда скрещиваются представители хоть и одного вида, но при этом не объединенные семейными связями.
Это когда скрещиваются представители хоть и одного вида, но при этом не объединенные семейными связями.
Каждая из этих разновидностей помогает не только эволюции. Ученые также активно стараются скрещивать разные виды живых существ. Лучше всего получается с растениями. Причин этому несколько:
- Разное количество хромосом. У каждого вида есть не только специфическое количество хромосом, но и их набор. Все это мешает воспроизводить потомство.
- Размножаться могут только растения-гибриды. И то не всегда.
- Полиплоидными могут быть только растения. Чтобы растение размножалось, оно должно стать полиплоидным. В случае с животными это верная смерть.
- Возможность вегетативной гибридизации. Это очень простой и удобный способ создания гибридов нескольких растений.
Это причины, по которым скрещивать два растения значительно проще и эффективнее. В случае с животными, возможно, в будущем получится добиться возможности размножения. Но на данный момент официальным в биологии считается мнение, что животные-гибриды утрачивают способность размножаться, так как данные особи являются генетически нестабильными.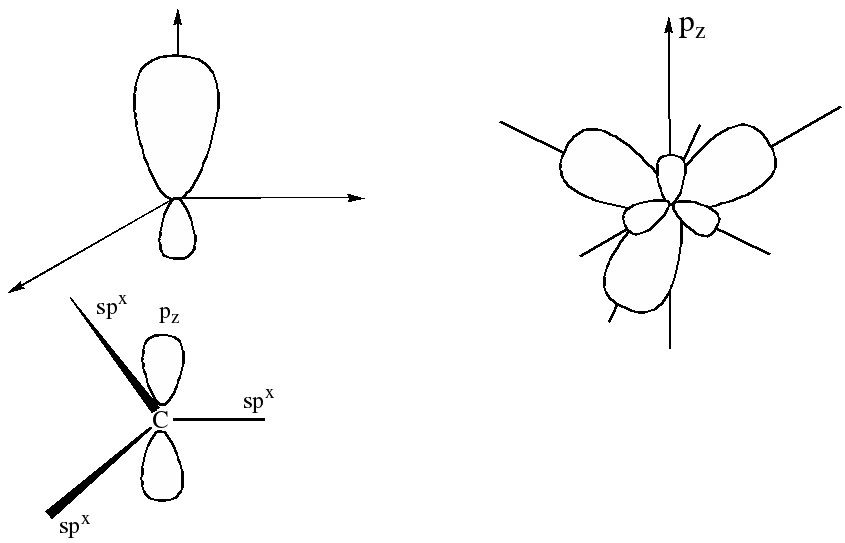 Следовательно, неизвестно, к чему может привести их размножение.
Следовательно, неизвестно, к чему может привести их размножение.
Виды гибридизации в биологии
Биология — наука достаточно широкая по своей специализации. Бывает два вида гибридизации, которые она предусматривает:
- Генетическая. Это когда из двух клеток делается одна с уникальным набором хромосом.
- Биохимическая. Примером данного вида является гибридизация ДНК. Это когда комплементарные нуклеиновые кислоты объединяются в одну ДНК.
Можно делить на большее количество разновидностей. Но это мы сделали в предыдущем подразделе. Так, отдаленная и внутривидовая гибридизация — это составные части первого типа. А там классификация еще больше расширяется.
Понятие вегетативной гибридизации
Вегетативная гибридизация — это понятие в биологии, которое означает такую разновидность скрещивания двух растений, при котором часть одного вида приживается на другом. То есть, гибридизация происходит за счет совмещения двух разных частей организма.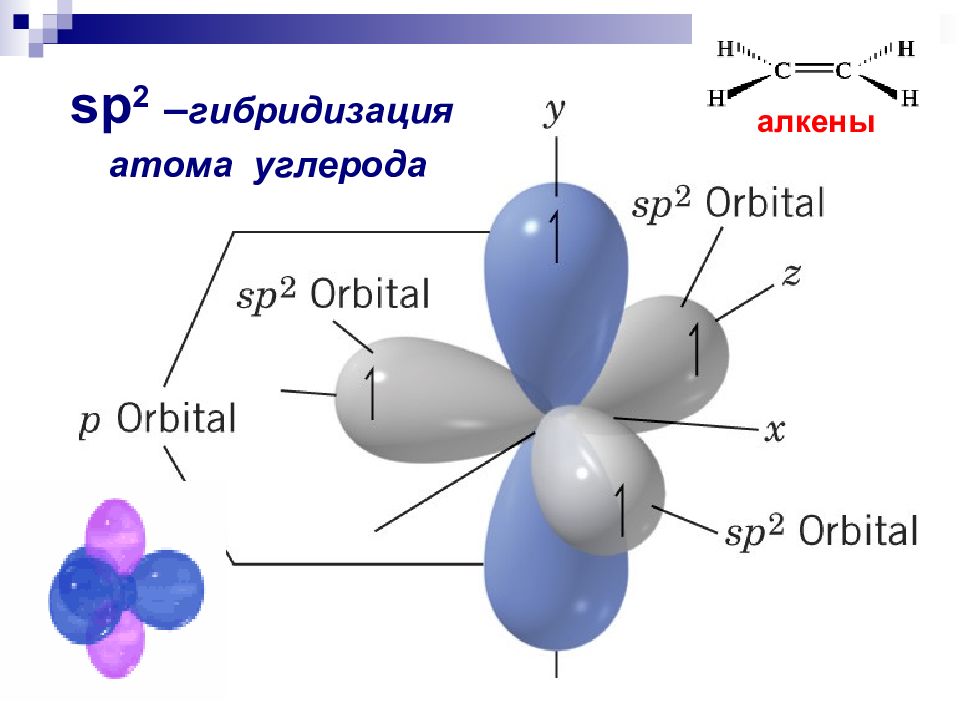 Да, так можно растение охарактеризовать. Ведь у него также есть свои органы, объединенные в целую систему. Следовательно, если называть растение организмом, ничего зазорного в этом нет.
Да, так можно растение охарактеризовать. Ведь у него также есть свои органы, объединенные в целую систему. Следовательно, если называть растение организмом, ничего зазорного в этом нет.
Вегетативная гибридизация имеет ряд преимуществ. Это:
- Удобство.
- Простота.
- Эффективность.
- Практичность.
Данные плюсы делают такую разновидность скрещивания очень популярной у садоводов. Также есть такое понятие, как соматическая гибридизация. Это когда скрещивают не половые клетки, а соматические, вернее, их протопласты. Данный способ скрещивания производится тогда, когда невозможно создать гибрид стандартным половым путем между несколькими растениями.
Гибридизация в химии
Но теперь мы немного отступим от биологии и поговорим о другой науке. В химии есть свое понятие, называется оно «гибридизация атомных орбиталей». Это очень сложный термин, но если разбираться немного в химии, то ничего сложного в нем нет. Сперва нужно объяснить, что же такое орбиталь.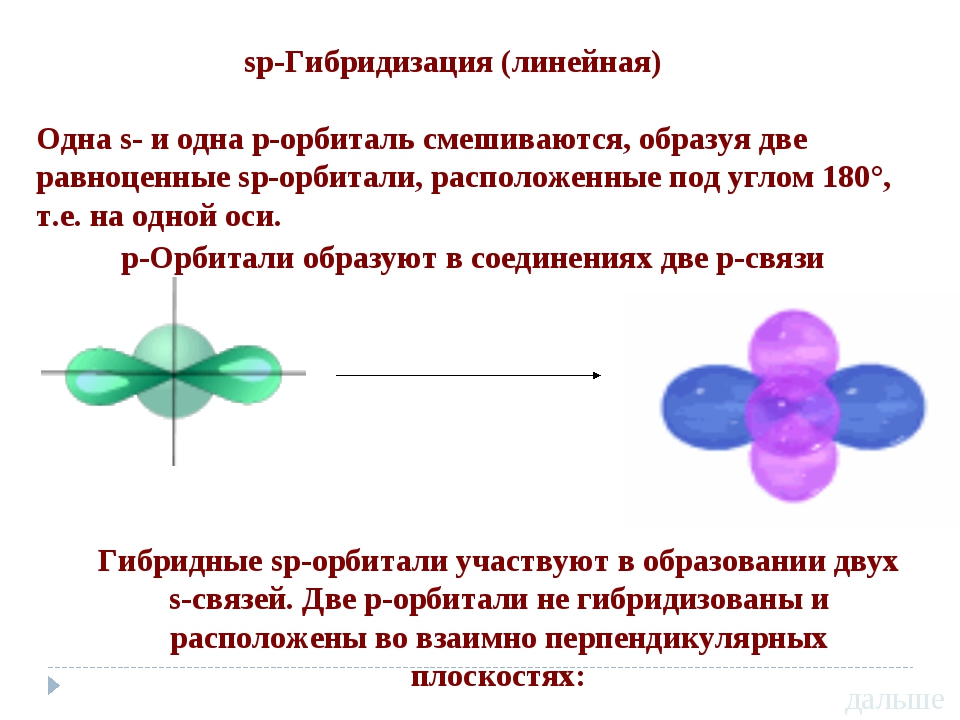
Это своеобразный путь, по которому движется электрон. Нас этому учили еще в школе. И если происходит такое, что данные орбитали разного типа смешиваются, получается гибрид. Существует три вида явления, называемого «гибридизация орбиталей». Это такие разновидности:
- sp-гибридизация — одна s и другая p орбиталь;
- sp 2 -гибридизация — одна s и две p орбитали;
- sp 3 -гибридизация — одна s и три p орбитали соединяются.
Данная тема достаточно сложная для изучения, и ее нужно рассматривать неразрывно от остальной части теории. Причем понятие гибридизации орбиталей касается больше конца данной темы, а не начала. Ведь нужно изучить само понятие орбиталей, какими они бывают и так далее.
Выводы
Итак, мы разобрались в значениях понятия «гибридизация». Это, оказывается, достаточно интересно. Для многих было открытием то, что в химии также есть данное понятие. Но если бы этого такие люди не знали, то чему бы они могли научиться? А так, есть развитие.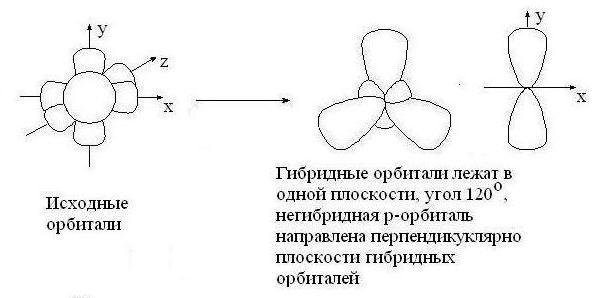 Важно не прекращать тренировать эрудицию, так как это обязательно будет характеризовать вас с хорошей стороны.
Важно не прекращать тренировать эрудицию, так как это обязательно будет характеризовать вас с хорошей стороны.
Типы гибридизации
Химия Типы гибридизации
просмотров — 2603
Чаще всего встречаются гибридизации sp, sp2, sp3 и sp3d2. Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества.
sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º (рис. 22).
Рис. 22. Схема sp-гибридизации
При sp-гибридизации образуются линейные трехатомные молекулы типа АВ2, где А – центральный атом, у которого происходит гибридизация, а В – присоединенные атомы, у которых гибридизация не происходит.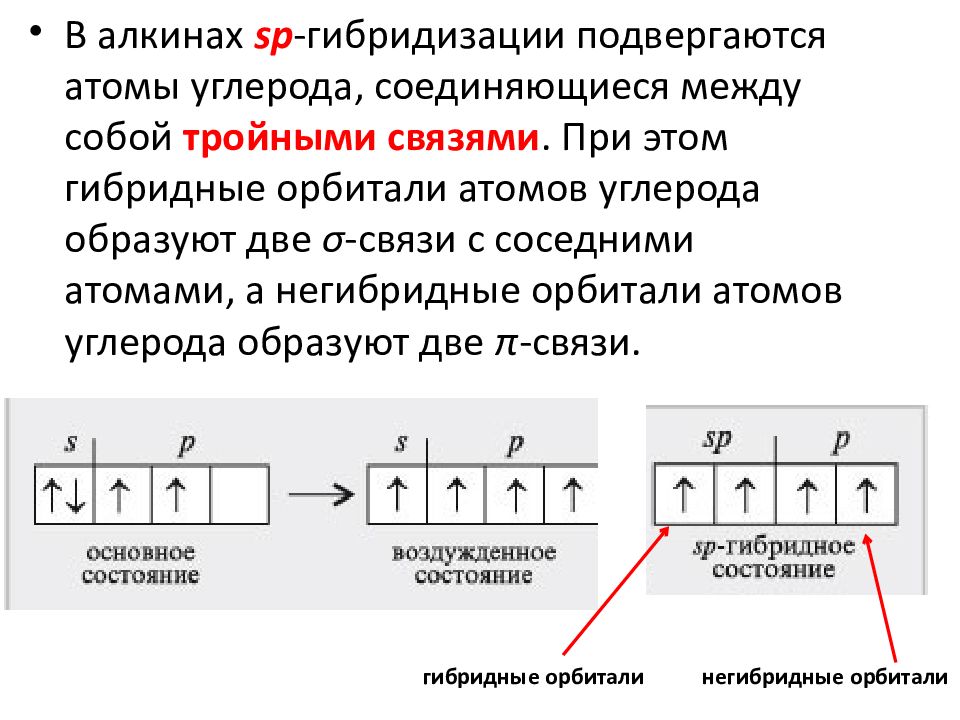 Такие молекулы образуются атомами бериллия, магния, а также атомами углерода в ацетилене (С2Н2) и в углекислом газе (СО2).
Такие молекулы образуются атомами бериллия, магния, а также атомами углерода в ацетилене (С2Н2) и в углекислом газе (СО2).
Пример 5.Объясните химическую связь в молекулах ВеН2 и ВеF2 и строение этих молекул.
Решение. Атомы бериллия в нормальном состоянии не образуют химических связей, т.к. не имеют неспаренных электронов (2s2). В возбужденном состоянии (2s12p1) электроны находятся на разных орбиталях, в связи с этим при образовании связей происходит sp-гибридизация по схеме, приведенной на рис. 22. К двум гибридным орбиталям присоединяются два атома водорода или фтора, как показано на рис. 23.
1) 2)
Рис. 23. Схема образования молекул ВеН2 (1) и ВеF2 (2)
Образующиеся молекулы – линейные, валентный угол 180º.
Пример 6. По экспериментальным данным молекула СО2 – линейная, причём, обе связи углерода с кислородом одинаковы по длине (0,116 нм) и энергии (800 кДж/моль).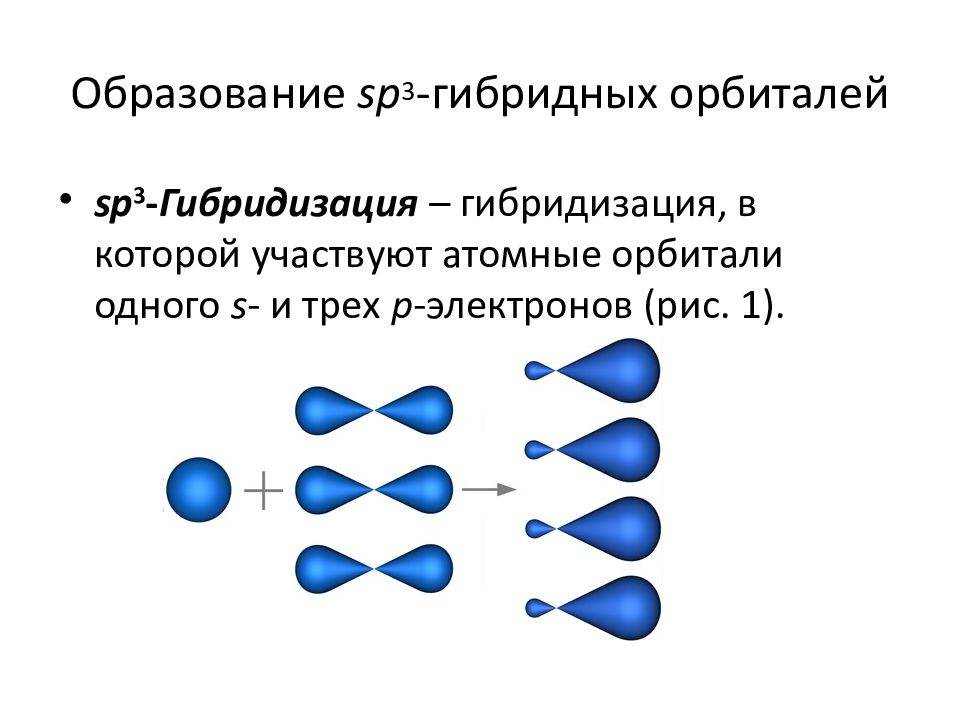 Как объясняются эти данные?
Как объясняются эти данные?
Решение. Эти данные о молекуле диоксида углерода объясняет следующая модель ее образования.
Атом углерода образует связи в возбужденном состоянии, при котором он имеет четыре неспаренных электрона: 2s12p3. При образовании связей происходит sp-гибридизация орбиталей. Гибридные орбитали направлены по прямой линии в противоположные стороны от ядра атома, а оставшиеся две чистые (негибридные) p-орбитали располагаются перпендикулярно друг к другу и к гибридным орбиталям. Все орбитали (гибридные и негибридные) содержат по одному неспаренному электрону.
Каждый атом кислорода, имеющий два неспаренных электрона на двух взаимно перпендикулярных p-орбиталях, присоединяется к атому углерода s-связью и p-связью: s-связь образуется с участием гибридной орбитали углерода, а p-связь образуется перекрыванием чистых p-орбиталей атомов углерода и кислорода. Образование связей в молекуле СО2 показано на рис. 24.
Рис.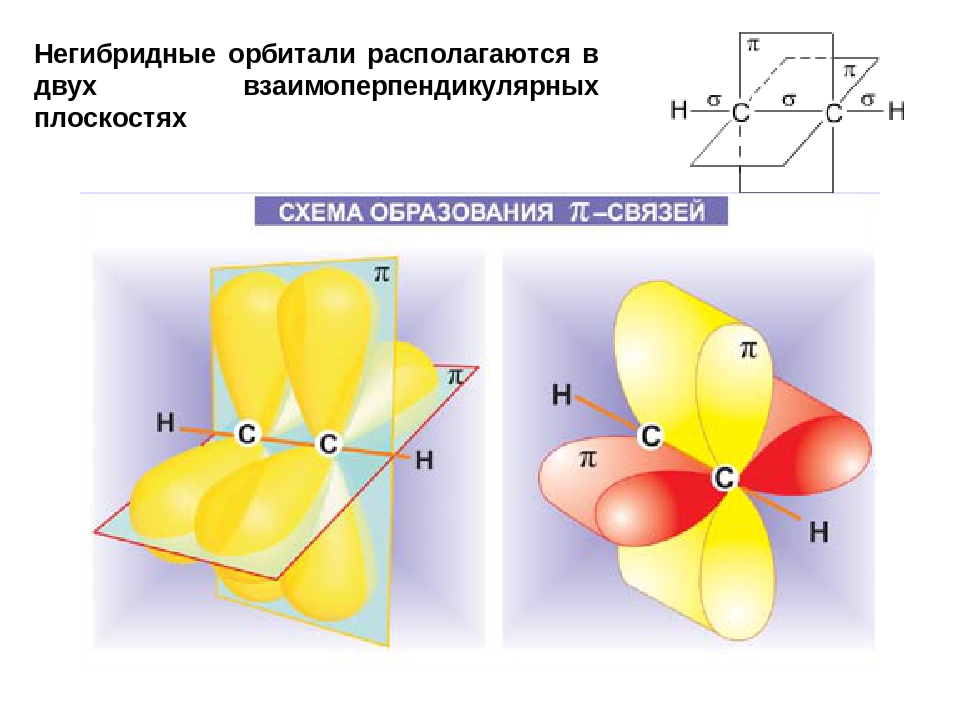 24. Схема образования молекулы СО2
24. Схема образования молекулы СО2
Кратность связи, равная двум, объясняет большую прочность связи, а sp-гибридизация – линейное строение молекулы.
Смешивание одной s- и двух p-орбиталей принято называть sp2-гибридизацией. При этой гибридизации получаются три равноценные q-орбитали, расположенные в одной плоскости под углом 120º (рис. 25).
Рис. 25. Схема sp2-гибридизации
Образующиеся при этой гибридизации молекулы типа АВ3 имеют форму плоского правильного треугольника с атомами А в центре и атомами В в его вершинах. Такая гибридизация происходит в атомах бора и других элементов третьей группы и в атомах углерода в молекуле С2Н4 и в ионе СО32-.
Пример 7.Объясните образование химических связей в молекуле ВН3 и ее строение.
Решение. Экспериментальные исследования свидетельствуют о том, что в молекуле ВН3 все три связи В–Н расположены в одной плоскости, углы между связями равны 120º. Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s12p2) и он образует связи sp2-гибридными орбиталями. Схема молекулы ВН3 приведена на рис. 26.
Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s12p2) и он образует связи sp2-гибридными орбиталями. Схема молекулы ВН3 приведена на рис. 26.
Рис. 26. Схема образования молекулы ВН3
В случае если в гибридизации принимают участие одна s- и три p-орбитали (sp3-гибридизация), то в результате образуются четыре гибридные орбитали, направленне к вершинам тетраэдра, ᴛ.ᴇ. ориентированные под углами 109º28¢ (~109,5º) друг к другу. Образующиеся молекулы имеют тетраэдрическое строение. Гибридизацией этого типа объясняется строение предельных углеводородов, соединений углерода с галогенами, многих соединений кремния, катиона аммония NH4+ и др. Классическим примером этой гибридизации является молекула метана CH4 (рис. 27)
Рис. 27. Схема образования химических связей в молекуле СН4
27. Схема образования химических связей в молекуле СН4
В случае если в гибридизации принимают участие одна s-, три p- и две d-орбитали (sp3d2— гибридизация), то возникают шесть гибридных орбиталей, напрвленных к вершинам октаэдра, ᴛ.ᴇ. ориентированных под углами 90º друг к другу. Образующиеся молекулы имеют октаэдрическое строение. Гибридизацией этого типа объясняется строение соединений серы, селена и теллура с галогенами, к примеру SF6 и SeF6, и многих комплексных ионов: [SiF6]2–, [Fe(CN)6]3– и т.д. На рис. 28 показано образование молекулы гексафторида серы.
Рис. 28. Схема молекулы SF6
Химические связи с участием гибридных орбиталей отличаются большой прочностью. В случае если энергию s-связи, образованную «чистыми» s-орбиталями, принять за единицу, то энергия связи при sp-гибридизации будет равна 1,43, при sp2-гибридизации 1,99, при sp3-гибридизации 2,00, а при sp3d2-гибридизации 2,92.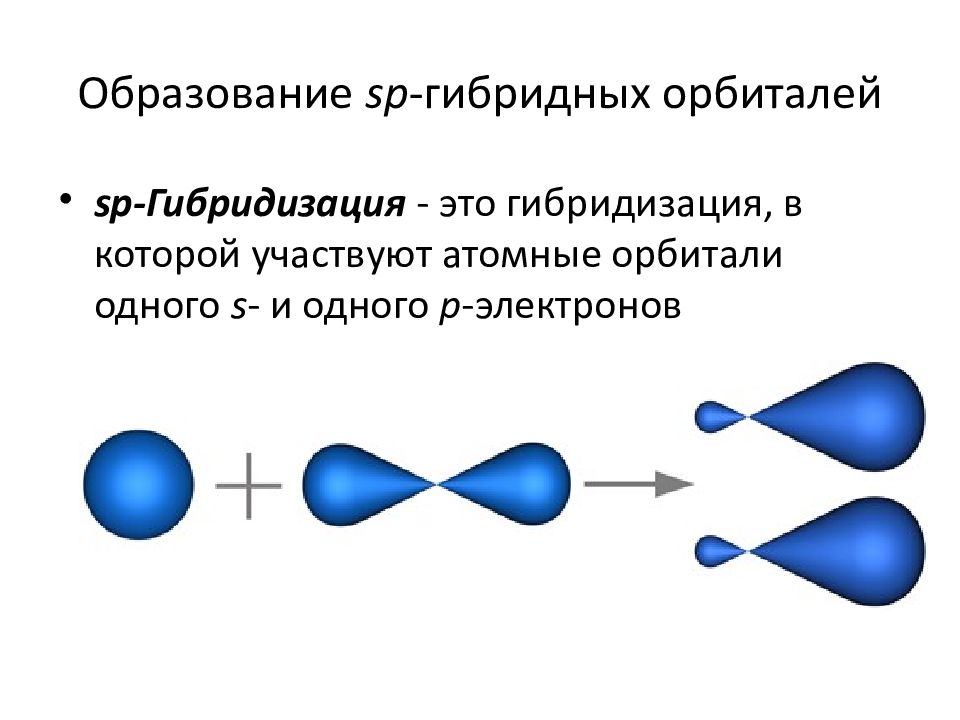 Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Кроме рассмотренных типов гибридизации, в химических соединениях встречаются гибридизации sp2d, sp3d, sp3d3, sp3d3 и другие. При sp2d-гибридизации молекулы и ионы имеют квадратную форму, при sp3d-гибридизации – форму тригональной бипирамиды и при sp3d3-гибридизации – пентагональной бипирамиды. Другие типы гибридизации встречаются редко.
Пример 8.Приведены уравнения двух похожих реакций:
1) CF4 + 2HF = H2CF6; 2) SiF4 + 2HF = H2SiF6
Какая из них невозможна с точки зрения образования химических связей?
Решение. Для образования H2CF6 необходима sp3d2-гибридизация, но в атоме углерода валентные электроны находятся на втором энергетическом уровне, на котором нет d-орбиталей. По этой причине первая реакция в принципе невозможна. Вторая реакция возможна, так как sp3d2-гибридизация у кремния возможна.
По этой причине первая реакция в принципе невозможна. Вторая реакция возможна, так как sp3d2-гибридизация у кремния возможна.
Читайте также
Таблица 2. Тип гибридизации Геометрия молекул Валентные углы Примеры sp Линейная 1800 Beh3, CO2, C2h3, BO2- sp2 Тригональная 1200 Alh4, AlF3, SO3,CO22-, NO3- sp3 Тетраэдрическая 109,50 Sih5, CCl4, Nh5+, SO42- sp3d Тригональная бипирамидальная 900 и 1200 PF5, AsF5, PCl5, sp3d2 … [читать подробенее]
Таблица 2.
Тип гибридизации
Геометрия молекул
Валентные углы
Примеры
sp
Линейная
1800
Beh3, CO2, C2h3, BO2-
sp2
Тригональная
1200
Alh4, AlF3, SO3,CO22-, NO3-
sp3
Тетраэдрическая
109,50
Sih5, CCl4, Nh5+, SO42-
sp3d
Тригональная бипирамидальная
900 и 1200
PF5, AsF5, PCl5,
sp3d2
. .. [читать подробенее]
.. [читать подробенее]
sp3 – гибридизация Все четыре валентные орбитали участвуют в гибридизации. Валентный угол 109о28’ (тетраэдр). Атомы углерода образуют только простые (&… [читать подробенее]
Периодический закон и периодическая система химических элементов Менделеева в строении атома. Физический смысл периодического закона. Структура периодической системы. Период, группа, подгруппа Основной закон химии — Периодический закон был открыт в 1869 году в то… [читать подробенее]
Чаще всего встречаются гибридизации sp, sp2, sp3 и sp3d2. Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества.
sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на.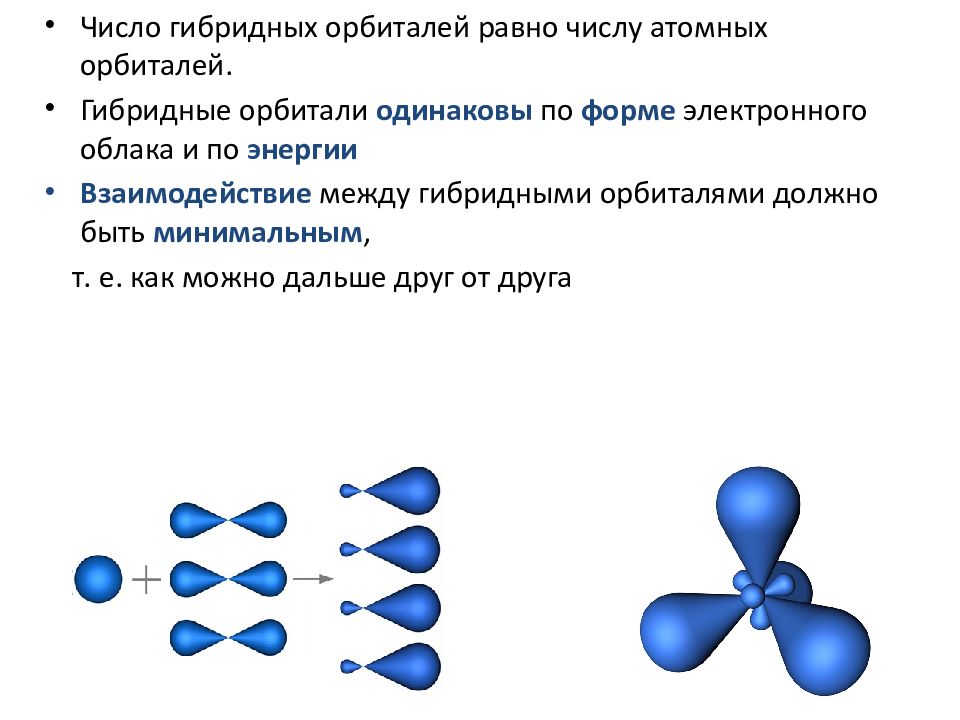 .. [читать подробенее]
.. [читать подробенее]
Образование связей описывается sp3 гибридизацией в молекуле. Тип гибридизации атомов. Угол между связями
Чаще всего встречаются гибридизации sp, sp 2 , sp 3 и sp 3 d 2 . Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества.
sp-Гибридизация . Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º (рис. 22).
Рис. 22. Схема sp-гибридизации
При sp-гибридизации образуются линейные трехатомные молекулы типа АВ 2 , где А – центральный атом, у которого происходит гибридизация, а В – присоединенные атомы, у которых гибридизация не происходит. Такие молекулы образуются атомами бериллия, магния, а также атомами углерода в ацетилене (С 2 Н 2) и в углекислом газе (СО 2).
Пример 5. Объясните химическую связь в молекулах ВеН 2 и ВеF 2 и строение этих молекул.
Решение. Атомы бериллия в нормальном состоянии не образуют химических связей, т.к. не имеют неспаренных электронов (2s 2). В возбужденном состоянии (2s 1 2p 1) электроны находятся на разных орбиталях, поэтому при образовании связей происходит sp-гибридизация по схеме, приведенной на рис. 22. К двум гибридным орбиталям присоединяются два атома водорода или фтора, как показано на рис. 23.
1) 2)
Рис. 23. Схема образования молекул ВеН 2 (1) и ВеF 2 (2)
Образующиеся молекулы – линейные, валентный угол 180º.
Пример 6. По экспериментальным данным молекула СО 2 – линейная, причём, обе связи углерода с кислородом одинаковы по длине (0,116 нм) и энергии (800 кДж/моль). Как объясняются эти данные?
Решение . Эти данные о молекуле диоксида углерода объясняет следующая модель ее образования.
Атом углерода образует связи в возбужденном состоянии, при котором он имеет четыре неспаренных электрона: 2s 1 2p 3 .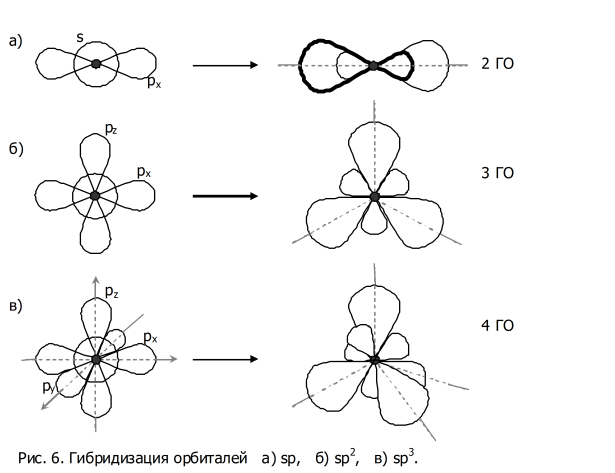 При образовании связей происходит sp-гибридизация орбиталей. Гибридные орбитали направлены по прямой линии в противоположные стороны от ядра атома, а оставшиеся две чистые (негибридные) p-орбитали располагаются перпендикулярно друг к другу и к гибридным орбиталям. Все орбитали (гибридные и негибридные) содержат по одному неспаренному электрону.
При образовании связей происходит sp-гибридизация орбиталей. Гибридные орбитали направлены по прямой линии в противоположные стороны от ядра атома, а оставшиеся две чистые (негибридные) p-орбитали располагаются перпендикулярно друг к другу и к гибридным орбиталям. Все орбитали (гибридные и негибридные) содержат по одному неспаренному электрону.
Каждый атом кислорода, имеющий два неспаренных электрона на двух взаимно перпендикулярных p-орбиталях, присоединяется к атому углерода s-связью и p-связью: s-связь образуется с участием гибридной орбитали углерода, а p-связь образуется перекрыванием чистых p-орбиталей атомов углерода и кислорода. Образование связей в молекуле СО 2 показано на рис. 24.
Рис. 24. Схема образования молекулы СО 2
Кратность связи, равная двум, объясняет большую прочность связи, а sp-гибридизация – линейное строение молекулы.
Смешивание одной s- и двух p-орбиталей называется sp 2 -гибридизацией
. При этой гибридизации получаются три равноценные q-орбитали, расположенные в одной плоскости под углом 120º (рис.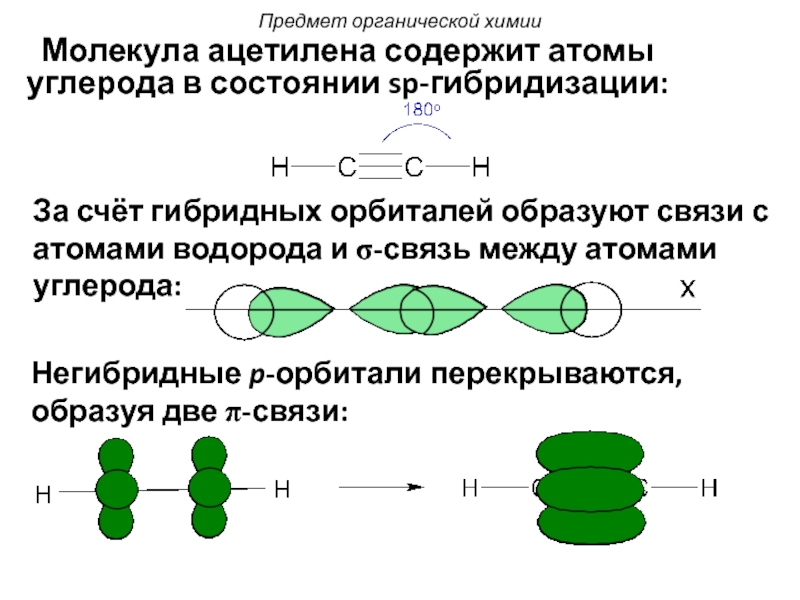 25).
25).
Рис. 25. Схема sp 2 -гибридизации
Образующиеся при этой гибридизации молекулы типа АВ 3 имеют форму плоского правильного треугольника с атомами А в центре и атомами В в его вершинах. Такая гибридизация происходит в атомах бора и других элементов третьей группы и в атомах углерода в молекуле С 2 Н 4 и в ионе СО 3 2- .
Пример 7. Объясните образование химических связей в молекуле ВН 3 и ее строение.
Решение. Экспериментальные исследования свидетельствуют о том, что в молекуле ВН 3 все три связи В–Н расположены в одной плоскости, углы между связями равны 120º. Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s 1 2p 2) и он образует связи sp 2 -гибридными орбиталями. Схема молекулы ВН 3 приведена на рис. 26.
Рис. 26. Схема образования молекулы ВН 3
Если в гибридизации участвуют одна s- и три p-орбитали (sp 3 -гибридизация
), то в результате образуются четыре гибридные орбитали, направленне к вершинам тетраэдра, т. е. ориентированные под углами 109º28 ¢ (~109,5º) друг к другу. Образующиеся молекулы имеют тетраэдрическое строение. Гибридизацией этого типа объясняется строение предельных углеводородов, соединений углерода с галогенами, многих соединений кремния, катиона аммония NH 4 + и др. Классическим примером этой гибридизации является молекула метана CH 4 (рис. 27)
е. ориентированные под углами 109º28 ¢ (~109,5º) друг к другу. Образующиеся молекулы имеют тетраэдрическое строение. Гибридизацией этого типа объясняется строение предельных углеводородов, соединений углерода с галогенами, многих соединений кремния, катиона аммония NH 4 + и др. Классическим примером этой гибридизации является молекула метана CH 4 (рис. 27)
Рис. 27. Схема образования химических связей в молекуле СН 4
Если в гибридизации участвуют одна s-, три p- и две d-орбитали (sp 3 d 2 — гибридизация ), то возникают шесть гибридных орбиталей, напрвленных к вершинам октаэдра, т.е. ориентированных под углами 90º друг к другу. Образующиеся молекулы имеют октаэдрическое строение. Гибридизацией этого типа объясняется строение соединений серы, селена и теллура с галогенами, например SF 6 и SeF 6 , и многих комплексных ионов: 2– , 3– и т.д. На рис. 28 показано образование молекулы гексафторида серы.
Рис. 28. Схема молекулы SF 6
Химические связи с участием гибридных орбиталей отличаются большой прочностью.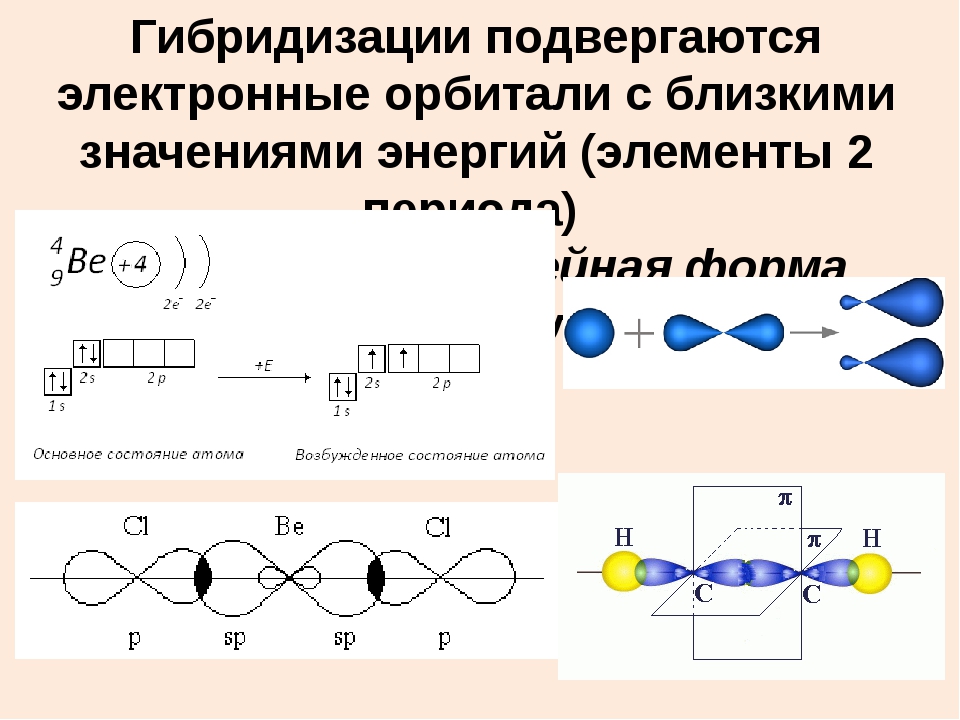 Если энергию s-связи, образованную «чистыми» s-орбиталями, принять за единицу, то энергия связи при sp-гибридизации будет равна 1,43, при sp 2 -гибридизации 1,99, при sp 3 -гибридизации 2,00, а при sp 3 d 2 -гибридизации 2,92. Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Если энергию s-связи, образованную «чистыми» s-орбиталями, принять за единицу, то энергия связи при sp-гибридизации будет равна 1,43, при sp 2 -гибридизации 1,99, при sp 3 -гибридизации 2,00, а при sp 3 d 2 -гибридизации 2,92. Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Кроме рассмотренных типов гибридизации, в химических соединениях встречаются гибридизации sp 2 d, sp 3 d, sp 3 d 3 , sp 3 d 3 и другие. При sp 2 d-гибридизации молекулы и ионы имеют квадратную форму, при sp 3 d-гибридизации – форму тригональной бипирамиды и при sp 3 d 3 -гибридизации – пентагональной бипирамиды. Другие типы гибридизации встречаются редко.
Пример 8. Приведены уравнения двух похожих реакций:
1) CF 4 + 2HF = H 2 CF 6 ; 2) SiF 4 + 2HF = H 2 SiF 6
Какая из них невозможна с точки зрения образования химических связей?
Решение.
Для образования H 2 CF 6 необходима sp 3 d 2 -гибридизация, но в атоме углерода валентные электроны находятся на втором энергетическом уровне, на котором нет d-орбиталей.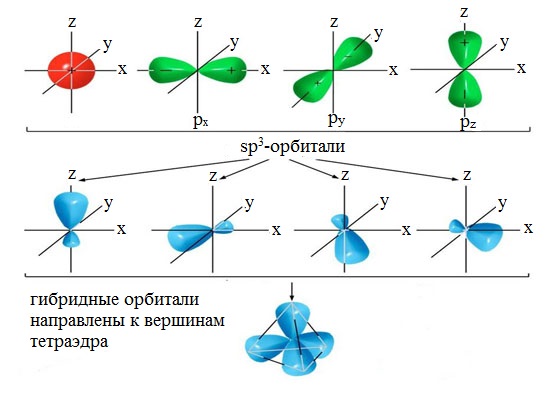 Поэтому первая реакция в принципе невозможна. Вторая реакция возможна, так как sp 3 d 2 -гибридизация у кремния возможна.
Поэтому первая реакция в принципе невозможна. Вторая реакция возможна, так как sp 3 d 2 -гибридизация у кремния возможна.
b – торсионный угол между плоскостями, проходящими через тройки атомов 1, 2, 3 и 2, 3, 4.
Линейная форма характерна для двухатомных молекул. Для предсказания пространственного строения многоатомной молекулы следует знать не только длину связи, но и значения валентных и тор-сионных углов.
Если молекула состоит из трех или более атомов, т.е. в ней присутствуют две или более химических связей, то между их направлениями образуются углы (вплоть до 180 0) , которые называются валентными углами (a) .
Торсионный угол (b) – двугранный угол между двумя плоскостями, проходящими через какие-либо выделенные тройки атомов.
Примеры геометрии молекул представлены на рис. 4.11.
Рассмотрим влияние гибридизации на геометрическую форму молекул.
Если учесть, что р-орбитали направлены друг к другу под углом 90 0 , следовало бы предложить, что связи в молекулах, например, Н 2 О, NH 3 должны быть также направлены друг к другу под прямыми углами. Однако это не так. Более того, часто не оправдывается на опыте ожидаемая неравноценность связей, образованных за счет различных по форме орбиталей. Опытным путем установлено, что, если атом образует несколько однотипных связей за счет электронов разных энергетических подуровней, то эти связи оказываются энергетически равноценными.
Однако это не так. Более того, часто не оправдывается на опыте ожидаемая неравноценность связей, образованных за счет различных по форме орбиталей. Опытным путем установлено, что, если атом образует несколько однотипных связей за счет электронов разных энергетических подуровней, то эти связи оказываются энергетически равноценными.
Рис. 4.11. Геометрия молекул:
(а) – линейная; (б) – треугольная; (в) – тетраэдрическая;
(г) – тригонально-бипирамидальная; (д) – октаэдрическая;
(е) – пентагонально-бипирамидальная
Квантовомеханическая теория строения атома не может объяснить этого факта, и для проведения теории в соответствие с экспериментом возникла гипотеза гибридизации орбиталей .
Согласно этой гипотезе, различные орбитали одного атома, участвующие в образовании s-связей, выравниваются по форме и энергии
. Из нескольких различных орбиталей образуется такое же число гибридных орбиталей, имеющих одинаковую форму и одинаковую энергию.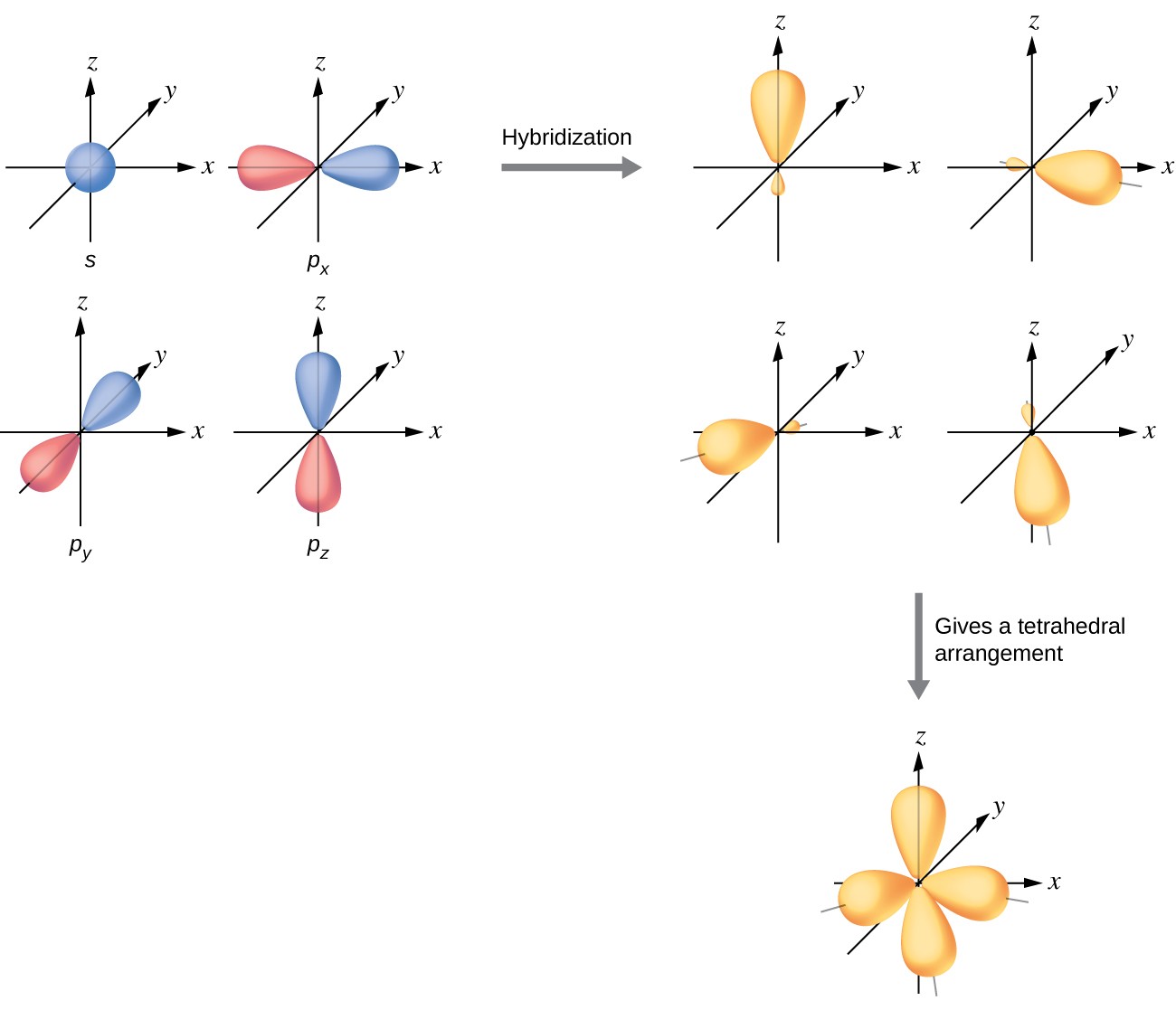 Гибрид-ные орбитали в пространстве вокруг ядра располагаются равномерно.
Гибрид-ные орбитали в пространстве вокруг ядра располагаются равномерно.
В гибридизации могут принимать участие орбитали различной формы. Рассмотрим лишь гибридизацию s- и p- атомных орбиталей. Орбиталь, возникающая при «выравнивании» s- и p- орбиталей, представляет собой неравноплечную «восьмерку» (рис. 4.12). Она в большей степени вытянута в одну сторону от ядра, чем в другую. Поскольку степень перекрывания валентных орбиталей в таком случае выше, химическая связь, образованная гибридной орбиталью, должна быть более прочной, чем образованная обычными s- и p- орбиталями.
Рис. 4.12. Форма sp-гибридной орбитали
В зависимости от количества взаимодействующих орбиталей в атоме в результате гибридизации образуется различное число гибрид-ных орбиталей. Следовательно, и формы молекул будут различны. Рассмотрим ряд простейших примеров.
При образовании молекул галогенидов бериллия, например, BeCl 2 , в образовании химических связей со стороны центрального атома принимают участие один s- и один p-электроны, появляющиеся при возбуждении атома:
Такое возбуждение оправдано, если выделяющаяся при последую-щем образовании химической связи энергия компенсирует затраты энер-гии на возбуждение атома (перескок s-электрона на p-орбиталь).
Наличие неспаренных электронов должно было бы обеспечить две связи атома бериллия с двумя атомами хлора (имеющими неспаренные 3p-электроны), однако эти связи были бы неравноценны.
При затрате небольшой энергии вместо исходных s- и p- орбиталей атома бериллия образуются две равноценные sp-орбитали. Гибридные sp-орбитали вытянуты (рис. 4.13, а) в противоположных друг другу направлениях (валентный угол 180 О). Обе образующиеся связи энергети-чески равноценны.
Поскольку энергия, выделяющаяся при образовании связей Be – Cl, больше, чем сумма затрат энергии на возбуждение атома бериллия и гибридизацию его 2s- и 2p-орбиталей, образование молекулы BeCl 2 энергетически выгодно.
Рассмотренный случай носит название sp-гибридизации
.
Молекулы, образованные с участием sp-гибридных орбиталей, линейны. Простейший пример подобного рода – линейная молекула ацетилена C 2 H 2 , образованная за счет sp-гибридных орбиталей атомов углерода (остальные p-орбитали атомов углерода участия в гиб-ридизации в данном случае не принимают, а образуют p-связи).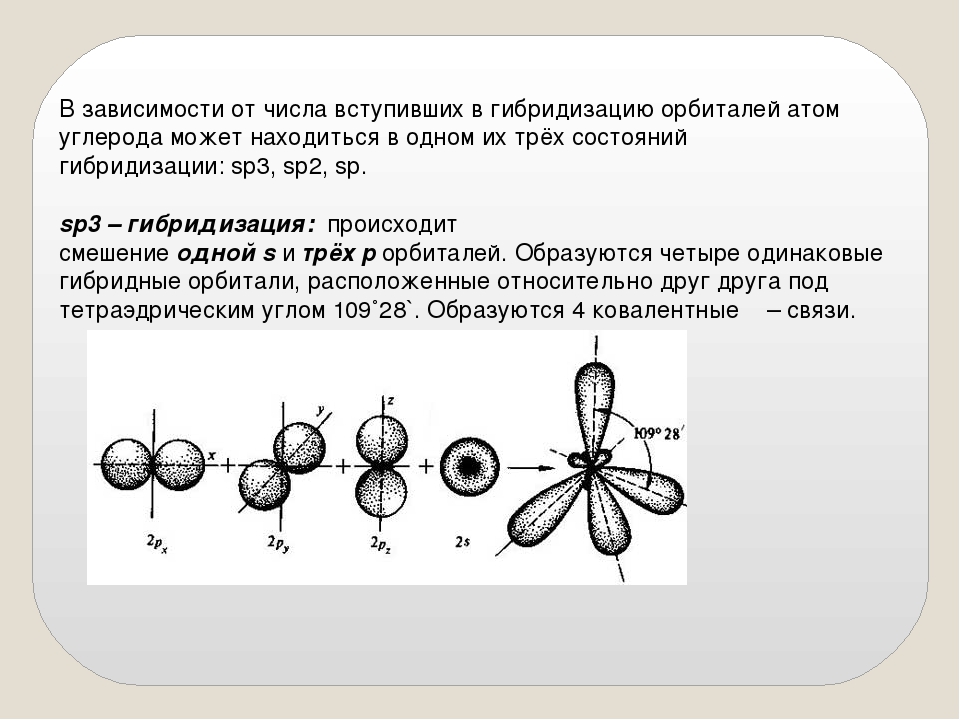
При гибридизации одной s- и двух p- орбиталей образуются три равноценные sp 2 -гибридные орбитали. Примером может служить обра-зование молекулы трихлорида бора. При возбуждении в атоме бора появляются три неспаренных электрона:
| |
Орбитали, на которых расположены эти электроны, усредняются по форме и энергии, образуя три sp 2 -гибридные орбитали, располагаю-щиеся под углом 120 О друг к другу (рис. 4.13, б). Этот угол является оптимальным: он обеспечивает максимальное взаимное удаление и минимальную энергию отталкивания трех гибридных орбиталей, следовательно, обеспечивает минимальную энергию системы.
Таким образом, молекулы, образованные за счет sp 2 -гибридных орбиталей, представляют собой правильный треугольник, в центре кото-рого находится центральный атом (в нашем случае — бор), а в вершинах – остальные атомы (хлора). Все три связи в молекуле равноценны.
Примеры молекул с sp 2 -гибридными орбиталями атома углерода – это органические вещества: этилен C 2 H 4 , бензол С 6 Н 6 и др.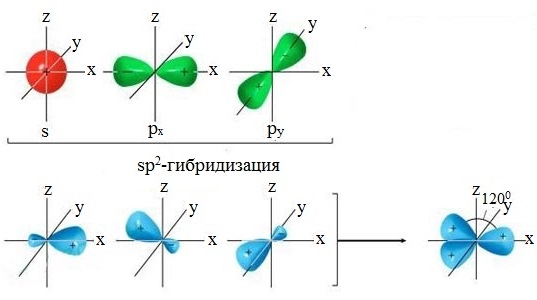 (в этих случаях три орбитали атома углерода гибридизуются, а четвертая – участвует в образовании p-связи).
(в этих случаях три орбитали атома углерода гибридизуются, а четвертая – участвует в образовании p-связи).
Если в образовании гибридных орбиталей принимают участие четыре орбитали (например, в молекуле метана CH 4), имеет место sp 3 -гибридизация. Возбужденный атом углерода имеет 4 неспаренных электрона (один s- и три p-электрона):
| |
Рис. 4.13. Схема расположения орбиталей при sp- (а), sp 2 — (б) и
sp 3 — гибридизации (в)
Если все четыре орбитали принимают участие в гибридизации, то четыре образовавшихся sp 3 -гибридные орбитали вследствие взаимного отталкивания ориентируются друг к другу под углом 109 О 28 / (рис. 4.9, в). При этом атом углерода занимает место в центре правильного тетраэдра, а в вершинах находятся его партнеры (в случае метана – атомы водорода).
В атоме азота на внешнем энергетическом уровне находятся пять электронов:
Современная квантовохимическая теория химической связи предполагает, что при образовании молекулы аммиака NH 3 орбитали атома азота подвергаются sp 3 -гибридизации.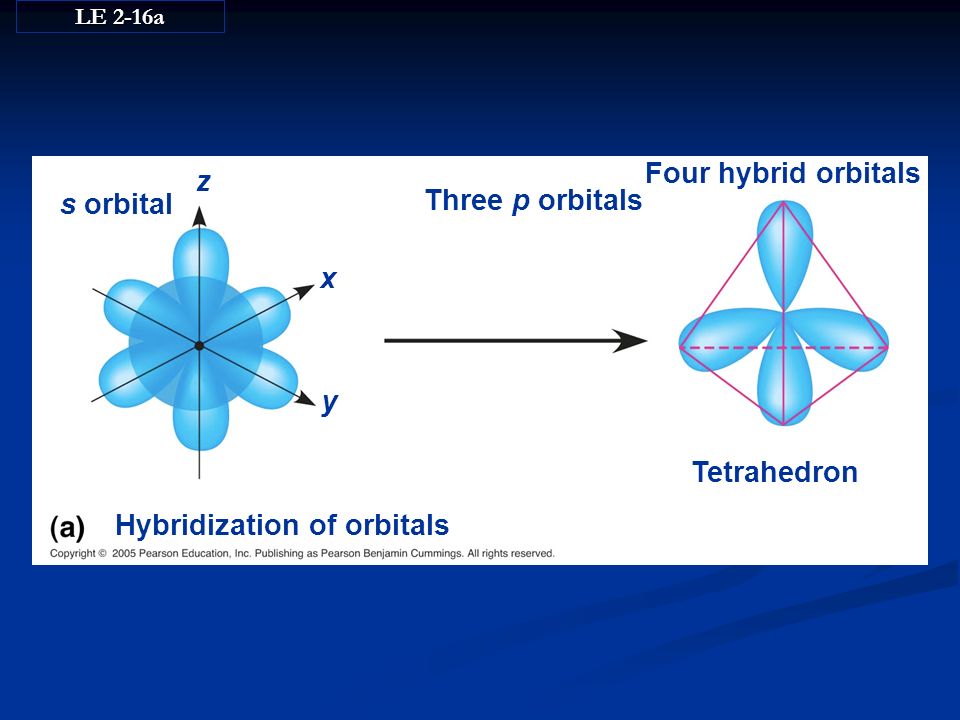 В этом случае говорят о гибридизации не электронов, а орбиталей, поэтому она может наблюю-даться как в случае орбиталей, содержащих по одному электрону, так и в случае орбиталей, заселенных двумя электронами, либо вовсе свободных от них. Три атома водорода аммиака занимают три вершины образующегося тетраэдра из sp 3 -гибридных орбиталей. Четвертая вершина тетраэдра занята гибридным электронным облаком, не участвующим в образовании химической связи. Поскольку не все вершины тетраэдра идентичны, валентный угол в молекуле аммиака меньше тетраэдрического и равен 107 0 , т.е. молекула представляет собой слегка искаженный тетраэдр (тригональную пирамиду см. рис. 4.10, б).
В этом случае говорят о гибридизации не электронов, а орбиталей, поэтому она может наблюю-даться как в случае орбиталей, содержащих по одному электрону, так и в случае орбиталей, заселенных двумя электронами, либо вовсе свободных от них. Три атома водорода аммиака занимают три вершины образующегося тетраэдра из sp 3 -гибридных орбиталей. Четвертая вершина тетраэдра занята гибридным электронным облаком, не участвующим в образовании химической связи. Поскольку не все вершины тетраэдра идентичны, валентный угол в молекуле аммиака меньше тетраэдрического и равен 107 0 , т.е. молекула представляет собой слегка искаженный тетраэдр (тригональную пирамиду см. рис. 4.10, б).
В молекуле воды валентный угол Н–О–Н также близок к тетраэдрическому (104,5 0). Объясняют это тем, что орбитали атома кислорода подвергаются sр 3 -гибридизации, причем две sр 3 -гибридные орбитали перекрываются с s-орбиталями двух атомов водорода, а две заселены неподеленными электронными парами.
Энергетические характеристики связей в галогеноводородах показывают, что даже в этом случае орбитали атомов галогенов подвержены sp 3 -гибридизации, и связь образована s-орбиталью атома водорода и sр 3 -гибридной орбиталью атома галогена.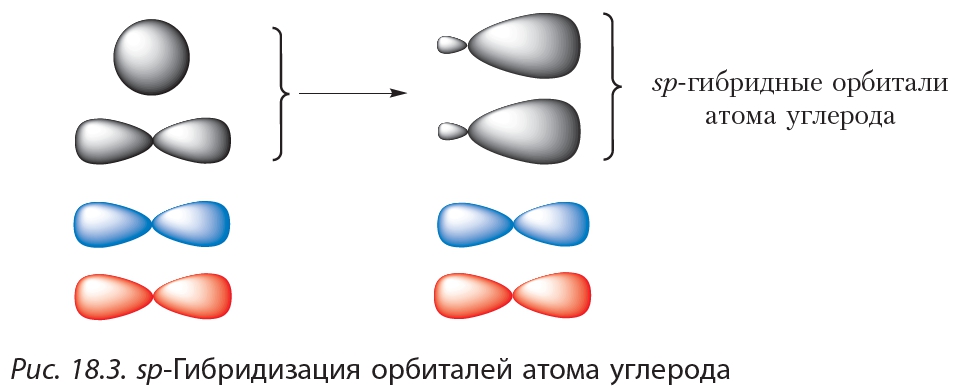 Кажется, что нет необходимости применять теорию гибридизации для двухатомных моле-кул, но связь в галогеноводородах обладает большей прочностью, чем дает расчет для связи, образованной «чистой» р-орбиталью.
Кажется, что нет необходимости применять теорию гибридизации для двухатомных моле-кул, но связь в галогеноводородах обладает большей прочностью, чем дает расчет для связи, образованной «чистой» р-орбиталью.
Примеры влияния неподеленных электронных пар центрального атома на геометрию молекулы рассмотрены также на рис. 4.14. и в табл. 4.3.
Таким образом, соответствие теории гибридизации эксперимен-тальным исследованиям (например, данным по энергетике химических связей) подтверждает важность самой концепции гибридизации. Гибридизацией определяется химическое и кристаллохимическое строение веществ, а, следовательно, и их химические свойства.
Рис. 4.14. Влияние неподеленных электронных пар (Е) центрального атома на пространственную конфигурацию молекул:
(а) – тетраэдр; (б) – тригональная пирамида; (в) – угловая форма;
(г) – тригональная бипирамида; (д) – искаженный тетраэдр; (е) – Т-форма; (ж) – линейная форма; (з) – октаэдр; (и) – тетрагональная пирамида; (к) – квадрат
Таблица 4.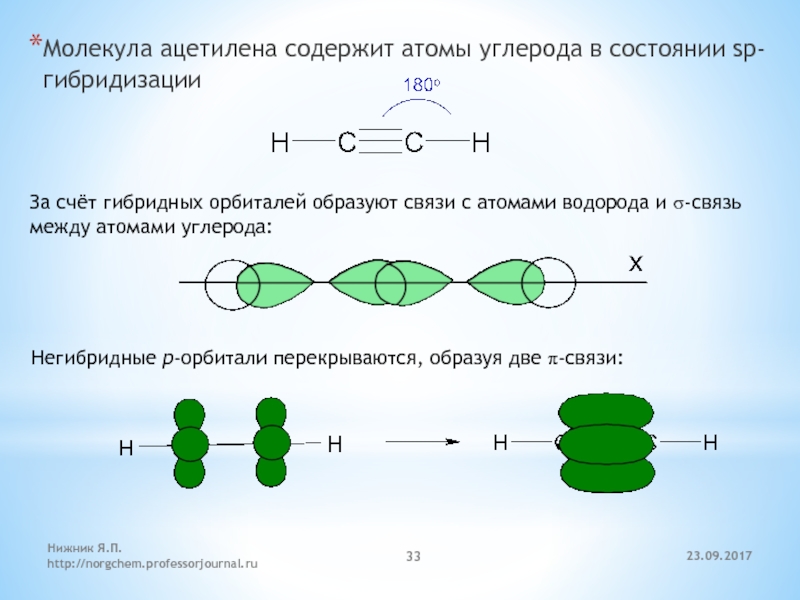 3
3
Число электронных пар центрального атома
и пространственная конфигурация молекул ABn
| Число электронных пар атома А | Расположение электронных пар | Число связывающих пар | Число неподеленных пар | Геометрическая форма и состав молекулы* | Примеры |
| Линейное | Линейная АВ 2 | BeH 2 , BeCl 2 | |||
| Треугольное | Плоский треугольник АВ 3 Угловая АВ 2 Е | BF 3 SnCl 2 | |||
| Тетраэдрическое | Тетраэдр АВ 4 Тригональная пирамида АВ 3 Е Угловая АВ 2 Е 2 | CCl 4 , CH 4 H 3 N, NF 3 H 2 O, OF 2 | |||
| Тригонально-бипира-мидальное | Тригональная бипирамида АВ 5 Неправильный тетраэдр АВ 4 Е Т-образная АВ 3 Е 2 Линейная АВ 2 Е 3 | PCl 5 SF 4 ClF 3 XeF 2 , IF | |||
| Октаэдрическое | Октаэдр АВ 6 Квадратная пирамида АВ 5 Е Плоский квадрат АВ 4 Е 2 | SF 6 , SiF IF 5 , SbF XeF 4 , ICl | |||
| Пентагонально-бипи-рамидальное | Пентагональная бипирамида АВ 7 Неправильный октаэдр АВ 6 Е | IF 7 XeF 6 |
*E – неподеленная электронная пара.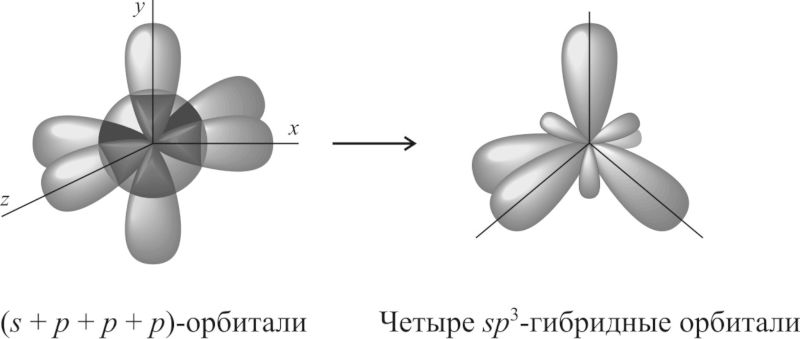
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р ) с образованием новых атомных орбиталей, называемых гибридными орбиталями .
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон
Sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Sp2-гибридизация
Sp2-гибридизация
Происходит
при смешивании одной s- и двух p-орбиталей.
Образуются три гибридные орбитали с
осями, расположенными в одной плоскости и
направленными к вершинам треугольника
под углом 120 градусов. Негибридная
p-атомная орбиталь перпендикулярна
плоскости и, как правило, участвует в
образовании π-связей
Негибридная
p-атомная орбиталь перпендикулярна
плоскости и, как правило, участвует в
образовании π-связей
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
|
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
|
Линейная |
BeF 2 , CO 2 , NO 2 + |
|||
|
sp 2 |
Треугольная |
BF 3 , NO 3 — , CO 3 2- |
||
|
sp 3 |
Тетраэдрическая |
CH 4 , ClO 4 — , SO 4 2- , NH 4 + |
||
|
dsp 2 |
Плоскоквадратная |
Ni(CO) 4 , 2- |
||
|
sp 3 d |
Гексаэдрическая | |||
|
sp 3 d 2 , d 2 sp 3 |
Октаэдрическая |
SF 6 , Fe(CN) 6 3- , CoF 6 3- |
4.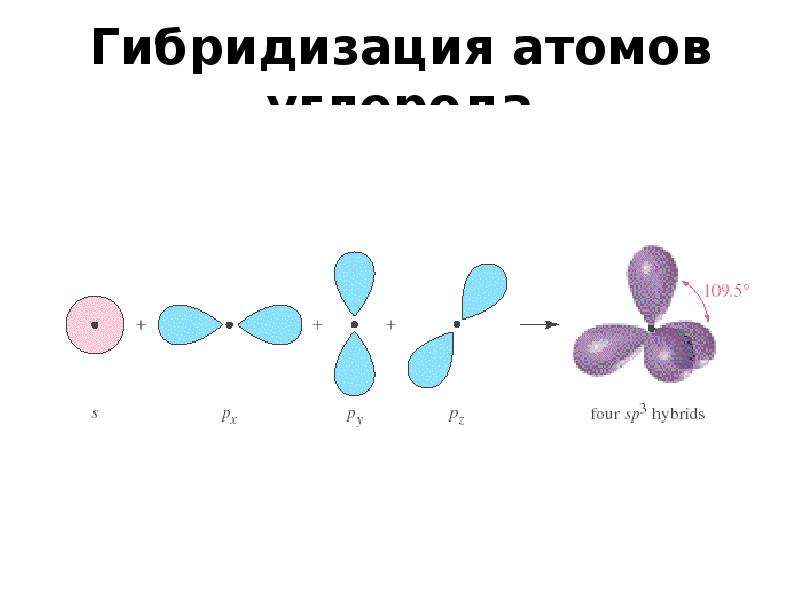 Электровалентная, ковалентная,
донорно-акцепторная, водородная связи.
Электронное строение σ и π связи.
Основные
характеристики ковалентной связи:
энергия связи, длина, валентный угол,
полярность, поляризуемость.
Электровалентная, ковалентная,
донорно-акцепторная, водородная связи.
Электронное строение σ и π связи.
Основные
характеристики ковалентной связи:
энергия связи, длина, валентный угол,
полярность, поляризуемость.
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной.
Ковалентная связь- химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой.
Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов.
Водородная связь -это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами
σ
связь-это первая и более прочная связь,
которая образуется при перекрывании
электронных облаков в направлении
прямой, соединяющий центры атомов.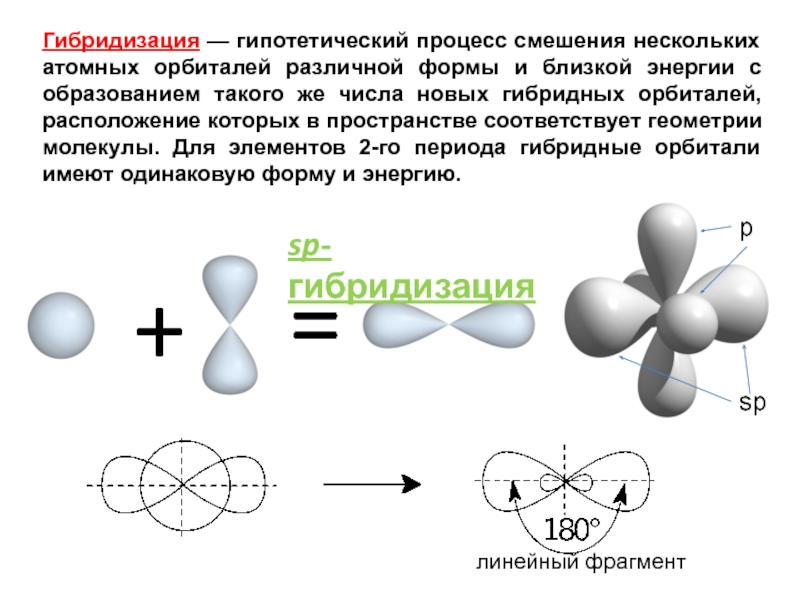
σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи.
π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер
Электроны π и σ связи теряют свою принадлежность к определенному атому.
Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения.
Длина связи- это расстояние между центрами связанных атомов.
Валентный угол- это угол между двумя связями, имеющий общий атом.
Энергия связи- энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность
Полярность
связи обусловлена неравномерным
распределением электронной плотности
вследствие различий в электроотрицательностях
атомов. По этому признаку ковалентные
связи подразделяются на неполярные и
полярные. Поляризуемость
связи выражается в смещении электронов
связи под влиянием внешнего электрического
поля, в том числе и другой реагирующей
частицы. Поляризуемость определяется
подвижностью электронов. Полярность и
поляризуемость ковалентных связей
определяет реакционную способность
молекул по отношению к полярным реагентам.
Поляризуемость
связи выражается в смещении электронов
связи под влиянием внешнего электрического
поля, в том числе и другой реагирующей
частицы. Поляризуемость определяется
подвижностью электронов. Полярность и
поляризуемость ковалентных связей
определяет реакционную способность
молекул по отношению к полярным реагентам.
5.
Ионная связь (электровалентная)-
очень прочная химическая связь,
образующаяся между атомами с большой
разностью электроотрицательностей,
при которой общая электронная пара
переходит преимущественно к атому с
большей электроотрицательностью.
Ковалентная
связь – возникает за счет обобществления
электронной пары посредством обменного
механизма, когда каждый из взаимодействующих
атомов поставляет по одному электрону.
Донорно акцепторная связь (координационная
связь) химическая связь между двумя
атомами или группой атомов, осуществляемая
за счет неподеленной пары электронов
одного атома (донора) и свободной орбитали
другого атома (акцептора).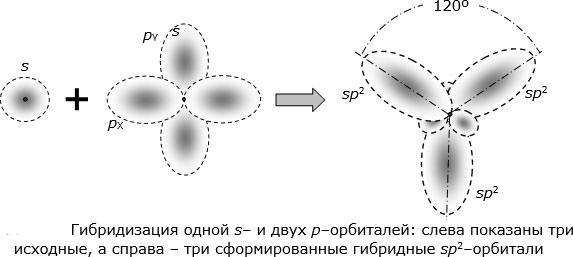 пример Nh5
Для возникновения
водородных связей важно, чтобы в молекулах
вещества были атомы водорода, связанные
с небольшими, но электроотрицательными
атомами, например: O, N, F. Это создает
заметный частичный положительный заряд
на атомах водорода. С другой стороны,
важно, чтобы у электроотрицательных
атомов были неподеленные электронные
пары. Когда обедненный электронами атом
водорода одной молекулы (акцептор)
взаимодействует с неподеленной
электронной парой на атоме N, O или F
другой молекулы (донор), то возникает
связь, похожая на полярную ковалентную.
При
образовании ковалентной связи в молекулах
органических соединений общая электронная
пара заселяет связывающие молекулярные
орбитали, имеющие более низкую энергию.
В зависимости от формы МО – σ-МО или
π-МО – образующиеся связи относят к σ-
или p-типу.
σ-Связь
– ковалентная связь, образованная при
перекрывании s-, p- и гибридных АО вдоль
оси, соединяющей ядра связываемых атомов
(т. е. при осевом перекрывании АО) .
π-Связь
– ковалентная связь, возникающая при
боковом перекрывании негибридных р-АО.
пример Nh5
Для возникновения
водородных связей важно, чтобы в молекулах
вещества были атомы водорода, связанные
с небольшими, но электроотрицательными
атомами, например: O, N, F. Это создает
заметный частичный положительный заряд
на атомах водорода. С другой стороны,
важно, чтобы у электроотрицательных
атомов были неподеленные электронные
пары. Когда обедненный электронами атом
водорода одной молекулы (акцептор)
взаимодействует с неподеленной
электронной парой на атоме N, O или F
другой молекулы (донор), то возникает
связь, похожая на полярную ковалентную.
При
образовании ковалентной связи в молекулах
органических соединений общая электронная
пара заселяет связывающие молекулярные
орбитали, имеющие более низкую энергию.
В зависимости от формы МО – σ-МО или
π-МО – образующиеся связи относят к σ-
или p-типу.
σ-Связь
– ковалентная связь, образованная при
перекрывании s-, p- и гибридных АО вдоль
оси, соединяющей ядра связываемых атомов
(т. е. при осевом перекрывании АО) .
π-Связь
– ковалентная связь, возникающая при
боковом перекрывании негибридных р-АО.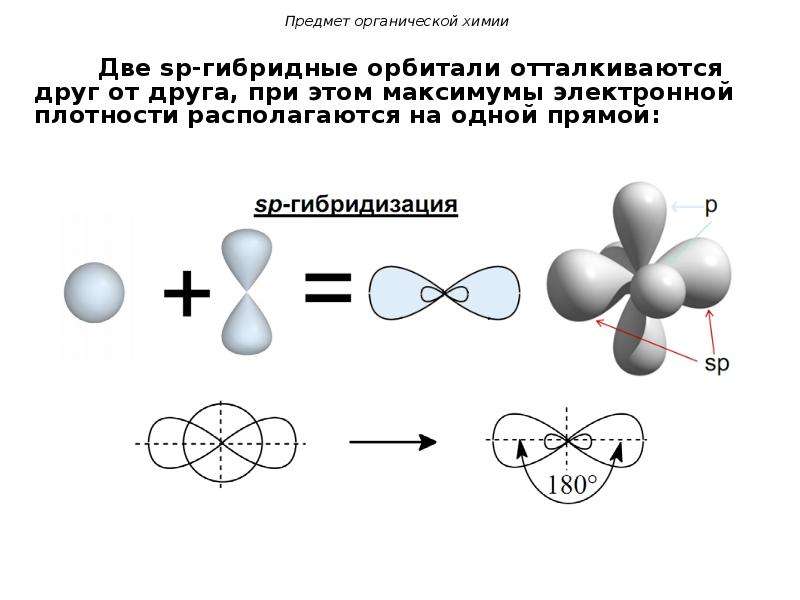 Такое перекрывание происходит вне
прямой, соединяющей ядра атомов.
Такое перекрывание происходит вне
прямой, соединяющей ядра атомов.
π-Связи
возникают между атомами, уже соединенными
σ-связью (при этом образуются двойные
и тройные ковалентные связи) . π-Связь
слабее σ-связи из-за менее полного
перекрывания р-АО.
Различное
строение σ- и π-молекулярных орбиталей
определяет характерные особенности σ-
и π-связей.
1.σ-Связь
прочнее π-связи. Это обусловлено более
эффективным осевым перекрыванием АО
при образовании σ-МО и нахождением
σ-электронов между ядрами.
2.По
σ-связям возможно внутримолекулярное
вращение атомов, т. к. форма σ-МО допускает
такое вращение без разрыва связи (cм
аним. Картинку внизу)) . Вращение по
двойной (σ + π) связи невозможно без
разрыва π-связи!
3.Электроны
на π-МО, находясь вне межъядерного
пространства, обладают большей
подвижностью по сравнению с σ-электронами.
Поэтому поляризуемость π-связи значительно
выше, чем σ-связи.
Характерные
свойства ковалентной связи —
направленность, насыщаемость, полярность,
поляризуемость — определяют химические
и физические свойства соединений.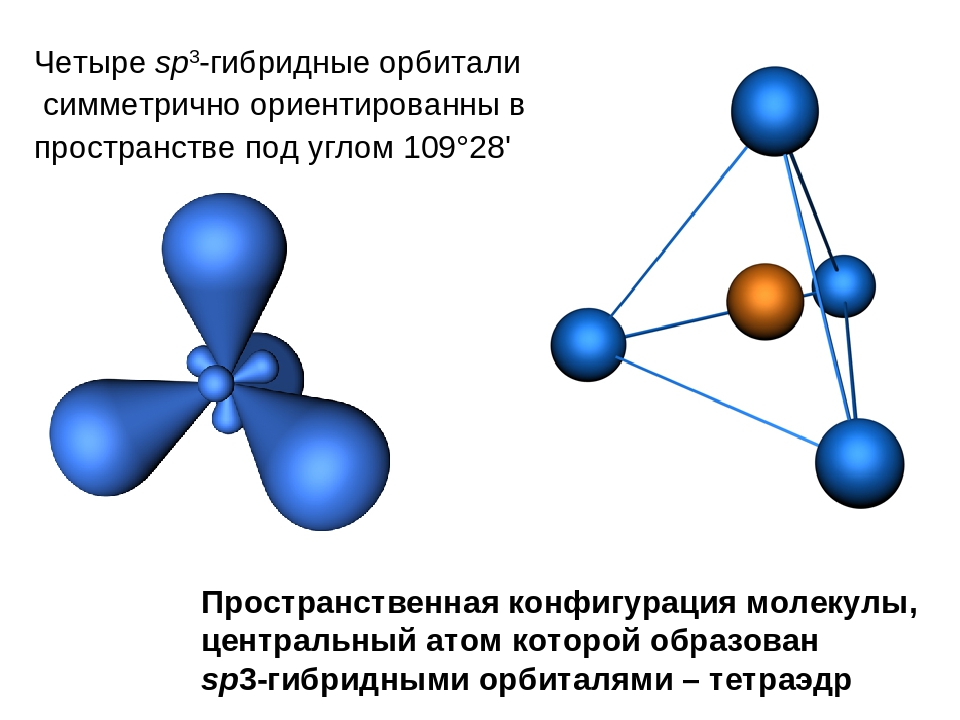
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы).
Поляризуемость
связи выражается в смещении электронов
связи под влиянием внешнего электрического
поля, в том числе и другой реагирующей
частицы.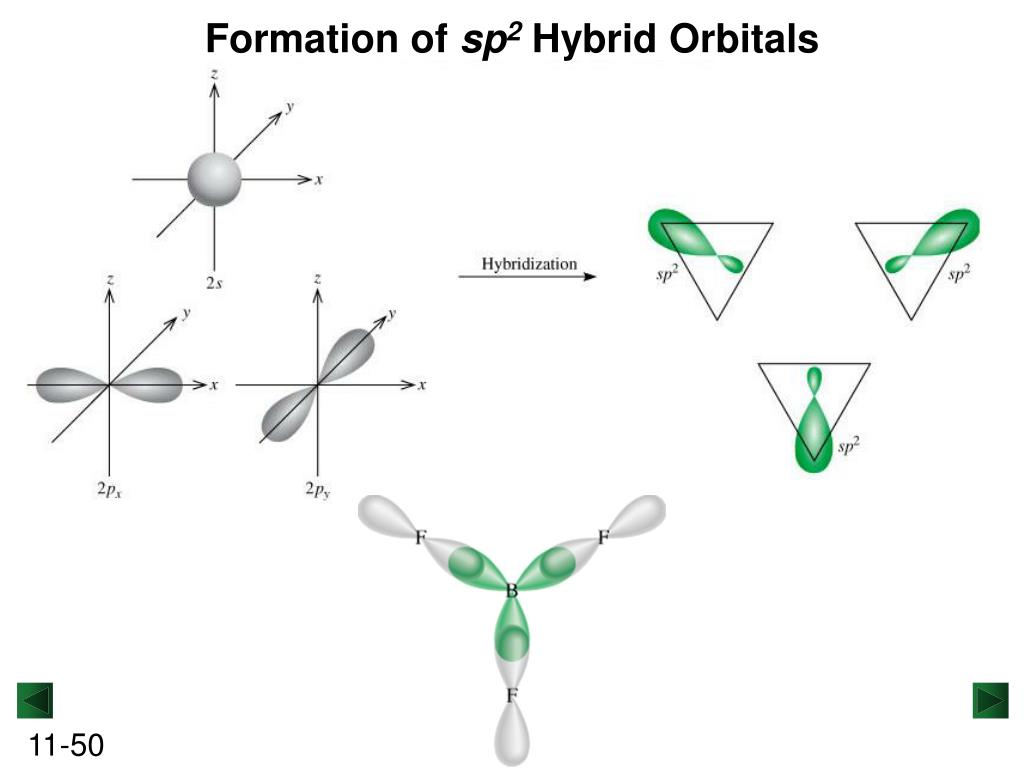 Поляризуемость определяется
подвижностью электронов.
Полярность и поляризуемость ковалентных
связей определяет реакционную способность
молекул по отношению к полярным реагентам.
Поляризуемость определяется
подвижностью электронов.
Полярность и поляризуемость ковалентных
связей определяет реакционную способность
молекул по отношению к полярным реагентам.
6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии)*.
Однако
до сих пор сохраняются и широко применяются
(особенно в медицине) тривиальные
(обыденные)
и полутривиальные названия, использовавшиеся
еще до того, как становилось известным
строение вещества. В этих названиях
могут отражаться природные источники
и способы получения, особо заметные
свойства и области применения. Например,
лактоза (молочный сахар) выделена из
молока (от лат. lactum
—
молоко), пальмитиновая кислота — из
пальмового масла, пировиноградная
кислота получена при пиролизе виноградной
кислоты, в названии глицерина отражен
его сладкий вкус (от греч. glykys
—
сладкий).
lactum
—
молоко), пальмитиновая кислота — из
пальмового масла, пировиноградная
кислота получена при пиролизе виноградной
кислоты, в названии глицерина отражен
его сладкий вкус (от греч. glykys
—
сладкий).
Тривиальные названия особенно часто имеют природные соединения — аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных.
Рациональная номенклатура предельных углеводородов
В
отличие от тривиальной названия
основываются на строении молекул.
Названия сложных структур состовляют
из названия блоков те радикалов связанных
с основным навиболее важным узлом
молекулы по этой номенклатуре алканы
рассматриваются как производные метана
у которого атомы водорода замещены
соответствующими радикалами. Выбор
метанового углерода произвольный
поэтому 1 соедин может иметь неск
названий.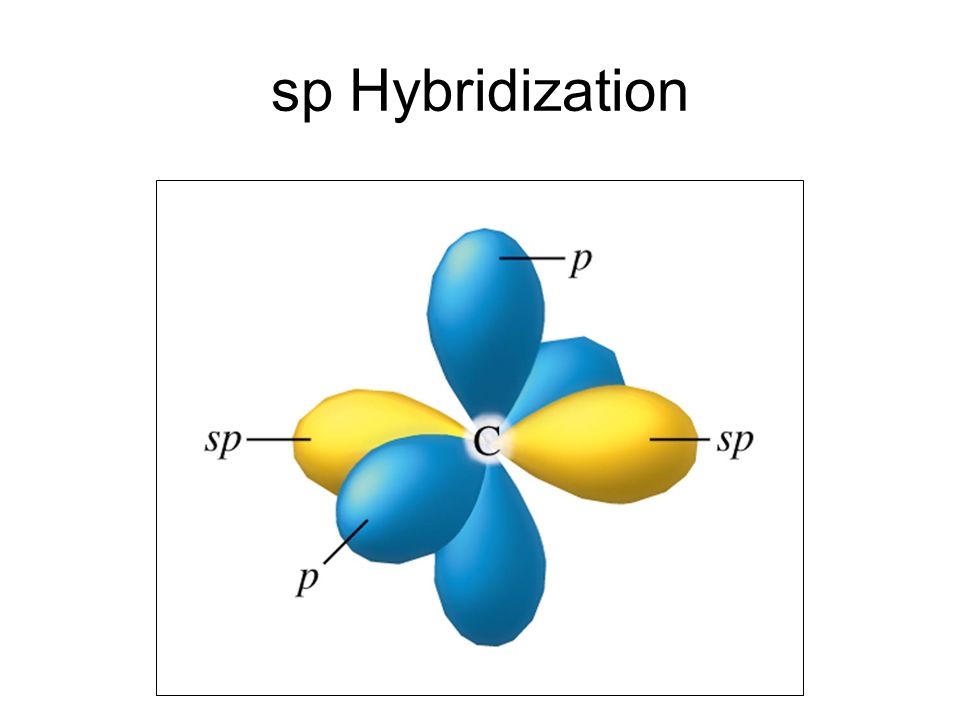 по этой номенклатуре алкены
рассматривают как производные этилена
а алкины-ацетилена.
по этой номенклатуре алкены
рассматривают как производные этилена
а алкины-ацетилена.
7. Гомология органических соединений или закон гомологов — состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только.
Изомеры- соединения имеющие одинаковый состав но разное строение и свойства.
8.
Нуклеоф
и
льные
и электроф
и
льные
реаг
е
нты
.
Участвующие в замещения
реакциях реагенты подразделяются
на нуклеофильные и электрофильные.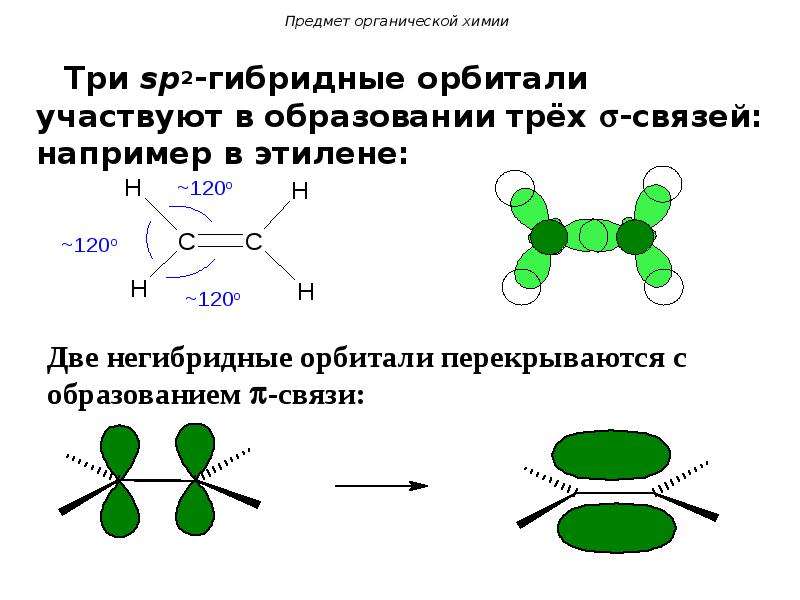 Нуклеофильные реагенты,
или нуклеофилы, предоставляют
свою паруэлектронов на
образование новой связи и вытесняют
из молекулы RX
уходящую группу (X) с парой электронов,
образовывавшей старую связь, например:
Нуклеофильные реагенты,
или нуклеофилы, предоставляют
свою паруэлектронов на
образование новой связи и вытесняют
из молекулы RX
уходящую группу (X) с парой электронов,
образовывавшей старую связь, например:
(где R — органический радикал).
К нуклеофилам относятся отрицательно заряженные ионы (Hal — , ОН — , CN — , NO 2 — , OR — , RS — , NH 2 — , RCOO — и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н 2 О, Nh4, R 3 N, R 2 S, R 3 P, ROH, RCOOH), и металлоорганич. соединения R — Me с достаточно поляризованной связью С — Me + , т. е. способные быть донорами карбанионов R — . Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН — , Н 2 О), алкоголиз (RO — , ROH), ацидолиз (RCOO — , RСООН), аминирование (NH — 2 , NH 3 , RNH 2 и др.), цианирование (CN -) и т. д.
Электрофильные реагенты,
или электрофилы, при образовании новой
связи служат акцепторами пары электронов и
вытесняют уходящую группу в виде
положительно заряженной частицы. К
электрофилам относятся положительно
заряженные ионы (например,
Н + ,
NO 2 +),
нейтральные молекулы с
электронным дефицитом, например SO 3 ,
и сильно поляризованные молекулы (СН 3 СОО — Br + и
др.), причём поляризация особенно
эффективно достигаетсякомплексообразованием с
коэффициентами Льюиса (Hal + —
Hal — · А,
R + —
Cl — · A,
RCO + —
Cl — · А,
где A= A1C1 3 ,
SbCl 5 ,
BF 3 и
др.). К реакциям с
участием электрофилов (электрофильное
замещение) относятся важнейшие реакцииароматических
углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя
— Крафтса):
К
электрофилам относятся положительно
заряженные ионы (например,
Н + ,
NO 2 +),
нейтральные молекулы с
электронным дефицитом, например SO 3 ,
и сильно поляризованные молекулы (СН 3 СОО — Br + и
др.), причём поляризация особенно
эффективно достигаетсякомплексообразованием с
коэффициентами Льюиса (Hal + —
Hal — · А,
R + —
Cl — · A,
RCO + —
Cl — · А,
где A= A1C1 3 ,
SbCl 5 ,
BF 3 и
др.). К реакциям с
участием электрофилов (электрофильное
замещение) относятся важнейшие реакцииароматических
углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя
— Крафтса):
(E + = Hal + , NO + 2 , RCO + , R + и др.)
В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов — в алифатическом (чаще всего в ряду металлоорганических соединений).
53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика)
Реакции
широко используются для получения
спиртов.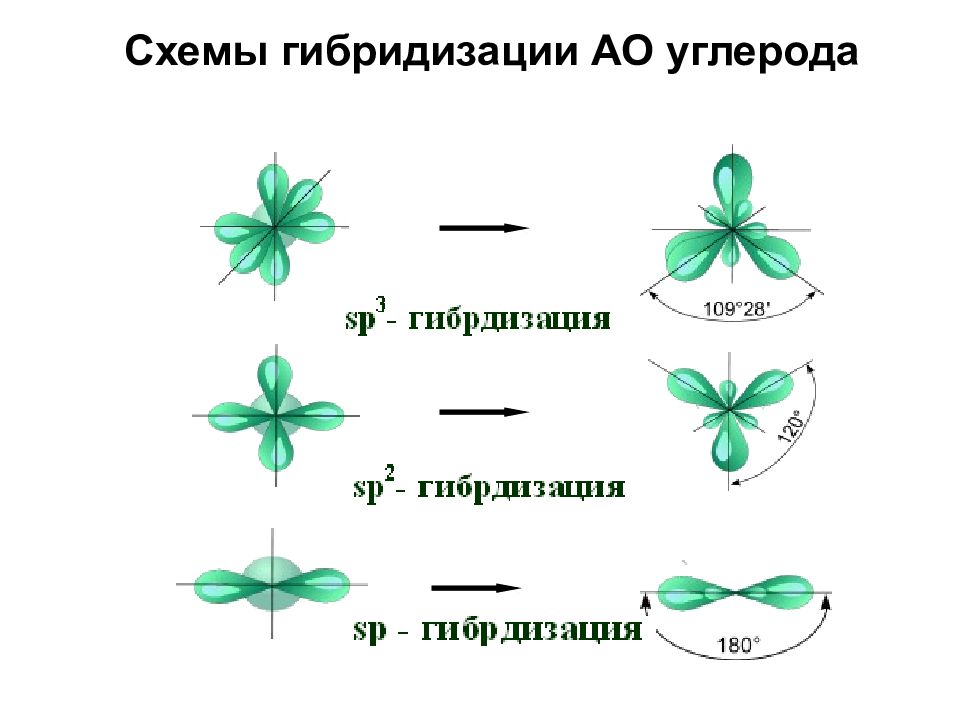 при присоединении к формальдегиду
реактива гриньяра(R-MgX)
образуется первичный спирт, другим
альдегидом вторичные, а кетонам тритичные
спирты
при присоединении к формальдегиду
реактива гриньяра(R-MgX)
образуется первичный спирт, другим
альдегидом вторичные, а кетонам тритичные
спирты
sp 3 -гибридизация характерна для соединений углерода. В результате гибридизации одной s-орбитали и трех
р-орбиталей образуются четыре гибридные sp 3 -орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5 о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH 4 , CCl 4 , C(CH 3) 4 и др.
Рис.5 sp 3 -гибридизация
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H 2 O кислород — sp 3 -гибридный, находится в центре неправильного тетраэдра, в вершины которого «смотрят» два атома водорода и две неподеленные пары электронов (рис. 2). Форма молекулы угловая, если смотреть по центрам атомов.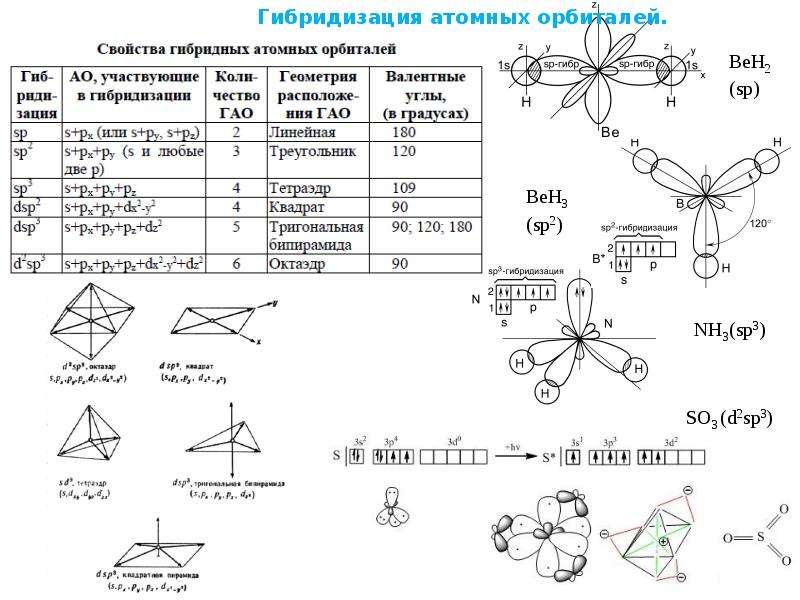 Валентный угол HОН составляет 105 о, что довольно близко к теоретическому значению 109 о.
Валентный угол HОН составляет 105 о, что довольно близко к теоретическому значению 109 о.
Рис.6 sp 3 -гибридизация атомов кислорода и азота в молекулах а) H 2 O и б) NCl 3 .
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому.
Теория гибридизации объясняет геометрию молекулы аммиака. В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о, соответствующие тетраэдру.
Рис.7 sp 3 — гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.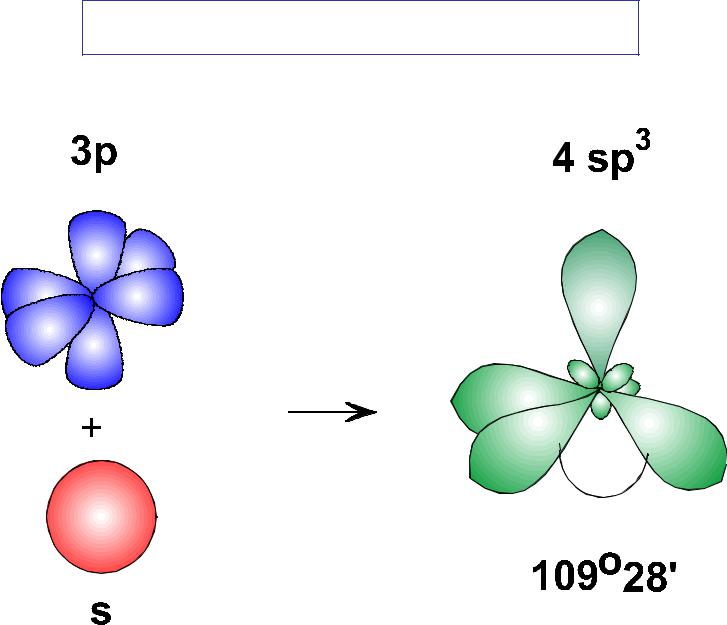
Гибридизация объясняет также отличие угла между связями О-Н в угловой молекуле воды. В результате гибридизации 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp 3 , из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру.
Рис.8 sp 3 -гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp 3 d 2 -гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как 4- , 4- . При этом молекула имеет конфигурацию октаэдра:
Рис. 9 d 2 sp 3 -гибридизация в ионе 4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом.
Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
Конец работы —
Эта тема принадлежит разделу:
Химическая связь. Типы взаимодействия молекул
Для молекулярных систем как и для многоэлектронных атомов невозможно точное решение уравнения шр дингера приближ нные решения достигаются.. существует два способа объяснения характера ковалентной связи метод валентных.. метод валентных связей основные положения мвс ковалентная связь..
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Все темы данного раздела:
Химическая связь. Типы взаимодействия молекул
Химическая связь – это совокупность сил между атомами, образующая устойчивые системы: молекулы, ионы, радикалы.
Ни одно из известных взаимодействий – электрическое, магнитное или гравитаци
Причина образования химической связи – понижение полной энергии системы
Рис. 1 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъя
1 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъя
Основные положения МВС
1)Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2)Ковалентная связь тем прочнее, че
Механизмы образования химической связи
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи.
Обменный механизм. К обменному механизму образования химической
Донорно-акцепторный механизм
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Примерами образования химической св
Валентность
Валентность- свойство атома данного элемента присоединять или замещать определённое число атомов другого элемента. Мерой валентности является число ковалентных связей, которые образует атом. При эт
Sp- гибридизация
sp–гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II).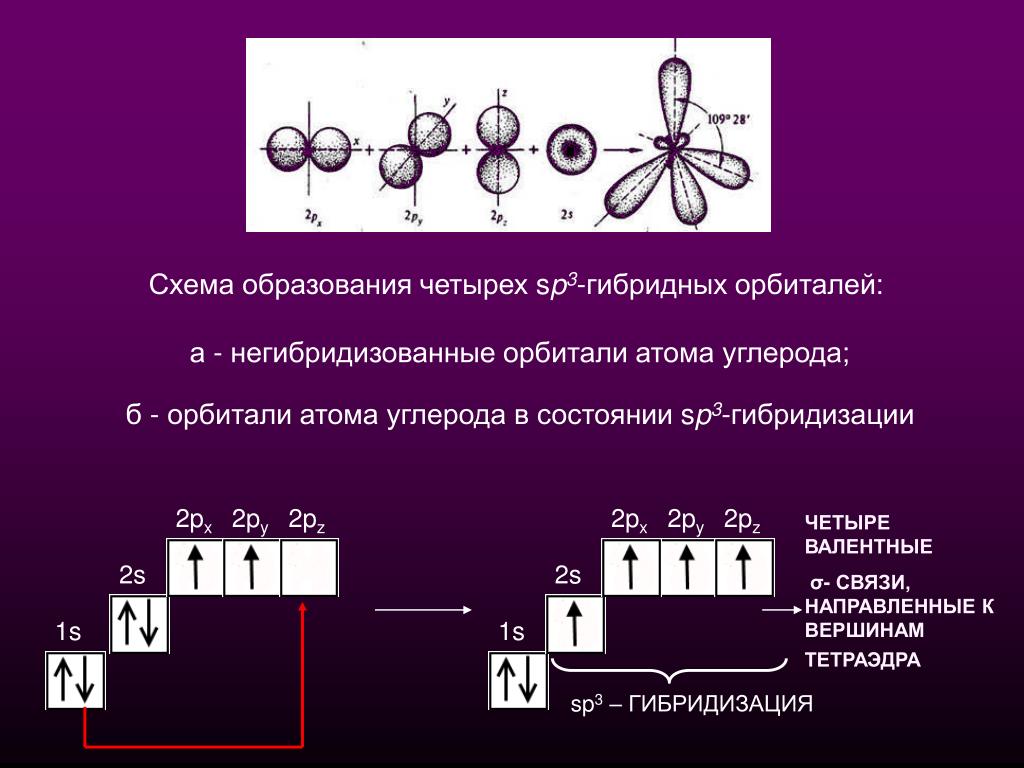 В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспар
В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспар
Метод молекулярных орбиталей
Метод ВС широко используется химиками. В рамках этого метода большая и сложная молекула рассматривается как состоящая из отдельных двухцентровых и двухэлектронных связей. Принимается, что электроны
Полярность связи
Между разными атомами чистая ковалентная связь может проявляться, если электроотрицательность (ЭО) атомов одинакова. Такие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов я
Водородная связь
Водородная связь является особым видом химической связи. Известно, что соединения водорода с сильно электроотрицательными неметаллами, такими как F, О, N, имеют аномально высокие температуры кипени
Энергия связи
Важное значение имеет энергетическая характеристика химической связи. При образовании химической связи общая энергия системы (молекулы) меньше энергии составных частей (атомов), т. е. Е(AB)
е. Е(AB)
Прочность увеличивается с уменьшением длины связи
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с
sp–гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180 о.
Рис.3 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
sp 2 -гибридизация
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp 2 -орбитали, расположенные в одной плоскости под углом 120 о друг к другу. Такова, например, конфигурация молекулы BF 3:
Рис.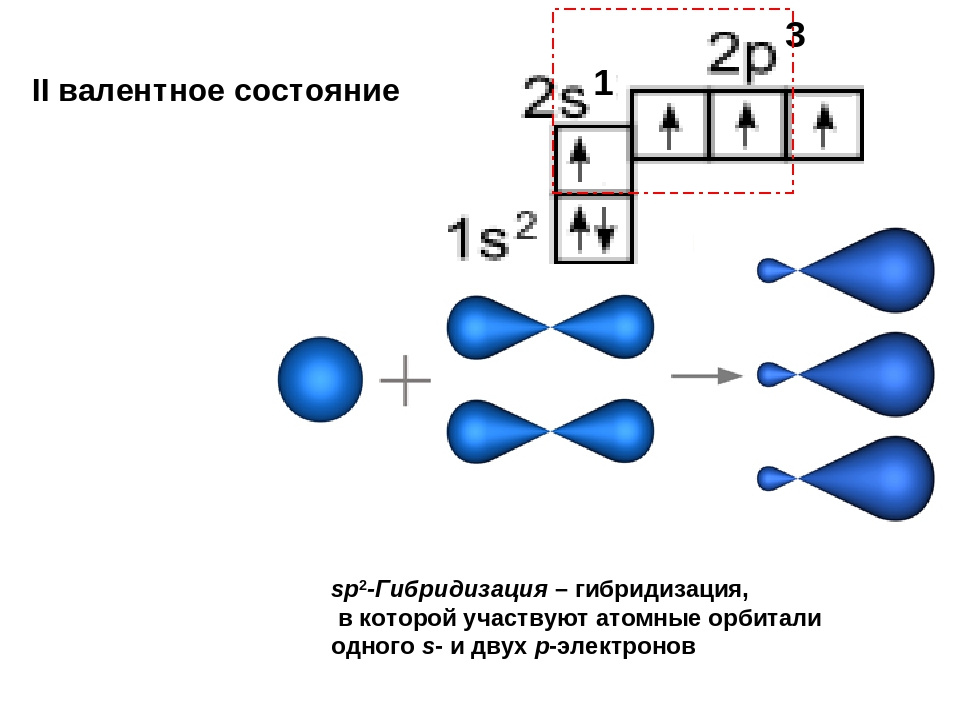 4
sp 2 -гибридизация
4
sp 2 -гибридизация
sp 3 -гибридизация
sp 3 -гибридизация характерна для соединений углерода. В результате гибридизации одной s-орбитали и трех
р-орбиталей образуются четыре гибридные sp 3 -орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5 о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH 4 , CCl 4 , C(CH 3) 4 и др.
Рис.5 sp 3 -гибридизация
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H 2 O кислород — sp 3 -гибридный, находится в центре неправильного тетраэдра, в вершины которого «смотрят» два атома водорода и две неподеленные пары электронов (рис. 2). Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105 о, что довольно близко к теоретическому значению 109 о.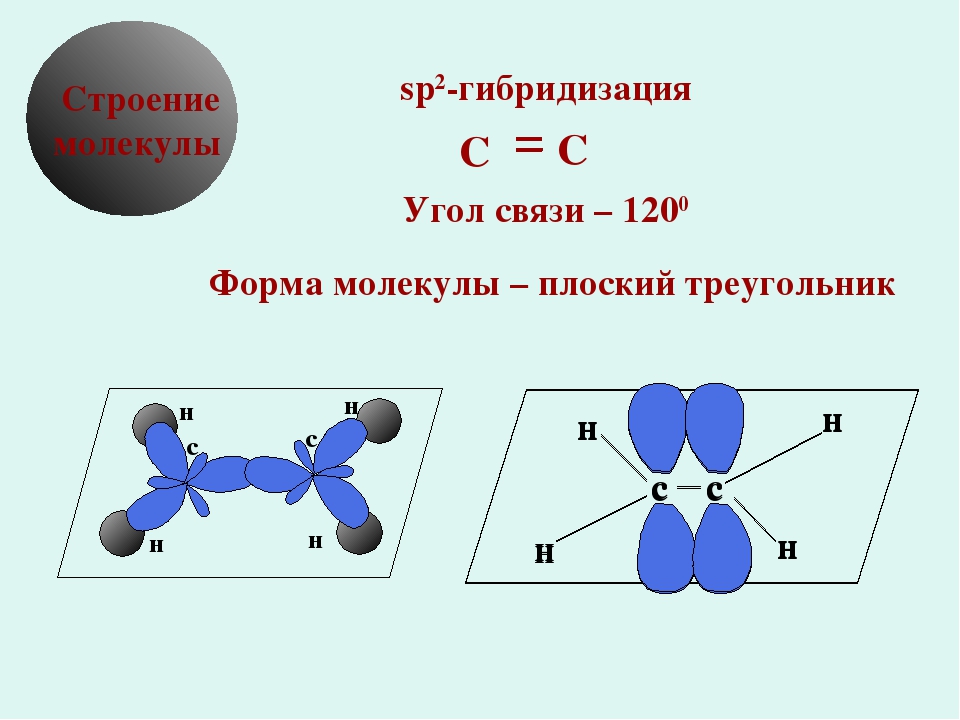
Рис.6 sp 3 -гибридизация атомов кислорода и азота в молекулах а) H 2 O и б) NCl 3 .
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому.
Теория гибридизации объясняет геометрию молекулы аммиака. В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о, соответствующие тетраэдру.
Рис.7 sp 3 — гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.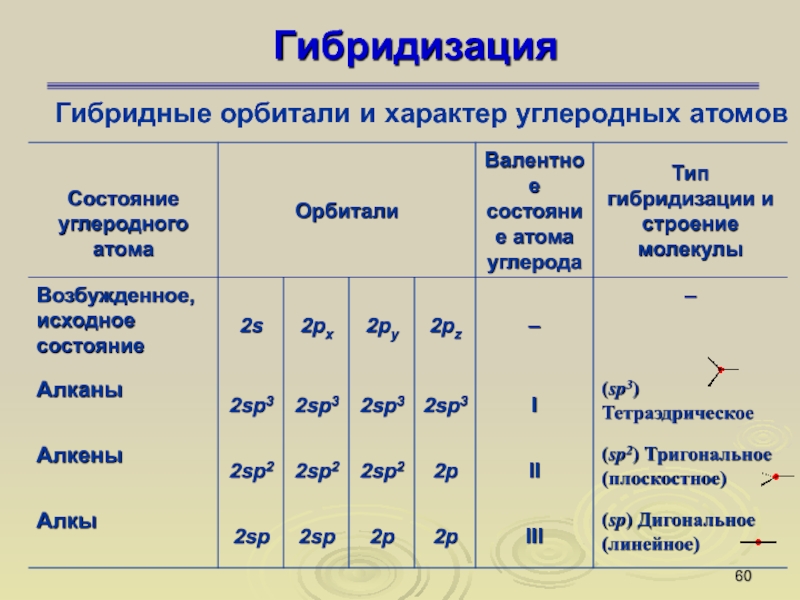
Гибридизация объясняет также отличие угла между связями О-Н в угловой молекуле воды. В результате гибридизации 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp 3 , из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру.
Рис.8 sp 3 -гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp 3 d 2 -гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как 4- , 4- . При этом молекула имеет конфигурацию октаэдра.
Подписаться на еженедельную рассылку aurumrp.ru
Гибридизация атомных орбиталей: понятие и основные виды
Одна из задач химии – это изучение строения вещества, в том числе выяснение механизма образования различных соединений из простых веществ, образуемых атомами одного химического элемента. Особенности взаимодействия атомов, точнее, их разноименно заряженных компонентов – электронных оболочек и ядер, – описываются как различные типы химической связи.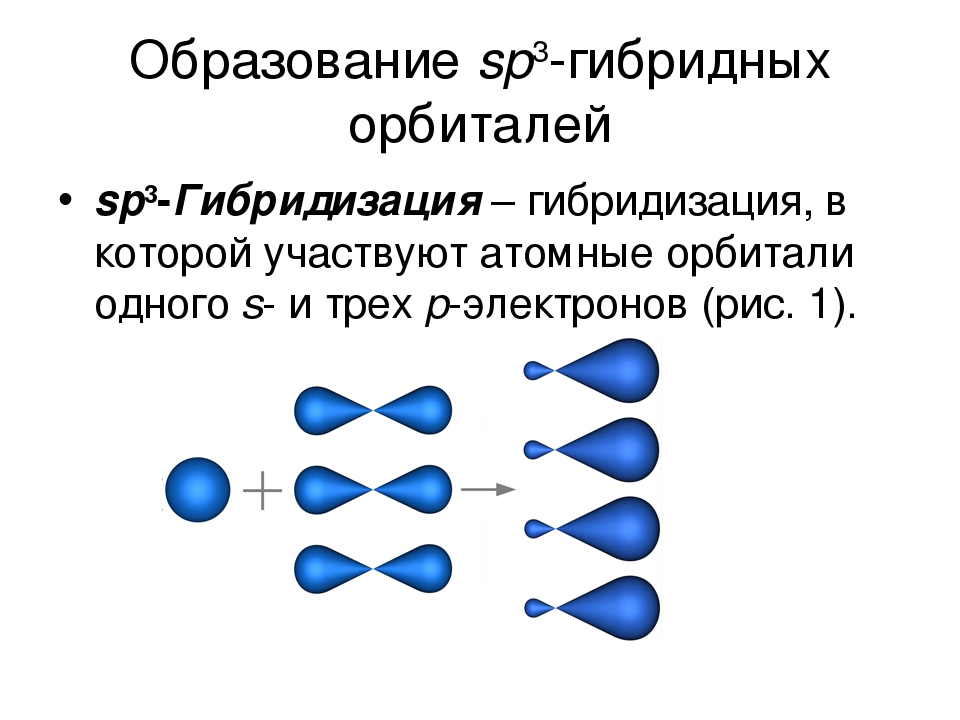 Так, вещества, имеющие молекулярное строение, образуются посредством ковалентной связи, для описания которой в 1931 году американским химиком Л. Полингом была предложена модель гибридизации атомных орбиталей.
Так, вещества, имеющие молекулярное строение, образуются посредством ковалентной связи, для описания которой в 1931 году американским химиком Л. Полингом была предложена модель гибридизации атомных орбиталей.
Понятие о ковалентной связи
В тех случаях, когда в процессе взаимодействия происходит образование общей для двух атомов пары валентных электронных облаков, говорят о ковалентной связи. В результате ее возникновения формируется мельчайшая частица простого или сложного вещества – молекула.
Одной из особенностей ковалентной связи является ее направленность – следствие сложной формы электронных орбиталей p, d и f, которые, не обладая сферической симметрией, имеют определенную пространственную ориентацию. Еще одна важная особенность данного типа химической связи – насыщаемость, обусловленная ограниченным количеством внешних – валентных – облаков в атоме. Именно поэтому существование молекулы, например, H2O, возможно, а H5O – нет.
Типы ковалентной связи
Образование общих электронных пар может происходить различными способами. В механизме образования ковалентной связи важную роль играет характер перекрытия облаков и пространственная симметрия результирующего облака. По данному критерию Л. Полинг предложил различать следующие типы:
В механизме образования ковалентной связи важную роль играет характер перекрытия облаков и пространственная симметрия результирующего облака. По данному критерию Л. Полинг предложил различать следующие типы:
- Сигма-связь (σ) отличается наибольшей степенью перекрытия по оси, проходящей через атомные ядра. Здесь плотность облака будет максимальной.
- Пи-связь (π) образуется при боковом перекрывании, и электронное облако, соответственно, имеет наибольшую плотность вне соединяющей ядра оси.
Эти пространственные характеристики имеют большое значение постольку, поскольку они коррелируют с энергетическими параметрами ковалентной связи.
Особенности многоатомных молекул
Концепция гибридизации атомных орбиталей была введена Полингом для объяснения одной из особенностей ковалентных связей в многоатомных молекулах. Известно, что связи, образуемые центральным атомом в таких молекулах, оказываются одинаковыми по пространственным и энергетическим характеристикам.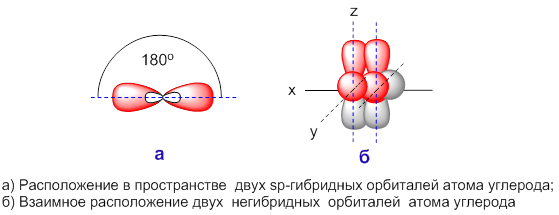 Это происходит вне зависимости от того, какие орбитали (s, p или d) участвуют в формировании общей электронной пары.
Это происходит вне зависимости от того, какие орбитали (s, p или d) участвуют в формировании общей электронной пары.
Очень удобным и наглядным примером для иллюстрации этого явления служит атом углерода. При вступлении в химическую связь атом в возбужденном состоянии имеет 4 валентных орбитали: 2s, 2px, 2py и 2pz. Три последних отличаются от орбитали 2s по энергии и форме. Тем не менее в молекуле, например, метана CH4 все четыре связи совершенно равноценны и имеют валентные углы 109,5° (в то время как p-орбитали расположены под углами 90°). В других соединениях углерода встречаются валентные углы 120° и 180°; в молекулах, содержащих азот (аммиак NH3) и кислород (вода H2O) эти углы составляют 107,5° и 104,5°. Возникновение подобных валентных углов также потребовало объяснения.
Суть явления
Идея гибридизации состоит в образовании усредненных орбиталей путем перекрывания электронных облаков разного типа с близкими значениями энергии – s, p, иногда d.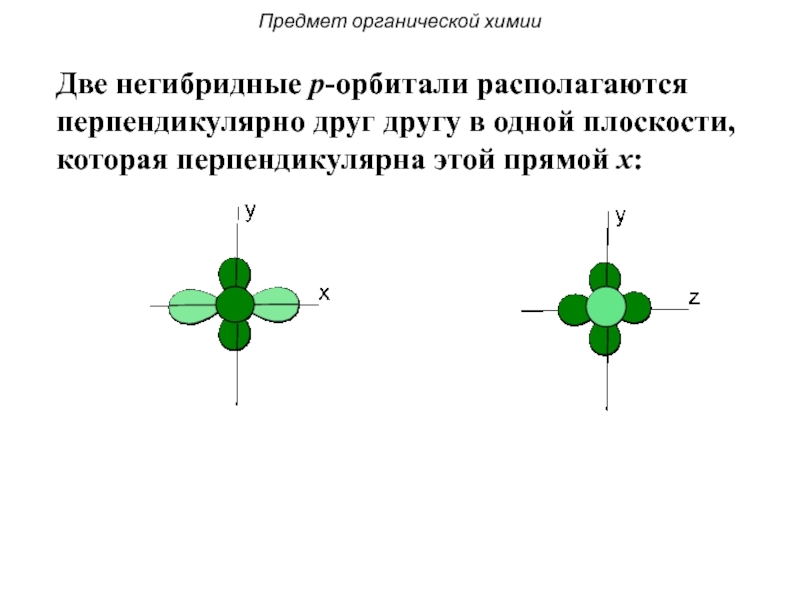 Количество результирующих – гибридных – орбиталей соответствует числу перекрывающихся облаков. Поскольку орбиталь – это волновая функция, определяющая вероятность нахождения электрона в той или иной точке атома, гибридная орбиталь представляет собой наложение волновых функций, происходящее в результате электронных переходов при возбуждении атома. Оно приводит к возникновению равнозначных волновых функций, различающихся только направленностью.
Количество результирующих – гибридных – орбиталей соответствует числу перекрывающихся облаков. Поскольку орбиталь – это волновая функция, определяющая вероятность нахождения электрона в той или иной точке атома, гибридная орбиталь представляет собой наложение волновых функций, происходящее в результате электронных переходов при возбуждении атома. Оно приводит к возникновению равнозначных волновых функций, различающихся только направленностью.
Гибридные орбитали эквивалентны по энергии и имеют одинаковую форму в виде объемной восьмерки, имеющей сильную асимметрию относительно ядра. На гибридизацию затрачивается меньше энергии, чем выделяется при образовании прочной ковалентной связи с гибридными орбиталями, поэтому такой процесс энергетически выгоден, то есть наиболее вероятен.
Основные виды гибридизации орбиталей и геометрия молекул
Возможны различные варианты перекрывания (смешения) внешних электронных облаков в атоме. Самыми распространенными являются следующие виды наложения орбиталей:
- Sp3-гибридизация.
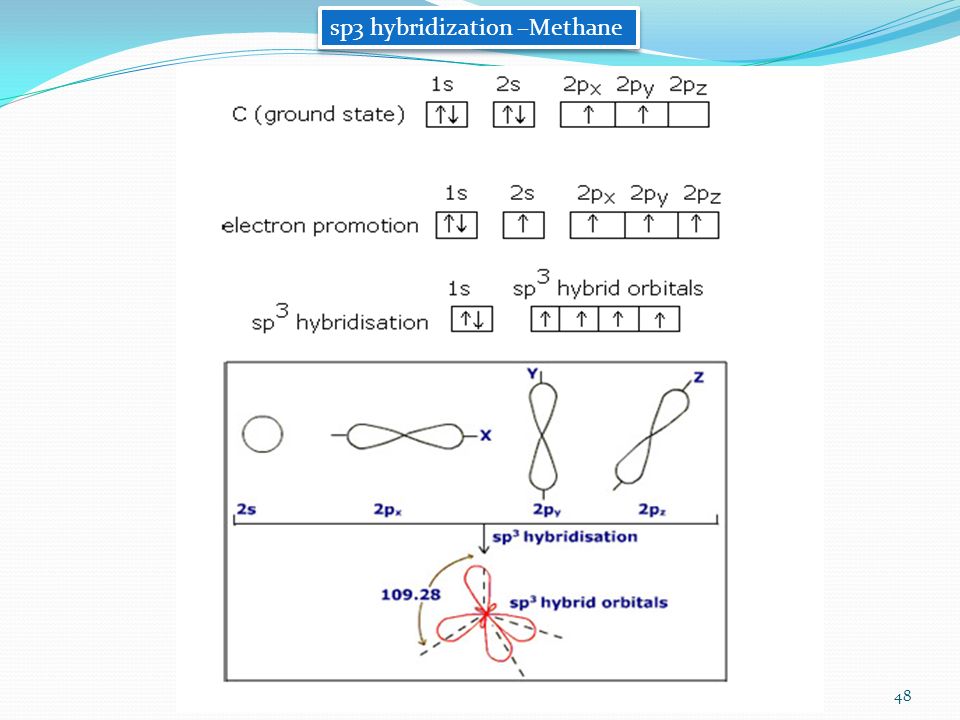 Данный вариант реализуется при наложении одной s- и трех p-орбиталей. Результатом его становятся четыре гибридные орбитали, оси которых направлены для любой пары под углами 109,5°, соответствующим минимальному взаимному отталкиванию электронов. При вступлении этих орбиталей в σ-связи с другими атомами, формируется молекула тетраэдрической конфигурации, например, метан, этан C2H6 (комбинация двух тетраэдров), аммиак, вода. В молекуле аммиака одна, а в молекуле воды – две из вершин тетраэдра заняты неподеленными электронными парами, что приводит к уменьшению валентного угла.
Данный вариант реализуется при наложении одной s- и трех p-орбиталей. Результатом его становятся четыре гибридные орбитали, оси которых направлены для любой пары под углами 109,5°, соответствующим минимальному взаимному отталкиванию электронов. При вступлении этих орбиталей в σ-связи с другими атомами, формируется молекула тетраэдрической конфигурации, например, метан, этан C2H6 (комбинация двух тетраэдров), аммиак, вода. В молекуле аммиака одна, а в молекуле воды – две из вершин тетраэдра заняты неподеленными электронными парами, что приводит к уменьшению валентного угла. - Sp2-гибридизация возникает при комбинации одной s- и двух p-орбиталей. В этом случае тройка гибридных орбиталей располагается под углами 120° в одной плоскости. Подобную треугольную форму имеют, например, молекулы трихлорида бора BCl3, находящего применение в различных технологиях. Другой пример – молекула этилена – формируется за счет дополнительной π-связи между атомами углерода, в которых по одной p-орбитали негибридные и ориентированы перпендикулярно плоскости, образуемой двумя треугольниками.
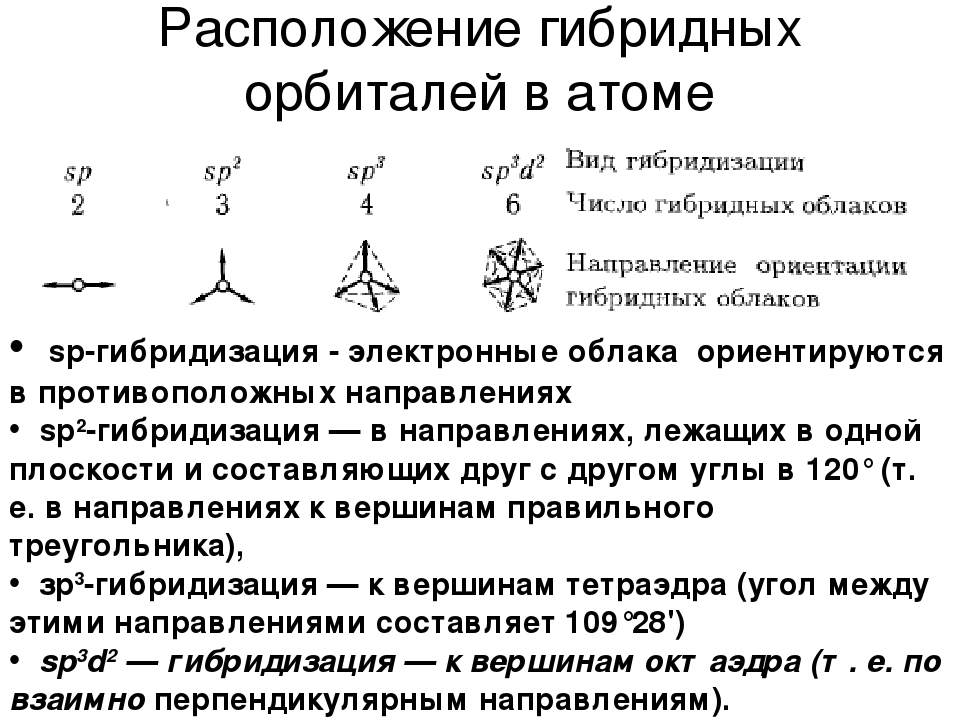
- Sp-гибридизация происходит, когда смешиваются одна s- и одна p-орбиталь. Два гибридных облака располагаются под углом 180°, а молекула имеет линейную конфигурацию. Примерами могут служить молекулы хлорида бериллия BeCl2 или ацетилена C2H2 (в последней две негибридные p-орбитали углерода образуют дополнительные π-связи).
Существуют и более сложные варианты гибридизации атомных орбиталей: sp3d, sp3d2 и другие.
Роль модели гибридизации
Концепция Полинга дает хорошее качественное описание строения молекул. Она удобна и наглядна, успешно объясняет некоторые особенности ковалентных соединений, такие как величина валентных углов или выравнивание длины химической связи. Однако количественная сторона модели не может считаться удовлетворительной, поскольку не позволяет делать многие важные предсказания, касающиеся физических эффектов, связанных с особенностями строения молекул, – например, молекулярных фотоэлектронных спектров. Сам автор концепции гибридизации уже в начале 1950-х годов отмечал ее недостатки.
Сам автор концепции гибридизации уже в начале 1950-х годов отмечал ее недостатки.
Тем не менее в становлении современных представлений о строении вещества модель гибридизации атомных орбиталей сыграла большую роль. На основе ее были разработаны более адекватные концепции, например, теория отталкивания электронных пар. Поэтому, безусловно, модель гибридизации явилась важным этапом в развитии теоретической химии, а при описании некоторых аспектов электронной структуры молекул она вполне применима и в настоящее время.
|
Дом Использование звукового сигнала Атомные орбитали Что такое атомная орбиталь? Орбиты 1s, 2s и 3s 2p и 3p орбитали Трехмерные орбиты Гибридные орбитальные станции Что такое гибридный орбитальный аппарат? Сп, сп 2 и сп 3 Гибридные орбитальные станции Прочее Глоссарий Ссылки
|
Гибридные орбитали
|
Тайна и чудо гибридных орбит
Тайна и чудо гибридных орбиталей
Чтобы электроны разлетались дальше, чем на 90° друг от друга, мы должны придумать новую модель, которая допускает это.
До сих пор мы изучали форму и относительную энергию s-, p-, d- и f-орбиталей. Однако, когда атомы образуют ковалентные соединения, атомных орбиталей недостаточно, потому что они заставляют связанные атомы располагаться слишком близко друг к другу.Как и следовало ожидать, электроны в ковалентных связях, как и везде с электронами, предпочитают находиться как можно дальше друг от друга, потому что они отталкиваются друг от друга. Впоследствии все орбитали внутри атома, содержащие валентные электроны, объединяются друг с другом, образуя «гибридные орбитали».
Вероятно, проще всего понять, как работают гибридные орбитали, показав вам пример. Давайте взглянем на диаграмму заполнения орбит валентных электронов на углероде (дополнительную информацию о диаграммах заполнения орбит см.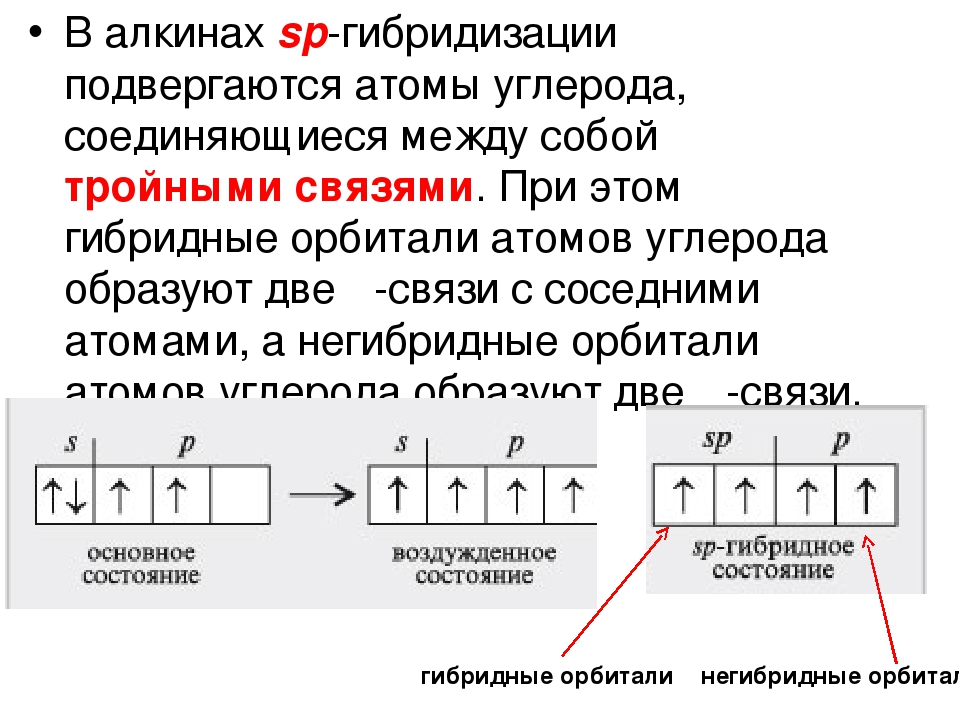 в «Современном атоме»).
в «Современном атоме»).
Рисунок 10.3 Диаграмма заполнения орбит валентных электронов на углероде.
Как видите, из четырех валентных орбиталей углерода одна заполнена (2s), две заполнены наполовину (2p) и одна полностью пуста. Это может быть электронная конфигурация несвязанного атома углерода, но она не объясняет, как углерод может связываться четыре раза, образуя метан. В конце концов, каждая ковалентная связь требует перекрытия орбиталей, содержащих по одному электрону от каждого атома. Если бы эта модель была верна, у нас не было бы связи с s-орбиталью, потому что она уже заполнена, две связи (по одной от двух p-орбиталей) и одна p-орбиталь, которая была совершенно пустой.В результате углерод мог связываться только дважды, что не соответствует действительности.
Молекулярные значения
Гибридные орбитали образуются путем смешения двух или более крайних орбиталей в атоме вместе. Единственный элемент, который не образует гибридных орбиталей, — это водород, так как он имеет только одну 1s-орбиталь.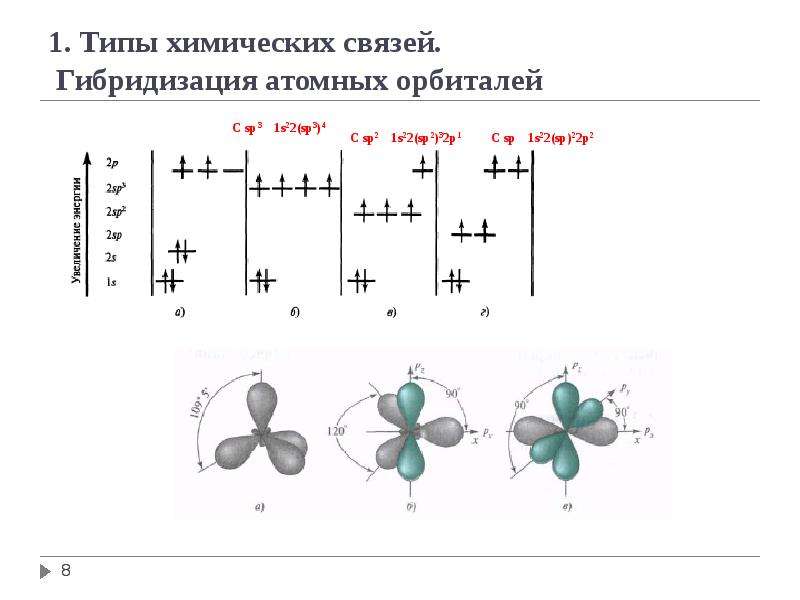
Что на самом деле происходит, когда углерод ковалентно связывается с другими элементами, так это то, что эти четыре непохожие s- и p-орбитали смешиваются друг с другом, образуя четыре идентичные гибридные орбитали.Названия этих новых гибридизированных орбиталей представляют собой комбинацию названий исходных четырех атомных орбиталей. В нашем примере одна s-орбиталь объединяется с тремя p-орбиталями, образуя четыре sp 3 орбитали:
Рисунок 10.4 Когда орбитали объединяются в гибридные орбитали, их форма и энергия усредняются.
Как видно из этой диаграммы, гибридная орбитальная конфигурация углерода оставляет место для четырех ковалентных связей, что хорошо соответствует четырем атомам водорода, ковалентно связанным в метане.
Как мы упоминали в «Современном атоме», s-орбитали имеют сферическую форму, а p-орбитали расположены под углом 90 градусов друг к другу. В результате, sp3-орбитали, образующиеся при объединении одной s- и трех p-орбиталей, будут располагаться под углом, отражающим смесь этих двух типов орбиталей (в данном случае 109,5):
Количество гибридных орбиталей, которые образуются, когда ковалентные связи молекулы зависят от количества одинарных связей и пар несвязанных электронов (неподеленных пар или неподеленных электронных пар), которые присутствуют в молекуле. Электроны как в одинарных связях, так и в несвязанных парах существуют на гибридных орбиталях.
Электроны как в одинарных связях, так и в несвязанных парах существуют на гибридных орбиталях.
Электроны в кратных связях существуют внутри чего-то, называемого «?-орбиталью», которая образуется, когда негибридизированная p-орбиталь одного атома перекрывается с негибридизированной p-орбиталью другого атома. Давайте посмотрим, как это работает в кислороде, O 2 .
The Mole Says
Электроны несвязанных атомов расположены на s-, p-, d- и f-орбиталях. Электроны в атомах, образовавших ковалентные соединения, существуют на гибридных орбиталях.
Каждый атом кислорода в O 2 имеет две неподеленные пары электронов и двойную связь с другим атомом кислорода. Первая из двух связей между двумя атомами кислорода требует гибридных орбиталей (поскольку все одинарные связи требуют гибридных орбиталей), но вторая использует запасную p-орбиталь в обоих атомах. В результате одна s-орбиталь смешивается с двумя p-орбиталями, образуя три sp 2 орбитали.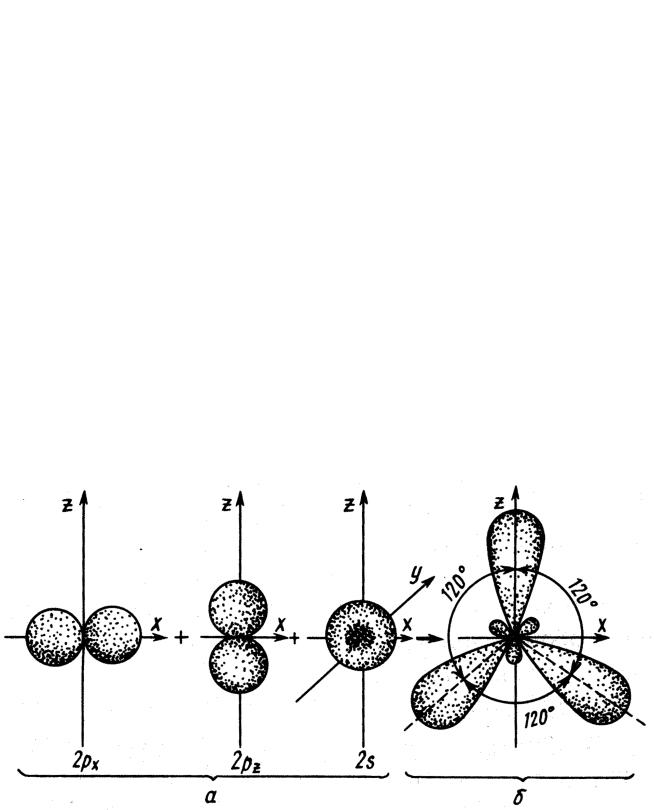
Давайте посмотрим, как выглядят орбитали каждого атома кислорода.
Рисунок 10.7 Три sp 2 орбитали, которые удерживают неподеленную пару электронов и электроны, разделенные одинарными связями, удаляются друг от друга как можно дальше под углом 120°. Р-орбитали каждого атома кислорода (не показаны) перекрываются, образуя двойную связь.
Три орбитали sp 2 расходятся друг от друга как можно дальше из-за отталкивания электронов. Р-орбитали, отвечающие за двойную связь, перекрываются как выше, так и ниже связи.
В следующей таблице показаны все типы гибридных орбиталей, обычно встречающихся в ковалентных соединениях, а также названия и валентные углы каждой орбитали и названия каждой молекулярной формы.
| Nonhybridized перекрывающихся орбиталей | Название Hybrid Orbital | Bond Angle | Молекулярная Форма |
|---|---|---|---|
| 1s, 1p | зр | 180 | линейный |
| 1s, 2p | зр 2 | 120 | треугольная планарная |
| 1с, 3п | сп 3 | 109. 5 5 | 5 Tetrahedral |
| 90 | октаэдрический |
Обычно одиночные ковалентные связи между двумя атомами называются «сигма-связями» или ? облигации. Эти сигма-связи создаются путем перекрытия двух гибридных орбиталей. Каждая кратная связь называется «пи-связью» или β-связью.Связи Pi создаются путем перекрывания негибридных p-орбиталей. Используя предыдущую таблицу, каждый атом в приведенном выше sp-гибридном атоме имеет два ? облигации и две ? облигации.
Выдержки из The Complete Idiot’s Guide to Chemistry 2003 Яна Гуча. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476.Вы также можете приобрести эту книгу на Amazon.com и в Barnes & Noble.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.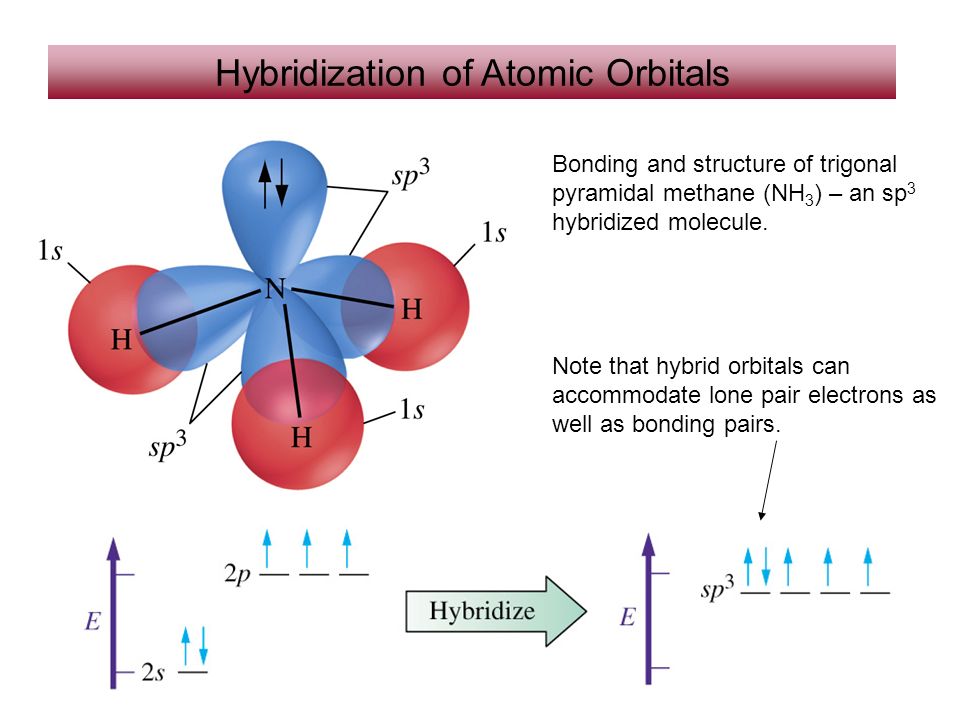
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Гибридные атомные орбитали – Химия
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Объясните концепцию гибридизации атомных орбит
- Определение гибридных орбиталей, связанных с различной молекулярной геометрией
Мышление в терминах перекрывающихся атомных орбиталей — это один из способов объяснить, как образуются химические связи в двухатомных молекулах.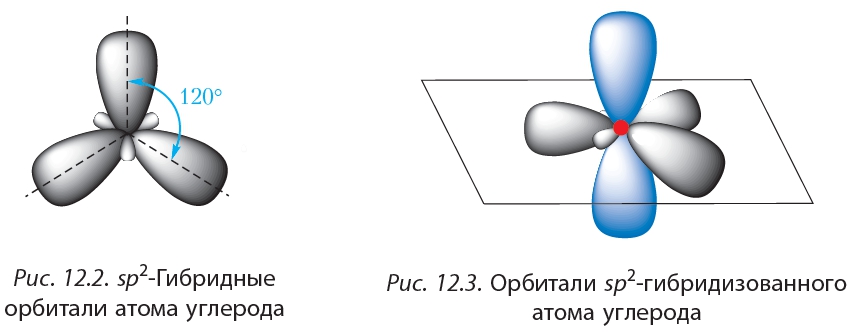 Однако, чтобы понять, как молекулы с более чем двумя атомами образуют стабильные связи, нам нужна более подробная модель. В качестве примера рассмотрим молекулу воды, в которой один атом кислорода связан с двумя атомами водорода. Кислород имеет электронную конфигурацию 1 s 2 2 s 2 2 p 4 с двумя неспаренными электронами (по одному на каждой из двух 2 p 90 орбиталей). Теория валентных связей предсказывает, что две связи O–H образуются в результате перекрытия этих двух орбиталей 2 p с орбиталями 1 s атомов водорода.Если бы это было так, валентный угол был бы равен 90°, как показано на [ссылка], потому что орбитали p перпендикулярны друг другу. Экспериментальные данные показывают, что валентный угол равен 104,5°, а не 90°. Предсказание модели теории валентной связи не соответствует реальным наблюдениям за молекулой воды; нужна другая модель.
Однако, чтобы понять, как молекулы с более чем двумя атомами образуют стабильные связи, нам нужна более подробная модель. В качестве примера рассмотрим молекулу воды, в которой один атом кислорода связан с двумя атомами водорода. Кислород имеет электронную конфигурацию 1 s 2 2 s 2 2 p 4 с двумя неспаренными электронами (по одному на каждой из двух 2 p 90 орбиталей). Теория валентных связей предсказывает, что две связи O–H образуются в результате перекрытия этих двух орбиталей 2 p с орбиталями 1 s атомов водорода.Если бы это было так, валентный угол был бы равен 90°, как показано на [ссылка], потому что орбитали p перпендикулярны друг другу. Экспериментальные данные показывают, что валентный угол равен 104,5°, а не 90°. Предсказание модели теории валентной связи не соответствует реальным наблюдениям за молекулой воды; нужна другая модель.
Квантово-механические расчеты показывают, почему наблюдаемые валентные углы в H 2 O отличаются от предсказанных на основе перекрытия 1 s орбиталей атомов водорода с 2 p орбиталей атома кислорода. Математическое выражение, известное как волновая функция, ψ , содержит информацию о каждой орбитали и о волновых свойствах электронов в изолированном атоме.Когда атомы связаны вместе в молекуле, волновые функции объединяются, чтобы произвести новые математические описания, которые имеют различные формы. Этот процесс комбинирования волновых функций для атомных орбиталей называется гибридизацией и математически осуществляется линейной комбинацией атомных орбиталей , LCAO (метод, с которым мы еще встретимся позже).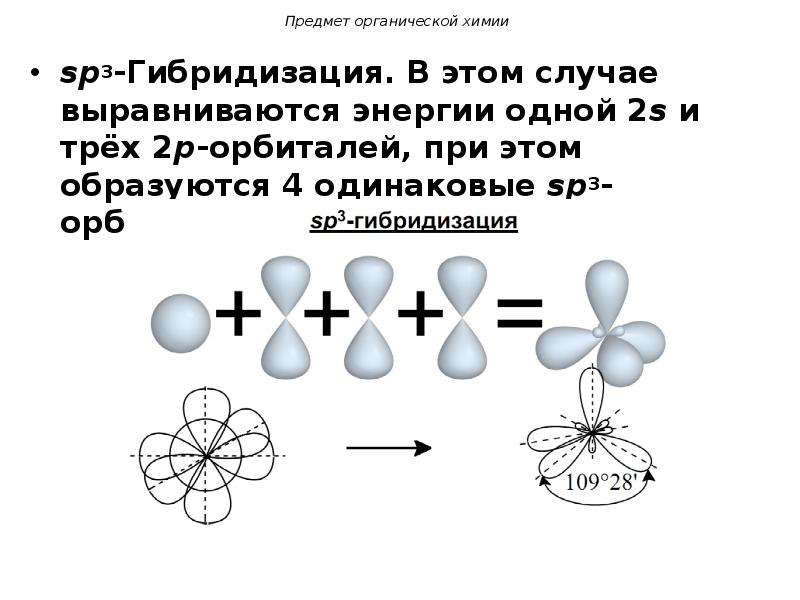 Образующиеся новые орбитали называются гибридными орбиталями. Валентные орбитали в изолированном атоме кислорода представляют собой орбиталь 2 s и три орбитали 2 p .Валентные орбитали атома кислорода в молекуле воды различаются; они состоят из четырех эквивалентных гибридных орбиталей, которые указывают примерно на углы тетраэдра ([ссылка]). Следовательно, перекрытие орбиталей O и H должно приводить к тетраэдрическому валентному углу (109,5 °). Наблюдаемый угол 104,5° является экспериментальным свидетельством, которому квантово-механические расчеты дают полезное объяснение: теория валентных связей должна включать компонент гибридизации, чтобы давать точные предсказания.
Образующиеся новые орбитали называются гибридными орбиталями. Валентные орбитали в изолированном атоме кислорода представляют собой орбиталь 2 s и три орбитали 2 p .Валентные орбитали атома кислорода в молекуле воды различаются; они состоят из четырех эквивалентных гибридных орбиталей, которые указывают примерно на углы тетраэдра ([ссылка]). Следовательно, перекрытие орбиталей O и H должно приводить к тетраэдрическому валентному углу (109,5 °). Наблюдаемый угол 104,5° является экспериментальным свидетельством, которому квантово-механические расчеты дают полезное объяснение: теория валентных связей должна включать компонент гибридизации, чтобы давать точные предсказания.
(a) Молекула воды имеет четыре области электронной плотности, поэтому теория VSEPR предсказывает тетраэдрическое расположение гибридных орбиталей.(б) Две гибридные орбитали кислорода содержат неподеленные пары, а две другие перекрываются с 1 s орбиталями атомов водорода, образуя связи O–H в H 2 O.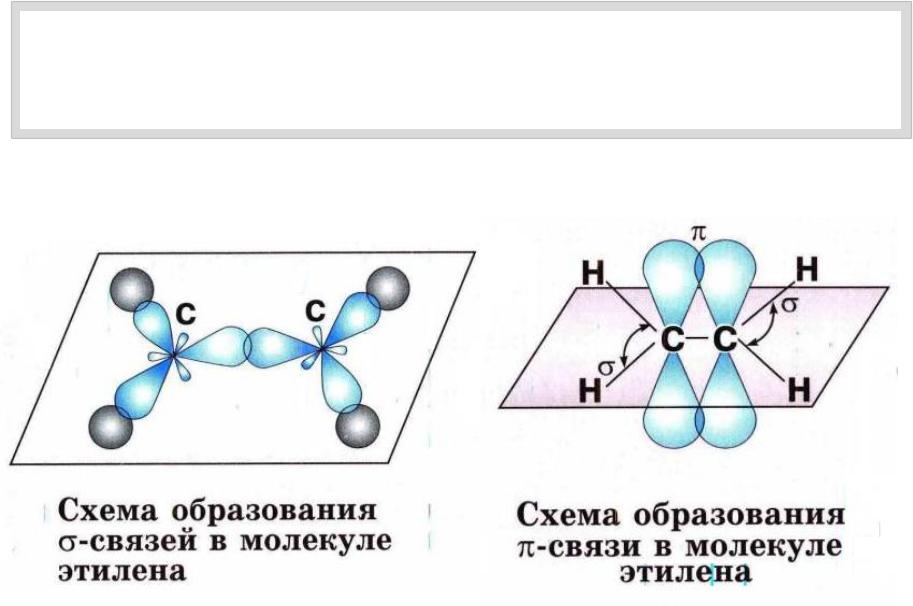 Это описание больше соответствует экспериментальная структура.
Это описание больше соответствует экспериментальная структура.
Следующие идеи важны для понимания гибридизации:
- Гибридные орбитали не существуют в изолированных атомах. Они образуются только в ковалентно связанных атомах.
- Гибридные орбитали имеют форму и ориентацию, которые сильно отличаются от атомных орбиталей в изолированных атомах.
- Набор гибридных орбиталей создается путем объединения атомных орбиталей. Количество гибридных орбиталей в наборе равно количеству атомных орбиталей, которые были объединены для создания набора.
- Все орбитали в наборе гибридных орбиталей эквивалентны по форме и энергии.
- Тип гибридных орбиталей, образующихся в связанном атоме, зависит от геометрии его электронной пары, как это предсказывает теория VSEPR.
- Гибридные орбитали перекрываются, образуя σ-связи. Негибридные орбитали перекрываются, образуя π-связи.
В следующих разделах мы обсудим распространенные типы гибридных орбиталей.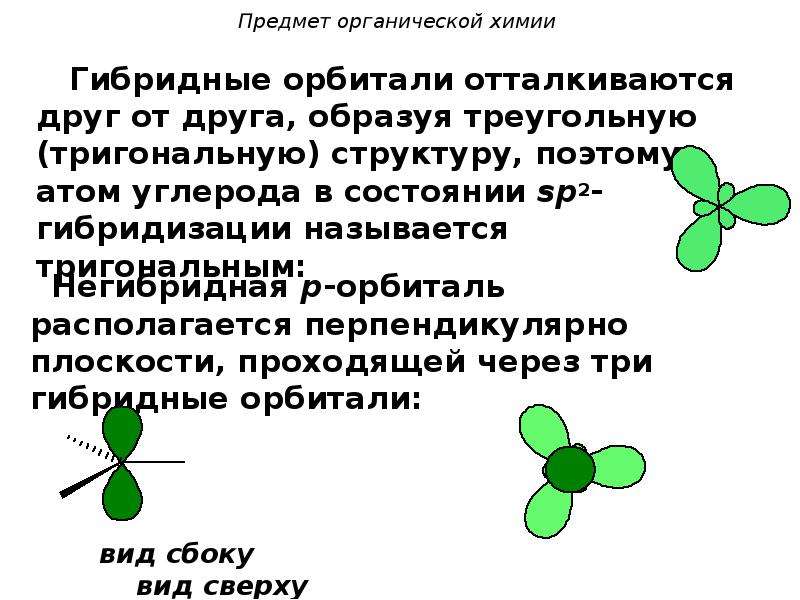
Атом бериллия в газообразной молекуле BeCl 2 является примером центрального атома без неподеленных пар электронов в линейном расположении трех атомов. В молекуле BeCl 2 имеются две области плотности валентных электронов, соответствующие двум ковалентным связям Be–Cl. Чтобы разместить эти два электронных домена, две из четырех валентных орбиталей атома Be будут смешиваться, образуя две гибридные орбитали.Этот процесс гибридизации включает смешивание валентной s орбитали с одной из валентных p орбиталей для получения двух эквивалентных sp гибридных орбиталей, ориентированных в линейной геометрии ([ссылка]). На этом рисунке набор орбиталей sp похож по форме на исходную орбиталь p , но есть важное отличие. Количество объединенных атомных орбиталей всегда равно количеству образовавшихся гибридных орбиталей. Орбиталь p — это одна орбиталь, которая может содержать до двух электронов.Набор sp представляет собой две эквивалентные орбитали, расположенные под углом 180° друг к другу. Два электрона, которые первоначально находились на орбитали s , теперь распределены по двум орбиталям sp , которые заполнены наполовину. В газообразном BeCl 2 эти полузаполненные гибридные орбитали будут перекрываться с орбиталями атомов хлора с образованием двух идентичных σ-связей.
Орбиталь p — это одна орбиталь, которая может содержать до двух электронов.Набор sp представляет собой две эквивалентные орбитали, расположенные под углом 180° друг к другу. Два электрона, которые первоначально находились на орбитали s , теперь распределены по двум орбиталям sp , которые заполнены наполовину. В газообразном BeCl 2 эти полузаполненные гибридные орбитали будут перекрываться с орбиталями атомов хлора с образованием двух идентичных σ-связей.
Гибридизация орбитали s (синяя) и орбитали p (красная) одного и того же атома дает две гибридные орбитали sp (желтая).Каждая гибридная орбиталь ориентирована преимущественно только в одном направлении. Обратите внимание, что каждая орбиталь sp содержит один лепесток, который значительно больше другого.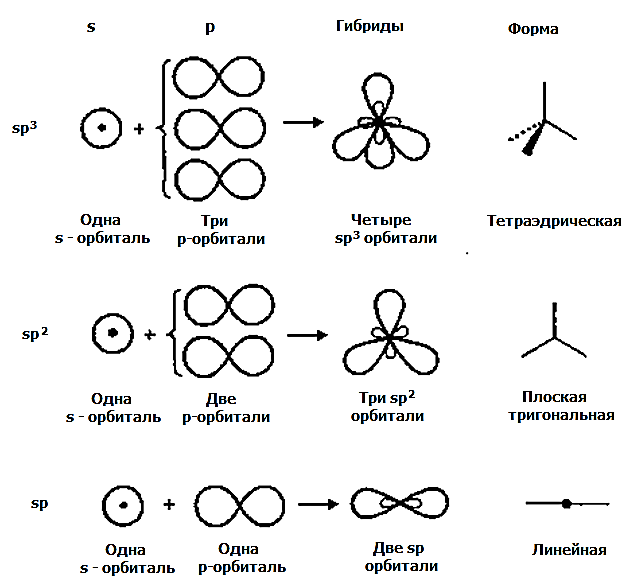 Набор из двух орбиталей sp ориентирован под углом 180°, что согласуется с геометрией для двух доменов.
Набор из двух орбиталей sp ориентирован под углом 180°, что согласуется с геометрией для двух доменов.
Мы иллюстрируем электронные различия в изолированном атоме Be и в связанном атоме Be на диаграмме орбитальных энергетических уровней в [ссылка]. На этих диаграммах каждая орбиталь представлена горизонтальной линией (указывающей ее энергию), а каждый электрон — стрелкой.Энергия увеличивается к верхней части диаграммы. Мы используем одну стрелку вверх, чтобы указать один электрон на орбитали, и две стрелки (вверх и вниз), чтобы указать два электрона с противоположным спином.
На этой диаграмме орбитальных энергетических уровней показаны гибридизованные орбитали sp на Be в линейной молекуле BeCl 2 . Каждая из двух гибридных орбиталей sp содержит один электрон и, таким образом, заполнена наполовину и доступна для связывания посредством перекрытия с орбиталью Cl 3 p .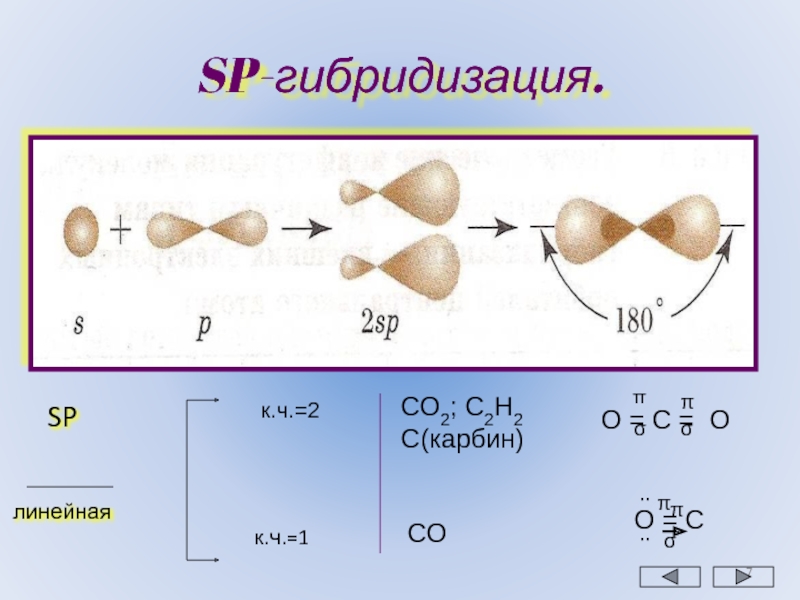
Когда атомные орбитали гибридизуются, валентные электроны занимают вновь созданные орбитали.Атом Be имел два валентных электрона, поэтому на каждую из sp -орбиталей приходится один из этих электронов. Каждый из этих электронов спаривается с неспаренным электроном атома хлора, когда гибридная орбиталь и орбиталь хлора перекрываются при образовании связей Be–Cl.
Любой центральный атом, окруженный всего двумя областями плотности валентных электронов в молекуле, будет демонстрировать sp гибридизацию. Другие примеры включают атом ртути в линейной молекуле HgCl 2 , атом цинка в Zn(CH 3 ) 2 , который содержит линейную структуру C–Zn–C, и атомы углерода в HCCH и CO 2 .
Посетите веб-сайт Университета Висконсин-Ошкош, чтобы узнать о визуализации гибридных орбиталей в трех измерениях.
Валентные орбитали центрального атома, окруженные тремя областями электронной плотности, состоят из набора из трех sp 2 гибридных орбиталей и одной негибридизированной p орбитали.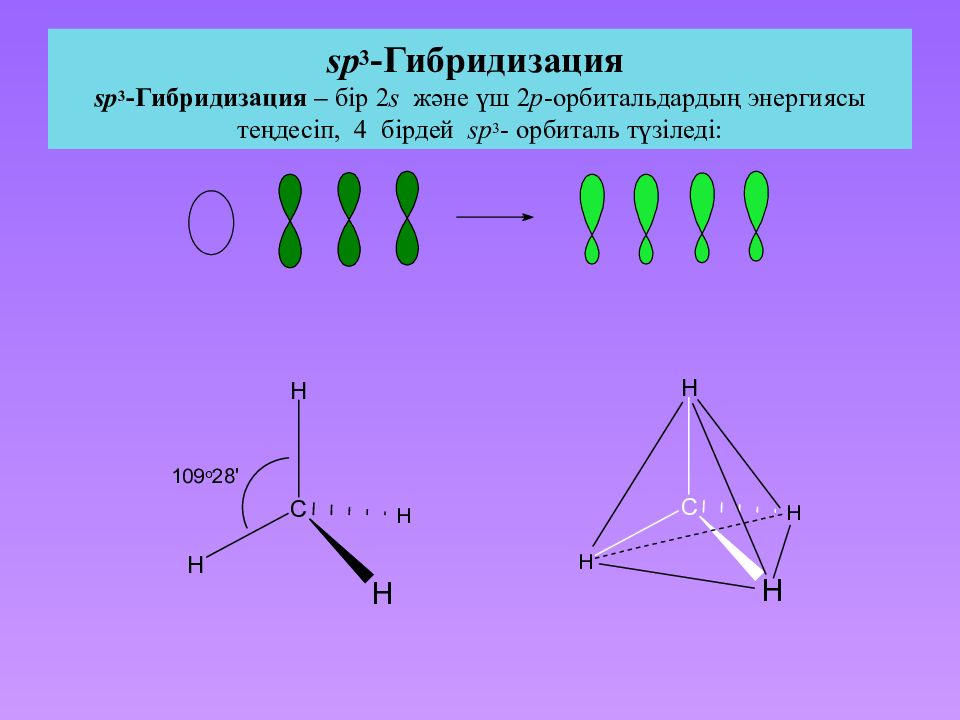 Такое расположение является результатом гибридизации sp 2 , смешивания одной орбитали s и двух орбиталей p для получения трех идентичных гибридных орбиталей, ориентированных в тригональной плоской геометрии ([ссылка]).
Такое расположение является результатом гибридизации sp 2 , смешивания одной орбитали s и двух орбиталей p для получения трех идентичных гибридных орбиталей, ориентированных в тригональной плоской геометрии ([ссылка]).
Гибридизация орбитали s (синяя) и двух орбиталей p (красная) дает три эквивалентные гибридные орбитали sp 2 (желтые), ориентированные под углом 120° друг к другу. Оставшаяся негибридизированная орбиталь p здесь не показана, а расположена вдоль оси z.
Хотя квантовая механика дает «пухлые» орбитальные лепестки, как показано на [ссылка], иногда для ясности эти орбитали рисуются тоньше и без второстепенных лепестков, как на [ссылка], чтобы не затенять другие особенности данной иллюстрации.Мы будем использовать эти «более тонкие» представления всякий раз, когда истинное представление слишком переполнено, чтобы его можно было легко визуализировать.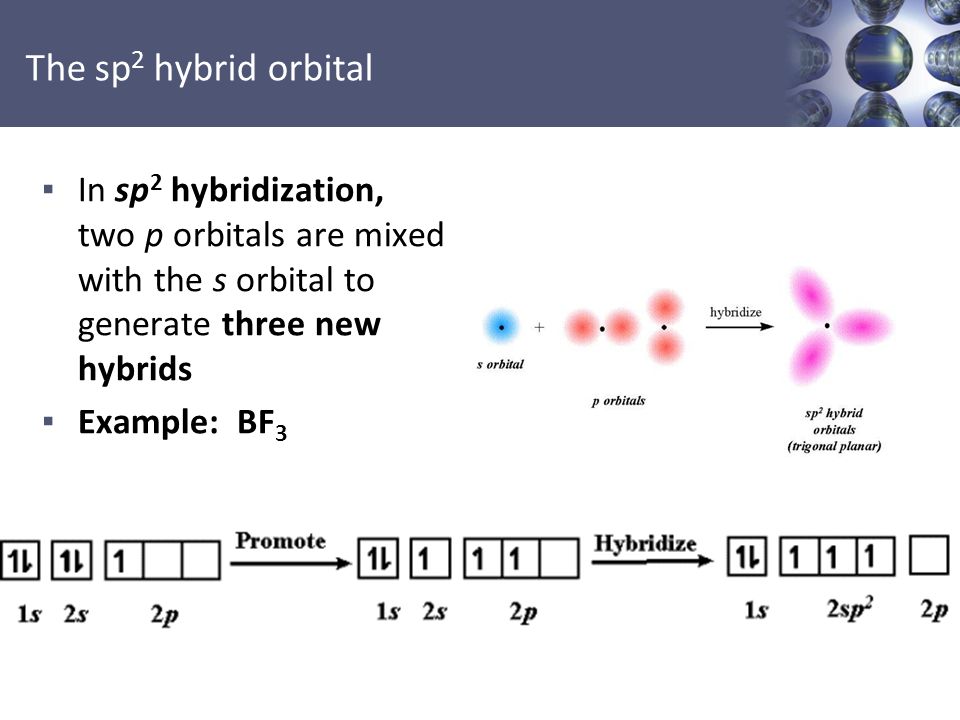
Этот альтернативный способ рисования тригональных плоских sp 2 гибридных орбиталей иногда используется в более скученных рисунках.
Наблюдаемая структура молекулы борана, BH 3, , предполагает sp 2 гибридизацию бора в этом соединении. Молекула тригонально-плоская, а атом бора участвует в трех связях с атомами водорода ([ссылка]).Мы можем проиллюстрировать сравнение орбиталей и распределения электронов в изолированном атоме бора и в связанном атоме в BH 3 , как показано на диаграмме орбитальных уровней энергии в [ссылка]. Мы перераспределяем три валентных электрона атома бора на трех гибридных орбиталях sp 2 , и каждый электрон бора соединяется с электроном водорода при образовании связи B–H.
BH 3 представляет собой электронодефицитную молекулу с тригонально-плоской структурой.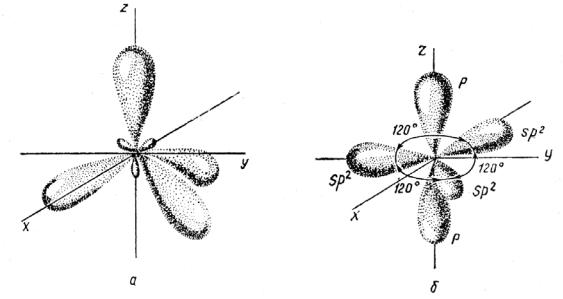
В изолированном атоме В имеется одна 2 s и три 2 p валентные орбитали.Когда бор находится в молекуле с тремя областями электронной плотности, три орбитали гибридизуются и создают набор из трех орбиталей sp 2 и одной негибридизированной орбитали 2 p . Каждая из трех полузаполненных гибридных орбиталей перекрывается с орбиталью атома водорода с образованием трех σ-связей в BH 3 .
Любой центральный атом, окруженный тремя областями электронной плотности, будет демонстрировать sp 2 гибридизацию. Сюда входят молекулы с неподеленной парой на центральном атоме, такие как ClNO ([ссылка]), или молекулы с двумя одинарными связями и двойной связью, соединенными с центральным атомом, как в формальдегиде, CH 2 O и этилене. H 2 CCH 2 .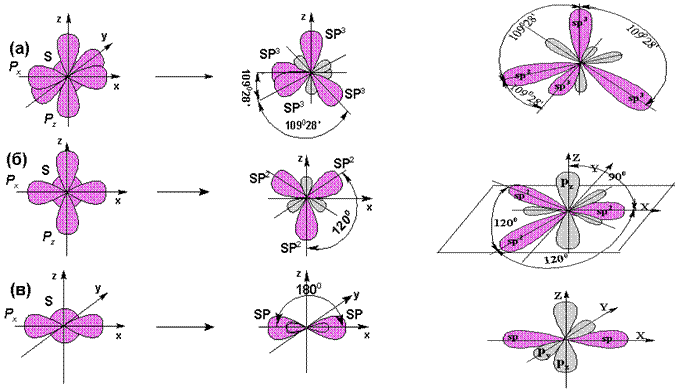
Центральный атом(ы) в каждой из показанных структур содержит три области электронной плотности и гибридизован. Как мы знаем из обсуждения теории VSEPR, область электронной плотности содержит все электроны, направленные в одном направлении. Неделящаяся пара, неспаренный электрон, одинарная связь или кратная связь будут считаться одной областью электронной плотности.
Валентные орбитали атома, окруженного тетраэдрическим расположением связывающих пар и неподеленных пар, состоят из набора четырех sp 3 гибридных орбиталей.Гибриды получаются в результате смешивания одной орбитали s и всех трех орбиталей p , что дает четыре идентичных гибридных орбитали sp 3 ([ссылка]). Каждая из этих гибридных орбиталей указывает на другой угол тетраэдра.
Гибридизация орбитали s (синяя) и трех орбиталей p (красная) дает четыре эквивалентных гибридных орбитали sp 3 (желтая), ориентированных под углом 109,5° друг к другу.
Молекула метана CH 4 состоит из атома углерода, окруженного четырьмя атомами водорода в углах тетраэдра. Атом углерода в метане проявляет sp 3 гибридизацию. Мы иллюстрируем орбитали и распределение электронов в изолированном атоме углерода и в связанном атоме в CH 4 в [ссылка]. Четыре валентных электрона атома углерода равномерно распределены по гибридным орбиталям, и каждый электрон углерода соединяется с электроном водорода при образовании связей С-Н.
Все четыре валентные атомные орбитали изолированного атома углерода гибридизуются, когда углерод связывается в молекуле типа CH 4 с четырьмя областями электронной плотности. Это создает четыре эквивалентных sp 3 гибридных орбиталей. Перекрытие каждой из гибридных орбиталей с водородной орбиталью создает σ-связь C–H.
В молекуле метана орбиталь 1 s каждого из четырех атомов водорода перекрывается с одной из четырех sp 3 орбиталей атома углерода, образуя сигма (σ) связь.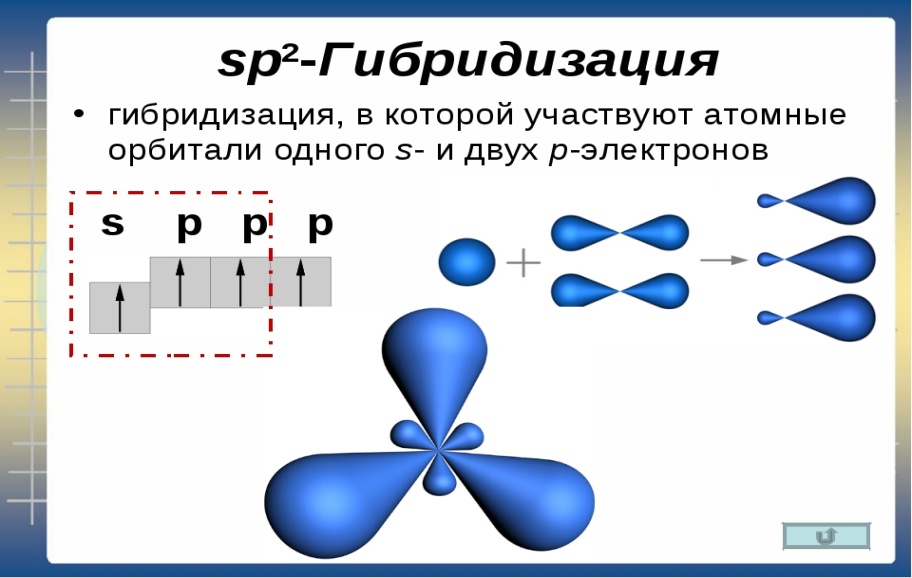 Это приводит к образованию четырех прочных эквивалентных ковалентных связей между атомом углерода и каждым из атомов водорода с образованием молекулы метана CH 4 .
Это приводит к образованию четырех прочных эквивалентных ковалентных связей между атомом углерода и каждым из атомов водорода с образованием молекулы метана CH 4 .
Структура этана, C 2 H 6, аналогична структуре метана в том, что каждый углерод в этане имеет четыре соседних атома, расположенных в углах тетраэдра — три атома водорода и один атом углерода ([ссылка] ). Однако в этане орбиталь sp 3 одного атома углерода перекрывается встык с орбиталью sp 3 второго атома углерода, образуя σ-связь между двумя атомами углерода.Каждая из оставшихся гибридных орбиталей sp 3 перекрывается с орбиталью s атома водорода с образованием σ-связей углерод-водород. Структура и общая схема связывающих орбиталей этана показаны в [ссылка]. Ориентация двух групп CH 3 не является фиксированной относительно друг друга.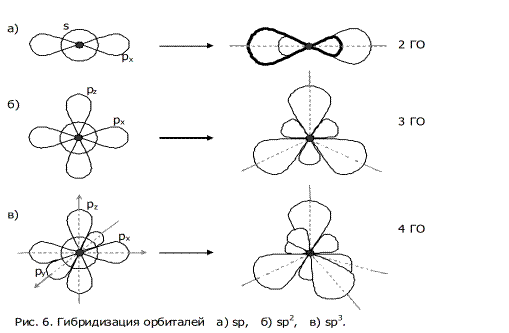 Экспериментальные данные показывают, что вращение вокруг σ-связей происходит легко.
Экспериментальные данные показывают, что вращение вокруг σ-связей происходит легко.
(a) В молекуле этана C 2 H 6 каждый углерод имеет четыре sp 3 орбитали.(b) Эти четыре орбитали перекрываются, образуя семь σ-связей.
Гибридная орбиталь sp 3 также может содержать неподеленную пару электронов. Например, атом азота в аммиаке окружен тремя парами связи и неподеленной парой электронов, направленных к четырем углам тетраэдра. Атом азота sp 3 гибридизован с одной гибридной орбиталью, занятой неподеленной парой.
Молекулярная структура воды соответствует тетраэдрическому расположению двух неподеленных пар и двух связывающих пар электронов.Таким образом, мы говорим, что атом кислорода sp 3 гибридизован, причем две гибридные орбитали заняты неподеленными парами, а две — связывающими парами. Поскольку неподеленные пары занимают больше места, чем связывающие пары, структуры, содержащие неподеленные пары, имеют валентные углы, слегка отличающиеся от идеальных. Совершенные тетраэдры имеют углы 109,5°, но наблюдаемые углы в аммиаке (107,3°) и воде (104,5°) немного меньше. Другие примеры гибридизации sp 3 включают CCl 4 , PCl 3 и NCl 3 .
Для описания пяти связывающих орбиталей в тригонально-бипирамидальном расположении мы должны использовать пять атомных орбиталей валентной оболочки (орбиталь s , три орбитали p и одну из орбиталей d ), что дает пять sp 3 d гибридные орбитали. При октаэдрическом расположении шести гибридных орбиталей мы должны использовать шесть атомных орбиталей валентной оболочки (орбиталь s , три орбитали p и две орбитали d в ее валентной оболочке), что дает шесть sp 3 d 2 гибридные орбитали.Эти гибридизации возможны только для атомов, имеющих d орбиталей в своих валентных подоболочках (то есть не находящихся в первом или втором периоде).
В молекуле пентахлорида фосфора PCl 5 имеется пять связей P–Cl (таким образом, пять пар валентных электронов вокруг атома фосфора), направленных к углам тригональной бипирамиды. Мы используем орбиталь 3 s , три орбитали 3 p и одну из орбиталей 3 d , чтобы сформировать набор из пяти гибридных орбиталей sp 3 d ([ссылка]), которые участвует в связях P–Cl.{\ text {+}} \) имеют одну неподеленную пару электронов на центральном атоме, а ClF 3 имеет две неподеленные пары, что придает ему показанную Т-образную форму.
(a) Пять областей электронной плотности вокруг фосфора в PCl 5 требуют пяти гибридных sp 3 d орбиталей. (b) Эти орбитали объединяются, образуя тригональную бипирамидальную структуру, где каждая большая доля гибридной орбитали указывает на вершину. Как и прежде, для каждой орбитали также имеются небольшие лепестки, направленные в противоположном направлении (не показаны для ясности).
Атом серы в гексафториде серы, SF 6 , проявляет sp 3 d 2 гибридизацию. Молекула гексафторида серы имеет шесть связывающих пар электронов, соединяющих шесть атомов фтора с одним атомом серы. На центральном атоме нет неподеленных пар электронов. Чтобы связать шесть атомов фтора, орбиталь 3 s , три орбитали 3 p и две из 3 d орбиталей образуют шесть эквивалентных sp 3 d 2 9004 к другому углу октаэдра.{\text{−}}\) и атом ксенона в XeF 4 .
(a) Гексафторид серы, SF 6 , имеет октаэдрическую структуру, требующую гибридизации sp 3 d 2 . (b) Шесть орбиталей sp 3 d 2 образуют октаэдрическую структуру вокруг серы. Опять же, малая доля каждой орбитали не показана для ясности.
Гибридизация атома определяется на основе количества областей электронной плотности, которые его окружают.Геометрические характеристики различных наборов гибридных орбиталей показаны в [ссылка]. Это расположение идентично геометрии электронной пары, предсказанной теорией VSEPR. Теория VSEPR предсказывает формы молекул, а теория гибридных орбиталей дает объяснение того, как формируются эти формы. Чтобы найти гибридизацию центрального атома, мы можем использовать следующие рекомендации:
- Определите структуру молекулы по Льюису.
- Определите количество областей электронной плотности вокруг атома, используя теорию VSEPR, в которой одинарные связи, кратные связи, радикалы и неподеленные пары считаются за одну область.
- Назначьте набор гибридных орбиталей из [ссылка], который соответствует этой геометрии.
Формы гибридных орбитальных наборов согласуются с геометрией электронной пары. Например, атом, окруженный тремя областями электронной плотности, sp 2 гибридизован, а три sp 2 орбитали расположены тригонально-плоскостно.
Важно помнить, что гибридизация была разработана для рационализации экспериментально наблюдаемой молекулярной геометрии.Модель хорошо работает для молекул, содержащих небольшие центральные атомы, в которых пары валентных электронов расположены близко друг к другу в пространстве. Однако для более крупных центральных атомов пары электронов валентная оболочка находятся дальше от ядра, и отталкивания меньше. Их соединения демонстрируют структуры, которые часто не согласуются с теорией VSEPR, и гибридные орбитали не нужны для объяснения наблюдаемых данных. Например, мы обсуждали валентный угол H–O–H в H 2 O, 104,5°, который больше соответствует гибридным орбиталям sp 3 (109.5°) на центральном атоме, чем с 2 p орбиталей (90°). Сера находится в той же группе, что и кислород, и H 2 S имеет аналогичную структуру Льюиса. Однако он имеет гораздо меньший валентный угол (92,1 °), что указывает на гораздо меньшую гибридизацию с серой, чем с кислородом. Продолжая движение вниз по группе, теллур даже больше, чем сера, а для H 2 Te наблюдаемый валентный угол (90 °) согласуется с перекрытием орбиталей 5 p без использования гибридизации. Мы используем гибридизацию там, где необходимо объяснить наблюдаемые структуры.{\текст{2−}}?\)
Решение
Структура Льюиса сульфата показывает, что существуют четыре области электронной плотности. Гибридизация sp 3 .
Проверьте свои знания
Что представляет собой гибридизация атома селена в SeF 4 ?
Ответ:
Атом селена sp 3 d гибридизован.
Назначение гибридизации
Мочевина, NH 2 C(O)NH 2 , иногда используется в качестве источника азота в удобрениях.Какова гибридизация каждого атома азота и углерода в мочевине?
Решение
Структура Льюиса мочевины
Атомы азота окружены четырьмя областями электронной плотности, которые образуют тетраэдрическую геометрию электронной пары. Гибридизация в тетраэдрическом расположении: sp 3 ([ссылка]). Это гибридизация атомов азота в мочевине.
Атом углерода окружен тремя областями электронной плотности, расположенными в тригональной плоскости.Гибридизация в тригональной плоской электронной паре sp 2 ([ссылка]), что является гибридизацией атома углерода в мочевине.
Check Your Learning
Уксусная кислота, H 3 CC(O)OH — это молекула, которая придает уксусу его запах и кислый вкус. Что такое гибридизация двух атомов углерода в уксусной кислоте?
Ответ:
H 3 C , sp 3 ; C (O)OH, sp 2
Мы можем использовать гибридные орбитали, представляющие собой математические комбинации некоторых или всех валентных атомных орбиталей, для описания электронной плотности вокруг ковалентно связанных атомов.Эти гибридные орбитали либо образуют сигма (σ) связи, направленные к другим атомам молекулы, либо содержат неподеленные пары электронов. Мы можем определить тип гибридизации вокруг центрального атома по геометрии областей электронной плотности вокруг него. Два таких участка означают гибридизацию sp ; три, sp 2 гибридизация; четыре, sp 3 гибридизация; пять, sp 3 d гибридизация; и шесть, sp 3 d 2 гибридизация.Связи Pi(π) образуются из негибридизованных атомных орбиталей ( p или d орбиталей).
Почему концепция гибридизации необходима в теории валентных связей?
Гибридизация введена для объяснения геометрии связывающих орбиталей в теории валентных связей.
Укажите форму, описывающую каждый набор гибридных орбит:
(а) сп 2
(б) сп 3 д
(в) сп
(г) сп 3 г 2
Объясните, почему атом углерода не может образовать пять связей, используя sp 3 d гибридные орбитали.{\ текст {3−}} \)
(г) ПКл 5
Молекула с формулой AB 3 может иметь одну из четырех различных форм. Укажите форму и гибридизацию центрального атома А для каждого из них.
треугольный плоский, sp 2 ; треугольная пирамидальная (одна неподеленная пара на А) sp 3 ; Т-образные (две одиночные пары на A sp 3 d или (три одиночные пары на A) sp 3 d 2
Метионин, CH 3 SCH 2 CH 2 CH(NH 2 )CO 2 H, аминокислота, содержащаяся в белках.Нарисуйте структуру Льюиса этого соединения. Каков тип гибридизации каждого углерода, кислорода, азота и серы?
Серная кислота производится с помощью ряда реакций, представленных следующими уравнениями:
\({\text{S}}_{8}\left(s\right)+8{\text{O}}_{2}\left(g\right)\phantom{\rule{0.2em} {0ex}}⟶\phantom{\rule{0.2em}{0ex}}8{\text{SO}}_{2}\left(g\right)\)
\(2\text{S}{\text{O}}_{2}\left(g\right)+{\text{O}}_{2}\left(g\right)\phantom{\ правило{0.2em}{0ex}}⟶\phantom{\rule{0.2em}{0ex}}2{\text{SO}}_{3}\left(g\right)\)
\({\text{SO}}_{3}\left(g\right)+{\text{H}}_{2}\text{O}\left(l\right)\phantom{\rule {0.2em}{0ex}}⟶\phantom{\rule{0.2em}{0ex}}{\text{H}}_{2}{\text{SO}}_{4}\left(l\right )\)
Нарисуйте структуру Льюиса, предскажите молекулярную геометрию с помощью VSEPR и определите гибридизацию серы для следующего:
(a) круговой S 8 молекула
(б) SO 2 молекула
(c) SO 3 молекула
(d) H 2 SO 4 молекула (атомы водорода связаны с атомами кислорода)
(a) Каждый S имеет изогнутую (109°) геометрию, sp 3
(b) Изогнутый (120°), sp 2
(c) Тригональная планарная, sp 2
(d) Тетраэдрический, sp 3
Два важных промышленных химиката, этен, C 2 H 4 , и пропен, C 3 H 6 , производятся в процессе парового (или термического) крекинга:
\(2{\text{C}}_{3}{\text{H}}_{8}\left(g\right)\phantom{\rule{0.2em}{0ex}}⟶\phantom{\rule{0.2em}{0ex}}{\text{C}}_{2}{\text{H}}_{4}\left(g\right)+ {\ text {C}} _ {3} {\ text {H}} _ {6} \ влево (г \ вправо) + {\ текст {CH}} _ {4} \ влево (г \ вправо) + { \text{H}}_{2}\left(g\right)\)
Для каждого из четырех соединений углерода сделайте следующее:
(a) Нарисуйте структуру Льюиса.
(b) Предскажите геометрию относительно атома углерода.
(c) Определите гибридизацию каждого типа атома углерода.
В течение многих лет после их открытия считалось, что инертные газы не могут образовывать соединения.Теперь мы знаем, что это убеждение ошибочно. Было обнаружено, что смесь газов ксенона и фтора, заключенная в кварцевую колбу и помещенная на подоконник, медленно производит белое твердое вещество. Анализ соединения показывает, что оно содержит 77,55% Xe и 22,45% F по массе.
(а) Какова формула соединения?
(б) Напишите структуру соединения по Льюису.
(c) Предскажите форму молекул соединения.
(d) Какая гибридизация соответствует предсказанной вами форме?
(а) XeF 2
(б)
(в) линейный (г) сп 3 г
Рассмотрим азотистую кислоту, HNO 2 (HONO).
(a) Напишите структуру Льюиса.
(b) Какова электронная пара и молекулярная геометрия внутренних атомов кислорода и азота в молекуле HNO 2 ?
(c) Какова гибридизация внутренних атомов кислорода и азота в HNO 2 ?
СпичкиStrike Anywhere содержат слой KClO 3 и слой P 4 S 3 . Тепло, выделяемое трением при зажигании спички, вызывает бурную реакцию этих двух соединений, которая поджигает деревянный стержень спички.{–}\) ион.
(а)
(б) атомы Р, тригонально-пирамидальные; Атомы S, изогнутые, с двумя неподеленными парами; Атомы Cl, тригонально-пирамидальные; (c) Гибридизация по P, S и Cl во всех случаях sp 3 ; (г) Степени окисления P +1, S\(-1\frac{1}{3},\) Cl +5, O –2. Официальные сборы: P 0; С 0; Cl +2: O –1
Определите гибридизацию каждого атома углерода в следующей молекуле. (Дано расположение атомов; нужно определить, сколько связей соединяет каждую пару атомов.)
Напишите структуры Льюиса для NF 3 и PF 5 . На основе гибридных орбиталей объясните тот факт, что NF 3 , PF 3 и PF 5 являются стабильными молекулами, а NF 5 не существует.
Фосфор и азот могут образовывать гибриды sp 3 с образованием трех связей и удержанием одной неподеленной пары в PF 3 и NF 3 соответственно. Однако азот не имеет валентных d орбиталей, поэтому он не может образовать набор гибридных орбиталей sp 3 d для связывания пяти атомов фтора в NF 5 .Фосфор имеет d орбиталей и может связывать пять атомов фтора с sp 3 d гибридными орбиталями в PF 5 .
Кроме NF 3 известны два других фторпроизводных азота: N 2 F 4 и N 2 F 2 . Какую форму вы предсказываете для этих двух молекул? Какова гибридизация азота в каждой молекуле?
Сноски
- 1 Обратите внимание, что орбитали иногда могут быть нарисованы в виде вытянутого «воздушного шара», а не в более реалистичной «пухлой» форме, чтобы упростить визуализацию геометрии.
Глоссарий
- гибридный орбитальный Орбиталь
- , созданная путем объединения атомных орбиталей на центральном атоме .
- гибридизация Модель
- , которая описывает изменения атомных орбиталей атома, когда он образует ковалентное соединение
- sp гибридный орбитальный
- одна из двух орбиталей с линейным расположением, полученная в результате объединения одной орбитали s и одной орбитали p
- sp 2 гибридный орбитальный
- одна из трех орбиталей с тригональной планарной компоновкой, которая является результатом объединения одной s и двух p орбиталей
- sp 3 гибридный орбитальный
- одна из четырех орбиталей с тетраэдрическим расположением, полученная в результате объединения одной s и трех p орбиталей
- sp 3 d гибридный орбитальный
- одна из пяти орбиталей с тригонально-бипирамидальным расположением, полученная в результате объединения одной s , трех p и одной d орбитали
- sp 3 d 2 гибридный орбитальный
- одна из шести орбиталей с октаэдрическим расположением, образующихся в результате объединения одной s , трех p и двух d орбиталей
Разница между чистыми и гибридными орбиталами
Автор: Madhu
Ключевое различие между чистыми и гибридными орбиталями заключается в том, что чистых орбиталей являются исходными атомными орбиталями, тогда как гибридные орбитали образуются в результате смешения двух или более атомных орбиталей.
При образовании химической связи простых молекул мы можем просто учитывать перекрытие атомных орбиталей. Но если мы собираемся обсуждать химическую связь в сложных молекулах, нам нужно знать, что такое орбитальная гибридизация. Орбитальная гибридизация — это химическая концепция, описывающая смешение атомных орбиталей с образованием новых гибридных орбиталей. Эти орбитали участвуют в образовании ковалентных химических связей.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2.Что такое чистые орбитали
3. Что такое гибридные орбитали
4. Сравнение бок о бок – чистые и гибридные орбитали в табличной форме
5. Резюме
Что такое чистые орбитали?
Чистые орбитали — это атомные орбитали, содержащие электроны атома. Эти орбитали не являются смешанными орбиталями, как гибридные орбитали. Орбиталь дает наиболее вероятное расположение электронов в атоме, поскольку электроны находятся в непрерывном движении вокруг атомного ядра. Вместо фиксированного местоположения это дает область, в которой электрон может появиться в определенное время.
Чистые атомные орбитали существуют в нескольких формах, таких как сферическая форма, форма гантели. Согласно квантовой механике, существует набор квантовых чисел, которые мы используем для обозначения орбитали. Этот набор чисел включает n (главное квантовое число), l (квантовое число углового момента), m (магнитное квантовое число) и s (квантовое число вращения). Каждая орбиталь занимает максимум два электрона. В соответствии с квантовым числом углового момента существует четыре широко известных атомных орбитали: s-орбиталь (сферическая форма), p-орбиталь (гантелеобразная), d-орбиталь (две гантели в одной плоскости) и f-орбиталь (сложная структура).
Что такое гибридные орбитали?
Гибридные орбитали — это молекулярные орбитали, которые образуются в результате смешения атомных орбиталей. Это гипотетические орбитали. Смешение происходит между атомными орбиталями одного и того же атома. это смешение происходит для того, чтобы образовать ковалентную химическую связь с другим атомом. Процесс такого смешения называется «гибридизацией орбит», в результате которой образуются гибридные орбитали. Мы называем эти орбитали в соответствии с атомными орбиталями, которые подвергаются гибридизации.
Рисунок 01: Гибридизация sp3
Соответственно, тремя основными формами гибридных орбиталей являются:
Гибридная орбиталь- sp – образуется в результате гибридизации атомных орбиталей s и p.Следовательно, полученная гибридная орбиталь имеет 50% характеристик s и 50% характеристик p-орбитали. Эта гибридная орбиталь имеет линейное пространственное расположение.
- sp 2 гибридная орбиталь – образуется в результате гибридизации одной s и двух p орбиталей. Следовательно, полученная гибридная орбиталь имеет 33% s-орбитальных характеристик и 66% p-орбитальных характеристик. Пространственное расположение тригонально-плоскостное.
- sp 3 гибридная орбиталь – образуется в результате гибридизации одной s и трех p орбиталей.Следовательно, полученная гибридная орбиталь имеет 25% характеристик s и 75% характеристик p. Пространственное расположение этих гибридных орбиталей тетраэдрическое.
В чем разница между чистыми и гибридными орбитами?
Чистые орбитали — это атомные орбитали, содержащие электроны атома, тогда как гибридные орбитали — это молекулярные орбитали, которые образуются в результате смешения атомных орбиталей. В этом ключевое различие между чистыми и гибридными орбиталями. Кроме того, гибридные орбитали образуются посредством орбитальной гибридизации, но чистые орбитали не гибридизуются.Более того, образование гибридных орбиталей важно при образовании сложных химических соединений посредством образования ковалентных химических связей. При рассмотрении номенклатуры орбиталей мы называем чистые орбитали s-, p-, d- и f-орбиталями, а гибридные орбитали — sp, sp 2 , sp 3 и т. д.
.Приведенная ниже инфографика сводит в таблицу разницу между чистыми и гибридными орбиталями для быстрого ознакомления.
Резюме
— Чистые и гибридные орбитальные устройства
Атомные орбитали — это области, в которых электроны существуют в атомах.В этой статье мы описали два типа орбиталей: чистые и гибридные. Ключевое различие между чистыми и гибридными орбиталями заключается в том, что чистые орбитали являются исходными атомными орбиталями, тогда как гибридные орбитали образуются в результате смешивания двух или более атомных орбиталей.
Артикул:
1. Либретексты. «Гибридные орбиты». Chemistry LibreTexts, Libretexts, 21 июля 2016 г. Доступно здесь
.Изображение предоставлено:
1. «AE4h» Автор Jfmelero — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
Разница между гибридными орбиталями и молекулярными орбиталями
Главное отличие — гибридные орбитали против молекулярных орбиталей
Орбитали — это гипотетические структуры, которые могут быть заполнены электронами.Согласно разным открытиям, ученые предлагали разные формы этих орбиталей. Существует три основных типа орбиталей: атомные орбитали, молекулярные орбитали и гибридные орбитали. Атомные орбитали — это гипотетические орбитали, расположенные вокруг ядра атома. Молекулярные орбитали — это гипотетические орбитали, образованные, когда два атома образуют ковалентную связь между собой. Гибридные орбитали — это гипотетические орбитали, которые образуются в результате гибридизации атомных орбиталей. Основное различие между гибридными орбиталями и молекулярными орбиталями состоит в том, что гибридных орбиталей образуются в результате взаимодействия атомных орбиталей одного и того же атома, а молекулярные орбитали образуются в результате взаимодействия атомных орбиталей двух разных атомов.
Ключевые области охвата
1. Что таковы гибридные орбитали
— образование, формы и свойства
2. Что такое молекулярные орбитали
— образование, формы и свойства
3. Каковы сходства между гибридными орбиталами и молекулярными орбиталями
– Обзор общих черт
4. В чем разница между гибридными и молекулярными орбиталами
– Сравнение основных различий
Ключевые термины: антисвязывающая молекулярная орбиталь, атомная орбиталь, связующая молекулярная орбиталь, гибридизация, гибридная орбиталь, молекулярная орбиталь
Что такое гибридные орбитальные станции
Гибридные орбитали — это гипотетические орбитали, образованные в результате смешивания атомных орбиталей в одном и том же атоме для образования ковалентной связи.Другими словами, атомные орбитали атома подвергаются гибридизации с образованием подходящих орбиталей для химической связи. Атомные орбитали бывают s-орбитальными, p-орбитальными, d-орбитальными и f-орбитальными. Гибридизация двух или более орбиталей образует новую гибридную орбиталь. Гибридные орбитали названы в соответствии с атомными орбиталями, которые подвергаются гибридизации. Некоторые примеры приведены ниже.
sp Гибридный орбитальный
Эти орбитали образуются при смешении одной s-орбитали и одной p-орбитали. Полученные гибридные орбитали имеют 50% характеристик s и 50% характеристик p.Пространственное расположение sp-орбиталей линейно. Следовательно, валентный угол между этими орбиталями равен 180 o °С. Атомы, подвергшиеся sp-гибридизации, имеют 2 пустые p-орбитали.
sp
2 Гибридный орбитальныйЭти орбитали образуются при гибридизации одной s-орбитали и двух p-орбиталей. Полученные гибридные орбитали имеют около 33% s-символов и около 66% p-символов. Пространственное расположение этих орбиталей тригонально-плоское. Следовательно, валентный угол между этими орбиталями равен 120 o °С.Атомы, которые подвергаются этой гибридизации, имеют 1 пустую р-орбиталь.
sp
3 ОрбитальныйЭти орбитали образуются при гибридизации одной s-орбитали и 3-х p-орбиталей. Полученные гибридные орбитали имеют около 25% s-символов и около 75% p-символов. Пространственное расположение этих орбиталей тетраэдрическое. Следовательно, валентный угол между этими орбиталями равен 109,5 o °С. Атомы, подвергшиеся такой гибридизации, не имеют пустых p-орбиталей.
sp
3 d 1 ОрбитальныйЭти орбитали образуются при гибридизации одной s-орбитали, 3 p-орбиталей и одной d-орбитали.Пространственное расположение этих орбиталей тригонально-плоское. Атомы, которые подвергаются этой гибридизации, имеют 4 пустых d-орбитали.
Рисунок 1: sp 3 гибридизация молекулы H 2 O
На изображении выше показана гибридизация атомных орбиталей молекулы кислорода с образованием двух ковалентных связей с двумя атомами водорода.
Что такое молекулярные орбитали
Молекулярные орбитали — это гипотетические орбитали, которые образуются в результате смешения (перекрытия) атомных орбиталей разных атомов.Это происходит, когда ковалентная связь образуется между двумя атомами. Например, если ковалентная связь образуется между атомами А и В, атомные орбитали, имеющие правильную симметрию, будут смешиваться, образуя молекулярную орбиталь. Следовательно, молекулярные орбитали — это области, в которых большая часть связывающих электронов находится между двумя атомами. Молекулярные орбитали могут быть двух типов: связывающие орбитали и разрыхляющие орбитали.
Связывание молекулярных орбиталей
Эти орбитали имеют меньшую энергию по сравнению с атомными орбиталями, которые претерпевают формирование молекулярной орбитали.Следовательно, эти орбитали стабильны. Пара электронов связи может быть найдена на этой орбитали.
Разрыхляющие молекулярные орбитали
Эти орбитали имеют более высокую энергию, чем атомные орбитали и связывающие молекулярные орбитали. Поэтому они менее стабильны. В большинстве случаев эти орбитали пусты.
Рисунок 2: Молекулярно-орбитальная диаграмма молекулы O 2
На изображении выше показана молекулярная орбитальная диаграмма двухатомного кислорода. Символ «σ» указывает на сигма-связывающую молекулярную орбиталь, а «σ*» указывает на разрыхляющую орбиталь.
Сходства между гибридными орбиталями и молекулярными орбиталями
- Гибридные орбитали и молекулярные орбитали образуются в результате смешения атомных орбиталей.
- Оба типа орбиталей показывают наиболее вероятное расположение электронной пары связи.
Разница между гибридными орбиталями и молекулярными орбиталями
Определение
Гибридные орбитали: Гибридные орбитали — это гипотетические орбитали, образованные в результате смешения атомных орбиталей в одном и том же атоме для образования ковалентной связи.
Молекулярные орбитали: Молекулярные орбитали — это гипотетические орбитали, которые образуются в результате смешения (перекрытия) атомных орбиталей разных атомов.
атомов
Гибридные орбитали: Гибридные орбитали образуются в одном и том же атоме.
Молекулярные орбитали: Молекулярные орбитали образуются между двумя атомами.
Антиадгезионный орбитальный
Гибридные орбитали: Гибридные орбитали не дают информации об антисвязывающих орбиталях.
Молекулярные орбитали: Молекулярные орбитали дают информацию об антисвязывающих орбиталях.
Заключение
И гибридные орбитали, и молекулярные орбитали являются гипотетическими орбиталями, которые показывают наиболее вероятное расположение электронов в атомах или между атомами. Они очень важны для предсказания формы молекулы. Основное различие между гибридными орбиталями и молекулярными орбиталями заключается в том, что гибридные орбитали образуются в результате взаимодействия атомных орбиталей в одном и том же атоме, а молекулярные орбитали образуются в результате взаимодействия атомных орбиталей двух разных атомов.
Каталожные номера:
1. Либретексты. «Гибридные орбиты». Химия LibreTexts. Libretexts, 21 июля 2016 г. Интернет. Доступно здесь. 14 августа 2017 г.
2. Либретексты. «Как построить молекулярные орбитали». Химия LibreTexts. Libretexts, 21 июля 2016 г. Интернет. Доступно здесь. 14 августа 2017 г.
Изображение предоставлено:
1. «Sp3-гибридизация h3O» Холмескаллас — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
2. «Диаграмма орбиталей молекул кислорода» Энтони. Себастьян — (CC BY-SA 3.0) через Commons Wikimedia
Гибридизация атомных орбиталей: гибридизация sp, sp2 и sp3 | Химия
10.6: Гибридизация атомных орбиталей I
Математическое выражение, известное как волновая функция ψ , содержит информацию о каждой орбитали и о волновых свойствах электронов в изолированном атоме. Когда атомы связаны вместе в молекуле, волновые функции объединяются, чтобы произвести новые математические описания, которые имеют различные формы.Этот процесс комбинирования волновых функций для атомных орбиталей называется гибридизацией и математически осуществляется линейной комбинацией атомных орбиталей . Образующиеся новые орбитали называются гибридными орбиталями.
Понимание атомно-орбитальной гибридизации
Следующие идеи важны для понимания гибридизации:
- Гибридные орбитали не существуют в изолированных атомах. Они образуются только в ковалентно связанных атомах.
- Гибридные орбитали имеют форму и ориентацию, которые сильно отличаются от атомных орбиталей в изолированных атомах.
- Набор гибридных орбиталей создается путем объединения атомных орбиталей. Количество гибридных орбиталей в наборе равно количеству атомных орбиталей, которые были объединены для создания набора.
- Все орбитали в наборе гибридных орбиталей эквивалентны по форме и энергии.
- Тип гибридных орбиталей, образующихся в связанном атоме, зависит от геометрии его электронной пары, как это предсказывает теория VSEPR.
- Гибридные орбитали перекрываются, образуя σ-связи. Негибридные орбитали перекрываются, образуя π-связи.
В следующих разделах мы обсудим распространенные типы гибридных орбиталей.
sp Гибридизация
Атом бериллия в газообразной молекуле BeCl 2 является примером центрального атома без неподеленных пар электронов в линейном расположении трех атомов. В молекуле BeCl 2 имеются две области плотности валентных электронов, соответствующие двум ковалентным связям Be–Cl. Чтобы разместить эти два электронных домена, две из четырех валентных орбиталей атома Be будут смешиваться, образуя две гибридные орбитали.Этот процесс гибридизации включает смешивание валентной орбитали s с одной из валентных p орбиталей с получением двух эквивалентных гибридных орбиталей sp , ориентированных в линейной геометрии. Набор орбиталей sp похож по форме на исходную орбиталь p , но есть важное отличие. Количество объединенных атомных орбиталей всегда равно количеству образовавшихся гибридных орбиталей. Орбиталь p — это одна орбиталь, которая может содержать до двух электронов.Набор sp представляет собой две эквивалентные орбитали, расположенные под углом 180° друг к другу. Два электрона, которые первоначально находились на орбитали s , теперь распределены по двум орбиталям sp , которые заполнены наполовину. В газообразном BeCl 2 эти полузаполненные гибридные орбитали будут перекрываться с орбиталями атомов хлора с образованием двух идентичных σ-связей.
Когда атомные орбитали гибридизуются, валентные электроны занимают вновь созданные орбитали. Атом Be имел два валентных электрона, поэтому каждая из sp орбиталей получает один из этих электронов.Каждый из этих электронов спаривается с неспаренным электроном атома хлора, когда гибридная орбиталь и орбиталь хлора перекрываются при образовании связей Be–Cl.
Любой центральный атом, окруженный всего двумя областями плотности валентных электронов в молекуле, будет демонстрировать sp гибридизацию. Другие примеры включают атом ртути в линейной молекуле HgCl 2 , атом цинка в Zn(CH 3 ) 2 , который содержит линейную структуру C–Zn–C, и атомы углерода в HCCH и CO2.
sp 2 Гибридизация
Валентные орбитали центрального атома, окруженные тремя областями электронной плотности, состоят из набора из трех sp 2 гибридных орбиталей и одной негибридизированной p орбитали. Такое расположение является результатом гибридизации sp 2 , смешивания одной орбитали s и двух орбиталей p для получения трех идентичных гибридных орбиталей, ориентированных в тригональной плоской геометрии.
Наблюдаемая структура молекулы борана, BH 3 , предполагает sp 2 гибридизацию бора в этом соединении. Молекула тригонально-плоская, атом бора участвует в трех связях с атомами водорода. Три валентных электрона атома бора на трех гибридных орбиталях sp 2 перераспределяются, и каждый электрон бора соединяется с электроном водорода при образовании связей B–H.
Любой центральный атом, окруженный тремя областями электронной плотности, будет демонстрировать sp 2 гибридизацию.Сюда входят молекулы с неподеленной парой на центральном атоме, такие как ClNO, или молекулы с двумя одинарными связями и двойной связью, соединенными с центральным атомом, как в формальдегиде CH 2 O и этилене H 2 CCH. 2 .
sp 3 Гибридизация
Валентные орбитали атома, окруженного тетраэдрическим расположением связывающих пар и неподеленных пар, состоят из набора четырех sp 3 гибридных орбиталей.Гибриды получаются в результате смешивания одной орбитали s и всех трех орбиталей p , что дает четыре идентичных гибридных орбитали sp 3 . Каждая из этих гибридных орбиталей указывает на другой угол тетраэдра.
Молекула метана CH 4 состоит из атома углерода, окруженного четырьмя атомами водорода в углах тетраэдра. Атом углерода в метане проявляет sp 3 гибридизацию. Четыре валентных электрона атома углерода равномерно распределены по гибридным орбиталям, и каждый электрон углерода соединяется с электроном водорода при образовании связей С-Н.
В молекуле метана орбиталь 1 s каждого из четырех атомов водорода перекрывается с одной из четырех sp 3 орбиталей атома углерода, образуя сигма (σ) связь. Это приводит к образованию четырех прочных эквивалентных ковалентных связей между атомом углерода и каждым из атомов водорода с образованием молекулы метана CH 4 .
Гибридная орбиталь sp 3 также может содержать неподеленную пару электронов.Например, атом азота в аммиаке окружен тремя парами связи и неподеленной парой электронов, направленных к четырем углам тетраэдра. Атом азота sp 3 гибридизован с одной гибридной орбиталью, занятой неподеленной парой.
Молекулярная структура воды соответствует тетраэдрическому расположению двух неподеленных пар и двух связывающих пар электронов. Таким образом, мы говорим, что атом кислорода sp 3 гибридизован, причем две гибридные орбитали заняты неподеленными парами, а две — связывающими парами.