Неорганические вещества клетки — Химическая организация клетки. Взаимосвязь строения и функций неорганических и органических веществ (белков, нуклеиновых кислот, углеводов, липидов, АТФ), входящих в состав клетки. Обоснование родства организмов на основе анализа химического состава их клеток
Основные термины и понятия, проверяемые в экзаменационной работе: азотистые основания, активный центр фермента, гидрофильность, гидрофобность, аминокислоты, АТФ, белки, биополимеры, денатурация, ДНК, дезоксирибоза, комплементарность, липиды, мономер, нуклеотид, пептидная связь, полимер, углеводы, рибоза, РНК, ферменты, фосфолипиды.
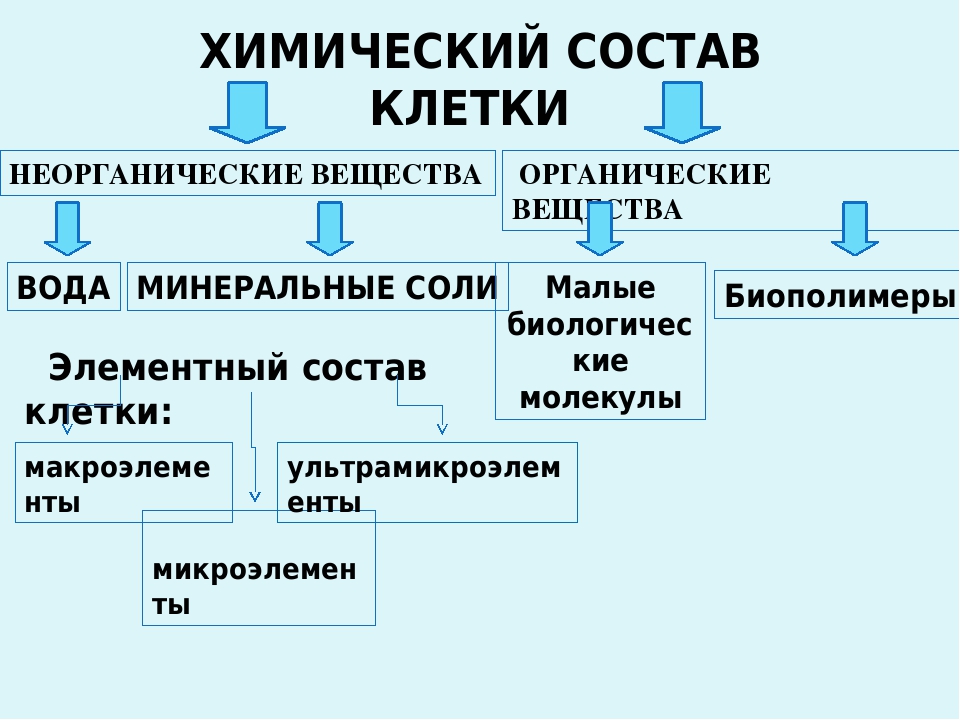
В состав клетки входит около 70 элементов периодической системы элементов Менделеева, а 24 из них присутствуют во всех типах клеток. Все присутствующие в клетке элементы делятся, в зависимости от их содержания в клетке, на группы:
макроэлементы – H, O, N, C,. Mg, Na, Ca, Fe, K, P, Cl, S;
микроэлементы – В, Ni, Cu, Co, Zn, Mb и др. ;
;
ультрамикроэлементы – U, Ra, Au, Pb, Hg, Se и др.
В состав клетки входят молекулы неорганических и органических
Неорганические соединения клетки – вода и неорганические ионы.
Вода – важнейшее неорганическое вещество клетки. Все биохимические реакции происходят в водных растворах. Молекула воды имеет нелинейную пространственную структуру и обладает полярностью. Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
Физические свойства воды: так как молекулы воды полярны, то вода обладает свойством растворять полярные молекулы других веществ. Вещества, растворимые в воде, называются гидрофильными. Вещества, нерастворимые в воде называются гидрофобными.
Вода обладает высокой удельной теплоемкостью. Чтобы разорвать многочисленные водородные связи, имеющиеся между молекулами воды, требуется поглотить большое количество энергии. Вспомните, как долго нагревается до кипения чайник. Это свойство воды обеспечивает поддержание теплового баланса в организме.
Вспомните, как долго нагревается до кипения чайник. Это свойство воды обеспечивает поддержание теплового баланса в организме.
Для испарения воды необходима достаточно большая энергия. Температура кипения воды выше, чем у многих других веществ. Это свойство воды предохраняет организм от перегрева.
Вода может находиться в трех агрегатных состояниях – жидком, твердом и газообразном.
Водородные связи обуславливают вязкость воды и сцепление ее молекул с молекулами других веществ. Благодаря силам сцепления молекул на поверхности воды создается пленка, обладающая такой характеристикой, как поверхностное натяжение.
При охлаждении движение молекул воды замедляется. Количество водородных связей между молекулами становится максимальным. Наибольшей плотности вода достигает при 4 Сº. При замерзании вода расширяется (необходимо место для образования водородных связей) и ее плотность уменьшается. Поэтому лед плавает.
Биологические функции воды. Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
Вода – активный участник реакций обмена веществ.
Вода участвует в образовании смазывающих жидкостей и слизей, секретов и соков в организме. Эти жидкости находятся в суставах позвоночных животных, в плевральной полости, в околосердечной сумке.
Вода входит в состав слизей, которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей. Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слезы, желчь, сперма и т.д.
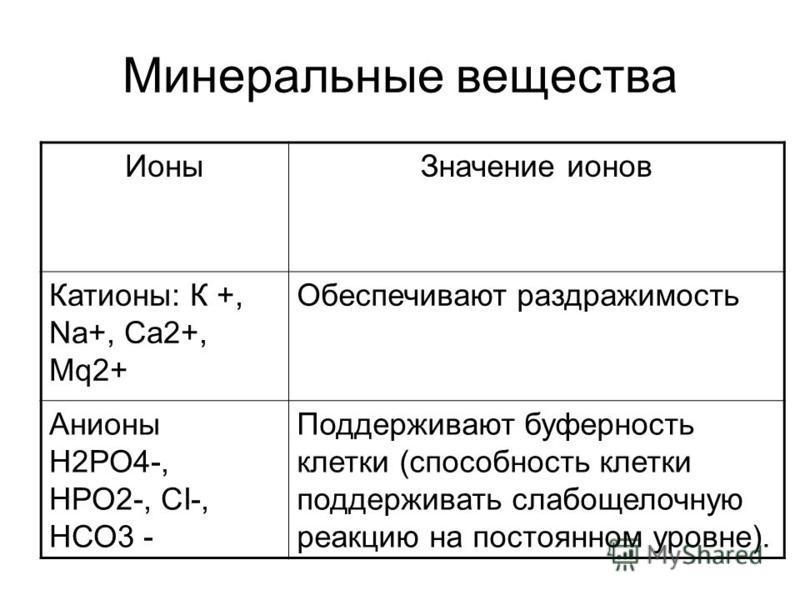
Неорганические ионы. К неорганическим ионам клетки относятся: катионы K+, Na+, Ca2+, Mg2+, NH3+ и анионы Cl–, NO3—, Н2
PO4—, NCO3—, НPO42-.Разность между количеством катионов и анионов (Nа+ , Ка+, Сl—) на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую рН внутриклеточной среды организма на уровне 6—9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему и поддерживают рН внеклеточной среды (плазмы крови) на уровне 7—4.
Соединения азота служат источником минерального питания, синтеза белков, нуклеиновых кислот. Атомы фосфора входят в состав нуклеиновых кислот, фосфолипидов, а также костей позвоночных, хитинового покрова членистоногих. Ионы кальция входят в состав вещества костей; они также необходимы для осуществления мышечного сокращения, свертывания крови.
ПРИМЕРЫ ЗАДАНИЙ
Часть А
А1. Полярностью воды обусловлена ее способность
1) проводить тепло 3) растворять хлорид натрия
2) поглощать тепло 4) растворять глицерин
А2. Больным рахитом детям необходимо давать препараты, содержащие
1) железо 2) калий 3) кальций 4) цинк
А3. Проведение нервного импульса обеспечивается ионами:
Проведение нервного импульса обеспечивается ионами:
1) калия и натрия 3) железа и меди
2) фосфора и азота 4) кислорода и хлора
А4. Слабые связи между молекулами воды в ее жидкой фазе называются:
1) ковалентными 3) водородными
2) гидрофобными 4) гидрофильными
А5. В состав гемоглобина входит
1) фосфор 2) железо 3) сера 4) магний
А6. Выберите группу химических элементов, обязательно входящую в состав белков
1) Na, K, O, S
2) N, P, C, Cl
3) C, S, Fe, O
4) C, H, O, N
А7. Пациентам с гипофункцией щитовидной железы дают препараты, содержащие
1) йод
2) железо
3) фосфор
4) натрий
Часть В
В1. Выберите функции воды в клетке
1) энергетическая 4) строительная
2) ферментативная 5) смазывающая
3) транспортная 6) терморегуляционная
В2. Выберите только физические свойства воды
1) способность к диссоциации
2) гидролиз солей
3) плотность
4) теплопроводность
5) электропроводность
6) донорство электронов
Часть С
С1. Какие физические свойства воды определяют ее биологическое значение?
Какие физические свойства воды определяют ее биологическое значение?
Неорганические вещества. Вода
Вы помните, что все вещества клетки делятся на неорганические и органические. Сегодня рассмотрим более подробно неорганические вещества. А конкретно – воду. Вдумайтесь в это древнегреческое изречение:
Человек может продержаться без воды несколько дней. Космические аппараты, которые всё чаще направляют к другим планетам, преследуют главную цель – поиск воды. Потому что наличие оксида водорода на планете – непременное условие существования жизни. По крайней мере, той формы жизни, к которой принадлежим мы и все окружающие нас живые организмы.
Именно
вода стала колыбелью зарождения первых живых организмов на Земле. И вот уже 4
миллиарда лет вода – основное вещество, из которого состоит живая природа. Так
почему именно вода? Ведь на Земле миллионы других химических соединений!
Так
почему именно вода? Ведь на Земле миллионы других химических соединений!
Вначале более подробно поговорим о содержании воды в живых организмах. В
среднем оно составляет
60–75 % их массы, но может значительно
колебаться. Рекордсмены здесь – медузы, которые ну просто одна
вода – 98 %. Не отстаёт и растительный мир – в листьях и сочных
плодах наших зелёных собратьев содержание воды также может достигать
фантастических 98 %.
У человека количество воды неодинаково в разных тканях и органах. В сером
веществе головного мозга её содержание составляет 85 %, в костях
– 22, а в эмали зуба всего 2–3 %. При
этом наибольшее содержание воды в организме наблюдается в эмбриональный
период, когда мы по водоносности практически не уступаем медузам – 95
%. Но с возрастом содержание воды в теле человека неуклонно уменьшается.
Вы помните из химии, что вода в природе находится в двух формах: свободной и связанной. В живых организмах свободная вода находится в межклеточных пространствах, сосудах, полостях органов, вакуолях. В основном она служит для переноса веществ из окружающей среды в клетку и наоборот. Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками.
Мы
уже сказали в начале, что вода выполняет уникальные функции в живой природе.
Это значит, что она обладает и уникальными свойствами. А функции и свойства
всегда зависят от строения. Вспомним строение молекулы воды.
H2O. Эта формула известна любому
ребёнку. А вот как соединяются атомы водорода и кислорода между собой, вы могли
подзабыть. Связи Н-О-Н ковалентные полярные и располагаются под углом
104,5°
. Как известно, кислород обладает более
высокой электроотрицательностью, чем водород, поэтому атом кислорода
притягивает к себе общие электронные пары и приобретает частично отрицательный
заряд. Ну а атомы водорода, от которых отодвинули их электроны, становятся
частично положительными.
Как известно, кислород обладает более
высокой электроотрицательностью, чем водород, поэтому атом кислорода
притягивает к себе общие электронные пары и приобретает частично отрицательный
заряд. Ну а атомы водорода, от которых отодвинули их электроны, становятся
частично положительными.
Таким образом, молекула воды поляризована и является диполем. Этот факт – первая ступенька к раскрытию тайны воды.
Далее обратим внимание на размеры молекулы воды. Приблизительно это 3·10-10 м. То есть молекула оксида водорода очень мала. Она самая маленькая из всех известных оксидов, что логично – в её состав входит два самых маленьких по диаметру атома. Например, другой ключевой оксид живых организмов – оксид углерода четыре – образован молекулами диаметром уже
Итак, маленькие размеры молекулы – вторая составляющая уникальных свойств воды.
 К ним и перейдём.
К ним и перейдём.1. Вода – универсальный растворитель.
В
ней прекрасно растворяются ионные соединения (кислоты, основания, соли) и некоторые
неионные, но полярные соединения. То есть те, в молекуле которых присутствуют
заряженные (полярные) группы, например, сахара (вы сталкиваетесь с этим каждый
день, правда?), а также простые спирты, аминокислоты.
Почему же вода так хороша в этом отношении? А потому что её молекулы, как мы
говорили, тоже полярны. Между молекулами воды и растворяемого вещества
тут же возникает электростатическое притяжение, которое приводит к образованию
так называемых водородных связей. И вода просто разрывает растворяемое
вещество.
Вы
же помните, что молекулы находятся в постоянном движении. И чем больше
температура, тем выше скорость их движения, поэтому справиться с сахаром в
утренней чашке чая нам легче кипятком.
Вещества, хорошо растворимые в воде, называются гидрофильными (от
греческого hygros – «влажный» и philia –
«дружба», «склонность»).
Зачем же вещества вообще растворять и почему это так важно? Когда вещество
переходит в раствор, значительно увеличивается его площадь соприкосновения,
молекулы или ионы могут двигаться более свободно и, следовательно, реакционная
способность вещества резко возрастает. Вот почему вода является основной
средой, в которой протекает большинство химических реакций. А все реакции
гидролиза и многочисленные окислительно-восстановительные реакции идут при
непосредственном участии воды.
Но способности воды к растворению не безграничны. Нам не удаётся отмыть жирные
руки без мыла. Потому что жиры, а также нуклеиновые кислоты и некоторые белки,
а это неполярные вещества, в воде не растворяются и называются гидрофобными
(от греческого phobos – «страх»). Но наличие таких веществ
– это не недостаток и не минус воде. Гидрофобные вещества могут образовывать с
водой поверхности раздела, на которых протекают многие химические реакции. Поэтому тот факт, что вода не растворяет неполярные вещества, для живых
организмов также очень важен.
Поэтому тот факт, что вода не растворяет неполярные вещества, для живых
организмов также очень важен.
Ещё физиологически важным свойством воды является её способность растворять
газы. Например, растворённым в воде кислородом дышит большинство водных
обитателей. Ну вы знаете.
Как растворитель, вода принимает участие в явлениях осмоса, играющих важнейшую
роль в жизнедеятельности клеток организма. Запомните, осмос – это
направленное движение молекул
воды через полупроницаемую мембрану из области с меньшей концентрацией
растворённых веществ в область с более высокой концентрацией этих веществ. То есть вода движется туда, где её меньше. Вот как это
происходит.
Полупроницаемая мембрана, например плазмалемма, способна пропускать маленькие
молекулы воды, а крупные молекулы, например сахаров, – задерживать. Если
разделить два раствора с разной концентрацией растворённых веществ, то через
некоторое время их концентрация выравняется. Но не за счёт перемещения молекул
растворённых веществ – они останутся на своих местах, а за счёт перемещения
молекул воды. Движение воды в сторону более высокой концентрации растворённых
веществ создаёт давление. Такое давление называется осмотическим. Чем
выше разность концентраций растворов, тем выше осмотическое давление.
Но не за счёт перемещения молекул
растворённых веществ – они останутся на своих местах, а за счёт перемещения
молекул воды. Движение воды в сторону более высокой концентрации растворённых
веществ создаёт давление. Такое давление называется осмотическим. Чем
выше разность концентраций растворов, тем выше осмотическое давление.
Растворы, осмотическое давление которых такое же, как в
клетках, называются изотоническими. Такие растворы, не вызывающие
изменение осмотического давления, относят к физиологическим. Вы, наверное,
встречались с водным раствором поваренной соли, в котором массовая доля NaCl составляет 0,9 %. Это и есть физиологический раствор,
который применяют в медицине.
Если концентрация раствора больше, чем у изотонического (то есть больше, чем
0,9 % NaCl), то такой раствор будет являться гипертоническим
(от греческого hyper – «сверх», «чрезмерно»). Соответственно, растворы с
более низкой концентрацией будут называться гипотоническими (от
греческого hypo – «под», что означает «ослабление»).
Почему в медицине применяют изотонические растворы? Как мы сказали, они не
изменяют осмотическое давление. Но что же произойдёт, если вместо
физиологического раствора применить раствор с другой концентрацией соли?
Давайте представим. Мы сделали инъекцию какого-либо препарата в кровь. Если мы
использовали при этом физиологический раствор, то концентрация соли в плазме не
изменится, и останется такой же, как в эритроцитах. Если же мы применим
гипертонический раствор, то повысим концентрацию соли в плазме, и вода начнёт выходить
из эритроцита, чтобы уравнять осмотическое давление.
Ну а введённый гипотонический раствор, наоборот, приведёт к поступлению воды в
эритроцит, что может привести к его разрыву. Эритроцит не выдержит давления
воды изнутри, так как этого не выдержит его клеточная мембрана.
А вот растительные клетки, покрытые толстой клеточной оболочкой, при увеличении
содержания воды остаются невредимыми, но становятся более упругими за счёт
осмотического давления воды на них изнутри. Если же воды перестаёт хватать –
растения увядают.
Если же воды перестаёт хватать –
растения увядают.
Давление цитоплазмы на клеточную стенку называется тургорным.
Второе
важнейшее свойство воды – высокая теплоёмкость.
Теплоёмкость – это отношение количества теплоты, полученного телом, к соответствующему
приращению его температуры. Количество тепла, необходимого для нагревания 1
г воды на 1°, достаточно, чтобы нагреть на 1° 9,25 г железа, 10,3
г меди. То есть вода обладает аномально высокой теплоёмкостью. В
чём секрет? В её строении. Мы с вами уже сказали, как происходит растворение в
воде полярных веществ: с образованием водородных связей между частично
положительными и частично отрицательными зарядами. Точно такие связи возникают
и между молекулами самой воды. Каждая из них стремится соединиться с четырьмя
соседними молекулами. Образуется сложная и прочная структура. Можно сказать –
монолитная, так как молекулы маленькие, связей очень много и держится всё это
очень прочно. Вот почему вода до последнего противится любому воздействию. В том
числе нагреванию. Ведь повышение температуры – это повышение скорости движения
молекул. А как её увеличишь, если все молекулы связаны по рукам и ногам
водородными связями.
Вот почему вода до последнего противится любому воздействию. В том
числе нагреванию. Ведь повышение температуры – это повышение скорости движения
молекул. А как её увеличишь, если все молекулы связаны по рукам и ногам
водородными связями.
Таким
образом вода, в большом количестве содержащаяся в живых организмах, помогает им
избегать резких перепадов температур в клетках и организме в целом, даже когда
колебания в окружающей среде достаточно велики. А как вы понимаете, это очень
важно для поддержания гомеостаза.
При испарении воды, когда между её молекулами также разрушаются водородные
связи, тратится много
теплоты – это позволяет регулировать температуру тела растениям при
транспирации, а животным при потоотделении.
3.
Высокая теплопроводность воды.
Благодаря этому свойству обеспечивается
равномерное распределение тепла по всему организму. Если бы в нашем организме
не было воды, то зимой нам нужно было бы надевать на руки не одни варежки, а
несколько.
4.
Высокое поверхностное натяжение воды.
Наверное, вы пробовали класть монетку на воду и добиваться того, чтобы она не
тонула. Это происходит из-за крепкого сцепления молекул воды водородными
связями с молекулами других веществ. В живых организмах благодаря высокому
поверхностному натяжению воды обеспечивается капиллярный кровоток, восходящий и
нисходящий токи в растениях.
На
этом всё. Секрет того, почему именно вода из миллионов других химических
соединений играет ключевую роль в живых организмах, раскрыт.
У оксида водорода маленькие и полярные молекулы, соединённые водородными
связями, – таково строение. Оксид водорода – универсальный растворитель,
у него высокая теплоёмкость, теплопроводность, теплота парообразования и
поверхностное натяжение – таковы свойства, основанные на его строении. И благодаря этим свойствам
вода выполняет уникальные функции в живых организмах. А её процентное
содержание зависит от интенсивности обмена веществ. У человека с возрастом
обмен веществ замедляется, соответственно клеткам не нужно прежнее количество
воды.
А её процентное
содержание зависит от интенсивности обмена веществ. У человека с возрастом
обмен веществ замедляется, соответственно клеткам не нужно прежнее количество
воды.
И закончим цитатой древнекитайского философа Лао Цзы: «Чтобы быть сильным, надо быть как вода. Нет препятствий – она течёт; плотина – она остановится; прорвётся плотина – она снова потечёт; в четырёхугольном сосуде она четырёхугольна; в круглом – кругла. Оттого, что она так уступчива, она нужнее всего и сильнее всего».
|
Трудовые действия |
Контроль параметров технологического процесса во время остановки, открытие и закрытие запорной арматуры |
|
Анализ выявленных дефектов и неисправностей в процессе остановки, принятие необходимых мер по их устранению |
|
|
Внесение записи в документацию об остановке технологического оборудования и технологического процесса |
|
|
Информирование руководителя смены о выявленных неисправностях в процессе остановки и проведение мер по их устранению |
|
|
Информирование руководителя смены (оператора дистанционного пульта управления в химическом производстве) об остановке технологического оборудования и технологического процесса |
|
|
Информирование принимающего смену аппаратчика о проделанных и незавершенных работах по остановке технологического процесса |
|
|
Получение распоряжений руководителя смены на проведение самостоятельной остановки технологического оборудования |
|
|
Последовательная остановка технологического оборудования и технологического процесса согласно производственной инструкции по рабочему месту с уведомлением руководителя смены |
|
|
Принятие мер по обеспечению сохранения работоспособности остановленного оборудования |
|
|
Освобождение технологического оборудования от рабочих сред, приведение оборудования в безопасное состояние |
|
|
Необходимые умения |
Записывать показания приборов в технологическую документацию |
|
Контролировать и регулировать параметры технологического процесса при остановке технологического оборудования |
|
|
Контролировать параметры технологического процесса и изменение показаний работы оборудования с помощью приборов |
|
|
Оценивать состояние основного и вспомогательного технологического оборудования |
|
|
Применять средства коммуникации и связи |
|
|
Производить последовательную остановку технологического оборудования согласно инструкциям |
|
|
Необходимые знания |
Основные неполадки в работе оборудования, возможные причины их возникновения и способы их устранения |
|
Основные стадии производства |
|
|
Влияние остановки технологического оборудования на ход смежных процессов |
|
|
Особенности остановки и эксплуатации установок и оборудования в зимний период |
|
|
Параметры технологического процесса, их взаимосвязь и влияние на безопасность процесса |
|
|
Порядок остановки цеха на плановый ремонт |
|
|
Последовательность остановки основного и вспомогательного технологического оборудования, правила регулирования параметров технологического процесса при остановке технологического оборудования |
|
|
Схемы противоаварийных блокировок |
|
|
Схемы сигнализаций и противоаварийной защиты |
|
|
Технологическая схема процесса и особенности ведения технологического процесса |
|
|
Технологические схемы по рабочему месту |
|
|
Технологический регламент процесса |
|
|
Требования охраны труда |
|
|
План мероприятий по ликвидации аварий |
|
|
Требования системы текущего обслуживания и ремонта оборудования |
|
|
Устройство, принципы работы и местоположение основного и вспомогательного оборудования, трубопроводов и запорно-регулирующей арматуры, контрольно-измерительных приборов и автоматики |
|
|
Другие характеристики |
— |
|
Трудовые действия |
Получение указаний от руководителя смены (оператора дистанционного пульта управления в химическом производстве) информации о приеме сырья, энергоресурсов и технологических сред |
|
Информирование руководителя смены (оператора дистанционного пульта управления в химическом производстве) о пуске оборудования или неполадках в работе оборудования |
|
|
Контроль работы включенного технологического оборудования, контроль и регулирование хода пусковых операций |
|
|
Контроль и регулирование параметров технологического процесса после каждой ступени повышения нагрузки и обеспечение стабилизации технологических параметров |
|
|
Обход технологического оборудования после каждой ступени повышения нагрузки |
|
|
Согласование действий с персоналом смены по вопросам ведения технологического процесса |
|
|
Ведение технологической документации в рамках процесса пуска полного цикла технологического процесса, отдельных стадий смежных процессов при производстве основных неорганических веществ, производстве удобрений и азотных соединений |
|
|
Включение технологического оборудования |
|
|
По мере выхода оборудования на нормальный технологический режим через руководителя смены передача заявки дежурному электромонтеру на подачу напряжения к электроприводам включаемого в работу оборудования |
|
|
Последовательное подключение технологического оборудования согласно требованиям производственной инструкции |
|
|
Прием в работу сырья и энергоресурсов согласно требованиям инструкций по рабочему месту и контроль приема энергоресурсов |
|
|
Проведение обхода оборудования, включаемого в работу |
|
|
Проведение отбора проб рабочей среды согласно графику аналитического контроля |
|
|
Фиксирование в документации по рабочему месту информации о пуске технологического оборудования |
|
|
Необходимые умения |
Контролировать и регулировать параметры технологического процесса при пуске технологического оборудования |
|
Контролировать и регулировать расход сырья, вспомогательных материалов и энергоресурсов |
|
|
Отбирать пробы сред для проведения анализов в соответствии с требованиями производственной инструкции |
|
|
Пользоваться запорной, регулирующей и предохранительной арматурой |
|
|
Предупреждать и устранять причины отклонений от норм технологического режима |
|
|
Производить последовательное повышение нагрузки технологического процесса |
|
|
Производить последовательный запуск технологического оборудования |
|
|
Производить пуск основного и вспомогательного оборудования в автоматическом режиме и вручную, выводить оборудование в резерв |
|
|
Производить регулирование технологического процесса с целью приведения параметров сбросов и выбросов отработанных сред к нормам |
|
|
Работать с автоматизированным рабочим местом |
|
|
Необходимые знания |
Параметры и правила регулирования параметров технологического процесса при пуске |
|
План мероприятий по ликвидации аварий |
|
|
Порядок увеличения нагрузки технологического процесса |
|
|
Порядок пуска и правила эксплуатации технологического оборудования |
|
|
Последовательность пуска отдельных узлов оборудования |
|
|
Правила эксплуатации арматуры |
|
|
Схемы сигнализаций, противоаварийных блокировок и противоаварийной защиты |
|
|
Технологические схемы по рабочему месту |
|
|
Устройство, принципы работы и месторасположение основного и вспомогательного оборудования, трубопроводов, арматуры, контрольно-измерительных приборов и автоматики |
|
|
Другие характеристики |
— |
Неорганические вещества, входящие в состав клетки.
2.3.2. Органические вещества клетки. Углеводы, липиды Углеводы. Общая формула Сn (h3O)n. Следовательно, углеводы содержат в своем составе только три химических элемента.Растворимые в воде углеводы.Функции растворимых углеводов: транспортная, защитная, сигнальная,
автора Мясников Александр Леонидович4.6. Неорганические вещества Неорганические вещества в плазме и сыворотке крови (калий, натрий, кальций, фосфор, магний, железо, хлор и др.), определяют физикохимические свойства крови.Количество неорганических веществ в плазме – около 1 %. В тканях организма они находятся в
Из книги автора Из книги автора Из книги автора6.9. Стволовые клетки Сейчас модно рассуждать на тему стволовых клеток. Когда меня спрашивают, что я об этом думаю, то я отвечаю вопросом на вопрос: «Где? В России или в мире?».В России и в мире ситуации в этой области совершенно разные. В мире идут интенсивные исследования и
Вода .
Из неорганических веществ, входящих в состав
клетки , важнейшим является вода. Количество ее составляет от
60 до 95% общей массы клетки . Вода играет важнейшую роль в
жизни клеток и живых организмов в целом . Помимо того что она
входит в их состав, для многих организмов это еще и среда
обитания.
Количество ее составляет от
60 до 95% общей массы клетки . Вода играет важнейшую роль в
жизни клеток и живых организмов в целом . Помимо того что она
входит в их состав, для многих организмов это еще и среда
обитания.
Роль воды в клетке определяется ее уникальными химическими и физическими свойствами, связанными главным образом с малыми размерами молекул, с полярностью ее молекул и с их способностью образовывать друг с другом водородные связи.
Вода как компонент биологических систем выполняет следующие важнейшие функции:
- Вода-универсальный растворитель
для полярных
веществ, например солей, Сахаров , спиртов, кислот и др.
Вещества, хорошо растворимые в воде, называются
гидрофильными.
Когда вещество переходит в раствор,
его молекулы или ионы получают возможность двигаться более
свободно; соответственно возрастает реакционная
способность вещества. Именно по этой причине большая часть
химических реакций в клетке протекает в водных растворах.
 Ее молекулы участвуют во многих химических реакциях,
например при образовании или гидролизе полимеров. В
процессе фотосинтеза вода является донором электронов,
источником ионов водорода и свободного кислорода.
Ее молекулы участвуют во многих химических реакциях,
например при образовании или гидролизе полимеров. В
процессе фотосинтеза вода является донором электронов,
источником ионов водорода и свободного кислорода. - Неполярные вещества вода не растворяет и не смешивается с ними, поскольку не может образовывать с ними водородные связи. Нерастворимые в воде вещества называются гидрофобными. Гидрофобные молекулы или их части отталкиваются водой, а в ее присутствии притягиваются друг к другу. Такие взаимодействия играют важную роль в обеспечении стабильности мембран , а также многих белковых молекул, нуклеинов вых кислот и ряда субклеточных структур.
- Вода обладает высокой удельной теплоемкостью.
Для
разрыва водородных связей, удерживающих молекулы воды,
требуется поглотить большое количество энергии. Это
свойство обеспечивает поддержание теплового баланса
организма при значительных перепадах температуры в
окружающей среде. Кроме того, вода отличается высокой
теплопроводностью,
что позволяет организму
поддерживать одинаковую температуру во всем его объеме.
- Вода характеризуется высокой теплотой парообразования, т. е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма. Благодаря этому свойству воды, проявляющемуся при потоотделении у млекопитающих , тепловой одышке у крокодилов и других животных , транспирации у растений , предотвращается их перегрев.
- Для воды характерно исключительно высокое поверхностное натяжение. Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение , восходящий и нисходящий токи в растениях). Многим мелким организмам поверхностное натяжение позволяет удерживаться на воде или скользить по ее поверхности.
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма .
- У растений вода определяет тургор
клеток, а у
некоторых животных выполняет опорные функции,
являясь гидростатическим скелетом (круглые и кольчатые
черви , иглокожие).

- Вода — составная часть смазывающих жидкостей (синовиальной — в суставах позвоночных , плевральной — в плевральной полости, перикардиальной — в околосердечной сумке) и слизей (облегчают передвижение веществ по кишечнику , создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли. Неорганические вещества в клетке, кроме воды, прецспавлевы минеральными солями. Молекулы солей в водном растворе распадаются на катионы и анионы. Наибольшее значение имеют катионы (К + , Na + , Са 2+ , Mg:+ , NH 4 +) и анионы (С1 , Н 2 Р0 4 -, НР0 4 2- , НС0 3 -, NO3 2— , SO 4 2-) Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и
внутри клетки обеспечивает возникновение потенциала
действия,
что лежит в основе возникновения нервного и
мышечного возбуждения. Разностью концентрации ионов по разные
стороны мембраны обусловлен активный перенос веществ через
мембрану, а также преобразование энергии.
Как мы уже знаем, клетка состоит из химических веществ органического и неорганического типа. Основными неорганическими веществами, входящими в состав клетки, являются соли и вода.
Вода как компонент живого
Вода – это доминирующий компонент всех организмов. Важные биологические функции воды осуществляются за счет уникальных свойств ее молекул, в частности наличии диполей, которые делают возможным возникновение водородных связей между клетками.
Благодаря молекулам воды в организме живых существ происходят процессы термостабилизации и терморегуляции. Процесс терморегуляции происходит за счет высокой теплоемкости молекул воды: внешние перепады температуры не влияют на температурные изменения внутри организма.
Благодаря воде органы человеческого организма сохраняют свою эластичность. Вода является одной из основных составляющих смазывающих жидкостей, необходимых для суставов позвоночных или околосердечной сумки.
Она входит в слизь, облегчающую передвижение веществ по кишечнику. Вода – составляющая желчи, слез и слюны.
Вода – составляющая желчи, слез и слюны.
Соли и другие неорганические вещества
Клетки живого организма помимо воды содержат такие неорганические вещества как кислоты, основания и соли. Наиболее важное значение в жизнедеятельности организма имеют Mg2+, h3PO4, K, CA2, Na, C1-. Слабые кислоты гарантируют стабильную внутреннюю среду клетки (слабощелочную).
Концентрация ионов в межклеточном веществе и внутри клетки может быть различной. Так к примеру ионы Na+ сконцентрированы только в межклеточной жидкости, в то время как К+ содержится исключительно в клетке.
Резкое сокращение либо повышения количества определенных ионов в составе клетке не только к ее дисфункции, но и к гибели. К примеру, снижение количества Са+ в клетке вызывает судороги внутри клетки и дальнейший ее отмирание.
Некоторые неорганические вещества часто вступают во взаимодействие с жирами, белками и углеводами. Так ярким примером являются органические соединения с фосфором и серой.
Сера, которая входит в состав молекул белка, отвечает за образование молекулярных связей организма. Благодаря синтезу фосфора и органических веществ происходит освобождение энергии с белковых молекул.
Благодаря синтезу фосфора и органических веществ происходит освобождение энергии с белковых молекул.
Соли кальция
Нормальному развитию костной ткани, а также функционированию головного и спинного мозга способствуют соли кальция. Обмен кальция в организме осуществляется за счет витамина D. Избыток или недостаток солей кальция влечет за собой дисфункцию организма.
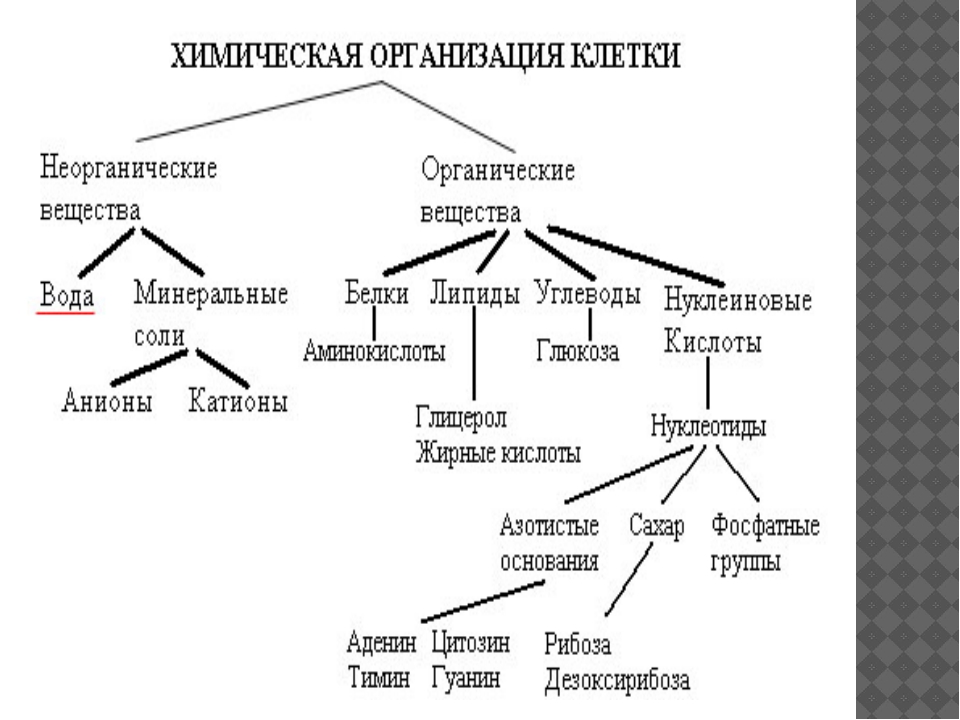
Клетки растений и животных содержат неорганические и органические вещества. К неорганическим относят воду и минеральные вещества. К органическим веществам относят белки, жиры, углеводы, нуклеиновые кислоты.
Неорганические вещества
Вода — это соединение, которое живая клетка содержит в наибольшем количестве. Вода составляет около 70% массы клетки. Большинство внутриклеточных реакций протекает в водной среде. Вода в клетке находится в свободном и связанном состоянии.
Значение воды для жизнедеятельности клетки определено ее строением и свойствами. Содержание воды в клетках может быть различным. 95% воды находится в клетке в свободном состоянии. Она необходима как растворитель для органических и неорганических веществ. Все биохимические реакции в клетке идут при участии воды. Вода используется для выведения различных веществ из клетки. Вода обладает высокой теплопроводностью и предотвращает резкие колебания температуры. 5% воды находится в связанном состоянии, образуя непрочные соединения с белками.
95% воды находится в клетке в свободном состоянии. Она необходима как растворитель для органических и неорганических веществ. Все биохимические реакции в клетке идут при участии воды. Вода используется для выведения различных веществ из клетки. Вода обладает высокой теплопроводностью и предотвращает резкие колебания температуры. 5% воды находится в связанном состоянии, образуя непрочные соединения с белками.
Минеральные вещества в клетке могут быть в диссоциированном состоянии или в соединении с органическими веществами.
Химические элементы, которые участвуют в процессах обмена веществ и обладают биологической активностью, называют биогенными.
Цитоплазма
содержит около 70% кислорода, 18% углерода, 10% водорода, кальций, азот, калий, фосфор, магний, серу, хлор, натрий, алюминий, железо. Эти элементы составляют 99,99% от состава клетки и их называют макроэлементами.
Например, кальций и фосфор входят в состав костей. Железо — составная часть гемоглобина.
Марганец, бор, медь, цинк, йод, кобальт — микроэлементы. Они составляют тысячные доли процента от массы клетки. Микроэлементы нужны для образования гормонов, ферментов, витаминов. Они влияют на обменные процессы в организме. Например, йод входит в состав гормона щитовидной железы, кобальт — в состав витамина В 12 .
Золото, ртуть, радий и др. — ультрамикроэлементы — составляют миллионные доли процента от состава клетки.
Недостаток или избыток минеральных солей нарушает жизнедеятельность организма.
Органические вещества
Кислород, водород, углерод, азот входят в состав органических веществ. Органические соединения представляют собой круп- ные молекулы, называемые полимерами. Полимеры состоят из многих повторяющихся единиц (мономеров). К органическим полимерным соединениям относят углеводы, жиры, белки, нуклеиновые кислоты, АТФ.
Углеводы
Углеводы состоят из углерода, водорода, кислорода.
Мономерами
углеводов являются моносахариды.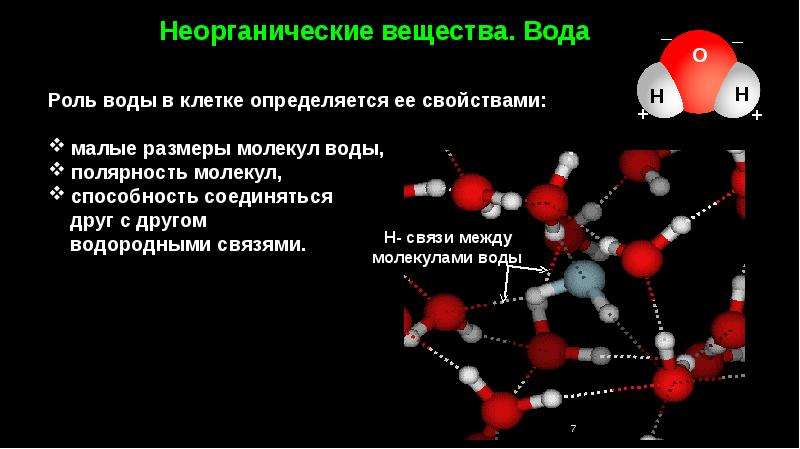 Углеводы раз- деляют на моносахариды, дисахариды и полисахариды.
Углеводы раз- деляют на моносахариды, дисахариды и полисахариды.
Моносахариды — простые сахара с формулой (СН 2 О) n , где n — любое целое число от трех до семи. В зависимости от числа угле- родных атомов в молекуле различают триозы (3С), тетрозы (4С), пентозы (5С), гексозы (6С), гептозы (7С).
Триозы С 3 Н 6 О 3 — например глицеральдегид и дигидроксиацетон — играют роль промежуточных продуктов в процессе дыхания, уча- ствуют в фотосинтезе. Тетрозы С 4 Н 8 О 4 встречаются у бактерий. Пентозы С 5 Н 10 О 5 — например рибоза — входит в состав РНК, дезоксирибоза входит в состав ДНК. Гексозы — С 6 Н 12 О 6 — например глюкоза, фруктоза, галактоза. Глюкоза — источник энергии для клетки. Вместе с фруктозой и галактозой глюкоза может участвовать в образовании дисахаридов.
Дисахариды образуются в результате реакции конденсации между двумя моносахаридами (гексозами) с потерей молекулы воды.
Формула дисахаридов С 12 Н 22 О 11 Среди дисахаридов наиболее широко распространены мальтоза, лактоза и сахароза.
Сахароза, или тростниковый сахар, синтезируется у растений. Мальтоза образуется из крахмала в процессе его переваривания в организме животных. Лактоза, или молочный сахар содержится только в молоке.
Полисахариды (простые) образуются в результате реакции конденсации большого числа моносахаридов. К простым полисахаридам относят крахмал (синтезируется у растений), гликоген (содержится в клетках печени и мышцах животных и человека), целлюлозу (образует клеточную стенку у растений).
Сложные полисахариды образуются в результате взаимодействия углеводов с липидами. Например, гликолипиды входят в состав мембран. К сложным полисахаридам относят также соединения углеводов с белками (гликопротеиды). Например, гликопротеиды входят в состав слизи, выделяемой железами желудоч- но-кишечного тракта.
Функции углеводов:
1. Энергетическая:
60% энергии организм получает при распаде углеводов. При расщеплении 1 г углеводов выделяется 17,6 кДж энергии.
2. Структурная и опорная: углеводы входят в состав плазматической мембраны, оболочки растительных и бактериальных клеток.
3. Запасающая: питательные вещества (гликоген, крахмал) откладываются в запас в клетках.
4. Защитная: секреты (слизь), выделяемые различными железами, предохраняют стенки полых органов, бронхов, желудка, кишечника от механических повреждений, вредных бактерий и вирусов.
5. Участвуют в фотосинтезе.
Жиры и жироподобные вещества
Жиры
состоят из углерода, водорода, кислорода. Мономерами
жиров являются жирные кислоты
и глицерин.
Свойства жиров определяются качественным составом жирных кислот и их количественным соотношением. Растительные жиры жидкие (масла), животные — твердые (например сало). Жиры нерастворимы в воде — это гидрофобные соединения. Жиры, соединяясь с белками, образуют липопротеиды, соединяясь с углеводами — гликолипиды. Гликолипиды и липопротеиды — это жироподобные вещества.
Жироподобные вещества входят в состав мембран клеток, мембранных органелл, нервной ткани. Жиры могут соединяться с глюко- зой и образовывать гликозиды. Например, гликозид дигитоксина — вещество, используемое при лечении болезней сердца.
Функции жиров:
1. Энергетическая: при полном распаде 1 г жира до углекислого газа и воды выделяется 38,9 кДж энергии.
2. Структурная: входят в состав клеточной мембраны.
3. Защитная: слой жира защищает организм от переохлаждения, механических ударов и сотрясений.
4. Регуляторная: стероидные гормоны регулируют процессы обмена веществ и размножение.
5. Жир — источник эндогенной воды. При окислении 100 г жира выделяется 107 мл воды.
Белки
В состав белков входят углерод, кислород, водород, азот. Мономерами белка являются аминокислоты. Белки построены из двадцати различных аминокислот. Формула аминокислоты:
В состав аминокислот входят: NH 2 — аминогруппа, обладающая основными свойствами; СООН — карбоксильная группа, имеет кислотные свойства.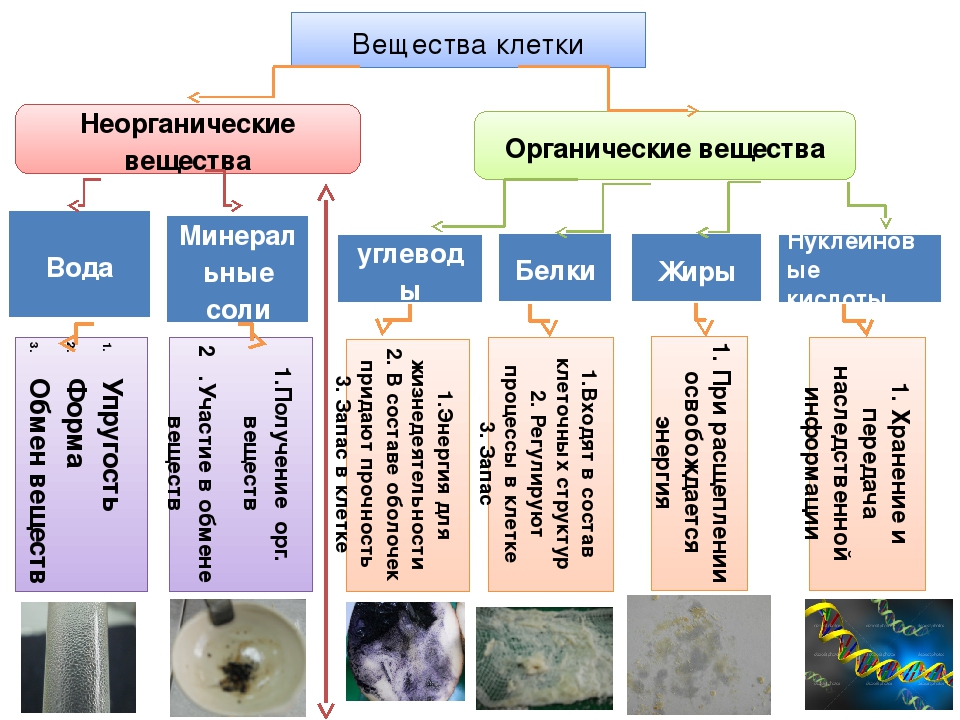 Аминокислоты отличаются друг от друга своими радикалами — R. Аминокислоты — амфотерные соединения. Они соединяются друг с другом в молекуле белка с помощью пептидных связей.
Аминокислоты отличаются друг от друга своими радикалами — R. Аминокислоты — амфотерные соединения. Они соединяются друг с другом в молекуле белка с помощью пептидных связей.
Схема конденсации аминокислот (образование пептидной связи)
Есть первичная, вторичная, третичная и четвертичная структуры белка. Порядок, количество и качество аминокислот, входящих в состав молекулы белка, определяют его первичную структуру. Белки первичной структуры могут с помощью водородных связей соединяться в спираль и образовывать вторичную структуру. Полипептидные цепи скручиваются определенным образом в компактную структуру, образуя глобулу (шар) — это тре- тичная структура белка. Большинство белков имеют третичную структуру. Аминокислоты активны только на поверхности глобулы. Белки, имеющие глобулярную структуру, объединяются вместе и образуют четвертичную структуру. Замена одной аминокислоты приводит к изменению свойств белка (рис. 30).
При воздействии высокой температуры, кислот и других факторов может происходить разрушение белковой молекулы.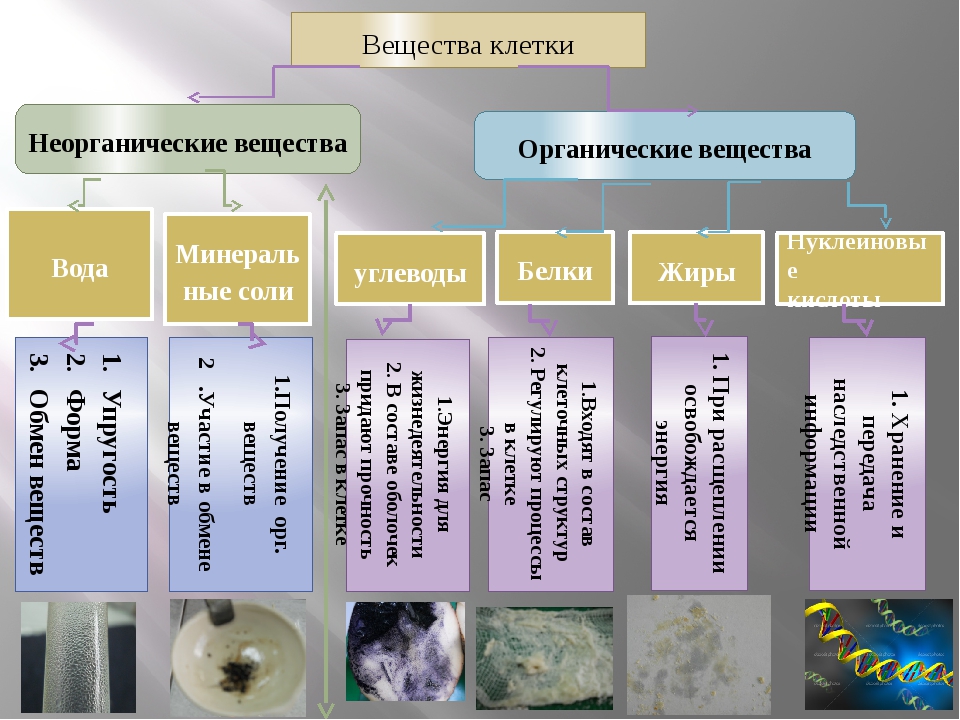 Это явление называется денатурацией (рис. 31). Иногда денатуриро-
Это явление называется денатурацией (рис. 31). Иногда денатуриро-
Рис. 30. Различные структуры молекул белка.
1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная (на примере гемоглобина крови).
Рис. 31. Денатурация белка.
1 — молекула белка до денатурации;
2 — денатурированный белок;
3 — восстановление исходной молекулы белка.
ванный белок при изменении условий вновь может восстановить свою структуру. Этот процесс называется ренатурацией и возможен лишь тогда, когда не разрушена первичная структура белка.
Белки бывают простые и сложные. Простые белки состоят только из аминокислот: например, альбумины, глобулины, фибриноген, миозин.
Сложные белки состоят из аминокислот и других органических соединений: например, липопротеины, гликопротеины, нук- леопротеины.
Функции белков:
1. Энергетическая. При распаде 1 г белка выделяется 17,6 кДж энергии.
2. Каталитическая. Служат катализаторами биохимических реакций. Катализаторы — ферменты. Ферменты ускоряют биохимические реакции, но не входят в состав конечных продуктов. Ферменты строго специфичны. Каждому субстрату соответствует свой фермент. Название фермента включает название субстрата и окончание «аза»: мальтаза, рибонуклеаза. Ферменты активны при определенной температуре (35 — 45 О С).
Служат катализаторами биохимических реакций. Катализаторы — ферменты. Ферменты ускоряют биохимические реакции, но не входят в состав конечных продуктов. Ферменты строго специфичны. Каждому субстрату соответствует свой фермент. Название фермента включает название субстрата и окончание «аза»: мальтаза, рибонуклеаза. Ферменты активны при определенной температуре (35 — 45 О С).
3. Структурная. Белки входят в состав мембран.
4. Транспортная. Например, гемоглобин переносит кислород и СО 2 в крови позвоночных.
5. Защитная. Защита организма от вредных воздействий: выработка антител.
6. Сократительная. Благодаря наличию белков актина и миозина в мышечных волокнах происходит сокращение мышц.
Нуклеиновые кислоты
Существует два типа нуклеиновых кислот: ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). Мономе- рами нуклеиновых кислот являются нуклеотиды.
ДНК (дезоксирибонуклеиновая кислота). В состав нуклеотида ДНК входит одно из азотистых оснований: аденин (А), гуанин (Г), тимин (Т) или цитозин (Ц) (рис. 32), углевод дезоксирибоза и остаток фосфорной кислоты. Молекула ДНК представляет собой двойную спираль, построенную по принципу комплементарности. В молекуле ДНК комплементарны следующие азотистые основания: А = Т; Г = Ц. Две спирали ДНК соединены водородными связями (рис. 33).
В состав нуклеотида ДНК входит одно из азотистых оснований: аденин (А), гуанин (Г), тимин (Т) или цитозин (Ц) (рис. 32), углевод дезоксирибоза и остаток фосфорной кислоты. Молекула ДНК представляет собой двойную спираль, построенную по принципу комплементарности. В молекуле ДНК комплементарны следующие азотистые основания: А = Т; Г = Ц. Две спирали ДНК соединены водородными связями (рис. 33).
Рис. 32. Строение нуклеотида.
Рис. 33. Участок молекулы ДНК. Комплементарное соединение нуклеотидов разных цепей.
ДНК способна к самоудвоению (репликации) (рис. 34). Репликация начинается с разделения двух комплементарных цепей. Каждая цепь используется в качестве матрицы для образования новой молекулы ДНК. В процессе синтеза ДНК участвуют ферменты. Каждая из двух дочерних молекул обязательно включает одну старую спираль и одну новую. Новая молекула ДНК абсо- лютно идентична старой по последовательности нуклеотидов. Такой способ репликации обеспечивает точное воспроизведение в дочерних молекулах той информации, которая была записана в материнской молекуле ДНК.
Рис. 34. Удвоение молекулы ДНК.
1 — матричная ДНК;
2 — образование двух новых цепей на основе матрицы;
3 — дочерние молекулы ДНК.
Функции ДНК:
1. Хранение наследственной информации.
2. Обеспечение передачи генетической информации.
3. Присутствие в хромосоме в качестве структурного компонента.
ДНК находится в ядре клетки, а также в таких органеллах клетки, как митохондрии, хлоропласты.
РНК (рибонуклеиновая кислота). Рибонуклеиновые кислоты бывают 3 видов: рибосомная, транспортная и информационная РНК. Нуклеотид РНК состоит из одного из азотистых оснований: аденина (А), гуанина (Г), цитозина (Ц), урацила (У), углевода — рибозы и остатка фосфорной кислоты.
Рибосомная РНК (рРНК) в соединении с белком входит в состав рибосом. рРНК составляет 80% от всей РНК в клетке. На рибосомах идет синтез белка.
Информационная РНК (иРНК)
составляет от 1 до 10% от всей РНК в клетке. По строению иРНК комплементарна участку молекулы ДНК, несущему информацию о синтезе определенного белка. Длина иРНК зависит от длины участка ДНК, с которого считывали информацию. иРНК переносит информацию о синтезе белка из ядра в цитоплазму к рибосоме.
По строению иРНК комплементарна участку молекулы ДНК, несущему информацию о синтезе определенного белка. Длина иРНК зависит от длины участка ДНК, с которого считывали информацию. иРНК переносит информацию о синтезе белка из ядра в цитоплазму к рибосоме.
Транспортная РНК (тРНК) составляет около 10% всей РНК. Она имеет короткую цепь нуклеотидов в форме трилистника и находится в цитоплазме. На одном конце трилистника находится триплет нуклеотидов (антикодон), кодирующий определенную аминокислоту. На другом конце триплет нуклеотидов, к которому при- соединяется аминокислота. Для каждой аминокислоты имеется своя тРНК. тРНК переносит аминокислоты к месту синтеза белка, т.е. к рибосомам (рис. 35).
РНК находится в ядрышке, цитоплазме, рибосомах, митохондриях и пластидах.
АТФ — Аденазинтрифосфорная кислота.
Аденазинтрифосфорная кислота (АТФ) состоит из азотистого основания — аденина, сахара — рибозы,
и трех остатков фосфорной кислоты
(рис. 36). В молекуле АТФ накапливается большое количество энергии, необходимой для биохимических процессов, идущих в клетке. Синтез АТФ происходит в митохондриях. Молекула АТФ очень неустой-
В молекуле АТФ накапливается большое количество энергии, необходимой для биохимических процессов, идущих в клетке. Синтез АТФ происходит в митохондриях. Молекула АТФ очень неустой-
чива и способна отщеплять одну или две молекулы фосфата с выделением большого количества энергии. Связи в молекуле АТФ называют макроэргическими.
АТФ → АДФ + Ф + 40 кДж АДФ→ АМФ + Ф + 40 кДж
Рис. 35. Строение тРНК.
А, Б, В и Г — участки комплементарного соединения внутри одной цепочки РНК; Д — участок (активный центр) соединения с аминокислотой; Е — участок комплементарного соединения с молекулой.
Рис. 36. Строение АТФ и ее превращение в АДФ.
Вопросы для самоконтроля
1. Какие вещества в клетке относят к неорганическим?
2. Какие вещества в клетке относят к органическим?
3. Что является мономером углеводов?
4. Какое строение имеют углеводы?
5. Какие функции выполняют углеводы?
6. Что является мономером жиров?
7. Какое строение имеют жиры?
Какое строение имеют жиры?
8. Какие функции выполняют жиры?
9. Что является мономером белка? 10.Какое строение имеют белки? 11.Какие структуры имеют белки?
12.Что происходит при денатурации белковой молекулы?
13.Какие функции выполняют белки?
14.Какие нуклеиновые кислоты известны?
15.Что является мономером нуклеиновых кислот?
16.Что входит в состав нуклеотида ДНК?
17.Какое строение имеет нуклеотид РНК?
18.Какое строение имеет молекула ДНК?
19.Какие функции выполняет молекула ДНК?
20. Какое строение имеет рРНК?
21.Какое строение имеет иРНК?
22.Какое строение имеет тРНК?
23.Какие функции выполняют рибонуклеиновые кислоты?
24.Какое строение имеет АТФ?
25.Какие функции выполняет АТФ в клетке?
Ключевые слова темы «Химический состав клеток»
азотистое основание альбумины
аминокислотная группа аминокислоты
амфотерные соединения
антикодон
бактерии
белки
биологическая активность биологический катализатор
биохимические реакции
болезнь
вещества
видовая специфичность
витамины
вода
водородные связи вторичная структура выработка антител высокая температура галактоза гексозы гемоглобин гепарин
гидрофобные соединения
гликоген
гликозиды
гликопротеиды
глицерин
глобула
глобулины
глюкоза
гормоны
гуанин
двойная спираль дезоксирибоза денатурация дисахарид
диссоциированное состояние
ДНК
единица информации живой организм животное жизнедеятельность жирные кислоты жировая ткань жироподобные вещества жиры
запас питательных веществ избыток
индивидуальная специфичность
источник энергии
капли
карбоксильная группа
качество кислота
клеточная стенка кодон
колебание температуры
количество
комплементарность
конечные продукты
кости
крахмал
лактоза
лечение
липопротеиды
макроэлементы
макроэргические связи
мальтоза
масса
мембрана клетки
микроэлементы
минеральные соли
миозин
митохондрии
молекула
молочный сахар
мономер
моносахарид
мукополисахариды
мукопротеиды
наследственная информация недостаток
неорганические вещества нервная ткань нуклеиновые кислоты нуклеопротеиды нуклеотид обмен веществ обменные процессы органические вещества пентозы
пептидные связи первичная структура перенос кислорода плоды
подкожная клетчатка
полимер полисахарид
полупроницаемая мембрана
порядок
потеря
проникновение воды
процент
радикал
разрушение
распад
растворитель
растение
расщепление
реакция конденсации
ренатурация
рибоза
рибонуклеаза
рибосома
РНК
сахар
свертывание крови
свободное состояние
связанное состояние
семена
сердце
синтез белка
слой
слюна
сократимые белки
строение
субстрат
теплопроводность
тетрозы тимин
тканевая специфичность
третичная структура
трилистник
триозы
триплет
тростниковый сахар углеводы
ультрамикроэлементы
урацил
участок
ферменты
фибриноген
формула
фосфорная кислота фотосинтез фруктоза функция
химические элементы
хлоропласты
хромосома
целлюлоза
цепь
цитозин
цитоплазма
четвертичная структура шар
щитовидная железа
элементы
ядро
неорганических веществ — Справочник химика 21
Твердые п жидкие отходы химических, нефтехимических и нефтеперерабатывающих производств состоят из разнообразных органических и неорганических веществ. Для выбора наиболее оптимального метода обезвреживания и утилизации этих отходов надо знать их состав, количество, свойства и факторы, влияющие на их изменения. Кроме того, необходимо знать степень токсичности этих отходов, чтобы правильно нормировать их содержание в почве и осуществлять санитарный контроль. [c.112]
Для выбора наиболее оптимального метода обезвреживания и утилизации этих отходов надо знать их состав, количество, свойства и факторы, влияющие на их изменения. Кроме того, необходимо знать степень токсичности этих отходов, чтобы правильно нормировать их содержание в почве и осуществлять санитарный контроль. [c.112]
Почему это так Дело в том, что молекулы неорганических веществ оказываются более прочными в том случае, если они состоят из двух или трех атомов. Но по мере присоединения новых и новых атомов молекула становится все более непрочной и склонна разрушиться. Поэтому неорганическая молекула, содержащая больше дюжины атомов,— большая редкость. [c.13]
Химики делят все вещества на два класса. К одному относятся, например, масло, сахар, крахмал, клей, желатин, шелк, каучук, бумага и пенициллин. Все это органические вещества. К, другому относятся воздух, вода, песок, глина, соль, золото, серебро, железо, латунь, стекло и цемент. Это неорганические вещества. [c.9]
Это неорганические вещества. [c.9]
Основные структурные типы неорганических веществ [c.103]
Становилось все более очевидным, что различие между органическими и неорганическими соединениями обусловлено особенностями химического строения молекул этих соединений. Многие химики начали говорить о разных типах строения молекул органических я неорганических соединений. Молекулы большинства неорганических веществ, с которыми имели дело химики XIX в., содержат всего от двух до восьми атомов. Да и вообще в молекулах очень немногих неорганических соединений число атомов достигает десятка. [c.73]
Органические вещества во многом отличаются от неорганических. Например, они гораздо менее прочны и менее долговечны, чем неорганические. Воду (а это неорганическое вещество) можно вскипятить, а получившийся пар нагреть до тысячи градусов без всякого для него вреда. Если вы охладите пар, из него снова получится вода. А если нагревать растительное масло (это — органическое вещество), то оно начнет дымить и гореть и перестанет быть растительным маслом. Соль (неорганическое вещество) вы можете нагревать до тех пор, пока она не расплавится и не раскалится докрасна. Охладите ее — и она останется той же солью. Если же нагревать сахар (органическое вещество), начнут выделяться газы, а потом сахар обуглится и почернеет. После охлаждения уже никогда не удастся снова получить сахар. [c.10]
Соль (неорганическое вещество) вы можете нагревать до тех пор, пока она не расплавится и не раскалится докрасна. Охладите ее — и она останется той же солью. Если же нагревать сахар (органическое вещество), начнут выделяться газы, а потом сахар обуглится и почернеет. После охлаждения уже никогда не удастся снова получить сахар. [c.10]
Еще более заметным для первых химиков было другое различие. Органические вещества можно было обработать теплом или какими-нибудь другими способами и превратить в неорганические. Однако не было известно такого способа, чтобы взять неорганическое вещество и превратить его в органическое. [c.10]
Химиков не переставало удивлять, что органические вещества при нагревании или каком-либо другом жестком воздействии легко превращаются в неорганические вещества. (Возможность обратного превращения, т. е. превращения неорганического вещества в органическое, была установлена несколько позднее.) То время было временем господства витализма — учения, рассматривающего жизнь [c. 69]
69]
Молекулы как органических, так и неорганических веществ состоят из различных атомов. Выяснилось, [c.11]
Комплексные соединения составляют наиболее обширный и разнообразный класс неорганических веществ. К ним принадле- кат также многие металлорганические соединения (стр. 465), связывающие воедино ранее разобщенные неорганическую химию и органическую химию. Многие комплексные соединения — витамин В)2, гемоглобин, хлорофилл и другие — играют большую роль в физиологических и биохимических процессах. Исследование свойств и пространственного строения комплексных соединений оказалось чрезвычайно плодотворным для кристаллохимии, [c.582]
В качестве растворителей применяют различные вещества. Так, вода может служить для извлечения из смеси твердых веществ тех пз них, которые растворимы в ней. Различные органические жидкости, такие, как диэтиловый, или серный, эфир, спирт, бензол, хлорированные углеводороды, бензин и другие погоны нефти, часто используются в лабораториях как растворители преимущественно органических, но часто и неорганических веществ.
 [c.140]
[c.140]До 1827 года химики были убеждены, что только живой организм может вырабатывать мочевину. Однако в 1827 году немецкий химик Фридрих Велер, к своему собственному изумлению, обнаружил, что на самом деле это не так. Он установил, что если кипятить неорганическое вещество цианат аммония, оно превращается в мочевину. Неорганическое вещество в пробирке превращалось в органическое Велер много раз повторил свой эксперимент, прежде чем решился опубликовать результаты. А когда в 1828 году он все же сделал это сообщение, оно ошеломило научный мир. [c.11]
Нефтеперерабатывающая и нефтехимическая промышленность относится к водоемким отраслям народного хозяйства и уступает по водопотреблению лишь энергетике, металлургии, химической нромышлеиности и коммунальному хозяйству. Большую часть воды используют для охлаждения н конденсации продуктовых потоков. В значительной части технологических процессов воду потребляют как растворитель или реагент, вводят в виде пара. Вода, пройдя тот или иной производственный цикл, претерпевает различные изменения либо безвозвратно теряется. Образующиеся сточные воды содержат растворимые и нерастворимые органические и неорганические вещества, включая токсичные. [c.73]
Вода, пройдя тот или иной производственный цикл, претерпевает различные изменения либо безвозвратно теряется. Образующиеся сточные воды содержат растворимые и нерастворимые органические и неорганические вещества, включая токсичные. [c.73]
Важнейшие классы неорганических веществ 41 [c.41]
Институтом катализа СО АН СССР разработана классификация промышлен-ых катализаторов по их назначению (по виду процесса, для которого предназначен анный катализатор). Согласно этой классификации катализаторы подразделяют на руппы 1) катализаторы синтеза на основе неорганических веществ 2) катализато-ы синтеза (превращений) органических соединений 3) катализаторы гидрирования, дегидрирования 4) катализаторы производства мономеров синтетического каучу-а 5) катализаторы полимеризации и конденсации 6) катализаторы окисления [c.3]
Сорбционную очистку сточных вод от ПАВ с помощью ионообменных смол широко применяют для очистки промышленных сточных вод. Р1онообменные материалы — твердые, не растворимые в воде вещества, в структуру которых входят группы атомов, песуииш электрический заряд, скомпенсированный подвижными ионами иротивополож1юго знака. Эти противоионы способны замещаться поиамп того же знака, находящимися в растворе. Ионообменные процессы с участием ПАВ отличаются рядом специфических свойств, не характерных для ионного обмена неорганических веществ [c.219]
Р1онообменные материалы — твердые, не растворимые в воде вещества, в структуру которых входят группы атомов, песуииш электрический заряд, скомпенсированный подвижными ионами иротивополож1юго знака. Эти противоионы способны замещаться поиамп того же знака, находящимися в растворе. Ионообменные процессы с участием ПАВ отличаются рядом специфических свойств, не характерных для ионного обмена неорганических веществ [c.219]
Свободный фтор при нормальных условиях — газ зеленовато-желтого цвета с неприятным запахом. Жидкий фтор желтого цвета. Уже при обычных температурах фтор энергично реагирует почти со всеми органическими и неорганическими веществами, причем реакция протекает с выделением большого количества тепла и часто сопровождается воспламенением. [c.128]
Свойство дифенилолпропана образовывать аддукты с различными органическими и неорганическими веществами (( нол, изопропиловый спирт, аммиак) может быть использовано для очистки дифенилолпропана-сырца, выделенного из реакционной массы любым ме- [c. 161]
161]
Фосген — важный промышленный продукт. Он применяется пр производстве ряда органических и неорганических веществ, на пример красителей. [c.444]
Э. В. В р и ц к е, А. 1). К а и у с т и н с к и й, 1 >. 1. В е с е л о в с к и й. Термодинамические константы неорганических веществ. Изд. АН СССР (1949). [c.202]
Молекула угольной кислоты может лишиться как одного, так и обоих атомов водорода. Если отделить от нее один из них, останется ион бикарбоната. А второй атом водорода отделяется от молекулы в тысячу раз труднее, чё и первый. Если все-таки отде.шть и его, то останется ион карбоната. У человека в крови и тканях всегда ес ь сама угольная кислота, ион бикарбоната и растворенная двуокись углерода, а карбонатного иона в них нет. Оба этих иона легко соединяются с ионами различных металлов. Получающиеся соединения, хотя и содержат углерод, во многом подобны неорганическим веществам. Например, карбонат кальция, или углекислый кальций, есть не что иное, как минерал известняк. Иногда он встречается в природе и в виде другого минерала, покраси- [c.162]
Иногда он встречается в природе и в виде другого минерала, покраси- [c.162]
Водные растворы многих органических веществ можно выпаривать или упаривать только на водяной бане, так как при нагревании чашки с раствором на пламени газовой горелки может произойти пригорание осадка. Хотя большинство неорганических веществ не изменяется под действием относительно высокой температуры, все же и их предпочитают выпаривать или упаривать на водяной бане. Применение бани позволяет более осторожно провести операцию, а также дает возможность лучше следить за ходом процесса. [c.147]
В то время как в. лабораториях ставились опыты по получению нефтеподобных продуктов из неорганических веществ, научная мысль под влиянием фактов геологического порядка стремилась разрешить проблему происхождения нефти другим путем — по ли- [c.310]
Важнейшие классы неорганических веществ 43 [c.43]
Всего неорганических веществ 331 [c. 503]
503]
Термодинамические константы неорганических веществ. Изд-во ЛН СССР, М., 1949. [c.464]
Важнейшие классы неорганических веществ. Все вещества делятся на простые и сложные. Простые вещсства состоят из одного элемента, в состав сложных в.ходит два пли более элементов. Простые вещества, в свою очередь, разделяются па металлы и неметаллы или металлоиды . Последнее деление основано на различии в физЕгческнх свойствах простых веществ. [c.39]
Книга является учебником по количественному анализу неорганических веществ, рассчитанным на студентов нехпми-ческих вузов и факультетов. [c.2]
Гранулированный носитель катализатора получают смешением тонко-измельченного порошка плавленного неорганического вещества (А12О3, 2гОг, 51С) или их смеси, со связующим или агломерирующим соединением (глина) и с органическими веществами, образующими газы при повышенной температуре (древесные опилки с размером частиц 0,04— 0,15 1им). Носитель обжигают при температуре 1000—1400° С [c.90]
Носитель обжигают при температуре 1000—1400° С [c.90]
Образующиеся в промышленном производстве отходы представляют собой гетерогенные и гомогенные системы, содержащие газообразные, жидкие или твердые органические и неорганические вещества. К гетерогенным относятся системы газ (Г) — твердое (Т), газ (Г) жидкость (Ж), жидкость (Ж) —твердое (Т), жидкость (ЖО — жидкость, малораст оримая в Ж] (Ж2). К гомогенным относятся системы газ (Г) — газ (Г), жидкость (ЖрО — растворимая в ней жидкость (Жог)- [c.470]
Явление изомерии будет подробно рассмотрено прн изучении органических соединеиг1Й (см. 162), среди которых оно очень распространено. Следует, одсако, иметь в пиду, что изомерия присуща и неорганическим веществам. Так, еще в 1O24 г. Либих [c.118]
В свою очередь, каждая из этих групп разделяется на подгруппы. Так, груп-а катализаторов синтеза неорганических веществ включает в себя следующие одгруппы 1.1) катализаторы синтеза аммиака среднетемпературные 1.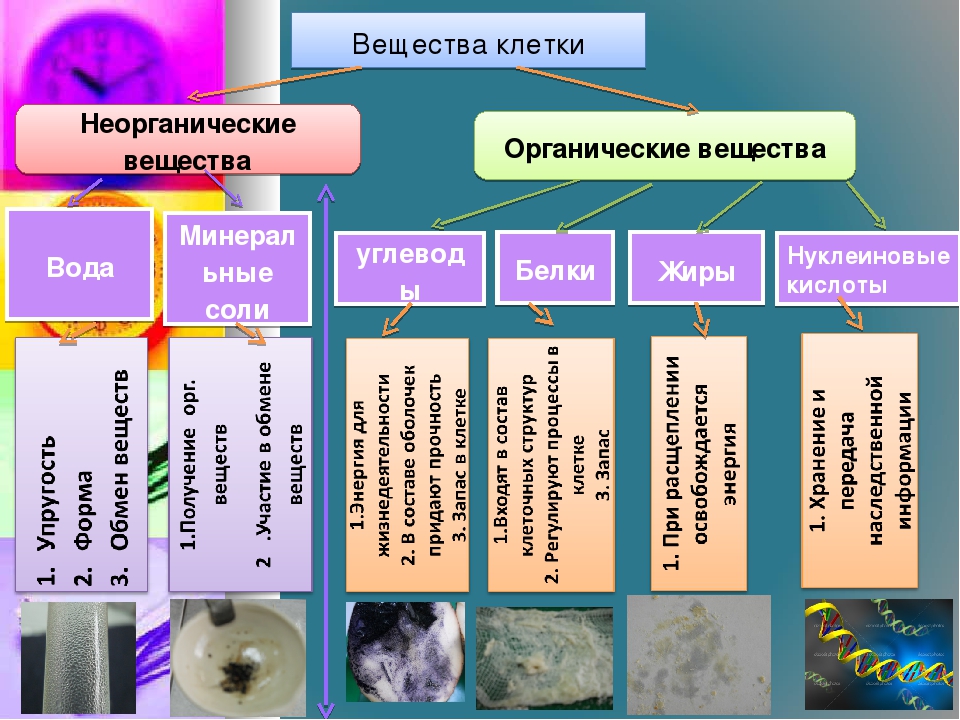 2) катали— [c.3]
2) катали— [c.3]
Из неорганических веществ в химической практике чаще всего ири.ходнтся и reть дело с оксидами, основаниями, кислотами и солями. Эти основные классы неорганических веществ подробно изучаются в средней Н1коле. Поэтому здесь приведем лишь важ-нейрпие сведения о них. [c.39]
2.4 Неорганические соединения, необходимые для функционирования человека — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Сравнить и сопоставить неорганические и органические соединения
- Определить свойства воды, которые делают ее жизненно важной
- Объясните роль солей в функционировании организма
- Различайте кислоты и основания и объясняйте их роль в pH
- Обсудить роль буферов в поддержании гомеостаза pH в организме
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать как основа как для геологии, так и для биологии. Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения могут быть неорганическими или органическими.
Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения могут быть неорганическими или органическими.
- Неорганическое соединение — это вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения действительно содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая вашим желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Двуокись углерода (CO 2 ) — один из немногих примеров.
- Органическое соединение — это вещество, содержащее как углерод, так и водород. Органические соединения синтезируются ковалентными связями в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород — вторые и третьи по распространенности элементы в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.

В следующем разделе рассматриваются четыре группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека.
Вода как смазка и амортизатор
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петли двери, вода в синовиальной жидкости смазывает суставы тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз. Вода также смягчает развивающийся плод в утробе матери.
Вода также смягчает развивающийся плод в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, которые поглощают и рассеивают тепло, но не испытывают соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды резко возрастает, вода, хранящаяся в теле, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение.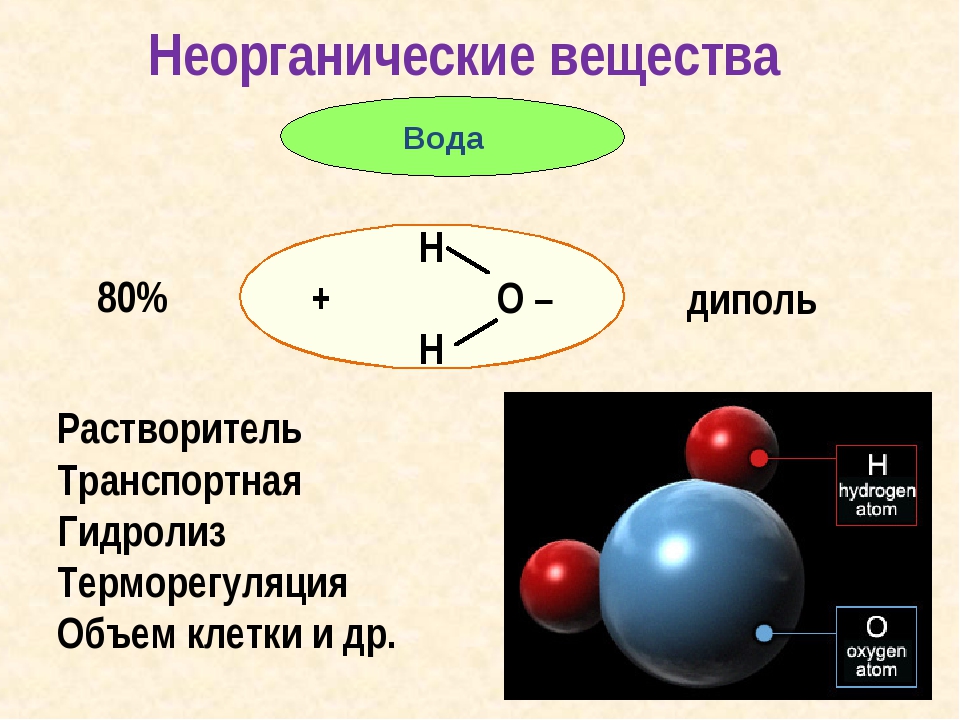 Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом.Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды. Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми».Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха).В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл. Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C6h22O6.Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора столько же частиц: 6.02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора столько же частиц: 6.02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Коллоид представляет собой смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия представляет собой жидкую смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает. Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, насколько быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение заданного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, насколько быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение заданного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 2.4.1). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода делится на H и OH. Одна часть разорванного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы вскоре поговорим).
Рисунок 2.4.1 — Дегидратационный синтез и гидролиз: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.Соли
Напомним, что соли образуются, когда ионы образуют ионные связи.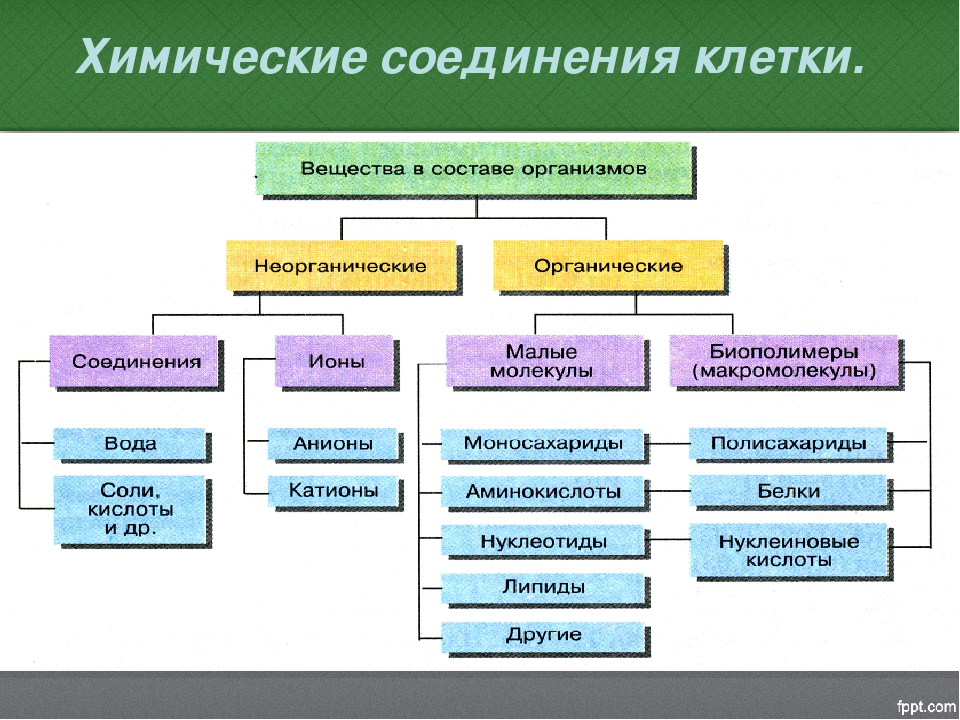 В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH —. Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH —. Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде (рисунок 2.4.2). Положительные и отрицательные области на молекуле воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде с образованием электролитов. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, выделяющее ионы водорода (H + ) в растворе (Рисунок 2.4.3 a ). Поскольку у атома водорода всего один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она выделяет весь свой H + в водянистую среду желудка.Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм. Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она выделяет весь свой H + в водянистую среду желудка.Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм. Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
 Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH —.
Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH —. Базы
A base — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H +, уже присутствующий в растворе (см. Рисунок 2.4.3 b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник (следующий участок пищеварительного тракта после желудка), если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает Н + . Бикарбонат принимает часть протонов H +, тем самым снижая кислотность раствора.
Бикарбонат принимает часть протонов H +, тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH. pH раствора представляет собой отрицательный десятичный логарифм концентрации иона водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано на рисунке 2.4.4. Шкала состоит из серии приращений от 0 до 14.Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.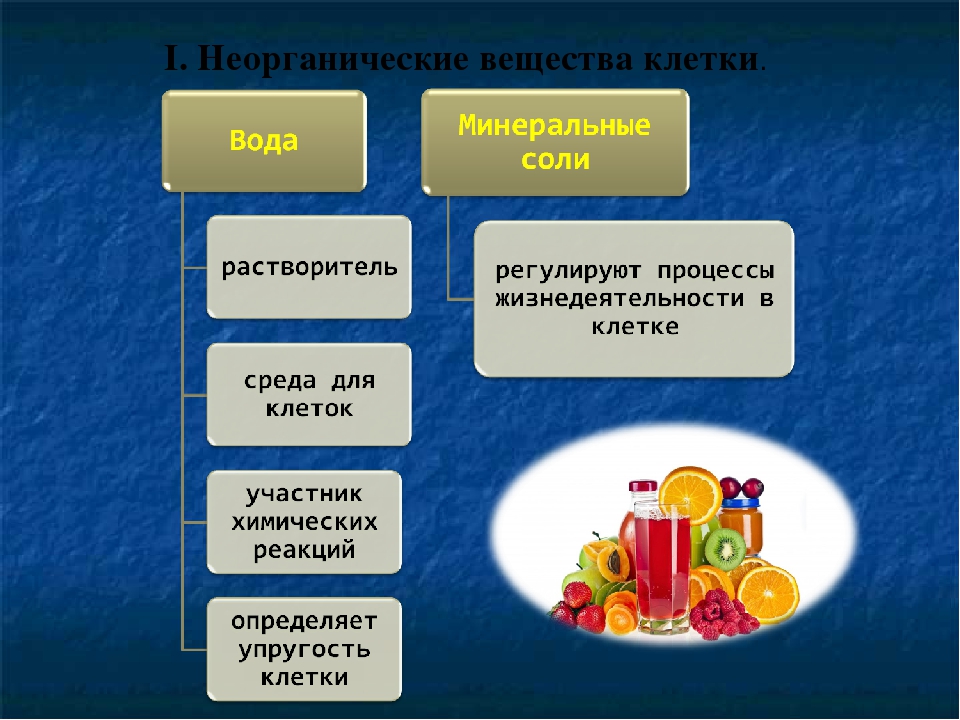 00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз кислотнее воды.
Буферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При таком слегка щелочном pH кровь может снижать кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, вместе называемых буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и ее конъюгированного основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действуя как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, вместе называемых буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и ее конъюгированного основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действуя как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Избыточная кислотность кислот и оснований, крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдохнуть, что вызывает накопление CO 2 (и H + ) в кровотоке.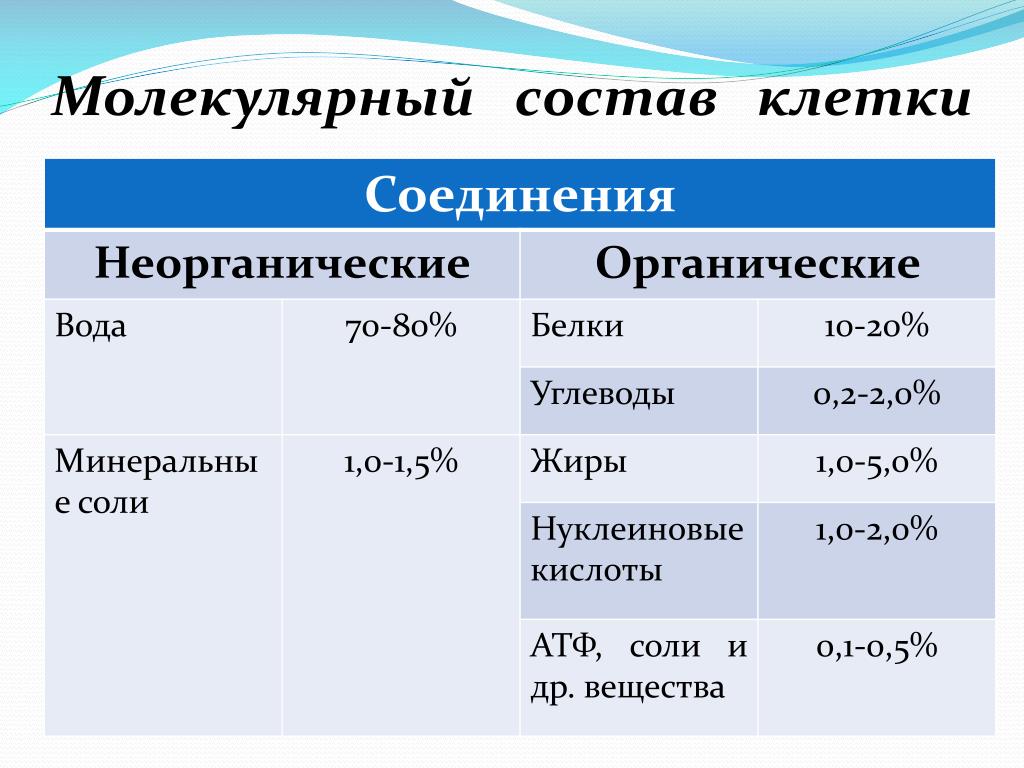 Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко. Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве.
Обзор главы
Неорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH —. Напротив, кислоты выделяют в растворе H + , делая его более кислым. Основания принимают H + , тем самым делая раствор более щелочным (едким).
Напротив, кислоты выделяют в растворе H + , делая его более кислым. Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + .У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, которые важны для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
Контрольные вопросы
Вопросы критического мышления
pH лимонного сока равен 2, а pH апельсинового сока равен 4.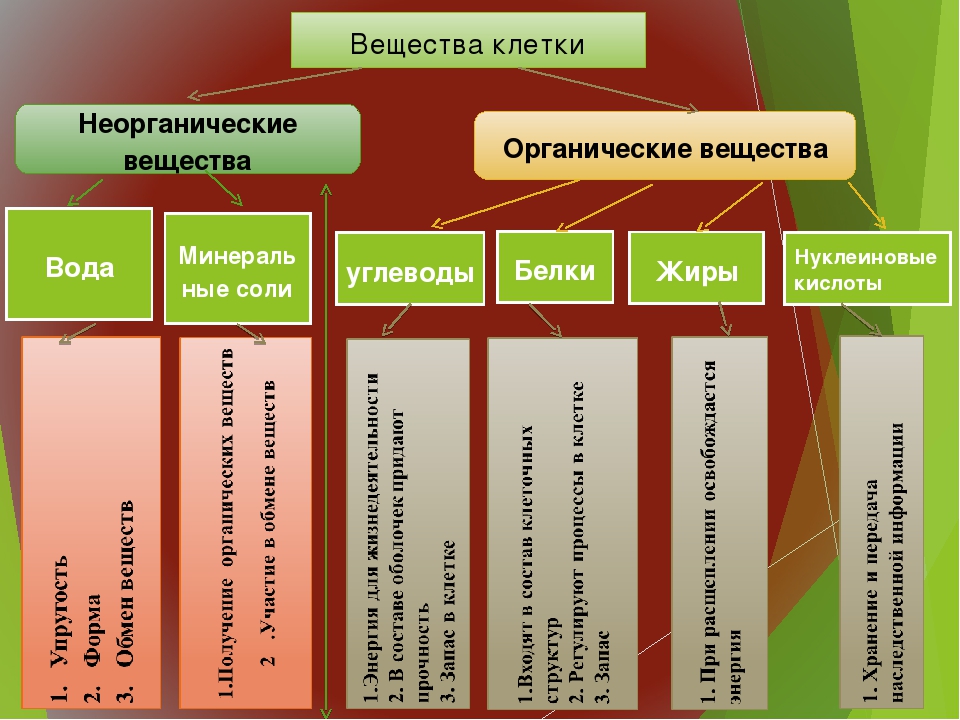 Какой из них более кислый и насколько? Что это значит?
Какой из них более кислый и насколько? Что это значит?
Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше.
Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната.Почему?
Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Поскольку избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода. Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального.
Неорганические соединения — обзор
V. ОРГАНИЧЕСКАЯ ХИМИЯ
Углерод — удивительный элемент. Он может связываться с собой и с другими элементами множеством способов. Фактически, он может образовывать одинарные, двойные и тройные связи с самим собой. Это составляет миллионы возможных органических соединений. Органическое соединение — это соединение, которое включает по крайней мере одну ковалентную связь углерод-углерод или углерод-водород.
Он может связываться с собой и с другими элементами множеством способов. Фактически, он может образовывать одинарные, двойные и тройные связи с самим собой. Это составляет миллионы возможных органических соединений. Органическое соединение — это соединение, которое включает по крайней мере одну ковалентную связь углерод-углерод или углерод-водород.
Большинство загрязнителей воздуха являются органическими. 16 Органические соединения можно разделить на две основные группы: алифатические и ароматические. Углеводороды — это самый основной тип органических соединений.Незамещенные углеводороды содержат только элементы углерод и водород. Алифатические соединения подразделяются на несколько химических семейств. Каждый углерод обычно образует четыре ковалентные связи. Алканы — это углеводороды, которые образуют цепи, каждое звено которых состоит из углерода. Одинарное звено — CH 4 , метан. Длина углеродной цепи увеличивается с добавлением атомов углерода. Например, структура этана:
А прототипная структура алкана:
Алканы содержат одинарную связь между каждым атомом углерода и включают простейшее органическое соединение, метан (CH 4 ) и его производные «цепи». такие как этан (C 2 H 6 ) и бутан (C 4 H 10 ).Алкены содержат по крайней мере одну двойную связь между атомами углерода. Например, 1,3-бутадиен имеет структуру CH 2 -CH-CH-CH 2 . Цифры «1» и «3» указывают положение двойных связей. Алкины содержат тройные связи между атомами углерода, простейшим из которых является этин, CH≡CH, который широко известен как ацетилен (газ, используемый сварщиками).
такие как этан (C 2 H 6 ) и бутан (C 4 H 10 ).Алкены содержат по крайней мере одну двойную связь между атомами углерода. Например, 1,3-бутадиен имеет структуру CH 2 -CH-CH-CH 2 . Цифры «1» и «3» указывают положение двойных связей. Алкины содержат тройные связи между атомами углерода, простейшим из которых является этин, CH≡CH, который широко известен как ацетилен (газ, используемый сварщиками).
Все ароматические углеводороды основаны на шестиуглеродной конфигурации бензола (C 6 H 6 ). Связь углерод-углерод в этой конфигурации имеет более одного электрона, так что структура бензола допускает резонанс между двойными и одинарными связями, т.е.е. фактические места переворота бензольных связей. Бензол — это среднее значение двух резонансных структур с одинаковым вкладом.
Термин «ароматический» происходит из наблюдения, что многие соединения, полученные из бензола, обладают сильным ароматом, например, ваниль, масло грушанки и сассафрас.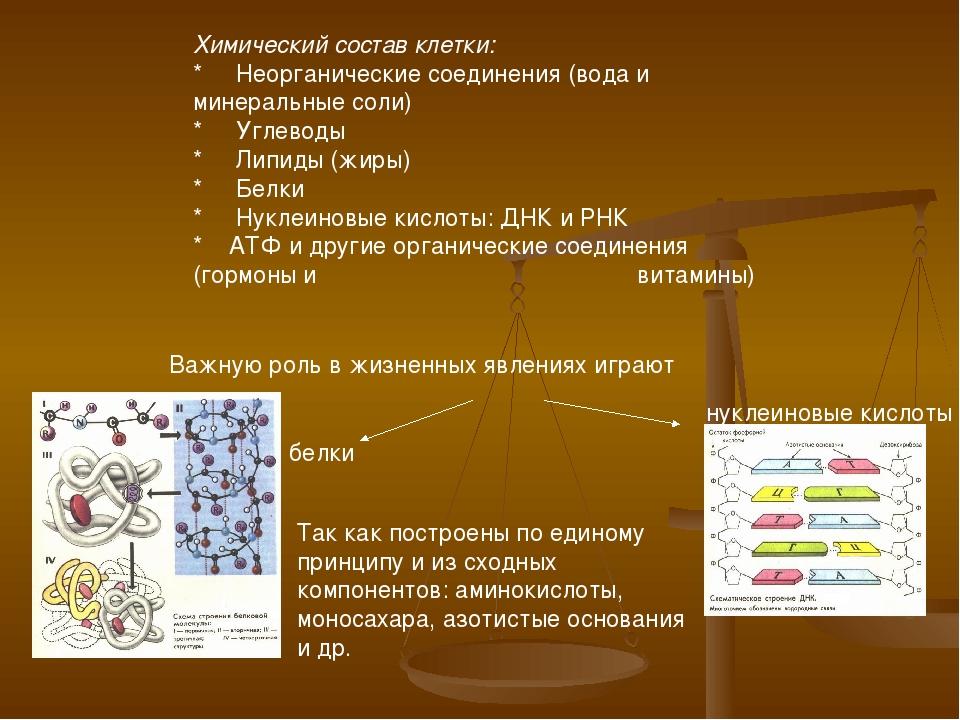 Таким образом, ароматические соединения содержат одно или несколько бензольных колец. Кольца плоские, то есть они остаются в одной геометрической плоскости как единое целое. Однако в соединениях с более чем одним кольцом, таких как высокотоксичные ПХБ, каждое кольцо является плоским, но кольца, которые связаны вместе, могут быть или не быть плоскими.На самом деле это очень важное свойство для токсичных соединений. Было показано, что некоторые планарные ароматические соединения более токсичны, чем их неплоские аналоги, возможно потому, что живые клетки могут с большей вероятностью позволить планарным соединениям связываться с ними и производить нуклеопептиды, которые приводят к биохимическим реакциям, связанным с клеточными дисфункциями, такими как как рак или эндокринные нарушения.
Таким образом, ароматические соединения содержат одно или несколько бензольных колец. Кольца плоские, то есть они остаются в одной геометрической плоскости как единое целое. Однако в соединениях с более чем одним кольцом, таких как высокотоксичные ПХБ, каждое кольцо является плоским, но кольца, которые связаны вместе, могут быть или не быть плоскими.На самом деле это очень важное свойство для токсичных соединений. Было показано, что некоторые планарные ароматические соединения более токсичны, чем их неплоские аналоги, возможно потому, что живые клетки могут с большей вероятностью позволить планарным соединениям связываться с ними и производить нуклеопептиды, которые приводят к биохимическим реакциям, связанным с клеточными дисфункциями, такими как как рак или эндокринные нарушения.
Как алифатические, так и ароматические соединения могут подвергаться замещению атомов водорода.Эти замены придают соединениям новые свойства, включая изменения растворимости, давления паров и токсичности.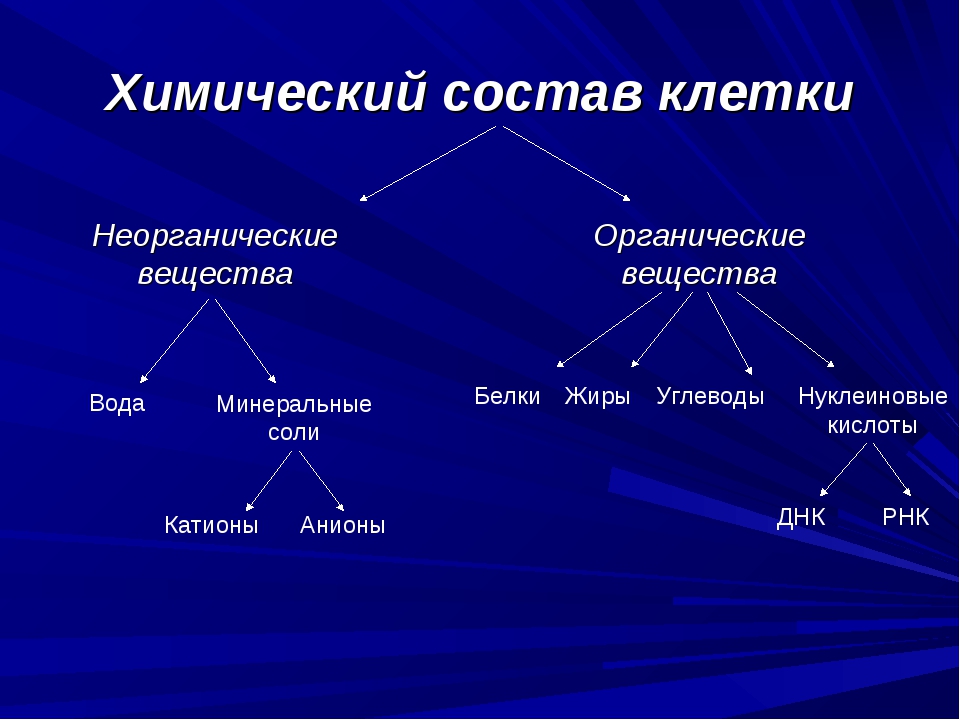 Например, галогенирование (замещение атома водорода галогеном) часто делает органическое соединение намного более токсичным. Таким образом, трихлорэтан представляет собой сильно канцерогенную жидкость, обнаруженную в источниках питьевой воды, тогда как незамещенный этан представляет собой газ с относительно низкой токсичностью. Вот почему одно из средств обработки хлорированных углеводородов и ароматических соединений включает методы дегалогенирования.
Например, галогенирование (замещение атома водорода галогеном) часто делает органическое соединение намного более токсичным. Таким образом, трихлорэтан представляет собой сильно канцерогенную жидкость, обнаруженную в источниках питьевой воды, тогда как незамещенный этан представляет собой газ с относительно низкой токсичностью. Вот почему одно из средств обработки хлорированных углеводородов и ароматических соединений включает методы дегалогенирования.
Важные функциональные группы, входящие в состав многих органических соединений, показаны в таблице 7.9.
Структуры органических соединений могут вызывать самые разные физические и химические характеристики, а также изменять биоаккумуляцию и токсичность этих соединений. Например, различия между эстрадиолом и молекулой тестостерона могут показаться небольшими, но они вызывают значительные различия в росте и воспроизводстве животных. В этих структурах можно увидеть очень тонкие различия между эстрогеном и андрогеном, женскими и мужскими гормонами соответственно. Но посмотрите на разительные различия в половых изменениях и изменениях в развитии, которые эти соединения вызывают у организмов!
Но посмотрите на разительные различия в половых изменениях и изменениях в развитии, которые эти соединения вызывают у организмов!
Приращение к простому соединению, такое как замена трех атомов водорода в молекуле этана атомами хлора, может привести к большим различиям (см. Таблицу 7.10). Замена двух или трех атомов водорода атомами хлора приводит к различиям в токсичности негалогенированной формы и хлорированной формы. То же самое и с простейшим ароматическим бензолом.Замена метильной группы на один из атомов водорода приводит к образованию толуола.
ТАБЛИЦА 7.10. Дополнительные различия в молекулярной структуре, ведущие к изменениям физико-химических свойств и опасностей
| Соединение | Физическое состояние при 25 ° C | –log P 0 растворимость в H 2 O при 25 ° C (моль л −1 ) | –логарифмическое давление пара при 25 ° C (атм) | Пределы воздействия на рабочих (частей на миллион) | Регулирующее агентство | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Метан, CH 4 | Газ | 2 . 8 8 | –2,4 | 25 | Канадская ассоциация безопасности | ||||||
| Тетрахлорметан (четыреххлористый углерод), CCl 4 | Жидкость | 2,2 | 0,8 | 2 предел кратковременного воздействия 60 мин. | Национальный институт наук о гигиене труда (NIOSH) | ||||||
| Этан, C 2 H 6 | Газ | 2,7 | –1,6 | Нет (простая администрация по борьбе с удушьем) | (Охрана труда и гигиена труда) OSHA) | ||||||
| Трихлорэтан, C 2 H Cl 3 | Жидкость | 2.0 | 1,0 | 450 STEL (15 мин) | OSHA | ||||||
| Бензол, C 6 H 6 | Жидкость | 1,6 | 0,9 | 5 STEL | OSHA | , C 6 H 6 O | Жидкость | 0,2 | 3,6 | 10 частей на миллион | OSHA |
| Толуол C 7 H 8 | Жидкость | 2,3 | . 4 4 | 150 STEL | UK Occupational & amp; Служба экологической безопасности |
Здесь можно извлечь множество уроков. Существуют неопределенности в использовании суррогатных соединений для представления целых групп химических веществ (поскольку небольшое изменение может значительно изменить молекулу). Однако это указывает на важность «зеленой химии» и вычислительной химии как инструментов для предотвращения попадания опасных химических веществ на рынок и в окружающую среду до того, как они будут произведены.Незначительные различия в молекулярной структуре могут сделать молекулы более безопасными, сохраняя при этом характеристики, которые в первую очередь делают их полезными, включая их рыночную стоимость.
ПРИМЕР ОРГАНИЧЕСКОЙ СТРУКТУРЫ 1
Если растворимость в воде 1-бутанола, 1-гексанола, 1-октанола и 1-нонанола, выраженная как –log S (в моль л -1 ), составляет 0,1, 0,9 , 2.4 и 3.1 соответственно, что это говорит вам о длине углеродных цепей и растворимости спиртов? (Помните, что это выражение растворимости — отрицательный логарифм!)
Ответ и обсуждение
Напомним, что растворимость выражается отрицательным логарифмом, поэтому удлинение углеродной цепи снижает полярность и, следовательно, растворимость в воде , поскольку «подобное растворяется как ”И вода очень полярная.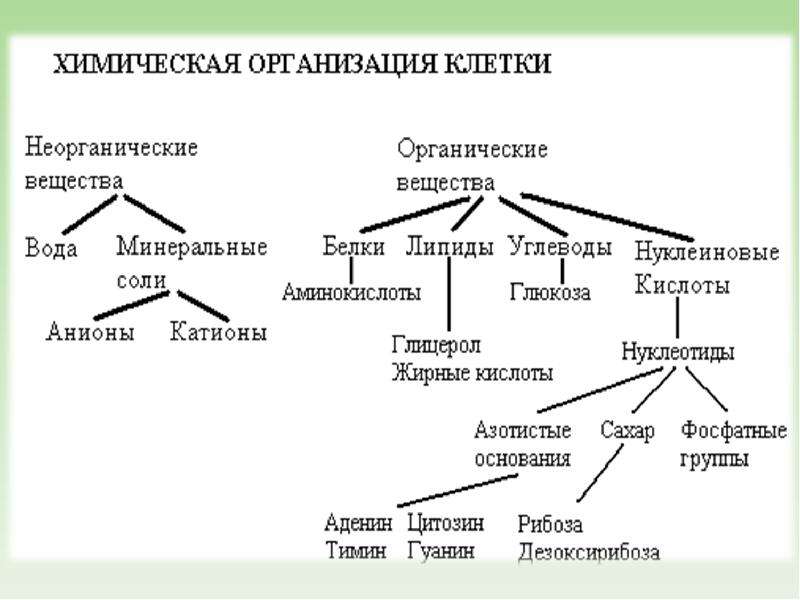 Таким образом, как показано на рис. 7.11, бутанол на несколько порядков гидрофильнее, чем нонанол.
Таким образом, как показано на рис. 7.11, бутанол на несколько порядков гидрофильнее, чем нонанол.
Рис. 7.11. Растворимость в воде четырех спиртов.
ПРИМЕР ОРГАНИЧЕСКОЙ СТРУКТУРЫ 2
Учтите полярность четырех спиртов в п. 2 выше. Если n -бутан, n -гексан, n -октан и n -нонан, растворимость в воде, выраженная как –log P 0 , составляет соответственно: 3,0, 3,8, 5,2 и 5,9 моль л -1 , какое влияние оказывает замещение атома водорода гидроксильной функциональной группой на полярность алкана? Может ли этот эффект наблюдаться и в ароматических соединениях? (Подсказка: . Сравните S для бензола, толуола и фенола в таблице в №1 выше; и вспомните, что фенол представляет собой гидроксилированный бензол.)
Ответ
Существует прямая зависимость (см. Рис. 7.12) между увеличением полярности и гидрофильности при гидроксилировании алканов в спирты. Вот почему спирты смешиваются с водой.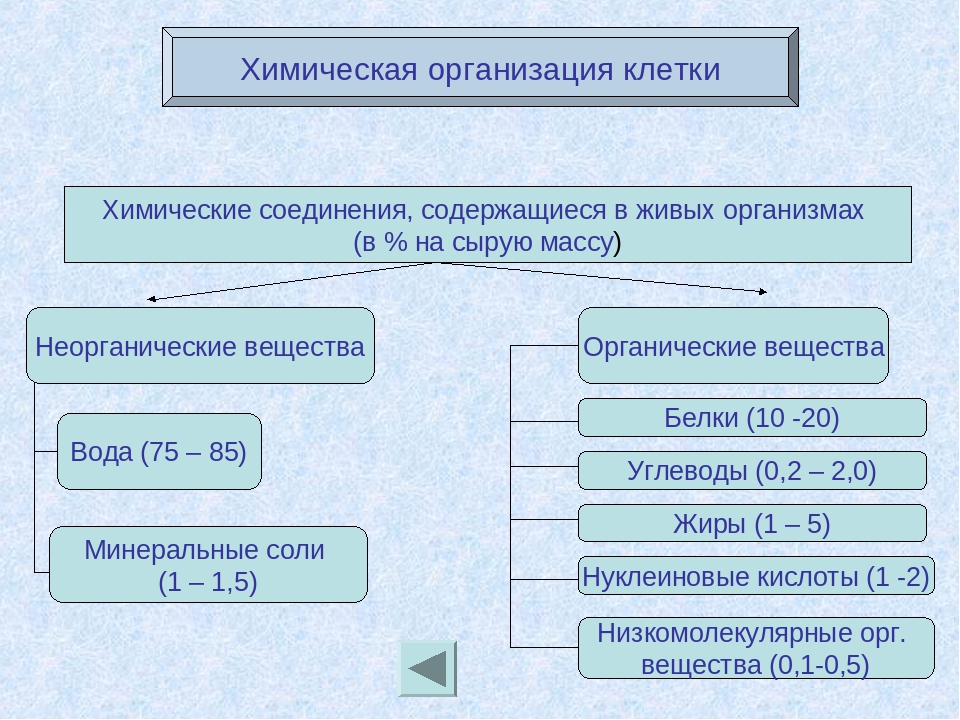 Это может быть важным фактом, особенно в процессах анаэробной обработки, когда микробы восстанавливают органические соединения и в процессе вырабатывают спирты (и, в конечном итоге, метан и воду). Гидроксилирование ароматического соединения, на что указывает сравнение растворимости бензола и фенола, также увеличивает полярность и гидрофильность.
Это может быть важным фактом, особенно в процессах анаэробной обработки, когда микробы восстанавливают органические соединения и в процессе вырабатывают спирты (и, в конечном итоге, метан и воду). Гидроксилирование ароматического соединения, на что указывает сравнение растворимости бензола и фенола, также увеличивает полярность и гидрофильность.
Рис. 7.12. Растворимость выбранных алифатических соединений в воде.
Следует отметить, что растворимость может быть изменена в системах окружающей среды с помощью соединений, известных как «поверхностно-активные вещества» (см. Рис. 7.13). Поверхностно-активные вещества могут быть очень эффективными при растворении адсорбированных гидрофобных соединений в почвах. Повышенная растворимость и дисперсность углеводородов и ароматических соединений с очень низкой растворимостью в воде улучшает десорбцию и биодоступность. К сожалению, широко применяемая группа поверхностно-активных веществ, т.е.е. Алкилфенолэтоксилаты (APE) были запрещены в Европе, потому что их продукты распада могут быть очень токсичными для водных организмов. APE вызывают особую озабоченность из-за их гормональных эффектов, особенно из-за их эстрогенности. Таким образом, необходимо помнить не только о физических и химических преимуществах таких соединений, но и о любых дополнительных рисках, которые они могут представлять. Это классический случай конкуренции между ценностями (т. Е. Более легкая и эффективная очистка по сравнению с дополнительными рисками для здоровья, связанными с очищающим химическим веществом).
APE вызывают особую озабоченность из-за их гормональных эффектов, особенно из-за их эстрогенности. Таким образом, необходимо помнить не только о физических и химических преимуществах таких соединений, но и о любых дополнительных рисках, которые они могут представлять. Это классический случай конкуренции между ценностями (т. Е. Более легкая и эффективная очистка по сравнению с дополнительными рисками для здоровья, связанными с очищающим химическим веществом).
Рис. 7.13. Структура прототипа поверхностно-активного вещества. Голова молекулы относительно полярна, а хвост относительно неполярен, поэтому в водной фазе более гидрофильные соединения будут реагировать с молекулой поверхностно-активного вещества в положении головы, в то время как более липофильные соединения будут реагировать в положении хвоста. В результате при наличии поверхностно-активных веществ в растворе будет большее количество органических соединений.
Источник : Валлеро Д., Разработка рисков опасных отходов . Баттерворт-Хайнеманн, Бостон, Массачусетс, 2003. Авторское право © 2003
Баттерворт-Хайнеманн, Бостон, Массачусетс, 2003. Авторское право © 2003 1. Изомеры
Изомеры — это соединения с идентичными химическими формулами, но разными структурами. Они очень важны в химии загрязнения воздуха, потому что даже немного отличающиеся структуры могут вызвать резкие различия в химических и физических свойствах. Таким образом, изомеры могут проявлять различное хемодинамическое поведение и различную токсичность. Например, три изомера пентана (C 5 H 12 ) показаны на рис.7.14. Разница в структуре объясняет значительные физические различия. Например, точки кипения n -пентана, изопентана и неопентана при 1 атм составляют 36,1 ° C, 27,8 ° C и 9,5 ° C соответственно. Таким образом, более низкая точка кипения неопентана означает, что этот изомер имеет более низкое давление пара, что увеличивает вероятность его попадания в атмосферу, чем два других изомера при тех же условиях окружающей среды.
Рис. 7.14. Изомеры пентана. Хотя химический состав идентичен, различное расположение молекул приводит к образованию молекул, которые проявляют очень разные физические, химические и биологические свойства.
Оптические изомеры или хиральные формы одного и того же соединения — это те, которые являются зеркальным отображением друг друга. Эти различия могут иметь значение, например, левая форма практически нетоксична и легко поддается биологическому разложению, но правая форма может быть токсичной и стойкой.
Разделение органических и неорганических соединений для конкретных приложений
Органические и неорганические соединения определяют структуру, свойства и реакции соединений.Химики в целом и химики-органики в частности могут создавать новые, никогда ранее не предложенные молекулы, которые при тщательном проектировании могут иметь важные свойства для улучшения человеческого опыта. Органические и неорганические соединения играют важную роль в таких отраслях, как производство каучука, пластмасс, топлива, фармацевтики, косметики, моющих средств, покрытий, красителей и агрохимии. Основы биохимии, биотехнологии и медицины построены на органических соединениях и их роли в жизненных процессах.Большинство современных высокотехнологичных материалов состоит, по крайней мере частично, из органических и неорганических соединений. Очевидно, что разделение органических и неорганических соединений критически важно для нашего высокого уровня жизни. В связи с этим мы решили выпустить этот спецвыпуск. Мы получили много статей для этого специального выпуска. Мы отобрали для публикации 7 лучших из них. Этот специальный выпуск содержит 5 оригинальных научных работ и 2 обзорные статьи.
Основы биохимии, биотехнологии и медицины построены на органических соединениях и их роли в жизненных процессах.Большинство современных высокотехнологичных материалов состоит, по крайней мере частично, из органических и неорганических соединений. Очевидно, что разделение органических и неорганических соединений критически важно для нашего высокого уровня жизни. В связи с этим мы решили выпустить этот спецвыпуск. Мы получили много статей для этого специального выпуска. Мы отобрали для публикации 7 лучших из них. Этот специальный выпуск содержит 5 оригинальных научных работ и 2 обзорные статьи.
Исследование Дж.-Y. Лю и др. под названием «Экспериментальные и модельные исследования по прогнозированию образования газовых гидратов» была предложена новая модель прогнозирования образования газовых гидратов на основе анализа некоторых кинетических моделей и кинетических наблюдений за процессом образования гидратов. Анализ настоящей модели показывает, что образование газового гидрата зависит не только от состава газа и содержания свободной воды, но также от температуры и давления. Благодаря контрастному эксперименту, прогнозируемый результат нового метода прогнозирования кинетики кристаллизации газовых гидратов близок к измеренному результату; это означает, что метод прогноза может точно отразить кристаллизацию гидрата.На практике различные параметры должны быть изменены в соответствии с практической ситуацией.
Благодаря контрастному эксперименту, прогнозируемый результат нового метода прогнозирования кинетики кристаллизации газовых гидратов близок к измеренному результату; это означает, что метод прогноза может точно отразить кристаллизацию гидрата.На практике различные параметры должны быть изменены в соответствии с практической ситуацией.
В другом исследовании L. Wang et al. озаглавленный «Синтез и предварительные свойства новых поли (ариловых эфиров), содержащих боковую группу β -нафталина», авторы синтезировали два новых поли (ариловых эфира), содержащих боковую группу β -нафталина, и структуры этих полимеров были определяется с помощью спектроскопии ЯМР. Эти полимеры показали хорошую термическую стабильность с высокой температурой плавления 256 ° C и 274 ° C соответственно.Они исследовали растворимость полимеров в обычных органических растворителях, таких как DMAc, DMSO, CH 2 Cl 2 и CHCl 3 , путем электропрядения в микроволокно (1–5 мкм мкм) с большим количеством нанопор (<100 мкм).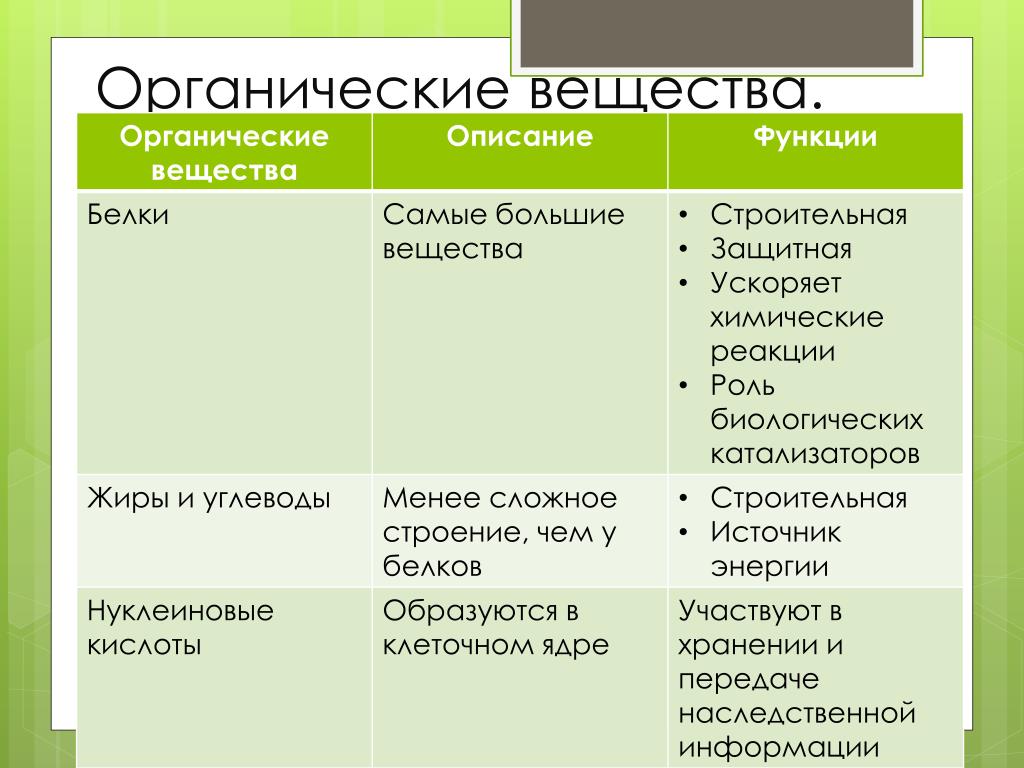 нм) из раствора CHCl 3 . Эти волокна показали высокую гидрофобность, а угол смачивания волокон превышает 120 °. В результате этого исследования эти полимеры обладали превосходной термической стабильностью и хорошей растворимостью. Волокна с множеством нанопор, полученные методом электроспиннинга, обладают высокой гидрофобностью.Полимеры потенциально могут быть использованы в качестве жаропрочных материалов, водонепроницаемых материалов и транспортных носителей.
нм) из раствора CHCl 3 . Эти волокна показали высокую гидрофобность, а угол смачивания волокон превышает 120 °. В результате этого исследования эти полимеры обладали превосходной термической стабильностью и хорошей растворимостью. Волокна с множеством нанопор, полученные методом электроспиннинга, обладают высокой гидрофобностью.Полимеры потенциально могут быть использованы в качестве жаропрочных материалов, водонепроницаемых материалов и транспортных носителей.
Еще одна ценная статья, озаглавленная «Очистка антоцианов с помощью или -дигидрокси-группировки путем сорбции в катионных смолах, заряженных Fe (III)», была опубликована A. Castañeda-Ovando et al. в этом спецвыпуске. Авторами предложен новый метод очистки антоцианов с o -дигидроксильным расположением. Этот метод основан на механизме обмена лигандов с использованием катионообменной смолы, загруженной ионами металлов, чтобы увеличить сродство смолы к антоцианину (ам) с o -дигидрокси-расположением.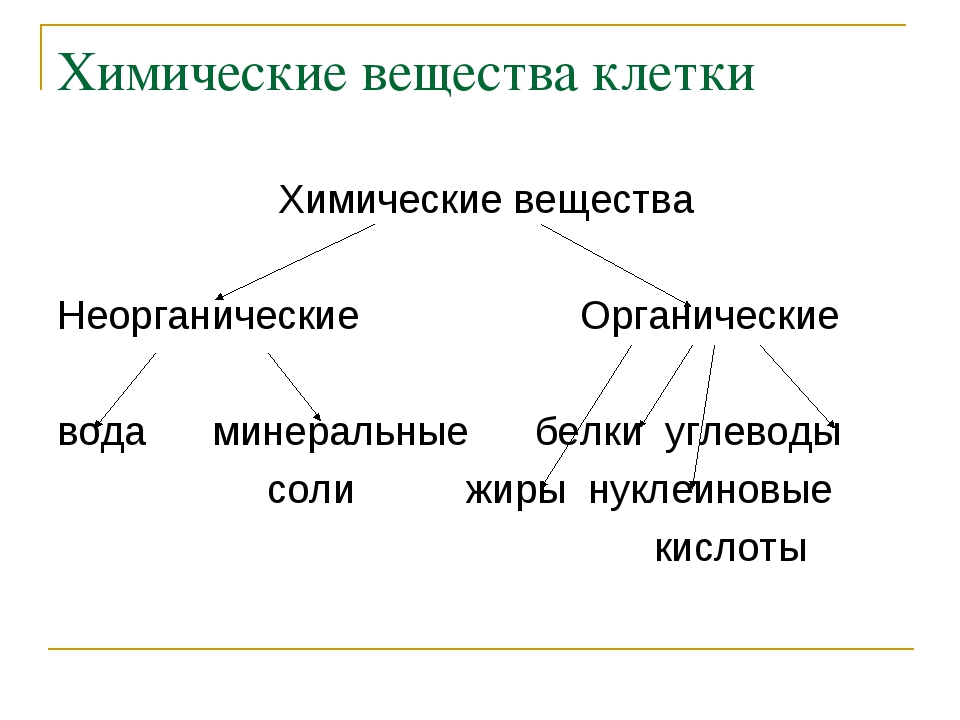 Они использовали этот метод для очистки основного антоциана (цианидин-3-глюкозид; Cy-3-glc) из антоцианового метанольного экстракта синей кукурузы. Наилучший результат сорбции показал использование Fe (III) в его ионной форме. Процедура очистки начинается с образования комплекса металл-антоцианин (Cy-3-glc-Fe), который был оптимальным при pH 5, с последующим процессом элюирования 0,1 M NaOH для удаления антоцианов без o -дигидроксигидроксигрупп, сахаров. , и органические кислоты. Наконец, чистый антоцианин получают путем добавления HCl 0.1 M, который разрушает комплекс металл-антоциан. Авторами предложен метод очистки Cy-3-глюкозида путем сорбции на катионообменной смоле, содержащей Fe3 +. Показано, что это вполне жизнеспособно для дигидроксиантоцианов o- , потому что (i) это снижает затраты на процедуру, поскольку его можно проводить за меньшее время в отличие от хроматографических методов, предложенных ранее, (ii) процент экстракции антоцианов достигнуто выше 99,99%, и (iii) можно собрать основной антоциан с высокой чистотой и проанализировать его другими спектроскопическими методами.
Они использовали этот метод для очистки основного антоциана (цианидин-3-глюкозид; Cy-3-glc) из антоцианового метанольного экстракта синей кукурузы. Наилучший результат сорбции показал использование Fe (III) в его ионной форме. Процедура очистки начинается с образования комплекса металл-антоцианин (Cy-3-glc-Fe), который был оптимальным при pH 5, с последующим процессом элюирования 0,1 M NaOH для удаления антоцианов без o -дигидроксигидроксигрупп, сахаров. , и органические кислоты. Наконец, чистый антоцианин получают путем добавления HCl 0.1 M, который разрушает комплекс металл-антоциан. Авторами предложен метод очистки Cy-3-глюкозида путем сорбции на катионообменной смоле, содержащей Fe3 +. Показано, что это вполне жизнеспособно для дигидроксиантоцианов o- , потому что (i) это снижает затраты на процедуру, поскольку его можно проводить за меньшее время в отличие от хроматографических методов, предложенных ранее, (ii) процент экстракции антоцианов достигнуто выше 99,99%, и (iii) можно собрать основной антоциан с высокой чистотой и проанализировать его другими спектроскопическими методами.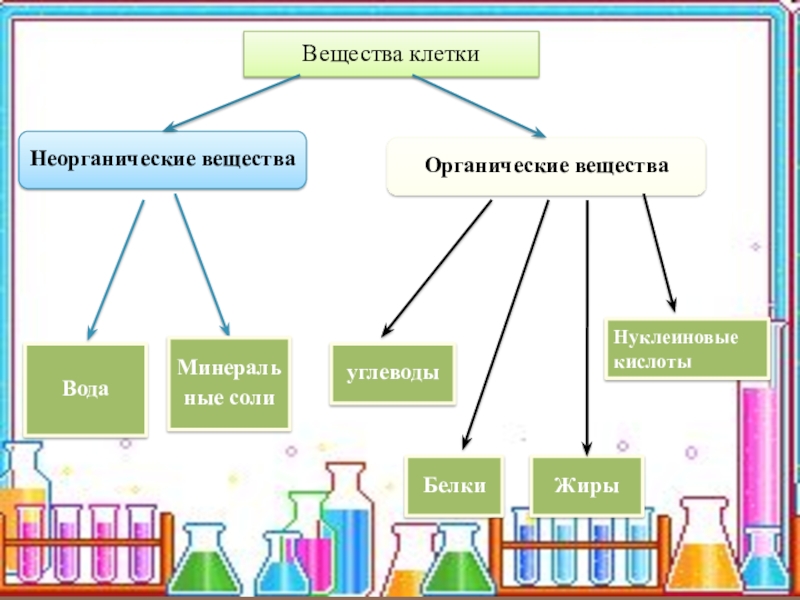
Статья A. Ioutsi et al., Озаглавленная «Послойная сборка полисахаридов и 6,10-ионена для разделения азотсодержащих фармацевтических препаратов и их энантиораспознавания с помощью капиллярного электрофореза». исследовали получение двух капилляров кремнезема, модифицированных слой за слоем 6,10-ионеном и N- (3-сульфо, 3-карбокси) -пропионилхитозаном (SCPC) и 6,10-ионеном и сульфатом декстрана (DS). Динамическое покрытие капилляра эффективно снижает адсорбцию фонового электролита, компонентов матрицы пробы и аналитов на его внутренней стенке.Такие покрытия обеспечивают хорошую воспроизводимость и чувствительность определения. Авторы демонстрируют, что разделение бета-блокаторов, блокаторов кальциевых каналов, альфа-адренергических агонистов, H2-блокаторов и диуретиков было наиболее эффективным и быстрым с капилляром, модифицированным сульфатом декстрана. Тетрагидрозолин, карбиноксамин и фурацилин, которые обычно используются для лечения аллергического ринита, были обнаружены в мочевине человека. Их концентрации, независимо подтвержденные с помощью ВЭЖХ, составили, и мкг мкг / мл -1 ; LOD = 0.07, 0,03 и 0,10 мкм г / мл -1 и LOQ = 1,0, 0,8 и 0,6 мкм г / мл -1 , соответственно. В результате этого исследования авторы сообщили об оптимальных условиях для идентификации и разделения тетрагидрозолина (альфа-адренергический агонист), карбиноксамина (h2-блокатор) и фурацилина в мочевине человека. Капилляры, модифицированные DS, также подходят для разделения других азотсодержащих соединений и их энантиомеров.
Их концентрации, независимо подтвержденные с помощью ВЭЖХ, составили, и мкг мкг / мл -1 ; LOD = 0.07, 0,03 и 0,10 мкм г / мл -1 и LOQ = 1,0, 0,8 и 0,6 мкм г / мл -1 , соответственно. В результате этого исследования авторы сообщили об оптимальных условиях для идентификации и разделения тетрагидрозолина (альфа-адренергический агонист), карбиноксамина (h2-блокатор) и фурацилина в мочевине человека. Капилляры, модифицированные DS, также подходят для разделения других азотсодержащих соединений и их энантиомеров.
Другой вклад в этот специальный выпуск озаглавлен «Анализ противогрибковых компонентов в галлах Melaphis chinensis и их влияние на борьбу с антракнозом китайской капусты, вызываемым Colletotrichumighginsianum » П.-C. Kuo et al. (из Тайваня) и предложила грибковые патогены, вызывающие различные заболевания, которые привели к высокому урожаю и снижению качества растений, представляющих коммерческий интерес, таких как фрукты, овощи и цветы. В своих предварительных экспериментальных результатах метанольные экстракты четырех видов лекарственных растений: Melaphis chinensis , Eugenia caryophyllata , Polygonum cuspidatum и Rheum officinale, обладали противогрибковой активностью по отношению к возбудителю Collegium officinale .Таким образом, это было проведено для идентификации и количественного определения химических компонентов в этих травах и для оценки противогрибкового действия этих соединений. Среди тестов индикаторное соединение метилгаллат из M. chinensis было наиболее эффективным против прорастания конидий. Кроме того, он продемонстрировал значительные эффекты контроля антракноза китайской капусты, вызванного C. Higginsianum PA-01 в камере роста. Эти результаты показывают, что M. chinensis может иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты и других крестоцветных культур.Результаты настоящего исследования показывают, что метанольные экстракты M.
В своих предварительных экспериментальных результатах метанольные экстракты четырех видов лекарственных растений: Melaphis chinensis , Eugenia caryophyllata , Polygonum cuspidatum и Rheum officinale, обладали противогрибковой активностью по отношению к возбудителю Collegium officinale .Таким образом, это было проведено для идентификации и количественного определения химических компонентов в этих травах и для оценки противогрибкового действия этих соединений. Среди тестов индикаторное соединение метилгаллат из M. chinensis было наиболее эффективным против прорастания конидий. Кроме того, он продемонстрировал значительные эффекты контроля антракноза китайской капусты, вызванного C. Higginsianum PA-01 в камере роста. Эти результаты показывают, что M. chinensis может иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты и других крестоцветных культур.Результаты настоящего исследования показывают, что метанольные экстракты M. chinensis, E. caryophyllata , P. cuspidatum и R. officinale могут иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты. и другие крестоцветные культуры. Разработанные аналитические методы ВЭЖХ являются удобными и доступными инструментами для идентификации видов и оценки качества растительного сырья. Для разработки новых ботанических пестицидов полезно следить за содержанием активных компонентов в травах.Согласно экспериментальным данным настоящего исследования, метилгаллат показал только 1/80 активности пестицида азоксистробина; однако экстракты трав будут более безопасными и менее опасными для экосистемы. Эти традиционные китайские лекарства могут быть дополнительно изучены на предмет их цитотоксичности и синергетического действия различных комбинаций. Было бы также возможно изучить противогрибковый механизм в будущем.
chinensis, E. caryophyllata , P. cuspidatum и R. officinale могут иметь потенциал для дальнейшей разработки пестицидов растительного происхождения для борьбы с антракнозом капусты. и другие крестоцветные культуры. Разработанные аналитические методы ВЭЖХ являются удобными и доступными инструментами для идентификации видов и оценки качества растительного сырья. Для разработки новых ботанических пестицидов полезно следить за содержанием активных компонентов в травах.Согласно экспериментальным данным настоящего исследования, метилгаллат показал только 1/80 активности пестицида азоксистробина; однако экстракты трав будут более безопасными и менее опасными для экосистемы. Эти традиционные китайские лекарства могут быть дополнительно изучены на предмет их цитотоксичности и синергетического действия различных комбинаций. Было бы также возможно изучить противогрибковый механизм в будущем.
Обзорная статья М. Доловы и А. Пика под названием «Хроматографические методы разделения длинноцепочечных моно- и полиненасыщенных жирных кислот. В этом обзоре представлены различные хроматографические системы, ТСХ, ВЭЖХ, ГХ, а также SFC, разработанные для идентификации и точного количественного определения длинноцепочечных моно- и полиненасыщенных жирных кислот из различных образцов с акцентом на избранную литературу, опубликованную за последнее десятилетие. Обсуждались почти все аспекты, такие как стадия предварительного разделения жирных кислот (до цис — и транс -), стационарная фаза, система растворителей и режим обнаружения. Этот обзор литературы, посвященный применению хроматографических методов, таких как ТСХ, ВЭЖХ, ГХ, а также SFC, для анализа моно- и полиненасыщенных жирных кислот (MUFA и PUFA) в различных матрицах, показывает, что все представленные хроматографические методы методы подходят для предварительного разделения и количественного определения этих соединений.Выбор хроматографических систем зависит от типа анализируемой пробы и от цели хроматографического анализа (проблема, которую следует решить с помощью этого метода).
В этом обзоре представлены различные хроматографические системы, ТСХ, ВЭЖХ, ГХ, а также SFC, разработанные для идентификации и точного количественного определения длинноцепочечных моно- и полиненасыщенных жирных кислот из различных образцов с акцентом на избранную литературу, опубликованную за последнее десятилетие. Обсуждались почти все аспекты, такие как стадия предварительного разделения жирных кислот (до цис — и транс -), стационарная фаза, система растворителей и режим обнаружения. Этот обзор литературы, посвященный применению хроматографических методов, таких как ТСХ, ВЭЖХ, ГХ, а также SFC, для анализа моно- и полиненасыщенных жирных кислот (MUFA и PUFA) в различных матрицах, показывает, что все представленные хроматографические методы методы подходят для предварительного разделения и количественного определения этих соединений.Выбор хроматографических систем зависит от типа анализируемой пробы и от цели хроматографического анализа (проблема, которую следует решить с помощью этого метода). На мгновение, чтобы получить полное фракционирование «транс- / цис-» жирных кислот из различных образцов, используется традиционная Ag-ТСХ или ВЭЖХ с аргентацией (Ag-ВЭЖХ). Колоночная хроматография, такая как ГХ и ВЭЖХ, может использоваться на дальнейших этапах хроматографического анализа ненасыщенных жирных кислот (MUFA и PUFA), особенно для определения количества разделенных жирных кислот.В случае геометрических изомеров ( цис, — и транс, -) и определения количества и положения двойных связей, присутствующих в исследуемых ненасыщенных жирных кислотах, популярны Ag-HPLC и различные системы ГХ. Текущая литература указывает, что инновации, которые внедряются в хроматографические системы, включают модифицированные стационарные фазы, новые дериватизирующие агенты для жирных кислот, а также разработку новых систем обнаружения, позволяющих проводить чувствительный и воспроизводимый анализ жирных кислот из сложных образцов.Более того, новые хроматографические системы в сочетании с другими инструментальными методами, такими как МС, МС / МС, ИК или двумерная ГХ, позволяют анализировать большое количество МНЖК и ПНЖК в меньших количествах, что требуется, например, при анализе пищевых продуктов.
На мгновение, чтобы получить полное фракционирование «транс- / цис-» жирных кислот из различных образцов, используется традиционная Ag-ТСХ или ВЭЖХ с аргентацией (Ag-ВЭЖХ). Колоночная хроматография, такая как ГХ и ВЭЖХ, может использоваться на дальнейших этапах хроматографического анализа ненасыщенных жирных кислот (MUFA и PUFA), особенно для определения количества разделенных жирных кислот.В случае геометрических изомеров ( цис, — и транс, -) и определения количества и положения двойных связей, присутствующих в исследуемых ненасыщенных жирных кислотах, популярны Ag-HPLC и различные системы ГХ. Текущая литература указывает, что инновации, которые внедряются в хроматографические системы, включают модифицированные стационарные фазы, новые дериватизирующие агенты для жирных кислот, а также разработку новых систем обнаружения, позволяющих проводить чувствительный и воспроизводимый анализ жирных кислот из сложных образцов.Более того, новые хроматографические системы в сочетании с другими инструментальными методами, такими как МС, МС / МС, ИК или двумерная ГХ, позволяют анализировать большое количество МНЖК и ПНЖК в меньших количествах, что требуется, например, при анализе пищевых продуктов. . Результаты, представленные в этой статье, подтверждают, что хроматографические методы по-прежнему являются мощным инструментом для анализа моно- и полиненасыщенных жирных кислот.
. Результаты, представленные в этой статье, подтверждают, что хроматографические методы по-прежнему являются мощным инструментом для анализа моно- и полиненасыщенных жирных кислот.
Последний обзор — обзорная статья в этом специальном выпуске; это от D. Datta et al., и он озаглавлен «Статус реактивной экстракции как метода разделения». В этой обзорной статье представлен современный обзор реактивного извлечения карбоновых кислот из ферментационных бульонов. В этой статье основное внимание уделяется реактивному извлечению, которое, как оказалось, является подходящим вариантом по сравнению с надлежащими методами извлечения. Были представлены механизмы родственных вторичных, третичных и четвертичных аминов и их реакции с карбоновыми кислотами (моно-, ди- и три-). Имеется сводка экспериментальных данных моделирования и их кинетических исследований.
Мы искренне надеемся, что такая серия ежегодных выпусков будет иметь долгосрочное влияние и за короткое время сможет собрать вокруг себя сообщество, во многом так же, как успешная ежегодная конференция.
Благодарности
Во-первых, мы выражаем искреннюю благодарность и признательность редакционной коллегии Journal of Chemistry за включение нашего специального выпуска в качестве ежегодного. Мы также хотели бы поблагодарить авторов этого специального выпуска за их научно обоснованные исследования / обзорные статьи.С большим удовольствием и уважением мы выражаем нашу благодарность рецензентам за критическую оценку каждой статьи, их конструктивную критику и своевременную реакцию, которая сделала возможным выпуск этого специального выпуска.
Хасан Услу
Драгомир Янков
Кайлас Л. Васевар
Саид Азизян
Наджиб Уллах
Вакар Ахмад
Неорганические вещества — очистка сточных вод
Несколько неорганических компонентов являются общими как для сточных, так и для природных вод и играют важную роль в установлении и контроле качества воды.Неорганическая нагрузка в воде является результатом сброса очищенных и неочищенных сточных вод, различных геологических образований и неорганических веществ, оставшихся в воде после испарения.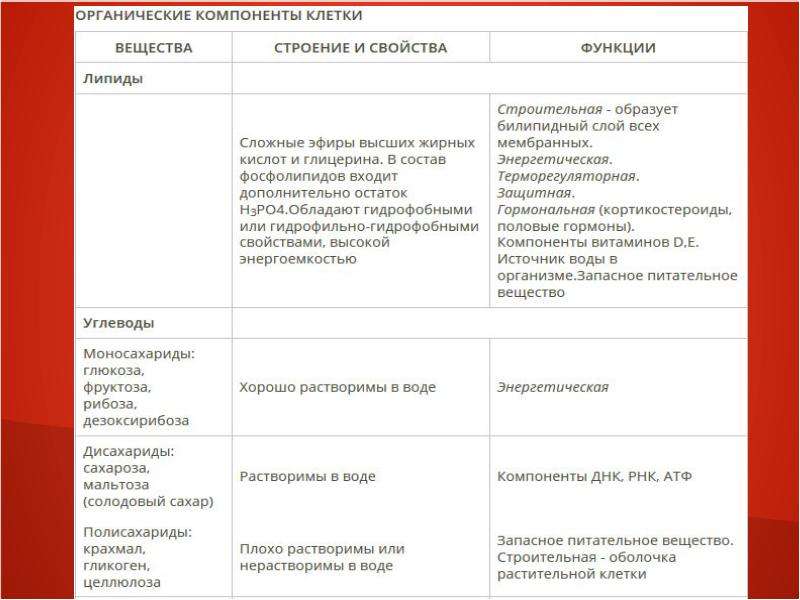 Природные воды растворяют горные породы и минералы, с которыми они соприкасаются. Как уже упоминалось, многие из неорганических компонентов, содержащихся в природных водах, также содержатся в сточных водах. Многие из этих компонентов добавляются человеком. Эти неорганические компоненты включают pH, хлориды, щелочность, азот, фосфор, серу, токсичные неорганические соединения и тяжелые металлы.
Природные воды растворяют горные породы и минералы, с которыми они соприкасаются. Как уже упоминалось, многие из неорганических компонентов, содержащихся в природных водах, также содержатся в сточных водах. Многие из этих компонентов добавляются человеком. Эти неорганические компоненты включают pH, хлориды, щелочность, азот, фосфор, серу, токсичные неорганические соединения и тяжелые металлы.
Когда рассматривается pH воды или сточных вод, мы просто имеем в виду концентрацию ионов водорода. Кислотность или концентрация ионов водорода запускает многие химические реакции в живых организмах. Значение pH 7 соответствует нейтральному состоянию. Низкое значение pH (менее 5) указывает на кислую среду; высокий pH (более 9) указывает на щелочные условия. Многие биологические процессы, такие как размножение, не могут функционировать в кислой или щелочной воде. Кислые условия также усугубляют проблемы токсического загрязнения, поскольку отложения выделяют токсичные вещества в кислых водах.
Многие важные свойства сточных вод обусловлены присутствием слабых кислот, оснований и их солей. Процесс очистки сточных вод состоит из нескольких различных единичных процессов (они обсуждаются позже). Можно с уверенностью сказать, что дезинфекция является одним из наиболее важных единичных процессов в общем процессе очистки сточных вод. pH влияет на дезинфекцию. Это особенно верно в отношении дезинфекции с использованием хлора; например, с увеличением pH увеличивается время контакта, необходимое для дезинфекции с использованием хлора.Общие источники кислотности включают шахтные дренажи, сток из хвостов шахт и атмосферные осадки.
Хлорид в форме иона Cl- является одним из основных неорганических компонентов воды и сточных вод. Источники хлоридов в природных водах включают: (1) выщелачивание хлоридов из горных пород и почв; (2) в прибрежных районах — вторжение соленой воды; (3) сельскохозяйственные, промышленные, бытовые и бытовые сточные воды; и (4) проникновение грунтовых вод в канализацию, прилегающую к соленой воде. Соленый вкус, вызываемый концентрацией хлоридов в питьевой воде, варьируется и зависит от химического состава воды.В сточных водах концентрация хлоридов выше, чем в сырой воде, потому что хлорид натрия (соль) является обычной частью рациона и проходит через пищеварительную систему в неизменном виде. Поскольку обычные методы обработки отходов не удаляют хлориды в какой-либо значительной степени, более высокие, чем обычно, концентрации хлоридов можно рассматривать как показатель того, что водоем используется для удаления отходов (Metcalf & Eddy, 2003).
Соленый вкус, вызываемый концентрацией хлоридов в питьевой воде, варьируется и зависит от химического состава воды.В сточных водах концентрация хлоридов выше, чем в сырой воде, потому что хлорид натрия (соль) является обычной частью рациона и проходит через пищеварительную систему в неизменном виде. Поскольку обычные методы обработки отходов не удаляют хлориды в какой-либо значительной степени, более высокие, чем обычно, концентрации хлоридов можно рассматривать как показатель того, что водоем используется для удаления отходов (Metcalf & Eddy, 2003).
Как упоминалось ранее, щелочность — это мера буферной способности воды, а в сточных водах помогает противостоять изменениям pH, вызванным добавлением кислот.Щелочность вызывается химическими соединениями, растворенными из почвы и геологических образований, и в основном из-за присутствия гидроксильных и бикарбонатных ионов. Эти соединения в основном представляют собой карбонаты и бикарбонаты кальция, калия, магния и натрия. Сточные воды обычно щелочные. Щелочность важна при очистке сточных вод, потому что анаэробное сбраживание требует достаточной щелочности, чтобы pH не упал ниже 6,2; если щелочность действительно упадет ниже этого уровня, метановые бактерии не смогут функционировать.Чтобы процесс пищеварения проходил успешно, щелочность должна составлять от 1000 до 5000 мг / л в виде карбоната кальция. Щелочность сточных вод также важна при химической очистке, биологическом удалении питательных веществ и всякий раз, когда аммиак удаляется воздушной десорбцией.
Щелочность важна при очистке сточных вод, потому что анаэробное сбраживание требует достаточной щелочности, чтобы pH не упал ниже 6,2; если щелочность действительно упадет ниже этого уровня, метановые бактерии не смогут функционировать.Чтобы процесс пищеварения проходил успешно, щелочность должна составлять от 1000 до 5000 мг / л в виде карбоната кальция. Щелочность сточных вод также важна при химической очистке, биологическом удалении питательных веществ и всякий раз, когда аммиак удаляется воздушной десорбцией.
В бытовых сточных водах «соединения азота возникают в результате биологического разложения белков и мочевины, выделяемой с отходами организма» (Peavy et al. 1987). При очистке сточных вод биологическая очистка не может осуществляться, если азот в той или иной форме не присутствует.Азот должен присутствовать в форме органического азота (N), аммиака (Nh4), нитрита (NO2) или нитрата (NO3). Органический азот включает такие природные компоненты, как пептиды, белки, мочевину, нуклеиновые кислоты и многочисленные синтетические органические материалы. Аммиак естественным образом присутствует в сточных водах. Его получают в основном путем деаэрации органических азотсодержащих соединений и гидролиза мочевины. Нитрит, промежуточная степень окисления азота, может попадать в водную систему благодаря его использованию в качестве ингибитора коррозии в промышленных применениях.Нитрат образуется в результате окисления аммиака.
Аммиак естественным образом присутствует в сточных водах. Его получают в основном путем деаэрации органических азотсодержащих соединений и гидролиза мочевины. Нитрит, промежуточная степень окисления азота, может попадать в водную систему благодаря его использованию в качестве ингибитора коррозии в промышленных применениях.Нитрат образуется в результате окисления аммиака.
Данные по азоту необходимы для оценки способности очистки сточных вод биологическими процессами. Если азота нет в достаточном количестве, может потребоваться добавить его в отходы, чтобы сделать их пригодными для обработки. По завершении процесса очистки важно определить, сколько азота содержится в сточных водах. Это важно, потому что сброс азота в водоприемники может стимулировать рост водорослей и водных растений.Они, конечно, вызывают большую потребность в кислороде в ночное время, что отрицательно сказывается на водных организмах и отрицательно сказывается на полезном использовании водных ресурсов.
Фосфор (P) — это макроэлемент, который необходим всем живым клеткам и повсеместно присутствует в сточных водах.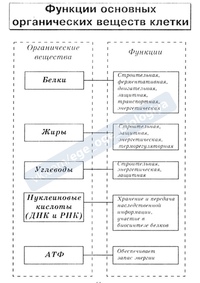 Он в основном присутствует в форме фосфатов, солей фосфорной кислоты. Городские сточные воды могут содержать от 10 до 20 мг / л фосфора в виде P, большая часть которого поступает из фосфатных компонентов в моющих средствах.Из-за вредоносного цветения водорослей, происходящего в поверхностных водах, существует большой интерес к контролю за количеством соединений фосфора, попадающих в поверхностные воды со сбросами бытовых и промышленных отходов и естественными стоками. Это особенно характерно для США, где около 15% населения сбрасывает сточные воды в озера, что приводит к эвтрофикации этих водоемов. Эвтрофикация приводит к значительным изменениям качества воды. Снижение поступления фосфора в водоприемники может решить эту проблему.
Он в основном присутствует в форме фосфатов, солей фосфорной кислоты. Городские сточные воды могут содержать от 10 до 20 мг / л фосфора в виде P, большая часть которого поступает из фосфатных компонентов в моющих средствах.Из-за вредоносного цветения водорослей, происходящего в поверхностных водах, существует большой интерес к контролю за количеством соединений фосфора, попадающих в поверхностные воды со сбросами бытовых и промышленных отходов и естественными стоками. Это особенно характерно для США, где около 15% населения сбрасывает сточные воды в озера, что приводит к эвтрофикации этих водоемов. Эвтрофикация приводит к значительным изменениям качества воды. Снижение поступления фосфора в водоприемники может решить эту проблему.
Сера (S) требуется для синтеза белков и высвобождается при их распаде. Сульфат-ион естественным образом встречается в большинстве систем водоснабжения, а также присутствует в сточных водах. Сульфат биологически восстанавливается до сульфида, который, в свою очередь, может соединяться с водородом с образованием сероводорода (h3S). h3S токсичен для животных и растений; более того, в определенных концентрациях h3S является смертельным токсином. h3S в системах перехватчиков может вызвать сильную коррозию труб и принадлежностей
h3S токсичен для животных и растений; более того, в определенных концентрациях h3S является смертельным токсином. h3S в системах перехватчиков может вызвать сильную коррозию труб и принадлежностей
Токсичные неорганические соединения, такие как медь, свинец, серебро, мышьяк, бор и хром, классифицируются как приоритетные загрязнители и токсичны для микроорганизмов.Таким образом, они должны приниматься во внимание при разработке и функционировании процесса биологической очистки. При введении в процесс обработки эти загрязнители могут убить микроорганизмы, необходимые для обработки, и, таким образом, остановить процесс обработки.
Тяжелые металлы являются основными токсикантами, обнаруженными в промышленных сточных водах; они могут отрицательно повлиять на биологическую очистку сточных вод. Ртуть, свинец, кадмий, цинк, хром и плутоний относятся к так называемым тяжелым металлам с высокой атомной массой.(Следует отметить, что термин «тяжелые металлы» довольно свободный и используется некоторыми как включающий мышьяк, бериллий и селен, которые на самом деле не являются металлами и их лучше назвать токсичными металлами. ) Присутствие любого из этих металлов в чрезмерных количествах. будут мешать многим полезным видам использования воды из-за своей токсичности. Городские стоки являются основным источником свинца и цинка во многих водоемах. (Примечание: свинец — токсичный металл, вредный для здоровья человека; безопасного уровня воздействия свинца не существует.Подсчитано, что до 20% общего воздействия свинца на детей может быть связано с водным путем с потреблением загрязненной воды.) Свинец поступает из выхлопных газов автомобилей, использующих этилированный бензин, тогда как цинк возникает в результате износа шин.
) Присутствие любого из этих металлов в чрезмерных количествах. будут мешать многим полезным видам использования воды из-за своей токсичности. Городские стоки являются основным источником свинца и цинка во многих водоемах. (Примечание: свинец — токсичный металл, вредный для здоровья человека; безопасного уровня воздействия свинца не существует.Подсчитано, что до 20% общего воздействия свинца на детей может быть связано с водным путем с потреблением загрязненной воды.) Свинец поступает из выхлопных газов автомобилей, использующих этилированный бензин, тогда как цинк возникает в результате износа шин.
Читать далее: Биологические характеристики сточных вод
Была ли эта статья полезной?
Важность неорганической химии для современного мира
Неорганическая химия не является изолированным разделом химии.Эта основная наука полностью интегрирована с другими областями химии, такими как органическая, физическая и аналитическая химия. Он занимается химией всех неорганических соединений и в основном включает химию металлов и особенно переходных металлов. Эти элементы играют решающую роль в промышленных каталитических процессах, которые необходимы для производства веществ и новых материалов со скоростью, намного превышающей скорость естественных химических реакций. Такие каталитические процессы могут происходить в растворе (гомогенный катализ) или на поверхности твердых материалов (гетерогенный катализ) и обычно включают элементы переходных металлов.
Он занимается химией всех неорганических соединений и в основном включает химию металлов и особенно переходных металлов. Эти элементы играют решающую роль в промышленных каталитических процессах, которые необходимы для производства веществ и новых материалов со скоростью, намного превышающей скорость естественных химических реакций. Такие каталитические процессы могут происходить в растворе (гомогенный катализ) или на поверхности твердых материалов (гетерогенный катализ) и обычно включают элементы переходных металлов.
Однако такие элементы также играют решающую роль в биологических процессах (так называемая биоинорганическая химия), где металлоферменты могут активировать небольшие молекулы, такие как O 2 , H 2 O 2 , NO, H 2 , CO и CO 2 , которые затем действуют как реагенты переноса кислорода, участвуют в процессах гидратации, действуют как молекулы-посредники или образуют важные компоненты окислительно-восстановительной биологии. Кроме того, на основе такой каталитической реактивности были разработаны многие металло-лекарства для лечения рака, артрита, рассеянного склероза и других аутоиммунных заболеваний.
Кроме того, на основе такой каталитической реактивности были разработаны многие металло-лекарства для лечения рака, артрита, рассеянного склероза и других аутоиммунных заболеваний.
Например, противоопухолевый препарат цисплатин, цис — [Pt (NH 3 ) 2 (Cl) 2 ] 2+ , уже был разработан в шестидесятых годах. Между тем, известно, что он медленно образует цис- — [Pt (NH 3 ) 2 (H 2 O) Cl] + , который может связываться с основаниями ДНК в клетке и вызывают апоптоз раковых клеток. Также в области химии атмосферы катализаторы на основе переходных металлов успешно используются для очистки газовых выбросов от угольных электростанций, для селективного каталитического восстановления (технология SCR) NO x в выхлопных газах легковых и грузовых автомобилей, а также для загрязнения, вызываемого отоплением углем низкого качества в зимнее время.
Огромной проблемой для химиков-неоргаников является стремление оптимизировать существующие и разрабатывать новые технологии, которые улучшат характеристики катализаторов с целью экономии энергии и обеспечения устойчивого развития.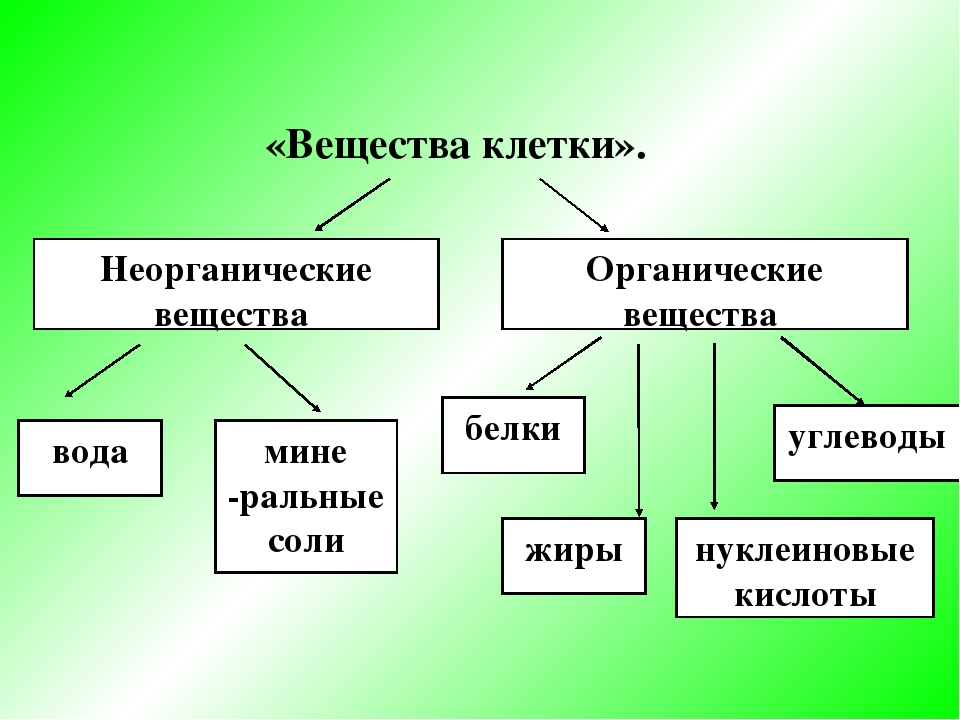 В этом отношении выяснение основных механизмов реакции для понимания лежащих в основе химических процессов, имеющих промышленное, экологическое или биологическое значение, имеет первостепенное значение для всего мира, чтобы противостоять угрожающим изменениям климата и серьезному загрязнению в густонаселенных районах. города.Здесь неорганическая химия действительно может повлиять на качество жизни и благополучие растущего населения мира.
В этом отношении выяснение основных механизмов реакции для понимания лежащих в основе химических процессов, имеющих промышленное, экологическое или биологическое значение, имеет первостепенное значение для всего мира, чтобы противостоять угрожающим изменениям климата и серьезному загрязнению в густонаселенных районах. города.Здесь неорганическая химия действительно может повлиять на качество жизни и благополучие растущего населения мира.
В серии « достижений в неорганической химии, » за последние 14 лет были опубликованы тематические выпуски, в которых основное внимание уделялось последним достижениям в конкретных областях неорганической химии в качестве услуги сообществу неорганической химии в частности и сообществу химиков в целом. Выбранные темы для этих тематических выпусков действительно охватывают широкий круг тем и предполагают участие экспертов в этих областях.
Автор: Руди ван Элдик , редактор, Достижения в неорганической химии
Вот несколько примеров тем, охваченных тематическими выпусками:
Том 64: Механизмы неорганических / биоорганических реакций (2012)
Том 65: Гомогенный катализ (2013)
Том 66: CO 2 Химия (2014)
Том 67: NO x Родственная химия (2015)
Том 68: Выводы из визуализации в биоинорганической химии (2016)
Другие недавние издания, посвященные этой теме:
Фотонные и электронные свойства фторидных материалов (2015)
Описательная неорганическая химия, 3e (2015)
Основы координационной химии, упрощенный подход (2015)
Моя жизнь в золотой век химии (2014)
Все вышеперечисленные и многие другие книги доступны в магазине Elsevier — используйте код скидки STC215 при оформлении заказа и сэкономьте до 30%!
1. | КРАТКОЕ ОПИСАНИЕ И ВЫВОДЫ |
| 1.1. | Важнейшие материалы по трем критериям |
| 1.1. | Неорганические элементы и соединения, наиболее востребованные на растущих рынках новой электроники и электрики в ближайшее десятилетие |
| 1.1. | Описание и изображения 37 семейств новой электроники и электрики |
| 1.2. | Идентифицированы 20 категорий химических и физических свойств, используемых ключевыми материалами в устройствах |
| 1.2. | Количество новых семейств устройств, использующих элементарный или слаболегированный алюминий, медь, золото, кремний и серебро, включая% 37 проанализированных семейств устройств и типичную функциональную форму в ближайшее десятилетие |
| 1.2. | Репозиция химических гигантов на благо |
| 1.2.1. | Itochu and partners |
| 1.2.2. | BASF и партнеры |
1. 2.3. 2.3. | Доу и другие |
| 1.3. | Необходимость снижения рисков |
| 1.3. | Анионы или металлы в наиболее популярных неорганических соединениях в новой электронике по количеству семейств устройств, в которых они используются, и процентному соотношению из 37 семейств устройств (для составов с несколькими металлами существует перекрытие). Основной функционал |
| 1.3. | Четыре семейства углеродных аллотропов, необходимых в новой электронике и электрике |
| 1.4. | Органические материалы, используемые и исследованные для 37 семейств новой электроники и электрики |
| 1.4. | Распространенность аллотропов углерода, которые наиболее широко используются, по крайней мере, экспериментально, для 37 типов новой электроники и электрики, придающих функциональную форму и% и количество обследованных устройств |
| 1.4. | Наиболее широко используемые соединения |
1. 4.1. 4.1. | Проанализировано много примеров |
| 1.4.2. | Возможное будущее химии железа |
| 1.5. | Самые универсальные электронные соединения |
| 1.5. | Семейства органических соединений, которые наиболее широко используются или исследуются для новой электроники, в% от образца и количество семейств устройств, использующих их |
| 1.5. | 138 производителей и предполагаемых производителей литиевых аккумуляторных батарей с указанием страны, химического состава катода и анода, формы электролита, корпуса, целевых областей применения, торговых отношений и успехов по veh |
| 1.6. | Примеры относительно менее распространенных или менее известных рецептур, чем те, которые были исследованы ранее |
| 1.6. | Изображения поперечного сечения SEM (a, b) и BSEM (c) катализатора Pt / TaOx на электроде GC |
| 1.6. | Подрывная новая электроника и электрика — тяга на рынок |
1. 7. 7. | Мелкие металлы и полупроводники, которые будут наиболее широко использоваться — результат опроса |
| 1.8. | Наиболее востребованные тонкие неорганические соединения — результаты обследования |
| 1.9. | Неорганические соединения — подробные результаты для 37 семейств устройств |
| 1.10. | Наиболее востребованные аллотропы углерода — результат исследования |
| 1.11. | Наиболее востребованные тонкие органические соединения — результаты обследования |
| 1.12. | Результаты исследования солей лития на крупнейшем рынке аккумуляторов |
| 1.13. | Менее распространенные или менее распространенные составы |
| 1.13.1. | Катализатор на основе оксида тантала для топливных элементов с полимерным электролитом |
| 1.13.2. | Химия вольфрама: новые применения |
1. 14. 14. | Структурная электроника |
| 1.15. | Структура двойной спирали, обнаруженная в неорганическом материале — ноябрь 2016 г. |
| 2. | ВВЕДЕНИЕ |
| 2.1. | Атакующие элементы |
| 2.1. | Некоторые из наиболее многообещающих элементов, используемых в исследованиях и производстве новой электроники и электрики — гораздо более широкие, чем сегодня, и далеко от кремния |
| 2.1. | Примеры неорганических материалов, необходимых для печатной электроники и ее поставщиков. |
| 2.2. | Сравнение более сложных неорганических и органических материалов, используемых в печатной и потенциально печатной электронике |
| 2.2. | Возрастающий потенциал прогресса в области печати и создания многослойных электрических и электронных устройств |
| 2.2. | Сюда входят композиты и смеси |
2. 3. 3. | Несопоставимые ценностные предложения |
| 2.3. | Признаки и проблемы неорганической, гибридной и органической тонкопленочной электроники образуют спектр |
| 2.3. | Типичные материалы с квантовыми точками от Evident Technologies и их возможное применение. |
| 2.4. | Сравнение ведущих фотоэлектрических технологий |
| 2.4. | Вероятное влияние неорганических печатных и потенциально печатных технологий на 2020 год — доминирующая технология по устройствам и элементам. Темно-зеленый показывает, где неорганические технологии чрезвычайно важны для активных (нелинейных) компонентов. S |
| 2.4. | А вот и печать |
| 2.5. | Большая ширина |
| 2.5. | Массовое производство гибких тонкопленочных электронных устройств с использованием технологий трех поколений |
| 2.6. | Варианты стратегии для химических компаний, стремящихся занять значительную долю рынка печатной электроники, с примерами. |
| 2.6. | Хрупкие химические вещества |
| 2.7. | Проблемы при составлении чернил |
| 2.7. | Металлический межблочный элемент и антенны на печатной батарее из диоксида марганца и цинка BlueSpark, поддерживающей встроенную антенну и межкомпонентные соединения |
| 2.8. | Размер компании не проблема |
| 2.9. | Неопределенности |
| 2.10. | Неорганические и органические |
| 2.11. | Препятствия |
| 2.12. | Фотогальваника |
| 2.13. | Примеры деятельности компании |
| 2.13.1. | Dow Chemical |
| 2.13.2. | Merck, DuPont и Honeywell |
| 2.13.3. | Байер |
| 2.14. | Progress with Semiconductors |
| 2.15. | Печатная и многослойная электроника и электрика требуют новых правил проектирования |
2. 16. 16. | Метаматериалы, нанотенны и мемристоры |
| 2.17. | Набор инструментов становится большим |
| 2.17.1. | Трехмерный |
| 2.17.2. | Использование интеллектуальных подложек |
| 2.17.3. | Планируемые приложения могут иметь большую площадь |
| 2.17.4. | Здоровье и окружающая среда на первый план |
| 2.17.5. | Три поколения? |
| 3. | НАИБОЛЕЕ ВАЖНЫЕ УСТРОЙСТВА И ИХ ТРЕБОВАНИЯ |
| 3.1. | Кондуктивная диаграмма направленности: антенны, электроды, межкомпонентные соединения, метаматериалы |
| 3.1. | Метаматериал с отрицательным показателем преломления искривляет электромагнитное излучение «неправильным» образом |
| 3.1. | Основные химические вещества и материалы для формирования токопроводящего рисунка: антенны, электроды, межкомпонентные соединения, метаматериалы |
3. 1.1. 1.1. | Серебряные чешуйчатые чернила продолжают доминировать в печати |
| 3.1.2. | Доля увеличения альтернативы |
| 3.1.3. | Замена ITO |
| 3.1.4. | 2D карбид титана |
| 3.1.5. | Для RFID-меток |
| 3.1.6. | Для логики и памяти |
| 3.1.7. | Для датчиков |
| 3.1.8. | Для умной упаковки |
| 3.1.9. | Для мемристоров |
| 3.2. | CIGS Photovoltaics |
| 3.2. | Обзор продукта проводящей печатной электроники |
| 3.2. | Разделенный кольцевой резонатор и решетка микропроводов, которые образуют материал с отрицательным показателем преломления при печати вместе с правильными размерами |
| 3.2.1. | Краткое описание технологии |
| 3.3. | DSSC Photovoltaics |
3. 3. 3. | Схематическое изображение тонкопленочного солнечного элемента CIGS |
| 3.3. | Преимущества и недостатки электрофоретических дисплеев |
| 3.3.1. | Краткое описание технологии |
| 3.4. | Электрофоретические дисплеи и альтернативы |
| 3.4. | Сравнение различных параметров OLED и E-Ink |
| 3.4. | Принцип действия электрофоретических дисплеев |
| 3.4.1. | Краткое описание технологии |
| 3.4.2. | Приложения дисплеев электронной бумаги |
| 3.4.3. | Чернила E |
| 3.4.4. | Приложение-убийца |
| 3.4.5. | SiPix, Тайвань |
| 3.4.6. | Альтернативы — электросмачивание |
| 3.5. | Неорганический светодиод |
| 3.5. | Отображение электронной бумаги в журнале, проданном в США в октябре 2008 г. |
| 3.5. | 138 производителей и предполагаемых производителей литиевых аккумуляторных батарей с указанием страны, химического состава катода и анода, формы электролита, корпуса, целевых областей применения, торговых отношений и успехов по veh |
| 3.6. | Некоторые материалы необходимы для низкомолекулярных OLED по сравнению с полимерными. |
| 3.6. | Этикетки на краях полок для розничной торговли от UPM |
| 3.6. | Литий-ионная аккумуляторная батарея |
| 3.7. | Перезаряжаемый литий / литий-металлический аккумулятор и топливный элемент PEM |
| 3.7. | Дополнительный дисплей мобильного телефона |
| 3.7. | Организации, работающие с сенсорными экранами |
| 3.8. | Идентифицированы 20 категорий химических и физических свойств, используемых ключевыми материалами в устройствах |
3. 8. 8. | Amazon Kindle 2, запущенный в США в феврале 2009 г. |
| 3.8. | MEMS и NEMS |
| 3.9. | OLED-дисплеи и освещение на органических светодиодах |
| 3.9. | Электрофоретическое отображение на коммерческой финансовой карте |
| 3.9. | Четыре семейства углеродных аллотропов, необходимых в новой электронике и электрике |
| 3.10. | Органические материалы, используемые и исследованные для 37 семейств новой электроники и электрики |
| 3.10. | Блок-схема производственного процесса |
| 3.10. | Силовые полупроводники |
| 3.11. | Суперконденсатор |
| 3.11. | Процесс печати светодиодов |
| 3.11.1. | Вид развертывания устройств на основе графена |
| 3.12. | Супер аккумулятор |
3.12. | OLED-структура, показывающая левую технологию на основе вакуума |
| 3.13. | Примеры светоизлучающих и дырочных молекул OLED |
| 3.13. | Сенсорный экран |
| 3.13.1. | Main Touch Technologies |
| 3.13.2. | Ведущие рыночные приложения |
| 3.13.3. | ITO Альтернативы сенсорным экранам |
| 3.13.4. | Более 100 профильных организаций |
| 3.13.5. | Транзистор, диод, термистор, тиристор для электроники |
| 3.13.6. | Химия вольфрама: новые применения |
| 3.14. | Структурная электроника |
| 3.14. | Функции в составе OLED с небольшими молекулами, обычно получаемого с помощью вакуумной обработки |
| 3.15. | Иллюстрация того, что активная матрица OLED AMOLED намного проще, чем AMLCD, которую она заменяет.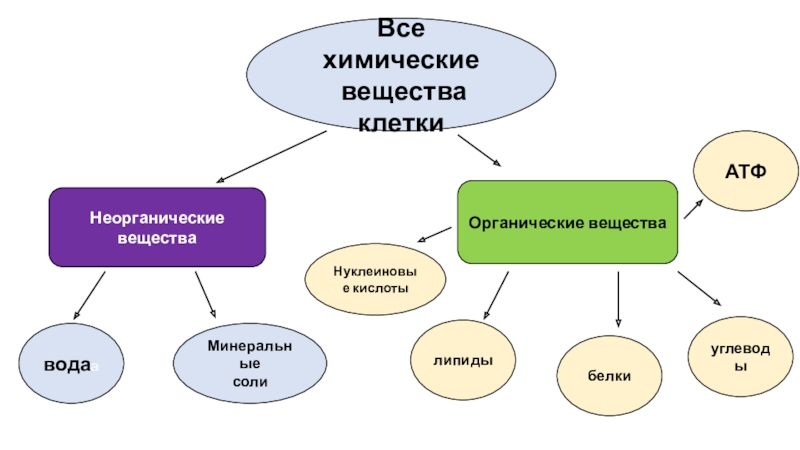 |
| 3.15. | Прочие интересующие устройства |
| 3.16. | Новые форматы материалов приведут к новым устройствам |
| 3.16. | Семейства силовых полупроводников |
| 3.17. | Последние силовые полупроводники по частоте использования |
| 3.18. | Вид внедрения графена в современные электрические и электронные компоненты |
| 3.19. | Прогноз рынка Touch по технологиям в 2012 году |
| 3.20. | Проводимость в омах на квадрат для различных пригодных для печати проводящих материалов при типичной используемой толщине по сравнению с массивным металлом, где нанотрубки относятся к карбюратору на нанотрубке или графену |
| 4. | УГЛЕРОДНЫЕ НАНОТРУБКИ И ГРАФЕН |
| Углеродные нанотрубки | |
| 4.1. | Структура одностенных углеродных нанотрубок |
4. 1. 1. | Полупроводники |
| 4.2. | Деятельность 113 организаций |
| 4.2. | Хиральный вектор представлен парой индексов (n, m). T обозначает ось трубки, а a1 и a2 — единичные векторы графена в реальном пространстве |
| 4.2. | Графен |
| 4.2.1. | Графен может снизить вес аккумуляторов для электромобилей |
| 4.3. | Графен — самый тонкий материал в мире, выделенный в Манчестерском университете |
| 4.3. | Обзор углеродных нанотрубок и графена |
| 4.4. | 113 профильных организаций |
| 4.4. | Целевое применение углеродных нанотрубок Eikos |
| 5. | ИНДИОВЫЕ СОЕДИНЕНИЯ В НОВОЙ ЭЛЕКТРОНИКЕ И ЭЛЕКТРИКЕ |
| 5.1. | Больше, чем история ИТО |
| 5.2. | Введите новые светоизлучающие устройства |
5. 3. 3. | Квантовые точки и полевые транзисторы |
| 5.4. | Стоимость и возможность печати — проблемы |
| 5.5. | Оксидный полупроводник с новым элементным составом |
| 6. | СОЕДИНЕНИЯ ТИТАНА В НОВОЙ ЭЛЕКТРОНИКЕ |
| 6.1. | Пьезоэлектрики, сборщики энергии, суперконденсаторы, дисплеи и датчики |
| 6.2. | Фотокатализ на смежные темы |
| 7. | ЦИНКОВЫЕ СОЕДИНЕНИЯ ДЛЯ НОВОЙ ЭЛЕКТРОНИКИ |
| 7.1. | Диэлектрик для изоляции, конденсаторов и других устройств |
| 7.1. | Нанопроволока из оксида цинка |
| 7.2. | СЭМ-изображение выровненного по вертикали нановолокна ZnO, легированного Ga |
| 7.2. | Повышение эффективности УФ-светодиодов |
| 8. | СОЕДИНЕНИЯ ФТОРА ДЛЯ НОВОЙ ЭЛЕКТРОНИКИ И ЭЛЕКТРИКИ |
8. 1. 1. | «Литий аккумуляторный», фториды щелочных металлов и прочие химические соединения фтора |
| 8.1. | Технологии сбора энергии по выделенной мощности |
| 8.2. | Материалы, используемые в наиболее перспективных трибоэлектрических демонстраторах для уборки урожая |
| 8.2. | Фторполимер для обработки OFET на основе раствора |
| 8.3. | Другие новые применения фторполимеров в 2015-6 |
| 8.3. | Аморфный фторполимер CYTOP |
| 8.4. | Вращающийся 40-миллиметровый электретный комбайн для сбора энергии |
| ТАБЛИЦЫ | |
| ЦИФРЫ |
(PDF) Роль неорганических соединений в пребиотическом синтезе органических соединений в пребиотических молекулах. Современная органическая химия, 2005, т. 9, No. 10 997
[53] Hirschmann, R .; Dewey, R.S .; Шеневальдт, Э.F .; Джошуа, H .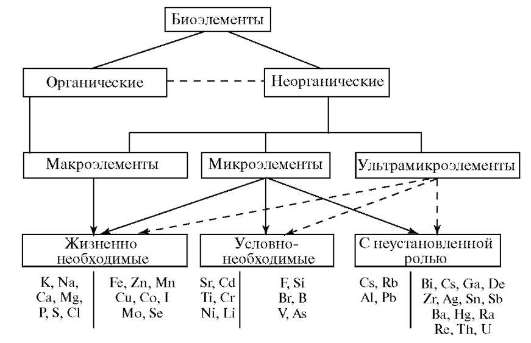 ;
;
Paleveda, W, J .; Schwam, H .; Barkemeyer, H .; Arison, B.H .; Вебер,
Д.Ф. J. Org. Chem., 1971, 36, 49-59.
[54] Leman, L .; Оргель, Л .; Гадири, М.Р. Наука, 2004, 306, 283-286.
[55] Orgel, L.E .; Истоки. Жизнь. Evol. Биосфера, 1998, 28, 227-234.
[56] Hill, A.R .; Bohler, C .; Оргель, Л. Истоки. Жизнь. Evol. Биосфера,
1998, 28, 235-243.
[57] Buningh, W.C. Патент США 1970, 3, 507, 613.
[58] Biron, J.П.; Паскаль, Р. Дж. Ам. Chem. Soc., 2004, 126, 9198-9199.
[59] Miyakawa, S .; Yamanashi, H .; Кобаяши, К .; Cleaves, H.J .;
Miller, S.L. Proc. Natl. Акад. Sci. США, 2002, 99, 14628-14631.
[60] Sleep, N.H .; Zahnle, K. J. Geophys. Рес., 2001, 106, 1373–1399.
[61] DiSanti, M.A .; Mumma, M.J .; Делло Руссо Н; Magee-Sauer, K .;
Новак, Р .; Реттиг, T. W. Nature, 1999, 399, 662–665.
[62] Merlivat, L .; Пино Ф .; Джавой, М. Планета Земля.Sci. Lett., 1987,
84, 100-108.
[63] Ацетогенез .; Дрейк, H.L. Ed. Чапмен и Холл: Нью-Йорк, 1994.
Метаногенез.
[64] Ферри, J.G. Эд. Chapman & Hall: New York, 1993.
[65] Hu, Z.G .; Спенглер, штат Нью-Джерси; Андерсон, M.E .; Ся, J.Q. Ludden, P.W .;
Lindahl, P.A .; Mu1nck E. J. Am. Chem. Soc., 1996, 118, 830-845.
[66] Abelson, P.H. Proc. Natl. Акад. Sci. США, 1966, 55, 1365–1372.
[67] Кобаяси К.; Tsuchiya, M.; Oshima, T.; Yanagawa, H. Origins.
Life. Evol. Biosphere, 1990, 20, 99-109.
[68] Hirose, Y.; Ohmuro, K.; Saigoh, M.; Nakayama, T.; Yamagata, Y.
Origins. Life. Evol. Biosphere, 1991, 20, 471-481.
[69] Takahashi, J.; Hosokawa, T.; Masuda, H.; Kaneko, T.; Kobayashi,
K.; Saito, T.; Utsumi, Y. Appl. Phys. Lett., 1999, 74, 877-879.
[70] Miyakawa, S.; Murasawa, K.; Kobayahi, K.; Sawaoka, A.B. J. Am.
Chem.Soc., 1999, 121, 8144-8145.
[71] Miyakawa, S.; Murasawa, K.I.; Kobayashi, K.; Sawaoka, A.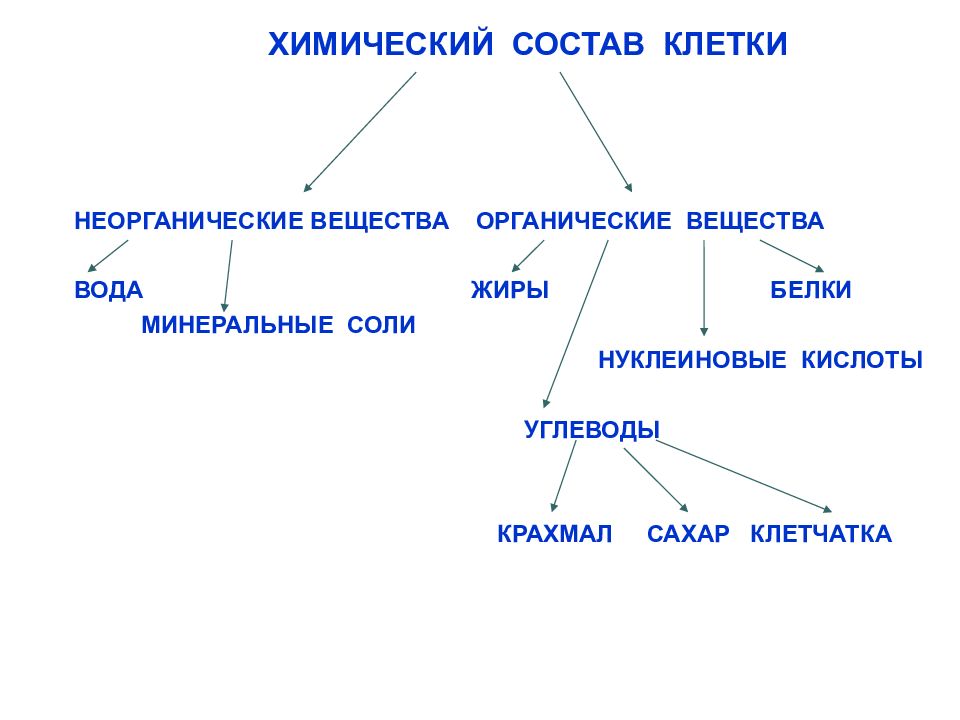 B.
B.
Origins. Life. Evol. Biosphere, 2000, 30, 557-566.
[72] Yamanashi, H.; Takeda, S.; Murasawa, K.; Miyakawa, S.; Kaneko,
T.; Kobayashi, K. Anal. Sci., 2001, 17, 1639–1642.
[73] Kobayashi, K.; Masuda, H.; Ushio, K.; Ohashi, A.; Yamanashi, H.;
Kaneko, T.; Takahashi, J.; Hosokawa, T.; Hashimoto, H.; Saito, T.
Adv. Space Res., 2001, 27, 207–215.
[74] Holleman, A.F .; Wiberg, E. Lehrbuch der Anorganischen Chemie
(de Gruyter, Berlin, 1985), стр. 1126–1152.
[75] Gmelins, Handbuch der Anorganischen Chemie, Syst.Nr.59, Fe,
Tl.A (Verlag Chimie, Берлин, 1929–1933), стр. 62, 63 и 160.
[76] Huber, C .; Wächtershäuser, G. Science, 1997, 276, 245-247.
[77] Cody, G.D .; Boctor, N.Z .; Filley, T.R .; Hazen, R.M .; Scott, J.H .;
Sharma, A .; Йодер, Х.S. Jr. Science, 2000, 289, 1337–1340.
[78] Delano, J.W .; Истоки. Жизнь. Evol. Биосфера, 2001, 31, 311-341.
[79] Уокер, J. C.G. Истоки. Жизнь. Evol. Биосфера, 1985, 16, 117-127.
C.G. Истоки. Жизнь. Evol. Биосфера, 1985, 16, 117-127.
[80] Schlesinger, G .; Миллер, С. Л. Дж. Мол. Evol., 1983, 19, 376–382.
[81] Miyakawa, S .; Tamura, H .; Sawaoka, A.B .; Kobayashi, K. Appl.
Phys. Lett., 1998, 72, 990–992.
[82] Miyakawa, S .; Кобаяши, К .; Саваока, А. Adv. Space Res.,
1999, 24, 465–468.
[83] Ponnamperuma, C .; Lemmon, R.M .; Mariner, R .; Calvin, M. Proc.
Нац. Акад. Sci. США, 1963, 49, 737–740.
[84] Levine, J.S .; Augustsson, T.R .; Натараджан, М. Истоки. Жизнь. Evol.
Биосфера, 1982, 12, 245–259.
[85] Miller, S.L. Science, 1953, 117, 528-529.
[86] Rode, B.M. Пептиды, 1999, 20, 773-786.
[87] Yanagawa, H .; Кобаяси, К. Истоки. Жизнь. Evol. Биосфера, 1992,
22, 147–159.
[88] Робертсон, М.П.; Миллер, С. Nature, 1995, 375, 772-774.
[89] Nelson, K.E .; Леви, М .; Миллер, С. Proc. Natl. Акад. Sci. США,
2000, 97, 3868-3871.
[90] Schlesinger, G . ; Миллер, С. Л. Дж. Мол. Evol., 1983, 19, 383–390.
; Миллер, С. Л. Дж. Мол. Evol., 1983, 19, 383–390.
[91] Scattergood, T.W .; McKay, C.P .; Borucki, W.J .; Giver, L.P .;
Ghyseghem, H.V .; Parris, J.E .; Миллер, С. Икар, 1989, 81,
413–428.
[92] Zahnle, K.J. J. Geophys. Res., 1986, 91, 2819–2834.
[93] Санчес Р.А .; Ferris, J.P .; Оргель, Л. J. Mol. Биол., 1967, 30,
223–253.
[94] Oró, J. Biochem. Биофиз. Res. Commun., 1960, 2, 407–412.
[95] Levy, M .; Miller, S.L .; Oró, J. J. Mol. Evol., 1999, 49, 165–168.
[96] Voet, A.B .; Шварц, А. Истоки. Жизнь. Evol. Биосфера, 1982,
12, 45–49.
[97] Lowe, C.U .; Rees, M.W .; Маркхэм, Р. Природа, 1963, 199,
219–222.
[98] Ferris, J.P .; Joshi, P.C .; Edelson, E.H .; Лоулесс, Дж.G. J. Mol. Evol.,
1978, 11, 293–311.
[99] Arrhenius, T .; Arrhenius, G .; Паплавский, В. Истоки. Жизнь. Evol.
Биосфера, 1994, 24, 1–17.
[100] Miller, S.L .; Оргель, Л. 1974, Истоки жизни на Земле,
Prentice-Hall, Inc. , Нью-Джерси.
, Нью-Джерси.
[101] Miyakawa, S .; Cleaves, H.J .; Миллер, С. Истоки. Жизнь. Evol.
Биосфера, 2002, 32, 195–208.
[102] Miyakawa, S .; Cleaves H.J .; Миллер, С. Истоки. Жизнь.Evol.
Биосфера, 2002, 32, 209-218
[103] Зенкевич, В.А .; Карпов, И. Вулканол. Seismol., 1991, 3, 19.
[104] Bray, C.J .; Эдвард, Т. J. Geochem. Explor., 1991, 42, 167-193.
[105] Ni, S .; Бун, Д. Биогеохим. Global Change Sel. Пап. Int.
Симп. Environ. Биогеохим. 10th, 1991 (1993), pp. 796. 32.
[106] Tanimoto, Y .; Bak, F. Appl. Environ. Microbiol., 1994, 60, 2450-
2455.
[107] Лахав Н. Биогенез: теории происхождения жизни Oxford Univ.
Press, New York, 1999.
[108] Bonner, W.A. Origins Life Evol. Биосф, 1991, 21, 59–111.
[109] Сагательян А.; Йокобаяси Ю. Soltani, K .; Гадири, M.R.A
Nature, 2001, 409, 797–801.
[110] Бернал, Дж. Д. (1951) Физическая основа жизни. Рутледж и Кеган
Paul Ltd.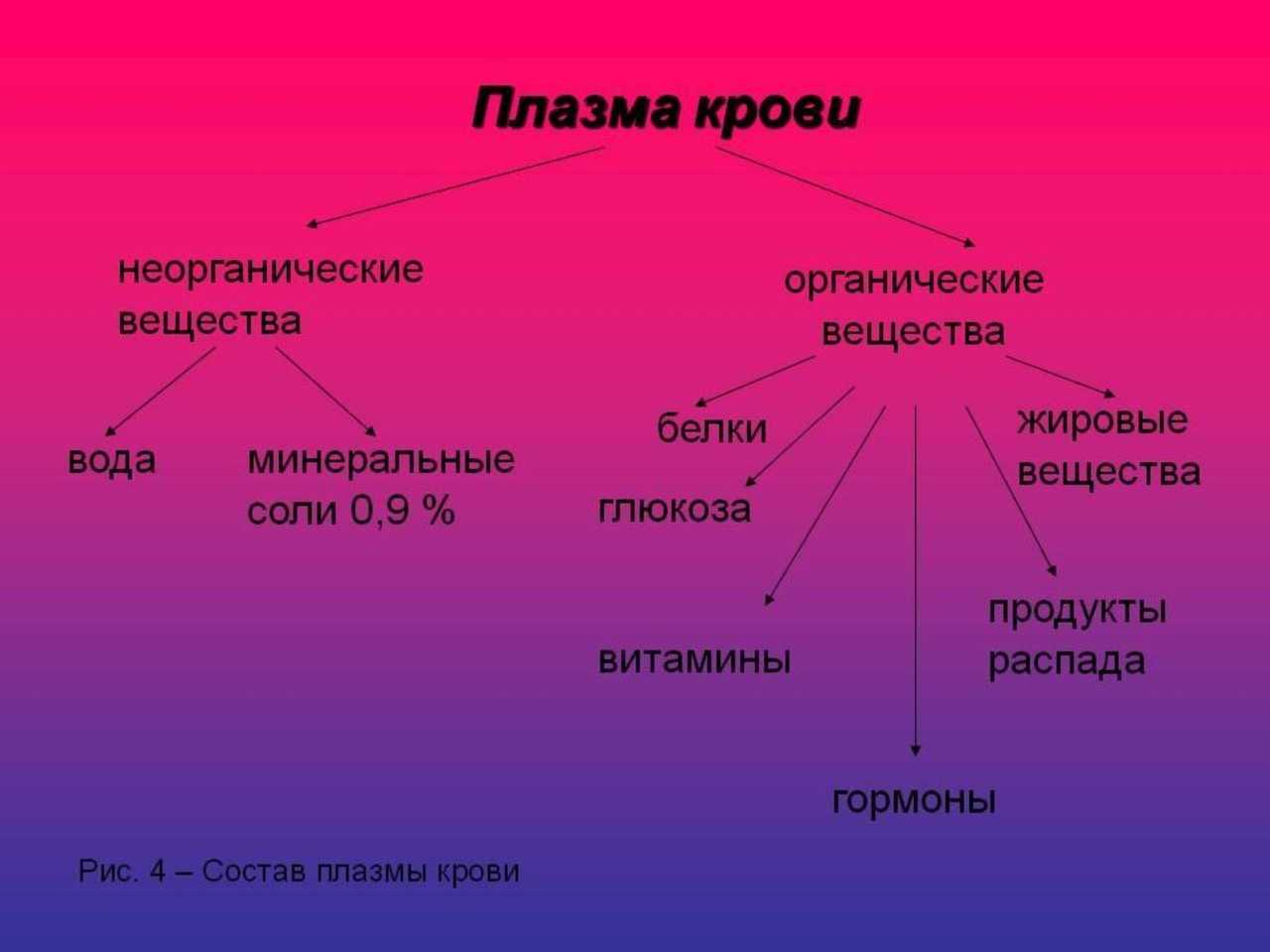 , Лондон.
, Лондон.
[111] Zaia, D.A.M. Аминокислоты, 2004, 27, 113-118.
[112] Klapper, M.H. Биохим. Биофиз. Res. Comm., 1977, 78,
1018–1024.
[113] Басюк В.А. (2002) Адсорбция биомолекул на кремнеземе. В:
Энциклопедия поверхностных и коллоидных наук. Пониссерил, С. Эд .;
Marcel Dekker Inc., Нью-Йорк, стр. 277.
[114] Cody, A.M .; Cody, R.D. J. Cryst. Рост., 1991, 113, 508–519.
[115] Orme, C.A .; Ной, А .; Wierzbicki, A .; McBride, M.T .; Grantham,
M .; Teng, H.H .; Dove, P.M .; ДеЙорео. J.J. Природа, 2001, 411,
775–779.
[116] Bailey, J .; Хризостому, А.; Hough, J.H .; Gledhill, T.M .; McCall,
A .; Clark, M.F .; Тамура, М. Science, 1998, 281, 672-674.
[117] Hazen, R.M .; Filley, T.R .; Добрый друг, Г.А. Proc. Natl. Акад. Sci.
США, 2001, 98, 5487–5490.
[118] Hitz, T .; Луизи, П. Helv. Чим. Acta., 2002, 85, 3975–3983.
[119] Hitz, T.H .; Луизи, П. Истоки. Жизнь.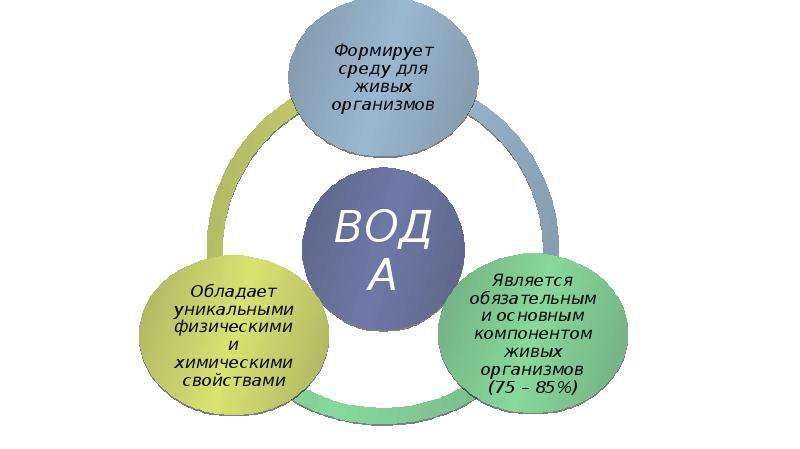 Evol. Биосфера, 2004, 34,
Evol. Биосфера, 2004, 34,
93–110.
[120] Дана, E.D. (1958) Учебник минералогии, переработанный и дополненный
Форд В.E. (Wiley, New York), 4-е изд., Стр. 125.
[121] Ferris, J.P .; Hill, A.R .; Liu, R.H .; Оргель, Л. Природа, 1996, 381,
59–61.
[122] Замараев К.И .; Романников, В.Н .; Salganik, R.I .; Wlassoff,
W.A .; Храмцов, В. В. Истоки. Жизнь. Evol. Биосфера, 1997, 27,
325–337.
[123] Hill, A.R .; Оргель, Л. Истоки. Жизнь. Evol. Биосфера, 1999. 29.
115–122.
[124] Bujdak, J .; Файбикова, К .; Eder, A .; Юнъяй, Ю.; Роде, Б.
Истоки. Жизнь. Evol. Биосфера, 1995, 25, 431-441.
[125] Bujdak, J .; Роде, Б. J. Mol. Evol., 1997, 45, 457-466.
[126] Bujdak, J .; Слосыарикова, Х .; Texler, N .; Schwendinger, M .; Роде,
Б.М. Monatshefte Fur Chemie, 1994, 125, 1033-1039.
[127] Cohen, A.E .; Махадеван, Л. Proc. Natl. Акад. Sci. США, 2003 г.,
100, 12141–12146.
[128] Tsang, S.C .; Дэвис, Дж. Дж .; Грин, M.L.H .; Hill, H.A.O .; Leung, Y.C .;
Сэдлер П.J. J. Chem. Soc. Chem. Commun., 1995, 17, 1803–1804.
[129] Davis, J.J .; Грин, M.L.H .; Hill, H.A.O .; Leung, Y.C .; Сэдлер, П.Дж .;
Sloan, J .; Xavier, A.V .; Цанг, S.C. Inorg. Чим. Acta., 1997, 272,
261-266.
[130] Chen, R.J .; Bangsaruntip, S .; Drouvalakis, K.A .; Kim, N.W.S .;
Прокладка, M .; Li, Y .; Kim, W .; Utz, P.J .; Dai, H. Proc. Natl. Акад. Sci.
США, 2003 г., 100, 4984-4989.
[131] Gooding, J.J .; Wibowo, R .; Лю, Дж.; Yang, W .; Losic, D .; Орбоны,
с .; Mearns, F.J .; Shapter, J.G .; Хибберт, Д. Варенье. Chem. Soc.,
2003, 125, 9006-9007.
[132] Li, J .; Ng, H.T .; Cassell, A .; Fan, W .; Chen, H .; Ye, Q .; Koehne,
J .; Han, J .; Meyyappan, M. Nano. Lett., 2003, 3, 597-602.
[133] Wong, S.S .; Йоселевич, Э .; Woolley, A.T .; Cheung, C.C .; Либер,
C.M. Nature, 1998, 394, 52-55.

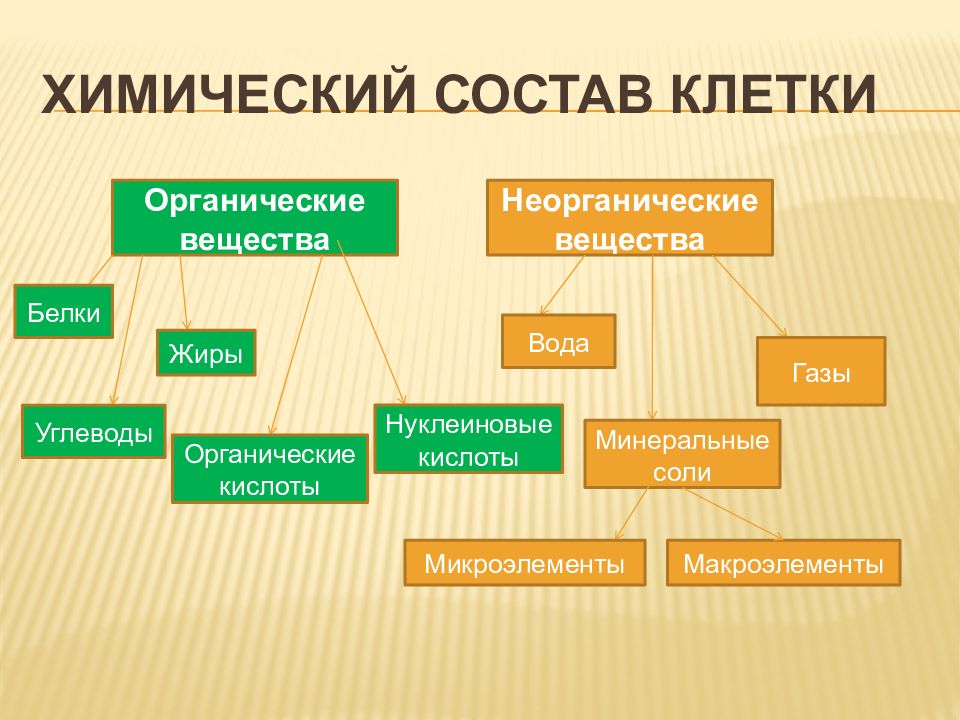 2.2. Трудовая функция / КонсультантПлюс
2.2. Трудовая функция / КонсультантПлюс