Аминокислоты. Состав аминокислот. Химические свойства аминокислот
Состав аминокислот
Аминокислоты — это производные углеводородов. В состав аминокислот входят молекулы, у которых есть два вида функциональных групп: карбоксильная группа, имеющая кислотные свойства и аминогруппа, обладающая основными свойствами этого вещества.
Состав аминокислот можно выразить формулой: NH2-R-COOH.
Примерами аминокислот могут быть:
- Аминоуксусная NH2-СH2-COOH
- Аминопропионовая NH2-СH2-СH2-COOH
- Аминокапроновая NH2-(СH2)5-COOH
- Аминоэнантовая NH2-(СH2)6-COOH
- Аминобензойная NH2-С6H4-COOH
В зависимости от расположения этих функциональных групп возникает множество изомеров. Наибольший интерес представляет А-аминокислоты, то есть аминокислоты, в которых карбоксильная группа и аминогруппа находятся рядом. Именно А-аминокислоты входят в состав белков!
Аминокислоты — это твёрдые кристаллические вещества, что объясняется строением их молекул. В состав аминокислот входит внутренняя соль, где соль, надо понимать, как сложное вещество с химической точки зрения!).
Получение аминокислот
Получение аминокислот связано с гидролизом белков, но их можно синтезировать из карбоновых кислот, для чего сначала получают хлорпроизводные кислоты, которые затем обрабатывают аммиаком.
Сератонин. АминокислотыСератонин. АминокислотыСератонин. АминокислотыХимические свойства аминокислот
Химические свойства аминокислот определяются наличием двух противоположных по свойствам функциональных групп (карбоксильная группа и аминогруппа), входящих в состав аминокислот, что придает им амфотерные свойства (свойства и кислоты, и основания одновременно). Так, аминокислоты вступают в химическую реакцию с основаниями и спиртами, при этом образуются химические соединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами — соли и сложные эфиры.
Так, аминокислоты вступают в химическую реакцию с основаниями и спиртами, при этом образуются химические соединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами — соли и сложные эфиры.
Как основания, аминокислоты легко взаимодействуют с кислотами, при этом образуются соли.
Сератонин. АминокислотыХимические свойства аминокислот позволяют им взаимодействовать друг с другом, но такое взаимодействие отличается от привычных реакций. В результате химических реакции могут образовываться соединения с большим числом аминокислотных остатков — полипептиды. Группа атомов — CO — NH, входящих в состав аминокислот, называется
Аминокислоты как «кирпичики», из которых построены белки, применяются в медицине: их прописывают больным и сильно и сильно ослабленным после тяжёлых операций и лечения, при заболеваниях желудочного тракта, а также нервных заболеваний. Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
Аминокапроновая кислота и аминоэнантовая кислота, служат исходным сырьём для получения синтетических волокон «капрон» и «энант».
Аминопропионовая кислота — образуется при гидролизе натурального шёлка. А вот её остаток содержится почти во всех белках!
Аминоуксусная кислота — представляет собой белое кристаллические вещество, которое очень хорошо растворимо в воде. Она имеет сладкий вкус, поэтому её второе название гликоль.
Урок 12. аминокислоты. белки — Химия — 10 класс
Химия, 10 класс
Урок № 12. Аминокислоты. Белки
Перечень вопросов, рассматриваемых в теме: урок посвящён аминокислотам, их строению, номенклатуре, знакомству с пептидной группой и пептидной связью, химическими свойствами аминокислот, пептидам и полипептидам, знакомству с глицином как представителем аминокислот, биологической роли аминокислот, белкам, их структуре, химическим свойствам.
Глоссарий
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот.
Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
Получение аминокислот
В промышленности α-аминокислоты получают гидролизом белков.
Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
Cl-CH2-COOH + 2NH3 → NH2-CH2
-COOH + NH4ClФизические и химические свойства аминокислот
Аминокислоты – кристаллические вещества без цвета и запаха, сладковатые на вкус. Хорошо растворяются в воде.
Аминокислоты – амфотерные соединения, так как аминогруппа проявляет основные свойства, а карбоксильная группа – кислотные.
Карбоксильная группа в составе аминокислот позволяет им реагировать со спиртами. В результате реакции образуются сложные эфиры.
Ион водорода от карбоксильной группы может переходить к аминогруппе, в результате образуется биполярный ион.
Пептиды
Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.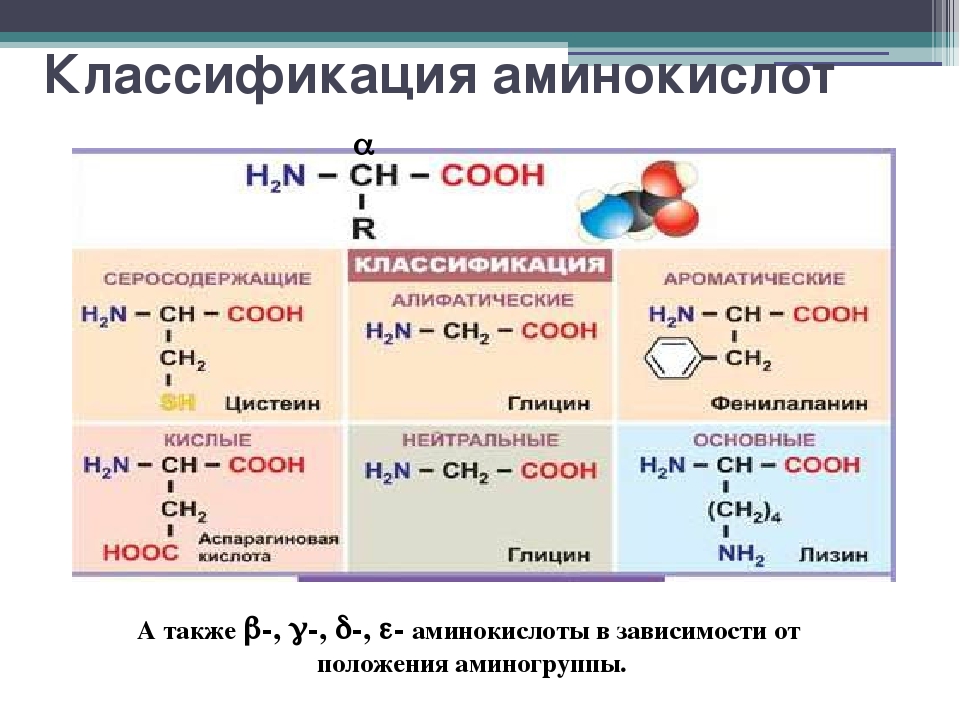
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
Структура белков
Последовательность остатков аминокислот в молекуле белка образует первичную структуру белка.
Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль. Образуется вторичная структура белка.
Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
Химические свойства белков
В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Превращения белков в организме
Белки являются обязательными компонентами в пищевом рационе человека. В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты. Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Успехи в изучении и синтезе белков
В 1954 г. британский биолог Фредерик Сенгер впервые расшифровал строение белка инсулина. Каждая молекула инсулина состоит из двух полипептидов, в одном из которых 21 остаток аминокислоты, а в другом – 30 аминокислотных остатков.
В 1967 г. был создан прибор – секвенатор, позволяющий определять последовательность остатков аминокислот в макромолекуле белка.
Первый белок, синтезированный в лаборатории в 1953 г. был окситоцин.
В настоящее время развивается наука, которая занимается синтезом искусственных белков, – генная инженерия.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Условие задачи: вычислите массовую долю азота в молекуле аспаргина
. Ответ запишите с точностью до десятых долей.
Ответ запишите с точностью до десятых долей.
Шаг первый: вычислить относительную молекулярную массу молекулы аспаргина:
М = 4·12 + 8·1 + 2·14 + 3·16 = 132 а.е.м.
Шаг второй: определить количество атомов азота в молекуле аспаргина и определить их относительную атомную массу:
2·14 = 28 а.е.м.
Шаг третий: определить массовую долю азота как отношение относительной атомной массы азота к относительной молекулярной массе аспаргина:
(28 : 132)·100 = 21,2 %.
Ответ: 21,2.
2. Решение задачи на определение количества различных олигопептидов, которые можно получить из определённого набора аминокислот.
Условие задачи: Сколько ди- и трипептидов можно составить из двух молекул аланина и одной молекулы цистеина?
Шаг первый: определить количество возможных дипептидов.
Из двух молекул аланина и одной молекулы цистеина можно составить три дипептида: Ala-Ala, Ala-Cys и Cys-Ala (два последних дипептида – разные соединения, так как в молекуле Ala-Cys карбоксильная группа аланина соединяется с аминогруппой цистеина, а в молекуле Cys-Ala карбоксильная группа цистеина соединяется с аминогруппой аланина).
Шаг второй: определить количество возможных трипептидов.
Ala-Ala-Cys, Ala-Cys-Ala, Cys-Ala-Ala – возможно составить 3 трипептида.
Ответ: 3 дипептида и 3 трипептида.
Efficient and Site-specific Antibody Labeling by Strain-promoted Azide-alkyne Cycloaddition
В этом исследовании, фрагмент антитела был сайт-специфически конъюгирован с флуорофором путем введения азида содержащего аминокислоты в фрагмент и взаимодействие фрагмента мутантного антитела с напряженными cyclooctyne (Рисунок 1). HerFab был выбран в качестве фрагмента антитела мишень, в которую А. Ф. был включен в качестве азида содержащих аминокислоты. Для того, чтобы выбрать остаток в HerFab для замены с ФП, анализировалась рентгеновская кристаллическая структура HerFab. 30 Важные требования к остатку включают достаточное расстояние от участка связывания антител , чтобы минимизировать снижение его сродства связывания и доступности растворителя для эффективной реакции конъюгации. Лейцин в положении 177 было достойного кандидата, так как остаток хорошо подвергается воздействию извне антитела и находится вблизи границы раздела двух областей иммуноглобулина, которая удалена от сайта связывания антител.
Лейцин в положении 177 было достойного кандидата, так как остаток хорошо подвергается воздействию извне антитела и находится вблизи границы раздела двух областей иммуноглобулина, которая удалена от сайта связывания антител.
 5-ADIBO). фрагмент антитела и Cy5.5-ADIBO подвергали взаимодействию в фосфатном буфере в течение 6 часов, и реакционную смесь анализировали с помощью SDS-PAGE в присутствии (+) и отсутствие (-) ДТТ (рисунок 3а). 25 Реакция с фрагментом дикого типа антитела также проведены и проанализированы в качестве контроля. Флуоресцентные изображения ясно показали конъюгации фрагмента мутантного антитела с Cy5.5-ADIBO, в то время как не конъюгация не наблюдалось в реакции с фрагментом дикого типа. Спрей ионизации Анализ методом электронного масс — спектрометрии (ESI-МС) показал количественный спряжения без заметного неконъюгированного фрагмента (рис 3b). В целом, эти результаты показали, что мутант HerFab, содержащий AF может быть эффективно и удобно, конъюгированного с напряженными cyclooctynes по SPAAC без какого-либо дополнительного реагента.
5-ADIBO). фрагмент антитела и Cy5.5-ADIBO подвергали взаимодействию в фосфатном буфере в течение 6 часов, и реакционную смесь анализировали с помощью SDS-PAGE в присутствии (+) и отсутствие (-) ДТТ (рисунок 3а). 25 Реакция с фрагментом дикого типа антитела также проведены и проанализированы в качестве контроля. Флуоресцентные изображения ясно показали конъюгации фрагмента мутантного антитела с Cy5.5-ADIBO, в то время как не конъюгация не наблюдалось в реакции с фрагментом дикого типа. Спрей ионизации Анализ методом электронного масс — спектрометрии (ESI-МС) показал количественный спряжения без заметного неконъюгированного фрагмента (рис 3b). В целом, эти результаты показали, что мутант HerFab, содержащий AF может быть эффективно и удобно, конъюгированного с напряженными cyclooctynes по SPAAC без какого-либо дополнительного реагента.
Рисунок 1: Схематическое изображение сайт-специфической маркировки антител по SPAAC. пустым «> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
пустым «> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 2: Экспрессия мутантной HerFab , содержащий AF в положении 177 (L177) в присутствии проэволюционировавшего пары т — РНК / Аарс. Выражение HerFab-L177AF в LB среде, содержащей эволюционировали тРНК / AFRs пары и 1 мМ AF. Очищенные образцы анализировали с помощью SDS-PAGE в присутствии (+) или отсутствие (-) ДТТ, а гель окрашивали с коммерческим пятном белка. Рисунок адаптирован из Ko, W. и др. 27.Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 3: Сопряжение реагируютион HerFab-L177AF с Cy5.5-ADIBO. (А) анализ SDS-PAGE конъюгации реакции дикого типа HerFab и HerFab-L177AF с Cy5.5-ADIBO. Реакционные смеси анализируют в присутствии (+) и отсутствии (-) ДТТ, и белковые полосы визуализируют с помощью коммерческого пятна белка (слева) и флуоресцентной томографии (справа). (Б) ESI-МС анализ HerFab-L177AF (слева) и HerFab-L177AF , помеченный Cy5.5-ADIBO (справа): Ожидаемая масса разница между HerFab- L177AF и конъюгированного антитела = 1190 Da, наблюдаемая масса разница = 1,190 Da , Рисунок адаптирован из Ko, W. и др. 27.Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
(Б) ESI-МС анализ HerFab-L177AF (слева) и HerFab-L177AF , помеченный Cy5.5-ADIBO (справа): Ожидаемая масса разница между HerFab- L177AF и конъюгированного антитела = 1190 Da, наблюдаемая масса разница = 1,190 Da , Рисунок адаптирован из Ko, W. и др. 27.Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
2.2: Структура и функция – Аминокислоты
Источник: BiochemFFA_2_1.pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
.Все белки на Земле состоят из одних и тех же 20 аминокислот. Связанные вместе в длинные цепи, называемые полипептидами, аминокислоты являются строительными блоками для огромного количества белков, присутствующих во всех живых клетках.
«Это одно из наиболее поразительных обобщений биохимии….что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе. » — Фрэнсис Крик
» — Фрэнсис Крик
Все аминокислоты имеют одинаковую основную структуру, которая показана на рис. 2.1. В «центре» каждой аминокислоты находится углерод, называемый α-углеродом, и к нему присоединены четыре группы: водород, α-карбоксильная группа, α-аминогруппа и R-группа, которую иногда называют боковая цепь. α-углеродная, карбоксильная и аминогруппы являются общими для всех аминокислот, поэтому R-группа является единственной уникальной особенностью каждой аминокислоты.(Небольшим исключением из этой структуры является структура пролина, в котором конец R-группы присоединен к α-амину.) За исключением глицина, R-группа которого состоит из атома водорода, все аминокислоты в белках связаны с четырьмя различными группами и, следовательно, могут существовать в двух формах зеркального отображения, L и D. За очень небольшими исключениями, каждая аминокислота, обнаруженная в клетках и в белках, имеет L-конфигурацию.
Рисунок 2.1 – Общая структура аминокислот В белках содержится 22 аминокислоты, и только 20 из них определены универсальным генетическим кодом. Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенофосфатсинтетазы. Пирролизинсодержащие белки встречаются гораздо реже и в основном приурочены к археям.
Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенофосфатсинтетазы. Пирролизинсодержащие белки встречаются гораздо реже и в основном приурочены к археям.
Основные и дополнительные
Диетологи делят аминокислоты на две группы: незаменимые аминокислоты (должны быть в рационе, потому что клетки не могут их синтезировать) и заменимые аминокислоты (могут вырабатываться клетками). Эта классификация аминокислот имеет мало общего со структурой аминокислот. Незаменимые аминокислоты значительно различаются от одного организма к другому и даже различаются у людей, в зависимости от того, взрослые они или дети. В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
Некоторые аминокислоты, которые обычно не являются незаменимыми, в определенных случаях может потребоваться получать с пищей. Людям, которые не синтезируют достаточное количество аргинина, цистеина, глутамина, пролина, селеноцистеина, серина и тирозина, например, из-за болезни, могут потребоваться пищевые добавки, содержащие эти аминокислоты.
Таблица 2.1 – Заменимые и незаменимые аминокислоты
Небелковые аминокислоты
В клетках также обнаружены α-аминокислоты, которые не включены в белки.Общие из них включают орнитин и цитруллин. Оба этих соединения являются промежуточными продуктами цикла мочевины. Орнитин является метаболическим предшественником аргинина, а цитруллин может образовываться при распаде аргинина. Последняя реакция производит оксид азота, важную сигнальную молекулу. Цитруллин является побочным продуктом метаболизма. Иногда его используют в качестве пищевой добавки для уменьшения мышечной усталости.
Химия группы R
Таблица 2.2 – Категории аминокислот (на основе свойств R-группы)
Мы разделяем аминокислоты на категории на основе химического состава их R-групп.Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту, классифицируемую разными авторами по-разному. Действительно, мы классифицируем тирозин и как ароматическую аминокислоту, и как гидроксильную аминокислоту. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) сходными боковыми группами будут функционировать сходным образом, например, во время фолдинга белка.
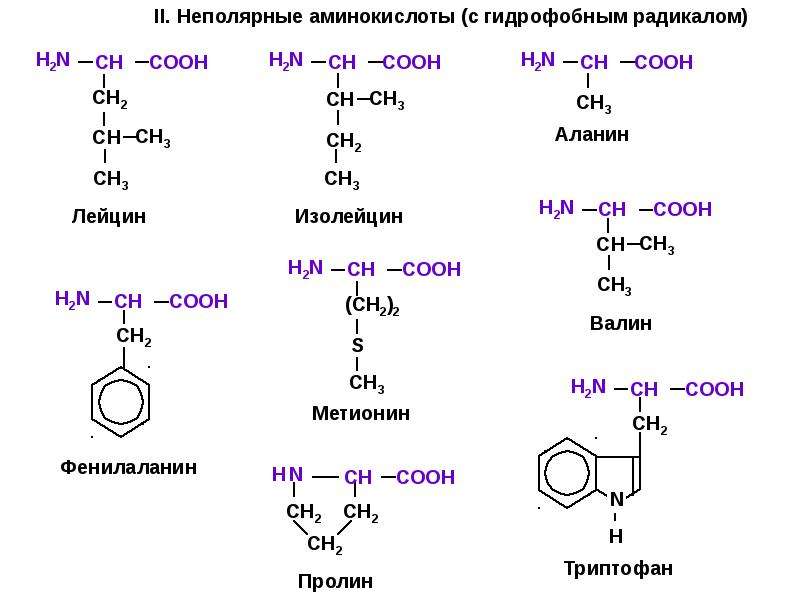
Неполярные аминокислоты
- Аланин (Ala/A) является одной из самых распространенных аминокислот в белках, уступая по распространенности только лейцину.
 D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG.
D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG. - Глицин (Gly/G) представляет собой аминокислоту с самой короткой боковой цепью, имеющую R-группу, состоящую только из одного водорода. В результате глицин является единственной аминокислотой, которая не является хиральной.Его небольшая боковая цепь позволяет ему легко вписываться как в гидрофобные, так и в гидрофильные среды.
- Глицин определяется в генетическом коде как GGU, GGC, GGA и GGG. Для человека это несущественно.
- Изолейцин (Ile/I) представляет собой незаменимую аминокислоту, кодируемую AUU, AUC и AUA. Он имеет гидрофобную боковую цепь, а также хиральную боковую цепь.
- Лейцин (Leu/L) представляет собой аминокислоту с разветвленной цепью, гидрофобную и незаменимую.Лейцин является единственной диетической аминокислотой, которая напрямую стимулирует синтез белка в мышцах, но следует соблюдать осторожность, поскольку 1) существуют противоречивые исследования и 2) токсичность лейцина опасна, что приводит к «четырем D»: диарее, дерматиту, деменции.
 и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG.
и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG. - Метионин (Met/M) представляет собой незаменимую аминокислоту, которая является одной из двух серосодержащих аминокислот, другой является цистеин. Метионин неполярен и кодируется исключительно кодоном AUG.Это аминокислота-«инициатор» в синтезе белка, она первой включается в белковые цепи. В прокариотических клетках формилируется первый метионин в белке.
- Пролин (Pro/P) – единственная аминокислота, обнаруженная в белках с R-группой, которая соединяется со своей собственной α-аминогруппой, образуя вторичный амин и кольцо. Пролин является заменимой аминокислотой и кодируется CCU, CCC, CCA и CCG. Это наименее гибкая из белковых аминокислот и, таким образом, придает конформационную жесткость, когда присутствует в белке.Присутствие пролина в белке влияет на его вторичную структуру. Это разрушитель α-спиралей и β-цепей. Пролин часто подвергается гидроксилированию в коллагене (для реакции требуется витамин С — аскорбат), что повышает конформационную стабильность белка.
 Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода.
Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода. - Валин (Val/V) — незаменимая неполярная аминокислота, синтезируемая в растениях.Это примечательно для гемоглобина, поскольку, когда он заменяет глутаминовую кислоту в положении номер шесть, он вызывает аномальную агрегацию гемоглобина в условиях низкого содержания кислорода, что приводит к серповидно-клеточной анемии. Валин кодируется в генетическом коде GUU, GUC, GUA и GUG.
Карбоксильные аминокислоты
- Аспарагиновая кислота (Asp/D) — заменимая аминокислота с карбоксильной группой в R-группе. Его легко получить переаминированием оксалоацетата. При pKa 3,9 боковая цепь аспарагиновой кислоты заряжена отрицательно при физиологическом pH.Аспарагиновая кислота определяется в генетическом коде кодонами GAU и GAC.
- Глутаминовая кислота (Glu/E), кодируемая GAA и GAG, является заменимой аминокислотой, которую легко получить путем трансаминирования α-кетоглутарата.
 Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Аминовые аминокислоты
- Аргинин (Arg/R) представляет собой аминокислоту, которая в одних случаях является незаменимой, а в других — заменимой.Недоношенные дети не могут синтезировать аргинин. Кроме того, хирургическая травма, сепсис и ожоги увеличивают потребность в аргинине. Однако большинству людей добавки с аргинином не нужны. Боковая цепь аргинина содержит сложную группу гуанидиния с рКа более 12, что делает его положительно заряженным при клеточном рН. Он кодируется шестью кодонами — CGU, CGC, CGA, CGG, AGA и AGG.
- Гистидин (His/H) является единственной из белковых аминокислот, содержащей имидазольную функциональную группу. Это незаменимая аминокислота для человека и других млекопитающих.С pKa боковой цепи, равным 6, его заряд может легко измениться при небольшом изменении pH.
 Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
- Лизин (Lys/K) – незаменимая аминокислота, кодируемая AAA и AAG. Он имеет R-группу, которая может легко ионизироваться с зарядом +1 при физиологическом pH и может быть посттрансляционно модифицирована с образованием ацетиллизина, гидроксилизина и метиллизина.Он также может быть убиквитинирован, сумоилирован, неддилирован, биотинилирован, карбоксилирован и купилирован. O-гликозилирование гидроксилизина используется для пометки белков для экспорта из клетки. Лизин часто добавляют в корма для животных, поскольку он является лимитирующей аминокислотой и необходим для оптимизации роста свиней и цыплят.
Ароматические аминокислоты
Рисунок 2.6 – Ароматические аминокислоты- Фенилаланин (Phe/F) – неполярная незаменимая аминокислота, кодируемая UUU и UUC.Это метаболический предшественник тирозина.
 Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама.
Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама. - Триптофан (Trp/W) представляет собой незаменимую аминокислоту, содержащую индольную функциональную группу. Это метаболический предшественник серотонина, ниацина и (в растениях) фитогормона ауксина. Несмотря на то, что он считается снотворным, нет четких результатов исследований, указывающих на это.
- Тирозин (Tyr/Y) — заменимая аминокислота, кодируемая UAC и UAU.Он является мишенью для фосфорилирования белков тирозиновыми протеинкиназами и играет роль в процессах передачи сигналов. В дофаминергических клетках головного мозга тирозингидроксилаза превращает тирозин в L-допу, непосредственный предшественник дофамина. Дофамин, в свою очередь, является предшественником норадреналина и адреналина. Тирозин также является предшественником гормонов щитовидной железы и меланина.
Гидроксиаминокислоты
- Серин (Ser/S) — одна из трех аминокислот, имеющих R-группу с гидроксилом (остальные — треонин и тирозин).
 Он кодируется UCU, UCC, UCA, UGC, AGU и AGC. Будучи способной образовывать водородные связи с водой, она классифицируется как полярная аминокислота. Для человека это не принципиально. Серин является предшественником многих важных клеточных соединений, в том числе пуринов, пиримидинов, сфинголипидов, фолиевой кислоты и аминокислот глицина, цистеина и триптофана. Гидроксильная группа серина в белках является мишенью для фосфорилирования некоторыми протеинкиназами. Серин также является частью каталитической триады сериновых протеаз.
Он кодируется UCU, UCC, UCA, UGC, AGU и AGC. Будучи способной образовывать водородные связи с водой, она классифицируется как полярная аминокислота. Для человека это не принципиально. Серин является предшественником многих важных клеточных соединений, в том числе пуринов, пиримидинов, сфинголипидов, фолиевой кислоты и аминокислот глицина, цистеина и триптофана. Гидроксильная группа серина в белках является мишенью для фосфорилирования некоторыми протеинкиназами. Серин также является частью каталитической триады сериновых протеаз.
- Треонин (Thr/T) – незаменимая полярная аминокислота. Это одна из трех аминокислот, несущих гидроксильную группу (другими являются серин и тирозин), и поэтому она является мишенью для фосфорилирования в белках. Он также является мишенью для гликозилирования белков. Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина.
 В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге.Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге.Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Тирозин — см. ЗДЕСЬ.
Рисунок 2.8 – Свойства аминокислот ВикипедияДругие аминокислоты
- Аспарагин (Asn/N) — заменимая аминокислота, кодируемая AAU и AAC. Его карбоксиамид в R-группе придает ему полярность. Аспарагин участвует в образовании акриламида в продуктах, приготовленных при высоких температурах (жарка во фритюре), когда он реагирует с карбонильными группами. Аспарагин может быть получен в организме из аспартата путем реакции амидирования с амином из глютамина.При распаде аспарагина образуется малат, который может окисляться в цикле лимонной кислоты.
- Цистеин (Cys/C) — единственная аминокислота с сульфгидрильной группой в боковой цепи. Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями.
 Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона.Цистеин определяется кодонами UGU и UGC.
Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона.Цистеин определяется кодонами UGU и UGC.
- Глутамин (Gln/Q) – это аминокислота, которая обычно не является незаменимой для человека, но может быть у людей, подвергающихся интенсивным спортивным тренировкам или страдающих желудочно-кишечными расстройствами. Он имеет карбоксиамидную боковую цепь, которая обычно не ионизируется при физиологических pH, но придает полярность боковой цепи. Глютамин кодируется CAA и CAG и легко производится амидированием глутамата.Глютамин является наиболее распространенной аминокислотой в циркулирующей крови и одной из немногих аминокислот, которые могут преодолевать гематоэнцефалический барьер.
- Селеноцистеин (Sec/U) является компонентом селенопротеинов, встречающихся во всех царствах жизни. Он является компонентом нескольких ферментов, включая глутатионпероксидазы и тиоредоксинредуктазы.
 Селеноцистеин встраивается в белки по необычной схеме с участием стоп-кодона UGA. Клетки, выращенные в отсутствие селена, обрывают синтез белка на УГА.Однако, когда присутствует селен, некоторые мРНК, которые содержат последовательность вставки селеноцистеина (SECIS), вставляют селеноцистеин, когда встречается UGA. Элемент SECIS имеет характерные нуклеотидные последовательности и паттерны спаривания оснований вторичной структуры. Двадцать пять белков человека содержат селеноцистеин.
Селеноцистеин встраивается в белки по необычной схеме с участием стоп-кодона UGA. Клетки, выращенные в отсутствие селена, обрывают синтез белка на УГА.Однако, когда присутствует селен, некоторые мРНК, которые содержат последовательность вставки селеноцистеина (SECIS), вставляют селеноцистеин, когда встречается UGA. Элемент SECIS имеет характерные нуклеотидные последовательности и паттерны спаривания оснований вторичной структуры. Двадцать пять белков человека содержат селеноцистеин. - Пирролизин (Pyl/O) представляет собой двадцать вторую аминокислоту, но редко встречается в белках. Как и селеноцистеин, он не закодирован в генетическом коде и должен быть включен необычными способами.Это происходит на стоп-кодонах UAG. Пирролизин обнаружен в метаногенных архейских организмах и по крайней мере в одной метанпродуцирующей бактерии. Пирролизин входит в состав ферментов, образующих метан.
Ионизирующие группы
Значения pKa для боковых цепей аминокислот сильно зависят от химической среды, в которой они присутствуют. Например, карбоксильная группа R, обнаруженная в аспарагиновой кислоте, имеет значение pKa 3,9 в свободном состоянии в растворе, но может достигать 14 в определенных средах внутри белков, хотя это необычно и экстремально.Каждая аминокислота имеет по крайней мере одну ионизируемую аминогруппу (α-амин) и одну ионизируемую карбоксильную группу (α-карбоксил). Когда они связаны пептидной связью, они больше не ионизируются. Некоторые, но не все аминокислоты имеют R-группы, способные к ионизации. Тогда заряд белка возникает из зарядов α-аминной группы, α-карбоксильной группы. и сумма зарядов ионизированных R-групп. Титрование/ионизация аспарагиновой кислоты изображено на рис. 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Например, карбоксильная группа R, обнаруженная в аспарагиновой кислоте, имеет значение pKa 3,9 в свободном состоянии в растворе, но может достигать 14 в определенных средах внутри белков, хотя это необычно и экстремально.Каждая аминокислота имеет по крайней мере одну ионизируемую аминогруппу (α-амин) и одну ионизируемую карбоксильную группу (α-карбоксил). Когда они связаны пептидной связью, они больше не ионизируются. Некоторые, но не все аминокислоты имеют R-группы, способные к ионизации. Тогда заряд белка возникает из зарядов α-аминной группы, α-карбоксильной группы. и сумма зарядов ионизированных R-групп. Титрование/ионизация аспарагиновой кислоты изображено на рис. 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Большинство белков имеют относительно узкие диапазоны оптимальной активности, которые обычно соответствуют среде, в которой они находятся (рис. 2.11). Стоит отметить, что образование пептидных связей между аминокислотами приводит к удалению ионизируемых водородов как из α-аминной, так и из α-карбоксильной групп аминокислот. Таким образом, ионизация/деионизация в белке происходит только с 1) амино-конца; 2) карбоксильный конец; 3) R-группы; или 4) другие функциональные группы (такие как сульфаты или фосфаты), добавленные к аминокислотам посттрансляционно — см. ниже.
2.11). Стоит отметить, что образование пептидных связей между аминокислотами приводит к удалению ионизируемых водородов как из α-аминной, так и из α-карбоксильной групп аминокислот. Таким образом, ионизация/деионизация в белке происходит только с 1) амино-конца; 2) карбоксильный конец; 3) R-группы; или 4) другие функциональные группы (такие как сульфаты или фосфаты), добавленные к аминокислотам посттрансляционно — см. ниже.
Карнитин
Не все аминокислоты в клетке входят в состав белков. Наиболее распространенные примеры включают орнитин (метаболизм аргинина), цитруллин (цикл мочевины) и карнитин (рис. 2.12). Когда жирные кислоты, предназначенные для окисления, перемещаются в митохондрии для этой цели, они проходят через внутреннюю мембрану, прикрепленную к карнитину. Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Фигура 2.12 — L-карнитин Из экзогенных источников жирные кислоты должны быть активированы при попадании в цитоплазму путем присоединения к коферменту А. Часть молекулы КоА заменяется карнитином в межмембранном пространстве митохондрии в реакции, катализируемой карнитином ацилтрансфераза I. Образовавшаяся молекула ацилкарнитина переносится через внутреннюю митохондриальную мембрану с помощью карнитинацилкарнитинтранслоказы, а затем в матриксе митохондрии карнитинацилтрансфераза II заменяет карнитин коферментом А (рис. 6.88).
Часть молекулы КоА заменяется карнитином в межмембранном пространстве митохондрии в реакции, катализируемой карнитином ацилтрансфераза I. Образовавшаяся молекула ацилкарнитина переносится через внутреннюю митохондриальную мембрану с помощью карнитинацилкарнитинтранслоказы, а затем в матриксе митохондрии карнитинацилтрансфераза II заменяет карнитин коферментом А (рис. 6.88).
Катаболизм аминокислот
Мы классифицируем аминокислоты как незаменимые и заменимые в зависимости от того, может ли организм их синтезировать. Однако все аминокислоты могут расщепляться всеми организмами. На самом деле они являются источником энергии для клеток, особенно во время голодания или для людей, придерживающихся диеты с очень низким содержанием углеводов. С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные продукты, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные продукты превращаются в ацетил-КоА. На рис. 2.13 показаны метаболические судьбы катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются одновременно глюкогенными и кетогенными.
На рис. 2.13 показаны метаболические судьбы катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются одновременно глюкогенными и кетогенными.
Посттрансляционные модификации
После синтеза белка боковые цепи аминокислот внутри него могут быть химически модифицированы, что приводит к большему разнообразию структуры и функций (рис. 2.14). Общие изменения включают фосфорилирование гидроксильных групп серина, треонина или тирозина.Лизин, пролин и гистидин могут иметь гидроксилы, присоединенные к аминам в их R-группах. Другие модификации аминокислот в белках включают добавление жирных кислот (миристиновой кислоты или пальмитиновой кислоты), изопреноидных групп, ацетильных групп, метильных групп, йода, карбоксильных групп или сульфатов. Они могут иметь эффекты ионизации (добавление фосфатов/сульфатов), деионизации (присоединение ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины имеют углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Кроме того, N-связанные и O-связанные гликопротеины имеют углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Некоторые аминокислоты являются предшественниками важных соединений в организме. Примеры включают адреналин, гормоны щитовидной железы, Ldopa и дофамин (все из тирозина), серотонин (из триптофана) и гистамин (из гистидина).
Рисунок 2.14 – Посттрансляционно модифицированные аминокислоты. Модификации показаны зеленым цветом. Рисунок 2.15. Фосфорилированные аминокислотыСтроительные полипептиды
Хотя аминокислоты выполняют в клетках и другие функции, их наиболее важная роль заключается в том, что они входят в состав белков.Белки, как мы отмечали ранее, представляют собой полимеры аминокислот.
Аминокислоты связаны друг с другом пептидными связями, при которых карбоксильная группа одной аминокислоты присоединяется к аминогруппе следующей с потерей молекулы воды. Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много).Конец пептида со свободной аминогруппой называется N-концом (для Nh3), а конец со свободным карбоксилом называется С-концом (для карбоксила).
Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много).Конец пептида со свободной аминогруппой называется N-концом (для Nh3), а конец со свободным карбоксилом называется С-концом (для карбоксила).
Как мы уже отмечали ранее, функция зависит от структуры, и цепочка аминокислот должна складываться в определенную трехмерную форму или конформацию, чтобы образовался функциональный белок. Сворачивание полипептидов в их функциональные формы является темой следующего раздела.
Аминокислоты
Введение:
Каждая аминокислота имеет по крайней мере одну аминовую и одну кислотную функциональные
Группа, как следует из названия.Различные свойства возникают в результате
вариации в структурах различных групп R. Группа Р
часто называют боковой цепью аминокислоты. Аминокислоты
имеют специальные общеупотребительные имена, однако трехбуквенное сокращение
потому что это имя используется чаще всего. Второе сокращение
, одна буква, используется в длинных белковых структурах.
таблица слева для структуры, названий и сокращений
20 аминокислот.
Группа Р
часто называют боковой цепью аминокислоты. Аминокислоты
имеют специальные общеупотребительные имена, однако трехбуквенное сокращение
потому что это имя используется чаще всего. Второе сокращение
, одна буква, используется в длинных белковых структурах.
таблица слева для структуры, названий и сокращений
20 аминокислот.
Существует четыре основных класса аминокислот.
определяются разными боковыми цепями: (1) неполярными и нейтральными,
(2) полярные и нейтральные, (3) кислые и полярные, (4) основные и полярные.
Принципы полярности:
Чем больше электроотрицательность разница между
атомов в связи, тем более полярна связь. Частичные отрицательные заряды
находятся на наиболее электроотрицательных атомах, остальные частично
положительный.Проверьте полярность функциональных
группы.
Неполярные боковые цепи:
Боковые цепи, содержащие чистые углеводородные алкильные группы (алкановые ответвления) или ароматические (бензольные кольца) неполярны . Примеры включают валин, аланин, лейцин, изолейцин, фенилаланин.
Количество алкильных групп также влияет на полярность. Чем больше алкильных групп, тем более неполярна аминокислота. будет.Этот эффект делает валин более неполярным, чем аланин; лейцин более неполярен, чем валин.
ВЕС. Перечислите все аминокислоты с неполярными боковыми цепями.
| Расположите следующие по возрастанию
неполярность, т.е. 1 = наименее неполярный, 4 = наиболее неполярный. лей; фэ; вал; аля |
Ответ
1 = аля
2 = значение
3 = лей
4= фе
Рейтинг основан на
увеличение числа
СН. |
Боковые цепи Polar:
Боковые цепи, содержащие различные функциональные группы, такие как кислоты, амиды, спирты и амины придают более полярный характер аминокислоты. Ранжирование полярности будет зависеть об относительном ранжировании полярности для различных функциональных групп как определено в функциональных группах. Кроме того, количество углерод-водородов в алкане или ароматическую часть боковой цепи следует рассматривать вдоль с функциональной группой.
Пример: аспарагиновая кислота более полярна, чем серин, потому что Кислотная функциональная группа более полярна, чем спиртовая группа.
Пример: Серин более полярен, чем треонин, поскольку треонин
имеет на одну метильную группу больше, чем серин. Метильная группа дает
немного более неполярный характер к треонину.
Пример: Серин более полярен, чем тирозин, поскольку тирозин имеет углеводородное бензольное кольцо.
ВЕС. Перечислите по аббревиатуре все аминокислоты, которые считаются несколько полярными.
| Расположите следующие аминокислоты по
возрастающая полярность. то есть 1 = более неполярный. сер ; клей; жерех; лиз; аля; глн |
Ответ 1 = аля 2 = лиз 3 = сер 4= клей 5 = аспид 6 = глн |
| Какая аминокислота наиболее нерастворима
в воде: изолейцин или аланин? |
Ответить Изолейцина больше СН, поэтому больше нерастворим, чем ала. |
| Какая аминокислота наиболее растворима в воде: lys или сер? | Ответить
Сер, алкогольная группа
более полярен, чем амин
в лис.
|
Аминокислоты
АминокислотыNext: Водородная связь в Up: Введение Предыдущий: Органические молекулярные кристаллы   Содержимое
Аминокислоты характеризуются наличием кислотных и основных групп в одной молекуле.Это карбоксильная группа COOH и аминогруппа соответственно. В так называемых -аминокислотах обе функциональные группы присоединены к одному и тому же атому углерода, т. . Репрезентативная структура аланина показана на рис. 1.1.
В водных растворах и в твердом состоянии эти молекулы часто образуют диполярные ионы, или 90–270 цвиттер-ионы 90–271 , при этом карбоксильная группа отдает протон аминогруппе.Это приводит к двум противоположно заряженным функциональным группам на одной и той же молекуле. Это показано на рисунке 1.2. В газовой фазе цвиттерионизация энергетически невыгодна, но взаимодействия, присутствующие в растворе и твердом состоянии, могут оказывать стабилизирующее влияние.
Это показано на рисунке 1.2. В газовой фазе цвиттерионизация энергетически невыгодна, но взаимодействия, присутствующие в растворе и твердом состоянии, могут оказывать стабилизирующее влияние.
Актуальность аминокислот заключается в их биологической важности; они не только образуют строительные блоки пептидов и белков, все клеточные ткани и жидкости в живых организмах содержат резервуар свободных аминокислот: «аминокислотный пул».Они принимают участие в метаболических реакциях, включая биосинтез полипептидов и белков, синтез нуклеотидов.
Наличие асимметричных атомов углерода во всех аминокислотах, кроме глицина, приводит к стереоизомерии: можно получить оптически активные D- и L-аминокислоты или оптически неактивные DL-аминокислоты. Большинство встречающихся в природе аминокислот относятся к L-типу по неясным причинам. Однако соотношение D- и L-типа может естественным образом изменяться в археологических образцах в процессе рацемизации; в сочетании с использованием стандартных лабораторных аналитических методик это позволяет использовать метод датирования образцов, отличный от датирования [18].
Однако соотношение D- и L-типа может естественным образом изменяться в археологических образцах в процессе рацемизации; в сочетании с использованием стандартных лабораторных аналитических методик это позволяет использовать метод датирования образцов, отличный от датирования [18].
Дальнейший интерес может быть мотивирован потенциальными технологическими применениями биоорганических молекул [19], такими как предлагаемое использование ДНК для создания электронных схем [20] и разработка светоизлучающих органических полимеров [21]. Важность аминокислот для фармацевтической промышленности и их использование в синтезе лекарств [18] в сочетании с перспективой разработки лекарств из первых принципов также обеспечивает мощную мотивацию.
Более неожиданная и, возможно, донкихотская мотивация для изучения аминокислот заключается в понимании происхождения жизни и возможностей внеземной жизни, чему может помочь исследование холодного межзвездного пространства на наличие признаков биомолекул [22,23]. Следы аминокислот были обнаружены на метеоритах, а глицин и аланин были обнаружены в лунных образцах. Предоставление удовлетворительного объяснения их присутствия требует всестороннего знания химии аминокислот; Методы ab initio могут служить полезным дополнением к экспериментальным подходам в таких усилиях.
Следы аминокислот были обнаружены на метеоритах, а глицин и аланин были обнаружены в лунных образцах. Предоставление удовлетворительного объяснения их присутствия требует всестороннего знания химии аминокислот; Методы ab initio могут служить полезным дополнением к экспериментальным подходам в таких усилиях.
Полное понимание роли аминокислот в этих важных процессах требует глубокого понимания биохимии, лежащей в их основе, и, следовательно, требуется полное и адекватное рассмотрение квантовой механики, лежащей в основе этой биохимии.Таким образом, они являются идеальными кандидатами для применения методов ab initio .
В свете вышеизложенного неудивительно, что уже существует всеобъемлющая совокупность ab initio работ по аминокислотам [22,24,25,26,27]. Однако большая часть этой работы посвящена конформационному анализу ограниченного подмножества из 20 встречающихся в природе -аминокислот, в частности аланина и глицина. Также существует множество работ, в которых методологии ab initio были объединены с моделями Онзагера [28,29] для моделирования поведения аминокислот в растворе. Очень мало работ было выполнено по определению нормальных мод и диэлектрических свойств. Возможно, это связано с тем, что большая часть работы была выполнена с использованием квантово-химических методов, таких как ограниченный метод Хартри-Фока (RHF), методы, которые не идеально подходят для изучения больших и сложных молекул. Меньше работ посвящено аминокислотам в твердом состоянии, где они обычно образуют молекулярные кристаллы. Действительно, этот аспект вызвал на удивление мало интереса у теоретиков, единственная работа в литературе, по-видимому, касается тензоров экранирования углерода-13 [30,31].
Очень мало работ было выполнено по определению нормальных мод и диэлектрических свойств. Возможно, это связано с тем, что большая часть работы была выполнена с использованием квантово-химических методов, таких как ограниченный метод Хартри-Фока (RHF), методы, которые не идеально подходят для изучения больших и сложных молекул. Меньше работ посвящено аминокислотам в твердом состоянии, где они обычно образуют молекулярные кристаллы. Действительно, этот аспект вызвал на удивление мало интереса у теоретиков, единственная работа в литературе, по-видимому, касается тензоров экранирования углерода-13 [30,31].
Next: Водородная связь в Up: Введение Предыдущий: Органические молекулярные кристаллы   Содержимое Администратор веб-страницы 2004-12-16
аминокислот
аминокислотХимия 240
Лето 2001
Аминокислоты — Строение и синтез
Последний
время, когда мы закончили наше исследование аминов. Сейчас мы посмотрим, что
происходит, когда функциональная группа карбоновой кислоты и функциональная аминогруппа
группы находятся в одной молекуле.Наше внимание будет сосредоточено на альфа-аминокислотах,
те, в которых аминогруппа связана с альфа-углеродом — тот
рядом с карбонильной группой — карбоновой кислоты. Это основные
строительные блоки белков и являются наиболее важным типом аминокислот.
Хотя существует много других способов связать аминогруппу и карбоксильную группу.
кислотной группы в одной молекуле, нас будет интересовать только
альфа-аминокислоты.
Сейчас мы посмотрим, что
происходит, когда функциональная группа карбоновой кислоты и функциональная аминогруппа
группы находятся в одной молекуле.Наше внимание будет сосредоточено на альфа-аминокислотах,
те, в которых аминогруппа связана с альфа-углеродом — тот
рядом с карбонильной группой — карбоновой кислоты. Это основные
строительные блоки белков и являются наиболее важным типом аминокислот.
Хотя существует много других способов связать аминогруппу и карбоксильную группу.
кислотной группы в одной молекуле, нас будет интересовать только
альфа-аминокислоты.
В белках обычно встречаются 20 альфа-аминокислот.Они есть
перечислены в Таблице 18.1 (стр. 503) Брауна. Когда структуры этих молекул
при рассмотрении становится ясно, что они имеют общую структурную единицу
RCH(NH 3 + )CO 2 — , в котором R может
быть либо водородом (аминокислота — глицин), либо одним из 19 других вариантов.
Единственным исключением из этого паттерна является пролин, в котором группа R образует
верхняя часть кольца, которая также включает аминогруппу и альфа-углерод
атом. Поскольку аминогруппа в пролине участвует в двух углеродно-азотных
связи, это вторичная аминогруппа.
Поскольку аминогруппа в пролине участвует в двух углеродно-азотных
связи, это вторичная аминогруппа.
Таблица дополнительно разделена на группы по структуре
из группы Р. (Группу R часто называют «боковой цепью».) Если
Группа R состоит только из углерода и водорода (без гетероатомов), боковая
Цепь считается неполярной, так как полярность очень мала.
с углерод-углеродными и углерод-водородными связями. Эти боковые цепи гидрофобны.
(избегая воды) во многом так же, как длинный углеводородный хвост
мыло или моющее средство гидрофобны.Это будет важно, когда мы рассмотрим
как характеристики белков зависят от их фолдинга
в водной среде. В метионине (сере) есть гетероатомы.
и триптофан (азот), но общее поведение этих аминокислот
предполагает, что эти гетероатомы вносят очень небольшой вклад в полярность
боковая цепь. Боковые цепи, которые содержат более полярные функциональные группы, такие как
поскольку амид, спирт и тиол обеспечивают места для полярной молекулы воды
к водородной связи. Таким образом, они несколько гидрофильны, как группы ОН.
в сахаре.Эти боковые цепи важны для создания достаточного количества белка.
растворим в воде, чтобы эффективно действовать внутри клетки.
Таким образом, они несколько гидрофильны, как группы ОН.
в сахаре.Эти боковые цепи важны для создания достаточного количества белка.
растворим в воде, чтобы эффективно действовать внутри клетки.
В двух случаях (аспарагиновая кислота и глутаминовая кислота) боковая цепь включает группа карбоновой кислоты в дополнение к той, которая находится рядом с аминогруппой. Эти группы ионизированы (присутствуют в виде карбоксилатного аниона), когда рН близка к нейтральной (pH ~ 7). (Мы рассмотрим кислотно-щелочное поведение амино Кислоты короче.)
Точно так же существуют три аминокислоты, боковые цепи которых включают амино группа.Эти аминогруппы также ионизированы (присутствуют в виде аммониевой ион) при нейтральном рН. Ионизированные группы довольно полярны и, как и ионизированные концов мыл или моющих средств, они делают боковую цепь достаточно гидрофильной.
При нейтральном pH (около 7, типичный pH большинства
жидкостей организма и pH, при которых обычно происходят биохимические реакции)
аминогруппы в аминокислотах протонируются с образованием ионов аммония и
карбоновые кислоты ионизируются до сопряженных с ними оснований (карбоксилат-ионов). Один из способов взглянуть на это — посмотреть на водный раствор с pH = 7 как на большое
резервуар кислоты, pK a поддерживается на уровне 7. Если кислота с
a pK a ниже 7 (как карбоновая кислота, pK a ~
5) растворяется в таком растворе, он является более сильной кислотой и переносит
протон к раствору и стать ионом карбоксилата. Таким образом, когда
pH поддерживается на уровне 7, карбоновые кислоты ионизируются.
Один из способов взглянуть на это — посмотреть на водный раствор с pH = 7 как на большое
резервуар кислоты, pK a поддерживается на уровне 7. Если кислота с
a pK a ниже 7 (как карбоновая кислота, pK a ~
5) растворяется в таком растворе, он является более сильной кислотой и переносит
протон к раствору и стать ионом карбоксилата. Таким образом, когда
pH поддерживается на уровне 7, карбоновые кислоты ионизируются.
Таким же образом, когда амин (типичный ион аммония pK a ~ 10) растворяется в воде, которая поддерживается при pH = 7, вода сильнее кислоты, поэтому амин протонируется, чтобы получить более слабую кислоту.Амины при удержании при pH = 7 протонируются с образованием ионов аммония. Практически, удерживая рН 7 означает, что раствор забуферен включением слабых кислот. и слабые основания в достаточной концентрации, чтобы перенос нескольких протонов существенно не меняет концентрацию H + .
Мы можем использовать эту идею при любом pH. Например, если аминокислоту растворить
в воде, которая поддерживается при pH = 2, раствор является более сильной кислотой, чем
карбоновая кислота, которая образуется при переносе протона на
карбоксилатный ион.Карбоновая кислота (pK a ~ 5) образуется как
более слабая кислота. Такая молекула будет иметь только положительный заряд от
ион аммония. Точно так же в основном растворе (рН> 11) раствор
более слабая кислота, чем ион аммония, поэтому ион аммония переносит протон
в раствор и становится аминогруппой.
Например, если аминокислоту растворить
в воде, которая поддерживается при pH = 2, раствор является более сильной кислотой, чем
карбоновая кислота, которая образуется при переносе протона на
карбоксилатный ион.Карбоновая кислота (pK a ~ 5) образуется как
более слабая кислота. Такая молекула будет иметь только положительный заряд от
ион аммония. Точно так же в основном растворе (рН> 11) раствор
более слабая кислота, чем ион аммония, поэтому ион аммония переносит протон
в раствор и становится аминогруппой.
Поскольку существуют небольшие различия в конкретных значениях pK и
амино- и карбоновых групп в аминокислотах, точный рН, при котором
преобладающим видом является цвиттерион (молекула с одним положительным
ион аммония и один отрицательный карбоксилат-ион) несколько различается.Этот рН
называется изоэлектрической точкой (pI), потому что это рН, при котором
Аминокислота с такой же вероятностью притягивается к положительному электроду, как и к
отрицательный. Значения pI для обычных аминокислот приведены в таблице.
18,2 (стр. 506 в коричневом цвете).
Значения pI для обычных аминокислот приведены в таблице.
18,2 (стр. 506 в коричневом цвете).
Обратите внимание, что кислые аминокислоты имеют низкие числа pI. Это имеет смысл потому что потребуется довольно сильнокислый раствор, чтобы гарантировать, что один карбоксилат-ионов протонированы. Аналогично, для основных аминокислот значения pI выше, поскольку потребуется довольно простое решение для убедитесь, что один из ионов аммония потерял протон и положительный обвинение.
Для всех аминокислот, кроме глицина, альфа-атом углерода представляет собой стереогенный атом углерода (присоединены четыре разные группы). В двух случаях в молекуле присутствует еще один стереогенный атом углерода. Только один из двух возможных энантиомеров встречается в природе в случаях аминокислот, в состав которых входят стереогенные атомы углерода. Во всех этих случаях абсолютная конфигурация альфа-стереогенного углерода S .
Определение абсолютных конфигураций стало возможным значительно позже
были установлены стереохимические отношения между аминокислотами и сахарами. вне.Эта работа показала, что если мы ориентируем проекцию Фишера амино
кислота с карбоксилатной ионной группой вверху и группой R внизу,
мы находим, что ион аммония направлен влево. По этой причине
считается, что аминокислоты имеют L-конфигурацию.
(в отличие от конфигураций D, назначенных общим
сахара). Вы можете проверить, что L-амино
кислота также является аминокислотой S .
вне.Эта работа показала, что если мы ориентируем проекцию Фишера амино
кислота с карбоксилатной ионной группой вверху и группой R внизу,
мы находим, что ион аммония направлен влево. По этой причине
считается, что аминокислоты имеют L-конфигурацию.
(в отличие от конфигураций D, назначенных общим
сахара). Вы можете проверить, что L-амино
кислота также является аминокислотой S .
Аминокислоты производятся в живых системах биохимическими путями, которые включают несколько ферментов.Ферменты — это белки, которые сами состоят L-аминокислот, поэтому они обеспечивают хиральную среду в котором образуется только один из двух энантиомеров. Лабораторный синтез аминокислот обычно не включает хиральное окружение, поэтому равные количество L- и D-амино кислоты образуются в типичных лабораторных синтезах. Смесь равных количеств энантиомеров называется смесью рацематов .
Лабораторный синтез аминокислот обычно
связанные с синтезом аминов и/или карбоновых кислот. мы посмотрим
в одном из таких синтезов — синтезе Штрекера. Мы не будем смотреть на его механизм
подробно, но мы будем искать сходства с реакциями, которые мы видели
до.
мы посмотрим
в одном из таких синтезов — синтезе Штрекера. Мы не будем смотреть на его механизм
подробно, но мы будем искать сходства с реакциями, которые мы видели
до.
Реакция начинается с образования имина из альдегида и аммиака. Кислотный катализ, необходимый для этого, исходит от хлорида аммония, слабого кислота. Далее следует добавление цианистого водорода к имину. Это аналог к изученным нами присоединениям нуклеофилов к альдегиду или кетону ранее. В этом случае ион цианида служит нуклеофилом.
Аминонитрил, полученный в результате этих стадий, очищают и обрабатывают
с водным HCl, затем OH —. Это превращает нитрил
в карбоксилатную соль. Мы можем поместить эту реакцию в контекст, думая
тройной связи CN как очень похожей на карбонильную группу. Это предполагает
что электрофильный H + атакует азот, за которым следует
нуклеофильной атакой воды на нитрильный углерод. Двойная связь C=N
остается, и его реакция с водой обратна образованию имина. В результате двойная связь C=N гидролизуется до двойной связи C=O.
Наконец, нейтрализация достаточным количеством основания дает нам цвиттерион аминокислоты.
В результате двойная связь C=N гидролизуется до двойной связи C=O.
Наконец, нейтрализация достаточным количеством основания дает нам цвиттерион аминокислоты.
Теперь давайте обратим внимание на то, как аминокислоты соединяются вместе, образуя белки. Ключевой структурный элемент здесь пептидная связь. Это амидная связь, соединяющая аммиачную группу одной аминокислоты к карбоксилатной группе другой новой ковалентной связью. связь. O — карбоксилата теряется вместе с двумя H + . ионы из группы аммония с образованием воды.Это вполне аналогично образование амида при нагревании карбоновой кислоты и амина. То конкретные условия реакции и процессы, необходимые для этого, могут быть (как мы увидим) довольно сложно, но полезно помнить, что происходит соединение карбоксилата углерода и аммонийного азота новой C-N (пептидной) связью.
Образовавшееся таким образом новое соединение называется пептидом. Наш пример
представляет собой дипептид, образованный из двух аминокислот.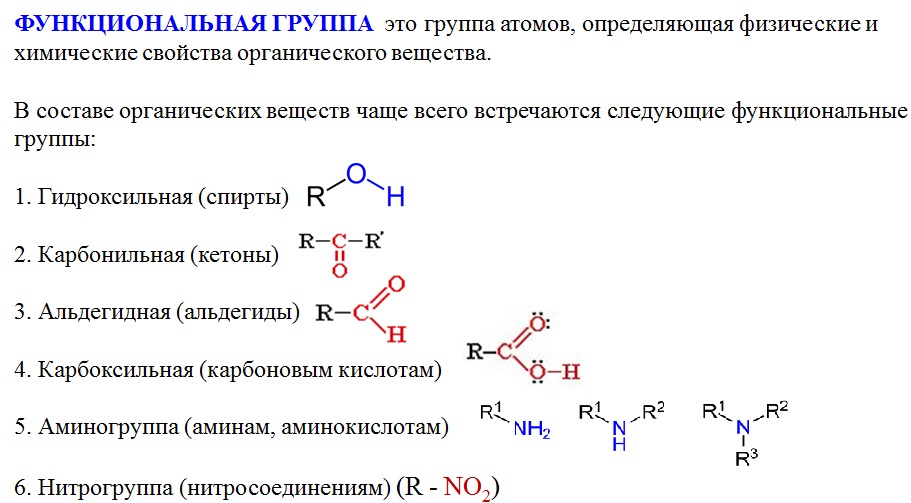 Если третья аминокислота присоединена
к дипептиду путем образования новой пептидной связи либо у аммониевой группы
или карбоксилатной группы дипептида, получаем трипептид, а
скоро.Полипептиды могут иметь много аминокислот. Полипептиды с более чем
100 аминокислот считаются белками.
Если третья аминокислота присоединена
к дипептиду путем образования новой пептидной связи либо у аммониевой группы
или карбоксилатной группы дипептида, получаем трипептид, а
скоро.Полипептиды могут иметь много аминокислот. Полипептиды с более чем
100 аминокислот считаются белками.
Поскольку аминокислота, карбоксильная группа которой участвует в образование пептидной связи еще имеет аммониевую группу, которая содержит атом азота, он называется N-концом пептида. Конец N обычно пишется слева. Соответственно, аминокислота который еще имеет свободную карбоксилатную группу, называется С-концом и написано справа.Когда записывается порядок аминокислот в пептиде вне, принято писать слева направо от N-конца к конец С. Полный порядок аминокислот в белке называется его последовательности и удобно выражается с помощью сокращенных названий аминокислот читаются от N к С-концу.
Последовательность удерживается вместе пептидными связями. В составе амида
функциональной группы, эти связи трудно разорвать, поэтому последовательность
белок достаточно стабилен. Хотя существует много возможных способов, которыми белок
цепь может быть свернута, конкретный образец складывания, принятый белком
полностью определяется его последовательностью.
Хотя существует много возможных способов, которыми белок
цепь может быть свернута, конкретный образец складывания, принятый белком
полностью определяется его последовательностью.
Во многих случаях рисунок складок «запирается» дисульфидными связями. Как мы обсуждали, изучая тиолы, наличие SH-групп вдоль белковой цепи дает возможность для сшивки между цепями или образования петель внутри цепи. Эти дисульфидные мостики важны для удержания белковой цепи в конкретная схема складывания.
Взгляд на Таблицу 18.1 говорит нам, что группы SH, необходимые для создания дисульфидные звенья находятся в аминокислоте цистеине. Белки, которые жесткие и используются в основном для структурных целей (кератин в волосах, кожа и перья, например) обычно имеют много дисульфидных связей и, таким образом, имеют высокое содержание цистеина.
Вернуться к плану курса
Аминокислоты
Встречающиеся в природе аминокислоты имеют общую структуру. Аминокислоты, как следует из названия, имеют две функциональные группы: аминогруппу (-NH 2 ) и карбоксильную группу (-COOH). Эти группы присоединены к одному (алифатическому) углероду. В органической химии углерод, непосредственно присоединенный к карбоксильной группе, находится в альфа (α) положении, поэтому все аминокислоты в белках состоят из альфа-аминокислот. Боковые цепи, которые отличают одну аминокислоту от другой, присоединены к альфа-углероду, поэтому структуры часто записываются так, как показано на рисунке , где R обозначает одну из 20 боковых цепей:
Эти группы присоединены к одному (алифатическому) углероду. В органической химии углерод, непосредственно присоединенный к карбоксильной группе, находится в альфа (α) положении, поэтому все аминокислоты в белках состоят из альфа-аминокислот. Боковые цепи, которые отличают одну аминокислоту от другой, присоединены к альфа-углероду, поэтому структуры часто записываются так, как показано на рисунке , где R обозначает одну из 20 боковых цепей:
Аминокислоты, обнаруженные в белках, имеют общая стереохимия. В структуре, показанной на рисунке, аминогруппа всегда находится слева от альфа-углерода. В органической химии эта стереохимия обозначается как L (от лево, означает левый). Таким образом, аминокислоты, содержащиеся в белках, представляют собой L-альфа-аминокислоты. (Биохимики, следуя привычке, обычно не относятся к стереохимии аминокислот в номенклатуре R и S.) Несколько D-аминокислот встречаются в природе, хотя и не в клеточных белках. (D происходит от dextro, означает право.) Например, некоторые пептидные антибиотики, такие как бацитрацин, содержат D-аминокислоты.
(D происходит от dextro, означает право.) Например, некоторые пептидные антибиотики, такие как бацитрацин, содержат D-аминокислоты.
Карбоксильные и аминогруппы аминокислот могут соответственно отдавать протон и принимать протон от воды. Этот обмен происходит одновременно в растворе, так что аминокислоты образуют в растворе дважды ионизированные частицы, называемые цвиттерионов (от немецкого zwei, означает два). Образование цвиттер-ионов можно объяснить принципами кислотно-щелочной химии.Самая сильная кислота, которая может существовать в воде, — это сопряженная кислота воды, ион гидроксония, H 3 O + . Карбоновые кислоты являются более сильными кислотами, чем вода, поэтому карбоксильная группа аминокислоты (pK a около 2) отдает протон воде. Точно так же α-аминогруппы (pK a больше 9) являются более сильными основаниями, чем вода, и принимают протон от воды. Таким образом, аминокислоты в воде имеют общую структуру:
Боковые цепи аминокислот придают им различные химические свойства и позволяют белкам иметь множество различных структур. Сколько белков возможно? Белковые цепи обычно имеют размер от 100 до 1000 аминокислот в длину. Даже если ограничиться наименьшей длиной цепочки, будет 20 100 , более 10 130 — то есть 1 со 130 нулями после нее — возможных первичных структур. (Опять же помните, что число элементарных частиц во Вселенной оценивается как 10 80 .) Очевидно, что не все эти потенциальные белки существуют в природе. Вместо этого первичные структуры белков связаны друг с другом, и почти все белки имеют гомологов, , то есть другие белки имеют общего предка.
Сколько белков возможно? Белковые цепи обычно имеют размер от 100 до 1000 аминокислот в длину. Даже если ограничиться наименьшей длиной цепочки, будет 20 100 , более 10 130 — то есть 1 со 130 нулями после нее — возможных первичных структур. (Опять же помните, что число элементарных частиц во Вселенной оценивается как 10 80 .) Очевидно, что не все эти потенциальные белки существуют в природе. Вместо этого первичные структуры белков связаны друг с другом, и почти все белки имеют гомологов, , то есть другие белки имеют общего предка.
Какие гомологи возможны? В общем, гомологичные белки имеют точно такие же короткие аминокислотные последовательности. В других случаях различия заключаются в замене одной боковой цепи аминокислоты другой, химически сходной. Существует шесть классов боковых цепей аминокислот; внутри группы боковые цепи аминокислот химически сходны. Замена одной боковой цепи аминокислоты на другую в той же группе известна как консервативная замена . Гомологичные белки связаны консервативными аминокислотными заменами, как показано на рис.Хотя неконсервативные замены допустимы в некоторых положениях первичной последовательности белка, общее правило, показанное на рисунке, соблюдается при оценке взаимосвязи двух первичных последовательностей белка. (Штрихи указывают на то, что все три белка имеют одну и ту же аминокислоту в этом положении — это действительно очень гомологичные белки!)
Гомологичные белки связаны консервативными аминокислотными заменами, как показано на рис.Хотя неконсервативные замены допустимы в некоторых положениях первичной последовательности белка, общее правило, показанное на рисунке, соблюдается при оценке взаимосвязи двух первичных последовательностей белка. (Штрихи указывают на то, что все три белка имеют одну и ту же аминокислоту в этом положении — это действительно очень гомологичные белки!)
Рисунок 2
Алифатические аминокислоты. Боковые цепи глицина, аланина, валина, лейцина и изолейцина, показанные на рисунке, содержат только насыщенные углерод-углеродные и углерод-водородные связи.Представление о том, что глицин содержит боковую цепь, может несколько сбить с толку, потому что четвертый заместитель на α-углероде представляет собой только один атом водорода. Единственная среди 20 аминокислот глицин не является оптически активным; D- и L-номенклатура не имеет значения. Аланин имеет метильную группу в боковой цепи, валин — 3-углеродную боковую цепь, а лейцин и изолейцин имеют 4-углеродные боковые цепи.
Аланин имеет метильную группу в боковой цепи, валин — 3-углеродную боковую цепь, а лейцин и изолейцин имеют 4-углеродные боковые цепи.
Рисунок 3
Ароматические аминокислоты. Фенилаланин, тирозин и триптофан содержат кольцевые системы. В порядке возрастания сложности фенилаланин имеет бензильную группу, а тирозин представляет собой фенилаланин с добавленной гидроксильной группой в транс-положении относительно метильной группы. Триптофан имеет два кольца, одно из которых содержит атом азота. Азот не ионизируется при биологически значимых значениях pH.
Ионизируемые основные аминокислоты. Гистидин, лизин и аргинин имеют атом азота, который, в отличие от азота триптофана, ионизирован в диапазоне рН, характерном для клетки.Гистидин имеет 5-членное имидазольное кольцо. Один из двух ионов азота имеет pK и около 7,0. Это означает, что при нейтральных значениях pH в клетках около половины молекул гистидина будут иметь протонированные боковые цепи (т.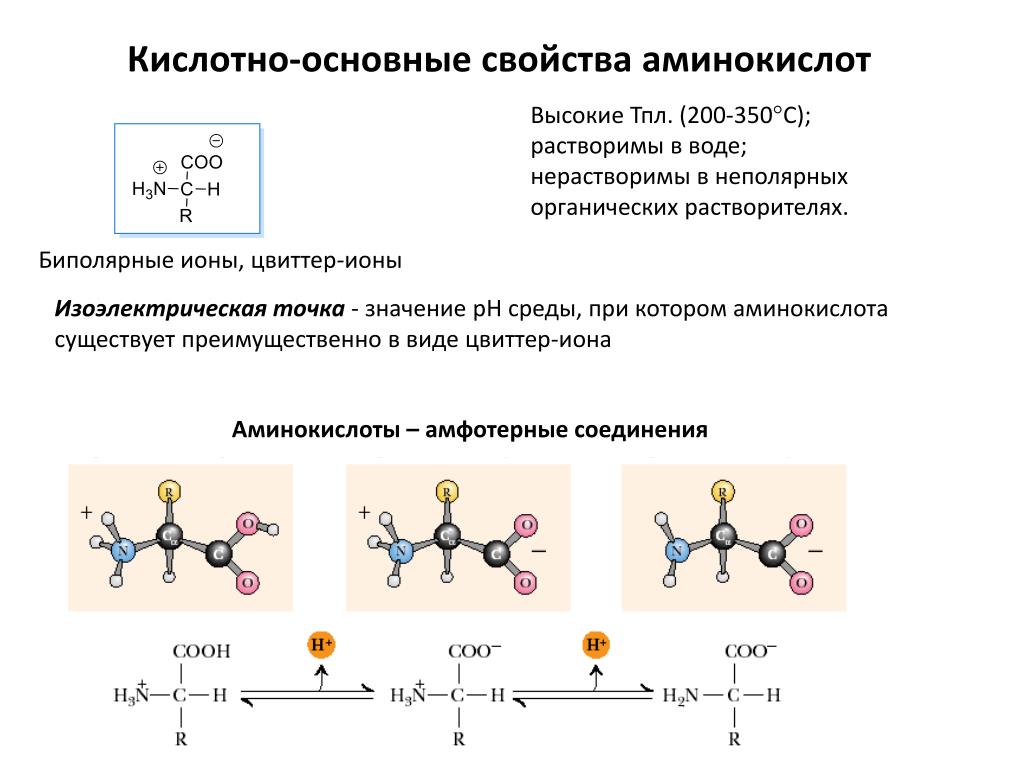 Гистидин часто используется в ферментах для связывания и высвобождения протонов во время ферментативной реакции.
Гистидин часто используется в ферментах для связывания и высвобождения протонов во время ферментативной реакции.
Лизин и аргинин почти полностью ионизированы при значениях рН, характерных для клетки.Лизин pK a больше 9; следовательно, он будет > 99% протонирован в клетке. Боковая цепь аргинина еще более проста; его pK a > 12. Следовательно, эти аминокислоты имеют суммарный положительный заряд в клетке.
Аминокислоты, содержащие карбоксилаты. Аспарагиновая кислота и аспарагин имеют четыре атома углерода; глутаминовая кислота и глютамин имеют в общей сложности пять атомов углерода. Аспарагиновая кислота имеет карбоновую кислоту, а аспарагин имеет амидную боковую цепь.Точно так же глутаминовая кислота имеет боковую группу карбоксильной кислоты, а глютамин имеет амидную группу. Значение pK a карбоксильных групп боковой цепи в аспартате и глутамате составляет около 4,0. Следовательно, эти группы боковых цепей почти полностью ионизированы в нейтральных условиях клеток и заряжены отрицательно.
Серин и цистеин можно рассматривать как связанные с аланином. Серин представляет собой аланин с гидроксильной (-ОН) группой, а цистеин представляет собой аланин с сульфгидрильной (-SH) группой.
Треонин имеет четыре атома углерода с гидроксильной группой на бета-углероде. Бета-углерод находится рядом с углеродом, содержащим альфа-углерод (альфа-углерод имеет аминогруппу). Наличие гидроксильной группы у треонина означает, что бета-углерод треонина оптически активен в дополнение к альфа-углероду. Как следует из названия, группа –ОН имеет конфигурацию D или трео по отношению к альфа-углероду. (Другая возможная стереохимия — эритро — вспомните букву Е, чтобы запомнить этот термин.Руки буквы Е указывают в одном направлении.)
Метионин имеет метильную группу на сере. В остове метионина на один углерод больше, чем в цистеине. (Цистеин с дополнительным углеродом называется гомоцистеином ; гомоцистеин является промежуточным продуктом в биосинтезе метионина. )
)
Пролин — лишний среди аминокислот. Он имеет четыре атома углерода, причем альфа-аминогруппа связана не только с альфа-углеродом, но и с последним углеродом боковой цепи.Циклическая боковая цепь означает, что пролин является конформационно жестким. То есть углерод-углеродные связи пролина в растворе не вращаются. Другие аминокислоты более гибки в растворе.
Пептидная связь. Пептидная связь соединяет карбоксильную и аминогруппы аминокислот. При активации карбоновые кислоты и амины образуют амидов . Аминокислоты бифункциональны, с каждой аминокислотой, имеющей как амино, так и карбоксильные группы. Пептиды состоят из аминокислот, соединенных «голова к хвосту» амидными связями.Пептиды классифицируют по длине цепи. Олигопептиды короче полипептидов , , хотя между двумя формами не существует определенного перехода. Соединение аминокислот с образованием пептидной связи формально происходит (хотя механизм ее образования более сложен) следующим образом:
Обратите внимание, что две аминокислоты могут образовывать дипептид (пептид, состоящий из двух единиц) одним из двух способов. Например, глицин и аланин могут образовывать глицилаланин (гли-ала) или аланилглицин (ала — гли):
Например, глицин и аланин могут образовывать глицилаланин (гли-ала) или аланилглицин (ала — гли):
Независимо от того, какое расположение происходит, каждый дипептид будет иметь одну свободную аминогруппу и одну свободную карбоксильную группу.Пептидные последовательности записываются в направлении от амино к карбоксильному концу.
Структура пептидной связи . Структура пептидной связи благоприятствует копланарным атомам N, C и O. Хотя пептидная связь формально представляет собой одинарную связь углерод-азот, неспаренные электроны на карбоксильной группе кислорода и на атоме азота могут перекрываться своими пи-орбиталями, что делает систему из трех атомов частично двойной связью. Система с частичной двойной связью затрудняет вращение пептидной связи в растворе.В результате пептидные связи могут существовать в одном из двух конформационных изомеров , с двумя атомами углерода либо цис-, либо транс-по отношению друг к другу.
Обычно предпочтение отдается транс-конформации. Пролин является исключительным случаем, потому что его пептидная связь не содержит водорода, что затрудняет замену цис- и транс-изомеров друг на друга:
Пролин обычно находится в транс-изомере, хотя превращение (изомеризация) между цис- и транс-формами может катализироваться специфическими ферментами.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Аминокислота — Химическая энциклопедия
В 1953 году Гарольд Юри и Стэнли Миллер провели удивительный эксперимент. в котором они производили «молекулы жизни» из смеси газы, которые они предложили, существовали в изначальной земле. Эксперименты смоделировали, что произойдет, когда удары молнии дадут энергию для химических реакций в атмосфере и предложил гипотезу о том, как на нашей планете могла зародиться жизнь.Аминокислоты были жизненно важными молекул, которые образовались в этом эксперименте и подтвердили эту гипотезу для происхождение жизни.
Аминокислота – это молекула, состоящая из двух функциональные группы , амин и карбоновая кислота , как показано на рисунке 1. На этом рисунке есть дополнительная группа называется боковой цепью, обозначаемой Р. Различия, наблюдаемые в встречающихся в природе аминокислотах, возникают из-за различия в этой боковой цепи.Двадцать встречающихся в природе молекул перечислены в таблице 1. В водный раствор , эта структура может измениться так, что протон из СООН перейдет в NH 2 и цвиттерион сформирован. Эта структура зависит от рН раствора. Большинство физиологические системы попадают в такой диапазон рН, что цвиттерионная форма аминокислоты являются наиболее стабильной формой в организме человека.
Стереохимия аминокислот также является важной концепцией. То атом углерода, отмеченный α на рисунке 1, является хиральным, поэтому аминокислота может быть один из двух энантиомеров. Обратите внимание, что структура, показанная на иллюстрации имеет аминогруппу справа и карбоксильная группа на вершине. Эта конфигурация обозначается формой L, и все встречающиеся в природе аминокислоты имеют эту форму.
Аминокислоты делятся на три группы в зависимости от природы боковая цепь.Девять аминокислот имеют боковые цепи, неполярный . Почти 50 процентов аминокислот, содержащихся в белках, имеют неполярные боковые цепи. Вторая категория аминокислот содержит шесть различные молекулы, имеющие полярные боковые цепи. Наконец, группа из пяти аминокислоты имеют боковые цепи, которые не только полярны, но и заряжены.
Рисунок 1.
Ключевая химическая характеристика аминокислот заключается в том, что они соединяются друг с другом. для образования белков.Поскольку функциональная группа COOH представляет собой кислоту, а NH 2 функциональная группа представляет собой основание, два конца аминокислот могут легко реагировать друг с другом. белок синтез сложнее, чем простая кислотно-щелочная нейтрализация, но учтите что бывает когда два амино
Таблица 1. Двадцать распространенных аминокислот, встречающихся в белках.
| ДВАДЦАТЬ ОБЫЧНЫХ АМИНОКИСЛОТ, ВХОДЯЩИХ В БЕЛКИ | ||
| Имя | Однобуквенное сокращение | Трехбуквенное сокращение |
| Глицин | г | Гли |
| аланин | А | Ала |
| Валин | В | Вал |
| Лейцин | л | Лея |
| изолейцин | я | Иль |
| Метионин | М | Встретились |
| Фенилаланин | Ф | фе |
| пролин | п | Про |
| серин | С | сер |
| Треонин | Т | тр |
| Цистеин | С | Цис |
| Аспарагин | Н | Асн |
| глютамин | Вопрос | Глн |
| Тирозин | Д | Тир |
| Триптофан | Вт | Трп |
| Аспартат | Д | Аспид |
| Глутамат | Е | Глю |
| гистидин | ЧАС | Его |
| Лизин | К | Лис |
| Аргинин | р | Арг |
кислоты реагируют с образованием пептидной связи.Новая молекула, теперь димер с двумя аминокислотные остатки по-прежнему имеют один конец, который является кислотой, а другой конец, который является основанием, поэтому очевидно, что процесс образования пептидной связи с другой аминокислотой может повторяться. Если много аминокислот натянуто вместе получается природный полимер — белок.
Библиография
Барретт, Г.К., и Элмор, Д.Т. (1998). Аминокислоты и пептиды. Нью-Йорк: Издательство Кембриджского университета.
Кантор, С.Р., и Шиммель, П.Р. (1980). Биофизическая химия, часть I. Сан-Франциско: WH Фриман.
Джонс, Дж. (2002). Синтез аминокислот и пептидов. Оксфорд: Книги Оксфордского университета.
