Химия, 8–9 класс: уроки, тесты, задания
Химия, 8–9 класс: уроки, тесты, задания-
-
Предмет химии
-
Физические тела и вещества
-
-
Разделение смесей.
 Методы очистки веществ
Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
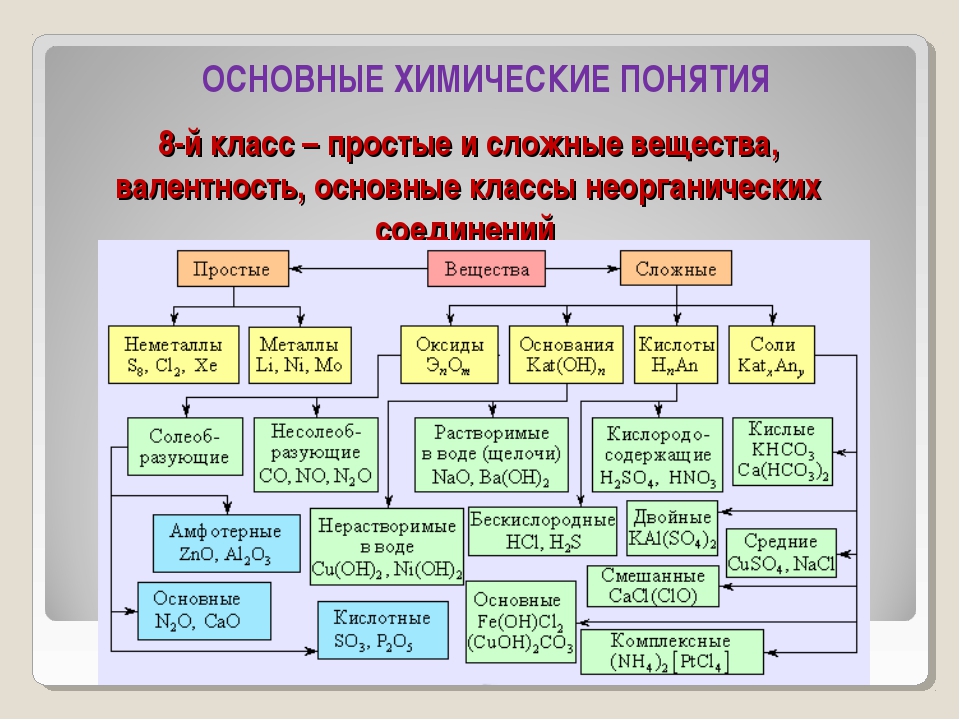
Отличия простых и сложных веществ
-
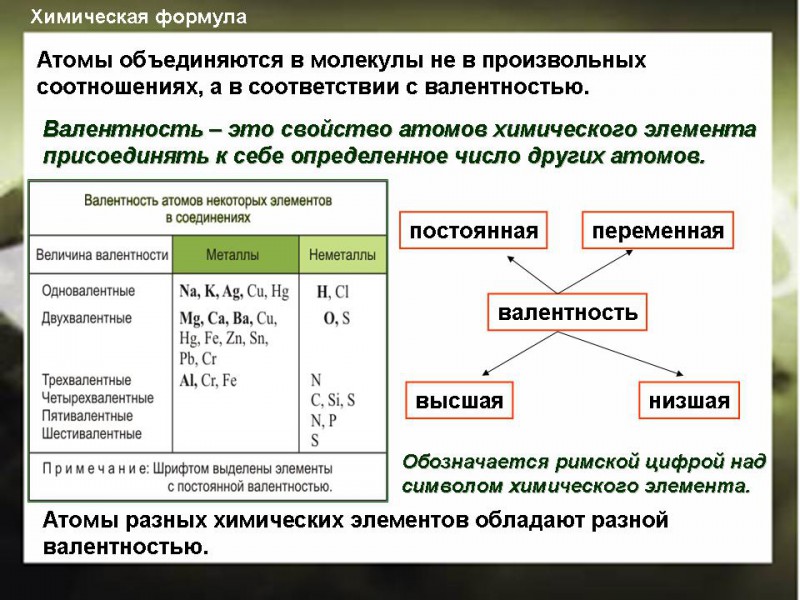
Валентность.
 Степень окисления. Составление формул по валентностям и степеням окисления
Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ в химических реакциях
-
Уравнения химических реакций
-
-
-
Классификация веществ
Металлы
-
Неметаллы
-
Оксиды: классификация, свойства, получение
-
Основания: классификация, свойства, получение
-
Кислоты: состав, свойства, получение
-
Амфотерные гидроксиды
-
Соли: состав и свойства
Взаимосвязь между классами неорганических веществ
-
-
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
-
-
-
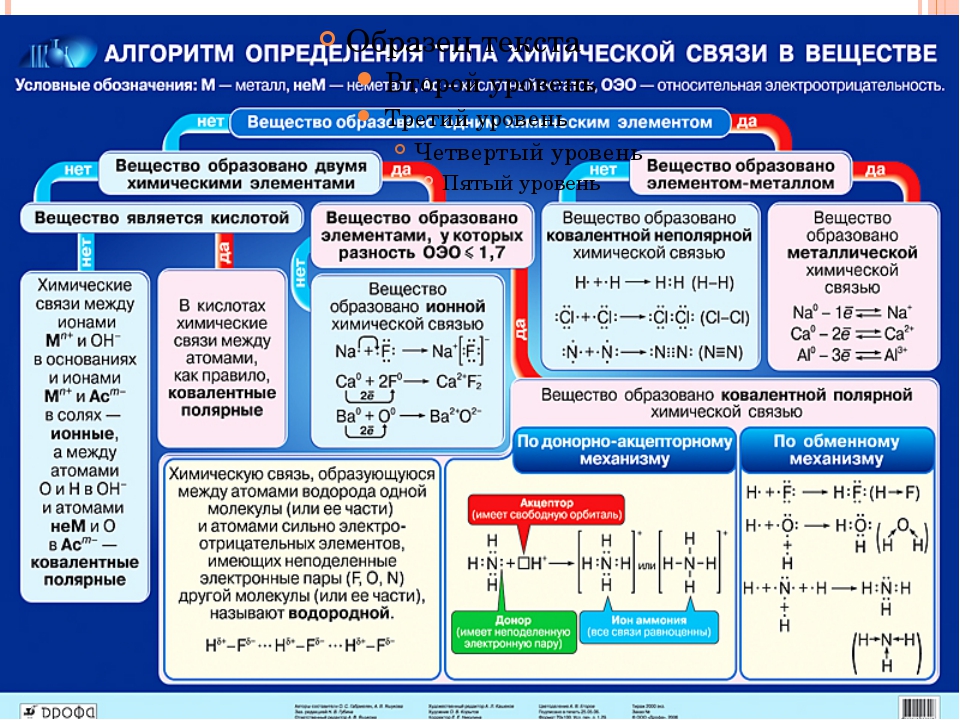
Электроотрицательность
-
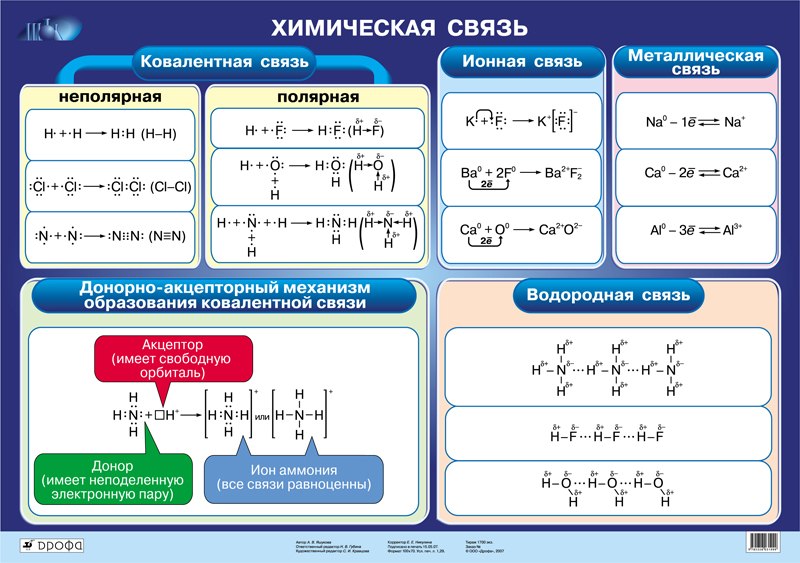
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
-
-
-
-
Окислители и восстановители, окисление и восстановление
-
-
-
Состав растворов
-
Растворение.
 Растворимость
Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов.
 Индикаторы
Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
-
-
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции.
 Катализаторы
Катализаторы
-
-
-
Свойства водорода
-
Свойства кислорода
-
Вода
-
Галогены.
 Хлор и его соединения
Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор. Соединения фосфора
-
Углерод.
 Соединения углерода
Соединения углерода
-
Кремний. Соединения кремния
-
-
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
-
-
-
Состав и строение органических веществ
-
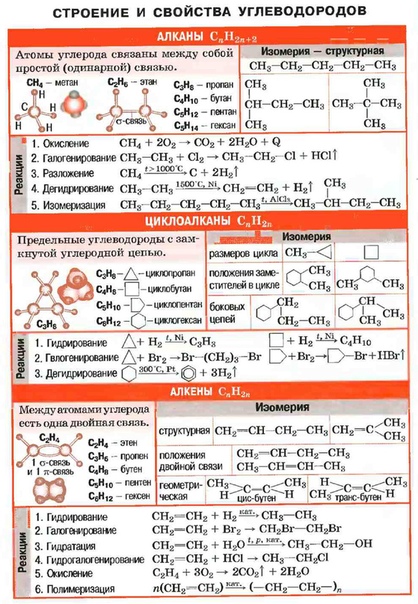
Углеводороды.
 Полимеры
Полимеры
-
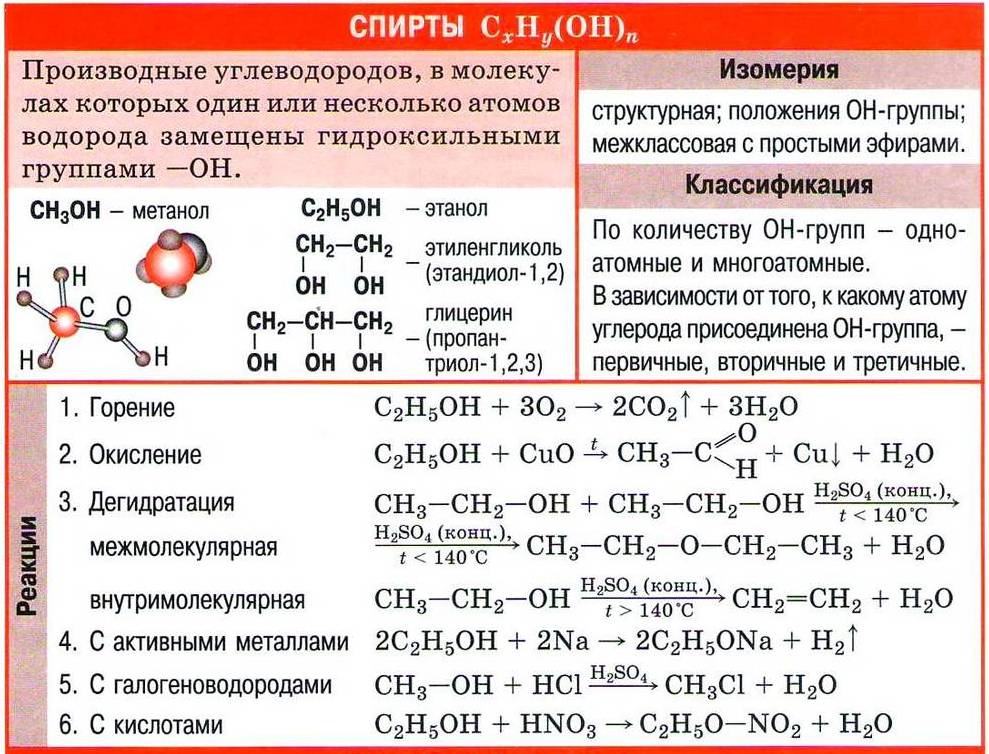
Одноатомные и многоатомные спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы: классификация и свойства
-
Белки
-
-
-
Природные источники углеводородов
-
Химия и пища.
 Химия и здоровье
Химия и здоровье
-
-
-
Методы научного познания. Химический эксперимент
-
Методы получения, собирания и распознавания газов
-
Обнаружение ионов
-
-
-
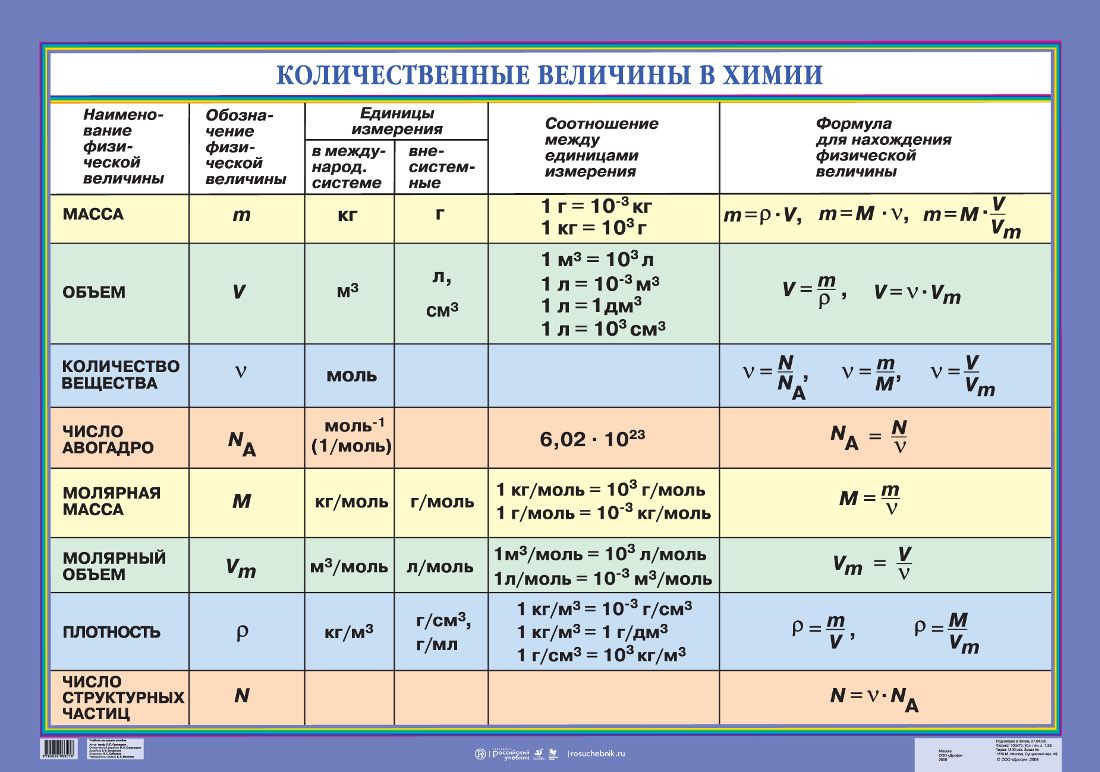
Физические величины
-
Относительная атомная и молекулярная массы.
 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
-
Основные понятия и законы химии
В развитии химии большую роль сыграло атомно-молекулярное учение, которое отличалось от предыдущих теорий своей логикой. Основы атомно-молекулярного учения впервые были изложены
Основы атомно-молекулярного учения впервые были изложены
М.В.Ломоносовым (1741 г.) в работе „Элементы математической химии». В основе этого учения лежит принцип дискретности вещества: любое вещество состоит из отдельных, очень малых частиц. Различие между веществами обусловлена различием между их частицами: частицы одного вещества одинаковы, частицы различных веществ — разные.
Частицы вещества находятся в непрерывном движении при любых условиях. Для большинства веществ такими частицами являются молекулы.
Молекула — наименьшая частица вещества, которая имеет постоянный состав и способна сохранять основные химические свойства этого вещества.
Молекулы простых веществ состоят из атомов одного химического элемента, а молекулы сложных веществ — из атомов различных элементов.
Атом — это наименьшая химически неделимая частица химического элемента, сохраняющая его химические свойства.
В состав молекул может входить различное количество атомов, например, молекулы газов (кроме инертных) главным образом, состоят из двух атомов, а молекулы белков — из сотен тысяч атомов.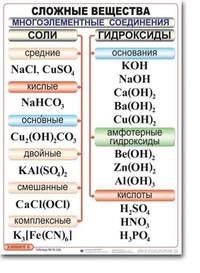 Размеры атомов определяются величинами порядка десятых долей нанометра (10-10 м). Абсолютные массы атомов и молекул очень малы: масса атома самого легкого элемента (Водорода) составляет 1,67-10-24 г, а масса атома одного из самых трудных элементов — Свинца — 3,4-10-22 г. Понятно, что такими величинами оперировать неудобно, поэтому в расчетах используют не абсолютные значения масс атомов, а относительные.
Размеры атомов определяются величинами порядка десятых долей нанометра (10-10 м). Абсолютные массы атомов и молекул очень малы: масса атома самого легкого элемента (Водорода) составляет 1,67-10-24 г, а масса атома одного из самых трудных элементов — Свинца — 3,4-10-22 г. Понятно, что такими величинами оперировать неудобно, поэтому в расчетах используют не абсолютные значения масс атомов, а относительные.
В 1960г. Международный союз теоретической и прикладной физики, а в 1961 г. Международный союз теоретической и прикладной химии (IUPAC — International Union of Pure and Applied Chemistry) приняли единую шкалу атомных масс, по которой массы атомов и молекул сравнивают с 1/12 массы атома Углерода 12C.
Количество молекул в макроскопических телах чрезвычайно велика, поэтому принято указывать не абсолютное количество атомов и молекул, а относительную. Число молекул или атомов в определенном веществе принято сравнивать с количеством атомов, содержащихся в 0,012 кг Карбона. Относительное количество атомов и молекул в веществе характеризуют физической величиной, которую называют количеством вещества (n).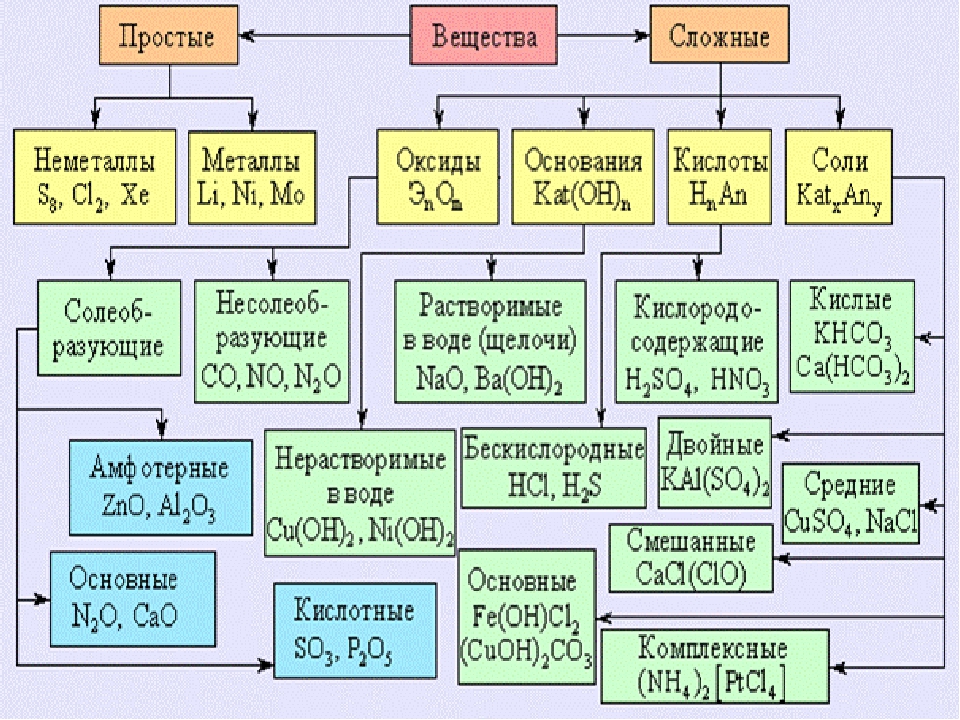 1023 моль-1. Тогда количество вещества можно рассчитать следующим образом:
1023 моль-1. Тогда количество вещества можно рассчитать следующим образом:
n = N /#Л
Кроме относительной молекулярной массы Mr, в химии и физике широко применяют понятие „молярная масса М».
Молярною массой (М) называют массу вещества, взятого в количестве один моль, ее выражают в граммах на моль (г/моль): M = m/n.
Надо заметить, что количественно молекулярная и молярная масса одинаковые, но относительная молекулярная масса — безразмерная величина, а молярная масса имеет размерность г/моль).
Один из основных законов химии — закон сохранения массы — открытый и экспериментально подтвержден великим русским ученым М.В.Ломоносовим в 1748 г. Этот закон можно сформулировать так:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. В 1789 г. закон сохранения массы независимо от М.В.Ломоносова открыл французский химик А.Л.Лавуазьє, который доказал, что во время реакции остается постоянной не только общая масса вещества, но и масса каждого из элементов веществ, которые взаимодействуют.
Закон сохранения массы стал научной основой для создания первых понятий химии, для открытия новых законов. Благодаря этому закону М.В. Ломоносов и А.Л. Лавуазье стали первыми учеными, которые обозначили первые представления о химические элементы и различные виды веществ.
Выдающийся российский физик П.М. Лебедев экспериментально доказал, что свет способно создавать давление, его можно рассматривать как один из видов материи. Подобные опыты натолкнули великого немецкого физика А.Ейнштейна на мысль, что между массой тела m и его энергией Е существует связь:
Е= mc2,
где с — скорость света.
Следовательно, уравнение Эйнштейна является математическим выражением закона сохранения массы и энергии — одного из основных законов современной физики, который иногда называют законом эквивалентности массы и энергии. В соответствии с этим законом,
Изменении массы на величину Am соответствует вполне определенное изменение энергии.
Небольшие изменения массы должны вызвать значительные энергетические эффекты, поскольку множитель с равна 9-1016 (скорость света составляет 3-108 м/с). Небольшиеэнергетические эффекты, сопровождающие химические реакции, не могут привести к заметным изменениям масс веществ, поэтому во время проверки закона сохранения массы в химических реакциях всегда подтверждалась его справедливость.
Небольшиеэнергетические эффекты, сопровождающие химические реакции, не могут привести к заметным изменениям масс веществ, поэтому во время проверки закона сохранения массы в химических реакциях всегда подтверждалась его справедливость.
Благодаря открытию закона сохранения массы в конце XVIII в. в химии прочно укоренились количественные методы исследования было изучено количественный состав многих веществ, известный французский химик Же. Пруст открыл закон постоянства состава.
Бытовая химия загрязняет воздух гораздо больше, чем думали
- Джонатан Эймос
- Корреспондент Би-би-си по вопросам науки
Автор фото, Getty Images
Подпись к фото,Товары бытовой химии — источних загрязнения воздуха летучими органическими соединениями
Проведенное в США исследование показало, что бытовая химия и химические вещества, содержащиеся в продуктах ежедневного использования, стали одним из главных источников загрязнения воздуха в городах. В этом смысле они уже соперничают с выхлопами автомобилей.
В этом смысле они уже соперничают с выхлопами автомобилей.
Исследование, которое провели ученые Университета Колорадо, было в основном посвящено так называемым летучим органическим соединениям (ЛОС).
Эти вещества содержатся в продуктах на основе нефти, таких как чистящие жидкости и краски. Попадая в воздух, ЛОС могут образовывать вредные для здоровья частицы.
Ученые утверждают, что мы сильно недооцениваем вред, наносимый летучими органическими соединениями, не являющихся частью автомобильных выхлопов.
Это кажется удивительным, поскольку по весу мы используем гораздо больше горючего, чем других химических продуктов.
Меньше бытовой химии
Около 95% сырой нефти идет на производство различных видов топлива и лишь примерно 5% перерабатывается для использования в таких продуктах, как дезодоранты, пестициды и клеи.
Но эксперт американского Национального управления океанических и атмосферных исследований доктор Джессика Гилман утверждает, что выводы исследования не должны удивлять, поскольку автомобильное топливо сгорает (превращаясь в основном в двуокись углерода и воду), а многие продукты бытовой химии просто выделяют эти вещества в воздух, как и было задумано при их создании.
«Чаще всего их используют в качестве растворителей — в таких продуктах, как жидкость для снятия лака или лак для волос, которым я пользовалась сегодня утром. Часто их используют в качестве чистящих веществ, например, для чистки ковров», — объясняет Джессика Гилман.
«Без них трудно, поскольку альтернатива таким чистящих жидкостям — обычная вода, которая, как вы знаете, не выводит все пятна», — говорит Джессика Гилман.
Ее коллега доктор Брайан Макдональд тем не менее считает, что сокращение количества химических веществ в домашнем хозяйстве было бы делом полезным.
«Используйте как можно меньше подобных веществ — не больше, чем необходимо», — советует он.
Анализ
Роджер Харрабин, обозреватель Би-би-си по вопросам экологии
Воздух, которым мы дышим, содержит настолько богатую смесь разнообразных компонентов, что исследователи не могут быть уверены в том, какое химическое вещество вызывает ту или иную проблему.
Установить ограничения по выбросам в атмосферу, которые удовлетворили бы всех, — это еще более сложная задача. Некоторым нравятся освежители воздуха. Другие от них задыхаются.
Чистящие аэрозоли полезны в хозяйстве, но у некоторых от них слезятся глаза. Я знаю человека, у которого в детстве спровоцировали астму химические выделения из сборной мебели в его спальне.
Эта область исследования запущена, поскольку население и СМИ уделяют основное внимание не химическим выделениям в доме, а автомобильным выхлопам на улице.
Ученые из Университета Колорадо собрали воедино большой объем информации по теме своего исследования.
Они заново изучили, какие химические вещества производители используют в своих товарах, и проверили статистику различных надзорных и регулирующих ведомств. Они запустили в небо над Лос-Анджелесом зонды, берущие пробы воздуха и оценили итоги измерений качества воздуха в домах и на улице, собранных другими исследователями.
Исследовательская группа пришла к выводу, что количество ЛОС, выделяемых в США потребительскими и промышленными продуктами, весьма вероятно, в два или три раза выше нынешних оценок. (Существуют также естественные источники ЛОС в окружающей среде).
Ученые также считают, что эти исследования переоценивают значение выбросов в атмосферу автомобильных двигателей.
50 на 50
В качестве примера исследователи приводят нынешние оценки американского Агентства по защите окружающей среды.
Агентство предполагает, что около 75% выбросов основанных на нефти ЛОС приходятся на автомашины и примерно 25% — на химические продукты.
По оценке ученых Университета Колорадо, расклад здесь примерно 50 на 50.
Автор фото, DAVID ILIFF
Подпись к фото,Ученые Университета Колорадо собрали воедино большой объем информации по теме своего исследования
«Использование этих продуктов приводит к тому, что выделения из них ЛОС сравнимы с тем, что вылетает из выхлопной трубы вашего автомобиля. Одна из причин в том, что в США, как и в Европе, меры по контролю над автомобильными выхлопами оказались действительно успешными», — говорит доктор Макдональд, ведущий автор исследования.
Одна из причин в том, что в США, как и в Европе, меры по контролю над автомобильными выхлопами оказались действительно успешными», — говорит доктор Макдональд, ведущий автор исследования.
Эксперты утверждают, что результаты американского исследования применимы и к другим развитым странам, в том числе европейским.
«Это исследование — полезное напоминание о том, что дискуссии о чистоте окружающей среды должны принимать во внимание все источники ее загрязнения и что одни лишь меры по снижению автомобильных выхлопов решают только часть проблемы», — говорит профессор респираторной медицины Медицинской школы Брайтона и Суссекса Энтони Фру:
Автомобили, конечно же, выделяют в атмосферу не только ЛОС. В числе вредных выбросов автомобильных двигателей — оксиды азота (NOx).
Более того, именно соединения ЛОС и NОx создают в атмосфере частицы, наиболее вредные для нашего здоровья.
Исследование Университета Колорадо опубликовано в журнале Science Magazine.
просто и понятно о ее значении в химии
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Определение
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.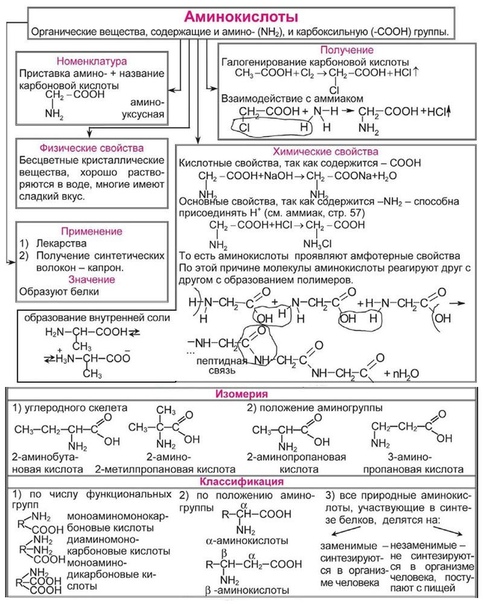
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
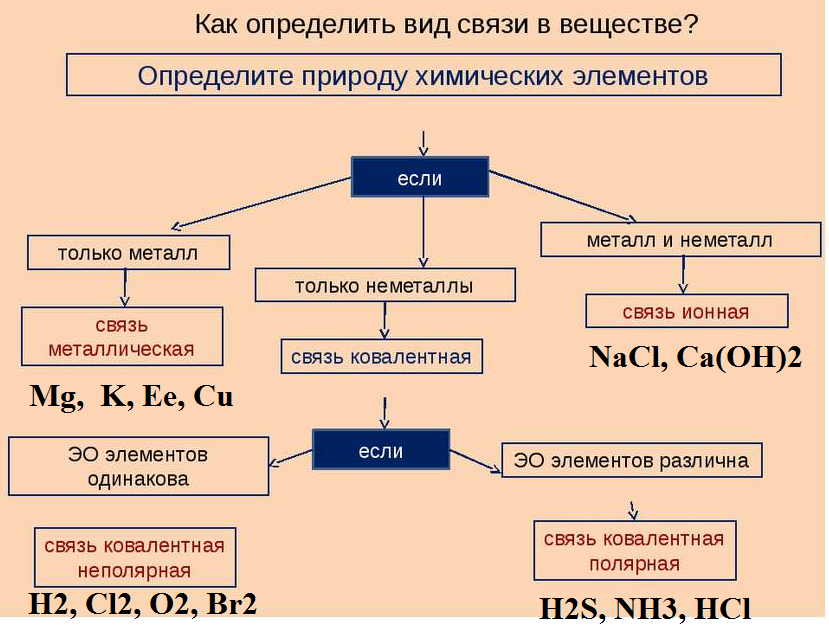
Как определить вид связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.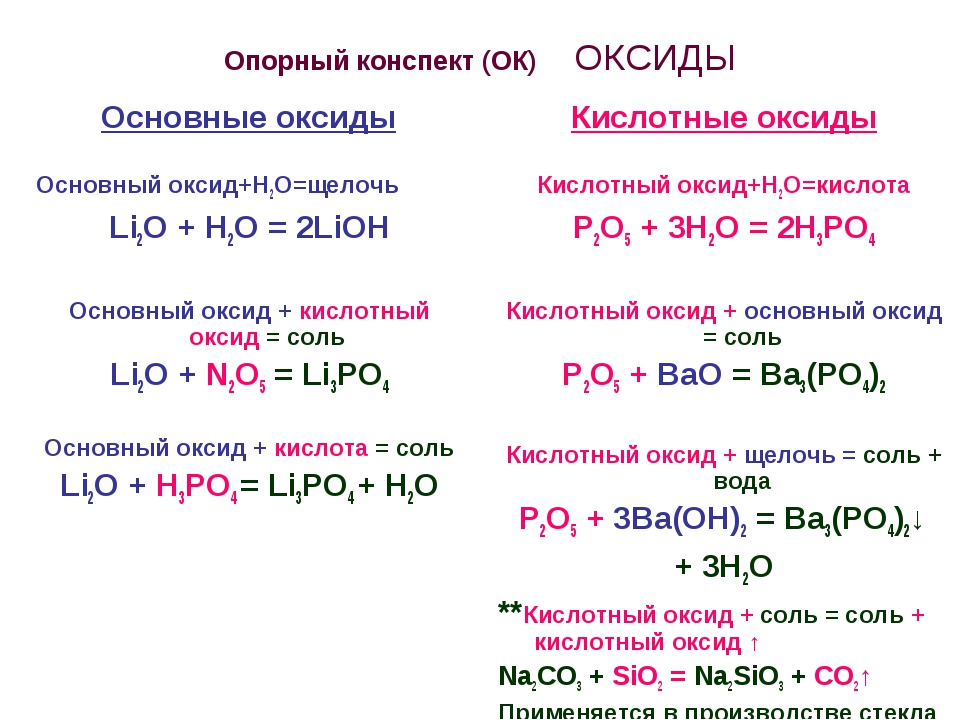
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Видео
И в завершение познавательное видео об разных видах химической связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Bonding: Definition, Types, Properties.
«Универсальный» глицерин применение и химия [Инфографика]
Глицерин применение – пищевые продукты, косметика и взрывчатые веществаЧитая этикетки косметических средств, мы зачастую замечаем в их составе глицерин. Также глицерин находится во множестве продуктов питания и в некоторых фармацевтических продуктах. Но какова причина его включения в состав и почему находит такое широкое применение глицерин?
Химия глицеринаГлицерин – простейший представитель трехатомных спиртов, при комнатной температуре представляет собой вязкую жидкость, без цвета и запаха, со сладким вкусом. Его можно выделить в качестве одного из побочных продуктов в производстве мыла, которое включает обработку растительных или животных жиров сильными щелочными растворами, а также глицерин синтезируется побочным продуктом в производстве биодизеля. Синтетически, глицерин можно получить из пропилена. Эти три метода в сочетании способствуют производству 950,000 тонн глицерина, которые ежегодно производятся в США и Европе.
Синтетически, глицерин можно получить из пропилена. Эти три метода в сочетании способствуют производству 950,000 тонн глицерина, которые ежегодно производятся в США и Европе.
Глицерин имеет широкий спектр применения в пищевой промышленности. Из-за его сладости, он может использоваться в качестве подсластителя в напитках – его сладость составляет приблизительно 60% от нормального белого сахара (сахарозы). Кроме того, он может действовать как увлажнитель, вещество, которое поглощает и удерживает влагу из окружающей среды. Это означает, что глицерин используется в качестве добавки в выпечке, который долго сохраняет ее свежий вид. Нашел глицерин применение и в кондитерских изделиях куда его добавляют с целью предотвращения кристаллизации сахара, а в ликеры его добавляют в качестве загустителя, ну и еще применение глицерина в качестве растворителя пищевых красителей (Глицерин – пищевая добавка под номером Е422).
Свойства, отмеченные выше также, делают глицерин полезным в фармацевтических препаратах и косметике. Необходимо отметить применение глицерина в зубных пастах, продуктах по уходу за кожей, кремах для бритья, и средствах полоскания ротовой полости. Его часто добавляют в качестве сглаживающего агента, а также в качестве увлажнителя для предотвращения высыхания продуктов. В фармации применение глицерина в качестве подсластителя, а также в качестве покрытия таблеток, используют для уменьшения размера частиц порошков лекарственных средств.
Очень полезен глицерин в составе антифриза. Благодаря наличию трех гидроксильных групп, глицерин образовывает водородные связи с молекулами воды. Композиция, содержащая 70% глицерина, имеет точку замерзания -38˚C (-36˚F). С 1920-х использовались композиции, содержащие 60% этиленгликоля для получения более низкой температуры замерзания: -45˚C (-49˚F). Это преимущество сдерживалось тем, что этиленгликоль токсичен, и приблизительно 225 мл 50%-го раствора является летальной дозой (LD50) для 80-килограммового взрослого.
Глицерин также находит применение в качестве сырья для производства взрывчатых веществ: это исходное вещество в производстве нитроглицерина, взрывчатых жидкостей, обычно находящихся в динамите и в небольшом количестве в топливе. Его производят взаимодействием глицерина с серной кислотной и азотной кислотой. В результате получается масляная жидкость, которая может взорваться при нагревании, или даже при падении контейнера с этой жидкостью. Поэтому его смешивают с абсорбирующими жидкостями для уменьшения чувствительности. Как следствие нашел глицерин применение и в промышленных, и военных целях, в качестве взрывчатых веществ, таких как TNT.
Есть, конечно, и другое применение глицерина – это очень важный химикат с широким диапазоном применений благодаря своим свойствам. Заключительный пример можно найти прямо на кухне: целлофан, используемый для упаковки пищевых продуктов. Целлофан в основном состоит из целлюлозы, но также содержит и глицерин (его добавляют для повышения эластичности и прочности).
На данный момент, ввиду большого избытка глицерина, получаемого в процессе производства биодизеля, осуществляется множество исследований в поисках новых способов применения глицерина, поистине универсального соединения.
Делитесь впечатлениями:
Таблицы DPVA.ru — Инженерный Справочник |
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Начала химии. Основные понятия. Классификация веществ. Закон постоянства вещества. Атомно-молекулярное учение. Основные понятия. Классификация веществ. Закон постоянства вещества. Атомно-молекулярное учение.
Поделиться:
| |||||||||||||||||||||
|
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. |
||||||||||||||||||||||
|
Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая |
Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Краткая химическая термодинамика — 3-е издание — A.P.H. Питерс
Содержание
Энергия
Царство термодинамики
Учет энергии
Движущие силы природы
Установка сцены: основные идеи
Система и окружение
Функции состояния
Механическая работа и температура Формы 60 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 и их взаимное преобразование
Формы возобновляемой энергии
Солнечная энергия
Энергия ветра
Гидроэлектроэнергия
Геотермальная энергия
Энергия биомассы
Ссылки
Проблемы
Первый закон термодинамики
Gas
Процессы постоянного тома
Процессы постоянного давления
Новая функция: Enthalpy
Отношения между ΔH и δ U
Использование и конвенции ΔH
Энтальпия Смена реакции
Стандартные энтальпии формирования
Многие виды использования δ F H F H 0 H 0 Data 0 Data
Список литературы
Проблемы
Термохимия
Calorimetryertry
Calorimeteretere
Calorimeters
Дифференциальные сканирующие калориметрии
Концепции теплосъемки
Концепции теплоснабжения
Концепции сгорания и пламени
Изменение энтальпии реакции
Энергии связи
Средняя энергия диссоциации связи
ссылки
Проблемы
Спонтанные изменения
Спонтанные изменения
Повседневные процессы
Экзотермичность: Возможный критерий
Спонтанные экзотермические процессы
Спонтанные процессы, связанные с изменением тепла
эндотермических процессов
Проблемы
Энтропия
Измерение энтропии
Второй закон термодинамики
Обратимость и энтропия
Изменение энтропии с температурой
Адиабатическое сжатие
Абсолют E Antropies
Третий закон термодинамики
Δ S для фазовых изменений
Направление времени
Ссылка
Проблемы
Свободная энергия: Арбитр
Процессы в изолированных системах
Гиббс Свободная энергия, G
Гиббс Свободная энергия и максимальная работа
Некоторые процессы с точки зрения Гиббса Свободная энергия
Процессы адсорбции
ЭКЗМЕНЫ
Эндотермические химические процессы
Экзотермический химический процесс
Стандартные изменения свободных энергии
Ссылка
Проблемы
Химическое равновесие
преамбулы
с давлением газа
Химический потенциал, μ
Давление и химический потенциал идеальных газов
Химический потенциал реальных газов
Активность
Активная масса чистых жидкостей и твердых тел
Активность веществ в растворах
Растворители или Мин. или компоненты
или компоненты
A Подведение итогов: деятельность как объединяющее понятие
Практические аспекты деятельности
Равновесие и изотерма реакции
Резюме
Список литературы
Задачи
Равновесные эксперименты и их интерпретация
Дата до уравнения изохоры Лейк 900 900 Шателье 9006
Применение уравнения изохора
Процессы испарения
Разложение Соединения Fe (OH) 3
Высокотемпературный диссоциация водяного пара
Уравнение Clapeyron
Сводка
Список литературы
Проблемы
Электрохимические клетки
Электрохимические ячейки
Энергетика ячейки
Стандартные электродные потенциалы
Изменение ЭДС ячейки с активностью
Ионная активность
Анализ э.м.ф. Данные для поиска E 0
Изменение ЭДС в зависимости от температуры
Литература
Проблемы
Свободная энергия и промышленные процессы
Свободная энергия как функция температуры
Форма интегрированного уравнения Гиббса-Гельмгольца 90 Уравнение Гельмгольца
Таможные формы свободной энергии
Синтез равновесных расчетов Ethanol
Использование коэффициентов активности
Эллингемные диаграммы
Профилактика коррозии
Электролиз алюминия
Тепловое снижение термического воздействия Magnesia
Титана и процесс KROLL
CILICON METAL
Резюме
Список литературы
Задачи
Вычислительная термохимия
Расчет адиабатической температуры пламени
Осаждение карбидной и нитридной фаз из разбавленного раствора в легированной стали
CVD Производство сверхчистого кремния
Переработка Отходы алюминиевой электролизной печи
Производство металлургического кремния в дуговой печи
Резюме
Ссылки
Приложения
Ответы
Рекомендуемая дополнительная литература
Алфавитный указатель
Selina Solutions for Concise Science Chemistry 1 Класс 9 ICSE глава 3 — Вода [Последнее издание]
Selina Solutions for Concise Science Chemistry 1 Класс 9 ICSE глава 3 — Вода Вода) включают все вопросы с решением и подробным объяснением.
 Это избавит студентов от сомнений по любому вопросу и улучшит навыки применения при подготовке к экзаменам. Подробные пошаговые решения помогут вам лучше понять концепции и устранить путаницу, если таковая имеется.
Shaalaa.com предлагает решения ICSE по краткой научной химии 1 класса 9 CISCE, которые помогают учащимся лучше и быстрее понять основные понятия.
Это избавит студентов от сомнений по любому вопросу и улучшит навыки применения при подготовке к экзаменам. Подробные пошаговые решения помогут вам лучше понять концепции и устранить путаницу, если таковая имеется.
Shaalaa.com предлагает решения ICSE по краткой научной химии 1 класса 9 CISCE, которые помогают учащимся лучше и быстрее понять основные понятия.
Кроме того, мы в Shaalaa.com предоставляем такие решения, чтобы студенты могли подготовиться к письменным экзаменам.Решения Selina для учебников могут быть основным подспорьем для самообучения и идеальным руководством для самопомощи для студентов.
Понятия, изложенные в Краткой научной химии 1 Класс 9 ICSE глава 3 Вода — это вода, наша линия жизни, вода — универсальный растворитель, соли, удаление жесткости воды, высолы, гигроскопические и высыхающие вещества, высыхающие и обезвоживающие вещества, мягкие и твердые Вода, Причины жесткости, Преимущества и недостатки жесткой воды, Физические свойства воды, Химические свойства воды, Растворы как «смеси» твердых веществ в воде, Компоненты растворов, Различные типы растворов, Насыщенные растворы, Концентрация раствора, Растворимость, кристаллы и кристаллизация, гидратированные и безводные вещества, предотвращение загрязнения воды.
Использование решений Selina Class 9 Водные упражнения для учащихся — это простой способ подготовиться к экзаменам, поскольку они включают в себя решения, расположенные по главам и по страницам. Вопросы, связанные с Selina Solutions, являются важными вопросами которые можно задать на выпускном экзамене. Максимум учащиеся 9-го класса CISCE предпочитают Selina Textbook Solutions, чтобы набрать больше баллов на экзамене.
Получите бесплатный просмотр дополнительных вопросов главы 3 Water Class 9 для Concise Science Chemistry 1 Class 9 ICSE и можете использовать Shaalaa.com, чтобы держать его под рукой при подготовке к экзамену
Научно-практический журнал по химическому образованию
Билл Байерс , Ольстерский университет, Великобритания
Джордж Боднер , Университет Пердью, США
Melanie Cooper , штатный университет Мичиган, US
Iztok Devetak , Университет Любляны, Словения
onno de jong , Университет Утрехт, Нидерланды
Энди Дикс , Университет Торонто, Канада
Ян Х ван Дриэль , Мельбурнский университет, Австралия
Одилла Финлейсон , Городской университет Дублина, Ирландия
Элисон Флинн 90 90 Оттава , Канада Martin Goedhart , Университет Гронингена, Нидерланды
Орла Кэтрин Келли , Церковь Ирландии Образование, Ирландия
Iwona Maciejowska , Ягеллонский университет, Польша
Rachel Mamlok-Naaman , Институт Вейцмана наук, Израиль
Мансур Ниаз , Universidad de Oriente, Ven Ezuela
Marykay Orgill , Университет Невады, Лас-Вегас, US
TINA L Levelton , Университет Монаш, Австралия
Георгий Papageorgiou , Деморитский университет Фракии, Греция
ILKA PARCHMANN , Университет Киль, Германия
Марисса Ролник , Университет Витса, Южная Африка
Майкл К. Сири , Эдинбургский университет, Великобритания
Сири , Эдинбургский университет, Великобритания
Дерек Син-пуи Чунг , Китайский университет Гонконга
Даниэль Тан , Наньянский технологический университет, Сингапур
KEITH TABER , Университет Кембридж, Великобритания
Zoltán Toth , Университет Дебрецен, Венгрия Георгиос Цапарлис (редактор учреждения), Университет Ионины, Греция Inbal Tuvi-Arad , открытый Израильский университет, Израиль Габриэла К. Уивер , Университет Пердью, США Ури Золлер , Хайфский университет, Израиль Ваня Гомеш Зуин , Федеральный университет Сан-Карлоса9, Бразилия
Посмотрим правде в глаза, органическая химия может показаться сложной для изучения.Особенно с точки зрения новичка. Именно по этой причине мы составили подробное руководство по выбору лучшего учебника по органической химии для вашей ситуации . Но как из ВСЕХ выбрать лучший ? Количество материала там зашкаливает. Но не волнуйтесь! Независимо от того, являетесь ли вы студентом, химиком или научным сотрудником, профессором университета, родителем или учителем средней школы, для вас всегда найдется хорошая книга по органической химии. В этом исчерпывающем обзоре мы поможем вам купить нужный учебник! Если вы не хотите искать дальше и сразу переходите к 1-му выбору для большинства ситуаций , «Органическая химия» Клейдена, Гривза и Уоррена, безусловно, является лучшим учебником для большинства нужд. Первоклассный подход к обучению, простой в использовании, с множеством примеров из реальной жизни, достаточным количеством практических задач и красивой графикой.Если бы мне нужно было выбрать только один, это был бы лучший учебник по органической химии: Clayden’s Organic Chemistry Clayden’s Organic Chemistry никогда не подведет вас как учебник по химии. Продолжайте читать, и вы найдете наиболее подходящую рекомендацию! В следующей таблице вы можете увидеть краткое описание каждой книги. Таким образом, вы можете узнать, соответствует ли он вашим потребностям с первого взгляда. Еще не решили? Не волнуйтесь! Ниже приводится наиболее полный и исчерпывающий обзор лучших учебников по органике в Интернете. Кроме того, если вы ищете лучшее дополнение для изучения органической химии, ознакомьтесь с нашим обзором лучших комплектов моделей по органической химии. Как мы уже ясно сказали, книга Клейдена будет лучшей книгой по органической химии в большинстве ситуаций . Авторами этой книги являются Джонатан Клейден, Ник Гривз и Стюарт Уоррен. Это достаточно просто, так что если вы только начинаете изучать органическую химию, вы сможете наверстать упущенное.Но также охватывает темы из самых продвинутых курсов органической химии. Если вы профессор, это также будет хорошей ставкой для планирования лекций. Кроме того, это отличный справочник по органической химии для любого химика. Эта книга стоит у меня на полке с тех пор, как я начал изучать химию в бакалавриате, и она всегда найдется там. Кроме того, это один из немногих доступных автономных учебников по химии. Многие считают Clayden лучшей книгой по органической химии .Клейден делает акцент на понятиях и связывает эти понятия вместе, надстраивая друг друга. Первое издание вышло в 2001 г., но последнее (2012 г. Если вы действительно хотите понять основы органической химии, Clayden’s — лучший выбор.Большинство других учебников структурированы по функциональным группам и наборам реакций, которые вы можете запустить, чтобы сделать это или добраться до них. С другой стороны, Клейден начинает с введения очень простой и распространенной реакции: реакции присоединения к карбонильным соединениям. Затем идут различные карбонильные реакции, такие как замещение или конденсации (реакции с потерей воды). Этот плавный прогрессивный механистический подход выделяет Клейдена среди всех текстов по органической химии, которые обычно более «просты» и полагаются на отдельные главы для отдельных типов молекул. Этот великолепный учебник является одним из
те немногие, которые хорошо используют цвета в качестве визуального инструмента обучения. Это, по моему
мнение, должно быть обязательным для любого хорошего учебника органической химии, опубликованного
после 2010 г. Стиль книги весьма уникален. Она написана в неформальной и честной манере, что делает ее чрезвычайно приятной для восприятия. Кроме того, в книге представлено множество примеров, основанных на интересных/известных молекулах или химических задачах.Единственные недостатки, о которых я могу думать, это то, что некоторые из последних глав, например, по металлоорганической химии, были бы лучше, если бы они были немного больше расширены. Кроме того, нет проблем внутри главы. Наконец, как видите, последнее издание 2012 года; если получение очень современного учебника является вашим главным приоритетом, возможно, вам следует изучить другие тексты. В остальном Clayden явно лучший инструмент для изучения органической химии. Примечательно, что они используют теорию молекулярных орбиталей в качестве модели для рационализации объяснений самого начала, что отлично подходит для учебных целей. В целом учебник Clayden по органической химии представляет собой идеальное сочетание хорошего содержания, отличного форматирования и образовательного и развлекательного стиля. На втором месте сразу после Clayden, его Organic Chemistry Дэвида Р. Кляйна. С точки зрения чисто вводного учебника по органической химии Лучший учебник по органической химии [Полное руководство]

Какая книга по органической химии самая лучшая?
 Если вам нужен учебник по органической химии для самостоятельного изучения, это тоже будет здорово. Однако, возможно, вы ищете что-то другое. Или для другого подхода к обучению. Или, может быть, вы ищете что-то более продвинутое, к чему стоит обращаться через годы.Многие из книг из этого списка сейчас лежат у меня в кабинете, а мои студенческие годы давно прошли.
Если вам нужен учебник по органической химии для самостоятельного изучения, это тоже будет здорово. Однако, возможно, вы ищете что-то другое. Или для другого подхода к обучению. Или, может быть, вы ищете что-то более продвинутое, к чему стоит обращаться через годы.Многие из книг из этого списка сейчас лежат у меня в кабинете, а мои студенческие годы давно прошли. Сводная таблица: 13 лучших учебников
Полный обзор всех книг
1.
 Клейден Органическая химия
Клейден Органическая химия  ) в значительной степени охватывает наиболее актуальные темы органической химии последних лет, такие как катализируемые палладием реакции Судзуки или Хека, или реакция метатезиса Граббса (все они удостоены премии Нобелевская премия).
) в значительной степени охватывает наиболее актуальные темы органической химии последних лет, такие как катализируемые палладием реакции Судзуки или Хека, или реакция метатезиса Граббса (все они удостоены премии Нобелевская премия).
Прогрессивный путь к фундаментальному пониманию 
Clayden: богатое содержание, визуально привлекательное и занимательное: 
2. Klein
Organic Chemistry
Clayden’s — наш лучший вариант 1, потому что он универсален для удовлетворения различных потребностей или ситуаций.Но если вы заинтересованы в лучшем учебнике по органической химии, чтобы следовать и понимать вводные концепции органической химии, Кляйн — это то, что вам нужно. Это также доступный ассортимент учебников.
Это также доступный ассортимент учебников.
Klein Organic Chemistry В отдельной книге используется подход, основанный на навыках. Они вводят и строят поверх всех типичных понятий, которые вы можете найти в любом учебнике по органической химии. Но они делают акцент на развитии навыков понимания и поддержки этих концепций.Многие профессора, которых я знаю, считают, что эта книга следует лучшему подходу к преподаванию органической химии.
Кляйн: отличный инструмент для студентов, которые ищут лучшее введение в органическую химию
В книге много задач, а не только в конце каждой главы (традиционный способ), но и везде, где они могут быть важны для понимания содержания читателем. Если ты действительно вводные проблемы, вы также можете взять копию учебного пособия для студентов и руководства по решениям.
Этот учебник по органической химии
включает множество цветных диаграмм, которые особенно полезны для идентификации различных
видов облигаций, или для иллюстрации распределения расходов.
В целом Klein Organic Chemistry является лучшим учебником по органической химии для получить основы органической химии правильно .
3.
Органическая химия как второй языкДэвид Р. Клейн не только автор отдельная книга, которую мы оценили как лучший учебник по органической химии, но также опубликовал Органическая химия как Второй язык. Я обнаружил, что многие люди путают их обоих, но они две совершенно разные книги. Кляйн Органическая химия Standalone — это классический учебник объемом 1300 страниц, который прекрасно охватывает все концепции органической химии, которые вам понадобятся.
Так что же такого особенного в этой другой книге?
Ну, с другой стороны, Органическая химия как второй язык похож на сокращенную версию более длинной книги на 400 страниц. В этой версии в основном отсутствуют предыстории, ненужные примеры и тематические исследования.Он сводится к тому, что действительно важно для понимания органической химии : концепции, краткие введения, четкие объяснения, примеры и задачи.
Органическая химия – предмет не из легких. Если вы студент, который собирается начать изучать органическую химию, вам нужно быть готовым. Мы бы сказали, что Органическая химия как второй язык является лучшей книгой по органической химии для подготовки к этому предмету .
Если вы просто интересуетесь органической химией , эта книга определенно станет вашим лучшим оружием.Но это не значит, что эта книга как раз для этого. Нет, он определенно охватывает все, что делает большинство других учебников, но гораздо более кратким и практичным способом. Кроме того, эта книга включает в себя все решения проблем, поэтому нет необходимости покупать отдельную книгу с решениями.
Должен ли я выбрать этот более короткий вариант?
Но это довольно необычная химия
учебник, так как это не типичная полная книга с более чем 1000 страниц. Учитывая
что мы постараемся помочь вам решить, является ли органическим
Химия как второй язык подходит именно вам.
Вам следует купить Органическая химия как второй язык , если:
- Вы ищете книгу, которую на самом деле можно прочитать полностью за месяц до начала изучения органической химии конечно, и идти с самого низа прямо вверх по части подготовки.
- Вы немного отчаялись и думаете что органическая химия слишком сложна для вас. Эта книга избавит вас от это.
- Вы хотите стать асом органической химии курсы/экзамены (что абсолютно не является взаимоисключающим, так как это отличный инструмент для обучения!).
- Вам нужно идеальное дополнение к другой обычный учебник по органической химии, или к курсу, в котором они дают вам достойные наборы материалов.
- Вы профессор, который хочет поставить вместе эффективный, действенный и полный курс органической химии.
Вам не следует выбирать Органическая химия в качестве второго языка , если:
- Вы уже знакомы и
правильно понять большинство вводных понятий органической химии.

- Вы хотите купить книгу, чтобы углубиться в более продвинутые понятия.
- Вы хотите хорошую органическую химию справочный учебник.
В целом, эта книга отлично подходит для понимания основ органической химии. Это поможет вам в наилучшей форме для изучения органической химии.
4.
Высшая органическая химияДамы и господа Представляю вам лучший учебник органической химии для продвинутые пользователи . Кэри и Сандберг Advanced Органическая химия на самом деле представляет собой пару двух учебников (Часть А и Часть Б), которые очень хорошо дополняют друг друга, но совершенно независимы с точки зрения содержания.
Эта книга, состоящая из двух частей, — моя самая любимая в мире. химический раздел моей полки. У меня есть и третье, и пятое издание. серия, и она была значительно обновлена с учетом самых последних успехи в исследованиях.
Advanced Organic Chemistry — это просто самый блестящий и подробный отчет в области органической химии. На протяжении двух томов все концепции подробно объясняются, а множество примеров организовано в виде схем, которые напоминают настоящую научную обзорную статью.Эта пара книг, вероятно, не подходит для абсолютных новичков, изучающих свой первый курс органической химии (она все равно будет работать, но много информации будет выше вашей головы). Однако, если вы от среднего бакалавриата до аспиранта, этот учебник должен иметь ! Ознакомьтесь с каждым из следующих томов:
На протяжении двух томов все концепции подробно объясняются, а множество примеров организовано в виде схем, которые напоминают настоящую научную обзорную статью.Эта пара книг, вероятно, не подходит для абсолютных новичков, изучающих свой первый курс органической химии (она все равно будет работать, но много информации будет выше вашей головы). Однако, если вы от среднего бакалавриата до аспиранта, этот учебник должен иметь ! Ознакомьтесь с каждым из следующих томов:
Advanced Organic Chemistry Part A: Structure and Mechanisms
Первая часть глубоко охватывает основы органическая химия и основные типы механизмов.Это автономный книга высшего уровня по этим темам, но она очень хорошо дополняется второй том, посвященный реакционной способности и синтезу.
Передовая органическая химия, часть B: Реакция и синтез
Часть B, абсолютно лучшая передовая органическая
В учебнике химии основное внимание уделяется типам реакций и их применению в
органический синтез. Две книги вместе дают наиболее полное
основу для изучения органической химии, которую вы можете найти.
Две книги вместе дают наиболее полное
основу для изучения органической химии, которую вы можете найти.
Мне еще предстоит встретиться со специалистом в области органической химии которые не владеют или не слышали о Advanced Органическая химия как лучший учебник органической химии.
5.
Введение в общую, органическую и биологическую химиюСейчас мы переходим от самого передового учебника по органической химии к самому общему. Timberlake’s Chemistry ближе к учебнику по общей химии, который затем углубляется как в органическую химию, так и в биологическую химию.
Вы начинаете путешествие, чтобы изучить химию, и вы заинтересованы в более ориентированном на органику книга? Это определенно ваш ответ!
Вам не нужен обычный учебник по общей химии, прежде чем вы погрузитесь в Тимберлейка. Начать можно буквально с нуля по химии . Книга начинается с обязательной математики, стоящей за химией, и удивительным образом склеивает все воедино.
На нем хранится МНОГО контента, но он не делает трудно читать.Есть отличные примеры, изучайте проверки и практикуйте задачи на всех уровнях «химической специализации».
Эта книга поможет вам разобраться в любой общей химии конечно, и любой вводной органической химии или даже биологической химии курсы. Кроме того, если вы заинтересованы в изучении химии самостоятельно, от общие понятия в органическую химию, это, скорее всего, лучший путь вверх.
6. Брюс
Органическая химияОрганическая химия Паула Ю.Bruice — один из самых недавно обновленных учебников. Если вы хотите взяться за учебник по органической химии, который очень хорошо написан и легко читается , Брюс должен быть в вашем списке лучших.
В этой книге основное внимание уделяется ответам на вопросы «почему?»
постоянно, поэтому он постоянно укрепляет и вновь укрепляет концепции
после того, как они уже были введены. Есть много практических вопросов, которые
можно покопаться.
Одним из самых сильных моментов является то, как книга все время перенаправляет вас туда, где концепции впервые обсуждались.В этом, Кстати, если что-то не очень понятно, можно моментально найти то, что нужно прочитайте, чтобы понять это. Такой способ сосредоточиться на концепциях и дальнейшем построении В верхней части списка Брюса сразу за пятью лучшими книгами по органическому химия.
7. Vollhardt
Органический Химия: структура и функцииЭто один из самых известных учебников для органических химии, Питер К. Фоллхардт — великий педагог. В нем представлены все понятия и тему комплексно.Фоллхардт не только даст вам основы, но он глубже погрузится в концепции, механизмы реакции и объяснение что именно происходит во всех типах органических реакций. Это очень полная книга, которая никогда не выйдет из моды.
Вероятно, самый существенный недостаток этого органического текст химии заключается в том, что это обычно дорого. Но если вы можете себе это позволить, все значит, вперед!
Я хотел бы подчеркнуть систематичность книги, и это
действительно хорош для начинающих. Они придерживаются номенклатуры IUPAC во всех
случаи. Например, они используют «пропанон» вместо общепринятого названия «ацетон».
или «оксациклопропан» вместо общепринятого «оксид этилена». Иногда общий
имена, выходящие за рамки систематических обозначений, могут сбить учащихся с толку. у тебя не будет
эта проблема с книгой Фоллхардта.
Они придерживаются номенклатуры IUPAC во всех
случаи. Например, они используют «пропанон» вместо общепринятого названия «ацетон».
или «оксациклопропан» вместо общепринятого «оксид этилена». Иногда общий
имена, выходящие за рамки систематических обозначений, могут сбить учащихся с толку. у тебя не будет
эта проблема с книгой Фоллхардта.
Кроме того, эта книга является одной из книг с наибольшим количеством материала , иногда она может показаться вам скучной, но она является идеальным справочным учебником по органической химии.
8. McMurry
Органический Chemistry John McMurry — еще один замечательный учебник по органической химии, рекомендованный многими профессорами. У меня есть старая первая версия этой книги, и с годами она становилась значительно толще, поэтому охватывает более широкий круг тем. Однако некоторые люди утверждают, что на самом деле в процессе повторного редактирования стало еще хуже. Я сам не сравнивал разные издания, но это нужно учитывать.
Если бы мы сравнили его с его прямым конкурентом, Vollhardt, я бы сказал, что Vollhardt выделяется количеством и разнообразием контента.С другой стороны, Макмерри гораздо более лаконичен, что приводит к более ясным объяснениям . Книга Макмерри очень легко читается и заставит вас влюбиться в органическую химию! Это также более доступный вариант.
Основные недостатки, которые я нахожу в в этой книге недостаточно практических упражнений возрастающей сложности, и советы по дальнейшему решению более сложных задач. Кроме того, Макмерри Это прекрасный учебник по органической химии.
9. Wade
Органическая химияИздание 9 th этого Книга была опубликована недавно (2016 г.), автором ее является Лерой Г.Уэйд и Ян В. Симек. Это блестящий образец учебного материала, и определенно входит в число лучших учебников по органической химии.
В книге большое внимание уделяется выполнению домашних заданий.
проблемы и обновлять их с каждым новым изданием. По содержанию это
отлично, и он обновляется довольно часто.
По содержанию это
отлично, и он обновляется довольно часто.
Недостатком Уэйда является то, что для последняя изданная в 2016 году книга, в ней многого не хватает в графическом дизайне и форматировании. Схемы и чертежи не очень привлекательны и иногда могут вызвать затруднения визуализировать, что вредно при изучении органической химии.
Но с другой стороны, пояснения и практические задачи просто великолепны . Кроме того, учебник Клейдена и Уэйда был учебником органической химии, которым я сам пользовался в студенческие годы. Но я думаю, что вы уже знаете, какой из них я предпочитаю.
10. Соломоновы острова
Органическая химия Еще один классический учебник по органической химии, который определенно входит в десятку лучших. То, что он занимает последнее место, не означает, что он плохой. Это хороший текст. Он довольно хорошо объясняет все концепции, и подчеркивает важность понимания, а не просто запоминания .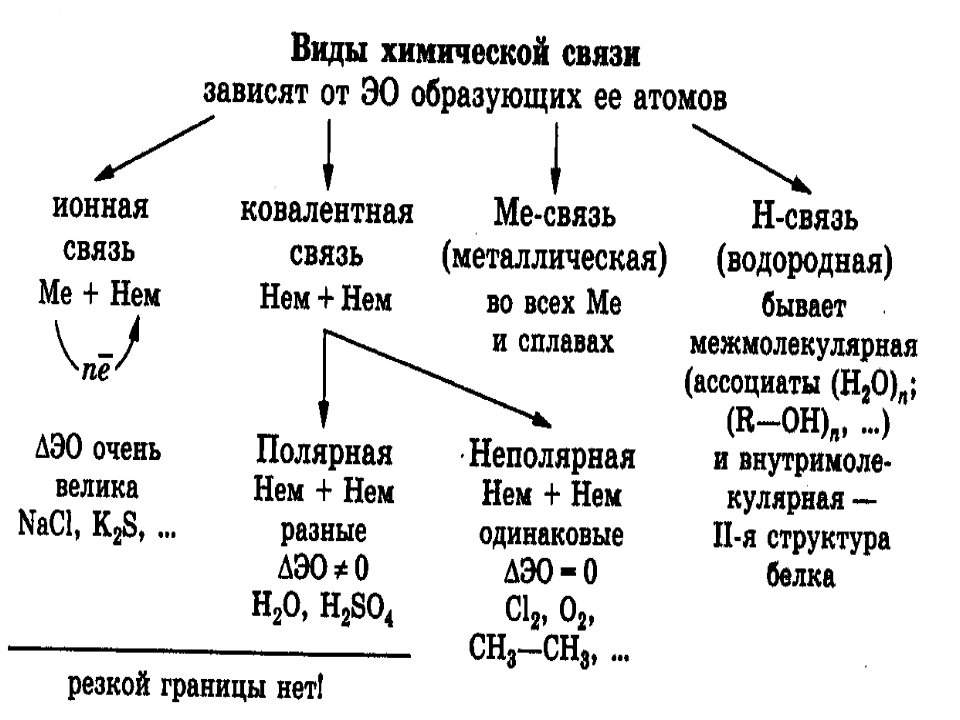 Он подталкивает вас к логике органической химии и хорошо использует аналогии. Вы можете проверить Соломонс Органическая химия здесь:
Он подталкивает вас к логике органической химии и хорошо использует аналогии. Вы можете проверить Соломонс Органическая химия здесь:
Порядок, в котором содержание Представлено как-то странно. Иногда кажется, что нужно читать, хотя последние главы, чтобы понять первые. это не самая большая проблема когда-либо, когда дело доходит до учебника для колледжа, но такие проблемы мешают ему из лучших учебников органической химии.
Дополнительные и прочие материалы
После исчерпывающего обзора «классических» лучших книг по органической химии мы хотели упомянуть еще три книги, которые могут быть вам интересны.Если вы ищете дополнения к своему учебнику по органической химии для самостоятельного изучения , возможно, вы захотите взглянуть на некоторые из них.
Вы решили, какой учебник купить, но хотите большего, чтобы хорошо подготовиться, или, может быть, книгу для самостоятельного изучения!
Это не типичные «автономные» учебники для колледжей. Однако весьма практичный и поучительный подход этих книг может оказаться для вас привлекательным. Они определенно помогут вам установить основы вашего обучения.Затем вы можете строить поверх этого.
Однако весьма практичный и поучительный подход этих книг может оказаться для вас привлекательным. Они определенно помогут вам установить основы вашего обучения.Затем вы можете строить поверх этого.
11. Руководство по выживанию в лаборатории органических химических веществ: руководство для учащихся по методам
Это входит в список лучших книг по органической химии для лаборатория . Лабораторные книги по химии могли бы заполнить целый пост отзывы само собой. Но я хотел убедиться, что добавил сюда лучший, как дополнение любого фактического учебника, который вы, возможно, выбрали.
Это руководство по выживанию — лучший компаньон для типичного студента (второкурсники-младшие) лабораторные курсы органической химии.Если вы преподаете или пройдя любой из этих курсов, получите экземпляр этой книги и переходите к следующему уровень!
Должен признаться, что совсем недавно я не знал этой книги, но когда я прочитал ее, я подумал, что это невероятно облегчит мою школьную жизнь! Он охватывает безопасность в лаборатории, как правильно вести лабораторный журнал, основное оборудование, лабораторные методы органической химии (такие как перекристаллизация, экстракция, дистилляция и т. д.), лабораторные приемы, основные эксперименты, хроматографические методы, такие как ТСХ или флэш-колонка, и, наконец, спектроскопические и другие приемы характеристики.В основном все, что вам нужно, чтобы выжить в любой лаборатории органической химии, которую вы можете там найти. Книга очень полезная и чрезвычайно увлекательная, с игривым/неформальным стилем письма, в ней даже можно найти несколько шуток. Вы не пожалеете об этой покупке!
д.), лабораторные приемы, основные эксперименты, хроматографические методы, такие как ТСХ или флэш-колонка, и, наконец, спектроскопические и другие приемы характеристики.В основном все, что вам нужно, чтобы выжить в любой лаборатории органической химии, которую вы можете там найти. Книга очень полезная и чрезвычайно увлекательная, с игривым/неформальным стилем письма, в ней даже можно найти несколько шуток. Вы не пожалеете об этой покупке!
12. Нажатие стрелки в органической химии: легкий Подход к пониманию механизмов реакций
Я думаю, что это одна из лучших дополнительных книг по органической химии. Эта книга Дэниела Э. Леви заполняет значительный пробел в школьном образовании по химии: органическая химия — это толкание стрелок.Я полагаю, что большинству профессоров и студентов будет значительно полезно прочитать Arrow-Pushing in Organic Chemistry . Книга рисует красивую картину того, как вы должны подходить к изучению механизмов толкания стрелы, что в основном язык органической химии .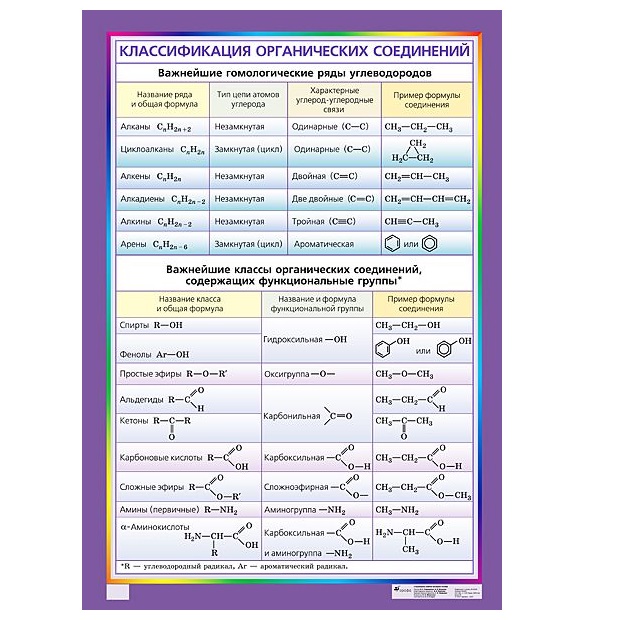
Это действительно отличная рабочая тетрадь или дополнение. Тем не мение, это не учебник и не чисто учебная книга. Это не начинается из понятий новичка, не объясняет основ органической химии в первых главах.Он буквально ныряет в толкающие стрелы механизмы, поэтому является очень практичным ресурсом. Он начинает объяснять концепции после нескольких главы, и возвращается к объяснению вещей, к которым уже обращались в начало практическим путем. Он следует странному порядку, но может работать на вас, если вы просто хотите «увидеть, как все работает» с самого начала вашего читать.
13. Органическая химия I для чайников
Этот член серии «для чайников» представляет собой интересный краткий обзор вводного курса органической химии.Это не учебник, и так относиться к нему нельзя. С набором «Органическая химия I для чайников» вы можете очень практично поцарапать поверхность органической химии. Я не особый поклонник этого учебника. Не потому, что это плохо для обучения: отлично подходит для изучения самых основ , но после того, как у вас закончатся ресурсы.
Он охватывает такие понятия, как номенклатура, стереохимия, функциональные группы, самые основные реакции органической химии (отщепление, замена) и содержит несколько интересных задач.Все очень неформально и прямолинейно. Если вы посещаете вводный курс органической химии, это может быть идеальным дополнением. Это очень наглядно, чего и требует органическая химия. Поскольку это не полный учебник, а просто вводное практическое изложение, это очень доступный ресурс.
Вскоре вам захочется большего, поэтому я поместил эту книгу в этот последний дополнительный раздел.
Подведение итогов: краткий обзор трех лучших книг
Итак, я закончу краткой справкой: три лучших книги по органической химии .Один из них будет работать для вас в большинстве ситуаций, это безопасные ставки. В зависимости от ваших конкретных потребностей вы можете выбрать тот или иной:
Возможно, вы еще не совсем разбираетесь в органической химии. Если вы готовитесь к экзамену по химии AP, вам следует ознакомиться с этим обзором наших лучших рекомендаций, чтобы сдать экзамен по химии AP! Кроме того, вот для экзаменов по химии SAT.
Мы также рассмотрели некоторые наборы по химии для младших школьников (и даже для взрослых!).
Кроме того, по многочисленным просьбам после получения нескольких электронных писем мы также подготовили несколько других руководств по обзору:
Если вы пропустите какие-либо книги по органической химии, которые вас интересуют, сообщите нам об этом в комментариях, и мы обязательно приложим к этому руку. один экземпляр и добавить его в обзор.Наслаждайтесь изучением органической химии и удачи!
Selina Concise Chemistry Class 7 ICSE Solutions PDF Скачать Бесплатно
Вы изо всех сил пытаетесь понять разницу между атомом и молекулой? Или не в состоянии получить точные и подходящие определения твердого тела, жидкости и газа? Если да, то прекратите поиски, так как вы получите все ответы здесь, на этом веб-сайте. Позвольте мне прояснить для вас еще одну вещь: это вспомогательный сайт, поэтому он никогда не запрашивает у вас регистрацию или вход в систему.Чтобы помочь студентам, этот сайт предоставляет возможность бесплатной загрузки.
ICSE — одна из лучших досок в Индии, на которой можно увидеть жесткие соревнования. Итак, если вы хотите взломать это, вы должны быть настолько проницательными и умными, а учебника для этого недостаточно, вам нужно что-то дополнительное. И именно поэтому этот сайт предоставляет PDF-файл Selina Concise Chemistry Class 7 ICSE Solutions.
Загрузить Selina Chemistry Class 7 ICSE Solutions PDF по главам
Стоит или нет?
Это общий вопрос, который вполне закономерен, будет ли этот PDF работать на самом деле или нет.Просто чтобы заверить вас, что я делюсь этим блогом. Selina Publishers Concise Chemistry Class 7 ICSE Solution — это тот материал, в котором вы получите решенные и объясненные вопросы и ответы от опытных учителей. Следуя этому PDF-файлу, вы легко сможете получить хорошие оценки на экзамене.
В вашем предмете «Химия» 7 глав, и каждая из них прекрасно объяснена здесь. Некоторые очень важные главы, такие как Элементы, Соединения и Смеси. Без понимания концепции вы не сможете хорошо работать.Итак, в этом PDF-файле вы получите хорошее руководство, такое как определение элемента, металлоидов, инертных или благородных газов, атома, молекулы и молекулярной формулы.
Без понимания концепции вы не сможете хорошо работать.Итак, в этом PDF-файле вы получите хорошее руководство, такое как определение элемента, металлоидов, инертных или благородных газов, атома, молекулы и молекулярной формулы.
После завершения каждой главы вы получите упражнение только для вашей самооценки и развития. В этом упражнении есть вопрос вроде —
.- Напишите название данных Символов, Гелий, Серебро, Криптон,
- Назовите основной металл, присутствующий в гемоглобине, меле, хлорофилле,
- Дайте некоторые неметаллические элементы
- Напишите разницу между соединениями и смесями
Эти типы вопросов вы получите после окончания каждой главы.Это поможет вам стать лучше, чем любые другие учебные ресурсы. Этот PDF-файл или учебный материал хорошо изучен и подготовлен экспертом ICSE, поэтому он соответствует шаблону экзамена той же доски. Вы никогда не почувствуете никаких проблем при прохождении этого материала. Здесь все прекрасно объяснено. Просто взгляните, и вы все поймете.
Просто взгляните, и вы все поймете.
Соберите знания, которые останутся с вами навсегда
Если у вас есть страсть быть лучшим, то здесь вы получите мотивацию.Этот PDF-файл решит все ваши вопросы и проблемы. Каждая глава будет настолько легкой для вас. Поскольку это подготовлено экспертами, вы получите правильные указания от этого. Во время экзамена вы не пропустите ни одного вопроса. Это преимущество практики этого PDF. На самом деле знания, которые вы почерпнете отсюда, останутся с вами навсегда.
Selina Краткая глава 3 Вода Растворы ICSE Класс 9 Химия
(i) Кристаллы превращаются в порошкообразное вещество.
(ii) Кристаллы теряют синюю окраску при дальнейшем нагревании.
(iii) Внутри трубки образуются дымящиеся пары, которые конденсируются возле горловины трубки, образуя бесцветную жидкость.
(iv) При дальнейшем нагревании пар выходит из горловины трубки, а вода собирается в стакане, расположенном под горловиной трубки.
(v) При дальнейшем нагревании остаток превращается в белый порошок, пар перестает выходить.
(i) Кристаллы рассыпаются в белый порошок с выделением большого количества пара и газа.
(ii) При сильном нагревании образуется коричневый остаток оксида железа (Fe 2 O 3 ) и выделяется смесь SO 2 и SO 3 .
7. Укажите названия и формулы двух веществ в каждом случае:
(а) Гидратированное вещество
(b) Безводное вещество
(c) Жидкий осушитель
(d) Основной осушитель
Раствор
(a) (i) Кристаллы соды для стирки: Na 2 CO 3 .10H 2 O
(ii) Медный купорос: CuSO 4 .5 H 2 O
(b) (i) Поваренная соль: NaCl
(ii) Селитра: KNO 3
(c) Серная кислота: H 2 SO 4
(d) Негашеная известь: CaO
8. Как влияет температура на растворимость KNO 3 и CaSO 4 в воде?
Как влияет температура на растворимость KNO 3 и CaSO 4 в воде?
Раствор
Растворимость нитрата калия (KNO 3 ) в воде увеличивается с повышением температуры.
Растворимость сульфата кальция (CaSO 4 ) в воде снижается с повышением температуры.
9. Растворимость NaCl при 40 o C составляет 36,5 г. Что подразумевается под этим утверждением?
Раствор
Растворимость NaCl при 40°C составляет 36,5 г, это означает, что 36,5 г NaCl растворяется в 100 г воды при температуре 40°C.
10. Какой тест вы проведете, чтобы выяснить, является ли данный раствор насыщенным, ненасыщенным или перенасыщенным?
Раствор
Раствор, в котором может быть растворено большее количество растворенного вещества при данной температуре, является ненасыщенным раствором.
Раствор, в котором при данной температуре нельзя растворить больше растворенного вещества, является насыщенным раствором при этой температуре.
Раствор, в котором некоторое количество растворенного вещества слегка отделяется при охлаждении, является перенасыщенным раствором.
11. Как влияет давление на растворимость газов? Объясните на примере.
Раствор
С увеличением давления растворимость газа в воде увеличивается.
С повышением температуры растворимость газа в воде уменьшается.
Например, растворимость углекислого газа в воде при нормальном атмосферном давлении низкая, но когда поверхность воды подвергается более высокому давлению, в ней растворяется намного больше газа CO 2 .
Аналогичным образом, в случае с газированной водой, при открытии бутылки растворенный газ быстро выходит пузырями, потому что давление на поверхность воды резко уменьшается.
12. Укажите термин:
(a) Раствор, в котором растворителем является жидкость, отличная от воды.
(b) Когда вещество поглощает влагу при воздействии влажного воздуха и растворяется в поглощенной воде и превращается в раствор.
(c) Вещество, содержащее кристаллизационную воду.
(d) Когда вещество поглощает влагу из атмосферы, но не образует раствор.
(e) Когда соединение теряет кристаллизационную воду при воздействии сухого воздуха.
(f) Вещество, способное удалять атомы водорода и кислорода в соотношении 2:1 (в виде воды) из соединения.
Раствор
(а) Неводный раствор
(b) Растекание
(c) Гидратированное вещество
(г) Гигроскоп
(e) Высолы
(f) Влагопоглотитель
13. Объясните почему:
(a) Вода является отличной жидкостью для использования в системах охлаждения.
(b) Решение всегда понятное и прозрачное.
(c) Зимой озера и реки не замерзают внезапно.
(d) Растворенное вещество нельзя отделить от раствора фильтрованием.
(e) Плавленый CaCl 2 или конц. H 2 SO 4 используется в эксикаторе.
H 2 SO 4 используется в эксикаторе.
(f) Вскипание видно при открытии бутылки газированной воды.
(g) Поваренная соль становится липкой под воздействием влажного воздуха в сезон дождей.
Раствор
(a) Вода является отличной жидкостью для использования в системах охлаждения из-за ее высокой удельной теплоемкости.
(b) Водорастворимое твердое вещество исчезает в растворе, где растворителем является вода, а вода обладает свойством быть чистой и прозрачной. Итак, Решение тоже ясное и прозрачное.
(c) Озера и реки не замерзают внезапно зимой из-за высокой удельной скрытой теплоты затвердевания, т. е. количества тепла, выделяющегося при затвердевании 1 г воды с образованием 1 г льда при 0°C. Она составляет около 336 Дж/г или 80 кал/г.
(d) Компонент, который растворяется в растворителе, известен как растворенное вещество.Таким образом, его нельзя отделить от раствора фильтрацией. Однако фильтрация используется, когда растворенное вещество нерастворимо в растворе.
Однако фильтрация используется, когда растворенное вещество нерастворимо в растворе.
(e) Плавленый CaCl 2 или концентрированный H 2 SO 4 по своей природе расплывается, т. е. поглощает влагу, и, следовательно, они используются в эксикаторах в качестве осушающих агентов.
(f) Углекислый газ растворяют в газированной воде под давлением. При открытии бутылки давление на поверхность воды резко уменьшается; поэтому растворимость CO 2 в воде снижается, и газ быстро выходит наружу.
(g) Поваренная соль становится липкой при воздействии в сезон дождей, потому что она обычно содержит небольшой процент хлорида магния и хлорида кальция в качестве примесей. Эти примеси поглощают влагу из муссонного воздуха из-за своей расплывающейся природы, и, таким образом, поваренная соль становится липкой.
14. Обычно растворимость кристаллического твердого вещества увеличивается с температурой. Равномерно ли оно возрастает во всех случаях? Назовите вещество, растворимость которого:
(a) Быстро увеличивается с температурой.
(b) растворимость постепенно увеличивается с температурой.
(c) Немного увеличивается с температурой.
(d) Сначала увеличивается, затем уменьшается с повышением температуры.
Раствор
(а) Нитрат калия
(б) Хлорид калия
(с) Хлорид натрия
(d) Сульфат кальция
15. Что такое осушающие или влагопоглотители? Приведи примеры.
Раствор
Это вещества, которые могут легко поглощать влагу из других веществ, не вступая с ними в химическую реакцию.
Примеры: Пентоксид фосфора (P 2 O 5 ), негашеная известь (CaO)
16. Заполните следующую таблицу:
|
Общее имя |
Химическое название |
Формула |
Кислота, основание или соль |
Выцветшее, гигроскопическое или расплывающееся вещество |
|
Твердый едкий кали |
||||
|
Негашеная известь |
||||
|
Масло купоросное |
||||
|
Сода для стирки |
||||
|
Сода едкая твердая |
||||
|
Медный купорос |
Раствор
|
Общее имя |
Химическое название |
Формула |
Кислота, основание или соль |
Выцветшее, гигроскопическое или расплывающееся вещество |
|
Твердый едкий кали |
Гидроксид калия |
КОН |
База |
Расплывающееся вещество |
|
Негашеная известь |
Оксид кальция |
СаО |
База |
Гигроскопическое вещество |
|
Масло купоросное |
Серная кислота |
H 2 SO 4 |
Кислота |
Гигроскопическое вещество |
|
Сода для стирки |
Гидратированный карбонат натрия |
Na 2 CO 3 . |
Соль |
Выцветшее вещество |
|
Сода едкая твердая |
Гидроксид натрия |
NaOH |
База |
Расплывающееся вещество |
|
Медный купорос |
Сульфат меди |
CuSO 4 |
Соль |
Выцветшее вещество |
17.В каком из следующих веществ будет
(а) Увеличение массы
(б) Уменьшение массы
(c) Масса не меняется при контакте с воздухом?
Хлорид натрия, железо, конц. серная кислота, поваренная соль, кристаллы карбоната натрия
Раствор
(а) Увеличение массы: Железо и конц. серная кислота
(b) Уменьшение массы: кристаллы карбоната натрия
(c) Без изменения массы: хлорид натрия
18. Укажите способы обезвоживания гидратированных солей.
Укажите способы обезвоживания гидратированных солей.
Раствор
Гидратированные соли могут быть преобразованы в безводные вещества при нагревании, а также при воздействии сухого воздуха.
Пример:
Реакция Габера: Соль Габера превращается в порошкообразный безводный сульфат натрия при воздействии сухого воздуха.
Na 2 SO 4 .10H 2 O → Na 2 SO 4 + 10H 2 O
Упражнение 3C
1. Каков состав воды? В каком объеме объединяются его элементы?
Раствор
В состав воды входят 2 атома водорода и 1 атом кислорода (H 2 O).
По количеству атомов они соединяются в соотношении 2:1.
2. Какая польза от растворимости кислорода и углекислого газа в воде?
Решение
- Воздух, растворенный в воде, очень важен с биологической точки зрения.

- Кислород, растворенный в воде, используется морскими организмами, такими как рыбы, для дыхания, и таким образом морская жизнь поддерживается.
- Водные растения используют растворенный углекислый газ в процессе фотосинтеза для приготовления пищи.
- Диоксид углерода, растворенный в воде, реагирует с карбонатом кальция с образованием бикарбоната кальция.
- Морские организмы, такие как устрицы и улитки, извлекают карбонат кальция из бикарбоната кальция для построения своих раковин.
3. Горячий насыщенный раствор нитрата натрия при охлаждении образует кристаллы.Почему?
Раствор
Растворимость нитрата натрия снижается при понижении температуры. Таким образом, когда горячий насыщенный раствор нитрата натрия охлаждается, он образует кристаллы, отделяясь от раствора.
4. Что такое водосодержащие вещества? Объясните примерами.
Раствор
Вещества, которые содержат молекулы воды вместе с солью, являются гидратированными веществами.
Примеры: Дегидрат карбоната натрия: Na 2 CO 3 .10Н 2 О
Пентагидрат сульфата меди: CuSO 4 .5H 2 O
5. Назовите три способа обезвоживания водосодержащих веществ.
Раствор
Методы обезвоживания водных веществ:
- При нагревании
- При испарении
- Воздействие сухого воздуха.
6. Каково значение растворенных примесей в воде?
Раствор
- Растворенные в воде примеси представляют собой соли и минералы.
- Растворенные соли придают воде специфический вкус.
- Соли и минералы необходимы для роста и развития.
- Они поставляют основные минералы, необходимые нашему организму.
7. Назовите два способа превращения насыщенного раствора в ненасыщенный раствор.
Раствор
При нагревании насыщенный раствор становится ненасыщенным, и в растворе может быть растворено больше растворенного вещества.
Добавляя больше растворителя, насыщенный раствор можно сделать ненасыщенным.
8. Что вы понимаете под?
(а) Мягкая вода
(б) Жесткая вода
(c) Временно жесткая вода
(d) Постоянно жесткая вода
Раствор
(а) Вода называется мягкой, если вода, содержащая соли натрия, легко образует мыльную пену.
(b) Вода считается жесткой, если она не образует легко пены с мылом.
(c) Вода, содержащая только гидрокарбонаты кальция и магния, называется временной жесткой водой.
(d) Вода, содержащая сульфаты и хлориды магния и кальция, называется постоянной жесткостью.
9. Каковы причины?
(а) Временная твердость
(b) Постоянная твердость
Раствор
(а) Присутствие гидрокарбонатов кальция и магния делает воду временно жесткой.
(b) Присутствие сульфатов и хлоридов магния и кальция делает воду постоянно жесткой.
10. Каковы преимущества (i) мягкой воды и (ii) жесткой воды?
Раствор
Преимущества мягкой воды:
- Когда вода мягкая, вы используете гораздо меньше мыла и моющих средств. Ваш бюджет будет отражать ваши сбережения.
- Сантехника прослужит дольше. Мягкая вода имеет низкое содержание минералов и поэтому не оставляет отложений в трубах.
- Одежда прослужит дольше и дольше останется яркой, если ее стирать в мягкой воде.
Преимущества жесткой воды:
- Вода без растворенных солей имеет очень плоский вкус. Наличие солей в жесткой воде делает ее вкусной. Так, жесткая вода используется для приготовления напитков и вин.
- Соли кальция и магния, присутствующие в небольших количествах в жесткой воде, необходимы для развития костей и зубов.
- Жесткая вода предотвращает отравление воды свинцовыми трубами. Когда эти трубы используются для подачи воды, некоторые соли свинца растворяются в воде, делая ее ядовитой.
 Сульфат кальция, присутствующий в жесткой воде, образует нерастворимый сульфат свинца в виде слоя внутри свинцовой трубы, что предотвращает отравление свинцом.
Сульфат кальция, присутствующий в жесткой воде, образует нерастворимый сульфат свинца в виде слоя внутри свинцовой трубы, что предотвращает отравление свинцом.
11. Что такое сталагмиты и сталактиты? Как они формируются?
Раствор
В некоторых известняковых пещерах конические объекты, похожие на столбы, свисают с крыши, а некоторые возвышаются над полом. Они образованы водой, содержащей растворенный гидрокарбонат кальция, непрерывно капающей из трещин в горных породах.Сброс давления приводит к превращению некоторого количества гидрокарбоната в карбонат кальция.
Ca (HCO 3 ) 2 → CaCO 3 + CO 2 + H 2 O
Этот карбонат кальция понемногу медленно откладывается как на крыше, так и на полу пещеры.
Коническая колонна, растущая вниз от крыши, называется сталактитом, а та, что растет вверх от пола пещеры, называется сталагмитом.
Они встречаются через некоторое время. За год некоторые вырастают менее чем на сантиметр, а некоторые могут достигать 100 см в высоту.
За год некоторые вырастают менее чем на сантиметр, а некоторые могут достигать 100 см в высоту.
CaCO 3 + CO 2 + H 2 O → Ca (HCO 3 ) 2
MgCO 3 + CO 2 + H 2 O → Mg (HCO 3 ) 2
Если вода течет по слоям гипса (CaSO 4 .2H 2 O), небольшое количество гипса растворяется в воде и делает ее твердой.
12.Назовите вещество, которое делает воду (i) временно жесткой и (ii) постоянно жесткой.
Раствор
(i) Гидрокарбонаты кальция и магния
(ii) Сульфаты и хлориды магния и кальция
13. Приведите уравнения, показывающие, что происходит, когда временная жесткая вода
(а) Вареный
(b) Обработанный гашеной известью
Раствор
(а) в вареном виде
Ca (HCO 3 ) 2 → CaCO 3 + H 2 O + CO 2 ↑
Mg (HCO 3 ) 2 → MgCO 3 + H 2 O + CO 2 ↑
(b) при обработке гашеной известью
Ca(HCO 3 ) 2 + Ca(OH) 2 → 2CaCO 3 + 2H 2 O
Mg (HCO 3 ) 2 + Ca(OH) 2→ MgCO 3 + 2H 2 O
14. Назовите недостатки жесткой воды.
Назовите недостатки жесткой воды.
Раствор
Недостатки жесткой воды:
- С мылом труднее образовать пену.
- При реакции с мылом может образовываться пена, что приводит к потере мыла.
- Внутри котлов образуются карбонаты кальция и магния. Это тратит энергию всякий раз, когда вы кипятите чайник.
- Трубы горячей воды «на меху». Карбонаты кальция и магния начинают покрывать внутреннюю часть труб, которые в конечном итоге могут засориться.
15. Что такое мыло? Для чего он используется?
Раствор
Мыло химически представляет собой натриевую соль стеариновой кислоты (органическая кислота с формулой C 17 H 35 COOH) и имеет формулу C 17 H 35 COONa.
Мыло используется для стирки.
16. В чем преимущество моющего средства перед мылом?
Раствор
Моющие средства лучше растворяются в воде, чем мыло, и на них не влияет жесткость воды, поскольку их соли кальция растворимы в воде.
17. Почему жесткость воды делает ее непригодной для использования в (i) бойлере и (ii) для стирки.
Раствор
Пар обычно производится в котлах, состоящих из множества узких медных трубок, окруженных огнем. Попадая в эти трубы, холодная вода тут же превращается в пар, а растворенные твердые вещества, не способные превращаться в пар, оседают на внутренних стенках труб.
Это продолжается и делает отверстие труб уже.В результате через трубы одновременно проходит меньше воды и производится меньше пара. Когда отверстие трубы становится очень узким, давление пара возрастает настолько, что временами котел взрывается.
Если используется жесткая вода, ионов кальция и магния воды соединяются с отрицательными ионами мыла, образуя слизистый осадок нерастворимых кальция и магния, обычно называемый мыльным творогом (накипью).
Образование мыльного творога будет продолжаться до тех пор, пока присутствуют ионы кальция и магния. До тех пор не будет образовываться мыльная пена и чистка одежды или тела будет невозможна. Кроме того, эти осадки трудно смываются с тканей и иногда образуют пятна ржавчины, если в воде присутствуют соли железа.
До тех пор не будет образовываться мыльная пена и чистка одежды или тела будет невозможна. Кроме того, эти осадки трудно смываются с тканей и иногда образуют пятна ржавчины, если в воде присутствуют соли железа.
18. Объясните уравнением, что наблюдается при обработке воды постоянной жесткости
(a) Оставшееся время
(b) Сода для стирки
Раствор
(a) Гашеная известь
Известь сначала тщательно смешивают с водой в баке, а затем подают в другой бак с жесткой водой.Вращающиеся лопасти тщательно перемешивают два раствора. Большая часть карбоната кальция оседает. Если остается какое-либо твердое вещество, оно удаляется фильтром. Это известно как процесс Кларка.
(b) Сода стиральная
При добавлении в жесткую воду промывочной или кальцинированной соды соответствующие нерастворимые карбонаты оседают и могут быть удалены фильтрованием.
Selina Publishers Краткие решения ICSE для классов 10, 9, 8, 7 и 6
Selina Publishers ICSE Textbook Solutions
APlusTopper. com предоставляет пошаговые решения для Selina Concise ICSE Solutions. Вы можете загрузить вариант загрузки Selina Concise ICSE Solutions с бесплатной загрузкой в формате PDF, который содержит решения по главам и ответы по различным предметам, таким как физика, химия, математика и биология (PCMB). Selina Publishers Concise Class 10 ICSE Solutions Все вопросы решаются и объясняются опытными преподавателями в соответствии с рекомендациями совета ICSE. Изучив эти решения Selina ICSE Solutions, вы сможете легко получить хорошие оценки на экзаменах ICSE Board.sdffd
com предоставляет пошаговые решения для Selina Concise ICSE Solutions. Вы можете загрузить вариант загрузки Selina Concise ICSE Solutions с бесплатной загрузкой в формате PDF, который содержит решения по главам и ответы по различным предметам, таким как физика, химия, математика и биология (PCMB). Selina Publishers Concise Class 10 ICSE Solutions Все вопросы решаются и объясняются опытными преподавателями в соответствии с рекомендациями совета ICSE. Изучив эти решения Selina ICSE Solutions, вы сможете легко получить хорошие оценки на экзаменах ICSE Board.sdffd
Selina Publishers Краткие решения ICSE для классов 10, 9, 8, 7 и 6
Selina Publishers Краткие решения ICSE для класса 10
Selina Publishers Краткие решения ICSE для класса 9
90 8Selina Publishers Concise ICSE Solutions for Class 7
Selina Publishers Concise ICSE Solutions for Class 6
Selina Concise ICSE Class 10 Math Solutions Chapter wise Ответы
Selina Publishers Concise Mathematics for Class 9 ICSE0 8 Selina Solutions By RK Bansal
ТЕМА – 1 СИСТЕМА ЦИФРОВ
1. Рациональные числа
Рациональные числа
2. Экспоненты (степени)
3. Квадраты и квадратные корни
4. Кубы и кубические корни (включая использование таблиц натуральных чисел)
5. Игра с числами
6. Наборы
ТЕМА – 2 ОТНОШЕНИЯ И пропорция
7. Процент и процент
8. Прибыль, убыток и скидка
9. Простое и сложное интересное
10. Прямые и обратные вариации 90
Тема — 3 Алгебра
11. Алгебраические выражения (включая операции на Алгебраические выражения)
12.Алгебраические тождества
13. Факторизация
14. Линейные уравнения с одной переменной (с задачами, основанными на линейных уравнениях)
15. Линейные неравенства (включая числовые линии)
ТЕМА – 4 ГЕОМЕТРИЯ
16. ГЕОМЕТРИЯ
17. Специальные типы четырехугольников
18. Построения (только с использованием линейки и компаса)
19. Представление 3-D в 2-D
ТЕМА – 5 ИЗМЕРЕНИЕ
6 20. Площадь трапеции90 и многоугольника90 и многоугольникаПлощадь поверхности, объем и емкость (кубовидный, кубический и цилиндрический)
Площадь трапеции90 и многоугольника90 и многоугольникаПлощадь поверхности, объем и емкость (кубовидный, кубический и цилиндрический)
ТЕМА – 6 ОБРАБОТКА ДАННЫХ (статистика)
22. Обработка данных
23. Вероятность
Математика средней школы 7 класс Selina Solutions by RK Bansal 9
9040 Блок 1: Номерная система
1. Целые числа
2. Рациональные номера
3. Фракции (включая проблемы)
4. Десятичные фракции (десятичныелись)
5. Исполнения (включая законы показателей)
Блок 2: коммерческая арифметика
6.Соотношение и доля (включая долю в соотношении)
7. Унитарный метод (включая время и работу)
8. Проценты и проценты
9. Прибыль, убыток и дисконт
10. Простые проценты
БЛОК 3: АЛГЕБРА 07 7 11. Фундаментальные понятия (включая основные операции)
12. Простые линейные уравнения (включая текстовые задачи)
13. Понятия множеств (некоторые простые деления по ведическому методу)
ЧАСТЬ 4: ГЕОМЕТРИЯ
14.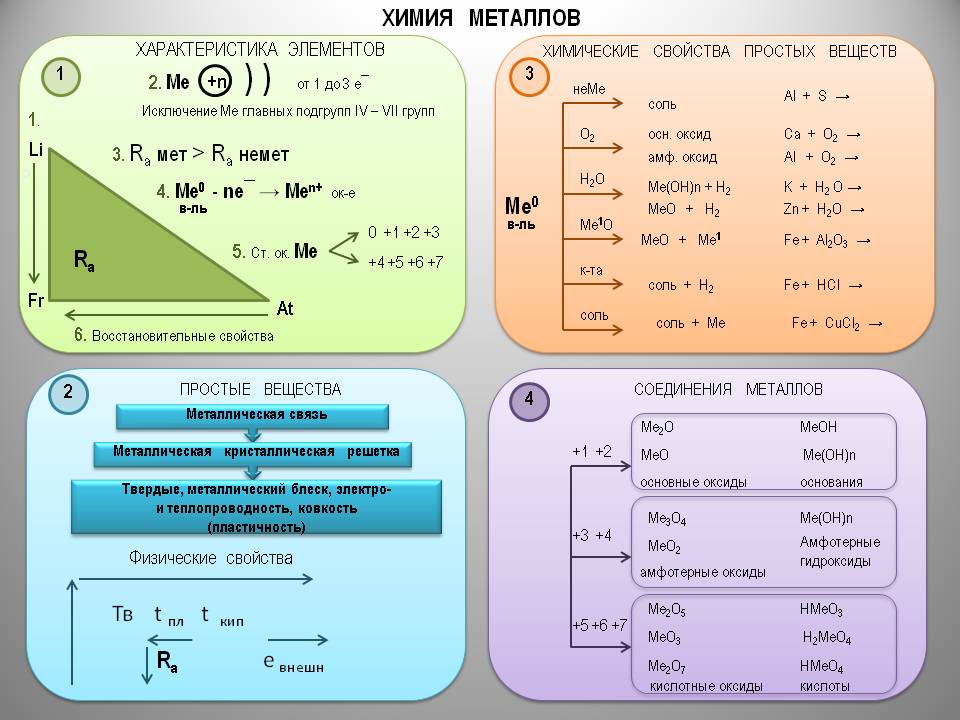 ГЕОМЕТРИЯ
ГЕОМЕТРИЯ
Строительство углов)
15.Треугольники
16. Теорема Пифагора
17. Симметрия (включая отражение и вращение)
18. Распознавание твердых тел (представление 3D в 2D)
19. Конгруэнтность: конгруэнтные треугольники
20. Измерение
Обработка (статистика)
21. Обработка данных
22. Вероятность
Средняя школа Математика
Средняя школа MateMatics Class 6 Selina Решения RK Bansal
Блок 1: Числа
1. Номер системы (консолидация чувства номера)
2 .Оценка
3. Числа в Индии и международной системе (со сравнением)
4. Разрядное значение
5. Натуральные числа и целые числа (включая шаблоны)
6. Отрицательные числа и целые числа
7. Числовая строка
8. HCF и LCM
9. Игра с номерами
10. Наборы
Блок 2: Соотношение, пропорция и арифметические проблемы
11. Соотношение
12. Пропорция (включая проблемы с словом)
Пропорция (включая проблемы с словом)
13. Унитарный метод
14. Фракции
15. Десятичные фракции
16.Процент (Процент)
17. Представление о скорости, расстоянии и времени
ЧАСТЬ 3: АЛГЕБРА
18. Основные понятия
19. Основные операции (связанные с алгебраическими выражениями)
20. Подстановка Символы)
21. Обрамление алгебраических выражений (включая вычисление)
22. Простые (линейные) уравнения (включая текстовые задачи)
ЧАСТЬ 4: ГЕОМЕТРИЯ
23. Основные понятия 90.006 24.Углы (с их типами)
25. Свойства углов и прямых (включая параллельные прямые)
26. Треугольники (включая типы, свойства и конструкции)
27. Четырехугольник
28. Многоугольники
29. Круг. Упражнение на симметрию
30. Повторное упражнение по симметрии
(включая построения по симметрии)
31. Распознавание твердых тел
ЧАСТЬ 5: ИЗМЕРЕНИЕ
32. Периметр и площадь плоских фигур
Периметр и площадь плоских фигур
ЧАСТЬ 6: ОБРАБОТКА ДАННЫХ 3 .0407
7 7 7Обработка данных (включая пиктограмму и гистограмму)34. Среднее значение и медиана
«Краткая средняя школа», предназначенная для учащихся ICSE, является частью «Интегрированной математики и естественных наук», в которую входят книги «Краткая математика», «Краткая физика», «Краткая химия» и «Краткая биология». выведены отдельно. Решения были написаны строго в соответствии с последней учебной программой, предписанной Советом по экзаменам ISC в Нью-Дели.
Selina Publishers Concise ICSE Solutions Основная цель Selina Concise ICSE Solutions — сделать основные понятия понятными и интересными для учащихся.Была предпринята попытка тщательно организовать содержание и представить его простым языком с учетом потребностей среднего учащегося. С помощью простых диаграмм были предприняты сознательные усилия, чтобы дать четкие объяснения всех аспектов предмета на школьном уровне. Было описано множество экспериментов и мероприятий, чтобы сделать обучение более интересным и привлекательным. Каждая глава была кратко изложена в конце под заголовком «Перепросмотр» для быстрого повторения главы.Подробные упражнения даны в конце каждой главы, чтобы помочь учащимся проверить и оценить свое понимание предмета в порядке самопомощи.
Было описано множество экспериментов и мероприятий, чтобы сделать обучение более интересным и привлекательным. Каждая глава была кратко изложена в конце под заголовком «Перепросмотр» для быстрого повторения главы.Подробные упражнения даны в конце каждой главы, чтобы помочь учащимся проверить и оценить свое понимание предмета в порядке самопомощи.
Были предприняты большие усилия, чтобы представить различные темы таким образом, чтобы вызвать у учащихся дух исследования, научный характер и понимание химических процессов.
Часто задаваемые вопросы о Selina Publishers ICSE Solutions
1. Почему я должен решить Selina Solutions?
Selina Учебники пользуются наибольшим спросом среди студентов ICSE, и их концепции подробно объясняются.У вас будут как простые, так и сложные вопросы для практики.
2. Достаточно ли решения Selina Solutions для получения высоких оценок на экзамене?
Решение задач Selina Publications поможет учащимся понять основные понятия. Одних только решений Selina Publishers ICSE Solutions недостаточно, чтобы получить больше баллов. Вам нужно сослаться на несколько других книг, и практика — лучший способ получить оценки на экзамене.
Одних только решений Selina Publishers ICSE Solutions недостаточно, чтобы получить больше баллов. Вам нужно сослаться на несколько других книг, и практика — лучший способ получить оценки на экзамене.
3. Является ли Селина лучшим рекомендателем для студентов ICSE?
Selina – один из лучших справочников для студентов, в котором понятия даны просто и исчерпывающе.
4. Где я могу найти Selina Solutions?
Selina ICSE Решения для предметов всех классов можно просмотреть по быстрым ссылкам, доступным на этой странице, или найти их в Интернете.
5. Содержит ли экзамен ICSE board вопросы от Selina Books?
На экзамене ICSE Board будут прямо или косвенно вопросы из Selina Books. Тем не менее, мы не можем сказать, что все вопросы будут только из учебников Selina Publisher, но, скорее всего, они появятся на экзаменах Совета ICSE.
Мы надеемся, что и преподавателям, и учащимся понравится учиться с помощью этих решений Selina Publishers Text Book Solutions.

 Введите свой запрос:
Введите свой запрос: