большинство клеток зародышевого мешка цветковых растений имеет
1.Хордовые — это ____ царства Животные
1. класс
2. семейство
3. подкласс
4. тип
5. вид
2.Хорда у хордовых животных это
1. твёрдый внутренний скелет
2.
…
отрезок, соединяющий две точки данной кривой
3. длинный эластичный продольный тяж из соединительной ткани
4. орган чувства
5. внутренний осевой скелет
6. зачаток спинного мозга
3.Симметрия тела у всех хордовых животных:
1. её нет
2.лучевая
3.двустороняя
4.радиальная
5.билатеральная
4.Выберите пункты относящиеся к общей характеристике типа Хордовые
1. Наличие позвоночника
2. Замкнутая кровеносная система
3. Нервные ганглии
4. Покровы с известковыми включениями
5. Головной мозг
6. Наличие внутреннего скелета
7. Незамкнутая кровеносная система
8. Хитиновый покров
9. Нервная трубка
10. Присутствие жаберных хотя бы в эмбриональном развитии
11. Наличие сердца
12. Наличие хорды хотя бы в эмбриональном развитии
13. Наличие хорды на протяжении всей жизни
5.Опишите взаиморасположение хорды и нервной трубки
(Где они вообще находятся в теле хордового животного)
6.
 Парные плавники ланцетника
1. тянутся на брюхе вдоль тела
2. отсутствуют
3. ограничивают жаберную область
4. расположены на спинной стороне
К какому подтипу относятся миноги?
1. Хордовые
2. Бесчерепные
3. Бесчелюстные
4. Безмозглые
5. Челюстные
6. Позвоночные
Чем представлена дыхательная система миноги?
1. Пятью парами жабр
2. Семью парами жаберных щелей
3. Одним непарным лёгким
4. Дыхательными трубками
5. 15 парами жаберных щелей
6. 150 парами жаберных щелей
7. Парными лёгкими
Соотнесите стадии жизненного цикла
Личинка-1
Взрослая-2
1. Называется пескоройка
2. Ведёт паразитический образ жизни
3. Питается фильтрацией
4. Размножается бесполым способом
5. Способна к половому размножению
Заранее спасибо 🙂
Парные плавники ланцетника
1. тянутся на брюхе вдоль тела
2. отсутствуют
3. ограничивают жаберную область
4. расположены на спинной стороне
К какому подтипу относятся миноги?
1. Хордовые
2. Бесчерепные
3. Бесчелюстные
4. Безмозглые
5. Челюстные
6. Позвоночные
Чем представлена дыхательная система миноги?
1. Пятью парами жабр
2. Семью парами жаберных щелей
3. Одним непарным лёгким
4. Дыхательными трубками
5. 15 парами жаберных щелей
6. 150 парами жаберных щелей
7. Парными лёгкими
Соотнесите стадии жизненного цикла
Личинка-1
Взрослая-2
1. Называется пескоройка
2. Ведёт паразитический образ жизни
3. Питается фильтрацией
4. Размножается бесполым способом
5. Способна к половому размножению
Заранее спасибо 🙂
что понимается под сеянцем яблони
какая кровь в шее? арториальная или венозная.
К какому типу относятся бабезиозы, балактидиозы, бластоцистозы и Болезнь Шагаса ?Типы: внутренний или внешний паразит.
Найдите животных,о которых идёт речь:Шакал, собака, лошадь,лиса, шелкопряд, шмель, медоносная пчела,зебра, капустница.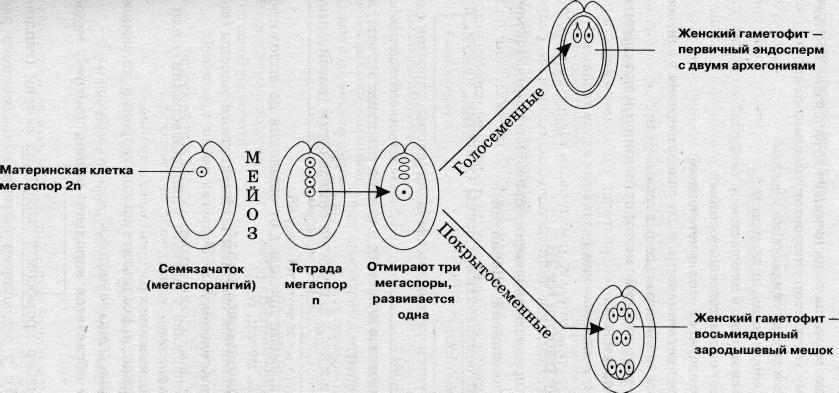 а) Первое домашнее животное,пред
…
ком которого является волк.б) Животное, появившееся в результате одомашнивания тарпана.с) Одомашненное животное,используемое для получения шелка.
а) Первое домашнее животное,пред
…
ком которого является волк.б) Животное, появившееся в результате одомашнивания тарпана.с) Одомашненное животное,используемое для получения шелка.
помогите пожалуйста помогите пожалуйста
помогите пожалуйста помогите пожалуйста
помогите пожалуйста помогите пожалуйста
Помогите пожалуйста помогите пожалуйста помогите пожалуйста
Запишите номера соответствующих животных,используемых для производства данного продукта.
На рисунке изображены рябчики, у которых, в отличие — Студопедия.Нет
Задания III этапа XXII Всероссийской олимпиады школьников по биологии. 2005-06 уч. год.
Классы
Задание 1. Задание включает 60 вопросов, к каждому из них предложено 4 варианта ответа. На каждый вопрос выберите только один ответ, который вы считаете наиболее полным и правильным. Индекс выбранного ответа внесите в матрицу ответов.
1. Большинство клеток зародышевого мешка цветковых растений имеет:
а) гаплоидный набор хромосом; б) диплоидный набор хромосом;
в) тринлоидный набор хромосом; г) тетрашюидный набор хромосом.
2. Верхний плод, образованный завязью пестика и другими частями цветка, встречается у:
а) яблони и груши; б) шиповника и земляники;
в) шиповника и граната; г) кактуса и крыжовника.
3. Женский заросток сосны представлен:
а) первичным эндоспермом; б) семязачатком;
в) вторичным эндоспермом; г) интегументом.
4. Запасные питательные вещества клубнелуковицы гладиолуса локализованы в:
а) стеблевой паренхиме; б) видоизмененных листьях;
в) почках; г) столонах.
5. Конечная почка побега липы:
а) верхушечная; б) боковая;
в) пазушная; г) спящая.
На рисунке изображено чередование поколений у высших растении.
Обозначением Б показан:а) диплоидный спорофит;
б) гаплоидный спорофит;
в) диплоидный гаметофит;
г) гаплоидный гаметофит.
7. Орган (-ы) брюссельской капусты, употребляемый в пищу:
а) видоизмененная верхушечная почка;
б) утолщенный реповидный стебель;
в) видоизмененное соцветие;
г) боковые видоизмененные почки.
8. Цветки со сростнолистной чашечкой у:
а) тюльпана; б) гороха;
в) ландыша; г) ивы.
9. Водопроводящими элементами сосны являются:
а) кольчатые и спиральные сосуды;
б) только кольчатые сосуды;
в) кольчатые, спиральные и пористые;
г) трахеиды.
Биология Ш-06, 10-11 классы
10. На рисунке изображено растение — редька посевная. Наиболее правильная формула цветка данного растения:
а) *Ч5Л4Т6ПШ;
б) Т.ВДТамПщ:
в) *ЧМЛ4Т2+4ПШ;
г) *Ч6Л4Т2+4ПШ.
11. Известно, что по строению цисты можно установить вид амебы. Циста дизентерийной амебы (Entamoeba histolyttca) имеет:
а) 1 ядро; б) 2 ядра;
в) 4 ядра; г) 8 ядер.
12. У плоских червей (Plathetminthes) имеется мускулатура:
а) только продольная; б) продольная и кольцевая;
в) только кольцевая; г) продольная, кольцевая и диагональная.
13. Изучение добытого экземпляра губки выявило наличие у нее прочного, но хрупкого кремниевого скелета. Наиболее вероятно, что данная губка является:
а) мелководным обитателем; б) глубоководным обитателем;
в) наземным обитателем; г) обитателей приливно-отливной зоны.
14. Многощетинковые черви (полихеты):
а) раздельнополы; б) гермафродиты;
в) изменяют свой пол в течение жизни;
г) бесполы, так как могут размножаться путем отрыва части тела.
15. Муха цеце является переносчиком трипанозом, вызывающих у человека:
а) сонную болезнь; б) восточную язву;
в) малярию; г) кокцидиоз.
16. Органами зрения у пауков являются:
а) 1 пара фасеточных глаз; б) 4 пары простых глаз;
в) 1 пара фасеточных и 2 пары простых глаз;г) 1 пара фасеточных и 3 пары простых глаз.
17. Кровеносная система у кольчатых червей:
а) незамкнутая;
б) замкнутая с одним кругом кровообращения;
в) замкнутая с двумя кругами кровообращения;
г) отсутствует.
18. Из головоногих моллюсков способен изменять свой удельный вес;
а) осьминог; б) каракатица;
в) наутилус; г) кальмар.
19. Морские змеи способны много часов находиться под водой благодаря:
а) большому запасу воздуха в легких В замедленному обмену веществ;
б) кожному дыханию;
в) дыханию с помощью наружных жабр;
г) дыханию через слизистую оболочку глотки.
20. Отделы сложного желудка жвачных млекопитающих расположены в следующей последовательности:
а) книжка, сетка, рубец, сычуг;
б) рубец, книжка, сычуг, сетка;
в) сетка, книжка, сычуг, рубец;
г) рубец, сетка, книжка, сычуг.
21. Речной уторь, обитающий в Европе и Северной Америке, нерестится:
а) каждую весну в ручьях и верховьях рек;
б) ежегодно летом в озерах и старицах;
в) раз в 4-5 лет на морских мелководьях;
г) один раз в жизни в Саргассовом море на глубине в несколько сотен метров.
22. Гекконы могут передвигаться по гладким вертикальным поверхностям и даже по потолку за счет того, что на подушечках пальцев у них есть:
а) маленькие крючочки;
б) железы, выделяющие клейкую жидкость;
в) щеточки из микроскопических волосков, увеличивающие сцепление;
г) присоски, образованные складками кожи.
На рисунке изображены рябчики, у которых, в отличие
Задания 11 класс
Часть I. Вам предлагаются тестовые задания, требующие выбора только одного ответа из четырех возможных. Максимальное количество баллов, которое можно набрать – 60 (по 1 баллу за каждое тестовое задание). Индекс ответа, который вы считаете наиболее полным и правильным, укажите в матрице ответов.
1. В благоприятных условиях спора бактерии:
а) делится, образуя 3 – 6 новых спор;
б) сливается с другой спорой с последующим делением;
в) погибает;
г) прорастает в новую бактериальную клетку.
2. Оформленных оболочкой ядер нет в клетках водорослей:
а) зеленых;
б) красных;
в) бурых;
г) сине-зеленых.
3. В клетках грибов нельзя обнаружить:
а) вакуоли;
б) митохондрии;
в) пластиды;
г) рибосомы.
4. Сфагнум размножается:
а) семенами;
б) пыльцой;
в) спорами;
г) зооспорами.
5. Большинство клеток зародышевого мешка цветковых растений имеет:
а) гаплоидный набор хромосом;
б) диплоидный набор хромосом;
в) триплоидный набор хромосом;
г) тетраплоидный набор хромосом.
6. Человек употребляет в пишу орган(-ы) цветной капусты:
а) видоизмененную верхушечную почку;
б) утолщенный реповидный стебель;
в) видоизмененное соцветие;
г) боковые видоизмененные почки.
7. Соцветие колос характерно для:
а) ландыша;
б) сирени;
в) ржи;
г) подорожника.
8. Семена без эндосперма у:
а) клещевины;
б) липы;
в) томата;
г) частухи подорожниковой.
9. Корневые шишки – это сильно утолщенные:
а) придаточные корни;
б) корневые волоски;
в) главные корни;
г) воздушные клубни.
10. Соплодие характерно для:
а) груши;
б) ананаса;
в) банана;
г) айвы.
11. К корнеотпрысковым растениям относят:
а) облепиху крушиновидную;
б) осот полевой;
в) осину дрожащую;
г) все перечисленные растения.
12. Ваниль душистая – многолетняя цепляющаяся лиана сем. Орхидные. В кондитерском производстве используют ее:
а) стебли;
б) стебли и листья;
в) соцветия;
г) плоды.
13. Манную крупу изготовляют из:
а) пшеницы;
б) проса;
в) овса;
г) ячменя.
14. Общим признаком голосеменных и покрытосеменных растений является:
а) развитие из спор;
б) наличие цветка;
в) развитие из семени;
г) редукция спорофита.
15. Простейшие, ведущие исключительно паразитический образ жизни:
а) корненожки;
б) жгутиконосцы;
в) солнечники;
г) споровики.
16. Муха цеце является переносчиком трипанозом, вызывающих у человека:
а) сонную болезнь;
б) восточную язву;
в) малярию;
г) кокцидиоз.
17. Изучение добытого экземпляра губки выявило наличие у нее прочного, но хрупкого кремниевого скелета. Наиболее вероятно, что данная губка является:
а) мелководным обитателем;
б) глубоководным обитателем;
в) наземным обитателем;
г) обитателем приливно-отливной зоны.
18. Спектр цветового зрения у медоносной пчелы:
а) такой же, как у человека;
б) сдвинут в инфракрасную часть спектра;
в) сдвинут в ультрафиолетовую часть спектра;
г) значительно шире, чем у человека, в обе стороны спектра.
19. Развитие личинок из яиц, отложенных аскаридами происходит:
а) при температуре 37оС, высокой концентрации СО2, в течение двух недель;
б) при температуре 20-30оС, высокой концентрации СО2, в течение двух недель;
в) при температуре 37оС, высокой концентрации О2, в течение недели;
г) при температуре 20-30оС, высокой концентрации О2, в течение двух недель.
20. В отличие от круглых червей, у кольчатых червей появилась:
а) пищеварительная система;
б) выделительная система;
в) кровеносная система;
г) нервная система.
21. Крылья у насекомых находятся на спинной стороне:
а) груди и брюшка;
б) груди;
в) головогруди и брюшка;
г) головогруди.
22. Рабочие пчелы являются:
а) самками, отложившими яйца и приступившими к уходу за потомством;
б) самками, у которых на развиты половые железы;
в) молодыми самками, способными через год отложить яйца;
г) самцами, развившимися из неоплодотворенных яиц.
23. Морские игуаны, живущие на Галапагосских островах, выводят избыток соли из организма:
а) с мочой;
б) через солевые железы;
в) через поры в коже;
г) с экскрементами.
24. У страуса нанду насиживает яйца и опекает птенцов:
а) только самка;
б) только самец;
в) по очереди оба родителя;
г) приемные родители, в гнездо которых подброшены яйца.
25. Самые большие гнезда среди птиц строят:
а) орлы;
б) пеликаны;
в) страусы;
г) африканские ткачики.
26. Из перечисленных организмов наиболее прогрессивными чертами строения обладают:
а) амеба;
б) дождевой червь;
в) гидра;
г) вольвокс.
27. Усложнение кровеносной системы соответствует эволюции хордовых в ряду следующих животных:
а) жаба – кролик – крокодил – акула;
б) акула – лягушка – крокодил – кролик;
в) акула – крокодил – лягушка – кролик;
г) крокодил – акула – жаба – собака.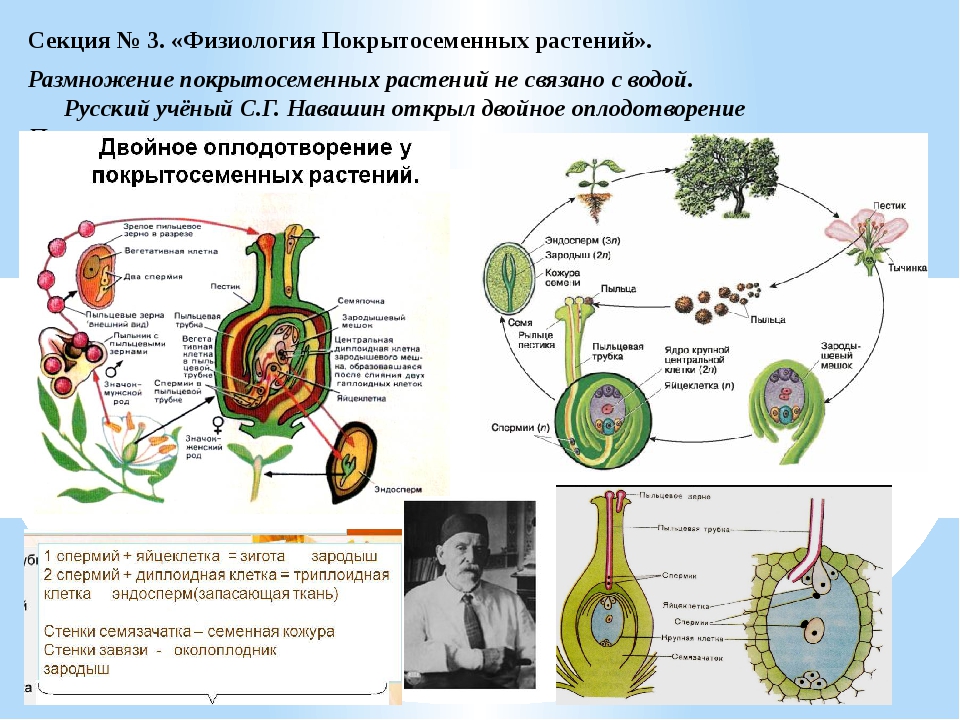
28. Наибольшее видовое многообразие обитателей Мирового океана наблюдается:
а) на коралловых рифах;
б) в открытом океане в тропиках;
в) в приполярных областях;
г) в глубоководных впадинах.
29. Считается, что при переносе информации из кратковременной памяти в долговременную теряется информации:
а) 5%;
б) 10%;
в) 50%;
г) более 90%.
30. Целлюлоза, попавшая в желудочно-кишечный тракт человека:
а) не расщепляется из-за отсутствия специфического фермента;
б) частично расщепляется бактериями в толстом кишечнике;
в) расщепляется α-амилазой слюны;
г) расщепляется панкреатической α-амилазой.
31. Какова реакция среды в двенадцатиперстной кишке:
а) слабокислая;
б) нейтральная;
в) слабощелочная;
г) щелочная.
32. Не известны гормоны, которые являются производными:
а) белков;
б) аминокислот;
в) липидов;
г) углеводов.
33. В процессе пищеварения переваривании белки расщепляются до:
а) глицерола;
б) жирных кислот;
в) моносахаридов;
г) аминокислот.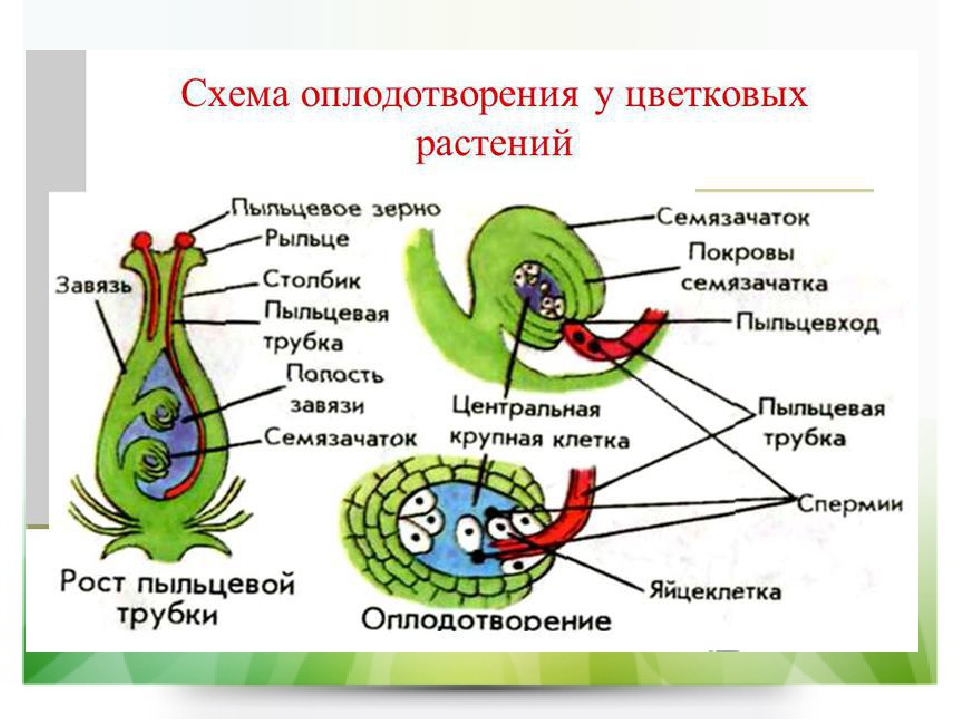
34. Такие симптомы как поражение слизистой оболочки рта, шелушение кожи, трещины губ, слезоточивость, светобоязнь, указывают на недостаток:
а) токоферола;
б) пиридоксина;
в) рибофлавина;
г) фолиевой кислоты.
35. Рецептор кожи, реагирующий на холод:
а) тельце Пачини;
б) тельце Мейснера;
в) нервное сплетение вокруг волосяной луковицы;
г) колба Краузе.
36. К вирусным заболеваниям не относится:
а) корь;
б) клещевой энцефалит;
в) краснуха;
г) дифтерия.
37. Пищевая цепь – это:
а) последовательность организмов в природном сообществе, каждый элемент которой является пищей для следующего;
б) последовательное прохождение пищи по различным разделам пищеварительного тракта;
в) зависимость растений от травоядных животных, их, в свою очередь, от хищников;
г) совокупность всех пищевых связей в экосистеме.
38. Постоянное вмешательство со стороны человека требуется для существования:
а) экосистем пресных вод;
б) природных экосистем суши;
в) экосистемы Мирового океана;
г) агроценозов.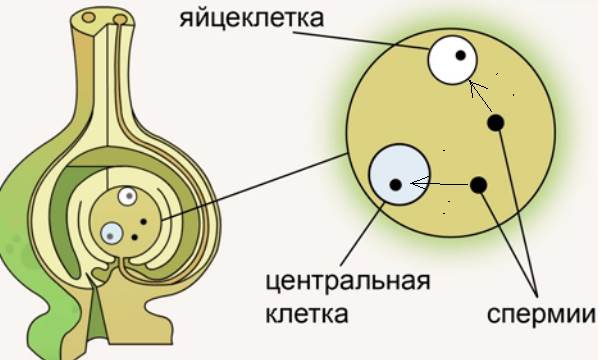
39. В природных условиях естественными носителями возбудителя чумы являются:
а) птицы;
б) грызуны;
в) копытные;
г) человек.
40. В обширных лесных массивах Севера часто проводятся так называемые концентрированные рубки с использованием тяжелой техники, которые приводят:
а) к смене лесных экосистем болотными;
б) к опустыниванию или полному разрушению экосистем;
в) к увеличению доли более ценных с точки зрения хозяйства пород деревьев;
г) к процессу превращения в почве органических остатков в гумус.
41. Листья суккулентов – растений засушливых местообитаний – характеризуются:
а) редуцированными устьицами; недифференцированным мезофиллом; отсутствием кутикулы; развитой аэренхимой;
б) частым рассечением, отсутствием механической ткани;
в) толстой кутикулой; мощным восковым налётом; клетками с крупными вакуолями; погружёнными устьицами;
г) хорошо развитой склеренхимой; преобладанием связанной воды.
42. Из названных организмов к надцарству прокариот относится:
а) эвглена зеленая;
б) инфузория-туфелька;
в) амеба;
г) стафилококк.
43. Две породы собак, например, болонка и немецкая овчарка, это животные:
а) одного вида, но с разными внешними признаками;
б) двух видов, одного рода и одного семейства;
в) двух видов, двух родов, но одного семейства;
г) одного вида, но обитающие в разных условиях окружающей среды.
44. Наука, изучающая развитие живой природы по отпечаткам и окаменелостям, которые находят в земной коре:
а) систематика;
б) история;
в) палеонтология;
г) эволюция.
45. Первые наземные позвоночные произошли от рыб:
а) лучеперых;
б) кистеперых;
в) цельноголовых;
г) двоякодышащих.
46. Контуры тела летяги, сумчатой летяги, шерстокрыла очень сходны. Это является следствием:
а) дивергенции;
б) конвергенции;
в) параллелизма;
г) случайного совпадения.
47. Число хромосом при половом размножении в каждом поколении возрастало бы вдвое, если бы в ходе эволюции не сформировался процесс:
а) митоза;
б) мейоза;
в) оплодотворения;
г) опыления.
48. Одно из положений клеточной теории гласит:
а) при делении клетки хромосомы способны к самоудвоению;
б) новые клетки образуются при делении исходных клеток;
в) в цитоплазме клеток содержатся различные органоиды;
г) клетки способны к росту и обмену веществ.
49. При партеногенезе организм развивается из:
а) зиготы;
б) вегетативной клетки;
в) соматической клетки;
г) неоплодотворенной яйцеклетки.
50. Матрицей для трансляции служит молекула:
а) тРНК;
б) ДНК;
в) рРНК;
г) иРНК.
51. Кольцевая ДНК характерна для:
а) ядер грибов;
б) клеток бактерий;
в) ядер животных;
г) ядер растений.
52. Разделить клетки, органоиды или органические макромолекулы по их плотности можно с помощью метода:
а) хроматография;
б) центрифугирование;
в) электрофорез;
г) авторадиография.
53. Мономерами нуклеиновых кислот являются:
а) азотистые основания;
б) нуклеозиды;
в) нуклеотиды;
г) динуклеотиды.
54. Ионы магния входят в состав:
а) вакуоли;
б) аминокислот;
в) хлорофилла;
г) цитоплазмы.
55. В процессе фотосинтеза источником кислорода (побочного продукта) является:
а) АТФ
б) глюкоза;
в) вода;
г) углекислый газ.
56. Из компонентов растительной клетки вирус табачной мозаики поражает:
а) митохондрии;
б) хлоропласты;
в) ядро;
г) вакуоли.
57. Из названных белков ферментом является:
а) инсулин;
б) кератин;
в) тромбин;
г) миоглобин.
58. В хлоропластах растительных клеток светособирающие комплексы расположены
а) на наружной мембране;
б) на внутренней мембране;
в) на мембране тилакоидов;
г) в строме.
59. Неаллельное взаимодействие генов при дигибридном скрещивании может дать во втором поколении расщепление:
а) 1:1;
б) 3:1;
в) 5:1;
г) 9:7.
60. При браках между людьми европеоидной и негроидной расы во втором поколении обычно не бывает людей с белым цветом кожи. Это связано с:
а) неполным доминированием гена пигментации кожи;
б) полимерностью генов пигментации кожи;
в) эпигеномной наследственностью;
г) нехромосомной наследственностью.
Часть II. Вам предлагаются тестовые задания с одним вариантом ответа из четырех возможных, но требующих предварительного множественного выбора. Максимальное количество баллов, которое можно набрать – 30 (по 2 балла за каждое тестовое задание). Индекс ответа, который вы считаете наиболее полным и правильным, укажите в матрице ответов.
1. Бактерии вызывают заболевания:
I. возвратный тиф. а) II, IV;
II. сыпной тиф. б) I, IV, V;
III. малярия.в) I, II, IV;
IV. туляремия. г) II, III, IV, V.
V. гепатит.
2. Корни могут выполнять функции:
I. образования почек. а) II, III, IV;
II. образования листьев.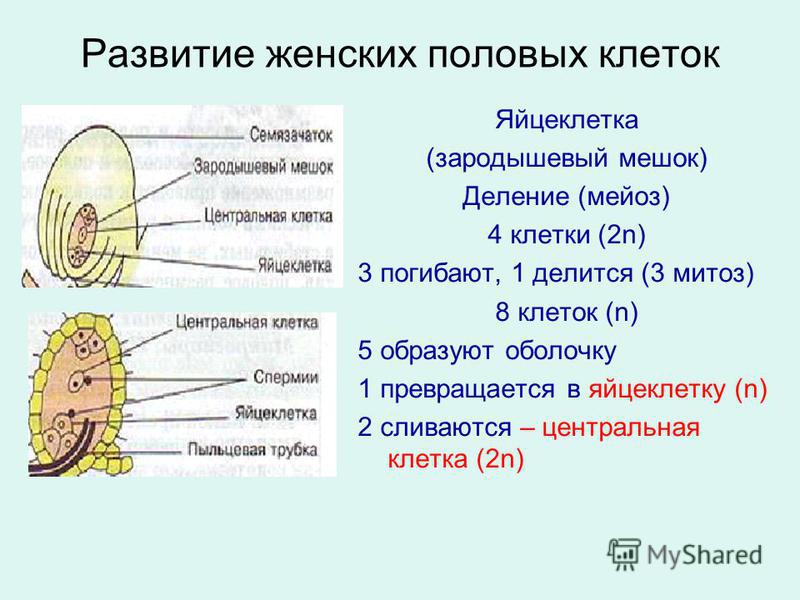 б) I, II, IV, V;
б) I, II, IV, V;
III. вегетативного размножения. в) I, III, IV, V;
IV. поглощения воды и минеральных веществ. г) I, II, III, IV.
V. синтеза гормонов, аминокислот и алкалоидов.
3. Если оборвать (обрезать) кончик главного корня:
I. корень погибнет. а) III, IV, V;
II. все растение погибнет. б) III, V;
III. рост корня в длину прекратится.в) I, IV, V;
IV. растение выживет, но будет слабым. г) II, IV, V.
V. начнут расти боковые и придаточные корни.
4. Среди паукообразных развитие с метаморфозом характерно для:
I. пауков. а) II;
II. клещей.б) II, III;
III. сольпуг. в) I, IV;
IV. сенокосцев. г) I, II, III, V.
V. скорпионов.
5. Животными, ведущими прикрепленный (сидячий) образ жизни, но имеющими свободноплавающих личинок, являются:
I. кораллы.а) I, II, III, IV;
II. губки.б) I, II, III, V;
III. асцидии.в) I, III, IV;
IV. коловратки. г) I, II, III, IV, V.
V. усоногие раки.
6. Хорда сохраняется в течение всей жизни у:
I. окуня. а) I, II, III, IV;
II. осетра.б) III, IV, V;
III. акулы. в) II, III, V;
IV. миноги.г) II, IV, V.
V. ланцетника.
7. Нерестится только один раз в жизни:
I. севрюга. а) II, III, V;
II. сардина. б) III, V;
III. горбуша.в) I, III, V;
IV. красноперка.г) I, II, III, V.
V. речной угорь.
8. Аллантоис выполняет у амниот функцию:
I. газообмена.а) I, III, IV;
II. терморегуляции. б) I, IV;
III. запасания воды. в) I, II, IV, V;
IV. накопления мочи.г) I, II, III, IV.
V. пищеварения.
9. В почечном клубочке в норме практически не фильтруются:
I. вода. а) I, II, III;
II. глюкоза. б) I, III, IV, V;
III. мочевина. в) II, IV, V;
IV. гемоглобин.г) IV, V.
V. альбумин плазмы.
10. Каждая популяция характеризуется:
I. плотностью.а) I, II, V;
II. численностью.б) I, IV, V;
III. степенью изоляции. в) II, V;
IV. независимой эволюционной судьбой. г) II, III, IV.
V. характером пространственного распределения.
11. К хищникам, как правило охотящимся из засады, относятся:
I. волк. а) II, III, IV, V;
II. рысь.б) I, IV;
III. ягуар.в) I, II, III, V;
IV. гепард. г) II, III, V.
V. медведь.
12. Из перечисленных животных в состав тундрового биоценоза входят:
I. белка. а) I, II, III, IV;
II. хорек. б) II, III, IV, V;
III. песец. в) III, IV;
IV. лемминг. г) III, IV, V.
V. зеленая жаба.
13. Аналогичные органы, развившиеся в ходе эволюции:
I. жабры рыбы и жабры рака. а) I, III, IV, V;
II. крылья бабочки и крылья птицы. б) I, II, IV, V;
III. усики гороха и усики винограда. в) I, II, III, V;
IV. волосы млекопитающих и перья птицы. г) I, II, III, IV.
V. колючки кактуса и колючки боярышника.
14. Из названных полимеров к неразветвленным относятся:
I. хитин. а) I, II, IV;
II. амилоза. б) I, II, III, IV;
III. гликоген. в) II, IV, V;
IV. Целлюлоза г) III, IV, V.
V. амилопектин.
15. В организме человека гормональные функции выполняют соединения:
I. белки и пептиды. а) III, IV, V;
II. производные нуклеотидов. б) I, III, IV, V;
III. производные холестерина. в) III, V;
IV. производные аминокислот. г) II.
V. производные жирных кислот.
Часть III.Вам предлагаются тестовые задания в виде суждений, с каждым из которых следует либо согласиться, либо отклонить. В матрице ответов укажите вариант ответа «да» или «нет». Максимальное количество баллов, которое можно набрать – 25.
1. Печеночные мхи – низшие растения.
2. Гаметы у мхов образуются в результате мейоза.
3. Крахмальные зерна – это лейкопласты с накопленным в них крахмалом.
4. После оплодотворения семязачатки превращаются в семена, а завязь в плод.
5. У всех беспозвоночных животных оплодотворение внешнее.
6. Гемолимфа насекомых выполняет те же функции, что и кровь позвоночных животных.
7. У всех представителей отряда пресмыкающихся сердце трехкамерное.
8. У домашних животных головной мозг, как правило, больше, чем у их диких предков.
9. Первые крокодилы были сухопутными рептилиями.
10. Характерной особенностью всех млекопитающих является живорождение.
11. В отличие от большинства млекопитающих для человека характерно наличие семи шейных позвонков и двух затылочных мыщелков.
12. В желудочно-кишечном тракте человека все белки перевариваются полностью.
13. Гипервитаминоз известен только для жирорастворимых витаминов.
14. Мозг человека потребляет примерно вдвое больше энергии на грамм веса, чем у крысы.
15. При тяжелой физической работе температура тела может подниматься до 39 градусов.
16. С вирусными инфекциями обычно борются с помощью антибиотиков.
17. Можно изучать кругообороты питательных веществ посредством ввода радиоактивных маркеров в природные или искусственные экосистемы.
18. Суккуленты легко переносят обезвоживание.
19. Сукцессия после вырубки леса является примером вторичной сукцессии.
20. Дрейф генов может играть роль эволюционного фактора только в очень малочисленных популяциях.
21. Генетическая информация у всех живых организмов хранится в виде ДНК.
22. Каждой аминокислоте соответствует один кодон.
23. У прокариот процессы трансляции и транскрипции происходят одновременно и в одном и том же месте.
24. Самые крупные молекулы в живых клетках – молекулы ДНК.
25. Все наследственные заболевания связаны с мутациями в хромосомах.
Часть IV.Вам предлагаются тестовые задания, требующие установления соответствия. Максимальное количество баллов, которое можно набрать – 12,5. Заполните матрицы ответов в соответствии с требованиями заданий.
Мах. 2,5 балла] Соотнесите красящие реактивы (1 – глицерин; 2 – гематоксилин; 3– фуксин; 4 – хлор–цинк–йод; 5 – раствор Люголя) с эффектами от их применения в процессе приготовления микропрепаратов: А – окрашивание ядер клеток; Б – окрашивание цитоплазмы; В – окрашивание зерен крахмала в клетках; Г – просветление препарата; Д – окрашивание целлюлозных оболочек клеток.
| Красящие реактивы | |||||
| Эффект применения |
2. [2,5 балла] Известно, что высокое содержание солей в почве создает в ней резко отрицательный водный потенциал, что ведет к нарушению поступления воды в клетки корня растения, а иногда и к повреждению клеточных мембран. Выберите приспособления, встречающиеся у растений, произрастающих на засоленных почвах.
01. Клетки корня солеустойчивых растений способны поглощать соли и выделять их через секретирующие клетки на листьях и стебле;
02. Содержимое клеток солеустойчивых растений обладает более отрицательным водным потенциалом, по сравнению с клетками других растений;
03. Клетки характеризуются высоким содержанием солей;
04. Цитоплазма клеток этих растений обладает низкой гидрофильностью;
05. Цитоплазма клеток солеустойчивых растений обладает большой гидрофильностью;
06. Клетки солеустойчивых растений характеризуются менее отрицательным водным потенциалом, нежели в окружающем их почвенном растворе;
07. Интенсивность фотосинтеза у растений, произрастающих на засоленных почвах, низкая;
08. Интенсивность фотосинтеза у этих растений высокая.
2. [2,5 балла] На рисунке изображен поперечный срез проводящего пучка картофеля (Solanum tuberosum). Соотнесите основные структуры проводящего пучка (А–Д) с их обозначениями на рисунке.
Задания теоретического тура олимпиады школьников по биологии, 8 класс
олимпиады школьников по биологии, 8 класс
Время выполнения – 180 минут
Часть I. Задание включает 30 вопросов, к каждому из них предложено 4 варианта ответа. На каждый вопрос выберите только один ответ, который вы считаете наиболее полным и правильным. Буквенный код ответа впишите в матрицу ответов. В листе ответа в клеточке соответствующей номеру теста запишите букву правильного ответа. В случае исправления буква должна быть продублирована.
1.Возбудитель холеры по форме клетки является:
А) бациллой
Б) вибрионом
В) спириллой
Г) кокком
2. Организмы, клетки которых не имеют оформленного ядра, аппарата Гольджи, относят к группе:
А) прокариот
Б) эукариот
В) водорослей
Г) простейших
3. Приспосабливаясь к жизни на суше высшие растения не сразу утратили под-вижность мужских гамет. Из перечисленных растений гаметы лишены жгутиков у:
А) сосны
Б) саговника
В) кукушкина льна
Г) плауна
4. Для питания грибы-сапротрофы используют?
А) азот воздуха и воду
Б) углекислый газ и кислород
В) органические вещества отмерших тел
Г) синтезированные ими органические вещества
5. Оформленных оболочкой ядер нет в клетках водорослей:
А)
зеленых
Б) красных
В) бурых
Г) сине-зеленых
6. Какова роль бактерии и грибов в круговороте
веществ:
А) производители
органических веществ
Б) потребители органических веществ +
В) разрушители органических веществ
Г) разрушители неорганических веществ
7.Большинство клеток зародышевого мешка цветковых
растений имеет:
А) гаплоидный набор хромосом
Б) диплоидный набор хромосом
В) триплоидный набор хромосом
Г) тетраплоидный набор хромосом
8.Манную крупу изготовляют из:
А) пшеницы
Б) проса
В) овса
Г) ячменя
9. Грибница белах грибов, поселяясь на корнях березы,
получает от нее:
А) минеральные
вещества
Б) органические вещества
В) соединения фосфора +
Г) соединения серы
10. Папоротниковидные, в отличие от покрытосеменных, не имеют:
А) проводящей системы
Б) цветков и плодов
В) хлоропластов в клетках
Г) эпидермиса с устьицами
11. Наиболее простое строение среди высших растений имеют мхи, так как у них:
А) нет корней
Б) стебель с узкими листьями
В) образуется много спор
Г) есть воздухоносные клетки
12. Все растения от водорослей до покрытосеменных имеют:
А) клеточное строение
Б) ткани
В) стебель с листьями
Г) проводящую систему
13. Плод покрытосеменных образуется из – ….
А) семязачатков
Б) околоплодников
В) завязи пестика
Г) пыльцевых зерен
14. Какая растительная ткань участвует в процессе испарения?
А) покровная
Б) механическая
В) основная
Г) образовательная
15. Какие группы животных не используют в процессе дыхания кислород:
А) дождевые черви и другие обитатели почвы
Б) эктопаразиты
В) личинки майского жука
Г) эндопаразиты
16. В процессе эволюции нервная трубка впервые появилась у:
А) рыбы
Б) ланцетника
В) пресмыкающегося
Г) взрослого земноводного
17. Первичную полость имеют:
А) кишечнополостные
Б) круглые черви
В) моллюски
Г) членистоногие
18. Размножение малярийного паразита в крови человека происходит:
А) лейкоцитах
Б) эритроцитах
В) тромбоцитах
Г) лимфоцитах
19.Спектр цветового зрения у медоносной пчелы:
А) такой же, как у
человека
Б) сдвинут в инфракрасную часть спектра
В) сдвинут в ультрафиолетовую часть спектра
Г) значительно шире, чем у человека, в обе стороны спектра
20. У бесчерепных животных скелет:
А) костный
Б) состоит из хитина
В) хрящевой
Г) представлен хордой
21.Рост костей в толщину обеспечивается клетками:
А) губчатого вещества кости
Б) желтого костного мозга
В) красного костного мозга
Г) внутреннего слоя надкостницы
22. Ткань, образованная одинаковыми по форме клетками, — это:
А) кровь
Б) костная
В) другое решение
Г) нервная
23. Какие мышцы приводят в движение кожу лица:
А) гладкие
Б) мимические
В) шейные
Г) жевательные
24. В организме человека с кислородом воздуха взаимодействует:
А) белок, определяющий резус-фактор
Б) глюкоза плазмы
В) гемоглобин эритроцитов
Г) фибриноген плазмы
25. При нарушении работы почек человека основанием для беспокойства является наличие в моче:
А) хлорида натрия
Б) белка
В) мочевины
Г) солей аммония
26. Не известны гормоны, которые являются
производными:
А) белков
Б) аминокислот
В) липидов
Г) углеводов
27. Если из крови удалить форменные элементы, то останется:
А) сыворотка
Б) лимфа
В) вода
Г) плазма
28. В основе иммунитета лежит способность клеток крови:
А) образовывать тромб при ранениях
Б) участвовать в выработке антител и фагоцитозе
В) осуществлять пластический обмен веществ
Г) осуществлять энергетический обмен веществ
29. Почему кровь не может попасть из аорты в левый желудочек сердца?
А) желудочек сокращается с большой силой и создает высокое давление
Б) полулунные клапаны заполняются кровью и плотно смыкаются
В) створчатые клапаны прижимаются к стенкам аорты
Г) створчатые клапаны закрыты, а полулунные открыты
30. Пучки длинных отростков нейронов, покрытые соединительно-тканной оболочкой и расположенные вне центральной нервной системы, образуют:
А) нервы
Б) спинной мозг
В) мозжечок
Г) кору больших полушарий
Часть 2. Вам предлагаются тестовые задания с множественными вариантами ответа (от 0 до 5). Максимальное количество баллов, которое можно набрать – 25 (по 1 баллу за каждый правильный ответ). Индексы верных ответов (В) и неверных ответов (Н) отметьте в матрице знаком «Х».
1. Для хвойных растений характерны признаки:
а) наличие семенной кожуры
б) образование плодов
в) ветроопыление
г) широкий спектр жизненных форм
д) преобладание спорофита в жизненном цикле
2. Выберите все возможные функции проводящих тканей цветковых растений:
а) фотосинтез
б) запасание питательных веществ
в) проведение воды
г) проведение органических веществ
д) транспорт гормонов
3. Пожелтение с последующим опадением листьев у растений может быть вызвано:
а) образованием цитокининов
б) недостатком азота в почве
в) недостатком воды в почве
г) изменением длины светового дня
д) нападением вредителей
4. Фотосинтез в листе происходит в клетках:
а) устьичных
б) губчатой ткани
в) столбчатой ткани
г) проводящей ткани
д) образовательной ткани
5. Полостное пищеварение происходит у:
а) гидры
б) свиного цепня
в) планарии
г) дождевого червя
д) губки сикон (Sycon)
|
№ |
|
а |
б |
в |
г |
д |
|
1 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
2 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
3 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
4 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
5 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
Часть 3. Вам предлагаются тестовые задания в виде суждений, с каждым из которых следует либо согласиться, либо отклонить. В матрице ответов укажите вариант ответа «да» или «нет». Максимальное количество баллов, которое можно набрать – 10 (по 1 баллу за каждое тестовое задание).
1. Тело низших растений всегда представлено слоевищем с крупными листьями.
2. Гаметы у мхов образуются в результате мейоза.
3. Нервная система медузы устроена сложнее, чем у полипов.
4. После оплодотворения семязачатки превращаются в семена, а завязь в плод.
5. Когти и волосы у млекопитающих имеют то же происхождение, что и головной мозг.
6. Гемолимфа насекомых выполняет те же функции, что и кровь позвоночных животных.
7. Первые крокодилы были сухопутными рептилиями.
8. Малый круг кровообращения начинается от левого желудочка.
9. При сильном похолодании некоторые птицы могут впадать в спячку.
10. Органические вещества обеспечивают твердость кости.
Часть 4. Вам предлагаются тестовые задания, требующие установления соответствия. Максимальное количество баллов, которое можно набрать – 8. Заполните матрицы ответов в соответствии с требованиями заданий.
1. мах. 5 баллов. ] Установите соответствие между видами амфибий (1–10) и местами обитания (А–Е), где преимущественно, вне сезона размножения, можно встретить их взрослых особей.
|
Виды амфибий: 1) серая жаба 2) квакша 3) шпорцевая лягушка 4) чесночница 5) остромордая лягушка |
6) протей 7) червяга 8) жерлянка 9) обыкновенный тритон 10) озёрная лягушка |
Места обитания: А) в воде и на берегу водоёмов Б) только на суше В) только в воде Г) на суше, регулярно зарываясь в почву Д) только в почве Е) в кронах деревьев
|
|
Виды амфибий |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Местообитание |
|
|
|
|
|
|
|
|
|
|
- мах. 3 балла Установите соответствие между изображениями эритроцитов (1–3) с раствором хлорида натрия (А–Е) соответствующей концентрации, в котором эритроциты принимают такую форму.
|
Раствор NaCl: 1) гипотонический 2) 0,9% NaCl 3) гипертонический 4) изотонический 5) 1,9% NaCl 6) 0,2 % NaCl |
А) |
Б) |
В) |
|
Раствор |
1 |
2 |
3 |
4 |
5 |
6 |
|
Эритроцит |
|
|
|
|
|
|
Имя __________________________
Класс __________________________
Матрица ответов на задания
олимпиады школьников по биологии.
Часть 1. 30 баллов
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1-10 |
|
|
|
|
|
|
|
|
|
|
|
11-20 |
|
|
|
|
|
|
|
|
|
|
|
21-30 |
|
|
|
|
|
|
|
|
|
|
Часть 2. 25 баллов
|
№ |
|
а |
б |
в |
г |
д |
|
1 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
2 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
3 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
4 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
5 |
в |
|
|
|
|
|
|
н |
|
|
|
|
|
Задание 3. 10 баллов
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
«да» |
|
|
|
|
|
|
|
|
|
|
|
«нет» |
|
|
|
|
|
|
|
|
|
|
Часть 4. [8 баллов]
1. [мах. 5 баллов]
|
Виды амфибий |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
местообитание |
|
|
|
|
|
|
|
|
|
|
2. [3 балла]
|
раствор |
1 |
2 |
3 |
4 |
5 |
6 |
|
эритроцит |
|
|
|
|
|
|
Ответы олимпиады школьников
по биологии.
Часть1. 30 баллов
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1-10 |
б |
а |
а |
в |
г |
в |
а |
а |
б |
б |
|
11-20 |
а |
а |
в |
а |
г |
б |
б |
б |
в |
г |
|
21-30 |
г |
в |
б |
в |
б |
г |
г |
б |
б |
а |
Часть 2. 25 баллов
|
№ |
|
а |
б |
в |
г |
д |
|
1 |
в |
х |
|
х |
|
х |
|
н |
|
х |
|
х |
|
|
|
2 |
в |
|
х |
х |
х |
х |
|
н |
х |
|
|
|
|
|
|
3 |
в |
|
х |
х |
х |
х |
|
н |
х |
|
|
|
|
|
|
4 |
в |
х |
х |
х |
|
|
|
н |
|
|
|
х |
х |
|
|
5 |
в |
х |
|
х |
х |
|
|
н |
|
х |
|
|
х |
Часть 3. 10 баллов
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
прав. ДА |
|
|
Х |
|
Х |
|
Х |
|
Х |
|
|
неправ нет |
Х |
Х |
|
Х |
|
Х |
|
Х |
|
Х |
Часть 4. 8 баллов
1. 3 балла
|
Виды амфибий |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
местообитание |
б |
ее |
вв |
гг |
бб |
вв |
дд |
аа |
бб |
аа |
2. 5 баллов
|
раствор |
1 |
2 |
3 |
4 |
5 |
6 |
|
эритроцит |
в |
б |
а |
б |
а |
в |
Примеры заданий всероссийской олимпиады школьников по биологии содержание заданий
Часть I. Вам предлагаются тестовые задания, требующие выбора только одного ответа из четырех возможных. Максимальное количество баллов, которое можно набрать – 60 (по 1 баллу за каждое тестовое задание). Индекс ответа, который вы считаете наиболее полным и правильным, укажите в матрице ответов.
В благоприятных условиях спора
бактерии:
а) делится, образуя 3 – 6
новых спор;
б) сливается с другой
спорой с последующим делением;
в)
погибает;
г) прорастает в новую
бактериальную клетку. +
Оформленных оболочкой ядер нет в
клетках водорослей:
а) зеленых;
б)
красных;
в) бурых;
г) сине-зеленых. +
В клетках грибов нельзя обнаружить:
а)
вакуоли;
б) митохондрии;
в) пластиды;
+
г) рибосомы.
Сфагнум размножается:
а) семенами;
б)
пыльцой;
в) спорами; +
г) зооспорами.
Большинство клеток зародышевого
мешка цветковых растений имеет:
а)
гаплоидный набор хромосом; +
б)
диплоидный набор хромосом;
в) триплоидный
набор хромосом;
г) тетраплоидный набор
хромосом.
Человек употребляет в пишу орган(-ы)
цветной капусты:
а) видоизмененную
верхушечную почку;
б) утолщенный
реповидный стебель;
в) видоизмененное
соцветие; +
г) боковые видоизмененные
почки.
Соцветие колос характерно для:
а)
ландыша;
б) сирени;
в) ржи;
г)
подорожника. +
Семена без эндосперма у:
а)
клещевины;
б) липы;
в) томата;
г)
частухи подорожниковой. +
Корневые шишки – это сильно
утолщенные:
а) придаточные корни;
+
б) корневые волоски;
в) главные
корни;
г) воздушные клубни.
Соплодие характерно для:
а)
груши;
б) ананаса; +
в) банана;
г)
айвы.
К корнеотпрысковым растениям
относят:
а) облепиху крушиновидную;
б)
осот полевой;
в) осину дрожащую;
г)
все перечисленные растения. +
Ваниль душистая – многолетняя
цепляющаяся лиана сем. Орхидные. В
кондитерском производстве используют
ее:
а) стебли;
б) стебли и
листья;
в) соцветия;
г) плоды. +
Манную крупу изготовляют из:
а)
пшеницы; +
б) проса;
в) овса;
г)
ячменя.
Общим признаком голосеменных и
покрытосеменных растений является:
а)
развитие из спор;
б) наличие цветка;
в) развитие из семени; +
г) редукция
спорофита.
Простейшие, ведущие исключительно
паразитический образ жизни:
а)
корненожки;
б) жгутиконосцы;
в)
солнечники;
г) споровики. +
Муха цеце является переносчиком
трипанозом, вызывающих у человека:
а)
сонную болезнь; +
б) восточную язву;
в)
малярию;
г) кокцидиоз.
Изучение добытого экземпляра губки
выявило наличие у нее прочного, но
хрупкого кремниевого скелета. Наиболее
вероятно, что данная губка является:
а)
мелководным обитателем;
б) глубоководным
обитателем; +
в) наземным обитателем;
г)
обитателем приливно-отливной зоны.
Спектр цветового зрения у медоносной
пчелы:
а) такой же, как у человека;
б)
сдвинут в инфракрасную часть спектра;
в)
сдвинут в ультрафиолетовую часть
спектра; +
г) значительно шире, чем у
человека, в обе стороны спектра.
Развитие личинок из яиц, отложенных
аскаридами происходит:
а) при
температуре 37оС, высокой
концентрации СО2, в течение двух
недель;
б) при температуре 20-30оС,
высокой концентрации СО2, в
течение двух недель;
в) при температуре
37оС, высокой концентрации О2,
в течение недели;
г) при температуре
20-30оС, высокой концентрации О2,
в течение двух недель. +
В отличие от круглых червей, у кольчатых
червей появилась:
а) пищеварительная
система;
б) выделительная система;
в)
кровеносная система; +
г) нервная
система.
Крылья у насекомых находятся на
спинной стороне:
а) груди и брюшка;
б)
груди; +
в) головогруди и брюшка;
г)
головогруди.
Рабочие пчелы являются:
а) самками,
отложившими яйца и приступившими к
уходу за потомством;
б) самками, у
которых на развиты половые железы; +
в)
молодыми самками, способными через год
отложить яйца;
г) самцами, развившимися
из неоплодотворенных яиц.
Морские игуаны, живущие на Галапагосских
островах, выводят избыток соли из
организма:
а) с мочой;
б) через
солевые железы; +
в) через поры в
коже;
г) с экскрементами.
У страуса нанду насиживает яйца и
опекает птенцов:
а) только самка;
б) только самец; +
в) по очереди оба
родителя;
г) приемные родители, в
гнездо которых подброшены яйца.
Самые большие гнезда среди птиц
строят:
а) орлы;
б) пеликаны;
в)
страусы;
г) африканские ткачики. +
Из перечисленных организмов наиболее
прогрессивными чертами строения
обладают:
а) амеба;
б) дождевой
червь; +
в) гидра;
г) вольвокс.
Усложнение кровеносной системы
соответствует эволюции хордовых в ряду
следующих животных:
а) жаба – кролик
– крокодил – акула;
б) акула – лягушка
– крокодил – кролик; +
в) акула –
крокодил – лягушка – кролик;
г)
крокодил – акула – жаба – собака.
Наибольшее видовое многообразие
обитателей Мирового океана наблюдается:
а)
на коралловых рифах; +
б) в открытом
океане в тропиках;
в) в приполярных
областях;
г) в глубоководных впадинах.
Считается, что при переносе информации
из кратковременной памяти в долговременную
теряется информации:
а) 5%;
б) 10%;
в)
50%;
г) более 90%. +
Целлюлоза, попавшая в желудочно-кишечный
тракт человека:
а) не расщепляется
из-за отсутствия специфического
фермента;
б) частично расщепляется
бактериями в толстом кишечнике; +
в)
расщепляется α-амилазой слюны;
г)
расщепляется панкреатической α-амилазой.
Какова реакция среды в двенадцатиперстной
кишке:
а) слабокислая;
б)
нейтральная;
в) слабощелочная; +
г)
щелочная.
Не известны гормоны, которые являются
производными:
а) белков;
б)
аминокислот;
в) липидов;
г) углеводов.
+
В процессе пищеварения переваривании
белки расщепляются до:
а) глицерола;
б)
жирных кислот;
в) моносахаридов;
г)
аминокислот. +
Такие симптомы как поражение слизистой
оболочки рта, шелушение кожи, трещины
губ, слезоточивость, светобоязнь,
указывают на недостаток:
а)
токоферола;
б) пиридоксина;
в)
рибофлавина; +
г) фолиевой кислоты.
Рецептор кожи, реагирующий на холод:
а)
тельце Пчини;
б) тельце Мейснера;
в)
нервное сплетение вокруг волосяной
луковицы;
г) колба Краузе. +
К вирусным заболеваниям не относится:
а)
корь;
б) клещевой энцефалит;
в)
краснуха;
г) дифтерия. +
Пищевая цепь – это:
а) последовательность
организмов в природном сообществе,
каждый элемент которой является пищей
для следующего; +
б) последовательное
прохождение пищи по различным разделам
пищеварительного тракта;
в) зависимость
растений от травоядных животных, их, в
свою очередь, от хищников;
г) совокупность
всех пищевых связей в экосистеме.
Постоянное вмешательство со стороны
человека требуется для существования:
а)
экосистем пресных вод;
б) природных
экосистем суши;
в) экосистемы Мирового
океана;
г) агроценозов. +
В природных условиях естественными
носителями возбудителя чумы являются:
а) птицы;
б) грызуны; +
в) копытные;
г)
человек.
В обширных лесных массивах Севера
часто проводятся так называемые
концентрированные рубки с использованием
тяжелой техники, которые приводят:
а)
к смене лесных экосистем болотными;
+
б) к опустыниванию или полному
разрушению экосистем;
в) к увеличению
доли более ценных с точки зрения
хозяйства пород деревьев;
г) к процессу
превращения в почве органических
остатков в гумус.
Листья суккулентов – растений
засушливых местообитаний – характеризуются:
а) редуцированными устьицами;
недифференцированным мезофиллом;
отсутствием кутикулы; развитой
аэренхимой;
б) частым рассечением,
отсутствием механической ткани;
в)
толстой кутикулой; мощным восковым
налётом; клетками с крупными вакуолями;
погружёнными устьицами; +
г) хорошо
развитой склеренхимой; преобладанием
связанной воды.
Из названных организмов к надцарству
прокариот относится:
а) эвглена
зеленая;
б) инфузория-туфелька;
в)
амеба;
г) стафилококк. +
Две породы собак, например, болонка
и немецкая овчарка, это животные:
а)
одного вида, но с разными внешними
признаками; +
б) двух видов, одного
рода и одного семейства;
в) двух видов,
двух родов, но одного семейства;
г)
одного вида, но обитающие в разных
условиях окружающей среды.
Наука, изучающая развитие живой
природы по отпечаткам и окаменелостям,
которые находят в земной коре:
а)
систематика;
б) история;
в) палеонтология;
+
г) эволюция.
Первые наземные позвоночные произошли
от рыб:
а) лучеперых;
б) кистеперых;
+
в) цельноголовых;
г) двоякодышащих.
Контуры тела летяги, сумчатой летяги,
шерстокрыла очень сходны. Это является
следствием:
а) дивергенции;
б)
конвергенции; +
в) параллелизма;
г)
случайного совпадения.
Число хромосом при половом размножении
в каждом поколении возрастало бы вдвое,
если бы в ходе эволюции не сформировался
процесс:
а) митоза;
б) мейоза; +
в)
оплодотворения;
г) опыления.
Одно из положений клеточной теории
гласит:
а) при делении клетки
хромосомы способны к самоудвоению;
б)
новые клетки образуются при делении
исходных клеток; +
в) в цитоплазме
клеток содержатся различные органоиды;
г)
клетки способны к росту и обмену веществ.
При партеногенезе организм развивается
из:
а) зиготы;
б) вегетативной
клетки;
в) соматической клетки;
г)
неоплодотворенной яйцеклетки. +
Матрицей для трансляции служит
молекула:
а) тРНК;
б) ДНК;
в)
рРНК;
г) иРНК. +
Кольцевая ДНК характерна для:
а)
ядер грибов;
б) клеток бактерий; +
в)
ядер животных;
г) ядер растений.
Разделить клетки, органоиды или
органические макромолекулы по их
плотности можно с помощью метода:
а)
хроматография;
б) центрифугирование;
+
в) электрофорез;
г) авторадиография.
Мономерами нуклеиновых кислот
являются:
а) азотистые основания;
б)
нуклеозиды;
в) нуклеотиды; +
г)
динуклеотиды.
Ионы магния входят в состав:
а)
вакуоли;
б) аминокислот;
в) хлорофилла;
+
г) цитоплазмы.
В процессе фотосинтеза источником
кислорода (побочного продукта)
является:
а) АТФ
б) глюкоза;
в)
вода; +
г) углекислый газ.
Из компонентов растительной клетки
вирус табачной мозаики поражает:
а)
митохондрии;
б) хлоропласты; +
в)
ядро;
г) вакуоли.
Из названных белков ферментом
является:
а) инсулин;
б) кератин;
в)
тромбин; +
г) миоглобин.
В хлоропластах растительных клеток
светособирающие комплексы расположены
а)
на наружной мембране;
б) на внутренней
мембране;
в) на мембране тилакоидов;
+
г) в строме.
Неаллельное взаимодействие генов
при дигибридном скрещивании может дать
во втором поколении расщепление:
а)
1:1;
б) 3:1;
в) 5:1;
г) 9:7. +
При браках между людьми европеоидной
и негроидной расы во втором поколении
обычно не бывает людей с белым цветом
кожи. Это связано с:
а) неполным
доминированием гена пигментации
кожи;
б) полимерностью генов пигментации
кожи; +
в) эпигеномной наследственностью;
г)
нехромосомной наследственностью.
Часть II. Вам предлагаются тестовые задания с одним вариантом ответа из четырех возможных, но требующих предварительного множественного выбора. Максимальное количество баллов, которое можно набрать – 30 (по 2 балла за каждое тестовое задание). Индекс ответа, который вы считаете наиболее полным и правильным, укажите в матрице ответов.
Бактерии вызывают заболевания:
I.
возвратный тиф. +
II.
сыпной тиф. +
III.
малярия.
IV.
туляремия. +
V.
гепатит.
а) II, IV;
б)
I, IV, V;
в)
I, II, IV;
+
г) II, III,
IV, V.
Корни могут выполнять функции:
I.
образования почек. +
II.
образования листьев.
III.
вегетативного размножения. +
IV.
поглощения воды и минеральных веществ.
+
V. синтеза
гормонов, аминокислот и алкалоидов.
+
а) II, III,
IV;
б) I,
II, IV, V;
в)
I, III, IV,
V; +
г) I,
II, III, IV.
Если оборвать (обрезать) кончик
главного корня:
I.
корень погибнет.
II.
все растение погибнет.
III.
рост корня в длину прекратится. +
IV.
растение выживет, но будет слабым.
V.
начнут расти боковые и придаточные
корни. +
а) III, IV,
V;
б) III,
V; +
в) I,
IV, V;
г)
II, IV, V.
Среди паукообразных развитие с
метаморфозом характерно для:
I.
пауков.
II. клещей.
+
III. сольпуг.
IV.
сенокосцев.
V.
скорпионов.
а) II; +
б)
II, III;
в)
I, IV;
г)
I, II, III,
V.
Животными, ведущими прикрепленный
(сидячий) образ жизни, но имеющими
свободноплавающих личинок, являются:
I.
кораллы. +
II.
губки. +
III.
асцидии. +
IV.
коловратки.
V.
усоногие раки. +
а)
I, II, III,
IV;
б) I,
II, III, V;
+
в) I, III,
IV;
г) I,
II, III, IV,
V.
Хорда сохраняется в течение всей
жизни у:
I.
окуня.
II. осетра.
+
III. акулы.
IV.
миноги. +
V.
ланцетника. +
а) I, II,
III, IV;
б)
III, IV, V;
в)
II, III, V;
г) II, IV,
V. +
Нерестится только один раз в жизни:
I.
севрюга.
II.
сардина.
III.
горбуша. +
IV.
красноперка.
V.
речной угорь. +
а) II,
III, V;
б)
III, V; +
в)
I, III, V;
г) I, II,
III, V.
Аллантоис выполняет у амниот функцию:
I.
газообмена. +
II.
терморегуляции.
III.
запасания воды.
IV.
накопления мочи. +
V.
пищеварения.
а) I, III,
IV;
б) I,
IV; +
в) I,
II, IV, V;
г) I, II,
III, IV.
В почечном клубочке в норме практически
не фильтруются:
I.
вода.
II.
глюкоза.
III.
мочевина.
IV.
гемоглобин. +
V.
альбумин плазмы. +
а) I,
II, III;
б)
I, III, IV,
V;
в) II,
IV, V;
г)
IV, V. +
Каждая популяция характеризуется:
I.
плотностью. +
II.
численностью. +
III.
степенью изоляции.
IV.
независимой эволюционной судьбой.
V.
характером пространственного
распределения. +
а) I,
II, V; +
б)
I, IV, V;
в)
II, V;
г)
II, III, IV.
К хищникам, как правило охотящимся
из засады, относятся:
I.
волк.
II. рысь.
+
III. ягуар. +
IV.
гепард.
V. медведь.
+
а) II, III,
IV, V;
б) I,
IV;
в) I,
II, III, V;
г) II, III,
V. +
Из перечисленных животных в состав
тундрового биоценоза входят:
I.
белка.
II.
хорек.
III. песец.
+
IV. лемминг.
+
V. зеленая
жаба.
а) I, II,
III, IV;
б)
II, III, IV,
V;
в) III,
IV; +
г) III,
IV, V.
Аналогичные органы, развившиеся в
ходе эволюции:
I.
жабры рыбы и жабры рака. +
II.
крылья бабочки и крылья птицы. +
III.
усики гороха и усики винограда. +
IV.
волосы млекопитающих и перья птицы.
V.
колючки кактуса и колючки боярышника.
+
а) I,
III, IV, V;
б) I, II, IV, V;
в)
I, II, III, V; +
г) I, II, III, IV.
Из названных полимеров к неразветвленным
относятся:
I.
хитин. +
II.
амилоза. +
III.
гликоген.
IV.
целлюлоза. +
V.
амилопектин.
а) I, II,
IV; +
б) I,
II, III, IV;
в)
II, IV, V;
г) III, IV,
V.
В организме человека гормональные
функции выполняют соединения:
I.
белки и пептиды. +
II.
производные нуклеотидов.
III.
производные холестерина.
+
IV. производные
аминокислот. +
V.
производные жирных кислот.
+
а) III, IV,
V;
б) I,
III, IV, V;
+
в) III, V;
г) II.
Часть III. Вам предлагаются тестовые задания в виде суждений, с каждым из которых следует либо согласиться, либо отклонить. В матрице ответов укажите вариант ответа «да» или «нет». Максимальное количество баллов, которое можно набрать – 25.
Печеночные мхи – низшие растения.
Гаметы у мхов образуются в результате мейоза.
Крахмальные зерна – это лейкопласты с накопленным в них крахмалом. +
После оплодотворения семязачатки превращаются в семена, а завязь в плод.
У всех беспозвоночных животных оплодотворение внешнее.
Гемолимфа насекомых выполняет те же функции, что и кровь позвоночных животных.
У всех представителей отряда пресмыкающихся сердце трехкамерное.
У домашних животных головной мозг, как правило, больше, чем у их диких предков.
Первые крокодилы были сухопутными рептилиями. +
Характерной особенностью всех млекопитающих является живорождение.
В отличие от большинства млекопитающих для человека характерно наличие семи шейных позвонков и двух затылочных мыщелков.
В желудочно-кишечном тракте человека все белки перевариваются полностью.
Гипервитаминоз известен только для жирорастворимых витаминов. +
Мозг человека потребляет примерно вдвое больше энергии на грамм веса, чем у крысы.
При тяжелой физической работе температура тела может подниматься до 39 градусов. +
С вирусными инфекциями обычно борются с помощью антибиотиков.
Можно изучать кругообороты питательных веществ посредством ввода радиоактивных маркеров в природные или искусственные экосистемы. +
Суккуленты легко переносят обезвоживание.
Сукцессия после вырубки леса является примером вторичной сукцессии. +
Дрейф генов может играть роль эволюционного фактора только в очень малочисленных популяциях. +
Генетическая информация у всех живых организмов хранится в виде ДНК.
Каждой аминокислоте соответствует один кодон.
У прокариот процессы трансляции и транскрипции происходят одновременно и в одном и том же месте. +
Самые крупные молекулы в живых клетках – молекулы ДНК. +
Все наследственные заболевания связаны с мутациями в хромосомах.
Часть IV. Вам предлагаются тестовые задания, требующие установления соответствия. Максимальное количество баллов, которое можно набрать – 12,5. Заполните матрицы ответов в соответствии с требованиями заданий.
Зародышевый мешок — Справочник химика 21
Зародышевый мешок образуется из материнской клетки мегаспоры (или материнской клетки макроспоры) в семяпочке. Такая клетка (фиг. 10, вверху справа) в результате мейоза [c.35]У цветковых растений гаплофаза редуцирована еще больше и представлена лишь пыльцевыми зернами и зародышевым мешком. Пыльцевые зерна еще можно считать до известной степени свободными организмами, тогда как зародышевый мешок неотделим от материнского растения. Известно, что пыльцевые зерна образуются в пыльниках, которые на ранней стадии развития содержат обычно больщое число материнских клеток пыльцы (фиг. 10, вверху слева). Мейоз происходит в материнских клетках пыльцы, которые в результате превращаются в тетрады, т. е. в группы из четырех гаплоидных клеток. Эти клетки затем отделяются друг от друга и образуют зрелые пыльцевые зерна. Сначала эти пыльцевые зерна имеют лишь по одному ядру, но затем путем митоза они превращаются в пыльцевые зерна, состоящие из двух клеток— вегетативной и генеративной. Ядро вегетативной клетки располагается в центре пыльцевого зерна и больше не делится генеративное же ядро делится еще раз и дает начало двум ядрам спермиев каждое из них локализуется в отдельной клетке (фиг. 10, нижний ряд слева). Такое пыльцевое зерно созрело и способно к оплодотворению. [c.35]
Более того, иногда наблюдается элиминация хромосом, т. е. отдельные хромосомы остаются в цитоплазме, не включаясь ни в пыльцевое зерно, ни в зародышевый мешок. Таким образом, в большинстве случаев пыльцевые зерна и зародышевые мешки получают неполный, несбалансированный набор хромосом, дающий летальный эффект. Итак, в большинстве случаев гаплоид будет полностью или почти полностью стерильным. [c.331]
Нормальный гаплоидный зародышевый мешок ]) дегенерирует и будет замещен другим зародышевым мешком, который образуется из соматической клетки семяпочки и не претерпевает редукционного деления. Этот зародышевый мешок пока еще находится на стадии четырех клеток (2). [c.382]
Прежде всего укажем, что при апомиксисе у цветковых растений зародышевые мешки и, следовательно, яйцеклетки содержат нередуцированные наборы хромосом. Как правило, это достигается таким изменением мейоза, в результате которого не происходит уменьшения числа хромосом наполовину в других случаях нормальный гаплоидный зародышевый мешок дегенерирует и замещается одним или несколькими зародышевыми мешками, развивающимися из соматических клеток семяпочки без мейоза (фиг. 185). [c.382]
Антипод— (см. Зародышевый мешок). [c.451]
Мегаспора — у цветковых растений одна из четырех тетрадных клеток, которые образуются в результате мейоза в материнской клетке мегаспоры в семяпочке. Одна из мегаспор дает впоследствии зародышевый мешок. [c.458]
Метод гибридизации основан на том, что при оплодотворении относительно неродственного материнского растения движение мужских гамет бывает затруднено в чужеродной среде зародышевого мешка. Одна из них может погибнуть, не достигнув яйцеклетки. Однако яйцеклетка обладает определенной способностью, зависящей от наследственности, к самостоятельному развитию под влиянием одних лишь химических веществ, привнесенных в зародышевый мешок пыльцевой трубкой. Если другая гамета нормально объединится с вторичным ядром зародышевого мешка и обеспечит жизнеспособный эндосперм, то из неоплодотворенной яйцеклетки разовьется гаплоидный зародыш. [c.83]
Спорофит разноспоровый, т. е. образует споры двух типов микроспоры и мегаспоры микроспора — пыльцевое зерно, мегаспора — зародышевый мешок [c.62]
Одна клетка растет, образуя зародышевый мешок [c.62]
Зародышевый мешок Конец, [c.62]
Зрелый зародышевый мешок непосредственно пе ед оплодотворением из семи имеющихся ядер шесть гаплоидные, одно диплоидное [c.62]
Разрастающийся зародышевый мешок [c.70]
Зародышевый мешок — зародышевый мешок и мегаспора, из которой он развивается, представляют собой гаплофазу в развитии женского гаметофита у цветковых растений. Чаще всего зародышевый мешок содержит 8 ядер, 3 из которых находятся в одном конце зародышевого мешка и образуют яйцевой аппарат, состоящий из яйцеклетки и двух синергид. Три клетки в противоположном конце зародышевого мешка называют клетками-антиподами. В середине зародышевого [c.455]
Зрелый зародышевый мешок с восемью ядрами [c.32]
Совокупность женских генеративных органов в цветке называется гинецеем, или пестиком. Полностью сформированный пестик развивается из одного или нескольких сросшихся между собой плодолистиков и имеет завязь, столбик и рыльце. В зависимости от числа плодолистиков завязь может быть одно-, двух-, трех- и многогнездной. В полости завязи закладываются бугорки семяпочек, в каждой из них в дальнейшем развивается женский гаметофит — зародышевый мешок. Место заложения и прикрепления семяпочек к завязи называется семяносцем, или плацентой. [c.163]
Проводящая система семяпочки сначала бывает представлена тяжами клеток прокамбия, которые по мере созревания семяпочки развиваются в сосудистые пучКи и состоят главным образом из ксилемы (кольчатых и спиральных сосудов) элементы флоэмы часто отсутствуют. У большинства покрытосеменных растений проводящая система дифференцирована недостаточно и имеет характер протоксилемы. Комплексы сосудов проходят из семяножки в халазу нуцеллуса и заходят в интегументы, обеспечивая тем самым поступление питательных веществ в семяпочку, зародышевый мешок и зародыш. Поступление пластических веществ в верхние слои клеток семяпочки происходит также в результате интенсивного межклеточного обмена. Иногда наблюдается редукция проводящей системы вплоть до почти полного ее исчезновения. [c.166]
А. Продольный срез через цветок во время оплодотворения. Некоторые пыльцевые зерна проросли на рыльце, одна нз пыльцевых трубок достигла зародышевого мешка. Б. Продольный срез через верхнюю часть столбика. Видны прорастаюш,ие пыльцевые зерна с пыльцевыми трубками разной длины. У —пыльцевое зерно 2 —пыльцевая трубка 3 —рыльце — столбик 5 —семяпочка —покровы семяпочки 7 —зародышевый мешок 5 —ядро пыльцевой трубки 9 —спермин / — лепестки // — чашелистики /2 —пыльник с пыльцевыми зернами —завязь / — тычиночная нить /5 —антиподы /6 —полярные ядра /7 —синергиды, /5 —яйцеклетка /9 —микропиле —нектарные железы. [c.38]
После того как образовалось исходное три-плоидиое ядро эндосперма, начинается быстрое деление ядер, которое, однако, не сопровождается образованием клеточных перегородок, так что зародышевый мешок оказывается выстланным по периферии тонким слоем цитоплазмы с множеством свободных ядер. Этот периферический слой ядер развивается в алейроновый слой. Приблизительно через 2 дня после оплодотворения между ядрами начинают возникать клеточные перегородки. Дальнейшее увеличение числа клеток идет центростремительно и осуществляется путем нормального клеточного деления [81 ]. [c.467]
Естественные тетраплоиды для кукурузы не известны, хотя и неоднократно предпринимались попытки их обнаружения [121 Были замечены факты спонтанного увеличения числа хромосом в соматических клет ках [131, а также нарушения редукции числа хромосом в мейозе [14 I Опыление гамет пыльцой окружающих их диплоидов ведет к образованию маложизнеспособных триплоидных семян и исключению их из популяции. Триплоидные особи также могут возникать в результате слияние двух спермиев с яйцеклеткой в случае проникновения в зародышевый мешок двух пыльцевых трубок [15]. [c.28]
Цитоэмбриологическое изучение процессов оплодотворения при скрещивании автотетраплоидных и диплоидных растений свидетельствовало о нормальном протекании их начальных стадий у большинства видов [8 . Проникшие в зародышевый мешок спермин успешно сливались с яйцеклеткой и полярным ягром. Вместе с тем при различных направлениях скрещивания наблюдались некоторые отличия в темпах протекания процессов оплодотворения и особенно развития эндосперма и зародыша. Пыльца тетраплоидных растений прорастает несколько медленнее, чем диплоидов. поэтому при скрешивании 2х х 4х оплодотворение семяпочки, деление клеток эндосперма и зиготы происходило в более поздние [c.124]
В результате обширных работ Стадлера и его сотрудников имеется довольно много данных о генетическом эффекте, возникающем при облучении ультрафиолетовыми лучами пыльцы кукурузы, и о различиях между эффектами, производимыми рентгеновыми и ультрафиолетовыми лучами . Пыльцу наносят одним слоем и облучают сверху. После облучения ею опыляют растение кукурузы. Семена кукурузы просматривают и, если нужно, высеивают для получения растений первого поколения (/= J. Во время облучения пыльцевое зерно содержит два гаплоидных ядра, которые также называют спермиями. Когда они входят в зародышевый мешок (до оплодотворения мешок содержит восемь гаплоидных ядер, которые появлялись в результате трех последовательных делений одного ядра, возникавшего после мейоза), одно из этих ядер-спер-миев сливается с ядром яйцеклетки и образуется диплоидная зигота, которая путем размножения дает зародыш, или эмбрион, семени, а затем — растение Fj. Второе ядро-спермий сливается с двумя другими гаплоидными ядрами ядра слияния) и образует триплоидное ядро, которое путем размножения развивается в эндосперм — богатую крахмалом ткань, составляющую основную массу семени, но не сохраняющуюся в растении [c.143]
Опыление смесью пыльцы разных видов также повышает скрещиваемость за счет того, что пыльца, имеющая разный генотип, может взаимно стимулировать рост составных частей ее, создавая в пестике условия, благоприятные для прорастания разной пыльцы. Такого же порядка явление происходит, очевидно, и при использовании таких приемов, как повторное опыление, доопыление материнской пыльцой, позднее опыление после кастрации. Для того чтобы не возникало при этом сомнения в том, что получены именно те гибридные зерна, которые планировалось получить, нужно знать цитоэ>1бриологию оплодотворения у отдельных видов и родов. Так, например, для пшеницы выяснено, что ее пыльца начинает прорастать через 5 минут после нанесения ее на рыльце, а пыльцевые трубки входят в зародышевый мешок через 20 минут (Модилевский, 1958). [c.140]
Зародышевый мешок (мегаспора) остается целиком закрытым в семязачатке (мегаспорангии) оплодотворенный семязачаток представляет собой семя [c.62]
Один из самых ярких примеров резкого изменения формы у растений — это переход от вегетативного роста к репродуктивному. У многих покрытосеменных растение на протяжении долгого времени образует только корни, побеги и листья. Затем, в какой-то момент жизненного цикла, бурный вегетативный рост прекращается и начинается ряд превращений, приводящих в конце концов к появлению репродуктивных органов. Первые морфологические изменения отмечаются в конусе нарастания стебля, который из узкого цилиндра превращается в уплощенный бугорок. На этом бугорке развиваются теперь зачатки цветко1в, содержащие чашелистики, лепестки, тычинки и плодолистики. В тычинках и плодолистиках происходит важный процесс — мейоз, завершающийся образованием гаплоидных клеток и полового поколения растения — гаметофита, имеющего одиночный набор хромосом (рис. 3.10). В тычинках (мужском органе) в результате мейоза образуются гаплоидные микроспоры, развивающиеся в мужской гаметофит (пыльцевое зерно) в завязи (женском органе), формирующейся из одного или нескольких плодолистиков, в процессе мейоза образуется гаплоидная мегаспора, развивающаяся в женский гаметофит (зародышевый мешок). Мужской и женский гаметофиты в конечном счете дают начало половым клеткам, т. е. спермию и яйцеклетке. Спермий по пыльцевой трубке проникает в семязачаток и оплодотворяет яйцеклетку. В результате слияния двух половых клеток восстанавливается бесполое поколение — спорофит, имеющий двойной набор хромосом. [c.97]
Моноспорические зародышевые мешки представлены двумя типами восьми- и четырехъядерными (Polygonum- и Oenothera-типами). Зародышевый мешок у них развивается только из одной макроспоры, остальные три отмирают. [c.168]
Oenothera-тип —упрощенный тип развития, зародышевый мешок при этом типе развития содержит только четыре ядра и образуется из микропилярной макроспоры. Весь цикл состоит из четырех делений, в результате которых образуются яйцевой аппарат из трех клеток и верхнее полярное ядро. Антиподы отсутствуют. [c.168]
Биспорические зародышевые мешки. Allium-тип развития характеризуется формированием зародышевого мешка из нижней халазальной двухъядерной макроспоры. В результате четырех делений образуется восьмиядерный двухполюсный зародышевый мешок. [c.168]
При развитии по Fritillaria-типу в результате двух делений мейоза возникают четыре ядра макроспор, из которых одно располагается в верхней части клетки, а остальные — в нижней. Сливаясь, ядра нижней части зародышевого мешка образуют триплоидное ядро (Зп). Затем происходит третье деление, в результате которого в верхней части зародышевого мешка появляются два гаплоидных ядра, а в нижней — два триплоидных. После четвертого деления образуется восьмиядерный двухполюсный зародышевый мешок. [c.169]
При Репаеа-типе ядра после второго, третьего и четвертого делений всегда располагаются крестообразно, в результате образуется четырехполюсный зародышевый мешок с четырьмя группами ядер. Затем в каждой тетраде возникают клетки, напоминающие яйцевой аппарат, а оставшиеся ядра от каждой тетрады сливаются в центре зародышевого мешка, образуя тетра-плоидное (4п) ядро центральной клетки. Как правило, яйцеклетка функционирует только в микропилярной группе клеток. [c.170]
Макроспорогенез и гаметогенез у них составляют единую цепь клеточных делений, завершающим звеном которой является формирование женского гаметофита крайне упрощенного строения, превратившегося во внутренний орган спорофита. Развитие его максимально сокращено и структура доведена до нескольких клеток. Однако несмотря на морфологическую редукцию, зародышевый мешок состоит из обособленной системы клеток, отличающихся четкой функциональной дифференциацией на разных этапах их развития. [c.171]
Зародышевый мешок у покрытосеменных имеет свой независимый путь развития и, несомненно, представляет качественно новое явление, присущее только данной груцпе растений. Среди других групп высших растений (архегониальные, голосеменные) он не встречается. Поэтому все попытки установить преемственную связь между строением женского гаметофита голосеменных и зародышевым мешком покрытосеменных пока ни к чему не привели. [c.171]
Генетические исследования (1963) — [ c.35 , c.36 , c.455 ]
Жизнь зеленого растения (1983) — [ c.97 ]
Цитология растений Изд.4 (1987) — [ c.118 , c.119 , c.166 , c.167 , c.168 , c.171 , c.172 , c.173 , c.174 , c.175 , c.176 , c.181 , c.183 , c.184 , c.188 , c.189 , c.192 , c.193 , c.194 , c.195 , c.201 , c.205 , c.207 , c.208 , c.209 , c.210 , c.219 , c.220 , c.221 ]
Физиология растений (1989) — [ c.335 , c.336 ]
11729 (Семенные растения и их общая характеристика) » СтудИзба
Семенные растения и их общая характеристика
Одним из важнейших приобретений в эволюции растений стало семя. В отличие от споровых, семенные растения размножаются семенами.
Эволюционное развитие семенных растений шло по пути дальнейшей редукции гаметофита. Все семенные растения разноспоровые, и их крайне редуцированный гаметофит заключен внутри мегаспоры. Мегаспора находится в мегаспорангии — нуцеллусе. Нуцеллус — это развитая паренхиматическая ткань, которая занимает центральную часть семяпочки. Часто нуцеллус, как центральную часть семяпочки, называют не совсем удачно ядром. Нуцеллус окружен со всех сторон нокровами, состоящими из особых клеток. Покровы иначе называются интегументами, их может быть 1 или 2 — наружный и внутренний. Большинство двудольных растений имеет 1 интегумент, у однодольных их обычно 2. Интегументы покрывают нуцеллус несплошь. С одной стороны, чаще сверху семяпочки, они не соединяются, образуя небольшое отверстие, которое называется микропиле, или пыльцевход. Та часть семяпочки, которая находится в противоположной стороне пыльцевхода, называется халазой. Семяпочка чаще всего имеет овально-яйцевидную форму, но существуют и другие формы. По положению к семяножке семяпочки делятся на прямые, обратные и согнутые.
Образование семяпочки и зародышевого мешка. Семяпочка образуется на плодолистике в виде небольшого бугорка. Разрастаясь, этот бугорок дает начало в первую очередь нуцеллусу, затем образуются интегументы — покровы.
В нуцеллусе еще очень молодой семяпочки обособляется обычно одна археспориальная клетка, иначе она называется материей некой клеткой мегаспор.
Материнская клетка мегаспоры сначала очень быстро растет и затем дважды делится — редукционно и митозом. В результате образуются 4 гаплоидные клетки, т. е. тетрада мегаспор. Эти 4 клетки располагаются в определенном порядке: одна под другой. В дальнейшем эти клетки развиваются неодинаково. Только одна мегаспора из четырех, обычно нижняя, продолжает быстро расти и постепенно сжимает 3 остальные, выше расположенные клетки, которые в конечном итоге погибают. Оставшаяся одна клетка — мегаспора — не остается в стадии покоя, она продолжает расти, претерпевая большие изменения и дает начало зародышевому мешку.
Весь процесс образования зародышевого мешка происходит следующим образом.
Нуцеллус покрыт одним или двумя дополнительными слоями ткани — интегументами. Они полностью заключают в себя спорангий, оставляя лишь отверстие на верхушке — микропиле. Нуцеллус и интегумент вместе называются семязачатком.
У высших растений всегда наблюдается правильное чередование двух многоклеточных поколений — спорофита и гаметофита. У цветковых растений мужские гаметофиты столь малы, что помещаются внутри оболочки пыльцевого зерна) и состоят всего лишь из нескольких клеток. Женский гаметофит цветковых (зародышевый мешок) помещается внутри семяпочки и состоит из 7 клеток (или содержит 7 ядер). У папоротников, хвощей и плаунов гаметофит представляет собой небольшое, но самостоятельное растение, иногда называемое заростком. Заростки папоротников и хвощей фотосинтезирующие, однолетние. Заростки плаунов живут под землей, развиваются в течение многих лет и питаются за счет симбиоза с грибами. У мхов гаметофит при своих небольших размерах явно доминирует над спорофитом. Гаметы у высших растений всегда образуются в результате митоза (что принципиально отличает их от гамет животных), поскольку тело гаметофита также построено из гаплоидных клеток. Поэтому фазу гаметофита ещё называют гаметофазой, или гаплофазой. Следует отметить, что на одном гаметофите одновременно могут развиваться как мужские половые органы, так и женские. Такой гаметофит называют однодомным (обоеполым). В других случаях гаметофиты растений, относящихся к одному и тому же виду, формируют либо только мужские органы, либо только женские. Такие гаметофиты называют двудомными (раздельнополыми — мужскими и женскими). Раздельнополые гаметофиты свойственны всем семенным растениям, у которых мужские гаметофиты развиваются из микроспор, образующихся в пыльниках, а женские — из мегаспор, образующихся в семяпочках
На мегаспоре — женском гаметофите развивается яйцеклетка. После оплодотворения формируется миниатюрный спорофит, а интегументы превращаются в семенную кожуру. Так формируется семя.
Женский гаметофит (зародышевый мешок)
Женский гаметофит цветковых растений обычно называется зародышевым мешком. Возникновение этого названия восходит к тем временам, когда еще не была ясна морфологическая природа чрезвычайно своеобразного женского гамотофита цветковых растений. В настоящее время оба термина употребляют как синонимы.
У большинства цветковых растений (вероятно, не менее чем у 80%) начало женскому гаметофиту дает одна из четырех потенциальных мегаспор тетрады путем трех последовательных митотических делений. Этот тип образования женского гаметофита называется моноспорическим. Его развитие происходит следующим образом (рис. 28,Б). В результате первого деления ядра функционирующей мегаспоры образуются два ядра, которые расходятся к полюсам (микропилярному и халазальному) сильно удлиняющейся мегаспоры, а между ними образуется крупная вакуоль. Далее каждое из этих двух ядер делится синхронно еще два раза и в результате у каждого полюса образуются по четыре ядра. Это восьмиядерная стадия развития женского гаметофита. От каждой из двух полярных четверок входит по одному ядру в центральную часть зародышевого мешка. Эти так называемые полярные ядра сближаются в центральной части и сливаются или сразу же, или только перед оплодотворением, а иногда и вовсе не сливаются. В результате слияния полярных ядер образуется ядро центральной клетки женского гаметофита, называемое часто вторичным ядром зародышевого мешка.
В дальнейшем (в процессе последнего митоза) возникают клеточные перегородки и свободноядерная стадия развития женского гаметофита переходит в клеточную стадию. У микропилярного полюса образуются три клетки яйцевого аппарата, у противоположного (халазального) — три клетки, называемые антиподами, а между этими двумя группами клеток — центральная клетка (содержащая два свободных полярных ядра или одно вторичное ядро). Три клетки яйцевого аппарата дифференцируются на одну яйцеклетку и две клетки, называемые синергидами (от греч. synergos — вместе действующие) или вспомогательными клетками. Таково строение так называемого нормального моноспорического женского гаметофита.
Нормальный моноспорический женский гаметофит не производит впечатления окончательно отработанной модели, в которой экономичность достигла такого же предела, как в случае мужского гаметофита. То, что предел здесь не достигнут, доказывается следующим. В процессе эволюции этого основного для цветковых растений типа женского гамотофита возникли зародышевые мешки других типов, образуемые двумя или даже четырьмя мегаспорами. Произошло сокращение митотических делений до двух или одного, а также изменилось распределение ядер. Разные сочетания этих изменений обусловили возникновение нескольких типов женского гаметофита, которые отличаются как числом ядер (4, 8, 16), числом клеточных групп и полярных ядер (1, 2, 4, 7—14), так и числом клеток в группах (например, яйцевой аппарат может состоять из 1, 2, 3, 5 и 7 клеток), а также другими признаками.
Основной особенностью моноспорического типа образования женского гаметофита является последовательное заложение клеточных перегородок при мейотических делениях и образование обособленных мегаспор. Совершенно иной характер имеет мегаспорогенез, предшествующий образованию биспорического (двухспорового) и тетраспорического (четырехспорового) гаметофитов. Изменения в мегаспорогенезе заключаются в подавлении заложения клеточной перегородки при мейотическом делении, вследствие чего вместо тетрад мегаспор возникают неклеточные образования, называемые ценоцитами (от греч. koinos — общий и kylos — сосуд, клетка), которые и развиваются далее в женские гаметофиты. Здесь возможны два варианта.
В первом случае образование клеточных перегородок подавляется только при втором делении мейоза. Поэтому оба ядра, вошедшие в состав жизнеспособной клетки диады, принимают участие в образовании женского гаметофита. Двухъядерная диада — это ценоцит, продукт слияния (вернее, перазделения) двух потенциальных мегаспор. Поскольку каждый такой ценоцит соответствует по происхождению паре обособившихся мегаспор, его рассматривают как двухспоровый ценоцит, а развивающийся из него женский гаметофит — как биспорический (двуспоровый). Биспорический женский гаметофит наблюдается у лука, пролески (Scilia), ландыша, амариллисовых, частуховых и некоторых других растений. Развитие такого женского гаметофита происходит более сокращенным путем и для образования восьмиядерной стадии требуется всего лишь два митотических деления.
Наконец, у некоторых растений, таких, как, поперомия, ильм, майник, рябчик, тюльпан, лилия, гусиный лук, плюмбаго, адокса и другие, образование клеточных перегородок подавляется при обоих мейотических делениях. Вся материнская клетка мегаспор превращается здесь в один четырехспоровый ценоцит, или тетрацепоспору. Четырехспоровый ценоцит соответствует четырем перазделившимся мегаспорам, почему женские гаметофиты этого типа называются тетраспорическими (четырехспоровыми). Для образования восьмиядерной стадии женского гаметофита требуется лишь одно митотическоо деление ядер четырехспорового ценоцита.
В отличие от моноспорического женского гаметофита, би- и тетраспорические называются ценоспорическими.
Женский гаметофит цветковых растений произошел из более примитивного архегониального жиского гаметофита далеких голосеменных предков путем выпадения последних стадий развития, ведущих к формированию архегониев. А у ценоспорических типов происходит, как мы видели, выпадение также начальных стадий. Но в то время как эволюция мужского гаметофита достигла кульминационной стадии и в его развитии полностью выпали все возможные начальные и конечные стадии, с женским гаметофитом эволюционный процесс как бы продолжает экспериментировать. Отсюда значительное число моделей женского гаметофита и путей его формирования, на чем здесь нет, однако, возможности останавливаться.
Женский гаметофит у всех голосеменных развивается полностью внутри мегаспорангия и не выходит даже частично наружу, т. е. не соприкасается непосредственно с воздушной средой. Доступ к женскому гаметофиту осуществляется только через микропиле. Таким образом внутри семязачатка создаются наиболее благоприятные условия защиты женского гаметофита от высыхания. В результате происходит постепенная редукция и упрощение женского гаметофита и архегониев, возникает возможность очень раннего формирования яйцеклетки, и у некоторых голосеменных (вельвичия и гнетум) образуются даже особые неотенические безархегониальные гаметофиты.
Мужской гаметофит
Голосеменные отличаются от папоротников также развитием мужского гаметофита, строением и способом прорастания микроспор. У папоротников, где развитие гаметофита происходит обычно лишь после высеивания спор, прорастание спор происходит через так называемый тетрадный рубец, расположенный на проксимальном полюсе споры. У голосеменных, где мужской гаметофит сильно упрощается и его развитие ускоряется, первые деления ядра микроспоры происходят уже внутри микроспорангия. В связи с ранним развитием мужского гаметофита и образованием гамет еще внутри оболочки споры возникает необходимость в приспособлении, посредством которого микроспора может изменять свой объем. Таким приспособлением оказывается борозда на дистальном полюсе микроспоры, впервые возникающая у некоторых семенных папоротников и характерная для огромного большинства голосеменных. Борозда служит не только для регулирования объема пыльцевого зерна. Она становится местом выхода из микроспоры гаустории (у низших групп) или пыльцевой трубки (у гнетовых и хвойных), также являющихся новообразованиями. Таким образом, у голосеменных, в отличие от папоротников, отверстие для выхода содержимого микроспоры образуется на дистальном полюсе. Гаустория (присоска) типа саговниковых растет горизонтально и служит лишь для прикрепления и питания мужского гаметофита; настоящая пыльцевая трубка хвойпых и гнетовых растет вертикально и служит главным образом для проведения спермиев к яйцеклеткам, т. е. является проводником (вектором), а не только присоской. Хотя обычно оба эти образования называют пыльцевыми трубками, но морфологически и функционально они очень различны.
Редуцированные мужские гаметофиты голосеменных достигают своего полного развития на мегаспорангии, паразитируя на нем. В этом отношении они резко отличаются от мужских гаметофитов всех разноспоровых бессеменных растений. Мужские гаметофиты голосеменных уже полностью лишены антеридиев. С другой стороны, для них характерно наличие так называемых клеток-ножек, или дислокаторов, являющихся сестринскими клетками мужских гамет. Дислокаторы представляют собой, как предполагают, стерильные сперматогенные клетки. Их разрушение ведет к освобождению мужских гамет при прорастании гаметофитов.
Наконец, следует отметить характерное для голосеменных (за исключением вельвичии, гнетума и секвойи вечнозеленой) нуклеарное (ядерное) дробление зиготы. В этом отношении они отличаются не только от низших групп, но и от покрытосеменных, для которых (за исключением лишь рода пион) характерно клеточное дробление зиготы.
Вывод
Семена при созревании отделяются от материнского растения и обычно имеют разнообразные приспособления для распространения.
Древнейшие из известных семенных растений относятся к позднему девону (около 360 млн. лет назад). Это были семенные папоротники.
Современные семенные растения представлены двумя отделами: голосеменными (Pinophyta) и покрытосеменными (Magnoliophyta).
Семязачатки голосеменных располагаются открыто на поверхности мегаспорофиллов, не образующих плодов. У покрытосеменных мегаспорофиллы, срастаясь краями, образуют полость, к внутренней поверхности которой и прикрепляются семязачатки. При созревании семян мегаспорофиллы образуют их вместилище, называемое плодом.
Центральная ячейка в цветущих растениях: спецификация, сигналы и эволюция
Front Plant Sci. 2020; 11: 5.
Hong-Ju Li
1 Государственная ключевая лаборатория молекулярной биологии развития, Институт генетики и биологии развития Китайской академии наук, Пекин, Китай
Wei-Cai Yang
1 State Ключевая лаборатория молекулярной биологии развития, Институт генетики и биологии развития Китайской академии наук, Пекин, Китай
2 Колледж передовых сельскохозяйственных наук, Университет Китайской академии наук, Пекин, Китай
1 Государственный ключ Лаборатория молекулярной биологии развития, Институт генетики и биологии развития Китайской академии наук, Пекин, Китай
2 Колледж передовых сельскохозяйственных наук, Университет Китайской академии наук, Пекин, Китай
Отредактировал: Дайсуке Маруяма, Городской университет Йокогамы, Япония
Рецензент: Аня Шмидт, Университет Гейдельберга, Германия ; Айлен Мариана Дистефано, Национальный университет Мар-дель-Плата Мар-дель-Плата, Аргентина
Эта статья была отправлена в отдел развития растений и EvoDevo, раздел журнала Frontiers in Plant Science
Поступила в редакцию 1 августа 2020 г .; Принята в печать 28 сентября 2020 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY). Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя (ов) и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
Во время размножения животных и низших растений одна сперматозоид обычно побеждает конкурентов в оплодотворении одной яйцеклетки. Но у цветковых растений две сперматозоиды оплодотворяют две соседние диморфные женские гаметы, яйцеклетку и центральную клетку, соответственно, чтобы инициировать зародыш и эндосперм в семени. Эндосперм питает развитие эмбриона, а также является основным источником питания человечества в зерновых культурах. Центральная клетка как одно из ключевых нововведений цветковых растений — самая большая клетка в многоклеточном гаплоидном женском гаметофите (зародышевом мешке).Эмбриональный мешок дифференцируется от продуктов мейоза посредством последовательных событий ядерных делений, клеточности и клеточной спецификации. В настоящее время накапливаются доказательства, которые сводят на нет роль центральной клетки, а не только предшественника эндосперма. В этом обзоре мы суммируем текущее понимание его клеточной судьбы, межклеточной коммуникации и эволюции. Мы также выделяем некоторые ключевые нерешенные вопросы для дальнейших исследований в этой области.
Ключевые слова: центральная клетка, двойное оплодотворение, цветковые растения, голосеменные, клеточная спецификация, межклеточная коммуникация
Введение
В отличие от животных, у которых гаплоидные споры, генерируемые мейозом, напрямую дифференцируются в функциональные гаметы, у растений гаплоидные Споры подвергаются дополнительному митозу с образованием многоклеточных гаметофитов.У низших растений, таких как мохообразные, гаметофиты являются доминирующими в их жизненных циклах и необычайно свободноживущими, тогда как у семенных растений (голосеменные и покрытосеменные) гаметофиты структурно редуцируются и развиваются в половых органах спорофитов. У цветковых растений (покрытосеменных) женские гаметофиты в процессе развития редуцируются до миниатюрной структуры с лишь несколькими клетками, встроенными в слои спорофитных тканей яичника. В отличие от видов с доминированием гаметофитов и голосеменных с доминированием спорофитов, появление дополнительной женской гаметы, центральной клетки, является важным нововведением в половом размножении и отличительной чертой покрытосеменных растений.Оплодотворение яйцеклетки и центральной клетки, известное как двойное оплодотворение, дает зародыш и эндосперм, соответственно, внутри семенной оболочки. Помимо действия в качестве предшественника эндосперма, центральная клетка также играет важную роль во время развития и функционирования эмбрионального мешка. Этот обзор описывает недавние достижения в нашем понимании центральной клетки с акцентом на клеточную спецификацию, межклеточную коммуникацию и эволюцию.
Типы зародышевого мешка
У цветущих растений, таких как Arabidopsis, на конце каждого нуцеллуса инициировалась единственная материнская клетка с мегапорами (MMC) (Yadegari and Drews, 2004; Shi and Yang, 2011; Yang et al., 2010; Lora et al., 2019). Посредством мейоза MMC производит четыре гаплоидных мегаспоры, из которых только одна становится функциональной мегаспорой, а остальные три дегенерируют (). Функциональная мегаспора проходит три раунда ядерного митоза с образованием синцитиального женского гаметофита с восемью ядрами. Впоследствии синцитиальный женский гаметофит подвергается одновременному цитокинезу с образованием типичного восьмиъядерного семиклеточного зародышевого мешка (; Christensen et al., 1997; Shi and Yang, 2011; Yang et al., 2010). Наконец, происходит спецификация клеточной судьбы и созревание для образования четырех типов клеток в функциональном женском гаметофите: две синергидные клетки и яйцеклетка на конце микропиле, диплоидная центральная клетка и три антиподальные клетки на халазальном конце, который плотно соединяется с материнские ткани (). Этот образец развития известен как моноспорический тип Polygonum, который существует у большинства покрытосеменных. В модельном растении Arabidopsis три антиподальные клетки недолговечны, тогда как у однодольных они пролиферируют и участвуют в развитии эндосперма.В качестве исключения базальный покрытосеменный Amborella trichopoda , единственный современный вид, образует уникальный зародышевый мешок типа Amborella, который содержит три синергидные клетки из-за дополнительного деления одной из микропиларных клеток (; Friedman, 2006; Friedman and Райерсон, 2009). Другая группа базальных цветковых растений, Nymphaeales (включая Hydatellaceae) и Austrobaileyales, демонстрирует зародышевый мешок типа Nuphar / Schisandra, который является четырехклеточным с гаплоидной центральной клеткой и без антипод (Baroux et al., 2002; Фридман, 2008; Повилус и др., 2015; Зини и др., 2016). Другие типы зародышевых мешков также существуют в ряде таксонов покрытосеменных в природе, таких как биспоровые и тетраспорические типы (Friedman et al., 2008; Schmid et al., 2015). Все различные паттерны, по-видимому, являются модульными с модулем микропиларового яичного аппарата и халазальным модулем у разных видов (Friedman and Williams, 2004). Неизвестно, имеет ли изменение структуры женских гаметофитов среди таксонов растений какое-либо адаптивное значение.Было высказано предположение, что лабильность развития на самой ранней стадии эволюции покрытосеменных может привести к этой вариации (Friedman, 2006). Учитывая разнообразную структуру, молекулярное определение центральной клетки может варьироваться от таксона к таксону. Это затрудняет обобщение регуляции развития зародышевого мешка и его эволюционного происхождения. Тем не менее, повсеместное распространение четырехклеточных типов указывает на то, что нескольких консервативных факторов может быть достаточно, чтобы управлять структурной организацией и детерминацией клеточной судьбы.На данный момент наше понимание молекулярной регуляции развития женских гаметофитов основано в основном на модельном растении Arabidopsis и нескольких видах сельскохозяйственных культур.
Паттерны женских гаметофитов и межклеточная передача сигналов между центральной клеткой и другими клетками. (A) Схематическая диаграмма megasporogensis. (B) Схематическая диаграмма трех типов женских гаметофитов, упомянутых в тексте. Тип Polygonum представлен большинством (> 70%) цветковых растений, включая Brassicaceae, Gramineae, Malvaceae, Leguminoseae и Solanaceae (Yadegari and Drews, 2004).Типы Amborella и Nuphar / Schisandra являются примитивными. Другие типы можно отнести к обзорам Yadegari and Drews (2004), Schmid et al. (2015) и Gonzalez et al. (2019). Белые формы внутри ячеек представляют собой вакуоли. (C) Схематическая диаграмма женского гаметофита в семяпочке, эмбрионе и эндосперме Arabidopsis после оплодотворения. Стрелки, межклеточная и клеточно-автономная передача сигналов.
Во время развития женского гаметофита позиционные сигналы, гормоны и скоординированная межклеточная коммуникация были предложены для управления установлением полярности и развития зародышевого мешка (Kägi and Groß-Hardt, 2007; Pagnussat et al., 2007, 2009; Молл и др., 2008; Сундаресан и Аландете-Саез, 2010 г .; Кириухова и др., 2011; Литуев и др., 2013; Мартин и др., 2013; Kong et al., 2015; Паноли и др., 2015; Tekleyohans et al., 2017). Было идентифицировано множество генетических факторов, участвующих в развитии зародышевого мешка и его клеточной дифференцировке (Yang et al., 2010; Chevalier et al., 2011; Erbasol Serbes et al., 2019). В следующих параграфах обобщены конкретные генетические регуляции центральной клетки ().
ТАБЛИЦА 1
Сводка генов, участвующих в функции и спецификации центральной клетки.
| Имя гена | Описание гена | Функция в FG / фенотип | Молекулярный механизм / клеточный процесс |
| AGL80 | MADS-бокс-белок | Центральная клетка переключается на дополнительные клетки | Регуляция транскрипции |
| AGL61 | MADS-бокс-белок | Переключение центральной клетки на дополнительные клетки, дегенерация центральной клетки | |
| TPL | Копрепрессор транскрипции | Спецификация центральной клетки | |
| CCG | Семейство TFIIB | Центральное клеточно-опосредованное притяжение пыльцевой трубки / Неудачное притяжение пыльцевой трубки | |
| CBP1 | Компоненты транскрипционного комплекса | ||
| GFA2 | Гомолог дрожжевого Mdj1p, шаперон | Неудачный синергизм гибели клеток а также слияние полярных ядер | Функция митохондрий |
| AAC2 | Транслокатор АТФ / АДФ | Неслитые полярные ядра, стойкие антиподальные клетки и уменьшенный размер яйцеклетки | |
| SYCO / FIONA | Цистеинил-т-РНК-синтетаза Продолжительность жизни антиподальных клеток, неудачное слияние полярных ядер|||
| GCD1 | Консервированный митохондриальный белок | Неслитые полярные ядра, меньшая яйцеклетка | |
| CLO | Сплайсосомные компоненты | Неслитые полярные ядра, переключение синергид и центральных клеток на судьбу яйцеклеток | Процессинг РНК |
| LIS | |||
| ATO | |||
| MAA3 | РНК-геликаза | Неслитые полярные ядра, аттракцион пыльцевой трубки | |
| Bip1 / 2 | Шапероны ER | Не слитые полярные ядра | Гомеостаз ER |
| ERdj3A / B | |||
| P58IPK | 74 | 74 | Белок SNARE | Неслитые полярные ядра | Динамика мембраны |
| WYR | Ортолог внутреннего центромерного белка (INCENP) | Дифференцировка центральных клеток, дополнительные яйцеклетки | Регулирование хромосомы |
| DME | ДНК гликозилаза | Требуется для материнской экспрессии импринтированных генов в центральной клетке | |
| FIS2, MEA, FIE | PRC2 комплекс | Ингибировать клеточное автономное развитие эндосперма | |
| CKI1 | Гистидиновый род судьба центрального клетка и антиподные клетки не слились полярные ядра | Цитокининовый сигнальный путь |
Развитие центральной клетки и спецификация
В отличие от других гаметофитных клеток, центральная клетка характеризуется своим центральным положением и большим объемом, включая большую центральную вакуоль на халазальном конце два полярных ядра, цитоплазма и органеллы, унаследованные от развивающегося синцитиального гаметофита.Полярные ядра сливаются перед оплодотворением у Arabidopsis, но после оплодотворения у злаков (Mol et al., 1994). Следовательно, центральная клетка является гомодиплоидной (2n) у большинства покрытосеменных и полиплоидной у некоторых других видов из-за слияния более чем двух ядер, но остается гаплоидной у некоторых базальных покрытосеменных, таких как Nymphaeales и Austrobaileyales (). Вариация плоидности центральной клетки может влиять на соотношение отцовского и материнского генома, которое влияет на размер семян. Хотя центральная клетка является отличительной чертой покрытосеменных и предпосылкой для двойного оплодотворения, молекулярные механизмы, контролирующие ее развитие и спецификацию, плохо изучены (Berger, 2003; Yang et al., 2010).
Формирование центральной клетки
Функциональное вскрытие нескольких генетических факторов пролило свет на молекулярный механизм образования центральной клетки. После клеточности два полярных ядра сливаются, давая начало большому центральному ядру клетки, и дефект слияния ядер будет влиять на функцию и спецификацию центральной клетки. Митохондрии играют активную роль в слиянии полярных ядер. GAMETOPHYTIC FACTOR2 ( GFA2 ) кодирует митохондриальный шаперон, который необходим для слияния полярных ядер с внешней мембраной (Christensen et al., 2002). Потеря функции GAMETE CELL DEFECTED1 (GCD1), консервативного митохондриального белка, вызывает неслияние полярных ядер, и яйцеклетка также меньше по размеру по сравнению с диким типом, что указывает на то, что GCD1 необходим для развития обеих женских гамет (Wu et al. др., 2012). Мутант митохондриальной цистеинил т-РНК синтетазы SYCO ARATH (SYCO) и ATP / ADP translocator 2 ( AAC2 ) приводит к неслитым полярным ядрам и стойким антиподным клеткам (Kägi et al., 2010). Кроме того, в этом процессе участвуют шапероны эндоплазматического ретикулума (ЭР).Утрата функции генов шаперонов ER арабидопсиса BiP1 и BiP2 также вызывает неслитые полярные ядра (Maruyama et al., 2010). Белки BiP могут взаимодействовать с ER-резидентным белком J-домена, чтобы опосредовать слияние полярных ядер с мембранами (Maruyama et al., 2014). Белки J-домена ERdj3A и P58IPK опосредуют слияние внешней ядерной мембраны, тогда как ERdj3B и P58IPK регулируют слияние внутренней ядерной мембраны. Метаболизм и процессинг РНК также вовлечены в развитие центральной клетки. Гомолог дрожжевой РНК-геликазы MAA3 (MAGATAMA3) необходим для слияния полярных ядер и привлечения пыльцевых трубок (Shimizu et al., 2008). Гены Arabidopsis LACHESIS ( LIS ), CLOTHO ( CLO / GFA1 ) и ATROPOS ( ATO ) кодируют основные сплайсосомные компоненты и первоначально экспрессируются во всем женском гаметофите. Дефект этих генов вызывает переключение синергид и центральных клеток на судьбу яйцеклеток (Groß-Hardt et al., 2007; Moll et al., 2008). У мутантов lis и clo полярные ядра также не могут слиться (Groß-Hardt et al., 2007; Völz et al., 2012). Более того, ген SEC22 растворимых N-этилмалеимид-чувствительных слитых белков рецепторов присоединения белков (SNARE) также участвует в слиянии полярных ядер (El-Kasmi et al., 2011). Накопление ROS коррелирует с активацией репортерных генов центральных клеток, таким образом, ROS также могут участвовать в развитии центральных клеток (Martin et al., 2013). Более того, мутант wyrd ( wyr ) предполагаемого растительного ортолога протеина внутренней центромеры ( INCENP ) продуцирует дополнительные яйцеклетки за счет дополнительных синергидных клеток и нарушает дифференцировку центральных клеток (Кириухова и другие., 2011). Эти исследования подчеркнули роль митохондрий, ER, динамики мембран и процессинга РНК в созревании центральной клетки ().
Сигнальный путь CKI1
Генетические исследования показали, что сигнальный путь цитокининов необходим для развития женских гаметофитов и спецификации судьбы центральных клеток (Pischke et al., 2002; Hejátko et al., 2003; Deng et al., 2010; Cheng et al., 2010; Cheng et al. др., 2013; Юань и др., 2016). Нарушение двухкомпонентной сенсорной гистидинкиназы CKI1, активатора пути передачи сигналов цитокининов, вызывает прерывание центральной вакуоли и деградацию женского гаметофита после завершения трех митотических делений (Pischke et al., 2002; Hejátko et al., 2003; Deng et al., 2010). Позднее с использованием клеточно-специфичных флуоресцентных маркеров было обнаружено, что маркер яиц неправильно экспрессируется во всех ядрах, в то время как центральный клеточный маркер либо отключен, либо неправильно экспрессируется в антиподальных ядрах, а маркер синергида экспрессируется в центральной клетке в синцитиальной области cki1 мутантный зародышевый мешок (Yuan et al., 2016). Это указывает на то, что центральная клетка переключилась на судьбу яйцеклетки у мутанта cki . Соответственно, эктопическая сверхэкспрессия CKI1 может включать центральные клеточно-специфические маркеры в гаметофитных клетках микропилар (Yuan et al., 2016). Эти данные предполагают, что CKI1 необходим для спецификации центральной клетки и антиподальных клеток, а также для ограничения судьбы яйцеклеток в центральной клетке. Интересно, что белок CKI1 локализован в ER и первоначально распространяется по всей поверхности на двухъядерной стадии, а затем ограничивается халазальной частью синцитиального зародышевого мешка на восьмиъядерной стадии и концентрируется вокруг центрального клеточного ядра в зрелом зародышевом мешке (Yuan et al. др., 2016). Это совпадает с передачей сигналов обогащенных цитокинином в халазале из-за локального биосинтеза цитокининов и экспрессии рецепторов (Cheng et al., 2013). Тем не менее, остается неизвестным, играет ли сам цитокинин прямую роль или нет, поскольку CKI1 может активировать нижестоящую передачу сигналов цитокинина независимо от цитокинина и лишен цитокинин-связывающей способности (Kakimoto, 1996; Yamada et al., 2001). Кроме того, центральная клеточная экспрессия IPT8 для биосинтеза цитокининов может частично спасти cki1 летальный фенотип женского гаметофита, предполагая, что активация передачи сигналов рецептора цитокинина может в некоторой степени компенсировать потерю CKI1 (Deng et al., 2010). Следует отметить, что мутант cki1 также обнаруживает неудачное слияние полярных ядер (Yuan et al., 2016; Zhang et al., 2020).
Динамическая локализация белка CKI1 также подразумевает роль движения полярных ядер в спецификации центральной клетки. Как CKI1 определяет судьбу центральной клетки и роль цитокинина еще предстоит исследовать (Weijers, 2016). Существуют доказательства того, что CKI1 действует выше белков гистидин-фосфотрансфера (AHP), которые также необходимы для развития женских гаметофитов (Deng et al., 2010; Cheng et al., 2013). AHP также участвуют в детерминации судьбы центральных и антиподальных клеток (Liu et al., 2017). А мутация MYB116 , предполагаемой мишени передачи сигналов CKI1, также влияет на развитие женских гаметофитов (Rabiger and Drews, 2013). Вместе эти данные убедительно подтверждают, что CKI1-обеспечиваемый сигнальный путь играет критическую роль в спецификации центральных клеток.
Транскрипционный контроль судьбы центральной клетки
Предыдущие исследования идентифицировали пары факторов транскрипции MADS-бокса семейства AGL, которые специфически экспрессируются в центральной клетке (Bemer et al., 2010). Эти факторы транскрипции часто действуют как гетеро- или гомодимеры для связывания CArG-бокса генов-мишеней. И AGL80 , и AGL61 / DIA экспрессируются специфически в центральной клетке и могут образовывать гетеродимер. Потеря функции AGL80 или AGL61 / DIA нарушает созревание центральных клеток и делает центральные клетки нефункциональными (Portereiko et al., 2006; Bemer et al., 2008; Steffen et al., 2008). Недавно сообщалось, что центральная клетка мутанта agl80 эктопически экспрессирует синергидные и антиподальные маркерные гены (Zhang et al., 2020). Это указывает на то, что комплекс AGL80-AGL61 / DIA необходим для спецификации судьбы центральной клетки. За исключением ДНК-связывающего домена MADS-бокса типа I, AGL80, но AGL61 / DIA, содержит домен репрессии транскрипции, мотив EAR, который важен для функции AGL80 и необходим для его взаимодействия с корепрессорными белками TOPLESS (TPL) ( Zhang et al., 2020), предполагая, что AGL80 действует как репрессор транскрипции в центральной клетке. Недавние данные действительно показали, что AGL80 подавляет транскрипцию специфичных для синергидов генов MYB98 , основного детерминантного фактора судьбы синергидных клеток, в центральной клетке путем прямого связывания с боксами CArG, присутствующими в вышестоящей промоторной области MYB98 Ген (Zhang et al., 2020). Соответственно, эктопическая экспрессия AGL80 в синергидах может репрессировать экспрессию MYB98 и включает транскрипционную экспрессию центрального клеточно-специфического гена DD22 в синергиде (Zhang et al., 2020). Кроме того, AGL80 может образовывать гомодимер в протопластах Arabidopsis. Тем не менее, также возможно, что эктопическая экспрессия AGL80 в синергидах также может включать экспрессию AGL61. Это означает, что AGL80 управляет транскрипцией гена, а репрессия транскрипции, опосредованная EAR-мотивом, играет критическую роль в ограничении судьбы центральных клеток.Остается определить, необходимы ли др. AGL в центральной клетке также для функции центральной клетки и роли ортологов AGL80 в злаках. AGL80 требуется для экспрессии DEMETER ( DME ), ДНК-гликозилазы, которая необходима для деметилирования ДНК в центральной клетке, а также для определения развития центральной клетки и эндосперма (Portereiko et al., 2006 ; Park et al., 2016). Эти находки подтверждают, что AGL80 играет критическую роль в организации эпигенетического пути в центральной клетке.
Эпигенетический контроль центральной клетки
DME-опосредованное деметилирование необходимо для активации транскрипции компонентов Polycomb Repressive Complex 2 (PRC2) в центральной клетке (Köhler et al., 2012). Нарушение комплекса PRC2 вызывает одновременное деление ядер центральной клетки перед оплодотворением и абортом семян (Köhler et al., 2012; Raissig et al., 2013; Schmidt et al., 2013). Это предполагает активное участие эпигенетической регуляции в поддержании центральной клетки.
На уровне эпигенетической регуляции центральная клетка резко отличается от яйцеклетки. Репрессоры, содержащие мотив EAR, подавляют экспрессию целевого гена посредством модификации хроматина регуляторных областей посредством деацетилирования гистонов, часто посредством образования комплекса с корепрессором TPL и гистоновыми деацетилазами. В центральной клетке Arabidopsis и риса локус-специфическое и активное деметилирование ДНК вносит вклад в гипометилирование материнских хромосом в эндосперме (Park et al., 2016).Репрессивная метка h4K9me2, как было обнаружено, отчетливо распределяется в яйцеклетке, центральной клетке и продуктах их оплодотворения, что указывает на эпигенетический диморфизм между двумя женскими гаметами (Pillot et al., 2010). Распределенный по эухроматину белок LHP1 / TFL2 связан с молчащими локусами, обогащенными h4K27me3, и обнаруживает более низкую экспрессию в центральной клетке, чем в яйцеклетке (Pillot et al., 2010). Интересно, что этот диморфизм устанавливается после клеточности эмбрионального мешка (Pillot et al., 2010). Об эпигенетическом диморфизме также свидетельствует экспрессия разных изоформ гистонов в двух женских гаметах (Ingouff et al., 2010). Более того, центральная клетка подвергается деметилированию по малым обедненным нуклеосомами мобильным элементам (Ibarra et al., 2012). Кроме того, центральная клетка, как доказано, транскрипционно более активна, чем яйцеклетка, как показано иммуноокрашиванием активной РНК-полимеразы II (Garcia-Aguilar et al., 2010). Эти исследования предполагают более активное состояние хроматина в центральной клетке, чем в яйцеклетке, что, по-видимому, коррелирует с транскрипционной активностью.Было высказано предположение, что этот эпигенетический диморфизм является биологически значимым, но все еще ожидает дальнейших доказательств (Baroux et al., 2011). Подробное обсуждение эпигенетической регуляции женского гаметофита, включая разницу между центральной клеткой и другими сестринскими клетками, можно отнести к другим обзорам (Armenta-Medina et al., 2011; Köhler et al., 2012; Kawashima and Berger, 2014). ; Ашапкин и др., 2019).
Процессинг РНК в спецификации центральной клетки
За исключением регуляции транскрипции, путь процессинга РНК также участвует в центральной спецификации клетки, как обсуждалось выше.У мутантов lis , clo и ato идентичность центральных клеток и яйцеклеток неверно определена (Groß-Hardt et al., 2007; Moll et al., 2008; Völz et al., 2012). У мутанта clo / + мутантные антиподные клетки принимают судьбу центральной клетки, что проявляется изменением положения, распадом мембраны, слиянием ядер и активацией транскрипции центральных клеточных маркерных генов (Moll et al., 2008).
Таким образом, эти исследования показывают, что многослойная и сложная регуляция судьбы центральных клеток и полное понимание лежащего в основе механизма все еще предстоит пройти долгий путь.
Межклеточная связь между центральной клеткой и ее соседями
Межклеточная связь является повсеместной в развитии растений и ответной реакции на стресс. Предполагается, что в эмбриональном мешке межклеточная передача сигналов имеет решающее значение для его развития и функционирования. Центральная клетка напрямую контактирует со всеми сестринскими клетками эмбрионального мешка, что поддерживает ее обширное межклеточное взаимодействие ().
Центральный клеточный контроль на яйце
Повсеместно экспрессируемый локализованный в митохондриях белок GCD1 необходим для взаимной передачи сигналов между яйцом и центральной клеткой (Wu et al., 2012). Экспрессия GCD1 либо в яйцеклетке, либо в центральной клетке может спасти дефект зародышевого мешка. Разумно предположить, что эта межклеточная коммуникация важна для координации развития двух диморфных женских гамет. GCD1 является консервативным белком, но его молекулярная функция в центральной клетке в настоящее время неясна (Wu et al., 2012).
Central Cell Control on Synergid
Эксперимент по лазерной абляции центральной клетки предполагает не клеточную автономную регуляцию центральной клетки при полной дифференцировке синергида (Susaki et al., 2015). Об этой регуляции также свидетельствует генетическая регуляция экспрессируемых центральной клеткой CCG и CBP1 на транскрипцию экспрессируемого синергидом гена MYB98 и аттрактантов пыльцевых трубок (Chen et al., 2007; Li et al. , 2015; Meng et al., 2019). CCG — это ранний транскрибируемый ген в центральной клетке (Zhang et al., 2020). Экспрессия CCG в центральной клетке не затрагивается в мутантном эмбриональном мешке agl80 , который не может определить судьбу центральной клетки (Zhang et al., 2020). Недавно было показано, что MYB98 экспрессируется до клеточности, что повышает вероятность того, что коммуникация между клетками может быть прослежена до коммуникации ядро-ядро в ценоцитах (Susaki et al., 2020). До сих пор неясно, инициируется ли транскрипция CCG и перед клеткой. Слитый белок фактора центральной клеточной детерминанты AGL80-GFP был первоначально обнаружен непосредственно перед слиянием полярных ядер, и на экспрессию MYB98 в синергидах не влияет мутант agl80 (Portereiko et al., 2006; Zhang et al., 2020). Эти находки подразумевают, что центральная межклеточная коммуникация синергид между клетками, вероятно, инициируется рано во время дифференцировки этих клеток.
Центральный клеточный контроль на антиподальных клетках
Центральная клетка-экспрессируемая в митохондриях локализованная цистеинил-т-РНК синтетаза FIONA / SYCO регулирует продолжительность жизни антипод неклеточно-автономным образом (Kägi et al., 2010). Интересно, что целенаправленное разрушение цепи переноса электронов в митохондриях центральной клетки показало, что продолжительность жизни антиподальных клеток связана с метаболической активностью центральной клетки (Kägi et al., 2010). Это говорит о том, что метаболическое состояние центральной клетки коррелирует с дифференцировкой окружающих клеток.
Молекулярный механизм межклеточной передачи сигналов
Интенсивная межклеточная коммуникация между четырьмя типами клеток может быть весьма необходимой и интригующей, поскольку каждый считает, что зародышевый мешок — это всего лишь уменьшенная «паразитическая» миниатюра, полученная из отдельных растений за долгую историю . Подчеркивающий молекулярный механизм этой межклеточной передачи сигналов неизвестен, и несколько линий доказательств дают некоторые ключи к разгадке.Некоторые механизмы, такие как передача сигналов через молекулы внеклеточного матрикса и симпластический транспорт, доказаны или предположительно задействованы во время созревания и функционирования женских гаметофитов.
Симпластическая связь — это клеточный канал межклеточного транспорта факторов транскрипции, малых РНК или других малых молекул, который, как предполагается, участвует в межклеточном транспорте малых молекул внутри зародышевого мешка (Han et al., 2000; Li et al., 2015, 2018; Erdmann et al., 2017). Используя флуоресцентные красители, было ясно показано, что симпластическая связь существует внутри зародышевого мешка. В эмбриональных мешочках Torenia fournieri молекулы менее 10 кДа могут свободно диффундировать между гаметофитными клетками, в то время как молекулы более 10 кДа не могут (Han et al., 2000). Более поздние данные показали, что молекулы до 20 кДа, включая 24-нуклеотидные малые РНК, могут перемещаться между центральными клетками и яйцеклетками арабидопсиса, тогда как эта способность к перемещению теряется после оплодотворения (Erdmann et al., 2017). Предполагается, что малые РНК, продуцируемые в эндосперме и даже в центральной клетке, перемещаются в яйцеклетку и эмбрион, чтобы направлять метилирование ДНК (Ibarra et al., 2012). Эти наблюдения убедительно подтверждают, что обмен материалами и межклеточная коммуникация существуют внутри эмбрионального мешка, но убедительные генетические доказательства и подчеркивающая клеточная поддержка, такая как присутствие плазмодесм, для этого движения все еще нуждаются в дальнейшем исследовании.
Апопластные пептиды широко используются в межклеточной передаче сигналов у растений.Профилирование транскриптома показало, что различные секретируемые пептиды высоко обогащены в зародышевом мешке. У Arabidopsis ccg мутантных яйцеклеток теряют способность притягивать пыльцевую трубку (Chen et al., 2007). Было показано, что в ccg яйцеклетках подавляется более сотни секретируемых генов, кодирующих пептиды (Li et al., 2015). Эти пептиды высоко экспрессируются в центральных клетках и секретируются в апопласт и даже в межклеточное пространство покровов (Li et al., 2015). Возможно, что некоторые белковые факторы, необходимые для более позднего развития эндосперма, были заранее активированы в центральной клетке перед оплодотворением. Три центральных клетки, экспрессирующие богатые цистеином пептиды, ESF1, были идентифицированы как необходимые для развития эмбрионального суспензора (Costa et al., 2014). Эти ESF1 также подавляются в яйцеклетках ccg и (Li et al., 2015). До сих пор остается загадкой, играют ли многочисленные секретируемые пептиды, подавляемые в ccg , роль в межклеточной коммуникации между центральной клеткой и ее соседями или в межклеточной передаче сигналов между продуктами оплодотворения.Об этом типе регуляции сообщалось, например, у кукурузы: экспрессируемый яйцеклетками секретируемый пептид ZmEAL1 регулирует клеточную судьбу антиподальных клеток (Krohn et al., 2012). Кроме того, одним из ключей к разгадке роли передачи сигналов экзосом является обнаружение экспрессии членов семейства тетраспанинов в зародышевом мешке (Boavida et al., 2013), поскольку было показано, что тетраспанины в растении необходимы для образования экзосом, необходимых для высвобождение малых РНК против патогенов (Cai et al., 2018). Однако функция этих тетраспанинов в зародышевом мешке все еще неизвестна, поскольку мутанты не проявляют фенотипа.
Различие между центральной клеткой и яйцеклеткой при слиянии со спермой
Двойное оплодотворение влечет за собой слияние сперматозоидов с двумя диморфными женскими гаметами, яйцеклеткой и центральной клеткой. Потенциал сперматозоидов для оплодотворения активируется EGG CELL1s ( EC1s ), которые экспрессируются специфически в яйцеклетке, но не в центральной клетке (Márton et al., 2005). Неизвестно, использует ли центральная клетка свой собственный способ активации сперматозоидов или использует секретируемый яйцеклеткой EC1.Предполагаемый рецептор адгезии гамет, GEX2, содержит внеклеточный домен и необходим для слияния сперматозоидов с обеими женскими гаметами (Mori et al., 2014). Это подразумевает наличие подобного или одного и того же лиганда на поверхности яйца и центральной клетки. Исследования с использованием живых изображений показали, что слияние сперматозоидов с центральной клеткой происходит с задержкой, чем с яйцеклеткой, что указывает на то, что могут существовать различия между двумя событиями слияния (Denninger et al., 2014; Hamamura et al., 2014). Исследование с полиспермическим мутантом tetraspore ( tes ) показало, что блок полиспермии существует в яйце, но не в центральной клетке (Scott et al., 2008). Другие сообщения предполагают, что яйцеклетка также может сливаться с двумя сперматозоидами с образованием триплоидного эмбриона, при этом центральная клетка сливается с одной сперматозоидом (Grossniklaus, 2017; Mao et al., 2020). Другое различие между центральной клеткой и яйцеклеткой состоит в том, что слияние плазматической мембраны со спермой может запускать митотическое деление центральной клетки, подтверждая сигнальную связь между плазмогамией и активацией ядерного деления (Aw et al., 2010).
Эволюция центральной клетки
Эволюционное происхождение двойного оплодотворения, которое характеризуется появлением центральной клетки, до сих пор остается загадкой, поскольку феномен двойного оплодотворения был открыт в конце 1890-х годов.Основываясь на разнообразии зародышевого мешка, были выдвинуты разные гипотезы для объяснения эволюции различной плоидности эндоспермов и значимости адаптации, то есть происхождения структурной новизны и ее относительной приспособленности (Friedman et al., 2008). Эволюция эмбрионального мешка тесно связана с генетикой эндосперма, и вариации эндосперма порождают вариации фенотипа, которые подлежат естественному отбору. Среди сохранившихся цветковых растений существует семь типов эндоспермов.Но наше понимание его эволюционной траектории, адаптации и даже молекулярной модуляции все еще очень ограничено.
Генетические данные о модельном растении Arabidopsis теперь предоставили новые ключи к разгадке эволюции центральной клетки. Недавно было обнаружено, что мутант с потерей функции AGL80 характеризуется неудачным слиянием со сперматозоидами и переключением маркерных генов на дополнительные клетки. Исследование AGL80 предполагает консервативный механизм детерминации центральных клеток у Brassicaceae с помощью механизма репрессии гена, опосредованного EAR-мотивом (Zhang et al., 2020). Это указывает на множественное расхождение спецификации центральных клеток во время эволюции, и должны быть найдены более примитивные механизмы. Было бы интересно исследовать, участвуют ли гомологи AGL80 у других видов также в спецификации или функции центральной клетки, даже если мотив EAR отсутствует. Хотя мотив EAR является консервативным только у Brassicaceae, еще предстоит раскрыть другой механизм репрессии транскрипции, выполняемый гомологами AGL80 или другими факторами транскрипции у однодольных и других таксонов.Из этого исследования выясняется, что определение судьбы центральной клетки не консервативно, как ожидалось, вместо этого оно происходило более одного раза. Эволюционная консервация AGL80 в центральной клетке семейства Brassicaceae может отражать быструю эволюцию центральной клетки, которая настроена на постзиготную репродуктивную изоляцию. Несовместимость двух видов в гибридном эндосперме составляет одну из основных постзиготических изоляций.
У голосеменных (нецветущих семенных растений), таких как Cycads, Gnetales и Gingko, окружающие гаметопитические клетки берут на себя роль функции эндосперма, питая зародыш.Женский гаметофит проходит многочисленные раунды митоза с образованием ценоцитарной клетки с примерно тысячами свободных ядер (Soma, 1997). При созревании содержащие яйца архегонии структурно похожи на структуру мха (), а пыльцевое зерно содержит две сперматозоиды в зрелом возрасте, и только одна сперматозоид передаст геном потомству. Было высказано предположение, что гаметофитные клетки, окружающие архегонии, действуют аналогично питательному эндосперму покрытосеменных. Эти многоклеточные гаметофиты накапливают резервы перед оплодотворением для поддержки эмбриогенеза после оплодотворения яйцеклетки.С появлением центральной клетки питательная роль зародыша переходит от гаметофита к оплодотворенной центральной клетке, эндосперму. Это дает цветущим растениям несколько преимуществ и в то же время усложняет процесс оплодотворения. Зависимое от оплодотворения распределение питательных веществ к эндосперму экономит энергию, поскольку эмбриогенез не всегда бывает стопроцентным. С другой стороны, эндосперм, содержащий геном обоих родителей, играет основную роль в постзиготическом гибридном барьере (Lafon-Placette et al., 2017), чтобы помочь сохранить идентичность видов за счет уменьшения потока генов.
Развитие архегониев гинкго. Это схематическая диаграмма основных стадий развития женского гаметофита Ginkgo и зрелого женского гаметофита Cycads и Gnetales. Схематическая диаграмма была составлена согласно Dhote, Gupta and Bijoy G (www.biologydiscussion.com) и Wang et al. (2014). Женский гаметогенез разных голосеменных довольно похож. Развитие женского гаметофита гинкго описывается как представитель.Короче говоря, он развивается из большой функциональной мегаспоры, оставшейся после мейоза споры. Ядро мегаспоры митотически делится с образованием тысяч свободных ядер внутри клетки с большой центральной вакуолью. После этого клеточность происходит центростремительно, и, наконец, вакуоль стирается. Клеточный гаметофит обычно называют эндоспермом, потому что он берет на себя роль питающего эмбриона, как эндосперм, образующийся в результате оплодотворения у цветковых растений.Затем начинается формирование архегония. От двух до четырех клеток дифференцируются в архегониальные инициалы, которые затем делятся периклинально, образуя небольшую внешнюю первичную начальную шейку и большую центральную клетку. Первичные инициалы шеи делятся вертикально дважды, в результате чего получается четыре ячейки шеи. Центральные клетки делятся асимметрично, образуя клетки верхнего вентрального канала, которые быстро исчезают, и большую яйцеклетку. С расширением яйцеклетки клетки шеи выталкиваются наружу и, наконец, дегенерируют, образуя отверстие для входа сперматозоидов.У Cycads и Gnetales ядро вентрального канала и ядро яйца находятся внутри одной клетки без разделения клеточной стенки. У Gnetales формируется массив шейных клеток, таким образом создавая более длинный канал для входа сперматозоидов.
Эволюция эндосперма у цветковых растений обсуждается в течение многих лет (Berger, 2003; Friedman et al., 2008). Один из сценариев происхождения эндосперма — это сексуализированные гаметофитные клетки, и оплодотворение запускает митотическую прогрессию питательной ткани.Этот сценарий подтверждается сходной закономерностью между развитием эндосперма покрытосеменных и женским гаметофитом голосеменных. Кроме того, развитие эндосперма, зависящее от оплодотворения, дает возможность родительской регуляции. Другой сценарий возникновения эндосперма состоит в том, что альтруистический эмбрион наконец берет на себя роль питателя эмбриона. В настоящее время, однако, до сих пор нет доказательств эволюционного происхождения центральной клетки, поскольку не было обнаружено переходной или первичной структуры женского гаметофита.Даже у самого древнего цветкового растения, Амбореллы, уже сформировался женский гаметофит четырехклеточного типа. Два недавних исследования показали, что сигнальный компонент цитокина, CKI1 у арабидопсиса, регулирует судьбу центральной клетки, а ортологичный ген CKI1 у гинкго экспрессируется в архегониях, а также в предшественниках и окружающих тканях (Yuan et al., 2016, 2018). Это исследование предполагает, что по крайней мере некоторые факторы, участвующие в развитии женских гаметофитов, были задействованы в голосеменных.
Хотя у голосеменных не образовывался эндосперм на основе оплодотворения, было проведено некоторое сравнение между голосеменными Gnetales и покрытосеменными (Friedman, 1998).У Gnetales двуядерная сперма переносится пыльцой и попадает в двуядерную яйцеклетку. Сообщалось, что у Gnetales яйцеклетка содержит два ядра, одно центрально расположенное как ядро яйца, другое — ядро вентрального канала (). У Welwitschia оплодотворяется только яйцеклетка, поскольку вторые ядра сперматозоидов не проникают в яйцеклетку и дегенерируют (Friedman, 2015). В Gnetum и Ephedra два сестринских ядра яйцеклетки слились с двумя сестринскими ядрами сперматозоидов, соответственно (Friedman, 1990).Однако ценоцитарный женский гаметофит созревает после проникновения пыльцевой трубки, и одновременное оплодотворение двух гаплоидных женских ядер определяет следующую судьбу продуктов оплодотворения. Но это отсутствие дифференцировки яиц уникально для Gnetales и Welwitschia (Friedman, 1998). После оплодотворения коненоцитарная ткань подвергается клеточности, и оба продукта оплодотворения инициируют эмбриогенез, и только один из них созревает с питанием окружающих гаметофитных тканей.Несмотря на сходство в развитии митотических сестринских ядер сперматозоидов в пределах одной и той же пыльцы и сестринских женских гаметофитных ядер, окончательной гомологии событий двойного оплодотворения между Gnetales и цветковыми растениями выявлено не было. Еще одна остающаяся загадка — это единственное плодотворное оплодотворение за счет потери другой спермы. Появление двух сперматозоидов, вероятно, послужило предпосылкой для возникновения второй компетентной к оплодотворению клетки и двойного оплодотворения.В отсутствие палеонтологической летописи видов с предком центральной клетки, выяснение эволюционного онтогенеза этой специализированной клетки затруднено. Было бы полезно генетическое вскрытие и изучение молекулярной эволюции ключевых генов, особенно тех, которые имеют консервативную роль в центральной спецификации клеток, которые извлекают выгоду из высвобождения все большего количества полных геномных последовательностей различных таксонов растений. Секвенирование с высокой пропускной способностью транскриптома небольшого количества образцов также будет способствовать раскрытию генетической иерархии и эволюции женского гаметофита, хотя функциональное исследование будет затруднительным из-за сложности генетической трансформации этих видов.
Перспектива
В настоящее время у нас есть более полное понимание клеточной спецификации и межклеточной передачи сигналов центральной клетки в молекулярных и эволюционных аспектах. Активное участие центральных клеток в разнообразных аспектах оплодотворения указывает на растущую важность этой ненаследуемой женской гаметы. Экспериментальные доказательства для полного понимания этой загадочной клетки все еще ограничены. Несмотря на исследования последних двух десятилетий, идентификация ключевых компонентов и их функциональная взаимосвязь остается основным препятствием в понимании функции и эволюции центральных клеток.Центральная клетка обогащена секретируемыми пептидами, но большинство из них еще предстоит функционально охарактеризовать, поскольку традиционные подходы к Т-ДНК и нокдауну генов бессильны в этих сильно повторяющихся и расходящихся последовательностях семейств генов. Кроме того, расслабление механизма сайленсинга генов активирует мобильные элементы и большое количество генов, что делает обратное генетическое исследование трудоемким. С появлением инновационных стратегий в экспериментальных методах, таких как одноклеточный транскриптом и эпитранскриптом, технология редактирования генов и увеличение количества секвенированных видов, мы можем ожидать более полного понимания центральной спецификации клеток, оплодотворения и координации с окружающими клетками, так как а также то, как центральная клетка помогает формировать подавляющее преобладание цветковых растений на земле.
Вклад авторов
Рукопись написали H-JL и W-CY. Оба автора внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Приносим извинения за то, что не смогли сослаться на некоторую связанную литературу из-за ограничения количества страниц.
Сноски
Финансирование. Это исследование было поддержано Национальным фондом естественных наук Китая (31870295 по H-JL и 319
по W-CY) и Программой десяти тысяч талантов (грант W03070036).Ссылки
- Armenta-Medina A., Demesa-Arevalo E., Vielle-Calzada J. P. (2011). Эпигенетический контроль спецификации клеток во время женского гаметогенеза. Секс. Завод Репрод. 24 137–147. 10.1007 / s00497-011-0166-z [PubMed] [CrossRef] [Google Scholar]
- Ашапкин В.В., Кутуева Л. И., Александрушкина Н. И., Ванюшин Б. Ф. (2019). Эпигенетическая регуляция развития гаметофитов растений. Внутр. J. Mol. Sci. 20: 3051. 10.3390 / ijms20123051 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ав С. Дж., Хамамура Ю., Чен З., Шнитгер А., Бергер Ф. (2010). Вступления сперматозоидов достаточно, чтобы вызвать деление центральной клетки, но отцовский геном необходим для развития эндосперма у Arabidopsis. Развитие 137 2683–2690.10.1242 / dev.052928 [PubMed] [CrossRef] [Google Scholar]
- Бару К., Раиссиг М. Т., Гроссниклаус У. (2011). Эпигенетическая регуляция и репрограммирование во время образования гамет у растений. Curr. Opin. Genet. Dev. 21 год 124–133. 10.1016 / j.gde.2011.01.017 [PubMed] [CrossRef] [Google Scholar]
- Бару К., Спиллейн К., Гроссниклаус У. (2002). Эволюционное происхождение эндосперма цветковых растений. Genome Biol. 3: 1026. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bemer M., Хейманс К., Аирольди К., Дэвис Б., Ангенент Г. К. (2010). Атлас экспрессии гена MADS-бокса типа I во время развития женских гаметофитов и семян у Arabidopsis. Plant Physiol. 154 287–300. 10.1104 / стр.110.160770 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Bemer M., Wolters-Arts M., Grossniklaus U., Angenent G.C. (2008). Белок домена MADS DIANA действует вместе с AGAMOUS-LIKE80, определяя центральную клетку в яйцеклетках Arabidopsis. Растительная клетка 20 2088–2101.10.1105 / tpc.108.058958 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бергер Ф. (2003). Эндосперм: перекресток развития семян. Curr. Opin. Plant Biol. 6 42–50. 10.1016 / с1369526602000043 [PubMed] [CrossRef] [Google Scholar]
- Боавида Л. К., Цинь П., Броз М., Беккер Дж. Д., Маккормик С. (2013). Тетраспанины Arabidopsis ограничены отдельными доменами экспрессии и типами клеток в репродуктивных тканях и образуют гомо- и гетеродимеры при экспрессии в дрожжах. Plant Physiol. 163 696–712. 10.1104 / pp.113.216598 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Cai Q., Qiao L., Wang M., He B., Lin F. M., Palmquist J., et al. (2018). Растения посылают небольшие РНК во внеклеточные везикулы грибковому патогену, чтобы заглушить гены вирулентности. Наука 360 1126–1129. 10.1126 / science.aar4142 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чен Ю. Х., Ли Х. Дж., Ши Д. К., Юань Л., Лю Дж., Шринивасан Р. и др.(2007). Центральная клетка играет решающую роль в направлении пыльцевых трубок Arabidopsis. Растительная клетка 19 3563–3577. 10.1105 / tpc.107.053967 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ченг К. Ю., Мэтьюз Д. Э., Шаллер Г. Э., Кибер Дж. Дж. (2013). Цитокинин-зависимая спецификация функциональных мегаспор женского гаметофита Arabidopsis. Завод J. 73 929–940. 10.1111 / tpj.12084 [PubMed] [CrossRef] [Google Scholar]
- Шевалье Э., Луберт-Худон А., Циммерман Э. Л., Маттон Д. П. (2011). Межклеточная коммуникация и сигнальные пути внутри яйцеклетки: от ее зарождения до оплодотворения. New Phytol. 192 13–28. 10.1111 / j.1469-8137.2011.03836.x [PubMed] [CrossRef] [Google Scholar]
- Кристенсен К. А., Горсич С. В., Браун Р. Х., Джонс Л. Г., Браун Дж., Шоу Дж. М. и др. (2002). GFA2 митохондрий необходим для гибели синергидных клеток Arabidopsis. Растительная клетка 14 2215–2232. 10.1105 / тпк.002170 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Кристенсен К. А., Кинг Э. Дж., Джордан Дж. Р., Дрюс Г. Н. (1997). Мегагаметогенез у Arabidopsis дикого типа и мутанта Gf. Секс. Завод Репрод. 10 49–64. 10.1007 / s004970050067 [CrossRef] [Google Scholar]
- Коста Л. М., Маршалл Э., Тесфай М., Сильверштейн К. А., Мори М., Умецу Ю. и др. (2014). Пептиды, происходящие из центральных клеток, регулируют формирование паттерна ранних зародышей цветковых растений. Наука 344 168–172.10.1126 / science.1243005 [PubMed] [CrossRef] [Google Scholar]
- Deng Y., Dong H., Mu J., Ren B., Zheng B., Ji Z., et al. (2010). Гистидинкиназа CKI1 арабидопсиса действует выше белков гистидин-фосфотрансфера, регулируя развитие женских гаметофитов и вегетативный рост. Растительная клетка 22 1232–1248. 10.1105 / tpc.108.065128 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Деннингер П., Блекманн А., Лаусер А., Фоглер Ф., Отт Т., Эрхардт Д. В. и др.(2014). Общение между мужчиной и женщиной запускает кальциевые сигнатуры во время оплодотворения у Arabidopsis. Nat. Commun. 5: 4645. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Эль-Касми Ф., Пакер Т., Стромпен Г., Стиргоф Ю. Д., Мюллер Л. М., Конц К. и др. (2011). Белок SEC22 SNARE арабидопсиса необходим для развития гаметофитов и поддержания целостности стека Гольджи. Завод J. 66 268–279. 10.1111 / j.1365-313x.2011.04487.x [PubMed] [CrossRef] [Google Scholar]
- Erbasol Serbes I., Паловаара Дж., Гросс-Хардт Р. (2019). Развитие и функции женского гаметофита цветкового растения. Curr. Вершина. Dev. Биол. 131 401–434. 10.1016 / bs.ctdb.2018.11.016 [PubMed] [CrossRef] [Google Scholar]
- Эрдманн Р. М., Хоффманн А., Вальтер Х. К., Вагенкнехт Х. А., Грос-Хардт Р., Геринг М. (2017). Молекулярное движение в женском гаметофите Arabidopsis thaliana . Завод Репродукт. 30 141–146. 10.1007 / s00497-017-0304-3 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Friedman W.Э. (1990). Двойное оплодотворение эфедры, нецветущего семенного растения: влияние на происхождение покрытосеменных растений. Наука 247 951–954. 10.1126 / science.247.4945.951 [PubMed] [CrossRef] [Google Scholar]
- Фридман У. Э. (1998). Эволюция двойного оплодотворения и эндосперма: историческая перспектива. Секс. Завод Репрод. 11 6–16. 10.1007 / s004970050114 [CrossRef] [Google Scholar]
- Friedman W. E. (2006). Эмбриологические доказательства лабильности развития во время ранней эволюции покрытосеменных. Природа 441 337–340. 10.1038 / природа04690 [PubMed] [CrossRef] [Google Scholar]
- Фридман В. Э. (2008). Hydatellaceae — кувшинки с склонностью к голосеменным. Природа 453 94–97. 10.1038 / природа06733 [PubMed] [CrossRef] [Google Scholar]
- Фридман В. Э. (2015). Развитие и эволюция женского гаметофита и процесс оплодотворения в Welwitschia mirabilis (Welwitschiaceae). Am. J. Bot. 102 312–324. 10.3732 / ajb.1400472 [PubMed] [CrossRef] [Google Scholar]
- Фридман В. Э., Мадрид Э. Н., Уильямс Дж. Х. (2008). Происхождение наиболее приспособленных и выживание наиболее приспособленных: связь развития женских гаметофитов с генетикой эндосперма. Внутр. J. Plant Sci. 169 79–92. 10.1086 / 523354 [CrossRef] [Google Scholar]
- Фридман У. Э., Райерсон К. С. (2009). Реконструкция предкового женского гаметофита покрытосеменных: выводы из Amborella и других древних линий цветковых растений. Am.J. Bot. 96 129–143. 10.3732 / ajb.0800311 [PubMed] [CrossRef] [Google Scholar]
- Фридман У. Э., Уильямс Дж. Х. (2004). Эволюция полового процесса в древних линиях цветковых растений. Растительная клетка 16 (Дополнение), S119 – S132. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гарсия-Агилар М., Мишо К., Леблан О., Гриманелли Д. (2010). Инактивация пути метилирования ДНК в репродуктивных органах кукурузы приводит к появлению апомиксоподобных фенотипов. Растительная клетка 22 3249–3267.10.1105 / tpc.109.072181 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Гонсалес А., Сато Х., Марацци Б. (2019). Эмбриология Helosis cayennensis (Balanophoraceae): строение женских цветков, плодов, эндосперма и зародыша. Растения 8:74. 10.3390 / растения8030074 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Гроссниклаус У. (2017). Полиспермия дает три родительские семена кукурузы. Curr. Биол. 27 R1300 – R1302. [PubMed] [Google Scholar]
- Groß-Hardt R., Каги К., Бауманн Н., Мур Дж. М., Баскар Р., Гальяно В. Б. и др. (2007). LACHESIS ограничивает судьбу гаметических клеток в женском гаметофите Arabidopsis. PLoS Biol. 5: e47. 10.1371 / journal.pbio.0050047 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хамамура Ю., Нисимаки М., Такеучи Х., Гейтманн А., Курихара Д., Хигасияма Т. (2014). Живое изображение шипов кальция во время двойного оплодотворения у Arabidopsis. Nat. Commun. 5: 4722. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Han Y.З., Хуанг Б. К., Зи С. Ю., Юань М. (2000). Симпластическая связь между центральной клеткой и клетками яйцевого аппарата зародышевого мешка Torenia fournieri Lind. до и во время оплодотворения. Планта 211 158–162. 10.1007 / s004250000289 [PubMed] [CrossRef] [Google Scholar]
- Хеджатко Дж., Пернисова М., Энева Т., Пальме К., Брзобохати Б. (2003). Предполагаемая сенсорная гистидинкиназа CKI1 участвует в развитии женских гаметофитов Arabidopsis. Mol.Gen. Genomics 269 443–453. 10.1007 / s00438-003-0858-7 [PubMed] [CrossRef] [Google Scholar]
- Ибарра К. А., Фенг Х., Шофт В. К., Сие Т. Ф., Узава Р., Родригес Дж. А. и др. (2012). Активное деметилирование ДНК в клетках-компаньонах растений усиливает метилирование транспозонов в гаметах. Наука 337 1360–1364. 10.1126 / наука.1224839 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ингуфф М., Радемахер С., Холек С., Сольич Л., Синь Н., Ридшоу А. и др.(2010). Зиготическая перезагрузка репертуара вариантов HISTONE 3 участвует в эпигенетическом репрограммировании у Arabidopsis. Curr. Биол. 20 2137–2143. 10.1016 / j.cub.2010.11.012 [PubMed] [CrossRef] [Google Scholar]
- Кэги К., Бауманн Н., Нильсен Н., Стиргоф Ю. Д., Грос-Хардт Р. (2010). Гаметическая центральная клетка Arabidopsis определяет продолжительность жизни соседних дополнительных клеток. Proc. Natl. Акад. Sci. США 107 22350–22355. 10.1073 / pnas.1012795108 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Kägi C., Грос-Хардт Р. (2007). Как женщины становятся сложными: дифференциация клеток в гаметофите. Curr. Opin. Plant Biol. 10 633–638. 10.1016 / j.pbi.2007.07.011 [PubMed] [CrossRef] [Google Scholar]
- Какимото Т. (1996). CKI1, гомолог гистидинкиназы, участвующий в передаче сигнала цитокинина. Наука 274 982–985. 10.1126 / science.274.5289.982 [PubMed] [CrossRef] [Google Scholar]
- Кавасима Т., Бергер Ф. (2014). Эпигенетическое репрограммирование при половом размножении растений. Nat. Преподобный Жене. 15 613–624. 10.1038 / nrg3685 [PubMed] [CrossRef] [Google Scholar]
- Кириухова О., Джонстон А. Дж., Клин Д., Каги К., Баскар Р., Мур Дж. М. и др. (2011). Спецификация женских гаметофитных клеток и развитие семян требуют функции предполагаемого ортолога Arabidopsis INCENP WYRD. Развитие 138 3409–3420. 10.1242 / dev.060384 [PubMed] [CrossRef] [Google Scholar]
- Кёлер К., Вольф П., Спиллейн К. (2012). Эпигенетические механизмы, лежащие в основе геномного импринтинга у растений. Annu. Rev. Plant Biol. 63 331–352. 10.1146 / annurev-arplant-042811-105514 [PubMed] [CrossRef] [Google Scholar]
- Конг Дж., Лау С., Юргенс Г. (2015). Растения-близнецы из лишних яйцеклеток Arabidopsis. Curr. Биол. 25 225–230. 10.1016 / j.cub.2014.11.021 [PubMed] [CrossRef] [Google Scholar]
- Крон Н. Г., Лаусер А., Джурани М., Дрессельхаус Т. (2012). Передача сигналов яйцеклетки секретируемым пептидом ZmEAL1 контролирует судьбу антиподальных клеток. Dev. Ячейка 23 219–225.10.1016 / j.devcel.2012.05.018 [PubMed] [CrossRef] [Google Scholar]
- Лафон-Пласетт К., Йоханнесен И. М., Хорнслиен К. С., Али М. Ф., Бьеркан К. Н., Брамсипе Дж. И др. (2017). Барьеры гибридизации на основе эндосперма объясняют структуру потока генов между Arabidopsis lyrata и Arabidopsis arenosa в Центральной Европе. Proc. Natl. Акад. Sci. США 114 E1027. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ли Х. Дж., Мэн Дж. Г., Ян В. К. (2018). Многослойные сигнальные пути для роста пыльцевых трубок и управления ими. Завод Репродукт. 31 год 31–41. 10.1007 / s00497-018-0324-7 [PubMed] [CrossRef] [Google Scholar]
- Ли Х. Дж., Чжу С. С., Чжан М. Х., Ван Т., Лян Л., Сюэ Ю. и др. (2015). CBP1 арабидопсиса представляет собой новый регулятор инициации транскрипции в опосредованном центральными клетками ведении пыльцевых трубок. Растительная клетка 27 2880–2893. 10.1105 / tpc.15.00370 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Литуев Д. С., Крон Н. Г., Мюллер Б., Джексон Д., Хеллригель Б., Дрессельхаус Т., и другие. (2013). Теоретические и экспериментальные данные указывают на отсутствие поддающегося обнаружению градиента ауксина в женском гаметофите покрытосеменных. Развитие 140 4544–4553. 10.1242 / dev.098301 [PubMed] [CrossRef] [Google Scholar]
- Лю Ц., Юань Л., Сун X., Ю. X., Сундаресан В. (2017). AHP2, AHP3 и AHP5 действуют ниже CKI1 в развитии женского гаметофита Arabidopsis. J. Exp. Бот. 68 3365–3373. 10.1093 / jxb / erx181 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lora J., Ян Х., Такер М. Р. (2019). Создание основы для инициации женской зародышевой линии в семяпочке растения. J. Exp. Бот. 70 2937–2949. 10.1093 / jxb / erz212 [PubMed] [CrossRef] [Google Scholar]
- Мао Ю., Габель А., Накель Т., Вихёвер П., Баум Т., Теклеоханс Д. Г. и др. (2020). Избирательная полиспермия яйцеклеток обходит триплоидный блок. eLife 9: e52976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мартин М. В., Фиол Д. Ф., Сундаресан В., Забалета Э.Дж., Пагнуссат Г. С. (2013). oiwa, женский гаметофитный мутант с нарушенной митохондриальной марганцевой супероксиддисмутазой, обнаруживает решающую роль активных форм кислорода во время развития зародышевого мешка и оплодотворения у Arabidopsis. Растительная клетка 25 1573–1591. 10.1105 / tpc.113.109306 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Мартон М. Л., Кордтс С., Бродхвест Дж., Дрессельхаус Т. (2005). Направление пыльцевых трубок из микропилара с помощью яичного аппарата 1 кукурузы. Наука 307 573–576.10.1126 / science.1104954 [PubMed] [CrossRef] [Google Scholar]
- Маруяма Д., Эндо Т., Нисикава С. (2010). BiP-обеспечиваемое слияние полярных ядер важно для регуляции пролиферации ядер эндосперма у Arabidopsis thaliana . Proc. Natl. Акад. Sci. США 107 1684–1689. 10.1073 / pnas.05107 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Маруяма Д., Ямамото М., Эндо Т., Нисикава С. (2014). Различные наборы ER-резидентных J-белков регулируют отдельные события слияния полярной ядерной мембраны у Arabidopsis thaliana . Physiol растительных клеток. 55 1937–1944. 10.1093 / pcp / pcu120 [PubMed] [CrossRef] [Google Scholar]
- Мэн Дж. Г., Чжан М. X., Ян В. К., Ли Х. Дж. (2019). TICKET привлекает пыльцевые трубки и обеспечивает репродуктивную изоляцию между родственными видами Brassicaceae. Sci. China Life Sci. 62 1413–1419. 10.1007 / s11427-019-9833-3 [PubMed] [CrossRef] [Google Scholar]
- Мол Р., Маттис-Рочон Э., Дюма К. (1994). Кинетика цитологических событий при двойном оплодотворении у Zea mays L. Завод J. 5 197–206. 10.1046 / j.1365-313x.1994.05020197.x [CrossRef] [Google Scholar]
- Moll C., von Lyncker L., Zimmermann S., Kägi C., Baumann N., Twell D., et al. (2008). CLO / GFA1 и ATO — новые регуляторы судьбы гаметических клеток растений. Завод J. 56 913–921. 10.1111 / j.1365-313x.2008.03650.x [PubMed] [CrossRef] [Google Scholar]
- Мори Т., Игава Т., Тамия Г., Миягишима С. Ю., Бергер Ф. (2014). Для прикрепления гамет требуется GEX2 для успешного оплодотворения Arabidopsis. Curr. Биол. 24 170–175. 10.1016 / j.cub.2013.11.030 [PubMed] [CrossRef] [Google Scholar]
- Пагнуссат Г. К., Аландете-Саез М., Боуман Дж. Л., Сундаресан В. (2009). Ауксин-зависимое формирование паттерна и спецификация гамет женского гаметофита Arabidopsis. Наука 324 1684–1689. 10.1126 / science.1167324 [PubMed] [CrossRef] [Google Scholar]
- Пагнуссат Г. К., Ю. Х. Дж., Сундаресан В. (2007). Переключение клеточной судьбы синергида на яйцеклетку в эмбриональных мешочках Arabidopsis eostre мутанта происходит из-за неправильной экспрессии BEL1-подобного гомеодоменного гена BLh2. Растительная клетка 19 3578–3592. 10.1105 / tpc.107.054890 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Паноли А., Мартин М. В., Аландете-Саез М., Саймон М., Нефф К., Сваруп Р. и др. (2015). Импорт ауксина и локальный биосинтез ауксина необходимы для митотических делений, размножения клеток и спецификации клеток во время развития женских гаметофитов у Arabidopsis thaliana . PLoS Один 10: e0126164. 10.1371 / journal.pone.0126164 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Park K., Ким М. Ю., Викерс М., Пак Дж. С., Хён Ю., Окамото Т. и др. (2016). Деметилирование ДНК инициируется в центральных клетках арабидопсиса и риса. Proc. Natl. Акад. Sci. США 113 15138–15143. 10.1073 / pnas.16114 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Пиллот М., Бару К., Васкес М. А., Отран Д., Леблан О., Вьелле-Кальсада Дж. П. и др. (2010). Эмбрион и эндосперм наследуют различные состояния хроматина и транскрипции от женских гамет у Arabidopsis. Растительная клетка 22 307–320. 10.1105 / tpc.109.071647 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Пишке М. С., Джонс Л. Г., Оцуга Д., Фернандес Д. Э., Дрюс Г. Н., Сассман М. Р. (2002). Гистидинкиназа Arabidopsis необходима для мегагаметогенеза. Proc. Natl. Акад. Sci. США 99 15800–15805. 10.1073 / pnas.232580499 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Portereiko M. F., Lloyd A., Steffen J. G., Punwani J. A., Otsuga D., Дрюс Г. Н. (2006). AGL80 необходим для развития центральных клеток и эндосперма Arabidopsis. Растительная клетка 18 1862–1872 гг. 10.1105 / tpc.106.040824 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Повилус Р. А., Лосада Дж. М., Фридман В. Э. (2015). Цветочная биология и онтогенез семяпочек и семян Nymphaea thermarum, водяной лилии, находящейся на грани исчезновения, с потенциалом в качестве модельной системы для базальных покрытосеменных растений. Ann. Бот. 115 211–226. 10.1093 / aob / mcu235 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Rabiger D.С., Дрюс Г. Н. (2013). MYB64 и MYB119 необходимы для клеточности и дифференцировки во время женского гаметогенеза у Arabidopsis thaliana . PLoS Genet. 9: e1003783. 10.1371 / journal.pgen.1003783 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Raissig M. T., Bemer M., Baroux C., Grossniklaus U. (2013). Геномный импринтинг эмбриона Arabidopsis частично регулируется PRC2. PLoS Genet. 9: e1003862. 10.1371 / journal.pgen.1003862 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шмид М. В., Шмидт А., Гроссниклаус У. (2015). Женский гаметофит: новая модель для системной биологии, специфичной для типов клеток, в развитии растений. Фронт. Plant Sci. 6: 907. 10.3389 / fpls.2015.00907 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Schmidt A., Wöhrmann H.J., Raissig M.T., Arand J., Gheyselinck J., Gagliardini V., et al. (2013). Белок группы Polycomb MEDEA и ДНК-метилтрансфераза MET1 взаимодействуют, подавляя автономное развитие эндосперма у Arabidopsis. Завод J. 73 776–787. 10.1111 / tpj.12070 [PubMed] [CrossRef] [Google Scholar]
- Скотт Р. Дж., Армстронг С. Дж., Даути Дж., Спилман М. (2008). Двойное оплодотворение у Arabidopsis thaliana включает блокад полиспермии на яйцеклетке, но не на центральной клетке. Mol. Завод 1 611–619. 10.1093 / mp / ssn016 [PubMed] [CrossRef] [Google Scholar]
- Ши Д. К., Ян В. К. (2011). Развитие семяпочек у Arabidopsis: успехи и проблемы. Curr. Opin.Plant Biol. 14 74–80. 10.1016 / j.pbi.2010.09.001 [PubMed] [CrossRef] [Google Scholar]
- Симидзу К. К., Ито Т., Исигуро С., Окада К. (2008). Ген геликазы MAA3 (MAGATAMA3) необходим для развития женских гаметофитов и управления пыльцевыми трубками у Arabidopsis thaliana . Physiol растительных клеток. 9 1478–1483. 10.1093 / pcp / pcn130 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Soma S. (1997). «Развитие женского гаметофита и эмбриогенез Ginkgo biloba » в Ginkgo Biloba: A Global Treasure , ред. Хори Т., Ридж Р. В., Тулек В., Дель Тредичи П., Тремуйо-Гиллер Дж., Тобе Х. (Токио: Springer;). [Google Scholar]
- Штеффен Дж. Г., Кан И. Х., Портерейко М. Ф., Ллойд А., Дрюс Г. Н. (2008). AGL61 взаимодействует с AGL80 и необходим для развития центральных клеток Arabidopsis. Plant Physiol. 148 259–268. 10.1104 / pp.108.119404 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Сундаресан В., Аландете-Саез М. (2010). Формирование узора в миниатюре: женский гаметофит цветковых растений. Развитие 137 179–189. 10.1242 / dev.030346 [PubMed] [CrossRef] [Google Scholar]
- Сусаки Д., Судзуки Т., Маруяма Д., Уэда М., Хигасияма Т., Курихара Д. (2020). Динамика спецификаций клеточных судеб при развитии женских гаметофитов Arabidopsis. bioRxiv [Препринт]. 10.1101 / 2020.04.07.023028 [CrossRef] [Google Scholar]
- Сусаки Д., Такеучи Х., Цуцуи Х., Курихара Д., Хигасияма Т. (2015). Живое изображение и лазерное разрушение выявляют динамику и межклеточную коммуникацию во время развития женского гаметофита Torenia fournieri . Physiol растительных клеток. 56 1031–1041. 10.1093 / pcp / pcv031 [PubMed] [CrossRef] [Google Scholar]
- Теклейоханс Д. Г., Накель Т., Грос-Хардт Р. (2017). Выкройка женского гаметофита цветковых растений. Plant Physiol. 173 122–129. 10.1104 / стр. 16.01472 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Фельц Р., фон Линкер Л., Бауманн Н., Дрессельхаус Т., Спранк С., Грос-Хардт Р. (2012). LACHESIS-зависимая передача сигналов яйцеклетки регулирует развитие женских гаметофитных клеток. Развитие 139 498–502. 10.1242 / dev.075234 [PubMed] [CrossRef] [Google Scholar]
- Ван Д., Лу Й., Чжан М., Лу З., Луо К., Ченг Ф. и др. (2014). Структура и функция клетки шеи во время оплодотворения у Ginkgo biloba L. Деревья 28 год 995–1005. 10.1007 / s00468-014-1013-2 [CrossRef] [Google Scholar]
- Вейерс Д. (2016). Переключатель женской идентичности помогает сохранить только одно яйцо в корзине. Dev. Ячейка 37 5–6. 10.1016 / j.devcel.2016.03.011 [PubMed] [CrossRef] [Google Scholar]
- У Дж. Дж., Пэн Х. Б., Ли У., Хэ Р., Синь Х. П., Сунь М. Х. (2012). Митохондриальная дисфункция GCD1 выявляет реципрокную передачу сигналов от клетки к клетке во время созревания женских гамет Arabidopsis. Dev. Ячейка 23 1043–1058. 10.1016 / j.devcel.2012.09.011 [PubMed] [CrossRef] [Google Scholar]
- Ядегари Р., Дрюс Г. Н. (2004). Развитие женского гаметофита. Растительная клетка 16 (Приложение 1): S133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ямада Х., Судзуки Т., Терада К., Такеи К., Исикава К., Мива К. и др. (2001). Гистидинкиназа Arabidopsis AHK4 представляет собой рецептор, связывающий цитокинин, который передает сигналы цитокинина через мембрану. Physiol растительных клеток. 42 1017–1023. 10.1093 / pcp / pce127 [PubMed] [CrossRef] [Google Scholar]
- Ян В. К., Ши Д. К., Чен Ю. Х. (2010). Развитие женского гаметофита у цветковых растений. Annu. Rev. Plant Biol. 61 89–108. 10.1146 / annurev-arplant-042809-112203 [PubMed] [CrossRef] [Google Scholar]
- Юань Л., Лю З., Сонг Х., Йернштедт Дж., Сундаресан В. (2018). Ортолог голосеменных растений гена CKI1, отвечающего за спецификацию центральных клеток покрытосеменных, является важным ключом к разгадке происхождения эндосперма. New Phytol. 218 1685–1696. 10.1111 / nph.15115 [PubMed] [CrossRef] [Google Scholar]
- Юань Л., Лю З., Сонг Х., Джонсон К., Ю. Х., Сундаресан В. (2016). Гистидинкиназа CKI1 определяет женский гаметический предшественник эндосперма. Dev. Ячейка 37 34–46. 10.1016 / j.devcel.2016.03.009 [PubMed] [CrossRef] [Google Scholar]
- Чжан М. X., Чжу С. С., Сюй Ю. С., Го Ю. Л., Ян В. К., Ли Х. Дж. (2020). Репрессия транскрипции определяет центральную клетку для двойного оплодотворения.
Proc. Natl. Акад. Sci. США
117
6231–6236. 10.1073 / pnas.1
5117 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Зини Л. М., Галати Б. Г., Ферруччи М. С., Зарлавский Г., Розенфельдт С. (2016). Ультраструктурное исследование женского гаметофита и эпистазы Cabombaceae и Nymphaeaceae. Флора 220 25–36. 10.1016 / j.flora.2016.02.006 [CrossRef] [Google Scholar]
(PDF) Сколько ядер составляет зародышевый мешок у цветковых растений?
Клеточная пролиферация
Наблюдения Фридмана
(1)
противоречат более раннему хорошо задокументированному отчету
Тобе и его соавторов по Amborella trichopoda.
(19)
На основе сопоставимого размера выборки они
описали восьмиъядерный фит мегагамето-
типа Polygonum с «нормальным» дополнением двух синергидов.
Более того, группа Тобе
(19)
сообщила об эфемерных антиподах,
, тогда как в материале Фридмана три антиподальных клетки
, как сообщается, устойчивы. Такое несоответствие
нельзя просто отклонить как ошибочное, явно требующее более подробного объяснения
. Например, тератологические случаи сверхчеловеческих синергидов и яйцеклеток были зарегистрированы у других
покрытосеменных, хотя и редко.
(20)
Однако обширная выборка и последовательность наблюдений, похоже, исключают возможность тератологии
здесь.Более того, оба исследования
Amborella сообщают о двуядерной центральной клетке. Таким образом, наблюдения
Фридмана не могут быть объяснены привлечением
дополнительного синергида из одного из других компонентных ядер
восьмиъядерной структуры, которая могла возникнуть в результате нарушения синхронизации
одного из митозов. Возможно ли, что оба описанных условия
поддерживаются в пределах Amborella tricho-
poda? Если предположить, что они в конечном итоге генетически контролируются троллингом, может ли Amborella поддерживать такой аллельный полиморфизм
среди (или внутри) местных популяций? Это кажется маловероятным для линии
, столь же древней и географически изолированной, как Amborella,
, в которой к настоящему времени должны быть установлены ограничения развития
.(Гибкость в пределах родословной не следует путать
с «лабильностью»
(1,21)
среди них).
Сообщения о сверхкомплектных ядрах часто встречаются в ангио-
пермских зародышевых мешках, но обычно встречаются в центральных или (чаще всего
) халазальных доменах.
(4,5,20)
Например, в тетра-
споровых зародышевых мешочках, таких как типы Peperomia и Drusa,
до четырех митозов приводят к окончательному дополнению до
16 ядер.Однако у зрелого мегагаметофита яйцеклеточный аппарат
обычно остается трехклеточным даже у тетраспоровых типов
, за исключением пеперомии, у которой яйцо
иногда двухклеточное в пределах 16-ядерного мегагаметофита
. .
(11)
В тетраспорных зародышевых мешочках избыточные ядра
экспрессируются либо как антиподальные, либо как центральные клетки, либо как
периферических клеток неустановленной природы, но не как синергид
или яйцеклетки.Более того, они являются прямым результатом переключения развития
, которое происходит намного раньше в онтогенезе: в
тетраспорных зародышевых мешочкахни формирование клеточной стенки, ни гибель клеток
не происходят на стадии тетрад, что приводит к
. четырехъядерный ценомегаспор.
Возможно, более близкая аналогия со случаем Amborella встречается в
зародышевых мешочках, которые соответствуют по паттерну развития
«типичному» моноспорическому типу Polygonum (рис.1а), за исключением
поведения антиподальных клеток. Записи фиксированных (а не
тератологических) дополнительных ядер чаще всего встречаются в
антиподальных клетках, которые играют лишь косвенную роль в репродуктивном процессе
. Антиподы разных видов
могут подвергаться запрограммированной гибели клеток, нарушению формирования клеточной стенки, полиплоидизации или пролиферации
. Например, до 12 клеток стручков против
было зарегистрировано у некоторых Gentianaceae и до
до 300 у некоторых Poaceae,
(11)
иногда с переменным числом ядер
.Такое разрастание сравнивалось с
ипроталлиальной тканью некоторых голосеменных.
(7)
Сходство
в поведении яичного аппарата Amborella и
антипод других видов, по-видимому, подтверждает более ранние
гипотезы
(6,8,9)
эволюционной гомологии между anti-
стручки и яичный аппарат. Кроме того, у мутантов кукурузы и
Arabidopsis были зарегистрированы дополнительные
синергидов.
(22,23)
Индетерминантный гаметофит 1 кукурузы (ig)
мутанты сочетают в себе различное количество дополнительных микропиларных митозов
до или после клеточной стадии с уменьшенным на
количеством халазальных митозов, что указывает на возможную позднюю стадию
Переключатель полярности.
Выводы и перспективы
Развитие — генетические исследования модельных организмов
начали улучшать наше понимание образования мегагаметофитов
у покрытосеменных,
(22–24)
но дальнейшие исследования
этих механизмов у семенных растений выиграют от более
явно филогенетического подхода.Однако попыткам реконструировать
структуру эволюции характерных черт цветущих
растений (т.е. отличить покрытосеменные от других семенных растений)
по-прежнему мешают проблемы сравнения внешних групп,
в основном из-за огромных пробелов, отражающих предшествующие Кайнозойские вымирания.
Даже в современную эпоху молекулярной систематики, филогенетический контекст
для цветковых растений никоим образом не решен. Основанный на последовательностях молекулярный анализ семенных растений
богат признаками, но ограничен сильно истощенным диапазоном из
существующих линий.Они выдвигают гипотезы о взаимосвязи, которые
сильно контрастируют с результатами морфологического анализа, согласно которым
включают таксоны ископаемых.
(10)
Сравнительные данные по организации мегагамето-
фитов вымерших семенных растений относительно ограничены.
(25)
Кроме того, как и данные по существующим таксонам, они
предоставляют противоречивые свидетельства. Например, среди ископаемых
семенных растений каменноугольного периода наиболее распространенное состояние семяпочки
включает три микропилярных архегонии, как и у некоторых сохранившихся
хвойных пород, что означает, что зародышевый мешок покрытосеменных мог иметь
, происходящих из аналогичной структуры (рис.2в). Напротив,
семяпочек позднепермского голосеменного Glossopteris, который
представляет собой вероятную стволовую группу покрытосеменных, обладали двумя
увеличенными синергидоподобными шейными клетками.
(26)
На мой взгляд, эти клетки
напоминают шейные клетки существующего рода Cycas,
(27)
, возможно,
, что указывает на то, что они дали начало синергидам из единственного архегония
. , как в гипотетическом примере на рис.2b.
Таким образом, дальнейшие конструкции еще предстоит изучить в загадочном переходе
от голосеменных к покрытосеменным.
Предложение Фридмана относительно возможного эволюционного значения
дополнительной синергии в Амборелле
(1)
является
стимулирующим и потенциально парадигматическим, но неизбежно вызывает
столько же вопросов, сколько и ответов.
О чем пишут газеты
1070 BioEssays 28.11
Жизненный цикл покрытосеменных | Цифровой атлас древней жизни
Избранные ссылки и дополнительная литература
Примечание: Бесплатный полный текст предоставляется издателем для элементов, отмеченных зеленой звездочкой.
Журнальные статьи
* Фридман, W.E., and K.C. Райерсон. 2009. Реконструкция предкового женского гаметофита покрытосеменных: выводы из Amborella и других древних линий цветковых растений. Американский журнал ботаники 96: 129-143.https://doi.org/10.3732/ajb.0800311
* Фридман, W.E., and J.H. Уильямс. 2003. Модульность женского гаметофита покрытосеменных и ее влияние на раннюю эволюцию эндосперма у цветковых растений. Evolution 57: 216-230. https://doi.org/10.1111/j.0014-3820.2003.tb00257.x
* Фридман, W.E., and J.H. Уильямс. 2004. Эволюция полового процесса в древних линиях цветковых растений. Растительная клетка 16: S119-S132. https://doi.org/10.1105 / tpc.017277
Фридман, W.E., W.N. Gallup, and J.H. Уильямс. 2003. Развитие женского гаметофита в Kadsura : значение для Schisandraceae, Austrobaileyales и ранняя эволюция цветковых растений. Международный журнал наук о растениях 164: S293-S305. https://doi.org/10.1086/376877
* Мадрид, E.N., and W.E. Фридман. 2009. Эволюционная основа эволюционной диверсификации структуры женских гаметофитов у Piper и Piperaceae. Анналы ботаники 103: 869-884. https://doi.org/10.1093/aob/mcp011
* Мадрид, E.N., and W.E. Фридман. 2010. Женский гаметофит и раннее развитие семян у Peperomia (Piperaceae). Американский журнал ботаники 97: 1-14. https://doi.org/10.3732/ajb.0800423
* Рудалл П.Дж., М.В. Ремизова, А. Бир, Э. Брэдшоу, Д. Стивенсон, Т.Д. Макфарлейн, Р.Э. Такетт, С. Ядав, Д. Соколов. 2008. Сравнительное развитие семяпочек и мегагаметофитов у водорослей и водяных лилий выявило мозаику особенностей среди ранних покрытосеменных. Анналы ботаники 101: 941-956. https://doi.org/10.1093/aob/mcn032
* Schmid, M.W., A. Schmidt, U. Grossniklaus. 2015. Женский гаметофит: новая модель клеточной системной биологии в развитии растений. Границы растениеводства . https://doi.org/10.3389/fpls.2015.00907
Тобе, Х., Ю. Кимото и Н. Пракаш. 2007. Развитие и строение женского гаметофита у Austrobaileya scandens (Austrobaileyaceae) . Журнал исследований растений 120: 431-436.https://doi.org/10.1007/s10265-007-0085-0
Уильямс, Дж. Х. и У. Э. Фридман. 2002. Идентификация диплоидного эндосперма в ранней линии покрытосеменных. Nature 415: 522-526. https://doi.org/10.1038/415522a
* Уильямс, Дж. Х., и У. Э. Фридман. 2004. Четырехклеточный женский гаметофит Illicium (Illiciaceae; Austrobaileyales): значение для понимания происхождения и ранней эволюции однодольных, эумагнолид и эвдикотов. Американский журнал ботаники 91: 332-351.https://doi.org/10.3732/ajb.91.3.332
Книги и учебники
Bergen, J.Y., and O.W. Колдуэлл. 1914. Введение в ботанику. Джинн и компания, Бостон. Читайте онлайн в Интернет-архиве.
Исав К. 1977. Анатомия семенных растений, 2-е изд. John Wiley & Sons, Нью-Йорк.
Эверт Р.Ф., С.Е. Эйххорн. 2013. Ворона Биология растений, 8-е изд. W.H. Freeman and Co., Нью-Йорк, Нью-Йорк.
Фостер, А.С., и Э.М. Гиффорд. 1974. Сравнительная морфология сосудистых растений, 2-е изд.W.H. Freeman and Co., Сан-Франциско.
Махешвари, П. 1950. Введение в эмбриологию покрытосеменных растений. McGraw-Hill Book Company, Inc., Нью-Йорк, Торонто, Лондон. Читайте онлайн в Интернет-архиве.
Симпсон, М. 2010. Систематика растений, 2-е изд. Academic Press, Берлингтон, Массачусетс.
Наконец-то, как растения делают яйца
Давняя загадка, связанная с фундаментальным процессом в биологии растений, была разгадана группой ученых из Калифорнийского университета в Дэвисе.
Революционное открытие группы о том, что растительный гормон ауксин отвечает за производство яиц, имеет несколько важных последствий.
Во-первых, это первое окончательное сообщение о растительном гормоне, действующем как морфоген, то есть о веществе, которое управляет паттерном развития клеток в зависимости от его концентрации.
Кроме того, результаты исследования дают новое захватывающее понимание эволюционного пути, по которому цветущие растения прошли 135 миллионов лет назад, когда они отделились от голосеменных, группы растений с «голыми семенами», в которую входят хвойные, саговники и гинкго.
Наконец, группа использовала свое открытие для создания дополнительных яйцеклеток в репродуктивных структурах растений, что повысило вероятность того, что эти методы когда-нибудь могут быть использованы для улучшения воспроизводства и плодородия сельскохозяйственных культур.
«Итак, теперь последовательность становится ясной, — сказал Венкатесан Сундаресан, профессор биологии растений и наук о растениях Калифорнийского университета в Дэвисе, который руководил исследованием. «Растение запускает синтез ауксина на одном конце женской репродуктивной единицы, называемой зародышевым мешком, создавая градиент ауксина.Затем восемь ядер в мешочке подвергаются воздействию различных уровней ауксина, но только ядро в правильном положении в градиенте становится яйцеклеткой. И эта клетка впоследствии оплодотворяется для создания следующего поколения ».
Статья с описанием исследования была опубликована 4 июня на интернет-сайте журнала Science, Science Express, перед публикацией в журнале в конце этого месяца.
Развитие сперматозоидов и яйцеклеток у растений
У человека и других животных половые клетки для производства яйцеклеток и спермы закладываются при рождении.Но клетки цветковых растений назначаются более или менее случайным образом, чтобы стать репродуктивными единицами, когда растение достигает половой зрелости. В цветке сперматозоиды производятся пыльцой на концах тычинок, а яйцеклетки развиваются в семязачатках, крошечных структурах, встроенных в яичник у основания пестика.
В начале процесса развития яйцеклетки «материнская клетка» в семяпочке делится несколько раз в последовательности, включающей как мейозные, так и митотические деления. Эти деления приводят к созданию продолговатой клеточной структуры, называемой зародышевым мешком, которая содержит восемь ядер, три из которых сгруппированы около открытого конца семяпочки.
В течение нескольких часов клеточные мембраны начинают формироваться, в конечном итоге образуя семь клеток: важнейшую яйцеклетку рядом с отверстием семяпочки, куда войдет пыльца, и шесть других поддерживающих клеток, выполняющих важные функции для образования семян.
«Большой вопрос в нашей области на протяжении последних 50 или более лет был: как этот процесс происходит в такой прекрасно организованной схеме?» — сказал Сундаресан. «Было ясно, что здесь есть программа, которая точно сообщает растениям, что им делать, и что она работает не с клетками, а с ядрами.”
Концентрации ауксина определяют судьбу ядер
Два года назад Сундаресан и доктор наук в его лаборатории Габриэла Пагнуссат использовали генетические инструменты, чтобы изменить положение одного ядра на одном конце зародышевого мешка у растения Arabidopsis. Когда они исследовали зрелый мешок, они обнаружили, что он произвел две яйцеклетки вместо одной.
Сундаресан обнаружил, что подобный сдвиг паттерна похож на реакцию, о которой сообщалось два десятилетия назад у дрозофилы в экспериментах, которые предоставили первое прямое доказательство существования морфогенов.
Это побудило его начать поиск вещества в Arabadopsis, которое могло бы действовать как морфоген. Когда группа обнаружила, что ауксин накапливается на открытом конце семяпочки, они обратили свое внимание на этот вездесущий гормон, который, как известно, играет бесчисленные сигнальные роли в росте растений и поведенческих процессах. (О существовании гормона впервые догадался Чарльз Дарвин, когда он изучал, как растения растут навстречу свету.)
После многих тестов Сундаресан и его группа обнаружили, что во время формирования зародышевого мешка концентрации ауксина действительно следовали градиенту, причем самые высокие уровни наблюдались в семяпочке в конце зародышевого мешка, куда входит пыльца, а самые низкие — на противоположных. конец мешочка.
Чтобы проверить теорию о том, что этот градиент определяет судьбу ядер в мешочке, Сундаресан и его группа создали серию генетически измененных растений Arabadopsis. У некоторых растений они увеличивали выработку ауксина в зародышевом мешочке, а у других снижали чувствительность мешочка к ауксину, создавая тот же эффект, что и снижение ауксина.
Когда они исследовали эти экспериментальные растения, их гипотеза подтвердилась: концентрация ауксина определяла судьбу ядер.Зная, был ли уровень ауксина высоким или низким, стало возможным предсказать появление или исчезновение яйцеклеток в разных местах внутри зародышевого мешка.
Наконец, группа использовала длинную серию биоманипулятивных техник, чтобы определить, что градиент ауксина, который они обнаружили в эмбриональном мешке, был обусловлен синтезом на месте, а не переносом из источника за пределами мешка.
«То, что мы узнали о том, как здесь работает ауксин, удивительно, — сказал Сундаресан.«Идея о том, что вы можете иметь такую небольшую молекулу, которая поддерживается в градиенте внутри этой восьмиъядерной структуры только посредством синтеза, просто ошеломляет».
Значение для эволюции цветковых растений
Развитие зародышевого мешка, возможно, является ключевым элементом в эволюции голосеменных растений к цветковым растениям, также известным как покрытосеменные.
Тем не менее, летопись окаменелостей мало что раскрывает об этапах, которые вели от образования семян голосеменных к производству семян покрытосеменных, когда переход произошел около 135 миллионов лет назад.Быстрое распространение цветковых растений и их возможное господство над растительностью Земли Дарвин назвал «отвратительной тайной».
Выяснив механизм развития зародышевого мешка, Сундаресан и его команда открыли дверь для новой работы по эволюционному пути между этими двумя основными группами растений. Это открытие подтверждает так называемую модульную теорию, которая утверждает, что у первых покрытосеменных произошло резкое сокращение женской репродуктивной единицы по сравнению с голосеменными, что позволило цветущим растениям размножаться более эффективно и в конечном итоге вытеснить своих предков с голыми семенами.
Пожалуй, наиболее примечательно то, что новая работа предполагает, что восемь ядер зародышевого мешка покрытосеменных сохранили пластичность развития в своей эволюции от голосеменных. «Удивительно, что даже несмотря на то, что расщепление предположительно произошло более ста миллионов лет назад, — сказал Сундаресан, — все эти ядра все еще могут стать яйцеклетками».
Соавторами исследования являются ведущий автор Габриэла Пагнуссат и Моника Аландете-Саез, которые работали в докторантуре с Сундаресаном, когда они выполняли свою работу, и Джон Л.Боуман, профессор биологии растений Калифорнийского университета в Дэвисе на момент исследования, сейчас работает в Университете Монаша в Мельбурне, Австралия.
Работа поддержана грантом Национального научного фонда.
О UC Davis
В течение 100 лет Калифорнийский университет в Дэвисе занимается обучением, исследованиями и предоставлением общественных услуг, которые важны для Калифорнии и меняют мир. В Калифорнийском университете Дэвиса, расположенном недалеко от столицы штата, обучается 31 000 студентов, годовой бюджет на исследования превышает 500 миллионов долларов, имеется комплексная система здравоохранения и 13 специализированных исследовательских центров.Университет предлагает междисциплинарное обучение в аспирантуре и более 100 специальностей бакалавриата в четырех колледжах — сельскохозяйственных и экологических наук, биологических наук, инженерии, литературы и науки — и ученых степеней в шести профессиональных школах — образование, право, менеджмент, медицина, ветеринария и Школа медсестер Бетти Ирен Мур.
Эволюционное происхождение эндосперма цветковых растений | Genome Biology
Жизненный цикл растений чередуется между гаплоидной и диплоидной фазами: гаплоидный гаметофит, производящий гаметы, можно рассматривать как функциональный эквивалент зародышевой линии животных, в то время как диплоидный спорофит, продуцирующий споры, включает корневую и побеговую системы.У примитивных растений (таких как мхи и папоротники) гаметофиты обычно свободноживущие, тогда как у семенных растений гаметофиты половой диморфизм и развиваются в половых органах цветка: мужской гаметофит (пыльцевое зерно) развивается внутри пыльников и женский гаметофит (зародышевый мешок) развивается внутри семяпочек, что в конечном итоге дает семена после двойного оплодотворения. Структура женского гаметофита и процесс оплодотворения являются отличительными чертами двух филогенетических групп семенных растений: нецветущих голосеменных растений (включая хвойные и саговники) и цветущих покрытосеменных растений (рис. 1).
Рисунок 1Реконструкция эволюционного онтогенеза эндосперма с помощью филогенетически закрепленной сравнительной эмбриологии. Схематическое изображение филогенетических деревьев (а) голосеменных и (б) покрытосеменных растений. Указаны только виды, имеющие отношение к тексту или иллюстрации в (c) . Деревья нарисованы согласно [15] и [16] соответственно. (c) Серия примеров видов, иллюстрирующих разнообразие структур зародышевого мешка среди существующих растений и последующее разнообразие плоидности эндосперма.Зародышевый мешок, изображенный для Amborella и Arabidopsis , относится к типу Polygonum. Вариации плоидности эндосперма у Piperaceae и Plumbaginaceae, временное присутствие эндосперма у Orchidaceae и его отсутствие у Podostemonaceae — все это только предсказывается на основе цитологических исследований [3]. Число плоидности эндосперма было точно измерено у некоторых базальных покрытосеменных [1] и известно для Arabidopsis . Для сравнения с женским гаметофитом покрытосеменных (зародышевый мешок) женский гаметофит двух видов голосеменных показан с обильной клеточной гаплоидной тканью и от одной до пяти архегоний, каждая из которых несет одну яйцеклетку.В случае Ephedra яйцеклетки двухъядерные с нормальным ядром яйца и ядром вентрального канала [8]. У голосеменных возникает ситуация «простой сложной полиэмбрионии» [10], в которой несколько яйцеклеток могут быть оплодотворены (митотически различными ядрами сперматозоидов), и каждая зигота затем генерирует четыре клона эмбриона. Степень этой полиэмбрионии варьируется между видами, и здесь изображена упрощенная форма. В конечном итоге выживет только один эмбрион, а остальные вырождаются (серые пунктирные линии в примере Abies ).В случае Ephedra оба ядра яйцеклетки оплодотворяются двумя ядрами сперматозоидов, выделяемыми одной пыльцевой трубкой (двойное оплодотворение), и полиэмбриония также применяется к обоим продуктам оплодотворения [2,8]. Структуры зародышевого мешка были нарисованы на основе [3], а фотографии любезно предоставлены Ботаническим садом Миссури [17]: Abies balsamea, Ephedra viridis, Amborella trichopoda, Nymphaea odorata, Peperomia argyreia, Orchis mascula, Plumbagora macrocarpaea и Oenotherapaea macrocarpa. Polypleurum dichotomum и Arabidopsis thaliana Фотографии любезно предоставлены Рольфом Рютисхаузером и Джоном Боуменом соответственно.
У голосеменных женский гаметофит — это большая многоклеточная структура, обнаруженная, например, у основания каждой чешуи сосновой шишки, производящая от одной до пяти архегоний, каждая из которых несет одну яйцеклетку. Большой женский гаметофит питает развивающийся после оплодотворения эмбрион. У покрытосеменных женские гаметофиты встроены в семяпочки, которые, в свою очередь, находятся в яичнике, который после оплодотворения развивается в плод.Каждый зародышевый мешок имеет высокополярную структуру и состоит из небольшого числа различных типов клеток: двух компетентных к оплодотворению клеток (яйцеклетка и центральная клетка) и различного количества стерильных клеток (синергид и антипод) в зависимости от вида ( Фигура 1).
Двойное оплодотворение — отличительная черта покрытосеменных растений. Каждая семяпочка получает пыльцевую трубку, по которой две сперматозоиды доставляются в зародышевый мешок. Один сперматозоид оплодотворяет яйцеклетку, образуя диплоидную зиготу, в то время как другой сперматозоид оплодотворяет центральную клетку, дающую начало эндосперму, который обычно является триплоидным.Считается, что, как и женский гаметофит голосеменных, эндосперм выполняет функцию питания эмбрионов. В зависимости от вида эндосперм может отсутствовать (как у Podostemonaceae, семейство речных сорняков), быть недолговечным (как у Orchidaceae, семейство орхидей), сохраняться в зрелых семенах (как у пшеницы, кукурузы и пальмы) или поглощается развивающимся зародышем (как у гороха, бобов и Arabidopsis ; примеры см. на Рисунке 1).
Моделирование женского гаметофита цветущих растений | Физиология растений
В последние десятилетия женский гаметофит (ФГ) цветковых растений привлекает большое внимание.Это с одной стороны, потому что эта мельчайшая структура порождает женские гаметы, представляет собой место оплодотворения и знаменует начало новой жизни. Кроме того, стало ясно, что FG служит привлекательной модельной системой для изучения спецификации клеток, межклеточной коммуникации и запрограммированной гибели клеток (PCD) (Lituiev et al., 2014; Sprunck and Gross-Hardt, 2011; Heydlauff, Gross-Hardt, 2014; Susaki et al., 2015). Знания, которые мы генерируем, в значительной степени продиктованы доступными методами и ресурсами.Соответственно, некоторые из новых идей, которые мы получили о развитии и функционировании FG, были вызваны созданием или адаптацией инструментов для анализа репродуктивной ткани. В свете этих технических достижений мы здесь обсуждаем недавние результаты и концепции, которые проливают свет на сложное развитие и функцию зародышевых мешочков цветущих растений с явным акцентом на механизмы, лежащие в основе спецификации различных клеточных идентичностей и межклеточной коммуникации.
Большинство покрытосеменных растений, включая важные культурные растения и арабидопсис ( Arabidopsis thaliana ), развивают FG так называемого типа polygonum.Эта структура из нескольких клеток объединяет и управляет различными сложными процессами, чтобы обеспечить репродуктивный успех. Для надежного выполнения различных задач в основе FG лежит разделение труда. Две женские гаметы, яйцеклетка и центральная клетка, оплодотворяются одним сперматозоидом каждая. В то время как оплодотворенная яйцеклетка дает начало эмбриону, соседние центральные клетки размножаются, образуя эндосперм, который питает развивающийся эмбрион. Кроме того, образуются дополнительные клетки, прилегающие к гамете: две синергиды дифференцируются рядом с точкой входа пыльцевой трубки, которая называется микропиле.Эти клетки играют ключевую роль в привлечении пыльцевой трубки и опосредуют высвобождение сперматозоидов. Кроме того, три центральные клетки, примыкающие к антиподальным клеткам, образуются на халазальном полюсе FG. Хотя антиподы пролиферируют и вносят вклад в эндосперм, например, у кукурузы ( Zea mays ), в модельном растении Arabidopsis этим клеткам еще нельзя было приписать четкую функцию. Семь клеток FG имеют клональное происхождение и восходят к единственной гаплоидной мегаспоре, которая формируется после мейоза (рис.1А). Мегаспора претерпевает ценоцитарную фазу с тремя митотическими делениями без цитокинеза (Рис. 1, B – D). На ранней восьмиъядерной стадии четыре ядра лежат на обоих концах FG (Fig. 1D). Впоследствии одно ядро с конца микропилара и одно ядро с полюса халазаля мигрируют к центру (рис. 1, D и E). Эти ядра называются полярными ядрами и интегрируются в центральную клетку. Клеточность разделяет синцитий на семь клеток, которые претерпевают дальнейшие морфологические изменения до достижения зрелости (рис.1F). Среди наблюдаемых изменений — изменения положения и размера ядра между яйцеклеткой и синергидом, а также слияние двух полярных ядер с заметным гомодиплоидным ядром. Кроме того, антиподы начинают сокращаться и дегенерировать в результате независимого от оплодотворения процесса, который длится пару дней (Kägi et al., 2010; Song et al., 2014; Fig. 1G).
Рисунок 1.
Внутри- и межклеточная коммуникация управляет формированием паттерна FG. От A до G, графическое изображение различных стадий развития FG.От A до D, функциональная мегаспора претерпевает три митотических деления без клеточности. E и F, ядерная миграция (E) и клеточность (F) компартментализуют FG. G — зрелые FG со слитыми полярными ядрами. От H до K, схематическое изображение рисунка FG, изображающего два отдельных слоя. Нижний слой представляет собой установление оси микропиляр-халазал (зеленый и желтый соответственно). Второй слой представляет собой FG после клеточности, включающую четыре различных типа клеток, наложенных на микропилар-халазальную ось.См. Текст для дальнейшего объяснения. аукс, ауксин; М — микропиларовая штанга; C — халазальный полюс; гам. ком., гаметическая компетентность; син — синергидная клетка; яйцо, яйцеклетка; cc, центральная ячейка; ap, антиподальная клетка.
Рисунок 1.
Внутри- и межклеточная коммуникация управляет формированием паттерна FG. От A до G, графическое изображение различных стадий развития FG. От A до D, функциональная мегаспора претерпевает три митотических деления без клеточности. E и F, ядерная миграция (E) и клеточность (F) компартментализуют FG.G — зрелые FG со слитыми полярными ядрами. От H до K, схематическое изображение рисунка FG, изображающего два отдельных слоя. Нижний слой представляет собой установление оси микропиляр-халазал (зеленый и желтый соответственно). Второй слой представляет собой FG после клеточности, включающую четыре различных типа клеток, наложенных на микропилар-халазальную ось. См. Текст для дальнейшего объяснения. аукс, ауксин; М — микропиларовая штанга; C — халазальный полюс; гам. ком., гаметическая компетентность; син — синергидная клетка; яйцо, яйцеклетка; cc, центральная ячейка; ap, антиподальная клетка.
Для изучения развития и функции FG использовались различные стратегии, среди которых передовая генетика была одним из наиболее успешных подходов.
ГЕНЕТИЧЕСКИЕ ИНСТРУМЕНТЫ ДЛЯ РАСКРЫТИЯ ДИФФЕРЕНЦИАЦИИ КЛЕТОК И ГЕРМЛИННОГО УЗОРА
Перспективные генетические подходы привели к появлению множества женских гаметофитных мутантов, анализ которых внес большой вклад в наше понимание молекулярных механизмов, управляющих развитием FG. В этой главе мы суммируем находки, которые продвинули наше понимание формирования паттерна FG и спецификации клеток.
RBR гомолог ретинобластомы Arabidopsis (Ebel et al., 2004) и белок LOB-домена кукурузы INDETERMINATE GAMETOPHYTE (Lin, 1978; Evans, 2007) необходимы для ограничения ядерной пролиферации в FG, и соответствующие мутанты вызывают сверхштатные ядра. Примечательно, что дополнительные ядра у мутантов ig1 и дифференцируются в соответствии с их относительным положением вдоль оси микропилар-халазал в дополнительные синергиды, яйцеклетки и центральные клетки (Guo et al., 2004). Это клеточное считывание показывает наличие полярных сигналов позиционирования, которые повторяют нуцеллярно-халазальную ось материнской ткани.
МУТАНТЫ С ВОЗМОЖНЫМИ ДЕФЕКТАМИ УСТАНОВЛЕНИЯ ИЛИ ИНТЕРПРЕТАЦИИ МИКРОПИЛАРНО-ХАЛАЗАЛЬНОЙ ОСИ
Как воспринимается и устанавливается эта полярность? Несколько линий доказательств позволяют предположить, что ауксин является ключом к руководству по поводу микропилара. Репортеры ауксинового ответа выявляют дискретный гормональный максимум в спорофитной нуцеллярной ткани на начальных этапах формирования зародышевого мешка (Pagnussat et al., 2009; Ceccato et al., 2013), а целенаправленное нарушение транспорта ауксина препятствует ранним этапам в зародышевом мешке. разработка (Ceccato et al., 2013). Кроме того, спецификация клеток в FG чувствительна к направленным на FG изменениям концентрации ауксина или ауксинового ответа (Pagnussat et al., 2009; Panoli et al., 2015). Однако существует некоторая неопределенность в отношении присутствия ауксина в FG, поскольку в двух из трех исследований не удалось выявить ответ на ауксин в гаплоидном зародышевом мешке с использованием репортеров, обычно применяемых для мониторинга ответа на ауксин в диплоидной ткани (Pagnussat et al., 2009; Ceccato et al. др., 2013; Литуев и др., 2013). Хотя мы не можем исключить возможность того, что механизмы декодирования ауксина фундаментально различаются между гаметофитной и спорофитной тканями, эти результаты предполагают, что влияние ауксина на развитие ФГ может быть косвенным (Ceccato et al., 2013; Литуев и др., 2013).
Важные открытия относительно спецификации полюса халязала получены из анализа His киназы CKI1. CKI1 родственен рецепторам цитокининов от AHK2 до AHK4, но лишен внеклеточного цитокинин-связывающего домена (Hwang and Sheen, 2001; Suzuki et al., 2001; Yamada et al., 2001). Тем не менее, эктопическая экспрессия CKI1 может активировать двухкомпонентный сигнальный путь цитокининов (Kakimoto, 1996). Мутации в гене CKI1 мешают развитию зародышевого мешка (Pischke et al., 2002; Hejátko et al., 2003) и вызывают дефекты халязальной части FG: специфичные для клеточного типа репортерные гены обнаруживают халязальное расширение идентичности яйцеклеток и синергидов, достигая антипод и центральной клетки, соответственно. Примечательно, что при экспрессии на всех стадиях мегагаметогенеза (Rabiger and Drews, 2013; Yuan et al., 2016) экспрессия CKI1 ограничивается двумя ядрами халязы на стадии четырех ядер (Yuan et al., 2016). Как следствие, два полярных ядра центральной клетки, рекрутируемые из микропилара и халазального полюса, различаются в отношении экспрессии CKI1.Это асимметричное наследование CKI1 центральной клетке может обеспечивать средства для установки микропилар-халязальной полярности по отношению к центральной клетке (Fig. 1H). Важная роль CKI1 в формировании клеточного паттерна дополнительно демонстрируется эктопической экспрессией гена, которая достаточна для индукции экспрессии центрального клеточного маркера в положении синергидов и яйцеклеток и образования дополнительных эндоспермов за счет эмбриона (Yuan et al. , 2016). Вместе эти находки указывают на то, что CKI1 не только определяет идентичность центральных клеток, но также ограничивает микропиларовые сигнатуры синергидом и яйцеклеткой.
Другой мутант, который может быть согласован со сдвигом или неправильной интерпретацией оси микропилар-халазал, — это измененная программа меристемы1 ( amp1 ), которая дифференцирует полностью функциональные яйцеклетки за счет синергидных клеток (Kong et al., 2015 ). Примечательно, что дефект может быть дополнен экспрессией спорофитных AMP1 , что свидетельствует о наличии мобильного фактора, генерируемого в ткани материнской яйцеклетки, который подавляет идентичность яйцеклеток у синергидов (Kong et al., 2015). wyrd Мутанты дефектны в предполагаемом ортологе Arabidopsis внутреннего центромерного белка (INCENP), а также обнаруживают репрограммирование одного или двух синергидов в яйцеклетки и дефекты дифференцировки центральных клеток (Kirioukhova et al., 2011). Участвует ли WYRD в начальном установлении идентичности клеток или скорее он необходим для поддержания установленного паттерна, в настоящее время неясно (Fig. 1I).
Точно так же мутанты eostre демонстрируют вторую яйцеклетку за счет одного синергида (Pagnussat et al., 2007). Дефект можно проследить до эктопической экспрессии гена BEL1-подобного гомеодомена 1 ( BLh2 ) и требует наличия гена KNOX KNAT3. В то время как BLh2 не активен в зародышевых мешочках дикого типа, его эктопическая экспрессия может мешать функциональному взаимодействию BELL-KNOX, подтверждая критическую роль KNAT3 в регуляции идентичности яйцеклеток.
Напротив, расширение халазальных идентичностей наблюдается в FGs, дефектных по факторам транскрипции MYB 119 и 64 (Rabiger and Drews, 2013). MYB64 экспрессируется во всех клетках FG, тогда как MYB119 ограничивается центральными клетками и антиподами. Примечательно, что MYB119 подавляется у мутантов cki1 . Однако, учитывая противоположные роли генов, с CKI1 , способствующими халазальной идентичности, в то время как MYB119 репрессирует ее, это, по-видимому, в основном связано с неспособностью cki1 создать клетки, экспрессирующие MYB119 (Fig. 1H).
Наконец, мутанты verdandi , которые дефектны по предполагаемому фактору транскрипции суперсемейства B3, обеспечивают интригующий фенотип с синергидами и антиподами, обнаруживающими дефекты в активации специфичного для клеточного типа молекулярного маркера.Дефект связан с нечастой активацией синергидного репортера в антиподальных клетках и наоборот (Matias-Hernandez et al., 2010). Фенотип потенциально указывает (1) на дефект в установлении или интерпретации микропилар-халазальных ориентиров наведения, (2) на общий модуль для регуляции дополнительных клеток или (3) на наличие дефекта, уже имманентного одноядерным клеткам. зародышевый мешок, который сохраняется до зрелой стадии, когда дефект становится очевидным (Matias-Hernandez et al., 2010).
ГЕНОВ, УЧАСТВУЮЩИХ В ОПРЕДЕЛЕНИИ ОТДЕЛЬНЫХ ТИПОВ КЛЕТОК
Кроме того, несколько факторов транскрипции вовлечены в дифференцировку клеток FG. У мутантов, дефектных по MYB98 , нитевидный аппарат, выступ клеточной стенки, характерный для синергид, не сформирован должным образом (Fig. 1J). Дефект коррелирует с неспособностью привлекать пыльцевые трубки и подтверждает идею о том, что нитевидный аппарат участвует в секреции аттрактантов пыльцевых трубок (Punwani et al., 2007). На основе транскриптома яйцеклетки пшеницы ( Triticum aestivum ) было идентифицировано растение-специфичное семейство факторов транскрипции, содержащее RWP-RK-домен (RKD). AtRKD1 и AtRKD2 специфически активируются в яйцеклетках Arabidopsis и, что примечательно, их сверхэкспрессия активирует профиль транскриптов, подобный яйцеклеткам, в ткани каллуса (Koszegi et al., 2011). Эти результаты предполагают, что RKD1 и RKD2 являются ключом к активации идентичности яйцеклеток (рис.1J). Из-за генетической избыточности этого семейства генов у Arabidopsis, полностью обедненные RKD FG еще не доступны. В свете этих сложностей очень интересна недавняя работа с Marchantia polymorpha . По сравнению с арабидопсисом, этот простой печеночник имеет меньший геном, что снижает сложность. Фактически, Marchantia кодирует только одну копию RKD, продвигая исследования потери функции. Rövekamp et al. (2016) и Koi et al. (2016) получили РНКи-индуцированные мутанты и мутанты, индуцированные рекомбинацией, соответственно.Оба исследования сообщают о дефектах развития яйцеклеток. Однако, хотя нуль-мутант, проанализированный Koi et al. проявляет дефекты дифференцировки яйцеклеток, Rövekamp et al. сообщили о морфологически незаметных яйцеклетках, которые, однако, продолжали свою эмбрионоподобную программу без оплодотворения. Различные наблюдаемые фенотипы, вероятно, связаны с разными аллелями или с разными условиями роста и предполагают роль RKD в дифференцировке яйцеклеток и репрессии партеногенетического репродуктивного пути.
Центральная клеточная спецификация, как было показано, зависит от фактора транскрипции MADS-домена AGL80 (Portereiko et al., 2006) и AGL61 (Steffen et al., 2008), который взаимодействует с AGL80. Мутанты с потерей функции обнаруживают дефекты развития в центральной клетке, сопровождаемые неспособностью инициировать экспрессию двух из трех протестированных репортеров центральных клеток (Fig. 1J). Кроме того, активные формы кислорода, которых особенно много в центральной клетке FG, играют важную роль в спецификации центральной клетки (рис.1J). У oiwa мутантов, дефектных по митохондриальной Mn-супероксиддисмутазе 1, синергиды и яйцеклетки обнаруживают повышенные уровни активных форм кислорода и сопутствующую активацию характерных генов центральных клеток (Martin et al., 2013).
КЛЕТОЧНАЯ СВЯЗЬ СРЕДИ ЖЕНСКИХ ГАМЕТОФИТИЧЕСКИХ КЛЕТОК
Управление дифференцировкой и развитием клеток FG требует межклеточной коммуникации. Именно это взаимодействие между отдельными клетками эмбрионального мешка вместе с замечательной пластичностью развития усложняет интерпретацию мутантных дефектов.Мутации в цистеинил-тРНК синтетазе SYCO ARATH приводят к увеличению продолжительности жизни антиподальных клеток и влияют на целостность митохондрий и слияние полярных ядер в центральной клетке (Kägi et al., 2010). Интересно, что SYCO экспрессируется только в центральной клетке, а целенаправленное разрушение митохондрий центральной клетки с использованием доминантной версии транслокатора АТФ / АДФ AAC2 (aac2 A199D ) подавляет гибель антиподных клеток. Wu et al. расширили картину, показав, что продолжительность жизни антипод аналогичным образом регулируется яйцеклеткой, поскольку экспрессируемый яйцеклеткой aac2 A199D также мешает антиподальной PCD (Wu et al., 2012). Эти исследования, таким образом, раскрывают неклеточную автономную роль митохондрий в регуляции гибели клеток и подтверждают, что антиподальная продолжительность жизни и метаболическая активность женских гамет взаимосвязаны (Fig. 1K). Wu et al. кроме того, показали, что функция митохондрий также передается между яйцеклеткой и центральной клеткой: мутации в GAMETE CELL DEFECTIVE1 (GCD1) влияют на созревание гамет и PCD антиподальных клеток. Примечательно, что активация GCD1 либо в яйцеклетке, либо в центральной клетке ускоряет созревание соответствующей другой гаметы, в то время как нацеленная экспрессия aac2 A199D в яйцеклетке препятствует слиянию полярных ядер в центральной клетке (Wu et al., 2012; Рис. 1К).
Поддержание выбора между гаметическими и вспомогательными клетками требует активности факторов сплайсинга пре-мРНК LACHESIS (LIS), CLOTHO (CLO) и ATROPOS (ATO). У соответствующих мутантов синергиды и центральные клетки обнаруживают морфологические и молекулярные особенности, характерные для яйцеклеток, тогда как антиподальные клетки выражают атрибуты центральных клеток (Groß-Hardt et al., 2007; Moll et al., 2008). В отличие от других мутантов, описанных ранее, лишние яйцеклетки и центральные клетки не оплодотворяются.Фенотип lis , clo и ато обнаруживает гаметический потенциал всех клеток FG и предполагает важную роль сплайсинга пре-мРНК в ограничении идентичности гаметических клеток. Примечательно, что фенотип развивается прогрессивно, и неправильная спецификация не очевидна в молодых зародышевых мешочках. Было показано, что активность промотора LIS сильно усиливается после клеточной обработки в гаметических клетках (Groß-Hardt et al., 2007), а специфичное для яйцеклеток РНКи-опосредованное восстановление транскрипта LIS частично фенокопировало мутанты lis . (Völz et al., 2012). Вместе эти результаты были интерпретированы в свете механизма латерального ингибирования, согласно которому женские гаметы репрессируют идентичность гамет в соседних дополнительных клетках (Groß-Hardt et al., 2007; Fig. 1I). Способность всех клеток FG в принципе принимать любую идентичность клеток FG замечательна и усложняет интерпретацию мутантных фенотипов. В случае дополнительных клеток эта пластичность интерпретируется как резервный механизм (Groß-Hardt et al., 2007), который может повысить надежность системы (Lituiev et al., 2014). Важная роль яйцеклетки в стабилизации паттернов клеточной спецификации проиллюстрирована характеристикой специфичного для яйцеклеток гена ZmEAL1 кукурузы. ZmEAL1 активируется на микропилярном полюсе незрелого зародышевого мешка, и опосредованная РНКи подавляющая регуляция генов препятствует антиподальной экспрессии IG1 и индуцирует репрограммирование антиподов в центральную клетку (Krohn et al., 2012; Рис. 1I). Роль яйцеклетки в спецификации клеток FG также рассматривалась в исследованиях по удалению отдельных клеток.
СОВРЕМЕННЫЕ ИННОВАЦИИ И БУДУЩИЕ ТЕХНОЛОГИЧЕСКИЕ ВЫЗОВЫ
Лазерная абляция клеток
Лазерная абляция является очень мощным инструментом для исследования роли отдельных типов клеток и, например, выявила важную роль покоящегося центра в поддержании статуса стволовых клеток соседних клеток (van den Berg et al., 1995) и раскрыли ключевую роль синергидов в привлечении пыльцевых трубок (Higashiyama et al., 2001).Lawit et al. использовали лазерную абляцию клеток для истощения ФГ функциональной яйцеклетки. Это фотонное вмешательство, а также дополнительная генетическая абляция яйцеклеток с использованием токсин-барназы (Lawit et al., 2013) активировали профиль яйцеклеток в соседних синергидных клетках. Исследование было подтверждено Susaki et al. (2015), которые показали, что функция синергидов по притяжению пыльцевых трубок теряется при абляции яйцеклеток, связанной со снижением активности приманки. Кроме того, авторы наблюдали сдвиг полярности синергидов по отношению к положению ядра.Это особенно актуально, поскольку, по-видимому, существует строгая корреляция между положением ядра и идентичностью клетки: яйцеклетка и синергиды занимают сходное проксимо-дистальное измерение. Однако они заметно различаются в отношении положения ядра: в то время как синергидные ядра обычно локализуются по направлению к проксимальному полюсу клетки, ядро яйцеклетки занимает дистальную часть клетки. Во всех описанных мутантах, демонстрирующих репрограммирование синергидов в яйцеклетки (Groß-Hardt et al., 2007; Pagnussat et al., 2007; Молл и др., 2008; Кириухова и др., 2011; Kong et al., 2015), переключение идентичности строго коррелирует со сдвигом положения ядра. Положение ядра может, таким образом, служить важным диагностическим признаком и поддерживает представление о том, что удаление яйцеклеток вызывает сдвиг идентичности в синергидах.
Микроинъекция клеток FG
Описанные механизмы предполагают жизненно важную связь между отдельными клетками FG. Как осуществляется обмен информацией? Одним из важных достижений на пути к ответу на этот вопрос стало создание протокола для микроинъекции клеток FG.Этот метод был первоначально разработан для Torenia fournieri с целью изучения симпластической связи как одного считывающего устройства для межклеточной коммуникации (Cantrill et al., 1999). Han et al. (2000) микроинъектировали центральную клетку трассером на основе фторфора различной молекулярной массы и впоследствии отслеживали их судьбу. Они обнаружили, что ФГ симпластически изолирована от окружающей спорофитной ткани. Перемещение флуоресцирующих молекул в яйцеклетку зависит от их размера (максимум 10 кДа) и стадии развития зародышевого мешка.После начальной пермиссивной фазы движение молекул между центральной клеткой и яйцеклеткой значительно уменьшилось после цветения, в то время как симпластическая связь между центральной и синергидной клеткой сохранялась. Знание о симпластической коммуникации между женскими гаметофитными клетками, кроме того, открыло дверь для включения чужеродных веществ в те клетки, которые не поддаются микроинъекции, такие как яйцеклетка и синергидная клетка. Путем микроинъекции в центральную клетку T.fournieri с морфолиноантисмысловыми олигонуклеотидами, меченными флуоресцеинизотиоцианатом, Okuda et al. (2009) смогли подавить активность пептидов LURE в синергиях, что привело к нарушению направления пыльцевых трубок. Совсем недавно этот метод был адаптирован к модельному растению Arabidopsis, и инъекция предшественника этилена 1-аминоциклопропан-1-карбоновой кислоты в центральную клетку неоплодотворенных ФГ вызвала распад синергидного ядра (Völz et al., 2013) . Несмотря на свои преимущества, проблема микроинъекций состоит в том, чтобы вводить вещества при минимальном значительном повреждении клеток.Только до сих пор можно было успешно провести микроинъекцию в большую центральную клетку. Микроинъекции флуоресцирующих индикаторов и биоактивных веществ имеют большие перспективы на будущее, и было бы очень желательно разработать протоколы, которые позволят добавлять или удалять целые ядра. Такие методы хорошо зарекомендовали себя в системах животных и несут большой потенциал как для фундаментальных, так и для прикладных исследований.
Транскриптомное профилирование клеток FG
Многоклеточный FG глубоко внедряется в яйцеклетку, защищенную материнскими покровами, что затрудняет изоляцию транскриптомов FG.Одной из элегантных стратегий, которая использовалась для обхода этой проблемы, является использование мутантов, которые не могут образовывать FG (Pagnussat et al., 2005; Johnston et al., 2007; Jones-Rhoades et al., 2007; Steffen et al. , 2007). Хотя такое дифференциальное профилирование транскриптов яйцеклеток дикого типа по сравнению с мутантными яйцеклетками успешно идентифицировало множество генов, играющих важную роль в развитии и функции FG, необходимо было разработать дополнительные методы, чтобы получить доступ к транскриптомам отдельных клеток FG.
Одним из первых технологических прорывов было создание протокола, который позволяет вручную изолировать отдельные клетки FG (Kranz and Dresselhaus, 1996).Метод включает частичное переваривание клеточного матрикса ферментами, разрушающими клеточную стенку, что, однако, может влиять на транскрипционный ландшафт изолированных клеток (Dresselhaus et al., 1994; Wei and Sun, 2002). С использованием этого мощного подхода стало возможным идентифицировать несколько репродуктивно важных игроков (Marton et al., 2005; Okuda et al., 2009; Sprunck et al., 2012). Этот метод особенно сложен для гаметофитов Arabidopsis из-за небольшого размера клеток.В свете этих физических ограничений лазерная микродиссекция (LAM) стала ценным инструментом (Gautam and Sarkar, 2015). Этот метод использует лазерный луч для вырезания отдельных срезов клеток, приготовленных из срезов микротома определенных тканей растений (Schmid et al., 2015). Хотя этот метод более подвержен загрязнению, он позволил определить транскрипционные ландшафты всего гаметофита Arabidopsis, а также отдельные клеточные транскриптомы для яйца, синергии и центральной клетки (Day et al., 2005). В сочетании со строгими биоинформатическими алгоритмами и данными микрочипов, этот подход идентифицировал несколько сотен генов, которые должны быть обогащены FG, и подтвердил экспрессию FG генов, ранее участвовавших в развитии эмбрионального мешка (Wuest et al., 2010).
Данные микрочипа ограничены, поскольку они обнаруживают только гены, представленные на чипе. Это ограничение преодолевается методами секвенирования следующего поколения. Фактически, повторное исследование центральных клеток арабидопсиса, сочетающее LAM и RNA-seq, улучшило чувствительность и разрешение, так что количество идентифицированных экспрессируемых генов могло быть удвоено (Schmid et al., 2012). Использование RNA-seq имеет и другие важные преимущества. Во-первых, он не ограничен заранее определенным набором генов, что позволяет идентифицировать непредсказуемые транскрипты, включая варианты сплайсинга пре-мРНК. Во-вторых, это открывает возможность изучения растений, которые ранее считались немодельными организмами. Одним из примеров является Boechera gunnisoniana , который тесно связан с Arabidopsis, но демонстрирует отчетливый апомиктический способ размножения. Сравнение этих двух видов может способствовать поиску генетических факторов, связанных с бесполым размножением.Фактически, сравнение транскриптомов между транскриптомами яиц, центральных клеток и синергидных клеток Boechera и Arabidopsis выявило несколько дифференциально экспрессируемых генов (Wuest et al., 2010; Schmidt et al., 2014; Florez Rueda et al., 2016). Основным недостатком LAM является трудоемкий процесс приготовления и выделения и связанный с этим низкий выход. Это можно преодолеть либо с помощью INTACT, изолирования ядер, помеченных в определенных типах клеток (Deal and Henikoff, 2010, 2011; Wuest et al., 2010), либо с помощью активируемых флуоресценцией клеток или сортировки ядер (Schmid et al., 2015). Оба метода позволяют выделить определенные профили транскриптов практически во всех типах клеток, для которых доступны определенные промоторы. Кроме того, эти методы могут быть особенно привлекательными, когда речь идет о более высоком временном разрешении профилей продолжительности жизни отдельных клеток. Первоначально предполагалось, что точный предел обнаружения INTACT составляет от 1% до 10% помеченных клеток в суспензии. Однако недавняя адаптация может показать, что крайне редкие церебральные клетки могут быть отобраны из суспензии мозга дрозофилы, что дает уровень обнаружения <0.1% (Генри и др., 2012). До сих пор было неясно, будет ли INTACT применим к отдельным клеткам ФГ.
Молекулярный маркер для динамической визуализации формирования FG-паттерна
Для визуализации молекулярных профилей отдельных женских гаметофитных клеток с помощью световой и флуоресцентной микроскопии конструкции промотор-репортер представляют собой мощный и универсальный инструмент. Маркер GUS с ядерной мишенью (Kägi and Groß-Hardt, 2010) может анализировать пространственное разрешение экспрессии генов, в то время как флуоресцентные репортеры позволяют визуализировать жизнь образцов в реальном времени, обеспечивая динамический профиль исследуемых процессов.
В последние десятилетия были идентифицированы репортеры компонентов цитоскелета (Dyachok et al., 2014), центромеры и специфичные для клеточного типа репортеры для всех типов FG (Kasahara et al., 2005; Pagnussat et al. , 2005; W. Yang et al., 2005; Portereiko et al., 2006; H. Yang et al., 2006; Groß-Hardt et al., 2007; Steffen et al., 2007; Ingouff et al., 2009 ; Wang et al., 2010; Adachi et al., 2011). Кроме того, было установлено несколько комбинаторных маркерных генов, объединяющих молекулярный репортер для синергид, яйцеклеток и центральной клетки или всех четырех клеток FG на одной плазмиде (Lawit et al., 2013; Völz et al., 2013). Примечательно, что эти молекулярные маркеры представляют собой только снимки клеточной жизни, и в большинстве случаев нам не хватает информации о точном появлении репортерных генов на шкале продолжительности жизни клетки. Чтобы контролировать клетки в «медленном движении», нам все еще необходимо повышать временное разрешение путем определения транскрипционного ландшафта клеток FG на последовательных стадиях.
ЗАКЛЮЧЕНИЕ
Стало очевидно, что дифференцировка клеток и формирование паттерна зародышевой линии регулируются сложным взаимодействием гаметофитных и спорофитных факторов и стабилизируются за счет сложных механизмов межклеточной коммуникации.Однако до сих пор невозможно вывести общую тему, которая объединяет текущие результаты или объясняет организованное формирование отдельных типов клеток. Одно из возможных объяснений состоит в том, что важные ключевые игроки подвергаются избыточному регулированию и ждут открытия, которое, как мы надеемся, будет облегчено в будущем благодаря появлению CRISPR-Cas9 и эксплуатации новых модельных заводов. Кроме того, замечательная способность всех клеток FG в основном быть способными принимать любую другую идентичность клеток FG усложняет интерпретацию мутантных фенотипов.В случае дополнительных клеток эта пластичность интерпретируется как резервный механизм (Groß-Hardt et al., 2007), который может увеличивать надежность системы (Lituiev et al., 2013).
Доступность репродуктивных тканей останется проблемой, для решения которой потребуются оригинальные концепции и инновационные методы, способствующие прогрессу в этой важной с агрономической точки зрения области.
БЛАГОДАРНОСТИ
Мы благодарны DFG и Фонду Volkswagen за финансовую поддержку.
Глоссарий
-
PCD
-
FG
-
RKD
-
LAM
Лазерная микродиссекция
LITERATURE CITED
Adachi
S
,Minamisawa
K
,Okushima
Y
,Inagaki
S
,Yoshiyama
K
, 000000
Kondou
K
,000
Kondou
КавасимаM
,Toyoda
T
,Matsui
M
и др.(2011
)Запрограммированная индукция эндоредупликации двухцепочечными разрывами ДНК у Arabidopsis
.Proc Natl Acad Sci USA
108
:10004
—10009
Cantrill
LC
,Общий
RL
,Goodwin
PB
(1999
)Межклеточная связь через эндомембраны растений
.Cell Biol Int
23
:653
—661
Ceccato
L
,Masiero
S
,Sinha Roy
D
,Bencivenga
S
,Roig-Villanova
I
,Dit
,Simon
R
,Colombo
L
(2013
)Материнский контроль PIN1 необходим для развития женского гаметофита у Arabidopsis
.PLoS One
8
:e66148
Day
RC
,Grossniklaus
U
,Macknight
RC
(2005
)Будьте конкретнее! Лазерная микродиссекция растительных клеток
.Trends Plant Sci
10
:397
—406
Deal
RB
,Henikoff
S
(2010
)Простой метод экспрессии генов и профилирования хроматина отдельных типов клеток в ткани
.Dev Cell
18
:1030
—1040
Deal
RB
,Henikoff
S
(2011
)Метод INTACT для клеточной экспрессии генов и профилирования хроматина у Arabidopsis thaliana
.Nat Protoc
6
:56
—68
Dresselhaus
T
,Lorz
H
,Kranz
E
(1994
)Репрезентативные библиотеки кДНК из нескольких растительных клеток
.Завод J
5
:605
—610
Dyachok
J
,Sparks
JA
,Liao
F
,Wang
YS
,Blancaflor
EB
0003 на основе белка Fluoreskeleton
9000 actos в живых растительных клетках: вариант флуорофора, актин-связывающий домен и промоторы .Цитоскелет
71
:311
—327
Ebel
C
,Mariconti
L
,Gruissem
W
(2004
)Гомологи ретинобластомы растений контролируют ядерную пролиферацию в женском гаметофите
.Природа
429
:776
—780
Evans
MM
(2007
)Неопределенный ген гаметофита1 кукурузы кодирует белок LOB-домена, необходимый для развития зародышевого мешка и листа
.Растительная ячейка
19
:46
—62
Florez Rueda
AM
,Grossniklaus
U
,Schmidt
A
(2016
)Лазерная микродиссекция (LAM) как инструмент для транскрипционного профилирования отдельных клеток
.J Vis Exp
111
:e53916
Gautam
V
,Sarkar
AK
(2015
)Лазерная микродиссекция, эффективный метод для понимания паттернов тканеспецифической экспрессии генов и функциональной геномики растений
.Mol Biotechnol
57
:299
—308
Groß-Hardt
R
,Kägi
C
,Baumann
N
,Moore
JM
,Baskar
R
,Gagliano
000 Gagliano
000 ,
Grossniklaus
U
(2007
)LACHESIS ограничивает судьбу гаметических клеток в женском гаметофите Arabidopsis
.PLoS Biol
5
:e47
Guo
F
,Huang
B-Q
,Han
Y
,Zee
S-Y
(2004
)Оплодотворение индетерминантного гаметофита кукурузы 1.
Протоплазма
223
:111
—120
Han
YZ
,Huang
BQ
,Zee
SY
,Yuan
M
(2000
)Симпластическая связь между центральной клеткой и клетками яйцевого аппарата эмбриона Torenia fournieri Lind.до и во время оплодотворения
.Планта
211
:158
—162
Hejátko
J
,Pernisová
M
,Eneva
T
,Palme
K
,Brzobohatý
B
() датчик используется в 2003 г. Развитие женского гаметофита у Arabidopsis
.Mol Genet Genomics
269
:443
—453
Генри
GL
,Дэвис
FP
,Пикард
S
,Эдди
SR
(2012
)Геномика нейронов дрозофилы
, специфичная для типов клеток.Нуклеиновые кислоты Res
40
:9691
—9704
Heydlauff
J
,Groß-Hardt
R
(2014
)Любовь — это поле битвы: запрограммированная гибель клеток во время оплодотворения
.J Exp Bot
65
:1323
—1330
Higashiyama
T
,Yabe
S
,Sasaki
N
,Nishimura
Y
,Miyagishima
S
000 000 Kuroiwa20002001
)Привлечение пыльцевой трубки синергидной клеткой
.Наука
293
:1480
—1483
Hwang
I
,Sheen
J
(2001
)Двухкомпонентная схема в трансдукции цитокининового сигнала Arabidopsis
.Природа
413
:383
—389
Ingouff
M
,Sakata
T
,Li
J
,Sprunck
S
,Dresselhaus
T
two,Berger
F
F мужские гаметы обладают одинаковой способностью оплодотворять яйцеклетку у Arabidopsis thaliana
.Curr Biol
19
:R19
—R20
Johnston
AJ
,Meier
P
,Gheyselinck
J
,Wuest
SE
,Federer
M
,Becker 9000
000
Schlagenhauf
,Schlagenhauf
Grossniklaus
U
(2007
)Генетическое вычитание профилей идентифицирует гены, необходимые для воспроизводства Arabidopsis, и выявляет взаимодействие между женским гаметофитом и материнским спорофитом
.Genome Biol
8
:1
—21
Jones-Rhoades
MW
,Borevitz
JO
,Preuss
D
(2007
)Профилирование экспрессии гаметофитов Arabidopsis по всему геному, женских гаметофитов,
секретируемых семейств женских гаметофитов.PLoS Genet
3
:e171
Kägi
C
,Baumann
N
,Nielsen
N
,Stierhof
YD
,Groß-Hardt
определяетR
cell (центральная ячейка
2010). Срок службы соседних дополнительных ячеек
.Proc Natl Acad Sci USA
107
:22350
—22355
Kägi
C
,Groß-Hardt
R
(2010
)Анализ развития и функции женского гаметофита: Существует несколько способов расколоть яйцо
.евро J Cell Biol
89
:258
—261
Kakimoto
T
(1996
)CKI1, гомолог гистидинкиназы, участвующий в передаче сигнала цитокинина
.Наука
274
:982
—985
Kasahara
RD
,Portereiko
MF
,Sandaklie-Nikolova
L
,Rabiger
DS
,Drews
GN
2005 требуется трубка для пыльцы и дифференцировка синергидных клеток у Arabidopsis .Заводская ячейка
17
:2981
—2992
Кириухова
O
,Johnston
AJ
,Kleen
D
,Kägi
C
,Baskar
R
,
Moore
Moore
Groß-Hardt
R
,Grossniklaus
U
(2011
)Спецификация женских гаметофитных клеток и развитие семян требуют функции предполагаемого ортолога Arabidopsis INCENP WYRD
.Девелопмент
138
:3409
—3420
Koi
S
,Hisanaga
T
,Sato
K
,Shimamura
M
,Yamato Katsuyuki
T
, Ishizaki 000
Ishizaki
Накадзима
K
(2016
)Эволюционно законсервированный растительный фактор RKD контролирует дифференцировку зародышевых клеток
.Curr Biol
26
:1775
—1781
Kong
J
,Lau
S
,Jürgens
G
(2015
)Растения-близнецы из сверхкомплектных яйцеклеток Arabidopsis
.Curr Biol
25
:225
—230
Koszegi
D
,Johnston
AJ
,Rutten
T
,Czihal
A
,Altschmied
L
,
Kumlehn
КириуховаO
,Gheyselinck
J
,Grossniklaus
U
и др.(2011
)Члены семейства факторов транскрипции RKD индуцируют программу экспрессии генов, подобную яйцеклетке
.Завод J
67
:280
—291
Kranz
E
,Dresselhaus
T
(1996
)Оплодотворение in vitro изолированными гаметами высших растений
.Trends Plant Sci
1
:82
—89
Krohn
NG
,Lausser
A
,Juranić
M
,Dresselhaus
T
(2012
)Передача сигналов о судьбе яичных клеток против Zpodal1 секретируемого пептида
.Dev Cell
23
:219
—225
Lawit
SJ
,Chamberlin
MA
,Agee
A
,Caswell
ES
,Albertsen
MC
(2013
трансгенных клеточных манипуляций)-тип-специфические флуоресцентные маркеры: мечение клеток, удаление клеток и придаточные эмбрионы
.Завод Репрод
26
:125
—137
Lin
B-Y
(1978
)Структурные модификации женского гаметофита, ассоциированные с мутантом неопределенного гаметофита (ig) кукурузы
.Банка J Genet Cytol
20
:249
—257
Литуев
DS
,Grossniklaus
U
(2014
)Паттернирование женского гаметофита покрытосеменных через призму теоретических парадигм
.Biochem Soc Trans
42
:332
—339
Литуев
DS
,Krohn
NG
,Müller
B
,Jackson
D
,Hellriegel
B
, Dresselhaus2013
)Теоретические и экспериментальные данные указывают на отсутствие поддающегося обнаружению градиента ауксина в женском гаметофите покрытосеменных
.Развитие
140
:4544
—4553
Martin
MV
,Fiol
DF
,Sundaresan
V
,Zabaleta
EJ
,Pagnussat
GC
(
2013 9000a митохондриальная марганец-супероксиддисмутаза, выявляет решающую роль активных форм кислорода во время развития зародышевого мешка и оплодотворения у Arabidopsis
.Заводская ячейка
25
:1573
—1591
Marton
ML
,Шнуры
S
,Broadhvest
J
,Dresselhaus
T
(2005
)Направляющая трубка для пыльцы из микропилара с помощью устройства для направления
кукурузы.Наука
307
:573
—576
Matias-Hernandez
L
,Battaglia
R
,Galbiati
F
,Rubes
M
,Eichenberger
C
,Gaterger
C
,
Gateria ,
Colombo
L
(2010
)VERDANDI является прямой мишенью комплекса идентичности яйцеклетки MADS-домена и влияет на дифференцировку эмбрионального мешка у Arabidopsis
.Растительная ячейка
22
:1702
—1715
Moll
C
,von Lyncker
L
,Zimmermann
S
,Kägi
C
,Baumann
N
,000 Gross
000 UR ,
Twell
Groß-Hardt
R
(2008
)CLO / GFA1 и ATO — новые регуляторы судьбы гаметических клеток у растений
.Завод J
56
:913
—921
Окуда
S
,Tsutsui
H
,Shiina
K
,Sprunck
S
,Takeuchi
H
,000 RAD
ha ha ha ha HamamuraY
,Mizukami
A
,Susaki
D
и др.(2009
)Дефенсин-подобный полипептид LUREs представляют собой аттрактанты пыльцевых трубок, секретируемые синергидными клетками
.Природа
458
:357
—361
Pagnussat
GC
,Alandete-Saez
M
,Bowman
JL
,Sundaresan
V
(2009
)Auxteopsis 9000.
Наука
324
:1684
—1689
Pagnussat
GC
,Yu
HJ
,Ngo
QA
,Rajani
S
,Mayalagu
S
,Johnson
CS
Xie
LF
,Ye
D
,Sundaresan
V
(2005
)Генетическая и молекулярная идентификация генов, необходимых для развития и функционирования женских гаметофитов у Arabidopsis
.Девелопмент
132
:603
—614
Pagnussat
GC
,Yu
HJ
,Sundaresan
V
(2007
)Переключение клеточной судьбы синергида на яйцеклетку у мутантных эмбриональных мешочков Arabidopsis с экспрессией BEL, подобных мутанту BEL, возникает из мешочков мутанта BEL. ген гомеодомена BLh2
.Растительная ячейка
19
:3578
—3592
Panoli
A
,Martin
MV
,Alandete-Saez
M
,Simon
M
,Neff
C
,0003
IDO
Swarup
Swarup
,
Yuan
L
,Pagnussat
GC
,Sundaresan
V
(2015
)Импорт ауксина и локальный биосинтез ауксина необходимы для митотических делений, размножения клеток и развития клеток у самок. Arabidopsis thaliana
.PLoS One
10
:e0126164
Pischke
MS
,Jones
LG
,Otsuga
D
,Fernandez
DE
,Drews
GN
, 000 000 000 Arabid гистидинкиназа необходима для мегагаметогенеза .Proc Natl Acad Sci USA
99
:15800
—15805
Portereiko
MF
,Lloyd
A
,Steffen
JG
,Punwani
JA
,Otsuga
D
Drew
Drew
необходим для развития центральных клеток и эндосперма Arabidopsis
.Растительная ячейка
18
:1862
—1872
Punwani
JA
,Rabiger
DS
,Drews
GN
(2007
)MYB98 положительно регулирует батарею экспрессируемых синергидом генов, кодирующих локализованные белки нитевидного аппарата
.Растительная ячейка
19
:2557
—2568
Rabiger
DS
,Drews
GN
(2013
)MYB64 и MYB119 необходимы для клеточности и дифференцировки во время женского гаметогенеза у Arabidopsis thaliana
.PLoS Genet
9
:e1003783
Rövekamp
M
,Bowman
JL
,Grossniklaus
U
(2016
)Marchantia MpRKD регулирует переход гаметофит-спорофит
в отсутствие оплодотворения яйцеклеток в покое.Curr Biol
26
:1782
—1789
Schmid
MW
,Schmidt
A
,Grossniklaus
U
(2015
)Женский гаметофит: новая модель для системной биологии конкретных типов клеток в развитии растений
.Фронтальный завод Sci
6
:907
Schmid
MW
,Schmidt
A
,Klostermeier
UC
,Barann
M
,Rosenstiel
P
000000
000
000000
000000 Grossnik метод транскрипционного профилирования определенных типов клеток у эукариот: лазерная микродиссекция и секвенирование РНК
.PLoS One
7
:e29685
Schmidt
A
,Schmid
MW
,Klostermeier
UC
,Qi
WH
,Guthorl
D
,9000
Sailer Rosenstiel
P
,Grossniklaus
U
(2014
)Апомиктическое и половое развитие зародышевой линии различается в отношении клеточного цикла, транскрипционной, гормональной и эпигенетической регуляции
.PLoS Genet
10
:e1004476
Song
X
,Yuan
L
,Sundaresan
V
(2014
)Антиподальные клетки сохраняются в результате оплодотворения в женском гаметофите Arabidopsis
.Завод Репрод
27
:197
—203
Sprunck
S
,Groß-Hardt
R
(2011
)Ядерное поведение, полярность клеток и спецификация клеток в женском гаметофите
.Репродукция полового растения
24
:123
—136
Sprunck
S
,Rademacher
S
,Vogler
F
,Gheyselinck
J
,Grossniklaus
000 U
000 000 000 000 000 Dresselinck -секретированный EC1 запускает активацию сперматозоидов во время двойного оплодотворения .Наука
338
:1093
—1097
Steffen
JG
,Kang
IH
,Macfarlane
J
,Drews
GN
(2007
)Идентификация генов
самок Arabtophyidteopsis.Завод J
51
:281
—292
Steffen
JG
,Kang
IH
,Portereiko
MF
,Lloyd
A
,Drews
GN
(1L
) требуется для AG
GN
(для1L
требуется взаимодействие с AGM
L) развитие клеток Arabidopsis
.Plant Physiol
148
:259
—268
Susaki
D
,Takeuchi
H
,Tsutsui
H
,Kurihara
D
,Higashiyama
T
(2015
визуализация в реальном времени и лазерное разрушение)
2015 9000 межклеточная коммуникация во время развития женского гаметофита Torenia fournieri
.Физиология растительных клеток
56
:1031
—1041
Suzuki
T
,Miwa
K
,Ishikawa
K
,Yamada
H
,Aiba
H
,000 Mizuno
000 000 000 Arabis сенсорная His-киназа, AHk4, может реагировать на цитокинины .Физиология растительных клеток
42
:107
—113
van den Berg
C
,Willemsen
V
,Hage
W
,Weisbeek
P
,Scheres
B
(0002 1995
) определяется сигнализацией направления .Природа
378
:62
—65
Völz
R
,Heydlauff
J
,Ripper
D
,von Lyncker
L
,Groß-Hardt
R
требуется для сигнала
Syner 2013 (требуется сигнал syner ) дегенерация и образование блока пыльцевой трубки .Dev Cell
25
:310
—316
Völz
R
,von Lyncker
L
,Baumann
N
,Dresselhaus
T
,Sprunck
S
, 000 000 000 000 Groß3LACHESIS-зависимая передача сигналов яйцеклетки регулирует развитие женских гаметофитных клеток
.Девелопмент
139
:498
—502
Wang
D
,Zhang
CQ
,Hearn
DJ
,Kang
IH
,Punwani
9000 MI2 JA ,
Skaggs
SchumakerKS
,Yadegari
R
(2010
)Идентификация генов транскрипционных факторов, экспрессируемых в женском гаметофите Arabidopsis
.БМК Завод Биол
10
:110
Wei
J
,Sun
MX
(2002
)Выделение зародышевого мешка Arabidopsis thaliana: простой и эффективный метод анализа структуры и отбора мутантов
.Отчет Plant Mol Biol
20
:141
—148
Wu
JJ
,Peng
XB
,Li
WW
,He
R
,Xin
HP
,Sun
MX3
(
) дисфункция выявляет реципрокную передачу сигналов от клетки к клетке во время созревания женских гамет Arabidopsis .
Dev Cell
23
:1043
–1058
Wuest
SE
,Vijverberg
K
,Schmidt
A
,Weiss
M
,Gheyselinck
J
000 9000 9000Lohr 9000 M Раненфюрер
J
,фон Меринг
C
,Grossniklaus
U
(2010
)Карта экспрессии гена женского гаметофита арабидопсиса показывает сходство между гаметами растений и животных
.Curr Biol
20
:506
—512
Ямада
H
,Сузуки
Т
,Терада
К
,Такеи
К
,Исикава
К
,Ишикава
К
,Яма
000
Мива
Мива
Mizuno
T
(2001
)Гистидинкиназа Arabidopsis AHK4 представляет собой цитокинин-связывающий рецептор, который передает сигналы цитокинина через мембрану
.Физиология растительных клеток
42
:1017
—1023
Yang
H
,Kaur
N
,Kiriakopolos
S
,McCormick
S
(2006
)Генерация EST и анализ генотипов Ze000, специфичных для женских особей
. .Планта
224
:1004
—1014
Ян
W
,Jefferson
RA
,Huttner
E
,Moore
JM
,Gagliano
WB
, 9000 9000 9000 9000000
9000000
000
000
9000 9000 9000аппаратно-специфический энхансер Arabidopsis, идентифицированный с помощью детекции энхансера
.Plant Physiol
139
:1421
—1432
юаней
L
,Liu
Z
,Song
X
,Johnson
C
,Yu
X
,Sundaresan
V
гистидинкиназа определяет женский гаметический предшественник эндосперма
.Dev Cell
37
:34
—46
Заметки автора
© 2017 Американское общество биологов растений.Все права защищены.
© Автор (ы) 2017. Опубликовано Oxford University Press от имени Американского общества биологов растений. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (https://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа правильно процитировано.
32.2D: Двойное удобрение растений
-
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Двойное оплодотворение
Покрытосеменные подвергаются двум событиям оплодотворения, при которых образуются зигота и эндосперм.
Задачи обучения
- Описать процесс двойного оплодотворения растений
Ключевые моменты
- В двойном оплодотворении участвуют две сперматозоиды; один оплодотворяет яйцеклетку, чтобы сформировать зиготу, а другой сливается с двумя полярными ядрами, которые образуют эндосперм.
- После оплодотворения оплодотворенная семяпочка образует семя, а ткани завязи становятся плодом.
- На первой стадии эмбрионального развития зигота делится с образованием двух клеток; один разовьется в суспензор, а другой — в проэмбрион.
- На второй стадии эмбрионального развития (у эвдикотов) развивающийся эмбрион имеет форму сердца из-за наличия семядолей.
- По мере роста зародыш начинает изгибаться, наполняя семя; на этом этапе семена готовы к распространению.
Ключевые термины
- двойное оплодотворение : сложный механизм оплодотворения, развившийся у цветковых растений; включает соединение женского гаметофита с двумя мужскими гаметами (спермой)
- суспензор : обнаружен в зиготах растений покрытосеменных; соединяет эндосперм с зародышем и обеспечивает путь питания от материнского растения к растущему эмбриону
- proembryo : скопление клеток в семяпочке оплодотворенного цветкового растения, которое еще не сформировалось в зародыш
Двойное оплодотворение
После того, как пыльца откладывается на рыльце, она должна прорасти и прорасти через столбик, чтобы достичь семяпочки.Микроспоры, или пыльца, содержат две клетки: клетку пыльцевой трубки и генеративную клетку. Клетка пыльцевой трубки превращается в пыльцевую трубку, по которой проходит генеративная клетка. Для прорастания пыльцевой трубки необходимы вода, кислород и определенные химические сигналы. По мере того, как пыльцевая трубка проходит через стиль, чтобы достичь зародышевого мешка, рост пыльцевой трубки поддерживается тканями этого стиля. Во время этого процесса, если генеративная клетка еще не разделилась на две клетки, теперь она делится с образованием двух сперматозоидов.Пыльцевая трубка направляется химическими веществами, выделяемыми синергиями, присутствующими в зародышевом мешке; он входит в семяпочек через микропиле. Из двух сперматозоидов один сперматозоид оплодотворяет яйцеклетку, образуя диплоидную зиготу; другой сперматозоид сливается с двумя полярными ядрами, образуя триплоидную клетку, которая развивается в эндосперм. Вместе эти два события оплодотворения у покрытосеменных известны как двойное оплодотворение. После завершения оплодотворения никакие другие сперматозоиды не могут проникнуть внутрь. Оплодотворенная семяпочка образует семя, а ткани завязи становятся плодом, обычно обволакивая семя.
Рисунок \ (\ PageIndex {1} \): Двойное оплодотворение : У покрытосеменных один сперматозоид оплодотворяет яйцеклетку с образованием зиготы 2n, в то время как другой сперматозоид сливается с двумя полярными ядрами, образуя эндосперм 3n. Это называется двойным оплодотворением.После оплодотворения начинается эмбриональное развитие. Зигота делится на две клетки: верхнюю (терминальную) и нижнюю (базальную). Деление базальной клетки приводит к суспензору, который в конечном итоге соединяется с материнской тканью.Суспензор обеспечивает транспортировку питания от материнского растения к растущему эмбриону. Терминальная клетка также делится, давая начало шаровидному проэмбриону. У двудольных (eudicots) развивающийся зародыш имеет форму сердца из-за наличия двух рудиментарных семядолей. У неэндоспермных двудольных растений, таких как Capsella bursa , эндосперм сначала развивается, но затем переваривается. В этом случае запасы корма перемещаются в две семядоли. По мере увеличения зародыша и семядолей они скапливаются внутри развивающегося семени и вынуждены сгибаться.В конце концов, зародыш и семядоли заполняют семя, после чего семя готово к распространению. Эмбриональное развитие приостанавливается через некоторое время; рост возобновляется только тогда, когда семена прорастают. Развивающийся саженец будет полагаться на запасы пищи, хранящиеся в семядолях, до тех пор, пока первый набор листьев не начнет фотосинтез.
Рисунок \ (\ PageIndex {1} \): Развитие эмбриона : Показаны стадии развития эмбриона в яйцеклетке пастушьей сумки ( Capsella bursa ).После оплодотворения зигота делится, образуя верхнюю терминальную клетку и нижнюю базальную клетку. (а) На первой стадии развития терминальная клетка делится, образуя глобулярный проэмбрион.