общие сведения. Физические и химические свойства
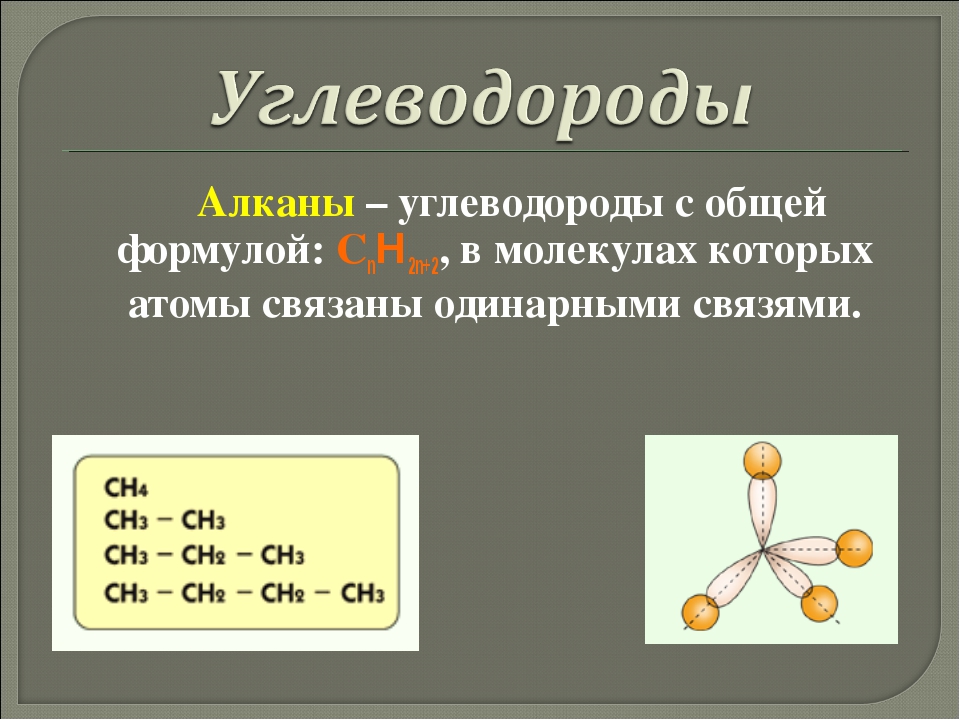
Алканы с химической точки зрения представляют собой углеводороды, то есть общая формула алканов включает в себя исключительно атомы углерода и водорода. Помимо того, что эти соединения не содержат никаких функциональных групп, они образуются только за счет одинарных связей. Такие углеводороды называются насыщенными.
Типы алканов
Все алканы можно выделить в две большие группы:
- Алифатические соединения. Их структура имеет вид линейной цепочки, общая формула алканов алифатического типа CnH2n+2, где n — количество атомов углерода в цепи.
- Циклоалканы. Эти соединения имеют циклическую структуру, что обуславливает существенное отличие их химических свойств от линейных соединений. В частности, структурная формула алканов этого типа обуславливает сходство их свойств с алкинами, то есть углеводородами с тройной связью между атомами углерода.
Электронная структура алифатических соединений
Эта группа алканов может иметь либо линейную, либо разветвленную углеводородную цепь.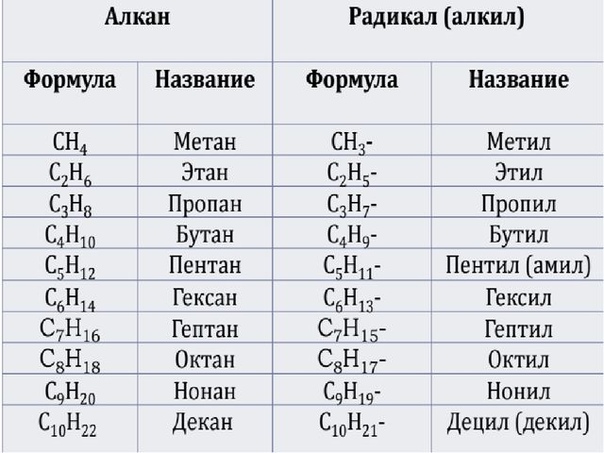 Их химическая активность является невысокой по сравнению с другими органическими соединениями, поскольку все связи внутри молекулы являются насыщенными.
Их химическая активность является невысокой по сравнению с другими органическими соединениями, поскольку все связи внутри молекулы являются насыщенными.
Молекулярная формула алканов алифатического типа говорит о том, что их химическая связь имеет sp3-гибридизацию. Это означает, что все четыре ковалентные связи вокруг атома углерода по своим характеристикам (геометрическим и энергетическим) являются абсолютно равноправными. При таком типе гибридизации электронные оболочки уровней s и p атомов углерода имеют одинаковую форму вытянутой гантели.
Между атомами углерода связь в цепи является ковалентной, а между атомом углерода и водорода она частично поляризована, при этом электронная плотность оттягивается к углероду, как к элементу более электроотрицательному.
Из общей формулы алканов следует, что в их молекулах существуют только связи C-C и C-H. Первые образуются в результате перекрывания двух электронных гибридизованных орбиталей sp3 двух атомов углерода, а вторые образуются при перекрывании орбитали s водорода и орбитали sp3 углерода.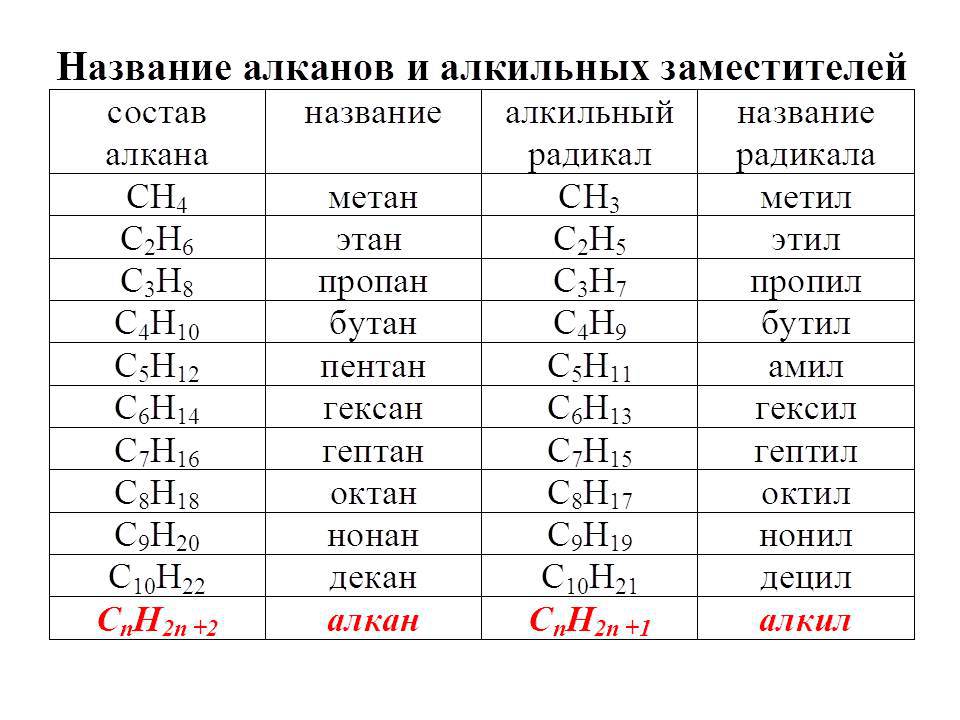 Длина связи C-C равна 1,54 ангстрема, а связи C-H — 1,09 ангстрема.
Длина связи C-C равна 1,54 ангстрема, а связи C-H — 1,09 ангстрема.
Геометрия молекулы метана
Метан является самым простым алканом, который состоит всего из одного атома углерода и четырех атомов водорода.
Благодаря энергетической равноправности его трех 2p и одной 2s орбиталей, полученной в результате sp3-гибридизации, все орбитали в пространстве расположены под одинаковым углом друг к другу. Он равен 109,47°. В результате такой молекулярной структуры в пространстве образуется подобие треугольной равносторонней пирамиды.
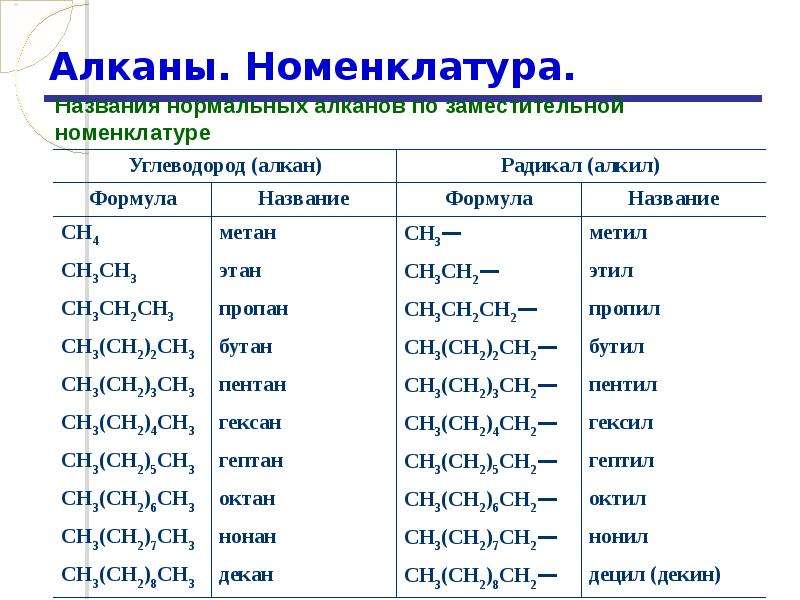
Простые алканы
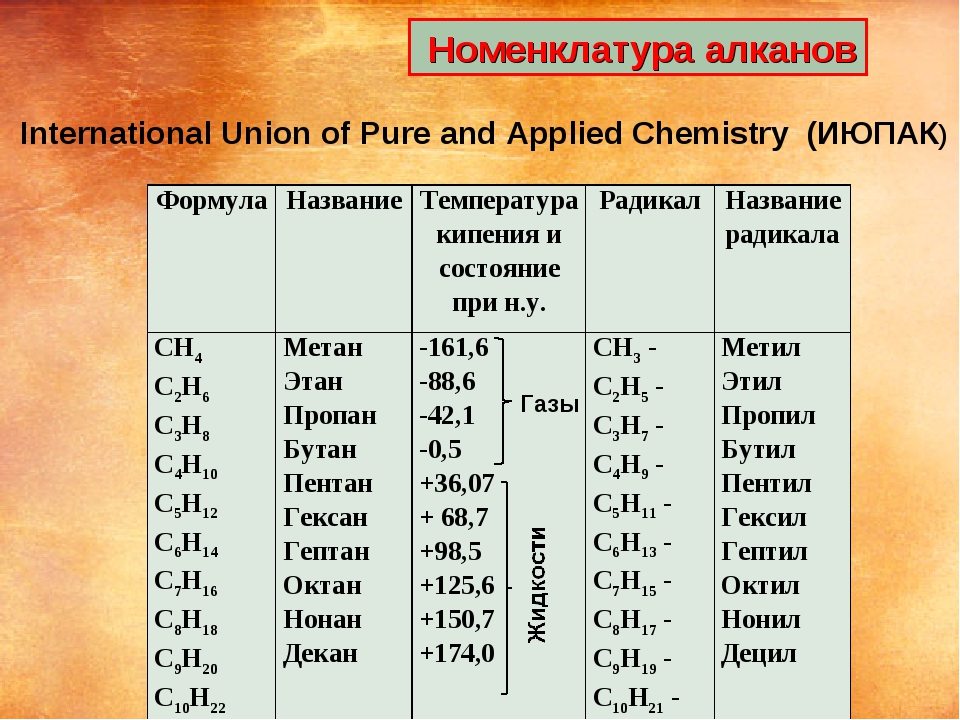
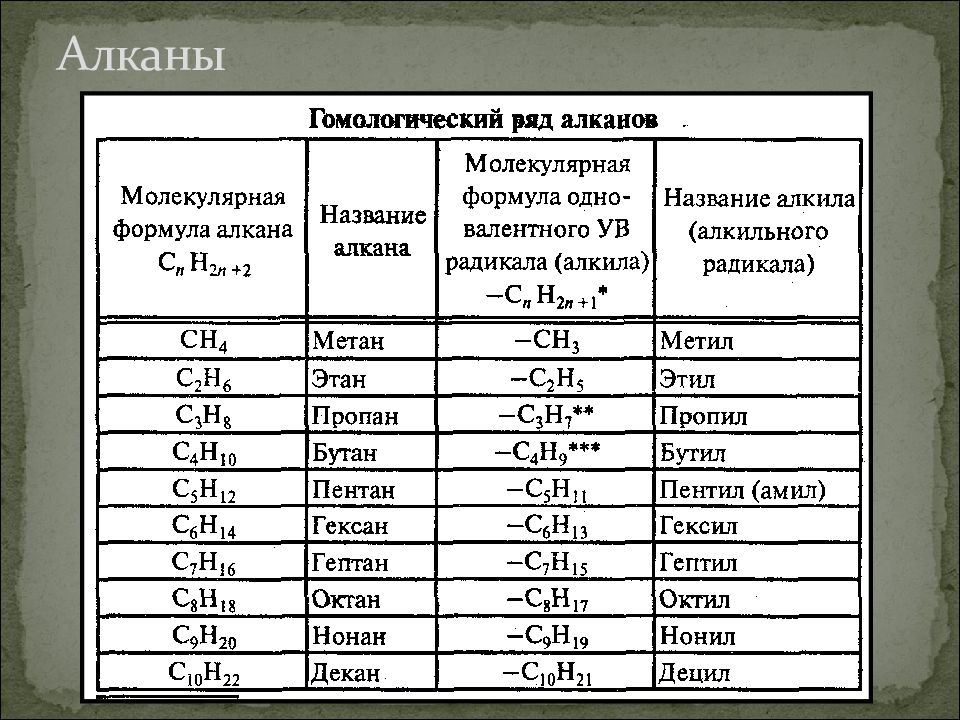
Самым простым алканом является метан, который состоит из одного атома углерода и четырех атомов водорода. Следующие в ряду алканов за метаном пропан, этан и бутан образованы тремя, двумя и четырьмя атомами углерода соответственно. Начиная с пяти атомов углерода в цепи, соединения получили название согласно номенклатуре ИЮПАК.
Таблица с формулами алканов и их названиями приведена ниже:
| Название | метан | этан | пропан | бутан | пентан | гексан | гептан | октан | нонан | декан |
| Формула | CH4 | C2H6 | C3H8 | C4H10 | C5H12 | C6H14 | C7H16 | C8H18 | C9H20 | C10H22 |
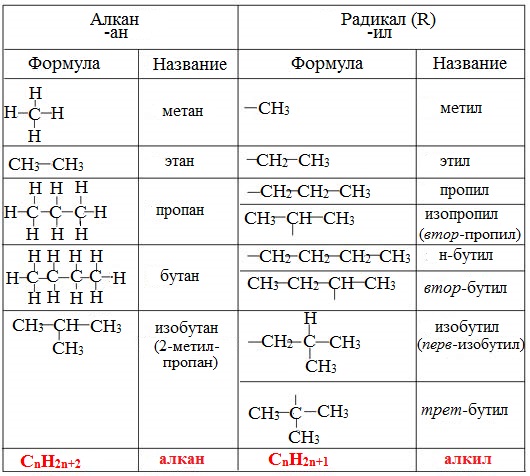
При потере одного водородного атома у молекулы алкана образуется активный радикал, окончание которого меняется с «ан» на «ил», например, этан C2H6 — этил C2H5. Структурная формула алкана этана приведена на фото.
Структурная формула алкана этана приведена на фото.
Номенклатура органических соединений
Правила определения названий алканов и соединений на их основе установлены международной номенклатурой ИЮПАК. Для органических соединений действуют следующие правила:
- Название химического соединения базируется на названии его самой длинной цепи из атомов углерода.
- Нумерацию атомов углерода следует начинать с конца, ближе к которому начинается разветвление цепи.
- Если в соединении присутствуют две или более углеродные цепи одинаковой длины, то в качестве основной выбирается та, которая имеет меньше всего радикалов, и они имеют более простую структуру.
- Если в молекуле имеются две и более одинаковые группы радикалов, тогда в названии соединения используются соответствующие префиксы, которые удваивают, утраивают и так далее названия указанных радикалов. Например, вместо выражения «3-метил-5-метил» используется «3,5-диметил».
- Все радикалы записываются в алфавитном порядке в общее название соединения, при этом префиксы не берутся во внимание.
 Последний радикал пишется слитно с названием самой цепи.
Последний радикал пишется слитно с названием самой цепи. - Числа, отражающие номера радикалов в цепи, отделяются от названий дефисом, а сами цифры записываются через запятую.
Соблюдение правил номенклатуры ИЮПАК позволяет легко определить молекулярную формулу алкана по названию вещества, например, 2,3-диметилбутан имеет следующий вид.
Физические свойства
Физические свойства алканов во многом зависят от длины углеродной цепи, образующей конкретное соединение. Основными свойствами являются следующие:
- Первые четыре представителя, согласно общей формуле алканов, при нормальных условиях находятся в газообразном состоянии, то есть это бутан, метан, пропан и этан. Что касается пентана и гексана, то они существуют уже в виде жидкостей, а начиная с семи атомов углерода, алканы представляют собой твердые вещества.
- При увеличении длины углеродной цепи увеличивается и плотность соединения, а также его температуры фазовых переходов первого рода, то есть температуры плавления и кипения.
- Поскольку полярность химической связи в формуле вещества алканов является незначительной, они не растворяются в полярных жидкостях, например, в воде.
- Соответственно их можно использовать в качестве хороших растворителей таких соединений, как неполярные жиры, масла и воски.
- В домашней газовой плите используется смесь алканов, богатая третьим членом химического ряда — пропаном.
- При кислородном горении алканов выделяется большое количество энергии в виде тепла, поэтому эти соединения используют в качестве горючего топлива.
Химические свойства
Ввиду наличия стабильных связей в молекулах алканов, их реакционная способность в сравнении с другими органическими соединениями является низкой.
С ионными и полярными химическими соединениями алканы практически не реагируют. Они ведут себя инертно в растворах кислот и оснований. Алканы вступают в реакцию только с кислородом и галогенами: в первом случае речь идет о процессах окисления, во втором — о процессах замещения. Некоторую химическую активность они проявляют и в реакциях с переходными металлами.
Некоторую химическую активность они проявляют и в реакциях с переходными металлами.
Во всех этих химических реакциях важную роль играют разветвления углеродной цепи алканов, то есть наличие в них радикальных групп. Чем их больше, тем сильнее изменяется идеальный угол между связями 109,47° в пространственной структуре молекулы, что приводит к созданию напряжений внутри нее и, как следствие, увеличивает химическую активность такого соединения.
Реакция простых алканов с кислородом происходит по следующей схеме: CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2.
Пример реакции с хлором приведен на фото ниже.
Опасность алканов для природы и человека
При содержании метана в воздухе в интервале концентраций 1-8% образуется взрывная смесь. Опасность для человека заключается еще и в том, что этот газ не имеет цвета и запаха. Кроме того, метан обладает сильным парниковым эффектом.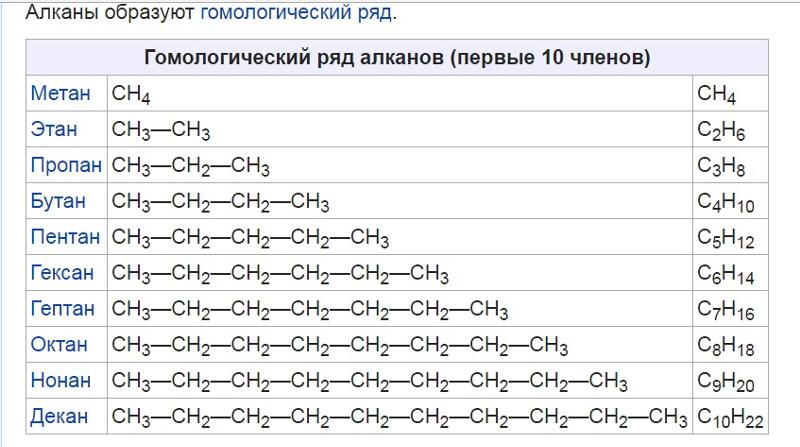 Остальные алканы, имеющие в своем составе несколько атомов углерода, также образуют взрывные смеси с воздухом.
Остальные алканы, имеющие в своем составе несколько атомов углерода, также образуют взрывные смеси с воздухом.
Гептан, пентан и гексан представляют собой легко воспламеняющиеся жидкости и являются опасными как для окружающей среды, так и для здоровья человека, поскольку они токсичны.
Строение алканов
Строение молекул алканов
Строение алканов определяет их химические и физические свойства. Поэтому для понимания свойств этих соединений необходимо иметь представление о химическом и пространственном строении их молекул.- Химическое строение вещества – это порядок соединения атомов в его молекулах, который отражается с помощью структурных формул.
- Пространственное строение – взаимное расположение атомов молекулы в трехмерном пространстве. Для изображения пространственного строения молекул используют стереохимическиеСтереохимические формулы — структурные формулы с внесенными в них элементами, отражающими пространственное располо-жение атомов.
 Связь, лежащую в плоскости рисунка, изображают простой линией; связь, расположенную над этой плоскостью, — жирным клином, а уходящую за плоскость — штрихованным клином. и проекционныеПроекционные формулы представляют собой проекции положения атомов молекулы с определенной точки зрения наблюдателя. формулы, а также молекулярные модели.
Связь, лежащую в плоскости рисунка, изображают простой линией; связь, расположенную над этой плоскостью, — жирным клином, а уходящую за плоскость — штрихованным клином. и проекционныеПроекционные формулы представляют собой проекции положения атомов молекулы с определенной точки зрения наблюдателя. формулы, а также молекулярные модели.
Из этих формул видно, что в алканах имеются два типа химических связей: С–С и С–Н. Связь С–С является ковалентной неполярной. Связь С–Н ковалентная слабополярная, так как углерод и водород близки по электроотрицательности (2.5 для углерода и 2.1 для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул: Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
 Пространственное строение, то есть взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих
атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, Гибридизация АО). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, sp3-Гибридизация). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С–Н или С–С.
Четыре σ-связи углерода направлены в пространстве под углом 109
Пространственное строение, то есть взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих
атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, Гибридизация АО). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, sp3-Гибридизация). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С–Н или С–С.
Четыре σ-связи углерода направлены в пространстве под углом 109Валентный угол Н–С–Н равен 109о28′.
Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей. Для записи удобно использовать пространственную (стереохимическую) формулу.
Построение стереохимической формулы
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3-атома углерода образуют более сложную пространственную конструкцию:
Анимация Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана C4H 10 (VRML-модель) или н-пентана:
Анимация
Алканы, гомологический ряд и общая формула алканов, строение молекулы метана и его гомологов, sp3- гибридизация, изомерия и номенклатура алканов
Матвеева Светлана Анатольевна, учитель химии
КГУ «Средняя школа № 6» г.Лисаковск
Тема урока : Алканы, гомологический ряд и общая формула алканов, строение молекулы метана и его гомологов, sp3— гибридизация, изомерия и номенклатура алканов
Цель урока: 1.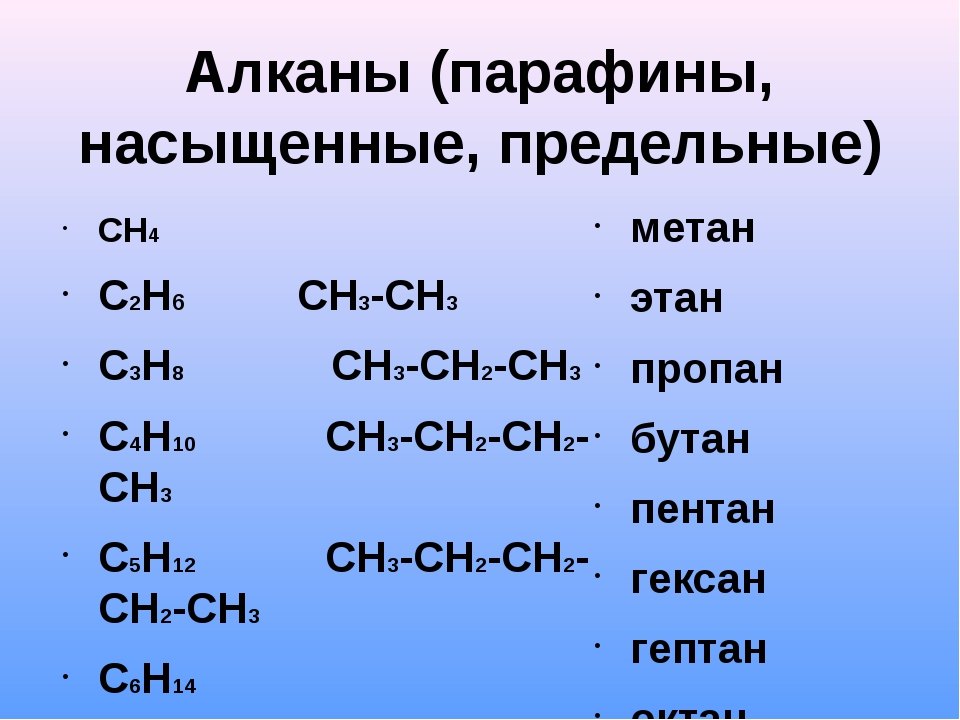 Знать понятие и номенклатуру алканов, общую формулу их строение и изомерию.
Знать понятие и номенклатуру алканов, общую формулу их строение и изомерию.
2.Уметь составлять структурные формулы алканов и называть их.
Задачи обучения: 1.Изучить понятие алканов их строение, номенклатуру- международную и рациональную.
2. Развивать навыки составления изомеров.
Виды деятельности учащихся: Индивидуальная работа с учебником, работа в паре, групповая работа
Оборудование : интерактивная доска, проектор, флипчарт, листы с заданиями, учебник, дескрипторы для оценивания, листы самооценивания
Идеи модулей Новой программы: Новые подходы в обучении; Обучение критическому мышлению; ИКТ, возрастные особенности
Интеграция с другими предметами—
с геометрией ( форма молекул-тетраэдрическая у алканов),
с русским языком (слова синонимы-алканы=парафины=предельные=насыщенные)
Функциональная грамотность— развитие коммуникативной компетенции учащихся в процессе групповой работы
Ход урока.
1.Организационый момент
2. Деление учащихся на группы (по 4-5) по цветам
3. Мозговой штурм
На столе стоит парафиновая свеча — зажигаем и читаем стихотворение
Когда в душе покоя нет —
Зажги свечу на радость людям!
Пусть золотой не меркнет свет,
А все невзгоды — позабудем!
Когда в душе покоя нет —
Зажги свечу на благо людям —
Пусть свет не меркнет золотой,
А все обиды позабудем.
(стихотворение сайта http://www.inpearls.ru)
Вопрос: Каким образом свеча связана с темой нашего урока? (Предположения учащихся)
« Разгадаем ребус» — на доске зашифровано слово «Парафины»
Тема урока «Алканы, гомологический ряд и общая формула алканов, строение молекулы метана и его гомологов, sp3— гибридизация, изомерия и номенклатура алканов .
Сегодня на уроке : Цель урока (формулируют учащиеся)
знать (формулируют учащиеся)
уметь (формулируют учащиеся)
4. Изучение нового материала. Работа группах
Изучение нового материала. Работа группах
А) Изучение состава и строения алканов
Групповая работа – создание коллаборативной среды. Вырабатываем правила работы в группе
Задание 1 для группы 1
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле метана и бутана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу метана и бутана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол, расстояние между атомами углерода (используйте рис.9 стр. 69).
5. Какую форму имеют данные молекулы углеводородов?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы метана и бутана.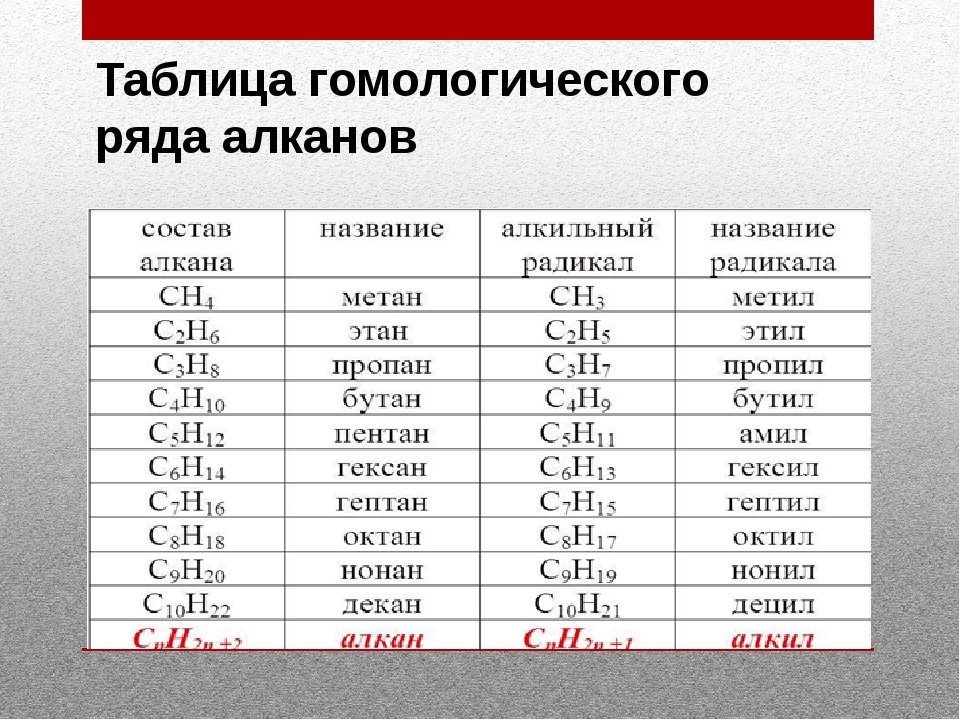
7. Что называют конформацией и возможна ли она у ваших соединений? Если да, то покажите.
Учащиеся проводят взаимооценивание ( критериальное -оценивание по дискрипторам)
Задание 1 для группы 2
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле этана и пентана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу этана и пентана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода (используйте рис.10,12 стр. 70-71).
5. Какую форму имеют данные молекулы углеводородов?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы этана и пентана.
7. Что называют конформацией и возможна ли она у ваших соединений? Если да, то покажите.
Задание 1 для группы 3
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле пропана и гексана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу пропана и гексана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода(используйте рис.11 и 12 стр. 71).
5. Какую форму имеют данные молекулы углеводородов?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы пропана и гексана.
7. Покажите конформеры для гексана.
Задание 1 для группы 4
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле гептана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу гептана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода(используйте рис.11 и 12 стр. 71).
5. Какую форму имеют данная молекула алкана?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы гептана.
7.Покажите конформеры для гептана.
Б) Изомерия и Номенклатура алканов-международная и рациональная.
Объяснение с использованием интерактивной доски
Цель: Изучить изомерию алканов-структурную и номенклатуру -международную и рациональную, научиться самим составлять изомеры и называть их и научить других .
Для алканов характерна структурная изомерия(углеродного скелета)
Номенклатура:
Международная
Задание-образец: дать название следующему углеводороду по международной( систематической) номенклатуре
1) Выбираем наиболее длинную цепь атомов углерода и нумеруем ее с того конца, к которому ближе радикалы1 2 3 4 5 6 7
2) Приставка:
место – (число) — название заместителей
у 2 и у 4 атомов углерода имеется 2 одинаковых
радикала метила
2,4-диметил
3) Корень слова:
число атомов углерода в главной цепи (7 – гепт)
2,4-диметил гепт
4) Суффикс:
Только одинарные связи между атомами углерода
2,4-диметил гепт ан
Рациональная ( называют как производные метана)
метилдиэтилметан
в) Работа в паре (взаимообучение)
1 вариант. Объяснить своему соседу как называют вещества по международной номенклатуре на примере алканов.
Объяснить своему соседу как называют вещества по международной номенклатуре на примере алканов.
,
2 вариант. Объяснить своему соседу как называют алканы по рациональной номенклатуре.
На взаимообучение друг друга отводится 5 минут
Дайте друг другу обратную связь- рекомендации по теме ( над чем поработать и что еще сделать необходимо для лучшего понимания данного вопроса.)
Г) Закрепление. Учащиеся работают в парах. Ответьте на вопросы ( в паре) по теме «Алканы»:
Цель: повторить и закрепить изученный материал по алканам (общая формула, строение, номенклатура).
Алканы-это…
Назовите общую формулу предельных углеводородов.
Напишите формулу алканов, имеющих в своем составе 8, 12, 16 атомов углерода.
Какой вид гибридизации характерен для алканов?
Назовите валентный угол и длину «С – С» связи в молекулах алканов.
Объясните, каким образом даются названия алканам по международной номенклатуре.
Сравните, чем отличается международная номенклатура от рациональной? Какая для вас легче? Почему?
Проанализируйте, в чем трудность составления изомеров алканов и их называния, если она есть? Что для этого необходимо предпринять?
Взаимооценивание проводится учащимися.
5. Первичное закрепление знаний
Тест.
1.Укажите, какие из веществ, формулы которых приведены ниже, являются изомерами н-гексана:
2.Общая формула гомологического ряда алканов:
а) СnH2n+2 в) СnH2n
б) СnH2n-2 г) СnH2n-6
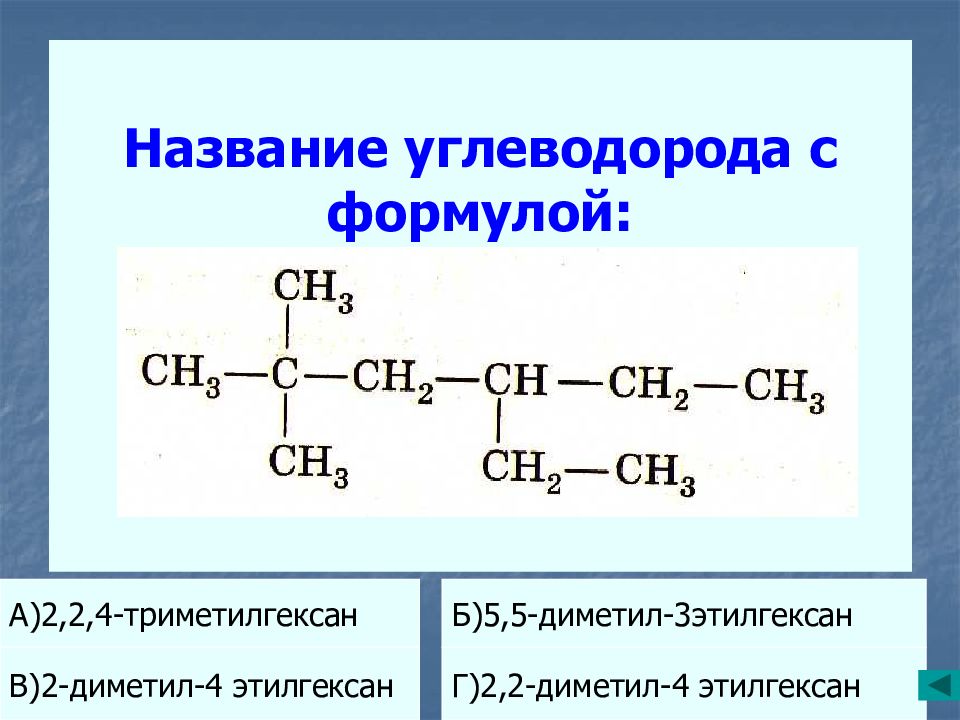
3. Выберите название приведенного алкана по международной номенклатуре
А) 2,2,3,3-метилбутан
Б) 2,3-тетраметилбутан
В)2,2,3,3. -тетраметилбутан
-тетраметилбутан
Г) октан
4. Тип гибридизации алканов:
а) sp³ —
б) sp² —
в) sp –
5.Тип ковалентной связи у алканов:
а) σ – связи
б) π — связи
в) σ и π связи
6. Типы изомерии у алканов:
а) структурная б) межклассовая
в) геометрическая г) структурная, межклассовая и геометрическая
Самооценивание производится самим учеников и записываются баллы в лист оценивания и подсчитываются баллы.
6.Рефлексия.
Сегодня я узнал….
Я на уроке понял…
Мне удалось…
Данная тема мне ….
Я для себя сегодня взял..
Работа на уроке для меня…
7. Домашнее задание: § 3.1 стр 73 у.2-3( на оценку «3») у 6-5( на оценку « 4») у.7-8 (на оценку «5»)
Приложение.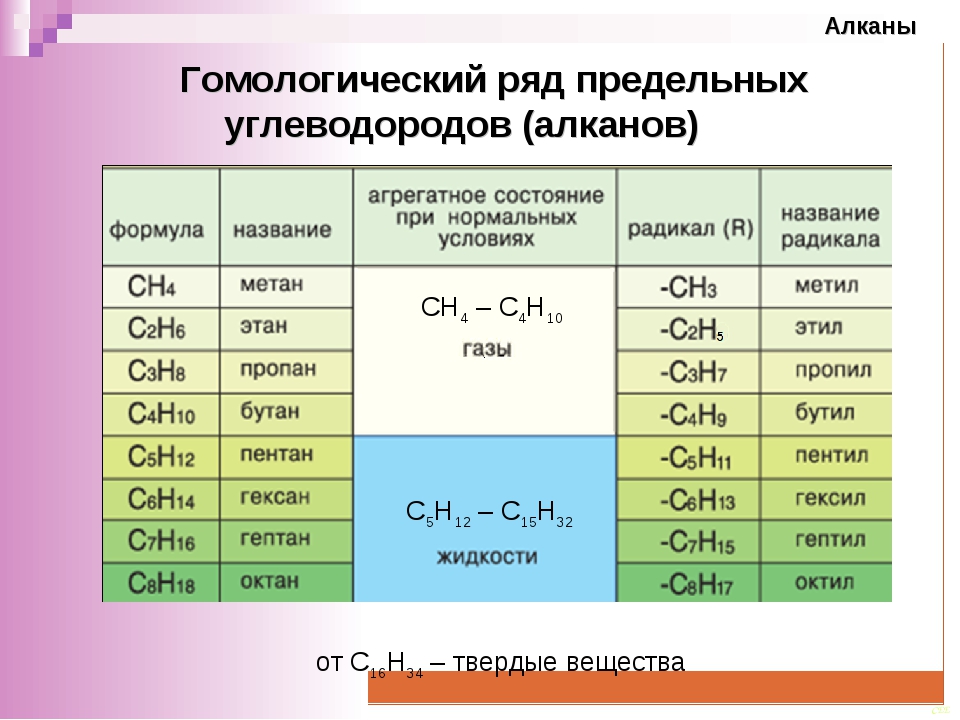
Дескрипторы к критериям оценки по работе в группе « Гомологический ряд, строение, состав свойства алканов».
грамотно, указано, что алканы углеводороды, общая формула указана, но не указано, что это насыщенные углеводороды .
Определение дано с подсказками, наводящими вопросами ,не указана общая формула
Определение не сформулировано
2. Общая формула
Приведена формула СnH2n+2 .Приведены 2 примера.
Приведена формула СnH2n+2 .
Приведен 1 пример.
Приведена формула СnH2n+2 , но не приведены примеры
Формула не приведена.
3.Что такое радикалы? Приведите примеры.
Определение дано-указано, что это частицы с неспаренным электроном, приведены примеры
Определение пытался сформулировать, приведены примеры
Приведены примеры, но определение не дано
Не пытался привести примеры и дать определение
4. Напишите структурную формулу алкана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода
Напишите структурную формулу алкана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода
Написана структурная формула правильно, указаны связи в молекуле, длина связи, определен тип гибридизации атома углерода, указан валентный угол
Написана структурная формула правильно, указаны связи в молекуле, длина связи, определен тип гибридизации атома углерода, не указан валентный угол
Написана структурная формулуа правильно, указаны связи в молекуле, не указаны длина связи, не определен тип гибридизации атома углерода, не указан валентный угол
Написана структурная формулу, но с недочетами.
5. Какую форму имеют данная молекула алкана?
Указал (а),что угол между атомами углерода 109°28′ , поэтому молекула имеет зигзагообразную форму .
Указал (а) ,что молекула имеет зигзагообразную форму , но не указано почему.
Пытался указать какую форму молекула имеет ( зигзагообразную форму), высказывал предположения.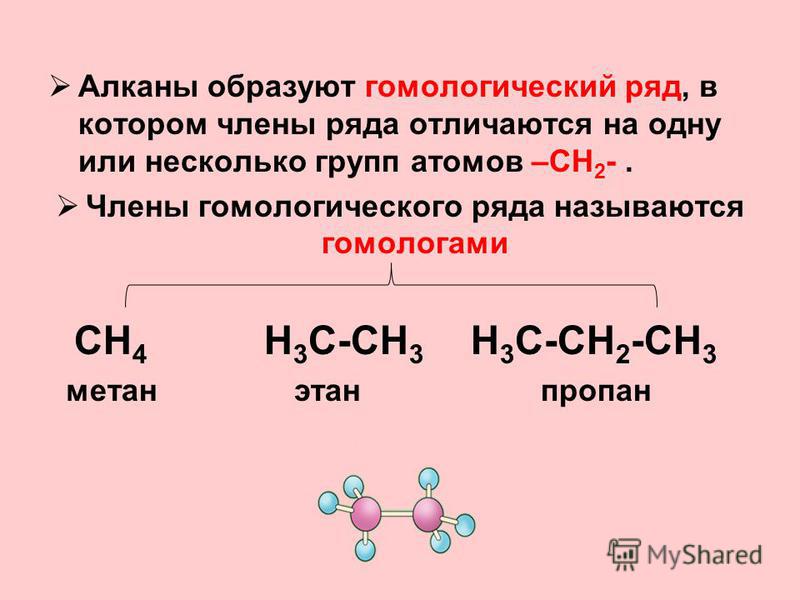
Не указал (а) ,что молекула имеет зигзагообразную форму и не пытался .
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы.
Принимал активное участие в сборке молекулы, пояснял, используя ТХС А.Бутлерова, как правильно собрать молекулу, какая валентность у атома углерода
Помогал собирать молекулу, пытался пояснять, как правильно собрать молекулу.
Комментировал, как можно собрать молекулу.
Не принимал участие в сборке молекулы
7. Что называют конформацией и возможна ли она у ваших соединений? Если да, то покажите.
Указал(а),что конформация-это различные геометрические формы молекул в пространстве за счет вращения С-С связей.
Продемонстрировал конформеры молекул.
Указал, что конформация -это различные геометрические формы молекул в пространстве , но не пояснил за счет чего образуется
Предположил, что такое конформеры и у каких соединений возможны.
Не пытался принимать участие в обсуждении.
Дескрипторы по работе в паре
Ответы на вопросы ( в паре) по теме «Алканы»:
Даны ответы на вопросы
За каждый ответ на 1-5 вопрос по 1 баллу
6-8 вопрос по 2 балла
Тест. «Алканы»
1.в2.а
3.в
4.а
5.а
6.а
Оцените себя за тест «Алканы»
(самооценка)
Подсчитайте общее количество баллов и переведите в оценку
34-37 баллов- «5»
26-33 балла –«4»
25- 18 баллов- «3»
менее 18 баллов – «2»
Фамилия имяПодсчитайте общее количество баллов и переведите в оценку
34-37 баллов- «5»
26-33 балла –«4»
25- 18 баллов- «3»
менее 18 баллов – «2»
Форма работы
Самооценка ( баллы)
Взаимооценка ( баллы)
Групповая работа
Работа в паре
Диалог-ответы на вопросы Ответы на вопросы ( в паре) по теме «Алканы»:
Тест по теме
Оценка учителя ______________________________________
Химия — 9
По Международной номенклатуре предельные углеводороды называют
алканами. На предыдущей странице приведены формулы некоторых алканов.
Первый представитель алканов – метан СН4.
На предыдущей странице приведены формулы некоторых алканов.
Первый представитель алканов – метан СН4.
Сравнивая формулы мeтана (CH4), этана (C2H6), пропана (C3H8) и других алканов, можно заметить, что каждый алкан по составу отличается от предыдушего на CH2 – метиленовую группу. Группу –СН2– называют гомологической разностью.
• Вещества, принадлежащие к одному классу и отличающиеся друг от друга на одну или несколько метиленовых групп, называют гомологами.
Meтан (CH4), этан (C2H6), пропан (C3H8), бутан (C4H10), пентан (C5H12) и др.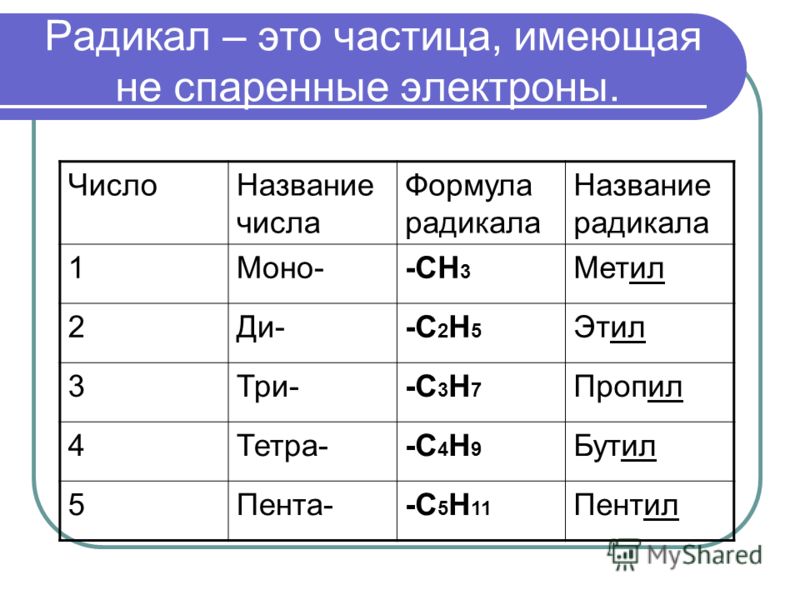 – гомологи друг друга. Гомологи, расположенные в порядке возрастания их
молекулярных масс, образуют гомологический ряд. Рассматриваемый ряд является гомологическим рядом
предельных углеводородов.
– гомологи друг друга. Гомологи, расположенные в порядке возрастания их
молекулярных масс, образуют гомологический ряд. Рассматриваемый ряд является гомологическим рядом
предельных углеводородов.
Шкатулка знаний • По-гречески “homoloqos” означает сходный.
Состав всех членов ряда можно выразить одной общей формулой. Например, состав алканов можно выразить общей формулой CnH2n+2, а их относительную молекулярную массу выражением Mr(CnH2n+2) = 14n + 2 (n ≥ 1), где n – обозначает число атомов С в молекуле алкана.
о б р а з е ц
Относительная молекулярная масса алкана равна 44. Назовите алкан и вычислите общее число σ-связей [σ(C–C) и σ(C–H)] в его молекуле.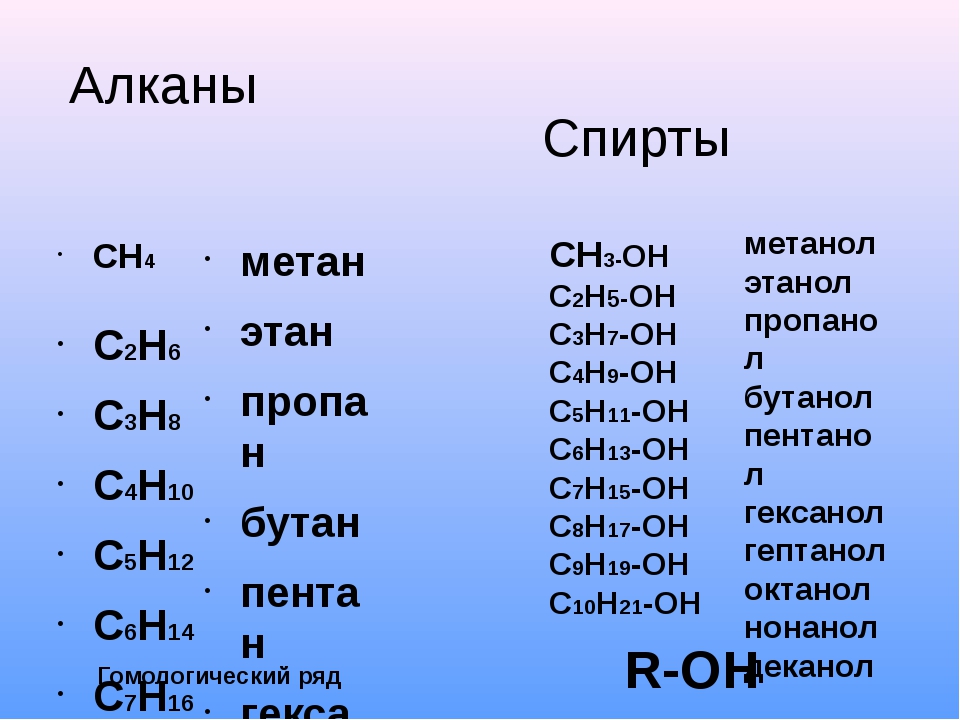
Mr(aлкан) = 14n+2 = 44; 14n = 42; n =3.
Значит, aлкан – это пропан. Из его структурной формулы находим:| Задача. | Плотность по водороду газообразного алкана равна 29. Определите молекулярную формулу алкана. |
Нахождение в природе.
Meтан в природе образуется при разложении остатков растительных и животных организмов без доступа воздуха (в болотах,
каменноугольных шахтах). Поэтому его иногда называют рудничным или
болотным газом. Meтан составляет основную часть (80-97%) природного газа.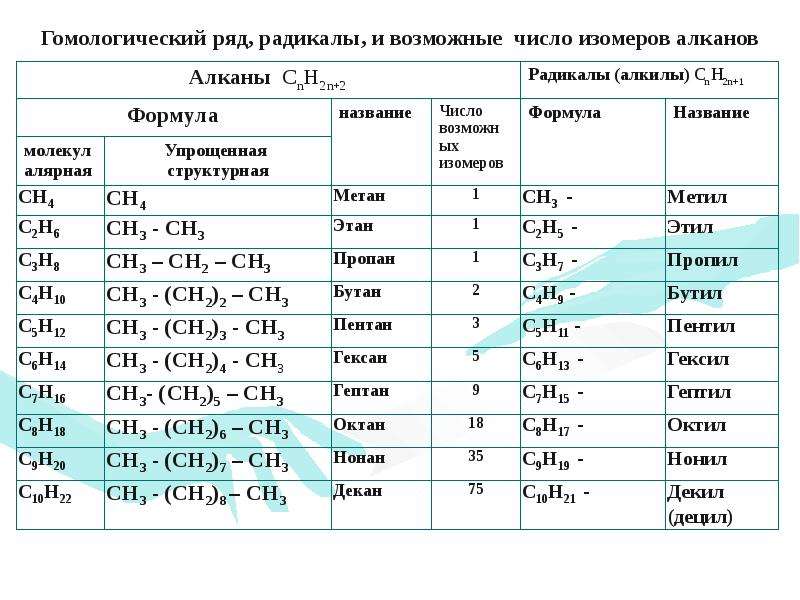 Он присутствует и в попутных нефтяных газах.
Он присутствует и в попутных нефтяных газах.
Физические свойства. Физические свойства. Meтан – газ без цвета и запаха, примерно в 2 раза легче воздуха. Этан, пропан и бутан – также газы. Следующие 11 представителей алканов (C5H12 – C15H32) – жидкости, остальные – твердые вещества. Метан в воде практически не растворим.
Пропан и бутан при обычной температуре под давлением легко сжижаются.
Углеводороды формула общая — Справочник химика 21
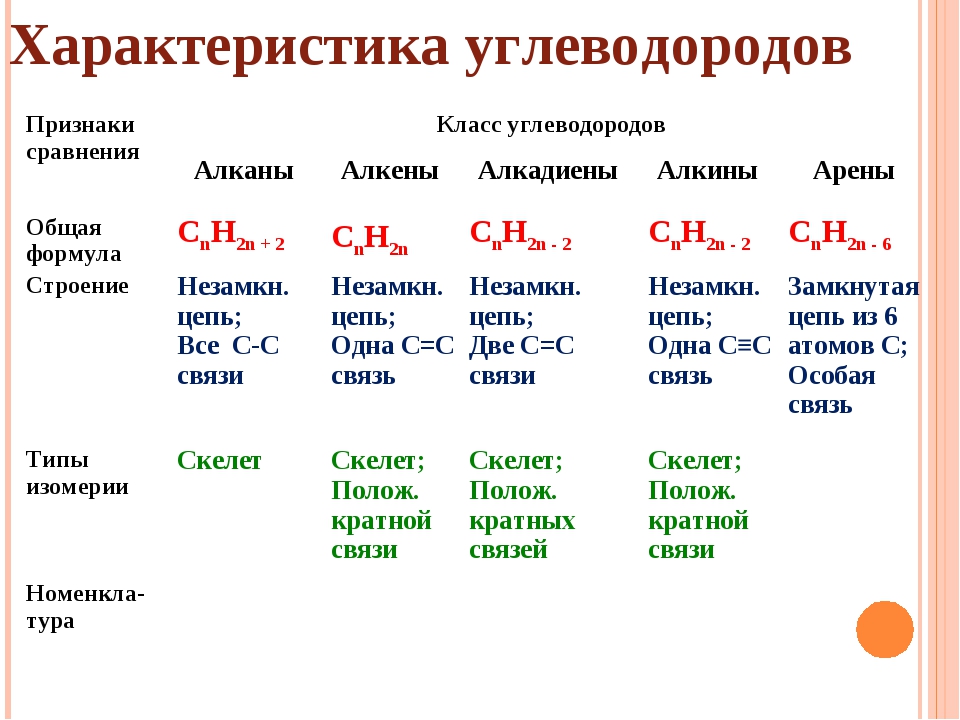
Алканы — углеводороды с общей молекулярной формулой С увели- [c.329]АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ Общая формула Общее название [c.118]
Углеводород Формула Общая длина цепи ( ) о А [c.28]
Номенклатура ацетиленовых углеводородов. Женевская номенклатура. Ацетиленовые углеводороды называют по женевской номенклатуре так же, как предельные (стр. 48), с той лишь разницей, что наличие тройной связи обозначают путем замены в женевском названии предельного углеводорода окончания -ан на окончание -ш. Поэтому углеводороды с тройной связью по женевской номенклатуре и объединяют общим названием алкины. После окончания -ин в названии ставят цифру, соответствующую номеру углеродного атома в цепи молекулы, за которым следует тройная связь. Принцип нумерации атомов цепи такой же, как в случае этиленовых углеводородов (стр. 67). Таким образом, ацетиленовые углеводороды, формулы которых написаны выше, называют так (1) — бутин-1 и (2) — бутин-2. Углеводород строения [c.84]
Женевская номенклатура. Ацетиленовые углеводороды называют по женевской номенклатуре так же, как предельные (стр. 48), с той лишь разницей, что наличие тройной связи обозначают путем замены в женевском названии предельного углеводорода окончания -ан на окончание -ш. Поэтому углеводороды с тройной связью по женевской номенклатуре и объединяют общим названием алкины. После окончания -ин в названии ставят цифру, соответствующую номеру углеродного атома в цепи молекулы, за которым следует тройная связь. Принцип нумерации атомов цепи такой же, как в случае этиленовых углеводородов (стр. 67). Таким образом, ацетиленовые углеводороды, формулы которых написаны выше, называют так (1) — бутин-1 и (2) — бутин-2. Углеводород строения [c.84]
Алканы — углеводороды, имеющие общую формулу С Н2 + 2. где атомы углерода связаны между собой только сг-связями. [c.370]
Алканами называются углеводороды, имеющие общую формулу С Н2п+г и содержащие только 5р -гибридизованные атомы углерода.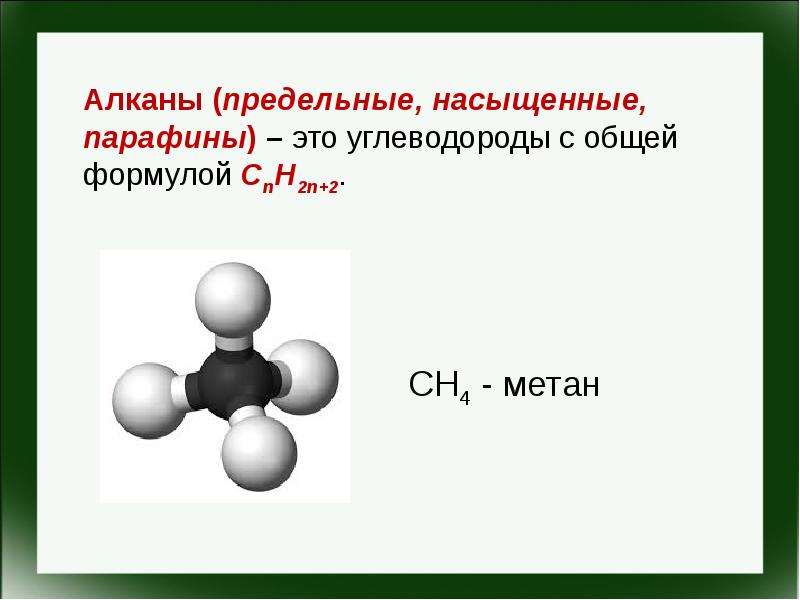 Они широко используются в качестве топлива, однако ограниченно применяются в химии. Это связано с тем, что алканы отличаются низкой реакционной способностью поэтому в лабораторной практике реакции с ними проводят довольно редко. По-видимому, алканы используются в лаборатории в основном в качестве растворителей. Тем не менее, нам кажется целесообразным начать рассмотрение именно с алканов, так как некоторые их реакции помогут читателю получить представление о важных физико-химических концепциях. Кроме того, на примере алканов мы впервые познакомимся с химическими методами, применяемыми для изучения процессов превращения исходных продуктов реакции в конечные. Номенклатура алканов является основой для названий многих органических соединений, поэтому мы подробно рассмотрим ее в этой главе. В начале главы мы познакомимся со структурой углеводородов, затем рассмотрим их номенклатуру, после чего остановимся на реакционной способности этих соединений. [c.98]
Они широко используются в качестве топлива, однако ограниченно применяются в химии. Это связано с тем, что алканы отличаются низкой реакционной способностью поэтому в лабораторной практике реакции с ними проводят довольно редко. По-видимому, алканы используются в лаборатории в основном в качестве растворителей. Тем не менее, нам кажется целесообразным начать рассмотрение именно с алканов, так как некоторые их реакции помогут читателю получить представление о важных физико-химических концепциях. Кроме того, на примере алканов мы впервые познакомимся с химическими методами, применяемыми для изучения процессов превращения исходных продуктов реакции в конечные. Номенклатура алканов является основой для названий многих органических соединений, поэтому мы подробно рассмотрим ее в этой главе. В начале главы мы познакомимся со структурой углеводородов, затем рассмотрим их номенклатуру, после чего остановимся на реакционной способности этих соединений. [c.98]
Алкены — углеводороды, имеющие общую формулу С Н2 , где два атома углерода связаны одной о-связью и одной я-связью.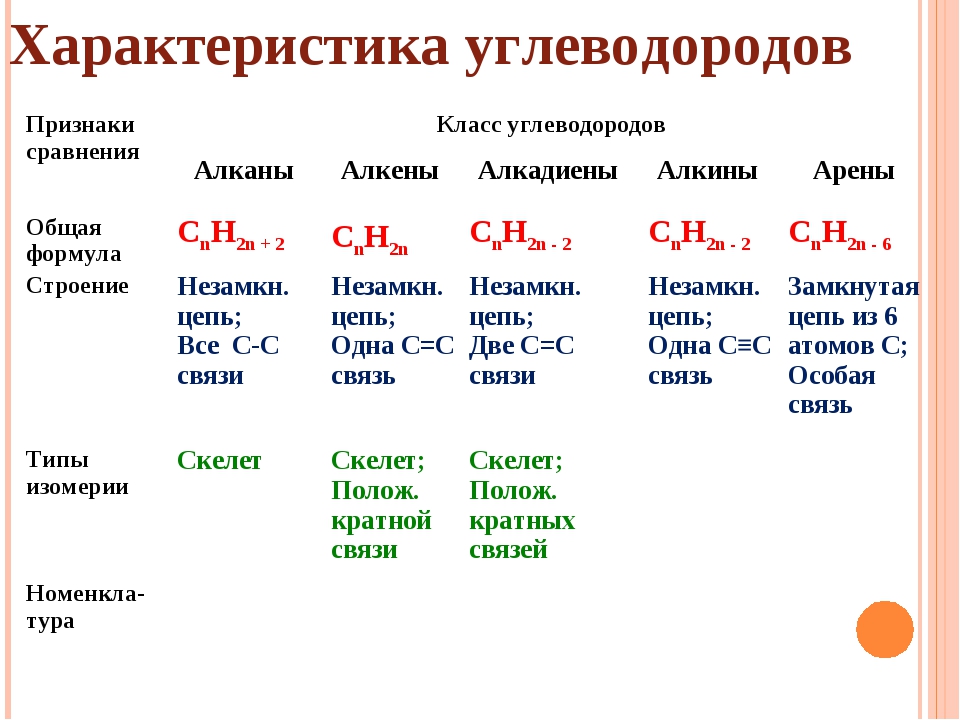 [c.370]
[c.370]
Гомологический ряд алкенов (этиленовых углеводородов) имеет общую формулу С Н2п. Углеводороды этого ряда имеют на два водородных атома меньше, чем соответствующие алканы как известно, это происходит из-за того, что между парой атомов углерода в алкенах имеется двойная связь. Структурные формулы и названия первых членов ряда следующие [c.96]
Алкины — углеводороды, имеющие общую формулу С Н2п-2> где два атома углерода связаны между собой одной тройной связью (две п- и одна а-связь). [c.370]
Алкены (этиленовые углеводороды, олефины). Общая формула С Н2 . Алкены — соединения, содержащие в открытой углерод-углеродной цепи одну двойную связь. [c.251]
Эти углеводороды, отвечающие общей формуле С Н2я+2, называются также парафиновыми, насыщенными ациклическими. [c.20]
Парафиновые (метановые) углеводороды имеют общую формулу ,ih3n+2. Углеводороды i—С4 (метан, этан, пропан, бутан) при нормальных условиях — газы, С5— ie при температуре 20 °С — жидкости, Сп и высшие при обычных условиях находятся в твердом состоянии.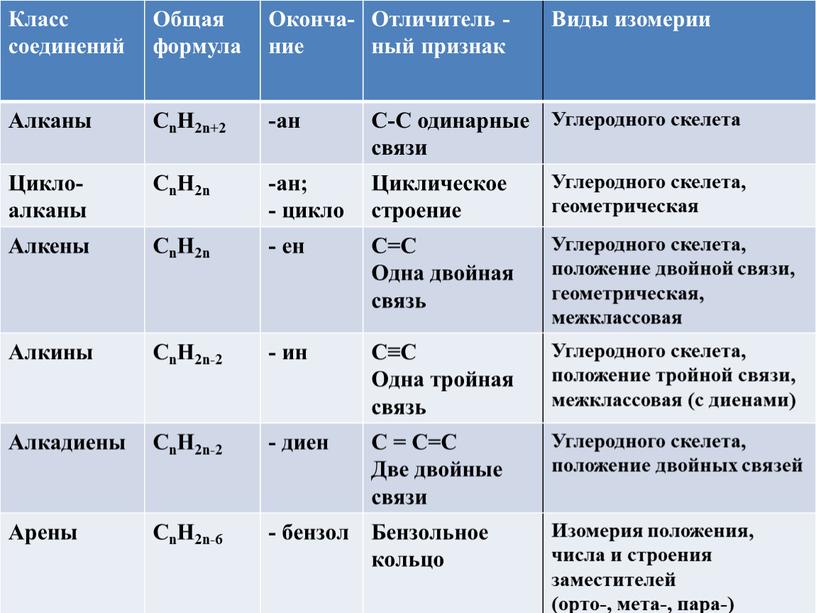 В пластовых флюидах газоконденсатных месторождений количество атомов углерода в нормальных парафинах доходит до = 33 и даже больше, обычно же /г = 22—25. [c.20]
В пластовых флюидах газоконденсатных месторождений количество атомов углерода в нормальных парафинах доходит до = 33 и даже больше, обычно же /г = 22—25. [c.20]
Приводимую ниже схему классификации углеводородов дополните общими формулами и 1—2 примерами конкретных соединений каждого типа [c.356]
На какие основные гомологические ряды делится класс углеводородов Дайте общую формулу и характеристику каждого из них. [c.241]
Выделение п-ксилола с помощью клатратных соединений. В последние годы был открыт класс неорганических комплексных соединений, которые способны образовывать молекулярные соединения с углеводородами [105]. Они получили название клатратных соединений [106]. Наиболее пригодны для образования клатратных соединений с углеводородами комплексы общей формулы МР4Х2, где М — элемент переменной валентности Р — пиридиновый остаток X — анион. Из ионов металлов наилучпше результаты дают двухвалентные никель, кобальт, марганец и железо.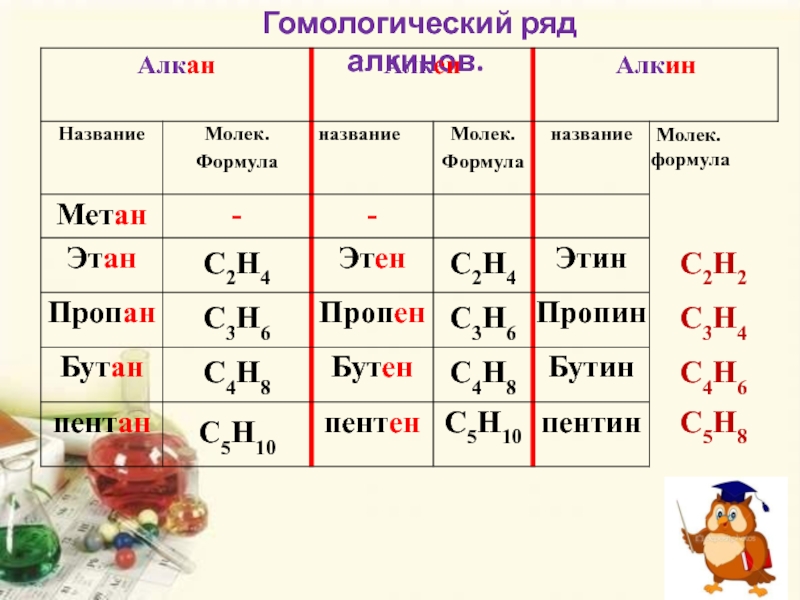 Наиболее пригодные азотистые основания — замещенные в 3- или 4-положении пиридины, а также хинолины. Анионом может быть простой одноатомный ион — хлор или бром, или многоатомный ион — тиоцианат, формиат, цианат, или нитрат [76, с. 235—298, 107]. [c.129]
Наиболее пригодные азотистые основания — замещенные в 3- или 4-положении пиридины, а также хинолины. Анионом может быть простой одноатомный ион — хлор или бром, или многоатомный ион — тиоцианат, формиат, цианат, или нитрат [76, с. 235—298, 107]. [c.129]
Рассмотрите схему, которая дана в 18. Выполните упражнение 22. Нарисуйте схему в тетради и подпишите под названием каждой группы углеводородов их общую формулу (упражнение 18). [c.173]
Алканы (насыщенные алифатические углеводороды, парафины) Общая формула С,Н2,+2 В молекулах алканов атомы углерода соединены в прямые или разветвленные цепи одинарными связями [c.239]
Бестужев [115] высказывается весьма оптимистически по поводу возможности идентификации основных групп высокомолекулярных углеводородов, если самой идентификации будут предшествовать операции по упрош,ению группового состава углеводородов узких нефтяных фракций при помош,и комплекса предложенных отдельными исследователями методик.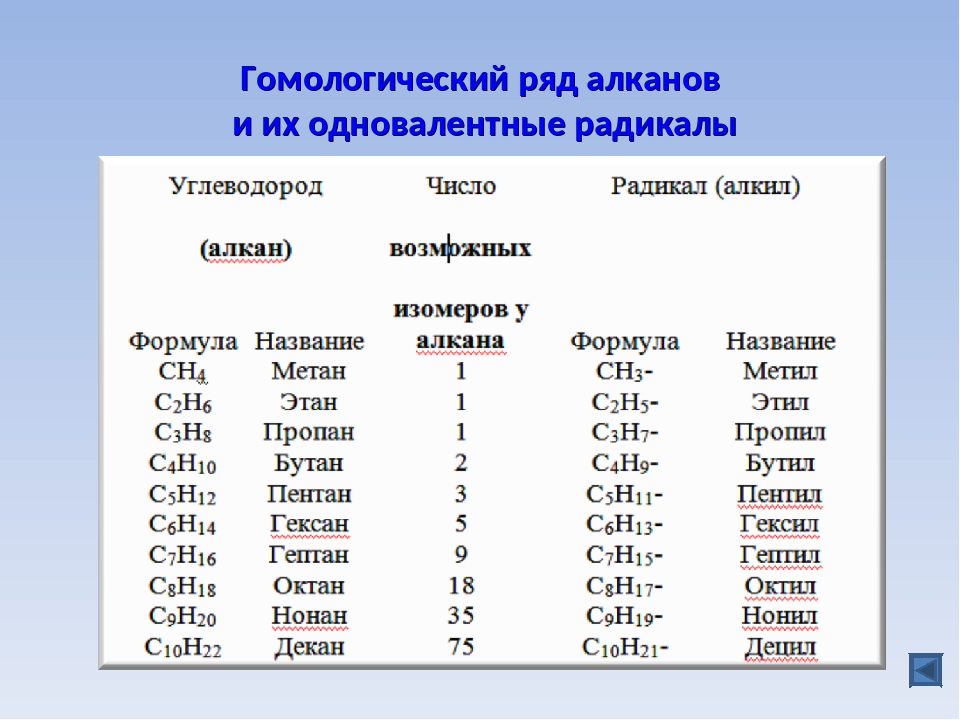 Он предлагает общую схему анализа высокомолекулярных фракций нефти, включающую 12 гомологических рядов и 24 группы углеводородов с общей формулой от СпН2п+2 С Н2п—20 [c.252]
Он предлагает общую схему анализа высокомолекулярных фракций нефти, включающую 12 гомологических рядов и 24 группы углеводородов с общей формулой от СпН2п+2 С Н2п—20 [c.252]
Но теории Раисов все углеводороды, имеющие общую формулу ЙСН2СН2СН = СНа, должны распадаться подобным же образом по цепному механизму, образуя в качестве главных продуктов реакции бутадиен и насыщенный углеводород. [c.110]
В спектрах углеводородов с двумя и более кратными связями возрастает количество иоиов, образование которых связано с миграцией водорода. Поэтому для углеводородов с общей формулой С Н . —2 (диеновые и цикломоноолефиновые) характеристическими является не один, а два гомологических ряда ионов (67, 68, 81, 82, 95, 96) диссоциативная ионизация алкилбензолов приводит преимущественно к образованию ионов с массами 77, 78, 91, 92, 105, 106, 119, 120 и т. д. Суммарная интенсивность пиков характеристических иоиов прямо пропорциональна концентрации соответствующей углеводородной группы.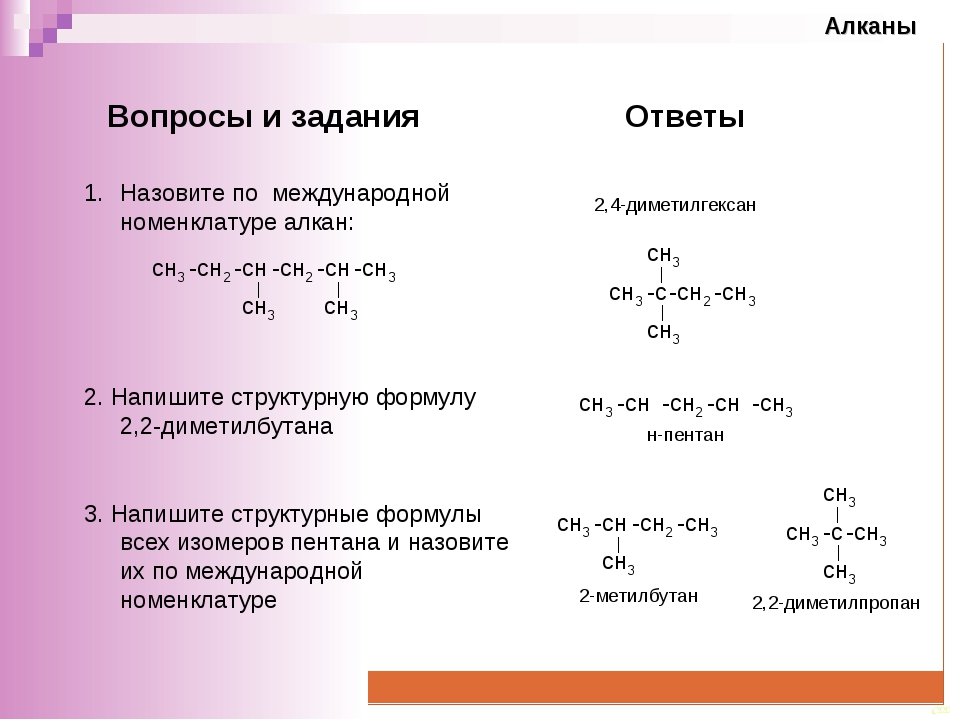 Аддитивность указанных свойств позволяет производить анализ и расчет состава сложных смесей аналогично смесям, состоящим из небольшого числа компонентов, а учет взаимных наложений осуществляется путем решения системы линейных уравнений. Все эти закономерности использовались для создания методов определения различных классов и типов углеводородов в сложных смесях (бензины, высокомолекулярные нефтяные фракции) [272— 280]. [c.140]
Аддитивность указанных свойств позволяет производить анализ и расчет состава сложных смесей аналогично смесям, состоящим из небольшого числа компонентов, а учет взаимных наложений осуществляется путем решения системы линейных уравнений. Все эти закономерности использовались для создания методов определения различных классов и типов углеводородов в сложных смесях (бензины, высокомолекулярные нефтяные фракции) [272— 280]. [c.140]
В настоящее время обычное мыло все более заменяют различные синтетические моющие средства. Как правило, основой их являются углеводороды с общим числом атомов С от 12 до 20 и различным строением, в которых часть атомов водорода замещена на атомы или радикалы, сообщающие молекулам достаточную растворимость в воде. Различают анионоактивные (как и обычное мыло), катионоактивные, амфотерные и неионогенные моющие вещества. Первые обычно характеризуются наличием в их составе группы —ЗОзЫа (с ионогенным натрием), вторые-группы —ЫНзС1 (с ионогенным хлором), третьи — одновременно групп и того и другого типа, а характерной для четвертых (неионогенных) является общая формула К—Н1—СНгСНгО- -СНгСНзО- -СИгСНгОН, где Р — углеводородный радикал, а Н1 — двухвалентный атом (О, 8) или радикал (—СНз—ЫН—, —СО—ЫН— и др.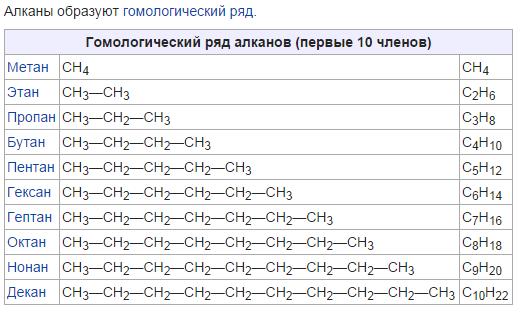 ). Почти все синтетические моющие средства имеют перед обычным мылом то важное преимущество, что безотказно действуют и в жесткой воде. [c.566]
). Почти все синтетические моющие средства имеют перед обычным мылом то важное преимущество, что безотказно действуют и в жесткой воде. [c.566]
Алкеиы—углеводороды, имеющие общую формулу QHn , где два атома углерода связаны между собой одной с-связью и одной я-связью. [c.434]
Углеродный скелет, построенный из С-атомов в состоянии 5/) -гибрндизации, может представлять собой не только цепь, но и кольцо (цикл). Из-за замыкания цикла уменьшается общее число атомов водорода и поэтому подобные циклические углеводороды имеют общую формулу С Н.2 . Их называют циклоалканами, полиметиленовыми углеводородами или нафтенами последнее название им дал В. В. Марковников, открывший эти углеводороды в составе бакинской нефти. [c.239]
Алютами называют углеводороды, имеющие общую формулу гомолошческого ряда одну тройную [c.102]
Ненасыщенные углеводороды с общей формулой С4Нв различаются положением двойной связи [c.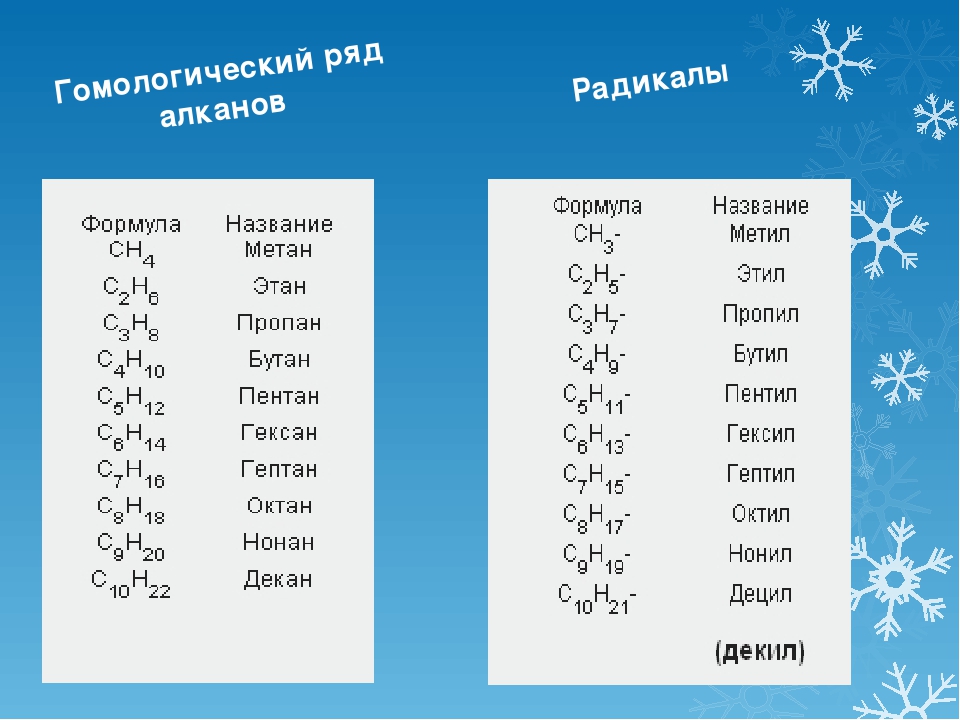 75]
75]
Помимо моносилана 81Н4 известны дисилан 312Но, трисилан 51лН8 и др. По составу силаны аналогичны предельным углеводородам, их общая формула 51 Н2 ь2- Но силаны нестойки, так как связи между I. 1 I [c.333]
Терпенами называются алициклические углеводороды с общей формулой С10Н16. содержащиеся в смоле и соке хвойных деревьев и в различных эфирных маслах. Терпены, как правило, носят эмпирические названия. [c.241]
Названия этих соединений образуют, прибавляя функциональное окончание -сульфоновая кислота к названию соответствующего углеводорода. Их общая формула КЗОдН. [c.209]
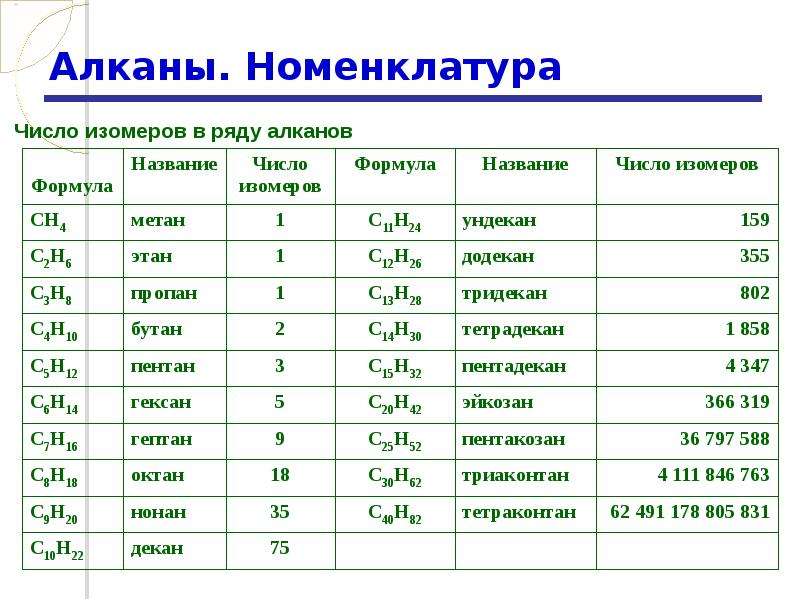
С увеличением количества атомов углерода в молекуле количество изомеров увеличивается, так например, для углеводородов с общей формулой СзН] насчитывается 18 изомеров, а для С10Н22 — уже 75 изомеров. У каждою [c.63]
Циклогексан СеН12 применяется в синтезе капрона Алкены (этиленовые углеводороды, олефины) Общая формула С Н2 Алкены — соединения, содержащие в открытой углерод углеродной цепи одну двойную связь Номенклатура, изомерия Названия алкенов по правилам ИЮПАК получают от названий алканов с нераз ветвленной цепью путем замены суффикса -ан на -ен При наличии разветвлений углерод углеродной цепи в алкене выбирают самую длинную цепь, которая включает двойную связь, и нумеруют ее с того конца, ближе к которому находится двойная связь, например [c.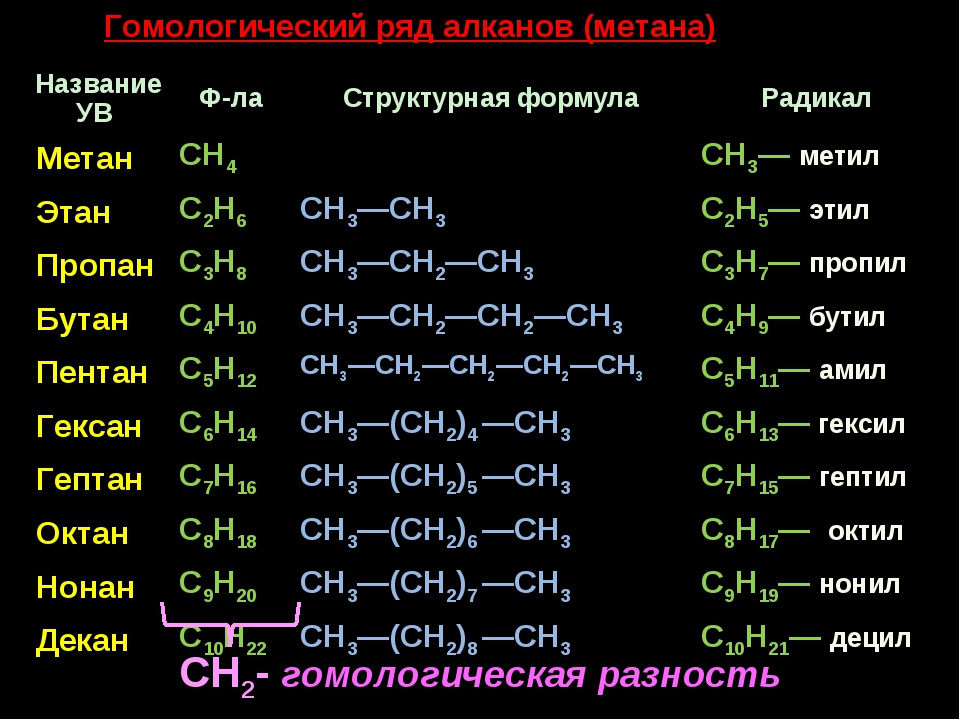 251]
251]
Для ароматических углеводородов принято общее название арены (АгН), чтобы отличить их, например, от олефинов. В правилах номенклатуры органических соединений ШРАС (ИЮПАК, Международного союза теоретической и прикладной химии) учтен тот факт, что тривиальные названия ароматических соединений настолько широко распространены в химической литературе, что было бы нецелесообразно заменять их систематическими названиями. Так, для метилбензола (5) сохранилось название толуол, а для фенилбензола — бифенил (6). Поскольку бензол имеет ось симметрии шестого порядка, нет необходимости нумеровать атомы в соединениях (5) и (6). Ниже приведены формулы нескольких наиболее важных моноциклических углеводородов с соответствующей нумерацией (в скобках даны их систематические Названия) (7)—акумол (изопропилбензол) (8) — п-цимол (4-изо-пропил-1-мстилбензол) (9) — о-ксилол (1,2-диметилбензол) (10) — мезитилен (1,3,5-триметилбензол) (II) — стирол (винилбензол). [c.315]
Рефрактометрический метод. Этот метод также использовался для косвенной проверки молекулярных весов и состоял в сравнении эксперимента.аьно ояределенного значения удельной рефракции чистого неизвестного соединения с теоретически подсчитанной величиной, вычисленной ка основании принятой для него формулы. Общий метод разработали Брюль, Ауере и Эйзенлор Гроссе [12] недавно примени. его к высоко-фторированным углеводородам. При вычислении теоретического значения удельной рефракции для углерода брались данные, которые нашел Эйзенлор, т. е. величина 2,418, а для фтора — величина 1,24, определенная экспериментально в лаборатории университета Джонса Гоп-кi н a. [c.100]
Этот метод также использовался для косвенной проверки молекулярных весов и состоял в сравнении эксперимента.аьно ояределенного значения удельной рефракции чистого неизвестного соединения с теоретически подсчитанной величиной, вычисленной ка основании принятой для него формулы. Общий метод разработали Брюль, Ауере и Эйзенлор Гроссе [12] недавно примени. его к высоко-фторированным углеводородам. При вычислении теоретического значения удельной рефракции для углерода брались данные, которые нашел Эйзенлор, т. е. величина 2,418, а для фтора — величина 1,24, определенная экспериментально в лаборатории университета Джонса Гоп-кi н a. [c.100]
Из углеводородов, растворимых в ЗОг, выделены дигидро-м-ксилен, дигидромезитилен, три углеводорода формулы С )Н 6 с тремя двойными связями каждый и гексагидрофлуорен. Из компонентов фенольного типа идентифицированы гексагидрокрезол (С/НиО) и четыре компонента общей формулы С Н д еО, где Л-8- И. [c.20]
Алканы
№______САБАҚТЫҢ ЖОСПАРЫ
ПЛАН ЗАНЯТИЯ №_______
Топ
Группа________________________________________
Күні
Дата____________________________________
Пәні
Дисциплина: Химия
Сабақтың тақырыбы:
Тема занятия:
Актуализации темы:
Тема
«углеводороды» — одна из основных в курсе органической химии средней школы. Другие классы органических веществ рассматривают как производные углеводородов,
и знания учащихся об этих соединениях будут в дальнейшем постоянно
востребованы. Кроме того, в теме «углеводороды» впервые рассматриваются почти
все теоретические вопросы органической химии. Поэтому только полное и
углубленное понимания учениками понятий этого раздела создает дидактическую
базу для осмысленного восприятия последующего материала.
Другие классы органических веществ рассматривают как производные углеводородов,
и знания учащихся об этих соединениях будут в дальнейшем постоянно
востребованы. Кроме того, в теме «углеводороды» впервые рассматриваются почти
все теоретические вопросы органической химии. Поэтому только полное и
углубленное понимания учениками понятий этого раздела создает дидактическую
базу для осмысленного восприятия последующего материала.
Новые понятия этой темы:
Классификация углеводородов, общая молекулярная формула, номенклатура, изомерия, гибридизация, б и П — связи, способы их образования, пространственная конфигурация молекул, реакции замещения.
Урок «Алканы. Состав. Строение. Номенклатура. Свойства»
Тип урока: «Урок изучения нового материала и первичного закрепления новых знаний».
Задачи урока:
Обучающие: Рассмотреть новый класс органических веществ,
научить составлять формулы, определять по формулам алканы, давать названия,
классифицировать углеводороды, сравнивать состав, строение, свойства.
Развивающие: Развивать познавательную активность, используя нестандартные задания, вырабатывать навыки логического мышления, делать выводы, выделять главное, сравнивать и обобщать. Совершенствовать умения устанавливать причинно — следственные связи (состав, строение, свойство, применение). Продолжить формирования умений оформлять результаты в тетради. Развивать навыки творческой работы, добывая самостоятельно знания при работе с дополнительной литературой.
Воспитательные: Изучая любой класс органических веществ, учащиеся
должны оперировать понятиями, сформированными при освоении этой темы. Глубокие
знания позволяют предсказывать особенности свойств любого класса, устанавливать
взаимосвязь между веществами, что приводит к пониманию единства материальной
основы окружающего мира. Через работу в парах воспитывать у учащихся культуру
общения, наблюдательность, пытливость, внимание, инициативу. На уроках
прививать интерес к химии, знакомить учащихся с ее ролью на современном этапе.
Методы и методические приемы:
Словесные, наглядные, письменные задания, практическая работа с учебником, методы стимулирования и мотивации учения, методы контроля, самоконтроля, фронтальный опрос, работа с наглядными пособиями, карточками. На уроке использовалась мультимедиа система. В обучающей программе были использованы анимации, звуковое сопровождение, которые сразу воздействовали на несколько информационных каналов обучаемого, усиливали восприятие и облегчали усвоение и запоминание материала.
Оборудование:
Шаро-стержневые модели, парафин, вазелин, пластмасса, зажигалка, уголь, нефть.
План урока:
1) организация начала занятия.
2) Подготовка к основному этапу занятия.
3) Усвоение новых знаний.
4) Первичная проверка понимания.
5) Подведение итогов урока.
6) Информация о домашнем задании.
Ход урока:
I. Ориентировочно-мотивационный этап.
Задача — подготовить учащихся к работе на уроке, к
восприятию новой темы.
При изучении любого класса веществ необходимо использовать план, который написан на доске:
1) Название класса
2) Определение класса
3) Гомологический ряд
4) Общая формула
5) Физические свойства
6) Строение
7) Особенности номенклатуры
8) Изомерия
9) Химические свойства
10) Способы получения
11) Применение
Органическая химия — это химия соединений углерода. Этот многоликий углерод — «царь живой природы», «основа жизни». Он образует огромный и разнообразный мир органических веществ, который окружает нас постоянно.
Демонстрация слайда «углерод».
Иногда природа хочет порадовать людей мгновенной
находкой и создает из соединений углерода удивительные драгоценные камни, но
чаще человеку предстоит приложить немало усилий и стараний, чтобы извлечь
красоту и пользу из даров природы. Атомы углерода встречаются в блестящем куске
угля, маслянистой нефти, удушливом газе. Что может быть общего у непохожих
нефти, угля и тончайшей занавески на окнах, прочных рыболовных сетей и
парафиновых свечек, у нашей ручки, линейки и вазелина?
Что может быть общего у непохожих
нефти, угля и тончайшей занавески на окнах, прочных рыболовных сетей и
парафиновых свечек, у нашей ручки, линейки и вазелина?
Все они состоят из атомов углерода и водорода, все горят и относятся к углеводородам.
Повторение классификации органических веществ.
По слайдам определить место алканов среди органических веществ.
II. Операционно-исполнительский этап.
Записать тему урока.
Работа по учебнику: найдите другое название алканов и определение
класса.
На этом этапе происходит формирование новых понятий, способов
действий, усвоение этих понятий с помощью разных заданий.
Учащиеся записывают синонимы алканов, определение класса из учебника, составляют гомологический ряд алканов, используя карточки- подсказки.
СН4 — метан Чем отличаются по составу углеводороды?
С2Н6 — этан Что такое гомологи?
С3Н4 — пропан Как вывести общую формулу?
И т. д.
д.
С помощью фронтальной беседы вывести общую формулу алканов —
Cnh3n+2
Для закрепления этапа урока выполнить упражнение. Допишите цифры в алканах: C8H , С10Н , С22Н , СН34, СН42, СН104.
Демонстрация слайда «гомологический ряд».
Повторить и закрепить.
Работа по карточкам-подсказкам.
Как узнать агрегатное состояние алканов по температуре кипения?
Карандашом допишите агрегатное состояние алканов.
Проверка правильности по слайду «физические свойства».
Отметить дополнительные сведения об алканах: нет запаха, не растворяются в воде и других полярных растворителях. Газообразные и жидкие алканы хорошо горят.
Демонстрация зажигалок.
Строение метана
Проверка усвоения первичных знаний и закрепления проводится с помощью слайдов (строение алканов) и заполнения обобщающей таблицы.
Демонстрация слайда «Связи».
С — С — одинарные связи прочные и малополярные. Из —
за этого алканы химически инертны. Поэтому для них будут характерны реакции
замещения.
Поэтому для них будут характерны реакции
замещения.
Подвести итог этапу изученного на уроке.
Особенности номенклатуры.
Повторить правила номенклатуры и выполнить работу в парах «проведи линию». Ответы проверить.
«Проведи линию».
В двух столбцах табл. 1 приведены формулы алканов и их названия по номенклатуре ИЮПАК. Нужно соединить линией каждую формулу с соответствующим ей названием предельного углеводорода.
Правила составления названий парафинов:
1. Выбираем в формуле наиболее длинную углеродную цепь, нумеруем атомы углерода, начиная с того конца цепи, к которому ближе находится разветвление.
2. Называем радикалы, начиная с простейшего, и указываем цифрами их местоположение.
3. Даем полное название углеводороду по числу атомов углерода в нумерованной цепи.
|
СН3 – СН — СН3 I СН3
CH3 — CH2 — CH2 — CH3
СН3 — CH2 – CН — CH2 — CH3 I СН3
СН3 I CH3 — C — CH3 I СН3
|
2-Метилропан
2,2-демитилпропан
н-бутан
3- метилпентан |
III. Рефлексивно-оценочный этап.
Рефлексивно-оценочный этап.
Используя научность, доступность, ранее изученный материал, учащиеся изучили новую тему. Для осуществления самоконтроля, взаимоконтроля и закрепления изученного на уроке я использовала контрольный срез «алканы». С учащимися подвести итог изученного на уроке.
Контрольный срез
1. При нормальных условиях октан представляет собой:
а) Газ б) Жидкость в) Твердое вещество
2. В составе природного газа преобладает:
а) Метан б) Этан в) Пропан г) Бутан
3. Укажите формулу гомолога метана:
а) С3Н6 б) С6Н10 в) C7H14 г) C5H12
4. Укажите формулу предельного углеводорода:
а) С2Н4 б) С3Н8 в) С4Н6 г) С6Н6
Выставить оценки.
Домашнее
задание: параграф 3, знать номенклатуру,
гомологический ряд алканов, изомерию, физические, химические свойства
(самостоятельно выучить), отгадать кроссворд.
|
|
1 |
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
||||
|
|
|
|
3 |
|
|
|
|
||
|
|
|
4 |
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
$ |
|
|
|
|
|||
|
? |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
||||
По горизонтали:
1. Апкан, имеющий молекулярную
формулу С3Н8.
Апкан, имеющий молекулярную
формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3. Французский химик, имя которого носит реакция получения углеводородов с более длинной углеродной цепью взаимодействием галогенопроизводных предельных углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы метана.
5. Трихлорметан.
6. Название радикала С2Н5-.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных условиях. Если ребята правильно ответили на вопросы, то з выделенном столбце по вертикали получат одно из названий предельных углеводородов.
Приготовить к следующим темам «алкены» и «алкины» мультимедиа
презентации.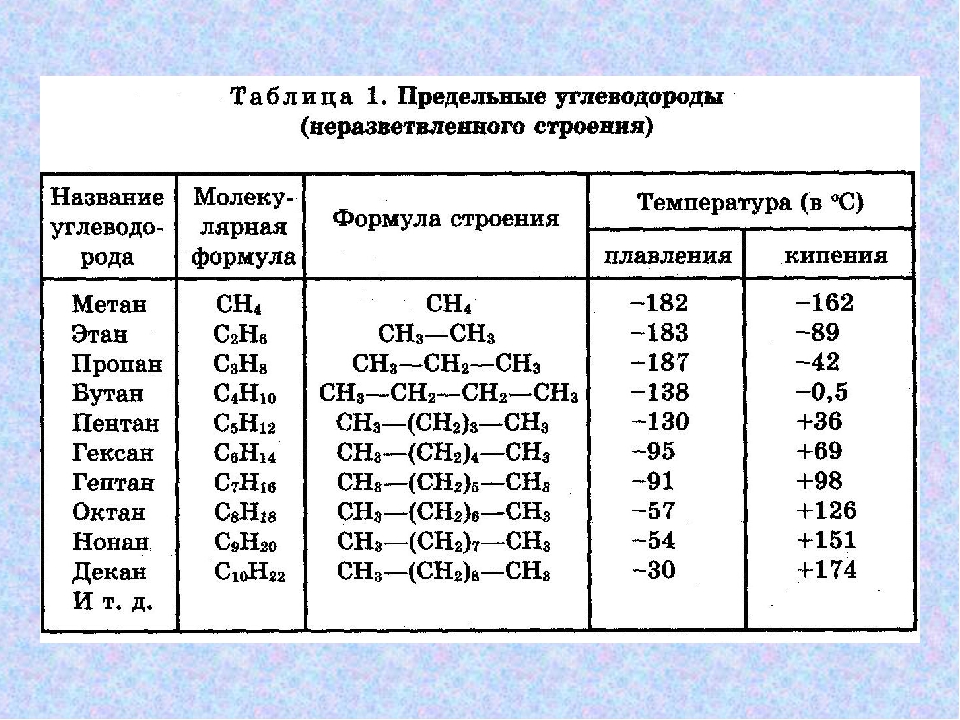
Скачано с www.znanio.ru
Технологическая карта урока по химии «Алканы»
Сидельникова И.М., учитель химии
МБОУ «Никифоровская СОШ №1»
Технологическая карта урока по химии
Тема урока: «Алканы. Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств»
Цель урока: организация условий достижения учащимися образовательных результатов по заданной теме:
— приобретение учебной информации,
— контроль усвоения теории,
— применение знаний и умений,
— формирование метапредметных УУД (регулятивных, познавательных, коммуникативных).
Задачи урока: освоение учащимися предметного (теоретического и практического) содержания по теме «Алканы. Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств»:
Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств»:
— знание определений понятий, понимание взаимосвязей между ними,
— умение применять эти знания и умения для решения практических задач,
— контроль уровня освоения материала,
— развитие метапредметных универсальных учебных действий.
Планируемые образовательные результаты:
Предметные
Знать: особенности электронного и пространственного строение молекулы алканов на примере метана, гомологический ряд предельных углеводородов, изомерию и номенклатуру алканов. Понимать: тетраэдрическое строение молекулы метана на основе представлений о гибридизации; Уметь: называть вещества по «тривиальной» и международной номенклатуре;
применять правила систематической международной номенклатуры как средства различения и идентификации веществ по их составу и строению. Характеризовать строение алканов; различать гомологи и изомеры, составлять формулы и называть их; конструировать модели молекул алканов;
Метапредметные:
Регулятивные
Постановка учащимися учебной задачи на основе сопоставления того, что известно и ранее усвоено, и того, что еще неизвестно.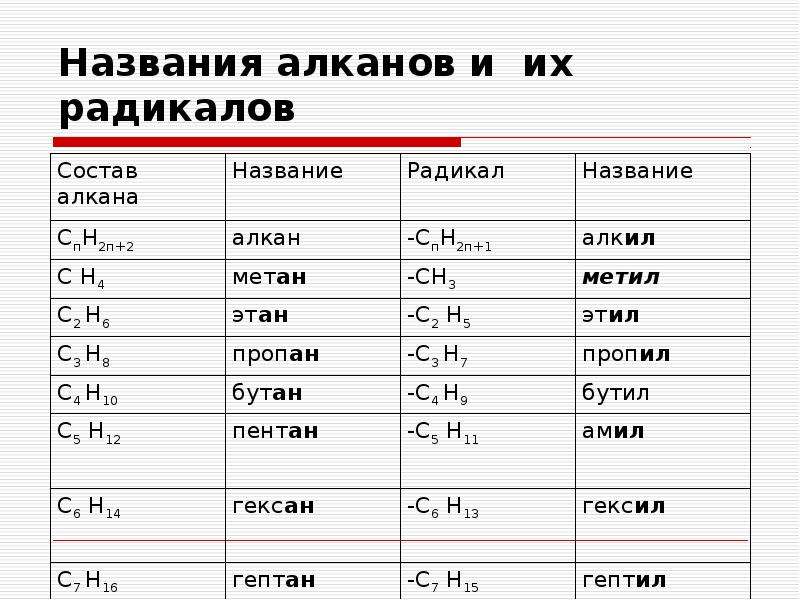 Выбор, принятие и сохранение учебной цели и задач. Составление плана достижения цели, осознанный выбор наиболее эффективных способов решения учебных и познавательных задач. Осуществление самоконтроля и самооценки, осознание качества и уровня усвоения. Саморегуляция учебной деятельности.
Выбор, принятие и сохранение учебной цели и задач. Составление плана достижения цели, осознанный выбор наиболее эффективных способов решения учебных и познавательных задач. Осуществление самоконтроля и самооценки, осознание качества и уровня усвоения. Саморегуляция учебной деятельности.
Познавательные
Сравнение, обобщение, конкретизация, анализ. Самостоятельное выделение и формулирование познавательной цели. Поиск и выделение необходимой информации. Умение определять понятия, создавать общения, устанавливать аналогии.
Умение структурировать знания и устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение и делать выводы. Рефлексия способов и условий действия, контроль и оценка процесса и результатов деятельности.
Коммуникативные
Планирование учебного сотрудничества и совместной деятельности с учителем и сверстниками. Умение работать индивидуально и в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учета интересов. Умение формулировать собственное мнение и позицию. Осознанное и произвольное построение речевых высказываний. Восприятие выступлений учащихся. Участие в обсуждении содержания материала. Взаимоконтроль, взаимопроверка, распределение обязанностей в группе. Формирование и развитие компетентности в области использования ИКТ.
Умение формулировать собственное мнение и позицию. Осознанное и произвольное построение речевых высказываний. Восприятие выступлений учащихся. Участие в обсуждении содержания материала. Взаимоконтроль, взаимопроверка, распределение обязанностей в группе. Формирование и развитие компетентности в области использования ИКТ.
Личностные
Формирование целостного мировоззрения, соответствующего современному уровню развития науки. Формирование ответственного отношения к учению, готовности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию. Осознанное осмысление обучающимися связи между целью учебной деятельности и ее мотивом. Осознание возникающих трудностей и стремление к их преодолению. Освоение новых видов деятельности. Формирование ценности безопасного образа жизни, усвоение правил индивидуального и коллективного безопасного поведения.
Организационная структура урока
|
Типовые этапы урока |
Задачи этапа |
Деятельность учителя |
Деятельность учащихся |
|
Организационный момент |
Положительный настрой на урок. |
Приветствует учащихся, проверяет готовность учащихся к уроку. |
Приветствуют учителя, проверяют готовность к уроку. |
|
Вхождение в тему урока и создание условий для осознанного восприятия нового материала |
Повторение и актуализация опорных знаний. Мотивация учебной деятельности. |
Организует работу по актуализации опорных знаний через выполнение задания по решению задачи на нахождение молекулярной формулы алкана. Предлагает ответить на вопросы: 1. Какая валентность характерна для атома «С» в органических веществах? 2. Сколько атомов «С» и «Н» входит в состав полученного углеводорода? Предлагает составить структурную формулу метана и ответить на вопрос интернет-урока №1. «Гомологический ряд алканов. Строение, номенклатура и изомерия алканов»: Почему алканы часто называют предельными углеводородами? |
Решают задачи на нахождение молекулярной формулы алкана по его плотности и массовым долям элементов, входящих в его состав. (для контроля и наглядности один ученик работает у доски). Отвечают на вопросы учителя (фронтальная работа). Составляют структурную формулу метана в тетради и отвечают на поставленный вопрос. |
|
Определение темы, цели и задач урока. Самоопределение в деятельности. |
Предлагает вспомнить определение гомологии (гомолог) и изомерии (изомеры) и её виды. Подводит итог того, что ученики уже многое знают о строении органических веществ. Нацеливает на систематизацию материала. Помогает учащимся сформулировать тему, цель и задачи урока. |
Работают в парах с материалом МЭО и ЭФУ (используют материал МЭО – Делают вывод о полученных ранее знаниях. Определяют тему урока «Алканы. |
|
|
Организация и самоорганизация учащихся в ходе усвоения материала. Организация обратной связи. |
Организация деятельности учащихся по освоению учебной информации на уровне «знание». |
Объясняет новую тему в режиме обсуждения с учащимися материала ЭФУ и МЭО занятие 2, интернет-урока №1. «Гомологический ряд алканов. Строение, номенклатура и изомерия алканов» Организует индивидуальную работу по выполнению интерактивного теста ( ЭФУ) |
Учащиеся самостоятельно работают с заданием в МЭО и электронным учебником (Габриелян О. С. Химия. Базовый уровень. 10 класс) Выделяют в ЭФУ цветом особо важную информацию, делают заметки и закладки. Определяют общую формулу алканов, признаки по которым углеводороды можно отнести к данному классу органических веществ. Формулируют определение алканов. Работают с электронным учебником (Габриелян О. С. Химия. Базовый уровень. 10 класс) выполняют тест «Гомологический ряд метана». Комментируют правильность выполнения теста. |
|
Первичное осмысление и закрепление связей и отношений объектов. Организация деятельности учащихся по освоению учебной информации на уровне «понимания». |
Организует работу в группах по изучению учебных модулей и выполнению предложенного задания. |
Работают в 3-х группах: изучают модули «Строение алканов на примере молекулы метана», «Гомологический ряд алканов. Виды изомерии предельных углеводородов», «Физические свойства алканов» (используют материал МЭО — интернет-урока №1. «Гомологический ряд алканов. и ЭФУ — параграф 3). Анализируют строение и физические свойства алканов. По результатам работы делают опорные конспекты. Каждая группа представляет результаты своей работы. Сравнивают с эталоном (Слайды 13-22 презентации к уроку). |
|
|
Практикум |
Организация деятельности учащихся по освоению учебной информации на уровне «умения». |
Организует работу с шаро-стержневыми моделями. Напоминает учащимся о необходимости соблюдения техники безопасности при работе с шаро-стержневыми моделями. Организует просмотр видео «Модели молекул метана и других углеводородов» Организует работу в парах по «Изготовление моделей молекул алканов». Акцентирует внимание школьников на правильности составления формул изомеров и их отличии от гомологов. Обобщение знаний проводится при выполнении заданий на составление формул гомологов и изомеров. Предлагает выполнить задания из МЭО Интернет-урок 2. Теория химического строения А.М.Бутлерова. Изомерия и изомеры и Занятие 2. Алканы и циклоаллканы Интернет-урок 1. Гомологический ряд алканов. Строение, номенклатура и изомерия алканов. |
Повторяют общие правила техники безопасности при работе с шаро-стержневыми моделями. (Работают с электронным учебником (Габриелян О. С. Химия. Базовый уровень. 10 класс) просмотр динамической шаро-стержневой модели молекулы метана) и просмотр обучающего видео «Модели молекул метана и других углеводородов» Составляют модели изомеров гексана, называют их по систематической номенклатуре. При этом вспоминают определение изомерии (изомеры) и её видов. Выполняют задание и составляют формулы изомеров пентана с последующей взаимопроверкой. Выполняют задание и дают название алкана по систематической номенклатуре с последующей самомопроверкой. Пытаются ответить на проблемный вопрос: Почему алканы часто называют предельными углеводородами? |
|
Проверка полученных результатов |
Организация деятельности учащихся по предъявлению результата освоения учебной информации. |
Организует состязание между группами на быстроту нахождения ответов на задания. |
Делятся на 2 группы. Отвечают на предложенные вопросы. |
|
Подведение итогов. Домашнее задание. |
Проведение самоанализа и самооценки собственной деятельности. Обеспечить понимание учащимися цели, содержания и способов выполнения домашнего задания. |
Делает выводы о работе учащихся. Выставляет отметки в Дневник.ру Сообщает и записывает домашнее задание, комментирует его выполнение. |
Рефлексируют, анализируют, какие умения и навыки отработали и закрепили. Отмечают домашнее задание в электронном учебнике. |
Используемая литература:
- Видео «Модели молекул метана и других углеводородов»
- Габриелян О. С. Химия. 10 класс, Базовый уровень. ЭФУ – М.: Дрофа, 2018.
- Мобильное электронное образование
- Хомченко И.Г. Общая химия: Учебник. – М.: ООО «Издательство Новая Волна», 1998.- 464
алканов — что это такое? Первые 20 алканов
Алканы: строительные блоки топлив
Топлива представляют собой смеси углеводородных цепей различной длины, отвечающие формуле C n +H 2n+2 . Молекулы, отвечающие этой формуле, известны как «алканы», и эти углеводороды содержатся во всех органических веществах. Они также составляют сырую нефть, и когда сырая нефть очищается путем фракционной перегонки, эти смеси алканов могут быть разделены на множество полезных продуктов, таких как дизельное топливо, газойль, керосин, судовой газойль и смазочные материалы среди других.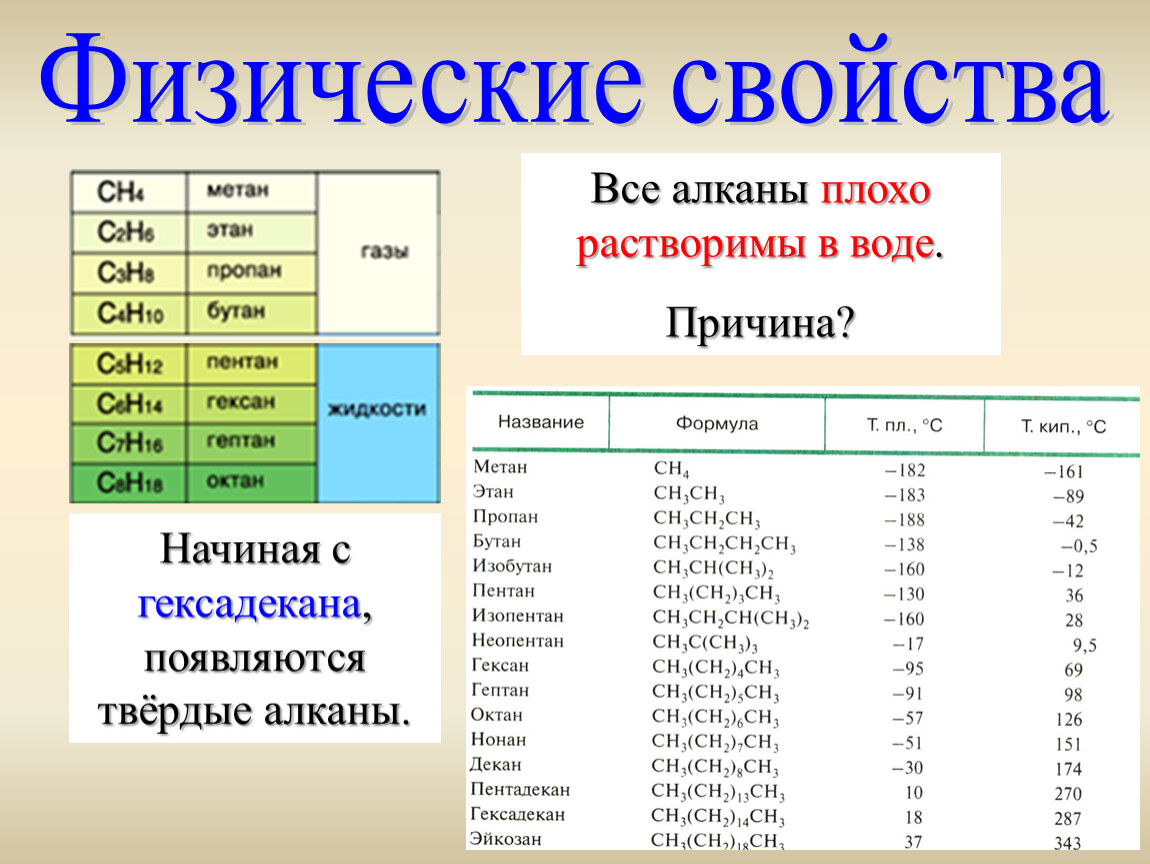
Алканы — не единственные углеводородные цепи, встречающиеся в сырой нефти — алкены (углеводороды с формулой C n + H 2n ) также присутствуют в сырой нефти, и они используются в химических процессах, а не в качестве топлива.
Когда смесь алканов образует дистиллят с температурой воспламенения выше 42 o C, они классифицируются как жидкое топливо. Подробнее о мазуте здесь.
Если вы хотите узнать больше о процессе очистки сырой нефти, который позволяет алканам создавать полезное топливо и масла, прочтите наше руководство по фракционной перегонке сырой нефти.
Таблица алкановых углеводородов
Ниже перечислены первые 20 алканов, хотя их намного больше. Каждый тип топлива будет иметь смеси различных алкановых цепей, и эти смеси придадут топливу желаемые свойства.
| алкан | Молекулярная формула | Состав | атомов углерода в цепи | атомов водорода в цепи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| метана | СН 4 | CH 4 | 1 | 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CH 3 -CH 3 | 2 | 2 | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пропан | C 3 H 8 | CH 3 -CH 2 -CH 3 | 3 | 3 | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Butane | C 4 H 10 | CH 3 -2 (CH 2 ) -CH 3 | 4 | 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pentane | C 5 H 12 | CH 900 05 3 -3 (CH 2 ) -CH 3 ) -CH 3 | 5 | 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гексан | C 6 H 14 | CH 3 -4 (CH 2 ) -CH 3 | 6 | 14 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HEPTANE | C 7 H 16 | CH 3 -5 (CH 2 ) -CH 37 | 16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Octane | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C 8 H 18 | CH 3 -6 (CH 2 ) -CH 3 38 | 18 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nonane | C 9 h 20 | CH 3 -7 (CH 2 ) -CH 3 | 9 | 9 | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Decane | C 10 H 22 | CH 3 -8(CH 2 )-CH 3 | 10 | 22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| undecane | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| undecane | C 11 H 24 | CH 3 -9 (CH 2 ) -CH 3 | 311 | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dodecane | C 12 H 26 | CH 3 -10 (CH 2 ) -CH 3 ) -CH 3 | 12 | 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tridecane | C 13 H 28 | CH 3 -11 (CH 2 ) -CH 3 | 13 | 28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| тетрадекана | C 14 H 30 | CH 3 -12 (CH 2 ) -CH 3 | 14 | 14 | 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PentadeCane | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C 15 H 32 H 32 | CH 3 -13 (CH 2 ) -CH 3 | 15 | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цетан (гексадекатан) | С 16 H 34 | CH 3 -14 (CH 2 ) -CH 3 ) -CH 3 | 16 | 16 | 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HeptadeCane | C 17 H 36 | CH 3 -15 (CH 2 ) -CH 3 ) -CH 3 | 17 | 36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| OctadeCane | C 18 H 38 | CH 3 -16 (CH 2 ) -CH 3 | 18 | 38 | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nonadecane | C 19 H 40 H CH | CH 3 -17 (CH 2 ) -CH 3 | 19 | 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eicosane | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C 20 H 42 | CH 3 -18 (CH 2 ) -CH 3 | 20 | 42 |
Алканы с разветвленной цепью получают из линейных алканов, но имеют не только прямую цепь в своей химической структуре, но и разветвленную одну или несколько алкильных групп. Алкильная группа представляет собой группу атомов углерода и водорода, присоединенных к молекуле алкана.Давайте взглянем на некоторые примеры разветвленных алканов, чтобы представить их более четко.
Алкильная группа представляет собой группу атомов углерода и водорода, присоединенных к молекуле алкана.Давайте взглянем на некоторые примеры разветвленных алканов, чтобы представить их более четко.
Мы видим, что алкановая цепь имеет ответвления алкильных групп.
Циклические алканы или циклоалканы состоят из атомов водорода и углерода, связанных вместе одинарными связями, где атомы углерода связаны друг с другом, образуя кольцо или петлю.
Общая химическая формула алканов и примеры
Общая формула алканов:
Общая формула циклических алканов:
Давайте рассмотрим несколько примеров алканов.Здесь мы видим, что эти алканы следуют общей химической формуле, указанной выше.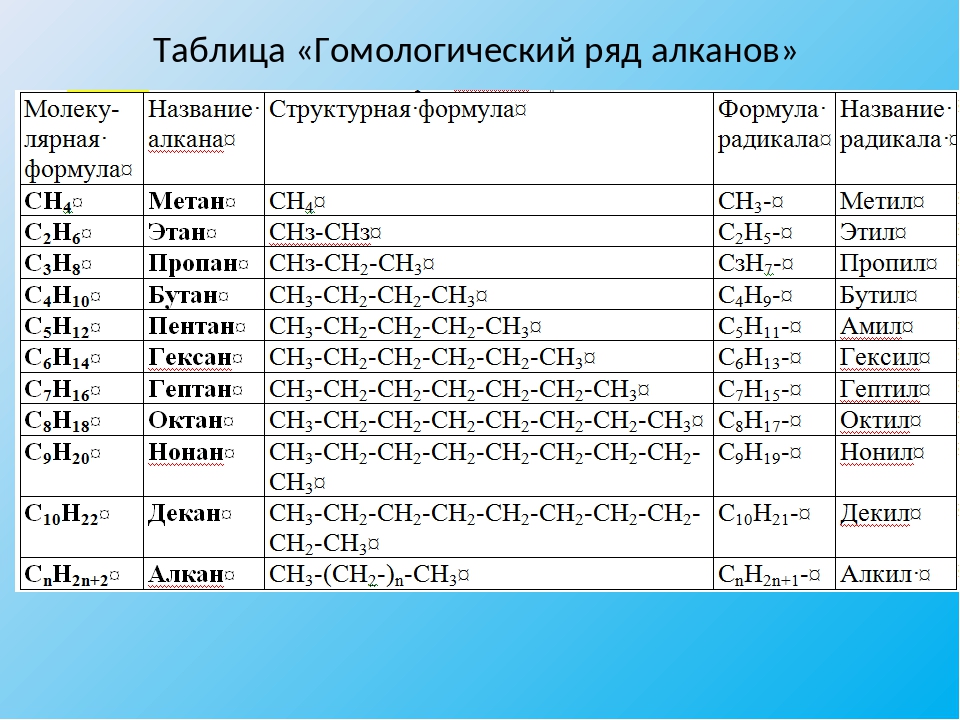
Пример 1: Пентан
Пентан представляет собой линейный алкан с прямой цепью и имеет пять атомов углерода (C), поэтому n = 5. Поэтому здесь мы используем общую химическую формулу для алканов C n h3( п +1).
Пример 2: Циклобутан
Циклобутан представляет собой циклический алкан и имеет четыре атома углерода (С), поэтому n = 4.Четыре атома углерода связаны друг с другом, образуя одно кольцо. Здесь мы используем общую формулу для циклических алканов C n h3( n +1- g ). Циклобутан можно нарисовать двумя способами: слева мы видим, что он показывает все атомы углерода и водорода, а справа циклобутан можно нарисовать в виде квадрата, где атомы водорода не показаны, и каждый край квадрата представляет атомы углерода. В химической структуре у нас есть кольцо, поэтому г = 1.
Пример 3: Спиро[2.
 2]пентан
2]пентан Спиро[2.2]пентан представляет собой алкан с двумя кольцами, поэтому он представляет собой циклический алкан с общей формулой C n h3( n +1- g ). Ниже мы видим, что каждое ребро структуры представляет собой атом углерода. Имеется 5 атомов углерода, поэтому n = 5, и два кольца, поэтому г = 2. Формула спиро[2.2]пентана C5H8. Давайте попробуем и посмотрим, соответствуют ли n = 5 и g = 2 общей химической формуле циклических алканов.
Пример 4: Декалин
Декалин представляет собой алкан с двумя кольцами, слитыми вместе, поэтому он классифицируется как циклический алкан с общей химической формулой C n h3( n +1- g ). Каждое ребро химической структуры соответствует одному атому углерода, поэтому имеется 10 атомов углерода и два кольца. Химическая формула C10h28. В этом случае n = 10 и г = 2.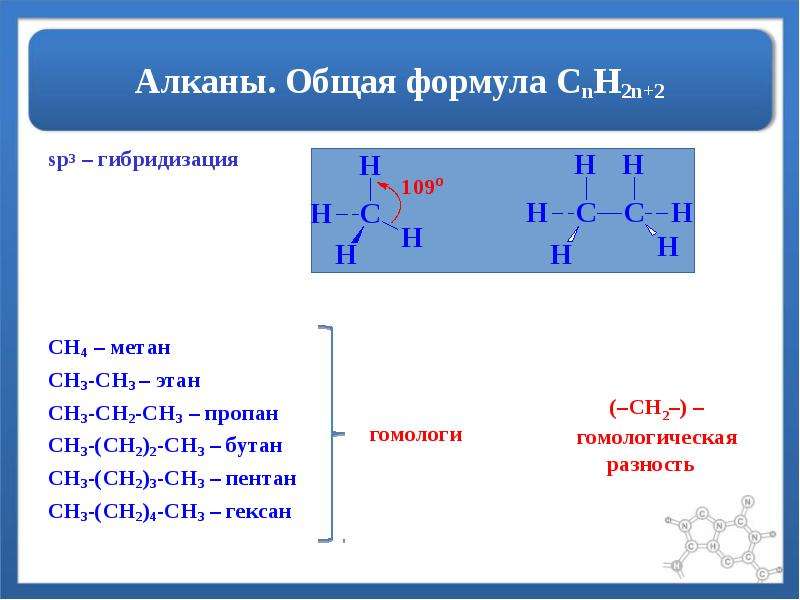 Если мы подставим эти значения в общую химическую формулу алканов, то получим, что C10h28 соответствует общей химической формуле алканов.
Если мы подставим эти значения в общую химическую формулу алканов, то получим, что C10h28 соответствует общей химической формуле алканов.
Краткий обзор урока
Алканы — это атомы углеводородов, состоящие из одинарных связей. Существует три типа алканов: линейные алканы с прямой цепью, разветвленные алканы и циклические алканы. Алканы с линейной прямой цепью состоят из углеводородной прямой цепи, в которой атомы углерода связаны друг с другом одинарными связями. Алканы с разветвленной цепью получают из линейных алканов с прямой цепью, но вместо одной прямой цепи в прямой цепи имеется одно или несколько ответвлений алкильных групп. Циклические алканы состоят из атомов водорода и углерода, одинарно связанных друг с другом, где атомы углерода связаны друг с другом, образуя кольцо.
Общая химическая формула алканов:
Общая химическая формула циклических алканов:
Алканы.
 Словарь терминов и определений
Словарь терминов и определений - Алканы : атомы углеводородов с одинарной связью
- Линейные алканы : атомы углерода связаны друг с другом в цепочечную структуру
- Алканы с разветвленной цепью : вместо прямой цепи имеется одно или несколько ответвлений алкильных групп на прямой цепи
- Циклические алканы : состоят из атомов водорода и углерода, соединенных одинарными связями, а атомы углерода связаны в кольцо
Результаты обучения
Просмотрите, просмотрите и проконсультируйтесь с этим уроком по алканам, когда будете готовиться к последующим:
- Обсудить структуру алканов
- Определите основные типы алканов
- Распознать химическую формулу алканов
Типы, свойства и структурная формула
Что такое алканы?
Алканы представляют собой органические соединения, состоящие из одинарно связанных атомов углерода и водорода. Формула алканов Cnh3n+2. Их можно разделить на три группы: цепные алканы, циклоалканы и разветвленные алканы.
Самое основное семейство соединений называется алканы. В их состав входят только водород и углерод. Каждый атом углерода образует четыре связи, а каждый атом водорода образует твердую связь. Химики использовали формулы угла линии, поскольку их быстрее и проще рисовать, в отличие от сокращенных структурных формул. Структурные формулы алканов действительно можно записать в сокращенной форме.
Углеводороды
Метан простой алкан содержит один атом углерода и четыре атома водорода, а его молекулярная формула – Ch5. Углеводородное значение состоит в том, что эти соединения состоят исключительно из атомов водорода и углерода. Поскольку это соединение имеет только одинарную ковалентную связь, его химическая структура
(Изображение будет добавлено в ближайшее время)
Длинноцепочечные молекулы алканов
С помощью одинарной ковалентной связи дополнительные атомы углерода связаны друг с другом. в длинноцепочечной молекуле алкана.Каждый атом связан с соответствующими атомами водорода, образуя в общей сложности 4 одинарных ковалентных связи. Вся длинноцепочечная структура называется октаном. Восьмиуглеродный алкан имеет молекулярную формулу C8h28 и структурную формулу, как показано на изображении ниже.
в длинноцепочечной молекуле алкана.Каждый атом связан с соответствующими атомами водорода, образуя в общей сложности 4 одинарных ковалентных связи. Вся длинноцепочечная структура называется октаном. Восьмиуглеродный алкан имеет молекулярную формулу C8h28 и структурную формулу, как показано на изображении ниже.
(изображение будет добавлено в ближайшее время)
Молекулярная формула
Структурная формула
Метан
(Ch5)
(изображение, чтобы быть добавлены в ближайшее время)
Метан
Этан
(C2H6)
(изображение, чтобы добавить в ближайшее время)
Этан
6 (C3H8)
Бутан
(C4h20)
(Изображение будет добавлено в ближайшее время)
Бутан 900 09
(C5H22)
(изображение, которое будет добавлено в ближайшее время)
Pentane
| 6 (C6H24) | (изображение Добавил скоро) гексан | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (C7H26) | (изображение, которое будет добавлено) Heptane | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Физические свойства алкалина прочие
По мере увеличения молекулярной массы или площади поверхности молекулы происходит значительное увеличение межмолекулярных сил Ван-дер-Ваальса.Есть два наблюдения, связанные с этим процессом:
Структурная формула алканаСтруктурные формулы алканов можно записать в сокращенной форме. Например, структурная формула пентана включает три группы метилена Ch3 в центральной части цепи. Их можно сгруппировать вместе, а структурную формулу можно записать. Самые первые пять алкан формул с неразветвленной цепью показаны ниже:
|



 Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств», ставят цель урока и намечают пути ее достижения через формулировку задач урока.
Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств», ставят цель урока и намечают пути ее достижения через формулировку задач урока.
 Строение, номенклатура и изомерия алканов»
Строение, номенклатура и изомерия алканов»
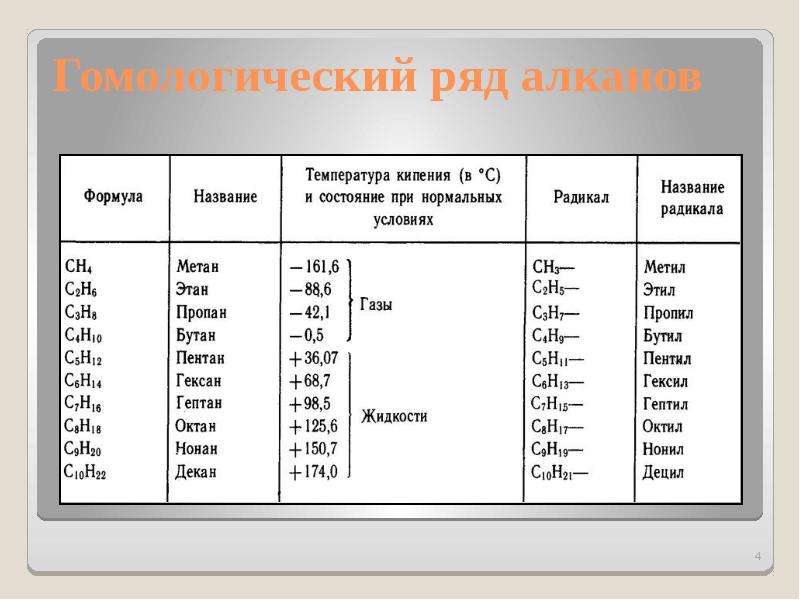


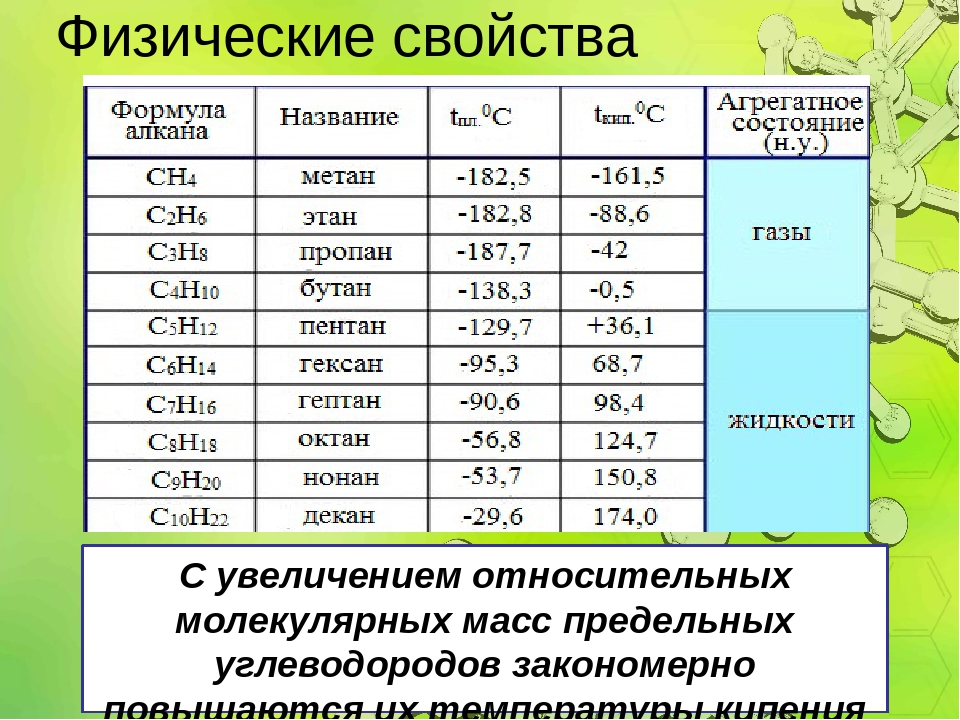
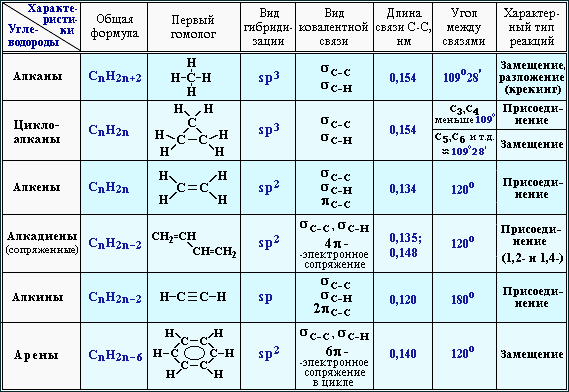
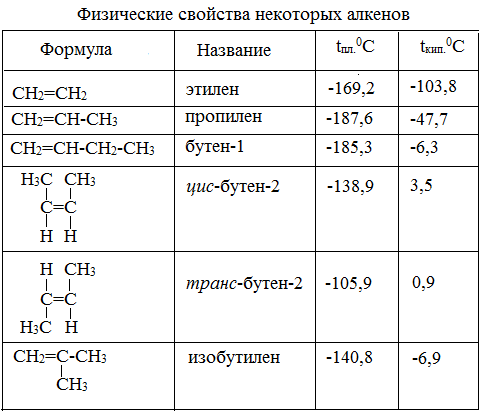 Молекулярные формулы, такие как формула октана, указывают количество и типы атомов в молекуле соединения. Молекулярную формулу C8h28 можно применять даже ко многим алканам, каждый из которых обладает уникальными физическими, химическими и токсикологическими свойствами. Соединения с одинаковой молекулярной формулой, но разными структурными формулами, известны как структурные изомеры этого соединения.
Молекулярные формулы, такие как формула октана, указывают количество и типы атомов в молекуле соединения. Молекулярную формулу C8h28 можно применять даже ко многим алканам, каждый из которых обладает уникальными физическими, химическими и токсикологическими свойствами. Соединения с одинаковой молекулярной формулой, но разными структурными формулами, известны как структурные изомеры этого соединения. 
 Они называются с использованием префикса, обозначающего количество атомов углерода в молекуле, и суффикса -ан (см. ниже).
Они называются с использованием префикса, обозначающего количество атомов углерода в молекуле, и суффикса -ан (см. ниже).
 В прямых цепях каждый средний углерод связан с двумя другими атомами углерода и двумя атомами водорода. Концевые атомы углерода связаны только с одним углеродом, но с тремя атомами водорода.
пентан
В прямых цепях каждый средний углерод связан с двумя другими атомами углерода и двумя атомами водорода. Концевые атомы углерода связаны только с одним углеродом, но с тремя атомами водорода.
пентан
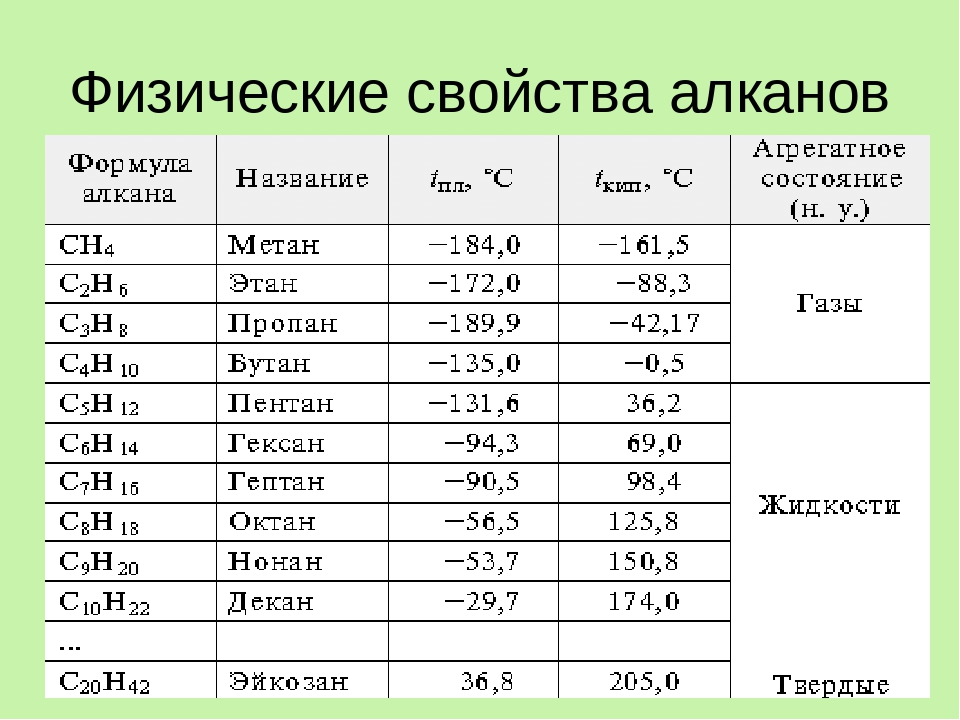 с 0,1% гидрохинона
с 0,1% гидрохинона 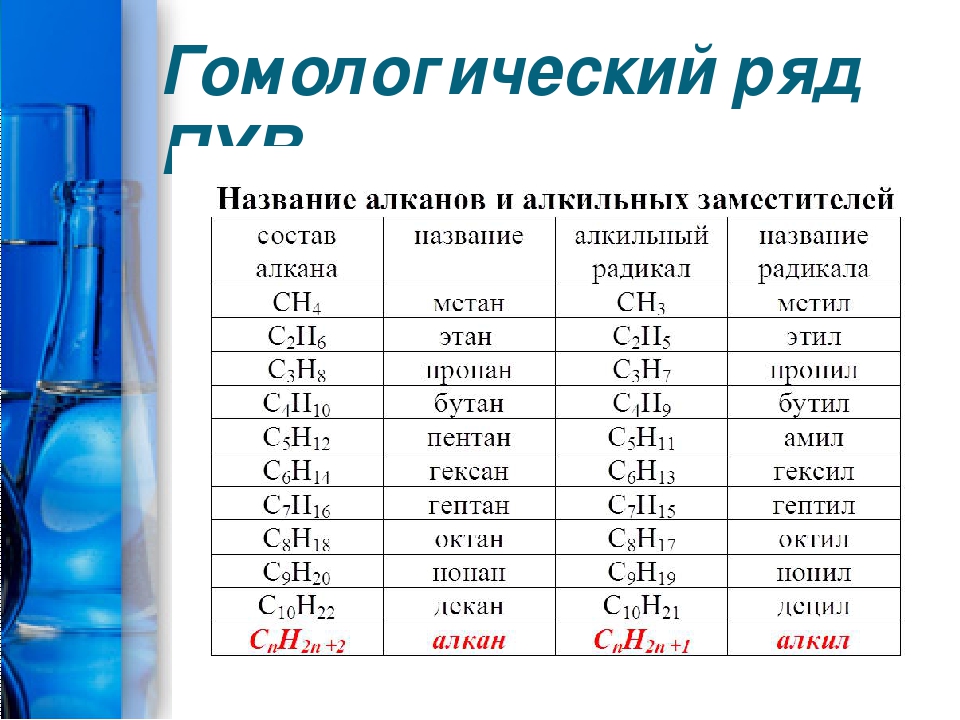 с 0,1% BHT
с 0,1% BHT  с 0,1% BHT
с 0,1% BHT  04 г/моль
04 г/моль  2 г/моль
2 г/моль 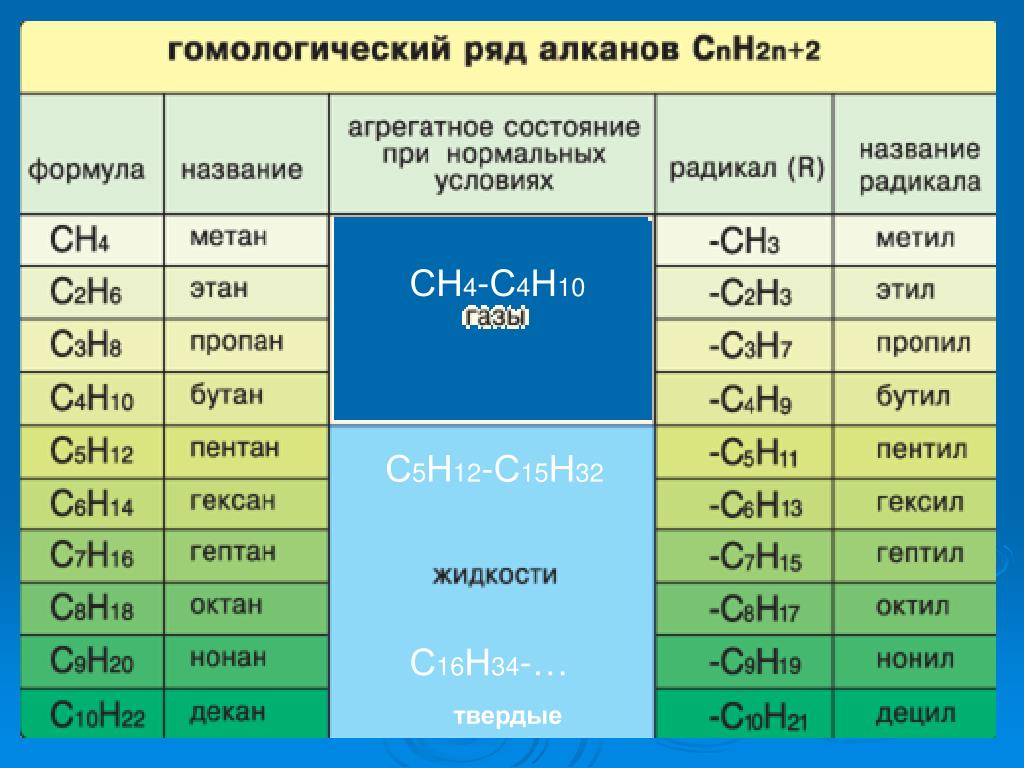 1мб — высокое разрешение
1мб — высокое разрешение  9мб — высокое разрешение
9мб — высокое разрешение  Эти соединения называются углеводородами. Органическое соединение, состоящее из углерода и водорода. Сами углеводороды делятся на два типа: алифатические углеводороды и ароматические углеводороды.Алифатические углеводородыУглеводород на основе цепочек атомов С. представляют собой углеводороды, основанные на цепочках атомов С. Существует три типа алифатических углеводородов. Алканы — алифатические углеводороды, содержащие только одинарные ковалентные связи. являются алифатическими углеводородами только с одинарными ковалентными связями. Алкены – алифатические углеводороды, содержащие двойную связь С–С. Углеводороды, содержащие хотя бы одну двойную связь С—С, и алкины — алифатические углеводороды, содержащие тройную связь С—С. углеводороды, содержащие тройную связь С-С.Иногда встречаются алифатические углеводороды с кольцом из атомов С; эти углеводороды называются циклоалканы (или циклоалкены или циклоалкины ).
Эти соединения называются углеводородами. Органическое соединение, состоящее из углерода и водорода. Сами углеводороды делятся на два типа: алифатические углеводороды и ароматические углеводороды.Алифатические углеводородыУглеводород на основе цепочек атомов С. представляют собой углеводороды, основанные на цепочках атомов С. Существует три типа алифатических углеводородов. Алканы — алифатические углеводороды, содержащие только одинарные ковалентные связи. являются алифатическими углеводородами только с одинарными ковалентными связями. Алкены – алифатические углеводороды, содержащие двойную связь С–С. Углеводороды, содержащие хотя бы одну двойную связь С—С, и алкины — алифатические углеводороды, содержащие тройную связь С—С. углеводороды, содержащие тройную связь С-С.Иногда встречаются алифатические углеводороды с кольцом из атомов С; эти углеводороды называются циклоалканы (или циклоалкены или циклоалкины ).  имеют особое шестиуглеродное кольцо, называемое бензольным кольцом . Электроны в бензольном кольце обладают особыми энергетическими свойствами, которые придают бензолу физические и химические свойства, заметно отличающиеся от свойств алканов. Первоначально термин ароматический использовался для описания этого класса соединений, потому что они были особенно ароматными.Однако в современной химии термин ароматический обозначает наличие шестичленного кольца, которое придает молекуле различные и уникальные свойства.
имеют особое шестиуглеродное кольцо, называемое бензольным кольцом . Электроны в бензольном кольце обладают особыми энергетическими свойствами, которые придают бензолу физические и химические свойства, заметно отличающиеся от свойств алканов. Первоначально термин ароматический использовался для описания этого класса соединений, потому что они были особенно ароматными.Однако в современной химии термин ароматический обозначает наличие шестичленного кольца, которое придает молекуле различные и уникальные свойства. 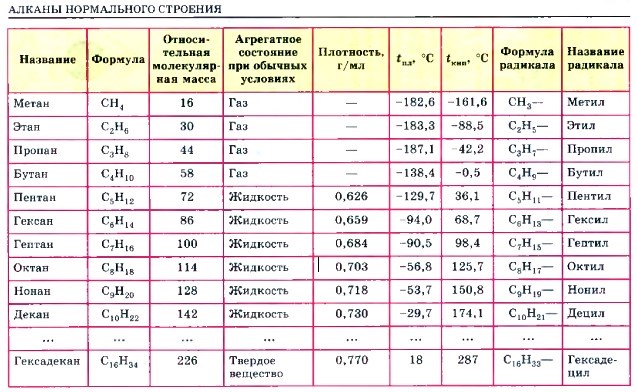 Лучшее представление молекулы метана показано на рис. 16.1 «Трехмерное представление метана».
Лучшее представление молекулы метана показано на рис. 16.1 «Трехмерное представление метана». 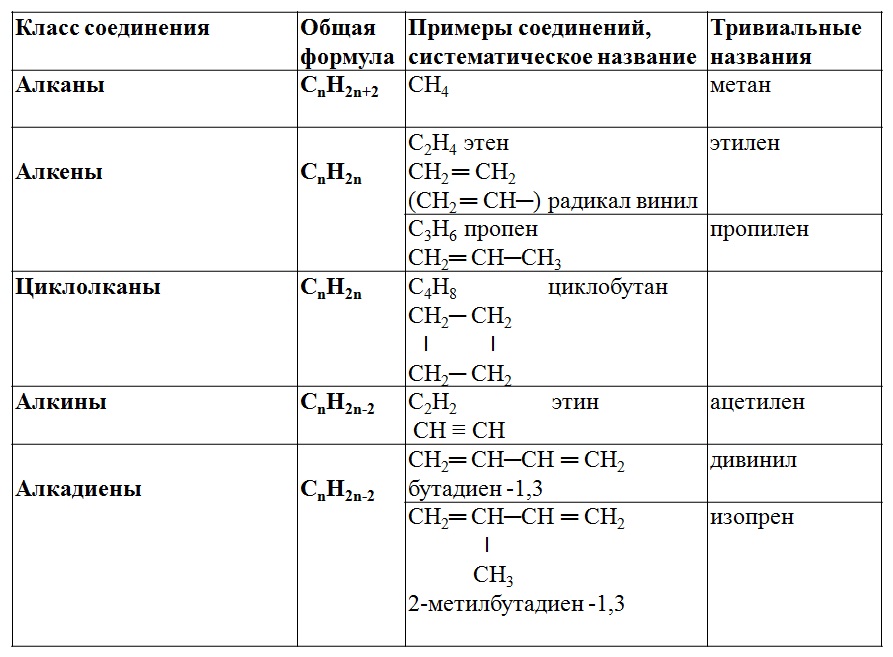 , в котором перечислены формулы каждого атома C в основной цепи молекулы. Например, сокращенная структурная формула этана — CH 3 CH 3 , а пропана — CH 3 CH 2 CH 3 . В таблице 16.1 «Первые 10 алканов» приведены молекулярные формулы, сокращенные структурные формулы и названия первых 10 алканов.
, в котором перечислены формулы каждого атома C в основной цепи молекулы. Например, сокращенная структурная формула этана — CH 3 CH 3 , а пропана — CH 3 CH 2 CH 3 . В таблице 16.1 «Первые 10 алканов» приведены молекулярные формулы, сокращенные структурные формулы и названия первых 10 алканов.  Углеродное соединение с максимально возможным числом атомов Н в его формуле..
Углеродное соединение с максимально возможным числом атомов Н в его формуле..  С четырьмя атомами C двойная связь C–C может проходить между первым и вторым атомами C или между вторым и третьим атомами C:
С четырьмя атомами C двойная связь C–C может проходить между первым и вторым атомами C или между вторым и третьим атомами C:  Различные молекулы с одинаковой молекулярной формулой называются изомерами. Молекула с той же молекулярной формулой, что и другая молекула, но с другой структурой. Изомеры распространены в органической химии и вносят свой вклад в ее сложность.
Различные молекулы с одинаковой молекулярной формулой называются изомерами. Молекула с той же молекулярной формулой, что и другая молекула, но с другой структурой. Изомеры распространены в органической химии и вносят свой вклад в ее сложность. 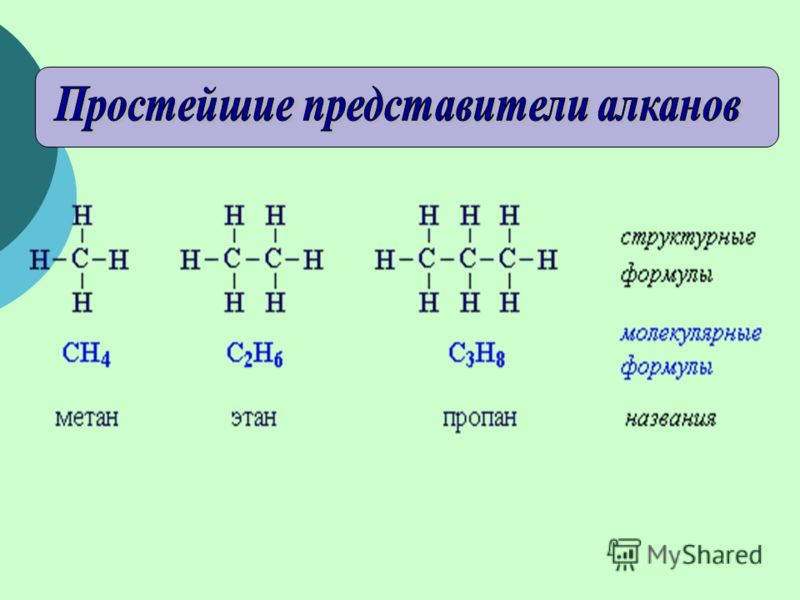 Наименьшим алкином является этин, также известный как ацетилен:
Наименьшим алкином является этин, также известный как ацетилен: 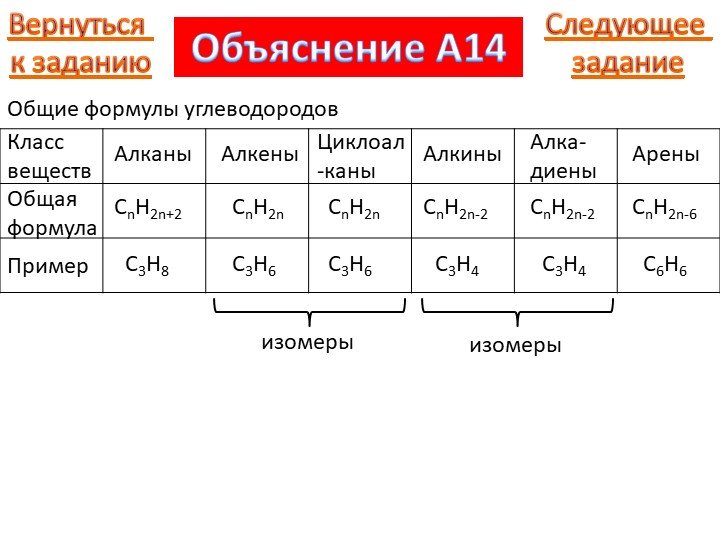 Как таковые, они лишь умеренно растворяются в H 2 O и других полярных растворителях. Небольшие углеводороды, такие как метан и этан, представляют собой газы при комнатной температуре, тогда как более крупные углеводороды, такие как гексан и октан, представляют собой жидкости. Даже более крупные углеводороды представляют собой твердые вещества при комнатной температуре и имеют мягкую воскообразную консистенцию.
Как таковые, они лишь умеренно растворяются в H 2 O и других полярных растворителях. Небольшие углеводороды, такие как метан и этан, представляют собой газы при комнатной температуре, тогда как более крупные углеводороды, такие как гексан и октан, представляют собой жидкости. Даже более крупные углеводороды представляют собой твердые вещества при комнатной температуре и имеют мягкую воскообразную консистенцию.  Реакция молекулы галогена через двойную или тройную связь С–С.. Один пример
Реакция молекулы галогена через двойную или тройную связь С–С.. Один пример 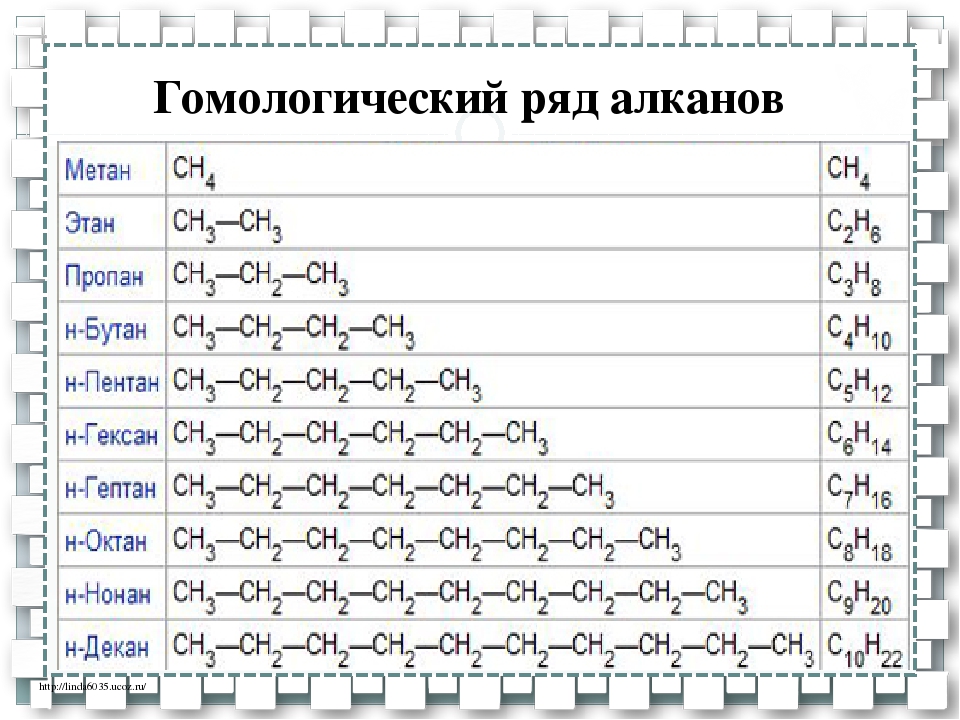 16.2 «Сгорание»). Реакция горения бензина, например, которую можно представить как C 8 H 18 , выглядит следующим образом:
16.2 «Сгорание»). Реакция горения бензина, например, которую можно представить как C 8 H 18 , выглядит следующим образом: