Свойства алканов — урок. Химия, 8–9 класс.
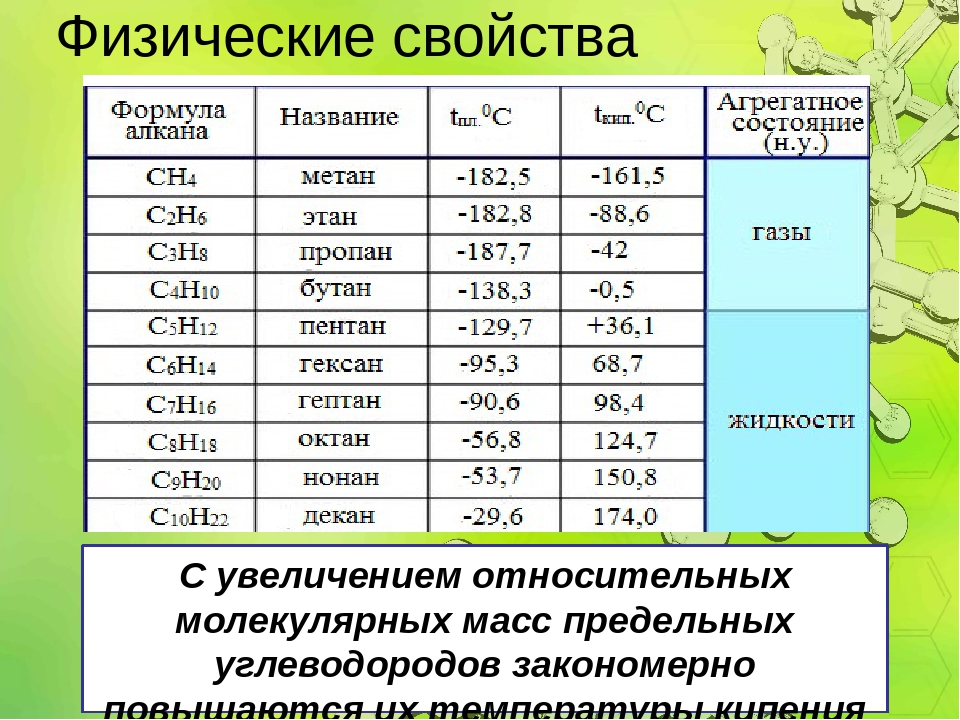
Физические свойства алканов
С ростом числа атомов углерода в гомологическом ряду алканов возрастают:
- температуры кипения;
- температуры плавления;
- плотность.
Метан, этан, пропан и бутан представляют собой бесцветные газы, не имеющие запаха.
Пентан и следующие алканы — бесцветные жидкости с характерным запахом.
Алканы с большим числом атомов углерода (\(> 15\)) — твёрдые легкоплавкие вещества без запаха.
Все алканы практически не растворяются в воде.
Химические свойства алканов
1. Реакции замещения.
Алканы реагируют при освещении с галогенами (хлором и бромом).
2. Реакции дегидрирования.
При нагревании все алканы способны разлагаться с отщеплением водорода:
3. Реакции разложения.
При сильном нагревании алканы разлагаются на уголь и водород:
4. Реакция горения.
Все алканы горят. При этом образуются углекислый газ и вода и выделяется большое количество тепла:
Нахождение в природе и применение алканов
Газообразные алканы (метан — бутан) входят в состав природного газа. Жидкие и твёрдые алканы содержатся в нефти.
Применение алканов основано на их свойствах.
Выделение большого количества теплоты позволяет использовать насыщенные углеводороды в качестве топлива.
Способность вступать в химические реакции даёт возможность применять алканы в качестве сырья для производства разнообразных органических веществ.
Физические и химические свойства алканов
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
| Название вещества | Структурная формула |
Метан |
CH4 |
|---|---|
|
Этан |
C2H6 |
|
Пропан |
C3H8 |
|
Бутан |
C4H10 |
|
Пентан |
C5H12 |
|
Гексан |
C6H14 |
|
Гептан |
C7H16 |
|
Октан |
C8H18 |
|
Нонан |
C9H20 |
|
Декан |
C10H22 |
В молекулах алканов выделяют первичные (т. е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C1h4 – C2H2 – C1H3 (1 – первичные, 2- вторичные атомы углерода)
CH3 –C3H(CH3) – CH3 (3- третичный атом углерода)
CH3 – C4(CH3)3 – CH3 (4- четвертичный атом углерода)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
CH3-CH2-CH2-CH2-CH3 (пентан)
CH3 –CH(CH3)-CH2-CH3 (2-метилбутан)
CH3-C(CH3)2-CH3 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Углы между связями в молекулах алканов 109,5.
Химические свойства алканов
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов.
X:X → 2X. (1)
R:H + X. → HX + R. (2)
R. + X:X → R:X + X
R. + R. → R:R (3)
R. + X. → R:X (3)
X. + X. → X:X (3)
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
CH4 + Cl2 = CH3Cl + HCl (хлорметан)
CH3Cl +Cl2 = CH2Cl2 + HCl (дихлорметан)
CH2Cl2 +Cl2 = CHCl3 + HCl (трихлорметан)
CHCl3 +Cl2 = CCl4
+ HCl (тетрахлорметан)
Нитрование (реакция Коновалова)
. При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция:
При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция:
CH3-CH3 +HNO3 = CH3-CH2-NO2 (нитроэтан) + H2O
Сульфохлорирование и сульфоокисление. Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды:
R-H + SO2 + Cl2 → R-SO3Cl + HCl
Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты:
R-H + SO2 + ½ O2 → R-SO3H
Крекинг
С8H18 = C4H10 (бутан)+ C3H8 (пропан)
2CH4 = C2H2 (ацетилен) + 3H2↑
Окисление. При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
CnH2n+2 + (3n+1)/2 O2 = nCO2 + (n+1)H2O
Физические свойства алканов
При обычных условиях С1-С4 – газы, С
5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН4 (болотный, рудничий газ)
– газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)H2 = CnH2n+2 (1)
nCO + (2n+1)H2 = CnH2n+2 + H2O (2)
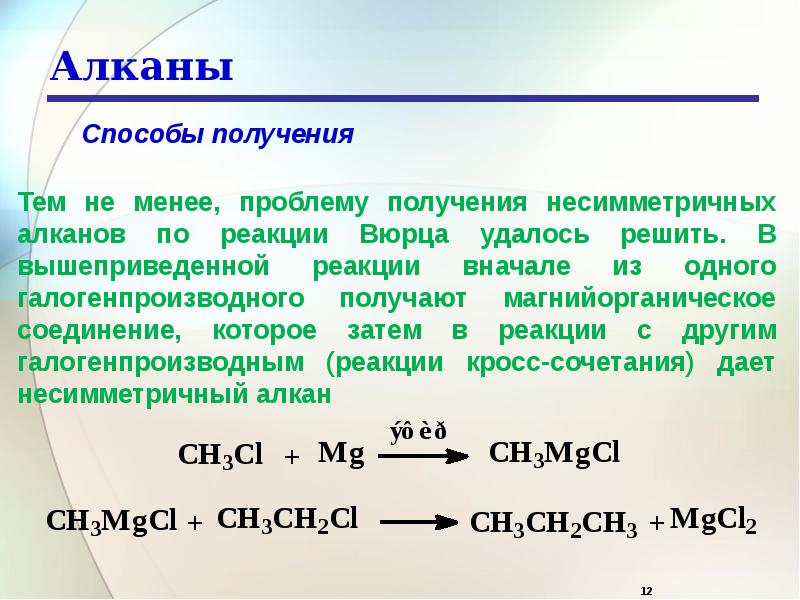
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R1-C≡C-R2 (алкин) → R1-CH = CH-R2 (алкен) → R1-CH2 – CH2 -R2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl (2)
CH3COONa↔ CH3COO— + Na+
2CH3COO— → 2CO2↑ + C2H6 (этан) (3)
CH3COONa + NaOH → CH4 + Na2CO3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Примеры решения задач
Строение и физические свойства алканов
Строение алканов
Алканы (парафины) – ациклические насыщенные углеводороды, состав которых выражается общей формулой Cnh3n+2 (n – число атомов углерода). Рассмотрим химическое и пространственное строение алканов. Атомы углерода в алканах связаны посредством одинарных связей. Значения электроотрицательностей атомов углерода и водорода равны 2,5 и 2,1 соответственно, т.е. близки, поэтому С-С связи в алканах ковалентные неполярные, а С-Н связи – слабополярные.
Рассмотрим химическое и пространственное строение алканов. Атомы углерода в алканах связаны посредством одинарных связей. Значения электроотрицательностей атомов углерода и водорода равны 2,5 и 2,1 соответственно, т.е. близки, поэтому С-С связи в алканах ковалентные неполярные, а С-Н связи – слабополярные.
В алканах одна s-орбиталь и три р-орбитали атомов углерода гибридизованы и находятся в состоянии sp3— гибридизации. Подробнее о гибридизации атомных орбиталей описано в разделе Химическая связь и строение молекул. Четыре sp3-гибридные орбитали атома углерода направлены к вершинам тетраэдра, с углом между ними около 109°28′, и длиной связи С–С равной 1,54 Å – именно в этом случае отталкивание между электронами и энергия системы минимальны. При перекрывании этих орбиталей друг с другом, и с s-орбиталями атомов водорода образуются σ-связи С–С и С–Н.
В молекуле метана гибридизованные орбитали атома углерода перекрываются со сферическими орбиталями атомов водорода.
Важно помнить, что в процессе гибридизации происходит только изменение формы орбиталей одного и того же атома, в то время как перекрывание орбиталей двух разных атомов приводит к возникновению химической связи между ними.
Образование С-С – связей в молекулах алканов происходит за счет перекрывания гибридных орбиталей двух атомов углерода:
Физические свойства
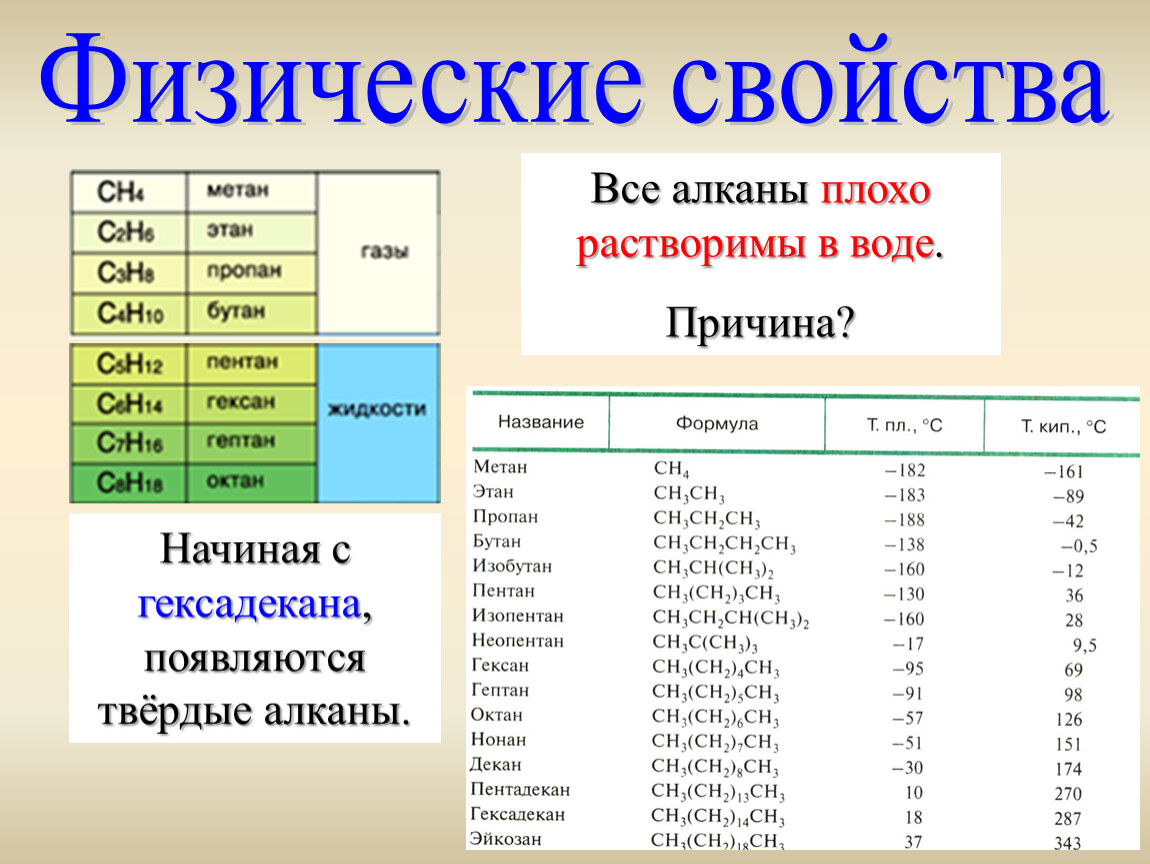
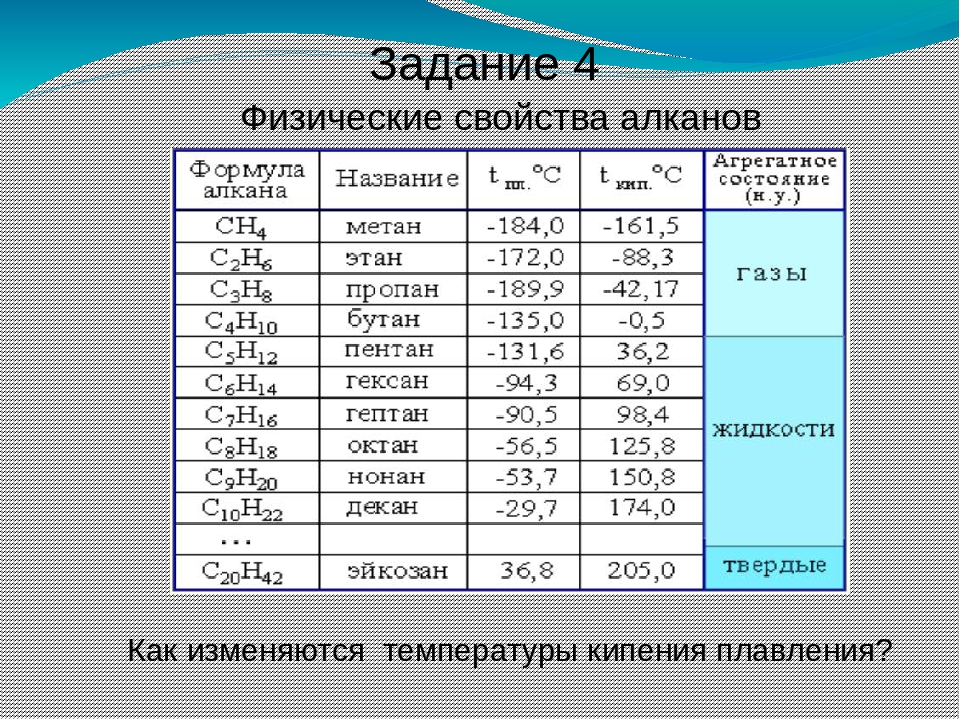
При комнатной температуре алканы от С1 до С4 являются газами, от С5 до С16-жидкостями, а более высокие алканы — твердые и воскоподобные.
Температура кипения нормальных алканов увеличиваются с ростом углеводородной цепи, однако по мере роста числа атомов углерода в цепи темп ее увеличения замедляется. Кривая температуры плавления не имеет такой же плавной зависимости. Между нечетными и четными алканами наблюдается только небольшое нелинейное повышение температуры плавления, что представлено на рисунке ниже.
Физические свойства разветвленных алканов отличны от свойств н-алканов с таким же числом атомов углерода в цепи.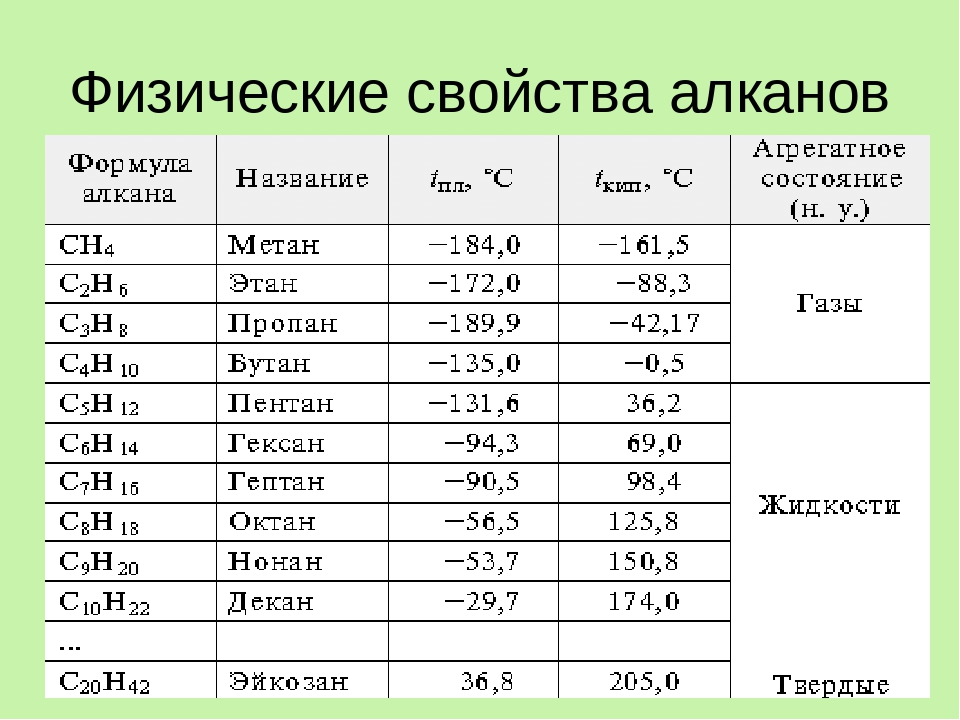 Так, чем больше разветвлений в цепи, тем ниже их температуры кипения и плавления.
Так, чем больше разветвлений в цепи, тем ниже их температуры кипения и плавления.
Циклоалканы С2-С3 – газы, высшие – жидкости или твердые вещества. Теппературы кипения циклоалканов примерно на 20 К выше, чем температуры кипения соответствующих н-алканов.
Растворимость
Растворимость алканов в воде ничтожна, однако в органических растворителях они хорошо растворяются.
Существует 2 эмпирических правила, которые связывают температуры плавления (или кипения) вещества с его растворимостью.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой плавления, по сравнению с веществами с более высокой температурой плавления. Это объясняется тем, что силы взаимодействия внутри кристаллической решетки, которые должны преодалеваться при растворении более слабые у веществ с низкой температурой плавления.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой кипения, по сравнению с веществами с более высокой температурой плавления.

Все растворители можно разделить на:
- Растворители с сильными (например, вода) межмолекулярными. Здесь действуют такие межмолекулярные силы как силы Ван-дер-Ваальса, дипольное притяжение, водородные связи, связывающие отдельные молекулы воды.
- Растворители с слабыми (бензол, гексан) межмолекулярными взаимодействиями. Здесь действуют в основном силы Ван-дер-Ваальса.
Чтобы вещество растворилось в воде необходимо чтобы энергия, выделяющаяся при растворении была достаточной для преодаления как сил сцепления между молекулами растворяемого вещества, так и сильных сил сцепления между молекулами воды. Силы сцепления в бензоле или гексане могут быть легко преодалены, в независимости от энергии, необходимой для разделения самих частиц растворенного вещества.
Значимым параметром при растворении вещества является температура. В основном (хотя и не всегда) увеличение температуры ведет к увеличению растворимости.
Углеводороды и в частности алканы, в которых силы сцепления слабы, будут растворяться в растворителях, межмолекулярные силы сцепления в которых также слабы (неполярные растворители). В этом влучае, первоначально существующие силы заменяются на равноценные и значительных изменений энергии не происходит. В силу отсутствия сильно электроотрицательных атомов в молекулах углеводородов, они не способны к прочному сцеплению с молекулами воды. Разрыв межмолекулярных связей молекулы воды энергетически невыгоден и углеводороды в ней нерастворимы.
В растворителях меньшей полярности и с меньшей склонностью к образованию водородных связей углеводороды способны более или менее растворяться. Также следует помнить, что водородная связь в воде, чем в других ассоциированных растворителях, так что растворимость углеводородов в них будет выше по сравнению с растворимостью в воде. Кроме этого, с увеличением углеводородного остатка растворителя, его химическая природа приближается к природе растворенного вещества и тенденция к растворимости увеличивается. Например, при комнатной температуре гексан не растворяется в метаноле, но растворяется в этаноле.
Например, при комнатной температуре гексан не растворяется в метаноле, но растворяется в этаноле.
Номенклатура и изомерия алканов описаны в разделе Номенклатура и изомерия органических соединений
Алканы физические свойства — Справочник химика 21
Гомологический ряд алкенов. Строение этилена. Природа, двойной утлерод-углеродной связи. Номенклатура алканов. Изомерия и строение алкенов. Физические свойства. [c.189]Физические свойства алканов и циклоалканов [c.134]
Физические свойства алканов [c.32]
ТАБЛИЦА б.П Физические свойства алканов [c.114]
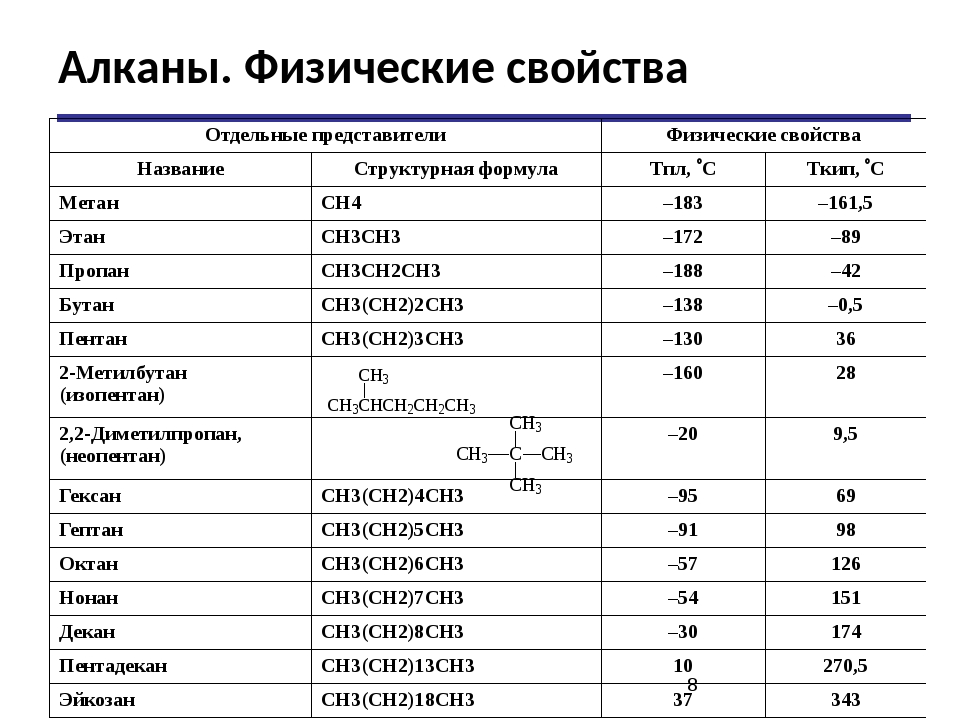
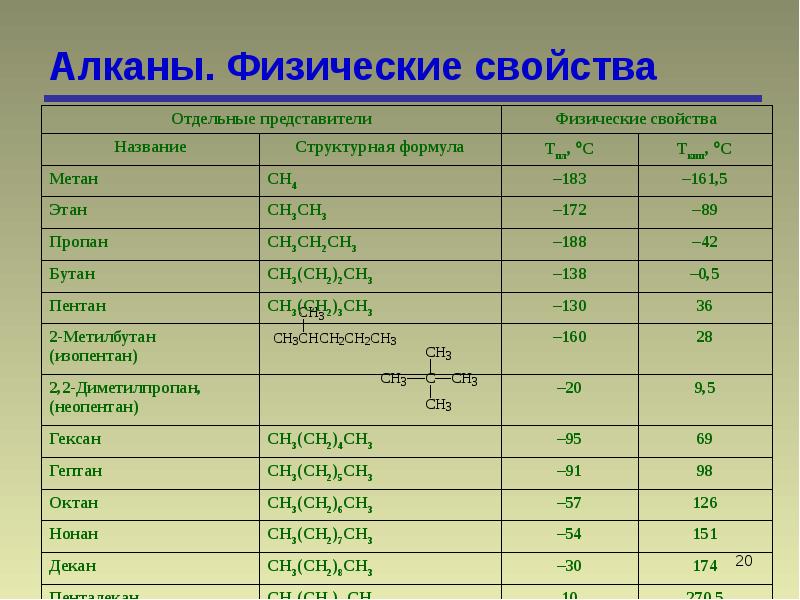
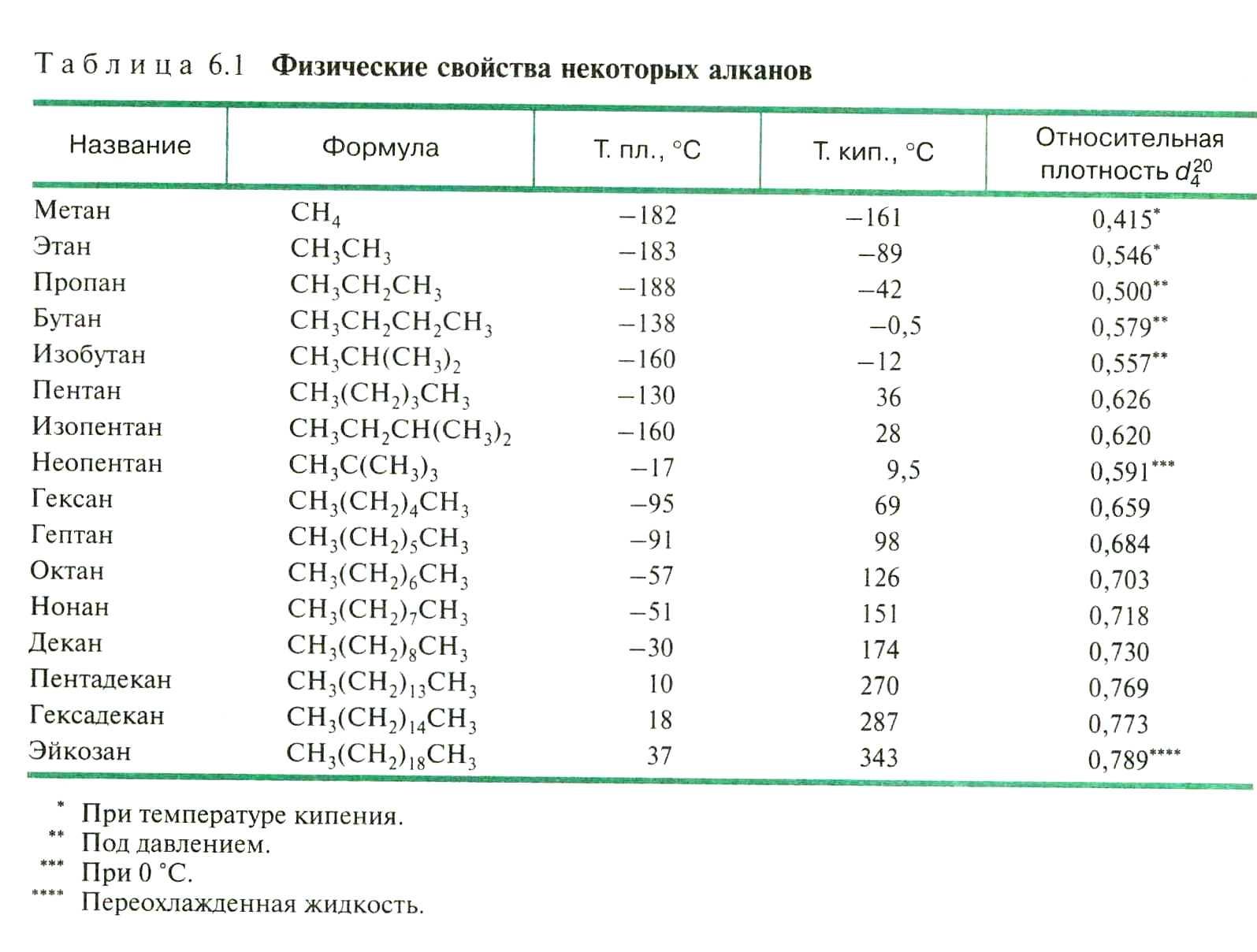
Общая характеристика физических и химических свойств алканов. Физические, свойства. Как видно из табл. 4, первые четыре члена гомологического ряда алканов при обычных условиях—газообразные вещества соединения от С5 до С15 —жидкости, от С]6 и выше — твердые вещества. В гомологическом ряду алканов постепенно повышаются температуры кипения, плавления, а также относительная плотность. Это позволяет предвидеть свойства неизвестного члена ряда, основываясь на свойствах его соседей. Например, т. кип. гексана 68,8 °С, гептана 98,4 °С. Разница в составе на одну группу СНг приводит к повышению температуры кипения на 29,6°С (гомологическая разность температур кипения). Для октана на основании этого можно рассчитать т. кип. 98,4 — -+ 29,6 = 128 °С это примерно на 2°С отличается от экспериментально найденной. При таком расчете следует иметь в виду, что гомологическая разность температур кипения (как и влияние гомологии на все другие физические константы) не остается неизменной у высших членов ряда изменение состава на группу СНг относительно меньше влияет на свойства молекулы. Алканы с разветвленной цепью кипят при более низкой температуре, чем изомеры е нормальной цепью. [c.53]
Это позволяет предвидеть свойства неизвестного члена ряда, основываясь на свойствах его соседей. Например, т. кип. гексана 68,8 °С, гептана 98,4 °С. Разница в составе на одну группу СНг приводит к повышению температуры кипения на 29,6°С (гомологическая разность температур кипения). Для октана на основании этого можно рассчитать т. кип. 98,4 — -+ 29,6 = 128 °С это примерно на 2°С отличается от экспериментально найденной. При таком расчете следует иметь в виду, что гомологическая разность температур кипения (как и влияние гомологии на все другие физические константы) не остается неизменной у высших членов ряда изменение состава на группу СНг относительно меньше влияет на свойства молекулы. Алканы с разветвленной цепью кипят при более низкой температуре, чем изомеры е нормальной цепью. [c.53]
Температуры кипения и плавления, плотность, показатель преломления, молекулярная рефракция. Характер изменения физических свойств алканов в гомологическом ряду.
 Разделение и очистка соединений [c.32]
Разделение и очистка соединений [c.32] В табл. 25 приведены физические свойства, групповой химический состав и дизельный индекс топлив, полученных из ряда нефтей Апшеронского полуострова [12]. Эти данные подтверждают и.эложенные выше положения о влиянии природы сырья и химического состава топлив на их цетановую характеристику. Высокосмолистые беспарафинистые нефти (балаханская тяжелая, бинагадинская тяжелая, кергезская и др.) дают дизельные топлива с высоким содержанием ароматических углеводородов, низким содержанием алканов и, как следствие этого, с низким цетановым числом. Нефти малосмолистые парафинистые (сураханская, кара-чухурская и др.), а также нефти смолистые беспарафинистые (раманинская, балаханская масляная и др.) дают дизельные топлива с низким содержанием ароматических углеводородов, высоким содержанием алканов и, как следствие этого, с высоким цетановым числом. Дизельные топлива из пара-финистых нефтей имеют высокую температуру застывания. С этой точки зрения лучшим сырьем для получения дизельных топлив являются смолистые беспарафинистые нефти типа бала-ханской масляной I сорта, раманинской П сорта и им подобные. [c.84]
[c.84]
По физическим свойствам бензол и его гомологи значительно отличаются от алканов и цикланов с тем же числом углеродных атомов в молекуле. Плотности и показатели преломления их выше. Бензол, л-ксилол, дурол, тетра-, пента- и гексаметилбензолы плавятся при температуре выше нуля. [c.30]
Показатель преломления. Одним из важных физических свойств парафина является его показатель преломления. В табл. 12 (стр. 50) были приведены данные о зависимости показателя преломления -алканов от числа атомов углерода в молеку ле. [c.55]
Рассмотрим некоторые конкретные физические свойства алканов и характер их изменения в гомологическом ряду (см. табл. 2.1). [c.34]
Примеси сильно влияют на физические свойства и кристалличность нормальных алканов. [c.521]
Общая характеристика физических и химических свойств алканов. Физические свойства. Как видно из табл. 4, первые четыре члена гомологического ряда алканов при обычных условиях — газообразные вещества соединения от С5 до С15 — жидкости, от i6 и выше — твердые вещества. В гомологическом ряду алканов постепенно повышаются температуры кипения, плавления, а также относительные плотности. Это позволяет предви- [c.50]
В гомологическом ряду алканов постепенно повышаются температуры кипения, плавления, а также относительные плотности. Это позволяет предви- [c.50]
Предпринимались также попытки учесть влияние комплекса физических свойств кипящей жидкости с помощью одной характеристики, например, реохора. Оказалось, что такие уравнения удовлетворительно описывают зависимость коэффициента теплоотдачи для определенных классов химических соединений. Например, для спиртов и алканов [c.226]
Кристаллы гексагональной сингонии способны существовать при повышенных температурах вплоть до температуры плавления н-алкана кристаллы же других сингоний существуют при пониженных температурах, ниже так называемой температуры перехода, вполне определенной для данного н-алкана. Кристаллы могут переходить из одной сингонии в другую при кристаллизации н-алкана из расплава или раствора в каком-либо растворителе, при плавлении кристаллов, а также в твердой фазе (рекристаллизация).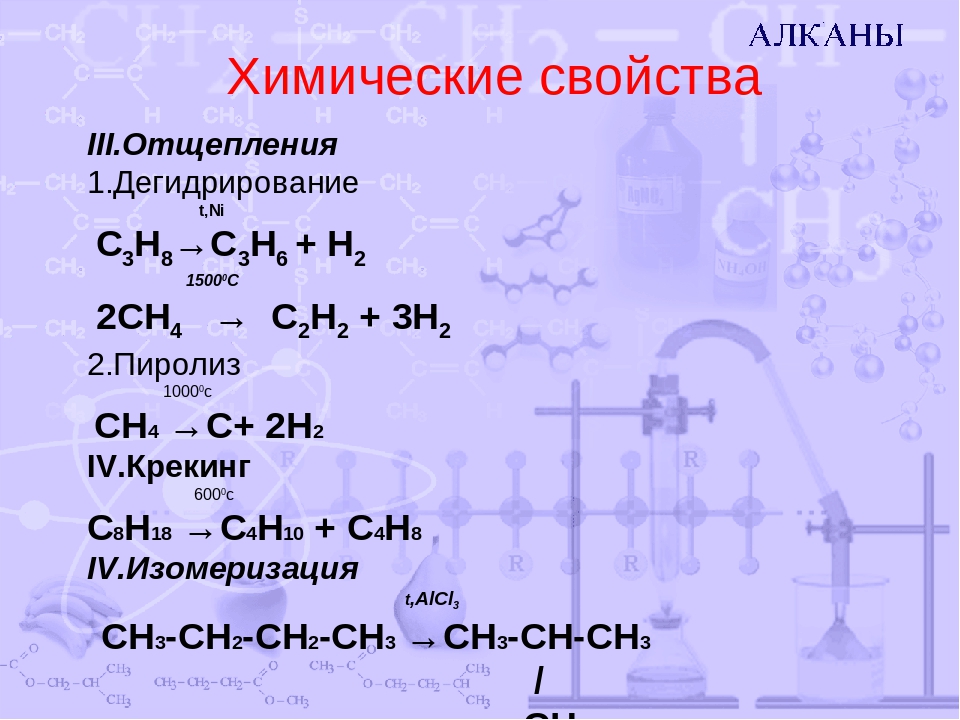 Переход кристаллов н-алканов из одной сингонии в другую полностью обратим. Температура перехода для индивидуальных н-алканов является физической константой, так как при достижении такой температуры скачкообразно изменяются физические свойства, например плотность, теплоемкость, коэффициент расширения и др. Так, переход кристалла н-алкана из гексагональной сингонии в ромбическую сопровождается тепловым эффектом, рав- [c.81]
Переход кристаллов н-алканов из одной сингонии в другую полностью обратим. Температура перехода для индивидуальных н-алканов является физической константой, так как при достижении такой температуры скачкообразно изменяются физические свойства, например плотность, теплоемкость, коэффициент расширения и др. Так, переход кристалла н-алкана из гексагональной сингонии в ромбическую сопровождается тепловым эффектом, рав- [c.81]
Еще в 1883 г. [58] было высказано мнение, что, в нефтяном парафине содержатся углеводороды предельного ряда нормальные и изостроения. Аналогичное мнение высказывалось в работе [59], где сравнивались температуры плавления, кипения и плотности парафиновых углеводородов, выделенных из пенсильванской нефти, и синтетических н-алканов. Более высокая плотность природных парафиновых углеводородов объяснялась [59] возможным присутствием изоалканов (указывалось, однако, на возможность присутствия углеводородов других гомологических рядов). Результаты изучения физических свойств узких фракций парафина, выделенного из нефти Мид-Континента методом дифракции рентгеновских лучей [60], позволили заключить, что н-алканов в парафине содержится не более 65 вес. %, содержание изоалканов достигает 20 вес,%. [c.38]
%, содержание изоалканов достигает 20 вес,%. [c.38]
Данные о физических свойствах алканов, содержащихся в нефтях в наибольших количествах, приведены в литературе. Здесь описаны только некоторые свойства, имеюнще особо важное значение как в изучении, так и технологии нефти и газа. [c.113]
В гомологическом ряду (который отличается на -СН -) наблюда-югся определенные закономерности изменения физических свойств алканов. При повышении молекулярной массы растут температуры кипе- [c.34]
S с h m i d t А. W., S с li о l 1 e г V. и. E b с i 1 e i ii K, 0 физических свойствах к-алканов п 1 алкеиов. Вег., 1941, В 74, N 7, 1313—132 5. [c.245]
По существу они очень схожи с физическими свойствами алканов (табл.3.2). [c.67]
Изомеры бутана и пентана относятся к одному классу органических соединений — алканам. Они отличаются только физическими свойствами. [c.294]
В гомологическом ряду алканов постепенно повышаются температуры плавления и кипения первые четыре члена ряда — газы, далее до — жидкости, начиная с С — твердые вещества.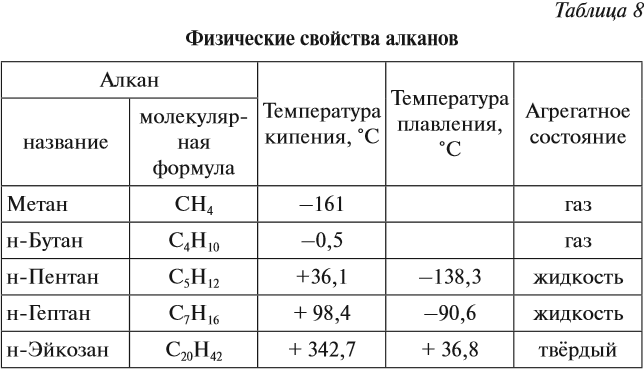 Все алканы нерастворимы в воде, плотность их меньше единицы. Физические свойства жидких алканов легко представить себе, вспомнив о бензине или керосине, которые являются смесью углеводородов. [c.230]
Все алканы нерастворимы в воде, плотность их меньше единицы. Физические свойства жидких алканов легко представить себе, вспомнив о бензине или керосине, которые являются смесью углеводородов. [c.230]
Непредельные углеводороды по своим физическим свойствам близки к алканам. Как п в гомологическом ряду алканов, первые четыре представителя алкенов, диенов и алкинов являются газообразными веществами, за ними идут жидкости и твердые веще- [c.246]
На основе различия физических свойств н-, изо- и циклоалканов разработан метод [49, 50], позволяющий по плотности, температуре плавления, молекулярному весу и показателю преломления составить определенное представление о химическом составе парафина. При разработке этого метода была использована зависимость температуры плавления н-алканов от молекулярного веса [51] [c.35]
В обычных условиях алканы не вступают в химические реакции. В табл. II. I приведены характеристики смесей алканов, физические свойства которых зависят от величины молекул и степени их разветвленностиОни легко растворимы в эфире и хлороформе и других органических растворителях, нерастворимы в воде и спирте.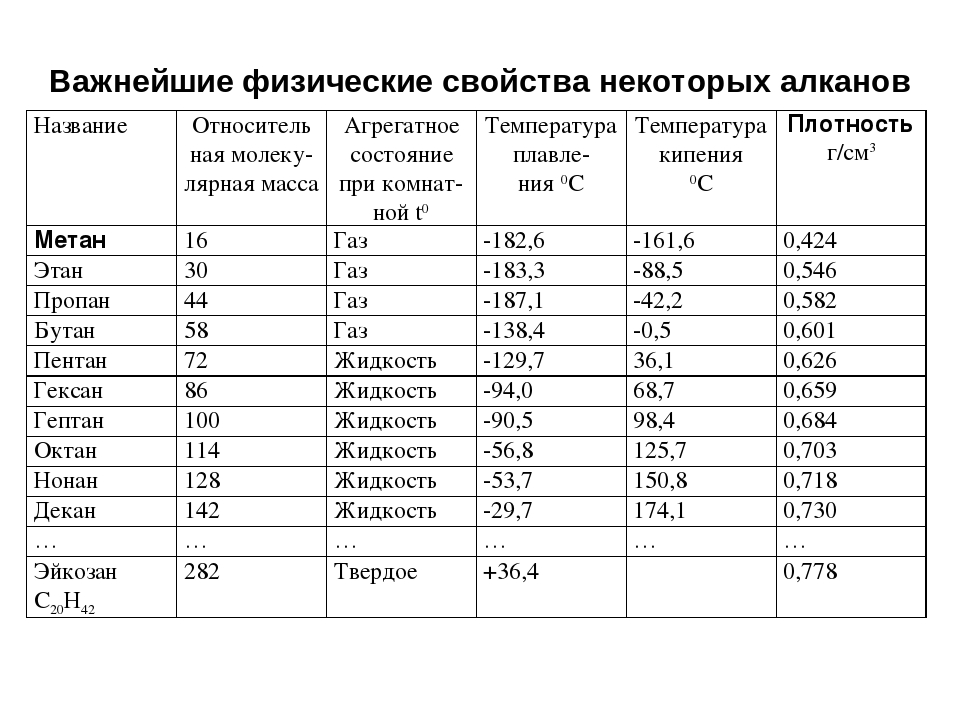 [c.27]
[c.27]
В работе [157] описывается приготовление и характеристика частично кристаллизованных пористых стекол с бидисперсным распределением размера пор. Показано, что Pt-катализаторы, нанесенные на такие пористые стекла, являются активными и селективными катализаторами образования бензола при Сб-дегидроциклизации алканов. При исследовании каталитических и физических свойств нанесенных на Si02 биметаллических систем (Pt—Au, Pt—Sn, Rh— u) прослежена определенная взаимосвязь между дисперсностью металлической фазы (рентгеновский метод) и активностью катализаторов в реакциях С5- и Се-дегидроциклизации н-гексана [158]. [c.244]
Работы по химической природе парафинов различного происхождения восходят к временам Гей-Люссака. В настояш,ее время установлено, что различные парафины состоят из твердых при обычных температурах высокомолекулярных линейных или разветвленных алканов [6]. Они обычно встречаются в природе, загрязненные примесями, влияние которых на физические свойства и кристалличность парафинов остается невыясненным [7, 8]. Самая ранняя достоверная, хотя и не совсем точная работа по американским парафинам проведена Мэбери (МаЬегу [9, 10]). [c.512]
Самая ранняя достоверная, хотя и не совсем точная работа по американским парафинам проведена Мэбери (МаЬегу [9, 10]). [c.512]
В алканах, перечисленных в табл. 24.1, все атомы углерода соединены в последовательную цепочку, и поэтому такие алканы называются неразветвленными. Однако для алканов, содержащих четыре или больще атомов углерода, возможны другие структуры, состоящие из разветвленных цепочек атомов углерода. На рис. 24.2 показаны обычные и сокращенные структурные формулы, возможные для алканов, содержащих четыре или пять атомов углерода. Отметим, что две возможные формы бутана имеют одинаковую молекулярную формулу С Н . Точно так же три возможные формы пен-тана имеют одинаковую молекулярную формулу jHij. Соединения с одинаковой молекулярной формулой, но с различными структурами называются изомерами. Изомеры одного и того же алкана несколько отличаются друг от друга по физическим свойствам. В качестве примера на рис.
 24.2 указаны температуры плавления и кипения изомеров бутана и пентана. Число возможных изомеров алкана быстро возрастает с числом входящих в него атомов углерода. Например, октан gHis имеет 18 изомеров, а декан С Нзг 75 изомеров. [c.411]
24.2 указаны температуры плавления и кипения изомеров бутана и пентана. Число возможных изомеров алкана быстро возрастает с числом входящих в него атомов углерода. Например, октан gHis имеет 18 изомеров, а декан С Нзг 75 изомеров. [c.411]Основные физические свойства циклоалканов помещены в табл. 7.13. Температура кипения циклоалканов выше температуры кипения алкенов или алканов с тем же числом атомов углерода в молекуле. Плотность соединений этой группы выше плотности соответствующих нормальных алканов, но ниже плотности аренов. Это свойство иногда используется для определения группового состава фракций нефти. На [ичие радикалов-заместителей резко снижает температуру плавления углеводорода, и тем значительнее, чем меньше углеродных атомов содержит алкильный заместитель. [c.136]
В связи с тем, что алкины — малопояярные вещества, по физическим свойствам они схожи с алканами и алкенами в отношении температур кипения и плавления, а также растворимости. А вот плотность и показатели преломления у ацетиленовых углеводородов существенно вьшхе, чем у соответствующих олефинов и алканов (табл.5.1). [c.121]
А вот плотность и показатели преломления у ацетиленовых углеводородов существенно вьшхе, чем у соответствующих олефинов и алканов (табл.5.1). [c.121]
Прокачиваемость зависит в основном от физических свойств ( вязкости, температуры застывания ) и состава ( сод )жання н-алканов, мехпримесей и воды) дизельных топлив. [c.138]
Алканами называют углеводороды с обш,еГ формулой Их называют также насыщенными или предельными углеводородами. Эти лазвапия указывают, что по сравнению с другиш1 гомологическими рядами содержание водорода в алканах максимально они насыщены водородом до предела. Все углеродные атомы алканов находятся в состоянии 5р -гибрндизации, иными словами — все связя здесь простые (одинарные). Физические свойства алканов приведены в табл. 9.1 [c.230]
Физические свойства. По физическим свойсгиам циклоалканы несколько отличаются от соответствующих алканов. Первые два члена гомологического ряда циклоалканов (циклопропан, циклобутан) — газы соединения с числом углеродных атомов от 5 до 10 — жидкости. Высшие циклоалканы — твердые вещества. Их температуры кипения и плавления выше, чем у алканов с тем же числом углеродных атомов. Как и предельные углеводороды, циклоалканы нерастворимы в воде. [c.265]
Высшие циклоалканы — твердые вещества. Их температуры кипения и плавления выше, чем у алканов с тем же числом углеродных атомов. Как и предельные углеводороды, циклоалканы нерастворимы в воде. [c.265]
Олефины (алкены) и ацетилены (алкины) по физическим свойствам близки к соответствующим алканам. Начиная с пентена и бутина, пенасыщеипые углеводороды представляют собой жидкости. [c.227]
Физические свойства. Углеводороды от С2Н2 ДО С4Н6 в обычных условиях — газы, от СгНд до С,бНзо — жидкости. Закономерности в изменениях температур кипения и плавления наблюдаются те же, что и в ряду алканов и алкенов. [c.306]
Общая химия в формулах, определениях, схемах (1996) — [ c.242 ]
Общая химия в формулах, определениях, схемах (0) — [ c.242 ]
Органическая химия (1979) — [
c.194
,
c. 196
]
196
]
Общая химия в формулах, определениях, схемах (1985) — [ c.242 ]
Общая химия в формулах, определениях, схемах (0) — [ c.242 ]
Органическая химия Том1 (2004) — [ c.139 ]
Органическая химия (2002) — [ c.220 ]
Химия справочное руководство (1975) — [ c.195 ]
Органическая химия Том 1 перевод с английского (1966) — [ c.55 , c.126 , c.128 ]
Начала органической химии Кн 1 Издание 2 (1975) — [ c.57 , c.60 ]
Алканы и циклоалканы — сравнение, изомеры, применение в природе.
 Алканы — химические свойства Алканы и циклоалканы
Алканы — химические свойства Алканы и циклоалканыТрадиционно курс органической химии начинают с изучения алканов — соединений, содержащий только атомы углерода и водорода (они называются углеводородами — не путать с углеводами!) и не содержащих двойных связей. Пользуясь правилом, что углерод четырёхвалентен, а водород образует только одну связь, мы можем нарисовать следующие молекулы в порядке возрастания количества атомов в них:
Метан, этан, пропан
Дальше дело становится интереснее. Следующее соединение должно иметь в себе четыре атома углерода, но выстроить их можно двумя способами:
Бутан и изобутан
Два этих соединения являются изомерами, поскольку брутто-формула у них одна и та же: C4H10. Но можно предположить, что свойства их будут различаться. Так и есть: изобутан имеет температуру кипения ниже нуля, а бутан — выше, поэтому сжижается немного легче, чем изобутан (при нормальных условиях оба вещества находятся в форме газа).
 Если рассматривать соединение с пятью атомами углерода, то таких изомеров будет уже три (попробуйте нарисовать их!). Общая формула у всех будет C5H12.
Если рассматривать соединение с пятью атомами углерода, то таких изомеров будет уже три (попробуйте нарисовать их!). Общая формула у всех будет C5H12.Собственно, как нетрудно проверить, у всех алканов формула выглядит как CnH2n+2. Первые восемь — это метан, этан, пропан, бутан, пентан, гексан, гептан и октан. Для того, чтобы выделить те изомеры, которые имеют линейное строение, их называют «нормальными», но для простоты пишут, например: н-гексан, н-гептан.
Теперь о свойствах. Как правило, чем «тяжелее» соединение, тем выше его температуры плавления и кипения. И это наблюдается в ряду алканов: метан — самый лёгкий из алканов -это газ, сжижающийся только при очень низкой температуре (Крит. температура — -83°C). Поэтому его хранят в баллонах под большим давлением, такие баллоны можно увидеть на некоторых автобусах, ездящих на природном газе, то есть — метане. В качестве примеси в природном газе (порядка 1%) присутствует этан, следующий алкан, также трудно сжижающийся.
Пропан уже более удобен в использовании: при нормальных условиях это газ, но под давлением в 25атм он сжижается, превращаясь в лёгкую прозрачную подвижную жидкость (занимающую гораздо меньший объём, чем газ при тех же условиях). В таком виде он находится в красных пропановых баллонах.
Бутан требует ещё меньшего давления — около 4атм, и это он плещется в небольших туристических баллонах с газом. При достаточно низкой температуре (-10°C, например) он может вообще отказаться вытекать из баллона, поэтому т.н. «зимнюю смесь» получают, добавляя небольшое количество пропана и изобутана.
Следующие члены ряда алканов ещё больше похожи друг на друга — это прозрачные жидкости разной степени летучести (н-пентан кипит при 30°C, а н-октан — при 125°). Но различные изомеры имеют довольно сильно отличающиеся физические характеристики, поэтому говорить, например, об октане, не уточняя, какой из 18 его изомеров имеется в виду, чаще всего бессмысленно.
Собственно, чистые алканы встречаются довольно редко.
 Например, бензин — это смесь алканов, получающаяся при перегонке нефти. Её сложно и бесмысленно разделять на отдельные вещества. Более тяжёлые фракции (с числом атомов углерода от 12 до 20) составляют основу дизельного топлива. Самые тяжёлые алканы называются парафинами. Хотя по правде говоря, полиэтилен — это тоже алкан (причём линейный!), но содержащий в себе тысячи и десятки тысяч атомов углерода. Его физические свойства вы, надеюсь, неплохо себе представляете.
Например, бензин — это смесь алканов, получающаяся при перегонке нефти. Её сложно и бесмысленно разделять на отдельные вещества. Более тяжёлые фракции (с числом атомов углерода от 12 до 20) составляют основу дизельного топлива. Самые тяжёлые алканы называются парафинами. Хотя по правде говоря, полиэтилен — это тоже алкан (причём линейный!), но содержащий в себе тысячи и десятки тысяч атомов углерода. Его физические свойства вы, надеюсь, неплохо себе представляете.Все алканы горят на воздухе, окисляясь до диоксида углерода и водяного пара. Метан можно каталитически окислить в метанол, формальдегид или муравьиную кислоту. Хлор с метаном реагируют, давая смесь метилхлорида, дихлорметана и хлороформа (трихлорметана).
Аналогично реагируют и все другие алканы, давая обычно сложную смесь продуктов. Реакции с бромом и иодом встречаются редко, а фтор обычно разрывает все связи, давая в итоге тетрафторметан и фтороводород. В целом химия алканов довольно бедна, но это и есть одна из причин, почему начинают обычно именно с них.
В отдельную категорию выделяются циклоалканы — алканы, имеющие циклическую структуру. Начиная с циклопропана, их ряд также бесконечен, и разнообразия в них видится больше. Существуют моноциклические, бициклические, трициклические циклоалканы, а также химические извращения развлечения вроде кубана, призмана и адамантана. Последний, кстати, содержится в нефти, своим строением напоминает кристаллическую решётку алмаза (отсюда и название) и встречается в молекулах некоторых лекарств (например, римантадина). Гораздо чаще, правда, в природных соединениях встречается циклопентановый и циклогексановые фрагменты.
Простейшие циклоалканы. Правая формула — адамантан.
По химическим и физическим свойствам циклоалканы мало отличаются от линейных алканов. Исключение составляет циклопропан и, в меньшей степени, циклобутан, из-за эффекта, известного, как «напряжение цикла». Поскольку в обычных условиях угол между C-C связями составляет около 120 град., то для того, чтобы «зажать» связи в циклопропан или циклобутан, требуется затратить дополнительную энергию (аналогично пружине или автомобильной рессоре). Поэтому в некоторых реакциях цикл может раскрываться. А поскольку запасённая энергия при этом высвобождается, то производные циклопропана исследовались как высокоэнергетичное ракетное топливо взамен керосина. Ещё одна особенность циклопропана — он удостоился чести использоваться как препарат для ингаляционного наркоза, однако был впоследствии заменён негорючими и менее токсичными аналогами.
Поэтому в некоторых реакциях цикл может раскрываться. А поскольку запасённая энергия при этом высвобождается, то производные циклопропана исследовались как высокоэнергетичное ракетное топливо взамен керосина. Ещё одна особенность циклопропана — он удостоился чести использоваться как препарат для ингаляционного наркоза, однако был впоследствии заменён негорючими и менее токсичными аналогами.
1. Свойста многих алканов можно найти в любом приличном справочнике, например «Физические Величины», а также в Wikipedia.
2. Адамантаны: Морозов И.С., Петров В.И., Фармакология адамантанов
3. Синтин https://ru.wikipedia.org/wiki/%D0%A1%D0%B8%D0%BD%D1%82%D0%B8%D0%BD
Физические свойства алканов — НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ. АЛКАНЫ — ОРГАНИЧЕСКАЯ ХИМИЯ — ОБЩАЯ ХИМИЯ — Химия подготовка к ЗНО и ДПА
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ОРГАНИЧЕСКАЯ ХИМИЯ
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ. АЛКАНЫ
АЛКАНЫ
Физические свойства алканов
Много физических свойств (температура плавления и кипения) гомологов меняются не линейно, а «пилкоподібною» зависимости от количества атомов Углерода, которую мы подаем в виде графика:
При нормальных условиях (0 °С, 1 атм) первые четыре гомологи представляют собой газы; соединения, содержит от 5 до 15 атомов Углерода — жидкости; высшие углеводороды — твердые вещества. При одинаковом числе атомов Углерода молекулы алканов с разветвленной строением имеют более низкие температуры кипения, чем нормальные алканы.
Все
алканы представляют собой бесцветные или белые вещества. Летучие углеводороды имеют
характерный «бензиновый» запах. Высшие углеводороды представляют собой жирные на ощупь
мягкие вещества, их типичный представитель — парафин, из которого изготавливают
свечи.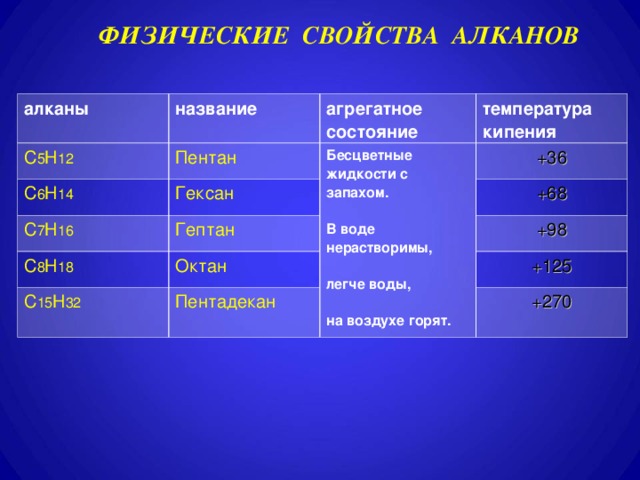
Алканы практически не растворимые в воде, потому что их молекулы малополярні и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как тетрахлорметан и др. Жидкие алканы легко смешиваются друг с одним.
Химические свойства алканов
По обычных условиях алканы химически инертны .они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и нітратною кислотами, концентрированными и расплавленными щелочами, не окисляются сильными окислителями — калий перманганатом КМnO4 т.д.
Химическая
устойчивость алканов объясняется высокой прочностью связей С-С и С — Н, а также их
неполярністю. Неполярные связи С-С в алканах не подвержены ионного разрыва,
но способны к расщеплению гемолитико под действием активных свободных радикалов. Для
алканов характерны радикальные реакции, в результате которых получаются соединения, где
атомы Водорода замещены на другие атомы или группы атомов. Итак, алканы вступают
в реакции, протекающие по механизму радикального замещения. За таким
механизмом легче всего замещаются атомы Водорода у третичных, затем у вторичных
и первичных атомов Углерода.
Итак, алканы вступают
в реакции, протекающие по механизму радикального замещения. За таким
механизмом легче всего замещаются атомы Водорода у третичных, затем у вторичных
и первичных атомов Углерода.
1. Галогенування. При взаимодействии алканов с галогенами (хлором и бромом) под действием ультрафиолетового излучения или высокой температуры образуется смесь продуктов моно — к полігалогензаміщених алканов. Общая схема этой реакции показана на примере метана:
2. Нитрования (реакция Коновалова). Во время действия азотной кислоты на алканы при температуре +140 °С и небольшом давлении протекает радикальная реакция:
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
4. Крекинг — это гомолітичний разрыв связей С-С,
протекающий при нагревании и под действием катализаторов.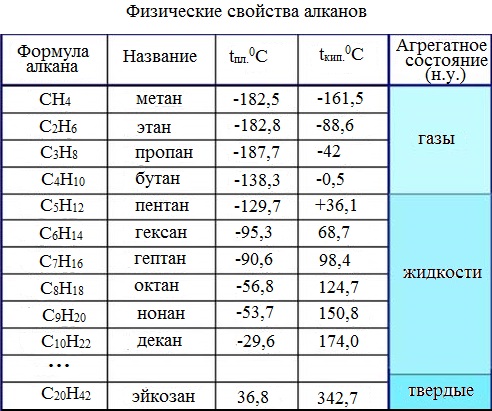 При крекинге алканов
образуются алкены и низшие алканы, при крекинге метана и этана образуется
ацетилен:
При крекинге алканов
образуются алкены и низшие алканы, при крекинге метана и этана образуется
ацетилен:
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисления. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
Мягкое каталитическое окисление бутана кислородом воздуха — один из промышленных способов извлечения уксусной кислоты:
На воздухе алканы сгорают до СO2 и Н2O:
Ответы | § 8. Гомологический ряд и физические свойства алканов — Химия, 10 класс
1. Почему алканы называют предельными и насыщенными углеводородами?
Потому что атомы углерода в молекулах алканов соединены только одинарными связями.
2. Какие соединения образуют гомологический ряд? Являются ли гомологами метан и этилен?
Гомологический ряд образуют соединения, сходные по строению и химическим свойствам и отличающиеся по составу молекул на одну или несколько групп Ch3\mathrm{CH_2}Ch3.
Метан и этилен не являются гомологами.
3. Алкан, имеющий неразветвлённую цепь из пяти атомов углерода, называется н-пентан. Составьте формулы двух изомеров и двух гомологов н-пентана. Является ли углеводород состава С7Н16 гомологом пентана?
Углеводород состава C7h26\mathrm{C_7{H_{16}}}C7h26 является гомологом пентана.
4. Приведите формулы газообразных при нормальных условиях алканов. Изобутан (изомер н-бутана) имеет температуру кипения, равную –12 °С. В каком агрегатном состоянии находится изобутан при нормальных условиях?
Формулы газообразных при нормальных условиях алканов:
Ch5\mathrm{CH_4}Ch5, Ch4−Ch4\mathrm{CH_3{-}CH_3}Ch4−Ch4, Ch4−Ch3−Ch4\mathrm{CH_3{-}CH_2{-}CH_3}Ch4−Ch3−Ch4, Ch4−Ch3−Ch3−Ch4\mathrm{CH_3{-}CH_2{-}CH_2{-}CH_3}Ch4−Ch3−Ch3−Ch4
Изобутан при нормальных условия находится в газообразном агрегатном состоянии.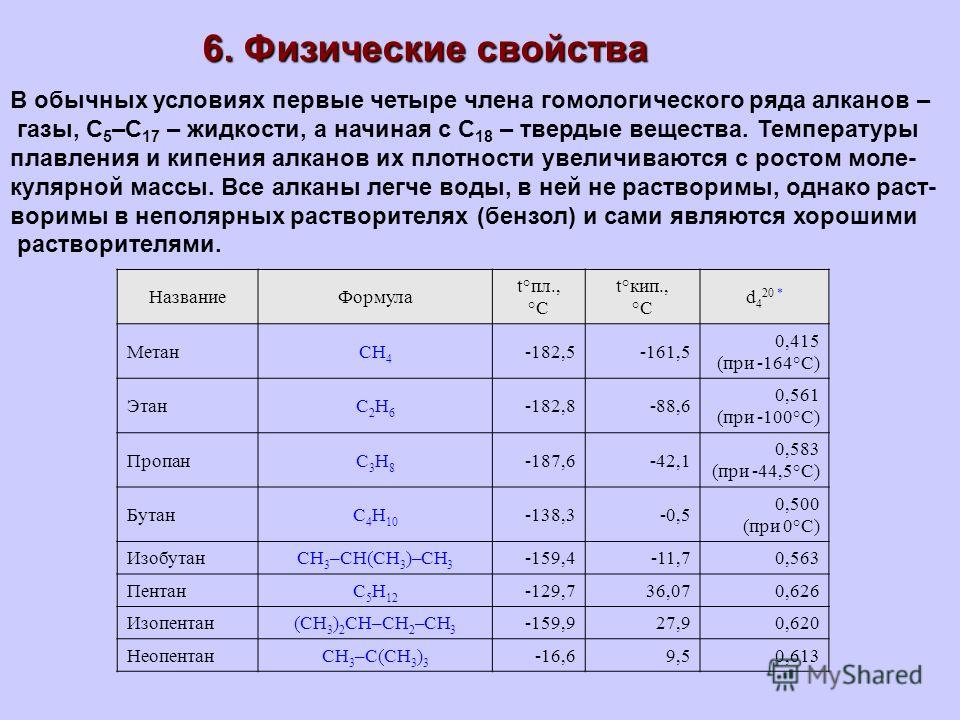 3}<1г/см3).
3}<1г/см3).
7. Постройте график зависимости температуры кипения алканов от числа атомов углерода в их молекулах.
8. Среди перечисленных укажите формулы предельных углеводородов: C2H6, C3H6, C8h24, C9h30.
Формулы предельных углеводородов: C2H6\mathrm{C_2H_6}C2H6, C9h30\mathrm{C_9{H_{20}}}C9h30.
Присоединяйтесь к Telegram-группе @superresheba_10, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Свойства и применение алканов. Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Физические свойства
В таблице ниже перечислены свойства и использование ряда различных алканов:
| Имя | Молекулярная формула | Молярная масса (г моль -1 ) |
Температура плавления (°C) |
Температура кипения Точка кипения (°C) |
Состояние (25°C, 101.  3кПа) 3кПа) |
Плотность жидкости (г см -3 , 20°С) |
Температура воспламенения (°С) |
Энтальпия сгорания (кДж моль -1 ) |
Использование |
|---|---|---|---|---|---|---|---|---|---|
| метан | Ч 4 | 16 | -182 | -162 | газ | -889 | основной компонент природного газа (топливо) | ||
| | |||||||||
| этан | С 2 Н 6 | 30 | -183 | -88.6 | газ | -1560 | компонент природного газа (топливо) | ||
| | |||||||||
| пропан | С 3 Н 8 | 44 | -188 | -42,1 | газ | -2217 | компонент сжиженного нефтяного газа (СНГ), баллонный газ (топливо) | ||
| | |||||||||
| бутан | С 4 Н 10 | 58 | -138 | -0.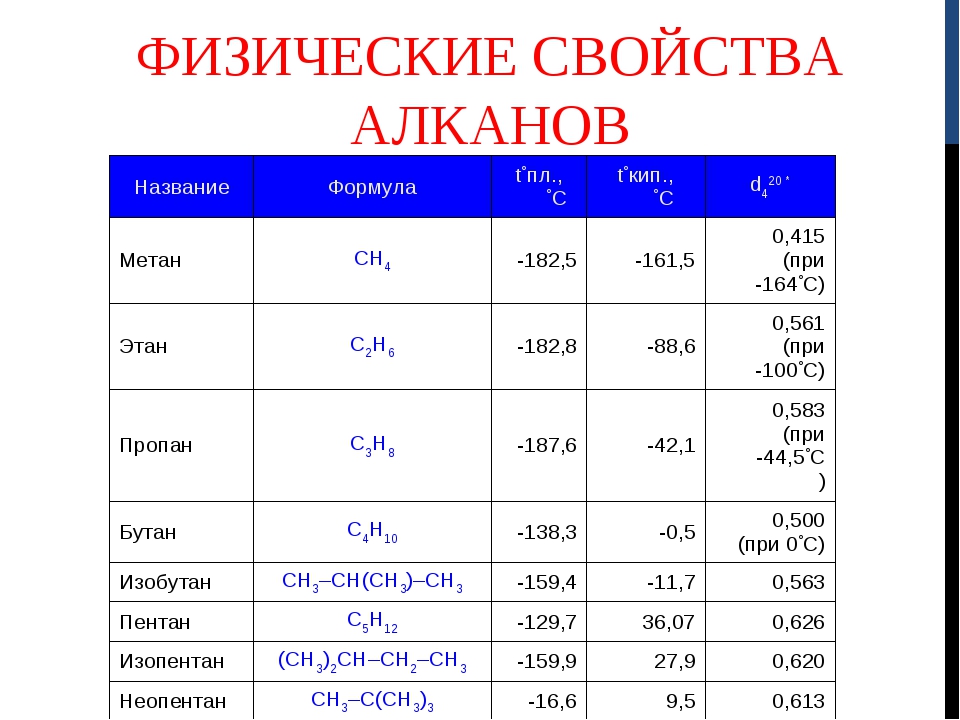 5 5 |
газ | -2874 | компонент сжиженного нефтяного газа (СНГ), зажигалки (топливо) | ||
| | |||||||||
| пентан | С 5 Н 12 | 72 | -130 | 36,1 | жидкость | 0.626 | -49 | -3536 | компонент бензина (бензин, топливо) |
| | |||||||||
| гексан | С 6 Н 14 | 86 | -95,3 | 68,7 | жидкость | 0,659 | -22 | -4190 | компонент бензина (бензин, топливо) |
| | |||||||||
| гептан | С 7 Н 16 | 100 | -90.6 | 98,4 | жидкость | 0,68 | -4 | -4847 | компонент бензина (бензин, топливо) |
| | |||||||||
| октан | С 8 Н 18 | 114 | -56,8 | 126 | жидкость | 0. 703 703 |
13 | -5506 | основной компонент бензина (бензин, топливо) |
| | |||||||||
| нонан | С 9 Н 20 | 128 | -50 | 151 | жидкость | 0,72 | 31 | компонент бензина (бензин, топливо) | |
| | |||||||||
| декан | С 10 Н 22 | 142 | -30 | 174 | жидкость | 0.730 | 46 | компонент бензина (бензин, топливо) | |
| | |||||||||
| гексадекан | С 16 Н 34 | 226 | 18,5 | 288 | жидкость | 0,775 | 135 | компонент дизельного топлива и мазута | |
| | |||||||||
| эйкозан | С 20 Н 42 | 282 | 36 | 343 | твердый | ||||
Алканы с температурой воспламенения (1) ниже комнатной температуры (например, компоненты бензина) следует хранить в прочных металлических контейнерах с узкими горлышками и плотно закрытыми крышками, чтобы предотвратить утечку паров и воспламенение от открытого пламени или искры. смесь пар/воздух.
смесь пар/воздух.
Цвет алканов
- Метан в бутан — бесцветные газы.
(пропан и бутан легко конденсируются под давлением и обычно продаются в жидком виде) - Алканы, содержащие от 5 до 19 атомов углерода, представляют собой бесцветные жидкости.
(бензин и керосин — смеси жидких алканов, в жидкости добавлен краситель из соображений безопасности) - Алканы, содержащие более 20 атомов углерода, представляют собой бесцветные воскообразные твердые вещества.
(парафин представляет собой смесь твердых алканов)
Плотность алканов
- Алканы менее плотны, чем вода (алканы будут плавать на поверхности воды)
- Плотность увеличивается с увеличением молекулярной массы.
Точка плавления и температура кипения алканов
- Простые алканы имеют низкие температуры плавления и кипения
(измеряется при 1 атм или 101.давление 3 кПа).
⚛ Метан в бутан имеет температуру кипения менее 25°C.
⚛ Метан в бутан – это газы при температуре 25°C.
⚛ Пентан в декан имеет температуру плавления менее 25°C.
⚛ Пентан в декан – это жидкости при температуре 25°C. - Температуры кипения увеличиваются по мере увеличения молекулярной массы, как показано на графике ниже:
| Температура (°C) |
Температура кипения алканов (из метана в гептан) Молярная масса (г моль -1 ) |
Алканы являются неполярными молекулами.
Между молекулами алканов действуют только слабые межмолекулярные силы (силы Ван-дер-Ваальса (2) , лондонские силы, дисперсионные силы, слабые межмолекулярные силы), поэтому для разрушения этих слабых межмолекулярных сил и разделения молекул требуется мало энергии. соединение плавится и кипит при довольно низких температурах.
По мере увеличения числа атомов углерода в цепи длинные углеродные цепи все больше притягиваются друг к другу этими слабыми межмолекулярными силами, поэтому с увеличением молярной массы алканов температуры плавления и кипения также повышаются.
Растворимость
- Алканы растворимы в неполярных растворителях.
Неполярные молекулы алканов притягиваются к другим неполярным молекулам за счет слабых межмолекулярных сил (ван-дер-ваальсовых сил, дисперсионных сил, лондонских сил), поэтому неполярные молекулы алканов растворяются в неполярных растворителях. - Алканы нерастворимы в полярных растворителях, таких как вода.
Молекулы в полярном растворителе, таком как вода, сильно притягиваются друг к другу в результате притяжения частичных отрицательных и частичных зарядов внутри каждой молекулы:δ + δ + H — O Δ- —H δ + 0 .
.
.
.
.Красные пунктирные линии ( … ) представляют межмолекулярное притяжение между частичным отрицательным зарядом атома кислорода одной молекулы воды и частичным положительным зарядом атома водорода другой молекулы воды.  Этот тип межмолекулярного притяжения известен как водородная связь.
Этот тип межмолекулярного притяжения известен как водородная связь. 0 0 Δ + H — O Δ- — H δ +
При добавлении неполярного алкана к полярному растворителю:(i) молекулы алканов притягиваются друг к другу, но не притягиваются к молекулам воды
(ii) молекулы воды притягиваются друг к другу, но не к молекулам алканов
, поэтому алкан не растворяется в полярном растворителе.
Химические свойства алканов
Сжигание алканов
В присутствии избытка кислорода, O 2 , алканы сгорают с образованием углекислого газа и воды, а также энергии в виде тепла и света.
| Общее слово Уравнение слова: | Alkane | + | + | Оксидов | → | → | Углекисный газ | + | Water | + Energy | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Пример (Уравнение слова): | Бутан | + | Oxygen | → | Диоксид углекислого газа | + | + | Water | + 2874 KJ MOL -1 | ||
| Пример (Химическое уравнение): | C 4 H 10 (G) | + | 6½O 2 (G) | → | → | 4CO 2 (G) | + | 5H 2 O (L) | + 2874 KJ MOL -1 |
- При сгорании любого алкана выделяется энергия, как показано на графике ниже:
Энергия, выделяемая
при сгорании
(кДж моль -1 )Теплота сгорания алканов
(из метана в гептан)
Молярная масса (г моль -1 ) - По мере увеличения молярной массы алкана с прямой цепью количество выделяемой энергии также увеличивается, как показано на графике выше.

Наклон графика выше составляет примерно 45 кДж г -1 , то есть если молярная масса алкана увеличится на 14 г (молярная масса каждого дополнительного СН 2 в углеродной цепи), то количество дополнительной энергии, выделяемой при его сгорании, составит около 45 кДж/г × 14 г = 630 кДж. - По мере увеличения длины углеродной цепи увеличивается количество энергии, выделяемой при сгорании.
⚛ Более длинная углеродная цепь содержит больше связей C-H и больше связей C-C.
⚛ Более длинная углеродная цепь производит больше связей C=O (как в CO 2 ) и больше связей OH (как в H 2 O).
⚛ Общий процесс разрыва связей С-С и С-Н и образования связей С=О и ОН высвобождает энергию.
⚛ Чем больше разорвано связей С-С и С-Н и чем больше образовано связей С=О и О-Н, тем больше высвобождается энергии (см. энергия связи).
Если для полного сгорания алкана недостаточно кислорода, то произойдет неполное сгорание алкана.
Продукты неполного сгорания включают воду и монооксид углерода и/или углерод.
Галогенирование алканов
Алканы не очень реакционноспособны.
Реакция между алканом и галогеном, таким как хлор или бром, не будет происходить без подачи энергии в виде ультрафиолетового света.
| условия реакции | реагенты | товары | |
|---|---|---|---|
| без ультрафиолетового излучения | алкан + галоген | → | нет реакции |
| ультрафиолетовый свет | алкан + галоген | УФ → |
галогенированные алканы |
Ультрафиолетовый свет дает достаточно энергии, чтобы разорвать связь С-Н в молекуле алкана и заменить атом водорода на атом галогена.
Реакции, в которых один атом в органической молекуле замещается другим атомом, называются реакциями замещения.
Примером реакции замещения является реакция гексана с бромом в присутствии УФ-излучения, как показано в химическом уравнении ниже:
| гексан | + | бром | Ультрафиолетовый свет ⇋ |
бромгексан | + | водород бромид | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
+ | руб. — руб. — руб. |
Ультрафиолетовый свет ⇋ |
|
+ | Н — Бр |
Затем возможны дальнейшие замены, как показано в химическом уравнении ниже:
| бромгексан | + | бром | Ультрафиолетовый свет ⇋ |
1,2-дибромгексан | + | водород бромид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
+ | руб. — руб. — руб. |
Ультрафиолетовый свет ⇋ |
|
+ | Н — Бр |
, пока все атомы водорода не будут заменены атомами брома, как показано в химическом уравнении ниже:
|
+ | руб. — руб. | Ультрафиолетовый свет ⇋ |
|
+ | Н — Бр |
Физические свойства алканов — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Температуры кипения
- Растворимость
- Растворимость в воде
- Растворимость в органических растворителях
- Вспомогательные вещества
Алканы малоактивны и не очень активны; все алканы бесцветны и не имеют запаха.
Точки кипения
Указанные температуры кипения относятся к изомерам с «прямой цепью», которых существует более одного. Первые четыре алкана представляют собой газы при комнатной температуре, а твердые вещества не начинают появляться примерно до \(C_{17}H_{36}\), но это неточно, поскольку разные изомеры обычно имеют разные температуры плавления и кипения. К тому времени, как вы получите 17 атомов углерода в алкане, будет невероятное количество изомеров!
Циклоалканы имеют температуру кипения примерно на 20 К выше, чем у соответствующего алкана с прямой цепью.
Между углеродом и водородом нет существенной разницы в электроотрицательности, поэтому нет существенной полярности связи. Сами молекулы также имеют очень небольшую полярность. Полностью симметричная молекула, такая как метан, совершенно неполярна, а это означает, что единственным притяжением между одной молекулой и ее соседями будут дисперсионные силы Ван-дер-Ваальса. Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере того, как молекулы становятся больше.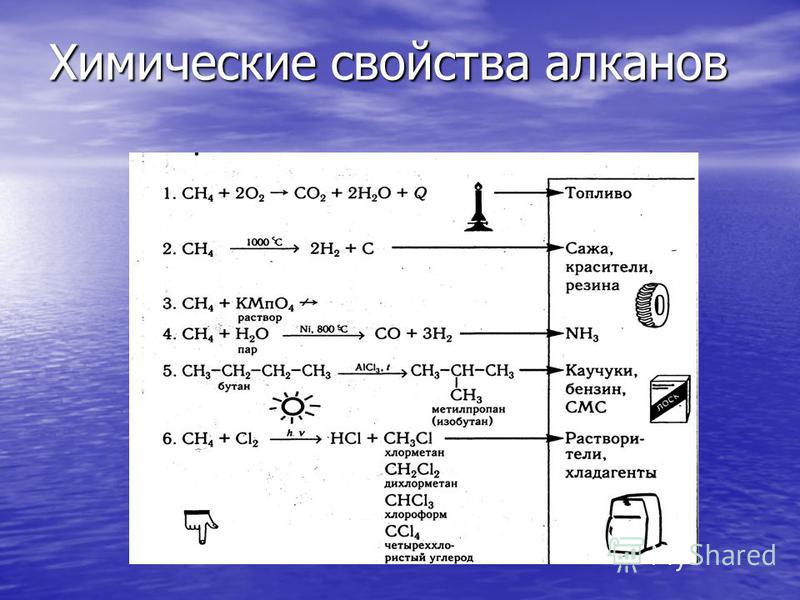 Следовательно, температуры кипения алканов увеличиваются с увеличением размера молекулы.
Следовательно, температуры кипения алканов увеличиваются с увеличением размера молекулы.
Если у вас есть изомеры, чем более разветвлена цепь, тем ниже будет температура кипения. Дисперсионные силы Ван-дер-Ваальса меньше для более коротких молекул и действуют только на очень коротких расстояниях между одной молекулой и ее соседями. Коротким молекулам жира (с большим количеством разветвлений) труднее располагаться так близко друг к другу, как длинным тонким молекулам.
Пример \(\PageIndex{1}\): Точки кипения, зависящие от структуры
Например, температуры кипения трех изомеров \(C_5H_{12}\):
- пентан: 309.2 К
- 2-метилбутан: 301,0 К
- 2,2-диметилпропан: 282,6 К
Несколько более высокие точки кипения циклоалканов, по-видимому, связаны с тем, что молекулы могут сближаться, потому что кольцевая структура делает их более аккуратными и менее «извилистыми»!
Растворимость
Алканы (как алканы, так и циклоалканы) практически нерастворимы в воде, но растворяются в органических растворителях. Однако жидкие алканы являются хорошими растворителями для многих других неионогенных органических соединений.
Однако жидкие алканы являются хорошими растворителями для многих других неионогенных органических соединений.
Растворимость в воде
При растворении молекулярного вещества в воде должно происходить следующее:
- разрушают межмолекулярные силы внутри вещества. В случае алканов это дисперсионные силы Ван-дер-Ваальса.
- разрушают межмолекулярные силы в воде, чтобы вещество могло поместиться между молекулами воды. В воде основным межмолекулярным притяжением являются водородные связи.
Чтобы разрушить любое из этих притяжений, требуется энергия, хотя количество энергии, необходимое для разрушения дисперсионных сил Ван-дер-Ваальса в чем-то вроде метана, относительно ничтожно; это не относится к водородным связям в воде.
Для упрощения, вещество растворится, если при образовании новых связей между веществом и водой высвобождается достаточно энергии, чтобы компенсировать то, что используется для разрушения первоначального притяжения. Единственным новым притяжением между молекулами алкана и воды являются силы Ван-дер-Ваальса. Эти силы не выделяют достаточного количества энергии, чтобы компенсировать энергию, необходимую для разрыва водородных связей в воде; алкан не растворяется.
Единственным новым притяжением между молекулами алкана и воды являются силы Ван-дер-Ваальса. Эти силы не выделяют достаточного количества энергии, чтобы компенсировать энергию, необходимую для разрыва водородных связей в воде; алкан не растворяется.
Описание сольватации только с помощью энергии является чрезмерным упрощением, поскольку энтропийные эффекты также важны при растворении веществ.
Растворимость в органических растворителях
В большинстве органических растворителей первичными силами притяжения между молекулами растворителя являются силы Ван-дер-Ваальса — либо дисперсионные силы, либо диполь-дипольные силы притяжения. Следовательно, когда алкан растворяется в органическом растворителе, силы Ван-дер-Ваальса разрушаются и заменяются новыми силами Ван-дер-Ваальса. Два процесса более или менее энергетически компенсируют друг друга; таким образом, нет барьера для растворимости.
Химические свойства алканов — Химия LibreTexts
Алканы не очень реакционноспособны по сравнению с другими химическими веществами. Это связано с тем, что атомы углерода основной цепи в алканах достигли своего октета электронов за счет образования четырех ковалентных связей (максимально допустимое количество связей в соответствии с правилом октета; поэтому число валентности углерода равно 4). Эти четыре связи, образованные углеродом в алканах, представляют собой сигма-связи, которые более стабильны, чем другие типы связи, из-за большего перекрытия атомных орбиталей углерода с атомными орбиталями соседних атомов. Чтобы заставить алканы реагировать, необходим ввод дополнительной энергии; либо через тепло, либо через излучение.
Это связано с тем, что атомы углерода основной цепи в алканах достигли своего октета электронов за счет образования четырех ковалентных связей (максимально допустимое количество связей в соответствии с правилом октета; поэтому число валентности углерода равно 4). Эти четыре связи, образованные углеродом в алканах, представляют собой сигма-связи, которые более стабильны, чем другие типы связи, из-за большего перекрытия атомных орбиталей углерода с атомными орбиталями соседних атомов. Чтобы заставить алканы реагировать, необходим ввод дополнительной энергии; либо через тепло, либо через излучение.
Бензин представляет собой смесь алканов и, в отличие от многих химических веществ, может храниться в течение длительного времени и без проблем транспортироваться. Только при воспламенении у него достаточно энергии для продолжения реакции. Это свойство затрудняет преобразование алканов в другие типы органических молекул. (Есть только несколько способов сделать это). Алканы также менее плотны, чем вода , как можно заметить, масло, алкан, плавает на воде.
Алканы являются неполярными растворителями .Поскольку присутствуют только атомы C и H, алканы неполярны. Алканы не смешиваются с водой, но свободно смешиваются с другими неполярными растворителями. Алканы, состоящие из слабых диполь-дипольных связей, не могут разорвать сильную водородную связь между молекулами воды, поэтому они не смешиваются с водой. Такой же характер проявляют и алкены. Поскольку алканы содержат только углерод и водород, при сгорании образуются соединения, содержащие только углерод, водород и/или кислород. Как и другие углеводороды, при сгорании в большинстве случаев образуются в основном углекислый газ и вода.Однако алканы требуют больше тепла для сгорания и не выделяют столько тепла при сгорании, как другие классы углеводородов. Следовательно, при сгорании алканов образуются более высокие концентрации органических соединений, содержащих кислород, таких как альдегиды и кетоны, при сгорании при той же температуре, что и у других углеводородов.
Общая формула алканов: C N H 2N+2 ; поэтому простейшим возможным алканом является метан, CH 4 . Следующим простейшим является этан, C 2 H 6 ; сериал продолжается бесконечно.Каждый атом углерода в алкане имеет sp3-гибридизацию.
Следующим простейшим является этан, C 2 H 6 ; сериал продолжается бесконечно.Каждый атом углерода в алкане имеет sp3-гибридизацию.
Алканы также известны как парафины или в совокупности как группа парафинов. Эти термины также используются для алканов, атомы углерода которых образуют одну неразветвленную цепь. Алканы с разветвленной цепью называются изопарафинами.
Метан с по Бутан являются легковоспламеняющимися газами при стандартной температуре и давлении (STP). Пентан представляет собой чрезвычайно легковоспламеняющуюся жидкость, кипящую при 36 °C, и температуры кипения и плавления постоянно повышаются; октадекан — первый алкан, твердый при комнатной температуре.Более длинные алканы представляют собой воскообразные твердые вещества; свечной воск обычно имеет цепочки от C 20 до C 25 . По мере увеличения длины цепи в конечном итоге мы получаем полиэтилен, который состоит из углеродных цепей неопределенной длины и обычно представляет собой твердое твердое вещество белого цвета.
Реакции
Алканы очень плохо реагируют с ионными или другими полярными веществами. Значения pKa всех алканов выше 50, поэтому они практически инертны по отношению к кислотам и основаниям. Эта инертность является источником термина «парафины» (лат. para + affinis, что здесь означает «отсутствие сродства»).В сырой нефти молекулы алканов оставались химически неизменными в течение миллионов лет.
Однако возможны окислительно-восстановительные реакции алканов, в частности с кислородом и галогенами, поскольку атомы углерода находятся в сильно восстановленном состоянии; в случае метана достигается самая низкая возможная степень окисления углерода (-4). Реакция с кислородом приводит к сгоранию без дыма; с галогенами, замещение. Кроме того, было показано, что алканы взаимодействуют с некоторыми комплексами переходных металлов и связываются с ними.
Свободные радикалы, молекулы с неспаренными электронами, играют большую роль в большинстве реакций алканов, таких как крекинг и риформинг, где алканы с длинной цепью превращаются в алканы с короткой цепью, а алканы с прямой цепью — в изомеры с разветвленной цепью.
В сильно разветвленных алканах и циклоалканах валентные углы могут значительно отличаться от оптимального значения (109,5°), чтобы оставить достаточно места для различных групп. Это вызывает напряжение в молекуле, известное как стерическое затруднение, и может существенно увеличить реакционную способность.То же самое предпочтительно и для алкенов.
Физические свойства алканов и их разновидностей
Углеводороды можно классифицировать как алканы, алкены, алкины и ароматические соединения. На вопрос «что такое алканы?» мы можем сказать, что алканы — это насыщенные ациклические/алифатические углеводороды. Это означает, что это соединения с открытой цепью (разветвленной или неразветвленной), и здесь каждый атом углерода связан с другими атомами только одной ковалентной связью. Алкан также называют парафином.Он состоит из атомов углерода и водорода, связанных одинарной ковалентной связью в древовидной структуре. Общая формула алканов CₙH₂ₙ+2.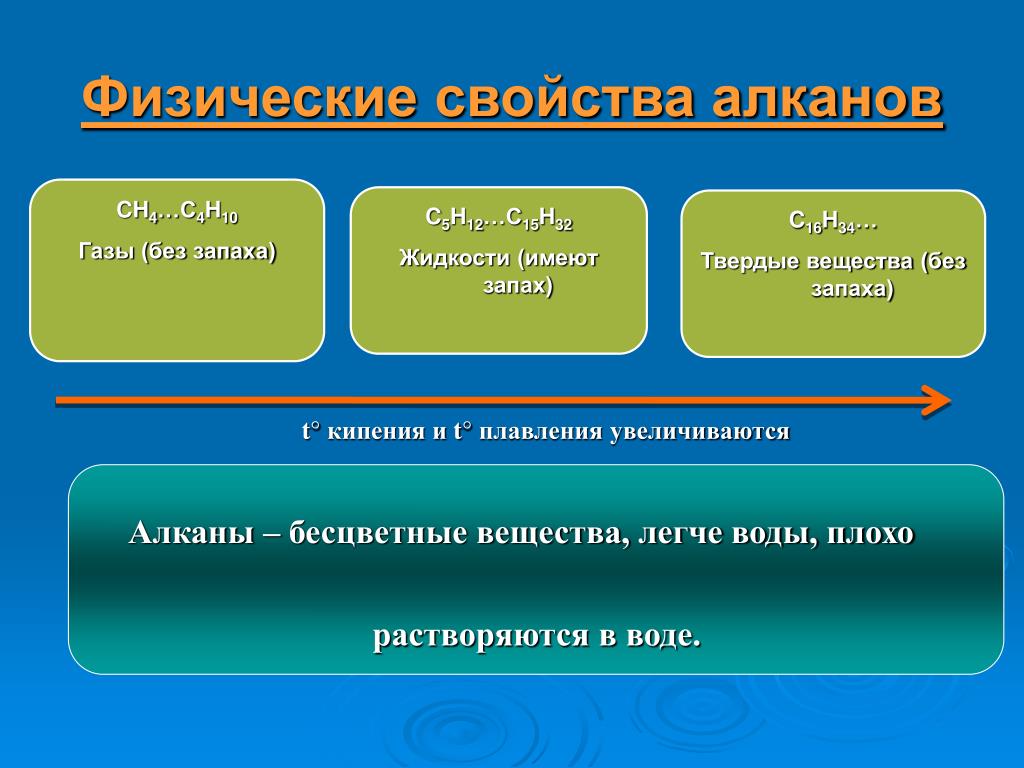 Здесь мы узнаем о свойствах алканов и их вариациях.
Здесь мы узнаем о свойствах алканов и их вариациях.
Изображение будет загружено в ближайшее время
Вышеуказанная структура представляет собой этан (C2H6), который является одним из наиболее распространенных алканов.
Свойства алканов
Давайте теперь посмотрим, каковы физические и химические свойства алканов.
Физические свойства алканов
Некоторые важные физические свойства алканов:
-
Алканы не имеют цвета и запаха.
-
Обладают слабыми силами притяжения Ван-дер-Ваальса.
-
Алканы с 1-4 атомами углерода являются газами, затем с 5-17 атомами углерода они являются жидкими, а алканы с 18 и более атомами углерода являются твердыми при 298К.
-
Структура алканов.
 В алканах все атомы углерода находятся в состоянии sp³-гибридизации, что означает, что они образуют четыре сигма-связи либо с атомами углерода, либо с атомами водорода. Их общая формула CₙH₂ₙ+2.
В алканах все атомы углерода находятся в состоянии sp³-гибридизации, что означает, что они образуют четыре сигма-связи либо с атомами углерода, либо с атомами водорода. Их общая формула CₙH₂ₙ+2.
Валентный угол между ними равен 109.5° и имеют тетраэдрическую геометрию.
Изображение скоро будет загружено
На рисунке выше показано трехмерное изображение метана.
-
Температура плавления и кипения
Алканы с более короткой цепью имеют низкие температуры плавления и кипения, но по мере увеличения числа атомов углерода в цепи температуры плавления и кипения повышаются.
-
Температура кипения – увеличивается с увеличением молекулярной массы, так как сила Ван-дер-Ваальса увеличивается с увеличением молекулярной массы.Алканы с прямой цепью имеют более высокую температуру кипения, чем их структурные изомеры.

-
Температура плавления. Она также увеличивается с увеличением молекулярной массы, потому что трудно разрушить межмолекулярные силы притяжения между высшими алканами, поскольку они обычно являются твердыми веществами. Алканы с четными номерами имеют лучшую упаковку в твердой фазе, чем алканы с нечетными номерами, поскольку они образуют хорошо организованную структуру, которую трудно разрушить, поэтому алканы с четными номерами имеют более высокую температуру плавления, чем алканы с нечетными номерами.
6) Растворимость
-
Алканы, как правило, являются неполярными молекулами из-за ковалентных связей между C-C и C-H, а также из-за очень небольшой разницы между электроотрицательностями углерода и водорода.
-
Мы знаем, что полярные молекулы растворимы в полярных растворителях, а неполярные молекулы обычно растворимы в неполярных растворителях, поэтому это означает, что алканы нерастворимы в воде или гидрофобны по своей природе.
-
Когда неполярный алкан добавляется в полярный растворитель, молекулы воды притягиваются друг к другу, а молекулы алкана притягиваются друг к другу, но молекулы воды и алкана не притягиваются друг к другу.
-
В органических растворителях они растворимы, поскольку энергия, необходимая для преодоления существующих ван-дер-ваальсовых сил и создания новых ван-дер-ваальсовых сил, вполне сопоставима.
7) Алканы имеют меньшую плотность, чем вода, они плавают на воде. Плотность увеличивается с увеличением молекулярной массы.
8) Помимо слабых сил Ван-дер-Уоллса, сил Лондона, сил дисперсии, между молекулами алканов действуют слабые межмолекулярные силы.
Химические свойства алканов
-
Горение алканов
При избытке кислорода O2 алканы легко сгорают с образованием углекислого газа, воды и энергии в виде тепла и света.
Алкан + Кислород → Углекислый газ + Вода + Энергия
C4h20(г) + 6½O2(г) → 4CO2(г) + 5h3O(л) + 2874 кДж моль-1
Вышеуказанная реакция представляет собой реакцию горения бутана . С увеличением молярной массы алкана с прямой цепью выделяется энергия. Также с увеличением длины углеродной цепи увеличивается энергия сгорания. В отсутствие достаточного количества кислорода алканы пытаются подвергнуться неполному сгоранию. Неполное сгорание приводит к образованию воды и угарного газа или углерода.
-
Галогенирование
Алканы менее реакционноспособны. Без ультрафиолетового света они не реагируют с галогенами. С помощью УФ-излучения получают галогенированный алкан. Это реакция замещения, в которой один или несколько атомов водорода замещаются атомами галогена.
Ch4-Ch3-Ch4 + Br2 → Ch4-Ch3-CHBr + HBr
Здесь пропан реагирует с бромом. Общее уравнение реакции замещения можно представить в виде
Общее уравнение реакции замещения можно представить в виде
R-H + X2 → R-X + H-X
, где R представляет собой углеродную цепь, а X представляет собой галоген.
Использование алканов
Из-за свойств алканов они очень полезны. Некоторые из применений:
-
Пропан и бутан используются в газовых горелках на пропане в качестве пропеллентов или аэрозольных распылителей при сжижении при низкой температуре.
-
Топливо с пентановым и октановым числом является хорошим топливом для двигателя внутреннего сгорания.
-
Нонан в гексадекан имеют высокую вязкость и находят применение в дизельном и авиационном топливе.
-
Алканы до С35 используются в качестве парафиновых свечей, в качестве антикоррозионных средств и в смазочных маслах.
 Высшие алканы расщепляются до более мелких алканов, а затем используются.
Высшие алканы расщепляются до более мелких алканов, а затем используются.
Алкан – обзор | ScienceDirect Topics
3.7 Физические свойства алканов
Алканы имеют плотность от 0,6 до 0,8 г/см 3 , поэтому они менее плотны, чем вода. Таким образом, бензин, который в основном представляет собой смесь алканов, имеет меньшую плотность, чем вода, и будет плавать на воде. Чистые алканы бесцветны, не имеют вкуса и почти не имеют запаха. Однако бензин имеет запах и некоторый цвет, потому что нефтепереработчики добавляют в бензин красители, чтобы указать его источник и состав.Бензин также содержит ароматические соединения (глава 5), обладающие характерным запахом.
Алканы содержат только связи углерод-углерод и углерод-водород. Поскольку углерод и водород имеют одинаковые значения электроотрицательности, связи С—Н практически неполярны. Таким образом, алканы неполярны и взаимодействуют только слабыми лондоновскими силами. Эти силы определяют физические свойства алканов, такие как растворимость и температура кипения.
Алканы не растворяются в воде, полярное вещество.Эти два вещества не соответствуют обычному критерию растворимости: «Подобное растворяется в подобном». Молекулы воды слишком сильно притягиваются друг к другу водородными связями, чтобы позволить неполярным алканам проскальзывать между ними и растворяться. Температуры кипения нормальных алканов увеличиваются с увеличением молекулярной массы (таблица 3.3). По мере увеличения молекулярной массы силы Лондона увеличиваются, потому что присутствует больше атомов, увеличивающих площадь поверхности или молекулы. Проще говоря, точек соприкосновения между соседними молекулами больше, а лондонские силы сильнее.
Таблица 3.3. Физические свойства алканов и циклоалканов
| углеводород | кипения | точка кипения (° C) | плотность (г / мл) |
|---|---|---|---|
| -1649 | 0.678 | ||
| Ethane | — 88. 6 6 | 0.691 | |
| Пропан | 42.1 | 0.690 | |
| Бутан | -0,5 | 0.711 | |
| Pentane | 36.1 | 0,6262 | |
| Гексан | 68,9 | 0,6603 | |
| гептана | 98,4 | 0,6837 | |
| Октан | 125,7 | 0,7025 | |
| Декан | 150,8 | 0,7176 | |
| циклопропан | -32,7 | (газ при 20 ° C) | |
| Cyclobutane | 12 | (газ при 20 ° C) | |
| Cyclopentane | 49.3 | 0,7457 | |
| Циклогексан | 80,7 | 0,7786 | |
| циклогептан | 110,5 | 0,8098 | |
| циклооктан | 148,5 | 0,8349 |
Нормальные алканы имеют эффективный контакт между цепями, и молекулы могут двигаться близко друг к другу. Ветвление в алканах увеличивает расстояние между молекулами, а цепочки атомов углерода менее способны сближаться друг с другом.Разветвленный алкан более компактен и имеет меньшую площадь поверхности, чем обычный алкан. Порядок температур кипения изомерных соединений C 5 H 12 иллюстрирует это явление. Для любой группы изомерных алканов наиболее разветвленный изомер имеет самую низкую температуру кипения. Нормальный алкан имеет самую высокую температуру кипения.
Ветвление в алканах увеличивает расстояние между молекулами, а цепочки атомов углерода менее способны сближаться друг с другом.Разветвленный алкан более компактен и имеет меньшую площадь поверхности, чем обычный алкан. Порядок температур кипения изомерных соединений C 5 H 12 иллюстрирует это явление. Для любой группы изомерных алканов наиболее разветвленный изомер имеет самую низкую температуру кипения. Нормальный алкан имеет самую высокую температуру кипения.
Физические свойства ряда циклоалканов с возрастающей молекулярной массой аналогичны свойствам ряда алканов. Плотность увеличивается, как и температура кипения (таблица 3.3). Температуры кипения циклоалканов выше, чем у алканов, содержащих такое же число атомов углерода.
Физические свойства алканов | Органическая химия
Ряд неразветвленных алканов, в котором последовательные члены отличаются на группу -CH 2 -, называется гомологическим рядом, и каждый алкан в этом ряду является гомологом.
Алканы неполярны из-за небольшой разницы электроотрицательностей между углеродом и водородом, что означает, что между их молекулами существуют лишь слабые дисперсионные силы.
Сила этих сил увеличивается пропорционально длине углеродной цепи. Первые четыре алкана представляют собой газы при комнатной температуре и атмосферном давлении; умеренные углеродные цепи, от C 5 до C 17 , являются жидкостями. Гомологи помимо C 17 являются твердыми веществами.
Дисперсионные силы также влияют на различные физические свойства алканов.
В гомологическом ряду с увеличением площади поверхности увеличиваются и дисперсионные силы между молекулами.Поскольку для разделения молекул требуется больше энергии, температуры кипения неразветвленных алканов повышаются с каждым дополнительным углеродом.
В отличие от алканов с прямой цепью, алканы с разветвленной цепью компактны и более сферичны, что уменьшает площадь взаимодействия и силу межмолекулярных сил. Поэтому по сравнению с неразветвленной формой разветвленные изомеры кипят при более низких температурах.
Поэтому по сравнению с неразветвленной формой разветвленные изомеры кипят при более низких температурах.
В то время как температуры кипения алканов с прямой цепью постепенно повышаются с увеличением количества атомов углерода, их температуры плавления не увеличиваются постоянно.Вместо этого тенденция чередуется между четными и нечетными членами гомологического ряда.
В кристаллическом состоянии даже алканы плотно упакованы в зигзагообразную структуру. Следовательно, молекулы испытывают более сильное притяжение, что приводит к более высоким температурам плавления.
Для сравнения, нечетные алканы менее плотно упакованы из-за их параллельного расположения, что приводит к более слабым взаимодействиям и более низким температурам плавления.
Температуры плавления разветвленных алканов определяются их молекулярной симметрией.
Разветвленные алканы с существенной симметрией плавятся при более высоких температурах, чем неразветвленные углеводороды. Для сравнения, асимметричное разветвление приводит к более низкой температуре плавления.
Алканы нерастворимы в воде из-за их неспособности образовывать водородные связи. Кроме того, поскольку их плотность ниже 1 г/см 3 , они плавают на воде.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
.