Неорганические соединения в клетке и их роль (минеральные вещества) | Биология. Реферат, доклад, сообщение, краткое содержание, лекция, шпаргалка, конспект, ГДЗ, тест
Раздел: Метаболизм
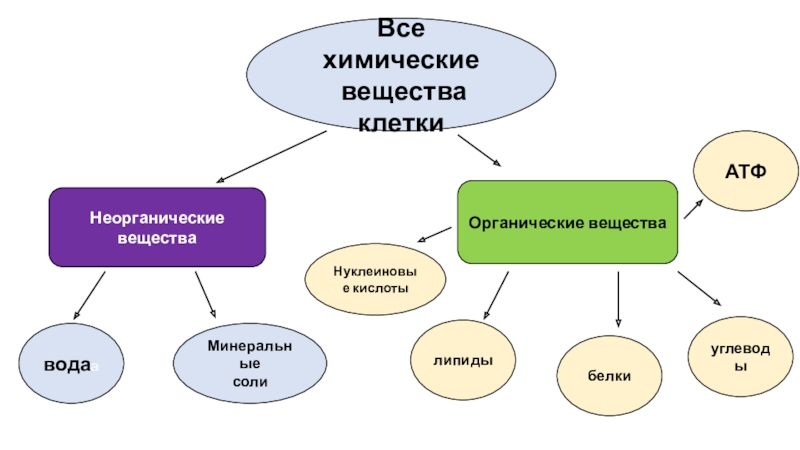
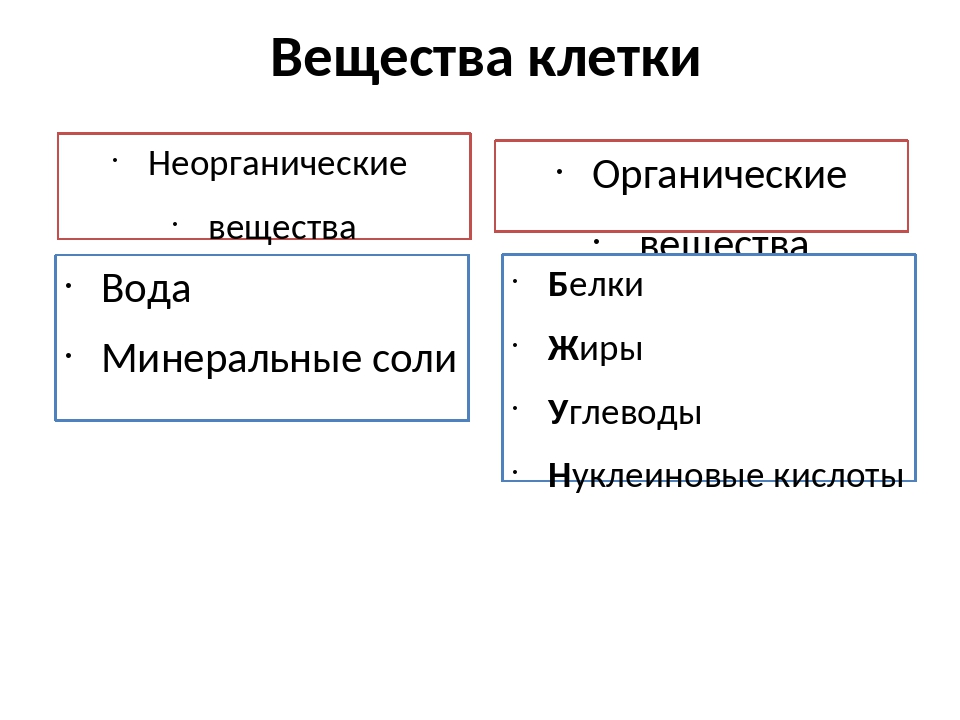
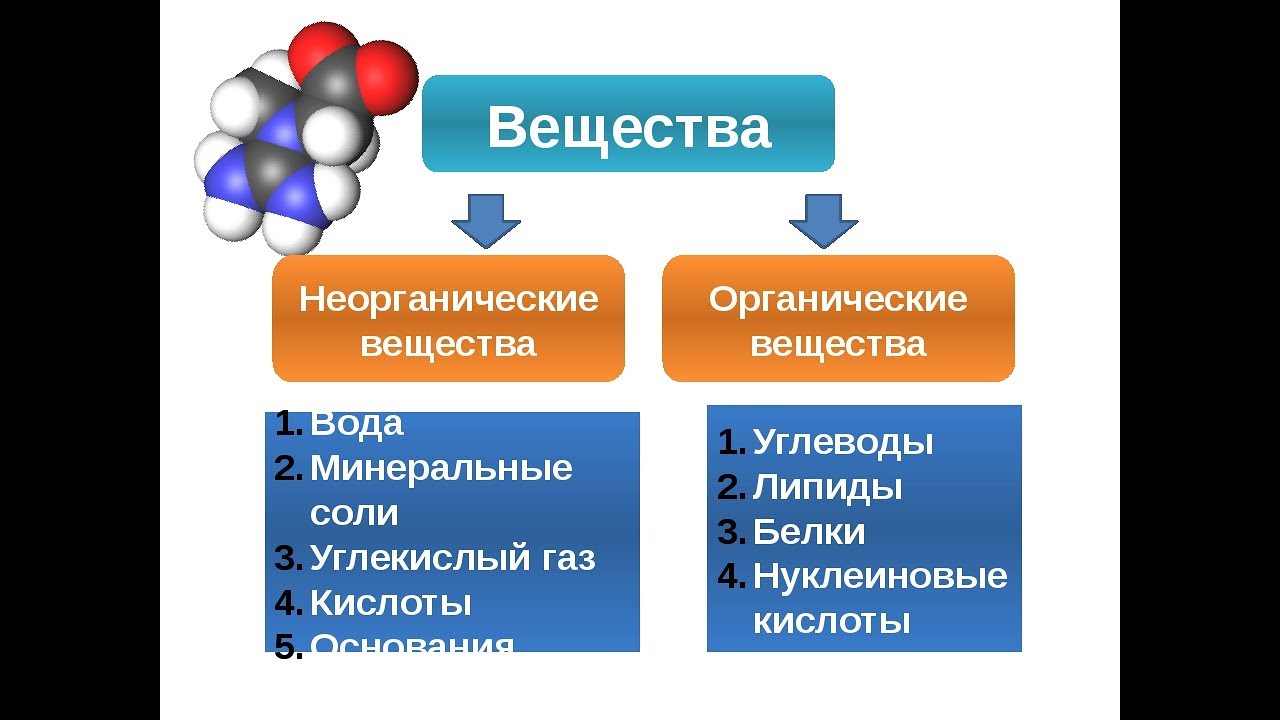
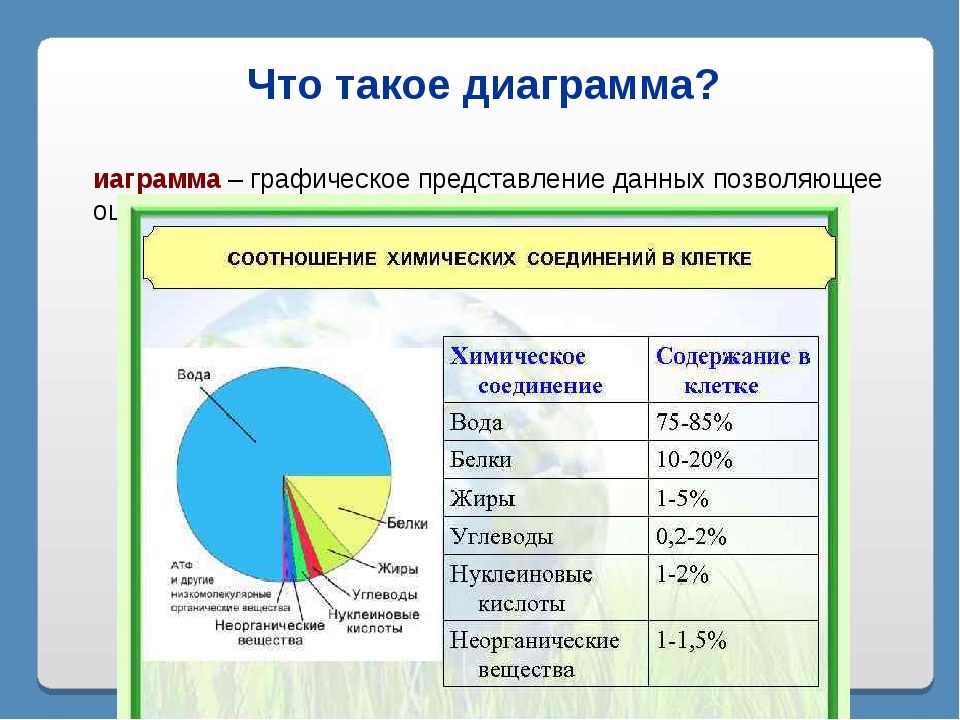
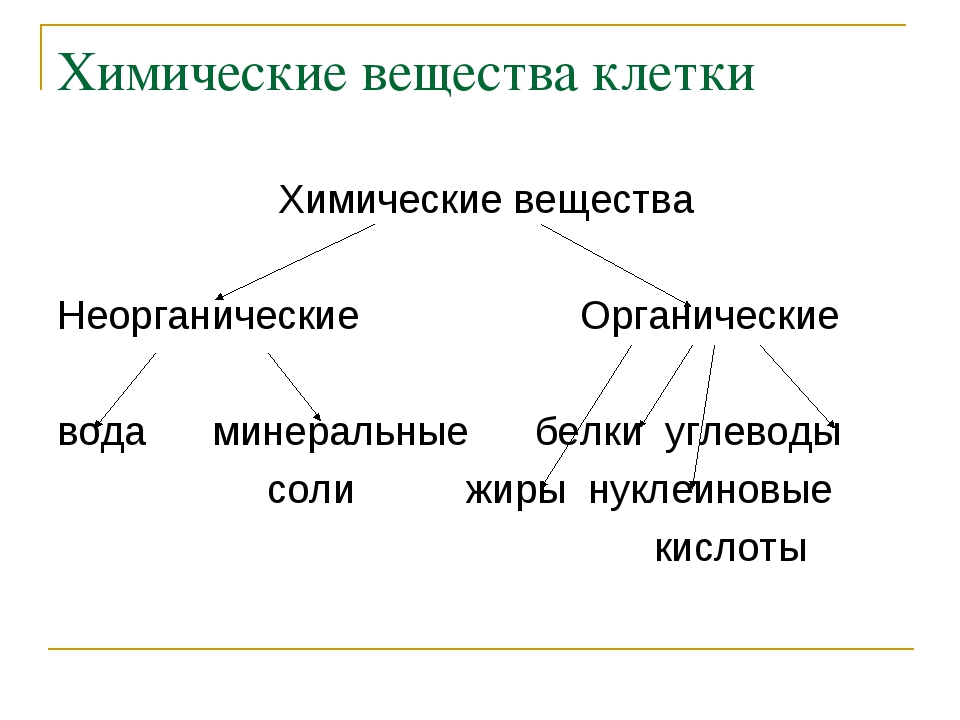
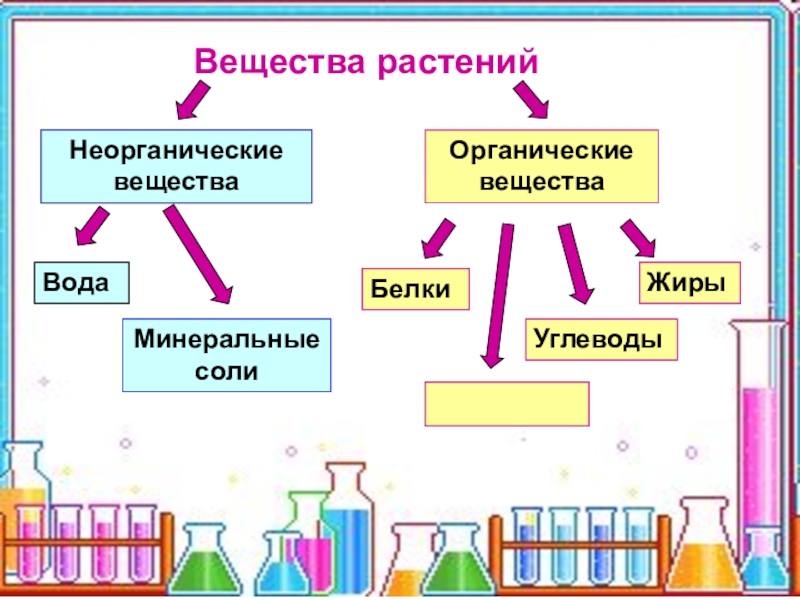
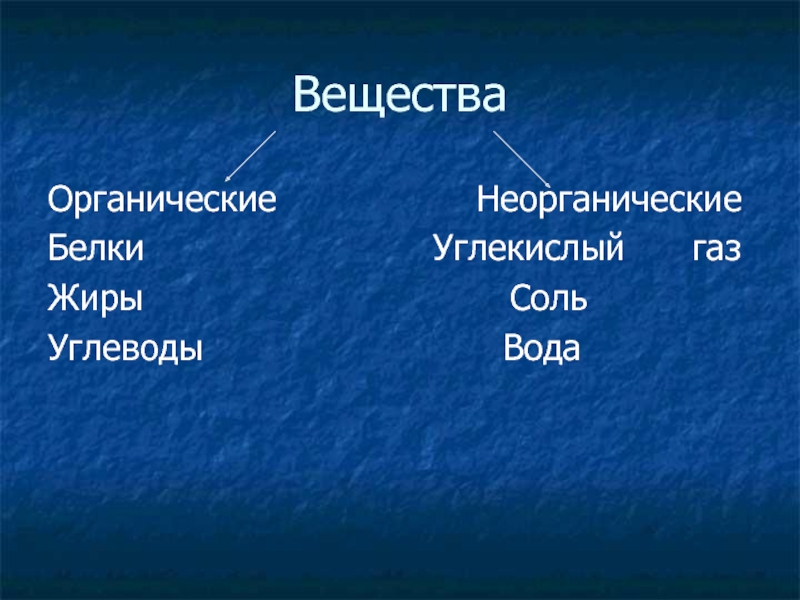
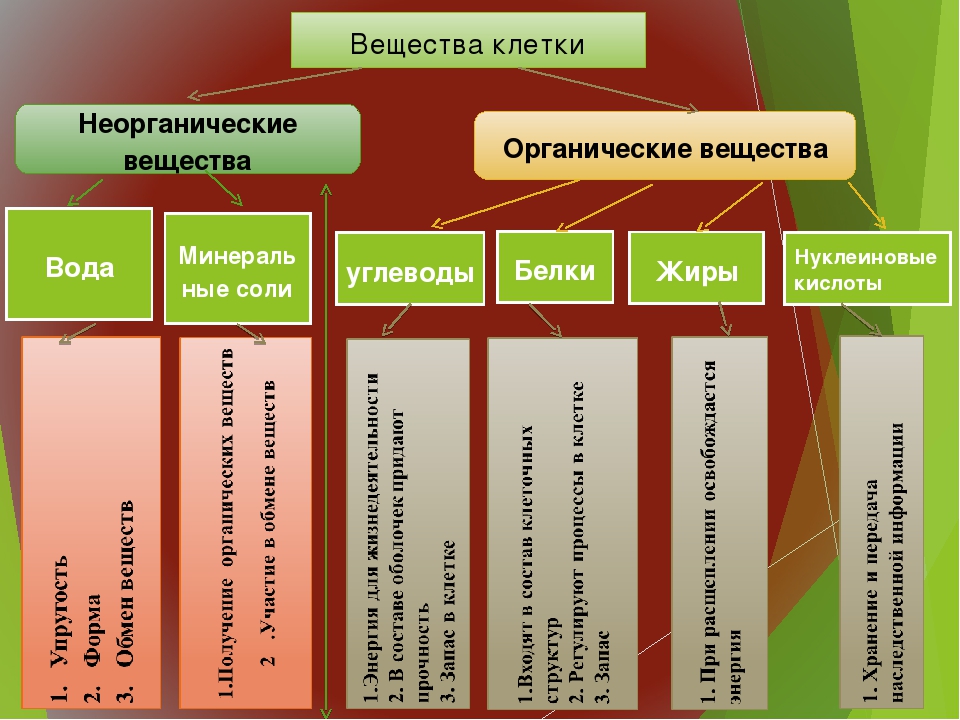
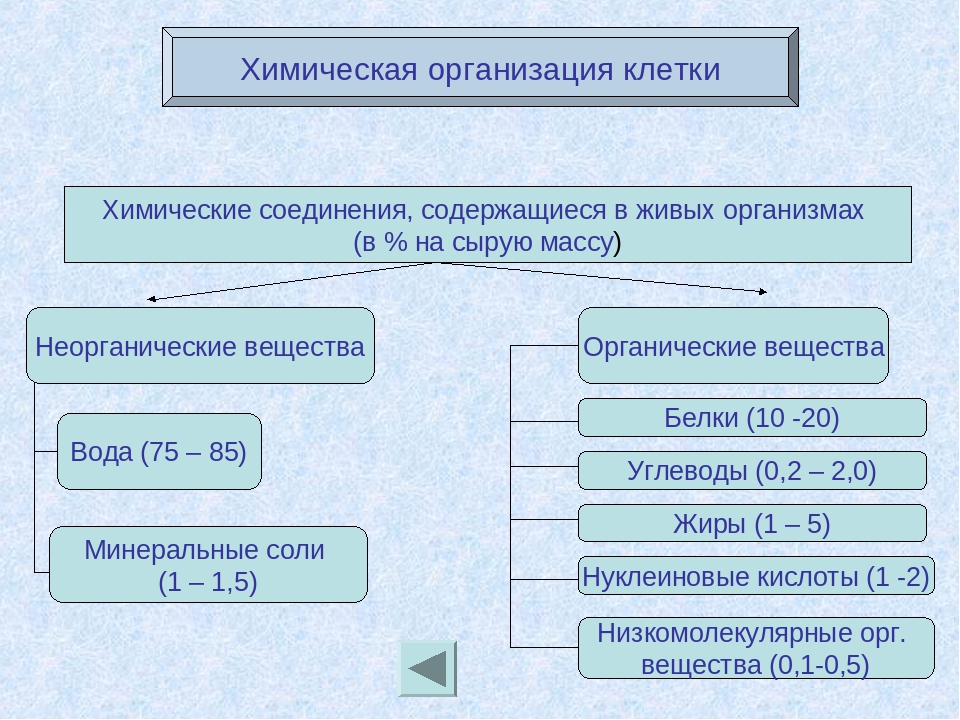
К неорганическим соединениям принадлежат вода, макро- и микроэлементы и их соединения; их называют минеральными веществами.
Вода — универсальный растворитель неорганических и некоторых органических веществ. Большинство химических реакций и физиологических процессов происходят в клетке в водных растворах. В крови, лимфатической системе, в системе пищеварения, в почках она выполняет транспортную функцию. Благодаря своим физико-химическим свойствам вода принимает участие в регуляции теплообмена и поддержке постоянной температуры тела. В организме взрослого человека её содержание в среднем 60-65 %. В организме новорождённого ребёнка 75-80 %.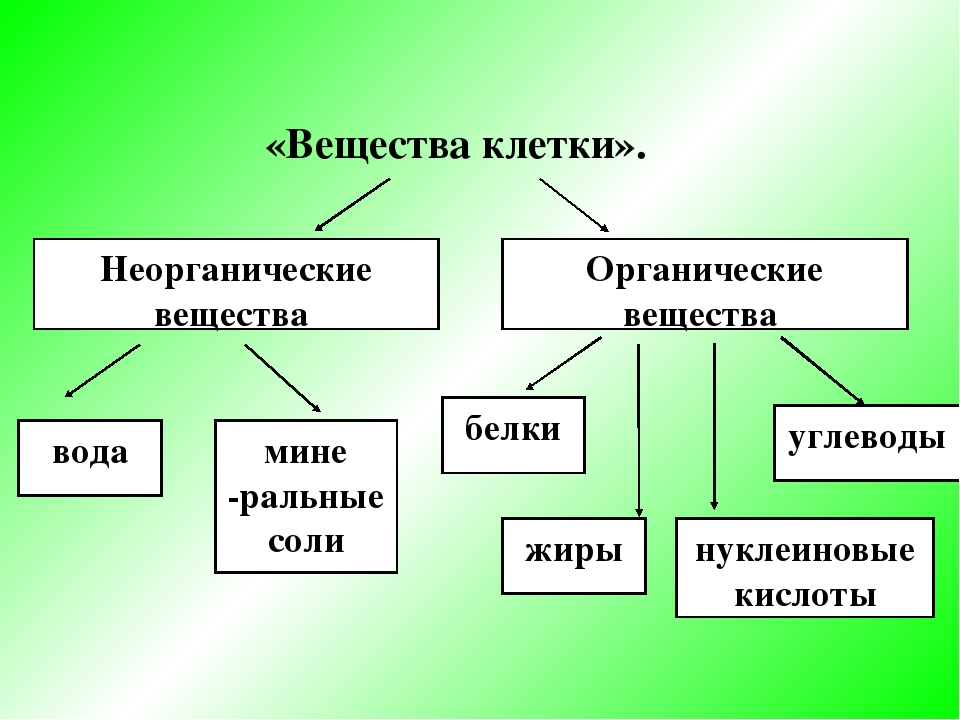 Чем младше организм, тем воды в нём больше. Вода входит в состав всех тканей и органов тела. В крови её почти 90 %, в мышцах — 75 %, в костях — до 50 %.
Чем младше организм, тем воды в нём больше. Вода входит в состав всех тканей и органов тела. В крови её почти 90 %, в мышцах — 75 %, в костях — до 50 %.
Определённое и постоянное содержание воды в организме человека является необходимым условием его существования. Изменение количества употреблённой воды вызывает нарушение функций всех клеток организма, а также процессов пищеварения и усвоения пищи, мочевыделения, умственной деятельности, теплообмена. Если человек теряет воду в количестве до 2 % от массы тела (1-1,5 л), у него возникает жажда; 6-8 % — слабость, головокружение и возможность потери сознания, 10 % — возникают галлюцинации и судороги, до 20-25 % — наступает смерть от обезвоживания клеток. Избыточное количество воды в организме перегружает сердечно-сосудистую, мочевыделительную и другие системы. Материал с сайта http://worldofschool.ru
Минеральные вещества в виде соединений макро- и микроэлементов, которые содержатся в клетке в растворимом состоянии (1-1,5 % от общей массы клетки), обеспечивают почти все процессы жизнедеятельности организма и его развитие.
-
Минеральные вещества и их роль в клетке реферат 10 класс
Доклад на тему неорганические соединения клеток
Биология минеральные вещества и их роль в клетке доклад
Реферат по биологии на тему наследственные болезни человека
Вода минеральные вещества и их роль в жизни клетке
-
Обоснуйте значение минеральных веществ для организма человека.
-
Каковы биологические функции неорганических соединений?
3. Минеральные вещества и их роль в клетке
Для нормальной жизнедеятельности организмов требуются минеральные соли. В клетке они находятся в твёрдом или в растворённом виде. Растворённые соли диссоциированы на ионы. Наиболее важными являются катионы металлов: калия K+, натрия Na+, кальция Ca2+, магния Mg2+, и анионы: Cl−, h3PO4−, HPO42−, HCO3−, CO32−.
В клетке они находятся в твёрдом или в растворённом виде. Растворённые соли диссоциированы на ионы. Наиболее важными являются катионы металлов: калия K+, натрия Na+, кальция Ca2+, магния Mg2+, и анионы: Cl−, h3PO4−, HPO42−, HCO3−, CO32−.
Роль минеральных солей в клетке разная. Так, ионы калия и натрия обеспечивают возбудимость клеток. Внутри клетки больше ионов K+ , а снаружи всегда больше содержание Na+, что приводит к возникновению разности потенциалов на клеточной мембране, обеспечивает раздражимость клеток и передачу возбуждения по нервам или мышцам. Перенос ионов через мембрану клетки осуществляется натрий-калиевым насосом и происходит с затратами АТФ (активный транспорт).
Рис. \(1\). Натриево-калиевый насос
Ионы кальция участвуют в регуляции мышечных сокращений, необходимы для процесса свёртывания крови. Твёрдые соли кальция входят в состав костной ткани, содержатся в раковинах моллюсков и панцирях ракообразных.
Ионы магния входят в состав хлорофилла, а ионы железа — в состав гемоглобина.
Катионы многих металлов (магния, кальция, железа, меди, кобальта, цинка, марганца и др.) необходимы для синтеза некоторых ферментов, гормонов и витаминов.
Анионы фосфорной и угольной кислот образуют буферные системы, поддерживающие на постоянном уровне содержание ионов водорода в клетке (рН среды). Анионы HPO42− и h3PO4− (фосфатная буферная система) обеспечивают рН цитоплазмы клеток в пределах \(6,9\)–\(7,4\). Анионы HCO3− и CO32− (бикарбонатная буферная система) поддерживают значение рН плазмы крови \(7,4\).
Минеральные соли, содержащие азот и фосфор, нужны для образования белков, ДНК, РНК, АТФ и др.
Фосфаты входят в состав костной и зубной ткани. Хлорид-ионы необходимы для образования соляной кислоты, содержащейся в желудочном соке, а сульфат ионы — для синтеза некоторых аминокислот.
Недостаток минеральных солей приводит к нарушению процессов обмена веществ и негативно сказывается на жизнедеятельности клетки.
Источники:
Рис. 1. Натриево-калиевый насос © ЯКласс.
Вещества живых организмов. Неорганические соединения — Учебник по Биологии. 9 класс. Задорожный
Учебник по Биологии. 9 класс. Задорожный — Новая программа
Вспомните вещества, необходимые организмам для их жизнедеятельности. Какую роль играют водные растворы в природе и в жизни человека? Какой тип химической связи существует в молекуле воды? Что такое ионы и как они образуются?
Химические элементы живых организмов
В состав растительных и животных клеток входит более 70 химических элементов. Но в клетке нет каких-либо особенных элементов, характерных только для живой природы. Те же элементы встречаются и в неживой природе.
Все химические элементы по содержанию в живой клетке разделяют на три группы: макроэлементы, микроэлементы и ультрамикроэлементы.
Содержание химических элементов в живых клетках
|
Группа элементов |
Химические символы элементов |
Процент от массы организма, % |
|
Макроэлементы |
Н, O, С, N, Р, S, Na, К, Mg, Са, Cl |
10-0,001 |
|
Микроэлементы |
Fe, Cu, Zn, Mn, Со, I, F, Ni и другие |
0,001-0,000001 |
|
Ультрамикроэлементы |
Au, Se, Hg, U, Ra и другие |
Менее 0,000001 |
Элементы О, С, Н, N иногда рассматривают как отдельную группу органогенных элементов ввиду того, что они входят в состав всех органических веществ и составляют до 98 % массы живой клетки.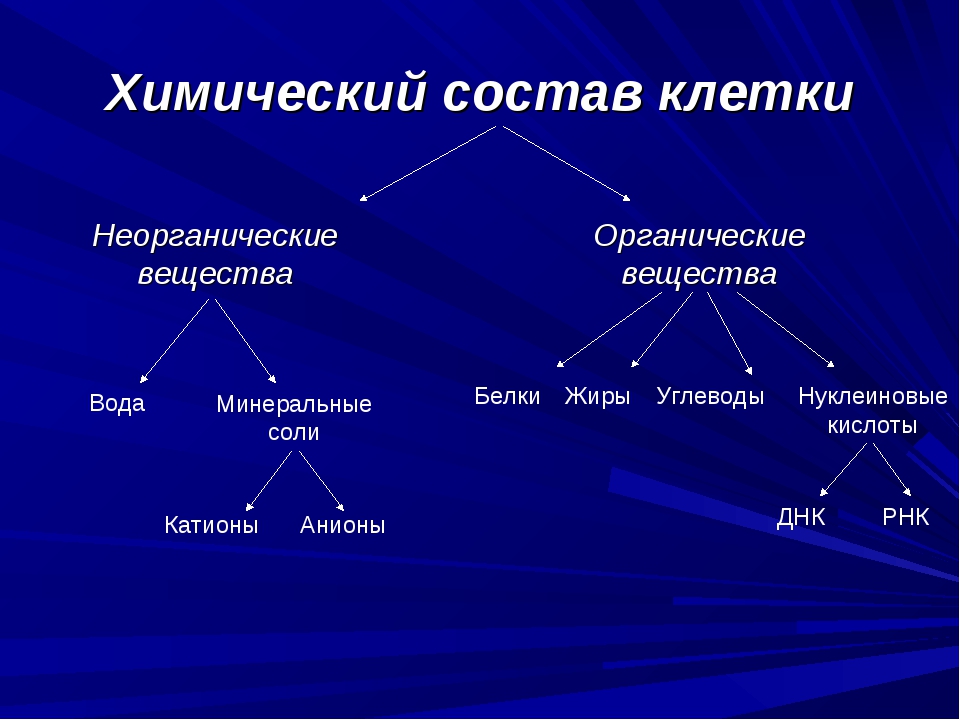
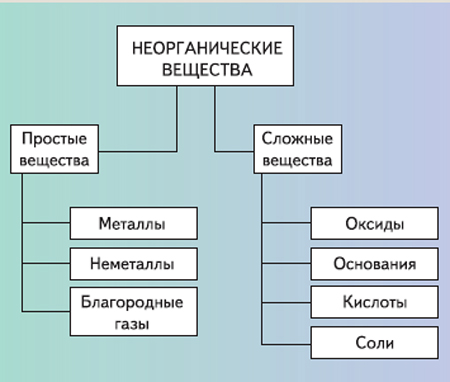
Неорганические вещества живых организмов
Изучая химию, вы узнали о таких группах веществ, как кислоты, соли, оксиды и др. Все они распространены в неживой природе, вне живых организмов. Поэтому их и называют неорганическими веществами. Но это не означает, что в живых организмах их вообще нет. Они есть и играют очень важную роль в процессах жизнедеятельности.
Неорганические вещества обычно попадают в живые организмы из внешней среды с пищей (у животных) или с раствором воды через поверхность организма (у растений, грибов и бактерий). Но в некоторых случаях живые организмы могут синтезировать их самостоятельно. Например, клетки желудка у позвоночных синтезируют хлоридную кислоту. Это позволяет более эффективно переваривать пищу, так как многие пищеварительные ферменты работают в кислой среде. Также самостоятельно вырабатывают сульфатную кислоту многие хищные моллюски в своих слюнных железах. Эта кислота может разрушать раковины и внешние покровы их жертв.
Функции неорганических веществ в клетке
|
Неорганические вещества |
Функции в клетке |
|
Катионы Гидрогена (Н+) |
Обеспечивают кислотно-щелочной баланс (поддерживают постоянство внутриклеточной среды) |
|
Катионы и анионы растворимых солей (Na+, К+, СГ) |
Создают разность потенциалов между содержимым клетки и внеклеточной средой, обеспечивая проведение нервного импульса |
|
Слаборастворимые соли Кальция и Фосфора |
Образуют опорные структуры (например, в костях позвоночных) |
|
Ионы металлических элементов |
Являются компонентами многих гормонов, ферментов и витаминов или участвуют в их активации |
|
Сложные неорганические соединения Нитрогена, Кальция и Фосфора |
Участвуют в синтезе органических молекул |
Неорганические соединения могут находиться в живых организмах как в растворенном (в виде ионов), так и в нерастворенном виде. Растворенными формами представлены многие соли.
Растворенными формами представлены многие соли.
Нерастворимые неорганические соединения также важны для живых организмов. Например, соли Кальция и Фосфора входят в состав скелета животных и обеспечивают его прочность (рис. 2.1, с. 10). Без таких веществ невозможно формирование здоровых зубов у человека.
Рис. 2.1. Кость человека с удаленными минеральными веществами можно легко завязать узлом
Рис. 2.2. Структуры живых организмов, которые состоят преимущественно из неорганических веществ
Из неорганических веществ также могут быть образованы различные структуры организмов животных (рис. 2.2).
Свойства воды
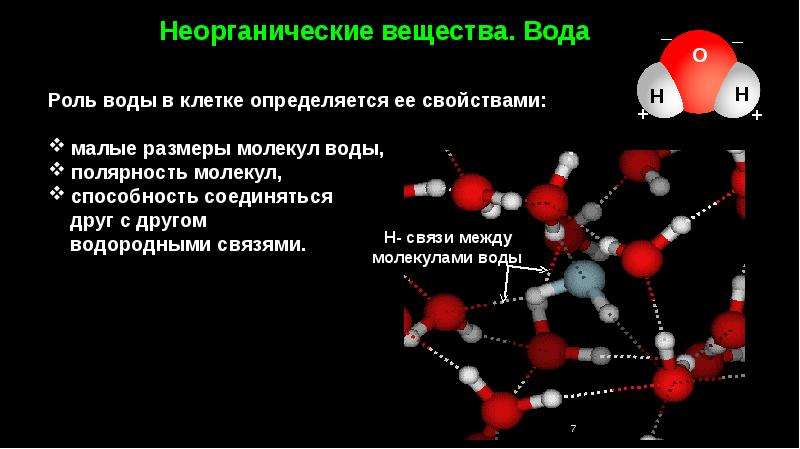
Свойства воды обусловлены особенностями строения ее молекулы, а также связями молекул друг с другом.
Как вы уже знаете, в молекуле воды (химическая формула — Н2O) между атомами Гидрогена и Оксигена существует ковалентная полярная связь (рис. 2.3). Это значит, что на атоме Оксигена формируется частичный отрицательный заряд (δ—), а на атомах Гидрогена — положительный (δ+).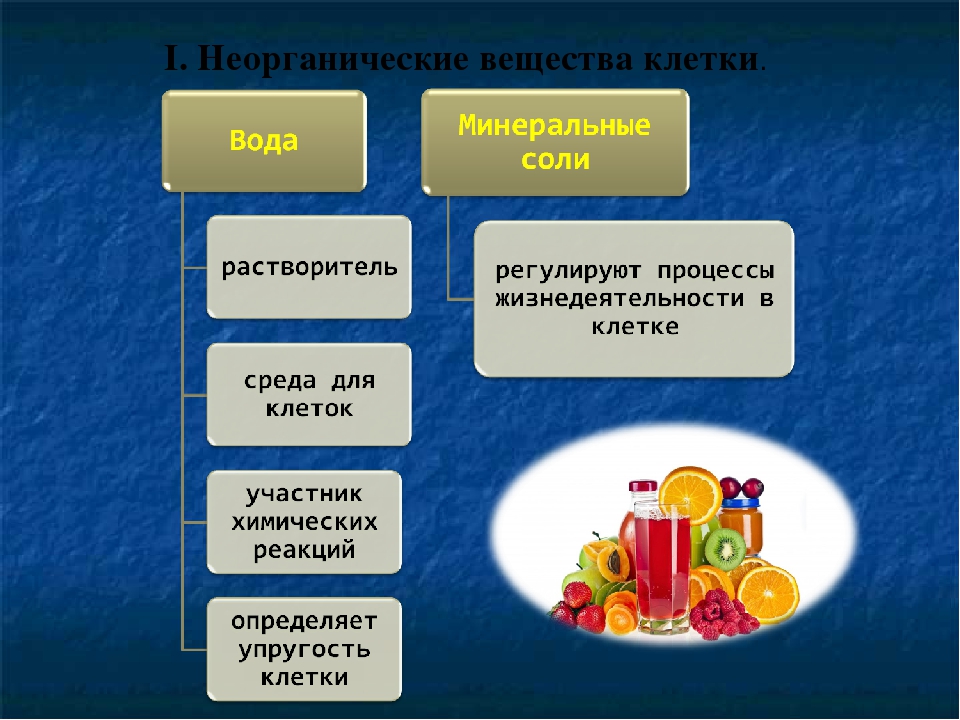 Положительно заряженный атом Гидрогена одной молекулы воды притягивается к отрицательно заряженному атому Оксигена другой молекулы воды. Такая связь называется водородной.
Положительно заряженный атом Гидрогена одной молекулы воды притягивается к отрицательно заряженному атому Оксигена другой молекулы воды. Такая связь называется водородной.
Водородная связь примерно в 15-20 раз слабее ковалентной. Поэтому водородная связь относительно легко разрывается, что происходит, например, при испарении воды. В жидком состоянии водородные связи между молекулами воды все время то разрываются, то образуются заново.
Рис. 2.3. Строение молекулы воды и образование водородных связей между ее молекулами
Биологическая роль воды
В живых организмах вода выполняет много функций: среды-растворителя, транспортную, метаболическую, терморегуляторную, структурную.
Вода является универсальным растворителем. Вещества, участвующие в большинстве биологических реакций, находятся в организме в водном растворе.
Транспортная роль воды очень важна для клеток и организмов в целом. Растворенные вещества вместе с водой могут переноситься из одних частей клетки в другие. А между различными частями многоклеточных организмов они переносятся в составе специальных жидкостей (например, в составе крови). Испарение воды листьями растений вызывает ее движение от корней вверх. При этом перемещаются и вещества, растворенные в воде.
А между различными частями многоклеточных организмов они переносятся в составе специальных жидкостей (например, в составе крови). Испарение воды листьями растений вызывает ее движение от корней вверх. При этом перемещаются и вещества, растворенные в воде.
Молекулы воды выполняют метаболическую функцию, когда участвуют в реакциях обмена веществ (их называют биохимическими реакциями). Терморегуляторная функция воды чрезвычайно важна для поддержания температуры тела организмов. Когда, например, человек потеет, то вода испаряется, снижая температуру его тела.
Структурная функция воды хорошо видна на примере растений и некоторых беспозвоночных животных. Растения поддерживают форму листьев и травянистых стеблей благодаря повышенному давлению в клетках, наполненных водой. А у многих червей форма тела поддерживается повышенным давлением воды в полостях тела.
В живых организмах содержатся как органические, так и неорганические вещества. Неорганические вещества — это вода, соли, кислоты и другие соединения. Они играют важную роль в жизнедеятельности живых организмов. Вода создает среду, в которой происходят реакции обмена веществ. Другие неорганические вещества участвуют в формировании скелета, работе нервной, пищеварительной и других систем организма.
Они играют важную роль в жизнедеятельности живых организмов. Вода создает среду, в которой происходят реакции обмена веществ. Другие неорганические вещества участвуют в формировании скелета, работе нервной, пищеварительной и других систем организма.
Проверьте свои знания
1. Какие неорганические вещества встречаются в живых организмах? 2. Докажите на примерах, что свойства воды имеют большое значение для живых клеток. 3. Какие функции могут выполнять кислоты в живых организмах? 4*. К каким последствиям для организма человека может привести потеря солей Na?
§2. Химические соединения в живых организмах. Неорганические вещества
1. Какие неорганические вещества входят в состав живых организмов?
В состав живых организмов входят такие неорганические вещества как вода, минеральные соли, неорганические (минеральные) кислоты и некоторые другие.
2. Какие вещества называют гидрофильными? Гидрофобными? Приведите примеры.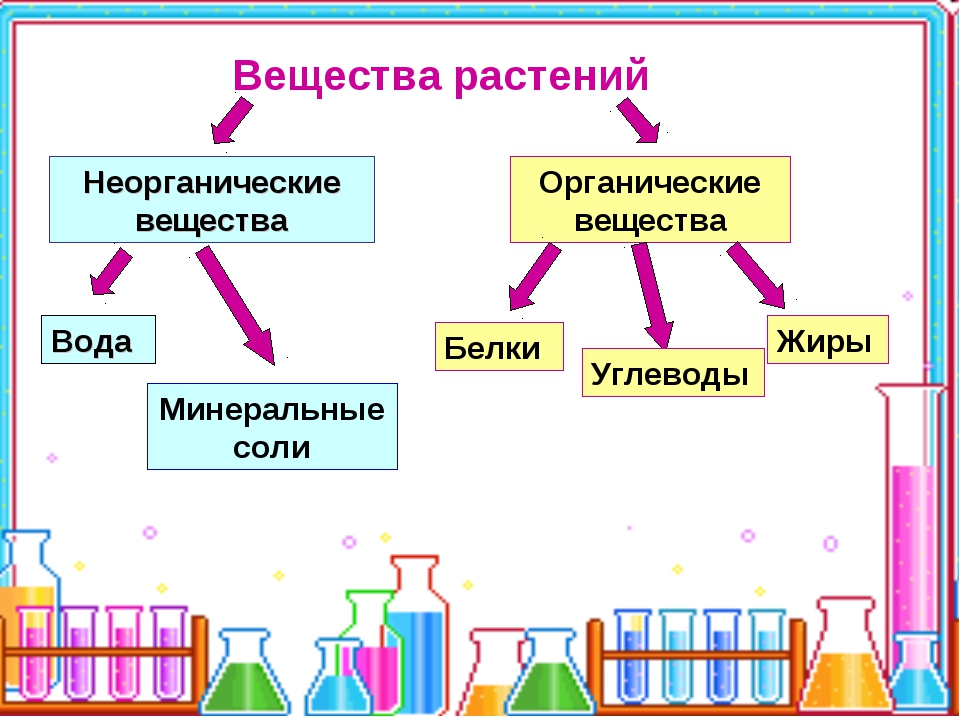
Гидрофильными называют вещества, которые интенсивно взаимодействуют с молекулами воды с образованием водородных связей. Как правило, гидрофильные вещества хорошо растворяются в воде. Гидрофобные вещества слабо взаимодействуют с молекулами воды, «стремятся» избежать контакта с ней. Такие вещества не растворяются в воде. Для базового уровня изучения биологии достаточно, чтобы учащиеся характеризовали гидрофильные вещества как растворимые в воде, а гидрофобные – как нерастворимые в ней.
Гидрофильными веществами являются, например, моно- и дисахариды, низшие спирты, низшие карбоновые кислоты, многие неорганические кислоты и соли. К гидрофобным относятся жиры, высшие карбоновые кислоты и некоторые другие вещества.
3. Охарактеризуйте биологическую роль минеральных солей и кислот.
Нерастворимые минеральные соли входят в состав различных опорных структур живых организмов, например, карбонат кальция (CaCO3) – в состав раковин моллюсков и панцирей ракообразных.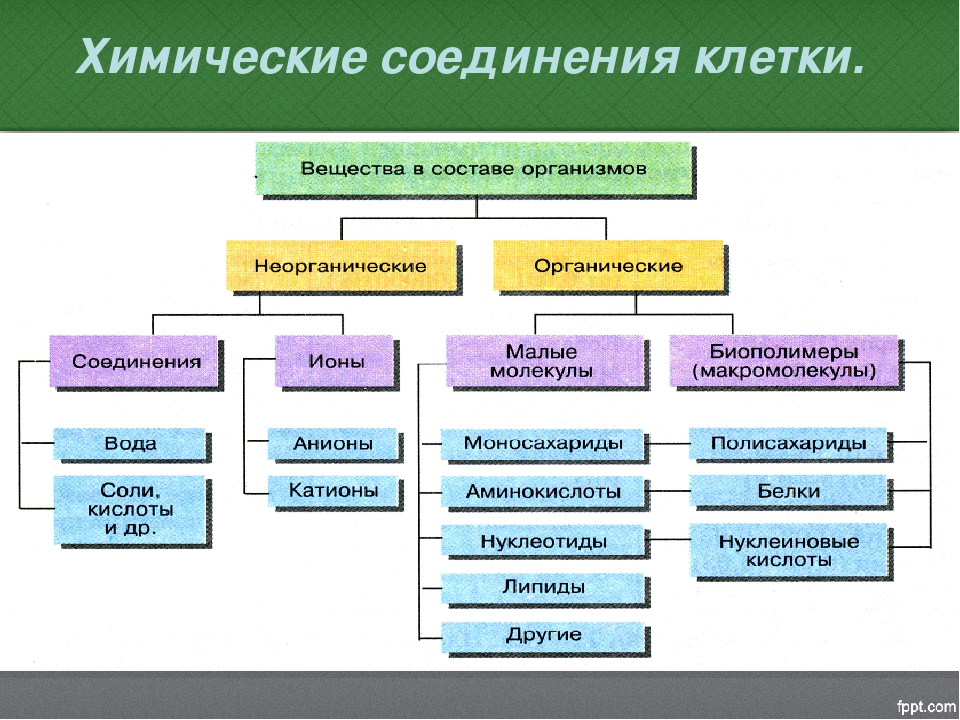 Внутриклеточный скелет некоторых протистов построен из сульфата стронция (SrSО4).
Внутриклеточный скелет некоторых протистов построен из сульфата стронция (SrSО4).
Растворимые минеральные соли в живых организмах находятся в виде ионов т.к. в водной среде происходит их диссоциация. С биологической точки зрения наиболее важными среди ионов являются катионы К+, Na+, Ca2+, Mg2+ и анионы Cl–, НСО3–, НРО42–, Н2РО4–. Разная концентрация ионов К+ и Na+ внутри и снаружи клеток приводит к возникновению разности электрических потенциалов на цитоплазматической мембране, что важно для передачи нервных импульсов и для транспорта веществ через мембрану. При уменьшении этой разности снижается возбудимость клеток. Остатки фосфорной кислоты входят в состав нуклеотидов и АТФ. Fe2+ входит в состав гемоглобина, Mg2+ – в состав хлорофилла. Ионы NO3– и NH4+ являются источниками атомов азота, а ион SO42– – атомов серы, которые необходимы автотрофным организмам для синтеза аминокислот. Ионы Са2+ и Mg2+ выполняют регуляторную функцию, активизируют многие ферменты. Например, ионы Mg2+ активизируют энергетический обмен и синтез АТФ.
Ионы Са2+ и Mg2+ выполняют регуляторную функцию, активизируют многие ферменты. Например, ионы Mg2+ активизируют энергетический обмен и синтез АТФ.
Минеральные (неорганические) кислоты также выполняют важные биологические функции. Соляная кислота создаёт кислую среду в желудке позвоночных животных и человека, способствуя уничтожению болезнетворных микроорганизмов и активации ферментов желудочного сока, стимулирует сокращения стенок желудка. Анионы фосфорной кислоты образуют фосфатную буферную систему, обеспечивающую поддержание нейтральной или слабощелочной среды внутри клеток. Угольная кислота и её анионы формируют бикарбонатную буферную систему, которая поддерживает слабощелочную реакцию внеклеточной среды.
4. Сколько воды содержится в живых организмах? От чего это зависит? Почему растения при недостатке воды увядают?
Содержание воды в живых организмах составляет 60–75% их массы. В организме некоторых животных (например, медуз), в листьях и сочных плодах растений массовая доля воды может достигать 98%.
Содержание воды зависит от вида организма, его возраста, типа клеток (тканей) и их физиологического состояния. Например, у человека в сером веществе головного мозга содержится около 85% воды, а в костной ткани – 22%. Наибольшее содержание воды в организме наблюдается в эмбриональный период (около 95%) и с возрастом постепенно уменьшается, что приводит к снижению функциональной активности клеток, тканей и организма в целом.
Вода определяет объём клетки и внутриклеточное (тургорное) давление, вызывающее напряжённое состояние клеточной оболочки. При недостатке воды в клетках снижается тургорное давление, поэтому растения увядают.
5. Два раствора глюкозы разделены мембраной, не пропускающей молекулы глюкозы, но пропускающей воду. Концентрация глюкозы в первом растворе — 1%, во втором — 0,1%. Что происходит с молекулами воды? Как называется это явление?
Молекулы воды перемещаются через полупроницаемую мембрану из менее концентрированного раствора (с массовой долей глюкозы 0,1%) в более концентрированный раствор (с массовой долей глюкозы 1%).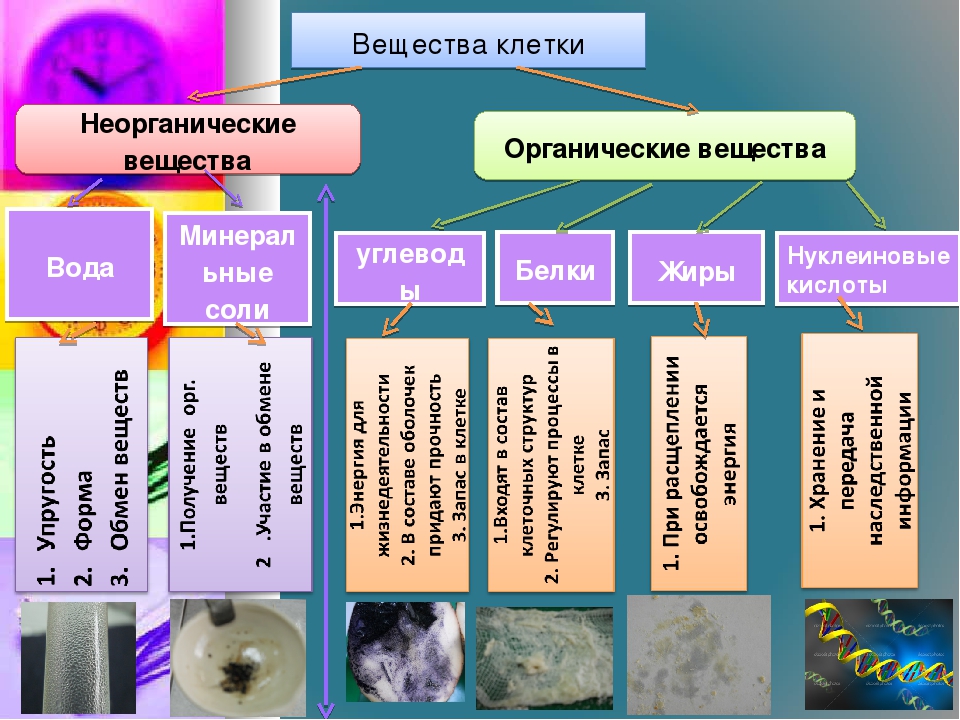 Это явление называется осмосом. За счёт осмоса происходит выравнивание концентраций глюкозы в растворах, разделённых полупроницаемой мембраной.
Это явление называется осмосом. За счёт осмоса происходит выравнивание концентраций глюкозы в растворах, разделённых полупроницаемой мембраной.
6. Каковы основные функции воды в живых организмах? Как физические и химические свойства воды связаны с её биологическими функциями?
Вода входит в состав клеток и межклеточного вещества, составляет основу крови, лимфы, тканевой жидкости, секретов желез. Она определяет объём клеток и обеспечивает поддержание тургорного давления. Вода – универсальный растворитель для полярных соединений и основная среда, в которой протекают процессы обмена веществ живых организмов. Большинство химических реакций в организме происходит именно в водных растворах. Поступление и выведение веществ из клеток осуществляется, как правило, в растворённом виде. Вода как растворитель участвует в явлениях осмоса, благодаря которому происходит выравнивание концентраций растворённых веществ в клетках и внеклеточной среде.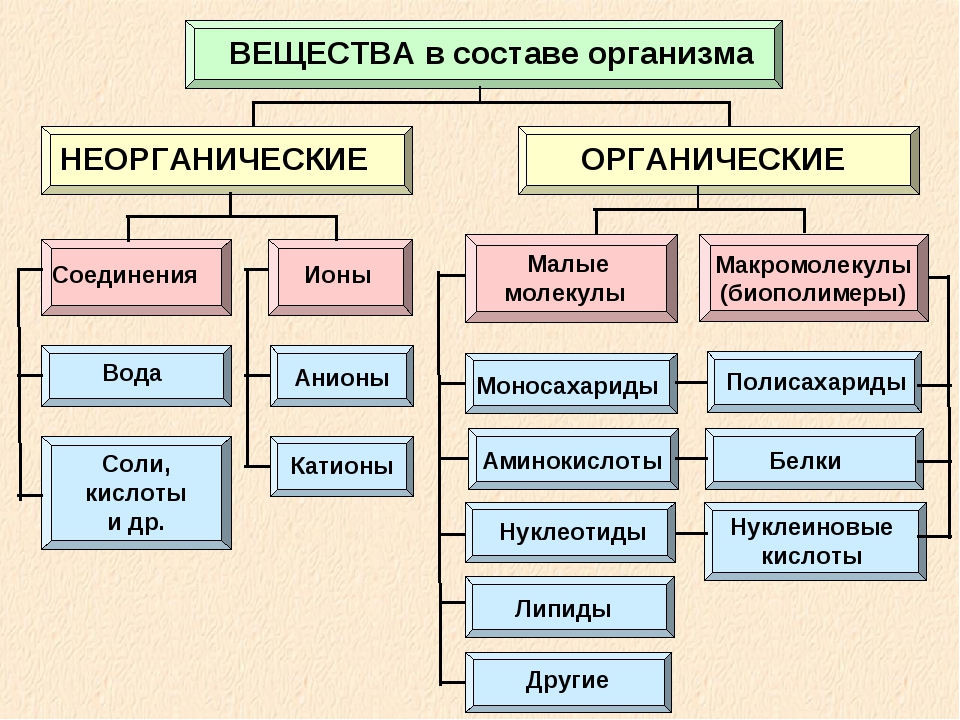
Вода – непосредственный участник многих биохимических реакций, например, реакций гидролитического расщепления (гидролиза) органических соединений. Она является одним из исходных веществ в реакциях фотосинтеза. Кислород, выделяющийся при фотосинтезе, образуется при расщеплении молекул воды.
Вода участвует в регуляции теплового режима организмов. Она обеспечивает равномерное распределение теплоты между тканями и органами, предотвращает резкие изменения температуры в клетках и организме в целом, даже когда температурные колебания в окружающей среде достаточно велики. При испарении воды организмами (транспирация у растений, потоотделение у млекопитающих) тратится много теплоты, что защищает их от перегрева.
Вода является универсальным растворителем и средой протекания процессов обмена веществ благодаря полярности молекул и их способности образовывать межмолекулярные водородные связи с другими соединениями. Малый размер молекул воды играет важную роль в осмотических явлениях.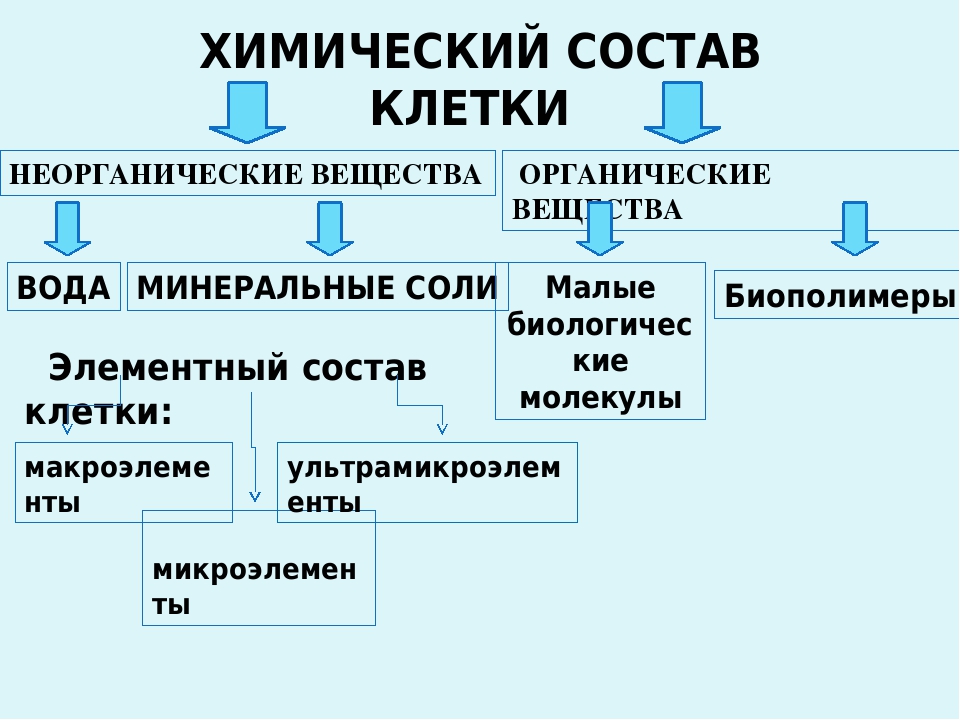 Участие воды в регуляции теплового режима организмов связано с её высокой теплоёмкостью, хорошей теплопроводностью и высокой теплотой парообразования. Это, в свою очередь, обусловлено способностью молекул воды образовывать между собой многочисленные водородные связи.
Участие воды в регуляции теплового режима организмов связано с её высокой теплоёмкостью, хорошей теплопроводностью и высокой теплотой парообразования. Это, в свою очередь, обусловлено способностью молекул воды образовывать между собой многочисленные водородные связи.
7. Как вы думаете, почему большинство полярных веществ хорошо растворяются в воде, а неполярные, как правило, нерастворимы в ней?
Молекулы воды полярны, что позволяет им интенсивно взаимодействовать с другими полярными веществами. Вода способствует обособлению структурных частиц полярных соединений (ионов, молекул), их переходу в раствор, образует вокруг ионов и полярных молекул гидратные оболочки.
С неполярными соединениями молекулы воды взаимодействуют очень слабо. Такие вещества практически нерастворимы в воде, но хорошо растворяются в неполярных растворителях (например, в бензине). Здесь уместно вспомнить древнее правило алхимиков: «Подобное растворяется в подобном».
8*. Буферные свойства внеклеточной среды обеспечивают угольная кислота и гидрокарбонат-ион, внутри клеток эту функцию выполняют анионы фосфорной кислоты. Почему эти соединения позволяют поддерживать в растворах определённую концентрацию ионов водорода, в то время как азотная и соляная кислоты, а также их анионы, не обладают такими свойствами?
Угольная кислота – слабый электролит. В водных растворах лишь небольшая часть её молекул диссоциирована на ионы, поэтому в межклеточной среде наряду с гидрокарбонат-ионами (НСО3–) содержатся и недиссоциированные молекулы угольной кислоты (Н2СО3). Внутри клеток наблюдается определённый баланс (равновесие) между анионами фосфорной кислоты Н2РО4– и НРО42–:
Н2СО3 ↔ Н+ + НСО3–
Н2РО4– ↔ Н+ + НРО42–
При снижении кислотности среды равновесие смещается вправо – высвобождаются дополнительные ионы водорода (Н+).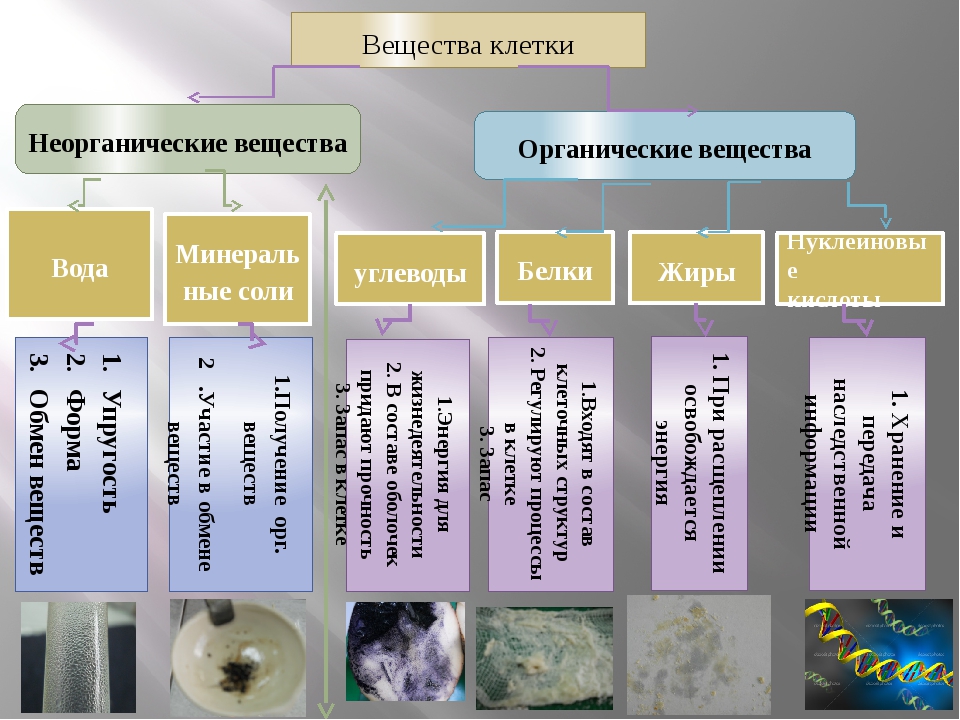 При повышении кислотности равновесие смещается влево – происходит связывание «лишних» ионов Н+. Благодаря этому реакция внеклеточной среды (или внутриклеточного содержимого) практически не меняется.
При повышении кислотности равновесие смещается влево – происходит связывание «лишних» ионов Н+. Благодаря этому реакция внеклеточной среды (или внутриклеточного содержимого) практически не меняется.
Азотная и соляная кислоты – сильные электролиты. При растворении в воде они почти полностью диссоциируют на ионы:
HNO3 → H+ + NO3–
HCl → H+ + Cl–
Диссоциация сильных электролитов практически необратима, поэтому их растворы не обладают буферными свойствами.
* Задания, отмеченные звёздочкой, предполагают выдвижение учащимися различных гипотез. Поэтому при выставлении отметки учителю следует ориентироваться не только на ответ, приведённый здесь, а принимать во внимание каждую гипотезу, оценивая биологическое мышление учащихся, логику их рассуждений, оригинальность идей и т. д. После этого целесообразно ознакомить учащихся с приведённым ответом.
Дашков М. Л.
Л.
Сайт: dashkov.by
Вернуться к оглавлению
| < Предыдущая | Следующая > |
|---|
единство функций и физико-химических свойств»
Задачи.
1. Изучить химические элементы, органические и неорганические вещества в единстве их функций и физико-химических свойств и, таким образом, получить доказательства единства живой и неживой природы, родства живых организмов друг с другом и взаимосвязи организмов с окружающей средой на молекулярном уровне жизни.
2. Совершенствовать умения определять цели своего обучения; извлекать знания из различных источников информации: таблиц, текста, схемы, устной речи и преобразовывать их в другую знаковую систему, развивая тем самым способность к самостоятельной целенаправленной познавательной деятельности.
3. Формировать коммуникативную компетентность,
то есть умение решать учебные задачи в
сотрудничестве со сверстниками и учителями.
Формировать коммуникативную компетентность,
то есть умение решать учебные задачи в
сотрудничестве со сверстниками и учителями.
Средства: материалы к заданиям, рисунки, химические формулы и заготовки кроссвордов на доске, иллюстрированная схема “Липиды”.
При подготовке к уроку использованы.
- Самое полное издание типовых вариантов заданий ЕГЭ: 2011: Биология / авт.-сост. Е.А. Никишова, С.П. Шаталова. – М.: АСТ: Астрель, 2011.
- Г.И. Лернер. Общая биология. 10-11 классы. Тестовые задания к основным учебникам: рабочая тетрадь / Г.И. Лернер. – М.: Эксмо, 2007.
- Н.Л. Галеева. Сто приёмов для учебного успеха ученика на уроках биологии: Методическое пособие для учителя. – М.: “5 за знания”, 2006.
- И.Р. Мухамеджанов. Тесты, зачеты, блицопросы по общей биологии: 10-11 классы. – М.: ВАКО, 2006.
- А.
 В. Пименов, И.Н. Пименова. Биология:
Дидактические материалы к разделу “Общая
биология”. 9 кл.; 10-11 кл. – М.: Изд-во НЦ ЭНАС, 2004.
В. Пименов, И.Н. Пименова. Биология:
Дидактические материалы к разделу “Общая
биология”. 9 кл.; 10-11 кл. – М.: Изд-во НЦ ЭНАС, 2004.
Ход урока
Подготовительный этап: обеспечение мотивации и принятие обучающимися целей урока.
Учитель биологии: “Мы завершаем изучение раздела “Общая биология”, рассмотрели почти все уровни организации жизни. Давайте перечислим их”.
Обучающиеся: “Сначала рассматривали биосферный уровень, затем биогеоценотический, популяционно-видовой, организменный и клеточный”.
Учитель биологии: “Теперь мы подходим к
изучению самого глубинного уровня организации
жизни – молекулярного. Одни и те же атомы
химических элементов образуют как органические,
так и неорганические молекулы. Это говорит о
единстве живой и неживой природы и тесном
взаимодействии организмов с окружающей средой. Таким образом, молекулярный уровень организации
жизни находится на границе живой и неживой
материи. Однако на нашей планете вне клетки жизни
нет. Выделенные из клетки молекулы теряют свою
биологическую сущность, перестают быть
“живыми”. Остаются только их физические и
химические свойства. Отсюда понятно как сложно и
одновременно увлекательно изучение
биологической химии, то есть химии живой
материи”.
Таким образом, молекулярный уровень организации
жизни находится на границе живой и неживой
материи. Однако на нашей планете вне клетки жизни
нет. Выделенные из клетки молекулы теряют свою
биологическую сущность, перестают быть
“живыми”. Остаются только их физические и
химические свойства. Отсюда понятно как сложно и
одновременно увлекательно изучение
биологической химии, то есть химии живой
материи”.
Учитель химии: “Когда мы говорим о молекулярном уровне жизни, то речь идёт, прежде всего, о крупных полимерных молекулах основных классов биогенных органических соединений – это углеводы, белки, нуклеиновые кислоты, а также липиды. Уникальность этих макромолекул проявляется в их многообразных функциях, которые связаны с физико-химическими свойствами и строением”.
Учитель биологии: “Из раздела “Основы общей
биологии” в 9 классе мы помним, что основными
функциями белков являются – ферментативная,
строительная, транспортная, нуклеиновых кислот
– информационная, углеводов – энергетическая,
липидов – строительная, запасающая,
энергетическая, но этим их функции не
исчерпываются.
Мы изучили сущность процессов фотосинтеза, дыхания, синтеза белка, удвоения ДНК, что помогло нам в целом представить как макромолекулы осуществляют свои функции.
Именно на молекулярном уровне жизни происходит включение всевозможных химических элементов Земли в различные вещества, участвующие в обменных процессах, то есть осуществляется связь живого и неживого. На языке экологии – это называется взаимосвязь организмов и окружающей среды. Поэтому рассмотрение молекулярного уровня организации жизни мы начнём именно с химических элементов и их функций в живой природе, затем перейдём к неорганическим, а потом к органическим веществам.
Таким образом, тема сегодняшнего урока: “Химические элементы, неорганические соединения, а также органические вещества углеводы и липиды: единство функций и физико-химических свойств”. Какова же будет познавательная цель данного урока?”.
Обучающиеся: “Изучить функции химических
элементов, неорганических веществ, а также
липидов и углеводов в связи с их строением”.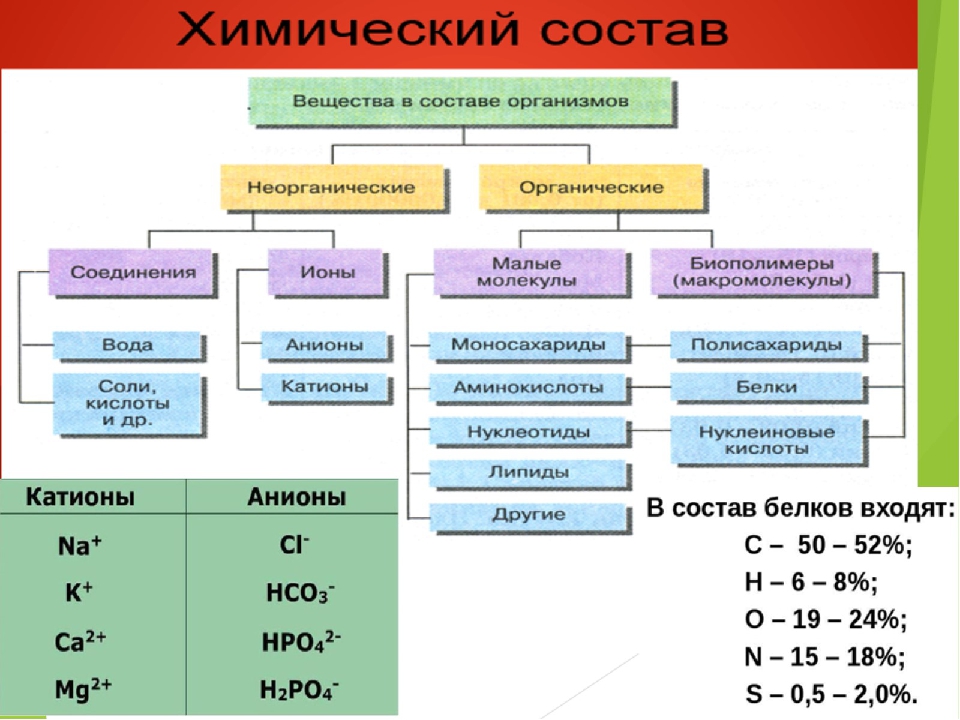
Учитель биологии: “Действительно, мы проводим интегрированный урок вместе с учителем химии, так как считаем, что в этом материале химия и биология органично дополняют друг друга и способствуют целостному восприятию всех проявлений жизни на Земле, как уникального явления природы.
Откроем и рассмотрим пакет материалов, которые потребуются нам в работе. Справочные таблицы по химическим элементам, кроссворд, который надо разгадать с использованием таблицы. Нам предстоит прослушать доклад и сформулировать по нему вопросы. В пакете текст “Углеводы”, с использованием которого будет предложено решить тест. Кроме того схему по функциям липидов, которая будет представлена на доске, предстоит преобразовать в таблицу. Будем делать записи в тетради. Работа предусмотрена индивидуальная, парная, групповая и фронтальная. Какие же умения мы будем развивать?”.
Обучающиеся: “Мы будем развивать умения
работать с таблицами, искать нужный материал в
тексте, преобразовывать схему в таблицу,
располагать всё красиво в тетради, а также решать
учебные задачи, работая индивидуально и вместе”.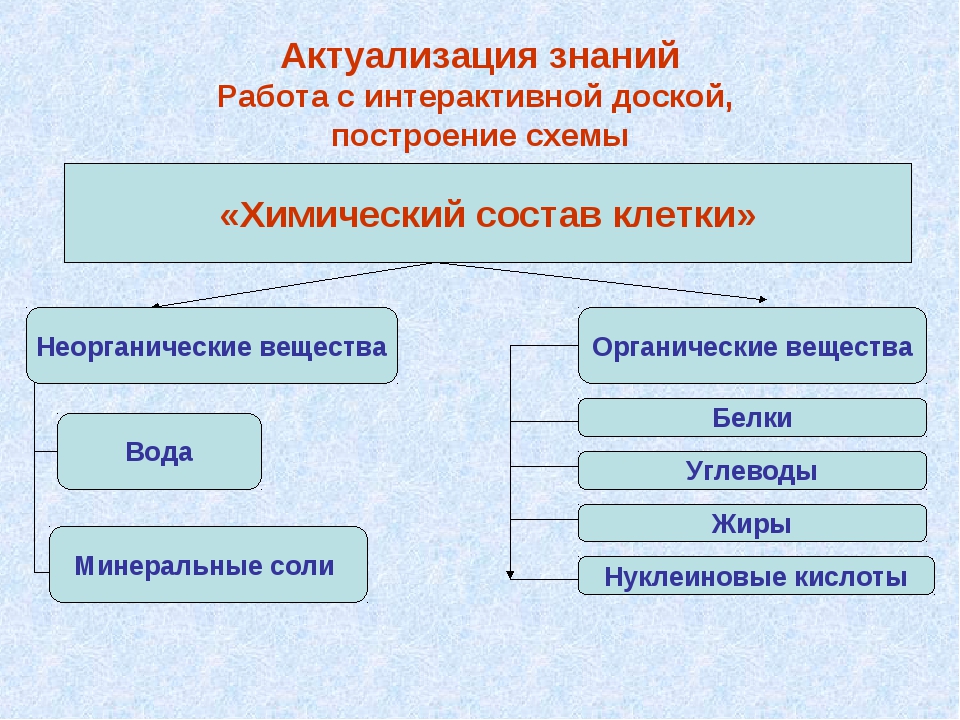
Учитель биологии: “Итак, задачи нашего урока …”. Просит прочитать вслух задачи урока.
Актуализация и приращение знаний
Первый смысловой блок: “Химические элементы”.
Учитель биологии: “О роли химических элементов при рассмотрении молекулярного уровня жизни говорилось выше, а теперь, используя справочную таблицу “Функции химических элементов”, решим кроссворд”. (Приложение 1). Обучающиеся разбиваются на команды методом “Подбери себе команду”. Команда заполняет кроссворд. Отчёт команд.
Второй смысловой блок: “Неорганические вещества”.
Учитель химии: “Вступая в химические связи
атомы химических элементов образуют молекулы
или химические соединения. Большие скопления
молекул или химических соединений – это
вещества. Например, вода – это соединение,
молекула или вещество.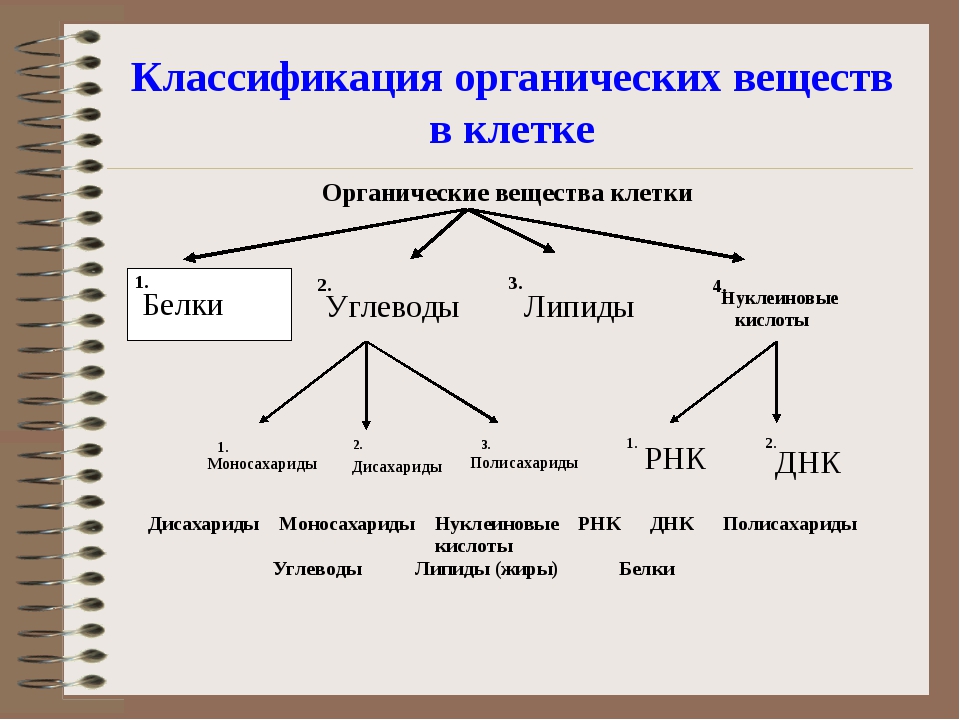 На какие две группы
делятся все вещества, входящие в состав живых
организмов?
На какие две группы
делятся все вещества, входящие в состав живых
организмов?
Обучающиеся: “Бывают неорганические и органические вещества”.
Учитель биологии: “Какие вещества относятся к неорганическим?”.
Обучающиеся: “К неорганическим веществам относятся вода и минеральные соли”.
Учитель биологии: “Почему они так называются?”.
Обучающиеся: “Они так называются, так как образуются в неживой природе, а в организм поступают из окружающей среды”.
Учитель биологии: “Вспомним из раздела “Основы общей биологии” какие четыре основных класса органических веществ образуют клетку?”.
Обучающиеся: “Это жиры (липиды), углеводы, белки и нуклеиновые кислоты”.
Учитель биологии: “Почему эти вещества называются органическими?”.
Обучающиеся: “Они называются органическими,
так как образуются только в живых организмах”.
Учитель биологии: “Рассмотрение неорганических веществ начнём с воды. Продолжаем командную работу. Прослушивая сообщение одноклассника (Приложение 2), каждая команда должна составить на тему доклада по четыре вопроса, которые потом задаст другой команде”.
Отчёт команд в форме обмена вопросами и ответами.
Затем каждая команда получает ещё по три вопроса от учителей (Приложение 3), после короткого обдумывания зачитывает свой вопрос и даёт ответ. Существенные дополнения к ответу другой команды идут в зачёт.
Учитель химии: “Какие ещё вещества кроме воды относятся к неорганическим?”.
Обучающиеся: “Это минеральные соли”.
Учитель химии: “Минеральные соли важны для
организма и здесь можно вспомнить соли различных
химических элементов: Ca, K, P, Na, Mg и т.д. Чуть более
подробно вспомним Ca3(PO4)2 . Как
видим это соль кальция и фосфорной кислоты. Где
её особенно много и для каких органов она
особенно важна?”.
Как
видим это соль кальция и фосфорной кислоты. Где
её особенно много и для каких органов она
особенно важна?”.
Обучающиеся: “Эта соль входит в состав костей и зубов”.
Учитель химии: “А теперь загадка. Какую соль мы называем поваренной, покупаем её в магазине и специально добавляем в пищу?”.
Обучающиеся: “Это NaCl”.
Учитель биологии: “Другие соли нам также нужны, но того их количества, которое содержится в продуктах вполне хватает и их не надо добавлять к пище.
Соль притягивает к себе воду, и от содержания соли NaCl в плазме крови зависит количество воды в клетках крови. Концентрация NaCl в плазме крови 0,9%. Раствор NaCl с концентрацией 0,9% называется гипертоническим и только в гипертоническом растворе можно вводить лекарства.
Почки и потовые железы выводят соли и в
основном соль NaCl из организма и её убыль должна
всё время пополняться. Поэтому в пищу добавляют
соль NaCl”.
Поэтому в пищу добавляют
соль NaCl”.
Третий смысловой блок: “Органические вещества – углеводы”.
Учитель биологии: “Теперь рассмотрим органические вещества или соединения — углеводы и липиды. Мы уже отмечали, что в единстве физико-химических свойств и биологических функций макромолекул и проявляется особенность молекулярного уровня организации жизни”.
Обучающимся предлагается решить тест после изучения текста “Углеводы” (Приложение 4). Работа парная. Проверка и обсуждение теста.
Четвёртый смысловой блок: “Органические вещества – липиды”.
Учитель химии: “Липиды состоят из жирных кислот и глицерола. Жирные кислоты содер-
жат в своей молекуле кислотную группу –СООН
(карбоксильную группу) Жирными они называются
потому, что входят в состав жиров. Общая формула
жирных кислот имеет вид R-СООН.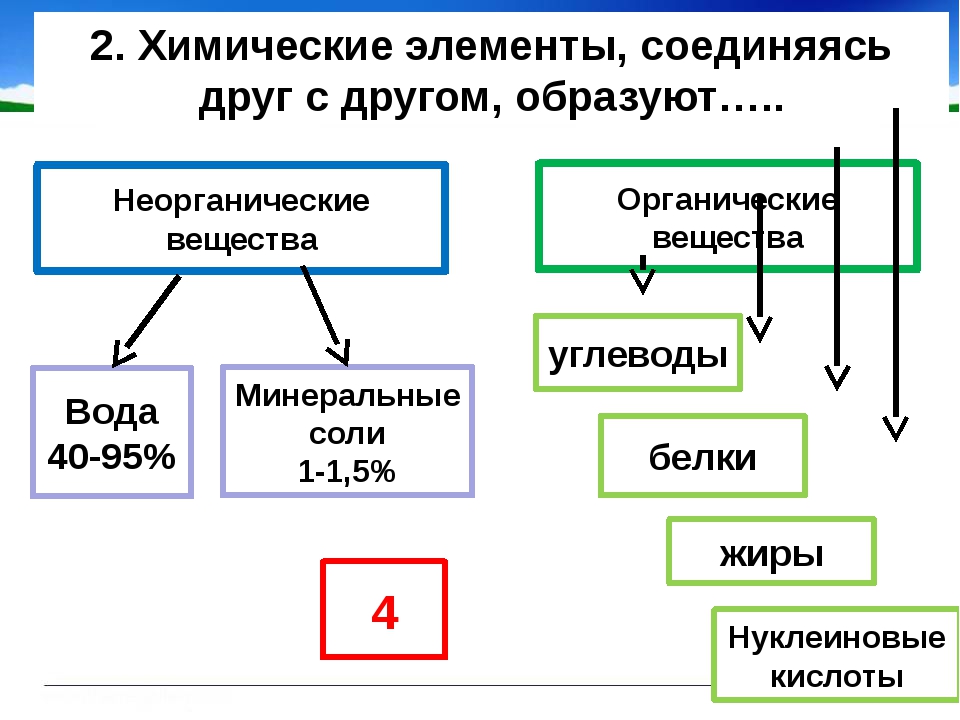 В липидах радикал R
представлен длинной цепью углеродных атомов.
Большинство жирных кислот содержит чётное
количество атомов углерода, чаще всего 16 или 18.
Самые распространённые – это стеариновая
кислота С17Н35СООН и олеиновая кислота
С17Н33СООН. Обратите внимание на
длинную цепь из атомов углерода и водорода,
составляющую углеводородный хвост молекулы.
Углеводородные хвосты молекул определяют многие
свойства липидов, в том числе нерастворимость
липидов в воде, то есть их гидрофобность.
В липидах радикал R
представлен длинной цепью углеродных атомов.
Большинство жирных кислот содержит чётное
количество атомов углерода, чаще всего 16 или 18.
Самые распространённые – это стеариновая
кислота С17Н35СООН и олеиновая кислота
С17Н33СООН. Обратите внимание на
длинную цепь из атомов углерода и водорода,
составляющую углеводородный хвост молекулы.
Углеводородные хвосты молекул определяют многие
свойства липидов, в том числе нерастворимость
липидов в воде, то есть их гидрофобность.
Иногда в жирных кислотах имеется одна или
несколько двойных связей С=С ,например, в
олеиновой кислоте. В этом случае жирные кислоты,
а также содержащие их липиды называются
ненасыщенными. Жирные кислоты и липиды, в
молекулах которых нет двойных связей, называются
насыщенными. Ненасыщенные жирные кислоты
плавятся при значительно более низких
температурах, чем насыщенные. Олеиновая кислота
– основной компонент оливкового масла – при
обычных температурах бывает жидкой, тогда как
стеариновая кислота при таких температурах
остаётся твёрдой”.
Олеиновая кислота
– основной компонент оливкового масла – при
обычных температурах бывает жидкой, тогда как
стеариновая кислота при таких температурах
остаётся твёрдой”.
Учитель биологии: “В клетках “холоднокровных” животных содержание ненасыщенных жирных кислот обычно выше, чем в клетках “теплокровных” животных. Как вы это объясните?”
Учитель химии: “Большая часть липидов – это сложные эфиры спирта глицерола, поэтому их называют глицеридами. У глицерола имеются три гидроксильные группы, каждая из которых способна вступать в реакцию соединения с жирной кислотой, т.е. образовывать сложный эфир. Обычно в реакцию соединения вступают все три гидроксильные группы глицерола , поэтому продукт реакции называют триглицеридом.
Основой клеточных мембран служит двойной слой
фосфоглицеридов, в молекуле которых спиртовая
группа глицерола этерифицирована не жирной, а
фосфорной кислотой. Такая молекула состоит из
головы, роль которой играет фосфатная группа, и
двух углеводородных хвостов – остатки жирных
кислот”.
Такая молекула состоит из
головы, роль которой играет фосфатная группа, и
двух углеводородных хвостов – остатки жирных
кислот”.
Затем обучающимся демонстрируется иллюстрированная схема “Функции липидов” (Приложение 5) и предлагается составить по этой схеме таблицу с тем же названием. Работа индивидуальная. Проверка и обсуждение таблицы.
Подведение итогов урока.
1. Анализ и оценка успешности решения задач, поставленных в начале урока.
2. Получение обучающимися информации о реальном результате их деятельности.
3. Перспективы будущей работы.
Осуществляется через систему вопросов.
Удалось ли нам выполнить задачи урока?
Какой вид работы больше понравился?
Что оказалось трудным?
Учитель озвучивает оценки за урок.
А что будем изучать дальше? Обучающиеся делают вывод: далее изучаем белки и нуклеиновые кислоты.

Учителя благодарят обучающихся за сотрудничество на уроке.
Ответы | § 2. Химические соединения в живых организмах. Неорганические вещества — Биология, 11 класс
Благодаря полярности молекулы воды способны формировать так называемые гидратные оболочки вокруг ионов и полярных молекул. Это способствует обособлению частиц и препятствует их склеиванию друг с другом, что особенно важно, например, для белковых молекул. Полярность молекул и способность образовывать водородные связи делает воду универсальным растворителем для полярных веществ, лучшим, чем большинство жидкостей. Растворение веществ способствует повышению их реакционной способности, т. к. молекулы или ионы получают возможность более свободно перемещаться и взаимодействовать друг с другом. Большинство химических реакций в живых организмах протекает именно в водных растворах. Таким образом, в качестве растворителя вода является основной средой протекания процессов обмена веществ — метаболизма. Кроме того, вода служит средством транспорта растворенных в ней веществ. Эту функцию она выполняет, например, в составе крови, лимфы, тканевой жидкости, мочи и секретов желез животных, в проводящих тканях растений.
Кроме того, вода служит средством транспорта растворенных в ней веществ. Эту функцию она выполняет, например, в составе крови, лимфы, тканевой жидкости, мочи и секретов желез животных, в проводящих тканях растений.
Вода является участником многих биохимических процессов, например фотосинтеза. Кислород, выделяющийся в ходе фотосинтеза, образуется при расщеплении молекул воды. Процессы расщепления сложных органических веществ (белков, полисахаридов, липидов и др.) до более простых соединений являются реакциями гидролиза, т. е. протекают при непосредственном участии воды.
Вода практически несжимаема, что важно для поддержания упругости клеток и тканей. Она определяет объем клеток и тургорное давление — давление внутреннего содержимого клетки на ее оболочку. Несжимаемость воды позволяет ей выполнять функцию гидроскелета у круглых и кольчатых червей.
Хорошие смазывающие свойства воды способствуют уменьшению трения в различных частях организма.
Вода обладает высокой теплоемкостью.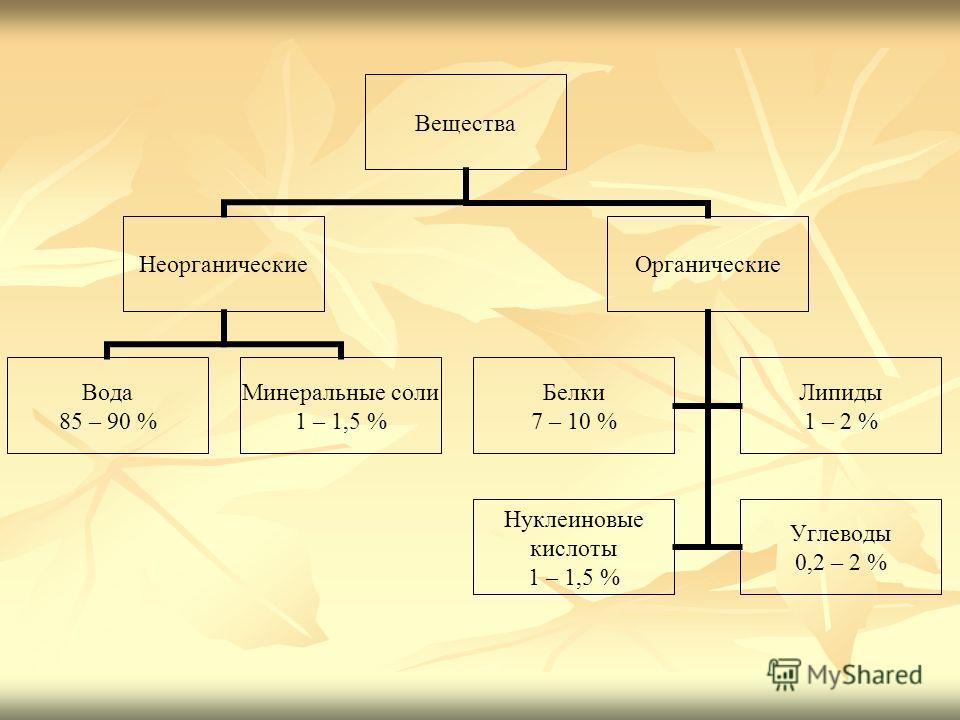 Это значит, что при поглощении или выделении большого количества теплоты температура самой воды изменяется незначительно. Поэтому даже резкие температурные колебания в окружающей среде не приводят к существенному изменению температуры внутри организма.
Это значит, что при поглощении или выделении большого количества теплоты температура самой воды изменяется незначительно. Поэтому даже резкие температурные колебания в окружающей среде не приводят к существенному изменению температуры внутри организма.
При переходе жидкой воды в состояние пара происходит разрушение всех водородных связей между ее молекулами, а это требует значительных затрат энергии. Поэтому испарение воды сопровождается охлаждением и используется живыми организмами для защиты от перегрева (потоотделение у млекопитающих, транспирация у растений).
Вода имеет относительно высокую для жидкостей теплопроводность. Движение воды (циркуляция крови у животных, восходящий и нисходящий ток растворов у растений и т. д.) в сочетании с высокой теплопроводностью способствует равномерному распределению теплоты в организме.
Неорганические вещества клетки, их строение и роль в клетке | Биология. Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга
Тема: Микробиология
Вода. Содержание воды в разных клетках отличается, по в большинстве случаев вода составляет более 2/3 массы клетки. Вода обладает уникальными свойствами, обусловлеными структурой молекулы. В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Электрический заряд внутри молекулы распределен неравномерно: в области атомов водорода преобладает положительный заряд, а в области, где расположен кислород, выше плотность отрицательного заряда. Таким образом, молекула воды — полярна (диполь). Отрицательно заряженный атом кислорода одной молекулы воды притягивается к положительно заряженному атому водорода другой молекулы с образованием непрочной водородной связи.
Содержание воды в разных клетках отличается, по в большинстве случаев вода составляет более 2/3 массы клетки. Вода обладает уникальными свойствами, обусловлеными структурой молекулы. В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Электрический заряд внутри молекулы распределен неравномерно: в области атомов водорода преобладает положительный заряд, а в области, где расположен кислород, выше плотность отрицательного заряда. Таким образом, молекула воды — полярна (диполь). Отрицательно заряженный атом кислорода одной молекулы воды притягивается к положительно заряженному атому водорода другой молекулы с образованием непрочной водородной связи.
Роль воды в клетке:
- Вода является хорошим растворителем для других полярных соединений. Большинство реакций, протекающих в клетке, могут идти только в водном растворе.
- Вода обладает высокой теплоемкостью, т.е. способностью поглощать теплоту при минимальном изменении температуры.
 Испаряя воду, организмы могут защищать себя от перегрева.
Испаряя воду, организмы могут защищать себя от перегрева. - Вода обладает высокой теплопроводностью. Такое свойство создает возможность равномерного распределения теплоты между тканями тела.
По отношению к воде все вещества клетки разделяются на две группы: гидрофильные и гидрофобные. К гидрофильным относятся вещества, хорошо растворимые в воде (соли, сахара и др.). К гидрофобным — те, которые в воде нерастворимы (жиры).
Соли. Эго ионные соединения. Они образованы катионами калия, натрия, магния и иных металлов и анионами соляной, угольной, серной, фосфорной кислот. Между наружной и внутренней поверхностью клеточной мембраны живой клетки существует разность концентраций ионов. Концентрация ионов Na+, Са2+ выше снаружи, а концентрация ионов К+, анионов органических кислот больше внутри клетки, следовательно, внутренняя сторона мембраны несет суммарный отрицательный заряд. Образующаяся разность потенциалов обеспечивает передачу возбуждения по нерву или мышце. Материал с сайта //iEssay.ru
Материал с сайта //iEssay.ru
Ионы кальция и магния — необходимы для работы многих ферментов в клетке, при их недостатке нарушаются жизненно важные процессы в клетке. Фтор — входит в со став эмали зубов. Фосфор входит в состав костной ткани и нуклеиновых кислот. Ряд важных функций выполняют в клетке некоторые неорганические кислоты и их соли. Например, соляная кислота создает кислую среду в желудке животных и человека. Остатки фосфорной кислоты, при соединяясь к ряду ферментных и иных белков, изменяют их физиологическую активность.
Неорганическая химическая биология: принципы, методы и приложения
О редакторе xiii
Список участников xv
Предисловие xix
Благодарности xxi
1. Новые применения иммобилизованной ионно-ионной хроматографии с химическим соединением
9d320 в химической хроматографии
Джеси Гу, Наджва Эдже и Тюльпан Лифа
1. 1 Введение 1
1 Введение 1
1.2 Принципы и традиционное использование 2
1.3 Краткая история 4
1.4 Новое приложение 1: Низкомолекулярные соединения на небелковой основе 5
1.4.1 Сидерофоры 6
1.4.2 Противораковое средство: трихостатин A 10
1.4.3 Противоопухолевый агент: блеомицин 12
1.4.4 Противоинфекционные агенты 13
1.4.5 Другие агенты 14
1.4.6 Выбор жизнеспособной цели 15
1.5 Новое приложение 2: многомерное Аффинная хроматография с иммобилизованными ионами металлов 17
1.6 Новое приложение 3: Метаболомика 20
1.7 Новое приложение 4: Твердофазный органический синтез, зависящий от координатных связей 20
1.8 Технология зеленой химии 21
1.9 Заключение 23
Благодарности 24
Ссылки 24
2. Металл Комплексы как инструменты структурной биологии 37
Майкл Д. Ли, Бим Грэм и Джеймс Д. Сворбрик
2.1 Структурно-биологические исследования и основные используемые методы 37
2. 2 Что могут предложить комплексы металлов в области структурной биологии? 38
2 Что могут предложить комплексы металлов в области структурной биологии? 38
2.3 Комплексы металлов для фазирования в рентгеновской кристаллографии 39
2.4 Комплексы металлов для получения структурных ограничений с помощью парамагнитной ЯМР-спектроскопии 41
2.4.1 Усиление парамагнитной релаксации (PRE) 42
2.4.2 Остаточное диполярное взаимодействие ( RDC) 43
2.4.3 Псевдоконтактные сдвиги (PCS) 43
2.4.4 Стратегии внедрения ионов лантаноидов в биомакромолекулы 44
2.5 Металлические комплексы как спиновые метки для измерения расстояний с помощью ЭПР-спектроскопии 53
2.6 Металлические комплексы как доноры для измерений расстояний с помощью передачи энергии резонанса люминесценции (LRET) 54
2.7 Заключительные заявления и перспективы на будущее 56
Ссылки 56
3. Методы AAS, XRF и MS в химической биологии металлических комплексов 63
Инго Отт, Кристоф Био и Кристиан Хартингер
3. 1 Введение 63
1 Введение 63
3.2 Атомно-абсорбционная спектроскопия (AAS) 64
3.2.1 Основы и основные принципы AAS 64
3.2.2 Инструментальные и технические аспекты AAS 65
3.2.3 Разработка метода и аспекты практического применения 67
3.2.4 Избранные примеры применения 69
3.3 Рентгеновская флуоресцентная спектроскопия полного отражения (TXRF) 72
3.3.1 Основы и основные принципы TXRF 72
3.3.2 Инструментальные / методические аспекты TXRF и приложений 73
3.4 Субклеточная рентгеновская флуоресцентная визуализация рутениевого аналога феррохина, кандидата в лекарство от малярии, с использованием синхротронного излучения 74
3.4.1 Применение рентгеновской флуоресценции в разработке лекарств с использованием феррохина в качестве примера 75
3.5 Масс-спектрометрические методы в неорганических химических веществах Биология 80
3.5.1 Масс-спектрометрия и неорганическая химическая биология: избранные приложения 83
3. 6 Выводы 90
6 Выводы 90
Благодарности 90
Ссылки 90
4.Комплексы металлов для визуализации клеток и организмов 99
Кеннет Инь Чжан и Кеннет Кам-Винг Ло
4.1 Введение 99
4.2 Фотофизические свойства 100
4.2.1 Флуоресценция и фосфоресценция 100
4.2.2 Двухфотонное поглощение 101
4.2.3 Апконверсионная люминесценция 102
4.3 Детектирование люминесцентных комплексов металлов во внутриклеточной среде 104
4.3.1 Конфокальная лазерная сканирующая микроскопия 104
4.3.2 Флуоресцентная микроскопия с визуализацией в течение всей жизни 105
4.3.3 Проточная цитометрия 106
4.4 Визуализация клеток и организмов 107
4.4.1 Факторы, влияющие на клеточное поглощение 107
4.4.2 Визуализация органелл 116
4.4.3 Двухфотонная визуализация и повышающая конверсия Эмиссионная визуализация клеток и организмов 133
4.4.4 Внутриклеточное зондирование и маркировка 136
4. 5 Заключение 143
5 Заключение 143
Благодарности 143
Ссылки 143
5.Клеточная визуализация с использованием карбонильных комплексов металлов 149
Лука Куарони и Фабио Зоби
5.1 Введение 149
5.2 Вибрационная спектроскопия карбонильных комплексов металлов 151
5.3 Микроскопия и визуализация клеточных систем 154
5.3.1 Методы вибрационной микроскопии 155
5.4 Инфракрасная микроскопия 155
5.4.1 Измерения концентрации с помощью ИК-спектроскопии и спектромикроскопии 157
5.4.2 Водопоглощение 158
5.4.3 Карбонилы металлов как инфракрасные зонды для визуализации клеток 158
5.4.4 Поглощение и реакционная способность комплексов карбонильных металлов in vivo 162
5.5 Рамановская микроскопия 167
5.5.1 Измерения концентрации с помощью рамановской спектроскопии и Спектромикроскопия 169
5.5.2 Карбонилы металлов как рамановские зонды для визуализации клеток 169
5.6 Методы ближнего поля 171
5. 6.1 Измерения концентрации методами ближнего поля 172
6.1 Измерения концентрации методами ближнего поля 172
5.6.2 Измерение с высоким разрешением внутриклеточного накопления металла и карбонила с помощью фототермического индуцированного резонанса 173
5.7 Сравнение методов 175
5.8 Выводы и перспективы 176
Благодарности 177
Ссылки 178
6. Исследование ДНК с использованием металлических комплексов
Лайонел Марселис, Виллем Вандерлинден и Андре Кирш-де Месмакер
6.1 Общее введение 183
6.2 Фотофизика комплексов Ru (II) 184
6.2.1 Первый комплекс Ru (II), изучаемый в литературе: [Ru (bpy) 3] 2+ 184
6.2.2 Гомолептические комплексы 186
6.2.3 Гетеролептические комплексы 186
6.2.4 Фотоиндуцированный перенос электронов (ПЭТ) и процессы переноса энергии 188
6.3 Современное состояние взаимодействия мононуклеарных комплексов Ru (II) с простой двухцепочечной ДНК 190
6.3.1 Исследования простых двухцепочечных ДНК 191
6. 3.2 Влияние ДНК на эмиссионные свойства 193
3.2 Влияние ДНК на эмиссионные свойства 193
6.4 Структурное разнообразие генетического материала 194
6.4.1 Механические свойства ДНК 195
6.4.2 Топология ДНК 195
6.4.3 Исследование SMF с [Ru (phen) 2 (PHEHAT)] 2+ и [Ru ( TAP) 2 (PHEHAT)] 2+ 198
6.5 Необычное взаимодействие двухъядерных комплексов Ru (II) с различными типами ДНК 200
6.5.1 Обратимое взаимодействие [{(Ru (phen) 2} 2HAT] 4+ с денатурированным ДНК 201
6.5.2 Нацеливание на G-квадруплексы с фотореактивным [{Ru (TAP) 2} 2TPAC] 4+ 204
6.5.3 Потоковая интеркаляция 205
6.6 Выводы 207
Благодарность 208
Ссылки 208
7. Визуализация белков и клеток с использованием дитиол-реактивных комплексов металлов 215
Danielle Park, Ivan Ho Shon, Minh Hua, Vivien M. Чен и Филип Дж. Хогг
7.1 Химия As (III) и Sb (III) 215
7.2 Цистеиновые дитиолы в функции белка 217
7.3 Визуализация дитиолов в изолированных белках с As (III) 218
7 . 4 Визуализация дитиолов на поверхности клеток млекопитающих с помощью As (III) 218
4 Визуализация дитиолов на поверхности клеток млекопитающих с помощью As (III) 218
7.5 Визуализация дитиолов во внутриклеточных белках с помощью As (III) 219
7.6 Визуализация рекомбинантных белков, меченных тетрацистеином, в клетках с As (III) 219
7.7 Визуализация гибели клеток у мышей с помощью оптически помеченных As (III) 220
7.7.1 Гибель клеток при здоровье и болезнях 220
7.7.2 Агенты для визуализации гибели клеток 222
7.7.3 Визуализация гибели клеток в опухолях мышей , Мозг и тромбы с оптически меченными As (III) 223
7.8 Визуализация гибели клеток в опухолях мышей с помощью радиоактивно меченого As (III) 225
7.9 Резюме и перспективы 227
Ссылки 227
8. Обнаружение ионов, анионов и малых молекул металлов с использованием комплексов металлов 233
Qin Ван и Кэтрин Дж. Франц
8.1 Как мы видим, что находится в клетке? 233
8.1.1 Почему металлические комплексы в качестве сенсоров? 234
8. 1.2 Стратегия проектирования датчиков, построенных из металлических комплексов 234
1.2 Стратегия проектирования датчиков, построенных из металлических комплексов 234
8.1.3 Общие критерии датчиков на основе металлов для биоимиджинга 236
8.2 Металлические комплексы для обнаружения ионов металлов 236
8.2.1 Привязанные датчики для обнаружения ионов металлов 237
8.2.2 Датчики смещения для обнаружения ионов металлов 240
8.2. 3 Контрастные агенты для МРТ для обнаружения ионов металлов 240
8.2.4 Хемодозиметры для ионов металлов 249
8.3 Комплексы металлов для обнаружения анионов и нейтральных молекул 252
3.2 Метод замещения: металлический комплекс как тушитель 258
8.3.3 Дозиметрический подход 262
8.4 Выводы 268
Благодарности 268
Сокращения 268
Ссылки 269
9. Фото-выделение ионов металлов в живых клетках 27
Селина Гвиздала и Шон С. Бурдетт
9.1 Введение в фотохимические инструменты, включая фотоклеточные комплексы 275
9. 2 Биохимия кальция и фотоклеточные комплексы 278
2 Биохимия кальция и фотоклеточные комплексы 278
9.2.1 Стратегии создания комплексов в фотоэлементах для Ca2 + 278
9.2.2 Биологические применения фотоэлементов Ca2 + комплексов 282
9.3 Биохимия цинка и фотоэлементы комплексов 284
9.3.1 Биохимические мишени для комплексов Zn2 + в фотоэлементах 284
9.3 Комплексы в фотокамке для Zn2 + 286
9.4 Комплексы в фотокамке для других ионов металлов 291
9.4.1 Комплексы в фотокамке для меди 291
9.4.2 Комплексы в фотокамере для железа 295
9.4.3 Комплексы в фотокамке для других ионов металлов 297
9.5 Выводы 298
Благодарность 298
Ссылки 298
10. Высвобождение биоактивных молекул с использованием металлических комплексов 309 V.
Симпсон и Ульрих Шацшнайдер
10.1 Введение 309
10.2 Низкомолекулярные мессенджеры 310
10.2.1 Биологическое образование и доставка CO, NO и h3S 310
10.2.2 Металл-нитрозильные комплексы для доставки оксида азота в клетку 311
10. 2.3 CO-высвобождающие молекулы (CORM) 314
2.3 CO-высвобождающие молекулы (CORM) 314
10.3 «Фотоотключение» нейротрансмиттеров из металлических комплексов 321
10.3.1 «Замкнутые» соединения 321
10.3.2 «Распаковка» биоактивных молекул 322
10.4 Активированные гипоксией комплексы кобальта 324
10.4.1 Биоредуктивная активация комплексов кобальта 324
10.4.2 Активированные гипоксией пролекарства кобальта и алкиляторы ДНК 326
.4.3 Пролекарства кобальта, активируемые гипоксией, ингибиторов ММП 329
10.5 Резюме 333
Благодарности 333
Ссылки 323
11. Комплексы металлов как ингибиторы ферментов и катализаторы в живых клетках 341
Джулиен Фуррер и Джулиен Фуррер Бруно Терриен
11.1 Введение 341
11.2 Ингибиторы на основе металлов: от интуиции к рациональному дизайну 342
11.2.1 Имитация структуры известных связующих ферментов 342
11.2.2 Согласование известных ферментных ингибиторов с комплексами металлов 343
11. 2.3 Обмен лигандов на ингибирование ферментов 344
2.3 Обмен лигандов на ингибирование ферментов 344
11.2.4 Контроль конформации с помощью координации металлов 344
11.2.5 Конкуренция с известными металло-ферментными процессами 345
11.3 Следующее поколение : Полиядерные комплексы металлов как ингибиторы ферментов 346
11.3.1 Полиоксометаллаты: ферментативные ингибирующие эффекты широкого спектра 347
11.3.2 Полиядерные G-квадруплексные стабилизаторы ДНК: потенциальные ингибиторы теломеразы 349
11.3.3. Полиядерные полипиридилрутениевые комплексы: ингибиторы ДНК-топоизомеразы II. 3 Цитотоксичность, контролируемая окислением 361
11.5 Каталитическая конверсия и удаление функциональных групп 361
11.6 Каталитически контролируемое образование углеродно-углеродной связи 362
11.7 Заключение 364
Ссылки 364
12. Другие применения металлических комплексов в химической биологии 373
Танмая Джоши, Малай Патра и Жиль Гассер
12. 1 Введение 373
1 Введение 373
12.2 Поверхностная иммобилизация белков и ферментов 5000 9000 373 12.3 Металлические комплексы как искусственные нуклеазы 378
12.3.1 Моно- и многоядерные комплексы Cu (II) и Zn (II) 380
12.3.2 Комплексы лантанидов 388
12.4 Повышение клеточного поглощения с использованием комплексов металлов 390
12.5 Выводы 394
Благодарности 394
Ссылки 394
Индекс 403
Различие между органическими и неорганическими соединениями 9048 Типы соединений 9000 48 Связь между органическими и неорганическими соединениями 9000 различных элементов приводит к образованию соединений. В зависимости от типа притяжения, которое существует между атомами соединения, соединения подразделяются на четыре основные категории:
-
В ковалентных соединениях атомы разных элементов делятся своими электронами для достижения стабильности
-
В ионных соединениях атомы различных элементов связаны друг с другом посредством полной передачи своих электронов
-
Металлические соединения характеризуются ассоциацией различных металлических атомов сильными металлическими силами
-
В координированных ковалентных соединениях определенные комплексные ионы удерживаются вместе ковалентными и координатные облигации
Все организмы в основном состоят из органических молекул.
Органические молекулы, которые очень важны для нас, — это в основном углеводы, белки, липиды и т. Д.
Развитию органической химии около 200 лет. В конце семнадцатого века химики всего мира начали различать органические соединения, полученные из растений и животных, и неорганические молекулы, полученные из минеральных ресурсов.
Разница между органическими и неорганическими соединениями
В первые годы развития химии химики сделали много неудачных попыток синтезировать органические соединения в лаборатории.После нескольких неудач все их усилия оказались тщетными, и они были вынуждены поверить в то, что органические соединения могут быть синтезированы с помощью особого механизма, который может происходить только внутри живых существ. Следовательно, в отличие от неорганических соединений, органические соединения не могут быть получены в лаборатории.
Синтез органических соединений
Открытие карбамида произвело революцию в области органической химии. Это открытие привело Кольбе в 1845 году к работе над получением уксусной кислоты в лаборатории, в то время как Хеннель успешно работал над получением этилового спирта, Бертло в 1856 году сделал успешную попытку получения метана в лаборатории без использования каких-либо живых организмов.
Это открытие привело Кольбе в 1845 году к работе над получением уксусной кислоты в лаборатории, в то время как Хеннель успешно работал над получением этилового спирта, Бертло в 1856 году сделал успешную попытку получения метана в лаборатории без использования каких-либо живых организмов.
Новая версия органической химии
После успешного синтеза различных органических соединений в лаборатории теория жизненной силы была полностью проигнорирована. Углубленное изучение органических соединений показало, что эти соединения в основном состоят из углерода. Изучение соединений углерода в основном известно как органическая химия.
Здесь следует отметить одну вещь: простое присутствие углерода в соединении не означает, что соединение является органическим.Например, CO2 содержит углерод, но является неорганическим соединением.
Углубленное понимание структуры органических соединений показывает, что все органические соединения состоят из углерода как основного компонента, который также неизменно связан с водородом.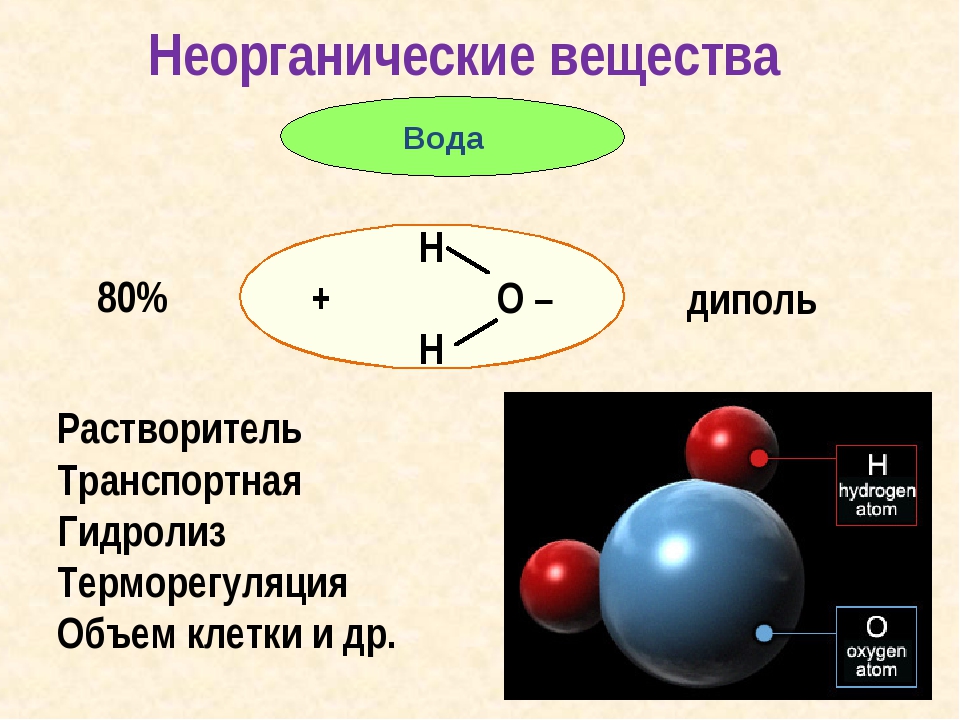 Эти органические соединения, состоящие в основном из углерода и водорода, называются углеводородами.
Эти органические соединения, состоящие в основном из углерода и водорода, называются углеводородами.
Существует большое количество органических соединений, содержащих неорганические частицы, такие как азот, сера, фосфор и т. Д.Но эти соединения являются производными только углеводородов и, следовательно, считаются органическими соединениями.
Следовательно, органическая химия определяется как химия углеводородов и их производных.
Разница между органическими и неорганическими соединениями (таблица)
| | Органическое соединение | Неорганическое соединение | Неорганическое соединение | 0 0 0 0 , водород и кислород. Обычно не содержит углерода. | |
| Природа соединений | Ковалентное соединение | Электровалентные / ионные / ковалентные соединения | |||
| Точки плавления и кипения |
Растворимость в воде | Нерастворимый | Растворимый | ||
| Растворимый в органических растворителях | Растворимый |
|
| 905 905 | Хорошие проводники |
| Горючесть | Горючий | Негорючие | |||
| Летучий | 5 летучий характер 05 | Летучий ile | |||
| Связь | выставлено | Не выставлено | |||
| Изомерия | выставлено | 905 Большое количество органических соединений


 Большинство неорганических соединений не проявляют четырехвалентности и катенации, и, следовательно, их количество ограничено.
Большинство неорганических соединений не проявляют четырехвалентности и катенации, и, следовательно, их количество ограничено. 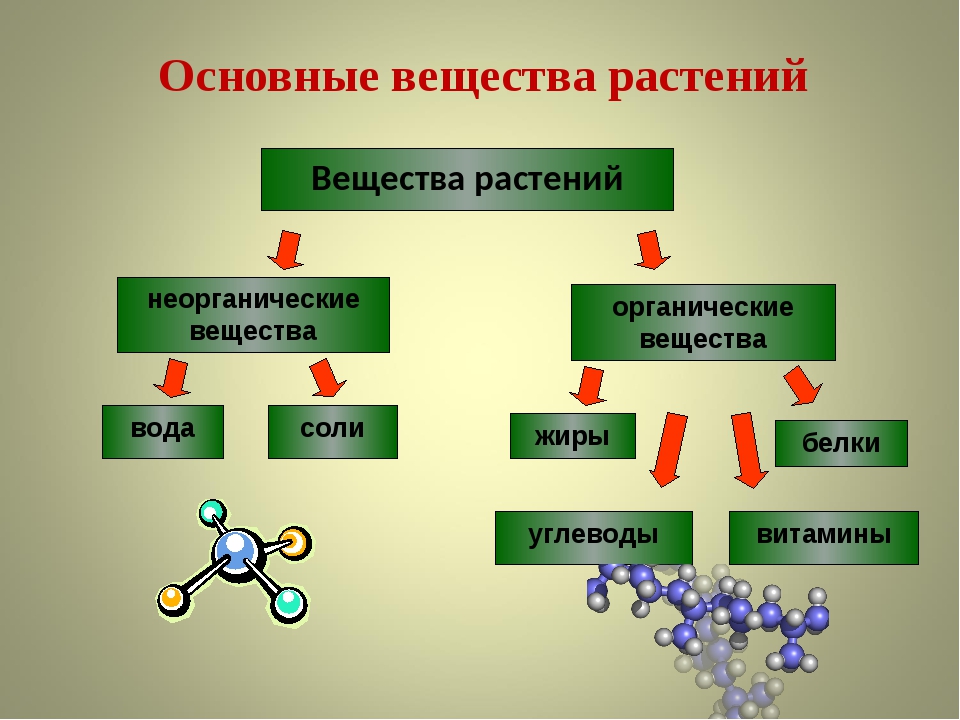
 Действительно, для некоторых химическая биология — это широкий термин, относящийся к использованию химических подходов и методов для изучения биологии и использованию биологических методов для создания новых молекул и изучения химии (1). Химическая биология также часто определяется с точки зрения использования малых молекул для раскрытия тонкостей биологии (2). Где неорганическая химия пересекается с химической биологией ?? Связь между неорганической химией и биологией была обширной и возникла несколько веков назад (3,4).В последнее время эта область получила название биоинорганической химии. Ядро биоинорганической химии сосредоточено на изучении центров металлов в металлопротеинах и металлоферментах (3). Синтетическая химия, важный компонент химической биологии, использовалась химиками-биоинорганиками для создания спектроскопических и функциональных моделей малых молекул металлических участков в белках. Кроме того, использование малых молекул для изучения биологии также применимо к неорганическим комплексам.
Действительно, для некоторых химическая биология — это широкий термин, относящийся к использованию химических подходов и методов для изучения биологии и использованию биологических методов для создания новых молекул и изучения химии (1). Химическая биология также часто определяется с точки зрения использования малых молекул для раскрытия тонкостей биологии (2). Где неорганическая химия пересекается с химической биологией ?? Связь между неорганической химией и биологией была обширной и возникла несколько веков назад (3,4).В последнее время эта область получила название биоинорганической химии. Ядро биоинорганической химии сосредоточено на изучении центров металлов в металлопротеинах и металлоферментах (3). Синтетическая химия, важный компонент химической биологии, использовалась химиками-биоинорганиками для создания спектроскопических и функциональных моделей малых молекул металлических участков в белках. Кроме того, использование малых молекул для изучения биологии также применимо к неорганическим комплексам.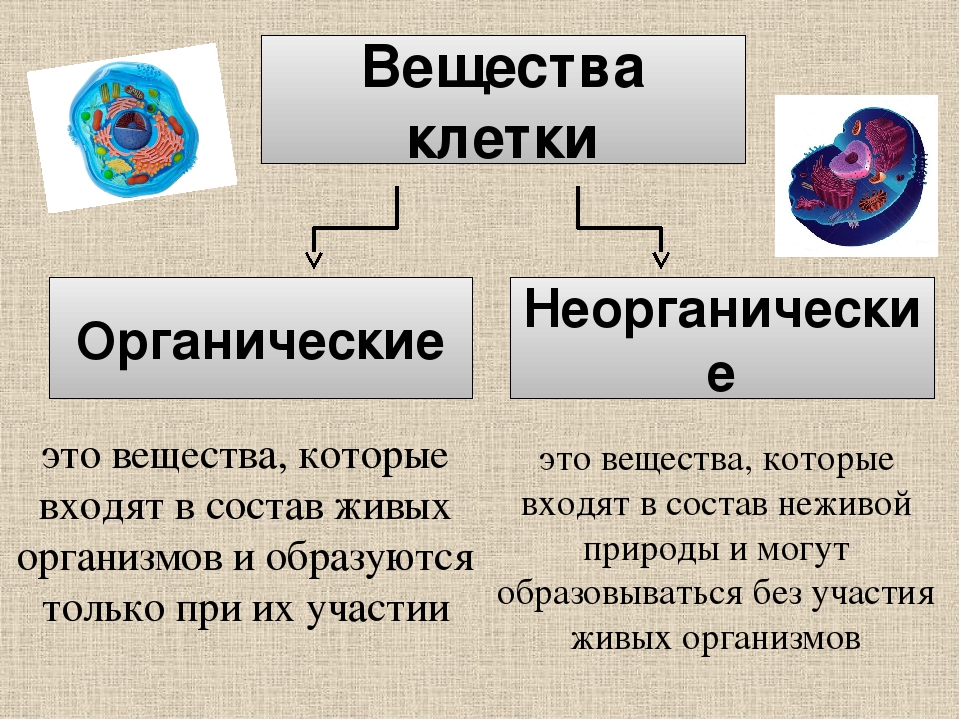 Действительно, неорганические комплексы использовались и продолжают использоваться для исследования биологических процессов и влияния на них, и такие подходы восходят к ранним временам смешения химии и биологии (4).Ясно, что независимо от используемого ярлыка, исследования на стыке неорганической химии и биологии продолжают процветать. В этом выпуске «Текущие мнения в химической биологии», посвященном «биоинорганической химии» или «неорганической химической биологии», рассматривается широкий круг тем, который дает представление о некоторых интересных новых открытиях в этой широкой области исследований. В частности, акцент был сделан на неорганических комплексах с небольшими молекулами, такими как зонды, которые могут встречаться в природе.
Действительно, неорганические комплексы использовались и продолжают использоваться для исследования биологических процессов и влияния на них, и такие подходы восходят к ранним временам смешения химии и биологии (4).Ясно, что независимо от используемого ярлыка, исследования на стыке неорганической химии и биологии продолжают процветать. В этом выпуске «Текущие мнения в химической биологии», посвященном «биоинорганической химии» или «неорганической химической биологии», рассматривается широкий круг тем, который дает представление о некоторых интересных новых открытиях в этой широкой области исследований. В частности, акцент был сделан на неорганических комплексах с небольшими молекулами, такими как зонды, которые могут встречаться в природе. Стимулируемые клиническим успехом цисплатина, были разработаны стратегии адресной доставки и активации пролекарств комплексов платины. Семейство полусэндвич-комплексов рутения и осмия демонстрирует многообещающие противораковые свойства и позволяет лучше настраивать лиганд, чем комплексы платины.Некоординированные взаимодействия с дуплексами ДНК, квадруплексными структурами и другими вторичными структурами используются моно- и полиядерными комплексами металлов. Белки приобретают все большее значение в качестве нетрадиционных мишеней для комплексов металлов либо за счет использования металла в качестве структурного каркаса, либо за счет использования реакционной способности координационных соединений по отношению к белковым противораковым мишеням.
Стимулируемые клиническим успехом цисплатина, были разработаны стратегии адресной доставки и активации пролекарств комплексов платины. Семейство полусэндвич-комплексов рутения и осмия демонстрирует многообещающие противораковые свойства и позволяет лучше настраивать лиганд, чем комплексы платины.Некоординированные взаимодействия с дуплексами ДНК, квадруплексными структурами и другими вторичными структурами используются моно- и полиядерными комплексами металлов. Белки приобретают все большее значение в качестве нетрадиционных мишеней для комплексов металлов либо за счет использования металла в качестве структурного каркаса, либо за счет использования реакционной способности координационных соединений по отношению к белковым противораковым мишеням.  Как правило, в такой стратегии разработки гидролитически активные комплексы металлов помещаются в непосредственную близость к целевому белку, связывая его со связывающим белком или ингибитором фермента.
Как правило, в такой стратегии разработки гидролитически активные комплексы металлов помещаются в непосредственную близость к целевому белку, связывая его со связывающим белком или ингибитором фермента.  Важным в этом контексте было выяснение высвобождения и потока меди и цинка в кортикальном глутаматергическом синапсе, где амилоид впервые откладывается в начале болезни Альцгеймера.
Важным в этом контексте было выяснение высвобождения и потока меди и цинка в кортикальном глутаматергическом синапсе, где амилоид впервые откладывается в начале болезни Альцгеймера.  Эти эксперименты предоставляют убедительные доказательства того, что такие процессы передачи заряда между белками, опосредованные ДНК, могут быть использованы в биологии.
Эти эксперименты предоставляют убедительные доказательства того, что такие процессы передачи заряда между белками, опосредованные ДНК, могут быть использованы в биологии. Комбинация света, металлов и NO предлагает новый захватывающий подход к лечению рака и изучению сигнальных путей NO в биологии.
Комбинация света, металлов и NO предлагает новый захватывающий подход к лечению рака и изучению сигнальных путей NO в биологии. 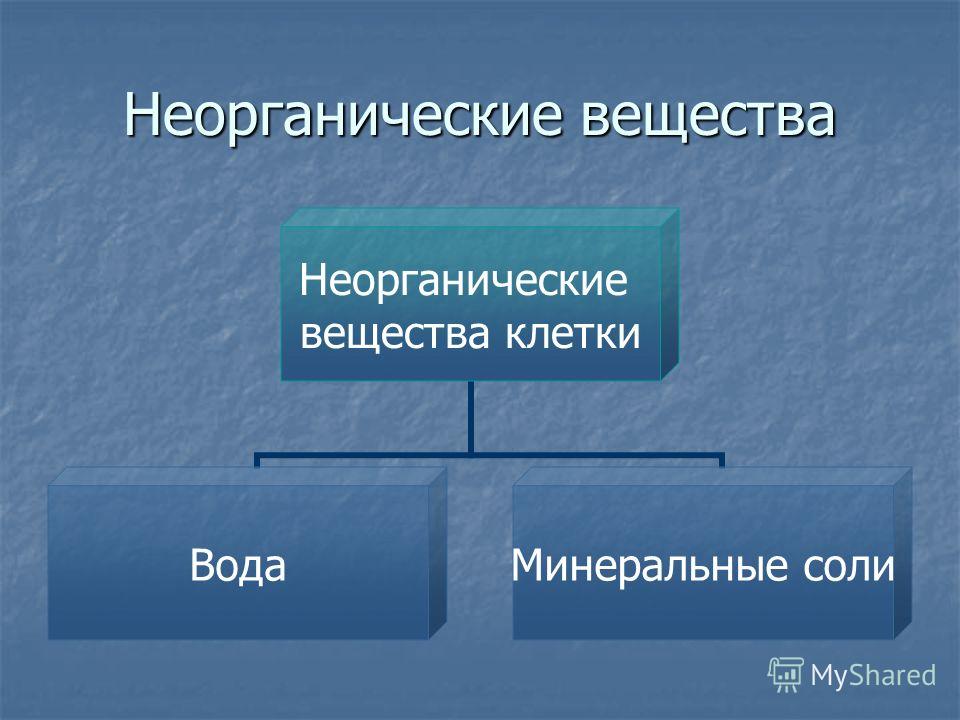 Это свойство затруднило предложение простого оптимизированного механизма для этих ферментов. В этом выпуске Dupureur рассматривает структурные, механические и вычислительные свойства рестрикционных ферментов, уделяя особое внимание роли ионов металлов и координационной сферы металла.Это сравнение иллюстрирует объединяющие темы в катализе фосфодиэфирной связи различными рестрикционными ферментами. В самом деле, есть особенности, которые сходятся в химии, которые обеспечивают понимание того, как изменения в активных сайтах и металлах могут приводить к одному и тому же общему результату расщепления фосфодиэфирного остова. Следует отметить, что многие компьютерные исследования предполагают, что механизмы могут включать движение ионов металлов, что является новой идеей в катализе, которая дает вдохновение для будущих направлений.
Это свойство затруднило предложение простого оптимизированного механизма для этих ферментов. В этом выпуске Dupureur рассматривает структурные, механические и вычислительные свойства рестрикционных ферментов, уделяя особое внимание роли ионов металлов и координационной сферы металла.Это сравнение иллюстрирует объединяющие темы в катализе фосфодиэфирной связи различными рестрикционными ферментами. В самом деле, есть особенности, которые сходятся в химии, которые обеспечивают понимание того, как изменения в активных сайтах и металлах могут приводить к одному и тому же общему результату расщепления фосфодиэфирного остова. Следует отметить, что многие компьютерные исследования предполагают, что механизмы могут включать движение ионов металлов, что является новой идеей в катализе, которая дает вдохновение для будущих направлений.  sivadcu.mehc@divad, URL: http://www.chem.ucdavis.edu
sivadcu.mehc@divad, URL: http://www.chem.ucdavis.edu 
 , 2013
, 2013 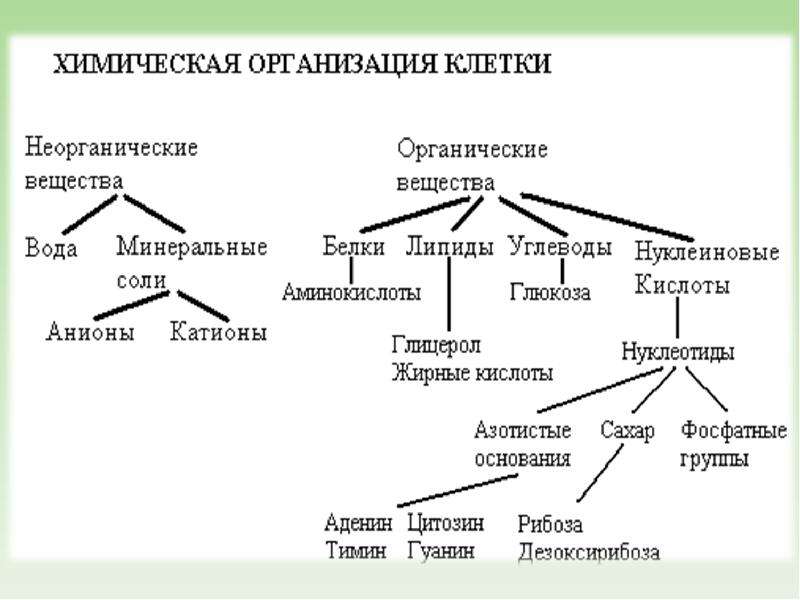
 Дж. Ча, П. Киатвутинон, Д.А. Мюллер, Д. Луо, Нат. Nanotechnol. 4 , 430 (2009)
Дж. Ча, П. Киатвутинон, Д.А. Мюллер, Д. Луо, Нат. Nanotechnol. 4 , 430 (2009) 
 Lee, H. Lee, Adv. Препарат Делив. Ред. 104 , 29–43 (2015)
Lee, H. Lee, Adv. Препарат Делив. Ред. 104 , 29–43 (2015) 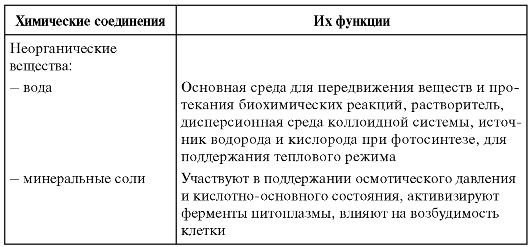


 Фраскони, О.М. Мараго, М.А.Яти, J. Phys .: Condens. Дело 29 , 203002 (2017)
Фраскони, О.М. Мараго, М.А.Яти, J. Phys .: Condens. Дело 29 , 203002 (2017) 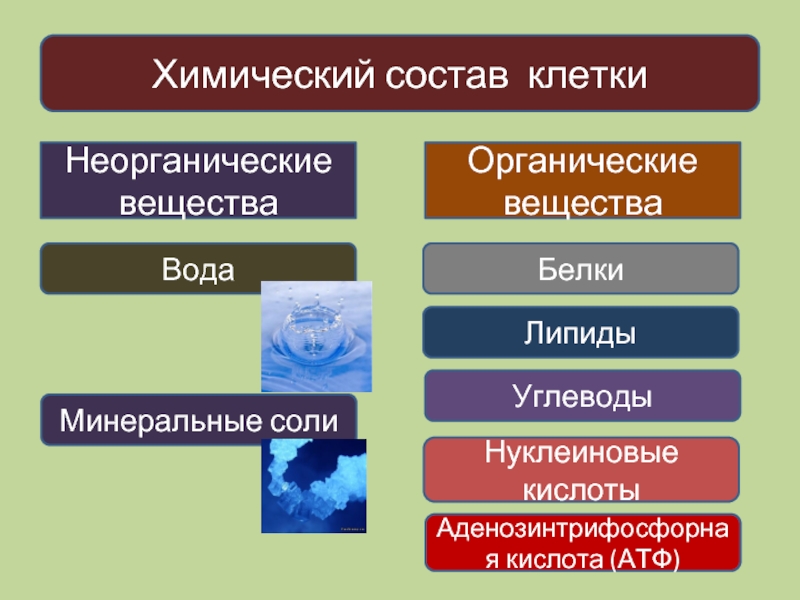

 Матер. 7 , 659 (2008)
Матер. 7 , 659 (2008) 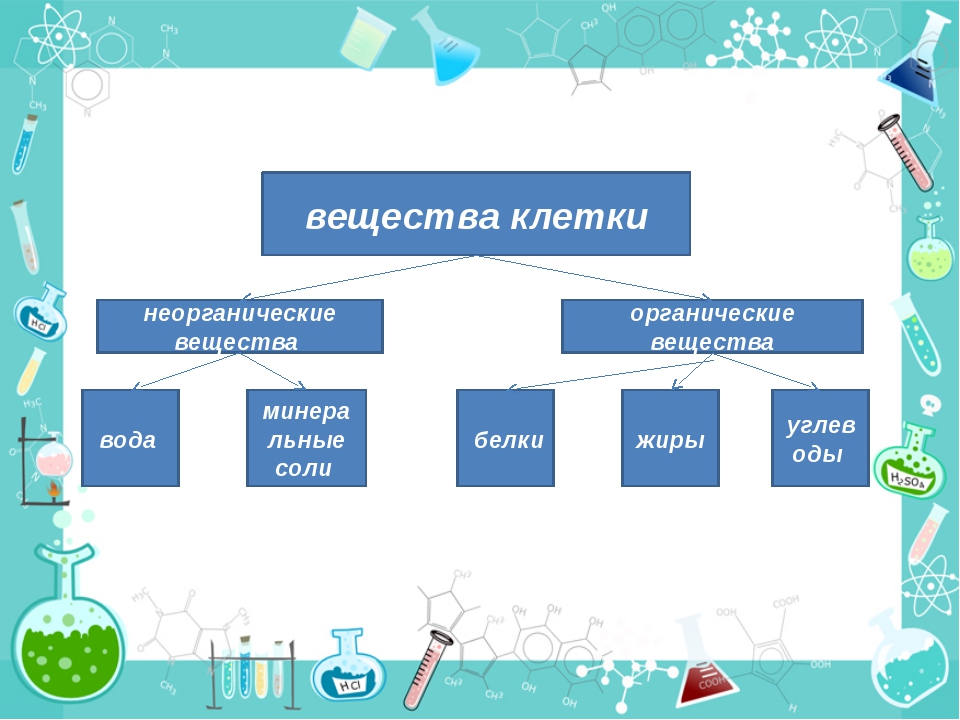
 Chang, A.L. Antaris, C. Chen, B. Zhang, S. Zhao, D.N. Atochin, P.L. Хуанг, К. Андреассон, Нат. Фотоника 8 , 723 (2014)
Chang, A.L. Antaris, C. Chen, B. Zhang, S. Zhao, D.N. Atochin, P.L. Хуанг, К. Андреассон, Нат. Фотоника 8 , 723 (2014) 

 Commun. 8 , 381 (2017)
Commun. 8 , 381 (2017) 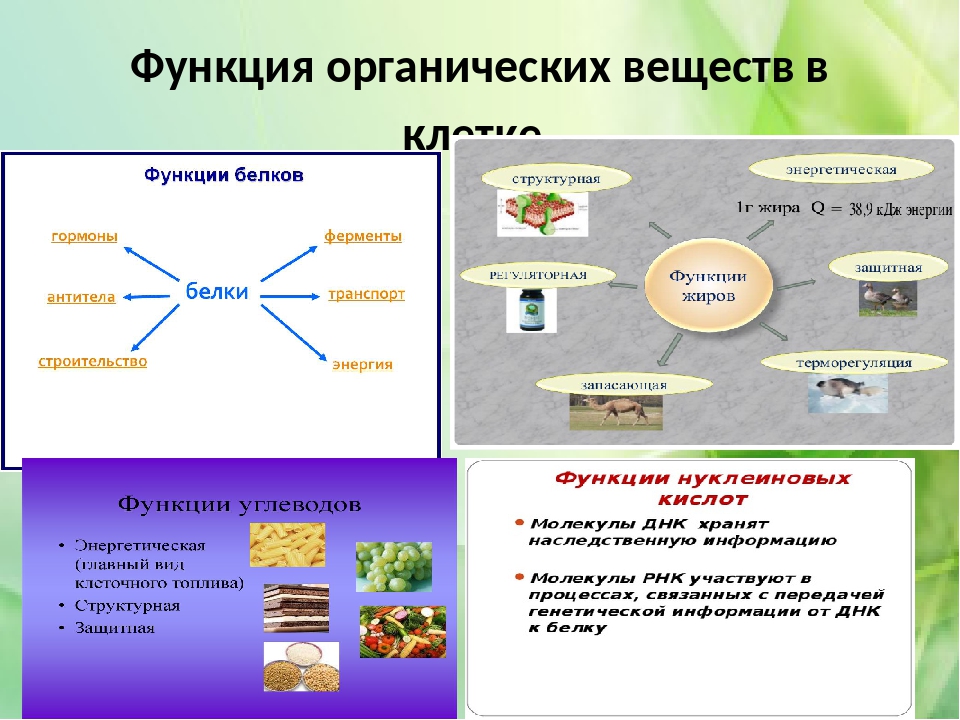

 Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения могут быть неорганическими или органическими.
Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения могут быть неорганическими или органическими.  Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.
Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые подпитывают ваше функционирование.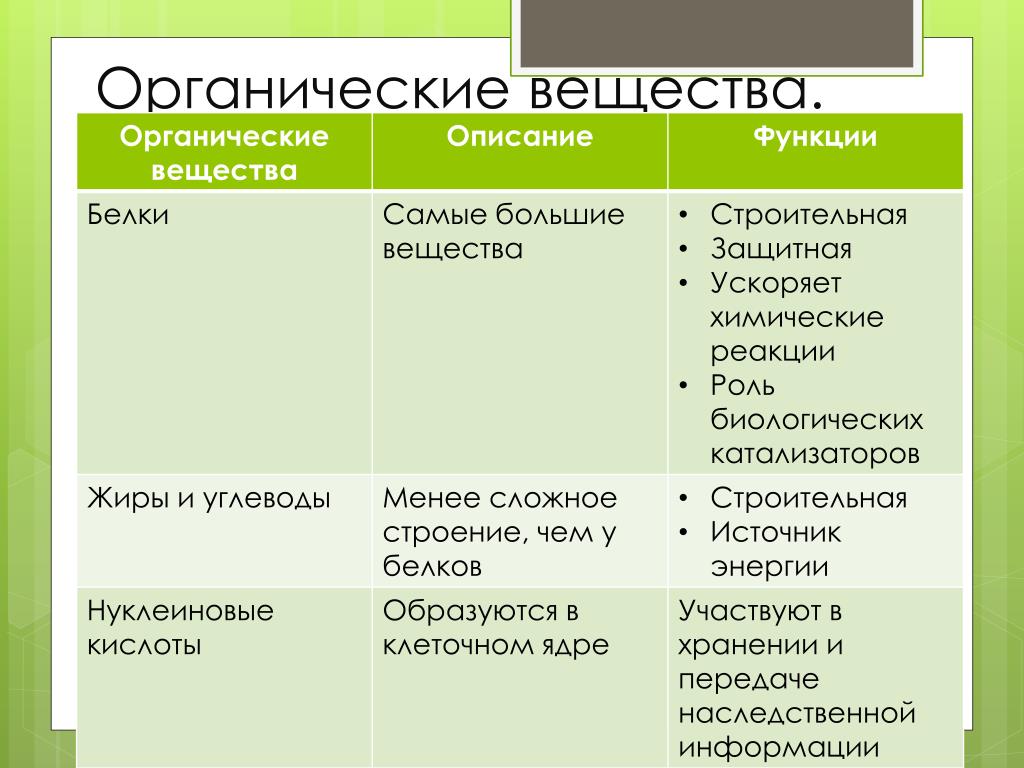
 Этот отвод тепла путем испарения приводит к охлаждению крови на периферии тела, около поверхности кожи, которая затем циркулирует обратно к сердцевине тела и охлаждает тело.
Этот отвод тепла путем испарения приводит к охлаждению крови на периферии тела, около поверхности кожи, которая затем циркулирует обратно к сердцевине тела и охлаждает тело.  В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды.Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды.Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.  Такие соединения называют гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Такие соединения называют гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными». 

 Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.  Рассмотрены клиническая химия серы и экономическое значение метаболизма серы; главы по химии, получению и анализу соединений серы включены.Есть справочник по номенклатуре соединений.
Рассмотрены клиническая химия серы и экономическое значение метаболизма серы; главы по химии, получению и анализу соединений серы включены.Есть справочник по номенклатуре соединений.  сульфаты
сульфаты 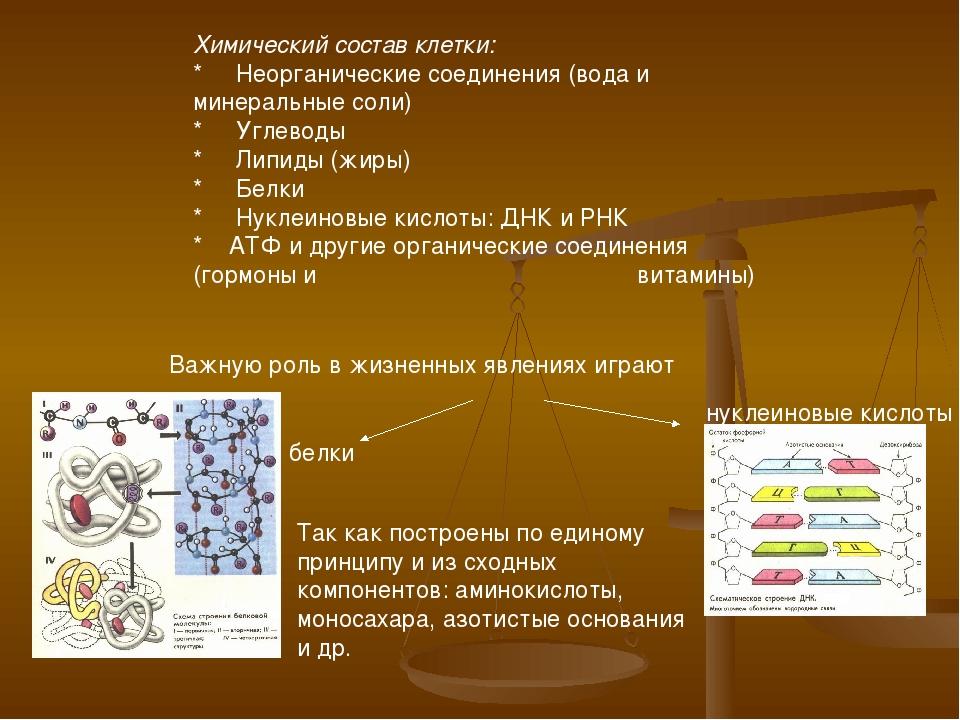 е.е. кислород имеет более высокую электроотрицательность)
е.е. кислород имеет более высокую электроотрицательность) 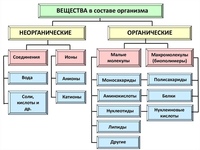 другие полярные молекулы (адгезия)
другие полярные молекулы (адгезия) 