ХИМИЯ с нуля – современный учебник
Приветствую Вас на HIMI4KA.RU – образовательном ресурсе, посвященному изучению химии для тех, кто раньше не учил, либо подзабыл основы этого увлекательного предмета. Если вы думаете, что данная наука вам не по зубам, то имейте в виду: выдающийся русский ученый Дмитрий Иванович Менделеев оставался в школе на второй год, а в гимназии, так вообще имел по химии тройку. Но это не помешало ему стать блестящим химиком с мировым именем.

Безусловно, Менделеев стал известным ученым не за один день, а за долгие годы изучения химии с нуля, выполняя различные опыты и эксперименты, читая десятки учебников, и заучивая наизусть сотни формул и определений. А ведь раньше не было интернета и за книгами необходимо было идти в библиотеку, где приходилось часами стоять в очереди, чтобы получить заветный «гранит науки». И это было не единственной сложностью на пути к знаниям, потому как данная научно-естественная наука тогда только зародилась, и в ней бытовали многие ошибочные теории и гипотезы. Другими словами, учебники по химии того времени могли не только не дать новых знаний, но еще и обучить ошибочным, поэтому приходилось многие теории проверять на практике. Тем не менее, несмотря на все трудности обучения своего времени, Д.И. Менделеев добился того, что стены любого кабинета химии и лаборатории украшает его наследие.
Понять суть и выучить основы химии достаточно просто, хотя многие незаслуженно считают ее трудной и скучной наукой. На самом деле все сложные реакции и превращения описываются простыми закономерностями, в основе которых лежат законы физики и базовые математические соотношения. Главное — это желание и стремление: чем больше стремление — тем больше знаний вы получите. Причем это правило относится к любому делу, за которое вы беретесь. Еще на процесс обучения влияет отношение преподавателя к предмету и материал, который он преподносит. Если преподаватель не горит желанием донести знания до обучающихся, следовательно, время будет проходить впустую. Но это не беда, ведь всегда можно почитать уроки химии дома, используя книги и учебники, однако, если материал будет подан в неверной последовательности или основы химии в нем будут изложены чересчур научным языком, то толку от такого обучения будет мало, не так ли? Поэтому сайт «Химия для чайников» будет вам невероятно полезным в обучении химии с нуля!
Неоспоримым достоинством курсов по химии является их уникальность и простота в освоении для начинающих. Даже если вы никогда ее не понимали, считали себя унылым чайником, а от решения задач у вас кружилась голова, то теперь появился отличный шанс в короткие сроки обучиться до уровня «отличника». Ведь уроки химии на нашем сайте — это не голые факты, числа, формулы — нет, это — полноценный учебник по химии, который содержит в себе всю необходимые теорию и практику, объясняет и учит даже в том случае, если вы никогда не понимали предмет.
- Если вы зашли на сайт впервые и планируете изучать основы химии с нуля, то сначала обязательно посетите таблицу Менделеева, которая поможет вам лучше ориентироваться в химических элементах.
- Вторым вашим шагом будет внимательное прочтение всех уроков из Самоучителя, который состоит из 4 разделов: общей, неорганической и органической химии, а также решения задач. Материал изложен последовательно и доступно, чтобы обучение было максимально эффективным.
- После этого вы переходите к третьему шагу, который заключается в просмотре видео-уроков по химии. Это поможет вам закрепить полученные знания и закрыть оставшиеся пробелы в изучении.
- Четвертый шаг для тех, кто собирается сдавать ОГЭ и ЕГЭ по химии, у нас подготовлен специальный курс подготовки к данным экзаменам. Теория в нем изложена кратко, поэтому прежде вам следует обязательно прочитать уроки химии из самоучителя. Не ленитесь, читайте, изучайте и тогда обязательно получите за экзамен максимальный балл!
И конечно же не стоит забывать, что сайт HIMI4KA.RU — это не волшебная таблетка, а самоучитель, который прежде всего рассчитан на вашу самостоятельную работу. Самое главное – внимательное и регулярное чтение материала, и тогда вы приятно удивитесь тому уровню знаний, которых достигните. Удачи!
himi4ka.ru
основные понятия, определения, термины и законы
Химия, основные понятия которой мы рассмотрим, – это наука, которая изучает вещества и их превращения, происходящие с изменением строения и состава, а значит, и свойств. Прежде всего необходимо определить, что же означает такой термин, как «вещество». Если говорить о нем в широком смысле, оно представляет собой форму материи, которая имеет массу покоя. Веществом является любая элементарная частица, к примеру, нейтрон. В химии же это понятие используется в более узком значении.
Для начала кратко опишем основные термины и понятия химии, атомно-молекулярного учения. После этого мы поясним их, а также изложим некоторые важные законы данной науки.

Основные понятия химии (вещество, атом, молекула) знакомы каждому из нас еще со школы. Ниже дана краткая характеристика их, а также других, не столь очевидных терминов и явлений.
Атомы
Прежде всего все вещества, которые изучаются в химии, сложены из маленьких частиц, называемых атомами. Нейтроны же не являются объектом изучения этой науки. Также следует сказать, что атомы могут соединяться друг с другом, в результате чего формируются химические связи. Для того чтобы разорвать эту связь, необходима затрата энергии. Следовательно, атомы в обычных условиях по одиночке не существуют (за исключением «благородных газов»). Они соединяются друг с другом хотя бы попарно.
Непрерывное тепловое движение
Непрерывным тепловым движением характеризуются все частицы, которые изучает химия. Основные понятия этой науки нельзя изложить, не рассказав о нем. При непрерывном движении средняя кинетическая энергия частиц пропорциональна температуре (однако следует заметить, что энергии у отдельных частиц разные). Екин = kT / 2, где k – постоянная Больцмана. Эта формула справедлива для любого вида движения. Так как Екин = mV2 / 2, движение массивных частиц более медленное. К примеру, если температура одинакова, молекулы кислорода в среднем перемещаются в 4 раза медленнее, чем молекулы углерода. Это происходит потому, что их масса больше в 16 раз. Движение бывает колебательным, поступательным и вращательным. Колебательное наблюдается и в жидких, и в твердых, и в газообразных веществах. А вот поступательное и вращательное легче всего осуществляется в газах. В жидкостях оно труднее, а в твердых веществах – еще более трудно.
Молекулы

Продолжим описывать основные понятия и определения химии. Если атомы объединяются между собой, образуя небольшие группы (их называют молекулами), такие группы принимают участие в тепловом движении, выступая как единое целое. До 100 атомов присутствует в типичных молекулах, а их число у так называемых высокомолекулярных соединений может достигать 105.
Немолекулярные вещества
Однако атомы часто объединяются в огромные коллективы количеством от 107 до 1027. В этом виде они уже практически не принимают участие в тепловом движении. Данные объединения уже мало напоминают молекулы. Они больше похожи на куски твердого тела. Вещества эти принято называть немолекулярными. В этом случае тепловое движение осуществляется внутри куска, а сам он не летает, подобно молекуле. Есть и переходная область размеров, в которую включаются объединения, состоящие из атомов в количестве от 105 до 107. Данные частицы являются или очень большими молекулами, или же представляют собой маленькие крупицы порошка.
Ионы

Необходимо отметить, что атомы и их группы могут обладать электрическим зарядом. В этом случае они называются ионами в такой науке, как химия, основные понятия которой мы изучаем. Так как одноименные заряды всегда отталкиваются друг от друга, вещество, где присутствует значительный избыток тех или иных зарядов, не может быть устойчиво. Отрицательные и положительные заряды в пространстве всегда чередуются. А вещество в целом остается электронейтральным. Заметим, что заряды, считающиеся в электростатике большими, с точки зрения химии ничтожны (на 105-1015 атомов – 1е).
Объекты изучения в химии
Нужно уточнить, что объектами изучения в химии выступают те явления, в которых не возникают и не разрушаются атомы, а только лишь перегруппировываются, то есть по-новому соединяются. Одни связи разрываются, в результате чего формируются другие. Иными словами, новые вещества появляются из атомов, бывших в составе исходных веществ. Если же и атомы, и существующие между ними связи сохраняются (к примеру, при испарении молекулярных веществ), то эти процессы относятся к области изучения уже не химии, а молекулярной физики. В случае когда атомы образуются или разрушаются, речь идет о предметах изучения ядерной или атомной физики. Однако граница между химическими и физическими явлениями размыта. Ведь деление на отдельные науки условно, тогда как природа неделима. Поэтому химикам очень полезно знание физики.
Основные понятия химии кратко были нами изложены. Теперь предлагаем вам подробнее их рассмотреть.
Подробнее об атомах

Атомы и молекулы — это то, с чем у многих ассоциируется химия. Основные понятия эти необходимо четко определить. То, что атомы существуют, две тысячи лет назад было гениально угадано. Затем, уже в 19 веке, у ученых появились экспериментальные данные (пока еще косвенные). Речь идет о кратных отношениях Авогадро, законах постоянства состава (ниже мы рассмотрим эти основные понятия химии). Атом продолжили исследовать в 20 веке, когда возникло множество уже прямых экспериментальных подтверждений. Они были основаны на данных спектроскопии, на рассеянии рентгеновских лучей, альфа-частиц, нейтронов, электронов и др. Размер данных частиц составляет примерно 1 Е = 1о-10м. Масса их – около 10-27 – 10-25 кг. В центре этих частиц находится положительно заряженное ядро, вокруг которого движутся электроны с отрицательным зарядом. Размер ядра составляет около 10-15 м. Получается, что электронная оболочка определяет размеры атома, однако при этом его масса практически полностью сосредоточена в ядре. Еще одно определение следует ввести, рассматривая основные понятия химии. Химический элемент — это вид атомов, заряд ядра которых одинаков.
Часто встречается определение атома как мельчайшей частицы вещества, химически неделимой. Как понять «химически»? Как мы уже отмечали, деление явлений на физические и химические условно. А вот существование атомов безусловно. Поэтому химию лучше определять через них, а не наоборот, атомы через химию.
Химическая связь

Это то, благодаря чему атомы удерживаются вместе. Она не позволяет им разлететься под влиянием теплового движения. Отметим основные характеристики связей — это межъядерное расстояние и энергия. Это также основные понятия химии. Длина связи определяется экспериментально с достаточно высокой точностью. Энергия – тоже, однако не всегда. К примеру, невозможно объективно определить, какова она по отношению к отдельной связи в сложной молекуле. Однако энергия атомизации вещества, необходимая для разрыва всех имеющихся связей, определяется всегда. Зная длину связи, можно определить, какие атомы являются связанными (у них короткое расстояние), а какие – нет (длинное расстояние).
Координационное число и координация
Основные понятия аналитической химии включают в себя два этих термина. Что же они обозначают? Давайте разберемся.
Координационное число представляет собой количество ближайших соседей данного конкретного атома. Другими словами, это число тех, с кем он связан химически. Координация представляет собой взаимное расположение, вид и число соседей. Другими словами, это понятие более содержательно. К примеру, координационное число азота, свойственное молекулам аммиака и азотной кислоты, одинаково – 3. Однако координация у них разная – неплоская и плоская. Она определяется независимо от представлений о природе связи, тогда как степень окисления и валентность – понятия условные, которые созданы для того, чтобы заранее предсказывать координацию и состав.
Определение молекулы
Мы уже касались этого понятия, рассматривая основные понятия и законы химии кратко. Теперь остановимся на нем более подробно. В учебниках часто встречается определение молекулы как наименьшей нейтральной частицы вещества, которая обладает его химическими свойствами, а также способна существовать самостоятельно. Необходимо отметить, что это определение в настоящий момент уже устарело. Во-первых, то, что все физики и химики именуют молекулой, свойств вещества не сохраняет. Вода диссоциирует, однако для этого необходимы минимум 2 молекулы. Степень диссоциации воды – это 10-7. Другими словами, этому процессу может подвергаться лишь одна молекула из 10 млн. Если у вас имеется одна молекула, или есть даже сто, вы не сможете получить представления о ее диссоциации. Дело в том, что тепловые эффекты реакций в химии обычно включают энергию взаимодействия между молекулами. Поэтому их нельзя найти по одной из них. И химические, и физические свойства молекулярного вещества можно определить лишь по большому коллективу молекул. Кроме того, существуют вещества, у которых способная существовать самостоятельно «наименьшая» частица неопределенно велика и очень отличается от привычных молекул. Молекула фактически представляет собой группу атомов, электрически не заряженную. В частном случае это может быть один атом, к примеру, Ne. Эта группа должна быть способна участвовать в диффузии, а также в других типах теплового движения, выступая как единое целое.
Как вы видите, не так просты основные понятия химии. Молекула — это то, что необходимо тщательно изучить. Она обладает своими собственными свойствами, а также молекулярной массой. О последней мы сейчас и поговорим.
Молекулярная масса
Как определить молекулярную массу на опыте? Один способ – основываясь на законе Авогадро, по относительной плотности пара. Самым точным методом является масс-спектрометрический. Электрон выбивают из молекулы. Полученный в результате этого ион сначала разгоняют в электрическом поле, затем отклоняют его магнитным путем. Отношение заряда к массе определяется именно величиной отклонения. Существуют также методы, основанные на свойствах, которыми обладают растворы. Однако молекулы во всех этих случаях непременно должны быть в движении – в растворе, в вакууме, в газе. Если они не движутся, невозможно объективно рассчитать их массу. Да и само их существование в этом случае трудно обнаружить.
Особенности немолекулярных веществ
Говоря о них, отмечают, что они состоят из атомов, а не из молекул. Однако это же справедливо и по отношению к благородным газам. Данные атомы движутся свободно, следовательно, лучше считать их одноатомными молекулами. Однако не это главное. Важнее, что в немолекулярных веществах имеется очень много атомов, которые связаны воедино. Нужно заметить, что деление всех веществ на немолекулярные и молекулярные является недостаточным. Деление по связности более содержательно. Рассмотрим, к примеру, различие в свойствах графита и алмаза. Оба они являются углеродом, однако первое – мягкое, а второе – твердое. Чем же они отличаются друг от друга? Разница заключается как раз в их связности. Если рассмотреть структуру графита, мы увидим, что прочные связи имеются лишь в двух измерениях. А вот в третьем очень значительны межатомные расстояния, следовательно, нет прочной связи. Графит легко скользит и раскалывается по этим слоям.
Связность структуры
Иначе ее называют пространственной размерностью. Она представляет собой количество измерений пространства, характеризующихся тем, что в них непрерывна (почти бесконечна) система остов (прочных связей). Значения, которые она может принимать, — 0, 1, 2 и 3. Следовательно, необходимо различать трехмерно-связные, слоистые, цепочечные и островные (молекулярные) структуры.
Закон постоянства состава
Мы уже изучили основные понятия химии. Вещество было вкратце рассмотрено нами. Теперь расскажем о законе, который относится к нему. Обычно его формулируют следующим образом: любое индивидуальное вещество (то есть чистое), независимо от того, каким способом оно было получено, имеет одинаковый количественный и качественный состав. Но что же значит понятие «чистое вещество»? Давайте разберемся.
Две тысячи лет назад, когда строение веществ нельзя было еще изучить прямыми методами, когда еще даже не существовали основные химические понятия и законы химии, привычные нам, его определяли описательно. К примеру, вода – это жидкость, которая составляет основу морей и рек. У нее нет запаха, цвета, вкуса. Она имеет такие-то температуры замерзания и плавления, от нее синеет сульфат меди. Соленой морская вода является потому, что она не чистая. Однако соли можно отделить с помощью перегонки. Примерно так, описательным методом, определялись основные химические понятия и законы химии.
Для ученых того времени было неочевидно, что жидкость, которая выделена разными способами (сжиганием водорода, обезвоживанием купороса, перегонкой морской воды), обладает одинаковым составом. Большим открытием в науке стало доказательство этого факта. Стало понятно, что соотношение кислорода и водорода не может плавно меняться. Это значит, что элементы состоят из атомов – неделимых порций. Так были получены формулы веществ, а также обосновано представление ученых о молекулах.
В наше время любое вещество явно или неявно определяют прежде всего формулой, а не температурой плавления, вкусом или цветом. Вода — Н2О. Если присутствуют другие молекулы, она уже не будет являться чистой. Следовательно, чистое молекулярное вещество представляет собой то, которое сложено из молекул только одного вида.
Однако как в этом случае быть с электролитами? Ведь в их составе присутствуют ионы, а не только молекулы. Необходимо более строгое определение. Чистое молекулярное вещество представляет собой то, которое сложено из молекул одного вида, а также, возможно, продуктов их обратимого быстрого превращения (изомеризации, ассоциации, диссоциации). Слово «быстрого» в этом контексте означает, что от этих продуктов мы не можем избавиться, они сразу же появляются вновь. Слово «обратимого» указывает на то, что превращение не доводится до конца. Если доводится, тогда лучше говорить, что оно неустойчиво. В этом случае оно не является чистым веществом.
Закон сохранения массы вещества
Этот закон еще с древнейших времен был известен в метафорической форме. Он гласил, что вещество несотворимо и неуничтожимо. Затем появилась его количественная формулировка. Согласно ей, вес (а с конца 17 столетия – масса) является мерой количества вещества.
Данный закон в привычном для нас виде был открыт в 1748 году Ломоносовым. В 1789 году его дополнил А. Лавуазье, французский ученый. Современная его формулировка звучит так: масса веществ, вступающих в химическую реакцию, равняется массе веществ, которые получаются в результате нее.
Закон Авогадро, закон объемных отношений газов
Последний из них был сформулирован в 1808 году Ж. Л. Гей-Люссаком, французским ученым. В настоящее время этот закон именуется законом Гей-Люссака. Согласно ему, объемы вступающих в реакцию газов относятся друг к другу, а также к объемам полученных газообразных продуктов как целые небольшие числа.
Закономерность, которую обнаружил Гей-Люссак, объясняет закон, который был открыт немного позже, в 1811 году, Амедео Авогадро, итальянским ученым. Он гласит, что при равных условиях (давления и температуры) в газах, имеющих одинаковые объемы, присутствует одинаковое количество молекул.
Два важных следствия вытекают из закона Авогадро. Первое заключается в том, что при одинаковых условиях один моль любого газа занимает равный объем. Объем любого из них при нормальных условиях (которыми являются температура 0 °С, а также давление 101,325 кПа) составляет 22,4 л. Второе следствие данного закона следующее: при равных условиях отношение масс газов, имеющих одинаковый объем, равняется отношению их молярных масс.
Существует и еще один закон, о котором непременно нужно упомянуть. Расскажем о нем вкратце.
Периодический закон и таблица
Д. И. Менделеев, основываясь на химических свойствах элементов и атомно-молекулярном учении, открыл этот закон. Это событие произошло 1 марта 1869 г. Периодический закон является одним из важнейших в природе. Его можно сформулировать следующим образом: свойства элементов и образуемых ими сложных и простых веществ имеют периодическую зависимость от зарядов ядер их атомов.
Периодическая таблица, которую создал Менделеев, состоит из семи периодов и восьми групп. Группами называются ее вертикальные столбцы. Элементы внутри каждой из них имеют схожие физические и химические свойства. Группа, в свою очередь, делится на подгруппы (главные и побочные).
Горизонтальные ряды этой таблицы именуют периодами. Элементы, которые находятся в них, отличаются между собой, однако у них есть и общее – то, что их последние электроны расположены на одном энергетическом уровне. В первом периоде находятся только два элемента. Это водород Н и гелий Не. Восемь элементов имеются во втором периоде. В четвертом их уже 18. Менделеев обозначил этот период как первый большой. В пятом также 18 элементов, его структура схожа с четвертым. В составе шестого – 32 элемента. Седьмой не закончен. Этот период начинается с франция (Fr). Мы можем предположить, что он будет содержать 32 элемента, как и шестой. Однако пока найдено лишь 24.
Правило откета
Согласно правилу откета, все элементы стремятся к тому, чтобы приобрести электрон или потерять его для того, чтобы иметь 8-электронную конфигурацию благородного газа, ближайшего к ним. Энергия ионизации – это то количество энергии, которое необходимо для отделения электрона от атома. Правило откета гласит, что при движении слева направо по периодической таблице необходимо больше энергии для отрыва электрона. Поэтому элементы, находящиеся с левой стороны, стремятся к тому, чтобы потерять электрон. Напротив, те, которые расположены с правой стороны, жаждут его приобрести.
Законы и основные понятия химии кратко мы изложили. Безусловно, это лишь общая информация. В рамках одной статьи невозможно подробно рассказать о столь серьезной науке. Основные понятия и законы химии, кратко изложенные в нашей статье, — это лишь отправная точка для дальнейшего изучения. Ведь в этой науке есть множество разделов. Существует, к примеру, органическая и неорганическая химия. Основные понятия каждого из разделов этой науки можно изучать очень долго. Но те, которые представлены выше, относятся к общим вопросам. Поэтому можно сказать, что это основные понятия органической химии, как и неорганической.
fb.ru
Основные понятия в химии
Химия — это наука о веществах, их свойствах и превращениях, происходящих в результате химических реакций, а также о фундаментальных законах, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается в основном изучением взаимодействий между атомами и молекулами, полученными в результате таких взаимодействий.
Химический элемент — определённый вид атома имеющий название, порядковый номер, и положение в таблице Менделеева называют химическим элементом. В настоящее время известно 118 химических элементов, заканчивая Uuo (Ununoctium — Унуноктий). Каждый элемент обозначен символом, который представляет одну или две буквы из его латинского названия (водород обозначен буквой H — первой буквой его латинского названия Hydrogenium).
Вещество — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Простое вещество — вещество, состоящее из атомов одного химического элемента: водород, кислород и т.д.
Сложное вещество — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Аллотропия — это способность некоторых химических элементов существовать в виде двух или нескольких простых веществ, различных по строению и свойствам. Например: алмаз и уголь состоят из одного и того же элемента — углерода.
Относительная атомная масса. Относительной атомной массой элемента называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Обозначают относительную атомную массу элемента символом Аr, где r — начальная буква английского слова relative (относительный).
Относительная молекулярная масса. Относительной молекулярной массой Мr называют отношение абсолютной массы молекулы к 1/12 массы атома изотопа углерода 12С.
Обратите внимание на то, что относительные массы по определению являются безразмерными величинами.
Таким образом, мерой относительных атомных и молекулярных масс избрана 1/12 часть массы атома изотопа углерода 12С, которая называется атомной единицей массы (а.е.м.):
Моль. В химии чрезвычайное значение имеет особая величина — количество вещества.
Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или других частиц) этого вещества, оно обозначается обычно n и выражается в молях (моль).
Моль — это единица количества вещества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 12 г углерода, состоящего только из изотопа 12С.
Число Авогадро. Определение моля базируется на числе структурных единиц, содержащихся в 12 г углерода. Установлено, что данная масса углерода содержит 6,02× 1023 атомов углерода. Следовательно, любое вещество количеством 1 моль содержит 6,02× 1023 структурных единиц (атомов, молекул, ионов).
Число частиц 6,02 × 1023 называется числом Авогадро или постоянной Авогадро и обозначается NA:
NA = 6,02 × 1023 моль-1
Молярная масса. Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится понятие молярной массы вещества.
Молярная масса M вещества представляет собой отношение его массы к количеству вещества:
где г — масса в граммах, n — количество вещества в молях, М — молярная масса в г/моль — постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента.
Валентность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов или количество связей, которые может образовывать вещество.
Степень окисления
(окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в формульной единице, например:
Na+Cl—, Mg2+Cl2—, N-3H3—, C+2O-2, C+4O2-2, Cl+F—, H+N+5
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
H+N+3O-22 — степень окисления, H+N3+O2-2 — заряды.
Степень окисления атома в простом веществе равна нулю, например:
O03, Br02, C0.
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
H+2S+6O-24, (+1 • 2) + (+6 • 1) + (-2 • 4) = +2 +6 -8 = 0
Химическая связь , взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют химические связи. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Основные характеристики химической связи — прочность, длина, полярность.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства — признаки вещества, при характеристике которых вещество не изменяет свой химический состав.(плотность, агрегатное состояние, температуры плавления и кипения и т.п.)
Химические свойства — способность веществ взаимодействовать с другими веществами или изменятся под действием определённых условий.Результатом является превращения одного вещества или веществ в другие вещества.
Физические явления — новые вещество не образуется.Химические явления — новые вещество образуется.examchemistry.com
Основные законы и понятия химии
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na– натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Простое вещество – это вещество, состоящее из атомов одного элемента.
Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо состоит из атомов элемента железа, а простое вещество – из двухатомных молекул, образованных атомами одного элемента — кислорода.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2и озон О3, либо разной кристаллической структурой, например, углерод, алмаз и карбин, химический знак которых – С.
Сложное вещество, или соединение, — это вещество, состоящее из атомов разных элементов.
Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления
может иметь положительное, отрицательное
и нулевое значения, которые обычно
ставятся над символом элемента сверху.
Например,
 ,
,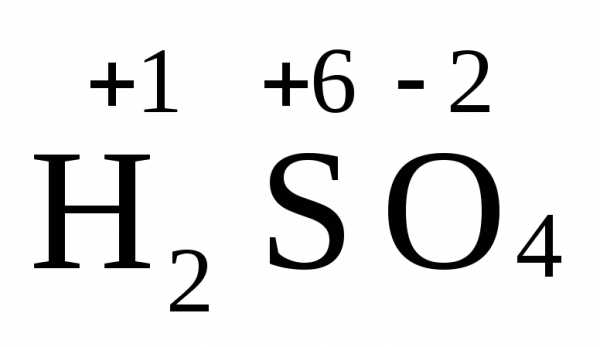
 .
Степень окисления элементов в простых
веществах равна нулю
Степень окисления некоторых элементов
в их соединениях имеет постоянное
значение. К таким элементам относятся
щелочные металлы (степень окисления
+1), металлыIIА подгруппы
Периодической системы (+2), а также серебро
.
Степень окисления элементов в простых
веществах равна нулю
Степень окисления некоторых элементов
в их соединениях имеет постоянное
значение. К таким элементам относятся
щелочные металлы (степень окисления
+1), металлыIIА подгруппы
Периодической системы (+2), а также серебро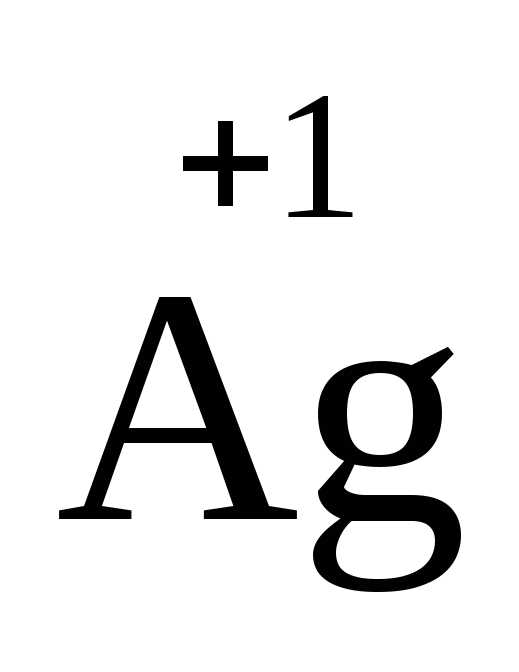
 , кадмий
, кадмий ,
алюминий
,
алюминий .
Водород проявляет степень окисления
+1 во всех соединениях, кроме гидридов,
в которых степень окисления водорода
равна –1.
Степень окисления кислорода практически
постоянна и составляет –2.
.
Водород проявляет степень окисления
+1 во всех соединениях, кроме гидридов,
в которых степень окисления водорода
равна –1.
Степень окисления кислорода практически
постоянна и составляет –2.Большинство элементов имеет переменную степень окисления, например, .
Массы атомов и молекул очень малы (10-25-10-20) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода12С.
Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы.
Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5.
Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы.
Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения.
Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023структурных единиц. Число 6,02×1023называется числом Авогадро. ¥
Применяя понятие
«моль», необходимо в каждом конкретном
случае указывать, какие именно структурные
единицы имеются в виду. Например, следует
различать моль атомов Н, моль молекул
Н2, моль ионов Н+. В моле
атомов, молекул, ионов водорода содержится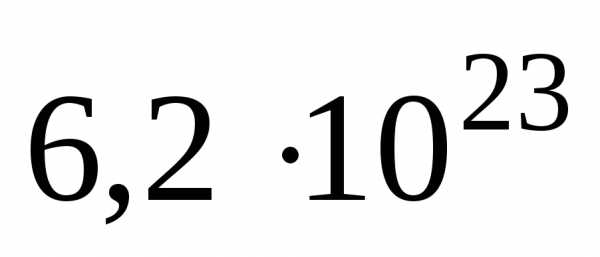 атомов, молекул, ионов водорода
соответственно.
атомов, молекул, ионов водорода
соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м.
Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой
после подбора коэффициентов будет выглядеть следующим образом:
(1)
Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:
Примем nравным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид
а) (2)
б) (3)
Все записанные уравнения удовлетворяют закону сохранения массы вещества.
Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что вещества, участвующие в реакции, написаны неправильно.
Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты.
Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения:
а)
б)
Чтобы исключить
промежуточное вещество
 ,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
+
______________________

Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих газов, но их объемы. Объем газа зависит от его количества, давления и температуры.
Количественные расчеты объемов газообразных веществ, участвующих в химической реакции, базируются на законе Авогадро.
В равных объемах любых газов, взятых при одинаковой температуре и давлении, содержится одно и то же число молекул.
В соответствии с законом Авогадро одинаковое число молекул газа занимает при одних и тех же условиях одинаковый объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует важный вывод (следствие из закона Авогадро):
При определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Поскольку объем данной массы газа зависит от давления и температуры, то при расчетах по химическим реакциям с участием газообразных веществ необходимо указывать условия, при которых находится газ. Наиболее употребительными являются так называемые «нормальные» условия (н.у.). К нормальным условиям относятся: температура 00С (273К) и давление, равное
Объем 1 моль любого газообразного вещества при нормальных условиях (н.у.) равен 22,4л.
Этот объем называется молярным или мольным объемом газа при нормальных условиях.
Вещества, способные распадаться в растворе или в расплаве на заряженные частицы (ионы), называются электролитами.
Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Катионами являются ионы водорода, Н+, ион аммония,NН+4, ионы металлов, например,Na+,Ca2+,Al3+. К анионам относятся гидроксид-ион, ОН—, ионы кислотных остатков, например,Cl—,NO3—,SO42-.
Свойства ионов резко отличаются от свойств атомов соответствующих элементов. Так, натрий и калий разлагают воду с выделением водорода, а ионы Na+иK+такими свойствами не обладают.
Процесс распада молекул электролитов на ионы называется электролитической диссоциацией.
Электролитическая диссоциация является обратимым процессом, т.е. в растворе или расплаве одновременно протекают две реакции: распад молекул на катионы и анионы (КАК++ А—) и ассоциация (соединение) ионов в молекулы (К++ А—КА). Поэтому уравнение реакции электролитической диссоциации записывается следующим образом: КАК++А—; знакуказывает на обратимость процесса.
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов одновременно присутствуют не только ионы, но и молекулы, не распавшиеся на ионы. Способность молекул данного электролита диссоциировать в растворе или расплаве характеризуется степенью диссоциации .
Степенью диссоциации называется отношение числа молекул (молей) электролита, распавшихся на ионы, к общему числу его молекул (молей). Степень диссоциации выражается либо в долях единицы, либо в процентах.
Все электролиты подразделяются на сильные и слабые. Сильные электролиты диссоциируют практически нацело, степень их диссоциации близка к единице (100%). В растворах сильных электролитов содержатся преимущественно ионы, недиссоциированных молекул практически нет.
Слабые электролиты характеризуются малой степенью диссоциации, поэтому в растворе присутствует значительное количество непродиссоциированных молекул.
К электролитам относятся кислоты, основания и соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Образовавшийся при диссоциации кислоты анион называется кислотным остатком.
Так, при диссоциации азотной кислоты (HNO3) образуются ион водорода Н+и анионNO3—(нитрат-ион)
HNO3 Н++ NO3—.
Кислоты делятся на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (HNO3) кислоты – кислородосодержащие, а соляная (HCl) и сероводородная (H2S) – бескислородные.
Кислоты различают по основности. Основность кислот определяется числом атомов водорода, способных замещаться на металл.
Кислоты бывают разной силы, что характеризуется их степенью диссоциации. У сильных кислот степень диссоциации близка к единице, а у слабых – значительно меньше единицы.
Слабые кислоты диссоциируют ступенчато. Например, угольная кислота диссоциирует в две ступени:
Названия кислотных остатков, полученных при ступенчатой диссоциации кислот, образуются прибавлением приставки гидро- или дигидро- (по числу оставшихся в анионе ионов водорода) к названию кислотного остатка, полученного при полной диссоциации кислоты. Например, ион СО32-называется карбонат-ионом, а ион НСО3—— гидрокарбонат-ионом, ион РО43-называется фосфат-ионом (или ортофосфат-ионом), ионHPO42-– гидрофосфат-ионом, а ион Н2РО4—— дигидрофосфат-ионом).
В таблице приведены формулы и названия некоторых кислот и их кислотных остатков.
Таблица
Формулы и названия кислот и кислотных остатков
|
Формула кислоты |
Название кислоты |
Кислотный остаток (анион) |
Название аниона |
|
HCl |
Сильные кислоты Соляная (хлористо-водородная) |
Cl— |
Хлорид |
|
HBr |
Бромисто-водородная |
Br— |
Бромид |
|
HJ |
Йодисто-водородная |
J— |
Иодид |
|
HNO3 |
Азотная |
NO3— |
Нитрат |
|
H2SO4 |
Серная |
SO42 HSO4— |
Сульфат Гидросульфат |
|
HF |
Слабые кислоты Фтористо-водородная |
F— |
Фторид |
|
HNO2 |
Азотистая |
NO2— |
Нитрит |
Формулы и названия кислот и кислотных остатков
|
H2S |
Сероводородная |
S2- HS— |
Сульфид Гидросульфид |
|
H2SO3 |
Сернистая |
SO32- HSO3— |
Сульфит Гидросульфит |
|
H2CO3 |
Угольная |
CO32- HCO3— |
Карбонат Гидрокарбонат |
|
H2SiO3 |
Кремниевая |
SiO32- HSiO3— |
Силикат Гидросиликат |
|
H3PO4 |
Ортофосфорная(фосфорная) |
PO43- HPO42- H2PO4— |
Фосфат Гидрофосфат Дигидрофосфат |
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (ОН—).
Основания имеют формулу Me(OH)n, где Ме — ион металла; ОН—— гидроксильная группа; n — количество гидроксильных групп, численно равное заряду иона металла (n+), например, K+OH,Ca2+(OH)2.
Запишем уравнение диссоциации основания на примере КОН
КОНК++ОН—
Названия гидроксидов образуются из слова гидроксид и названия металла: NaOH — гидроксид натрия, Ba(OH)2 — гидроксид бария. Если металл имеет переменную степень окисления, то в скобках указывается римской цифрой степень окисления металла в данном основании: Fe(OH)2 — гидроксид железа (П), Fe(OH)3 — гидроксид железа (Ш). Некоторые гидроксиды имеют специфические названия, например, гидроксид калия — едкое кали, гидроксид натрия — едкий натр, гидроксид кальция — гашеная известь.
Число гидроксильных групп в формуле основания определяет его кислотность. Например, NH4OH — однокислотное основание, Cu(OH)2 — двухкислотное.
Названия катионов, содержащих, кроме металла, гидроксильные ионы. образуются из названия металла с прибавлением приставки гидроксо-, причем, если в состав катиона входят две гидроксогруппы, то название будет включать приставку дигидроксо-. Так, катион, образующийся на первой стадии диссоциации гидроксида алюминия, Al(OH)2+, называется ионом дигидроксоалюминия, а катион, образующийся на второй стадии, Al(OH)2+ — ионом гидроксоалюминия.
Основания подразделяются на растворимые и нерастворимые, а также сильные и слабые. Так, все гидроксиды 1А группы Периодической системы элементов Д.И. Менделеева, например, NaOH, KOH, а также гидроксиды щелочно-земельных металлов, Ca(OH)2, Sr(OH)2, Ba(OH)2 — хорошо растворимые соединения и сильные электролиты. Они называются щелочами. Большинство гидроксидов других металлов плохо растворяются в воде и являются слабыми электролитами. Гидроксид аммония, NH4OH, диссоциирующий по уравнению NH4OH NH4++OH—, является слабым электролитом, но хорошо растворим в воде.
Существуют гидроксиды, способные проявлять как свойства кислот, так и свойства оснований. Такие гидроксиды называются амфотерными. К ним относятся, например, Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 и др.
Солями называются электролиты, полученные при замещении ионов водорода в кислоте на ионы металла или гидроксид-ионов основания на анионы кислотного остатка.
При полном замещении образуются средние соли, например, K2SO4,Al(NO3)3,CuCO3. Средние соли состоят из ионов металла и ионов кислотного остатка, полученного при полном отщеплении всех ионов водорода в процессе диссоциации кислоты.
Названия средних солей складываются из названия кислотного остатка и названия металла. При этом, если металл имеет переменную валентность, то она указывается римской цифрой. Например, K2SO4– сульфат калия,Al(NO3)3– нитрат алюминия,CuCO3– карбонат меди (II).
При неполном замещении водорода в кислоте на металл образуются кислые соли. В этом случае кислотный остаток содержит один или два иона водорода, и соли называются в соответствии с названиями анионов, например, K2HPO4– гидрофосфат калия,KH2PO4– дигидрофосфат калия. Кислые соли образуют только многоосновные кислоты.
Основные соли являются продуктом неполного замещения гидроксид-ионов в основании на анионы кислотного остатка. В основных солях катион состоит из иона металла и одного или двух гидроксид-ионов. Если в состав катиона входит один гидроксид-ион, то к названию металла добавляется приставка гидроксо- , а если два, — то дигидроксо-, например CuOHCl– хлорид гидроксомеди (II),Al(OH)2NO3– нитрат дигидроксоалюминия. Основные соли образуют только многокислотные основания.
Помимо средних, кислых и основных солей, существуют также двойные, смешанные и комплексные соли, которые в данной работе не рассматриваются.
Кислоты, основания и соли — это электролиты. К неорганическим соединениям относится еще один класс соединений, которые не являются электролитами, — оксиды.
Оксидами называются вещества, состоящие из двух элементов, одним из которых является кислород.
Примеры оксидов: NO, NO2, Mn2O7, ZnO, K2O.
Названия оксидов образуются из слова “оксид” и названия элемента, образующего оксид, с указанием степени окисления этого элемента, которая записывается в скобках римской цифрой. Так, первые три из указанных оксидов называются: NO — оксид азота (П), NO2— оксид азота (IV), Mn2O7-оксид марганца (VII). В названиях последних трех оксидов не указывается степень окисления элемента, поскольку она постоянна для этих элементов: Al2O3— оксид алюминия, ZnO оксид цинка, K2O — оксид калия.
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные. К солеобразующим оксидам относятся такие оксиды, которые при взаимодействии с кислотами или основаниями, а иногда и с кислотами, и с основаниями образуют соль. Безразличные оксиды не реагируют ни с кислотами, ни с основаниями. К ним относятся NO, N2O, CO.
Солеобразующие оксиды способны образовывать соли. Они делятся на основные, кислотные и амфотерные.
Основные оксиды — это оксиды, которым соответствуют основания.
Так, оксиду натрия соответствует основание NaOH, а оксиду кальция CaO — основание Ca(OH)2.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Оксиду углерода (IV) — СО2 — соответствует угольная кислота Н2СО3, оксиду фосфора (V) — Р2О5— фосфорная кислота,H3PO4.
Кислотные оксиды иначе называются ангидридами соответствующих кислот, например, Р2О5– фосфорный ангидрид, СО2– угольный ангидрид.
Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислоте. Так, степень окисления углерода в СО2и Н2СО3равна +4, а степень окисления фосфора в Р2О5и Н3РО4равна +5.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства как кислоты, так и основания.
Так, оксид цинка ZnO — амфотерный оксид, ему соответствует амфотерный гидроксид Zn(OH)2, оксид хрома (III) — Cr(OH)3— тоже амфотерен, ему соответствует амфотерный гидроксид Cr(OH)3. Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
Неорганические соединения (оксиды, кислоты, основания и соли) вступают в многочисленные реакции между собой, которые можно проследить на примере методов получения этих соединений.
studfiles.net
Основы химии
Глава 1.
Общие химические и экологические закономерности.
С чего начинается химия?
Cложный ли это вопрос? На него каждый ответит по-своему.
В середней школе учащиеся изучают химию в течение ряда лет. Многие довольно хорошо сдают выпускной экзамен по химии. Однако…
Беседы с абитуриентами и затем и студентами первых курсов говорят о том, что остаточные знания по химии после средней школы незначительные. Одни путаются в различных определениях и химических формулах, а другие вообще не могут воспроизвести даже основные понятия и законы химии, не говоря уже о понятиях и законах экологии.
У них химия так и не начиналась.
Химия, по-видимому, начинается с глубокого освоения ее основ, и прежде всего, основных понятий и законов.
1.1. Основные химические понятия.
В таблице Д.И.Менделеева рядом с символом элемента стоят цифры. Одна цифра обозначает порядковый номер элемента, а вторая атомную массу. Порядковый номер имеет свой физический смысл. О нем мы будем вести разговор позже, здесь остановимся на атомной массе и выделим в каких единицах она измеряется.
Следует сразу оговориться, что атомная масса элемента, приведенная в таблице, величина относительная. За единицу относительной величины атомной массы принята 1/12 часть массы атома углерода, изотопа с массовым числом 12, и назвали ее атомной единицей массы /а.е.м./. Следовательно, 1 а.е.м. равна 1/12 части массы изотопа углерода 12 С. И она равна 1,667*10–27 кг. /Абсолютная масса атома углерода равна 1,99*10–26 кг./
Атомная масса , приведенная в таблице, является массой атома, выраженной в атомных единицах массы. Величина безразмерная. Конкретно для каждого элемента атомная масса показывает, во сколько раз масса данного атома больше или меньше 1/12 части массы атома углерода.
Аналогичное можно сказать и о молекулярной массе.
Молекулярная масса – это масса молекулы, выраженная в атомных единицах массы. Величина тоже относительная. Молекулярная масса конкретного вещества равна сумме масс атомов всех элементов, входящих в состав молекулы.
Важным понятием химии является понятие «моль». Моль – такое количество вещества, которое содержит 6,02*1023 структурных единиц /атомов, молекул, ионов, электронов и т.д./. Моль атомов, моль молекул, моль ионов и т.д.
Масса одного моля данного вещества называется его молярной /или мольной/ массой. Она измеряется в г/моль или кг/моль и обозначается буквой «М». Например, молярная масса серной кислоты МН2SO4 =98г/моль.
Следующее понятие «Эквивалент». Эквивалентом /Э/ называют такое весовое количество вещества, которое взаимодействует с одним молем атомов водорода или замещают такое его количество в химических реакциях. Следовательно, эквивалент водорода ЭН равен единице. /ЭН =1/. Эквивалент кислорода ЭО равен восьми /ЭО =8/.
Различают химический эквивалент элемента и химический эквивалент сложного вещества.
Эквивалент элемента – величина переменная. Она зависит от атомной массы /А/ и валентности /В/, которую элемент имеет в конкретном соединении. Э=А/В. Например, определим эквивалент серы в оксидах SO2 и SO3 . В SO2 ЭS =32/4=8, а в SO3 ЭS =32/6=5,33.
Молярную массу эквивалента, выраженную в граммах, называют эквивалентной массой. Следовательно, эквивалентная масса водорода МЭН =1г/моль, эквивалентная масса кислорода МЭО =8г/моль.
Химический эквивалент сложного вещества /кислоты, гидроксида, соли, оксида/– такое количество соответствующего вещества, которое взаимодействует с одним молем атомов водорода, т.е. с одним эквивалентом водорода или замещает такое количество водорода или любого другого вещества в химических реакциях.
Эквивалент кислоты /ЭК / равен частному от деления молекулярной массы кислоты на число атомов водорода, участвующих в реакции. Для кислоты H2 SO4 , когда оба атома водорода вступают в реакцию H2 SO4 +2NaOH=Na2 SO+2H2 O эквивалент будет равен ЭН2SO4 = МН2SO4 /nН =98/2=49
Эквивалент гидроксида /Эгидр. / определяется как частное от деления молекулярной массы гидроксида на число гидроксогрупп, вступающих в реакцию. Например, эквивалент NaOH будет равен: ЭNaOH =МNaOH /nОН =40/1=40.
Эквивалент соли /Эсоли / можно рассчитать, поделив ее молекулярную массу на произведение числа атомов металла, вступающих в реакцию, и их валентность. Так, эквивалент соли Al2 (SO4 )3 будет равен ЭAl2(SO4)3 =МAl2(SO4)3 /6=342/2,3=342/6=57.
Эквивалент оксида /Эок / можно определить, как сумму эквивалентов соответствующих элемента и кислорода. Например, эквивалент СО2 будет равен сумме эквивалентов углерода и кислорода: ЭСО2 =ЭС +ЭО =3+8=7.
Для газообразных веществ удобно пользоваться эквивалентными объемами /ЭV /. Так как при нормальных условиях моль газа занимает объем 22,4л, то исходя из этой величины, легко определить эквивалентный объем любого газа. Рассмотрим водород. Мольная масса водорода 2г занимает объем 22,4л, тогда его эквивалентная масса 1г занимает объем 11,2л /или 11200мл /. Следовательно ЭVН =11,2л. Эквивалентный объем хлора равен 11,2л /ЭVCl =11,2л/. Эквивалентный объем СО равен 3,56 /ЭVCО =3,56л/.
Химический эквивалент элемента или сложного вещества используется в стехиометрических расчетах обменных реакций, а в соответствующих расчетах окислительно–восстановительных реакций применяют уже окислительный и восстановительный эквиваленты.
Окислительный эквивалент определяют как частное от деления молекулярной массы окислителя на число электронов, которое он принимает в данной окислително–восстановительной реакции.
Восстановительный эквивалент равен молекулярной массе восстановителя поделенной на число электронов, которое он отдает в данной реакции.
Напишем окислително–восстановительную реакцию и определим эквивалент окислителя и восстановителя:
5N2 aS+2KMnO4 +8H2 SO4 =S+2MnSO4 +K2 SO4 +5Na2 SO4 +8H2 O
Окислителем в этой реакции является перманганат калия. Эквивалент окислителя будет равен массе KMnO4 деленной на число электронов, принятых окислителем в реакции (nе=5). ЭKMnO4 =МKMnO4 /nе=158/5=31,5. Молярная масса эквивалента окислителя KMnO4 в кислой среде равна 31,5г/моль.
Эквивалент восстановителя Na2 S будет: ЭNa4S =МNa4S /nе=78/2=39. Молярная масса эквивалента Na2 S равна 39г/моль.
В электрохимических процессах, в частности при электролизе веществ, пользуются электрохимическим эквивалентом. Электрохимический эквивалент определяют как частное от деления химического эквивалента вещества, выделяемого на электроде, на число Фарадея /F/. Электрохимический эквивалент более подробно будет рассмотрен в соответствующем параграфе курса.
Валентность . При взаимодействии атомов между ними образуется химическая связь. Каждый атом может образовывать только определенное количество связей. Количество связей предопределяет такое уникальное свойство каждого элемента, которое называют валентностью. В наиболее общем виде валентностью называют способность атома образовывать химическую связь. За единицу валентности принимают одну химическую связь, которую способен образовать атом водорода. В связи с этим, водород является одновалентным элементом, а кислород – двухвалентным, т.к. с атомом кислорода могут образовывать связь не более двух водородов.
Умение определять валентность каждого элемента, в том числе и в химическом соединении, является необходимым условием успешного усвоения курса химии.
С валентностью соприкасается и такое понятие химии как степень окисления . Подстепенью окисления понимают тот заряд, который имеет элемент в ионном соединении или имел бы в ковалентном соединении, если бы общая электронная пара бала бы полностью смещена к более электроотрицательному элементу. Степень окисления имеет не только цифровое выражение, но и соответствующий знак заряда (+) или (–). Валентность не имеет этих знаков. Например, в H2 SO4 степень окисления: водорода +1, кислорода –2, серы +6, а валентность, соответственно, будет 1, 2, 6.
Валентность и степень окисления в числовых значениях не всегда совпадают по величине. Например, в молекуле этилового спирта СН3 –СН2 –ОН валентность углерода 6, водорода 1, кислорода 2, а степень окисления, например, углерода первого –3, второго –1: –3 СН3 ––1 СН2 –ОН.
1.2. Основные экологические понятия.
За последнее время понятие “экология” глубоко входит в наше сознание. Это понятие, введенное еще в 1869г Э.Геккелем /происходит от греческого oikos – дом, место, жилище, logos – учение/ все больше и больше тревожит человечество.
В учебниках биологии экологию определяют как науку о взаимоотношениях живых организмов и среды их обитания. Практически созвучное определение экологии дает Б.Небел в своей книге «Наука об окружающей среде» – Экология – наука о различных аспектах взаимодействия организмов между собой и с окружающей средой. В других источниках можно встретить и более широкое толкование. Например, Экология – 1/. Наука, изучающая отношение организмов и их системных совокупностей и окружающей среды; 2/. Совокупность научных дисциплин, исследующих взаимоотношение системных биологических структур /от макромолекул до биосферы/ между собой и с окружающей средой; 3/. Дисциплина, изучающая общие законы функционирования экосистем различного иерархического уровня; 4/. Комплексная наука, исследующая среду обитания живых организмов; 5/. Исследование положения человека как вида в биосфере планеты, его связей с экологическими системами и воздействие на них; 6/. Наука о выживании в окружающей среде. /Н.А.Агиджанян, В.И.Торшик. Экология человека./. Однако под термином «экология» понимают не только экологию как науку, а само состояние окружающей среды и его влияние на человека, животный и растительный мир.
mirznanii.com
Основные понятия химии — Викиверситет
Химияw — это наука о веществах, их свойствах, строении и превращениях, происходящих в результате химических реакцийw, а также о законах, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям между ними способны формировать молекулы, то химия занимается в основном изучением взаимодействий между атомами и молекулами, полученными в результате таких взаимодействий.
Веществоw — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Атом — мельчайшая, химически неделимая, электронейтральная частица вещества. Состоит из ядра и электронной оболочки.
Каждый атом принадлежит определённому химическому элементуw. Элемент имеет название, порядковый номер, и положение в периодической таблице Менделеева. В настоящее время известно 118 химических элементов, заканчивая Uuo (Ununoctium — унуноктийw). Каждый элемент обозначен символом, который представляет одну или две буквы из его латинского названия (водородw обозначен буквой H — первой буквой его латинского названия Hydrogenium).
Валентностьw — количество химических связей, которое образует один атом.
Молекулаw — наименьшая частица вещества, сохраняющая его химические свойства. Состоит из атомов.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойстваw — признаки вещества, при характеристике которых вещество не изменяет свой химический состав (плотность, агрегатное состояние, температуры плавления и кипения и т. п.)
Химические свойстваw — способность веществ взаимодействовать с другими веществами или изменяться под действием определённых условий. Результатом является превращение одного вещества или веществ в другие вещества.
Агрегатные состояния веществаw — состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем). Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазмуw. Существуют и другие агрегатные состояния, например, жидкие кристаллыw или конденсат Бозе — Эйнштейнаw.
Мольw — мера количества вещества, содержащая Число Авогадроw (NA ≈ 6,02 × 1023) любых структурных частиц. (NA — количество атомов в 12 грам
ru.wikiversity.org
Краткий курс неорганической химии
Краткий курс повторения неорганической химии.
Автор: учитель химии и биологии Петухова Г.А.
Химия- наука о веществах, их свойствах и превращениях.
Классификация неорганических веществ.
Металлы— Li,Na,K,Rb,Cs,Cu,Ag,Mg,Ca,Zn,Ba,Hg,Al,Fe,Co,Ni,W Неметаллы: H2, Be, B, C, Si, N2, P,As, O2, S, Se, F2, Cl2, Br2, J2 , As, He, Ne, Ar, Kr, Xe Вещества сложные: 1) Оксиды и типы оксидов: несолеобразующие – CO, NO, N2O; кислотные оксиды: В2О3, СО2, SiO2, N2O3, N2O5, P2O5, SO2, SO3, CrO3, Mn2O7; основные оксиды:Li2O, Na2O, K2O, CuO, MgO, CaO, BaO, MnO, FeO, CrO; амфотерные оксиды: Al2O3, ZnO, Fe2O3, Mn2O3, Cr2O32) Основания – 2 типов: щелочи— растворимые в воде основания: LiOH, NaOH, KOH, Ba(OH)2, Ca(OH)2, Mg(OH)2не растворимые в воде основания: Zn(OH)2, Cu(OH)2, Pb(OH)2, Fe(OH)2,Fe(OH)3, Al(OH)33) Кислоты – HCl (соляная или хлороводородная), HCIO4 (хлорная), HNO2(азотистая), HNO3 (азотная),H2S (сероводородная), H2SO3 (сернистая),H2SO4(серная),H2CO3(угольная), H2SiO3(кремневая), H3PO4(фосфорная или ортофосфорная),HMnO4(марганцовая), HF(плавликовая или фтороводородная), HBr (бромоводородная), HJ (иодоводородная), H3BO3 (борная), H2ZnO2(цинковая), HAlO2 (алюминиевая),H2CrO4(хромовая) 4) Соли – МеCI(хлориды), MeCIO4(хлораты), MeNO2(нитриты), MeNO3(нитраты), MeS (сульфиды), MeSO3(сульфиты) MeSO4(сульфаты), MeCO3(карбонаты), MeSiO3(силикаты), MePO4(фосфаты или ортофосфаты), MeF (фториды), MeBr(бромиды), MeJ (иодиды), MeBO3(бораты), MeZnO2 (цинкаты), MeAIO2 (алюминаты), MeCrO4(хроматы)
Химические свойства веществ:
1) Металл (от Li….до Hg в ряду активности металлов) + О2 = основной оксид 4Li + O2 =2 Li2O; 4Al + 3O2= 2Al2O3
2) Основной оксид +вода = основание Na2O + 2H2O=2NaOH MgO+ H2O=Mg(OH)2; Fe2O3+3 H2O= 2Fe(OH)3
3) Основной оксид+кислотный оксид = соль CaO+ SO3=CaSO4 K2O+N2O5=2KNO3
4) Основной оксид+кислота = соль+вода 3Na2O + 2H3PO4=2Na3 PO4+ 3H2O 5) Неметалл+ О2 = кислотный оксид 6) Кислотный оксид+вода = кислота 7) Кислотный оксид +щелочь = соль+вода
8) Кислота+ Ме (от Li….до Pb в ряду ак-ти металлов) = соль+ H2 исключение: Cu, Hg, Ag реагируют с конц. и разб. HNO3, конц. H2SO4 при нагревании: Cu+ 2H2SO4 (конц.) = CuSO4 +SO2+2H2O 3Cu+8HNO3(разб.) = 3Cu(NO3)2+2NO +4H2O Cu+4HNO3конц.=Cu(NO3)2+2NO2 +2H2O; (Pt, Au c «цар. водкой») 9) кислота+основание =соль+вода (реакция нейтрализации)
10) кислота+соль = новая кислота+новая соль 11) основание (щелочь) + соль = новое основание + новая соль 12) нераств. основание = основной оксид + вода 13) соль+соль = новая соль + новая соль 14) нераств соль = основной оксид + вода 15) соль + металл (более активный, чем металл в составе соли) = новая соль + металл
Генетическая связь веществ: Металл- основной оксид- основание- соль (Na -Na2O –NaOH – Na2SO3) Неметалл – кислотный оксид – кислота – соль ( S – SO2 – H2SO3 — Na2SO3) Типы химических связей:
1) Ковалентная неполярная – атомы в молекуле одинаковы:N2, O2, O3, CI2,Br2, J2,F2 (ЭО одинакова) 2)Ковалентная полярная — атомы в молекуле состоят из разных атомов неметаллов – ЭО отличается незначительно, появляется смещение электронной пары к более ЭО элементу — кислотные оксиды, например: N2O5, P2O5, SO2, Н2О , все кислоты Н2S, HCl 3)ионная связь— между ионами: металла и неметалла- ЭО резко отличается, металл отдает электрон неметаллу (основные оксиды СаО, щелочи, н-р NaOH, соли н-р, NaCI 4)металлическая связь Кристалличесие решетки:
1)атомные – в узлах атомы, это вещества с ковалентной связью, с высокой температурой плавления, твердые- алмаз, графит (С), SiO22)молекулярные- в узлах молекулы, это газы, жидкости, низкая тем. пл. и кипения, хрупкие (иод), твердые — сера 3) ионные, с высокой темпер. плавления, твердые –это соли 4) металлические
Получение газов:
Кислород разложение перманганата калия при нагревании: 2КМnO4= К2 МnO4 +MnO2 + О2(выт-ем воздуха или воды, в сосуд, расположенный вниз дном, проверка- тлеющая лучина загорается). Водород получают: цинк + кислота, пробирка перевернута вверх дном, Н2 горит со звуком «па» Zn+ 2HCl= ZnCI2+Н2Аммиак NH3 получают, собирая в пробирку вверх дном, нагревая соль аммония и твердую щелочь, выт-ем воздуха, лакмус синеет, среда щелочная 2NH4CI+Ca(OH)2=CaCI2+2NH3+2H2O; Углекислый газ СО2мрамор + кислота СаCO3+ 2HCl=CaCI2+ H2O+СО2 лучина гаснет, пробирка вниз дном, помутнение известковой воды.
Строение атома
Атом состоит из из: ( +) ядра и (- ) электронов, образующих электронную оболочку атомов. Масса ядра атома зависит от числа протонов и нейтронов, а его заряд- только от числа протонов. Число нейтронов= атомная масса – порядковый номер элемента.
Порядковый номер элемента = заряду ядра, общему числу электронов (e). Электроны распределены по энергетическим уровням, число которых совпадает с номером периода. +1Н 1е; +2 Нe 2e,+3Li 2e1e, +4Be 2e2e, +5B 2e3e, +6C 2e4e, +7N 2e5e, +8O 2e6e, +9F 2e7e, +10Ne 2e8e, +11Na 2e8e1e, +12 Mg 2e8e2e, +13AI 2e8e3e, +14 Si 2e8e4e, +15 P 2e8e5e, +16 S 2e8e6e, +17CI 2e8e7e, +18Ar 2e8e8e, +19 K 2e8e8e1e, +20Ca 2e8e8e2e
Число внешних электронов совпадает с номером группы
в периоде: слева на право 1) возрастает число электронов на внешнем энергетическом уровне 2) увеличивается заряд ядра 3) число энергетических уровней не меняется 4)уменьшается радиус атома, в результате металлические свойства элементов ослабевают, а неметаллические усиливаются, например, во 2 периоде К –щелочной металл, Ве- амфотерный, а остальные неметаллы. В начале периодов элементы образуют основные оксиды, потом амфотерные, заканчиваются кислотными.
В главных подгруппах: 1)число электронов на внешнем энергетическом уровне одинакова 2)число энергетических уровней увеличивается 3)радиус атома увеличивается, в результате усиливаются металлические свойства, а неметаллические ослабевают, например, в 1 гр. главной подгруппе металлические свойства от Li к Cs усиливаются.
Качественные реакции.
1)Чтобы определить соли, содержащие катион бария Ва2+, надо добавить анион сульфата SO42—, образуется белый осадок BaSO4
2) на анион хлора CI— — катион серебра Ag+, белый осадок AgCI
3)на катион меди Сu2+ нужна щелочь, н-р, NaOH, образуется голубой студенистый осадок гидроксида меди Cu(OH)2
4)на карбонаты МеСО3 – кислота, образуется углекислый газ СО2 в виде пены, при пропускании его через прозрачный раствор известковой воды Са(ОН)2 наблюдается помутнение, т.к. образуется карбонат кальция. СаCO3+ 2HCl=CaCI2+ H2O+ СО2 5)кислоту и щелочь определяем по изменению цвета индикаторов: в кислоте лакмус краснеет, а в щелочи синеет, фенолфталеин в кислоте прозрачный, а в щелочи малиновый. В нейтральных средах (соли, образуемые щелочью и сильной кислотой, н-р, Na2SO4, KNO3, LiCI и в воде) индикаторы не меняет цвета.
6)на ион железа –щелочь, будет зеленый осадок гидроксида железа, цинк с щелочью — белый осадок, алюминий с щелочью- белый желеобразный осадок, на соли аммония –щелочь, выделится газ с резким запаха аммиака NH3
7)на фосфат действуем ионом Ag+, образуется желтый осадок фосфата серебра 3AgNO3 +H3PO4=Ag3 PO4+3HNO3
Соли, имеющие кислую среду, в своем составе имеют анион сильной кислоты, а катион нерастворимого основания н-р, СuSO4, Fe (NO3)2, AgCI, ZnF2, Pb SO4, —лакмус красный
Соли, имеющие щелочную среду, в своем составе имеют катион щелочи, анион слабой кислоты, н-р, К2СО3, Na2S, Li2SO3, CaSiO3, Mg3(PO4)2, (NH4)2SO3, лакмус синеет, фенолфталеин малиновый
Решение химических задач
1) Расчет массовой доли элемента в веществе. Определить массовую долю алюминия в его оксиде. Сначала расчитаем молекулярную массу вещества по таблице Менделеева (сумма атомных масс), потом атомную массу умножаем на число атомов элемента и делим на молекулярную массу вещества. Mr (AI2O3)=27х2+16х3=102 w(AI)=27х2:102=0,53 или 53% 2)Расчет массовой доли вещества в растворе в 100г воды растворили 15 г гидроксида натрия. Какой будет массовая доля растворенного вещества в растворе? Определяем массу раствора= масса воды+ масса растворенного вещества, т.е. m(р-ра)=m(Н2О) + m(NaOH)=100г +15г=115г w(NaOH)= m(NaOH): m(р-ра) = 15: 115=0,13 или 13%
3)Определить количество вещества кислорода, необходимого для окисления 7 моль оксида серы (IV)
2SO2+O2=2SO3 по уравнению реакции 2 моль SO2взаимодействует с 1 моль О2 по условию задачи 7 моль SO2взаимодействует с х моль О2 х=7моль х1 моль :2 моль= 3,5 моль кислорода.
4)Какой объем оксида углерода (II) требуется для полного восстановления 0,2 моль оксида железа(III)
3СО+ Fe2O3=2Fe+3CO2 по уравнению реакции: 3моль COвзаимодействует с 1 моль Fe2O3 по условию задачи: х моль СOвзаимодействует с 0,2 моль Fe2O3 х = 0,6 моль; V(CO)=Vm x n(CO)=22,4л\моль х 0,6 =13,44л
5)Определить массу оксида алюминия, образовавшегося при взаимодействии с кислородом 12 моль алюминия
4AI+3O2=2 AI2O3 по ур-ю 4 моль AI —2 моль AI2O3 по условию задачи 12моль AI —-х моль AI2O3 х=6 моль молярная масса М( AI2O3 )=102 г\моль m ( AI2O3 )=6 х 102=612г
6)Какой объем углекислого газа образуется при разложении 400г карбоната кальция? CaCO3=CaO+CO2 молярная масса М(CaCO3)=40+12+16х3=100 х (CaCO3)= m CaCO3 : М(CaCO3)= 400 г:100г\моль=4 моль по урав-ию: 1 моль— 1 моль по условию 4 моль—- х моль х=4 моль (CO2) V=Vm . n (CO2) =22,4л\моль х 4 моль=89,6 л (CO2)
7)Определите массу осадка, образовавшегося при сливании 520г 12% раствора хлорида бария с серной кислотой
BaCI2+Н2 SO4= BaSO4+2НCI а) определим массу хлорида бария в растворе, для этого массу раствора умножаем на массовую долю растворенного вещества: m(BaCI2)=mр-ра (BaCI2). w(BaCI2)= 0,12х520г=62,4г
б) определяем количество данного вещества: n(BaCI2) = m (BaCI2) :М (BaCI2) =62,4г :208г\моль =0,3 моль
по таблице Менделеева М(BaCI2)=208, М (BaSO4)= 233 по уравнению 1 моль BaCI2 —1 моль BaSO4 по условию 0,3 моль BaCI2 —х моль BaSO4 х=0,3 моль BaSO4 в) определяем массу осадка BaSO4 m=0,3х233г\моль=69,9г
Использованная литература.
1. Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 9 класс.: Методическое пособие. – М.: Дрофа, 2003г.
2. Химия 9 класс.: Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия.9»/ О.С. Габриелян, П.Н. Берёзкин, А.А. Ушакова и др. – М.: Дрофа, 2010.
3. Габриелян О.С., Смирнова Т.В. Изучаем химию в 9 кл.: Дидактические материалы. – М.: Блик плюс, 2004.
«
»aplik.ru
