Классификация растворов в химии :: SYL.ru
Растворами принято называть однородные смеси, состоящие минимум из двух компонентов. Один из них — растворитель. Он задает агрегатное состояние раствора и, как правило, составляет большую часть его массы. При этом в системе может содержаться одновременно несколько растворителей и растворенных веществ. Классификация растворов достаточно обширна. Разделение их на виды может быть основано на различных характеристиках.
Классификация растворов по природе растворителя
В данном случае растворы подразделяются на водные и неводные. Вода — наиболее распространенный и универсальный растворитель на планете, однако она способна растворить не все вещества. При выборе растворителя часто руководствуются так называемым правилом подобия. Заключается оно в том, что в водной среде лучше растворяются вещества неорганической природы. Для растворения органических соединений же необходимо применять особые органические растворители, например бензол, хлороформ или спирты.
По размеру частиц растворенного вещества
Наиболее общий принцип классификации. В данном случае выделяют два типа систем: истинные и коллоидные.
В первом случае растворенное вещество находится в виде отдельных атомов и молекул. Размеры этих частиц настолько малы, что их невозможно различить визуально или при помощи оптического микроскопа. Истинными являются, например, водные растворы поваренной соли, сахара или уксусной кислоты. Основным их отличительным признаком является отсутствие помутнений.
В коллоидных системах растворенное вещество содержится в виде агрегатов достаточно большого размера (от 1 до 1000 нм), которые заметны невооруженным взглядом. Свет, проходящий сквозь такой раствор, конусообразно рассеивается. Это явление получило название эффекта Тиндаля.

Классификация коллоидных систем
В свою очередь, коллоидные системы принято разделять на типы в зависимости от агрегатного состояния растворителя и растворенного вещества. В таблице ниже приведена их классификация. Агрегатное состояние растворителя указано по вертикали, а растворенного вещества — по горизонтали.
| Твердое | Жидкое | Газообразное | |
| Твердое | Сплав, керамика, композитные материалы | Капиллярные системы (например, почва) | Пористые тела (пемза) |
| Жидкое | Суспензия (известка), гель | Эмульсия (молоко) | Пена |
| Газообразное | Аэрозоли (дым) | Аэрозоли (туманы, облака) | — |

Дым представляет собой раствор твердых частиц углерода в воздухе.

При смешивании воды с маслом образуется еще один вид дисперсных систем — эмульсии. Как правило, они достаточно быстро расслаиваются. При необходимости в эмульсии добавляются специальные вещества-стабилизаторы.

Еще один довольно необычный пример раствора — морская пена. Причем ее можно рассматривать с двух точек зрения: как раствор воздуха в воде (на этом основано пенообразование как таковое) и как истинный водный раствор минеральных солей.
Классификация истинных растворов
Примерами истинных являются водные растворы соли, соды, сахара, уксусной кислоты и т. д. Их принято классифицировать в зависимости от концентрации растворенного вещества. По этому признаку выделяют три вида растворов в химии.
Если при данных условиях (температуре, давлении) можно растворить большее количество вещества, чем уже содержится в растворе, он называется ненасыщенным.
Насыщенный раствор содержит максимально возможное в условиях проведения эксперимента количество растворенного вещества.
Если же в растворе содержится больше вещества, чем в насыщенном, такая система называется пересыщенной. Получить ее можно при очень медленном и аккуратном охлаждении насыщенного раствора, приготовленного при более высокой температуре.
Пересыщенные растворы крайне неустойчивы. При нарушении равновесия моментально начинается процесс кристаллизации избыточно содержащегося растворенного вещества. Инициировать выпадение осадка может добавление маленького кристалла вещества, попадание инородного тела (например, пыли) или встряхивание раствора.

Классификация по степени насыщенности
Довольно распространен другой принцип разделения растворов на виды. Так, в зависимости от концентрации раствора, можно выделить два типа: разбавленные и концентрированные. Однако граница между ними весьма условна.
Разбавленный раствор характеризуется низким содержанием растворенного вещества. При этом его нельзя отождествлять с ненасыщенным.
Например, раствор, содержащий всего лишь 0,0000134 моль/л хлорида серебра, является разбавленным, так как концентрация растворенного вещества в нем очень мала. Однако при обычных условиях растворить большее количество соединения в нем невозможно, а потому такой раствор одновременно будет насыщенным.
По физическим свойствам
Довольно часто вещества и их растворы классифицируют по способности проводить электрический ток. Ею обладают растворы веществ с ионной связью в молекулах. Под действием молекул воды эти соединения способны подвергаться электролитической диссоциации на ионы. Такие вещества и их растворы получили название электролитов. Примеры электролитов: растворы хлорида натрия, серной кислоты, бромида калия.
Органические вещества, как правило, находятся в растворе в виде нейтральных молекул или же малодиссоциированы. Такие системы не способны проводить ток и называются неэлектролитами.

Таким образом, классификация растворов обширна и разнообразна. Тип ее выбирается в зависимости от конкретных целей.
www.syl.ru
Классификация растворов в химии
Растворами принято называть однородные смеси, состоящие минимум из двух компонентов. Один из них — растворитель. Он задает агрегатное состояние раствора и, как правило, составляет большую часть его массы. При этом в системе может содержаться одновременно несколько растворителей и растворенных веществ. Классификация растворов достаточно обширна. Разделение их на виды может быть основано на различных характеристиках.
Классификация растворов по природе растворителя
В данном случае растворы подразделяются на водные и неводные. Вода — наиболее распространенный и универсальный растворитель на планете, однако она способна растворить не все вещества. При выборе растворителя часто руководствуются так называемым правилом подобия. Заключается оно в том, что в водной среде лучше растворяются вещества неорганической природы. Для растворения органических соединений же необходимо применять особые органические растворители, например бензол, хлороформ или спирты.
По размеру частиц растворенного вещества
Наиболее общий принцип классификации. В данном случае выделяют два типа систем: истинные и коллоидные.
В первом случае растворенное вещество находится в виде отдельных атомов и молекул. Размеры этих частиц настолько малы, что их невозможно различить визуально или при помощи оптического микроскопа. Истинными являются, например, водные растворы поваренной соли, сахара или уксусной кислоты. Основным их отличительным признаком является отсутствие помутнений.
В коллоидных системах растворенное вещество содержится в виде агрегатов достаточно большого размера (от 1 до 1000 нм), которые заметны невооруженным взглядом. Свет, проходящий сквозь такой раствор, конусообразно рассеивается. Это явление получило название эффекта Тиндаля.

Классификация коллоидных систем
В свою очередь, коллоидные системы принято разделять на типы в зависимости от агрегатного состояния растворителя и растворенного вещества. В таблице ниже приведена их классификация. Агрегатное состояние растворителя указано по вертикали, а растворенного вещества — по горизонтали.

Дым представляет собой раствор твердых частиц углерода в воздухе.

При смешивании воды с маслом образуется еще один вид дисперсных систем — эмульсии. Как правило, они достаточно быстро расслаиваются. При необходимости в эмульсии добавляются специальные вещества-стабилизаторы.

Еще один довольно необычный пример раствора — морская пена. Причем ее можно рассматривать с двух точек зрения: как раствор воздуха в воде (на этом основано пенообразование как таковое) и как истинный водный раствор минеральных солей.
Классификация истинных растворов
Примерами истинных являются водные растворы соли, соды, сахара, уксусной кислоты и т. д. Их принято классифицировать в зависимости от концентрации растворенного вещества. По этому признаку выделяют три вида растворов в химии.
Если при данных условиях (температуре, давлении) можно растворить большее количество вещества, чем уже содержится в растворе, он называется ненасыщенным.
Насыщенный раствор содержит максимально возможное в условиях проведения эксперимента количество растворенного вещества.
Если же в растворе содержится больше вещества, чем в насыщенном, такая система называется пересыщенной. Получить ее можно при очень медленном и аккуратном охлаждении насыщенного раствора, приготовленного при более высокой температуре.
Пересыщенные растворы крайне неустойчивы. При нарушении равновесия моментально начинается процесс кристаллизации избыточно содержащегося растворенного вещества. Инициировать выпадение осадка может добавление маленького кристалла вещества, попадание инородного тела (например, пыли) или встряхивание раствора.

Классификация по степени насыщенности
Довольно распространен другой принцип разделения растворов на виды. Так, в зависимости от концентрации раствора, можно выделить два типа: разбавленные и концентрированные. Однако граница между ними весьма условна.
Разбавленный раствор характеризуется низким содержанием растворенного вещества. При этом его нельзя отождествлять с ненасыщенным.
Например, раствор, содержащий всего лишь 0,0000134 моль/л хлорида серебра, является разбавленным, так как концентрация растворенного вещества в нем очень мала. Однако при обычных условиях растворить большее количество соединения в нем невозможно, а потому такой раствор одновременно будет насыщенным.
По физическим свойствам
Довольно часто вещества и их растворы классифицируют по способности проводить электрический ток. Ею обладают растворы веществ с ионной связью в молекулах. Под действием молекул воды эти соединения способны подвергаться электролитической диссоциации на ионы. Такие вещества и их растворы получили название электролитов. Примеры электролитов: растворы хлорида натрия, серной кислоты, бромида калия.
Органические вещества, как правило, находятся в растворе в виде нейтральных молекул или же малодиссоциированы. Такие системы не способны проводить ток и называются неэлектролитами.

Таким образом, классификация растворов обширна и разнообразна. Тип ее выбирается в зависимости от конкретных целей.
www.nastroy.net
Классификация растворов.
I.Растворы классифицируются по агрегатному состоянию растворителя и растворенного вещества.
Растворы могут быть жидкими, твердыми и газовыми.
Растворителемможет быть твердое вещество, жидкость и газ.
Практически все газы друг в друге растворяются. В жидкостях растворяются жидкости, газы и твердые вещества. В твердых телах растворяются только твердые тела. В твердых растворах происходит образование гомогенной системы из твердых компонентов.
Газовые растворы– это растворы
газов, жидкостей и твердых тел в газах.
В пределе при нулевом давлении любой
реальный газ представляет систему
независимых друг от друга частиц, т.е.
обладает признаками идеальной системы.
Смесь этих газов, называемая
идеальным
газом, подчиняетсязакону Дальтона: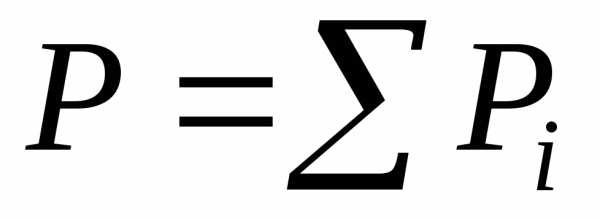 (гдеР– общее давление;Рi– парциальное давлениеi-го
компонента). С повышением давления
появляется взаимодействие между
частицами, тогда смесь реальных газов,
паров жидкости и твердых тел рассматривают
как газовый раствор.
(гдеР– общее давление;Рi– парциальное давлениеi-го
компонента). С повышением давления
появляется взаимодействие между
частицами, тогда смесь реальных газов,
паров жидкости и твердых тел рассматривают
как газовый раствор.
Наибольшее распространение получили жидкие, в частности,водные растворы. В случае растворов «жидкость – газ» и «жидкость – твердое тело» растворителем принято считать жидкость. У растворов «жидкость – жидкость» растворителем считают компонент, который находится в избытке по сравнению с другими компонентами, именуемых растворенными веществами.
Количество вещества, растворенного в данном объеме растворителя, называется концентрацией.
Способы выражения концентраций:
1)Молярная концентрация М (или молярность) – число молей вещества, растворенного в 1 м3 (или литре) раствора:
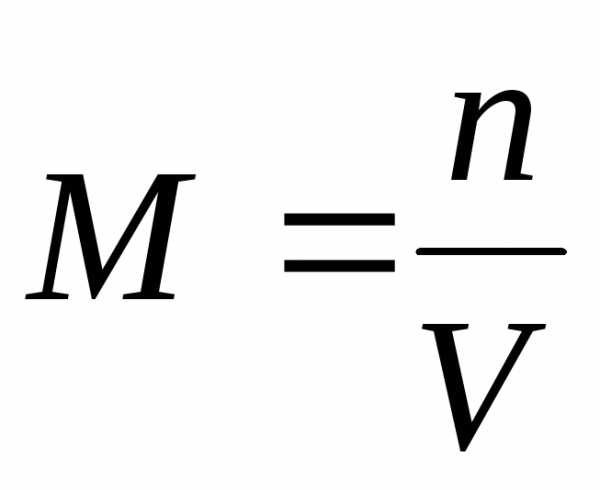
2)Моляльная концентрация т (или моляльность) – число молей растворенного вещества в 1 кг или 1000 г растворителя:
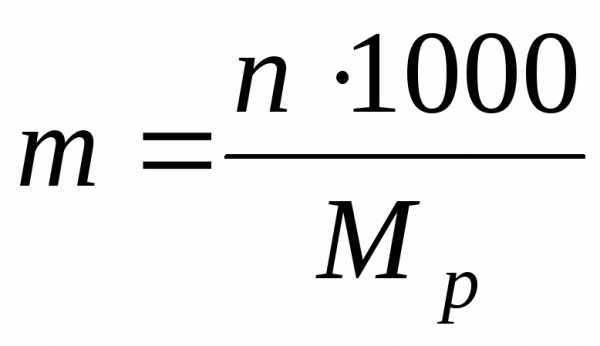
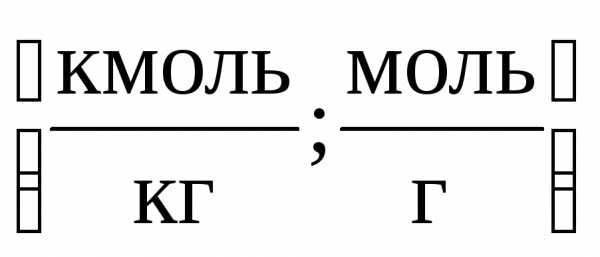
где M
p – масса растворителя.3)Процентная концентрация ω определяется количеством граммов вещества в 100 г (весовые) или 100 мл (объемные) раствора:
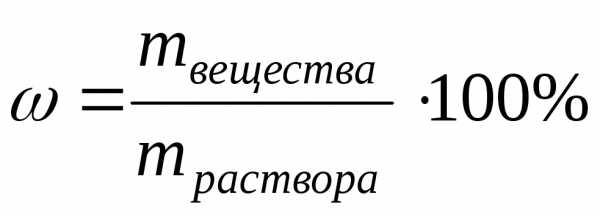 или
или

4)Мольная доляN – отношение числа молейniодного компонента к суммарному числу молейnвсех компонентов раствора:
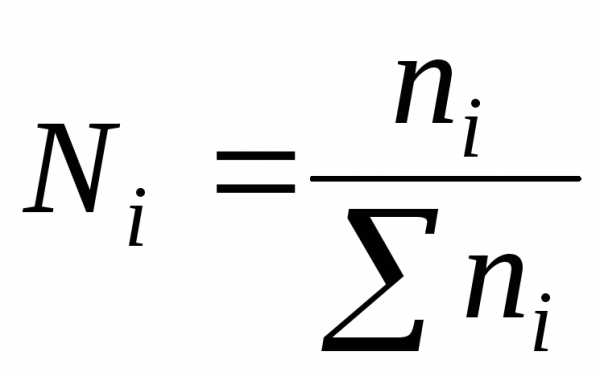
Сумма мольных долей всех компонентов раствора равна единице:
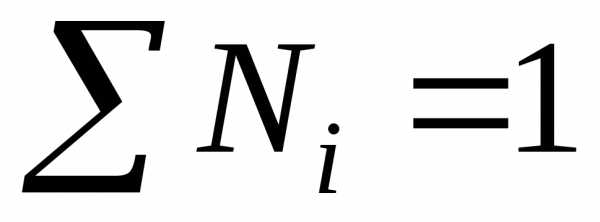
Пример.Проведем расчет М,mиNпо известной массовой концентрации серной кислотыω=98%,плотность раствора равна 1,84 г/л; молярные массы компонентов раствора равныг/моль;г/моль.
Молярность раствора равна:
Моляльность раствора составляет:
Мольная доля серной кислоты равна:
II.Растворы подразделяются также по степени взаимодействия растворителя и растворенного вещества.
-
Растворы
идеальные
предельно разбавленные
реальные
(неидеальные)
Идеальными раствораминазываются такие растворы, у которых сила взаимодействия между одноименными и разноименными молекулами одинакова.
А – растворенное вещество, fA—A
В – растворитель, fВ-ВРаствор АВ fA—A= fВ-В= fA-В
В идеальных растворах энергия взаимодействия молекул разных компонентов одна и та же; все молекулы раствора (растворенных веществ и растворителя) обладают одинаковым силовым полем, а объемы молекул всех компонентов равны. В идеальном жидком растворе, в отличие от идеального газа, между молекулами существует взаимодействие. Одинаковая энергия взаимодействия всех молекул в растворе приводит к их равномерному распределению в объеме. Поэтому энтропия смешения компонентов идеального раствора ΔSравна энтропии смешения идеального газаΔSи.г..
Одинаковый объем всех молекул обуславливает неизменность объема системы при образовании идеального раствора. Тепловой эффект при этом образовании идеального раствора равен нулю. В связи с этим можно дать другое определение идеальных жидких растворов.
ΔV=0; ΔH=0; ΔS=ΔSи.г.
Объем и энтальпия идеальных растворов аддитивны и зависят от состава раствора.
Следует иметь в виду, что идеальными могут считаться растворы, когда выполняются все вышеперечисленные условия и, кроме того, должны быть равны парциальные давления компонентов, у них должны быть одинаковая температура и одно и то же агрегатное состояние.
Идеальные растворы потому и называются идеальными, что они не существуют в действительности. Однако имеется значительное число растворов, близких по свойствам к идеальным растворам. К ним относятся разбавленные растворы.
Энергия Гиббса i-го компонента идеального раствора численно равна химическому потенциалу и может быть представлена следующим образом:
Когда ∆Hi =0, химический потенциалi-го компонента в идеальном растворе равен:
, где
µi , µip–химические потенциалыi-го индивидуального компонента в растворе;Ni –мольная доляi-го компонента.
Продифференцируем данное уравнение и получим:
В связи с тем, что получаем:
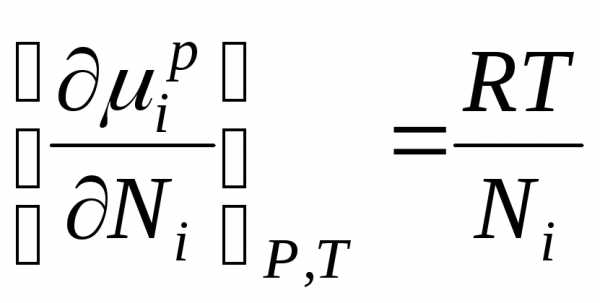
Это уравнение показывает соотношение между химическим потенциалом компонентов идеального раствора и его составом, определяемым мольной долей компонентов раствора.
Рассмотрим предельно разбавленные растворы, которые часто называют просто разбавленными.Предельно разбавленными раствораминазываются такие растворы, у которых растворитель подчиняется законом идеальных растворов, а растворимое вещество – законам реальных растворов.
Концентрация растворенного вещества в разбавленном растворе бесконечно мала, поэтому взаимодействием между его молекулами можно пренебречь. Тогда предельно разбавленные растворы можно описать закономерностями и уравнениями, которые справедливы для идеальных растворов.
Неидеальными (реальными) раствораминазываются такие растворы, у которых силы взаимодействия между одноименными и разноименными молекулами различны.
Раствор АВ fA—A≠ fВ-В≠ fA-В
Реальные растворы не подчиняются закономерностям идеальных и предельно разбавленных растворов. Однако, введя вспомогательные величины, свойства неидеальных растворов тоже можно выразить через закономерности идеальных растворов.
studfiles.net
§ 1. Растворимость
Раствор – однофазная гомогенная система, состоящая из двух или более компонентов, а также продуктов их взаимодействия, состав которой может непрерывно меняться в пределах, ограниченных взаимной растворимостью веществ.
Вещество называют
Растворимостью называют, как способность вещества образовывать раствор с данным растворителем, так и количественную характеристику этой способности. Качественно растворимость характеризуется понятиями «хорошо растворимо», «мало растворимо», «нерастворимо». Количествен-ной мерой растворимости является масса вещества в граммах, которая способна раствориться в 100 г растворителя при данной температуре с образованием насыщенного раствора.
Раствор называется насыщенным, если в нем находится предельное при данных условиях количество растворенного вещества. Если в растворе содержится больше растворенного вещества, чем это определяется растворимостью, раствор называется пересыщенным, а если меньше – ненасыщенным.
§ 2. Способы выражения состава растворов
Важнейшей характеристикой раствора является количественное содержание растворенных веществ. На практике состав раствора принято выражать с помощью следующих величин:
1. Массовая доля растворенного вещества w2 (иначе процентная массовая концентрация) – отношение массы растворенного вещества m2 к массе раствора m
(1)
Здесь и далее у величин, относящихся к растворителю, применяется индекс «1», индекс «2» относится к растворенному веществу, а отсутствие индекса указывает на свойство раствора как целого.
Это безразмерная величина, выраженная в долях единицы или в процентах, % масс. Таким образом, w2 показывает, сколько грамм растворенного вещества содержится в ста массовых частях раствора.
2. Моляльная концентрация вещества Сm (иначе моляльность раствора) – отношение числа моль растворенного вещества n2 к массе растворителя m1 в килограммах
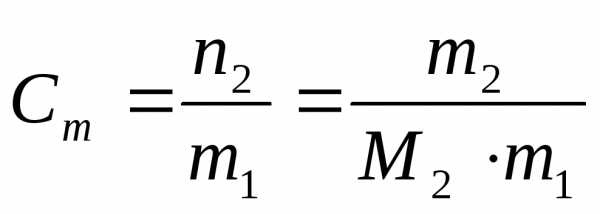 ,
(2)
,
(2)
где М2 – молярная масса растворенного вещества, г/моль.
Если массу растворителя выражать в граммах, то для расчета моляльности следует пользоваться формулой
. (3)
Данный способ выражения состава раствора показывает, сколько моль растворенного вещества содержится в 1 кг растворителя. Его единицы измерения – моль/кг.
3. Молярная концентрация вещества С2 (иначе молярность раствора) – отношение числа моль растворенного вещества к объёму раствора V в дм3 (иначе в литрах)
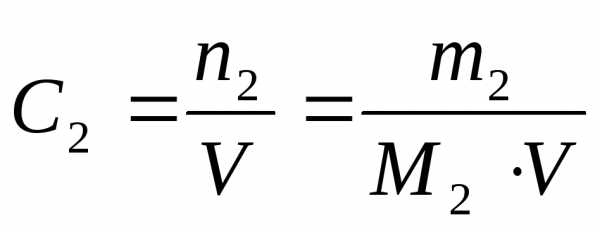 .
(4)
.
(4)
Она показывает, сколько моль растворенного вещества содержится в 1 дм3 раствора. Единицы измерения – моль/дм3 или М.
4. Молярная
концентрация эквивалента вещества С2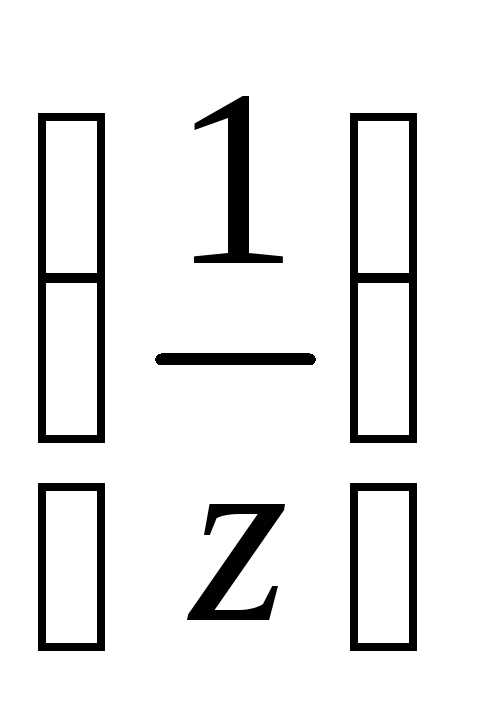 (иначе
нормальность раствора, нормальная
концентрация или эквивалентная
концентрация) – отношение числа моль
эквивалентов растворенного вещества
n2
(иначе
нормальность раствора, нормальная
концентрация или эквивалентная
концентрация) – отношение числа моль
эквивалентов растворенного вещества
n2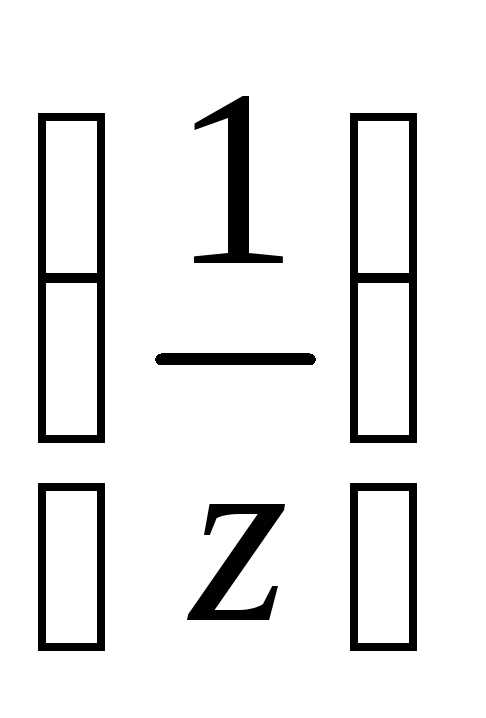 к объёму раствора в дм3
к объёму раствора в дм3
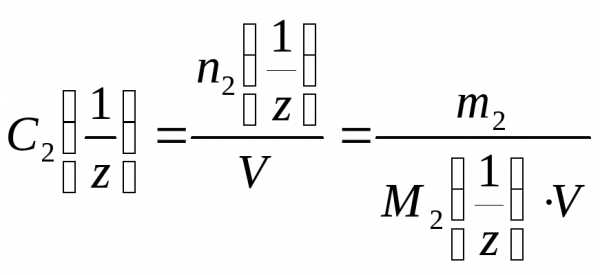 ,
(5)
,
(5)
где М2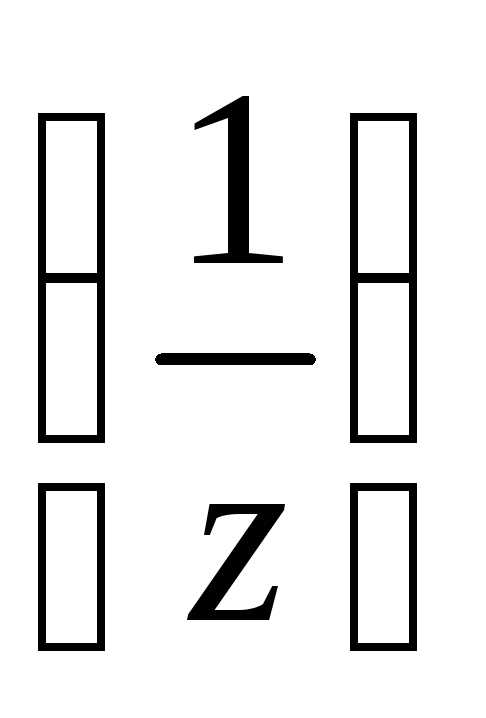 –
молярная масса эквивалента растворенного
вещества, г/моль;z
– число эквивалентности растворенного
вещества.
–
молярная масса эквивалента растворенного
вещества, г/моль;z
– число эквивалентности растворенного
вещества.
Нормальность раствора показывает, сколько моль эквивалентов растворенного вещества содержится в 1 дм3 раствора. Единицы измерения –моль/дм3 или н.
Взаимосвязь между молярной и нормальной концентрациями одного и того же растворенного вещества выражается соотношением
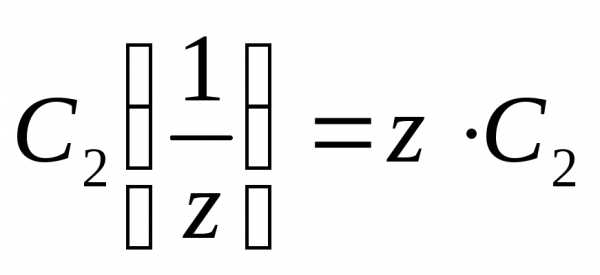 .
(6)
.
(6)
То есть, эквивалентная концентрация в z раз больше молярной концентрации.
5. Титр раствора Т – масса растворенного вещества в граммах, которая содержится в одном см3 (иначе 1 мл) раствора
. (7)
Единицы измерения данного способа выражения состава раствора –г/мл или г/см3.
6. Мольная доля растворенного вещества х2 – отношение числа моль растворенного вещества к общему числу моль всех компонентов раствора n
. (8)
Это безразмерная величина, выраженная в долях единицы.
Общее правило, используемое для приготовления разбавленных растворов из концентрированных: при одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу:
w1 × m1 = w2 × m2 , (9)
где m1 (m2) – масса исходного (конечного) раствора. Если массу раствора представить через его плотность и объем, то формула (9) примет вид
ω1 · ρ1 · V1= ω2 · ρ2 · V2 , (10)
где V1 (V2) – объем исходного (конечного) раствора; r1 (r2) – плотность исходного (конечного) раствора.
Если раствор получают путем смешивания двух растворов с различной концентрацией одного и того же растворенного вещества, то содержание растворенного вещества в конечном растворе можно определить с помощью правила смешивания: массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3
m1 / m2 = (w3 – w2) / (w1 – w3). (11)
При использовании правила смешивания применяют так называемое правило креста (иначе квадрат Пирсона):
w1 w3 – w2 m1
w3
w2 w1 – w3 m2
m1 / m2 = (w3 – w2) / (w1 – w3)
Пояснение:по
диагонали из большей концентрации
вычитают меньшую, получают (w1
–w3),так как w1
> w3,и (w3 –w2),
так как w3>
w3,и (w3 –w2),
так как w3> w2.
Затем составляют отношение масс исходных
растворовm1
/ m2.
w2.
Затем составляют отношение масс исходных
растворовm1
/ m2.
Если при сливании двух растворов, содержащих различные по природе растворенные вещества, между ними происходит химическое взаимодействие, то по закону эквивалентов вещества реагируют в количествах, пропорциональных их эквивалентам. Например, для процесса взаимодействия кислоты с основанием будет выполняться соотношение
. (12)
studfiles.net
Урок: Растворы. Типы растворов
Тема: Растворы. Типы растворов
Цели урока:
Обучающие: начать формировать понятие о растворе, познакомить учащихся с растворением как физико-химическим процессом и растворами как физико-химическими процессами, показать зависимость растворимости твердых веществ от температуры, дать классификацию растворов по признаку растворимости, сформировать наглядное представление о процессах, происходящих в растворах,.
Развивающие: развивать логическое мышление, память, умение сравнивать; развивать умения и навыки познавательной деятельности учащихся;
Воспитательные: внимание в процессе демонстрации химических опытов; повышать интерес учащихся к предмету.
Тип урока: усвоения новых знаний. Включение учащихся в активную языковую деятельность. 2. Стремление к грамотному общению.
Методы и формы обучения: рассказ учителя, фронтальная беседа, демонстрация опытов, рассказ с элементами беседы.
Оборудование и реактивы: периодическая система химических элементов Д. И. Менделеева; таблица «Растворимость кислот, щелочей, солей»; набор химических реактивов: вода, мел, песок, сахар, NaCl, подсолнечное масло, яичный белок.
ХОД УРОКА
ОРГАНИЗАЦИОННЫЙ МОМЕНТ
Приветствие, проверка готовности класса к уроку.
ІІ. АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ
Учитель. Из курса природоведения и повседневной жизни вам известно, что в воде растворяется много веществ. При этом образуются растворы. Растворы – играют важную роль в нашей жизни, с ними каждый из нас постоянно сталкивается как в быту, так и на производстве. Да и сам организм человека содержит растворы самых разных веществ. Рассмотрим особенности растворов, а также поведение различных веществ в них.
ІІІ. МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
А что же представляют собой растворы и каково их значение для человека? Какую роль они играют в природе? Это мы узнаем на сегодняшнем уроке.
IV.СООБЩЕНИЕ ТЕМЫ, ЦЕЛЕЙ И ЗАДАЧ УРОКА
— изучить: понятие растворы и их классификацию;
— научиться составлять уравнения химических реакций, характеризующих свойства спиртов
V. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Учитель. Вам известно, что при смешивании веществ с водой образуются однородные системы (растворы).
Пример. Сахар или соль растворяются в воде. Образуется однородная система — раствор.
Вопрос. А если песок растворить в воде? Образуется неоднородная система, так как песок плохо растворяется в воде. Процесс растворения веществ в воде — это не только физическое явление. Из практики вам известно, что при растворении многих веществ в воде, например серной кислоты, происходит разогревание. Выделение теплоты — это признак химической реакции.
Отсюда — определение.
Растворы — однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
При растворении вещества измельчаются, дробятся. Поэтому растворы относятся к дисперсным системам.
Слово «диспергирование» означает дробление. Самое большое значение имеют дисперсные системы, в которых средой является вода и другие жидкости.
Дисперсные системы делятся на следующие виды:
истинные растворы;
коллоидные растворы;
грубодисперсные системы.
Рассмотрим подробно, что представляют собой эти растворы.
І. Истинные растворы
Истинные растворы однородные, частицы растворенного вещества маленькие, меньше 1 нм(1 нм = 10—9 м), их нельзя выявить даже с помощью ультрамикроскопа.
Задание. Привести примеры истинных растворов. Демонстрация.
К истинным растворам относятся растворы сахара, соли в воде.
ІІ. Коллоидные растворы
Примеры. Раствор яичного белка, силикатного клея.
Демонстрация.
Они прозрачные, как истинные растворы, но размер частиц растворенного вещества больше — от 1 до 100 нм.
Эти частицы состоят из множества молекул, способны рассеивать свет, проходящий через эти растворы. Отдельные частицы выявляют с помощью ультрамикроскопа.
Слипание коллоидных частиц называется коагуляцией. При этом образуется гель — желеобразная масса (желе, мармелад, холодец).
ІІІ. Грубодисперсные системы
При смешивании некоторых веществ с водой образуются не растворы, а мутные смеси, которые называют взвесями (суспензии).
Они делятся на суспензии, эмульсии и аэрозоли.
Суспензии — это взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды.
Примеры: глина, песок с водой. Демонстрация.
Эмульсии — взвеси, в которых мелкие капельки жидкости равномерно распределены между молекулами другой жидкости.
Примеры: растительное масло с водой, керосин с водой.
Демонстрация.
Аэрозоли — взвеси, в которых мелкие частицы твердого вещества или жидкости равномерно распределены в газовой среде.
Примеры: пыль в воздухе, туман.
Мы рассмотрели разные виды дисперсных систем.
А где же в жизни человеку встречаются растворы? И какое они имеют значение в природе и жизни человека?
Растворы человеку встречаются в быту, медицине, природе, на химическом производстве и т. п. В быту — это растворы соли, сахара в воде, столовый уксус — раствор уксусной кислоты в воде, газированная вода — раствор CO2 в H2O и т. д.
В медицине — растворы лекарственных препаратов для инъекций, микстуры и т. п.
В сельском хозяйстве, химической промышленности, авто- и авиапромышленности и т. п. значение растворов также огромно.
В парфюмерии широко применяют различные эмульсии и аэрозоли.
В строительстве — грубодисперсные системы (растворы песка, мела, цемента и т. д.), имеющие важное значение для этой отрасли народного хозяйства.
Такие примеры можно приводить бесконечно, так как в воде растворяется много твердых веществ, газов и жидкостей.
VI. ДОМАШНЕЕ ЗАДАНИЕ
Выучить § . Подготовить сообщение: значение растворов в природе и жизни человека.
VII.ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Изучив эту тему, повторим некоторые важные моменты.
Вопросы учащимся
Что такое растворы?
На какие группы делятся растворы? Привести примеры.
Какое значение имеют растворы для человека?
Где в природе вам встречались растворы и каково их значение?
VIII. ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ, ВЫСТАВЛЕНИЕ ОЦЕНОЧНЫХ БАЛЛОВ
infourok.ru
ХИМИЯ. РАСТВОРЫ И РАСТВОРИМОСТЬ — это… Что такое ХИМИЯ. РАСТВОРЫ И РАСТВОРИМОСТЬ?
Молекулы воды притягивают ионы водорода, и образуются ионы гидроксония Н3О+. Менее полярные соединения (спирты или сахара и т.п.) в воде почти не диссоциируют. Иногда вещество начинает растворяться в результате химической реакции, которая изменяет его свойства. Так, мрамор (или известняк СаСО3) в чистой воде практически нерастворим, но растворяется в воде подкисленной:
Молекулы некоторых твердых веществ настолько прочно связаны друг с другом, что эти вещества не растворяются ни в одном растворителе, за исключением тех, с которыми взаимодействуют химически. В качестве примеров можно привести алмаз, графит, стекло и песок.
Влияние температуры и давления. Растворимость жидкостей и твердых веществ обычно увеличивается при повышении температуры, поскольку при этом возрастает энергия движения (кинетическая энергия) молекул и уменьшается их взаимное притяжение. Изменение давления мало влияет на растворимость, так как объем при растворении меняется незначительно. Гораздо больше давление влияет на растворимость газов. Газ лучше растворяется при увеличении давления, под действием которого часть его молекул переходит в раствор. При повышении температуры растворимость газов снижается — кинетическая энергия молекул возрастает, они быстрее движутся и легче «вырываются» из растворителя.
См. также РАСТВОРЫ.
Электролиты. Некоторые растворы, как и металлы, проводят электрический ток. В этом случае носителями заряда служат ионы. Вещества, раствор которых проводит электрический ток, носят общее название электролитов, не проводящие — неэлектролитов.
См. также ЭЛЕКТРОЛИТЫ. Концентрация — это количество растворенного вещества, содержащееся в единице массы или объема раствора. Ее можно выразить в таких единицах, как, например, г/л (число граммов вещества в литре раствора). Иногда концентрацию измеряют в процентах. При этом необходимо указывать, какие проценты имеются в виду: весовые или объемные. Например, 10%-ный раствор спирта в воде — это раствор, содержащий 10 объемов спирта и 90 объемов воды (объемные проценты), а 10%-ный раствор хлорида натрия в воде — раствор, в котором на 10 массовых единиц вещества приходится 90 массовых единиц воды (массовые проценты). Когда количество растворенного вещества очень мало, используют единицу «миллионная доля» — одна часть растворенного вещества на миллион частей раствора (в англоязычной литературе ее обозначают ppm, в русской — м.д. или млн-1). Для описания химических реакций удобнее выражать концентрацию в виде числа молекул или ионов растворенного вещества на единицу объема раствора.
Моль. Моль — одна из семи основных единиц Международной системы единиц (СИ). Ее определяют как количество вещества, которое содержит столько же атомов, молекул или ионов, сколько 12 г изотопа углерода 12С (см. выше), а именно 6,022*10 23 (число Авогадро). Понятие моля позволяет подсчитать, сколько частиц (атомов или молекул) вещества содержится в том или ином его массовом количестве. Например, из определения моля следует, что 6 г изотопа углерода 12С должны содержать 3,011*10 23 атомов. Кроме того, из определения атомной массы известно, что количество граммов любого элемента, численно равное его атомной массе, содержит число Авогадро атомов этого элемента. Таким образом, 4,0026 г гелия, 32,06 г серы и 200,59 г ртути содержат одинаковое число атомов соответствующего элемента, а именно 6,022*1023. Аналогично, для веществ, состоящих из молекул, моль вещества — это такое его количество, масса которого в граммах численно равна молекулярной массе вещества. Таким образом, моль хлора Cl2 имеет массу 35,453*2 = 70,906 г, моль хлорида натрия NaCl — (22,9898 + 35,453) = 58,443 г, а моль ионов натрия Na+ — 22,9898 г.
Молярность. Молярность — это концентрация вещества в растворе, выраженная в молях растворенного вещества, содержащихся в 1 л раствора. Так, децимолярный (сокращенно 0,1 М) раствор хлорида натрия содержит 0,1 моль (или 5,8443 г) NaCl в 1 л раствора.
Моляльность. Моляльность — это число молей растворенного вещества в 1000 г растворителя. Так, 0,1-моляльный раствор хлорида натрия в воде содержит 0,1 моль (или 5,8443 г) NaCl в 1000 г Н2О. Эта единица используется реже, чем молярность.
Нормальность. Нормальность — это число эквивалентов вещества, содержащихся в 1 л раствора. Для систем, в которые входят кислоты, основания и соли, эквивалент — это количество вещества, которое расходуется при взаимодействии с 1 моль ионов водорода Н+. Например, при образовании моля сульфата натрия Na2SO4 (1 моль = 142,0412 г) 1 моль серной кислоты теряет 2 моля Н+. Таким образом, 1 моль сульфата натрия содержит 2 эквивалента, и нормальность одномолярного раствора сульфата натрия равна двум (2 н.).
См. также ЭКВИВАЛЕНТНАЯ МАССА.
Энциклопедия Кольера. — Открытое общество. 2000.
dic.academic.ru
Понятие раствора.
Коллоидная химия
Растворы.
Растворами называют однородные системы переменного состава. Химический состав и физические свойства одного раствора во всех частях его объёма одинаковы.
В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Часто для определения раствора используют понятия гомогенной и системы.
В этом случае, раствором называется гомогенная система, состоящая из двух или более компонентов.
Гомогенные и гетерогенные системы
Гомогенная система (от греч. όμός — равный, одинаковый; γένω — рождать) — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система (от греч. έτερος — разный; γένω — рождать) — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела.
Растворы могут существовать в трёх агрегатных состояниях – твёрдом, жидком и газообразном (парообразном). Примерами твёрдых растворов могут служить некоторые сплавы металлов, например сплав золота и меди, газообразных – воздух.
Наиболее важный вид растворов – жидкие растворы.
Растворы имеют чрезвычайно важное значение в жизни человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.).
Растворители
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Истинные и коллоидные растворы
В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности). Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на:
1. Истинные растворы (размер частиц меньше 1 мкм) и
2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Они гетерогенны, так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой).
Растворы высокомолекулярных соединений: белков, полисахаридов, каучука обладают свойствами как истинных, так и коллоидных растворов и выделяются в особую группу.
Растворы, механические смеси и химические соединения
Однородность растворов делает их очень сходными с химическими соединениями.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов.
Раствор это не одно химическое соединение, а как минимум два смешанных соединения. В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям.
Механическая смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонентов). В смеси исходные вещества включены неизменными. При смешивании не возникает никакое новое вещество.
От механических смесей растворы резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Процесс растворения
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.
Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением, а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов, если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем больше концентрация раствора. А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие, при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
- Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым.
- Если растворяется менее 1 г вещества – малорастворимым.
- Если в раствор переходит менее 0,01 г вещества, то такое вещество называют практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества, состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
