Оксиды азота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 июля 2018; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 июля 2018; проверки требуют 3 правки. Эта статья описывает оксиды азота как химические соединения; об образовании и способах сокращения выбросов оксидов азота при горении см. NOx (оксиды азота).Окси́ды азо́та — неорганические бинарные соединения азота с кислородом.
Известны 10 соединений азота с кислородом. Кроме пяти классических оксидов азота — закиси азота N2O, окиси азота NO, оксида азота(III) N2O3, диоксида азота NO2 и оксида азота(V) N2O5 — известны также димер диоксида азота N2O4 и 4 малостабильных соединения: нитрозилазид NON
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза, токсичен. Также N2O называют закисью азота. Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси;
- увеличивает содержание кислорода в поступающем заряде;
- повышает скорость (интенсивность) сгорания в цилиндрах двигателя.
Оксид азота NO (монооксид азота
) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота(II) — очень реакционное соединениеru.wikipedia.org
Оксиды азота. Азотная кислота | АЛХИМИК
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Солеобразующие оксиды: N2O3, NO2, N2O4, N2O5
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
2N2O = 2N2 + O2
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 = 2NO
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4NH3 + 5O2 = 4NO + 6H2O
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):
2NO + O2 = 2NO2

 Оксид азота (IV)
Оксид азота (IV)Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
2NO2 + H2O = HNO2 + HNO3
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
4NO2 + O2 + 2H2O ⇄ 4HNO3
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
В избытке кислорода образуется только нитрат натрия:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H
Ниже 22 0С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

 Оксид азота (III)
Оксид азота (III)N2O3 + H2O = 2HNO2
Оксид азота (V) N 2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 ⇄ 2H2O + 4NO2↑ + O2↑
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства

 Азотная кислота
Азотная кислотаКислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
HNO3 ⇄ H+ + NO3—
Как и все кислоты, она реагирует:
а) с оксидами металлов:
MgO + 2HNO3 = Mg(NO3)2 + H2O
б) с основаниями:
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
в) с солями более слабых кислот:
K2CO3 + HNO3 = KNO3 + CO2↑ + H2O
Окислительно – восстановительные свойства
Азотная кислота является одним из сильнейших окислителей. Ее окислительно-восстановительные свойства обусловлены присутствием в молекуле HNO 3 атома азота в высшей степени окисления N+5 в составе кислотного остатка NO3—. Окислительные свойства кислотного остатка NO3— значительно сильнее, чем ионов водорода Н+, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины, находящимися в конце ряда напряжений. Так как окислителем в HNO3 являются ионы NO3—, а не ионы Н+, то при взаимодействии HNO3 с металлами практически никогда не выделяется водород. Нитрат-ионы NO3— при взаимодействии HNO3 с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл. На следующей схеме показано, какие продукты могут образоваться при восстановлении HNO3:

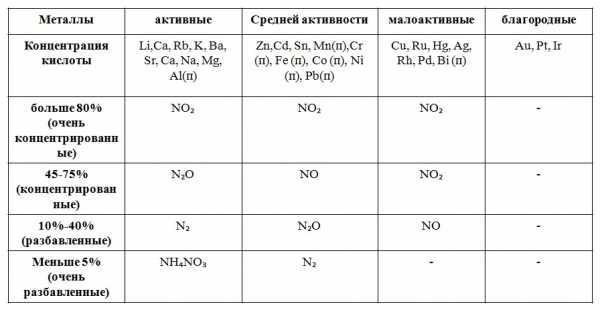 Общая схема взаимодействия азотной кислоты с металлами
Общая схема взаимодействия азотной кислоты с металлами10HNO3 + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni = Ni(NO3)2 + 2NO2↑ + 2H2O
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
5HNO3 + P = HPO3 + 5NO2↑ + 2H2O
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
3Al + 12HNO3 = Al(NO3)3 + Al2O3 + 9NO2↑ + 6H2O
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:
2HNO3 + S = H2SO4 + 2NO↑
Взаимодействие азотной кислоты с медьюПолучение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba(NO
В промышленности получение азотной кислоты идет в три стадии:
- Окисление аммиака до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
- Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
- Растворение оксида азота (IV) в воде и избытком кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
Примеры:
2NaNO3 = 2NaNO2 + O2↑
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
*на изображении записи кристаллы нитрата меди (II)
Похожее
al-himik.ru
Двуокись азота no2 – Все о газоснабжении
-
Ответы на экзаменационные билеты
- Оксиды азота
- Двуокись азота NO2
-
Незаметные и опасные оксиды азота
- Что такое оксиды азота?
-
Выхлопные газы автомобилей
- Оксид углерода (CO – угарный газ)
- Оксиды азота (NO, NO2, N2O, N2O3, N2O5, в дальнейшем – NOx)
- Углеводороды (CnHm – этан, метан, этилен, бензол, пропан, ацетилен и др.)
- Двуокись азота NO2
Ответы на экзаменационные билеты
Оксиды азота
С кислородом N образует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O – закись азота, «веселящий газ». Физические свойства: бесцветный, со сладковатым запахом, растворим в воде, t плавления -91 °C, t кипения -88,5 °C. Анестезирующее средство.
Химические свойства: разлагается при 700 °C: 2N2O?2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + h4?N20+ Н2O.
Получение: NpNO3?N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2, но при действии Н2O и щелочей он не образует ни Н2N2O2, ни ее солей. N2O – несолеобразующий.
Оксид азота (II) NO – окись азота. Физические свойства: бесцветный газ, плохо растворим в воде, t плавления -164 °C, t кипения -152 °C.
Химические свойства: NO обладает окислительно-восстановительными свойствами:
1) при обычной температуре устойчив, при понижении t димеризуется в N2O2;
2) при 700 °C разлагается: 2NO?2N2 + O2? поддерживая горение, является восстановителем;
3) с водородом. Смесь равных объемов NO и h4 взрывается: 2NO + 2h4 = N2? + Н2O, где NO – окислитель;
4) с галогенами: 2NO + Сl2 = 2NOСl? (нитрозилхлорид). NO – несолеобразующий.
Получение:
1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4h4O;
2) в промышленности: каталитическое окисление аммиака: 4Np +5O2 = 4NO? + 6h4O;
3) NO образуется в грозу: N2 + O2 = 2NO?.
Оксид азота (III) N203. Физические свойства: темно-синяя жидкость (при низких t), t плавления -102 °C, t кипения 3,5 °C. Химические свойства: N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + h4O.
Получение: NO2 + NO = N2O3.
Оксид азота (IV) – NO2. Физические свойства: ядовитый газ бурого цвета с резким запахом; t плавления —11,2 °C, t кипения – 21 °C. Химические свойства: кислотный ангидрид:
Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + h4O.
Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Димеризуется при низких температурах: 2NO2(бурый газ)?N2O4(бесцветная жидкость).
Получение: 2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2h4O. Оксид азота (V) – N2O5. Физические свойства: малостойкое белое кристаллическое вещество. Сильный окислитель.Химические свойства: ангидрид HN03.
Ответы на экзаменационные билеты
Экзамен сдан, ответы на экзаменационные вопросы, контрольные, курсовые, лекции, шпаргалки
Источник: eksdan.ru
Двуокись азота NO2
Диоксид азота – бурый ядовитый газ с резким характерным запахом. При температуре плюс 21.1°С он переходит в красно-бурую жидкость. В газообразном и жидком диоксиде азота имеет место равновесие между молекулами NO2 и димером N2O4.
С повышением температуры равновесие сдвигается в сторону молекул NO2, а при охлаждении возрастает доля молекул N2O4. Молекулы NO2 обусловливают окраску диоксида азота и обладают парамагнитными свойствами. Молекулы N2O4 диамагнитны и бесцветны. Поэтому при нагревании окраска диоксида азота усиливается, при охлаждении вещество бледнеет. Выше 140 °C (по другим данным – выше 290 °C) диоксид азота состоит практически исключительно из молекул NO2 и имеет темный цвет, при температуре ниже -12 °C белые кристаллы состоят только из молекул N2O4. Чистый жидкий диоксид азота бурый (во время кипения) или желтоватый (при более сильном охлаждении).
Благодаря сравнительно высокой температуре кипения оксид азота (IV) легко перевести в жидкое состояние. С этой целью мы использовали максимально упрощенную установку.
Диоксид азота получали в литровой конической колбе с помощью реакции азотной кислоты и меди. По полипропиленовой трубке газ попадал в пробирку с газоотводной трубкой и впаянной сверху насадкой (см. фотографии). Благодаря насадке газ, который поступает в пробирку через газоотводную трубку, должен опуститься в нижнюю часть пробирки перед тем, как выйти наружу через верхнюю трубку. Пробирка охлаждалась в банке или стакане со смесью лед-соль (3 : 1). Сверху пробирка была закрыта стеклянной пробкой, но неплотно. Пробка должна создавать в системе избыточное давление, но пропускать немного газа, чтобы обеспечить его поток через установку.
Перед тем как начать реакцию азотной кислоты и меди, ловушку нужно подержать в охлаждающей смеси (примерно на протяжении 20-30 минут), чтобы она успела остыть. В противном случае первые порции диоксида азота покинут установку без конденсации. Перед запуском установки внимательно проверьте, чтобы все соединения были плотными и не пропускали газ.
Когда в колбу с азотной кислотой бросили медь, началась реакция и колба быстро заполнилась бурым газом, диоксид азота начал поступать в охлаждаемую пробирку, которая служила ловушкой. Часть газа покидала систему через неплотно закрытую пробку, но большая часть конденсировалась. В результате в пробирке собралось несколько миллилитров темно-зеленой жидкости. В этом можно легко убедиться, вынув пробирку на несколько секунд из охлаждающей смеси.
У читателя может возникнуть вопрос: почему жидкость зеленая, ведь жидкий диоксид азота красно-бурый, а при более сильном охлаждении лишь слегка желтоватый? Зеленый цвет жидкому газу придают примеси воды. С небольшим количеством воды жидкий диоксид азота образует ярко-зеленый раствор, содержащий HNO3, HNO2, N2O4 и NO2. Вспомните, что для простоты мы не стали подключать U-образную трубку с осушителем.
Двуокись азота NO2
Двуокись азота NO2 Диоксид азота – бурый ядовитый газ с резким характерным запахом. При температуре плюс 21.1°С он переходит в красно-бурую жидкость. В газообразном и жидком диоксиде азота имеет
Источник: chemistry-chemists.com
Незаметные и опасные оксиды азота
Уайт сидел на берегу реки, вдыхая полной грудью освежающий деревенский воздух. В этот момент он задумался. Чем же этот воздух лучше городского по составу ? Каких газов в нём нет и какие из них наиболее опасны ? В ожидании клёва под жужжащий звук пролетающих мимо комаров, ученый поглядел на своего друга, затаившегося с удочкой в соседних кустах. Это напомнило Уайту о двух неразлучных газах, всегда находящихся в атмосфере, – оксидах азота.
Что такое оксиды азота?
Оксида азота (NO и NO2) встречаются в атмосфере вместе, поэтому и действие их на организм принято рассматривать совместно. Монооксид (NO) – бесцветный газ со сладковатым запахом, не раздражает дыхательные пути при вдыхании. Диоксид азота (NO2), или “бурый газ”, – высокотоксичный газ, как следует из названия, оранжево-бурого цвета, с характерным остро-сладким запахом. Даже при небольшом содержании бурого газа в воздухе он способен вызвать в человеческом организме негативные изменения. Оксиды азота – распространенные загрязнители воздуха в больших городах. Во многих странах мира они включены в списки веществ, концентрацию которых обязательно следует определять на предприятиях и рабочих местах.
Откуда оксиды азота возникают в воздухе?
Около 1% содержащегося в воздухе оксидов азота появляется естественным путем в атмосфере во время грозы, а также выделяется растениями или образуется в почве. Наибольшая же часть появляется во время сжигания различного рода топлива: угля, нефти, природного газа. В городах они возникают, в первую очередь, от автомобильных выхлопов (порядка 80%), работы электростанций и на предприятиях тяжелой и пищевой промышленности. Каждый курильщик ежедневно выделяет оксиды азота в атмосферу.
Где могут возникнуть высокие концентрации оксидов азота?
Высокие концентрации оксидов азота на улице характерны для густонаселенных городов с большим количеством заводов и производств. Много оксидов азота вблизи загруженных автомобильных трасс. Там концентрация может быть выше на 30-100% по сравнению с удаленными от заводов и дорог территориями. Внутри помещений высокие концентрации диоксида азота могут возникать вследствие работы керосиновых и газовых нагревательных приборов, газовых печей, большого числа выкуренных сигарет.
Как действуют оксиды азота ?
Монооксид связывается в крови с гемоглобином, ответственным за процесс дыхания в организме. В ходе этой реакции меняется степень окисления ионов железа, входящих в состав гемоглобина, с двух до трех. Это приводит к тому, что гемоглобин не может больше обратимо связывать кислород и таким образом выходит из процесса дыхания. Диоксид азота, взаимодействуя с водой слизистых оболочек, образует азотистую и азотную кислоты. Эти кислоты разъедают стенки альвеол, за счет чего сыворотка крови может попасть в полость легких. При растворении в этой жидкости вдыхаемого воздуха, образуется пена, препятствующую газообмену в организме.
Какие характерные признаки воздействия на организм оксидов азота?
Монооксид азота не раздражает дыхательных путей. При малых концентрациях относительно безвреден. Однако в помещениях при высокой концентрации может привести к летальному исходу вследствие остановки процесса дыхания. Диоксид азота – гораздо более опасное соединение, сильно раздражает слизистые оболочки дыхательных путей. При продолжительном вдыхании может привести к серьёзным последствиям, таким как отёк лёгких, воспаление лёгких, бронхиты. Уже при малых концентрациях человек ощущает присутствие этого газа. Однако после десяти минут вдыхания способность организма обнаруживать NO2 пропадает, оставляя чувство сухости и першения в горле. Через некоторое время пропадают и эти симптомы. Диоксид азота ослабляет зрение, а точнее – способность глаза адаптироваться к темноте. Наличие в воздухе диоксида азота вызывает увеличение усилий, затрачиваемых на дыхание, причем даже при очень низких концентрациях. При длительном воздействии оксидов азота ухудшается сопротивляемость легких к бактериям, повышается риск сердечных и раковых заболеваний. Таким образом, человек может даже не догадываться о подстерегающей его опасности.
Что делать, если Вы столкнулись с высокой концентрацией оксидов азота ?
Самое верное средство – осторожно вынести пострадавшего на свежий воздух на носилках. После этого надо срочно вызвать скорую помощь. Народные и подручные средства, к сожалению, при таком отравлении не помогут.
Взглянув ещё раз на своего друга, Уайт закурил. Он медленно выдохнул крутящиеся клубы табачного дыма. Ученый поймал себя на мысли: только что он сам заставил себя дышать воздухом с повышенным содержанием оксидов азота. Поморщившись, он выкинул сигарету в воду. Не хватало ещё самому в свободное время тратить свой организм.
Незаметные и опасные оксиды азота
Монооксид (NO) – бесцветный газ со сладковатым запахом, не раздражает дыхательные пути при вдыхании. Диоксид азота (NO2), или «бурый газ», – высокотоксичный газ, как следует из названия, оранжево-бурого цвета, с характерным остро-сладким запахом.
Источник: www.dialog-consult.ru
Выхлопные газы автомобилей
Выхлопные газы (или отработавшие газы) – основной источник токсичных веществ двигателя внутреннего сгорания – это неоднородная смесь различных газообразных веществ с разнообразными химическими и физическими свойствами, состоящая из продуктов полного и неполного сгорания топлива, избыточного воздуха, аэрозолей и различных микропримесей (как газообразных, так и в виде жидких и твердых частиц), поступающих из цилиндров двигателей в его выпускную систему. В своем составе они содержат около 300 веществ, большинство из которых токсичны. Основными нормируемыми токсичными компонентами выхлопных газов двигателей являются оксиды углерода, азота и углеводороды. Кроме того, с выхлопными газами в атмосферу поступают предельные и непредельные углеводороды, альдегиды, канцерогенные вещества, сажа и другие компоненты. Примерный состав выхлопных газов представлен в таблице 1.
При работе двигателя на этилированном бензине в составе выхлопных газов присутствует свинец, а у двигателей, работающих на дизельном топливе – сажа.
Оксид углерода (CO – угарный газ)
Прозрачный, не имеющий запаха ядовитый газ, немного легче воздуха, плохо растворим в воде. Оксид углерода – продукт неполного сгорания топлива, на воздухе горит синим пламенем с образованием диоксида углерода (углекислого газа).
В камере сгорания двигателя CO образуется при неудовлетворительном распыливании топлива, в результате холоднопламенных реакций, при сгорании топлива с недостатком кислорода, а также вследствие диссоциации диоксида углерода при высоких температурах. При последующем сгорании после воспламенения (после верхней мертвой точки, на такте расширения) возможно горение оксида углерода при наличии кислорода с образованием диоксида. При этом процесс выгорания CO продолжается и в выпускном трубопроводе.
Необходимо отметить, что при эксплуатации дизелей концентрация CO в выхлопных газах невелика (примерно 0,1 – 0,2%), поэтому, как правило, концентрацию CO определяют для бензиновых двигателей.
Оксиды азота (NO, NO2, N2O, N2O3, N2O5, в дальнейшем – NOx)
Оксиды азота раздражающе воздействуют на слизистые оболочки глаз, носа, разрушают легкие человека, так как при движении по дыхательному тракту они взаимодействуют с влагой верхних дыхательных путей, образуя азотную и азотистую кислоты. Как правило, отравление организма человека NOx проявляется не сразу, а постепенно, причем каких либо нейтрализующих средств нет.
Закись азота (N2O – гемиоксид, веселящий газ) – газ с приятным запахом, хорошо растворим в воде. Обладает наркотическим действием.
NO2 (диоксид) – бледно-желтая жидкость, участвующая в образовании смога. Диоксид азота используется в качестве окислителя в ракетном топливе.
Считается, что для организма человека оксиды азота примерно в 10 раз опаснее CO, а при учете вторичных превращений – в 40 раз.
Оксиды азота представляют опасность для листьев растений. Установлено, что их непосредственное токсичное влияние на растения проявляется при концентрации NOx в воздухе в пределах 0,5 – 6,0 мг/м 3 . Азотная кислота вызывает сильную коррозию углеродистых сталей.
На величину выброса оксидов азота оказывает значительное влияние температура в камере сгорания. Так, при повышении температуры от 2500 до 2700 К скорость реакции увеличивается в 2,6 раза, а при уменьшении от 2500 до 2300 К – уменьшается в 8 раз, т.е. чем выше температура, тем выше концентрация NOx. Ранний впрыск топлива или высокие давления сжатия в камере сгорания также способствуют образованию NOx. Чем выше концентрация кислорода, тем выше концентрация оксидов азота.
Углеводороды (CnHm – этан, метан, этилен, бензол, пропан, ацетилен и др.)
Наличие CH в отработавших газах двигателей объясняется тем, что смесь в камере сгорания является неоднородной, поэтому у стенок, в переобогащенных зонах, происходит гашение пламени и обрыв цепных реакций (см. рисунок 1).

Рис. 1 – Схема образования CH в выхлопных газах
1 – поршень; 2 – гильза; 3 – пристеночные слои смеси
Не полностью сгоревшие CH, выбрасываемые с выхлопными газами и представляющие собой смесь нескольких сотен химических соединений, имеют неприятный запах. CH являются причиной многих хронических заболеваний.
Токсичны также и пары бензина, которые являются углеводородами. Допустимая среднесуточная концентрация паров бензина составляет 1,5 мг/м 3 . Содержание CH в выхлопных газах возрастает при дросселировании, при работе двигателя на режимах принудительного холостого хода (ПХХ , например, при торможении двигателем.). При работе двигателя на указанных режимах ухудшается процесс смесеобразования (перемешивания топливовоздушного заряда), уменьшается скорость сгорания, ухудшается воспламенение и, как результат, – возникают его частые пропуски.
Выделение CH вызывается неполным сгоранием вблизи холодных стенок, если до конца сгорания остаются места с сильным локальным недостатком воздуха, недостаточным распыливанием топлива, при неудовлетворительном завихрении воздушного заряда и низких температурах (например, режим холостого хода).
Углеводороды образуются в переобогащенных зонах, где ограничен доступ кислорода, а также вблизи сравнительно холодных стенок камеры сгорания. Они играют активную роль в образовании биологически активных веществ, вызывающих раздражение глаз, горла, носа и их заболевание, и наносящих ущерб растительному и животному миру.
Углеводородные соединения оказывают наркотическое действие на центральную нервную систему, могут являться причиной хронических заболеваний, а некоторые ароматические CH обладают отравляющими свойствами.
Углеводороды (олефины) и оксиды азота при определенных метеорологических условиях активно способствуют образованию смога.
Он представляет собой аэрозоль, состоящую из дыма, тумана, пыли, частичек сажи, капелек жидкости (во влажной атмосфере). Возникает в атмосфере промышленных городов при определенных метеорологических условиях.
Поступающие в атмосферу вредные газы вступают в реакцию между собой и образуют новые, в том числе и токсичные соединения. В атмосфере при этом происходят реакции фотосинтеза, окисления, восстановления, полимеризации, конденсации, катализа и т.д.
В результате сложных фотохимических процессов, стимулируемых ультрафиолетовой радиацией Солнца, из оксидов азота, углеводородов, альдегидов и других веществ образуются фотооксиданты (окислители).
Низкие концентрации NO2 могут создать большое количество атомарного кислорода, который в свою очередь образует озон и вновь реагирует с веществами, загрязняющими атмосферный воздух. Наличие в атмосфере формальдегида, высших альдегидов и других углеводородных соединений также способствует вместе с озоном образованию новых перекисных соединений.
Продукты диссоциации взаимодействуют с олефинами, образуя токсичные нитроперекисные соединения. При их концентрации более 0,2 мг/м 3 наступает конденсация водяных паров в виде мельчайших капелек тумана с токсичными свойствами. Их количество зависит от сезона года, времени суток и других факторов. В жаркую сухую погоду смог наблюдается в виде желтой пелены (цвет придает присутствующий в воздухе диоксид азота NO2 – капельки желтой жидкости).
Смог вызывает раздражение слизистых оболочек, особенно глаз, может вызвать головную боль, отеки, кровоизлияния, осложнения заболеваний дыхательных путей. Ухудшает видимость на дорогах, увеличивая тем самым количество дорожно-транспортных происшествий.
Опасность смога для жизни человека велика. Так, например, лондонский смог 1952 г. называют катастрофой, так как за 4 дня от смога погибло около 4 тыс. человек. Наличие в атмосфере хлористых, азотных, сернистых соединений и капелек воды способствует образованию сильных токсичных соединений и паров кислот, что губительно сказывается на растениях, а также сооружениях, особенно на исторических памятниках, сложенных из известняка.
Природа смогов различна. Например, в Нью-Йорке образованию смога способствуют реакции фтористых и хлористых соединений с капельками воды; в Лондоне – присутствие паров серной и сернистой кислот; в Лос-Анджелесе (калифорнийский или фотохимический смог) – наличие в атмосфере оксидов азота, углеводородов; в Японии – присутствие в атмосфере частиц сажи и пыли.
Выхлопные газы автомобилей
В состав выхлопных газов входят три основные вещества – азот, углекислый газ и вода. В зависимости от режима работы двигателя их состав может изменяться
Источник: carspec.info
Двуокись азота NO2
Монооксид азота NO.
Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ‑связь ( N=O), в твердом состоянии димер N2O2 со связью N – N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Мало растворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. Весьма реакционноспособна смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты.
Уравнения важнейших реакций:
2NO + O2 (изб.) = 2NO2 (20 °C)
2NO + С (графит) = N2 + СO2 (400–500 °C)
lONO + 4Р (красн.) = 5N2 + 2Р2O5 (150–200 °C)
2NO + 4Cu = N2 + 2Cu2O (500–600 °C)
Реакции смеси NO и NO2:
NO + NO2 + Н2O = 2HNO2(p)
NO + NO2 + 2KOH (разб.) = 2KNO2 + h4O
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (450–500 °C)
Получение: в промышленности– окисление аммиака (см.) кислородом на катализаторе, в лаборатории
– взаимодействие разбавленной азотной кислоты с восстановителями:
8HNO3 (хол.) + 6Hg = 3Hg2(NO3)2 + 2NO
или восстановление нитритов:
2NaNO2 + 2h4SO4 (разб.) + 2NaI = 2NO
↑ + I2↓ + 2h4O + 2Na2SO4
Диоксид азота NO2.
Кислотный оксид, условно отвечает двум кислотам – HNO2 и HNO3 (кислота для NIV не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2O4 (тетраоксид диазота). Молекула NO2 – радикал со строением незавершенного треугольника [‑N(O)2] (sр2‑гибридизация) с ковалентными σ, π‑связями N=O. Молекула N2O4 содержит очень длинную связь N – N (175 пм), которая легко разрывается при температуре выше комнатной (в интервале 20,7–135,0 °C). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Усиливает химическую активность NO (см.). Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит. Уравнения важнейших реакций:
Получение: в промышленности– окисление NO (см.) кислородом воздуха, в лаборатории
– взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO3 (конц., гор.) + S = h4SO4 + 6NO2↑ + 2Н2O
5HNO3 (конц., гор.) + Р (красн.) = Н3РO4 + 5NO2↑ + Н2O
2HNO3 (конц., гор.) + SO2 = h4SO4 + 2NO2↑
Бесцветный газ с приятным запахом («веселящий газ»), N=N=O, формальная степень окисления азота +I, плохо растворим в воде. Поддерживает горение графита и магния:
2N2O + С = СO2 + 2N2 (450 °C)
N2O + Mg = N2 + MgO (500 °C)
Получают термическим разложением нитрата аммония:
NpNO3 = N2O + 2Н2O (195–245 °C)
Применяется в медицине как анестезирующее средство.
Триоксид диазота N2O3.
При низких температурах – синяя жидкость, ON=NO2, формальная степень окисления азота +III. При 20 °C на 90 % разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2, при нагревании реагирует иначе:
Смотрите также
Синтез бензальанилина
Цель работы: провести литературный обзор по аминам. Синтезировать бензальанилин. Амины – производные аммиака, в которых атомы водорода замещены углеводородными группами. Атом азота в ам .
Электрофильное ароматическое замещение
Электрофильное замещение, несомненно, составляет самую важную группу реакций ароматических соединений. Вряд ли найдется какой-нибудь другой класс реакций, который так детально, глубоко и все .
Использование озона
Озон – высокоэффективное и универсальное окисляющее вещество, которое используется в обработке воды в целях дезинфекции, удаления марганца и железа, улучшения вкуса, устранения цвета и запа .
Двуокись азота NO2
Двуокись азота NO2 Монооксид азота NO. Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ‑связь ( N=O), в твердом состоянии димер N2O2 со связью N – N. Чрезвычайно
Источник: www.chemiemania.ru
progazosnabgenie.ru
Химия №2
Определение химического эквивалента металла объемным методом.
Цель работы.
Теоретическая часть.
Химическим эквивалентом называют количество единиц атомной и молекулярной массы вещества, равноценное в химических реакциях 1,008 единицы атомной массы водорода или молю электронов, принимающих участие в окислительно-восстановительных реакциях:
1.6*10-19Кл * 6.02*1023моль-19.6484*104Кл*моль.
Экспериментально эквивалент элемента можно определить путем определения количества присоединяемого элементом водорода, кислорода или другого элемента, эквивалент которого известен.
Элемента можно определять и электрохимическим путем на основании закона Фарадея, согласно которому при прохождении 96494 Кл электричества через раствор электролита на электродах выделяется один эквивалент вещества.
В настоящей работе использован наиболее простой и доступный метод определения эквивалентов металлов, основанный на измерении объема водорода при реакции вытеснения его активным металлом из кислоты.
Порядок проведения работы.
В пробирку 1 (см. рисунок) до одной четверти ее объема налить раствор соляной кислоты плотностью 1,21. Боковой отросток должен быть сухим. Навеску металла ссыпать в отросток пробирки. Отверстия пробирки тщательно закрыть и проверить прибор на герметичность. Для этого поднять или опустить бюретку 3, причем уровень воды в бюретке 2 не должен резко изменяться.
Убедившись в герметичности прибора, установить уровни воды в бюретках на одном уровне. Записать положение уровня в бюретке 2. Поднять пробирку 1 (см. пунктир на рисунке) и ссыпать металл из бокового отростка в кислоту. Выделившийся водород увеличивает объем газа в рабочей части прибора, и уровень воды в бюретке 2 понижается.
После окончания выделения водорода тщательно выровнять уровни в обеих бюретках и записать новое значение объема.
Расчет по полученным данным.
Дано:
Vл1=25,6 Vл2=18
Vп1=28,3 Vп2=36,6
t=13C
р=746мм.рт.ст.
m=0,0245г

где h – парциальное давление паров воды при данной температуре (см. таблицу).
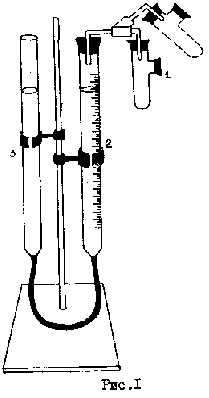
Реакция идет по формуле: Me+2HClMeCl2+H2 (1)
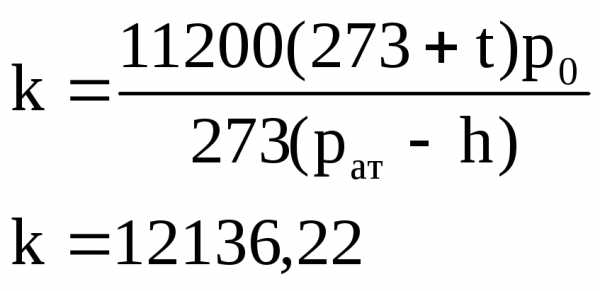
Vл=Vл1-Vл2=8,6
Vп=Vп1-Vп2=8,9
Vср=(Vп+Vл)/2=8,8
Д ля расчета атомной массы металла возьмем формулу:
А=Э*n, где Э — эквивалент металла
— валентность элемента
Из химического уравнения (1) видно, что данный элемент имеет валентность 2, а значит А=33,78*2=76,6. Получившаяся молярная масса находится между Zn и Ga, но т.к валентность искомого элемента 2, то это Zn.
Ответ: Zn.
1. При взаимодействии 1,04 г некоторого металла с раствором кислоты выделилось 0,672 л водорода. Определить этот металл.
Ответ: Cr.
2. При взаимодействии 1,5 г некоторого простого вещества с водой выделилось 0,923 л водорода, измеренного при t=27°C и давлении 1,013*105 Па. Определить это вещество.
Ответ:Ca.
3. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислить эквивалентную массу и основность H3PO4 в этой реакции. На основании расчета написать уравнение реакции.
Ответ: 49 г/моль; 2.
3
studfiles.net
Химия №2
Определение химического эквивалента металла объемным методом.
Цель работы.
Теоретическая часть.
Химическим эквивалентом называют количество единиц атомной и молекулярной массы вещества, равноценное в химических реакциях 1,008 единицы атомной массы водорода или молю электронов, принимающих участие в окислительно-восстановительных реакциях:
1.6*10-19Кл * 6.02*1023моль-19.6484*104Кл*моль.
Экспериментально эквивалент элемента можно определить путем определения количества присоединяемого элементом водорода, кислорода или другого элемента, эквивалент которого известен.
Элемента можно определять и электрохимическим путем на основании закона Фарадея, согласно которому при прохождении 96494 Кл электричества через раствор электролита на электродах выделяется один эквивалент вещества.
В настоящей работе использован наиболее простой и доступный метод определения эквивалентов металлов, основанный на измерении объема водорода при реакции вытеснения его активным металлом из кислоты.
Порядок проведения работы.
В пробирку 1 (см. рисунок) до одной четверти ее объема налить раствор соляной кислоты плотностью 1,21. Боковой отросток должен быть сухим. Навеску металла ссыпать в отросток пробирки. Отверстия пробирки тщательно закрыть и проверить прибор на герметичность. Для этого поднять или опустить бюретку 3, причем уровень воды в бюретке 2 не должен резко изменяться.
Убедившись в герметичности прибора, установить уровни воды в бюретках на одном уровне. Записать положение уровня в бюретке 2. Поднять пробирку 1 (см. пунктир на рисунке) и ссыпать металл из бокового отростка в кислоту. Выделившийся водород увеличивает объем газа в рабочей части прибора, и уровень воды в бюретке 2 понижается.
После окончания выделения водорода тщательно выровнять уровни в обеих бюретках и записать новое значение объема.
Расчет по полученным данным.
Дано:
Vл1=25,6 Vл2=18
Vп1=28,3 Vп2=36,6
t=13C
р=746мм.рт.ст.
m=0,0245г

где h – парциальное давление паров воды при данной температуре (см. таблицу).
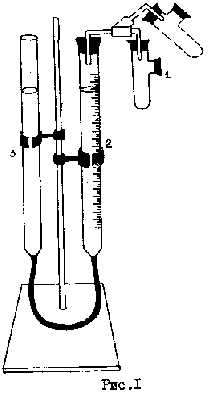
Реакция идет по формуле: Me+2HClMeCl2+H2 (1)
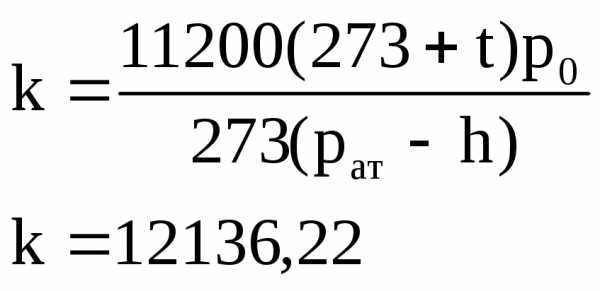
Vл=Vл1-Vл2=8,6
Vп=Vп1-Vп2=8,9
Vср=(Vп+Vл)/2=8,8
Д ля расчета атомной массы металла возьмем формулу:
А=Э*n, где Э — эквивалент металла
— валентность элемента
Из химического уравнения (1) видно, что данный элемент имеет валентность 2, а значит А=33,78*2=76,6. Получившаяся молярная масса находится между Zn и Ga, но т.к валентность искомого элемента 2, то это Zn.
Ответ: Zn.
1. При взаимодействии 1,04 г некоторого металла с раствором кислоты выделилось 0,672 л водорода. Определить этот металл.
Ответ: Cr.
2. При взаимодействии 1,5 г некоторого простого вещества с водой выделилось 0,923 л водорода, измеренного при t=27°C и давлении 1,013*105 Па. Определить это вещество.
Ответ:Ca.
3. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислить эквивалентную массу и основность H3PO4 в этой реакции. На основании расчета написать уравнение реакции.
Ответ: 49 г/моль; 2.
3
studfiles.net
Диоксид азота
Химический элемент азот с порядковым номером 7 расположен в 5 группе периодической системы Менделеева. Этот двухатомный газ при нормальных условиях достаточно инертен. В земной атмосфере на его долю приходится три четверти. Элемент характеризуется следующими степенями окисления: −3, −1, 0, 1, 2, 3, 4, 5. Он входит в состав многих соединений. Одним из них является красновато-коричневый ядовитый газ (отличается способностью раздражать дыхательные пути, вызывает отек легких при больших концентрациях), имеющий характерный резкий, едкий запах — это диоксид азота. Формула имеет вид NO2. Молярная масса 46,01 г/моль. Плотность 2,62 г/дм³. Температура кипения 21 °C. При растворении в воде реагирует с ней. Показатель преломления 1,449 (при 20 ° C).
Диоксид азота играет важную роль в химии атмосферы, в том числе в формировании тропосферного озона. Одновременно он является крупным загрязнителем воздуха и промежуточным продуктом в промышленном синтезе азотной кислоты, миллионы тонн которой производятся каждый год. Это один из нескольких оксидов азота (бинарные неорганические соединения азота с кислородом) со степенями окисления:
I — закись азота N2O;
II — монооксид азота NO;
III — триоксид диазота N2O3;
IV — диоксид азота NO2 и тетраоксид диазота N2O4;
V — пентаоксид диазота N2O5;
тринитрамид N(NO2)3.
Диоксид азота легко сжижается. Он тяжелее воздуха. При нормальных условиях NO2 смешан (примерно, 1:1) с бесцветным веществом (своим димером) N2O4. Химия NO2 хорошо изучена.
При взаимодействии с водой гидролизуется, в результате образуются две кислоты (азотистая и азотная): 2NO2 + h3O → HNO2 + HNO3.
В реакциях со щелочами образуются соли этих же двух кислот: 2NaOH + 2NO2 → NaNO2 + NaNO3 + h3O.
Он является сильным окислителем, способен окислять SO2 до SO3. На этом его свойстве основан метод нитрозного получения серной кислоты. В среде NO2 многие вещества, включая органические соединения, серу, уголь и фосфор, горят.
Диоксид азота обычно образуется в результате окисления оксида азота кислородом воздуха: O2 + 2NO → 2NO2
В лаборатории NO2 получают в два этапа: дегидратацией азотной кислоты до пентаоксида диазота, который затем разлагают термическим путем:
2HNO3 → N2O5 + h3O,
2N2O5 → 4NO2 + O2.
В результате термического разложения нитратов некоторых металлов также можно получить NO2:
2Pb(NO3)2 → 4NO2 + 2PbO + O2.
Окисел может образовываться при взаимодействии азотной кислоты (концентрированной) с металлами (например, медью):
4HNO3 + Cu → 2NO2 + Cu(NO3)2 + 2h3O.
При воздействии азотной кислоты (концентрированной) на олово, кроме диоксида азота, образуется оловянная кислота в качестве побочного продукта:
4HNO3 + Sn → h3O + h3SnO3 + 4NO2.
В некоторых источниках окисел N2O4(IV) называют не иначе, как тетраоксид азота. Но это неправильное название, так как вещество является тетраоксидом диазота. NO2 существует в равновесии с бесцветным газом N2O4: 2NO2↔N2O4.
Так как это равновесие является экзотермическим, то оно сдвигается в сторону NO2 при более высоких температурах, а при более низких — в сторону N2O4. Димер переходит в твердое состояние при температуре минус 11,2 оС. При температуре 150 градусов разлагается: N2O4 → 2NO2, затем 2NO2 → 2NO + O2.
Азотная кислота медленно выделяет NO2, который придает характерный желтый цвет большинству образцов этой кислоты:
4HNO3 → 4NO2 + 2h3O + O2.
Диоксид азота легко обнаружить по запаху уже при низких концентрациях, вдыхания его паров лучше избегать. Одним из потенциальных источников NO2 является дымящая азотная кислота, которая выделяет NO2 при температурах выше 0 градусов. Симптомы отравления (отек легких), как правило, появляются после вдыхания потенциально смертельных доз через несколько часов. Существует ряд доказательств, что долгосрочное воздействие NO2 при концентрациях выше 40—100 мкг/м³ может снизить функцию легких и увеличить риск респираторных симптомов. В исследованиях некоторых ученых установлена связь между концентрацией NO2 и синдромом внезапной детской смерти.
Диоксид азота образуется в большинстве процессов горения, где используется воздух в качестве окислителя.
При повышенных температурах азот соединяется с кислородом с образованием оксида азота: O2 + N2 → 2NO, затем NO окисляется на воздухе с образованием диоксида O2 + 2NO → 2NO2:
При нормальных атмосферных концентраций это очень медленный процесс.
Наиболее вероятным источниками NO2 являются двигатели внутреннего сгорания, тепловые электростанции и, в меньшей степени, целлюлозные заводы.
Газовые обогреватели и печи являются также источниками этого окисла. Необходимый для горения избыток воздуха вносит азот, который при высоких температурах преобразуется в оксиды азота.
В домашних хозяйствах керосиновые обогреватели и газовые обогреватели являются также источниками NO2.
Диоксид азота вырабатывается при атмосферных ядерных испытаниях (красноватый цвет грибовидного облака).
В некоторых сельскохозяйственных районах его приземные концентрации могут достигать 30 мкг/м³.
NO2 также естественным образом вырабатывается при грозе, дожде.
fb.ru
