Вред суррогатного алкоголя и спиртосодержащих жидкостей
Опасно ли употребление суррогатов алкоголя? Безусловно, опасно, так как сопровождается тяжелыми, вплоть до смертельного исхода, поражениями печени, почек, глаз, центральной нервной системы. Часть отравлений бывает связана с употреблением поддельных спиртных напитков. При этом иногда страдают люди, вовсе не злоупотребляющие ими.
Также нередко пьют суррогаты хронические алкоголики. Они часто используют вовсе «несъедобные» продукты бытовой химии, технические спирты, лекарственные жидкости, что приводит к очень тяжелым отравлениям.
Суррогаты алкоголя и их виды
Что же такое суррогаты алкоголя? Это спиртосодержащие жидкости, применяемые в быту и для технических нужд. Их употребляют с целью опьянения при недоступности обычных спиртных напитков. Также сюда можно отнести поддельные алкогольные напитки (вина, коньяки, водку, самогон, настойки, коктейли), изготовленные с использованием ненадлежащего сырья или с нарушениями технологии.
Суррогаты подразделяют на две группы:
- Содержащие этанол, или истинные суррогаты. Сюда относятся лекарства (настойки пустырника, боярышника), различные лосьоны, одеколоны, технический этиловый спирт. Более опасные суррогаты – это бытовые жидкости, такие как растворители, средства для мытья стекол и поверхностей, политура; тормозная жидкость, антифризы; клей БФ. Они могут содержать гидролизный и сульфатный спирты, денатурат, примеси метилового спирта, этиленгликоля, альдегиды, эфирные масла, ацетон, хлороформ, красители, прочие ядовитые вещества.
- Вещества, не содержащие этиловый спирт, но вызывающие опьянение. Их называют ложными суррогатами. Это метиловый, пропиловый, бутиловый, амиловый и муравьиный спирты, этиленгликоль, дихлорэтан и жидкости различного назначения, в которые они входят в большой концентрации. Они крайне ядовиты и вызывают опасные поражения различных органов и смерть.

Особую опасность представляют поддельные алкогольные напитки. Попавшие в них ядовитые соединения, особенно метиловый спирт, которые приводят к смертельным отравлениям.
Признаки отравления алкогольными суррогатами
Первыми признаками отравления алкогольными суррогатами бывают тошнота, затем рвота, чувство дурноты, головокружение, боли в животе, мучительная головная боль. Клиническая картина первоначально такая же, как при отравлении большим количеством водки. Дальнейшие симптомы зависят от того, чем вызвано отравление и насколько велика доза выпитого.
Метанол (метиловый спирт). По запаху и вкусу не отличается от этилового спирта, но является смертельным ядом.
Продукт сухой перегонки древесины. Используется в качестве растворителя при производстве лаков, как добавка к жидкому топливу для двигателей внутреннего сгорания.
Состояние пострадавшего напрямую зависит от количества выпитого. Приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению. Смертельная доза метанола равна 80-100 мл. Первыми признаками отравления будут тошнота и рвота, мушки перед глазами. Кожа больного сухая и красная. В течение последующих суток состояние его ухудшается. Появляется жажда, боли в животе, одновременно головная боль, сильные боли в икроножных мышцах, двоение в глазах.
Смертельная доза метанола равна 80-100 мл. Первыми признаками отравления будут тошнота и рвота, мушки перед глазами. Кожа больного сухая и красная. В течение последующих суток состояние его ухудшается. Появляется жажда, боли в животе, одновременно головная боль, сильные боли в икроножных мышцах, двоение в глазах.
В тяжелых случаях часто наступает слепота. Появляются судороги, возбуждение, напряжение затылочных мышц. Нарушается сердечный ритм, падает давление. Если количество выпитого спирта близко к смертельной дозе, наступает кома и остановка дыхания. Возможно молниеносное развитие отравления со смертельным исходом.
Этиловый спирт частично нейтрализует метанол.
Этиленгликоль. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом.
Применяется как компонент автомобильных антифризов и тормозных жидкостей, в производстве целлофана, полиуретанов и ряда других полимеров, как растворитель красящих веществ.
Смертельная доза его равна 100-300 мл. После 6-8 часов от приема этиленгликоля возникают головная боль, боли в пояснице, животе; жажда, понос, рвота. Кожа и слизистые сухие, красные, с синюшным оттенком.
При тяжелом отравлении больной возбужден, зрачки расширены. Позднее появляются судороги, больной теряет сознание. В терминальной стадии развивается сердечная недостаточность с отеком легких, острая печеночная и почечная недостаточность, смерть.
Что делать при отравлении суррогатами алкоголя
При подозрении на отравление суррогатами алкоголя надо срочно вызвать скорую помощь, так как тяжесть состояния может нарастать очень быстро.
Если пострадавший в сознании, до прибытия врача ему надо дать выпить теплую воду в большем количестве и затем вызвать рвоту.
Человека без сознания укладывают на бок, очищают рот и носоглотку от рвотных масс. Чтобы не допустить западение языка, выводят его из полости рта и фиксируют.
Если точно известно, что отравление вызвал метиловый спирт, больному, находящемуся в сознании, можно дать выпить коньяк или водку.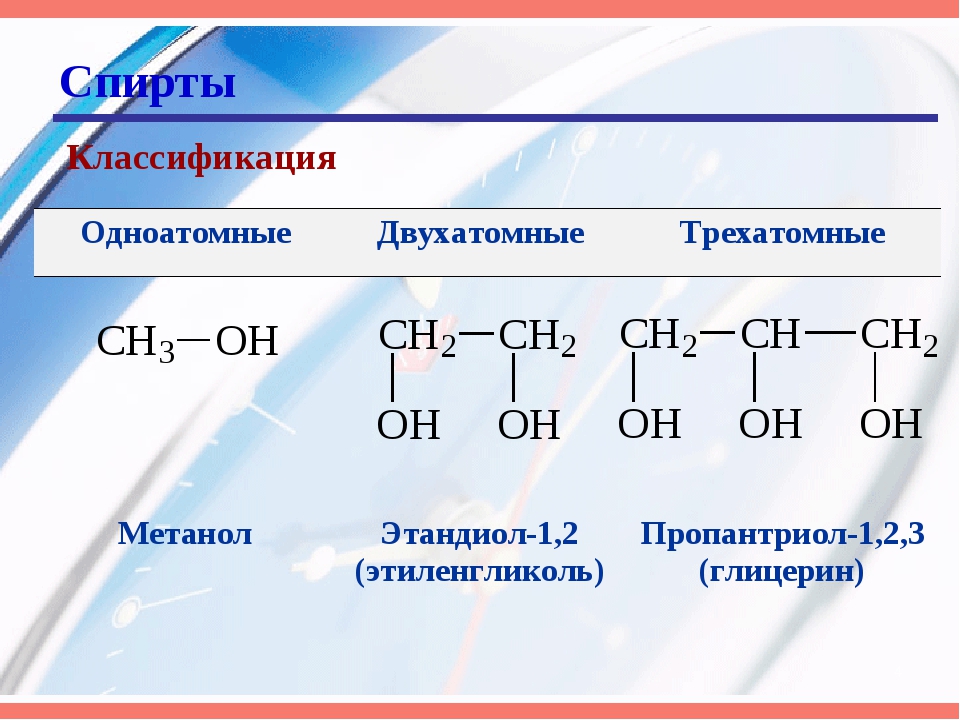 Содержащийся в них этиловый спирт частично нейтрализует метанол.
Содержащийся в них этиловый спирт частично нейтрализует метанол.
Профилактика отравлений суррогатами алкоголя
Самая надежная профилактика отравлений – никогда не употреблять суррогаты алкоголя. Чтобы избежать случайных отравлений, храните продукты бытовой химии отдельно, в посуде, имеющей соответствующие надписи.
Покупайте все спиртные напитки в хорошо проверенных, пользующихся отличной репутацией специализированных магазинах.
А лучше не пейте вообще. Помните, алкоголь вреден для здоровья!
Химические свойства фенола — урок. Химия, 10 класс.
Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензольного кольца.
Реакции гидроксильной группы
Фенол так же, как насыщенные одноатомные спирты, реагирует с активными металлами. Но из-за действия бензольного кольца на гидроксильную группу кислотные свойства фенола выражены сильнее, чем у алканолов, и фенол взаимодействует также со щелочами.
1. Взаимодействие с активными металлами:
2C6H5OH+2Na→2C6H5ONa+h3↑.
В этой реакции образуется фенолят, хорошо растворимый в воде.
2. Взаимодействие со щелочами:
C6H5OH+NaOH→C6H5ONa+h3O.
Кислотные свойства фенола выражены слабо. Они слабее, чем у угольной кислоты, что подтверждается реакцией при пропускании углекислого газа через раствор фенолята:
C6H5ONa+CO2+h3O→C6H5OH+NaHCO3.
При действии на феноляты других кислот также выделяется фенол:
C6H5ONa+HCl→C6H5OH+NaCl.
Реакции бензольного кольца
1. Галогенирование.
Фенол в отличие от бензола легко вступает в реакцию с бромной водой:
C6H5OH+3Br2→C6h3Br3OH↓+3HBr.
Атомы брома замещают водород в положениях \(2\),\(4\),\(6\). В реакции с бромной водой выпадает белый осадок \(2\),\(4\),\(6\)-трибромфенола.
Эта реакция используется для качественного определения фенола.
Смотреть видео по теме дополнительно:
2. Нитрование.
Фенол легко реагирует с азотной кислотой. Если кислота концентрированная, то в результате реакции образуется \(2\),\(4\),\(6\)-тринитрофенол (пикриновая кислота):
C6H5OH+3HNO3→C6h3(NO2)3OH↓+3h3O.
Структурная формула продукта реакции:
Пикриновая кислота обладает довольно сильными кислотными свойствами.
Качественная реакция на фенол
Фенол можно обнаружить с помощью хлорида железа(\(III\)). Реакция протекает с образованием соединения, имеющего фиолетовую окраску.
Дополнительная информация в видео.
Пояснения к номенклатуре продукции, сведения по которой отражаются в форме N 1-алкоголь / КонсультантПлюс
Пояснения к номенклатуре продукции,
сведения по которой отражаются в форме N 1-алкоголь
Спирт этиловый из пищевого сырья и технический (стр. 001) — спирт, произведенный из пищевого или непищевого сырья методом спиртового брожения либо гидратацией этилена, а также иными способами с последующей перегонкой и ректификацией или без нее с содержанием спирта не менее 88% объема готовой продукции.
001) — спирт, произведенный из пищевого или непищевого сырья методом спиртового брожения либо гидратацией этилена, а также иными способами с последующей перегонкой и ректификацией или без нее с содержанием спирта не менее 88% объема готовой продукции.
По строке 001 приводятся объемы:
— спирта этилового, выработанного из пищевого сырья (из зерновых культур, свеклы, картофеля, патоки, отходов виноделия, головной фракции этилового спирта и др.), а также спирта, полученного в результате переработки в брагоректификационном аппарате возвращенного из ликероводочного производства неисправимого (грязного) брака, при условии соответствия его (спирта) требованиям действующей нормативно-технической документации (строка 002);
— спирта этилового технического (строка 005), в составе которого учитываются спирт этиловый технический синтетический (строка 006), спирт этиловый технический гидролизный (строка 007) и спирт этиловый технический сульфитный (строка 008).
Строка 001 = строка 002 + строка 005.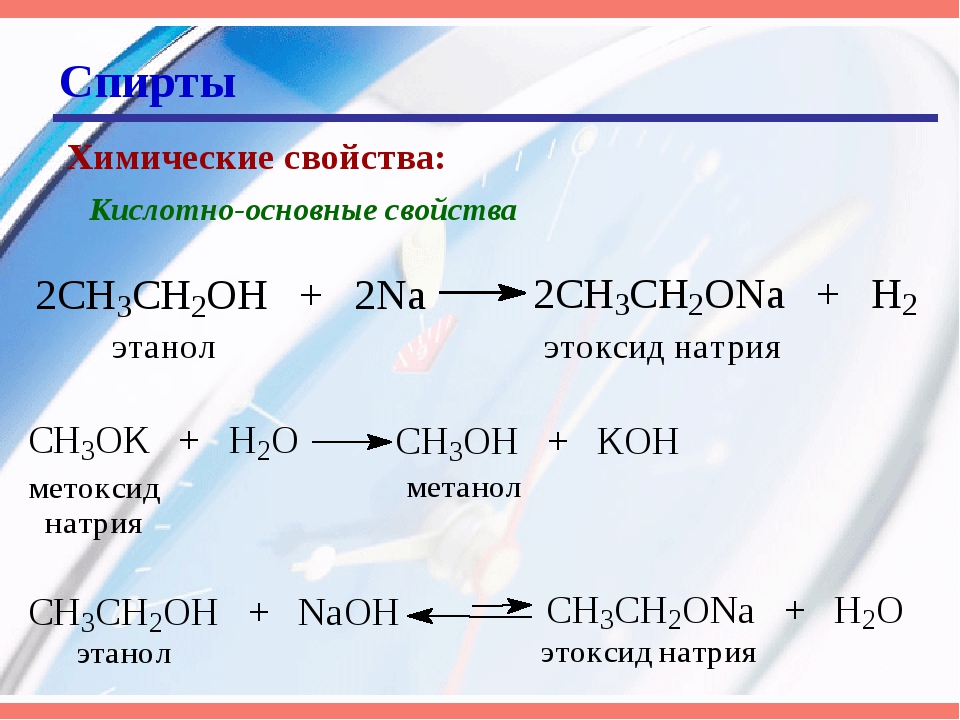
Строка 005 >= строка 006 + строка 007 + строка 008.
Спирт этиловый технический синтетический — спирт, полученный методом органического синтеза, спирт этиловый технический гидролизный — полученный методом гидролиза растительных материалов, спирт этиловый технический сульфитный — полученный путем биохимической переработки древесной массы.
По строкам 003, 009, 011, 013, 015 отражаются данные по спирту этиловому ректификованному, полученному соответственно из пищевого сырья, а также техническому (в целом, в том числе по видам: синтетическому, гидролизному, сульфитному).
Ректификация — осуществляемое в специальных аппаратах разделение многокомпонентных жидких смесей на практически чистые компоненты.
Предприятие, осуществляющее наряду с производством этилового спирта (пищевого или технического) также и его ректификацию в собственных цехах ректификации, в отчетности по форме N 1-алкоголь приводит данные по всем видам произведенных им спиртов, в т.ч. ректификованных (строки 001 — 009, 011, 013, 015).
Предприятие — производитель спирта этилового с дальнейшей его ректификацией в собственных цехах ректификации и предприятие, вырабатывающее спирт-ректификат из пищевого сырья (бражки), при составлении отчетности по форме N 1-алкоголь по всем графам формы должны соблюдать следующие логические контроли:
Строка 002 >= строки 003;
Строка 003 >= строки 004;
Строка 005 >= строки 009;
Строка 006 >= строки 011;
Строка 007 >= строки 013;
Строка 008 >= строки 015;
Строка 009 = строка 011 + строка 013 + строка 015.
Предприятие, осуществляющее только ректификацию полученного от сторонних организаций этилового спирта (пищевого или технического), приводит данные только по ректификованным спиртам, в т.ч. полученным из спирта, принятого на ректификацию от сторонних организаций (строки 003, 004, 009 — 016).
Строка 010 = строка 012 + строка 014 + строка 016.
Все виды этиловых спиртов (из пищевого сырья и технических), спирты коньячные, а также спиртосодержащая денатурированная продукция учитываются в декалитрах в пересчете на безводный этиловый спирт.
Неизбежные технологические потери, обусловленные самой сущностью технологического процесса производства спирта (например, при производстве этилового пищевого спирта — это потери условного крахмала при разваривании, солодоращении, траты сахара на побочное брожение и размножение дрожжей, потери спирта при брагоректификации и т.д.), в объемы его производства не включаются.
Спирт денатурированный (денатурат) из пищевого сырья (строка 017) и спирт этиловый технический денатурированный (строка 019) — этиловый спирт, содержащий добавки красителя или специальные вещества, наличие которых исключает его использование при производстве алкогольной и спиртосодержащей пищевой продукции.
Предприятие, осуществляющее наряду с производством этилового спирта (пищевого или технического) также и его денатурацию в собственных цехах денатурации, в отчетности по форме N 1-алкоголь приводит данные по всем видам произведенных им спиртов, в т.ч. денатурированных (строки 001, 002, 005 — 008, 017 и 019).
Предприятие, осуществляющее только денатурацию полученного от сторонних организаций этилового спирта (пищевого или технического), приводит данные только по денатурированным спиртам, в т.ч. полученным из спирта, принятого на денатурацию от сторонних организаций (строки 017 — 020).
Предприятие — производитель спирта этилового с дальнейшей его денатурацией в собственных цехах денатурации при составлении отчетности по форме N 1-алкоголь по всем графам формы должно соблюдать следующие логические контроли:
Строка 002 >= строки 017;
Строка 005 >= строки 019;
Строка 017 >= строки 018;
Строка 019 >= строки 020.
Спирт этиловый (головная фракция) из отходов пищевого спирта (строка 021) является промежуточным этапом технологического процесса производства этилового спирта и, как правило, полностью перерабатывается с целью получения конечного продукта.
Спирт этиловый (головная фракция) из отходов пищевого спирта не учитывается в составе спирта этилового из пищевого сырья.
Спирт-сырец этиловый виноградный (строка 022) — продукт с объемной долей этилового спирта не менее 40%, произведенный путем перегонки виноматериалов, сброженных виноградных выжимок, дрожжевых и клеевых осадков.
Спирты коньячные (строка 023) — винный дистиллят с объемной долей этилового спирта 55 — 70%, произведенный фракционной перегонкой виноматериалов с объемной долей этилового спирта не менее 7,5% и находившийся в постоянном контакте с древесиной дуба в течение всего периода выдержки.
Дистилляты виноградные и плодовые (строка 024) — продукты с объемной долей этилового спирта 52 — 86%, произведенные путем перегонки виноматериалов, сброженных плодовых сусел, спирта-сырца виноградного или плодового, виноградных или плодовых выжимок, дрожжевых или гущевых осадков.
Спирт этиловый (головная фракция) из отходов пищевого спирта, спирт-сырец этиловый виноградный, спирты коньячные, дистилляты виноградные и плодовые в объем спирта этилового из пищевого сырья и технического не включаются, а учитываются самостоятельно.
Спирт этиловый питьевой 95% (строка 032) — ректификованный этиловый спирт, произведенный из пищевого сырья, разведенный умягченной водой до 95% объема готовой продукции.
Виноматериалы — сырье для изготовления вина, полученное в результате спиртового брожения виноградного сусла, виноградной мезги либо плодового сока с добавлением или без добавления этилового спирта, произведенного из пищевого сырья, с содержанием этилового спирта не более 22,5% объема готовой продукции.
Виноматериалы не относятся к винам виноградным и винам плодовым и учитываются отдельно.
Виноматериалы виноградные необработанные (строка 025) — виноматериалы для производства шампанских вин, вырабатываемых из сортов винограда, установленных национальным стандартом.
Виноматериалы виноградные обработанные (строка 026) — виноматериалы, прошедшие полный цикл технологической обработки, установленный для данного вида виноматериалов технологическими инструкциями.
Соки спиртованные от 20 град. до 25 град. для ликероводочных изделий — это полуфабрикаты, получаемые путем прессования дробленого свежего плодово-ягодного сырья и консервирования полученного сока с этиловым ректификованным спиртом.
до 25 град. для ликероводочных изделий — это полуфабрикаты, получаемые путем прессования дробленого свежего плодово-ягодного сырья и консервирования полученного сока с этиловым ректификованным спиртом.
В позицию «Водка и ликероводочные изделия» (строка 029) согласно Общероссийскому классификатору продукции ОК-005-93 включаются все виды водок и спирт этиловый питьевой 95% (код 918110), изделия ликероводочные крепостью 30% и свыше (бальзамы, джины, ромы, ликеры, аперитивы, настойки полусладкие и горькие, напитки крепкие из плодового спирта, коктейли и прочие) (918120), наливки и настойки сладкие крепостью менее 30% (918130), изделия ликероводочные слабоградусные крепостью менее 30% (918140).
Строка 029 >= строка 030 + строка 031 + строка 032.
Водки и особые водки — спиртные напитки крепостью 40,0 — 45,0%, 50,0 — 56,0%, полученные обработкой специальным адсорбентом водно-спиртового раствора, с добавлением ингредиентов или без них, с последующим фильтрованием.
Ликероводочные изделия — спиртные напитки крепостью 6,0 — 60,0%, а именно: ликеры, кремы, наливки, пунши, настойки (в том числе сладкие, полусладкие, полусладкие слабоградусные, горькие, горькие слабоградусные), напитки десертные, аперитивы, бальзамы, джины, коктейли различной органолептической и цветовой гаммы с различным содержанием сахара, изготавливаемые смешиванием полуфабрикатов, ингредиентов и других пищевых добавок со спиртом-ректификатом и исправленной питьевой водой.
Ликероводочные изделия с объемной долей этилового спирта до 25% (включительно) (строка 030) — те же спиртные напитки крепостью до 25% (включительно).
Вино — алкогольная продукция, произведенная из виноматериалов, с содержанием этилового спирта, произведенного из пищевого сырья, не более 22% объема готовой продукции.
Виноградные вина (строка 033) — вина, выработанные из виноградных материалов. Шипучее виноградное вино, искусственно насыщенное углекислотой путем сатурации, относится к виноградным винам и включается в общий объем их производства. Полусухие и полусладкие вина следует также относить к виноградным винам.
Вина натуральные виноградные (молодые, без выдержки, выдержанные и марочные (строки 034, 035 и 036) — вина, произведенные без добавления этилового спирта или винного дистиллята.
В состав показателя «Вина натуральные молодые, без выдержки» (строка 034) включаются вина молодые и вина без выдержки.
Предприятия — производители виноградных вин при составлении отчетности по форме N 1-алкоголь должны соблюдать следующий логический контроль по всем графам формы:
строка 033 >= строка 034 + строка 035 + строка 036.
Плодовые вина (строка 037) — вина, выработанные из соков плодово-ягодных спиртованных, виноматериалов плодовых сброженно-спиртованных, соков плодовых и ягодных концентрированных. Сидр и шипучие (газированные), а также полусладкие и полусухие плодово-ягодные вина относятся к плодовым винам.
Сидр — слабоалкогольный напиток, произведенный путем сбраживания яблочного сусла с добавлением сахара или без него, с последующим насыщением двуокисью углерода эндогенного или экзогенного (газированного) происхождения.
Медовые вина — вина, произведенные путем спиртового брожения медового сусла с добавлением или без добавления сахара и спирта.
Медовые напитки — напитки, произведенные на основе брожения медового сусла с добавлением или без добавления сахара и спирта, настоев пряно-ароматического сырья, пищевых вкусоароматических добавок и других компонентов.
Строка 037 >= строки 038.
Напитки винные (виноградные и плодовые) (строка 039) — алкогольные напитки с объемной долей этилового спирта 5 — 28%, получаемые из виноградных и плодовых виноматериалов с добавлением или без добавления этилового спирта из пищевого сырья, коньячных, виноградных, плодовых спиртов или дистиллятов, винных концентратов, сахаросодержащих, пищевых вкусоароматических добавок и воды.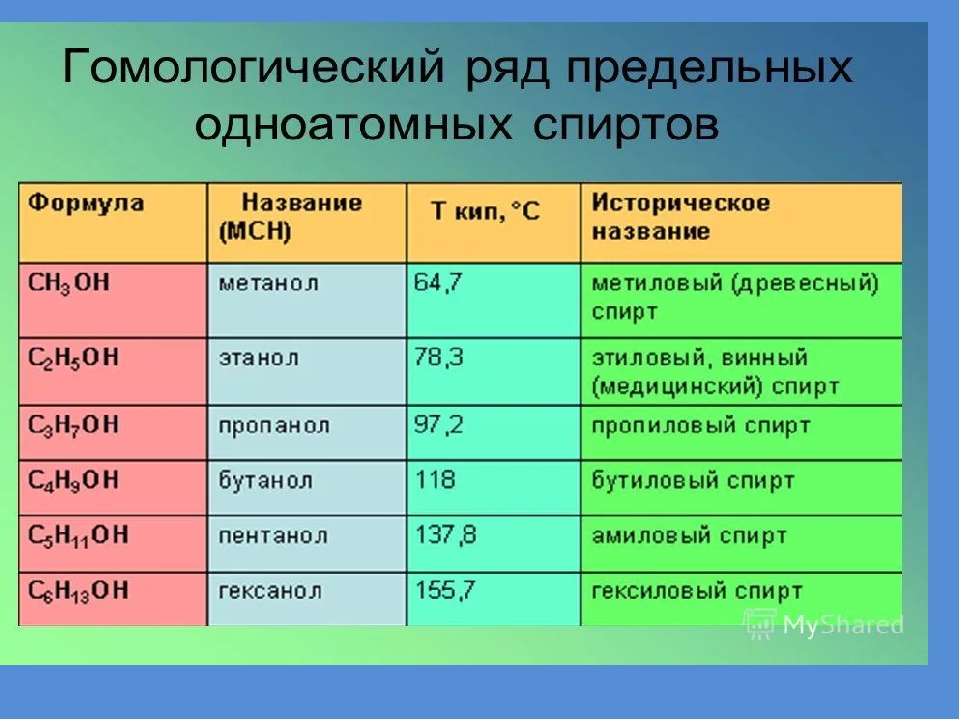
По строке 039 также учитываются напитки и коктейли винные газированные крепостью свыше 9%, но не более 20%.
Коктейли винные газированные — алкогольные напитки, произведенные путем смешивания виноградных или плодовых виноматериалов или их концентратов со спиртом, водой, с использованием вкусоароматических добавок или без них, с насыщением двуокисью углерода.
По строке 040 учитываются слабоалкогольные напитки с содержанием этилового спирта не более 9%, в том числе джин-тоник.
По строке 041 приводятся данные по винам шампанским и игристым.
Вина шампанские — вина, насыщенные двуокисью углерода эндогенного происхождения при вторичном брожении необработанных виноградных виноматериалов в бутылках или резервуарах под давлением.
Вина игристые — вина, насыщенные двуокисью углерода эндогенного происхождения при вторичном брожении обработанных и необработанных виноматериалов в бутылках или резервуарах под давлением.
Коньяки (строка 042) — крепкие спиртные напитки, выработанные из выдержанного не менее 3 лет коньячного спирта, крепостью не ниже 40%.
По строке 043 учитываются коньячные напитки и бренди.
Коньячные напитки — алкогольные напитки, произведенные из коньячных спиртов, выдержанных в контакте с древесиной дуба не менее 1 года, с добавлением при необходимости сахара, колера, дубового экстракта и воды.
Бренди — крепкие алкогольные напитки, вырабатываемые из коньячного или виноградного спирта с добавлением различных компонентов в соответствии с техническими условиями на данный вид продукции.
Коньяки в указанную позицию не включаются.
Кальвадосы (строка 044) — алкогольные напитки, произведенные из выдержанных или молодых яблочных спиртов или дистиллятов, с использованием компонентов древесины дуба.
Спиртосодержащая денатурированная продукция — продукция, приготовленная из спиртосодержащих отходов ликероводочного и спиртового производств, с добавлением различных денатуратов и красителей, предусмотренных рецептурой в количествах, исключающих возможность использования ее для производства алкогольной и пищевой продукции.
Спиртосодержащая денатурированная продукция является сырьем для производства парфюмерно-косметической продукции, товаров бытовой химии и другой продукции, в состав которой входят спирты.
Готовая парфюмерно-косметическая продукция (лосьоны, одеколоны) и товары бытовой химии (аэрозоли, средства для мытья посуды), розлитые в потребительскую тару, в отчете по форме N 1-алкоголь не отражаются.
С введением настоящего Порядка отменяется ранее действовавшая Инструкция по заполнению формы федерального государственного статистического наблюдения за производством спирта этилового, спиртосодержащей, алкогольной продукции и розливом алкогольной продукции, утвержденная Постановлением Госкомстата России от 09.11.2001 N 83.
Управление статистики
предприятий и других
хозяйствующих субъектов
Самое важное об изопропиловом спирте — Екотеп
В продуктовой линейке компании «Экотеп» присутствуют товары не только для полиграфии, но и некоторые универсальные средства с очень широким спектром применения. Именно таков изопропанол — надежный очиститель, качественный растворитель, экстрагент, стабилизатор и даже антисептик! Читайте дальше, чтобы узнать: возможно, спирт изопропиловый — это именно то, что нужно вам!
Именно таков изопропанол — надежный очиститель, качественный растворитель, экстрагент, стабилизатор и даже антисептик! Читайте дальше, чтобы узнать: возможно, спирт изопропиловый — это именно то, что нужно вам!
Прежде, чем мы поговорим о применении изопропилового спирта в полиграфии и не только, выясним, что же это за жидкость.
Спирт изопропиловый, сокращенно — изопропанол (он же втор-пропанол, пропанол-2 или ИПС) — это жидкость, образованная в результате гидрирования ацетона или гидратации пропилена. На вид жидкость является абсолютно прозрачной и имеет резкий запах. По своей формуле изопропанол не отличается от других вторичных спиртов жирного ряда.
Изопропиловый спирт: применениеЦенность изопропанола — в его возможностях, в частности растворимых. Благодаря им, соединение эффективно используют абсолютно в разных отраслях:
- используется как дополнение к увлажнению (увлажняющему раствору) в печатном процессе
- для изготовления стеклоомывателей с разной степенью морозостойкости в автохимии
- для очистки медных кабелей от окисления в металлургии
- как растворитель в лакокрасочной промышленности
- для изготовления бурильного раствора в газодобыче
- для удаления смол при деревообработке
- как заменитель этилового спирта в изготовлении парфюмерии, косметических средств, салфеток
- для изготовления бытовых химикатов
- для изготовления антисептических жидкостей в фармацевтике
- для проведения гистологических исследований в медицине и др.

Поговорим более подробно о некоторых из сфер использования.
Изопропиловый спирт в полиграфииКачественный изопропиловый спирт купить можно в нашей компании. Поскольку мы предлагаем товары для полиграфии, в первую очередь, расскажем о применении изопропанола в печатном деле.
В полиграфии спирт используется как добавка к увлажняющему раствору. Часть ИПС от общего состава раствора составляет 12-14%. Изопропанол в составе раствора позволяет уменьшить толщину водного слоя на печатной форме.
Кроме того, ИПС можно применять для обезжиривания в подготовке поверхностей для нанесения пленки, клея или ленты и очистки высокоточных инструментов и оптических приборов.
Узнать больше об ИПС, который поставляет компания «Экотеп», загрузить сертификат качества и узнать контакты менеджера, чтобы купить изопропанол, вы можете на нашем специальном сайте.
Использование в бытуИзопропанол купить можно и для бытовых нужд. Жидкость не является токсичной, и ее используют для дезинфекции и обработки. ИПС прекрасно справляется с очисткой стекла (подходит для мытья окон), поверхностей на кухне, чистки сантехники. Однозначное преимущество такого спирта по сравнению с бытовой химией — отсутствие опасных компонентов, которые могут вызвать раздражение и аллергии. Однако, не следует забывать, что применение изопропанола внутрь строго запрещено! Он не должен контактировать с продуктами питания и не используется для изготовления лекарств, принимаемых внутрь — только как антисептик.
Жидкость не является токсичной, и ее используют для дезинфекции и обработки. ИПС прекрасно справляется с очисткой стекла (подходит для мытья окон), поверхностей на кухне, чистки сантехники. Однозначное преимущество такого спирта по сравнению с бытовой химией — отсутствие опасных компонентов, которые могут вызвать раздражение и аллергии. Однако, не следует забывать, что применение изопропанола внутрь строго запрещено! Он не должен контактировать с продуктами питания и не используется для изготовления лекарств, принимаемых внутрь — только как антисептик.
Безопасность — прежде всего, поэтому не стоит забывать, что изопропанол — это спирт, и поэтому его взаимодействие с огнем недопустимо. Воздержитесь от работы с жидкостью ИПС и при высоких температурах, чтобы предупредить возгорание. Нельзя использовать изопропиловый спирт в работе с резиной и пластмассой.
Прежде чем изопропанол купить, ознакомьтесь с дополнительной информацией в соответствующей категории. Там вы узнаете больше о производителе и упаковки ИПС, которые можно заказать в компании «Экотеп».
Там вы узнаете больше о производителе и упаковки ИПС, которые можно заказать в компании «Экотеп».
Пропоксилированный жирный спирт C12-14. Группа PCC!
Чтобы связаться с нами при помощи выше излагаемого вопросника, заполните пожалуйста данные, указанные в анкете. Предоставление данных является добровольным, но если Вы этого не сделаете, у Вас не будет возможности отправить нам сообщение таким образом.
Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящаяся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша). Вы можете связаться с нашим инспектором по защите персональных данных при помощи электронной почты: hide_email_a address=»[email protected]».
Мы обрабатываем Ваши данные для общения с Вами и чтобы отвечать на Ваши вопросы. Основанием для обработки Ваших данных является реализация законодательно обоснованной заинтересованности администратора или законодательно обоснованная заинтересованность третьей стороны (обратная связь с Вами, маркетинг наш или наших партнеров, в частностиКомпании PCC, на который Вы можете не выразить своего согласия), либо обработка Вашего запроса перед заключением потенциального договора в зависимости от содержания Вашего сообщения.
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Спирты, подготовка к ЕГЭ по химии
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.
В результате реакции раствор
окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Спирт изопропиловый абсолютированный
Внешний вид: Бесцветная, прозрачная жидкость, не содержащая механических примесей
Плотность при 20°С, г/см3: 0,785 — 0,786
Массовая доля изопропилового спирта, %, не менее: 99,7
Цветность по платиново-кобальтовой шкале, не более: 5
Массовая доля кислот в пересчете на уксусную кислоту, % не более: 0,0007
Массовая доля сернистых соединений в пересчете на серу, % не более: 0,00005
Бромное число, г брома на 100 г спирта, не более: 0,006
Массовая доля воды, % не более: 0,15
Массовая доля диизопропилового эфира, % не более: 0,03
Смешиваемость с водой: выдерживает испытание
Массовая доля ацетона, % не более: 0,03
Массовая доля нелетучего остатка, % не более: 0,0005
Описание: спирт изопропиловый абсолютированный — Пропанол-2, изопропанол.
Опасное воздействие на человека: 3 класс опасности (вещества умеренно опасные).
Упаковка и тара: отгрузка продукции производится в железнодорожных цистернах и автомобильным транспортом.
Применение: изопропиловый спирт применяется в полиграфии, химической, нефтеперерабатывающей, медицинской, мебельной, пищевой, лесохимической, парфюмерной промышленности.
Полиграфия: изопропиловый спирт используют для увлажнения в печатных процессах.
Химия: изопропиловый спирт используется для производства ацетона, для синтеза изопропил ацетата и других сложных эфиров, в производстве пластмасс для промывки полимера (производство полиэтилена низкого давления и полипропилен).
Лакокрасочная промышленность: изопропиловый спирт применяется в качестве вспомогательного растворителя нитроцеллюлозы, ацетилцеллюлозы, этилцеллюлозы.
Нефтеперерабатывающая промышленность: изопропиловый спирт применяется как растворитель карбамида, раствор которого в спирте применяется для депарафинизации дизельных топлив, как экстрагент в смеси с метанолом и водой в процессе селективной
экстракции нафтеновых кислот, в качестве добавки к маслам для повышения их качества в части антикоррозийных свойств и температуры застывания, для удаления воды из бензиновых емкостей.
Медицина: изопропиловый спирт используется как антисептик, обеззараживающее средство, при изготовлении медицинских экстрагентов, растворительных эссенций и смол.
Изопропиловый спирт применяется в качестве экстрагентов чистых вещей или примесей в тонкой химической технологии, а также в производстве парфюмерии и косметических средств.
Лесохимическая промышленность: изопропиловый спирт в смеси с другими растворителями применяется для экстракции смол из древесины.
Деревообрабатывающая и мебельная промышленности: изопропиловый спирт применяется в качестве растворителя различных масел, клеев и т. д., для снятия старых лаковых покрытий.
Авиация: Изопропиловый спирт применяется в качестве стабилизатора авиационного бензина и антиобледенителя.
Транспорт: изопропиловый спирт применяется в качестве компонента моторного топлива для повышения его октанового числа.
Гарантийный срок хранения: один год со дня изготовления продукта.
Вернуться в каталог
Заказ продукции
14.
 2: Спирты. Номенклатура и классификация
2: Спирты. Номенклатура и классификация
-
- Последнее обновление
- Сохранить как PDF
- Номенклатура спиртов
- Классификация спиртов
- Резюме
- Упражнения по обзору концепции
- Ответы
- Упражнения
- Ответы
Цели обучения
- Определите общую структуру спирта.
- Определите структурную особенность, которая классифицирует спирты как первичные, вторичные или третичные.
- Назовите спирты как общепринятыми названиями, так и названиями IUPAC
Спирт представляет собой органическое соединение с гидроксильной (ОН) функциональной группой на алифатическом атоме углерода. Поскольку ОН является функциональной группой всех спиртов, мы часто представляем спирты общей формулой ROH, где R представляет собой алкильную группу. Спирты широко распространены в природе. Большинство людей знакомы с этиловым спиртом (этанолом), активным ингредиентом алкогольных напитков, но это соединение является лишь одним из семейства органических соединений, известных как спирты.В семейство также входят такие знакомые вещества, как холестерин и углеводы. Метанол (СН 3 ОН) и этанол (СН 3 СН 2 ОН) являются первыми двумя членами гомологического ряда спиртов.
Спирты широко распространены в природе. Большинство людей знакомы с этиловым спиртом (этанолом), активным ингредиентом алкогольных напитков, но это соединение является лишь одним из семейства органических соединений, известных как спирты.В семейство также входят такие знакомые вещества, как холестерин и углеводы. Метанол (СН 3 ОН) и этанол (СН 3 СН 2 ОН) являются первыми двумя членами гомологического ряда спиртов.
Номенклатура спиртов
Спирты с одним-четырьмя атомами углерода часто называют общепринятыми названиями, в которых за названием алкильной группы следует слово спирт :
Согласно Международному союзу теоретической и прикладной химии (IUPAC), спирты получают путем изменения окончания названия исходного алкана на — ol .Вот некоторые основные правила ИЮПАК для обозначения спиртов:
- За исходное соединение принимается самая длинная непрерывная цепь (НЦЦ) атомов углерода, содержащая ОН-группу — алкан с таким же числом атомов углерода.
 Цепь нумеруется с конца, ближайшего к ОН-группе.
Цепь нумеруется с конца, ближайшего к ОН-группе. - Число, указывающее положение группы ОН, ставится перед названием исходного углеводорода, а окончание — e исходного алкана заменяется суффиксом — ол . (В циклических спиртах атом углерода, несущий группу ОН, обозначается C1, но цифра 1 в названии не используется.) Заместители названы и пронумерованы, как в алканах.
- Если в одной и той же молекуле присутствует более одной группы ОН (полигидроксиспирты), используются такие суффиксы, как — диол и — триол . В этих случаях сохраняется окончание — и исходного алкана.
На рисунке \(\PageIndex{1}\) показаны некоторые примеры применения этих правил.
Рисунок \(\PageIndex{1}\): Правила ИЮПАК для спиртов. Названия и структуры некоторых спиртов демонстрируют использование правил IUPAC.
Пример \(\PageIndex{1}\)
Дайте название IUPAC для каждого соединения.
- HOCH 2 CH 2 CH 2 CH 2 CH 2 OH
Раствор
- Десять атомов углерода в LCC делают соединение производным декана (правило 1), а ОН на третьем атоме углерода делает его 3-деканолом (правило 2).

Атомы углерода нумеруются с конца, ближайшего к группе ОН. Это фиксирует две метильные группы (CH 3 ) в шестом и восьмом положениях. Название 6,8-диметил-3-деканол (не 3,5-диметил-8-деканол).
- Пять атомов углерода в LCC делают соединение производным пентана. Две группы ОН у первого и пятого атомов углерода делают соединение диолом и дают название 1,5-пентандиол (правило 3).
Упражнение \(\PageIndex{1}\)
Дайте название IUPAC для каждого соединения.
Пример \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 2-гексанол
- 3-метил-2-пентанол
Раствор
- Окончание — ол указывает на спирт (функциональная группа ОН), а hex — основа говорит нам о том, что в LCC шесть атомов углерода.
 Начнем с рисования цепочки из шести атомов углерода: –C–C–C–C–C–C–.
Начнем с рисования цепочки из шести атомов углерода: –C–C–C–C–C–C–.Цифра 2 означает, что группа ОН присоединена ко второму атому углерода.
Наконец, мы добавляем столько атомов водорода, чтобы у каждого атома углерода было четыре связи.
- Окончание — ол указывает на функциональную группу ОН, а пент — основа говорит нам о том, что в LCC пять атомов углерода. Начнем с рисования цепочки из пяти атомов углерода: –C–C–C–C–C–
Цифры указывают на наличие метильной группы (CH 3 ) у третьего атома углерода и группы ОН у второго атома углерода.
Упражнение \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
Резюме
В системе IUPAC спирты получают путем изменения окончания названия исходного алкана на — ol . Спирты классифицируются по количеству атомов углерода, присоединенных к атому углерода, присоединенному к группе ОН.
Упражнения по обзору концепции
-
Является ли изобутиловый спирт первичным, вторичным или третичным? Объяснять.
-
Что такое LCC в 2-этил-1-гексаноле? Что принимают за LCC при наименовании соединения? Объяснять.
Ответы
-
первичный; атом углерода, несущий группу ОН, присоединен только к одному другому атому углерода
-
7 атомов углерода; цепочка из 6 атомов включает атом углерода, несущий ОН-группу
Ответы
-
- 1-гексанол; первичный
- 3-гексанол; вторичный
- 3,3-дибром-2-метил-2-бутанол; высшее
Спирт в химии: виды, применение и формула
Номенклатура
Спиртовая функциональная группа гидроксил представляет собой группу -ОН. При наименовании спиртов из названия углеводорода удаляется -e и добавляется суффикс -ol . Число перед названием углеводорода говорит о местонахождении спиртовой группы.
При наименовании спиртов из названия углеводорода удаляется -e и добавляется суффикс -ol . Число перед названием углеводорода говорит о местонахождении спиртовой группы.
Например, в 1-бутаноле четыре атома углерода, поэтому исходное название углеводорода — бутан. -e удаляется из бутана и добавляется -ol, в результате чего получается бутанол. 1 указывает, что спиртовая группа находится на первом углероде.
Углеродная цепь должна быть пронумерована таким образом, чтобы спирт имел наименьший номер.Называя молекулу 1-бутанолом, вы можете назвать ее либо 4-бутанолом, либо 1-бутанолом, в зависимости от того, с какой стороны молекулы вы начинаете считать. Поскольку 1 меньше, чем 4, 1-бутанол является правильным. Если в молекуле две спиртовые группы, суффикс меняется на -диол .
Классификация молекул спирта
Молекулы можно классифицировать на основе количества спиртовых групп.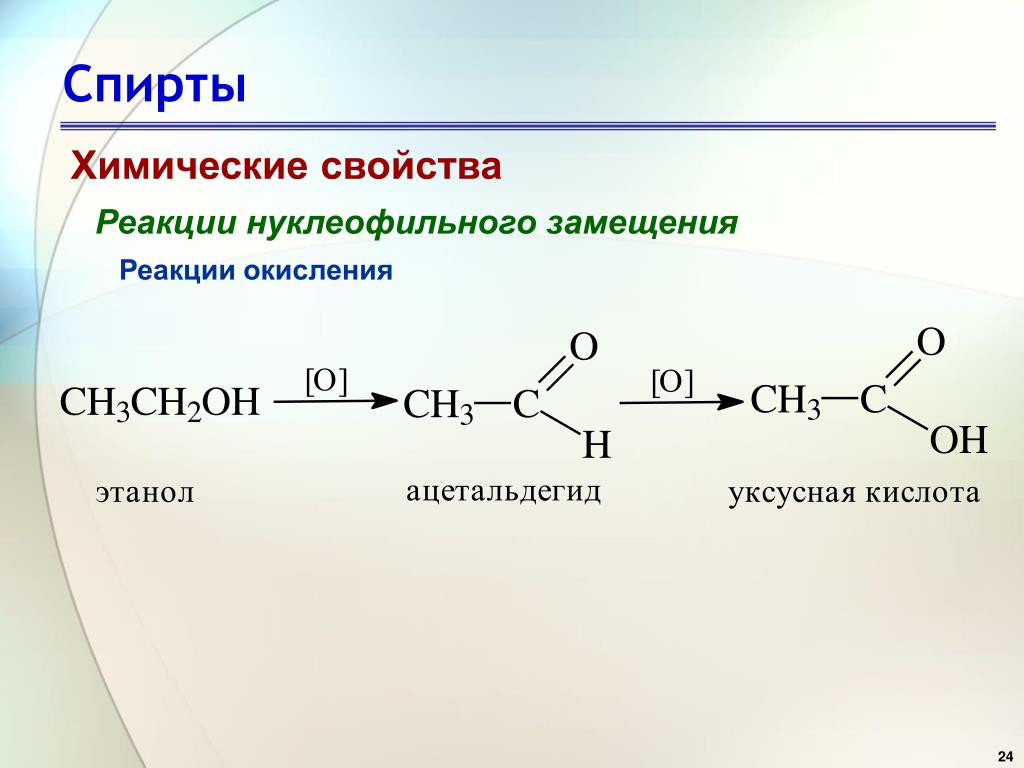
- одноатомный -одна спиртовая группа в молекуле
- двухатомный — две спиртовые группы на молекулу
- многоатомный — более 2 спиртовых групп на молекулу
Растворимость
Количество спиртовых групп в молекуле влияет на ее растворимость .По мере увеличения количества спиртовых групп в молекуле с тем же числом атомов углерода растворимость в воде увеличивается. Например, 1,4-бутандиол лучше растворим в воде, чем 1-бутанол.
Другой способ думать об этом состоит в том, что по мере увеличения числа атомов углерода в спирте растворимость в воде уменьшается. Так, 1-октанол с восемью атомами углерода на спиртовую группу менее растворим в воде, чем 1-бутанол с четырьмя атомами углерода на спиртовую группу.
Так, 1-октанол с восемью атомами углерода на спиртовую группу менее растворим в воде, чем 1-бутанол с четырьмя атомами углерода на спиртовую группу.
Классификация функциональных групп спиртов
Спирты также можно классифицировать на основе углерода, к которому они присоединены.
- первичный — спирт присоединен к углероду с двумя атомами водорода
- вторичный — спирт присоединен к углероду с одним водородом
- третичный — спирт присоединен к атому углерода без водорода
Реакционная способность
Различные классы спиртов реагируют по-разному.Например, первичный и вторичный спирты будут реагировать с окислителями, а третичный спирт — нет. Это связано с тем, что для того, чтобы произошла реакция окисления, водород должен быть удален из углерода рядом со спиртом. Поскольку третичные спирты не имеют водорода на углероде рядом со спиртом, окисление не происходит.
Поскольку третичные спирты не имеют водорода на углероде рядом со спиртом, окисление не происходит.
Краткий обзор урока
Спирты — это молекулы, содержащие гидроксильную или спиртовую функциональную группу -ОН.Глядя на молекулу, вы можете определить функциональную группу спирта, найдя -ОН. Молекулы можно классифицировать по количеству спиртовых групп, которые они содержат.
- одноатомный — молекула с одной спиртовой группой
- двухатомный — молекула с двумя спиртовыми группами
- многоатомный — молекула с более чем двумя спиртовыми группами
Отношение спиртовой группы к атомам углерода будет влиять на растворимость молекулы в воде.Чем больше спиртовых групп, тем лучше растворим спирт в воде.
Кроме того, сами спиртовые группы можно классифицировать по количеству атомов водорода у соседнего атома углерода:
- первичные — два атома водорода
- вторичный — один водород
- третичный — без водорода
Эта классификация влияет на реакционную способность спиртовых групп в реакциях окисления. Итак, в следующий раз, когда вы будете пить пиво, вы сможете классифицировать алкоголь и предсказать его растворимость и реакционную способность и произвести впечатление на своих друзей!
Итак, в следующий раз, когда вы будете пить пиво, вы сможете классифицировать алкоголь и предсказать его растворимость и реакционную способность и произвести впечатление на своих друзей!
Реактивность спирта
Реактивность спиртаАлкоголь Номенклатура
В системе номенклатуры IUPAC функциональные группы обычно обозначаются одним из двух способов.На наличие функции может указывать характерный суффикс и номер места. Это характерно для двойных и тройных связей углерод-углерод, которые имеют соответствующие суффиксы ene и yne . Галогены, с другой стороны, не имеют суффикса и называются заместителями, например: (CH 3 ) 2 C=CHCHClCH 3 представляет собой 4-хлор-2-метил-2-пентен. Если вы не уверены в правилах IUPAC для номенклатуры, вам следует просмотреть их сейчас.
Спирты обычно называют по первой процедуре и обозначают суффиксом ol , как в этаноле, CH 3 CH 2 OH (обратите внимание, что номер локатора не требуется для двухуглеродной цепи).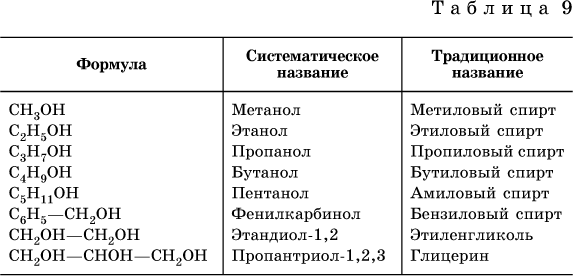 В более длинных цепях расположение гидроксильной группы определяет нумерацию цепей. Например: (CH 3 ) 2 C=CHCH(OH)CH 3 представляет собой 4-метил-3-пентен-2-ол. Другие примеры номенклатуры ИЮПАК показаны ниже вместе с общими названиями, часто используемыми для некоторых более простых соединений.Для монофункциональных спиртов эта общая система состоит из обозначения алкильной группы , за которой следует слово спирт . Спирты также могут быть классифицированы как первичные, 1° , вторичные, 2° и третичные, 3° , таким же образом, как и алкилгалогениды. Эта терминология относится к алкильному замещению атома углерода, несущего гидроксильную группу (выделена синим цветом на иллюстрации).
В более длинных цепях расположение гидроксильной группы определяет нумерацию цепей. Например: (CH 3 ) 2 C=CHCH(OH)CH 3 представляет собой 4-метил-3-пентен-2-ол. Другие примеры номенклатуры ИЮПАК показаны ниже вместе с общими названиями, часто используемыми для некоторых более простых соединений.Для монофункциональных спиртов эта общая система состоит из обозначения алкильной группы , за которой следует слово спирт . Спирты также могут быть классифицированы как первичные, 1° , вторичные, 2° и третичные, 3° , таким же образом, как и алкилгалогениды. Эта терминология относится к алкильному замещению атома углерода, несущего гидроксильную группу (выделена синим цветом на иллюстрации).
Многие функциональные группы имеют характерное обозначение суффикса, и только один такой суффикс (кроме «ene» и «yne») может использоваться в имени.Когда гидроксильная функциональная группа присутствует вместе с функцией более высокого номенклатурного приоритета, она должна цитироваться и располагаться с помощью префикса гидрокси и соответствующего номера. Например, молочная кислота имеет название IUPAC 2-гидроксипропановая кислота.
Например, молочная кислота имеет название IUPAC 2-гидроксипропановая кислота.
Соединения, содержащие функциональную группу C–S–H, называются тиолами или меркаптанами . Название IUPAC (CH 3 ) 3 C–SH представляет собой 2-метил-2-пропантиол, обычно называемый трет-бутилмеркаптаном.Химия тиолов здесь описываться не будет, за исключением того, что они являются более сильными кислотами и более мощными нуклеофилами, чем спирты.
Алкогольные реакции
Функциональной группой спиртов является гидроксильная группа, –OH . В отличие от алкилгалогенидов, эта группа имеет две реакционноспособные ковалентные связи: связь С-О и связь О-Н. Электроотрицательность кислорода значительно больше, чем у углерода и водорода. Следовательно, ковалентные связи этой функциональной группы поляризованы, так что кислород богат электронами, а углерод и водород электрофильны, как показано на рисунке справа.Действительно, биполярная природа связи O–H такова, что спирты являются намного более сильными кислотами, чем алканы (примерно в 10 30 раз), и почти во столько же раз более сильными, чем простые эфиры (замещенные кислородом алканы, у которых нет O–H).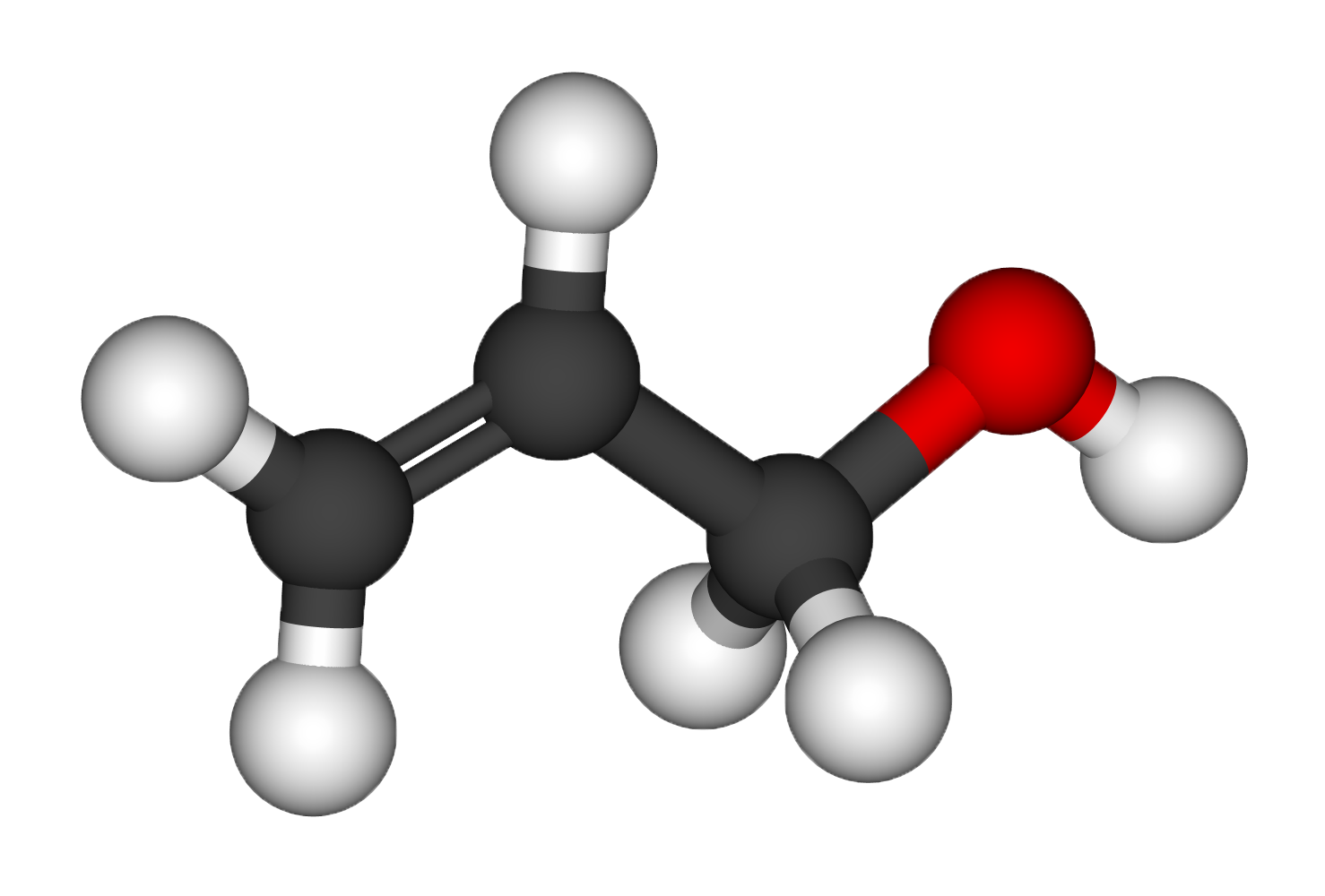 группа). Наиболее реакционноспособным участком в молекуле спирта является гидроксильная группа, несмотря на то, что прочность связи О–Н значительно больше, чем у связей С–С, С–Н и С–О, что еще раз демонстрирует различие между термодинамическим и химическая стабильность.
группа). Наиболее реакционноспособным участком в молекуле спирта является гидроксильная группа, несмотря на то, что прочность связи О–Н значительно больше, чем у связей С–С, С–Н и С–О, что еще раз демонстрирует различие между термодинамическим и химическая стабильность.
| Для обсуждения того, как молекулярная структура влияет на кислотность, нажмите здесь. |
|---|
Электрофильное замещение на кислороде |
|---|
1. Замещение гидроксильного водорода
Из-за повышенной кислотности атом водорода в гидроксильной группе довольно легко замещается другими заместителями. Простым примером является легкая реакция простых спиртов с натрием (и гидридом натрия), как описано в первом уравнении ниже.Другой такой реакцией замещения является изотопный обмен, который происходит при смешивании спирта с оксидом дейтерия (тяжелая вода). Этот обмен, катализируемый кислотой или основанием, в нормальных условиях протекает очень быстро, поскольку в большинстве экспериментальных систем трудно избежать следов таких катализаторов.
Этот обмен, катализируемый кислотой или основанием, в нормальных условиях протекает очень быстро, поскольку в большинстве экспериментальных систем трудно избежать следов таких катализаторов.
| 2 R-O-H + 2 Na 2 R-O (-) Na (+) + H 2 | 6
| R-O-H + D 2 O R-O –D + D–O–H |
Механизм, по которому протекают многие реакции замещения такого рода, прост.Атом кислорода спирта является нуклеофильным и поэтому подвержен атаке электрофилами. Полученный промежуточный продукт «ониевый» затем теряет протон на основание, давая продукт замещения. Если сильный электрофил отсутствует, нуклеофильность кислорода может быть повышена путем превращения его в сопряженное основание (алкоксид). Затем этот мощный нуклеофил атакует слабый электрофил. Эти два варианта механизма замещения показаны на следующей диаграмме.
Получение трет-бутилгипохлорита из трет-бутилового спирта является примером электрофильного галогенирования кислорода, но эта реакция ограничена 3-спиртами, поскольку 1- и 2-гипохлориты теряют HCl с образованием альдегидов и кетонов. В следующем уравнении электрофил можно рассматривать как Cl (+) .
В следующем уравнении электрофил можно рассматривать как Cl (+) .
(CH 3 ) 3 C–O–H + Cl 2 + NaOH (CH 3 ) 3 C–O–Cl + NaCl + H 900
Алкильное замещение гидроксильной группы приводит к простым эфирам. Эта реакция дает примеры как сильного электрофильного замещения (первое уравнение ниже), так и слабого электрофильного замещения (второе уравнение).Последняя реакция S N 2 известна как Синтез простого эфира Вильямсона и обычно используется только с 1º-алкилгалогенидными реагентами, поскольку сильное алкоксидное основание приводит к отщеплению E2 2º- и 3º-алкилгалогенидов.
Одной из важнейших реакций замещения по кислороду является образование сложного эфира в результате взаимодействия спиртов с электрофильными производными карбоновых и сульфокислот. На следующем рисунке показаны общие формулы этих реагентов и их сложных эфиров, в которых группа R’–O– представляет собой спиртовую часть. Электрофильный атом хлорангидридов и ангидридов окрашен в красный цвет. Примеры конкретных реакций этерификации можно выбрать в меню под диаграммой, и они будут отображаться в том же месте.
Электрофильный атом хлорангидридов и ангидридов окрашен в красный цвет. Примеры конкретных реакций этерификации можно выбрать в меню под диаграммой, и они будут отображаться в том же месте.
Посмотреть реакцию Этерификация ацилхлорида Этерификация ангидрида Метансульфонатная формация Образование тозилата
Замена гидроксильной группы |
|---|
2.Нуклеофильное замещение гидроксильной группы
Используя в качестве эталона химическое поведение алкилгалогенидов, нам предлагается искать аналогичные реакции замещения и элиминирования спиртов. Основное отличие, конечно, заключается в изменении уходящего аниона с галогенида на гидроксид. Поскольку кислород немного более электроотрицательный, чем хлор (3,5 против 2,8 по шкале Полинга), мы ожидаем, что связь CO будет более полярной, чем связь C-Cl. Кроме того, независимое измерение электрофильного характера атомов углерода по их химическим сдвигам ЯМР (как 13 C, так и альфа-протонов) указывает на то, что заместители кислорода и хлора оказывают аналогичное электроноакцепторное влияние при связывании с sp 3 гибридизованным углеродом. атомы.Несмотря на это многообещающее фоновое свидетельство, спирты не подвергаются тем же реакциям S N 2 , которые обычно наблюдаются с алкилгалогенидами. Например, показанная ниже быстрая реакция S N 2 1-бромбутана с цианидом натрия не имеет аналогов при обработке 1-бутанола цианидом натрия. На самом деле этиловый спирт часто используется в качестве растворителя в реакциях замещения алкилгалогенидов, таких как эта.
атомы.Несмотря на это многообещающее фоновое свидетельство, спирты не подвергаются тем же реакциям S N 2 , которые обычно наблюдаются с алкилгалогенидами. Например, показанная ниже быстрая реакция S N 2 1-бромбутана с цианидом натрия не имеет аналогов при обработке 1-бутанола цианидом натрия. На самом деле этиловый спирт часто используется в качестве растворителя в реакциях замещения алкилгалогенидов, таких как эта.
| CH 3 CH 2 CH 2 CH 2 -OH + Na (+) CN (-) Нет реакции |
Ключевым фактором здесь является стабильность уходящего аниона (бромид по сравнению сгидроксид). Мы знаем, что HBr является гораздо более сильной кислотой, чем вода (более чем в 18 раз), и это различие будет отражаться в реакциях, которые генерируют их сопряженные основания. Более слабое основание, бромид-анион, более стабильно, и его высвобождение в реакции замещения или отщепления будет гораздо более благоприятным, чем высвобождение гидроксид-иона, более сильного и менее стабильного основания.
Мы знаем, что HBr является гораздо более сильной кислотой, чем вода (более чем в 18 раз), и это различие будет отражаться в реакциях, которые генерируют их сопряженные основания. Более слабое основание, бромид-анион, более стабильно, и его высвобождение в реакции замещения или отщепления будет гораздо более благоприятным, чем высвобождение гидроксид-иона, более сильного и менее стабильного основания.
Ясно, что очевидным шагом к улучшению реакционной способности спиртов в реакциях S N 2 будет модификация функциональной группы –ОН таким образом, чтобы повысить ее стабильность в качестве уходящего аниона.Одной из таких модификаций является проведение реакции замещения в сильной кислоте таким образом, чтобы –ОН превратился в –ОН 2 (+) . Поскольку ион гидроксония (H 3 O (+) ) является гораздо более сильной кислотой, чем вода, его сопряженное основание (H 2 O) является лучшей уходящей группой, чем гидроксид-ион. Единственная проблема с этой стратегией заключается в том, что многие нуклеофилы, включая цианид, дезактивируются протонированием в сильной кислоте, эффективно удаляя нуклеофильный реагент, необходимый для замещения.Сильные кислоты HCl, HBr и HI не подвержены этой трудности, потому что их сопряженные основания являются хорошими нуклеофилами и даже более слабыми основаниями, чем спирты. Следующие уравнения иллюстрируют некоторые реакции замещения спиртов, на которые могут влиять эти кислоты. Как и для алкилгалогенидов, нуклеофильное замещение 1º-спиртов протекает по механизму S N 2, тогда как 3º-спирты реагируют по механизму S N 1. Реакции 2º-спиртов могут протекать по обоим механизмам и часто дают некоторые перегруппированные продукты.Цифры в скобках рядом с формулами минеральных кислот представляют весовой процент концентрированного водного раствора, формы, в которой эти кислоты обычно используются.
Единственная проблема с этой стратегией заключается в том, что многие нуклеофилы, включая цианид, дезактивируются протонированием в сильной кислоте, эффективно удаляя нуклеофильный реагент, необходимый для замещения.Сильные кислоты HCl, HBr и HI не подвержены этой трудности, потому что их сопряженные основания являются хорошими нуклеофилами и даже более слабыми основаниями, чем спирты. Следующие уравнения иллюстрируют некоторые реакции замещения спиртов, на которые могут влиять эти кислоты. Как и для алкилгалогенидов, нуклеофильное замещение 1º-спиртов протекает по механизму S N 2, тогда как 3º-спирты реагируют по механизму S N 1. Реакции 2º-спиртов могут протекать по обоим механизмам и часто дают некоторые перегруппированные продукты.Цифры в скобках рядом с формулами минеральных кислот представляют весовой процент концентрированного водного раствора, формы, в которой эти кислоты обычно используются.
Хотя эти реакции иногда называют «катализируемыми кислотой», это не совсем правильно. При общем превращении сильная кислота НХ превращается в воду, очень слабую кислоту, поэтому для полного превращения спирта в алкилгалогенид требуется по крайней мере стехиометрическое количество НХ.Необходимость использования эквивалентных количеств очень сильных кислот в этой реакции ограничивает ее применимость простыми спиртами типа, показанного выше. Спирты, имеющие группы, чувствительные к кислотам, конечно, не выдержат такой обработки. Тем не менее идея модификации функциональной группы -ОН для повышения ее стабильности в качестве уходящего аниона может быть реализована в других направлениях. На следующей диаграмме показаны некоторые модификации, доказавшие свою эффективность. В каждом случае гидроксильная группа превращается в эфир сильной кислоты.В первых двух примерах показаны сложные эфиры сульфоновой кислоты, описанные ранее. Третий и четвертый примеры показывают образование эфира фосфита (X представляет собой оставшиеся бромы или дополнительные заместители спирта) и эфира хлорсульфита соответственно.
При общем превращении сильная кислота НХ превращается в воду, очень слабую кислоту, поэтому для полного превращения спирта в алкилгалогенид требуется по крайней мере стехиометрическое количество НХ.Необходимость использования эквивалентных количеств очень сильных кислот в этой реакции ограничивает ее применимость простыми спиртами типа, показанного выше. Спирты, имеющие группы, чувствительные к кислотам, конечно, не выдержат такой обработки. Тем не менее идея модификации функциональной группы -ОН для повышения ее стабильности в качестве уходящего аниона может быть реализована в других направлениях. На следующей диаграмме показаны некоторые модификации, доказавшие свою эффективность. В каждом случае гидроксильная группа превращается в эфир сильной кислоты.В первых двух примерах показаны сложные эфиры сульфоновой кислоты, описанные ранее. Третий и четвертый примеры показывают образование эфира фосфита (X представляет собой оставшиеся бромы или дополнительные заместители спирта) и эфира хлорсульфита соответственно. Все эти уходящие группы (окрашены синим цветом) имеют сопряженные кислоты, которые намного сильнее воды (на 13–16 степеней десяти), поэтому уходящий анион, соответственно, более стабилен, чем гидроксид-ион. Мезилатные и тозилатные соединения особенно полезны, поскольку их можно использовать в реакциях замещения с широким спектром нуклеофилов.Промежуточные соединения, образующиеся в реакциях спиртов с трибромидом фосфора и тионилхлоридом (последние два примера), редко выделяют, и эти реакции продолжаются до алкилбромидных и хлоридных продуктов.
Все эти уходящие группы (окрашены синим цветом) имеют сопряженные кислоты, которые намного сильнее воды (на 13–16 степеней десяти), поэтому уходящий анион, соответственно, более стабилен, чем гидроксид-ион. Мезилатные и тозилатные соединения особенно полезны, поскольку их можно использовать в реакциях замещения с широким спектром нуклеофилов.Промежуточные соединения, образующиеся в реакциях спиртов с трибромидом фосфора и тионилхлоридом (последние два примера), редко выделяют, и эти реакции продолжаются до алкилбромидных и хлоридных продуктов.
Важность промежуточных соединений сульфоновых эфиров в общих реакциях нуклеофильного замещения спиртов можно проиллюстрировать следующим превращением 1-бутанола в пентаннитрил (бутилцианид), реакцией, которая не происходит с одним спиртом (см. выше).С другой стороны, фосфор и тионилгалогениды действуют только для превращения спиртов в соответствующие алкилгалогениды.
| CH 3 CH 2 CH 2 CH 2 -OH + CH 3 SO 2 CL | Pyridine | 5 | CH 3 CH 2 CH 2 CH 2 -OSO 2 CH 3 CH 3 | Na (+) CN (-) (-) 5 5 5 CH 3 CH 2 CH 2 CH 2 -CN + CH 3 SO 2 O (–) Na (+) |
Некоторые примеры реакций замещения спирта с использованием этого подхода к активации гидроксильной группы показаны на следующей диаграмме. Первые два случая служат для подтверждения того факта, что производные сульфонатных эфиров спиртов могут заменять алкилгалогениды в различных реакциях S N 2 . Следующие два случая демонстрируют использование трибромида фосфора для превращения спиртов в бромиды. Этот реагент можно использовать без добавления основания (например, пиридина), потому что полученная фосфористая кислота является более слабой кислотой, чем HBr. Трибромид фосфора лучше всего использовать с 1-спиртами, поскольку 2-спирты часто дают побочные продукты перегруппировки, возникающие в результате конкурирующих реакций S N 1.Обратите внимание, что кислород эфира в реакции 4 не подвергается воздействию этого реагента; тогда как альтернативный синтез с использованием концентрированного HBr расщепляет простые эфиры. Трихлорид фосфора (PCl 3 ) аналогичным образом превращает спирты в алкилхлориды, но для этого превращения обычно предпочтительнее тионилхлорид, поскольку неорганическими продуктами являются газы (SO 2 и HCl).
Первые два случая служат для подтверждения того факта, что производные сульфонатных эфиров спиртов могут заменять алкилгалогениды в различных реакциях S N 2 . Следующие два случая демонстрируют использование трибромида фосфора для превращения спиртов в бромиды. Этот реагент можно использовать без добавления основания (например, пиридина), потому что полученная фосфористая кислота является более слабой кислотой, чем HBr. Трибромид фосфора лучше всего использовать с 1-спиртами, поскольку 2-спирты часто дают побочные продукты перегруппировки, возникающие в результате конкурирующих реакций S N 1.Обратите внимание, что кислород эфира в реакции 4 не подвергается воздействию этого реагента; тогда как альтернативный синтез с использованием концентрированного HBr расщепляет простые эфиры. Трихлорид фосфора (PCl 3 ) аналогичным образом превращает спирты в алкилхлориды, но для этого превращения обычно предпочтительнее тионилхлорид, поскольку неорганическими продуктами являются газы (SO 2 и HCl). Трииодид фосфора нестабилен, но может образовываться in situ из смеси красного фосфора и йода и действует для превращения спиртов в алкилйодиды.В последнем примере показана реакция тионилхлорида с хиральным 2º-спиртом. Присутствие органического основания, такого как пиридин, важно, поскольку оно обеспечивает существенную концентрацию иона хлорида, необходимую для конечной реакции S N 2 промежуточного соединения хлорсульфита. В отсутствие основания хлорсульфиты разлагаются при нагревании с образованием ожидаемого алкилхлорида с сохранением конфигурации
Трииодид фосфора нестабилен, но может образовываться in situ из смеси красного фосфора и йода и действует для превращения спиртов в алкилйодиды.В последнем примере показана реакция тионилхлорида с хиральным 2º-спиртом. Присутствие органического основания, такого как пиридин, важно, поскольку оно обеспечивает существенную концентрацию иона хлорида, необходимую для конечной реакции S N 2 промежуточного соединения хлорсульфита. В отсутствие основания хлорсульфиты разлагаются при нагревании с образованием ожидаемого алкилхлорида с сохранением конфигурации
Третичные спирты обычно не используются для реакций замещения обсуждаемого здесь типа, потому что пути реакций S N 1 и E1 являются доминирующими и их трудно контролировать.Этот аспект химии спиртов будет затронут в следующем разделе.
Значение сложных эфиров сульфокислоты как промежуточных продуктов во многих реакциях замещения невозможно переоценить. Строгое доказательство конфигурационной инверсии, которая происходит в месте замещения в реакциях S N 2, использует такие реакции. Пример такого доказательства будет отображаться выше, когда нажата кнопка An Inversion Proof под диаграммой.Сокращения для наиболее часто используемых сульфонильных производных приведены в следующей таблице.
Строгое доказательство конфигурационной инверсии, которая происходит в месте замещения в реакциях S N 2, использует такие реакции. Пример такого доказательства будет отображаться выше, когда нажата кнопка An Inversion Proof под диаграммой.Сокращения для наиболее часто используемых сульфонильных производных приведены в следующей таблице.
| Sulfonyl Group 3 CH 3 — 3 — CH 3 C 6 H 4 SO 2 — 4 BRC 6 H 4 SO 2 — | CF 3 SO 2 – | |||
|---|---|---|---|---|
| Название и аббревиатура. | Мезил или Ms | Тозил или Ts | Брозил или Bs | Трифил или Tf |
|
Для более полного обсуждения реакций гидроксильного замещения и описания других селективных методов этого превращения щелкните здесь. |
3. Реакции элиминирования спиртов
При обсуждении реакций с алкилгалогенидами мы отметили, что 2º- и 3º-алкилгалогениды быстро удаляют E2 при обработке сильными основаниями, такими как гидроксид и алкоксиды. Спирты не подвергаются таким реакциям отщепления, вызванным основанием, и фактически часто используются в качестве растворителей для таких реакций. Это еще один пример того, как стабильность уходящей группы часто влияет на скорость реакции.
Когда спирт обрабатывается гидроксидом натрия, возникает следующее кислотно-щелочное равновесие. Большинство спиртов являются более слабыми кислотами, чем вода, поэтому предпочтение отдается левой стороне.
R–O–H + Na (+) OH (–) R–O (–) Na (+) + H–OH
Удаление воды из спирта называется обезвоживанием . Учитывая, что вода является намного лучшей уходящей группой, чем гидроксид-ион, для достижения таких реакций целесообразно использовать кислотный, а не основной катализ. Ниже показаны четыре примера этой полезной техники. Обратите внимание, что галогеноводородные кислоты (HX) обычно не используются в качестве катализаторов, потому что их сопряженные основания являются хорошими нуклеофилами и могут давать продукты замещения. Сопряженные основания серной и фосфорной кислот не являются хорошими нуклеофилами и не дают замещения в обычных условиях их применения.
Ниже показаны четыре примера этой полезной техники. Обратите внимание, что галогеноводородные кислоты (HX) обычно не используются в качестве катализаторов, потому что их сопряженные основания являются хорошими нуклеофилами и могут давать продукты замещения. Сопряженные основания серной и фосфорной кислот не являются хорошими нуклеофилами и не дают замещения в обычных условиях их применения.
Первые два примера (верхний ряд) типичны, а более легкое исключение 3º-спирта предполагает преобладающий Е1-характер реакции.Это согласуется с тенденцией разветвленных 1- и 2-спиртов давать продукты перегруппировки, как показано в последнем примере. Последние две реакции также демонстрируют, что правило Зайцева применимо как к дегидратации спирта, так и к элиминированию алкилгалогенидов. Таким образом, среди продуктов предпочтение отдается изомеру с более высокой степенью замещения по двойной связи.
Следует отметить, что обсуждаемые здесь реакции дегидратации, катализируемые кислотами, являются обратными реакциям гидратации алкенов, катализируемым кислотами. Действительно, для таких обратимых реакций, как эта, законы термодинамики требуют, чтобы механизм в обоих направлениях протекал по одному и тому же пути реакции.Это известно как принцип микроскопической обратимости . Для иллюстрации на следующей диаграмме перечислены три шага каждого преобразования. Реакция дегидратации показана синими стрелками; реакция гидратации показана пурпурными стрелками. Промежуточные продукты в этих реакциях являются общими для обеих, и участвуют общие переходные состояния. Это хорошо видно на энергетических диаграммах, отображаемых нажатием кнопки под уравнениями.
Действительно, для таких обратимых реакций, как эта, законы термодинамики требуют, чтобы механизм в обоих направлениях протекал по одному и тому же пути реакции.Это известно как принцип микроскопической обратимости . Для иллюстрации на следующей диаграмме перечислены три шага каждого преобразования. Реакция дегидратации показана синими стрелками; реакция гидратации показана пурпурными стрелками. Промежуточные продукты в этих реакциях являются общими для обеих, и участвуют общие переходные состояния. Это хорошо видно на энергетических диаграммах, отображаемых нажатием кнопки под уравнениями.
Вызванная основанием элиминация спиртов E2 может быть достигнута, если используются их производные сульфонатных эфиров.Это имеет то преимущество, что позволяет избежать сильных кислот, которые в некоторых случаях могут вызвать молекулярную перестройку и/или миграцию двойных связей. Поскольку производные 3º-сульфоната иногда нестабильны, эту процедуру лучше всего использовать с 1º и 2º-мезилатами или тозилатами. Применение этой последовательности реакций показано здесь для 2-бутанола. Правило Зайцева благоприятствует образованию 2-бутена (цис + транс) вместо 1-бутена.
Применение этой последовательности реакций показано здесь для 2-бутанола. Правило Зайцева благоприятствует образованию 2-бутена (цис + транс) вместо 1-бутена.
| CH 3 CH 2 CH 2 CH (CH 3 ) -OH 5 | CH 3 SO 2 CL 5 | CH 3 CH 2 CH (CH 3 ) –OSO 2 CH 3 | C 2 H 5 O (–) Na (+) |
CH 3 CH = CHCH 3 CH 3 CH 2 CH = CH 2 + CH 2 + CH 3 SO 2 O (-) Na (+) + C 2 Н 5 ОХ |
Удаление E2 3º-спиртов в относительно некислых условиях может быть достигнуто обработкой оксихлоридом фосфора (POCl 3 ) в пиридине. Эта процедура также эффективна с затрудненными 2º-спиртами, но для незатрудненных и 1º-спиртов замена промежуточного соединения хлорфосфата S N 2 на ион хлорида конкурирует с элиминацией. Некоторые примеры этих и родственных реакций приведены на следующем рисунке. Первое уравнение показывает дегидратацию 3º-спирта. Предполагается, что преобладание незайцевского продукта (менее замещенная двойная связь) связано со стерическими затруднениями атомов водорода метиленовой группы, препятствующими подходу основания к этому участку.Во втором примере показаны две процедуры исключения, примененные к одному и тому же 2º-спирту. В первом используется одностадийный метод POCl 3 , который хорошо работает в этом случае, поскольку замена S N 2 задерживается стерическими затруднениями. Второй метод представляет собой еще один пример, в котором промежуточный сложный эфир сульфокислоты придает спирту подобную галогену реакционную способность. В каждом случае уходящая анионная группа представляет собой сопряженное основание сильной кислоты.
Эта процедура также эффективна с затрудненными 2º-спиртами, но для незатрудненных и 1º-спиртов замена промежуточного соединения хлорфосфата S N 2 на ион хлорида конкурирует с элиминацией. Некоторые примеры этих и родственных реакций приведены на следующем рисунке. Первое уравнение показывает дегидратацию 3º-спирта. Предполагается, что преобладание незайцевского продукта (менее замещенная двойная связь) связано со стерическими затруднениями атомов водорода метиленовой группы, препятствующими подходу основания к этому участку.Во втором примере показаны две процедуры исключения, примененные к одному и тому же 2º-спирту. В первом используется одностадийный метод POCl 3 , который хорошо работает в этом случае, поскольку замена S N 2 задерживается стерическими затруднениями. Второй метод представляет собой еще один пример, в котором промежуточный сложный эфир сульфокислоты придает спирту подобную галогену реакционную способность. В каждом случае уходящая анионная группа представляет собой сопряженное основание сильной кислоты.
|
Пиролитический син-Элиминация |
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки должны
отправить по адресу [email protected].
Эти страницы предоставлены IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
20.2 Спирты и простые эфиры – Химия
Простые эфиры представляют собой соединения, содержащие функциональную группу –O–.У простых эфиров нет обозначенного суффикса, как у других типов молекул, которые мы назвали до сих пор. В системе IUPAC атом кислорода и меньшая углеродная ветвь называются алкокси-заместителем, а остальная часть молекулы — основной цепью, как в алканах.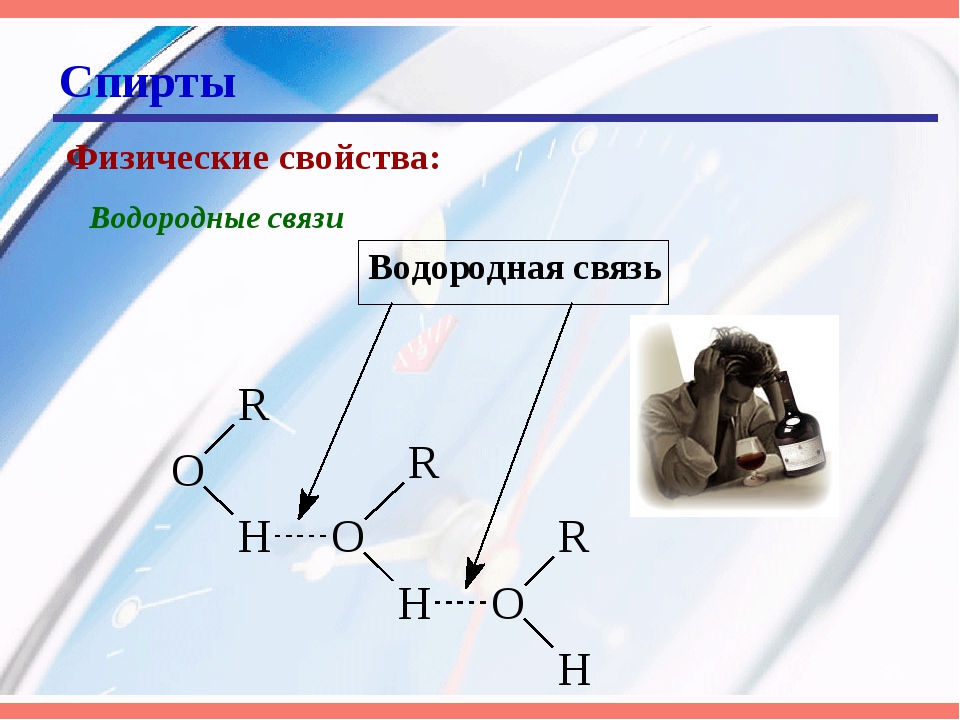 Как показано в следующем соединении, красные символы представляют меньшую алкильную группу и атом кислорода, который можно назвать «метокси». Более крупная углеродная ветвь будет этаном, что сделает молекулу метоксиэтаном. Многие эфиры называются общими именами вместо системных имен IUPAC.Для общих названий две ветви, связанные с атомом кислорода, называются отдельно, а за ними следует «эфир». Общее название соединения, показанного в примере 2, — этилметиловый эфир:
Как показано в следующем соединении, красные символы представляют меньшую алкильную группу и атом кислорода, который можно назвать «метокси». Более крупная углеродная ветвь будет этаном, что сделает молекулу метоксиэтаном. Многие эфиры называются общими именами вместо системных имен IUPAC.Для общих названий две ветви, связанные с атомом кислорода, называются отдельно, а за ними следует «эфир». Общее название соединения, показанного в примере 2, — этилметиловый эфир:
Пример 2
Наименование эфиров
Укажите IUPAC и общепринятое название эфира, показанного здесь:
Раствор
ИЮПАК: Молекула состоит из этоксигруппы, присоединенной к цепи этана, поэтому название ИЮПАК будет этоксиэтан.
Общее: обе группы, присоединенные к атому кислорода, являются этиловыми группами, поэтому общее название будет диэтиловым эфиром.
Проверьте свои знания
Укажите IUPAC и общее название показанного эфира:
Ответ:
ИЮПАК: 2-метоксипропан; общий: изопропилметиловый эфир
Эфиры можно получить из спиртов отщеплением молекулы воды от двух молекул спирта. Например, при обработке этанола ограниченным количеством серной кислоты и нагревании до 140 °С образуются диэтиловый эфир и вода:
Например, при обработке этанола ограниченным количеством серной кислоты и нагревании до 140 °С образуются диэтиловый эфир и вода:
В общей формуле эфиров R— O —R углеводородные группы ( р) могут быть одинаковыми или разными.Диэтиловый эфир, наиболее широко используемое соединение этого класса, представляет собой бесцветную летучую жидкость, которая легко воспламеняется. Впервые он был использован в 1846 году в качестве анестетика, но в настоящее время его место в значительной степени заняли более совершенные анестетики. Диэтиловый эфир и другие простые эфиры в настоящее время используются главным образом в качестве растворителей камедей, жиров, восков и смол. Третичный -бутилметиловый эфир, C 4 H 9 OCH 3 (сокращенно МТБЭ — части названий, выделенные курсивом, не учитываются при ранжировании групп в алфавитном порядке — поэтому бутил стоит перед метилом в общем названии), используется в качестве присадки к бензину. МТБЭ принадлежит к группе химических веществ, известных как оксигенаты, из-за их способности повышать содержание кислорода в бензине.
МТБЭ принадлежит к группе химических веществ, известных как оксигенаты, из-за их способности повышать содержание кислорода в бензине.
Хотите попрактиковаться в именовании эфиров? Этот краткий видеообзор подытоживает номенклатуру эфиров.
Углеводы и диабет
Углеводы — это большие биомолекулы, состоящие из углерода, водорода и кислорода. Пищевые формы углеводов — это продукты, богатые этими типами молекул, такие как макароны, хлеб и конфеты. Название «углевод» происходит от формулы молекул, которые можно описать общей формулой C m (H 2 O) n , что показывает, что они в некотором смысле являются «углеродом и водой» или «гидраты углерода.Во многих случаях м и n имеют одинаковое значение, но могут быть и разными. Меньшие углеводы обычно называют «сахарами», биохимический термин для этой группы молекул — «сахарид» от греческого слова «сахар» (рис. 1). В зависимости от количества сахарных единиц, соединенных вместе, их можно классифицировать как моносахариды (одна сахарная единица), дисахариды (две сахарные единицы), олигосахариды (несколько сахаров) или полисахариды (полимерная версия сахаров — полимеры были описаны в раздел о вторичной переработке пластика ранее в этой главе). Научные названия сахаров можно узнать по суффиксу -ose в конце названия (например, фруктовый сахар — это моносахарид, называемый «фруктоза», а молочный сахар — это дисахарид, называемый лактозой, состоящий из двух моносахаридов, глюкозы и галактозы). , соединенные вместе). Сахара содержат некоторые функциональные группы, которые мы обсуждали: обратите внимание на спиртовые группы, присутствующие в структурах, и на то, как моносахаридные звенья связаны с образованием дисахарида путем образования эфира.
Научные названия сахаров можно узнать по суффиксу -ose в конце названия (например, фруктовый сахар — это моносахарид, называемый «фруктоза», а молочный сахар — это дисахарид, называемый лактозой, состоящий из двух моносахаридов, глюкозы и галактозы). , соединенные вместе). Сахара содержат некоторые функциональные группы, которые мы обсуждали: обратите внимание на спиртовые группы, присутствующие в структурах, и на то, как моносахаридные звенья связаны с образованием дисахарида путем образования эфира.
Организмы используют углеводы для различных функций. Углеводы могут накапливать энергию, например полисахариды гликоген у животных или крахмал у растений. Они также обеспечивают структурную поддержку, такую как полисахаридная целлюлоза в растениях и модифицированный полисахаридный хитин в грибах и животных. Сахара рибоза и дезоксирибоза являются компонентами остова РНК и ДНК соответственно.Другие сахара играют ключевую роль в функционировании иммунной системы, в межклеточном распознавании и во многих других биологических функциях.
Сахара рибоза и дезоксирибоза являются компонентами остова РНК и ДНК соответственно.Другие сахара играют ключевую роль в функционировании иммунной системы, в межклеточном распознавании и во многих других биологических функциях.
Сахарный диабет — это группа метаболических заболеваний, при которых у человека наблюдается повышенная концентрация сахара в крови (рис. 2). Диабет может быть вызван недостаточной выработкой инсулина поджелудочной железой или клетками организма, которые не реагируют должным образом на вырабатываемый инсулин. У здорового человека инсулин вырабатывается, когда он необходим, и функционирует для транспортировки глюкозы из крови в клетки, где она может использоваться для получения энергии.Долгосрочные осложнения диабета могут включать потерю зрения, болезни сердца и почечную недостаточность.
В 2013 г. было подсчитано, что приблизительно 3,3% населения мира (~380 миллионов человек) страдали диабетом, что ежегодно приводило к более чем миллиону смертей. Профилактика включает в себя здоровое питание, много физических упражнений и поддержание нормальной массы тела. Лечение включает в себя все эти методы образа жизни и может потребовать инъекций инсулина.
Профилактика включает в себя здоровое питание, много физических упражнений и поддержание нормальной массы тела. Лечение включает в себя все эти методы образа жизни и может потребовать инъекций инсулина.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Спирты и эфиры
Спирты и эфирыСпирты и эфиры
Наименование спиртов
Спирты содержат группу ОН, присоединенную к насыщенному углероду. Общие названия спиртов
по названию алкильной группы.
Общие названия спиртов
по названию алкильной группы.
| CH 3 OH | Спирт метиловый | ||
| СН 3 СН 2 ОН | Спирт этиловый | ||
| СН 3 СНОНСН 3 | Изопропиловый спирт |
Систематическая номенклатура спиртов добавляет окончание -ol к названию спирта. исходный алкан и использует число для идентификации углерода, несущего группу ОН.Систематическое название для изопропиловый спирт, например, представляет собой 2-пропанол.
| CH 3 OH | Метанол | ||
| СН 3 СН 2 ОН | Этанол | ||
| СН 3 СНОНСН 3 | 2-пропанол |
| Практическая задача 6: Более 50 органических соединений имеют
был выделен из масла, которое дает характерный запах розы.
Нажмите здесь, чтобы проверить свой ответ на практическая задача 6 |
Метанол, или метиловый спирт, также известен как древесный спирт , потому что он был Первоначально производился путем нагревания древесины до дистиллированной жидкости.Метанол очень токсичен и многие люди ослепли или умерли от его употребления. Этанол, или этиловый спирт, является алкоголь, связанный с «алкогольными» напитками. Это сделано как минимум 6000 лет, добавляя дрожжи в растворы, богатые сахаром или крахмалом. В дрожжевые клетки получают энергию в результате катализируемых ферментами реакций, превращающих сахар или крахмал в этанол и CO 2 .
C 6 H 12 O 6 ( aq ) 2 CH 3 CH 2 OH( aq ) + 2 CO 2 ( г )
Когда концентрация спирта достигает 10-12% по объему, дрожжевые клетки погибают. Бренди, ром, джин и различные виды виски с более высокой концентрацией алкоголя
получают путем перегонки спирта, полученного в результате этой реакции брожения. Этанол не
так же токсичен, как метанол, но все же опасен. Большинство людей опьянены кровью
содержание алкоголя около 0,1 г на 100 мл. Повышение уровня алкоголя в
крови до 0,4–0,6 г/100 мл может привести к коме или смерти.
Бренди, ром, джин и различные виды виски с более высокой концентрацией алкоголя
получают путем перегонки спирта, полученного в результате этой реакции брожения. Этанол не
так же токсичен, как метанол, но все же опасен. Большинство людей опьянены кровью
содержание алкоголя около 0,1 г на 100 мл. Повышение уровня алкоголя в
крови до 0,4–0,6 г/100 мл может привести к коме или смерти.
Определение уровня алкоголя в крови
Предпочтительным методом определения того, находится ли человек за рулем в нетрезвом состоянии или в состоянии алкогольного опьянения, является алкотестер, патент на который был выдан Р.Ф. Боркенштейн в 1958 году. Химия алкотестера основана на реакции между алкоголем в выдыхаемом воздухе и ионами хромата или дихромата.
3 CH 3 CH 2 OH( г ) + 2 Cr 2 O 7 2- ( aq ) + 16 H + ( водный раствор ) 3 CH 3 CO 2 H ( водный раствор ) + 4 Cr 3+ ( водный раствор ) + 11 Н 2 О( л )
Прибор содержит две ампулы с небольшими образцами бихромата калия. растворяется в серной кислоте.Одна из этих ампул используется в качестве эталона. Другой открыт
и в эту ампулу добавляют анализируемый образец дыхания. Если алкоголь присутствует в
дыхание, восстанавливает желто-оранжевый Cr 2 O 7 2- ион до
зеленый Cr 3+ ион. Степень, в которой цветовой баланс между двумя ампулами
нарушен, является прямым показателем количества алкоголя в образце дыхания.
Измерения содержания алкоголя в выдыхаемом воздухе затем преобразуются в оценки
концентрации алкоголя в крови, принимая, что 2100 мл воздуха выдыхается из
в легких содержится столько же алкоголя, сколько в 1 мл крови.
растворяется в серной кислоте.Одна из этих ампул используется в качестве эталона. Другой открыт
и в эту ампулу добавляют анализируемый образец дыхания. Если алкоголь присутствует в
дыхание, восстанавливает желто-оранжевый Cr 2 O 7 2- ион до
зеленый Cr 3+ ион. Степень, в которой цветовой баланс между двумя ампулами
нарушен, является прямым показателем количества алкоголя в образце дыхания.
Измерения содержания алкоголя в выдыхаемом воздухе затем преобразуются в оценки
концентрации алкоголя в крови, принимая, что 2100 мл воздуха выдыхается из
в легких содержится столько же алкоголя, сколько в 1 мл крови.
Измерения, проведенные с помощью алкотестера, представлены в процентах содержания алкоголя в крови. концентрация (BAC). В большинстве штатов BAC 0,10% достаточно для DUI или DWI. убеждение. (Это соответствует концентрации алкоголя в крови 0,10 г алкоголя). на 100 мл крови.)
Этанол окисляется до CO 2 и H 2 O алкогольдегидрогеназой
ферментов в организме. В результате этой реакции выделяется 30 кДж на грамм, что делает этанол
лучший источник энергии, чем углеводы (17 кДж/г), и почти такой же хороший источник
энергия в виде жира (38 кДж/г).Унция спиртного напитка крепостью 80 может обеспечить до 3% алкоголя.
среднесуточное потребление калорий, а употребление алкоголя может способствовать ожирению. Многие
однако алкоголики недоедают из-за отсутствия витаминов в калориях
они получают из алкогольных напитков.
В результате этой реакции выделяется 30 кДж на грамм, что делает этанол
лучший источник энергии, чем углеводы (17 кДж/г), и почти такой же хороший источник
энергия в виде жира (38 кДж/г).Унция спиртного напитка крепостью 80 может обеспечить до 3% алкоголя.
среднесуточное потребление калорий, а употребление алкоголя может способствовать ожирению. Многие
однако алкоголики недоедают из-за отсутствия витаминов в калориях
они получают из алкогольных напитков.
Растворимости спиртов
Как правило, полярные или ионные вещества растворяются в полярных растворителях; неполярный
вещества растворяются в неполярных растворителях.В результате углеводороды не растворяются в
вода. Часто говорят, что они не смешиваются (буквально «не смешиваются») с водой.
Спирты, как и следовало ожидать, обладают свойствами между крайними значениями углеводородов и
вода. Когда углеводородная цепь короткая, спирт растворяется в воде. Здесь нет
лимит на количество метанола (СН 3 ОН) и этанола (СН 3 СН 2 ОН),
например, то, что может раствориться в данном количестве воды. Как углеводородная цепь
становится длиннее, спирт становится менее растворимым в воде, как показано в таблице ниже.Один конец молекулы спирта настолько неполярен, что считается гидрофобным.
(буквально «ненавидящий воду»). На другом конце находится группа -ОН,
может образовывать водородные связи с соседними молекулами воды и поэтому считается гидрофильным
(буквально «водолюбивый»). Чем длиннее углеводородная цепь, тем
увеличивается гидрофобность молекулы и растворимость спирта в
воды постепенно уменьшается, пока не станет практически нерастворимым в воде.
Здесь нет
лимит на количество метанола (СН 3 ОН) и этанола (СН 3 СН 2 ОН),
например, то, что может раствориться в данном количестве воды. Как углеводородная цепь
становится длиннее, спирт становится менее растворимым в воде, как показано в таблице ниже.Один конец молекулы спирта настолько неполярен, что считается гидрофобным.
(буквально «ненавидящий воду»). На другом конце находится группа -ОН,
может образовывать водородные связи с соседними молекулами воды и поэтому считается гидрофильным
(буквально «водолюбивый»). Чем длиннее углеводородная цепь, тем
увеличивается гидрофобность молекулы и растворимость спирта в
воды постепенно уменьшается, пока не станет практически нерастворимым в воде.
Растворимость спиртов в воде
| Формула | Имя | Растворимость в Вода (г/100 г) |
||
| CH 3 OH | метанол | бесконечно растворимый | ||
| СН 3 СН 2 ОН | этанол | бесконечно растворимый | ||
| СН 3 (СН 2 ) 2 ОХ | пропанол | бесконечно растворимый | ||
| СН 3 (СН 2 ) 3 ОХ | бутанол | 9 | ||
| СН 3 (СН 2 ) 4 ОХ | пентанол | 2.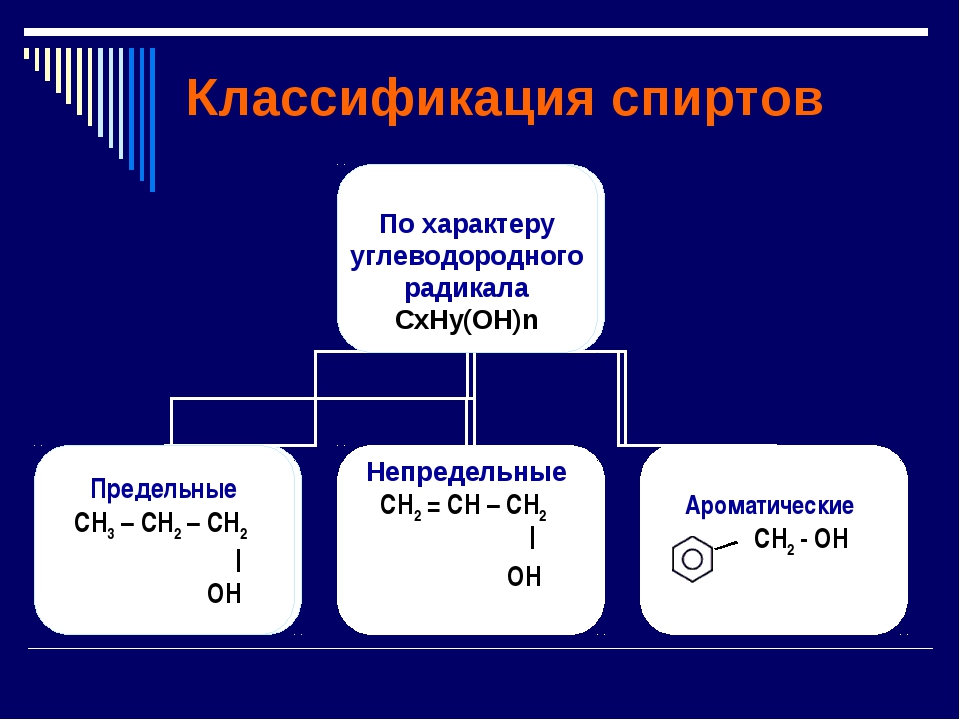 7 7 |
||
| СН 3 (СН 2 ) 5 ОХ | гексанол | 0,6 | ||
| СН 3 (СН 2 ) 6 ОН | гептанол | 0,18 | ||
| СН 3 (СН 2 ) 7 ОН | октанол | 0.054 | ||
| СН 3 (СН 2 ) 9 ОХ | деканол | нерастворим в воде |
Первичные, вторичные и третичные спирты
Спирты классифицируются как первичные (1), вторичные (2) или третичные (3) на основе их структур.
Этанол является первичным спиртом, потому что к нему присоединена только одна алкильная группа. углерод, несущий ОН
заместитель. Структуру первичного спирта можно обозначить как RCH 2 OH,
где R обозначает алкильную группу. Изопропиловый спирт, содержащийся в медицинском спирте, является
вторичный спирт, который имеет две алкильные группы у атома углерода с заместителем ОН (R 2 CHOH).
Примером третичного спирта (R 3 COH) является трет -бутил (или t -бутил).
спирт или 2-метил-2-пропанол.
углерод, несущий ОН
заместитель. Структуру первичного спирта можно обозначить как RCH 2 OH,
где R обозначает алкильную группу. Изопропиловый спирт, содержащийся в медицинском спирте, является
вторичный спирт, который имеет две алкильные группы у атома углерода с заместителем ОН (R 2 CHOH).
Примером третичного спирта (R 3 COH) является трет -бутил (или t -бутил).
спирт или 2-метил-2-пропанол.
Фенолы
Другим классом спиртов являются фенолы , в которых группа ОН присоединена к ароматической
кольцо, как показано на рисунке ниже. Фенолы являются сильнодействующими дезинфицирующими средствами. Когда антисептик
методы были впервые представлены в 1860-х годах Джозефом Листером, это был фенол (или карболовая
кислота, как ее тогда называли), которая использовалась. Производные фенола, такие как o -фенилфенол,
до сих пор используются в коммерческих дезинфицирующих средствах, таких как Lysol.
Температуры кипения спиртов
Вода имеет необычно высокую температуру кипения из-за водородных связей. между молекулами H 2 O. Спирты могут образовывать аналогичные водородные связи, как показано на рисунке ниже.
В результате температуры кипения спиртов намного выше, чем у алканов с близкие молекулярные массы.Температура кипения этанола, например, составляет 78,5°С, тогда как пропан с примерно такой же молекулярной массой кипит при -42,1°С.
Спирты в виде кислот и оснований
Спирты – кислоты Бренстеда в водном растворе.
CH 3 CH 2 OH( водный ) + H 2 O( л ) H 3 O + ( aq ) + CH 3 CH 2 O — ( aq )
Таким образом, спирты реагируют с металлическим натрием с образованием солей натрия соответствующих
сопряженное основание.
2 Na( с ) + 2 CH 3 OH( l ) 2 Na + ( алк ) + 2 CH 3 O — ( алк ) + H 2 ( г )
Сопряженное основание спирта известно как алкоксид .
| [Na + ][CH 3 O — ] | [Na + ][CH 3 CH 2 O — ] | ||
| метоксид натрия | этоксид натрия |
Приготовление спиртов
Спирты можно получить добавлением воды к алкену в присутствии сильной кислоты.
Например, концентрированная серная кислота.Эта реакция включает добавление H 2 O
молекулы через двойную связь С=С. Поскольку эти реакции подчиняются правилу Марковникова, продукт реакции равен
часто сильно замещенный 2 или 3 спирт.
Менее замещенные 1 спирты могут быть получены реакциями замещения, которые происходят, когда первичному алкилгалогениду позволяют реагировать с ионом OH — .
CH 3 CH 2 CH 2 Br + OH — CH 3 CH 2 CH 2 OH +Бр —
Эфиры
Спирты (ROH) можно рассматривать как производные воды, в которых один из атомов водорода атомы заменены алкильной группой.Если заменить оба атома водорода на алкильных групп, получаем эфир (РОР). Эти соединения названы добавлением слово эфир к названиям алкильных групп.
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир |
Диэтиловый эфир, часто известный под общим названием «эфир», когда-то использовался
широко используется как анестетик. Так как смеси диэтилового эфира и воздуха взрываются в
наличие искры, эфир был заменен более безопасными анестетиками.
Так как смеси диэтилового эфира и воздуха взрываются в
наличие искры, эфир был заменен более безопасными анестетиками.
Спирты по сравнению с эфирами
Существуют важные различия как между физическими, так и химическими свойствами спирты и эфиры. Рассмотрим, например, диэтиловый эфир и 1-бутанол, которые структурные изомеры с формулой C 4 H 10 O.
| CH 3 CH 2 OCH 2 CH 3 | CH 3 CH 2 CH 2 CH 2 OH | |||
| ВР = 34,5С | ВР = 117,2С | |||
| d = 0,7138 г/мл | д = 0.8098 г/мл | |||
| не растворим в воде | растворим в воде |
Формы этих молекул очень похожи, как показано на рисунке ниже.
Принципиальным отличием этих соединений является наличие в спирте ОН-групп, которые отсутствует в эфире. Поскольку водородные связи не могут образовываться между молекулами в эфира, температура кипения этого соединения более чем на 80°С ниже, чем у соответствующего алкоголь.Поскольку водородные связи для организации структуры жидкости отсутствуют, эфир значительно менее плотный, чем соответствующий спирт.
Эфиры могут действовать как акцепторы водородных связей, как показано на рисунке ниже. Но они не могут выступать в качестве доноров водородных связей. В результате эфиры менее растворимы в воды, чем спирт с той же молекулярной массой.
Отсутствие группы ОН в
эфир также имеет важные последствия для его химических свойств.В отличие от спиртов,
эфиры практически инертны к химическим реакциям. Они не реагируют с большинством окислителей.
или восстановители, и они устойчивы к большинству кислот и оснований, за исключением высоких
температуры. Поэтому они часто используются в качестве растворителей для химических реакций.
Поэтому они часто используются в качестве растворителей для химических реакций.
Соединения, которые являются потенциальными источниками иона H + , или протон, часто описываются как протонных. Этанол, например, является протонным растворитель.
CH 3 CH 2 OH( водный ) + H 2 O( л ) H 3 O + ( aq ) + CH 3 CH 2 O — ( aq )
Вещества, которые не могут служить источником протона, называются апротонными . Потому что они не содержат ОН группа, эфиры апротонные растворители.
Эфиры можно синтезировать, расщепляя молекулу воды между двумя спиртами в наличие тепла и концентрированной серной кислоты.
| Н + | ||||
| 2 CH 3 CH 2 ОН | CH 3 CH 2 OCH 2 CH 3 |
Они также могут быть образованы реакцией первичного алкилгалогенида с ионом алкоксида.
CH 3 CH 2 CH 2 Br + CH 3 O — CH 3 CH 2 CH 2 9042 +Бр —
Органическая химия: функциональные группы
Функциональные группы | Алкилгалогениды | Спирты и эфиры | Альдегиды и Кетоны | В Карбонильная группа | Амины, алкалоиды и амиды | Реактивы Гриньяра
Исследования 1990-х годов: Химия чеснока
Периодический Таблица | Глоссарий | Прохладный Апплеты
Тематический обзор Gen Chem | Главная страница справки по общей химии | Поиск: Сайт общей химии.
Этанол | Подкаст | Мир химии
Мира Сентилингам
На этой неделе состав нашего любимого напитка для общения. Давайте поднимем бокалы за Тима Харрисона:
Тим Харрисон
Этанол — это простая молекула, содержащая всего 9 атомов и известная людям задолго до появления современной химии. Он имеет множество повседневных применений, начиная от растворителей, чистящих средств, топлива для настольной кулинарии, промышленного применения и даже медицинского применения.Этанол даже находит применение в термометрах, где он окрашен в красный цвет. Тем не менее, вы, вероятно, лучше всего знакомы с этанолом как с психоактивным веществом в алкогольных напитках, таких как пиво, вино и спиртные напитки.
Он имеет множество повседневных применений, начиная от растворителей, чистящих средств, топлива для настольной кулинарии, промышленного применения и даже медицинского применения.Этанол даже находит применение в термометрах, где он окрашен в красный цвет. Тем не менее, вы, вероятно, лучше всего знакомы с этанолом как с психоактивным веществом в алкогольных напитках, таких как пиво, вино и спиртные напитки.
Считается, что использование этанола восходит к доисторическим временам, когда его производили путем естественной ферментации сахаров во фруктах. Ферментация требует ферментов из дрожжей и происходит анаэробно (то есть без кислорода), создавая растворы, содержащие до 15% этанола.Помимо этанола, также производится углекислый газ. Но хотя контролируемая ферментация или пивоварение, возможно, изначально была разработана как способ сделать воду безопасной для питья, опьяняющее действие алкоголя, несомненно, сыграло определенную роль в популяризации его потребления в обществе.
Этанол имеет химическую формулу CH 3 CH 2 OH, и широкая публика часто называет его просто «алкоголем». Однако термин «спирт» на самом деле относится к целому семейству органических химических веществ, одним из членов которого является этанол.Этанол также известен под рядом других названий, таких как этиловый спирт, этилгидрат и хлебный спирт. Спирты имеют гидроксильную группу, то есть от O до H, в которой атом кислорода, связанный с водородом, ковалентно связан с углеродом. Гидроксильную группу не следует путать с гидроксид-ионом ОН —.
Электроотрицательность атома кислорода, который поляризует гидроксильные группы, делает этанол таким хорошим полярным растворителем, и это основное применение этанола в химии.Он смешивается с водой во всех пропорциях, образуя водородные связи между гидроксильными группами спирта и водой.
Алкоголь для потребления человеком, такой как вино или виски, облагается высоким налогом или пошлиной. Чтобы избежать уплаты пошлины за промышленное применение этанола, например, в парфюмерии в качестве растворителя ароматических химикатов, его необходимо сделать непригодным для питья. Этанол, обработанный таким образом, считается «денатурированным», и в парфюмерии это делается путем добавления небольшого количества бензоата денатония, который представляет собой чрезвычайно горький на вкус материал, торговое название которого — Bitrex.Другие денатурирующие агенты, используемые в других местах, включают метанол, другие спирты и кетоны. Метиловый спирт представляет собой этанол, смешанный с 10 процентами ядовитого спирта метанола. Иногда, как в Великобритании, метанол добавляют вместе с характерным пурпурным красителем.
Чтобы избежать уплаты пошлины за промышленное применение этанола, например, в парфюмерии в качестве растворителя ароматических химикатов, его необходимо сделать непригодным для питья. Этанол, обработанный таким образом, считается «денатурированным», и в парфюмерии это делается путем добавления небольшого количества бензоата денатония, который представляет собой чрезвычайно горький на вкус материал, торговое название которого — Bitrex.Другие денатурирующие агенты, используемые в других местах, включают метанол, другие спирты и кетоны. Метиловый спирт представляет собой этанол, смешанный с 10 процентами ядовитого спирта метанола. Иногда, как в Великобритании, метанол добавляют вместе с характерным пурпурным красителем.
Этанол также может производиться в промышленных масштабах несколькими способами, не зависящими от медленного превращения сахаров дрожжами в низкую концентрацию в водном растворе. Этен (или этилен, если использовать его старое название) из нефтяной промышленности можно гидратировать с использованием пара и катализаторов для быстрого и высокого выхода этанола.
Исторически этанол использовался в качестве топлива — возможно, у вас даже когда-то был химический набор с метиловым спиртом или спиртовой горелкой в качестве источника тепла. Этанол имеет показатель сгорания 26,8 МДж/кг, что лучше, чем у древесины, но меньше, чем у бензина. В наши дни, когда использование сырой нефти в качестве источника топлива находится под пристальным вниманием — как из-за изменения климата, так и из-за истощения мировых запасов — этанол, экологически чистое топливо, становится все более широко используемым.
Этанол для топлива в настоящее время производится из богатых сахаром культур, таких как сладкая кукуруза или сахарный тростник, но существует растущая область химии, посвященная преобразованию целлюлозы из отходов или непищевых культур или использованию водорослей для производства этанола. Таким образом, земля, используемая для выращивания продуктов питания, не изымается из производства продовольственных культур. В Бразилии 25-процентный этанол обычно подмешивают в бензин. В Соединенных Штатах коммерчески доступны два варианта: E85 содержит 85% этанола и 15% бензина (или бензина), но может использоваться только в специально модифицированных двигателях, тогда как Gasohol, содержащий 10% этанола и 90% бензин — можно использовать в немодифицированных автомобилях.
В Соединенных Штатах коммерчески доступны два варианта: E85 содержит 85% этанола и 15% бензина (или бензина), но может использоваться только в специально модифицированных двигателях, тогда как Gasohol, содержащий 10% этанола и 90% бензин — можно использовать в немодифицированных автомобилях.
Этанол также можно использовать в топливных элементах, где он может реагировать с кислородом воздуха над платиновым катализатором. Это не производит тепла и света, но преобразует химическую энергию этанола непосредственно в электрическую энергию. Возможно, однажды можно будет взять свой ноутбук или мобильный телефон в паб и налить стопку виски в топливный элемент, содержащийся в устройстве, или в зарядное устройство, вместо того, чтобы подключать его к электросети.
Помимо сжигания, этанол также может быть частично окислен как до альдегида (называемого этаналем или ацетальдегидом), так и до карбоновой кислоты (называемой этановой или уксусной кислотой).Когда алкогольные напитки испаряются или превращаются в уксус, который по сути представляет собой этановую кислоту, именно бактерии acetobacter в воздухе вызывают окисление. Процесс окисления также помогает организму избавиться от этанола из наших систем, и считается, что частично окисленный этаналь способствует симптомам похмелья, возникающим после чрезмерного употребления алкоголя.
Процесс окисления также помогает организму избавиться от этанола из наших систем, и считается, что частично окисленный этаналь способствует симптомам похмелья, возникающим после чрезмерного употребления алкоголя.
В лаборатории можно использовать подкисленный бихромат калия для осуществления обоих окислений.Окисление до этановой кислоты требует большего количества окислителя, чем для первой стадии до альдегида. Изменение цвета этой реакции с оранжевого на зеленый использовалось в первых алкотестерах до того, как стали использоваться более точные электрохимические устройства. Они были сделаны из простых трубок, заполненных силикагелем, пропитанным оранжевым раствором бихромата калия. Водителей, подозреваемых в пьянстве, заставляли дуть в трубку, и по мере того, как алкоголь в их выдыхаемом воздухе реагировал с ионами дихромата, зеленый цвет гидратированных ионов хрома (III) распространялся дальше по трубке, давая представление о том, сколько алкоголя присутствовал в дыхании и, следовательно, сколько алкоголя они употребили.
Этанол также может использоваться в качестве химического сырья для производства других полезных материалов. Двумя распространенными примерами являются его дегидратация до этилена путем пропускания пара над нагретым оксидом алюминия или над крошечными кусочками фарфора, содержащими ионы алюминия; и его использование для получения многих сложных эфиров при взаимодействии, конечно же, с соответствующими карбоновыми кислотами. Например, этилэтаноат (этилацетат) представляет собой запах растворителя, связанный с ударопрочными клеями.
Итак, химическое вещество, известное уже не менее 9000 лет, до сих пор оказывается очень полезным в своих традиционных целях и во многих новых технологических приложениях.
Мира Сентилингам
Действительно, напитки, топливо, лекарства и многое другое. Лично я держу пальцы скрещенными, чтобы иметь возможность использовать его для зарядки телефона в баре. Это был Тим Харрисон из Бристольского университета с универсальной химией этанола. Теперь, на следующей неделе, тонкая грань между любовью и ненавистью. Или это может быть просто ненависть.
Теперь, на следующей неделе, тонкая грань между любовью и ненавистью. Или это может быть просто ненависть.
Андреа Селла
Есть ли у вас эмоциональная привязанность к молекуле или соединению? Подумай об этом? Есть ли какое-то соединение, к которому вы питаете привязанность? Это может сопровождаться тягой к такому маленькому алкалоиду, как кофеин.Или, возможно, это для чего-то более сильного, менее законного…
А как же ненависть? Есть ли молекула, которую вы действительно ненавидите? Тот, кого вы хотели бы видеть уничтоженным? Для меня есть одна молекула, одна удивительная молекула, которая выделяется из толпы.
Эта молекула представляет собой гексафторид серы, SF 6 . И я это ненавижу.
Мира Сентилингам
И чтобы узнать, почему Андреа Селла из UCL так ненавидит гексафторид серы, а также услышать обе стороны этой истории, чтобы вы могли составить собственное мнение, присоединяйтесь к нам на следующей неделе.


 Один из
наиболее распространенное из этих соединений известно под общим названием цитронеллол . Использовать
Систематическая номенклатура для названия этого спирта имеет следующую структуру.
Один из
наиболее распространенное из этих соединений известно под общим названием цитронеллол . Использовать
Систематическая номенклатура для названия этого спирта имеет следующую структуру.