«Решение задач на нахождение формулы органического вещества»
Разделы: Химия
Цель: применение алгоритма при решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения задач;
- закрепить навыки работы с алгоритмами;
- показать взаимосвязь химии и математики.
ХОД УРОКА
1. Оргмомент
Учитель знакомит класс с темой урока, целью и задачами урока.
2. Повторение общих формул органических веществ.
Учитель предлагает учащимся назвать общие формулы алканов, алкенов, алкинов, циклоалканов, алкадиенов, типы гибридицациии атомов углерода, характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
АЛГОРИТМ №1.
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) = (2)
б) если СО2 дано в объеме:
n(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
n(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример:
При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = = 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 = 5
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в данной формулу один атом N.
Ответ: С5Н5N
4. Составление алгоритма нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
АЛГОРИТМ № 2
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = (2)
б) если w дана в долях:
n(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример:
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1), задача решена.
Ответ: С4Н10
5. Закрепление материала
Учащиеся решают задачи самостоятельно, по необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Гара Н.Н., Горбусева Н. И. Сборник задач. –
М.:Дрофа, 2010.
Задачи: 1.5; 1.17; 2.10; 2.27.
xn--i1abbnckbmcl9fb.xn--p1ai
Вывод формул органических веществ по продуктам сгорания табличным методом
Львова Елена Михайловна
Учитель-методист Почетный работник образования
КГУ гимназия город Балхаш Казахстан
Вывод молекулярных формул органических веществ
по продуктам сгорания
Задача 1. Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Общепринятое решение
|
Дано: | Решение: Составляем пропорции: |
| Вывести формулу |
Задача 2 Общепринятое решение.
1) При сгорании 3г. углеводорода было получено 8,8 г.углекислого газа,5,4 г. воды. Относительная плотность углеводорода по воздуху равна 1,03. Определите молекулярную формулу углеводорода.
3г. 8,8г. 5,4г.
CxHу + О2 = СО2 + Н2О
44г 18г
Т.к. -.это углеводород = кроме углерода и водорода в нём больше ничего не содержится. Весь углерод из углеводорода перешёл в 8,8г СО2, а водород в 5,4г Н2О.
1. Рассчитаем Мr(CxHу)
Мr(CxHу) = 1,03 29 = 30
2.Рассчитаем массу углерода в 8,8г СО2
Х = 2,4г
3. Рассчитаем массу водорода в 5,4г Н2О.
Х = 0,6
4. Рассчитаем количество атомов углерода и водорода
γ = т/Аr; х : у = ;= С2Н6
5. Устанавливаем простейшая формула или истинная
Мr(С2Н6) = 12 2 + 6 = 30; Это истинная формула
Задача 1 мое решение
| анализ | v=m/M v=V/Vm |
| Найдем М углеводорода | М (CхHу) = Vm · ρ |
| По условию | 4.4г 6.72л 7.2г |
| Уравнение | CxHу + О2 = СО2 + Н2О |
| М (г/моль) | 44 18 |
| М v (л/моль) | 22.4 |
| Количество (моль) | 0.1 0.3 0.4 |
| Отношение количеств | 1 3 4 |
| Количество элемента | 3 8 |
| Молекулярная формула | C3H8 |
Задача 2 мое решение
| М углеводорода | Мr(CxHу) = 1,03 29 = 30 М=30г/моль |
| Массы по условию | 3г. 8,8г. 5,4г. |
| уравнение | CxHу + О2 = СО2 + Н2О |
| Молярная масса г/моль | 30 44 18 |
| Количество вещества(моль) | 0.1 0.2 0.3 |
| Отношение количеств веществ | 1 2 3 |
| Количество элементов Углерода водорода | 2 6 |
| Формула | С2 Н6 |
Решите самостоятельно.
Задача 1
При сжигании 3,1 г вещества (плотность по водороду 15,5), в котором обнаружены азот, водород и углерод, образуются 4,5 г воды; 4,4 г углекислого газа и 1,4 г азота. Определите молекулярную формулу вещества и процентный состав химических элементов.
Задача 2 При сжигании 0.46 г органического вещества было получено 0.88 г оксида углерода (IV) и 0.54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу.
Задача3. При сгорании органического вещества массой 3,9 г, относительная плотность паров которого по воздуху равна 3.9 г, относительная плотность паров которого по воздуху равна 2, 69, образовался оксид углерода (IV) объёмом 6, 72 л (н.у.) и вода массой 2,7 г воды. Какова формула вещества?
Задача 4. При сжигании углеводорода образовалось 22,0 углекислого газа и 4,5 г воды. Определите молекулярную формулу углеводорода, зная, что он содержит 2 атома углерода.
Задача 5 При сгорании органического вещества массой 2,3 г образовались оксид углерода (IV) массой 4,4 г и вода массой 2,7 г. Относительная плотность паров этого вещества по воздуху равна 1. 59. Определите его структурную формулу. Зная, что не реагирует с металлическим натрием.
Задача 6. При сжигании 1,8 г органического вещества образовалось 2, 016 л оксида углерода (IV) (н.у.) и 2,16 г водяных паров. Напишите структурные формулы и названия всех возможных изомеров этого вещества, если известно. Что 1 л его паров при нормальных условиях имеет массу 2, 679 г.
Задача 7. При полном окислении 0,9 г гомолога этиленгликоля в токе кислорода образовалось 1,76 г оксида углерода (IV) и 0.9 г воды. Определите молекулярную формулу вещества.
kopilkaurokov.ru
Решение задач на вывод формул органических веществ

Решение задач на вывод формул веществ
Дёмина Евгения Валерьевна,
учитель химии
МБОУ «Средняя общеобразовательная школа
№ 8 им. К.К. Рокоссовского»
г. Курска
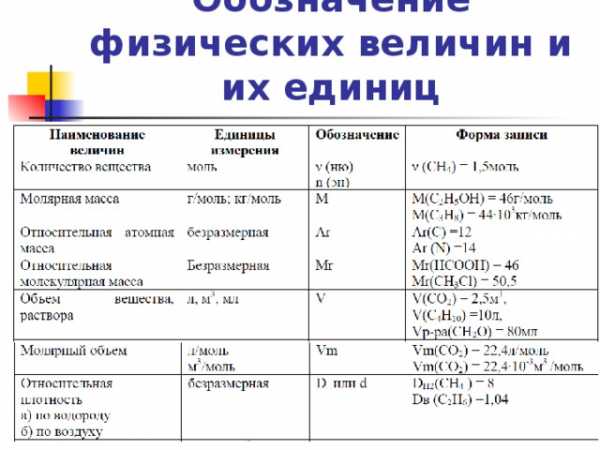
Обозначение физических величин и их единиц

Цель и задачи:
Цель: Сформировать умение решать различные типы задач на вывод молекулярной формулы вещества.
Задачи:
1. Расширить знания учащихся о способах решения задач;
2. Закрепить навыки работы с алгоритмами;
3. Показать взаимосвязь химии и математики.
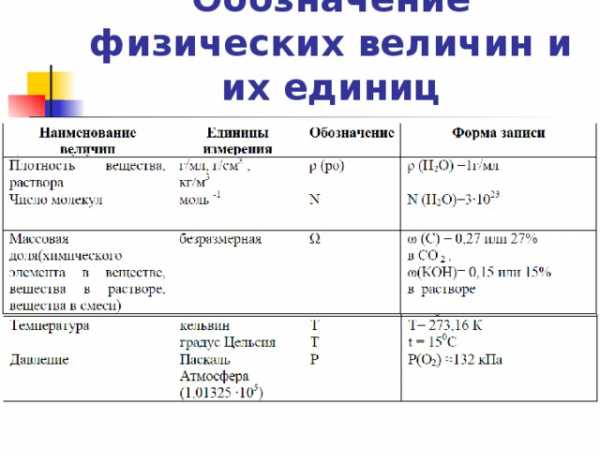
Обозначение физических величин и их единиц

1. Вывод формулы вещества на основе массовой доли элементов. Алгоритм решения:

По мнению австрийского физиолога Герхарда Кромбаха, любовь-всего лишь химия. Выведите ее простейшую формулу, если массовые доли углерода, водорода и азота в ней составляют: 79,33%, 9,1% и 11,57%.


Суточная потребность человека в витамине РР 20-30 мг. Недостаток его в организме вызывает пелагру- заболевание, проявляющееся в поражении кожи, желудочно-кишечного тракта и психики. Массовые доли химических элементов в молекуле составляют: углерода — 59,02%, водорода — 4,92%, азота — 11,2%, кислорода — 25,6%. Найдите молекулярную формулу витамина РР.


2. Нахождение простейшей формулы вещества по данным об отношении масс элементов. Алгоритм решения:
Формула углеводорода в общем виде СхНу, отношение масс элементов С и Н равно отношению их атомных масс, умноженных на соответствующие индексы х и у:
отсюда следует, что отношение нижних индексов х и у равно:

Я пью его в мельчайших дозах,
На сахар капаю раствор,
А он способен бросить в воздух
Любую из ближайших гор.
Определите простейшую формулу вещества, о котором идет речь в стихотворении В.Шаламова, если в этом веществе m(С): m(Н) : m(О): m(N)=
36 : 5 : 144 :42.


В состав очень модных сейчас жевательных резинок и конфет с мятным вкусом входит ментол. Ментол (в переводе с лат. означает «масло мяты») оставляет во рту холодящий вкус. Определите его простейшую формулу, если соотношение масс углерода, водорода и кислорода как 30:5:4.


3. Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе).

Относительная молекулярная масса «мышечного сахара» или инозита равна 180. Содержание углерода в нем — 40%, водорода — 6%, кислорода — 53%. Установите молекулярную формулу вещества.


Некоторые феромоны (вещества, вырабатываемые насекомыми с целью оповещения о тревоге, сборе и т.д.) содержат алкены, например, в феромоне мух есть алкен с массовой долей углерода 85,7% и молярной массой 420. Определите его молекулярную формулу.


4. Нахождение молекулярной формулы вещества по данным о массовых долях и его относительной плотности паров по другому газу (водороду, воздуху и т.д.).
Формулы для расчетов:
D – относительная плотность

Некоторая карбоновая кислота, используемая в пищевой промышленности, и имеющая код Е280, содержит 49% углерода, 8% водорода, 43% кислорода. Относительная плотность ее паров по кислороду 2,3125. Определите молекулярную формулу кислоты.


Лекарственные препараты, используемые при лечении алкоголизма, замедляют превращение альдегида в другие продукты. Плотность его паров по водороду 22; процентный состав: углерода — 54,55%, водорода — 9,09% и кислорода — 36,36%. Определите молекулярную и выведите структурную формулы.


5. Нахождение молекулярной формулы сложного вещества по данным о массовых долях и плотности его паров, измеренных при нормальных условиях.
Формулы для расчетов:

Считают, что причиной неудачной попытки отравить Распутина в 1916 г в доме Юсупова (роман В.Пикуля «Нечистая сила») было обстоятельство, что синильная кислота и некоторые цианиды образуют нетоксичные соединения с веществом, которое содержит углерод-39,97%, водород — 6,33%, кислород-53,3%. 300см 3 паров вещества (при н.у.) имеют массу 2,42 г. Вывести молекулярную формулу вещества.


6. Нахождение молекулярной формулы вещества по данным о его массе и продуктах сгорания, а также о относительной плотности его паров по другому газу или абсолютной плотности.

Азотсодержащее органическое соединение массой 11,8 г, плотность паров которого по воздуху равна 2,035, сожгли в избытке кислорода. При этом образовался оксид углерода (IV) объемом 13,44 л, азот объемом 2,24 л и вода массой 16,2 г. Выведите молекулярную формулу этого вещества, составьте структурные формулы трех его изомеров и назовите их. (C 3 H 9 N.)


7. Вывод формулы вещества на основе общей формулы гомологического ряда органических соединений

На полное гидрирование этиленового углеводорода массой 2,8 г израсходован водород объемом 0,896 л (н. у.). Какова молярная масса и структурная формула этого соединения, имеющего неразветвленную цепь углеродных атомов?


Задачи для самостоятельного решения
1. В питьевой воде были обнаружены следы вещества, обладающего общетоксичным и наркотическим действием. На основе качественного и количественного анализов этого вещества было установлено, что это производное фенола и массовые доли элементов в нем равны: 55% С, 4,0% Н, 14% О, 27% СL. Определите простейшую формулу вещества.
2. Установите формулу циклоалкана, который в смеси с кислородом в концентрации 15-18% применяют для наркоза, (его используют при операции больных с заболеваниями легких, печени и диабетом), если его плотность равна 1,875 г/л, (н.у.) а массовая доля углерода составляет 0,857.


Литература
- 1. Д.Л. Ерыгин, Е.А. Шишкин «Методика решения задач по химии» М.,Просвещение, 1989.
- 2. О.С. Габриелян, П.В. Решетов, И.Г. Остроумов «Задачи по химии и способы их решения». М., Дрофа, 2006.
- 3. А.С. Егоров «Самоучитель по решению химических задач», Ростов-на-Дону, «Феникс», 2000.
- 4.Н.Е. Кузьменко, В.В. Еремин «Сборник задач по химии: 8-11 классы». Москва, «Экзамен», 2006.
- 5. Б.Д. Степин, Л.Ю. Аликберова «Занимательные задания и эффектные опыты по химии», М., «Дрофа», 2002.

Дёмина Евгения Валерьевна,
учитель химии
МБОУ «Средняя общеобразовательная школа № 8 им. К.К. Рокоссовского» г. Курска
E-mail:
Т. 8 906 573 63 61
multiurok.ru
«Решение задач на нахождение формулы органического вещества» (10 класс)
Тема: «Решение задач на нахождение формулы органического вещества» (10 класс)
Цель: применение алгоритма при решении задач на вывод формул.
Задачи:
расширить знания учащихся о способах решения задач;
закрепить навыки работы с алгоритмами;
показать взаимосвязь химии и математики.
ХОД УРОКА
1. Оргмомент
Учитель знакомит класс с темой урока, целью и задачами урока.
2. Повторение общих формул органических веществ.
Учитель предлагает учащимся назвать общие формулы алканов, алкенов, алкинов, циклоалканов, алкадиенов, типы гибридицациии атомов углерода, характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
АЛГОРИТМ №1.
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) = (2)
б) если СО2 дано в объеме:
n(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
n(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример:
При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = = 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 = 5
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в данной формулу один атом N.
Ответ: С5Н5N
4. Составление алгоритма нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
АЛГОРИТМ № 2
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = (2)
б) если w дана в долях:
n(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример:
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1), задача решена.
Ответ: С4Н10
5. Закрепление материала
Учащиеся решают задачи самостоятельно, по необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
6. Домашнее задание
kopilkaurokov.ru
Урок химии «Решение задач на нахождение молекулярной формулы органического соединения».
УРОК № 41.
ТЕМА УРОКА: «Решение задач на нахождение молекулярной формулы органического соединения».
ТИП УРОКА: урок систематизации и комплексного применения знаний, умений и навыков.
ФОРМА УРОКА: практикум по решению химических задач.
ЦЕЛИ УРОКА:
создание условий для проявления познавательной активности учащихся;
развитие личности учащихся на основе освоения УУД;
систематизация и применение предметных ЗУН, учебных действий в условиях решения типовых задач и задач повышенного уровня сложности.
ЗАДАЧИ УРОКА:
Дидактическая: формировать УУД (личностные, коммуникативные, регулятивные, познавательные) в условиях решения химических задач различного уровня сложности.
.
Образовательные: творчески использовать химические знания, применять изученные алгоритмы при решении задач; научить учащихся применять знания по математике при решении практических задач на нахождение химических формул углеводородов.
Развивающие: формировать рациональные приёмы мышления у учащихся, совершенствовать умение сравнивать и обобщать; стимулировать познавательную активность, чтобы в дальнейшем они самостоятельно овладевали методами решения расчётных задач повышенной трудности.
Воспитательные: содействовать формированию идей о целостности мира, развивать чувство ответственности, упорство и настойчивость в достижении поставленной цели; воспитывать интерес к химии как науке, сознательное отношение к химическим знаниям.
ФОРМЫ ОБУЧЕНИЯ: фронтальная, индивидуальная, групповая (парная), коллективная.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВЛЕННОСТИ ОБУЧАЮЩИХСЯ
Знать:
алгоритмы решения химических задач на вывод молекулярных формул органических соединений по общей формуле класса веществ; массовой доле элементов в веществе, его плотности при нормальных условиях и относительной плотности; по продуктам сгорания вещества; по уравнению реакции;
классификацию органических соединений;
химические свойства и способы получения изученных классов органических соединений.
Уметь:
ставить новые учебные задачи в сотрудничестве с учителем;
составлять план и последовательность действий;
осуществлять итоговый и пошаговый контроль по результату, коррекцию действий с учетом сделанных ошибок;
самостоятельно определять качество и уровень усвоения материала;
использовать известные алгоритмы при решении задач;
использовать знаково-символические средства при решении задач;
осуществлять поиск, анализ и передачу информации, в т.ч. средствами ИКТ;
проявлять активность во взаимодействии при различных формах работы;
осуществлять самоконтроль и взаимный контроль, мотивацию учебной деятельности.
ОБОРУДОВАНИЕ И ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ:
проектор,
интерактивная доска,
ноутбук,
мультимедийная презентация к уроку,
инструктивные карточки для учащихся,
калькуляторы у учащихся,
задачи, самостоятельно составленные учащимися к уроку,
карточки с домашним заданием.
ХОД УРОКА:
Недостаточно лишь понять задачу, необходимо желание решить её. Где есть желание найдётся путь! Дьёрдь Пойа
ОРГАНИЗАЦИОННЫЙ ЭТАП.
-Учащиеся рассаживаются пятью группами по 4 человека. Каждый самостоятельно составил дома задачу на вывод молекулярной формулы органического вещества с использованием уравнения химической реакции. Разбираются инструкционные карточки четырех цветов.
-Приветствие учителя.
2 ЭТАП, ПОСТАНОВКА ЦЕЛИ И ЗАДАЧ УРОКА. МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ УЧАЩИХСЯ,
-Жизнь постоянно ставит перед нами разные задачи и решать их можно разными путями. У каждого есть выбор, и он пытается найти свой, более оптимальный путь решения. Согласитесь, что для этого нужен опыт. Именно накоплению этого опыта посвящается наш сегодняшний урок.
— Вспомните, задачи какого типа мы наиболее часто решали на уроках органической химии? (задачи на вывод молекулярных формул)
-Для чего учащемуся необходимо уметь решать такие задачи? (при сдаче единого государственного экзамена предлагаются задания блока «С», где присутствует задача на вывод молекулярной формулы; возможно, навыки определения количественного состава органических соединений потребуются в дальнейшей профессиональной деятельности)
-Как вы считаете, все ли типы задач на вывод формулы органического соединения мы освоили? (нет)
-Предлагаю вам сформулировать тему сегодняшнего занятия.
— «Решение задач на нахождение молекулярной формулы органического соединения». (записывается в тетрадь)
-Если бы вы проводили этот урок, как бы вы его спланировали? (совместно составляется план урока)
План урока:
1. Актуализация ранее изученных алгоритмов решения задач:
а) нахождение молекулярной формулы органического соединения по общей формуле класса органических веществ;
б) нахождение молекулярной формулы органического соединения по массовым долям химических элементов в веществе, а также по плотности веществ и относительной плотности газов;
в) нахождение молекулярной формулы органического соединения по продуктам его сгорания;
2.Решение задач, самостоятельно составленных учащимися на нахождение молекулярной формулы органического соединения по уравнению химической реакции (проверка домашнего задания).
3. Промежуточный контроль.
4. Решение задач повышенного уровня сложности.
5. Домашнее задание.
6. Подведение итогов урока.
—Обратите внимание на эпиграф нашего занятия: Недостаточно лишь понять задачу, необходимо желание решить её. Где есть желание найдётся путь!
-Желаю успеха! Приступаем к работе.
3 ЭТАП. АКТУАЛИЗАЦИЯ ЗНАНИЙ.
а) Нахождение молекулярной формулы органического соединения по общей формуле класса органических веществ:
— пример задачи: «Определите молекулярную формулу алкана, обнаруженного в кожуре яблок, молекулярная масса которого равна 436»,
— повторим алгоритм:
АЛГОРИТМ №1.
1. Вспоминаем общую формулу названного класса органических соединений.
2.Записываем сумму масс атомов химических элементов в молекуле, выразив неизвестные индексы через «n». Приравниваем полученное выражение к известной молекулярной или молярной массе вещества.
3. Рассчитываем значение «n» и записываем общую формулу органического соединения.
4. При необходимости даем название веществу, записываем его структурную формулу и формулы его изомеров.
-индивидуально решаем задачу по карточке:
1.СnH2n+2
2. 12n+2n+2=436
3. n=31 => C31H64
-находим букву, соответствующую правильному ответу, и вписываем ее в ключевое слово (э).
б) Нахождение молекулярной формулы органического соединения по массовым долям химических элементов в веществе, а также по плотности веществ и относительной плотности газов:
— пример задачи: «Углеводород, образующийся при термическом крекинге октана содержит 85, 7% углерода. Относительная плотность его по водороду равна 28. Определите молекулярную формулу вещества»
— повторим алгоритм:
АЛГОРИТМ №2.
1. Вычисляем молярную массу вещества.
М(в) = D(x) * М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = (2)
б) если w дана в долях:
n(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
— решаем задачу по карточке в паре с соседом по парте:
1. M=28 * 2 = 56 г/моль
2. x=56 * 85,7 : 1200 = 4
y=56 * (100-85,7) : 100 = 8
3. M (C4H8) = 56 г/моль => задача решена правильно.
-находим букву, соответствующую правильному ответу, и вписываем ее в ключевое слово (т).
в) Нахождение молекулярной формулы органического соединения по продуктам его сгорания:
Прибор для органического анализа Дюма-Либиха.
-Суть анализа проста: надо взять известную массу органического соединения, сжечь его и определить, сколько получилось продуктов сгорания. Затем перейти к решению задачи на вывод формулы органического соединения. Прибор для органического анализа состоит из устройства для сжигания в воздухе обогащенном кислородом и системы ловушек для поглощения основных продуктов сгорания. Современные приборы действуют на том же самом принципе, хотя их чувствительность и скорость несравнимы с приборами Дюма и Либиха. Приборы, выпускаемые сейчас, позволяют взять для анализа буквально десятые доли миллиграмма. При этом анализ выполняется очень быстро.
— пример задачи: «Определите молекулярную формулу продукта реакции Зелинского – Казанского при сжигании 3,9 г которого образуется 13,2 г оксида углерода (IV) и 2,7 г воды. Плотность вещества по воздуху равна 2,69.»
— повторим алгоритм:
АЛГОРИТМ №3.
1. Вычисляем молярную массу вещества.
М(в) = D(x) * М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) = (2)
б) если СО2 дано в объеме:
n(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, формулу умножаем на 2 (это применимо и к N)
n(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
— решаем задачу по карточке всей группой:
Решение:
1.M (CxHyOz) = 2,69 * 29 = 78 г/моль
2. x = (78*13,2) : (3,9* 44) = 1029,6 : 171,6 = 6
3. y = 2 * (78 * 2,7) : (3,9 * 18) = 2 * 210,6 : 70,2 = 6
4. M (C6H6) = 12 * 6 + 6 = 78 г/моль => вещество не содержит кислород, задача решена правильно.
-находим букву, соответствующую правильному ответу, и вписываем ее в ключевое слово (а).
4 ЭТАП. ВОСПРОИЗВЕДЕНИЕ НА НОВОМ УРОВНЕ.
Решение задач, самостоятельно составленных учащимися на нахождение молекулярной формулы органического соединения по уравнению химической реакции (проверка домашнего задания).
-зачитываются наиболее интересные и грамотно составленные задачи,
— учащиеся обмениваются задачами в паре, решают их,
-взаимопроверка. Если задача решена правильно, в ключевое слово вписывается буква «н».
Промежуточный контроль.
-Удалось ли вам решить задачи, составленные одноклассниками?
-Каждому цвету карточки соответствует свое ключевое слово. (этан, этен, этин, арен).
Взаимопроверка. Выставление отметки.
5 ЭТАП. ПРИМЕНЕНИЕ ЗНАНИЙ И УМЕНИЙ В НОВОЙ СИТУАЦИИ.
— Часто решая задачи по органической химии мы забываем о тех правилах и законах, которые изучили в курсе неорганической химии. При решении следующей задачи, необходимо вспомнить один из основополагающих законов природы.
-предлагается задача «При гидрировании 140 г некоего алкена образовалось 145 г алкана. Установите молекулярную формулу продукта реакции»
-выдвигается гипотеза по ее решению.
— Как называется используемый нами закон? (закон сохранения массы веществ)
-Кем он был открыт? (демонстрация портретов М.В.Ломоносова и А.Л.Лавуазье)
-решение задачи на доске:
1. CnH2n + H2 = CnH2n+2
2. m (H2) = 145г — 140г = 5г ( по закону сохранения массы веществ )
3. n (H2) = 5 : 2 = 2,5 моль
4. M (CnH2n+2) = 145 : 2,5 = 58 г/моль
5. 12n + 2n + 2 = 58
n = 4 => C4H10
-Оценка работы учащегося.
-Наибольшую актуальность для вас, как для будущих выпускников, имеют задачи части «С», с которыми мы сталкиваемся на ЕГЭ. К ним относятся и задачи на вывод молекулярной формулы по уравнениям двух химических реакций.
-предлагается задача «При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г хлорпроизводного и 12,3 г бромпроизводного. Определите молекулярную формулу алкена.»
-выдвигается гипотеза по ее решению,
— решение – на доске:
1. CnH2n + HCl = CnH2n+1Cl
CnH2n + HBr = CnH2n+1Br
2. M (CnH2n+1Cl) = 12n + 2n + 1 + 35,5 = 14n + 36,5
M (CnH2n+1Br) = 12n + 2n + 1 + 80 = 14n + 81
3. n (CnH2n+1Cl) = n (CnH2n+1Br)
n = m : M
7,85 : (14n + 36,5) = 12,3 : (14n + 81)
— подсчет – в группах: n = 3 => C3H6
-проверка правильности выполнения подсчетов.
6 ЭТАП, ИНФОРМАЦИЯ О ДОМАШНЕМ ЗАДАНИИ, ИНСТРУКТАЖ ПО ЕГО ВЫПОЛНЕНИЮ.
-Предлагаются карточки с 5 задачами повышенного уровня сложности. Учащийся решает дома любые 2 по выбору.
7 ЭТАП. ПОДВЕДЕНИЕ ИТОГОВ УРОКА, РЕФЛЕКСИЯ.
— Хватало ли вам времени на выполнение заданий?
— Какой тип задач кажется вам наиболее сложным?
— Что нового вы узнали на сегодняшнем занятии?
— Сохраните ли вы инструкционные карточки?
— Удалось ли нам выполнить составленный в начале урока план?
-Учитель благодарит ребят за работу, желает успехов в освоении химических знаний.
ИНСТРУКЦИОННАЯ КАРТОЧКА №1
а) Нахождение молекулярной формулы органического соединения по общей формуле класса органических веществ.
АЛГОРИТМ №1.
1. Вспоминаем общую формулу названного класса органических соединений.
2.Записываем сумму масс атомов химических элементов в молекуле, выразив неизвестные индексы через «n». Приравниваем полученное выражение к известной молекулярной или молярной массе вещества.
3. Рассчитываем значение «n» и записываем общую формулу органического соединения.
4. При необходимости даем название веществу, записываем его структурную формулу и формулы его изомеров.
ЗАДАЧА №1. — РЕШАЕМ САМОСТОЯТЕЛЬНО!!!
«Определите молекулярную формулу алкана, обнаруженного в кожуре яблок, молекулярная масса которого равна 436»
Решение:
1.СnH2n+2
2. 12n+2n+2=436
3. n=31 => C31H64
Находим букву, соответствующую правильному ответу, и вписываем ее в ключевое слово.
б) Нахождение молекулярной формулы органического соединения по массовым долям химических элементов в веществе, а также по плотности веществ при нормальных условиях и относительной плотности газов.
АЛГОРИТМ №2.
1. Вычисляем молярную массу вещества.
М(в) = D(x) * М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = (2)
б) если w дана в долях:
n(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
ЗАДАЧА №2. — РЕШАЕМ В ПАРЕ!!!
«Углеводород, образующийся при термическом крекинге октана, содержит 85, 7% углерода. Относительная плотность его по водороду равна 28. Определите молекулярную формулу вещества»
Решение:
1. M=28 * 2 = 56 г/моль
2. x=56 * 85,7 : 1200 = 4
y=56 * (100-85,7) : 100 = 8
3. M (C4H8) = 56 г/моль => задача решена правильно.
Находим букву, соответствующую правильному ответу, и вписываем ее в ключевое слово.
в) Нахождение молекулярной формулы органического соединения по продуктам его сгорания и относительной плотности (плотности при н.у.).
АЛГОРИТМ №3.
1. Вычисляем молярную массу вещества.
М(в) = D(x) * М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
x = (2)
б) если СО2 дано в объеме:
n(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
y = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
ЗАДАЧА №3. — РЕШАЕМ ГРУППОЙ!!!
«Определите молекулярную формулу продукта реакции Зелинского – Казанского при сжигании 3,9 г которого образуется 13,2 г оксида углерода (IV) и 2,7 г воды. Плотность вещества по воздуху равна 2,69.»
Решение:
1.M (CxHyOz) = 2,69 * 29 = 78 г/моль
2. x = (78*13,2) : (3,9* 44) = 1029,6 : 171,6 = 6
3. y = 2 * (78 * 2,7) : (3,9 * 18) = 2 * 210,6 : 70,2 = 6
4. M (C6H6) = 12 * 6 + 6 = 78 г/моль => вещество не содержит кислород, задача решена правильно.
Находим букву, соответствующую правильному ответу, и вписываем ее в ключевое слово.
Решение задач, самостоятельно составленных учащимися на нахождение молекулярной формулы органического соединения по уравнению химической реакции (проверка домашнего задания).
МОГУТ БЫТЬ ПРИМЕНЕНЫ РАЗЛИЧНЫЕ АЛГОРИТМЫ.
ОБМЕНЯЙТЕСЬ ЗАДАЧАМИ В ПАРЕ, РЕШИТЕ ИХ!!!
ЗАДАЧА №4. (прикрепить условие)
Решение:
Проверьте решение друг у друга. Если задача решена правильно, в ключевое слово вписывается буква «н».
Правильный ответ
Буква
C6H6
а
C2H6
е
C3H4
и
C2H2
к
C5H12
л
Решил правильно!
н
C8H16
р
C4H8
т
C31H64
э
КЛЮЧЕВОЕ СЛОВО
Э
Т
А
Н
ОТМЕТКА УЧАЩЕГОСЯ:
ЗАДАЧА №5.
«При гидрировании 140 г некоего алкена образовалось 145 г алкана. Установите молекулярную формулу продукта реакции»
Решение:
1. CnH2n + H2 = CnH2n+2
2. m (H2) = 145г — 140г = 5г ( по закону сохранения массы веществ )
3. n (H2) = 5 : 2 = 2,5 моль
4. M (CnH2n+2) = 145 : 2,5 = 58 г/моль
5. 12n + 2n + 2 = 58
n = 4 => C4H10
ЗАДАЧА №6.
«При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г хлорпроизводного и 12,3 г бромпроизводного. Определите молекулярную формулу алкена»
Решение:
1. CnH2n + HCl = CnH2n+1Cl
CnH2n + HBr = CnH2n+1Br
2. M (CnH2n+1Cl) = 12n + 2n + 1 + 35,5 = 14n + 36,5
M (CnH2n+1Br) = 12n + 2n + 1 + 80 = 14n + 81
3. n (CnH2n+1Cl) = n (CnH2n+1Br)
n = m : M
7,85 : (14n + 36,5) = 12,3 : (14n + 81)
— подсчет – в группах: n = 3 => C3H6
infourok.ru
Урок «Решение задач на вывод формул органических веществ» (10 класс, химия)
Тема урока : Решение задач на вывод формул органических веществ
№ УЭ
Учебный материал с указанием заданий
Руководство
по выполнению
№, стр. учебника, слайды презентации
1.0
0. ЦЕЛЬ:
Закрепить практические навыки в решении задач. Уметь решать задачи на нахождение молекулярной формулы вещества на основании относительной плотности, массовой доли химических элементов в веществе и по продуктам сгорания.
Воспроизведите знания:
– Что такое массовая доля элемента?
– Как определить количество вещества?
— Чему равен молярный объем газа?
– Как определить относительную молекулярную массу?
– Как определить относительную молекулярную массу углеводорода, зная относительную плотность по водороду или воздуху?
0.3 В конце урока заполнить пробелы в высказывании известного человека. (Приложение № 4)
Устно
Слайд №4
1.1.
Используя алгоритмы в Приложении №1, решить задачу на определение молекулярной формулы вещества на основании результатов количественного анализа (массовой доли элементов) и относительной плотности.
Цель: определить формулу вещества по массовым долям атомов, входящих в его состав
1. Задача №1. Найдите молекулярную формулу углеводорода, содержание углерода в котором 92,31 %, а водорода-7,69%, относительная плотность по водороду равна 39.
2. Самостоятельно проверить правильность решения задачи по алгоритму и поставить количество баллов.
А) рассчитана истинная молекулярная масса вещества по относительной плотности – 2 балла
Б) правильно найдены количество вещества атомов С и Н (n(С), n(Н)) – 2 балла
В) установлена молекулярная формула вещества – 2 балла
Итого – 6 баллов
1 2 3 4 5 6
Письменно в тетради по вариантам
Самоконтроль
Впишите название вещества.
Приложение №1, алгоритмы решения задач
Слайд №5
Слайд №6
Слайды №7,8
1.2
Используя алгоритмы в Приложении №2, решить задачу на определение молекулярной формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
Цель: определить формулу вещества по продуктам сгорания вещества .
1. Задача №2. При сгорании 8,6 г углеводорода образовалось 26,4 г оксида углерода (IV) и 12,6 г воды. Плотность углеводорода по воздуху равна 2,966. Определите молекулярную формулу углеводорода.
2.Проверить правильность решения и поставить количество баллов.
А) рассчитана истинная молекулярная масса вещества по относительной плотности – 2 балла
Б) правильно найдены количество вещества атомов С и Н (n(С), n(Н)) – 2 балла
В) установлена молекулярная формула вещества – 2 балла
Итого – 6 баллов
7 2 8 9 10 3
Письменно в тетради по вариантам
Взаимопроверка в парах.
Впишите название вещества.
Приложение №2, алгоритмы решения задач.
Слайд №9
Слайд № 10
Слайды №11,12
1.3
Прочитайте материал приложения №3. Определите, какой газ ускоряет созревание плодов?
Цель: Закрепить умение решать задачи на определение формулы углеводорода
Найдите ошибку в решении задачи – 2 балла
Предложить правильное решение – 2 балла
Итого – 4 балла
11 12 13 6 2 3
Работа в парах
Письменно в тетради
Впишите название вещества
Приложение №3, алгоритмы решения задач в Приложениях № 1,2
Слайды 13-16
1.4
1. Впишите недостающие буквы в высказывание. (Приложение №4)
2. Подсчитать количество баллов и оценить свою работу на уроке:
16-14 баллов – «5»
13-11 баллов – «4»
10 – 7 баллов – «3»
3. Контроль знаний
Решить задачи по вариантам
1 вариант
При сгорании 1,3 г вещества образуется 4,4 г оксида углерода(IV) и 0,9 г воды. Плотность паров этого вещества по водороду равна 39. Определите молекулярную формулу данного вещества.
2 вариант
При сжигании углеводорода массой 29 г. образовалось 88 г. оксида углерода (IV) и 45 г. воды. Относительная плотность вещества по воздуху равна 2. найдите молекулярную формулу углеводорода.
Д\з: Решить задачи
1.Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
2. При сгорании органического соединения массой 4,8 г. получен оксид углерода (IV) массой 6,6 г. и вода массой 5,4 г. Плотность вещества по водороду равна 16. Найдите молекулярную формулу вещества
Слайды 17, 18
Слайд 19
Слайд 20
Приложение №1
Определение формул веществ по массовым долям атомов, входящих в его состав
1способ
1.Внимательно прочитайте условие задачи и кратко запишите его
2. Пусть масса всего вещества=100г, тогда m(атомов)=100г * (атома)% / 100%
3. Найдём количество вещества каждого атома:
n(C) = m / M = х моль,
n(H) = m / M = у моль.
4. Определяем мольное соотношение атомов С и Н:
n(C) : n(H) = х : у.
Таким образом, находим простейшую формулу — СхНу.
5. Нахождение относительной молекулярной массы по простейшей формуле искомого вещества.
6.Находим истинную относительную молекулярную массу по формуле через относительную плотность
Мr истинная = D(газу.) • Мr газа = z г/моль.
7.Сравнение относительных молекулярных масс, найденных по истинной и простейшей формуле искомого вещества и нахождение истинной формулы искомого вещества.
К= Мr ист/ Мr прост. ; К* С х Ну——находим формулу
2 способ
1. Рассчитываем относительную молекулярную массу вещества.
Мr(СxНy) = D(газу.) • М газа = z г/моль.
2. Находим число молей атомов углерода в 1 моль вещества методом пропорций
m г (в-ва) – 100%
m г (С) — (C) %
решаем пропорцию
m(С)= m г (в-ва) * (C) % / 100% = х г
Находим n(C)
n= m/М
n(C) = х г:12 г/моль = а моль
3. Находим аналогично число молей атомов водорода в 1 моль вещества.
m г (в-ва) – 100%
m г (Н) — (Н) %
решаем пропорцию
m(Н)= m г (в-ва) * (Н) % / 100% = у г
Находим n(Н)
n(H) = у г:1 г/моль = б моль
4. Установите соотношение атомов n(C) : n(H) =а:б
Ответ: истинная формула углеводорода СаНб.
3 способ
Находим истинную молекулярную массу по формуле через относительную плотность
Мr истинная = D(газу.) • М газа = z.
Находим индексы атомов углерода и водорода в этом веществе по их массовым долям.
ω (э)= n* Ar(э) . 100%
Mr в-ва
n=ω*Mr : Ar*100%
n (C) = ω*Mr : Ar(C)*100%= x
n (H) = ω*Mr : Ar(H)*100%= y
Формула вещества — СxНy.
Приложение №2
Определение формул веществ по продуктам сгорания.
1-й способ.
1.Находим истинную молярную массу по формуле через относительную плотность
Мr истинная = D(газу.) • М газа = z г/моль.
2.Определяем массу 1 моль углерода по оксиду углерода (IV).
M(CO2)=44г/моль, значит, m(CO2)=44г.
Составляем пропорцию и решаем:
В 44 г (СО2) содержится 12 г (С),
а в m г (СО2)-х г (С)
m= хг (С).
3.Определяем массу 1 моль водорода по воде.
М(Н2О)=18 г/моль, m(Н2О)=18 г.
Составляем пропорцию и решаем:
В 18 г (Н2О) – 2 г (Н),
а в m г (Н2О) — у г (Н)
m= уг (Н).
4.Определяем, есть ли в веществе кислород m (C) + m(H)
5. Определяем отношение атомов. n(С) :n(Н) = х/12 : у/1 .
Составляем простейшую формулу С хН у и находим Мr простейшую.
6.Сравниваем относительные молекулярные массы, найденные по истинной и простейшей формуле искомого вещества и нахождение истинной формулы искомого вещества.
К= Мr ист/ Мr прост. ; К* С х Н у——находим формулу
2-й способ.
1. Находим истинную молекулярную массу по формуле через относительную плотность
Мr истинная = D(газу.) • М газа = z г/моль.
2. Массу углерода определяем по массе оксида углерода (IV), а массу водорода — по массе воды. Для этого определяем количество вещества оксида углерода (IV) и количество вещества воды, а по ним n(C) и n(H) :
а) M(CO2)= 44 г/моль
M(h3O)= 18 г/моль
n=m : M.
n(C)=n(CO2)=m(CO2) : 44 г/моль=х моль
n(H)=2n(h3O)=2*m(h3O): 18 г/моль= у моль
б) Определяем массы углерода и водорода:
m=M*n
m(C)=12*х
m(H)=1*у
3) Определяем массы углерода и водорода по формуле m=M*n
4) Определяем, есть ли в веществе кислород:
m(C) + m(H)=m(в-ва) (г). Если равно, то кислорода нет. А если не совпадает, то определяем массу кислорода.
5. Находим соотношение атомов углерода и водорода: n(C) :n(H) = х:у
Составляем простейшую формулу С хН у и находим Мr простейшую.
6. Сравнение относительных молекулярных масс, найденных по истинной и простейшей формуле искомого вещества и нахождение истинной формулы искомого вещества.
К= М ист/ Мr прост. ; К* С х Н у——находим формулу
3 способ
2. Найдите молярную массу углеводорода:
М (в-ва) = Dгаза * Мгаза
3. Заполните таблицу
Формулы
Массы по условию задачи
Молярные массы
Количество в-ва
n = m / M
Количество вещества в целых числах
СхНу
z
СО2
x
Н2О
y
Исходя из этого:
х моль С
1 моль СхНу содержит
у*2 моль Н (так как в молекуле Н2О 2 атома водорода)
8. Запишите формулу углеводорода: СхН2у
Приложение №3
Массовая доля углерода в углероде равна 85,71%, водорода -14,29%. Относительная плотность углеводорода по азоту равна 1. Выведите молекулярную формулу углеводорода, напишите его структурную формулу.
Дано:
(C) = 85,71%
(Н) = 14,29%
D (N2) = 1
_____________
Mr (СхНy) – ?
Решение:
1) m(С)=85,71г, m(Н) =14,29 г
2) n (С) = m/М=85,71г:12 г/моль= 7моль
n(Н)= 14, 29г : 2г/моль= 7 моль
n (С): n(Н)= 7: 7= 1: 1
Значит формула СН
3) Мrпрост = 12 + 1= 13
Мrист = Мr(N2) * 1 = 28 *1 = 28
4) Мrист / Мrист = 28 : 13 = 2. Значит, формула С2Н2
Приложение №4
т
р
м
я
щ
й
я
ж
й
ш
м
у
9 2 13 9
8 1 6 13 10 2
у
ч
ю
х
м
д
ж
ы
ь
13 4 2 3 13 13 13 13
5 6 2 3 1 12
в
д
у
щ
в
9 2 13
м
м
.
10 12 2 10 12 13 8 2
М
.
В
.
м
в
6 5 5 3 5 9 5
Отчет ученика(цы) 10 класса _________________________________________
Тема урока : Решение задач на вывод формул органических веществ
УЭ-1.1. Задача №1. Найдите молекулярную формулу углеводорода, содержание углерода в котором 85,7%, а водорода-14,3%, относительная плотность по воздуху равна 1,931.
Решение
Впиши название полученного вещества:
1 2 3 4 5 6
УЭ1.2. Задача №2. При сгорании 8,6 г углеводорода образовалось 26,4 г оксида углерода (IV) и 12,6 г воды. Плотность углеводорода по воздуху равна 2,966. Определите молекулярную формулу углеводорода.
Решение
Впиши название полученного вещества:
7
2
8
9
10
3
УЭ 1.3. Найдите ошибку в решении задачи и предложите правильное решение
Впиши название полученного вещества:
11
12
13
6
2
3
УЭ 1.4. Заполни:
т
р
м
я
щ
й
я
ж
й
ш
м
у
9 2 13 9
8 1 6 13 10 2
у
ч
ю
х
м
д
ж
ы
ь
13 4 2 3 13 13 13 13
5 6 2 3 1 12
в
д
у
щ
в
9 2 13
м
м
.
10 12 2 10 12 13 8 2
М
.
В
.
м
в
6 5 5 3 5 9 5
Подсчитай общее количество баллов и поставь оценку –
Самостоятельная работа:
infourok.ru
Методическая разработка практической работы «Решение задач на выведение молекулярной формулы органических соединений»
государственное автономное профессиональное образовательное учреждение Чувашской Республики «Межрегиональный центр компетенций –
Чебоксарский электромеханический колледж»
Министерства образования и молодежной политики Чувашской Республики
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
практической работы
« Решение задач на выведение молекулярных формул органических соединений».
Автор: Хлебникова Л.А. – преподаватель
ГАПОУ ЧР МЦК ЧЭМК
г. Чебоксары 2017г.
Тема « Решение задач на выведение молекулярных формул органических соединений».
Цель: научиться решать задачи на вывод формулы органического вещества, определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ.
ТЕОРЕТИЧЕСКИЙ ОБЗОР
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов вы находите сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Алгоритм для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) = (2)
б) если СО2 дано в объеме:
n(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
n(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример 1. При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = = 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 = 5
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в данной формулу один атом N.
Ответ: С5Н5N
Алгоритм на нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = (2)
б) если w дана в долях:
n(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример 2. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти: СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1), задача решена.
Ответ: С4Н10
Задания для самостоятельной работы:
Задание 1. Вывод формулы на основе массовой доли элемента.
1. Какова молекулярная формула углеводорода, содержащего 80% углерода и 20% водорода? Относительная плотность вещества по водороду равна 15.
2. Плотность паров предельного углеводорода (при н.у.) равна 1,97 г/л. Массовая доля углерода в нем – 82%. Найдите молекулярную формулу углеводорода.
3. Какова молекулярная формула углеводорода, содержащего 82,5% углерода? Плотность паров данного углеводорода по воздуху составляет 2.
4. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57.
5. .Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 15,79%. Относительная плотность паров этого вещества по воздуху составляет 3,93.
6. Выведите формулу вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность паров этого вещества по воздуху равна 4,41.
7. Плотность паров углеводорода по воздуху равна 2,345, а массовая доля углерода составляет 88,235%. Определите молекулярную формулу данного углеводорода.
8. Определите формулу углеводорода с массовой долей углерода 85,7%. Плотность паров вещества по воздуху – 1,931. Напишите структурную формулу.
Задание 2. Вывод формулы по продуктам сгорания вещества.
1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
3. При сгорании 36 г. органического вещества получили 55 г. оксида углерода (IV) и 27 г. воды. Относительная плотность вещества по воздуху равна 2,48. найдите молекулярную формулу органического вещества.
4. При сгорании органического вещества массой 3,9 г. образовались: оксид углерода (IV) массой 13,2 г. и воды массой 2,7 г. Относительная плотность вещества по водороду равна 39. найдите молекулярную формулу вещества.
5. При сгорании органического соединения массой 4,8 г. получен оксид углерода (IV) массой 6,6 г. и вода массой 5,4 г. Плотность вещества по водороду равна 16. Найдите молекулярную формулу вещества.
6. При сжигании углеводорода массой 29 г. образовалось 88 г. оксида углерода (IV) и 45 г. воды. Относительная плотность вещества по воздуху равна 2. найдите молекулярную формулу углеводорода.
7. При сжигании углеводорода объемом 2,24 л. получили 13,2 г. оксида углерода (IV) и 7,2 г. воды. Относительная плотность углеводорода по водороду равна 22. найдите молекулярную формулу углеводорода.
8. При сгорании 2,2г органического соединения образовалось 6,6г оксида углерода (IV) и 2,7 г воды. Плотность вещества по водороду равна 42. Определите молекулярную формулу вещества.
infourok.ru
