Смещение химического равновесия | Дистанционные уроки
04-Май-2013 | комментариев 6 | Лолита Окольнова
В части А ЕГЭ по химии есть задания на тему смещения химического равновесия. Это довольно простая тема обратимости химических реакций и укладывается буквально в три примера.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех факторов: концентрации, температуры и давления.
Еще в 1994 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Влияние концентрации на смещение химического равновесия
пример 1
реакция образования аммиака — протекает в газовой среде
пример 2
реакция образования сложного эфира — реакция, проходящая в жидкой среде.
- Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и в жидкой среде.
- Удаление продуктов из среды реакции так же смещает равновесие в сторону продуктов реакции.
- Увеличение концентрации продуктов смещает химическое равновесие в сторону обратной реакции.
Влияние температуры на смещение химического равновесия
Все химические реакции делятся на два типа:
- Эндотермические реакции — реакции, протекающие с поглощением теплоты.
-
Экзотермические реакции — протекают с выделением теплоты.
Соответственно, с помощью температурного воздействия мы можем оказывать влияние на смещение химического равновесия в системе:
в эндотермической реакции:
- увеличение температуры смещает равновесие в сторону продуктов (прямой реакции);
- уменьшение температуры смещает равновесие в сторону реагентов (обратной реакции);
в экзотермической реакции:
- увеличение температуры смещает равновесие в сторону реагентов (обратной реакции);
- уменьшение температуры смещает равновесие
Влияние давления на смещение химического равновесия
Этот вопрос относится только к реакциям в газовой среде.
- При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -образования аммиака).
- При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества, например: 2C (тв) + O2 (г) ↔ 2CO (г), то их количество не учитывается.
Если объем (количество веществ) смеси не меняется, то изменение давления не будет оказывать влияние на смещение химического равновесия.
Катализаторы не влияют на смещение химического равновесия!
- В ЕГЭ это вопрос А21 — Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
Еще на эту тему:
Обсуждение: «Смещение химического равновесия»
(Правила комментирования)distant-lessons.ru
Химическое равновесие
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях.
Химическое равновесие — состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2).
При химическом равновесии концентрации веществ остаются неизменными.
Химическое равновесие имеет динамический характер: прямая и обратная
реакции при равновесии не прекращаются.
Для реакции mA + nB « pC + dD константа равновесия равна
K = K1 / K2 = ([C]p
Константа равновесия зависит от
температуры и природы реагирующих веществ. Чем больше константа
равновесия, тем больше равновесие сдвинуто в сторону образования
продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
| |
V1 | |
|
| A + Б | « | В | ; увеличение P приводит к V1 > V2 |
| |
V2 | |
|
| 2 | |
1 | |
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
| |
V1 | |
| A + Б | « | В + Q, то увеличение t°C приводит к V2 > V1 |
| |
V2 | |
| |
V1 | |
| A + Б | « | В — Q, то увеличение t°C приводит к V1 > V2 |
| |
V2 | |
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на положение равновесия.
www.examen.ru
Персональный сайт — Каталог статей
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
| Реагенты Продукты |
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ).
Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
| Fe + S FeS |
Пример. Реакция синтеза аммиака является обратимой:
| N2 + 3H2 2NH3 |
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание Nh4 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается.
Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
| Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия. |
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому.
| N2 + 3H2 2NH3 + Q |
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
| При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. |
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
| При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом |
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования Nh4, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:
| давление, МПа | 0,1 | 10 | 20 | 30 | 60 | 100 |
| объемная доля NH3, % | 0,4 | 26 | 36 | 46 | 66 | 80 |
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
| При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. |
himi4ok.ucoz.ru
Равновесие химическое и не только. Видеоурок. Химия 11 Класс
Данный урок посвящен изучению понятия «химическое равновесие» и способов его смещения. Из материалов урока вы узнаете, какие условия влияют на смещение химического равновесия и как действует «принцип Ле Шателье».
Большинство химических реакций обратимы, т. е. протекают одновременно в противоположных направлениях. В тех случаях, когда прямая и обратная реакция идут с одинаковой скоростью, наступает химическое равновесие.
При наступлении химического равновесия число молекул веществ, составляющих систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Например, равновесие реакции H2(г) + I2(г)⇆ 2HI (г) наступает тогда, когда в единицу времени образуется по прямой реакции ровно столько же молекул йодоводорода, сколько их распадается по обратной реакции на йод и водород.
Способность реакции протекать в противоположных направлениях называется кинетической обратимостью.
В уравнении реакции обратимость обозначается двумя противоположными стрелками (⇆) вместо знака равенства между левой и правой частями химического уравнения.
Химическое равновесие является динамическим (подвижным). При изменении внешних условий равновесие сдвигается и возвращается в исходное состояние, если внешние условия приобретают постоянные значения. Влияние на химическое равновесие внешних факторов вызывает его смещение.
Положение химического равновесия зависит от следующих параметров реакции:
— температуры;
— давления;
— концентрации.
Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье (Рис. 1).
Рис. 1. Анри Луи Ле Шателье
Современная формулировка принципа Ле-Шателье
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
1. Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое – эндотермическому.
Пример: промышленное производство аммиака. Рис. 2.
Рис. 2. Установка для производства аммиака
Реакция синтеза аммиака:
N2+ 3H2 ⇆ 2NH3+ Q
Прямая реакция – экзотермическая, а обратная реакция – эндотермическая.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам.
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры – в направлении экзотермической реакции.
Чтобы сместить равновесие в сторону получения аммиака, температуру нужно понизить.
2. Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам.
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом.
В реакции синтеза аммиака при повышении давления равновесие смещается в сторону образования аммиака, потому что реакция идет с уменьшением объёма.
3. Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам.
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
В реакции получения аммиака, чтобы сместить равновесие в сторону получения аммиака, необходимо повысить концентрацию водорода и азота.
Подведение итога урока
На уроке вы узнали о понятии «химическое равновесие» и способах его смещения, какие условия влияют на смещение химического равновесия и как действует «принцип Ле Шателье».
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§§ 24, 25)
- Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. Химия: 11 класс: Учебник для учащихся общеобраз. учрежд. (профильный уровень): в 2-х ч. Ч.2. М.: Вентана-Граф, 2008. (§ 24)
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобр. учрежд.: базовый уровень/ Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010. (§ 13)
- Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011. (с. 96–98)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 65–68)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Hemi.nsu.ru (Источник).
- Alhimikov.net (Источник).
- Prosto-o-slognom.ru (Источник).
Домашнее задание
- с. 65–66 №№ 12.10–12.17 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
- В каком случае изменение давления не будет вызывать смещение химического равновесия в реакциях с участием газообразных веществ?
- Почему катализатор не способствует смещению химического равновесия?
interneturok.ru
Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
Дополнительные сочиненияНа уроке будет рассмотрена тема «Обратимые и необратимые химические реакции. Химическое равновесие», будут рассматриваться факторы, влияющие на смещение химического равновесия. Вы познакомитесь с принципом Ле Шателье. Вводится понятие обратимых и необратимых реакций.
Тема: Классификация реакций, термохимия, скорость
Урок: Обратимые и необратимые химические реакции. Химическое равновесие и способы его смещения
1. Понятие прямой и обратной реакции
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, Прямая реакция. Но многие химические реакции могут идти в обратную сторону.
АВ А+В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+ВАВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2 (1)
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.
Рис. 1
Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
2. Константа равновесия
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
Рис. 2
Химическое равновесие (Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.
Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
Если , то в системе больше исходных веществ. Если , то в системе больше продуктов реакции.
3. Обратимые и необратимые химические реакции
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р+5О2 =2Р2О5 (2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
4. Факторы, влияющие на смещение равновесия
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
· Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
· Температура
· Давление
· Концентрации веществ
· Добавление катализатора
· Изменение площади реакционной поверхности гетерогенных реакций
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.
Остальные факторы рассматриваем более детально.
Температура
Реакция синтеза аммиака (Рис. 3)
относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается. Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие. В данном случае влево, так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
Изменение концентрации веществ
При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования. Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
Изменение давления
Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2 (3)
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Подведение итога урока
На уроке была изучена тема «Химическое равновесие», рассмотрены условия смещения равновесия в случае обратимых реакций.
Список литературы
1. Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Электроотрицательность. Различие между полярной ковалентной и ионной связями .
2. Таблица Менделеева .
3. Электроотрицательность атомов по полингу .
Домашнее задание
1. №№7-9 (с. 63) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Какие факторы не влияют на смещение химического равновесия?
3. Назовите условия наступления химического равновесия.
dp-adilet.kz
Химическое равновесие и способы его смещения. Контрольные задания:
Исходные концентрации азота и водорода составляют, соответственно, 1,5 и 2,5 моль/л. Рассчитайте их концентрации в момент, когда концентрация аммиака составила 0,5 моль/л.
Рассчитайте, как
изменится скорость прямой реакции
Na2S2O3
+ H2SO4
= Na2SO4
+ H2O
+ SO2 + S
+ S при разбавлении реагирующей смеси в 4
раза.
при разбавлении реагирующей смеси в 4
раза.
Рассчитайте, как
изменится скорость прямой реакции 2SO2
+ O2 2SO3
при увеличении давлении в 2 раза.
2SO3
при увеличении давлении в 2 раза.
Напишите уравнение
константы равновесия (Кр) гомогенной
реакции N2
+ 3H2 2NH3.
Рассчитайте,
как изменится скорость реакции при
увеличении концентрации в 3раза.
2NH3.
Рассчитайте,
как изменится скорость реакции при
увеличении концентрации в 3раза.
Рассчитайте, как изменится скорость гомогенной газовой реакции при повышении температуры на 600С, если температурный коэффициент реакции равен двум.
Укажите смещения
равновесия реакций:PCI5(г)
 PCI3(г)
+ CI2(г)
PCI3(г)
+ CI2(г) H0
=129,70 кДж, N2
+ 3H2
H0
=129,70 кДж, N2
+ 3H2 2NH3
2NH3
 H0
= — 17 кДж А) при повышении температуры,
Б) при повышении давления.
H0
= — 17 кДж А) при повышении температуры,
Б) при повышении давления.
В замкнутом сосуде
протекает обратимый процесс:PCI5(г)
 PCI3(г)
+ CI2(г).
Исходная
концентрация PCI5
равнялась
2,4 моль/л. Равновесие установилосьпосле
диссоциации 33,3% хлорида фосфора (V).
Вычислите константу равновесия.
PCI3(г)
+ CI2(г).
Исходная
концентрация PCI5
равнялась
2,4 моль/л. Равновесие установилосьпосле
диссоциации 33,3% хлорида фосфора (V).
Вычислите константу равновесия.
Рассчитайте, как изменится скорость реакции, протекающей в газовой фазе, если реагирующую смесь охладить с 700С до 200С. Температурный коэффициент реакции равен 2.
Определите как изменится скорость прямой реакции 2СО + О2= 2СО2, если общее давление в системе увеличить в 4 раза.
Укажите условия,
при которых равновесие реакции 4HCI
(г) + O2
 2CI2(г)
+2H2O(ж)
2CI2(г)
+2H2O(ж)
 H
H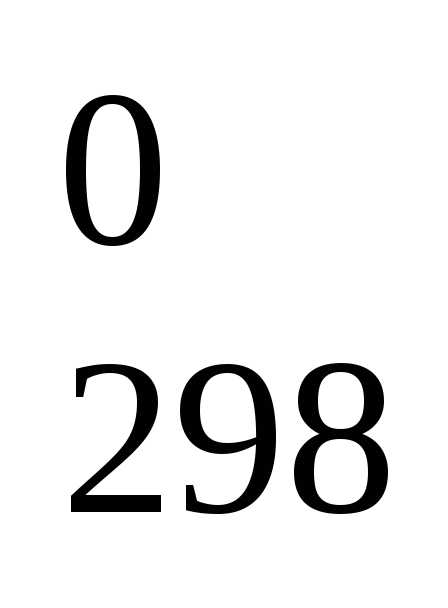 =
— 202,4 кДж.
=
— 202,4 кДж.
Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2(г) + В2(г) = 2А2В(г), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
Во сколько раз возрастет скорость химической реакции между газообразными веществами, реагирующими по уравнению А + В → С, если увеличить давление в 2 раза?
Во сколько раз возрастет скорость химической реакции между газообразными веществами 2А + 3В → С, если увеличить давление в 3 раза?
На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ = 2,5)?
На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 27 раз? Температурный коэффициент скорости реакции равен 3.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Во сколько раз изменится скорость реакции 2А + В А2B, если концентрацию вещества [А] увеличить в два раза, а концентрацию вещества [В] уменьшить в два раза?
Во сколько раз следует увеличить концентрацию водорода в системе N2 + 3Н2 2NН3, чтобы скорость реакции возросла в 125 раз?
Как изменится скорость реакции 3А + 2В А2В3, если концентрацию [А] увеличить в три раза, а концентрацию [В] уменьшить в два раза?
Чему равен температурный коэффициент скорости химической реакции, если при увеличении температуры со 100 до 150 °С скорость реакции возрастает в 243 раза?
Во сколько раз следует увеличить концентрацию йода в системе I2 + H2 = 2HI, чтобы скорость реакции возросла в 8 раз?
Как изменится скорость реакции 3А А+ 2В, если концентрацию [А] увеличить в три раза?
В системе СО + Cl2 = СОCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию Cl2 – от 0,02 до 0,06 моля/л. Во сколько раз возросла скорость реакции?
Во сколько раз следует увеличить концентрацию оксида углерода в системе 2СО = СO2 + С, чтобы скорость реакции возросла в 6 раз?
Во сколько раз следует увеличить концентрацию хлора в системе Cl2 + H2 = 2HCl, чтобы скорость реакции возросла в 4 раза?
При повышении температуры на 50° скорость реакции возросла в 1024 раза. Вычислите коэффициент .
Окисление серы и ее диоксида протекает по уравнениям: а) S(k) + O2 = SO2(k); 2SO2(г) + O2 = 2SO3(г). Как изменяется скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Рассчитайте, во сколько раз изменится скорость реакции: 2SO2(г) + O2 = 2SO3(г), если концентрации всех исходных веществ увеличить в 3 раза.
Как изменится скорость реакции: 2H2S(г) + O2(г) = 2H2O(г) + 2SO2(г)если: а) увеличить объем системы в 2 раза; б) повысить концентрацию H2S в 3 раза?
Как изменится скорость реакции: 4HCl(г) + О2(г) = 2Н2О(г) + 2 Cl2(г), если а) уменьшить давление в системе в 2 раза; б) повысить концентрацию О2 в 4 раза?
Как изменится скорость реакции: 2NO(г) + O2(г)→ 2NO2(г), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза?
Во сколько раз изменится скорость реакции: С(т) + О2(г) = СО2(г), если уменьшить давление в 4 раза?
studfiles.net
Химическое равновесие и условия его смещения — Статьи по химии — Статьи, выступления
Существуют обратимые и необратимые химические реакции. Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях с сопоставимыми скоростями, называют обратимыми, например:
В тот момент, когда скорости прямой и обратной реакции выравниваются, устанавливается химическое равновесие, то есть соотношение между продуктами реакций и исходными веществами остается постоянным. Состояние системы, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием. Такое состояние может сохраняться бесконечно долго, если не происходит изменения условий реакции (концентрации, температуры, давления). При изменении этих условий происходит смещение (или сдвиг) равновесия.
Смещение равновесия определяется принципом Ле-Шателье, который гласит: если на систему, находящуюся в равновесии, оказывается какое-либо внешнее воздействие, то система реагирует так, чтобы уменьшить это воздействие. Например:
Реакция протекает в газовой фазе, обратима, прямая реакция экзотермична. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми. При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассматриваемой выше реакции можно записать в виде:
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево – обратной (константа скорости обратной реакции k2). В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратимая реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной – увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Константа химического равновесия представляет собой отношение константы скорости прямой реакции к константе скорости обратной реакции, а также отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа химического равновесия зависит от температуры и природы реагирующих веществ, но не зависит от концентрации.
Константа химического равновесия является количественной характеристи-кой химического равновесия и характеризует выход продуктов реакции. Если К >1, то в равновесной системе больше продуктов реакции, т.е. в данном случае выход продуктов реакции больше, чем исходных веществ. Если К<1, химическое равновесие смещено в сторону образования исходных веществ, которых находится больше в равновесной системе.
Способы смещения химического равновесия:
1. Увеличение концентрации одного из реагирующих веществ вызовет смещение равновесия в сторону его потребления, так, добавление в систему азота или водорода вызовет сдвиг равновесия вправо, а аммиака — влево. Уменьшение концентрации какого-либо из участников равновесия вызовет его образование. Так, например, связывая аммиак в соль, можно равновесие полностью сместить вправо.
2. Изменение давления вызовет в равновесной системе смещения в сторону той реакции, которая может компенсировать это изменение. В данном случае увеличение давления ускорит реакцию, идущую с уменьшением общего количества газообразных веществ, то есть равновесие сместится вправо, а уменьшение давления — реакцию, идущую с увеличением общего количества газообразных веществ, то есть равновесие сместится влево.
3. Увеличение температуры, то есть подвод тепла, смещает равновесие в сторону реакции, идущей с поглощением тепла, то есть эндотермической, а уменьшение температуры, то есть отнятие тепла, — в сторону реакции, идущей с выделением тепла, то есть экзотермической. В данном примере повышение температуры смещает равновесие влево, а понижение — вправо (в сторону синтеза аммиака).
4. Катализатор не влияет на положение равновесия, поскольку он в равной степени изменяет скорости прямой и обратной реакций.
Информация с сайта http://netlik.hop.ru/ravnovesie.html
lotoskay.ucoz.ru
