10. Химический состав клетки (белки, их структура и функции).
Белки, или протеины, составляюи ри 50 до 85% органических соединений, входящих в состав живых организмов. Во всех тканях любых существ важнейшей частью являются белки. Они входят в состав всех клеток, клеточных органоидов и межклеточных жидкостей. Основными элементами белка являются: кислород, водород, азот и сера. Кроме того, в их состав могут входить фосфор, железо, магний и другие. Молекула белка — типичный полимер, она состоит из аминокислот. При соединении аминокислот в молекуле белка образуется химическая связь между карбоксильной группой аминокислоты и аминной группой другой. Связь которая образуется между молекулами аминокислота, называется пептидной. Белки имеют 4 структуры белка: Первичной структурой белковой молекулы является полипептидная цепь. Внутримолекулярные силы заставляют цепь изгибаться – возникает вторичная структура. Молекула белка бывает складчатой и спиральной. Складчатая структура при этом характерна для белков с низким метаболизмом. Большинству белковых молекул присуща третичная структура, получавшая название третичной. Полипептидные цепи скручиваются, образуя глобулу. Группы белковых молекул образуют устойчивые комплексы, которые называются четвертичными структурными. Функции белков. В клетке белки выполняют структурную, сократительную. Ферментативную функции. Структурная функция выражается в том, что белки – основной строительный материал цитоплазмы, наружной и внутренней мембран – входят в состав хромосом и других органоидов клетки. Сократительная функция обеспечивает одно из основных свойств жизни – явления раздражительности и движения. С ферментативной функцией белков связано то, что они катализируюи все реакции, протекающие в организме.
11. Нуклеиновые кислоты, их строение, локализация, значение
Простейшие нуклеиновые кислоты – мононуклеотиды. Более сложные нуклеиновые кислоты состоят из двух или более нуклеотидов – полинуклеотиды. В состав нуклеиновых кислот входят углерод, кислород, водород, азот и фосфор. Известны 2 типа нуклеиновых кислот: ДНК и РНК. Они отличаются и строением и биологическими свойствами. ДНК и РНК в клетке имеют различную локализацию. ДНК имеется в ядре, входит в состав хроматина, сосредоточена в хромосомах, имеется внутри митохондрий и пластид. В ядре ДНК вступает соединение с гистонами и протаминами, образуя нуклепротеиды. Основные хранители РНК – ядрышки, находящиеся в ядре, и рибосомы, расположенные в цитоплазме. Кроме того, РНК находится в гиалоплазме. В состав нуклеотида входит молекула фосфорной кислоты, моносахарида и 4 азотистых оснований: Аденин, Гуанин, Цитозин, Тимин или Урацил. РНК содержит моносахарид рибозу, в то время как в состав ДНК входит дезоксирибоза. Азотистые основания аденин, гуанин, цитозин есть в составе как ДНК, так и РНК, но тимин входит в состав ДНК, а урацил – в состав РНК. С нуклеиновыми кислотами связаны процессы синтеза белка, а этим в свою очередь определяется характер обмена веществ, закономерности роста и развития, явления наследственности и изменчивости.
12. Роль ДНК и РНК в передаче наследственной информации. Основные этапы: транскрипция, процессинг, трансляция. Главную роль в процессе передачи и реализации наследственной информации играют нуклеиновые кислоты. Основная биологическая функция ДНК заключается в хранении, постоянном самовозобновлении, самовоспроизведении и передаче генетической информации клетке. Информация хранится в последовательности нуклеотидов. Эта последовательность нуклеотидов, или генетический код, контролирует последовательность аминокислот в молекуле белка. ДНК является матрицей для построения иРНК. ДНК принимает участие только в одном этапе биосинтеза белка: транскрипции. Транскрипция – процесс переноса генетического кода, записанного на молекуле ДНК на молекулу иРНК. Транскрипция происходит при синтезе молекул иРНК, нуклеотиды которой присоединяются к нуклеотидам ДНК по принципу комплементарности. Молекула иРНК снимается с ДНК, как с матрицы, после чего она отделяется и перемещается в цитоплазму, где в специальных органоидах – рибосомах происходит процесс трансляции. Непосредственное участие в синтезе белка принимает иРНК. Биологическая роль иРНК связана преимущественно синтезом белка, т.е. реализацией наследственной информации. Именно РНК является посредником между ДНК и строящейся в клетке белковой молекулой. Выделяют иРНК, тРНК и рРНК. иРНК обеспечивает перенос информации о структуре белка от молекулы ДНК в рибосомы, где синтезируется белок. рРНК содержится в рибосомах и участвует в синтезе белка. тРНК доставляет аминокислоты к месту синтеза белка, т.е. к рибосомам. Трансляция – процесс перевода генетической информации, записанной на иРНК в структуру белковой молекулы, синтезируемой на рибосомах при участии тРНК. На иРНК генетический код записан «языком» триплетов нуклеотидов. Они передают информацию только тем тРНК, кодовый триплет которых комплементарен триплету иРНК. При образовании связи между кодовыми триплетами происходит передача информации и аминокислота присоединяется к цепочке белковой молекулы.
studfiles.net
Химический состав клетки
Молекулярный состав клетки сложен и разнороден. Отдельные соединения — вода и минеральные вещества — встречаются также и в неживой природе; другие — органические соединения (углеводы, жиры, белки, нуклеиновые кислоты и др.) — характерны для живых организмов. Таким образом, отличие живого или неживого в химическом отношении проявляется уже на молекулярном уровне.
Белки
Из всех органических веществ в клетке ведущая роль принадлежит белкам. На долю белков приходится 50-80% сухой массы. Молекулярная масса белков огромна (от десятков тысяч до многих сотен тысяч условных единиц): у белка яйца — альбумина — она составляет 36 000, у гемоглобина — 65 000, а у сократительного белка мышц (актомиозина) — 1 500 000, в то время как у молекулы глюкозы она равна 180.
Молекула белка представляет собой цепь из нескольких десятков или сотен аминокислот, поэтому она имеет огромные размеры и называется макромолекулой (гетерополимером).
Белки наиболее специфичны и важны для организма. Они относятся к непериодическим полимерам. В отличие от других полимеров, их молекулы состоят из сходных, но нетождественных мономеров — 20 аминокислот.
Каждая аминокислота имеет свое название, особое строение и свойство. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из специфической части — радикала R и части, одинаковой для всех аминокислот, включающей аминогруппу — NH2 с основными свойствами и карбоксильную группу — COOH с кислотными свойствами.
Наличие в одной молекуле кислотной и основной групп обусловливает их высокую реактивность. Через эти группы происходят соединения аминокислот при образовании полимера — белка.
В строении молекул белков различают четыре уровня организации.
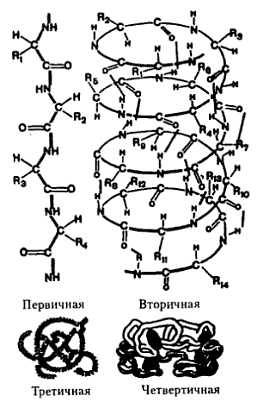
Структура белковой молекулы
- Первичная структура — полипептидная цепь из аминокислот, связанных в определенной последовательности прочными пептидными связями (возникающими между аминогруппой одной аминокислоты и карбоксильной группой другой). В результате образуется длинная полипептидная цепь.
- Вторичная структура — полипептидная цепь, закрученная в виде спирали. В ней между пептидными связями соседних витков возникают малопрочные водородные связи.
- Третичная структура — представляет собой причудливую, но для каждого белка специфическую конфигурацию — глобулу (клубок), в которой переплетаются участки белковой цепи.
- Четвертичная структура — типична не для всех белков. Она возникает при соединении нескольких макромолекул, образующих агрегаты. Например, гемоглобин крови представляет агрегат из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение структуры белка называется денатурацией. Она возникает под воздействием высокой температуры, лучистой энергии, химических веществ и других факторов и может быть частично обратимой.
Биологическая роль белков в клетке и во всех жизненных процессах очень велика. Прежде всего, белки — это катализаторы, ускоряющие клеточные реакции в десятки, сотни миллионов раз. Все биокатализаторы (они называются ферментами, или энзимами) — вещества белковой природы.
Строительная функция белков сводится к их участию в формировании всех клеточных органоидов и мембраны.
Следующая функция белка — сигнальная, обусловленная способностью к обратимым изменениям структуры под влиянием раздражителей, которая лежит в основе важного свойства живого — раздражимости.
Сократительная функция белка состоит в том, что все виды двигательных реакций клетки выполняются особыми сократительными белками мышц.
Транспортная функция белков выражается в способности специфических белков (гемоглобин, альбумин и др.) крови обратимо соединяться с органическими и неорганическими веществами и доставлять их в разные органы и ткани.
Белки выполняют и защитную функцию. В организме в ответ на проникновение в него чужеродных веществ вырабатываются антитела — особые белки, которые нейтрализуют, обезвреживают чужеродные белки. Белки при расщеплении в клетке до аминокислот выделяют энергию, необходимую для жизненных процессов в клетке.
Нуклеиновые кислоты — это высокомолекулярные органические соединения, имеющие первостепенное биологическое значение. Впервые они были обнаружены в ядре (в конце XIX в.), отсюда и получили название («нуклеус» — ядро). Нуклеиновые кислоты хранят и передают наследственную информацию и определяют синтез белка
.Существует два вида нуклеиновых кислот: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Основное место нахождения ДНК — ядро клетки. ДНК обнаружена также в некоторых органоидах (пластиды, митохондрии, центриоли). РНК встречается в ядрышках, в рибосомах и цитоплазме клеток.
Дезоксирибонуклеиновая кислота
Молекула ДНК имеет сложное строение. Она состоит из двух спирально закрученных нитей. Ее мономерами служат нуклеотиды. Каждый нуклеотид — химическое соединение, состоящее их трех веществ: азотистого основания, пятиатомного сахара дезоксирибозы и остатка фосфорной кислоты.
Фосфорная кислота и углевод (дезоксирибоза) у всех нуклеотидов одинаковы, а азотистые основания бывают четырех типов: аденин, гуанин, цитозин и тимин. Они и определяют название соответствующих нуклеотидов: адениловый (А), гуаниловый (Г), тимидиловый (Т) и цитидиловый (Ц).
Каждая цепь ДНК представляет полинуклеотид, состоящий из нескольких десятков тысяч нуклеотидов.
Азотистые основания в молекуле ДНК соединены между собой неодинаковым количеством водородных связей. Аденин-тимин образуют две водородные связи, гуанин-цитозин соединяются тремя водородными связями.
Способность к избирательному взаимодействию аденина с тимином, а гуанина с цитозином, основанная на особенностях расположения в пространстве атомов этих молекул, называется комплементарностъю (дополнительностью). Это объясняется тем, что А и Т и Г и Ц строго соответствуют друг другу, как две половинки разбитого стекла, дополняют друг друга, отсюда и название комплементарность (от греч. «комплемент» — дополнение).
Если известно расположение нуклеотидов в одной цепи, то по принципу комплементарности можно определить порядок нуклеотидов во второй цепи. Например, если последовательность нуклеотидов в одной цепи будет А—А—А—Ц—Т—Т—Г—Г—Г, то на соответствующем участке второй цепи последовательность нуклеотидов обязательно будет следующей: Т-Т-Т—Г-А—А-Ц-Ц-Ц.
Соединяются комплементарные нуклеотиды водородными связями. Удвоение молекулы ДНК — ее уникальная способность, обеспечивающая передачу наследственной информации от материнской клетки дочерним.
Этот процесс получил название редупликации ДНК. Он осуществляется следующим образом. Незадолго перед делением клетки молекула ДНК раскручивается, и ее двойная цепочка под действием фермента с одного конца расщепляется на две самостоятельные цепи. На каждой половине из свободных нуклеотидов клетки, по принципу комплементарности, выстраивается вторая цепь. В результате вместо одной молекулы ДНК возникают две совершенно одинаковые молекулы. Таким образом, процесс редупликации обеспечивает точное копирование информации и передачу ее из поколения в поколение.
ДНК называют веществом наследственности, так как биологическая наследственная информация закодирована в ее молекулах с помощью химического кода. В клетках всех живых существ один и тот же код. В его основе лежит последовательность соединений в нитях ДНК четырех азотистых оснований: А, Т, Г, Ц.
Различные комбинации трех смежных нуклеотидов образуют триплеты, называемые кодонами.
Рибонуклеиновая кислота
Рибонуклеиновая кислота — РНК — полимер, по структуре сходный с одной цепочкой ДНК, но значительно меньших размеров. Мономерами РНК являются нуклеотиды» состоящие из фосфорной кислоты углевода (рибозы) и азотистого основания. Три азотистых основания РНК — аденин, гуанин и цитозин — соответствуют таковым ДНК, а вместо тимина в РНК присутствует урацил. Образование биополимера РНК происходит через ковалентные связи между рибозой и фосфорной кислотой соседних нуклеотидов.
Известны три вида РНК: информационная РНК (и-РНК) передает информацию о структуре белка с молекулы ДНК, транспортная РНК (т-РНК) транспортирует аминокислоты к месту синтеза белка и рибосомная РНК (р-РНК) — содержится в рибосомах, участвует в поддержании структуры рибосомы.
shkolo.ru
2.3.3. Органические вещества клетки. Белки.
2.3.3. Органические вещества клетки. Белки.
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу Nh3 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
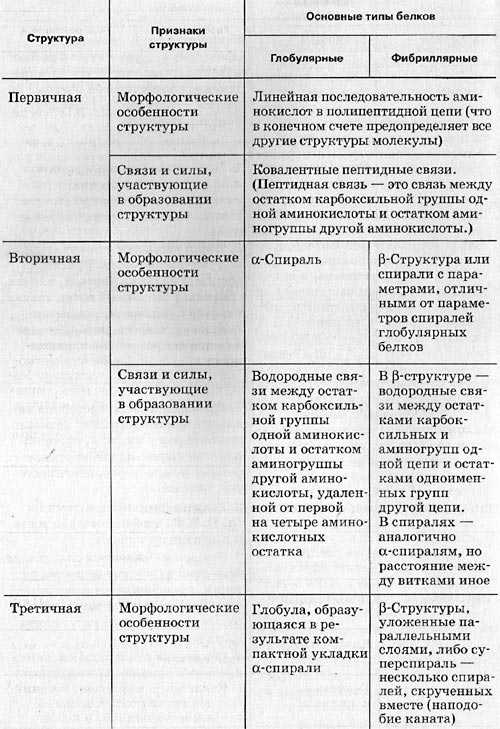
Структура белковой молекулы – ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
1.Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
2.Длинная молекула белка сворачивается и приобретает сначала вид спирали – вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие цепь.
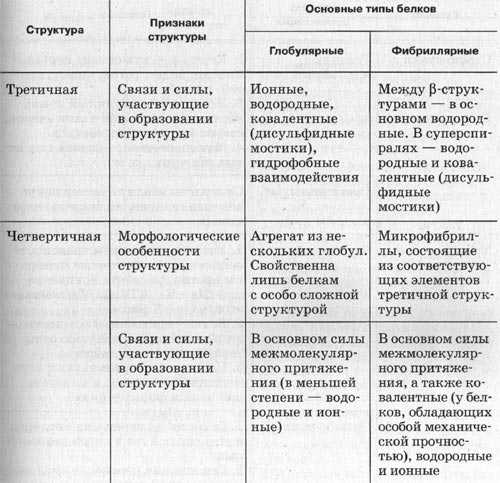
3.Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями.
4.Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными.
Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Таблица. Образование структур (уровня пространственной организации) белков.
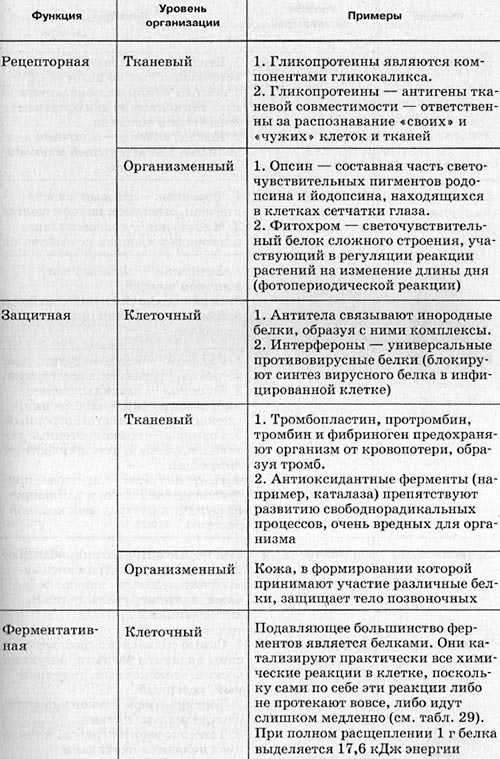
Функции белков.
Каталитическая (ферментативная) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
Таблица. Основные функции белков и пептидов.

Тематические задания.
Часть А
А1. Последовательность аминокислот в молекуле белка зависит от:
1) структуры гена
2) внешней среды
3) их случайного сочетания
4) их строения
А2. Человек получает незаменимые аминокислоты путем
1) их синтеза в клетках
3) приема лекарств
2) поступления с пищей
4) приема витаминов
А3. При понижении температуры активность ферментов
1) заметно повышается
2) заметно понижается
3) остается стабильной
4) периодически изменяется
А4. В защите организма от кровопотерь участвует
1) гемоглобин
2) коллаген
3) фибрин
4) миозин
А5. В каком из указанных процессов белки не участвуют?
1) обмен веществ
2) кодирование наследственной информации
3) ферментативный катализ
4) транспорт веществ
А6. Укажите пример пептидной связи:
Часть В
В1. Выберите функции, характерные для белков
1) каталитическая
2) кроветворная
3) защитная
4) транспортная
5) рефлекторная
6) фотосинтетическая
В2.
Установите соответствие между структурой белковой молекулы и ее особенностями
|
ОСОБЕННОСТИ СТРУКТУРЫ |
СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ |
|
|
|
Часть С
С1. Почему продукты хранят в холодильнике?
С2. Почему продукты, подвергшиеся тепловой обработке, хранятся дольше?
СЗ. Объясните понятие «специфичность» белка, и какое биологическое значение имеет специфичность?
С4. Прочитайте текст, укажите номера предложений, в которых допущены ошибки и объясните их.
1) Большая часть химических реакций в организме катализируется ферментами.
2) Каждый фермент может катализировать множество типов реакций.
3) У фермента есть активный центр, геометрическая форма которого изменяется в зависимости от вещества, с которым фермент взаимодействует.
4) Примером действия фермента может быть разложение мочевины уреазой.
5) Мочевина разлагается на двуокись углерода и аммиак, которым пахнет кошачий лоток с песком.
6) За одну секунду уреаза расщепляет до 30000 молекул мочевины, в обычных условиях на это потребовалось бы около 3 млн. лет.
biology100.ru
Химический состав клеток.
Клетка
С точки зрения концепции живых систем по А. Ленинджеру.
Живая клетка – это способная к саморегуляции и самовоспроизведению изотермическая система органических молекул, извлекающая энергию и ресурсы из окружающей среды.
В клетке протекает большое количество последовательных реакций, скорость которых регулируется самой клеткой.
Клетка поддерживает себя в стационарном динамическом состоянии, далеком от равновесия с окружающей средой.
Клетки функционируют по принципу минимального расхода компонентов и процессов.
Т.о. клетка – элементарная живая открытая система, способная к самостоятельному существованию, воспроизведению и развитию. Она является элементарной структурно-функциональной единицей всех живых организмов.
Из 110 элементов периодической системы Менделеева в организме человека обнаружено 86 постоянно присутствующих. 25 из них необходимы для нормальной жизнедеятельности, причем 18 из них необходимы абсолютно, а 7 — полезны. В соответствии с процентным содержанием в клетке химические элементы делят на три группы:
Макроэлементы Основные элементы (органогены) – водород, углерод, кислород, азот. Их концентрация: 98 – 99,9 %. Они являются универсальными компонентами органических соединений клетки.
Микроэлементы – натрий, магний, фосфор, сера, хлор, калий, кальций, железо. Их концентрация 0,1%.
Ультрамикроэлементы – бор, кремний, ванадий, марганец, кобальт, медь, цинк, молибден, селен, йод, бром, фтор. Они влияют на обмен веществ. Их отсутствие является причиной заболеваний (цинк — сахарный диабет, иод — эндемический зоб, железо — злокачественная анемия и т.д.).
Современной медицине известны факты отрицательного взаимодействия витаминов и минералов:
Цинк снижает усвоение меди и конкурирует за усвоение с железом и кальцием; (а дефицит цинка вызывает ослабление иммунной системы, ряд патологических состояний со стороны желез внутренней секреции).
Кальций и железо снижают усвоение марганца;
Витамин Е плохо совмещается с железом, а витамин С – с витаминами группы В.
Положительное взаимовлияние:
Витамин Е и селен, а также кальций и витамин К действуют синергично;
Для усвоения кальция необходим витамин Д;
Медь способствует усвоению и повышает эффективность использования железа в организме.
Неорганические компоненты клетки.
Вода – важнейшая составная часть клетки, универсальная дисперсионная среда живой материи. Активные клетки наземных организмов состоят на 60 – 95% из воды. В покоящихся клетках и тканях (семена, споры) воды 10 — 20%. Вода в клетке находится в двух формах – свободной и связанной с клеточными коллоидами. Свободная вода является растворителем и дисперсионной средой коллоидной системы протоплазмы. Ее 95%. Связанная вода (4 – 5 %) всей воды клетки образует непрочные водородные и гидроксильные связи с белками.
Свойства воды:
Вода – естественный растворитель для минеральных ионов и других веществ.
Вода – дисперсионная фаза коллоидной системы протоплазмы.
Вода является средой для реакций метаболизма клетки, т.к. физиологические процессы происходят в исключительно водной среде. Обеспечивает реакции гидролиза, гидратации, набухания.
Участвует во многих ферментативных реакциях клетки и образуется в процессе обмена веществ.
Вода – источник ионов водорода при фотосинтезе у растений.
Биологическое значение воды:
Большинство биохимических реакций идет только в водном растворе, многие вещества поступают и выводятся из клеток в растворенном виде. Это характеризует транспортную функцию воды.
Вода обеспечивает реакции гидролиза – расщепление белков, жиров, углеводов под действием воды.
Благодаря большой теплоте испарения происходит охлаждение организма. Например, потоотделение у человека или транспирация у растений.
Большая теплоемкость и теплопроводность воды способствует равномерному распределению тепла в клетке.
Благодаря силам адгезии (вода – почва) и когезии (вода – вода) вода обладает свойством капиллярности.
Несжимаемость воды определяет напряженное состояние клеточных стенок (тургор), гидростатический скелет у круглых червей.
studfiles.net
Химический состав клетки — Энциклопедия по биологии
Сходство элементарного химического состава клеток всех организмов доказывает единство живой природы. Вместе с тем нет ни одного химического элемента, содержащегося в живых организмах, который не был бы найден в телах неживой природы. В этом находит свое выражение общность живой и неживой природы. Ниже дан перечень основных химических элементов, входящих в состав клетки (в % на сырую массу):
| Кислород — 65 — 75 Углерод — 15 — 28 Водород — 8 — 10 Азот — 1,5 — 3,0 |
Магний — 0,02 — 0,03 Натрий — 0,02 — 0,03 Кальций — 0,04 — 2,00 Железо — 0,01 — 0,015 Калий — 0,15 — 0,40 Сера — 0,15 — 0,20 Фосфор — 0,20 — 1,00 Хлор — 0,05 — 0,10 |
Цинк — 0,0003 Медь — 0,0002 Йод — 0,0001 Фтор — 0,0001 |
Этот перечень, естественно, распадается на 3 группы. Кислород, углерод, водород и азот — группа элементов, которыми живые существа богаче всего. В клетке они составляют до 98% ее сырой массы. Вторая группа объединяет следующие 8 элементов, которые представлены десятыми и сотыми долями процента в веществе живой клетки; их общая сумма — около 1,9% общей массы клетки. В третью группу входят такие микроэлементы, которых в живой клетке очень мало, но они совершенно необходимы для ее нормального функционирования.
Несмотря на единство элементарного состава живой и неживой природы, клетки живых существ построены из таких специфических химических соединений этих элементов, которые получили специальное название — органические вещества. В настоящее время органические вещества в природе могут образовываться на нашей планете только в теле живых организмов. Это, конечно, не исключает возможности их искусственного синтеза, осуществляемого в лабораториях.
В состав клеток входят и неорганические соединения. Но за исключением воды они составляют незначительную долю по сравнению с содержанием органических веществ.
Процентное соотношение в клетке воды, различных органических и неорганических веществ следующее (в расчете на сырую массу):
Вода — 70—85
Белки — 10—20
Жиры — 1—5
АТФ и другие низкомолекулярные органические вещества — 0,1—0,5
Углеводы — 0,2—2,0
Неорганические вещества (кроме воды) — 1—1,5
Значение воды в теле живой клетки огромно. Вода составляет основу тех коллоидных систем, из которых состоит клетка. Она является растворителем, а все обменные процессы в клетке могут протекать лишь в растворах. Вода играет важную роль во многих реакциях, происходящих в организме. К их числу относятся, например, реакции гидролиза, при которых высокомолекулярные органические вещества (белки, жиры, углеводы) расщепляются за счет присоединения к ним воды. Наконец, вода служит основой для жидкостей, передвижение которых в теле многоклеточных организмов обеспечивает перенос необходимых веществ от одной части организма к другой. Поэтому чем выше биохимическая активность той или иной клетки или ткани, тем выше содержание в ней воды. Велика роль воды и в теплорегуляции клетки и организма в целом.
Неорганические вещества (кроме воды) находятся в организмах в виде анионов и катионов в растворах и в виде соединений с органическими веществами. Важное функциональное значение для нормальной жизнедеятельности клетки имеют катионы К+, Nа+, Са2+ и Mg2+ и анионы НРО24, Н2РО4— ,НСО3-, Сl-В соединении с органическими веществами особое значение имеют сера, входящая в состав многих белков; фосфор как обязательный компонент веществ хромосом; железо, входящее в состав белка крови гемоглобина, и магний, находящийся в молекуле хлорофилла. Кроме того, фосфор в форме нерастворимого фосфорнокислого кальция составляет твердую основу костного скелета позвоночных и раковин моллюсков.
Ведущими органическими веществами, входящими в состав клетки, являются белки, углеводы, жиры, нуклеиновые кислоты (ДНК и РНК) и аденозинтрифосфорная кислота (АТФ).
Белки — основная составная часть любой живой клетки. На их долю приходится половина сухого вещества клетки (после удаления из нее волы). Белки выполняют в ней чрезвычайно разнообразные функции, из которых самая важная — каталитическая функция. Любая химическая реакция в клетке протекает при участии особых биологических катализаторов — ферментов. А любой фермент — белок. Следовательно, без белков-ферментов клетка не смогла бы осуществить ни одной химической реакции, а значит не смогла бы ни расти, ни размножаться, ни функционировать. Где нет белка, там нет жизни. Именно это и заставило Ф. Энгельса определить жизнь как форму cуществования белковых тел — такую форму, которая реализуется через постоянный обмен веществ.
Помимо каталитической, очень важна структурная функции белков. Белки входят в состав всех мембран, окружающих и пронизывающих клетку. В соединении с ДНК белок составляет тело хромосом, а в соединении с РНК — тело рибосом. Растворы низкомолекулярных белков входят в состав жидких фракций клетки. Наконец, именно с белками связано осуществление таких функций, как перенос кислорода в теле организма (его осуществляет белок крови — гемоглобин), сокращение мускулатуры, передача раздражения по нервам и целый ряд других.
Химический состав белков чрезвычайно разнообразен, и в то же время все они построены по одному принципу — по принципу полимера: молекула одного белка состоит из многих не вполне одинаковых мономеров — молекул аминокислот. Всего известно 20 различных аминокислот, входящих в состав белков. Каждая из них имеет карбоксильную группу (СООН), аминную группу (NH2) и третью химическую составную часть (радикал — R), которой одна аминокислота отличается от другой. В молекуле, белка аминокислоты химически соединены пептидной связью: карбоксильная группа одной кислоты соединяется с аминной группой другой; при каждом таком соединении выделяется молекула воды:
В молекуле того или иного белка одни аминокислоты могут многократно повторяться, а другие совсем отсутствуют. Общее число аминокислот, составляющих одну молекулу белка, иногда достигает нескольких сот тысяч. В результате молекула белка представляет собой макромолекулу, т. е. молекулу с очень большой молекулярной массой: от нескольких десятков тысяч до многих сотен тысяч.
Химические и физиологические свойства белков определяются не только тем, какие аминокислоты входят в их состав, но и тем, какое место в длинной цепочке белковой молекулы занимает каждая из аминокислот. Так достигается огромное разнообразие первичной структуры белковой молекулы. В живой клетке белки имеют еще и вторичную и третичную структуру, с чем также связаны их специфические функциональные свойства. Вторичная структура белковой молекулы достигается ее спирализацией: длинная цепочка соединенных между собой аминокислот закручивается, а витки спирали плотно прилегают друг к другу. Третичная структура определяется тем, что слирализованная молекула белка еще многократно и закономерно сворачивается, образуя компактную глобулу (шарик). Именно такое состояние белковой молекулы соответствует активному состоянию белка-фермента. Если же под действием различных факторов (нагревание, обработка химическими веществами) происходит разворачивание белковой молекулы и потеря вторичной и третичной структуры белка, то он при этом теряет и свои ферментативные свойства.. Такое изменение может оказаться обратимым (белок восстановит свою вторичную и третичную структуру), если воздействие не было слишком сильным. Необратимые изменения структуры белков в клетке ведут к ее гибели.
Углеводы — столь же необходимая составная часть любой клетки, как и белок. В растительных клетках их значительно больше, чем в животных. Углеводы — своеобразное «топливо» для живой клетки: окисляясь, они высвобождают химическую энергию, которая расходуется клеткой на все процессы жизнедеятельности. У растений углеводы выполняют и важные строительные функции: из них образуются оболочки как живых клеток, так и мертвых (древесина).
По химическому составу углеводы делятся на две большие группы: простые и сложные углеводы. В наиболее широкоизвестных простых углеводах содержится 5 (пентозы) или 6 (гексозы) атомов углерода и столько же молекул воды. Примерами простых углеводов могут служить глюкоза и фруктоза, находящиеся во многих плодах растений.
Сложные углеводы — это соединение нескольких молекул простых углеводов в одну. Пищевой сахар (сахароза), например, состоит из одной молекулы глюкозы и одной молекулы фруктозы. Значительно большее количество молекул простых углеводов входит в такие сложные углеводы, как крахмал, клетчатка (целлюлоза), гликоген. В молекуле клетчатки, например, до 100—150 молекул глюкозы.
Жиры и липоиды — также обязательная составная часть любой клетки. Как и углеводы, жиры используются клеткой как источник энергии: при расщеплении жиров освобождается энергия. Подкожный жир играет важную теплоизоляционную роль у многих животных (водные млекопитающие). У животных, впадающих зимой в спячку, жиры обеспечивают организм необходимой энергией, так как питательные вещества извне в это время не поступают. Жиры составляют запас питательных веществ и в семенах многих растений.
По химическому составу жиры представляют собой соединение глицерина с различными жирными кислотами. Именно этим высокомолекулярным кислотам жиры и липоиды обязаны своим важным биологическим свойством: они не растворяются в воде. Поэтому жироподобные вещества — липоиды входят в состав всех мембран клетки и ее структурных элементов. Средний, липондный, слой таких мембран препятствует свободному перемещению воды из клетки в клетку.
Нуклеиновые кислоты впервые были обнаружены в ядрах клеток. Существует два типа нуклеиновых кислот: дезоксирибонуклеиновые (сокращенно ДНК) и рибонуклеиновые (сокращенно РНК). ДНК содержится преимущественно в ядре клетки, РНК — в цитоплазме и в ядре. Значение нуклеиновых кислот состоит в том, что они обеспечивают синтез в клетке специфических для нее белков. Благодаря функции ДНК, связанной с синтезом белков-ферментов, осуществляется и ее генетическая роль: ДНК является носителем наследственной информации.
Рис. 5. Схема строения нуклеотида
Молекулярная структура ДНК отражает ее особое химическое свойство — способность к саморепродукции (репликации) и ее основную функцию — обеспечение синтеза специфических белков. Это очень длинная двойная цепочка. Длина ее во многие сотни раз превышает длину цепочки белковой молекулы. Как и молекуле белка, молекуле ДНК присуща спиральная структура: двойная цепочка спирально закручена вокруг своей продольной оси. Каждая одинарная цепочка представляет собой полимер и состоит из отдельных, соединенных между собой мономеров — нуклеотидов. В состав любого нуклеотида входят два постоянных химических компонента (фосфорная кислота и углевод дезоксирибоза) и один переменный, который может быть представлен одним из четырех азотистых оснований: аденином, гуанином, тимином или цитозином (рис. 5). Поэтому в молекулах ДНК всего 4 разных нуклеотида. Разнообразие же молекул ДИК огромно и достигается благодаря различной последовательности нуклеотидов в цепочке ДНК. Таким образом, и ДНК и белки построены по одному и тому же химическому принципу: специфичность ДНК обусловливается порядком нуклеотидов в ее молекуле, специфичность белка — порядком аминокислот в его молекуле. Как будет видно из дальнейшего, это совпадение имеет первостепенное значение при синтезе белков.
Рис. 6. Схема строения молекулы дезоксирибонуклеиновой кислоты (ДНК): две цепочки нуклеотидов, закрученные спирально, соединены азотистыми основаниями: а — аденин, Т— тимин, Г — гуанин, Ц — цитозин
Две одинарные цепи ДНК соединены в одну двойную через нуклеотиды. При этом возможны лишь такие химические соединения: аденина с тимином и гуанина с цитозином. Поэтому последовательность нуклеотидов в одной цепочке жестко определяет и последовательность их в другой цепочке. Строгое соответствие нуклеотидов друг другу в парных цепочках молекулы ДНК получило название комплементарности (рис. 6). Эта особенность химического строения молекулы ДНК создается в процессе синтеза ДНК в живой клетке, который называется репликацией. Схематически этот процесс изображен на рис. 7. Сводится он к тому, что исходная двойная цепочка молекулы ДНК под действием специального фермента постепенно распадается на две одинарные — и тут же к каждой из них по принципу химического сродства (аденин к тимину, гуанин к цитозину) присоединяются свободные нуклеотиды. Тем самым вновь восстанавливается двойная структура ДНК. Но теперь уже таких двойных молекул получается две вместо одной. Поэтому синтез ДНК и получил название саморепродукции, или репликации: каждая молекула ДНК как бы сама себя удваивает.
Молекулярная структура РНК близка к таковой ДНК. Но есть и существенные различия. Молекула РНК представляет собой не двойную, а одинарную цепочку из нуклеотидов. Поэтому РНК не способна к саморепродукции. В состав молекул РНК также входят 4 нуклеотида, но один из них иной, чем в ДНК: вместо тимина в РНК содержится другое азотистое соединение — урацил. Кроме того, в состав всех нуклеотидов молекулы РНК входит не дезоксирибоза, а рибоза. Молекулы РНК не столь велики, как молекулы ДНК. О двух формах РНК будет сказано дальше.
Аденозинтрифосфорная кислота (АТФ). Это органическое вещество входит в состав любой клетки, где выполняет одну из важнейших функций. Химически АТФ представляет собой нуклеотид, в состав которого входят азотистое основание аденин, углевод рибоза и фосфорная кислота. Но в отличие от нуклеотида, входящего в состав РНК, в молекуле АТФ содержатся три молекулы фосфорной кислоты. Это обстоятельство и определяет биохимические особенности и функцию АТФ. Неустойчивые химические связи, которыми соединены молекулы фосфорной кислоты в АТФ, очень богаты энергией: при разрыве этих связей энергия высвобождается и используется в живой клетке на процессы жизнедеятельности и синтез. Такой разрыв осуществляется через реакцию присоединения воды молекулой АТФ и отщеплением от нее одной молекулы фосфорной кислоты.
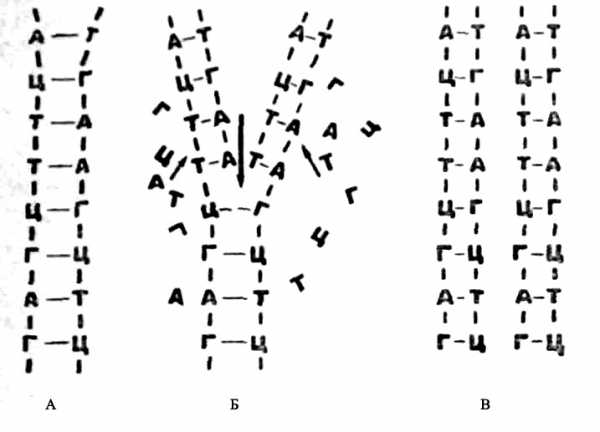 Рис. 7. Схема репликация (самоудвоения) молекулы ДНК. А — исходная молекула ДНК перед репликацией; Б — репликация молекулы ДНК: цепи расходятся и к каждой из них подстраивается новая цепь из свободных нуклеотидов по принципу комплементарпости; В — две молекулы ДНК. образовавшиеся в результате репликации
Рис. 7. Схема репликация (самоудвоения) молекулы ДНК. А — исходная молекула ДНК перед репликацией; Б — репликация молекулы ДНК: цепи расходятся и к каждой из них подстраивается новая цепь из свободных нуклеотидов по принципу комплементарпости; В — две молекулы ДНК. образовавшиеся в результате репликации
В результате молекула АТФ превращается в АДФ (аденозин-дифосфорная кислота):
АТФ + Н2О → АДФ + Н3РO4 + свободная энергия.
Обратный процесс превращения АДФ в АТФ происходит путем присоединения молекулы фосфорной кислоты к АДФ с выделением воды и поглощением большого количества энергии. Таким образом, система обеспечивает в живой клетке постоянный обмен энергии.
biologiya.net
Химический состав клетки | Учеба-Легко.РФ
Химический состав клетки включает как неорганические, так и органические вещества
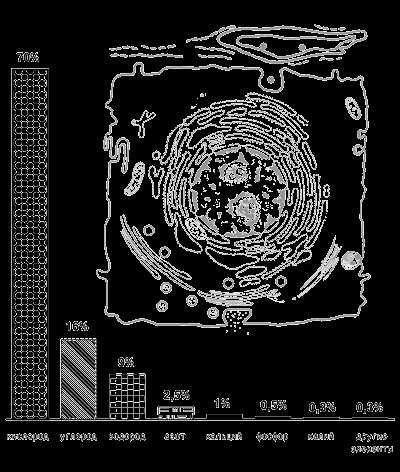
Рисунок 1 .Содержание химических веществ в клетке
Основные вещества клетки включают молекулы нуклеиновых кислот, белков, жиров, углеводов, воды, кислорода и углекислого газа.
В неживой природе эти вещества нигде не встречаются вместе.В организме человека обнаружено 86 постоянно присутствующих элементов периодической системы Д.И. Менделеева.
Из них 25 необходимы для поддержания жизнедеятельности, 18 из которых абсолютно необходимы, а 7 – полезны.
На долю четырех химических элементов – кислорода, водорода, углерода и азота – приходится около 98% массы клетки. Другие элементы присутствуют в ней в незначительных количествах: серы 0,15-0,2%, цинка 0,003%, а йода – всего 0,000001%.
Основные вещества клетки =
Нуклеиновые кислоты + Белки + Жиры (липиды) +
Углеводы + Вода + Кислород + Углекислый газ
Нуклеиновые кислоты являются основой молекул дезоксирибонуклеиновой и рибонуклеиновой кислот – хранителей наследственной (генетической) информации, о которых мы скажем чуть позже.
Белки – основные вещества, необходимые клетке для существования и выполнения своих функций. Они составляют 50% сухой массы клетки. Само понятие “жизнь” в биологическом смысле неразрывно связано с понятием белка – будь то клетка или организм в целом. Белки – сложные высокомолекулярные вещества, состоящие из аминокислот.
Трудно сказать почему, но из всего многообразия аминокислот для построения белковых молекул природа выбрала лишь двадцать (представим их в виде бусин разных цветов), а белки представляют собой бусы, собранные в нужном порядке. При условии, что число аминокислот (бусин) в одной белковой цепи достигает нескольких сотен, число возможных комбинаций белковых молекул (бус) практически неограниченно!
Белковая молекула не остается в клетке в форме нити бус (это всего лишь первичная структура), она компактно “упаковывается” благодаря химическим и физическим связям, возникающим между атомами аминокислот, по мере синтезирования белковой цепи.
Вторичная структура белка похожа на спираль, а третичная – на плотный шарик (глобулу) или шнур (фибриллу).
Так называемая четвертичная структура образуется при объединении нескольких белковых молекул между собой и/или с небелковыми молекулами. Например, молекула гемоглобина состоит из гема – частицы небелковой природы, содержащей железо, и глобина – белка.
С учетом биологического назначения, белки можно разделить на три группы:
1) ферменты – биологические катализаторы химических реакций в клетке;
2) специфические белки, производимые “на экспорт” (гормоны, медиаторы и другие);
3) структурные белки, необходимые для восстановления и обновления клеточных элементов.
Из молекул жиров (точнее, из фосфолипидов ) состоят все мембраны клетки. Жиры используются организмом как теплоизолятор, предохраняя его от потери тепла. Большое значение имеют жиры и как внутренний резерв для извлечения воды: при “сжигании” 1 кг жира образуется 1,1 кг воды.
Кроме того, жиры являются богатейшим источником энергии.
Углеводы, в первую очередь глюкоза и гликоген (полимер глюкозы), являются основным и легко доступным источником энергии. Однако энергетическая ценность жиров в 6 раз выше энергетической ценности гликогена, а запасы жиров в здоровом организме превышают запасы гликогена в печени и мышцах в 30 раз.
Большинство клеток на 70-80% состоят из воды, костные клетки – на 20%. Даже в эмали зубов – самой твердой ткани организма – содержится 10% воды.
Вода является универсальным растворителем, в ней происходят все биохимические реакции клетки, при участии воды осуществляется теплорегуляция. Вода во многом определяет физические свойства клетки – ее объем, упругость, участвует в метаболизме, транспорте питательных веществ, кислорода, углекислого газа, а также в выведении токсичных веществ из организма.
Кислород – мощный природный окислитель – поступает в клетку в процессе преобразования энергии, а углекислый газ является одним из конечных продуктов процесса клеточного дыхания.
uclg.ru
Химический состав клетки
Неорганические вещества
Содержание химических элементов клетки. Клетки живых существ существенно отличаются от окружающей их среды не только по структуре химических соединений, входящих в их состав, но также по набору и содержанию химических элементов. Из известных в настоящее время химических элементов в живой природе обнаружено около 90. В зависимости от содержания этих элементов в организмах живых существ их можно разделить на три группы:
1) макроэлементы, то есть элементы, содержащиеся в клетках в значительных количествах (от десятков процентов до сотых долей процента). К этой группе относятся водород, кислород, углерод, азот, натрий, кальций, фосфор, сера, калий, хлор. В сумме эти элементы составляют около 99% массы клеток, причем 98% приходится на долю первых четырех элементов (водород, кислород, углерод и азот).
2) микроэлементы, на долю которых приходится менее сотых долей процента от массы живых организмов. К этим элементам относятся железо, цинк, марганец, кобальт, медь, никель, йод, фтор. В сумме они составляют около 1% массы клеток. Невзирая на то, что содержание этих элементов в клетке мало, они необходимы для ее жизнедеятельности. При отсутствии или низком содержании таких элементов возникают различные заболевания. Нехватка йода, например, приводит у человека к возникновению заболеваний щитовидной железы, а недостаток железа может вызвать анемию.
3) ультрамикроэлементы, содержание которых в клетке крайне мало (менее 10-12 %). В эту группу входят бром, золото, селен, серебро, ванадий и многие другие элементы. Большинство этих элементов также необходимы для нормального функционирования организмов. Так, например, дефицит селена приводит к возникновению раковых заболеваний, а недостаток бора вызывает заболевание у растений. Некоторые элементы этой группы, как и микроэлементы, входят в состав ферментов.
В отличие от живых организмов, в земной коре самыми распространенными элементами являются кислород, кремний, алюминий и натрий. Поскольку содержание углерода, водорода и азота в живом веществе выше, чем в земной коре, можно сделать вывод, что молекулы, в состав которых входят атомы этих элементов, необходимы для осуществления процессов, обеспечивающих жизнедеятельность.
Четыре наиболее распространенных в живой материи элемента обладают одним общим свойством: они легко образуют ковалентные связи за счет спаривания электронов. Для того чтобы образовать стабильные электронные связи, атому водорода на внешней электронной оболочке недостает одного электрона, атому кислорода — двух, азота — трех и углерода — четырех электронов. Эти элементы могут легко реагировать друг с другом, заполняя внешние электронные оболочки. Помимо этого, три элемента: азот, кислород и углерод — способны образовывать как одинарные, так и двойные связи, благодаря чему значительно возрастает количество химических соединений, построенных из этих элементов.
Углерод, водород и кислород оказались подходящими для образования живой материи еще и потому, что они самые легкие среди элементов, образующих ковалентные связи. Очень важной с точки зрения биологии является также способность атома углерода образовывать ковалентные связи сразу с четырьмя другими атомами углерода. Таким образом, ковалентно связанные атомы углерода способны формировать каркасы огромного количества самых разных органических молекул.
Вода и другие неорганические вещества, их роль в жизнедеятельности клеток. Большинство химических соединений, из которых состоит клетка, характерны только для живых организмов. Однако в клетке есть ряд веществ, встречающихся и в неживой природе. Это в первую очередь вода, которая в среднем составляет около 80% от массы клеток (ее содержание может колебаться в зависимости от вида клетки и ее возраста), а также некоторые соли.
Вода — это крайне необычное в физическом и химическом отношении вещество, которое значительно отличается по свойствам от других растворителей. Первые клетки возникли в первичном океане и в процессе дальнейшего развития научились использовать эти уникальные свойства воды.
По сравнению с другими жидкостями вода характеризуется необычно высокой температурой кипения, плавления, удельной теплоемкостью, а также большими теплотой испарения, плавления, теплопроводностью и поверхностным натяжением. Это обусловлено тем, что молекулы воды более прочно связаны друг с другом, чем молекулы других растворителей.
Высокая теплоемкость воды (способность поглощать тепло при незначительном изменении собственной температуры) обеспечивает предохранение клетки от резких колебаний температуры, а такое свойство воды, как высокая теплота испарения, используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными является защитной реакцией на повышение температуры. Наличие у воды высокой теплопроводности обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и характеризуются упругостью.
Уникальные свойства воды определяются особенностями структуры ее молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода, входящих в состав молекулы. Атом кислорода, на внешней электронной орбите которого находится два электрона, объединяет их с двумя электронами атомов водорода (каждый атом водорода имеет на внешней электронной орбите по одному электрону). Вследствие этого между атомом кислорода и двумя атомами водорода образуются две ковалентные связи. Однако более отрицательный атом кислорода стремится притянуть к себе электроны. В результате каждый из атомов водорода приобретает небольшой положительный заряд, а атом кислорода несет на себе отрицательный заряд. Отрицательно заряженный атом кислорода одной молекулы воды притягивается к положительно заряженному атому водорода другой молекулы, что приводит к образованию водородной связи. Таким образом, молекулы воды оказываются связанными друг с другом.
Важным свойством водородной связи является ее меньшая прочность по сравнению с ковалентной связью (она примерно в 20 раз слабее ковалентной связи). Поэтому водородные связи относительно легко образуются и легко разрываются. Однако даже при 100° между молекулами воды существует еще достаточно сильное взаимодействие. Наличие водородных связей между молекулами воды обеспечивает ее некоторую структурированность, что объясняет такие ее необычные свойства, как высокая температура кипения, плавления и высокая теплоемкость.
Еще одним характерным свойством молекулы воды является ее дипольность. Как уже говорилось выше, атомы водорода в молекуле воды несут небольшой положительный заряд, а атомы кислорода — отрицательный. Однако угол связи Н-О-Н составляет 104,5°, поэтому в молекуле воды отрицательный заряд сосредоточен на одной стороне, а положительный заряд — на другой. Дипольность молекулы воды характеризует ее способность ориентироваться в электрическом поле. Именно это свойство воды определяет ее уникальность как растворителя: если в молекулах веществ содержатся заряженные группы атомов, они вступают в электростатические взаимодействия с молекулами воды, и эти вещества растворяются в ней. Такие вещества называются гидрофильными. В клетках имеется большое количество гидрофильных соединений: это соли, низкомолекулярные органические соединения, углеводы, белки, нуклеиновые кислоты. Однако есть ряд веществ, которые почти не содержат заряженных атомов и не растворяются в воде. К этим соединениям относятся, в частности, липиды (жиры). Такие вещества называют гидрофобными. Гидрофобные вещества не взаимодействуют с водой, но хорошо взаимодействуют друг с другом. Липиды, являющиеся гидрофобными соединениями, формируют двумерные структуры (мембраны), почти непроницаемые для воды.
Благодаря своей полярности вода растворяет больше химических веществ, чем любой другой растворитель. Именно в водной среде клетки, где растворены разнообразные химические вещества, осуществляются многочисленные химические реакции, без которых жизнедеятельность невозможна. Вода растворяет также продукты реакций и выводит их из клеток и из многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями.
Одно из важных свойств воды как химического соединения заключается в том, что она вступает во многие химические реакции, протекающие в клетке. Эти реакции называются реакциями гидролиза. В свою очередь молекулы воды образуются в результате многих реакций, протекающих в живых организмах.
Масса атома водорода очень мала, его единственный электрон в молекуле воды удерживается атомом кислорода. Вследствие этого ядро атома водорода (протон) способно отрываться от молекулы воды, в результате чего образуется гидроксильный ион (ОН—) и протон (Н+).
Н2O <=> Н+ + OH—
Этот процесс называется диссоциацией воды. Гидроксильные и водородные ионы, образующиеся при диссоциации воды, также являются участниками многих важных реакций, протекающих в организме.
Кроме воды важную роль в жизнедеятельности клетки играют растворенные в ней соли, которые представлены катионами калия, натрия, магния, кальция и других металлов, а также анионами соляной, серной, угольной и фосфорной кислот.
Для многих катионов характерно неравномерное распределение между клеткой и окружающей ее средой: так, в цитоплазме клетки концентрация К+ более высокая, а концентрация Na+ и Са2+ более низкая, чем в окружающей клетку среде. Внешней по отношению к клетке может быть как природная среда (например, океан), так и жидкости организма (кровь), которые по ионному составу близки к морской воде. Неравномерное распределение катионов между клеткой и окружающей средой поддерживается в процессе жизнедеятельности, на это клетка затрачивает значительную часть образующейся в ней энергии. Неравномерное распределение ионов между клеткой и окружающей средой необходимо для осуществления многих важных для жизнедеятельности процессов, в частности для проведения возбуждения по нервным и мышечным клеткам, осуществления сокращения мышц. После смерти клетки концентрация катионов вне клетки и внутри нее быстро выравнивается.
Содержащиеся в клетке анионы слабых кислот (НС03—, НРO42-) играют важную роль для поддержания внутри клетки постоянной концентрации ионов водорода (рН). Несмотря на то, что в процессе жизнедеятельности в клетке образуются как щелочи, так и кислоты, в норме реакция в клетке почти нейтральная. Это обусловлено тем, что анионы слабых кислот могут связывать протоны кислот и гидроксильные ионы щелочей, нейтрализуя таким образом внутриклеточную среду. Кроме того, анионы слабых кислот вступают в химические реакции, осуществляемые в клетке: в частности, анионы фосфорной кислоты необходимы для синтеза столь важного для клетки соединения, как АТФ.
Неорганические вещества содержатся в живых организмах не только в растворенном, но и в твердом состоянии. Например, кости формируются главным образом из фосфата кальция (в меньших количествах в них присутствует и фосфат магния), а раковины моллюсков — из карбоната кальция.
Органические вещества клетки. Биополимеры
В живых организмах присутствует огромное количество разнообразных соединений, которые практически не встречаются в неживой природе и которые называют органическими соединениями. Каркасы молекул этих соединений построены из атомов углерода. Среди органических соединений можно выделить низкомолекулярные вещества (органические кислоты, их эфиры, аминокислоты, свободные жирные кислоты, азотистые основания и т. д.). Однако основная масса сухого вещества клетки представлена высокомолекулярными соединениями, которые являются полимерами. Полимеры — это соединения, образованные из низкомолекулярных повторяющихся единиц (мономеров), последовательно связанных друг с другом ковалентной связью и образующих длинную цепь, которая может быть как неразветвленной, так и разветвленной. Среди полимеров различают гомополимеры, состоящие из одинаковых мономеров. Если обозначить мономер каким-либо символом, например буквой X, то структуру гомополимера условно можно представить следующим образом: -Х-Х-…-Х-Х. В состав гетерополимеров входят мономеры различной структуры. Если мономеры, входящие в состав гетерополимера, обозначить как X и У, то структура гетерополимера может быть представлена, например, в виде ХХУУХУ…ХХУУХУ. К биополимерам (то есть полимерам, встречающимся в живой природе) относятся белки, нуклеиновые кислоты и углеводы.
Белки
Структура белков. Среди органических соединений, представленных в клетке, основными являются белки: на их долю приходится не менее 50% сухого вещества. В состав всех белков входят углерод, водород, кислород, азот. Кроме того, почти все они содержат серу. В некоторых белках присутствуют также фосфор, железо, магний, цинк, медь, марганец. Так, железо входит в состав белка гемоглобина, находящегося в эритроцитах многих животных, а магний обнаруживается в пигменте хлорофилле, необходимом для осуществления фотосинтеза.
Характерная особенность белков — их большая молекулярная масса: она колеблется в пределах от нескольких тысяч до сотен тысяч и даже миллионов килодальтон. Мономером, то есть структурной единицей любого белка, являются аминокислоты, для которых характерно сходное, но не совсем одинаковое строение.
Как видно из представленной формулы, молекула аминокислоты состоит из двух частей. Та часть, что обведена рамкой, одинакова у всех аминокислот. Она содержит аминогруппу (-NН2), присоединенную к атому углерода, и следующую далее карбоксильную группу (-СООН). Вторая часть молекулы аминокислоты, изображенная в формуле в виде латинской буквы R, называется боковой цепью, или радикалом. Она имеет разную структуру у различных аминокислот. В качестве структурных элементов (мономеров) в состав белков входит 20 различных аминокислот, таким образом, в белках может встречаться 20 различных по структуре боковых цепей. Боковые радикалы могут быть заряжены отрицательно или положительно, содержать ароматические кольца и гетероциклические структуры, гидрофобные группировки, гидроксильные (-ОН) группы или атомы серы.
В белковых молекулах последовательно расположенные молекулы аминокислот соединяются друг с другом ковалентно, образуя длинные неразветвленные полимерные цепи. Аминокислоты в цепи расположены таким образом, что аминогруппа одной аминокислоты взаимодействует с карбоксильной группой другой. При взаимодействии двух этих групп выделяется молекула воды и образуется пептидная связь. Образовавшееся соединение называется пептидом. Если пептид состоит из двух аминокислот, его называют дипептидом, из трех — трипептидом. Молекулы белка могут содержать сотни и даже тысячи аминокислотных остатков. Таким образом, белки представляют собой полипептиды. Нужно отметить, что белковые молекулы представляют собой не беспорядочно построенные полимеры различной длины — каждая белковая молекула характеризуется определенной последовательностью аминокислот, которая определяется структурой гена, кодирующего данный белок.
Последовательность аминокислотных остатков в молекуле белка определяет его первичную структуру, то есть его формулу. Точно так же, как алфавит, в состав которого входят 33 буквы, позволяет создать огромное количество слов, с помощью 20 аминокислот можно создать почти неограниченное количество белков, различающихся как по количеству входящих в их состав аминокислот, так и по их последовательности. Общее число различных белков, встречающихся у всех видов живых организмов, составляет величину порядка 1010-1012. Важнейшей задачей современной биологии является определение первичной структуры белков, а также установление зависимости между первичной структурой и функциональной активностью белков. Поскольку последовательность аминокислот задается структурой гена, то первичную структуру белков в настоящее время определяют, выясняя последовательность нуклеотидов в соответствующем гене, используя для этого методы генной инженерии.
Белковая молекула в нативном (неповрежденном) состоянии обладает характерной для нее пространственной структурой, или конформацией. Она определяется тем, как сворачивается полипептидная цепь белка в растворе. Чаще всего отдельные участки полипептидной цепи сворачиваются в спираль (α-спираль) или образуют зигзагообразные структуры, располагающиеся антипараллельно, — так называемый складчатый слой, или β-структура. Образование α-спирали и β-структуры приводит к формированию вторичной структуры белка. При этом боковые цепи аминокислот располагаются с наружной стороны спирали или зигзагообразной структуры. Спиральная структура стабилизируется водородными связями, которые образуются между NH-группами, находящимися на одном витке, и CO-группами, расположенными на другом витке спирали. Эти водородные связи параллельны оси спирали.
Структура типа складчатого слоя также стабилизируется за счет водородных связей, которые образуются между параллельными слоями. Хотя водородные связи слабее ковалентных, присутствие их в значительном количестве делает структуры типа α-спирали или β-складчатого слоя достаточно прочными.
Спиральные участки и структуры типа складчатого слоя подвергаются дальнейшей упаковке, в результате чего формируется третичная структура белка. На этом этапе растворимые белки обычно образуют глобулярную структуру, имеющую вид клубка, в которой заряженные аминокислотные остатки оказываются на поверхности, а гидрофобные аминокислотные остатки — внутри клубка. При этом зачастую сближаются аминокислотные остатки, которые в полипептидной цепи расположены далеко друг от друга. Для каждого белка характерен свой способ упаковки, который задается уже на уровне первичной структуры данного белка, то есть зависит от порядка расположения аминокислот в полипептидной цепи.
Многие белки состоят из нескольких полипептидных цепей одинаковой или различной структуры. При объединении таких цепей образуется сложный белок, для которого характерна четвертичная структура. Такие белки называют олигомерами, а входящие в состав олигомера отдельные полипептидные цепи — мономерами.
Большая часть белковых молекул способна сохранять свою биологическую активность, то есть способность выполнять свойственную им функцию только в узком диапазоне температур и кислотности среды. При повышении температуры или изменении кислотности до экстремальных значений в структуре белков происходят изменения, которые называют денатурацией. Примером денатурации является свертывание белка яйца, наблюдающееся при его варке. При денатурации не происходит разрыва ковалентных связей, но разрушается характерная для данного белка четвертичная, третичная и вторичная структура, в результате чего в денатурированном состоянии полипептидные цепи белков образуют случайные и беспорядочные клубки и петли.
Функции белков. Для белков характерно значительное разнообразие функций. Самую большую и наиболее важную по биологическому значению группу белков составляют белки-ферменты, которые являются катализаторами, ускоряющими протекание различных химических реакций.
Вторая по величине группа белков представлена белками, являющимися структурными элементами клетки. К ним, например, относится фибриллярный белок коллаген, главный структурный белок, входящий в состав соединительной и костной ткани. Другие типы белков являются компонентами сократительных и двигательных систем. Таковы, например, актин и миозин, два главных элемента сократительной системы мышц. Из структурных белков формируется цитоскелет клетки, представляющий собой пучки фибриллярных белков, соединяющих различные органеллы клетки друг с другом и с плазматической мембраной клетки.
Некоторые белки выполняют транспортную функцию, они способны связывать и переносить с током крови различные вещества. Наиболее известным из таких белков является гемоглобин, который находится в эритроцитах позвоночных и, связываясь с кислородом, осуществляет его перенос из легких в ткани. Сывороточные липопротеиды переносят с током крови сложные липиды, а сывороточный альбумин — свободные жирные кислоты.
К транспортным белкам относятся также белки, встроенные в биологические мембраны и осуществляющие перенос различных веществ через эти мембраны. В обычных условиях клеточная мембрана слабо проницаема для таких веществ, как К+, Na+, Са2+, поскольку поры, сформированные белками-каналами, закрыты. Однако некоторые воздействия, например электрические импульсы или биологически активные вещества, связывающиеся с каналами, открывают пору, вследствие чего ион, способный проникать через этот канал, перемещается с одной стороны мембраны на другую в направлении уменьшения концентрации. Перемещение ионов в противоположном направлении осуществляется с затратой энергии другими транспортными белками мембраны, называемыми ионными насосами.
В специализированных клетках растений и животных осуществляется синтез специальных регуляторов или гормонов, часть из которых (но не все) являются белками, регулирующими различные физиологические процессы. Наиболее известным из них является, пожалуй, инсулин — гормон, вырабатываемый в поджелудочной железе и регулирующий уровень глюкозы в клетках организма. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Кроме того, белки способны осуществлять защитную функцию. При попадании в организм животных или человека вирусов, бактерий, чужеродных белков или других полимеров в организме происходит синтез специальных защитных белков, которые называют антителами или иммуноглобулинами. Эти белки связываются с чужеродными полимерами. Связывание антител с белками вирусов или бактерий подавляет их функциональную активность и останавливает развитие инфекции. Антитела обладают уникальным свойством: они способны отличать чужеродные белки от собственных белков организма. Такой механизм защиты организма от возбудителей заболеваний называют иммунитетом. Иммунитет к инфекционным заболеваниям можно создать путем инъекции очень небольших количеств некоторых биополимеров, входящих в состав микроорганизмов или вирусов, являющихся возбудителями данной болезни. При этом образуются антитела, которые впоследствии способны защитить организм, если он подвергнется заражению данным микроорганизмом или вирусом. Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
При недостатке питания у животных резко усиливается распад белков до входящих в его состав аминокислот, последние после соответствующих превращений могут использоваться в качестве источника энергии (энергетическая функция белков).
Часть бактерий и все растения способны синтезировать все 20 аминокислот, входящих в состав белков. Однако животные в процессе эволюции потеряли способность синтезировать 10 особо сложных аминокислот, которые они должны получать с растительной и животной пищей. Эти аминокислоты получили название незаменимых. Они входят в состав растительных и животных белков, получаемых с пищей, которые в пищеварительном тракте расщепляются до аминокислот. В клетках из этих аминокислот строятся собственные белки, характерные для данного организма. Отсутствие в пище незаменимых аминокислот вызывает тяжелые нарушения обмена веществ.
Ферменты и их роль в процессе жизнедеятельности. При той температуре и кислотности среды, которая характерна для клетки, скорость большинства химических реакций невелика. Однако реально в клетке реакции протекают с очень большой скоростью. Это достигается за счет присутствия в клетке специальных катализаторов — ферментов, которые значительно увеличивают скорость химических реакций. Ферменты — самый крупный и специализированный класс белков. Именно ферменты обеспечивают протекание в клетке многочисленных реакций, из которых складывается клеточный обмен веществ. В настоящее время известно более тысячи ферментов. Их каталитическая эффективность необычайно велика: они способны ускорять реакции в миллионы раз.
Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром. Известно, что химический катализ чаще всего осуществляется за счет образования комплекса превращаемого в процессе реакции вещества (субстрата) с катализатором. И в процессе ферментативной реакции субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре. Для ферментов характерно пространственное соответствие между субстратом и активным центром, они подходят друг к другу, «как ключ к замку». Таким образом, ферменты характеризуются субстратной специфичностью, поэтому каждый фермент обеспечивает протекание одной или нескольких реакций одного типа.
Связывание субстрата с ферментом (образование фермент-субстратного комплекса) сопровождается перераспределением электронного облака, окружающего превращаемое в процессе реакции вещество (субстрат), за счет взаимодействия с аминокислотами фермента, которые участвуют в формировании активного центра. Вследствие этого отдельные связи между атомами в молекуле субстрата ослабляются и разрушаются значительно легче, чем в растворе. В других случаях (реакции, при которых происходит образование связи) две молекулы субстрата сближаются в активном центре фермента настолько, что между ними легко образуется химическая связь. При денатурации фермента его каталитическая активность исчезает, так как нарушается структура активного центра.
В состав многих ферментов входят так называемые кофакторы — низкомолекулярные органические или неорганические соединения, способные осуществлять определенные типы реакций. К кофакторам принадлежит, например, динуклеотид НАД (никотинамидадениндинуклеотид), обеспечивающий дегидрирование различных субстратов. Его функции подробно будут рассмотрены в разделе «Энергетический обмен». Известно также большое количество ферментов, в состав которых входят металлы (железо, медь, кобальт, марганец), также участвующие в превращении субстратов в процессе каталитического акта.
Нуклеиновые кислоты
Еще одним важным классом биополимеров являются нуклеиновые кислоты, которые являются носителями генетической информации, а также принимают участие в процессе синтеза белков. В живой природе обнаружено два типа нуклеиновых кислот, а именно: дезоксирибонуклеиновая кислота (сокращенно ДНК) и рибонуклеиновая кислота (РНК). ДНК и РНК обнаруживаются у всех прокариот и эукариот, исключение составляют вирусы, часть которых содержит только РНК, тогда как другие — только ДНК. ДНК и РНК состоят из мономеров, называемых мононуклеотидами. Мононуклеотиды, входящие в состав ДНК и РНК, обладают сходной, но не одинаковой структурой. Мононуклеотиды состоят из трех основных компонентов: 1) азотистого основания, 2) сахара пентозы и 3) фосфорной кислоты.
Мононуклеотиды, входящие в состав ДНК, содержат пятиуглеродный сахар дезоксирибозу и одно из четырех азотистых оснований: аденин, гуанин, цитозин и тимин (сокращенно А, Г, Ц и Т).
Мононуклеотиды, входящие в состав РНК, содержат пятиуглеродный сахаррибозу, а также одно из четырех оснований: аденин, гуанин, цитозин и урацил (сокращенно А, Г, Ц и У).
Дезоксирибонуклеиновая кислота (ДНК). ДНК является носителем генетической информации и сосредоточена в клетке главным образом в ядре, где она является основным компонентом хромосом (у эукариот ДНК обнаруживается также в митохондриях и хлоропластах). ДНК представляет собой полимер, состоящий из ковалентно связанных между собой мононуклеотидов, в состав которых входит дезоксирибоза и четыре азотистых основания (аденин, гуанин, цитозин и тимин). Количество мононуклеотидов, входящих в состав ДНК, очень велико: в клетках прокариот, содержащих единственную хромосому, вся ДНК присутствует в виде одной макромолекулы с молекулярной массой более 2*109.
Структура молекулы ДНК была расшифрована Уотсоном и Криком в 1953 году. Молекула ДНК представляет собой две нити, расположенные параллельно друг другу и формирующие правозакрученную спираль. Ширина спирали составляет около 2 нм, тогда как длина может достигать сотен тысяч нанометров. Мононуклеотиды, входящие в состав одной цепи, последовательно соединяются за счет образования ковалентных связей между дезоксирибозой одного и фосфорной кислотой другого мононуклеотида. Азотистые основания, которые располагаются по одну сторону от образовавшегося остова одной цепи ДНК, формируют водородные связи с азотистыми основаниями второй цепи. Таким образом, в спиральной молекуле двухцепочечной ДНК азотистые основания находятся внутри спирали. Структура спирали такова, что входящие в ее состав полинуклеотидные цепи могут быть разделены только после раскручивания спирали.
Молекула ДНК устроена таким образом, что количество входящих в ее состав азотистых оснований одного типа (аденина и гуанина) равно количеству азотистых оснований другого типа (тимина и цитозина), то есть А+Г=Т+Ц. Это обусловлено размером азотистых оснований: длина структуры, образующейся при формировании водородной связи между парами аденин-тимин и гуанин-цитозин, составляет примерно 11 А. Размеры этих пар соответствуют размеру внутренней части спирали ДНК. Пара А-Г была бы слишком велика, а Ц-Т — мала для формирования спирали. Таким образом, азотистое основание, стоящее в одной цепи ДНК, определяет основание, располагающееся в том же месте другой цепи. Строгое соответствие нуклеотидов, расположенных параллельно друг другу в парных цепочках молекулы ДНК, получило название комплементарности (дополнительности). Именно благодаря этому свойству молекулы ДНК возможно точное воспроизведение (репликация) генетической информации. В клетке репликация (самоудвоение) ДНК происходит в результате разрыва водородных связей между азотистыми основаниями соседних цепей ДНК и последующего синтеза двух новых (дочерних) молекул ДНК с использованием в виде матрицы родительских цепей. Такие реакции были названы реакциями матричного синтеза.
Рибонуклеиновая кислота. РНК представляет собой полимер, состоящий из ковалентно связанных между собой мононуклеотидов, в состав которых входит рибоза и четыре азотистых основания (аденин, гуанин, цитозин и урацил). В клетках существует три разных типа рибонуклеиновых кислот: информационная, или матричная, РНК (иРНК, или мРНК), транспортная РНК (тРНК) и рибосомная РНК (рРНК). Молекулы всех трех типов РНК одноцепочечные. И все они имеют значительно меньшую молекулярную массу, чем молекулы ДНК. В большинстве клеток содержание РНК во много раз (от 5 до 10) выше, чем содержание ДНК. Все три типа РНК необходимы для обеспечения синтеза белка в клетке.
Информационная РНК. Информационная РНК синтезируется в ядре в процессе транскрипции, в ходе которого на одной из цепей ДНК обеспечивается матричный синтез молекулы РНК. Молекула иРНК состоит примерно из 300-30000 нуклеотидов и представляет собой структуру, комплементарную определенному участку одноцепочечной молекулы ДНК (гену). После синтеза иРНК переходит в цитоплазму, где она прикрепляется к рибосомам и используется в качестве матрицы, определяющей последовательность аминокислот в растущей полипептидной цепи. Таким образом, последовательность нуклеотидов в цепи ДНК, а затем и синтезируемой с ее использованием в качестве матрицы иРНК определяет последовательность аминокислот в синтезируемом белке. Каждый из тысяч белков, синтезируемых клеткой, кодируется специфической иРНК.
Транспортная РНК. Функция тРНК состоит в том, чтобы в ходе синтеза белка, осуществляемого на рибосомах, транспортировать к вновь синтезируемой полипептидной цепи определенные аминокислоты. Молекулрная масса тРНК невелика: молекулы содержат от 75 до 90 мононуклеотидов.
Рибосомная РНК. Рибосомная РНК входит в состав рибосом — органелл, с помощью которых осуществляется синтез белка. Молекулы рРНК состоят из 3-5 тысяч мононуклеотидов.
Углеводы
Углеводами, или сахаридами, называются соединения с общей формулой (СН2O)п, являющиеся альдегидоспиртами или кетоспиртами. Углеводы подразделяют на моно-, ди- и полисахариды.
Моносахариды, или простые сахара, чаще всего состоят из нити (пентозы) или шести (гексозы) атомов углерода и имеют со-(ггиетственно формулы (СН2O)5 и (СН2O)6.
Наиболее распространенным простым сахаром является шести углеродный сахар глюкоза, это исходный мономер, из которого построены многие полисахариды. Глюкоза является также главным источником энергии в клетке. Пентозы (рибоза и дезоксирибоза) входят в состав нуклеиновых кислот и АТФ.
В молекуле дисахаридов объединены два простых сахара. Наиболее известными представителями дисахаридов является сахароза, или пищевой сахар, молекула которого состоит из молекул глюкозы и фруктозы.
Молекулы полисахаридов представляют собой длинные цепи, построенные из многих моносахаридных единиц, причем цепи могут быть как линейными, так и разветвленными. Большинство полисахаридов содержат в качестве мономеров повторяющиеся единицы одного и того же вида или двух чередующихся видов, поэтому они не могут выполнять роль информационных биополимеров.
В живой природе содержится огромное количество углеводов. Это связано в первую очередь с широким распространением двух полисахаридов: крахмала и целлюлозы. Крахмал содержится в больших количествах в растениях. Он является той формой полисахарида, в которой запасается топливо. Целлюлоза — это главный компонент внеклеточных волокнистых и одревесневших растительных тканей. В пищеварительном тракте животных отсутствуют ферменты, способные расщеплять целлюлозу до мономеров. Однако эти ферменты имеются у бактерий, которые обитают в пищеварительном тракте некоторых животных, позволяя им использовать целлюлозу в качестве продукта питания
Полисахариды входят в состав жестких стенок растительных и бактериальных клеток, они являются также составным элементом более мягких оболочек клеток животных. Таким образом, углеводы выполняют в клетке две основные функции: энергетическую и строительную.
Липиды
Липиды представляют собой нерастворимые в воде органические соединения, входящие в состав клеток. Эти вещества могут быть экстрагированы (переведены в растворенное состояние) неполярными растворителями, такими, как хлороформ, бензол или эфир. Известно несколько классов липидов, однако наиболее важную функцию в организме выполняют, по-видимому, фосфолипиды, являющиеся эфирами трехатомного спирта глицерина и фосфорной кислоты. При образовании молекулы фосфолипида две гидроксильные группы глицерина взаимодействуют с высокомолекулярными жирными кислотами, содержащими 16-18 атомов углерода, а одна гидроксильная группа взаимодействует с фосфорной кислотой. Молекулы всех фосфолипидов содержат полярную голову и неполярный хвост, образованный двумя молекулами жирной кислоты. На границе раздела масло-вода молекулы фосфолипидов ориентируются таким образом, что их полярные головы погружаются в воду, а гидрофобные хвосты — в масло. По поверхности воды фосфолипиды растекаются в виде монослоя, в котором жирно-кислотные хвосты ориентированы в сторону относительно гидрофобного воздуха, а заряженные головы направлены в сторону водной среды.
Молекулы фосфолипидов способны формировать двумерные структуры, которые получили название бислоя: бислой образован из двух монослоев фосфолипидов, ориентированных относительно друг друга так, что гидрофобные хвосты фосфолипидов располагаются внутри бислоя, а полярные головы направлены наружу. Такой бислой характеризуется очень высоким электрическим сопротивлением. Именно бислои, состоящие из фосфолипидов, являются важнейшим компонентом биологических мембран. Биологические мембраны представляют собой природные пленки толщиной 5-7 нм, сформированные бислоем фосфолипидов, содержащим белковые молекулы. Таким образом, липиды выполняют в клетке строительную функцию.
Кроме того, липиды являются важным источником энергии-. при полном превращении в клетке 1 г липидов в воду и углекислый газ выделяется примерно в 2 раза больше энергии, чем при таком же превращении углеводов. Накапливаемый в подкожной клетчатке жир является хорошим теплоизолирующим материалом. Кроме того, липиды являются источником воды, которая в значительных количествах выделяется при их окислении. Именно поэтому многие животные, запасающие жиры (например, верблюды во время переходов по пустыне, медведи, сурки, суслики во время спячки), могут длительное время обходиться без воды.
Некоторые вещества, относящиеся к липидам, обладают высокой биологической активностью: это ряд витаминов, например витамины А и Б, а также некоторые гормоны (стероидные). Важную функцию в организме животных выполняет холестерин, являющийся компонентом клеточных мембран: неправильный обмен холестерина у людей приводит к возникновению атеросклероза — заболевания, при котором холестерин откладывается в виде бляшек на стенках кровеносных сосудов, сужая их просвет. Это приводит к нарушению кровоснабжения органов и является причиной таких тяжелых се рдечнососудистых заболеваний, как инсульт или инфаркт миокарда.
www.polnaja-jenciklopedija.ru
