Примеры решения задач на нахождение формулы вещества
Примеры решения задач на нахождение формулы вещества
Эмпирическая формула любого вещества — это формула, которая выражает простейшее целочисленное отношение элементов, содержащихся в данном веществе. Эмпирические формулы иногда называют также простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав — массовые доли элементов.
Вывод химических формул, если известны массовые доли химических элементов, входящих в состав данного вещества
Пример 1. Известно, что вещество состоит из 0,4 (40%) массовых долей кальция Са, 0,12 (12%) массовых долей углерода С, 0,48 (48%) массовых долей кислорода О. Вывести химическую формулу этого вещества.
Решение. При делении численных значений массовых долей химических элементов, входящих в состав данного вещества, на их относительные атомные массы находят отношение числа атомов: 0,4:0,12:0,48
0,4/40 (Са) : 0,12/12 (С): 0,48/16 (О) = 0,01 : 0,01 : 0,03 = 1 : 1 : 3
В этих расчетах часто употребляют массовые доли, выраженные в процентах:
40/40 (Сa) : 12/12 (С) : 48/16 (О) = 1 : 1 : 3
Расчет показывает, что в данном веществе на один атом кальция приходится один атом углерода и три атома кислорода. Следовательно, химическая формула данного вещества СаСО3
Пример 2. Соединение содержит 36,5% натрия, 25,4% серы и 38,1% кислорода. Определите формулу вещества.
1. С помощью соответствующих обозначений запишем условие задачи, найдем атомные массы элементов, о которых идет речь в условии задачи
|
Дано: ω(Na) = 36,5% ω(S) = 25,4% ω(O) = 38,1% Ar(Na) = 23 Ar(S) = 32 Ar(O) = 16 |
Решение 2. Разделим массовую долю каждого элемента на его атомную массу x : y : z = 36,5 / 23 : 25.4 / 32 : 38 / 16 x : y : z = 1,587 : 0,793 : 2,381 3. Разделим полученные величины на наименьшую. Полученные числа — индексы элементов в формуле соединения. x : y : z = 1,587 / 0,793 : 0,793 / 0,793 : 2,381 / 0,793 x : y : z = 2 : 1 : 3, следовательно Na2SO3 4. Запишем ответ Ответ: Na2SO3 |
|
Найти: NaxSyOz — ? |
examchemistry.com
«Задачи на вывод химической формулы неорганических веществ»
Вариант 1
1. Оксид трехвалентного элемента содержит 31,43 % элемента. Какой это элемент?
2. Хлорид двухвалентного элемента содержит 55,9 % хлора. Какой это элемент?
Вариант 2
1. Соединение некоторого элемента ЭCl2. Массовая доля элемента в нем составляет 44,1 %. Установите элемент.
2. Оксид трехвалентного элемента содержит 68,57 кислорода. Какой это элемент?
Вариант 3
1. Оксид четырехвалентного элемента содержит 21,2 % кислорода. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля элемента в нем составляет 70,9 %. Установите элемент.
Вариант 4
1. Хлорид одновалентного элемента содержит 75,26 % неизвестного элемента. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля серы в нем составляет 29,1 %. Установите элемент.
Вариант 5
1. Оксид четырехвалентного элемента содержит 78,8 % неизвестного элемента. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля элемента в нем составляет 55,7 %. Установите элемент.
Вариант 6
1. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля этого элемента в оксиде составляет 62,2 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля серы в нем составляет 44,28%. Установите элемент.
Вариант 7
1. Хлорид четырехвалентного элемента содержит 92,21 % хлора. Какой это элемент?
2. Соединение некоторого элемента имеет формулу ЭS. Массовая доля серы в нем составляет 18,93%. Установите элемент.
Вариант 8
1. Некоторый элемент проявляет в оксиде степень окисления +2. Массовая доля этого элемента в оксиде составляет 92,6 %. Какой это элемент?
2. Хлорид двухвалентного элемента содержит 7,79 % неизвестного элемента. Какой это элемент?
Вариант 9
1. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля кислорода в оксиде составляет 37,8 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля серы в нем составляет 32,98%. Установите элемент.
Вариант 10
1. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля кислорода в оксиде составляет 48 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля элемента в нем составляет 67,01%. Установите элемент.
Вариант 11
1. Некоторый элемент проявляет в оксиде степень окисления +5. Массовая доля этого элемента в оксиде составляет 83,94 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу ЭCl3. Массовая доля элемента в нем составляет 52,6%. Установите элемент.
Вариант 12
1. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля элемента в оксиде составляет 52 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля элемента в нем составляет 81,06 %. Установите элемент.
Вариант 13
1. Оксид двухвалентного элемента содержит 7,4 % кислорода. Установите элемент.
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля элемента в нем составляет 55,7 %. Установите элементВариант 14
1. Некоторый элемент проявляет в оксиде степень окисления +3. Массовая доля этого кислорода в оксиде составляет 25,6 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля серы в нем составляет 44,28 %. Установите элемент.
Вариант 15
1. Хлорид трехвалентного элемента содержит 52,58 % неизвестного элемента. Какой это элемент?
2. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля элемента в оксиде составляет 66,67 %. Какой это элемент?
Вариант 16
1. Хлорид двухвалентного элемента содержит 36,04% неизвестного элемента. Какой это элемент?
2. Некоторый элемент проявляет в оксиде степень окисления +5. Массовая доля кислорода в оксиде составляет 6,06 %. Какой это элемент?
Вариант 17
1. Хлорид двухвалентного элемента содержит 47,4 % хлора. Какой это элемент?
2. Некоторый элемент проявляет в оксиде степень окисления +3. Массовая доля этого элемента в оксиде составляет 74,476%. Какой это элемент?
Вариант 18
1. Хлорид двухвалентного элемента содержит 63,96 % хлора. Какой это элемент?
2. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля кислорода в оксиде составляет 33,33 %. Какой это элемент?
Вариант 19
1. Соединение некоторого элемента имеет формулу Э2S. Массовая доля серы в нем составляет 29,1 %. Установите элемент.
2. Хлорид двухвалентного элемента содержит 55,9 % хлора. Составьте формулу хлорида. Назовите элемент.
Вариант 20
1. Соединение некоторого элемента ЭCl2. Массовая доля элемента в нем составляет 44,1 %. Установите элемент.
2. Оксид трехвалентного элемента содержит 68,57 кислорода. Составьте формулу оксида. Назовите элемент.
Вариант 21
1. Оксид четырехвалентного элемента содержит 21,2 % кислорода. Какой это элемент?
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля элемента в нем составляет 70,9 %. Установите элемент.
Вариант 22
1. Хлорид одновалентного элемента содержит 75,26 % неизвестного элемента. Какой это элемент?
2. Соединение некоторого элемента Э2О3 . Массовая доля элемента в нем составляет 31,43 % . Какой это элемент?
Вариант 23
1. Некоторый элемент проявляет степень окисления + 4. Массовая доля элемента в оксиде составляет 78,8 %. Какой это элемент?
2. Хлорид двухвалентного элемента содержит 24,7 % хлора. Какой это элемент?
Вариант 24
1. Оксид шестивалентного элемента содержит 62,2 %. Неизвестного элемента. Какой это элемент?
2. Соединение некоторого элемента имеет формулу Э2S. Массовая доля серы в нем составляет 44,28%. Установите элемент.
Вариант 25
1. Оксид трехвалентного элемента содержит 31,43 % элемента. Какой это элемент?
2. Хлорид двухвалентного элемента содержит 55,9 % хлора. Какой это элемент?
Вариант 26
1. Соединение некоторого элемента ЭCl2. Массовая доля элемента в нем составляет 44,1 %. Установите элемент.
2. Оксид трехвалентного элемента содержит 68,57 кислорода. Какой это элемент?
Вариант 27
1. Оксид четырехвалентного элемента содержит 21,2 % кислорода. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля элемента в нем составляет 70,9 %. Установите элемент.
Вариант 28
1. Хлорид одновалентного элемента содержит 75,26 % неизвестного элемента. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля серы в нем составляет 29,1 %. Установите элемент.
Вариант 29
1. Оксид четырехвалентного элемента содержит 78,8 % неизвестного элемента. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля элемента в нем составляет 55,7 %. Установите элемент.
Вариант 30
1. Некоторый элемент проявляет в оксиде степень окисления +6. Массовая доля этого элемента в оксиде составляет 62,2 %. Какой это элемент?
2. Соединение некоторого элемента имеет формулу R2S. Массовая доля серы в нем составляет 44,28%. Установите элемент.
multiurok.ru
Молекулярные, структурные, электронные и другие химические формулы
Химические знаки позволяют изобразить состав сложного вещества в виде формул.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Химические формулы составляют на основании валентности атомов.
Формулы различают молекулярные, структурные, электронные и другие.
Молекулярные формулы (H3PO4, Fe2O3, Al(OH)3, Na2SO4, O2 и т.д.) показывают качественный (т.е. из каких элементов состоит вещество) и количественный (т.е. сколько атомов каждого элемента имеются в веществе) состав.
Структурные формулы показывают порядок соединения атомов в молекуле, соединяя атомы черточками (одна черточка — одна химическая связь между двумя атомами в молекуле).
Рассмотрим составление структурных формул кислот.
1) Составление структурных формул бескислородных кислот.
При составлении структурных формул бескислородных кислот следует учитывать, что в молекулах этих кислот атомы водорода связаны с атомами неметалла:
2) Составление структурных формул кислородсодержащих кислот.
При составлении структурных формул кислородсодержащих кислот нужно помнить, что водород связан с центральным атомом посредством атомов кислорода:
Следует помнить, что в кислородсодержащих кислотах центральным атомом всегда будет неметалл (S, P, N и т.д.).
Если, например, требуется составить структурные формулы серной и ортофосфорной кислот, то поступают так:
а) пишут один под другим атомы водорода данной кислоты:
б) затем через атомы кислорода черточками связывают их с центральным атомом:
в) к центральному атому (с учетом валентности) присоединяют остальные атомы кислорода:
Электронные формулы так же, как и структурные, показывают порядок соединения атомов в молекуле (связь показана посредством электронной пары, в которой один электрон принадлежит одному атому, а другой электрон — другому атому):
Итак:
По химической формуле можно:
1) определить, к какому классу соединений относится данное вещество;
2) прогнозировать строение и свойства вещества;
3) вычислять молекулярную массу вещества и молярную массу его; массу его молекулы в а.е.м.; массовые доли (%) элементов вещества.
Химические формулы веществ дают возможность записать результат любой химической реакции в виде уравнения: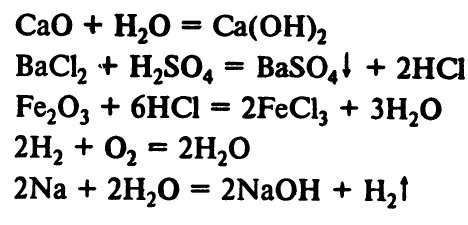
[Справочник школьника. Решение задач по химии. Н.И. Берман]
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
Таблица. Основные химические формулы для решения задач
Documents войти Загрузить ×- Математика
Related documents
Масса молекулы. Количество вещества
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn

Домашнее задание №6
V m – молярный объем газа

Время, минуты 0 15 75 100 125

1)При растворении 16г CaC в воде выделяется 31, 3 кДж

Задача 10. В газовой фазе при 60°С протекает реакция по
КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЯРНЫЙ ОБЪЁМ ГАЗОВ.
химия — pedportal.net

ЗАДАЧИ НА СКОРОСТЬ температурный коэффициент реакции – 3. Какой будет

Стандартные термодинамические величины некоторых

Файл8 класс Семинар. Задачи по теме Моль
Тест по химии «Простые вещества», учитель А.Ю. Парамонов

Решение задач по теме «Газообразные вещества».
studydoc.ru
Основные формулы для решения химических задач
Поиск Лекций
1. Количество вещества (размерность — моль): n(x) = , где m(x) — масса вещества х (г), М (х) — молекулярная масса вещества х (г/моль).
а) для газов: n(х) = , где V (x) — объем газа x в л, Vm — молярный объем газов, который при нормальных условиях составляет 22,4 л/моль;
б) нормальные условия: Т = 273 К = 0 °С, Р = 101 кПа = 760 мм рт. ст. = 1 атм. В системе СИ для измерения давления используется величина Па;
в) количество атомов, молекул или ионов вещества х:
N(x) = NA × n(х),
где NA — число Авогадро, равное 6,02 × 1023.
2. Массовая доля вещества х (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах):
w(x) = = .
3. Массовая доля элемента в соединении:
w(Э) = n × ,
где n — число атомов элемента, массовая доля которого определяется в соединении.
4. Объемная доля вещества х (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах):
j(x) = .
Для газов j(x) = , где x, y… — компоненты газовой смеси; j(O2) = 21 % (в воздухе).
5. Молярная доля вещества х (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах):
c(х) = ,
где x, y, z — компоненты смеси.
6. Молярная концентрация вещества х (размерность — моль/л, иногда обозначается — М): С(х) = .
7. Плотность вещества х (размерность г/мл = г/см3):
r(х) = .
8. Плотность газа х по газу y (безразмерная величина):
Dy (x) = ,
где M(x) и M(y) — молекулярные массы газов x и y (молекулярная масса воздуха 29 г/моль).
9. Универсальный газовый закон: P1 = P2 . Этот закон выполняется при неизменной массе газовой смеси.
10. Закон Менделеева — Клайперона: P × V = n × RT = m × R × , где R — универсальная газовая постоянная, равная 8,314 Дж/моль × К в системе СИ.
11. Растворимость вещества (х) определяется количеством граммов данного вещества, которое может раствориться в 100 г воды при заданной температуре (размерность — г; всегда указывается, при какой температуре измерена): Рt(x) = , где w — массовая доля насыщенного раствора при данной температуре.
12. Выход продукта реакции показывает, во сколько раз меньше получилось практического продукта реакции по сравнению с вычисленным теоретически по уравнению реакции (безразмерная величина, изменяемая в пределах от 0 до 1, иногда измеряется в процентах): w(х) = = = . Последнее соотношение — для газов.
13. Закон Гесса: тепловой эффект реакции не зависит от промежуточных стадий, а зависит лишь от начального и конечного состояний системы. Отсюда вытекает практическое следствие: тепловой эффект реакции равен разности между суммой теплот образования конечных продуктов и суммой теплот образования исходных веществ с учетом коэффициентов при формулах этих веществ в уравнениях реакции.
14. Число частиц в заданном количестве вещества х: N(x) = n × NA, NA = 6,02 × 1023.
15. Закон действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам. Для реакции типа aA + bB = dD, где a, b, d — стехиометрические коэффициенты (коэффициенты реакции), u = k × Ca(A) × Cb(B), где k — константа скорости химической реакции, равна скорости реакции при концентрациях реагирующих веществ, равных одному молю.
16. Константа равновесия реакции aA + bB Û dD + eE вычисляется по формуле: K(равновесия) = , где С — молярная концентрация веществ в равновесном состоянии.
17. Закон Вант — Гоффа: при увеличении температуры на каждые 10 градусов скорость реакции возрастает в 2—4 раза. = , где g—температурный коэффициент Вант — Гоффа, который колеблется для разных реакций от 2 до 4.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная
1. Фельдман Ф. Г., Рудзитис Г. Е. Химия: учебники с 8-го по 11-й класс средней школы. М.: Просвещение. 2004—2009.
2. Цветков Л. А. Органическая химия: Учебник для 10-го класса средней школы. М.: Просвещение, 2004—2009.
3. Химия: Справочные материалы / под ред. Ю. Д. Третьякова. М.: Просвещение, 1984—1998.
Дополнительная
1. Хомченко Г. П. Химия для поступающих в вузы. М.: Высш. шк., 1988—2002.
2. Ахметов Н. С. Неорганическая химия: в 2 ч. 3-е изд. М.: Просвещение. 1992.
3. Хомченко Г. П., Хомченко И. Г. Задачи по химии для поступающих в вузы. М.: Высш. шк., 1986—2002.
4. Мовсумзаде Э. М., Аббасова Г. А., Захарочкина Т. Г. Химия в вопросах и ответах с использованием ЭВМ. М.: Высш. шк., 1991.
5. Лидин Р. А., Молочко В. А. Химия для абитуриентов. М.: Химия, 1994.
6. Справочник школьника. Химия. М.: ТКО «АСТ», 1996—2002.
7. Справочник школьника: Решение задач по химии. М.: ТКО «АСТ». 1996.
8. Кузьменко Н. Е., Еремин В. В. Химия: тесты для школьников и поступающих в вузы. М.: ОНИКС 21 век; Мир и образование, 2002.
9. Кузьменко Н. Е., Еремин В. В. 2500 задач по химии с решениями (для поступающих в вузы). М.: ОНИКС 21 век; Мир и образование, 2002.
10. Кузьменко Н. Е., Еремин В. В. Химия 8—11-е классы: пособие для средней школы. Изд. 2-е, стереотипное. М.: Экзамен, 2002.
11. Кузьменко Н., Еремин В., Попков В. Химия для школьников старших классов и поступающих в вузы. М.: ОНИКС 21 век; Мир и образование, 2002.
12.Большой справочник «Химия» (для школьников и поступающих в вузы). М.: Дрофа, 1999.
poisk-ru.ru
Расчёты по химическим формулам | Задачи 130
Задача 130.
Из навески чугунных стружек массой 3,4260 г после соответствующей обработки получили 0,0998 г SiO2. Вычислить процентное содержание (по массе) кремния в анализируемом чугуне.
Решение:
Мольные массы кремния оксида кремния равны соответственно 28,086 и 60,086г/моль. Рассчитаем массу кремния, затраченного на образование оксида кремния из пропорции:
Процентное содержание кремния (по массе) в анализируемом образце можно вычислить по формуле:
Где — массовая доля вещества (В) в процентах, %; m(B) — масса вещества (В) в образце, г; m(обр.) — масса анализируемого образца, г.
Тогда
Ответ: 1,36%.
Задача 131.
Какой объем водорода (условия нормальные) надо затратить для восстановления 125 г МоО3 до металла?
Решение:
Уравнение протекающей реакции:
МоО3 + 3Н2 = Мо + 3Н2О
Мольная масса МоО3 равна 143,94 г/моль. Мольный объём газа равен 22,4 л/моль. Согласно уравнению реакции 3 моль водорода восстанавливают 1 моль оксида молибдена. Рассчитаем объём водорода, затраченный на восстановление 125 г оксида молибдена из пропорции:
Ответ: 58,3л.
Задача 132.
При взаимодействии соляной кислоты с 1,20 г сплава магния с алюминием выделилось 1,42 л водорода, измеренного при 23°С и давлении 100,7 кПа. Вычислить процентный состав сплава (по массе).
Решение:
Мольные массы Mg и Al соответственно равны 24,312 и 26,98 г/моль. Мольный объём газа равен 22,4 л/моль.
Найдём. Какой объём займёт 1,24 л Н2 при нормальных условиях (Р = 101,325 кПа и Т = 273 К), используя уравнение объединённого газового закона:
Уравнение протекающей реакции:
Mg + 2HCl = MgCl2 + H2↑;
2Al + 6HCl = 2AlCl3 + 3H2↑./p>
Далее составляем диагональную схему. При составлении такой схемы необходимо учитывать следующее: если значение свойства смеси больше значения свойства какого-то компонента, берут разность значений свойств смеси и этого компонента; наоборот, при большем значении свойства какого-то компонента берут разность значений свойств компонента и смеси. В соответствии с этими правилами диагональная схема для данной задачи будет иметь вид:
Делая массу смеси пропорционально числам отношения, получим значения масс магния и алюминия в смеси:
Процентное содержание магния и алюминия (по массе) в анализируемом образце можно вычислить по формуле:
Где — массовая доля вещества (В) в процентах, %; m(B) — масса вещества (В) в образце, г; m(обр.) — масса анализируемого образца, г.
Тогда
Ответ: 49,17% Mg; 50,83% Al.
Задача 133.
Для определения содержания NaС1 в техническом NaNO3 2,00г последнего растворили в воде и к полученному раствору добавили в избытке раствор AgNO3. Полученный осадок промыли и высушили. Масса осадка оказалась равной 0,287г. Найти массу NaС1, содержавшегося в исходном образце.
Решение:
Мольные массы AgNO3 и AgCl соответственно равны 58,543 и 143,321 г/моль. AgNO3 осаждает ионы Cl- из раствора в виде осадка нерастворимой соли AgCl. Реакция протекает по схеме:
AgNO3 + NaCl = AgCl↓ + NaNO3
Согласно уравнению реакции 1 моль NaCl образует 1 моль AgCl. Рассчитаем массу NaC, содержащегося в исходном образце из пропорции:
Ответ: 0,117г.
Задача 134.
Простейшая формула гидразина NH2. Какова его истинная формула, если плотность пара гидразина по воздуху равна 1,1: а) NH2; б) N2H4; в) N3H6?
Решение:
Истинную молекулярную массу гидразина находим исходя из его плотности по воздуху:
M(NxHy) = D(Возд.). 29 = 1,1 .29 = 32 г/моль,
где 29 – молекулярная масса воздуха.
Так как простейшая формула вещества NH2, то этой формуле отвечает молекулярная масса, равная 16. Вычислим множитель (n), на который следует умножить значения всех членов в простейшей формуле, разделив значение M(NxHy) на значение M(NH2):
Теперь значения индексов в простейшей формуле умножим на 2, получим: 2 . NH2 = N2H4. Таким образом, истинная формула гидразина имеет вид: N2H4.
Ответ: б).
Задача 135.
Простейшая формула соединения углерода с водородом СН2. Какова истинная формула соединения, если масса 1 л газа равна массе 1 л азота: а) С3Н6; б) С2Н4; в) С4Н8?
Решение:
Мольный объём любого газа равен 22,4л/моль. Мольная масса N2 равна 28 г/моль. Следовательно, мольная масса соединения CxHy равна тоже 28г/моль. Простейшая формула со-единения СН2. Этой формуле соответствует молекулярная масса равная 28. Вычислим множитель (n), на который следует умножить значения всех членов в простейшей формуле, разделив значение M(CxHy) на значение CH2:
Теперь значения индексов в простейшей формуле умножим на 2, получим: 2 . Ch3 = С2H4. Таким образом, истинная формула гидразина имеет вид: С2H4.
Ответ: б).
Задача 136.
Какова молекулярная формула соединения азота с кислородом, если плотность этого газа по водороду равна 15: а) NО; б) N2О; в) NO2?
Решение:
Истинная молекулярная масса вещества может быть вычислена по формуле:
M(B) = D .M(H2)
Тогда
M(NxOy) = 15 . 2 = 30 г/моль.
Данной молекулярной массе отвечает формула оксида азота NO [M(NxOy) = x + y = 30; x = 30 – y = 30 – 16 = 14].
Ответ: а).
Задача 137.
Металл вытеснил из кислоты 16,8 мл Н2 (условия нормальные). Какой объем N2 необходим для связывания этого количества водорода в Nh4: а) 11,2 мл; 6) 5,6 мл; в) 8, мл?
Решение:
Уравнение реакции имеет вид:
N2 + 3H2 = 2NH3
1 моль любого газа при нормальных условиях занимает объём 22,4 л. Согласно уравнению реакции 1 моль (22,4 л) N2 связывается с 3 моль (67,2л) Н2, образуя 2 моль NH3. Рассчитаем объём азота, необходимый для связывания водорода из пропорции:
Ответ: б).
Задача 138.
При разложении СаСО3 выделилось 11,2л СО2. Чему равна масса КОН, необходимая для связывания выделившегося газа в карбонат: а) 56г; 6) 112 г; в) 28?
Решение:
Уравнение протекающей реакции:
2KOH + CO2 = K2CO3 + H2O
1 моль любого газа при нормальных условиях занимает объём 22,4 л. Молекулярная масса КОН равна 56. Согласно уравнению реакции 1 моль СО2 связывает 2 моль КОН в К2СО3. Рассчитаем массу КОН, необходимую для связывания выделившегося углекислого газа в карбонат из пропорции:
Ответ: 56г.
Задача 139.
Определить реакцию среды в растворе после взаимодействия 90г NаОН с 73г НСI: а) нейтральная; б) кислая; в) щелочная.
Решение:
Уравнение протекающей реакции:
NaOH + HCl = NaC + H2O
Мольные массы NaOH и HCl соответственно равны 40 и 36,453 г/моль. Находим количества взятых для реакции NaOH и HCl:
Согласно уравнению реакции 1 моль NaOH реагирует с 1 моль HCl. В избытке взят раствор NaOH так как 2,25 > 2. При диссоциации избытка NaOH образуется дополнительное количество ионов OH—:
NaOH <—> Na+ + OH—
Избыточное количество гидроксид-ионов OH— придаёт раствору щелочную реакцию (РН>7).
Ответ: в).
buzani.ru
ЗАДАЧИ НА ВЫВОД ХИМИЧЕСКОЙ ФОРМУЛЫ ВЕЩЕСТВА
|
Вывод химической формулы вещества |
Номер задачи |
Формулы для вычислений |
|
По массовым долям (%) химических элементов |
1 |
(1) где k – число атомов этого элемента в молекуле. |
|
По массовым долям (%) химических элементов и плотности соединения |
2 |
М (вещ-ва) = Dг ·М (г) и (1) где Dг – относительная плотность по газообразному веществу М (г) – молярная масса газообразного вещества |
|
По плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
|
По массовым долям (%) химических элементов и массе соединения |
4 |
М находится по соотношению, |
|
По массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
|
Дано: |
Решение: M кислоты= 32/42,67 = 75 (г/моль) |
|
Вывести формулу соединения |
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
|
Дано: |
Решение:
М (CхНу)= 21 · 2 = 42
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
|
Вывести формулу соединения |
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
|
Дано: |
Решение: |
|
Вывести формулу алкана |
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
|
Дано: |
Решение: |
|
Вывести формулу соединения |
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
|
Дано: |
Решение: Составляем пропорции: |
|
Вывести формулу |
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
|
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M= mRT/PV= (0, 51 · 8,31 · 280)/(98,64 ·103·118 ·10-6) = =101,95 г/моль.
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
|
Вывести формулу соединения |
Задачи для самостоятельного решения
|
1. Определить химическую формулу соединения, если известны массовые доли элементов: натрия – 27,06%; азота – 16,47 %; кислорода – 57,47%. Ответ: NaNO3 |
|
2. Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
|
3. Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
|
4. Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
|
4. Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества. Ответ: C6H14О |
sheremet-sosh37.edusev.ru
