Химические вещества: примеры, свойства
Элементарными частицами физической материи на нашей планете являются атомы. В свободном виде они могут существовать только при очень высоких температурах. В обычных условиях элементарные частицы стремятся к объединению между собой при помощи химических связей: ионной, металлической, ковалентной полярной или неполярной. Таким способом образуются вещества, примеры которых мы и рассмотрим в нашей статье.
Простые вещества
Процессы взаимодействия между собой атомов одного и того же химического элемента заканчиваются образованием химических веществ, называемых простыми. Так, уголь образован только атомами углерода, газ водород – атомами гидрогена, а жидкая ртуть состоит из частиц ртути. Понятие простое вещество не нужно отождествлять с понятием химического элемента. Например, углекислый газ состоит не из простых веществ углерода и кислорода, а из элементов карбона и оксигена. Условно соединения, состоящие из атомов одного и того же элемента, можно разделить на металлы и неметаллы. Рассмотрим некоторые примеры химических свойств таких простых веществ.

Металлы
Исходя из положения металлического элемента в периодической системе, можно выделить следующие группы: активные металлы, элементы главных подгрупп третьей – восьмой групп, металлы побочных подгрупп четвертой – седьмой групп, а также лантаноиды и актиноиды. Металлы – простые вещества, примеры которых мы приведем далее, имеют следующие общие свойства: тепло- и электропроводность, металлический блеск, пластичность и ковкость. Такие характеристики присущи железу, алюминию, меди и другим. С увеличением порядкового номера в периодах возрастают температуры кипения, плавления, а также твердость металлических элементов. Это объясняется сжатием их атомов, то есть уменьшением радиуса, а также накоплением электронов. Все параметры металлов обусловлены внутренним строением кристаллической решетки данных соединений. Ниже рассмотрим химические реакции, а также приведем примеры свойств веществ, относящихся к металлам.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:

Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Неметаллы
Наиболее важные неметаллические элементы находятся в подгруппах азота, карбона, а также относятся к группам галогенов и халькогенов периодической системы. Приведем примеры веществ, относящихся к неметаллам: это сера, кислород, азот, хлор. Все их физические особенности противоположны свойствам металлов. Они не проводят электрический ток, плохо пропускают тепловые лучи, имеют низкую твердость. Взаимодействуя с кислородом, неметаллы образуют сложные соединения – кислотные оксиды. Последние, реагируя с кислотами, дают кислоты:
Типичная реакция, характерная для кислотных окислов – это взаимодействие со щелочами, приводящее к появлению соли и воды.
Химическая активность неметаллов в периоде усиливается, это связано с увеличением способности их атомов притягивать электроны от других химических элементов. В группах наблюдаем обратное явление: неметаллические свойства ослабевают вследствие раздувания объема атома за счет добавления новых энергетических уровней.

Итак, мы рассмотрели виды химических веществ, примеры, иллюстрирующие их свойства, положение в периодической системе.
www.nastroy.net
Простые и сложные вещества — получение и свойства
Все вещества, о которых мы говорим в школьном курсе химии, принято делить на простые и сложные. Простые вещества — это такие вещества, в состав молекул которых входят атомы одного и того же элемента. Атомарный кислород (O), молекулярный кислород (O2) или просто кислород, озон (O3), графит, алмаз — это примеры простых веществ, которые образуют химические элементы кислород и углерод. Сложные вещества делятся на органические и неорганические. Среди неорганических веществ, прежде всего выделяют следующие четыре класса: окислы (или оксиды), кислоты (кислродные и безкислородные), основания (растворимые в воде основания называются щелочами) и соли. Соединения неметаллов (исключая кислород и водород) не входят в эти четыре класса, мы будем их называть условно «и другие сложные вещества».
Простые вещества принято делить на
металлы, неметаллы и инертные газы. К
металлам относятся все химические
элементы, у которых идет заполнение
d- и f-подуровней, это в 4-ом периоде
элементы: Sc — Zn, в 5-ом периоде: Y —
Cd, в 6-ом периоде: La — Hg, Ce — Lu, в 7
периоде Ac — Th — Lr. Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.е. являются амфотерными
гидроксидами. Поэтому эти элементы
можно считать металло-неметаллами,
занимающими промежуточное
положение между металлами и
неметаллами. Таким образом,
классификация химических элементов
зависит от того, какими свойствами
будут обладать их гидроксиды:
основными — значит это металл,
кислотными — неметалл, и теми и
другими (в зависимости от условий) —
металло-неметалл. Один и тот же
химический элемент в соединениях с
низшей положительной степенью
окисления (Mn+2, Cr+2) проявляет ярко
выраженные «металлические» свойства,
а в соединениях с максимальной
положительной степенью окисления
(Mn+7, Cr+6) проявляет свойства
типичного неметалла. Чтобы увидеть
взаимосвязь простых веществ, оксидов,
гидроксидов и солей приведем сводную
таблицу.
www.himikatus.ru
Простые вещества — урок. Химия, 8–9 класс.
Все химические вещества делятся на простые и сложные.
Простыми называют вещества, образованные атомами одного химического элемента.
Некоторые простые вещества состоят из молекул.
Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие.
Из двухатомных молекул состоят водород h3, кислород O2, азот N2, галогены F2, Cl2, Br2, I2.
Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4, восемь — в молекулах серы S8.
Модели молекул водорода и азота
Модель молекулы белого фосфора
Другая группа простых веществ имеет немолекулярное строение. К таким веществам относятся все металлы, а также фосфор красный, алмаз, графит, кремний и другие.
Их химические формулы записывают химическим символом элемента без индекса: Fe, P, C, Si и т. д.

Модель кристалла железа
Химических элементов известно \(118\), а простых веществ — более \(400\). Один химический элемент может образовать несколько простых веществ.
Явление существования нескольких простых веществ, образованных атомами одного химического элемента, называется аллотропией.
Простые вещества, состоящие из атомов одного химического элемента — аллотропные модификации (аллотропные видоизменения).
Пример:
химический элемент кислород образует простые вещества, отличающиеся составом молекул: кислород O2 и озон O3. Кислород — газ без запаха, необходим живым организмам для дыхания. Озон имеет запах, ядовит.
Химический элемент фосфор образует молекулярное вещество фосфор белый P4 и немолекулярное — фосфор красный P. Эти вещества отличаются не только строением, но и свойствами. Белый фосфор имеет запах, самовоспламеняется на воздухе. Красный фосфор без запаха, горит только при нагревании.
Химический элемент углерод образует немолекулярные вещества алмаз и графит. Они обозначаются одинаковой формулой — C, но имеют разное строение и отличаются свойствами. Алмаз представляет собой прозрачное, бесцветное, очень твёрдое вещество. Графит — непрозрачный, тёмно-серый, мягкий.
Алмаз и графит
Химический элемент и простое вещество
Названия химического элемента и простого вещества в большинстве случаев совпадают, поэтому следует различать эти два понятия.
Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение).
Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Пример:
Химический элемент | Простое вещество |
| Относительная атомная масса кислорода равна \(16\) | Кислород плохо растворяется в воде |
| Азот входит в состав белков | Азот используют для получения аммиака |
| Атомы водорода входят в состав молекул воды | Водород легче воздуха |
www.yaklass.ru
Простые и сложные вещества — Первоначальные химические понятия Химия 7 класс Савчин М.М. — Грамота 2015 год
Тема 1 Первоначальные химические понятия
§ 9. Простые и сложные вещества
Освоив эту тему, вы сможете:
• различать понятия «простое вещество» и «сложное вещество», формулы простых и сложных веществ;
• понимать понятие «химическое соединение»;
• приводить примеры простых и сложных веществ;
• описывать простые и сложные вещества, известные вам из повседневного обихода;
• высказывать суждения о многообразии веществ.
Большинство атомов химических элементов обладают способностью сочетаться друг с другом или с атомами других химических элементов. Вследствие этого образуются химические соединения. Независимо от состава их структурных частиц и простые, и сложные вещества являются химическими соединениями, так как между ними возникают химические связи.
Вы уже ознакомились со строением атомов химических элементов. Вещества, составляющими которых являются атомы, называют атомными.
Однако среди всего разнообразия химических соединений существуют и молекулярные вещества. Составной частью их являются молекулы.
Молекулы — мельчайшие частицы вещества, сохраняющие его химические свойства.
Молекулу считают пределом делимости вещества. Если она разрушается, то разрушается и вещество. Характерной особенностью молекул является непрерывное движение.
— Вспомните из курса природоведения, какое явление называется диффузией.
Каждая молекула состоит из определенного количества атомов одного или различных химических элементов.
— Вспомните из курса природоведения, как делятся вещества по составу и происхождению.
Какие вещества называют: а) простыми; б) сложными? Приведите несколько примеров простых и сложных веществ, которыми вы чаще всего пользуетесь в быту.
Простые вещества — это вещества, образованные одним химическим элементом.
Например, простые вещества водород, кислород, азот образованные в соответствии химическими элементами Гідрогеном, Оксигеном, Азотом. В состав их молекул входят по два соединенные между собой атомы этих элементов (рис. 41 а, 6, в).
Элемент Кислород при определенных условиях образует еще одну простую вещество — озон, молекула которого содержит три атома (рис. 41 г).
Рис. 41. Модели молекул простых веществ: а — водорода; б — кислород; в — озона; г — азота
Сложные вещества — это вещества, образованные двумя или более химическими элементами.
К сложным веществам относятся; вода, сахар, мыло, поваренная соль, мел, метан (составляющая природного газа), углекислый газ. Вещества, входящие в состав клеток живых организмов (белки, жиры и углеводы), являются сложными и содержат преимущественно атомы Углерода, Кислорода, Водорода, Азота, Серы, Фосфора и имеют молекулярное строение.
— Вспомните, как доказать, что вода является сложным веществом. Какие методы исследования использовали ученые, чтобы определить состав воды?
На рисунке 42 изображена модели молекул метана, углекислого газа и воды. Молекула метана состоит из одного атома Углерода и четырех атомов Водорода, молекула углекислого газа — из одного атома Карбона и двух атомов Кислорода, молекула воды — из одного атома Кислорода и двух атомов Водорода.
Рис. 42. Модели молекул сложных веществ: а — метана; б — углекислого газа; в — воды
Итак, в зависимости от состава, вещества классифицируют на простые и сложные. Схему классификации веществ изображено на рисунке 43.
Рис. 43. Классификация веществ
Простые вещества: металлы и неметаллы. Простые вещества разделяют па две группы. Металлические элементы образуют металлы, нерудные — неметаллы. Их различают по физическим свойствам.
— Вспомните, с какими физическими свойствами веществ вы уже ознакомились. Назовите их.
Обратимся к демонстрациям и рассмотрим образцы простых веществ металлов и неметаллов. Из металлов наиболее распространенными в технике, различных отраслях производств, быту с железо, цинк, алюминий, медь, серебро, золото; из неметаллов в лаборатории имеются сера, углерод, красный фосфор, бром, йод.
— Обратите внимание на агрегатное состояние металлов и неметаллов. Почему, по вашему мнению, бром хранят в запаянных ампулах?
За основу деления простых веществ па металлы и неметаллы взято их физические свойства (табл. 2).
Таблица 2
Физические свойства простых веществ
|
Металлы |
Неметаллы |
|
Металлический блеск |
Не имеют металлического блеска |
|
Электропроводящие |
Неелектропровідні |
|
Теплопроводные |
Нетеплопровідні |
|
Высокие температуры плавления |
Низкие температуры плавления |
|
Пластические, ковкі |
Хрупкие |
|
Нелетучие |
Летучие Некоторые из них имеют характерный запах |
Неметаллы — это вещества, которые по большей части состоят из молекул. Молекулы многих из них двухатомные. Однако встречаются и многоатомные молекулы: уже упоминавшийся озон, кристаллическая сера — содержит восемь атомов Серы, белый фосфор — четыре атома этого элемента. В простых веществах, образованных элементом Карбоном, атомы соединяются в определенном порядке, не образуя молекул.
Металлы состоят из атомов соответствующих элементов. Названия металлов часто совпадают с названиями металлических элементов, их образующих. Например, вещества алюминий, цинк, никель, хром, магний образованные соответствующими химическими элементами. Однако вещество медь состоит из атомов элемента Купруму, серебро — Аргентуму, золото — Ауруму, ртуть — Меркурию, железо — Железа. В названия неметаллов элементов и простых веществ совпадают для незначительного количества веществ (табл. 3).
Таблица С
Названия химических элементов и простых веществ
|
Металлические |
Неметаллические |
||
|
Химический элемент |
Простое вещество |
Химический элемент |
Простое вещество |
|
Алюминий |
алюминий |
Арсен |
арсен |
|
Аргентум |
серебро |
Бром |
бром |
|
Аурум |
золото |
Водород |
водород |
|
Купрум |
медь |
Йод |
йод |
|
Магний |
магний |
Карбон |
углерод |
|
Манган |
манган |
Азот |
азот |
|
Меркурий |
ртуть |
Оксиген |
кислород |
|
Платина |
платина |
Силиция |
силиция |
|
Плюмбум |
свинец |
Сульфур |
сера |
|
Станум |
олово |
Фтора |
фтор |
|
Ферум |
железо |
Фосфор |
фосфор |
|
Хром |
хром |
Хлор |
хлор |
Лабораторный опыт 2
Ознакомление с образцами простых и сложных веществ
Задача 1. Рассмотрите внимательно вещества, выданные вам в банках. Прочтите надписи на этикетках: Н2О (вода), S (сера), Р (фосфор), Mg (магний), NaOH (натрия гидроксид), С (углерод), Fe3O4 (ферум(II, III) оксид), Fе (железо), ZnO (цинк оксид), СаСО3 (кальций карбонат), Аl (алюминий), Zn (цинк), СаО (кальций оксид), Nа2СО3 (натрий карбонат).
Распределите эти вещества на две группы: простые и сложные. Простые классифицируйте вещества на металлы и неметаллы.
Задание 2. Опишите: а) чем отличаются по составу простые и сложные вещества; 6) по каким признакам вы сделали классификацию.
Задание 3. Опишите физические свойства веществ на основе ваших наблюдений.
Выполнив задание, запишите данные в рабочую тетрадь в виде таблицы. В конце работы сформулируйте выводы.
|
Простые вещества |
Описание свойств по наблюдениям |
Сложные вещества |
Описание свойств по наблюдениям |
|
Металлы |
|||
|
Неметаллы |
|||
Многообразие веществ. Многообразие веществ объясняется способностью атомов элементов сочетаться между собой. В зависимости от того, какие атомы, в каком количестве и как соединяются, образуется много простых и сложных веществ (рис. 44).
Рис. 44. Простое вещество сера (а) и сложное вещество аметист (б)
Простых веществ существует чуть больше, чем химических элементов — 400, ибо, как вы уже знаете, один и тот же элемент (Оксиген, Карбон, Фосфор, Сульфур) может образовывать две или более веществ.
Сложных веществ известно гораздо больше (почти 20 милл). Это вода, в состав молекулы которого входят Водород и Кислород, углекислый газ — Карбон и Кислород, поваренная соль — Натрий и Хлор. В состав названных веществ входят только два элемента — это бинарные соединения. Однако значительное количество веществ состоит из трех и более элементов. Так, в состав глюкозы входят три элемента: Карбон, Гидроген и Оксиген, а питьевая сода содержит четыре элемента: Натрий, Водород, Карбон и Кислород.
К сложным относятся все органические вещества. Кроме того, существует целая индустрия по добыче синтетических и искусственных соединений, которые имеют огромное производственное и бытовое назначение.
— Вспомните из курса природоведения, какие вещества называют неорганическими, органическими. Приведите примеры неорганических и органических соединений.
При нормальных условиях (температура 0 °С, давление 101,3 кПа) вещества находятся в трех агрегатных состояниях: жидком (вода, масло, спирт), твердом (цинк, железо, сера, фосфор, углерод, медь) и газуватому (водород, кислород, озон, азот, углекислый газ, инертные газы).
СУММИРУЕМ ИЗУЧЕННОЕ
• Вещества подразделяют на простые и сложные.
• Сложные вещества образуются из двух и более химических элементов. их значительно больше, чем простых.
• Каждая простое и сложное вещество характеризуется определенными свойствами, то есть признаками, по которым можно выявить их сходство и различие.
• Сложные вещества бывают органического и неорганического происхождения.
• Многообразие веществ объясняется способностью атомов элементов сочетаться между собой.
ЗАДАНИЯ ДЛЯ КОНТРОЛЯ ЗНАНИЙ
1. Объясните, что означают понятия «молекула», «простое вещество», «сложное вещество», «химическое соединение».
2. Приведите примеры: а) простых и сложных веществах; б) органических и неорганических веществ.
3. Обоснуйте, являются ли идентичными понятия «химическое соединение» и «смесь веществ».
4. Охарактеризуйте физические свойства: а) сахара; б) воды; в) масла.
5. Обоснуйте, почему сложных веществ больше, чем простых.
6. Выскажите собственное суждение о важности веществ для жизни и здоровья человека.
ИНТЕРЕСНО ЗНАТЬ
Английский химик Г. Дэви впервые выделил в свободном состоянии, методом электролиза, металлы натрий, калий, кальций, стронций, барий, магний. Эти работы положили начало изготовления сильных ламп для прожекторов, маяков и т. др. Впоследствии ученый создал безопасную шахтерскую лампу, которая использовалась во всем мире, пока не была заменена лампочкой с аккумулятором.
Склодовская-Кюри Мария (1867-1934) — французский физик и химик, педагог, общественный деятель. Наука обязана ему открытием и исследованием двух радиоактивных элементов — Полония и Радия. Открытие элемента Радия начало метод лечение им рака кожи. За свой труд была награждена двумя Нобелевскими премиями, которые пожертвовала на строительство санатория в г. Закопане и Радиологического института в г. Варшаве (Польша).
schooled.ru
Конспект «Простые и сложные вещества»
«Простые и сложные вещества»
Ключевые слова конспекта: агрегатные состояния веществ, кристаллическая решетка, вещества молекулярного и немолекулярного строения, простые и сложные вещества.
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.

В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
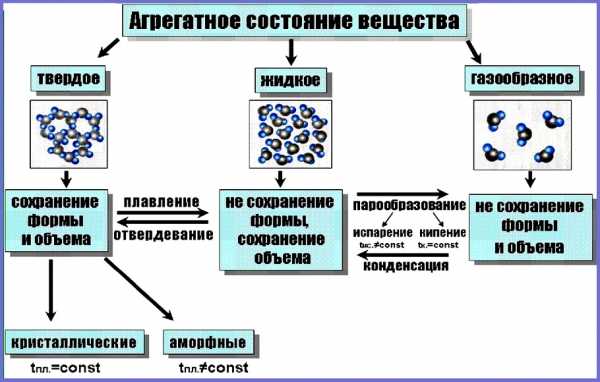
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.

Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
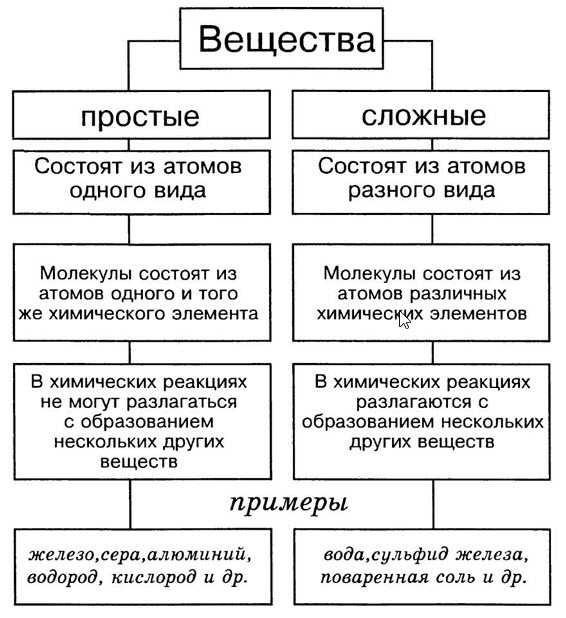
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями.
С — алмаз, графит, карбин;
О — кислород, озон;
Р — белый, красный, черный;
S — ромбическая, моноклинная, пластическая
Конспект урока «Простые и сложные вещества».
Следующая тема: «Химические элементы и их знаки».
Простые и сложные вещества
5 (100%) 1 voteuchitel.pro
§ 3. Классификация сложных веществ
Сложные вещества по своему составу подразделяются на бинарные соединения (соединения из атомов только двух элементов) и соединения, в составе которых содержатся атомы более двух элементов. Например, из ряда соединений, состав которых выражается формулами NaI, KNO2, AlN, CaH2, Na2SO3, к бинарным относятся: CaH2, NaI, AlN
По своему составу и свойствам неорганические вещества классифицируют на оксиды, основания, кислоты и соли.
Оксиды – сложные вещества, молекулы которых состоят из атомов кислорода и атомов какого – либо элемента (металла или неметалла).
Примеры оксидов: SO3, CuO, H2O, Fe2O3, CO2.
Основания – сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп (-ОН).
Примеры оснований: КОН, Ca(OH)2, Al(OH)3, Fe(OH)2
-6-
К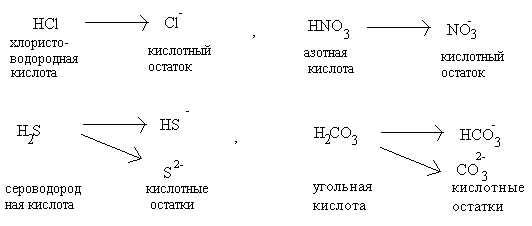 ислоты– сложные
вещества, молекулы которых содержат
атомы водорода, способные замещаться
атомами металла с образованием соли.
Молекулы всех кислот построены однотипно:
они состоят из атомов водорода и кислотных
остатков. Кислотные остатки – это атомы
или группы атомов, которые остаются
после полного или частичного замещения
водорода в молекуле кислоты. Например,
ислоты– сложные
вещества, молекулы которых содержат
атомы водорода, способные замещаться
атомами металла с образованием соли.
Молекулы всех кислот построены однотипно:
они состоят из атомов водорода и кислотных
остатков. Кислотные остатки – это атомы
или группы атомов, которые остаются
после полного или частичного замещения
водорода в молекуле кислоты. Например,
Соли – сложные вещества, молекулы которых всегда содержат атомы металла и атомы кислотного остатка. Соли можно рассматривать как продукт полного или частичного замещения атомов водорода в молекулах кислот атомами металлов, или гидроксильных групп в молекулах оснований на кислотные остатки.
Примеры солей: Ca(HCO3)2, Mg3(PO4)2, FeCl2, K2CO3, CuOHCl.
Номенклатуру и свойства каждого из этих классов соединений смотри в следующих параграфах (§ 4 — § 8).
ЗАДАНИЕ 3 (для самоконтроля)
1.Укажите, к какому классу химических соединений относится каждое из указанных веществ: а) сернистый газ – SO2, едкий калий — КОН, магнитный железняк – Fe3O4; б) поваренная соль — NaCl, медный купарос – CuSO4·5 H2O, углекислый газ – СО2; в) гашеная известь – Са(ОН)2; триоксид серы – SO3, калийная селитра – KNO3.
2. В приведенных ниже формулах солей подчеркните кислотный остаток:
а) Ca3(PO4)2, FeCl3, K2CO3; б) CaHPO4, CuSO4, CuOHCl;
в) KMnO4, FeCl2, Ca(H2PO4)2.
3. Укажите, какие из веществ, состав которых выражается ниже формулами: Cu(OH)2, Al(OH)3, FeOHCl, Zn(OH)2, Ca(OH)2, ALOHCl2
относятся к основаниям, какие – к амфотерным гидроксидам?
§ 4. Бинарные соединения, их номенклатура.
ОКСИДЫ (КЛАССИФИКАЦИЯ)
Состав бинарного соединения можно выразить общей формулой Э’mЭ»n, где атом элемента (Э») имеет отрицательную степень окисления. Названия бинарных соединений составляются из корня латинского названия электроотрицательного элемента (Э») с окончанием »ид» и русского названия элемента Э’ (Э’ – элемент с положительной степенью окисления).
Если элемент (Э’), имеющий положительную степень окисления, может находиться в различных степенях окисления, то в скобках римскими цифрами указывается окислительное число (количественное выражение степени окисления).
Примеры бинарных соединений и их названия:
NaH – гидрид натрия, СаН2 – гидрид кальция;
CaF2 –фторид кальция, NaI – иодид натрия;
CrCl3 – хлорид хрома (III), или трихлорид хрома;
Ca3N2 – нитрид кальция, СаС2 – карбид кальция;
Al4C3 – карбид алюминия, BN – нитрид бора;
SiC – карбид кремния (IV).
-7-
Кбинарным соединениям относятся оксиды, в составе которых атомы кислорода имеют С.О., равную (-2):Al2+3O3-2, Cr+6O3-2, C+4O2-2.
Названия оксидов составляют аналогично другим бинарным соединениям, например, СаО – оксид кальция, Al2O3 – оксид алюминия,
СО2 – оксид углерода (IV), CrO3 – оксид хрома (VI).
При названии оксидов можно указывать греческими числительными (моно, ди, три, тетра) число атомов кислорода, приходящееся на один атом элемента в соединении, например, MnO – монооксид марганца, СО2 – диоксид углерода, СrО3 – триоксид хрома.
По химическим свойствам оксиды делятся на следующие типы:
Основные оксиды – соединения металлов (в низших степенях окисления) с кислородом. Им соответствуют гидроксиды, являющиеся основаниями. Оксиды щелочных и щелочноземельных металлов взаимодействуют (растворяются) с водой с образованием оснований (растворимых в воде – щелочей). Например:Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Основные оксиды остальных металлов не растворяются в воде и соответствующие им гидроксиды (основания) получают из солей реакцией обмена со щёлочью. Названия основных гидроксидов определяется названием образующих их металлов:
Оксид Соответствующий ему гидроксид Название
K2O KOH Гидроксид калия
ВаО Ва(ОН)2 Гидроксид бария
Al2O3 Al(OH)3 Гидроксид алюминия
FeO Fe(OH)2 Гидроксид железа (II)
Cr2O3 Cr(OH)3 Гидроксид хрома (III)
Кислотные оксиды (или ангидриды кислот)- это такие оксиды, которым соответствуют гидроксиды – кислоты. К ним относятся оксиды неметаллов (например, СО2, SO3, P2O2) и оксиды некоторых металлов в их высших степенях окисления (например, CrO3, V2O5, Mn2O7).
Кислотные оксиды можно рассматривать как продукты дегидратации кислот (ангидриды). Например:
Кислота Ангидрид кислоты
H2C+4 O3 C+4O2
H2S+6O4 S+6O3
HN+5O3 N2+5O5
H3P+5O4 P2+5O5
Таким образом, зная формулу кислотного оксида, можно легко вывести формулу соответствующей кислоты и наоборот, зная формулу кислоты, можно написать формулу соответствующего ангидрида.
Амфотерные оксиды – такие оксиды, которые в зависимости от условий проявляют и основные, и кислотные свойства, т.е. могут взаимодействовать как с кислотами, так и с основаниями. К ним относятся оксиды цинка — ZnO, алюминия – Al2O3, хрома (III) – Cr2O3, марганца (IV) – MnO2 и др.
Оксиды основные, кислотные, амфотерные называются солеобразующими. Все они способны образовывать соли при взаимодействии с кислотами или основаниями. Есть небольшая группа оксидов, которые не способны образовывать соли. Они называются несолеобразующими, или индифферентными (NO, CO).
УПРАЖНЕНИЕ 3.
Какие из перечисленных оксидов относятся к основным? К кислотным? К амфотерным? P2O5, CaO, Na2O, Mn2O7, Ni2O3, ZnO, Al2O3, SiO2. Запишите формулы соответствующих им гидроксидов и укажите, какие из них являются основаниями, какие — кислотами, какие проявляют амфотерные свойства. Какие из перечисленных оксидов могут использоваться в качестве осушителей?
ОТВЕТ К основным оксидам относятся оксиды металлов при невысоких степенях окисления. Из приведенных оксидов основными являются: СаО, Na2O, Ni2O3, FeO.
-8-
К кислотным относятся : P2O5, Mn2O7, SiO2, т.к. P2O5 и SiO2 – это оксиды неметаллов, а Mn2O7 – оксид марганца в высшей С.О. (+7). Оксиды ZnO и Al2O3 относятся к амфотерным.
Гидроксиды Са(ОН)2, Fe(OH)2, NaOH, Ni(OH)2 – основания; гидроксиды Н3РО4, HMnO4 и H2SiO3 – кислоты; Zn(OH)2 и Al(OH)3 – имеют амфотерный характер.
В качестве осушителей могут использоваться оксиды: Р2О5, СаО, Na2O, т.к. они активно взаимодействуют с водой.
ЗАДАНИЕ 4 (для самоконтроля)
1. Какие основания соответствуют следующим оксидам : Ag2O, MgO, Cu2O, CrO?
2. Каким кислотам соответствуют следующие ангидриды:
N2O5, Cl2O7, SO2, CrO3, SiO2?
3. Какие оксиды соответствуют следующим гидроксидам
Cr(OH)3, Zn(OH)2, LiOH, Ba(OH)2?
4. Какие из приведенных оксидов ZnO, FeO, Al2O3, CaO, P2O3, Cr2O3, Mn2O7 обладают амфотерными свойствами?
5. Какие из оксидов Fe2O3, CaO, MgO, SO3, P2O5, Na2O, CO2, MnO взаимодействуют с водой?
6. Какие оксиды соответствуют следующим кислотам:
H2SO3, HNO2, HPO3, H3PO4, H2CrO4?
7. Какие из перечисленных оксидов могут использоваться в качестве осушителей: CaO, SiO2, CuO, P2O5, Fe2O3?
8. Какие из перечисленных выше оксидов (п.7) могут быть использованы для осушки углекислого газа?
9. Каждому основанию соответствует основной оксид – оксид металла. Можно ли утверждать, что всякому оксиду металла соответствует основание? Почему?
studfiles.net
Химические вещества: примеры, свойства :: SYL.ru
Элементарными частицами физической материи на нашей планете являются атомы. В свободном виде они могут существовать только при очень высоких температурах. В обычных условиях элементарные частицы стремятся к объединению между собой при помощи химических связей: ионной, металлической, ковалентной полярной или неполярной. Таким способом образуются вещества, примеры которых мы и рассмотрим в нашей статье.
Простые вещества
Процессы взаимодействия между собой атомов одного и того же химического элемента заканчиваются образованием химических веществ, называемых простыми. Так, уголь образован только атомами углерода, газ водород – атомами гидрогена, а жидкая ртуть состоит из частиц ртути. Понятие простое вещество не нужно отождествлять с понятием химического элемента. Например, углекислый газ состоит не из простых веществ углерода и кислорода, а из элементов карбона и оксигена. Условно соединения, состоящие из атомов одного и того же элемента, можно разделить на металлы и неметаллы. Рассмотрим некоторые примеры химических свойств таких простых веществ.

Металлы
Исходя из положения металлического элемента в периодической системе, можно выделить следующие группы: активные металлы, элементы главных подгрупп третьей – восьмой групп, металлы побочных подгрупп четвертой – седьмой групп, а также лантаноиды и актиноиды. Металлы – простые вещества, примеры которых мы приведем далее, имеют следующие общие свойства: тепло- и электропроводность, металлический блеск, пластичность и ковкость. Такие характеристики присущи железу, алюминию, меди и другим. С увеличением порядкового номера в периодах возрастают температуры кипения, плавления, а также твердость металлических элементов. Это объясняется сжатием их атомов, то есть уменьшением радиуса, а также накоплением электронов. Все параметры металлов обусловлены внутренним строением кристаллической решетки данных соединений. Ниже рассмотрим химические реакции, а также приведем примеры свойств веществ, относящихся к металлам.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:

Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Неметаллы
Наиболее важные неметаллические элементы находятся в подгруппах азота, карбона, а также относятся к группам галогенов и халькогенов периодической системы. Приведем примеры веществ, относящихся к неметаллам: это сера, кислород, азот, хлор. Все их физические особенности противоположны свойствам металлов. Они не проводят электрический ток, плохо пропускают тепловые лучи, имеют низкую твердость. Взаимодействуя с кислородом, неметаллы образуют сложные соединения – кислотные оксиды. Последние, реагируя с кислотами, дают кислоты:
Типичная реакция, характерная для кислотных окислов – это взаимодействие со щелочами, приводящее к появлению соли и воды.
Химическая активность неметаллов в периоде усиливается, это связано с увеличением способности их атомов притягивать электроны от других химических элементов. В группах наблюдаем обратное явление: неметаллические свойства ослабевают вследствие раздувания объема атома за счет добавления новых энергетических уровней.

Итак, мы рассмотрели виды химических веществ, примеры, иллюстрирующие их свойства, положение в периодической системе.
www.syl.ru
