|
ПОЛЕЗНЫЕ ССЫЛКИ: БОНУСЫ ИНЖЕНЕРАМ!: МЫ В СОЦ.СЕТЯХ: |
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
tehtab.ru
Таблица валентности химических элементов
Понятие валентности химических элементов
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле – мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трем, углерода – четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN2O, CO, SiO2, SO3валентность по кислороду азота равна единице, углерода – двум, кремния – четырем, серы – шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду – шести (SO3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO2. В первом из которых валентность углерода равна II, а во втором – четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
|
Порядковый номер |
Русское / англ. название |
Химический символ |
Валентность |
|
1 |
Водород / Hydrogen |
H |
I |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
I |
|
4 |
Бериллий / Beryllium |
Be |
II |
|
5 |
Бор / Boron |
B |
III |
|
6 |
Углерод / Carbon |
C |
II, IV |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV, V |
|
… |
|||
Примеры решения задач
ru.solverbook.com
Ответы@Mail.Ru: Помогите в контрольной работой.
Контрольная работа по теме: «Строение вещества».Вариант 1
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В молекуле СО2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SiO2, CaO, Na 2SO4 ; б) HClO4, CO2, NaBr; в) MgO. NaI, Cs 2O ; г) H 2O, AlCl3, RbI.
3. Дисперсная система, в которой в газовой дисперсионной среде распределены частицы жидкости, — это:
а) аэрозоль, б) пена, в) эмульсия, г) золь.
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) Nh4, б) (Nh5)2 S, в) CCl4, г) SiF4.
5.Наибольшую электроотрицательность имеет элемент:
а) азот, б) сера, в) бром, г) кислород.
6.Степень окисления -3 фосфор проявляет в соединении:
а) P2O3, б) P2O5, в) Ca3P2 г) Ca(h3PO4)2.
7.Валентность V характерна для:
а) Ca, б) P, в) O, г) Si.
8. Истинным раствором является:
а) речной ил, б) кровь, в) соляная кислота, г) молоко.
9. Молекулярную кристаллическую решётку имеет:
а) h3S, б) NaCl, в) SiO2, г) Cu.
10. Гомологом вещества, формула которого СН2=СН-СН3, является:
а) бутан, б) бутен-1, в) бутен-2, г) бутин-1.
11. Вещество, формула которого NaHS называют:
а) сульфид натрия, б) сульфат натрия, в) гидросульфид натрия, г) гидросульфат натрия.
Часть В: Задания со свободным ответом.
(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8. Назовите эти вещества.
( 5 балла)
Какой объём кислорода потребуется для полного сгорания 1 кг этилена (этена)?
( 7 баллов)
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57. Определите число связей и их тип в молекуле данного вещества.
otvet.mail.ru
Таблица валентностей химических элементов. Таблица валентности. Стандартные, высшие, низшие, редкие валентности, исключения. Максимальная валентность, минимальная валентность. Версия для печати.Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
www.dpva.ru
Валентность химических элементов. Степень окисления химических элементов.
1 / 1
Поля, отмеченные звёздочкой (*), обязательны для заполнения!
Проверьте, пожалуйста, правильность заполнения всех полей!
Введите Ф. И. О. *
1. Степень окисления серы в сульфите железа (II) *
-1
+2
0
+4
2. Значения высшей и низшей степеней окисления хлора соответственно равны *
0 и -1
+5 и -3
+7 и -1
+7 и -7
3. Одинаковую степень окисления фосфор имеет в соединениях *
Ca 3P 2 и H 3PO 4
KH 2PO 4 и KPO 3
P 4O 6 и P 4O 10
H 3PO 4 и H 3PO 3
4. Наибольшую степень окисления марганец имеет в соединении *
MnSO4
MnO2
K2MnO4
Mn2O3
5. Степень окисления хрома в его амфотерных соединениях равна *
+1
+2
+3
+6
6. Высшие степени окисления азота и алюминия соответственно равны *
+5 и +3
+5 и 0
-5 и +3
+2 и +5
7. Одинаковую степень окисления железо проявляет в соединениях: *
FeO и FeCO3
Fe(OH)3 и FeCl2
Fe2O3 и Fe(NO3)2
FeO и FePO4
8. Валентность IV и степень окисления -3 проявляет азот в соединении *
N2H4
NH3
NH4Cl
N2O5
9. Атомы азота и углерода имеют одинаковую степень окисления в соединениях *
NH3 и CO
NO2 и CCl4
N2O3 и CO2
Na3N и CH4
10. Валентность IV характерна для *
Ca
P
O
Si
webanketa.com
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA

Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
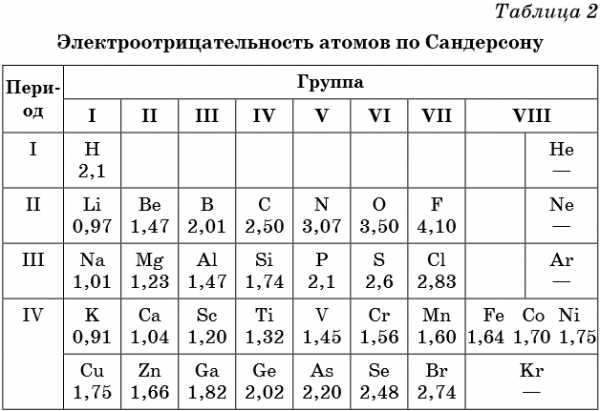

Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
himi4ka.ru
Выберите один из предложенных вариантов ответовЧисло электронов в атоме Mg (магния)равноwssl
24
20
36
12
Вода имеет кристаллическую решетку
атомную
ионную
металлическую
молекулярную
Число протонов в ядре атома Si равно
28
42
56
14
Вещества с атомной кристаллической решеткой
очень твердые и тугоплавкие
проводят электрический ток
хрупкие и легкоплавкие
имеют металлический блеск
Химические элементы расположены в порядке возрастания их атомных радиусов
N, C, B
Al, Si, P
B, C, N
Ca, Mg, Be
Какое из перечисленных веществ является простым?
сера
карборунд
хлорная известь
оксид натрия
Наименьшей электроотрицательностью обладает
Fr
Rb
Na
K
Валентность III характерна для
P
Ca
Si
O
В каком соединении атом углерода равен +2 ?
CO
Ch5
CO2
Na2CO3
Немолекулярное строение имеет
h3S
Cu
P
N2
Выберите два из предложенных вариантов ответов
Cильными электролитами являются:
HCl
NaOH
Ch4COOH
Fe(OH)3
Сложными веществами являются:
HCl
HNO3
N2
Fe
К оксидам относится группа веществ:
SO2 MgO
P2O5 CO2
PbO MgO
Zn(NO3)2 CaO
Установите соответствие
Установите соответствие между исходными веществами и продуктами реакций
| 1 | 2 | 3 |
| SnCl2+ NaNO3 | Cu(OH)2+ HCl | MnCl2 + NaOH |
выпадение осадка   -123
реакция не идет   -123
Установите соответствие между исходными веществами и продуктами реакций
| 1 | 2 | 3 |
| CuO + HCl | CuCl2 + Na3PO4 | Cu(NO3)2 + Na2S |
хлорид меди(II) + вода   -123
сульфид меди + нитрат натрия   -123
Установите соответствие степени окисления брома в соединении
+7   -123
+5   -123
Установите правильную последовательность      19
Расположите элементы в порядке уменьшения их атомного радиуса
Расположите элементы в порядке возрастания их атомного радиуса:
Расположите элементы в порядке уменьшения их атомного радиуса
Впишите в поле правильный ответ
Определить массу (г)серной кислоты (h3SO4), если известно, что количество вещества h3SO4 равно 5 моль. Ответ запишите с точностью до целых.
uecoll.ru
