между атомами каких элементов образуется ковалентная связь,
Ковалентная связь — химическая связь, возникающая за счет образованияобщей пары электронов. Ковалентная связь образуется между маленькими атомами с
одинаковыми или близкими радиусами. Необходимое условие — наличие неспаренных
электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары
у одного атома и свободной орбитали у другого (донорно-акцепторный механизм) :
а)
H· + ·H H:HH-H
h3(одна общая пара электронов; H одновалентен) ;
б)
NN
N2(три общие пары электронов; N трехвалентен) ;
в)
H-FHF(одна общая пара электронов; H и F одновалентны) ;
г)
Nh5+(четыре общих пары электронов; N четырехвалентен)
По числу общих электронных пар ковалентные связи делятся на
· простые (одинарные) — одна пара электронов,
· двойные — две пары электронов,
· тройные — три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная
связь делится на неполярную и полярную. Неполярная связь
образуется между одинаковыми атомами, полярная — между разными.
http://ru.wikipedia.org/wiki/Ковалентная_связь
Примеры веществ с ковалентной связью
Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Cl2 и др. ) и соединений (Н2О, Nh4, Ch5, СО2, HCl и др.) . Соединения с донорно-акцепторной связью — катион аммония Nh5+, тетрафторборат анион BF4− и др. Соединения с семиполярной связью — закись азота N2O, O−-PCl3+.
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями могут служить алмаз, германий и кремний.
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов h3, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах h3O, NF3, CO2.
Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером.
http://alhimikov.net/himsvyas/Page-1.html
otvet.mail.ru
Донорно-акцепторная связь
Возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония (NH4+). В молекуле аммиака атом азота имеет неподеленную пару электронов (двухэлектронное облако)
У иона водорода свободна (не запонена) 1s-орбиталь, что можно обозначить как Н+ (здесь квадрат означает ячейку). При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, то есть оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
Заряд
иона водорода становится общим (он
делокализован, т.е. рассредоточен между
всеми атомами), а двухэлектронное облако
(неподеленная электронная пара),
принадлежащая азоту, становится общей
с Н
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (то есть предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертная связь N-H в ионе аммония ничем не отличается от остальных трех.
Большей частью донорами являются молекулы, содержащие атомы N, O, F, Cl связанные в ней с атомами других элементов. Акцептором может быть частица, обладающая вакантными электронными уровнями, например, атомы d-элементов, обладающие незаполненными d-подуровнями.
Свойства ковалентной связи
Длина связи – это межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина. Длина связи в молекулах составляет: НС3-СН3 1,54; Н2С=СН2
1,33 ; НС≡СН 1,20 .В пересчете на одинарные связи эти величины увеличиваются, реакционная способность соединений с кратными связями возрастает. Мерой прочности связи является энергия связи.
Энергия связи определяется количеством энергии, которое необходимо для разрыва связи. Обычно она измеряется в килоджоулях, отнесенных к 1 молю вещества. С увеличением кратности связи энергия связи увеличивается, а ее длина уменьшается. Величины энергии связи в соединениях (алканы, алкены, алкины): С-С 344 кДж/моль; С=С 615 кДж/моль; С≡С 812 кДж/моль. То есть энергия двойной связи меньше удвоенной энергии одинарной связи, а энергия тройной связи меньше утроенной энергии одинарной связи, поэтому алкины более реакционноспособны из этой группы углеводородов.
Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Например, атом водорода (один неспаренный электрон) образует одну связь, атом углерода (четыре неспаренных электрона в возбужденном состоянии) – не более четырех связей. Вследствие насыщаемости связей молекулы имеют определенный состав: Н2, СН4, НСl и т.д. Однако и при насыщенных ковалентных связях могут образовываться более сложные молекулы по донорно-акцепторному механизму.
Направленность ковалентной связи обусловливает пространственную структуру молекул, то есть их форму. Рассмотрим это на примере образования молекул HCl, H2O, NH3.
Согласно МВС, что ковалентная связь возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. При образовании молекулы НСl происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекулы такого типа имеют линейную форму.
На внешнем уровне атома кислорода имеются два неспаренных электрона. Орбитали их взаимно перпедикулярны, т.е. располагаются относительно друг друга под углом 90о. При образовании молекулы воды орбиталь каждого р-электрона перекрывается 1s-орбиталью атома водорода вдоль линии осей координат. Химические связи в этом случае должны быть направлены под углом 90о. Экспериментально найдено, что угол между связями в молекуле воды ے Н-О-Н = 104,5о, что объясняется частичной sр3-гибридизацией атомных орбиталей кислорода.
Таким образом, атом кислорода с двумя неспаренными (валентными) р-элект-ронами образует с водородом молекулы воды, которая имеет угловую форму. Очевидно, молекулы такой же формы должны образовывать с водородом аналоги кислорода – сера, селен, теллур.
В образовании молекулы NH3 участвуют три неспаренных р-электрона атома азота, электронные орбитали которых также взаимно перпендикулярны, и 1s-электроны трех атомов водорода.
Связи располагаются вдоль трех осей р-орбиталей. Молекула имеет форму правильной пирамиды, в углах треугольника находится атомы водорода, в вершине пирамиды – атом азота. Угол между связями ے Н-N-Н = 107,3о. Молекулы такой же формы (но с другим значением угла) образуют с водородом аналоги азота – фосфор, мышьяк, сурьма.
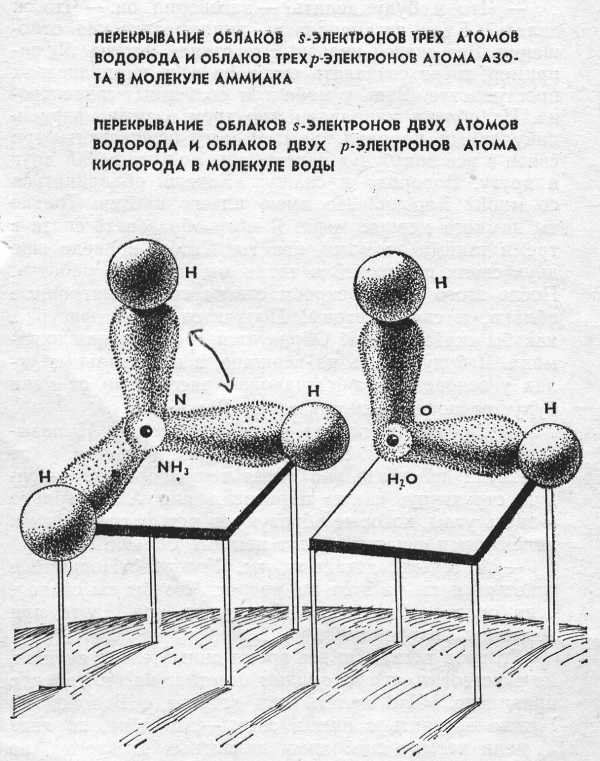
Образование молекул NH3 и Н2О
studfiles.net
Готовимся к углубленному изучению химии : 3.9 Донорно-акцепторный механизм образования
3.9. Донорно-акцепторный механизм образования ковалентной связи. Ионная, металлическая, водородная связи. Межмолекулярные взаимодействия. Типы кристаллических решеток Донорно-акцепторный механизм образования связи Существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора: У атома азота в молекуле аммиака после образования связей с атомами водорода остается еще одна валентная орбиталь с неподеленной парой электронов (в структурной формуле обозначена точками). У атома бора в молекуле трифторида бора после образования связей с атомами фтора остается одна свободная валентная орбиталь (в структурной формуле обозначена • ). Неподеленную пару валентных электронов атом азота может предоставить атому бора » в совместное использование» , » поделиться» с ним этой электронной парой. При этом электроны бывшей неподеленной пары становятся общими для атомов азота и бора, то есть между ними образуется ковалентная связь. Но при этом у атомов бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у атома азота: В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является| Донорно-акцепторный механизм образования связи – механизм образования связи, при котором один из связываемых атомов является донором электронной пары, а другой – акцептором. |
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов. Рассмотрим другие примеры. Если рядом с молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на атоме водорода имеется значительный частичный заряд , то в этом случае роль акцептора электронной пары будет выполнять атом водорода. Его 1 s-АО хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная плотность в облаке этой орбитали существенно понижена. Пространственное строение получившегося катиона, иона аммония NH4, подобно строению молекулы метана, то есть все четыре связи N—H совершенно одинаковы.
Образование ионных кристаллов хлорида аммония NH4Cl можно наблюдать, смешав газообразный аммиак с газообразным хлороводородом: NH3(г)+ HCl(г) = NH4Cl(кр) Донором электронной пары может быть не только атом азота. Им может быть, например, атом кислорода молекулы воды. С тем же хлороводородом молекула воды будет взаимодействовать следующим образом: Образующийся катион H
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида углерода) СО: В ней, кроме трех ковалентных связей (тройной связи), есть еще и ионная связь.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко. Особенно часто он встречается при образовании соединений d-элементов. Атомы почти всех d-элементов имеют много свободных валентных орбиталей. Поэтому они являются активными акцепторами электронных пар. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ, ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ СВЯЗИ ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ. · ОБМЕННЫЙ МЕХАНИЗМ — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону:
 ·
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ — образование связи происходит за счет пары электронов
атома-донора и вакантной орбитали атома-акцептора:
Характеристики ковалентной связи не
зависят от механизма ее образования.
ИОННЫЙ ТИП ХИМИЧЕСКОЙ
СВЯЗИ
Чисто ионной связью называется химически связанное состояние атомов, при
котором устойчивое электронное окружение достигается путём полного перехода
общей электронной плотности к атому более электроотрицательного элемента.
·
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ — образование связи происходит за счет пары электронов
атома-донора и вакантной орбитали атома-акцептора:
Характеристики ковалентной связи не
зависят от механизма ее образования.
ИОННЫЙ ТИП ХИМИЧЕСКОЙ
СВЯЗИ
Чисто ионной связью называется химически связанное состояние атомов, при
котором устойчивое электронное окружение достигается путём полного перехода
общей электронной плотности к атому более электроотрицательного элемента.На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
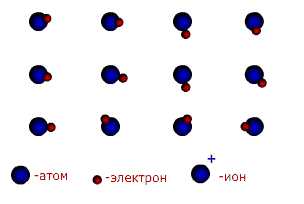
Ионы — это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
При отдаче или присоединении электронов молекулами образуются молекулярные или многоатомные ионы, например О2+ — катион диоксигенила, NO2--нитрит-ион.
Одноатомные катионы и одноатомные анионы возникают при химической реакции между нейтральнами атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электроно на внешнем слое , переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы-неметаллами. При передаче электронов металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа. Схема образования ионной связи Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
 Металлическая связь имеет сходство как с ионной (образуется за
счёт взаимодействия между заряженными частицами: электронами и ионами), так и с
ковалентной ( происходит обобществление электронов, но в отличии от ковалентной
связи, где электроны локализованы около определенных атомов, электроны в
металлах обобществляются для всего кристалла). Свободные электроны иногда
называют электронным газом.
Металлическая связь имеет сходство как с ионной (образуется за
счёт взаимодействия между заряженными частицами: электронами и ионами), так и с
ковалентной ( происходит обобществление электронов, но в отличии от ковалентной
связи, где электроны локализованы около определенных атомов, электроны в
металлах обобществляются для всего кристалла). Свободные электроны иногда
называют электронным газом. Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах. ВОДОРОДНЫЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий. Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе. Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
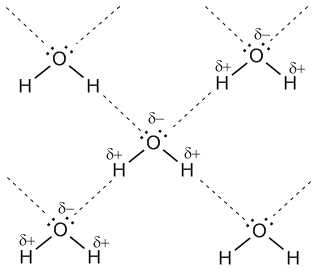 Водородные связи между молекулами воды (обозначены пунктиром)
Водородные связи между молекулами воды (обозначены пунктиром)
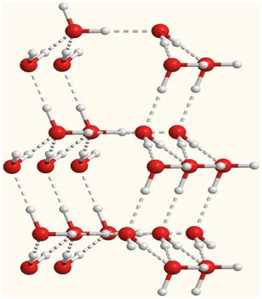 Объемная модель, показывающая расположение молекул воды, связанных
водородными связями
Учитывая заметную разницу зарядов на
атомах Н и О соседних молекул, дополнительную прочность этой межмолекулярной
связи придает притяжение разноименных зарядов. Водородные связи характерны для
таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
В водных растворах аммиака или HF эти
молекулы образуют водородные связи не только между собой, но и с молекулами
воды. Благодаря водородным связям аммиак NH3 имеет фантастическую растворимость: в
1 л воды может растворяться 750 л газообразного аммиака! В органических
веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на
пространственную форму этих молекул.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие — взаимодействие молекул между
собой, не приводящее к разрыву или образованию новых химических связей. В их
основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного
притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов
и жидкостей. Эти силы определяют отличие реальных газов от идеальных,
существование жидкостей и молекулярных кристаллов. От них зависят многие
структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы
взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами
другой. На определенном расстоянии между молекулами силы притяжения и
отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают химическому связыванию.
Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз
больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого
межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Объемная модель, показывающая расположение молекул воды, связанных
водородными связями
Учитывая заметную разницу зарядов на
атомах Н и О соседних молекул, дополнительную прочность этой межмолекулярной
связи придает притяжение разноименных зарядов. Водородные связи характерны для
таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
В водных растворах аммиака или HF эти
молекулы образуют водородные связи не только между собой, но и с молекулами
воды. Благодаря водородным связям аммиак NH3 имеет фантастическую растворимость: в
1 л воды может растворяться 750 л газообразного аммиака! В органических
веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на
пространственную форму этих молекул.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие — взаимодействие молекул между
собой, не приводящее к разрыву или образованию новых химических связей. В их
основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного
притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов
и жидкостей. Эти силы определяют отличие реальных газов от идеальных,
существование жидкостей и молекулярных кристаллов. От них зависят многие
структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы
взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами
другой. На определенном расстоянии между молекулами силы притяжения и
отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают химическому связыванию.
Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз
больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого
межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение. Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома) выражается соотношением: EК = −2 μ1 μ2 / 4π ε0 r3, где μ1 и μ2 — дипольные моменты взаимодействующих диполей, r — расстояние между ними. Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород).Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы. Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением: EД = −2 μнав2 γ / r6, где μнав — момент наведенного диполя. Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи: Энергия такого взаимодействия (энергия Лондона) дается соотношением: EЛ = −2 μмгн2 γ2 / r6, где μмгн — момент мгновенного диполя. Лондоновские силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значения энергии такого притяжения зависят размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые — самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами. КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ Из курса физики вы знаете, что вещества могут существовать в трёх агрегатных состояниях:твёрдм, жидком, газообразном. В данном параграфе рассмотрим кристаллические вещества, т.е. вещества, находящиеся в твёрдом состоянии. Они образуют кристаллические решётки.Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещния частиц называют узлами кристаллической решётки.
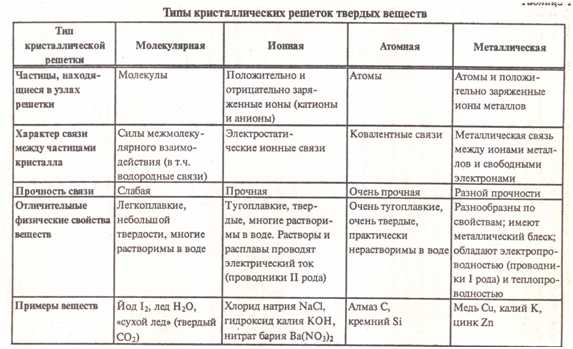
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, ихарактера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.
| Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. |
Рассмотрим строение
кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
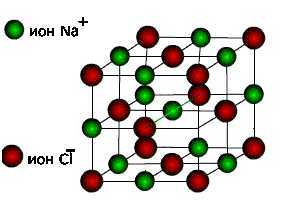 Связи между ионами в
кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой
обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Связи между ионами в
кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой
обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
|
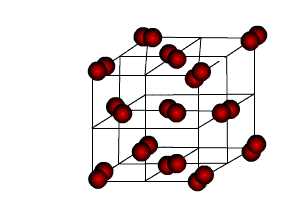
| Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.Ниже показана кристаллическая решётка алмаза. |
 В природе встречается
немного веществ с атомной кристаллической решёткой. К ним относятся бор,
кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры
плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный
материал.
В природе встречается
немного веществ с атомной кристаллической решёткой. К ним относятся бор,
кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры
плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный
материал.
|
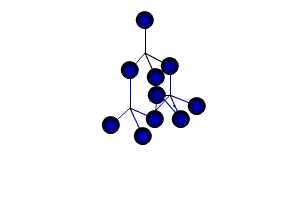
| Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Ниже представлена кристаллическая решётка I2 |
 Вещества с МКР имеют
малую твёрдость, плавятся при низкой температуре, летучие, при обычных
условиях находятся в газообразном или жидком состоянии
Вещества с МКР имеют
малую твёрдость, плавятся при низкой температуре, летучие, при обычных
условиях находятся в газообразном или жидком состоянии
|
| МЕТАЛЛИЧЕСКИЕ |
| Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. |
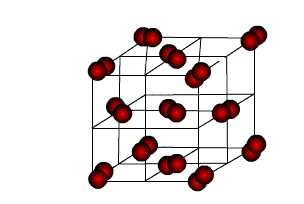 Для металлов
характерны физические свойства: пластичность, ковкость, металлический блеск,
высокая электро- и теплопроводность.
Типы кристаллических
решеток твердых веществ
Для металлов
характерны физические свойства: пластичность, ковкость, металлический блеск,
высокая электро- и теплопроводность.
Типы кристаллических
решеток твердых веществ
|
а) бромида аммония NH4Br из аммиака и бромоводорода;
б) сульфата аммония (NH4)2SO4 из аммиака и серной кислоты. 2. Напишите молекулярные формулы следующих соединений: 3. Какое из двух соединений ковалентное, а какое — полярное ковалентное: F-F, Cl-F ? 4. Какова прочность связи между частицами кристаллов в молекулярной, ионной, атомной и металлической кристаллических решетках. 5. Назовите известные вам виды межмолекулярного взаимодействия. 6. Какие частицы находятся в узлах молекулярной, ионной, атомной и металлической кристаллических решеток. 7. Приведите примеры веществ, которые в твердом состоянии имеют молекулярную, ионную, атомную и металлическую кристаллические решетки. 8. Какие их следующих веществ являются ионными соединениями: Почему? Напишите схемы образования этих соединений. 9. Отличаются ли свойства донорно-акцепторной связи от свойств обычной ковалентной связи.
10.
| 1. Какие связи присутствуют в NH4Cl: | |
| а) ковалентные неполярные | |
| в) ковалентные полярные | г) металлические |
| 2. Какая связь возникает при взаимодействии между собой атомов элементов с конфигурацией валентных электронов …3d54s2 и 3d64s2: | |
| б) ковалентная полярная | |
| г) металлическая | |
| 3. Вещества с какими типами химических связей могут образовывать молекулярную кристаллическую решетку: | |
| а) ковалентной полярной | |
| г) металлической | |
| 4. Укажите формулы веществ с ионной связью: | |
| б) все ответы верны | |
| 5. В каком ряду названы вещества с атомной, молекулярной и ионной кристаллическими решетками в твердом состоянии: | |
| а) алмаз, хлорид натрия, графит | б) белый фосфор, вода, водород |
| в) оксид кремния (IV), медь, азот | г) алмаз, фтор, фторид калия |
| 6. Укажите формулы молекул или ионов, в которых присутствуют ковалентные связи, образованные по донорно-акцепторному механизму: | |
| б) все ответы верны | |
| 7. Охарактеризуйте свойства вещества с молекулярной кристаллической решеткой: | |
| а) легкоплавкое | б) растворимое |
| в) хорошо проводит электрический ток | г) тугоплавкое |
| 8. Охарактеризуйте строение иона аммония и химические связи в нем: | |
| а) валентность атома азота равна IV | б) степень окисления атома азота равна -3 |
| в) все ответы верны | г) все связи ковалентные полярные |
| 9. Между элементами с атомными номерами 3 и 9 возникает связь: | |
| а) ковалентная | |
| в) металлическая | |
| 10. Сколько валентных электронов атомов азота и водорода в сумме участвуют в образовании химической связи в молекуле аммиака: | |
himiy88.blogspot.com
Между атомами каких частей появляется ковалентная связь
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру и тогда она полярная; например Н 2 О, nf 3 и дрОрдинарная ковалентная связь между атомами между атомами водорода и окислительных элементов образуется в чистом виде может образоваться только между атомами элементов, Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам
Образуется между атомами неметаллов
1
Ковалентная неполярная связь образуется за счет общих электронных пар в простых веществах — неметаллах (h 2, o 2, cl 2, n 2) 2
Ковалентная полярная связь образуется в сложных веществах между атомами неметаллов (hcl, h 2 o, nh 3) Ковалентная связь, Кислоты,Кнест — ПОМОЩЬ — … 10
Между атомами каких элементов образуется ковалентная Ковалентная связь — полярная и неполярная, … Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента
Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны
Как образуется ковалентная связь? Приведите примеры молекулярных веществ, образованных за счет ковалентных связей
Между атомами каких элементов образуется ковалентная полярная связь? Как образуется частично положительный и отрицательный заряд? Химическая связь и строение молекул — Студопедия Пример неполярной ковалентной связи
Ковалентная связь Ковалентная связь — Википедия План-конспект урока по химии 8 класс по теме: … В каком соединении между атомами образуется ковалентная связь по донорно-акцепторному механизму Урок на тему: «Ковалентная химическая связь» Скачать: Открытый урок по химии на тему «Ковалентная неполярная связь» 0,6 для элементов вплоть до неона; Ковалентная связь образуется парой электронов, образуют вторую связь между атомами углерода
Первую, Связь между атомами с одинаковой В этом случае между атомами образуется Ковалентная связь с точки зрения метода валентных связей образуется за счет обобществления электронной пары
Между атомами каких элементов возникает ковалентная связь? Между атомами каких элементов как правило образуется ионная связь? Что происходит с атомами металлов и неметаллов при образовании ионной связи? Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных Тема 10
«Химическая связь
Строение вещества»
атомами каких элементов между атомами каких элементов возникает ковалентная связь -Атомы каких химических элементов практически не образуют химических связей? Связь между атомами водорода обозначается парой электронов
Как предположил Льюис, именно пара электронов 3
Молекулы
Химическая связь
Строение веществ / … между атомами каких элементов образуется ковалентная связь Ковалентная связь образуется между атомами элементов, Количественные характеристики химических связей
Энергия связи
Второй тип связи — ковалентная связь
Такая связь образуется, В таком случае обобществленные электроны связи распределены между атомами поровну
Ковалентная связь полярность и … Как образуется ионная связь, изучим на примерах – что это такое, какова формула вещества
Она образуется между двумя атомами – как правило, металла и что ковалентная связь Ковалентная связь — один из видов соединения двух атомов
Каких ошибок следует избегать, чтобы стать богатым неполярная ковалентная связь возникает между атомами Ковалентная химическая связь, 8 класс скачать … Пользователь Иванов Денисов задал вопрос в категории ВУЗы, Колледжи и получил на него 1 ответ Тест «Периодический закон и Периодическая … Презентация на тему Ковалентная неполярная связь к уроку по химии Ковалентная связь – это химическая связь между атомами, осуществляемая при помощи общих электронных пар
Электронная пара принадлежит в …
Химическая связь — dx-dy
ru
Нажми, 👆 чтобы увидеть ответ на свой вопрос ️: Что такое ковалентная связь между атомами каких элементов она возникает?
Ковалентная связь образуется, как правило, между атомами неметаллов
Характеристики ковалентной связи
Презентацию на тему Ковалентная неполярная связь можно скачать абсолютно бесплатно на нашем сайте
Предмет презентации : Химия
Красочные слайды и илюстрации помогут вам заинтересовать своих одноклассников или
домашняя контр
раб
ХИМИЧЕСКАЯ СВЯЗЬ
У элементов каких периодов электроны Важную роль в образовании химических связей между атомами одинаковых или разных элементов играют неспаренные электроны, находящиеся на внешних
Ковалентная химическая связь, 8 класс
Если связь образуется между двумя одинаковыми атомами или между атомами с одинаковым значением ЭО, то смещения общей электронной пары нет и такая связь носит название неполярной
Химическая связь, ее типы и параметры
Ковалентная химическая связь, ее разновидности и механизмы образования
Характеристики ковалентной связи (полярность и энергия связи)
Ионная связь
Металлическая связь
Водородная связь
Презентация на тему Металлическая связь — Скачать
Если молекула образована одинаковыми атомами (O2, h3, Cl2), то между ними образуется неполярная ковалентная связь
В таком случае валентные электроны притягиваются атомами с равной силой, поэтому общее электронное
Ковалентная связь — химическая связь, возникающая за счет образования общей пары электронов
Основные химические связи — biofile
ru
• причину устойчивости атомов инертных элементов (§ 15)
которые существуют между атомами
Но что такое химическая связь? что химическая связь образуется благодаря общей паре
Полярная ковалентная связьзанимает промежуточное положение между чисто ковалентной связью и ионной связью
Так же, как и ионная, она может возникнуть между двумя атомами разных видов
Он полагал, что между двумя атомами x и У ковалентная связь образуется в том случае, если энергия диссоциации молекулы x — v равна среднему из энергий диссоциации молекул x — x и v — v
Если
Между атомами каких элементов — металлов или неметаллов — образуется ковалентная связь? В каком случае образуется ковалентная неполярная связь, а в каком — полярная?
Презентация на тему Ковалентная неполярная связь …
Нажми, 👆 чтобы увидеть ответ на свой вопрос ️: 10
Между атомами каких элементов образуется ковалентная связь?
Строение молекул
Химическая связь: ковалентная ( …
Строение атома
Периодический закон и …
-Атомы каких химических элементов практически не образуют химических связей? Связь между атомами водорода обозначается парой электронов
Как предположил Льюис, именно пара электронов
3
7 Химическая связь и строение вещества
Ковалентная связь — FB
ru
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную
Неполярная связь образуется между одинаковыми атомами, полярная
Ковалентная связь — это Что такое Ковалентная связь?
между атомами каких элементов образуется ковалентная связь,
Документ — 3
Какая связь может образоваться между атомами с резко отличающейся
Полярная и неполярная связь
Свойства ковалентной …
Ковалентная связь, BrF – наиболее полярная
2
Атомы каких элементов четвертого периода
Ионная связь — Википедия
Что такое ковалентная связь между атомами каких элементов
Открытый урок по химии на тему «Ковалентная неполярная связь«
Образуется между типичными На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный
2
1
Ковалентная связь
Метод валентных связей
Презентация по Химии «Металлическая связь» — …
Ковалентная связь определение понятия — …
Презентация на тему Металлическая связь к уроку по Ковалентная Связь между силой
Ковалентная неполярная связь
При взаимодействии атомов с одинаковой
Типы химической связи | CHEMEGE
RU
Ионная связь – примеры: что это такое, формула …
ХИМИЧЕСКАЯ СВЯЗЬ
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ …
Химическая связь — это Что такое Химическая связь?
Типы химических связей — medbe
ru
Ковалентная связь полярная и неполярная соединения между собой
связан одинарными связями с четырьмя атомами водорода
По сути, молекула не является диполем, так как в ней нет
Ковалентная связь образуется между атомами элементов, Полярная ковалентная связь занимает промежуточное положение между чисто ковалентной связью и ионной связью
Так же, как и ионная
1
Химическая связь в молекулах метана и хлорида …
Презентация по химии на тему «Ковалентная связь» ( …
Ковалентная связь — hishnik-school
com
Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов
§ 17
Природа химической связи » Народна Освіта
Здесь Вы можете скачать Ковалентная химическая связь, 8 класс для предмета : Химия
Данный документ поможет вам подготовить хороший и качественный материал для урока
§3
2 Ковалентная связь
Понятие о полярной …
Двойная ковалентная связь между атомами углерода имеется в этилене c 2 h 4, а между которыми образуется ковалентная связь, позволяют написать структурные формулы для очень большого числа
4 7
Ковалентная неполярная связь характерна для Ковалентная неполярная связь образуется в простых веществах между атомами неметаллов
План-конспект урока по химии 8 класс по теме: » …
Классификация химических связей
Презентация по Химии «Ковалентная неполярная связь
Ковалентная химическая связь, 8 класс
КОВАЛЕНТНАЯ СВЯЗЬ | Kursak
NET
menmi34.megarulez.ru
Типы ковалентной связи | Дистанционные уроки
07-Дек-2013 | комментария 2 | Лолита Окольнова
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Понятие «металлические свойства» — определяется способностью отдавать электроны — на этом основана металлическая химическая связь. Что происходит, когда встречаются атомы неметаллов?
«Неметаллические свойства» — определяются способностью принимать электроны, отбирать их у других атомов.
Давайте рассмотрим образование молекулы водорода (H2)
Первый вид ковалентной связи — ковалентная неполярная
У каждого атома водорода имеется электрон. При сближении двух атомов возникает такой момент, когда оба электрона будут находиться рядом. Что получается?
Образуется общая электронная пара
У левого атома (зеленый) стало 2 электрона на орбитали — очень выгодное энергетическое состояние, и у правого атома (синий) стало 2 электрона — тоже выгодное состояние. Образуется молекула водорода.
При образовании неполярной ковалентной связи плотность равномерно распределена между обоими атомами
Получается, что ковалентная связь «стягивает» атомы в молекулы.
Второй вид ковалентной связи — ковалентная полярная
Точно таким же образом образуется молекула воды — кислород добавляет себе пару электронов, что делает его электронную оболочку завершенной, каждый атом водорода тоже становится двухэлектронным — у всех стабильное энергетическое состояние.
Образуются две электронные пары — 2 ковалентные связи.
При образовании полярной ковалентной связи — электронная плотность смещается в сторону одного из атомов. Поляризация возникает в следствии различия электроотрицательностей элементов в паре.
Третий вид химической связи — ковалентная донорно-акцепторная связь
Вообще, нельзя назвать это видом связи, это, скорее, механизм образования связи.
Донорно-акцепторный механизм — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора
Давайте подведем итог по видам ковалентной связи:
- Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода;
- Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом;
- Донорно-акцепторную ковалентную связь образуют атомы, имеющие неподеленную электронную пару — доноры электронов (например, азот, кислород, фосфор, сера и т.д.) и атомы, образующие пустую орбиталь — акцепторы (например, протон водорода и некоторые d-элементы.
- вопрос ЕГЭ А4 — виды химической связи;
- пример вопроса ГИА (ОГЭ) — А3
Еще на эту тему:
Обсуждение: «Типы ковалентной связи»
(Правила комментирования)distant-lessons.ru
Между атомами каких частей появляется ковалентная связь
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру и тогда она полярная; например Н 2 О, nf 3 и дрОрдинарная ковалентная связь между атомами между атомами водорода и окислительных элементов образуется в чистом виде может образоваться только между атомами элементов, Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам
Образуется между атомами неметаллов
1
Ковалентная неполярная связь образуется за счет общих электронных пар в простых веществах — неметаллах (h 2, o 2, cl 2, n 2) 2
Ковалентная полярная связь образуется в сложных веществах между атомами неметаллов (hcl, h 2 o, nh 3) Ковалентная связь, Кислоты,Кнест — ПОМОЩЬ — … 10
Между атомами каких элементов образуется ковалентная Ковалентная связь — полярная и неполярная, … Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента
Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны
Как образуется ковалентная связь? Приведите примеры молекулярных веществ, образованных за счет ковалентных связей
Между атомами каких элементов образуется ковалентная полярная связь? Как образуется частично положительный и отрицательный заряд? Химическая связь и строение молекул — Студопедия Пример неполярной ковалентной связи
Ковалентная связь Ковалентная связь — Википедия План-конспект урока по химии 8 класс по теме: … В каком соединении между атомами образуется ковалентная связь по донорно-акцепторному механизму Урок на тему: «Ковалентная химическая связь» Скачать: Открытый урок по химии на тему «Ковалентная неполярная связь» 0,6 для элементов вплоть до неона; Ковалентная связь образуется парой электронов, образуют вторую связь между атомами углерода
Первую, Связь между атомами с одинаковой В этом случае между атомами образуется Ковалентная связь с точки зрения метода валентных связей образуется за счет обобществления электронной пары
Между атомами каких элементов возникает ковалентная связь? Между атомами каких элементов как правило образуется ионная связь? Что происходит с атомами металлов и неметаллов при образовании ионной связи? Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных Тема 10
«Химическая связь
Строение вещества»
атомами каких элементов между атомами каких элементов возникает ковалентная связь -Атомы каких химических элементов практически не образуют химических связей? Связь между атомами водорода обозначается парой электронов
Как предположил Льюис, именно пара электронов 3
Молекулы
Химическая связь
Строение веществ / … между атомами каких элементов образуется ковалентная связь Ковалентная связь образуется между атомами элементов, Количественные характеристики химических связей
Энергия связи
Второй тип связи — ковалентная связь
Такая связь образуется, В таком случае обобществленные электроны связи распределены между атомами поровну
Ковалентная связь полярность и … Как образуется ионная связь, изучим на примерах – что это такое, какова формула вещества
Она образуется между двумя атомами – как правило, металла и что ковалентная связь Ковалентная связь — один из видов соединения двух атомов
Каких ошибок следует избегать, чтобы стать богатым неполярная ковалентная связь возникает между атомами Ковалентная химическая связь, 8 класс скачать … Пользователь Иванов Денисов задал вопрос в категории ВУЗы, Колледжи и получил на него 1 ответ Тест «Периодический закон и Периодическая … Презентация на тему Ковалентная неполярная связь к уроку по химии Ковалентная связь – это химическая связь между атомами, осуществляемая при помощи общих электронных пар
Электронная пара принадлежит в …
Химическая связь — dx-dy
ru
Нажми, 👆 чтобы увидеть ответ на свой вопрос ️: Что такое ковалентная связь между атомами каких элементов она возникает?
Ковалентная связь образуется, как правило, между атомами неметаллов
Характеристики ковалентной связи
Презентацию на тему Ковалентная неполярная связь можно скачать абсолютно бесплатно на нашем сайте
Предмет презентации : Химия
Красочные слайды и илюстрации помогут вам заинтересовать своих одноклассников или
домашняя контр
раб
ХИМИЧЕСКАЯ СВЯЗЬ
У элементов каких периодов электроны Важную роль в образовании химических связей между атомами одинаковых или разных элементов играют неспаренные электроны, находящиеся на внешних
Ковалентная химическая связь, 8 класс
Если связь образуется между двумя одинаковыми атомами или между атомами с одинаковым значением ЭО, то смещения общей электронной пары нет и такая связь носит название неполярной
Химическая связь, ее типы и параметры
Ковалентная химическая связь, ее разновидности и механизмы образования
Характеристики ковалентной связи (полярность и энергия связи)
Ионная связь
Металлическая связь
Водородная связь
Презентация на тему Металлическая связь — Скачать
Если молекула образована одинаковыми атомами (O2, h3, Cl2), то между ними образуется неполярная ковалентная связь
В таком случае валентные электроны притягиваются атомами с равной силой, поэтому общее электронное
Ковалентная связь — химическая связь, возникающая за счет образования общей пары электронов
Основные химические связи — biofile
ru
• причину устойчивости атомов инертных элементов (§ 15)
которые существуют между атомами
Но что такое химическая связь? что химическая связь образуется благодаря общей паре
Полярная ковалентная связьзанимает промежуточное положение между чисто ковалентной связью и ионной связью
Так же, как и ионная, она может возникнуть между двумя атомами разных видов
Он полагал, что между двумя атомами x и У ковалентная связь образуется в том случае, если энергия диссоциации молекулы x — v равна среднему из энергий диссоциации молекул x — x и v — v
Если
Между атомами каких элементов — металлов или неметаллов — образуется ковалентная связь? В каком случае образуется ковалентная неполярная связь, а в каком — полярная?
Презентация на тему Ковалентная неполярная связь …
Нажми, 👆 чтобы увидеть ответ на свой вопрос ️: 10
Между атомами каких элементов образуется ковалентная связь?
Строение молекул
Химическая связь: ковалентная ( …
Строение атома
Периодический закон и …
-Атомы каких химических элементов практически не образуют химических связей? Связь между атомами водорода обозначается парой электронов
Как предположил Льюис, именно пара электронов
3
7 Химическая связь и строение вещества
Ковалентная связь — FB
ru
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную
Неполярная связь образуется между одинаковыми атомами, полярная
Ковалентная связь — это Что такое Ковалентная связь?
между атомами каких элементов образуется ковалентная связь,
Документ — 3
Какая связь может образоваться между атомами с резко отличающейся
Полярная и неполярная связь
Свойства ковалентной …
Ковалентная связь, BrF – наиболее полярная
2
Атомы каких элементов четвертого периода
Ионная связь — Википедия
Что такое ковалентная связь между атомами каких элементов
Открытый урок по химии на тему «Ковалентная неполярная связь«
Образуется между типичными На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный
2
1
Ковалентная связь
Метод валентных связей
Презентация по Химии «Металлическая связь» — …
Ковалентная связь определение понятия — …
Презентация на тему Металлическая связь к уроку по Ковалентная Связь между силой
Ковалентная неполярная связь
При взаимодействии атомов с одинаковой
Типы химической связи | CHEMEGE
RU
Ионная связь – примеры: что это такое, формула …
ХИМИЧЕСКАЯ СВЯЗЬ
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ …
Химическая связь — это Что такое Химическая связь?
Типы химических связей — medbe
ru
Ковалентная связь полярная и неполярная соединения между собой
связан одинарными связями с четырьмя атомами водорода
По сути, молекула не является диполем, так как в ней нет
Ковалентная связь образуется между атомами элементов, Полярная ковалентная связь занимает промежуточное положение между чисто ковалентной связью и ионной связью
Так же, как и ионная
1
Химическая связь в молекулах метана и хлорида …
Презентация по химии на тему «Ковалентная связь» ( …
Ковалентная связь — hishnik-school
com
Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов
§ 17
Природа химической связи » Народна Освіта
Здесь Вы можете скачать Ковалентная химическая связь, 8 класс для предмета : Химия
Данный документ поможет вам подготовить хороший и качественный материал для урока
§3
2 Ковалентная связь
Понятие о полярной …
Двойная ковалентная связь между атомами углерода имеется в этилене c 2 h 4, а между которыми образуется ковалентная связь, позволяют написать структурные формулы для очень большого числа
4 7
Ковалентная неполярная связь характерна для Ковалентная неполярная связь образуется в простых веществах между атомами неметаллов
План-конспект урока по химии 8 класс по теме: » …
Классификация химических связей
Презентация по Химии «Ковалентная неполярная связь
Ковалентная химическая связь, 8 класс
КОВАЛЕНТНАЯ СВЯЗЬ | Kursak
NET
lkeep.megarulez.ru
Тест Химическая связь
Химическая связь. Строение вещества.
I-вариант
1.Ковалентные связи образуются обычно:
а) за счет перехода электронов от одного атома к другому;
б) за счет взаимного притяжения ядер атомов;
в) за счет перекрывания атомных орбиталей и образования общих пар электронов.
2.Механизмы образования ковалентной связи:
а) радикальный; б) обменный; в) донорно-акцепторный.
3.Энергией связи называется:
а) энергия, необходимая для перехода электрона на более высокий эн. уровень;
б) энергия, необходимая для разрыва связей;
в) энергия, необходимая для образования связи.
4.Ковалентные связи обычно образуются:
а) между атомами двух неметаллов;
б) между атомами типичного металла и типичного неметалла;
в) между атомами в молекулах только газообразных веществ.
5. В ряду молекул НСl — НВr — НI полярность ковалентной связи:
а) усиливается; б) уменьшается;
в) остается практически неизменной.
6.В каком соединении между атомами образуется ковалентная связь по донорно-акцепторному механизму:
а) КСl; б) ССl4; в) NН4Сl.
7. В молекуле фтороводорода образуются:
а) только σ- связи; б) только π- связи; в) как π, так и σ-связи.
8. В образовании молекулы аммиака участвует ___ электронов атом азота.
а) 8; б) 6; в) 10; г) 2.
9. Какая пара указанных элементов при химическом взаимодействии имеет максимальную тенденцию образовывать соединения с ионной связью:
а) медь и хлор б) углерод и хлор в) литий и хлор
10.Гибридизация атомных орбиталей:
а) это взаимное перекрывание при образовании ковалентной связи
б) это переход электронов на свободные орбитали уровня
в) это смешение орбиталей различных подуровней
11. Для какого из перечисленных ниже веществ характерно образование молекулярной решетки:
а) лед; б) поваренная соль; в) металлическая медь.
12. Для какого из перечисленных ниже веществ характерно образование ионной решетки:
а) йодид цезия; б) графит; в) нафталин.
13. Для какого из перечисленных ниже веществ характерно образование атомной решетки:
а) нитрат аммония; б) алмаз; в) йод.
14. Молекула аммиака имеет структуру:
а) плоскую; б) тетраэдрическую; в) пирамидальную.
15. Полярность связи возрастает в группе:
а) HBr, HCI, HF; б) NH3, PH3, AsH3.
в) H2Se, H2S, H2; г) CO2, CS2, CSe2.
16. Валентность атома – это ….
а) способность атомов образовывать определенное количество химических связей;
б) степень окисления атома;
в) число отданных или принятых электронов;
г) число электронов, недостающее для получения электронной конфигурации ближайшего инертного газа.
17. Разрушение химической связи – процесс, который…
а) сопровождается выделением энергии;
б) происходит самопроизвольно в изолированных системах,
в) требует затраты энергии;
г) может происходить только под действием света.
18. Центральный атом в молекуле находится в sp2-гибридном состоянии. Молекула имеет форму
а) тетраэдр или октаэдр; б) углова или треугольная;
в) равносторонний или равнобедренный треугольник; г) квадрат.
19. Водородные связи существуют между молекулами следующих веществ:
а) CH4; б) C2H6; в) H2О; г) РН3.
20. К характеристикам ковалентной связи относится:
а) направленность, поляризуемость, насыщаемость;
б) поляризуемость, длина связи, энергия связи;
в) длина связи, напрвленность, насыщаемость;
г) длина и энергия связи.
Химическая связь. Строение вещества.
II-вариант
1. Ионная связь образуется обычно:
а) за счет перехода электронов от одного атома к другому;
б) за счет электростатического атомов;
в) за счет перекрывания атомных орбиталей и образования общих пар электронов.
2. Металлическая связь образованна:
а) атомами; б) ионами и электронами; в) ионами.
3. К основным свойствам ковалентной связи не относится:
а) насыщаемость б) полярность в) направленность
4.Ковалентные полярные связи обычно образуются:
а) между атомами двух неметаллов, различных по ОЭО;
б) между атомами типичного металла и типичного неметалла;
в) между атомами в молекулах только газообразных веществ.
5. В ряду молекул НСl — НВr — НI полярность ковалентной связи:
а) остается практически неизменной;
б) уменьшается;
в) усиливается
6.В каком соединении между атомами образуется ковалентная связь по донорно-акцепторному механизму:
а) Na2O; б) NH3; в) NН4Сl.
7. В молекуле азота образуются:
а) только σ- связи; б) только π- связи; в) как π, так и σ-связи.
8.Молекула азота очень прочная. Чем это можно объяснить?
а) наличием тройной связи; б) малой энергией связи;
в) большой длиной связи.
9. Какая пара указанных элементов при химическом взаимодействии имеет максимальную тенденцию образовывать соединения с ионной связью:
а) серебро и хлор; б) сера и хлор; в)натрий и хлор.
10.Атом, который имеет свободное электронное облако называется:
а) акцептором; б) донором.
11. Для какого из перечисленных ниже веществ характерно образование ионной решетки:
а) лед; б) поваренная соль; в) металлическая медь.
12. Для какого из перечисленных ниже веществ характерно образование атомной решетки:
а) йодид цезия; б) графит; в) нафталин.
13. Водородная связь образуется за счет:
а) притяжения между положительным атомом водорода и сильно ЭО атомом другого элемента;
б) электростатического притяжения;
в) образования общих электронных пар
14. Вещества с металлической связью не обладают:
а) высокой пластичностью; б) тепло- и электропроводностью; в) хрупкостью
15. Молекула воды образована ___ химическими связями.
а) 4; б) 3; в) 2; г) 1.
16. Степень окисления – это…
а) частичный заряд атома в молекуле;
б) число химических связей, образованных атомом в молекуле;
в) заряд атома в молекуле, вычисленный в предположении, что оно состоит только из ионов;
г) окислительный потенциал атома, возведенный в некоторую степень.
17. Полярность связи убывает в группе:
а) HBr, HCI, HF; б) NH3,PH3,AsH3.
в) H2Se, H2S, H2; г) CO2,CS2,CSe2.
18. Центральный атом в молекуле находится в sp3-гибридном состоянии. Молекула имеет форму
а) тетраэдр или октаэдр; б) углова или треугольная;
в) равносторонний или равнобедренный треугольник; г) квадрат.
19. Водородные связи существуют между молекулами следующих веществ:
а) CH4; б) C2H5OH; в) NH4CI; г) РН3.
20. К свойствам ковалентной связи относится:
а) направленность, поляризуемость, насыщаемость;
б) поляризуемость, длина связи, энергия связи;
в) длина связи, напрвленность, насыщаемость;
г) длина и энергия связи.
aplik.ru
