Электролитическая диссоциация электролитов в водных растворах.
Как известно из курса физики, электрическим током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными c ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Кроме металлов, существуют также вещества растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которых проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся попеременно в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, т. е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии. Поэтому для того, чтобы хлорид натрия смог проводить электрический ток, его необходимо расплавить, т.е. превратить в жидкость. В результате сообщения энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na+Cl− , т.е. происходит диссоциация на свободные подвижные ионы:
Na+Cl− ↔ Na+ + Cl−
Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации, в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:
или более упрощенно:
NaCl ↔ Na+ + Cl−(участвующие в гидратации кристалла NaCl и ионов молекулы воды не записываются)
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными. Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается молекулами воды, но выделяющаяся в результате этого энергия недостаточна отрыва ионов Ba2+ и SO42- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т. к. абсолютно нерастворимых веществ не бывает).
к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов. Например:
NaOH = Na+ + OH−
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты. Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации. Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул. Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
Гидратация катионов водорода настолько сильна, что можно говорить не просто о катионе водорода, окружённом молекулами воды (как это было с катионами натрия), а о полноценной частице – ионе гидроксония H3O+, содержащей три полноценные ковалентные связи H-О, одна из которых образована по донорно-акцепторному механизму.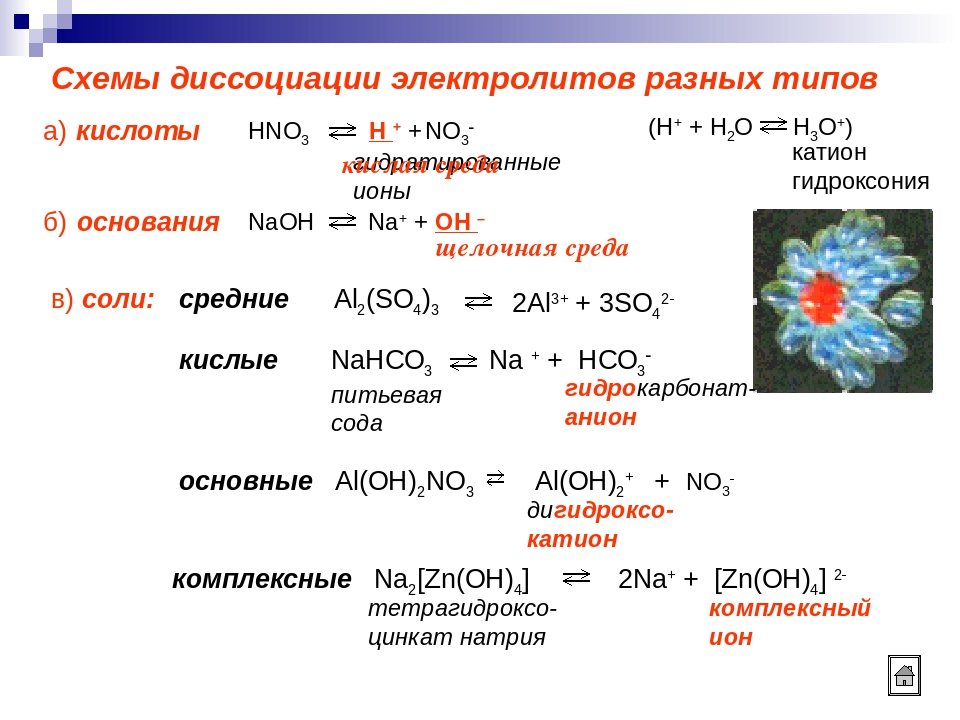 Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:
Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:
H2O + HCl = H3O+ + Cl−
Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды.
HCl = H+ + Cl−
Диссоциация многоосновных кислот протекает ступенчато, например:
H3PO4 ↔ H+ + H2PO4−
H2PO4− ↔ HPO42- + H+
HPO42- ↔ PO43- + H+
Таким образом, как мы уже выяснили, к электролитам относят: соли, кислоты и основания.
Для описания способности электролитов к электролитической диссоциации используют величину, которая называется степенью диссоциации (α).
Степень диссоциации – отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.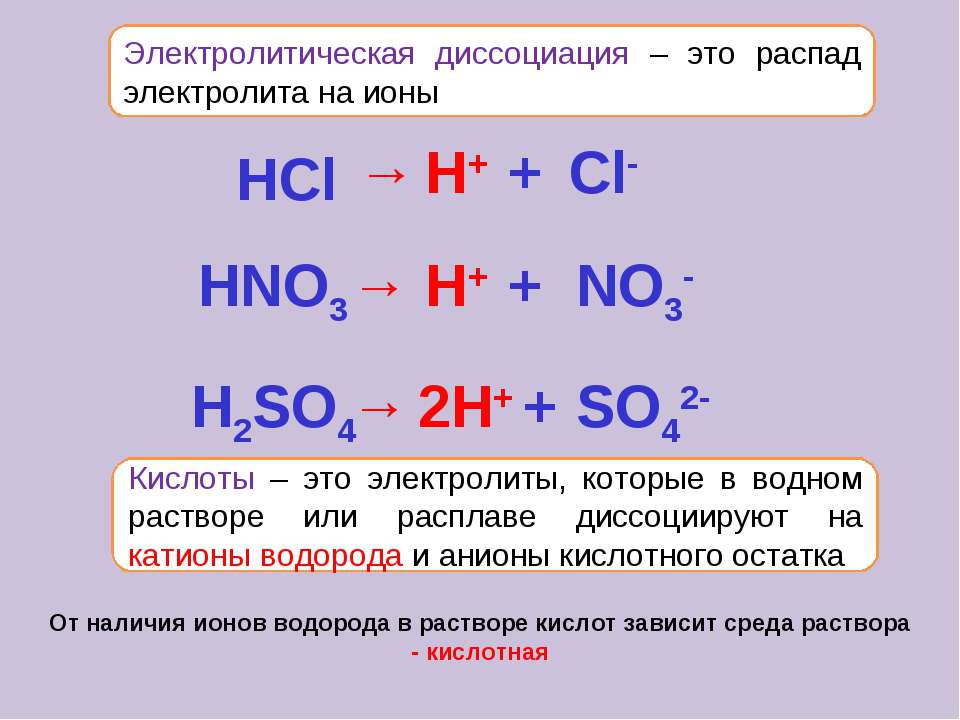
По степени диссоциации электролиты делят на сильные (α>30%), средней силы (30%> α>3%) и слабые (α<3%):
| Электролиты | ||
| Сильные (α>30%) | средней силы (30%> α>3%) | слабые (α<3%) |
| 1) почти все соли 2) некоторые кислоты: HCl, HBr, HI, HNO3, HClO4, H2SO4(разб.) 3) гидроксиды ЩМ и ЩЗМ (NaOH, KOH, Ca(OH)2 и т.д.) | Mg(OH)2 HNO2 H2SO3 по первой ступени H3PO4 | 1) все гидроксиды металлов кроме гидроксидов ЩМ и ЩЗМ 2) H2CO3, H2SiO3, H2S, H2O 3) NH3∙H2O (или NH4OH) 4) CH3COOH и др. |
Вещества, которые не являются ни кислотами, ни солями, ни гидроксидами, считаются неэлектролитами. К неэлектролитам, например, относятся простые вещества, оксиды, органические вещества (спирты, углеводороды, углеводы, хлорпроизводные углеводородов и т.д.).
Сильные электролиты диссоциируют практически необратимо и в их водных растворах содержание исходных молекул крайне мало:
KOH → K+ + OH−
Na2SO4 → 2Na+ + SO42-.
Теория электролитической диссоциации – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ.
- В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.
Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ имени М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается
α = ν / ν0.
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0. 1, или 10%.
1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
NaCl → Na+ + Cl—
CaCl2 → Ca2+ + 2Cl—
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
Сh4COOH ⇄ Сh4COO— + H+
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Что еще почитать?
Противостояние титанов

Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
#ADVERTISING_INSERT#ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ | Энциклопедия Кругосвет
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ. Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!» Как же ток добрался до пассажира?
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток.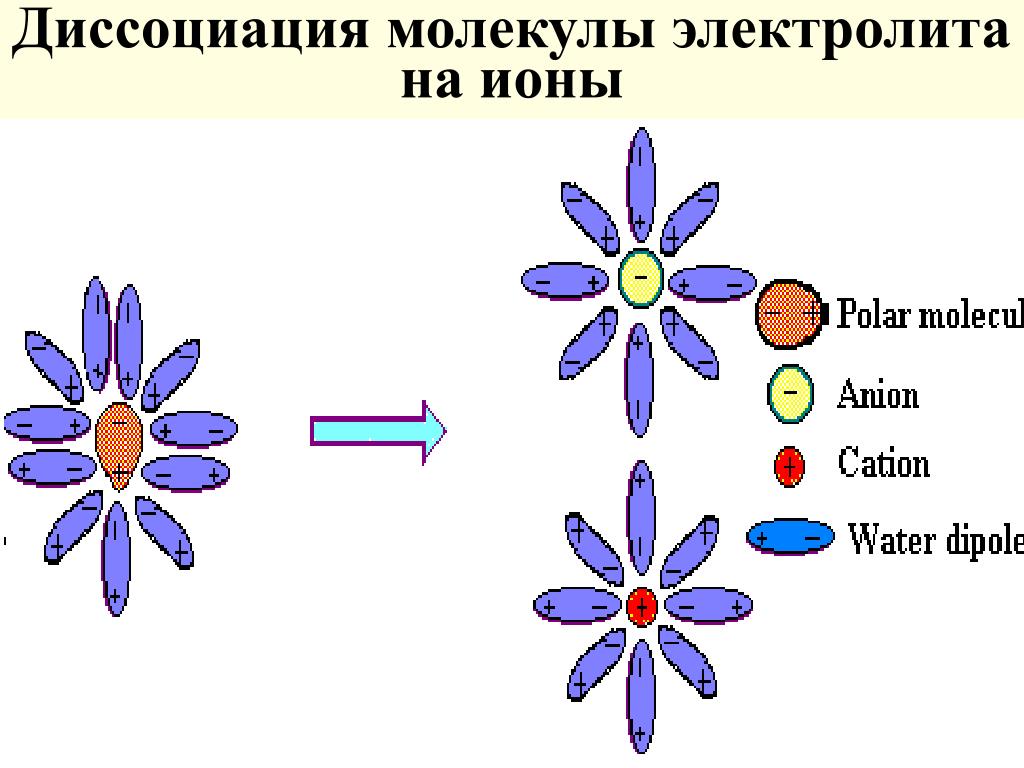 Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток. Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион». Электролит – вещество, раствор которого проводит электрический ток. Происходит это в результате движения в растворе заряженных частиц – ионов. Спустя много лет и в другой стране был придуман забавный стишок, позволяющий запомнить заряд ионов:
Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток. Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион». Электролит – вещество, раствор которого проводит электрический ток. Происходит это в результате движения в растворе заряженных частиц – ионов. Спустя много лет и в другой стране был придуман забавный стишок, позволяющий запомнить заряд ионов:
Для двух ребят подарков груз
ИОН взвалил себе на спину:
Для КАТИ ОН несет свой плюс,
Для АНИ ОН несет свой минус.
Причина появления в растворах заряженных частиц была совершенно непонятной. Само название «электролит» (от греч. lysis – разрушение, растворение) предполагало, что ионы появляются в растворе при пропускании через него электрического тока.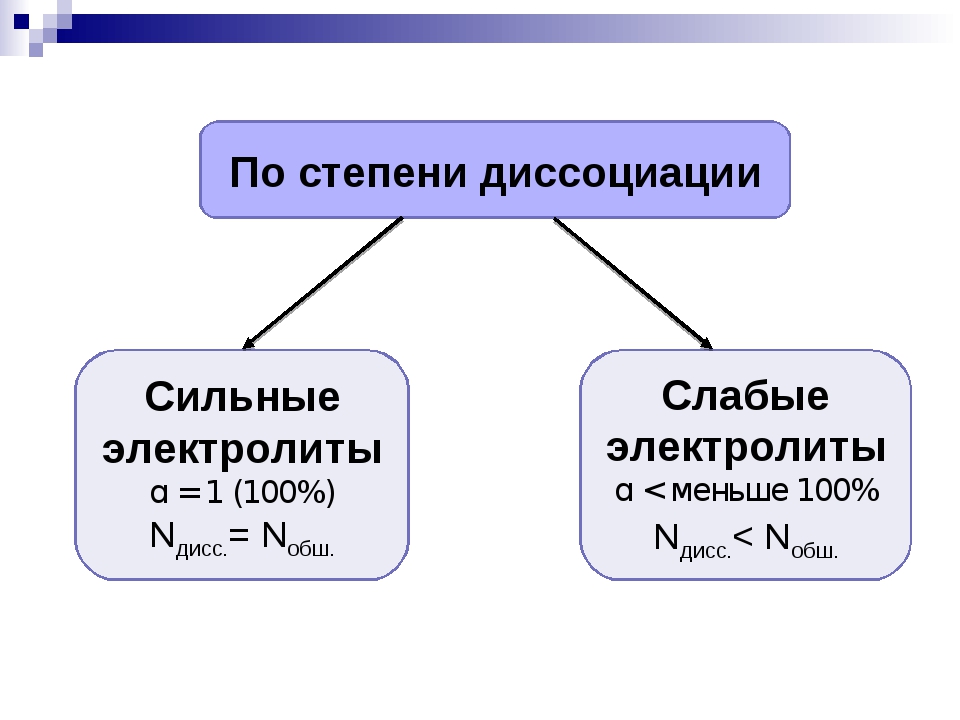
Изучение растворов методами физической химии, например, с помощью измерения oсмотического давления и криоскопии (см. также МОЛЕКУЛЯРНОЙ МАССЫ ОПРЕДЕЛЕНИЕ), показало, что растворах электролитов число частиц больше, чем дают расчеты, основанные на концентрации растворенного вещества. Получалось, например, что в разбавленных растворах поваренной соли число частиц вдвое больше, чем вычисленное по формуле NaCl, в растворах CaCl
Явления диссоциации химикам были известны; например, при нагревании хлорида аммония: он возгоняется с одновременной диссоциацией на две молекулы: NH4Cl ® NH3+ HCl. Но распад при нагревании было объяснить намного легче: энергия, необходимая для диссоциации, черпается за счет тепловой энергии. А вот откуда берется энергия при растворении соли в воде при комнатной температуре, никто объяснить не мог (температура раствора часто почти не меняется). Более того, при растворении некоторых солей в воде раствор сильно нагревается! Непонятно было также, как и на что может распадаться в растворе поваренная соль – ведь не на натрий же и хлор!
А вот откуда берется энергия при растворении соли в воде при комнатной температуре, никто объяснить не мог (температура раствора часто почти не меняется). Более того, при растворении некоторых солей в воде раствор сильно нагревается! Непонятно было также, как и на что может распадаться в растворе поваренная соль – ведь не на натрий же и хлор!
В 1887 году шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду. Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет.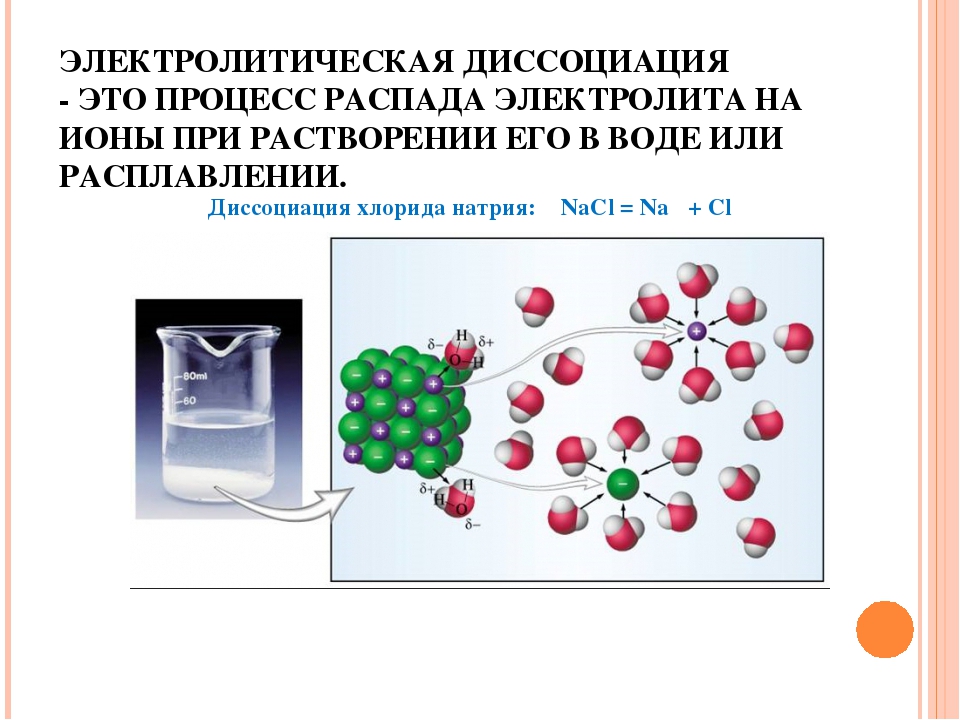
Теория Аррениуса, с одной стороны, объясняла, почему растворы электролитов проводят ток, с другой стороны – объясняла увеличение числа частиц в растворе. Например, в растворе сульфат алюминия Al2(SO4)3 распадается сразу на пять ионов: два катиона алюминия Al3+ и три сульфат-аниона SO42–. За создание теории электролитической диссоциации Аррениус в 1903 году был удостоен Нобелевской премии по химии.
По степени диссоциации на ионы электролиты стали относить к сильным (полный распад на ионы) и к слабым (на ионы распадается только часть растворенного вещества). К сильным электролитам относятся щелочи, многие кислоты (серная, азотная, соляная), большинство солей. К слабым электролитам относятся уксусная СН3СООН, азотистая HNO2, сероводородная H2S, угольная Н2СО3, сернистая H2SO3, большинство органических кислот. Воду также можно отнести к слабым электролитам, так как лишь очень небольшая часть ее молекул находится в растворах в виде катионов Н+ и анионов ОН–. Фосфорная кислота Н3РО4 – электролит средней силы. Тело человека также содержит растворы электролитов и проводит электрический ток. Прохождение через тело тока силой всего 0,1 ампера может быть смертельным.
Фосфорная кислота Н3РО4 – электролит средней силы. Тело человека также содержит растворы электролитов и проводит электрический ток. Прохождение через тело тока силой всего 0,1 ампера может быть смертельным.
Многие ученые – современники Аррениуса, вначале не приняли его теорию. У многих из них то время еще не было четкого понимания, чем ионы отличаются от нейтральных атомов. Им казалось невероятным, как, например, хлорид натрия в воде может существовать в виде отдельных ионов натрия и хлора: как известно, натрий бурно реагирует с водой, а раствор хлора имеет желто-зеленый цвет и ядовит. В результате диссертация Аррениуса получила ряд отрицательных отзывов. К числу самых непримиримых противников Аррениуса принадлежал и Д.И.Менделеев, создавший «химическую» теорию растворов, в отличие от «физической» теории Аррениуса. Менделеев считал, что в растворах происходят по сути химические взаимодействия между растворенным веществом и растворителем, тогда как теория Аррениуса представляла водные растворы как механическую смесь ионов и воды. В 1889 году Менделеев опубликовал Заметку о диссоциации растворенных веществ, в которой ставился под сомнение сам факт распада на ионы в растворах электролитов. «Сохраняя все то, что приобретено в отношении к пониманию растворов, – писал Менделеев, – мне кажется, можно оставить в стороне гипотезу об особом виде диссоциации – на ионы, совершающейся с электролитами при образовании слабых растворов».
В 1889 году Менделеев опубликовал Заметку о диссоциации растворенных веществ, в которой ставился под сомнение сам факт распада на ионы в растворах электролитов. «Сохраняя все то, что приобретено в отношении к пониманию растворов, – писал Менделеев, – мне кажется, можно оставить в стороне гипотезу об особом виде диссоциации – на ионы, совершающейся с электролитами при образовании слабых растворов».
Хотя Менделеев, критикуя Аррениуса, во многом был не прав, в его рассуждениях была значительная доля истины. Как это часто бывает в науке, в ожесточенном споре между приверженцами физической и химической теории правыми оказались обе стороны. Очень сильное химическое взаимодействие между ионами и молекулами растворителя дает ту энергию, которая необходима для разрушения кристаллической решетки или молекул электролитов. В случае водных растворов эта энергия называется энергией гидратации (hydor по-гречески вода) и она может достигать очень больших значений; так, энергия гидратации катионов Na+ почти вдвое больше, чем энергия разрыва связи в молекуле Cl2.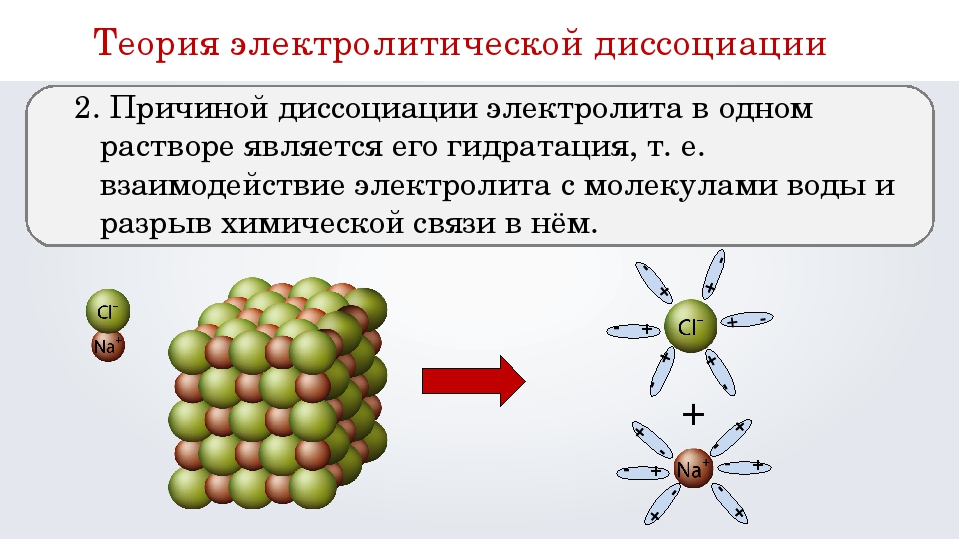 Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решетки). В результате если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решетки (или энергии связи между атомами в таких электролитах, как HCl, H2SO4), растворение будет сопровождаться нагреванием, а если меньше – охлаждением раствора. Именно поэтому при растворении в воде таких веществ как LiCl, безводный CaCl2 и многих других раствор нагревается, а при растворении KCl, KNO3, NH4NO3 и некоторых других – охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой и может даже примерзнуть к мокрой подставке!
Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решетки). В результате если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решетки (или энергии связи между атомами в таких электролитах, как HCl, H2SO4), растворение будет сопровождаться нагреванием, а если меньше – охлаждением раствора. Именно поэтому при растворении в воде таких веществ как LiCl, безводный CaCl2 и многих других раствор нагревается, а при растворении KCl, KNO3, NH4NO3 и некоторых других – охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой и может даже примерзнуть к мокрой подставке!
Механизм электролитической диссоциации можно рассмотреть на примере хлороводорода. Связь H–Cl – ковалентная, полярная (см. МОЛЕКУЛ СТРОЕНИЕ), молекулы HCl – диполи с отрицательным полюсом на атоме Cl и положительным на атоме Н. Полярны и молекулы воды. В водном растворе молекулы HCl окружены со всех сторон молекулами воды так, что положительные полюса молекул Н2О притягиваются к отрицательным полюсам молекул HCl, а отрицательные полюса – к положительным полюсам молекул HCl. В результате связь H–Cl сильно поляризуется и разрывается с образованием гидратированных катионов H+ и анионов Cl–: диполи Н2О как бы растаскивают молекулы HCl на отдельные ионы. Каждый катион H+ в растворе окружен со всех сторон диполями Н2О, направленными к нему своими отрицательными полюсами, а каждый анион Cl– окружен противоположно ориентированными диполями Н2О. Аналогичные процессы происходят в воде с молекулами H2SO4, другими молекулами с полярными ковалентными связями, а также с ионными кристаллами. В них уже имеются «готовые» ионы, и роль диполей воды сводится к отделению катионов от анионов.
Полярны и молекулы воды. В водном растворе молекулы HCl окружены со всех сторон молекулами воды так, что положительные полюса молекул Н2О притягиваются к отрицательным полюсам молекул HCl, а отрицательные полюса – к положительным полюсам молекул HCl. В результате связь H–Cl сильно поляризуется и разрывается с образованием гидратированных катионов H+ и анионов Cl–: диполи Н2О как бы растаскивают молекулы HCl на отдельные ионы. Каждый катион H+ в растворе окружен со всех сторон диполями Н2О, направленными к нему своими отрицательными полюсами, а каждый анион Cl– окружен противоположно ориентированными диполями Н2О. Аналогичные процессы происходят в воде с молекулами H2SO4, другими молекулами с полярными ковалентными связями, а также с ионными кристаллами. В них уже имеются «готовые» ионы, и роль диполей воды сводится к отделению катионов от анионов.
Ионы резко отличаются по своим физическим и химическим свойствам от нейтральных атомов. Например, атомы Na реагируют с водой, а катионы Na+ – нет; хлор – сильный окислитель и ядовит, а анионы Cl– не являются окислителем и не ядовиты. Цвет ионов при гидратации может измениться. Например, негидратированные ионы меди бесцветны (безводный CuSO4), а гидратированные – голубые.
Например, атомы Na реагируют с водой, а катионы Na+ – нет; хлор – сильный окислитель и ядовит, а анионы Cl– не являются окислителем и не ядовиты. Цвет ионов при гидратации может измениться. Например, негидратированные ионы меди бесцветны (безводный CuSO4), а гидратированные – голубые.
Учитывая диссоциацию в растворах, уравнения многих реакций можно записать в сокращенном ионном виде. Ионное уравнение показывает, какие именно ионы участвуют в реакции. Например, полное уравнение реакции AgNO3 + NaCl ® AgCl + NaNO3 можно записать в сокращенном ионном виде: Ag+ + Cl– ® AgCl. Суть реакции состоит в образовании осадка AgCl при встрече ионов Ag+ и Cl–, тогда как ионы Na+ и NO3– остаются в растворе и фактически не принимают участия в реакции.
Илья Леенсон
Применение электролитов » Primelab | Производство лабораторного и аналитического оборудования
Основные свойства
Обычная вода и многие другие вещества не способны проводить ток. Растворы становятся токопроводимыми, только если вещества могут распадаться на ионы. В отличие от металлов электролиты называют проводниками второго порядка. Ими могут выступать некоторые кристаллы и расплавы, например иодид серебра, диоксид циркония.
Растворы становятся токопроводимыми, только если вещества могут распадаться на ионы. В отличие от металлов электролиты называют проводниками второго порядка. Ими могут выступать некоторые кристаллы и расплавы, например иодид серебра, диоксид циркония.
Основным свойством электролитов является возможность электролитической диссоциации, представляющей собой процесс распада молекул при взаимодействии с водой, другими растворителями. В результате распада появляются заряженные ионы.
В зависимости от типа образующихся ионов различают такие электролиты:
- щелочные,
- кислотные,
- солевые.
В щелочных электропроводимость обеспечивается ионами ОН и металлов. В кислотных – ионами Н+, а также остатками оснований кислот. Процесс диссоциации зависит от таких факторов:
- концентрации веществ,
- выбора растворителя,
- температуры.
- растворимые соли,
- сильные кислоты,
- щелочи.

Если говорить об аккумуляторах, то для них важна плотность токопроводящих сред. Она определяет емкость батарей и срок их службы.
Возможности для применения
В основном применение электролитов распространено в промышленности. С их помощью изготавливают источники тока разного назначения. Это могут быть автомобильные аккумуляторы и различные виды батарей. Для них используются щелочные вещества, проводящие ток.
Аналитическая практика предполагает использование ионометров и рН-метров, которые заполнены солевыми веществами, проводящими ток. Приборы применяют для измерения кислотности среды, концентрации определенных веществ.
Если говорить об электрохимической индустрии, то многие растворы для гальванирования металлов создаются на основе веществ, способных к диссоциации. Также они применяются в биологии и медицине. Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
К достоинствам аккумуляторов, построенных на щелочных веществах, способных к диссоциации, относят:
- длительный срок службы;
- надежность;
- меньшее количество токсичных веществ, выделяемых в процессе работы;
- возможность использования в широком температурном диапазоне;
- неприхотливость;
- меньшая масса в сравнении с кислотными.
Если говорить об автомобильной индустрии, в ней являются востребованными кислотные аккумуляторы. К их непосредственным преимуществам относятся:
- простое и отработанное обслуживание;
- низкий саморазряд;
- приемлемая стоимость;
- способность давать высокий ток при старте.
Основные меры предосторожности
Все популярные вещества, способные проводить ток, созданы на основе щелочи или серной кислоты. Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
Среди правил обращения с такими опасными веществами главными являются следующие:
- наличие в помещении нейтрализующих веществ, воды, аптечки;
- для нейтрализации кислотного ожога необходим раствор соды, используется одна чайная ложка на стакан воды;
- для нейтрализации щелочных ожогов применяется раствор борной кислоты, берется чайная ложка на стакан воды;
- если агрессивное вещество попало в глаза, для его нейтрализации применяются растворы в два раза слабее;
- если произошел ожог, сначала используется нейтрализующее вещество, а потом вода.
Важно при работе соблюдать все правила техники безопасности, чтобы избежать ожогов. Основные из них:
- кислоту необходимо наливать в воду и ни в коем случае не наоборот;
- при работе с твердой щелочью ее необходимо опускать в воду при помощи щипцов;
- хранение в одном помещении или работа одновременно с кислотными и щелочными веществами запрещена.
Если при выполнении работ предполагается кипение вещества, оно будет сопровождаться выделением взрывоопасного и горючего газа – водорода. Соответственно, в помещении необходимо предусмотреть его отвод, взрывобезопасную проводку, защитить все электроприборы.
Соответственно, в помещении необходимо предусмотреть его отвод, взрывобезопасную проводку, защитить все электроприборы.
Хранение опасных веществ организовывают в пластиковых емкостях. Для работы с ними подходит фарфоровая, керамическая и стеклянная посуда.
Электролитическая диссоциация — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Электрический ток – направленное движение заряженных частиц – электронов или ионов.
Электролиты – это вещества, растворы или расплавы (в ЕГЭ чаще речь о растворах) которых проводят электрический ток, то есть содержат заряженные частицы. Свободных электронов в растворе не бывает, носителями заряда являются ионы. Электрический ток проводят расплавы веществ с ионной кристаллической решеткой.
К электролитам относятся:
- Соли
- Кислоты
- Основания
Чем больше в растворе заряженных частиц, тем лучше он проводит электрический ток, т. е. чем больше молекул вещества диссоциирует, тем более сильным электролитом оно является.
е. чем больше молекул вещества диссоциирует, тем более сильным электролитом оно является.
Список сильных и слабых электролитов нужно знать наизусть!
Сильные электролиты (в растворах): 11
- Растворимые соли
FeCl3, CuSO4, K2CO3 и т.д.
8 растворимых гидроксидов: LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.
- Сильные кислоты
HI, HBr, HCl, H2SO4(разб), HNO3, HClO4, HClO3, HMnO4, H2CrO4
Слабые электролиты:
- Слабые основания
нерастворимые гидроксиды, NH3∙H2O, растворы аминов
- Слабые кислоты и кислоты средней силы
H3PO4, HF, H2SO3, H2CO3, H2S, H2SiO3, органические кислоты.
H2O – очень слабый электролит, диссоциирует ничтожно мало. Чистая дистиллированная вода не проводит ток.
Неэлектролиты: большинство органических соединений, оксиды, вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи и т.д.
Сила электролита определяется степенью диссоциации. Рассмотрим соль А2В и кислоту Н3Х:
Диссоциация — всегда обратимый процесс.
Соли диссоциируют (обратимо распадаются на ионы) почти на 100%:
А2В ⇄ 2А+ + В2-. Так как все молекулы распались на ионы, из 1 моль АВ получилось 1 моль В2- и 2 моль А+, то есть три моль ионов.
Многоосновные кислоты и основания диссоциируют ступенчато:
Н3Х ⇄ H+ + H2X—
H2X— ⇄ HX2- + H+
HX2-⇄X3- + H+
При этом каждая следующая ступень диссоциации протекает хуже предыдущей, т. к. присутсвует конкурирующий процесс — обратная реакция. Порядок примерно такой: Из 1 моль молекул слабой кислоты по первой ступени диссоциировало 0,05 моль, по второй — 0,0002 моль и по третьей – 0,00000001 моль. Итого образовалось чуть больше 0,1 моль ионов.
к. присутсвует конкурирующий процесс — обратная реакция. Порядок примерно такой: Из 1 моль молекул слабой кислоты по первой ступени диссоциировало 0,05 моль, по второй — 0,0002 моль и по третьей – 0,00000001 моль. Итого образовалось чуть больше 0,1 моль ионов.
Очевидно, этот раствор этой кислоты проводит ток хуже, чем раствор соли.
Пара вопросов для тренировки:
1) Какие частицы образутся при диссоциации нитрата натрия
а) Na+, N+5, O-2; б) Na+, NO3— в) Na, NO2, O2 г) NaNO2, O2
Решение: нитрат натрия образован остатком азотной кислоты и катионом натрия. Уравнение его диссоциации: NaNO3 ⇄ Na+ + NO3—. Ответ б).
2) В четырех пробирках находятся одномолярные растворы следующих веществ:
а) H3PO4 б) Na2SO4 в) NaCl г) HBr
В какой пробирке больше всего ионов?
Решение: a) ортофосфорная кислота – средней силы, диссоциирует слабо, большая часть молекул останутся в растворе молекулами.
б) сульфат натрия – соль, диссоциирует полностью, из одного моль соли олучается три моль ионов: Na2SO4 ⇄ 2Na+ + SO42-.
в) хлорид натрия – соль, диссоциирует полностью, из одного моль соли образуется два моль ионов: NaCl ⇄ Na+ + Cl—.
г) бромоводородная кислота – сильная, но диссоциирует не полностью (в отличие от солей). В реакции HBr ⇄ H+ + Br- из одного моль HBr образуется меньше двух моль ионов.
Ответ б).
Ты нашел то, что искал? Поделись с друзьями!Электролитическая диссоциация, свойство водных растворов проводить электрический ток
Купить рН-метры, pH meters в Санкт-Петербурге
В каталоге товаров/продукции представлены рН-метры — pH метры Россия, карманные рН-метры, портативные рН-метры, стационарные рН-метры, рН-метры для пищевой промышленности, категории: pH meter made in Russia, pocket pH meters, portable pH meters, stationary pH meters, pH meters for food industry, ; портативные, стационарные лабораторные модели измерителей водородного показателя (показателя pH), компактные карманные приборы рН-метры, автономные портативные рН-метры для оперативного определения кислотности или щелочности среды, лабораторные модели стационарные измерители водородного показателя (показателя pH), ,pH метры Россия
Подробнее. ..
Купить pH метры производства Россия — pH meter made in Russia в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить портативные, стационарные pH метры Россия в Санкт-Петербурге по выгодной цене. компактные модели рН-метров, приборов для измерения водородного показателя.
..
Купить pH метры производства Россия — pH meter made in Russia в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить портативные, стационарные pH метры Россия в Санкт-Петербурге по выгодной цене. компактные модели рН-метров, приборов для измерения водородного показателя.
карманные рН-метры
Подробнее… Купить карманные рН-метры — pocket pH meters в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Легкие и удобные устройства предназначены для оперативного определения кислотности или щелочности среды / определения уровня pH среды в полевых условиях, когда использование более громоздких лабораторных «портативных рН-метров»; «стационарных рН-метров» приборов зат…рН-метры для пищевой промышленности
Подробнее. ..
Приборы для анализа пищевых продуктов — купить рН-метры для пищевой промышленности — pH meters for food industry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Универсальные измерительные приборы контроля качества продуктов питания применяются в различных лабораториях и производстве.
Купить прибор в Санкт-Петербурге по выгодной цене. рН-метры. В каталоге ХИМСНАБ-СПБ представлены…
..
Приборы для анализа пищевых продуктов — купить рН-метры для пищевой промышленности — pH meters for food industry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Универсальные измерительные приборы контроля качества продуктов питания применяются в различных лабораториях и производстве.
Купить прибор в Санкт-Петербурге по выгодной цене. рН-метры. В каталоге ХИМСНАБ-СПБ представлены…
Купить электроды для измерения pH, анализаторы pH-электроды для рН-метров
Выносные электроды предназначеных для проведения измерений в лабораторных и полевых измерений рН, определения окислительно-восстановительного потенциала, удельной электрической проводимости и температуры воды, водных растворов. Анализаторы состоят из измерительного преобразователя и комбинированных датчиков (первичных преобразователей), обеспечивающих измерение параметров водной среды. Измерительные приборы отличает высокая производительность и точность осуществляемых измерений.
Измерительные приборы отличает высокая производительность и точность осуществляемых измерений.
Купить электроды и датчики, electrodes and sensors в Санкт-Петербурге
В каталоге товаров/продукции представлены электроды и датчики — Ион-селективные электроды, pH-электроды, электроды для измерения pH, датчики ОВП, редокс-электроды, датчики проводимости, датчики температуры, кислородные датчики, электроды вспомогательные (сравнения), категории: Ion-selective electrodes, pH-electrodes, sensors ORP, conductivity sensors, temperature sensors, oxygen sensors, the auxiliary electrode (comparison), ; Ион-селективные электроды, pH-электрод, датчики ph, электрод ph метра, электроды для измерения ph, измерительный электрод ph, рН-метрический электрод, измерение значения концентрации ионов водорода, определение концентрации ионов водорода, электроды датчики ОВП, редокс-электроды, измерение окислительно-восстановительного потенциала, многодиапазонные зонды и электроды, электроды датчики проводимости, электрод сенсор датчик температуры, электрод сенсор датчик кислородный, специальные лабораторные и промышленные электроды сравнения, электроды вспомогательные,Ион-селективные электроды
Подробнее. ..
Купить Ион-селективные электроды — Ion-selective electrodes в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного…
..
Купить Ион-селективные электроды — Ion-selective electrodes в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного…
pH-электроды, электроды для измерения pH
Подробнее… Купить pH-электроды (pH-electrodes) лабораторные измерительные устройства, анализаторы жидкости, растворов, воды и водных сред используемые для получения точных и воспроизводимых показаний приборов, опредлеление кислотности или щелочности выраженной в виде pH. В комании ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93 можно приобрести рН-электроды для рН-метров, анализаторов воды предназначе. ..
..
датчики ОВП, редокс-электроды
Подробнее… Индикаторные элементы для проведения измерения окислительно-восстановительных потенциалов. В обратимых окислительно-восстановительных системах позволяют проводить определение концентрации компонентов. Специализированные электроды и датчики ОВП, редокс-электроды имеют особые электрохимические характеристики для потенциометрических измерений, регистрации ОВП растворов. Измерительное оборудован…датчики проводимости
Подробнее… Купить многодиапазонные датчики проводимости — conductivity sensors для кондуктометров использующих выносной (сменный) электрод в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить датчик проводимости в Санкт-Петербурге по выгодной цене. Специализированные электроды и датчики, electrodes and sensors с подключаемым кабелем используемые для определения проводимости и солесодержания в вод…
Специализированные электроды и датчики, electrodes and sensors с подключаемым кабелем используемые для определения проводимости и солесодержания в вод…
кислородные датчики
Подробнее… Купить кислородные датчики — oxygen sensors для стационарных и портативных оксиметров в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Модели стандартных полярографических датчиков растворенного кислорода применяемых в настольных и портативных приборах. Отдельные модели датчиков кислорода состоят из платинового катода, серебряного анода и фторопластовой мембраны. Конструкции датчика делаю…электроды вспомогательные (сравнения)
Подробнее… Купить электроды вспомогательные (сравнения) — auxiliary electrode (comparison) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Лабораторный вспомогательный или опорный электрод, заполненный концентрированным раствором КСl — электролит является вторым по значимости элементом измерительного прибора «рН-метра» . Данный тип электрода позволяет создать опорную точку, относитель…
индикаторная бумага в ПОЛОСКАХ или индикаторная бумага в КАТУШКАХ. Подобрать по диапазону pH: 0 — 6 рН; 1 — 12 рН; 4,5 — 10 рН; 7 — 14 рН; 1 — 11 рН; 5,5 — 9 рН; 1 — 14 рН; 0 — 14 рН; 0 — 12 рН, также в каталоге ХИМСНАБ-СПБ
лабораторного оборудования и приборов, раздела измерительные приборы можно приобрести приборы для измерения водородного показателя pH:
«рН-метры»;
«карманные рН-метры»;
«портативные рН-метры»;
«стационарные рН-метры» и
«pH-электроды»
Оставьте заявку ON-LINE или позвоните.
Лабораторный вспомогательный или опорный электрод, заполненный концентрированным раствором КСl — электролит является вторым по значимости элементом измерительного прибора «рН-метра» . Данный тип электрода позволяет создать опорную точку, относитель…
индикаторная бумага в ПОЛОСКАХ или индикаторная бумага в КАТУШКАХ. Подобрать по диапазону pH: 0 — 6 рН; 1 — 12 рН; 4,5 — 10 рН; 7 — 14 рН; 1 — 11 рН; 5,5 — 9 рН; 1 — 14 рН; 0 — 14 рН; 0 — 12 рН, также в каталоге ХИМСНАБ-СПБ
лабораторного оборудования и приборов, раздела измерительные приборы можно приобрести приборы для измерения водородного показателя pH:
«рН-метры»;
«карманные рН-метры»;
«портативные рН-метры»;
«стационарные рН-метры» и
«pH-электроды»
Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента. Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ • Большая российская энциклопедия
-
В книжной версии
Том 35.
 Москва, 2017, стр. 312
Москва, 2017, стр. 312 -
Скопировать библиографическую ссылку:
Авторы: Е. П. Агеев, Н. Н. Матушкина
ЭЛЕКТРОЛИТИ́ЧЕСКАЯ ДИССОЦИА́ЦИЯ, частичный или полный распад вещества в растворе или расплаве на положительно и отрицательно заряженные частицы – ионы. Вещества, существующие в растворе или расплаве в виде ионов, называются электролитами. Первые представления о строении растворов электролитов сформулированы в 1884 С. Аррениусом и включали следующие положения. Во-первых, при растворении электролита не все молекулы диссоциируют на ионы, а лишь некоторая их доля α, названная степенью диссоциации. Если при Э. д. одной молекулы электролита образуется ν ионов, то их концентрация в растворе равна ναс (с – концентрация электролита), а концентрация недиссоциированных молекул (1-α )с. Общая концентрация частиц в растворе составит (1-α)с+ναс=с[1+α(ν-1)]. Выражение [1+α(ν-1)] показывает, во сколько раз увеличивается концентрация частиц в растворе за счёт Э. д. Это уравнение позволяет объяснить эксперим. данные по коллигативным (зависящим от количества) свойствам растворов. Во-вторых, к процессу Э. д. применим закон действующих масс. Пусть в объёме раствора V содержится 1 моль вещества MA, Э. д. которого происходит по схеме МА⇄М++А–. Тогда равновесные концентрации частиц в растворе [M+]=[A–]=α/V, [MA]=(1-α)/V. Уравнение закона действующих масс K=[M+][A–]/[MA]=α2/[(1-α)V]. Т. к. молярная концентрация с=1/V, а т.
д. одной молекулы электролита образуется ν ионов, то их концентрация в растворе равна ναс (с – концентрация электролита), а концентрация недиссоциированных молекул (1-α )с. Общая концентрация частиц в растворе составит (1-α)с+ναс=с[1+α(ν-1)]. Выражение [1+α(ν-1)] показывает, во сколько раз увеличивается концентрация частиц в растворе за счёт Э. д. Это уравнение позволяет объяснить эксперим. данные по коллигативным (зависящим от количества) свойствам растворов. Во-вторых, к процессу Э. д. применим закон действующих масс. Пусть в объёме раствора V содержится 1 моль вещества MA, Э. д. которого происходит по схеме МА⇄М++А–. Тогда равновесные концентрации частиц в растворе [M+]=[A–]=α/V, [MA]=(1-α)/V. Уравнение закона действующих масс K=[M+][A–]/[MA]=α2/[(1-α)V]. Т. к. молярная концентрация с=1/V, а т. н. разведение V=1/с, то K=α2с/(1-α). Обе формулы отражают взаимосвязь между K и α и представляют собой математич. выражение закона разбавления Оствальда (В. Оствальд, 1888), согласно которому константа Э. д. K не зависит от разбавления раствора, а зависит только от темп-ры и природы растворителя.
н. разведение V=1/с, то K=α2с/(1-α). Обе формулы отражают взаимосвязь между K и α и представляют собой математич. выражение закона разбавления Оствальда (В. Оствальд, 1888), согласно которому константа Э. д. K не зависит от разбавления раствора, а зависит только от темп-ры и природы растворителя.
В зависимости от величины α различают слабые и сильные электролиты. Вещества, у которых в растворе с концентрацией 0,1 моль α<0,03, относят к слабым электролитам, у которых α>0,3 – к сильным, при 0,03<α<0,3 – к электролитам средней силы. Сильными электролитами являются мн. растворимые соли, некоторые кислоты и основания, слабыми – большинство органич. кислот и оснований. Э. д. электролитов, молекулы которых могут распадаться на неск. ионов, протекает по стадиям. При Э. д. многоосновных кислот легче отделяется первый протон, а каждый последующий ион водорода отщепляется труднее, т. к. возрастает заряд аниона.
к. возрастает заряд аниона.
Ионная теория Э. д. Аррениуса позволила трактовать явления, связанные с ионными равновесиями, и легла в основу качественного химич. анализа. Недостатки теории состоят в игнорировании ион-дипольных, ион-ионных и диполь-дипольных взаимодействий. Попытка учёта этих взаимодействий привела к формированию совр. теорий растворов электролитов.
См. также Растворы (раздел Растворы электролитов), Электролитов растворы и Электролиты расплавленные.
Электролитическая диссоциация электролитов в водных растворах.
Как известно из курса физики, электрический током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Другие металлов, существуют также растворы или расплавы, которые проводят электрический ток. Такие вещества называют электролитами.
Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которые проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть заряженные частицы, которые могли бы быть электрическими проводниками, присутствующими, но статичны, т.е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» главным образом.
Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии. Поэтому для того, чтобы хлорид натрия стал электрическим током, необходимо его расплавить, т. е. превратить в жидкость. В результате энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na + Cl — , т.е. происходит диссоциация на свободные подвижные ионы:
е. превратить в жидкость. В результате энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na + Cl — , т.е. происходит диссоциация на свободные подвижные ионы:
Na + Cl — ↔ Na + + Cl —
Однако, добиться диссации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом это становится возможным? Ведь для того, чтобы произошло разрушение кристаллической решетки, требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации , в результате чего ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекулы воды:
или более упрощенно:
NaCl ↔ Na + + Cl — (участвующие в гидратации кристалла NaCl и основная молекулы воды не записываются)
Если энергия, выделяющаяся при гидра кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными. Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается этой энергией, недостаточной отрыва от него Ba 2+ и SO 4 2- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается этой энергией, недостаточной отрыва от него Ba 2+ и SO 4 2- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов.Например:
NaOH = Na + + OH —
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты. Как и в ионных соединениях, причина образования из электронейтральных молекул кроется в их гидратации. Существование гидратированных таким образом энергетически более выгодно, чем существование гидратированных молекул. Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
Гидратация катионов водорода, окружённом молекулами воды (как это было с катионами натрия), а о полноценной частице — ионе гидроксония H 3 O + , которые представляют собой три полноценные ковалентные связи H-О, одна из образована по донорно-акцептор механизму. Таким образом, уравнение диссоциации соляной кислоты правильно записывать так:
Таким образом, уравнение диссоциации соляной кислоты правильно записывать так:
H 2 O + HCl = H 3 O + + Cl —
Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, игнорируют явное участие в диссоциации молекулы воды.
HCl = H + + Cl —
Диссоциация многоосновных кислот протекает ступенчато, например:
H 3 PO 4 ↔ H + + H 2 PO 4 —
H 2 PO 4 — ↔ HPO 4 2- + H +
HPO 4 2- ↔ PO 4 3- + H +
Таким образом, как мы уже объясняли, к электролитам относят: соли, кислоты и основания.
Для описания способности электролитов к электролитической диссоциации используют определение, которое называется степенью диссоциации (α) .
Степень диссоциации — отношение числа продиссоциировавших частиц, к общему количеству растворенных частиц.
По степени диссоциации электролиты делят на сильные ( α> 30%) , средней силы ( 30%> α> 3%) и слабые ( α <3%):
| Электролиты | ||
| Сильные ( α> 30%) | средней силы ( 30%> α> 3%) | слабые ( α <3%) |
| почти все соли 2) некоторые кислоты: HCl, HBr, HI, HNO 3 , HClO 4 , H 2 SO 4 (разб.) 3) гидроксиды ЩМ и ЩЗМ (NaOH, KOH, Ca (OH) 2 и т.д.) | Mg (OH) 2 HNO 2 H 2 SO 3 по первой ступени H 3 PO 4 | 1) все гидроксиды металлов кроме гидроксидов ЩМ и ЩЗМ 2) H 2 CO 3 , H 2 SiO 3 , H 2 S, H 2 O 3) NH 3 ∙ H 2 O (или NH 4 OH) 4) CH 3 COOH и др. |
Вещества, которые не являются ни кислотами, ни солями, ни гидроксидами, считаются неэлектролитами . К неэлектролитам, например, простые вещества, оксиды, органические вещества (спирты, углеводороды, углеводы, хлорпроизводные углеводородов и т.д.).
Сильные электролиты диссоциируют практически необратимо и в их водных растворах содержание исходных молекул крайне мало:
KOH → K + + OH —
Na 2 SO 4 → 2Na + + SO 4 2- .
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ | Энциклопедия Кругосвет
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ. Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!» Как же ток добрался до пассажира?
Еще на заре изучения электрических явлений ученые заметили, но и растворы могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и других электрических соединений не проводят электрические токи. Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион».Электролит — вещество, проводящего электрический ток. Происходит это в результате движения в растворе заряженных частиц — возбудитель. Спустя много лет и в другой стране был придуман забавный стишок, позволяющий запомнить заряд необы:
Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и других электрических соединений не проводят электрические токи. Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион».Электролит — вещество, проводящего электрический ток. Происходит это в результате движения в растворе заряженных частиц — возбудитель. Спустя много лет и в другой стране был придуман забавный стишок, позволяющий запомнить заряд необы:
Для двух ребят подарков груз
ИОН взвалил себе на спину :
Для КАТИ ОН несет свой плюс ,
Для АНИ ОН несет свой минус .
Причина появления в растворах заряженных частиц совершенно непонятной. Само название «электролит» (от греч. Lysis — разрушение, растворение) предполагало, что ионы появляются в растворе при пропускании через него электрического тока.
Само название «электролит» (от греч. Lysis — разрушение, растворение) предполагало, что ионы появляются в растворе при пропускании через него электрического тока.
Изучение растворов методами физической химии, например, с помощью измерения осмотического давления и криоскопии ( см. Также МОЛЕКУЛЯРНОЙ МАССЫ ОПРЕДЕЛЕНИЕ), показало, что растворах электролитов число частиц больше, чем дают расчеты, основанные на растворе раствора вещества. Получено, например, что в разбавленных растворах соли числа частиц вдвое больше, чем вычисленное по формуле NaCl, в растворах CaCl 2 — втрое больше и т.д. Это можно было бы объяснить, что соединения при растворении в воде распадаются на несколько частей — как говорят химики, претерпевают диссоциацию (от латинского диссоциации — разъединение, разделение).
Явления диссоциации химикам были известны; например, при нагревании хлорида аммония: он возгоняется с одновременной диссоциацией на две молекулы: NH 4 Cl ® NH 3 + HCl. При распадании при нагревании было легче объяснить: энергию, необходимую для диссоциации, черпается за счет тепловой энергии.А вот откуда берется энергия при растворении в воде при комнатной температуре, почти часто не меняется. Более того, при растворении некоторых солей в воде раствор сильно нагревается! Непонятно было также, как и на что может распадаться в растворе поваренная соль — ведь не на натрий же и хлор!
При распадании при нагревании было легче объяснить: энергию, необходимую для диссоциации, черпается за счет тепловой энергии.А вот откуда берется энергия при растворении в воде при комнатной температуре, почти часто не меняется. Более того, при растворении некоторых солей в воде раствор сильно нагревается! Непонятно было также, как и на что может распадаться в растворе поваренная соль — ведь не на натрий же и хлор!
В 1887 году шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказывать предположение, что в таких растворах вещества распадаются на заряженные частицы — ионы, которые могут передвигаться к электродам — отрицательно заряженному катоду и положительно заряженному аноду.Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод — расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под электрическим током. Дальнейшие исследования показали, что это не так: ионы только переносчиками зарядов в растворе существуют независимо от того, проходит через раствор ток или нет.
Дальнейшие исследования показали, что это не так: ионы только переносчиками зарядов в растворе существуют независимо от того, проходит через раствор ток или нет.
Теория Аррениуса, с одной стороны, объясняла, почему растворы электролитов проводят ток, с другой стороны — объясняла объем частиц в растворе.Например, растворе сульфат алюминия Al 2 (SO 4 ) 3 распадается сразу на пять первых: два катиона алюминия Al 3 + и три сульфат-аниона SO 4 2– . За создание теории электролитической диссоциации Аррениус в 1903 году был удостоен Нобелевской премии по химии.
По степени диссоциации на ионы электролиты стали относить к сильным (полный распад на ионы) и к слабым (на ионы распадается только часть растворенного вещества).К сильным электролитам атома щелочи, многие кислоты (серная, азотная, соляная), большинство солей. К слабым электролитам принадлежит уксусная СН 3 СООН, азотистая HNO 2 , сероводородная H 2 S, угольная Н 2 СО 3 , сернистая H 2 SO 3 , большинство кислот. Воду также можно отнести к слабым электролитам, как лишь очень небольшая часть ее находится в растворах в виде катионов Н + и анионов ОН — .Фосфорная кислота Н 3 РО 4 — электролит средней силы. Тело человека также содержит растворы электролитов и проводит электрический ток. Прохождение через тело силы силой всего 0,1 ампера может быть смертельным.
Воду также можно отнести к слабым электролитам, как лишь очень небольшая часть ее находится в растворах в виде катионов Н + и анионов ОН — .Фосфорная кислота Н 3 РО 4 — электролит средней силы. Тело человека также содержит растворы электролитов и проводит электрический ток. Прохождение через тело силы силой всего 0,1 ампера может быть смертельным.
Многие ученые — современники Аррениуса, вначале не приняли его теорию. У многих из них то время еще не было четкости, чем ионы отличаются от нейтральных элементов. Им кажется невероятным, например, хлорид натрия в воде может существовать в виде отдельного натрия хлора и натрия: как известно, натрий бурно реагирует с водой, а раствор хлорид имеет желто-зеленый цвет и ядовит.В результате диссертации Аррениуса получила ряд отрицательных отзывов. К числу самых непримиримых противников Аррениуса принадлежал и Д.И.Менделеев, создаваемый «химическую» теорию решенийоров, в отличие от «физической» теории Аррениуса. Менделеев считал, что в настоящее время по сути химические взаимодействия между растворенным веществом и растворителем, как теория Аррениуса представляла водные растворы как механическую смесь первой и воды. В 1889 году Менделеев опубликовал Заметку о диссоциации растворенных веществ , которая ставит под сомнение сам факт распада на ионы в растворах электролитов.«Сохраняя все то, что приобретено в отношении к пониманию растворов, — писал Менделеев, — мне кажется, что можно оставить в стороне гипотезу об особом виде диссоциации — на ионы, совершенные с электролитами при образовании слабых растворов».
Менделеев считал, что в настоящее время по сути химические взаимодействия между растворенным веществом и растворителем, как теория Аррениуса представляла водные растворы как механическую смесь первой и воды. В 1889 году Менделеев опубликовал Заметку о диссоциации растворенных веществ , которая ставит под сомнение сам факт распада на ионы в растворах электролитов.«Сохраняя все то, что приобретено в отношении к пониманию растворов, — писал Менделеев, — мне кажется, что можно оставить в стороне гипотезу об особом виде диссоциации — на ионы, совершенные с электролитами при образовании слабых растворов».
Хотя Менделеев, критикуя Аррениуса, во многом не прав, в его рассуждениях была значительная доля истины. Как это часто бывает в науке, в ожесточенном споре между приверженцами физической и химической теории оказались обе стороны. Очень сильное химическое взаимодействие между ионами и молекулами растворителя дает ту энергию, которая необходима для разрушения кристаллической решетки или молекулы электролитов.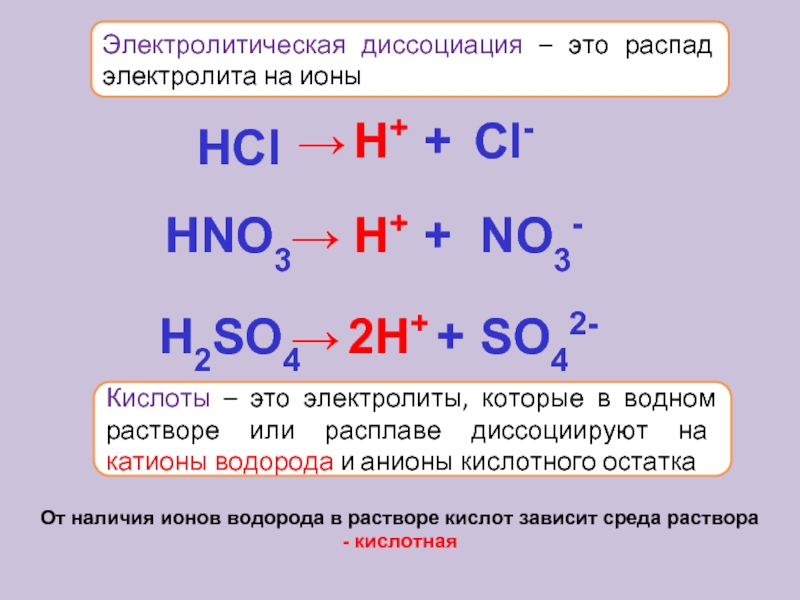 В случае водных растворов эта энергия называется энергией гидратации (гидро по-гречески вода) и она может достигать очень больших значений; так, энергия гидратации катионов Na + почти вдвое больше, чем энергия разрыва связи в молекуле Cl 2 . Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решетки). В результате суммарной энергии гидратации и анионов при образовании раствора больше энергии кристаллической решетки (или энергии связи между атомами в таких электролитах, как HCl, H 2 SO 4 ), растворение будет сопровождаться нагреванием, а если меньше — охлаждением раствора .Именно поэтому при растворении в воде таких веществ как LiCl, безводный CaCl 2 и многих других раствор нагревается, при растворении KCl, KNO 3 , NH 4 NO 3 и некоторых других — охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой и может даже примерзнуть к мокрой подставке!
В случае водных растворов эта энергия называется энергией гидратации (гидро по-гречески вода) и она может достигать очень больших значений; так, энергия гидратации катионов Na + почти вдвое больше, чем энергия разрыва связи в молекуле Cl 2 . Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решетки). В результате суммарной энергии гидратации и анионов при образовании раствора больше энергии кристаллической решетки (или энергии связи между атомами в таких электролитах, как HCl, H 2 SO 4 ), растворение будет сопровождаться нагреванием, а если меньше — охлаждением раствора .Именно поэтому при растворении в воде таких веществ как LiCl, безводный CaCl 2 и многих других раствор нагревается, при растворении KCl, KNO 3 , NH 4 NO 3 и некоторых других — охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой и может даже примерзнуть к мокрой подставке!
Механизм электролитической диссоциации можно рассмотреть на примере хлороводорода. Связь H – Cl — ковалентная, полярная ( см .МОЛЕКУЛ СТРОЕНИЕ), молекулы HCl — диполи с отрицательным полюсом на атоме Cl и положительным на атоме Н. Полярны и молекулы воды. В водном растворе молекулы HCl окружены со всеми молекулами воды так, что положительные молекулы полюса Н 2 О притягиваются к отрицательным полюсам молекулы HCl, а отрицательные полюса — к положительным полюсам молекулы HCl. В результате связи H – Cl сильно поляризуется и разрывается при образовании гидратированных катионов H + и анионов Cl — : диполи Н 2 Как бы растаскивают молекулы HCl на отдельные ионы.Каждый катион H + в растворе окружен со всеми сторонними диполями Н 2 О, направленными к нему своими отрицательными полюсами, каждый анион Cl — окружен противоположно ориентированными диполями Н 2 О. Аналогичные процессы в воде с молекулами H 2 SO 4 , другими молекулами с полярными ковалентными связями, а также с ионными кристаллами.
Связь H – Cl — ковалентная, полярная ( см .МОЛЕКУЛ СТРОЕНИЕ), молекулы HCl — диполи с отрицательным полюсом на атоме Cl и положительным на атоме Н. Полярны и молекулы воды. В водном растворе молекулы HCl окружены со всеми молекулами воды так, что положительные молекулы полюса Н 2 О притягиваются к отрицательным полюсам молекулы HCl, а отрицательные полюса — к положительным полюсам молекулы HCl. В результате связи H – Cl сильно поляризуется и разрывается при образовании гидратированных катионов H + и анионов Cl — : диполи Н 2 Как бы растаскивают молекулы HCl на отдельные ионы.Каждый катион H + в растворе окружен со всеми сторонними диполями Н 2 О, направленными к нему своими отрицательными полюсами, каждый анион Cl — окружен противоположно ориентированными диполями Н 2 О. Аналогичные процессы в воде с молекулами H 2 SO 4 , другими молекулами с полярными ковалентными связями, а также с ионными кристаллами. В них уже имеются «готовые» ионы, и роль диполей воды сводится к отделению катионов от анионов.
В них уже имеются «готовые» ионы, и роль диполей воды сводится к отделению катионов от анионов.
Ионы резко отличаются по физическим и химическим свойствам своим нейтральным атомам. Например, атомы Na реагируют с водой, а катионы Na + — нет; хлор — сильный окислитель и ядовит, а анионы Cl — не являются окислителем и не ядовиты. Цвет первой при гидратации может измениться. Например, негидратированные ионы меди бесцветны (безводный CuSO 4 ), а гидратированные — голубые.
Используя диссоциацию в растворах, уравнения многих факторов можно записать в сокращенном ионном виде.Ионное уравнение показывает, какие именно ионы участвуют в реакции. Например, полное уравнение реакции AgNO 3 + NaCl ® AgCl + NaNO 3 можно записать в сокращенном ионном виде: Ag + + Cl — ® AgCl. Суть реакции состоит в образовании осадка AgCl при встрече Ag + и Cl — , тогда как ионы Na + и NO 3 — остаются в растворе и фактически не принимают участие в реакции.
Илья Леенсон
Применение электролитов »Primelab | Производство лабораторного и аналитического оборудования
Основные свойства
Обычная вода и другие вещества не проводят ток.Растворы становятся токопроводимыми, только если вещества распадаться на ионы. В отличие от металлов электролиты называют проводниками второго порядка. Ими могут выступать некоторые кристаллы и расплавы, например иодид серебра, диоксид циркония.
Основным своим электролитом является возможность электролитической диссоциации, представляющей собой процесс распада молекул при взаимодействии с водой, другими растворителями. В результате распада появились заряженные ионы.
В зависимости от типа образующихся идеально различают такие электролиты:
- щелочные,
- кислотные,
- солевые.
В щелочных электропроводящих способных ионами ОН и металлов. В кислотных — ионами Н +, а также остатками оснований кислот. Процесс диссоциации зависит от таких факторов:
- содержит веществ,
- выбора растворителя,
- температуры.

- растворимые соли,
- сильные кислоты,
- щелочи.
Если говорить об аккумуляторах, то для них важна плотность токопроводящих сред.Она определяет емкость батарей и срок их службы.
Возможности для применения
В основном применение электролитовено в промышленности. С их помощью изготавливают источники тока разного назначения. Это могут быть автомобильные аккумуляторы и различные виды батарей. Для них используются щелочные вещества, проводящие ток.
Аналитическая практика использования ионометров и рН-метров, которые заполнены солевыми веществами, проводящими ток. Приборы применяют для измерения кислотности среды, систематическими веществами.
Если говорить об электрохимической индустрии, то растворы для гальванирования методов на основе веществ, способных к диссоциации. Также они применяются в биологии и медицине. Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
К достоинствам аккумуляторов, построенных на щелочных веществах, способных к диссоциации, относят:
- длительный срок службы;
- надежность;
- меньшее количество токсичных веществ, выделяемых в процессе работы;
- возможность использования в широком температурном диапазоне;
- неприхотливость;
- меньшая масса в сравнении с кислотными.
Если говорить об автомобильной индустрии, то это востребованные кислотные аккумуляторы. К их непосредственным преимуществам защиты:
- простое и отработанное обслуживание;
- низкий саморазряд;
- приемлемая стоимость;
- способность давать высокий ток при старте.
Основные меры предосторожности
Все популярные вещества, способные проводить ток, основание щелочи или серной кислоты. Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
- наличие в помещении нейтрализующих веществ, воды, аптечки;
- для нейтрализации кислотного ожога необходим раствор соды, используется одна чайная ложка на воды;
- для нейтрализации щелочных ожогов раствор борной кислоты, берется чайная ложка на воды;
- если агрессивное вещество попало в глаза, для его нейтрализации применяются растворы в два разаее;
- если произошел ожог, сначала используется нейтрализующее вещество, а потом вода.
Важно при работе соблюдать все правила безопасности, чтобы избежать ожогов. Основные из них:
- кислоту необходимо наливать в воду и ни в коем случае не наоборот;
- при работе с твердой щелочью ее необходимо опускать в воду при помощи щипцов;
- хранение в одном помещении или работа одновременно с кислотными и щелочными веществами запрещена.

Если при выполнении работ кипение вещества, оно будет сопровождаться выделением взрывоопасного и горючего газа — водорода.Соответственно, в помещении необходимо предусмотреть его отвод, взрывобезопасную проводку, защитить все электроприборы.
Хранение опасных веществ организовывают в пластиковых емкостях. Для работы с ними подходит фарфоровая, керамическая и стеклянная посуда.
Билим булагы — Химия: Электролитическая диссоциация
Хорошо, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора.
Он состоит из угольных стержней (электродов), собственных проводов к электрической сети. В цепи включена электрическая лампочка, которая показывает или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрические токи, называются электролитами. Вещества, которые в тех же условиях на ионы не проводят, называются неэлектролитами.К электролитам соединения цепи, и почти все соединения, к большинству соединений, основных соединений.
Вещества, которые в тех же условиях на ионы не проводят, называются неэлектролитами.К электролитам соединения цепи, и почти все соединения, к большинству соединений, основных соединений.
Для объяснения различных водных растворов электролитов шведским ученым С.Арениусом в 1887 г. была предложена теория электролитической диссоциации. В расширенной системе развита учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.Ионы находятся в более устойчивых электронных состояниях, чем устойчивы.
Они могут состоять из одного атома — это простые ионы (Na + , Mg 2+ , Аl 3+ и т.д.) — или из нескольких элементов — это сложные ионы (NО 3 — , СО 4 2– , РО 4 3– и т.д. ).
).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами. Направленное движение происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс : параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения (ассоциация) . Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.Например:
С помощью теории электролитической диссоциации определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Диссоциация многоосновных кислот протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами H 3 РO 4 имеются ионы (в составе увеличивающегося количествах)
Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами H 3 РO 4 имеются ионы (в составе увеличивающегося количествах)
Основания называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.Например: KOH = K + OH
«Электролитическая диссоциация» — процесс обратный, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α ). Степень диссоциации — это отношение числа распавшихся ионы молекул N и к общему количеству растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах.Если α = 0 , то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20% , то это означает, что из 100 молекул данного электролита 20 распалось на ионы.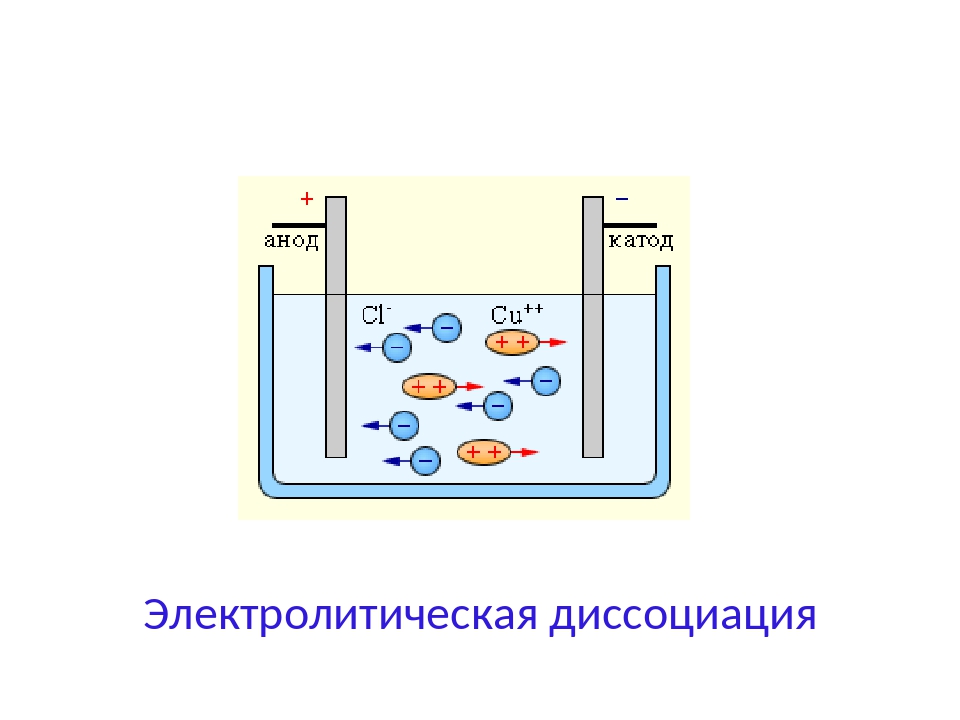
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов вызывают реакции между ионами. Они называются ионными реакциями, уравнения этих уравнений — ионными уравнениями. Они используют более простые методы, записанные в указанной форме, и имеют более общий характер.
При составлении ионных уравнений следует руководствоваться тем, что вещества: * малодиссоциированные (вода), * малорастворимые (выпадающие в осадок) * газообразные записываются в молекулярной форме.
Знак ↓ стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется из сферы реакции в виде газа.
Константа K в , равная концентрация концентраций протонов и гидроксид-его, называется ионным произведением воды.Используется постоянная не только для чистой воды, но и для разбавленных водных растворов. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и K в , при понижении температуры — наоборот. При диссоциации воды на ион Н + образует один ион ОН –, следовательно, в воде, использу этих каждый одинаковы: [Н + ] = [ОН –].
При диссоциации воды на ион Н + образует один ион ОН –, следовательно, в воде, использу этих каждый одинаковы: [Н + ] = [ОН –].
Гидролиз солей — это обменное разложение солей водой.Гидролизу подвергаются только растворимые в воде соли
Соль — это электролит, который диссоциирует в растворе и его ионы взаимодействуют с молекулами воды. Катионы получают от воды ионы OH — , а анионы получают ионы Н + .
В процессе гидролиза образуется электролит более слабый, недиссоциируемый, следовательно, более устойчивый, чем гидролизуемая соль. Гидролиз практически возможен лишь в том случае, если один из получаемых электролитов (кислота или основание) более слабый, чем гидролизуемая соль.Гидролиз — это процесс обратный процесс нейтрализации
Наиболее быстро и полно гидролиз происходит в разбавленных растворах.
По степени диссоциации все кислоты и растворимые основания (щелочи) разделяют на сильные и слабые.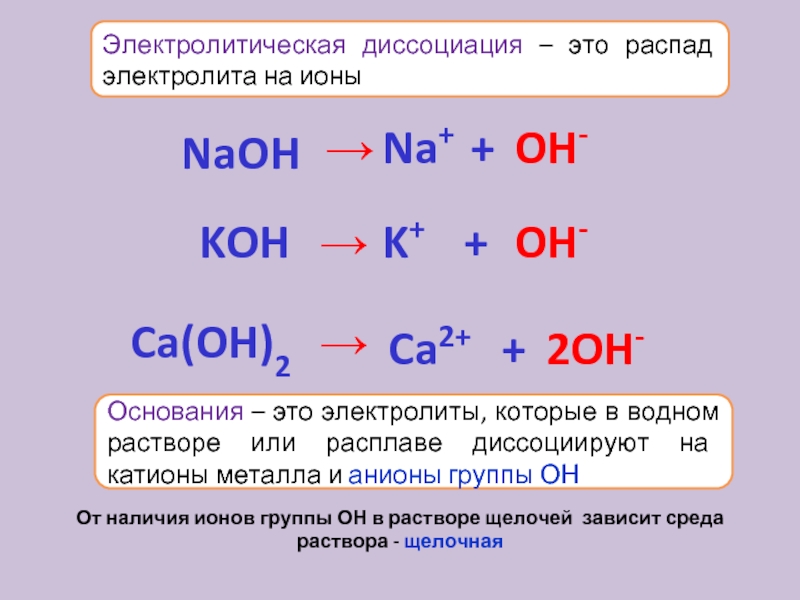
Сильные кислоты: HClO 4 , HClO 3 , H 2 SO 4 , HNO 3 , HI, HBr, HCl.
Сильные основания (щелочи): CsOH, RbOH, KOH, NaOH, LiOH, Ba (OH) 2 , Sr (OH) 2 , Ca (OH) 2 .
1) Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются. При растворении в воде они полностью диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы.
2) Соли, образованные сильной кислотой и слабым основанием гидролизуются с получением кислой среды, рН≤7.
3) Соли, образованные сильным основанием и слабой кислотой гидролизуются с получением щелочной среды, рН≥7.
4) Соли, образованные слабым основанием и слабой кислотой гидролизуются, соль растворима.Обычно такие соли
Константа диссоциации для уксусной кислоты CH 3 COOH = 1,8 · 10 -5 , константа диссоциации для гидроксида аммония также равна NH 4 OH = 1,8 · 10 -5 . Т.е. численные показатели этих веществ равны, что говорит о получении нейтральной среды при гидролизе ацетата аммония.
Т.е. численные показатели этих веществ равны, что говорит о получении нейтральной среды при гидролизе ацетата аммония.
(Химики обычно нюхают соль (кроме цианидов). Ацетат аммония пахнет уксусной кислотой, поэтому говорят о слабой кислотности этой соли)
Более подробно рассматриваются летучесть аммиака, как газообразного вещества при длительном хранении вещества.
Гидролиз солей может протекать ступенчато. Количество ступеней равно валентности металла в составе соли валентности кислотного остатка.
Таким образом, гидролизуются соли, если они растворимы и образованы сильным и слабым компонентами соли (катионом или анионом). При наличии в составе соли сильного катиона, полученного из щелочи, гидролиз соли к образованию щелочной среды. Эта соль образована сильной кислотой и слабым основанием, сильным анионым к образованию кислой среды при гидролизе соли.Т.е. работает закон: «Кто сильный, тот и прав!».
Представленная модифицированная таблица растворимости солей ориентирована на определение рН среды, которая образуется при гидролизе соли.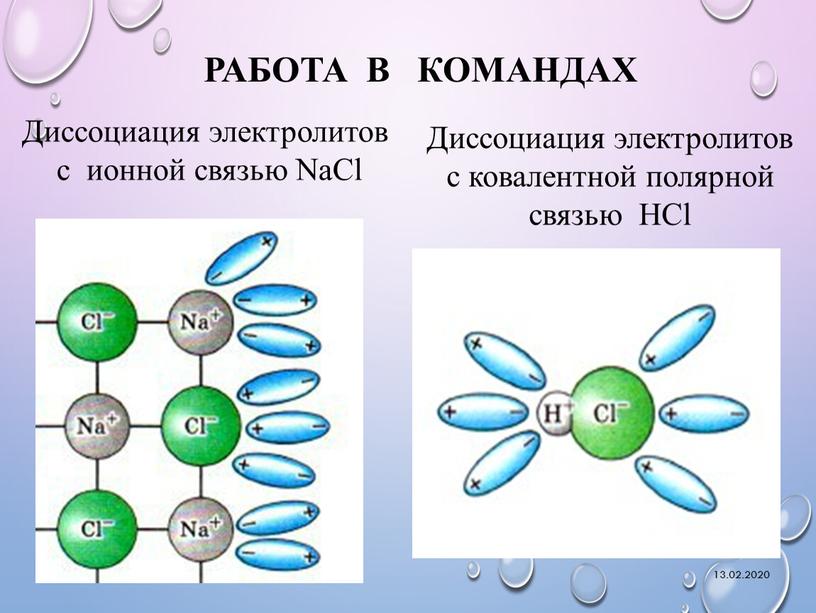
HOH
Гидроксид водорода, соединение гидроксильной группы OH — и катиона H +
CsOH
Гидроксид цезия — сильнейшее основание.
RbOH
Гидроксид рубидия, является одним из самых сильных оснований.
КОН
Гидроксид калия. Сильное основание.
NaOH
Гидроксид натрия. Сильное основание.
LiOH
Гидроксид лития. Сильное основание.
Ba (OH) 2
Гидроксид бария. Сильное основание.
Sr (OH) 2
Гидроксид стронция. Сильное основание.
Са (ОН) 2
Гидроксид кальция. Сильное основание.
NH 4 ОН
Гидроксид аммония.Сильное основание.
Мг (OH) 2
Гидроксид магния. Слабое основание. Не растворяется в воде.
Al (OH) 3
Гидроксид алюминия. Слабое основание. Не растворяется в воде.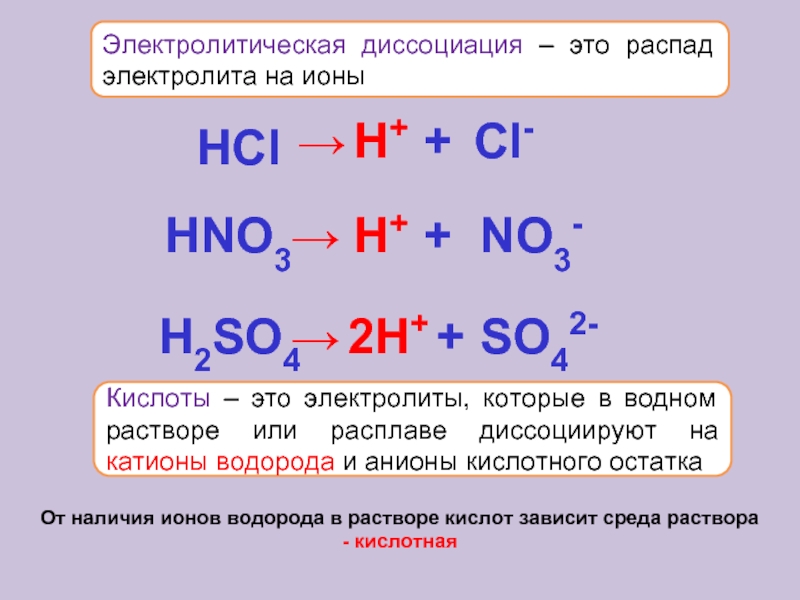
Mn (OH) 2
Гидроксид марганца. Слабое основание. Не растворяется в воде.
Zn (OH) 2
Гидроксид цинка. Слабое основание. Не растворяется в воде.
Cr (OH) 3
Гидроксид хрома.Слабое основание. Не растворяется в воде.
Fe (OH) 2
Гидроксид железа (II). Слабое основание. Не растворяется в воде.
Fe (OH) 3
Гидроксид железа (III). Слабое основание. Не растворяется в воде.
Co (OH) 2
Гидроксид кобальта. Слабое основание. Не растворяется в воде.
Ni (OH) 2
Гидроксид никеля. Слабое основание. Не растворяется в воде.
Pb (OH) 2
Гидроксид свинца. Слабое основание. Малорастворим в воде.
Cu (OH) 2
Гидроксид меди. Слабое основание. Не растворяется в воде.
Hg (OH) 2
Не существует в водном растворе.
Ag (OH)
Не существует.
HClO 4
Хлорная кислота. Cильный окислитель, так как содержит хлор в высшей степени окисления +7.
CsClO 4
Перхлорат цезия. Слабо растворим в воде примерно 2 гр на 100 мл при температуре 25 o C.
Диссоциирует, образуя нейтральную среду.
RbClO 4
Перхлорат рубидия. Слабо растворим в воде.
Диссоциирует, образуя нейтральную среду.
KClO 4
Перхлорат калия. Слабо растворим в воде примерно 2,1 гр на 100 мл при 25 o C.
Диссоциирует, образуя нейтральную среду.
NaClO 4
Перхлорат натрия. Хорошо растворяется в воде примерно 211 гр на 100 мл при температуре 25 o C.
Диссоциирует, образуя нейтральную среду.
LiClO 4
Перхлорат лития. Растворим в воде примерно 58 гр на 100 мл при температуре 25 o C.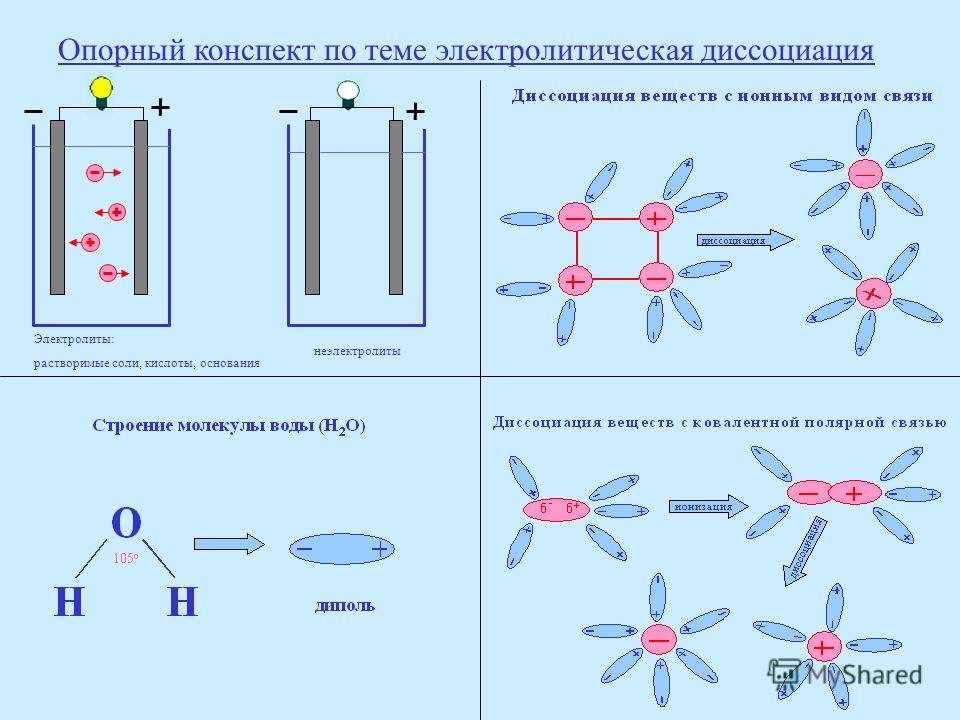
Диссоциирует, образуя нейтральную среду.
Ba (ClO 4 ) 2
Перхлорат бария.Хорошо растворяется в воде примерно 340 гр на 100 мл при температуре 25 o C.
Диссоциирует, образуя нейтральную среду.
Sr (ClO 4 ) 2
Перхлорат стронция. Нет данных.
Диссоциирует, образуя нейтральную среду.
Ca (ClO 4 ) 2
Перхлорат кальция. Хорошо растворяется в воде примерно 188 гр на 100 мл при температуре 25 o C.
Диссоциирует, образуя нейтральную среду.
NH 4 ClO 4
Перхлорат аммония. Хорошо растворяется в воде примерно 24,5 гр на 100 мл при температуре 25 o C.
Диссоциирует, образуя нейтральную среду.
мг (ClO 4 ) 2
Перхлорат магния. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Al (ClO 4 ) 3
Перхлорат алюминия.Хорошо растворяется в воде примерно 135 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Mn (ClO 4 ) 2
Перхлорат марганца. Хорошо растворяется в воде примерно 52 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Zn (ClO 4 ) 2
Перхлорат цинка. Хорошо растворяется в воде примерно 112 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cr (ClO 4 ) 3
Перхлорат хрома. Хорошо растворяется в воде примерно 133 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (ClO 4 ) 2
Перхлорат железа (II). Хорошо растворяется в воде примерно 300 гр на 100 мл при температуре 25 o C.
Хорошо растворяется в воде примерно 300 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (ClO 4 ) 3
Перхлорат железа (III). Хорошо растворяется в воде примерно 395 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Co (ClO 4 ) 2
Перхлорат кобальта. Хорошо растворяется в воде примерно 110 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Ni (ClO 4 ) 2
Перхлорат никеля.Хорошо растворяется в воде примерно 111 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Pb (ClO 4 ) 2
Перхлорат свинца. Хорошо растворяется в воде примерно 80 гр на 100 мл при температуре 25 o C.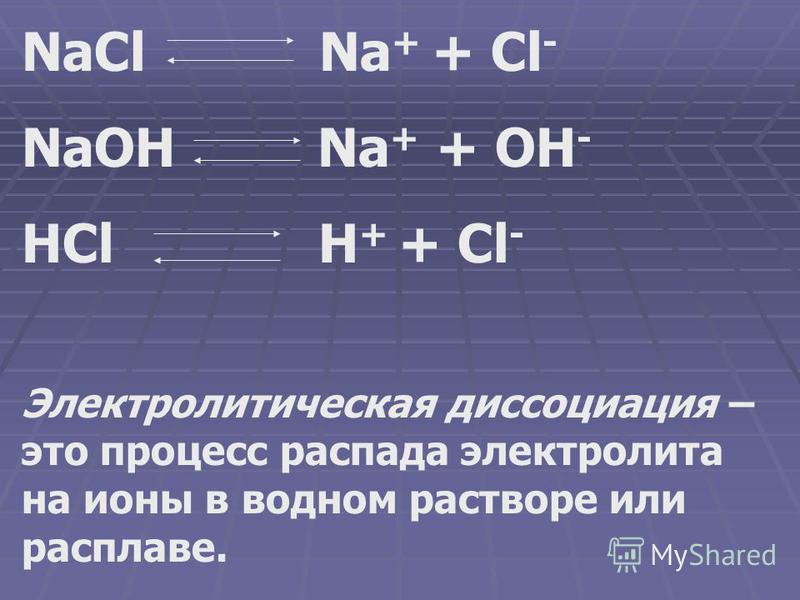
В результате гидролиза, образуется кислая среда.
Cu (ClO 4 ) 2
Перхлорат меди. Хорошо растворяется в воде примерно 150 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Hg (ClO 4 ) 2
Перхлорат ртути (II). Хорошо растворяется в воде примерно 290 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
AgClO 4
Перхлорат серебра. Хорошо растворяется в воде примерно 557 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
HClO 3
Хлорноватая кислота. сильная кислота, в которой хлор имеет степень окисления +5.
Заменить.
CsClO 3
Хлорат цезия. Растворяется в воде примерно 9 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
RbClO 3
Хлорат рубидия. Растворяется в воде примерно 7 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
KClO 3
Хлорат калия. Растворяется в воде примерно 8 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
NaClO 3
Хлорат натрия. Хорошо растворяется в воде примерно 100 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
LiClO 3
Хлорат лития.Хорошо растворяется в воде примерно 400 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
Ba (ClO 3 ) 2
Хлорат бария. Растворяется в воде примерно 37 гр на 100 мл при температуре 25 o C.
Диссоциирует.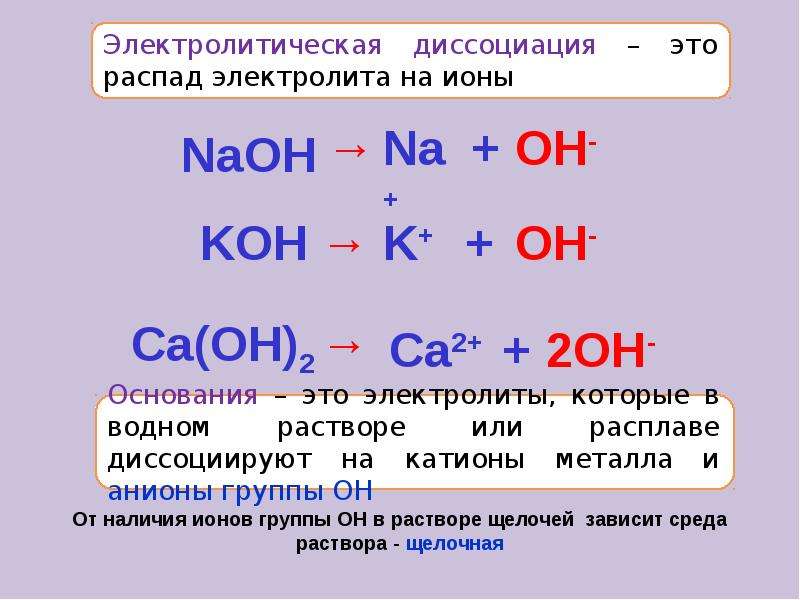 Образует нейтральную среду.
Образует нейтральную среду.
Sr (ClO 3 ) 2
Хлорат стронция. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
Ca (ClO 3 ) 2
Хлорат кальция. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
NH 4 ClO 3
Хлорат аммония. Растворяется в воде примерно 30 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
мг (ClO 3 ) 2
Хлорат магния. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Al (ClO 3 ) 3
Хлорат алюминия. Растворяется в воде примерно 77 гр на 100 мл при температуре 25 o C.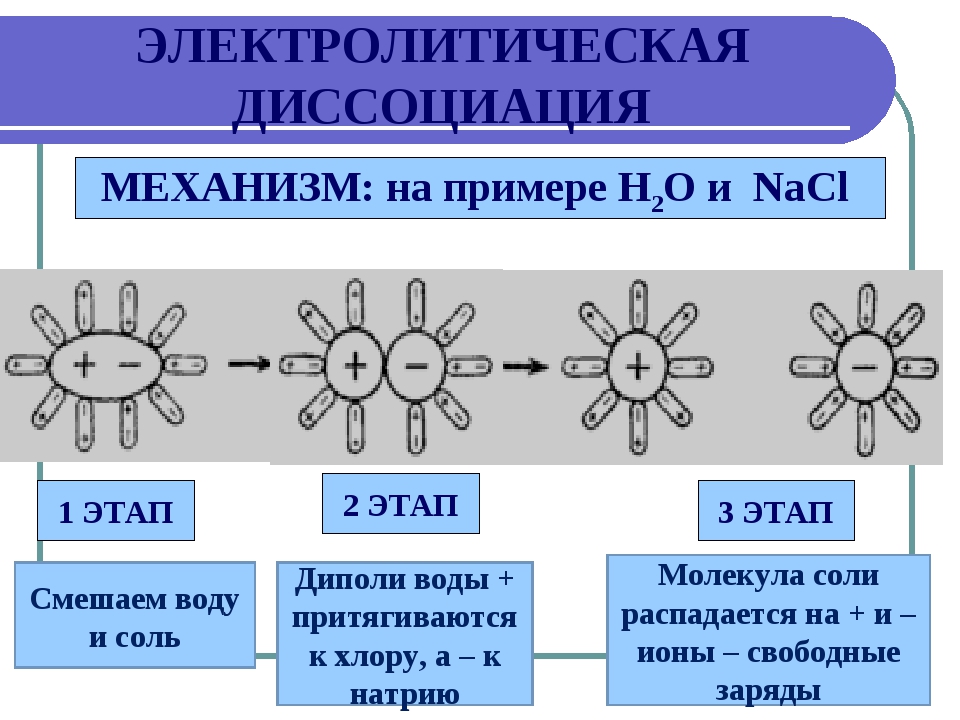
В результате гидролиза, образуется кислая среда.
Mn (ClO 3 ) 2
Хлорат марганца.Нет данных
В результате гидролиза, образуется кислая среда.
Zn (ClO 3 ) 2
Хлорат цинка. Хорошо растворяется в воде примерно 218 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cr (ClO 3 ) 3
Хлорат хрома. Хорошо растворяется в воде примерно 142 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (ClO 3 ) 2
Хлорат железа (II). Хорошо растворяется в воде примерно 210 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (ClO 3 ) 3
Хлорат железа (III). Нет данных
В результате гидролиза, образуется кислая среда.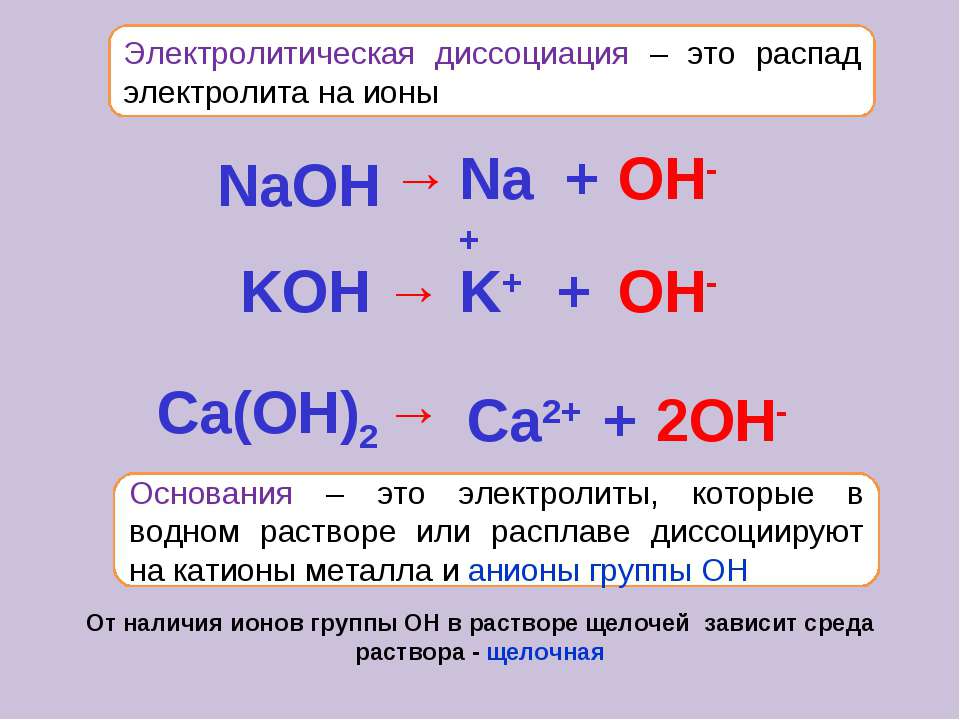
Co (ClO 3 ) 2
Хлорат кобальта. Хорошо растворяется в воде примерно 185 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Ni (ClO 3 ) 2
Хлорат никеля. Хорошо растворяется в воде примерно 145 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Pb (ClO 3 ) 2
Хлорат свинца. Хорошо растворяется в воде примерно 144 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cu (ClO 3 ) 2
Хлорат меди. Хорошо растворяется в воде примерно 250 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Hg (ClO 3 ) 2
Хлорат ртути. Растворяется в воде примерно 25 гр на 100 мл при температуре 25 o C.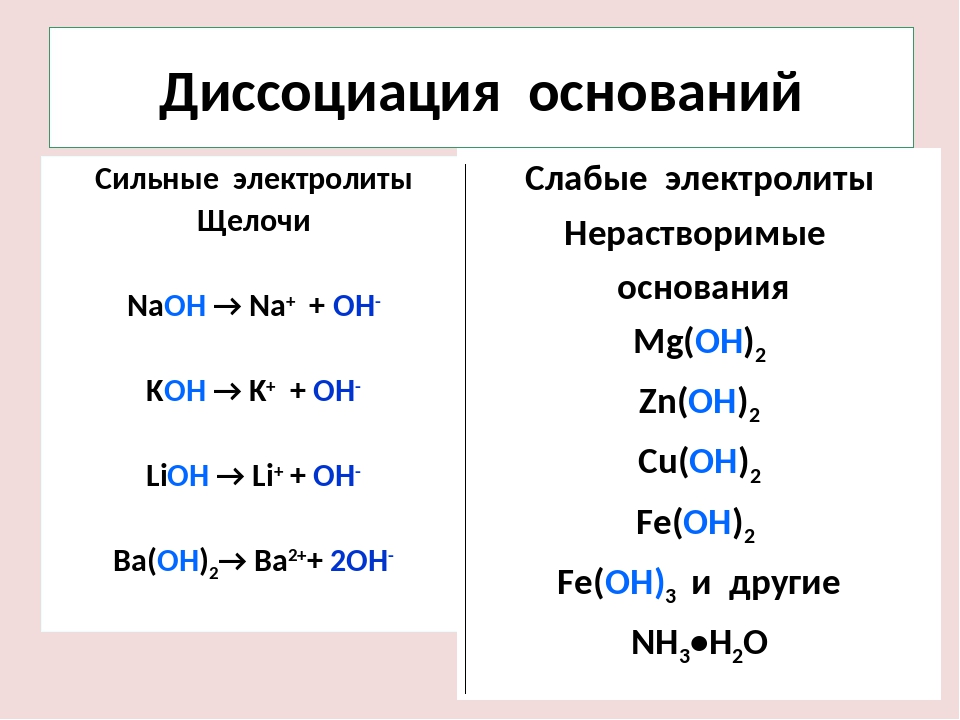
В результате гидролиза, образуется кислая среда.
AgClO 3
Хлорат серебра.Растворяется в воде примерно 18 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
H 2 SO 4
Серная кислота. сильная кислота, отвечающая высшей степени окисления серы (+6)
CS 2 SO 4
Сульфат цезия. Хорошо растворяется в воде примерно 180 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
руб 2 СО 4
Сульфат рубидия. Растворяется в воде примерно 51 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
К 2 СО 4
Сульфат калия. Растворяется в воде примерно 12 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
Образует нейтральную среду.
Na 2 SO 4
Сульфат натрия.Растворяется в воде примерно 30 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
Li 2 SO 4
Сульфат лития. Растворяется в воде примерно 34 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
BaSO 4
Сульфат бария. Не растворяется в воде.
СрСО 4
Сульфат стронция.Плохо растворяется в воде, примерно 0,013 гр на 100 мл при 25 o C.
Диссоциирует. Образует нейтральную среду.
CaSO 4
Сульфат кальция. Плохо растворяется в воде, примерно 0,26 гр на 100 мл при 25 o C.
Диссоциирует. Образует нейтральную среду.
(NH 4 ) 2 SO 4
Сульфат аммония.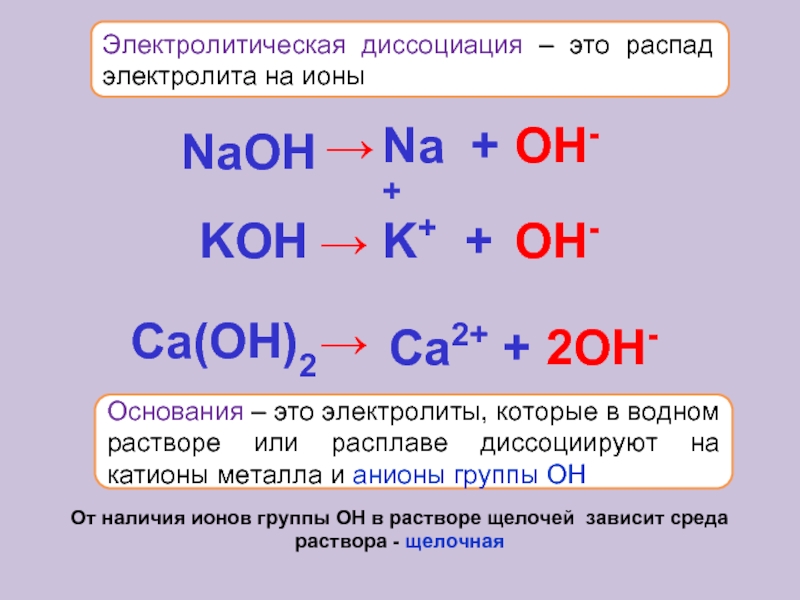 Хорошо растворяется в воде, примерно 118 гр на 100 мл при температуре 25 o C.
Хорошо растворяется в воде, примерно 118 гр на 100 мл при температуре 25 o C.
Диссоциирует. Образует нейтральную среду.
MgSO 4
Сульфат магния. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Al 2 (SO 4 ) 3
Сульфат алюминия. Растворяется в воде, примерно 37 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
MnSO 4
Сульфат марганца. Хорошо растворяется в воде, примерно 63 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
ZnSO 4
Сульфат цинка. Хорошо растворяется в воде, примерно 57 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cr 2 (SO 4 ) 3
Сульфат хрома. Хорошо растворяется в воде, примерно 220 гр на 100 мл при температуре 25 o C.
Хорошо растворяется в воде, примерно 220 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
FeSO 4
Сульфат железа (II). Хорошо растворяется в воде, примерно 53 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe 2 (SO 4 ) 3
Сульфат железа (III). Очень хорошо растворяется в воде, примерно 440 гр на 100 мл при 25 o C.
В результате гидролиза, образуется кислая среда.
CoSO 4
Сульфат кобальта. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
NiSO 4
Сульфат никеля. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
ПбСО 4
Сульфат свинца.Не растворяется в воде.
CuSO 4
Сульфат меди. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
HgSO 4
Сульфат ртути. Почти не растворим.
Гидролизуется большим количеством воды, образуя кислую среду.
Ag 2 SO 4
Сульфат серебра. Плохо растворяется в воде, примерно 0,84 гр на 100 мл при 25 o C.
В результате гидролиза, образуется кислая среда.
HNO 3
Азотная кислота. Cильный окислитель. Нитрат-ион в воде не гидролизуется.
ЦСНО 3
Нитрат цезия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
РБНО 3
Нитрат рубидия. Хорошо растворяется в воде, примерно 70 гр на 100 мл при температуре 25 o C.
Хорошо растворяется в воде, примерно 70 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
КНО 3
Нитрат калия. Растворяется в воде, примерно 38 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NaNO 3
Нитрат натрия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
LiNO 3
Нитрат лития.Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Ba (NO 3 ) 2
Нитрат бария. Растворяется в воде, примерно 10 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Sr (№ 3 ) 2
Нитрат стронция. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25 o C.
Растворяется в воде, примерно 74 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Ca (НЕТ 3 ) 2
Нитрат кальция. Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NH 4 НЕТ 3
Нитрат аммония. Хорошо растворяется в воде, примерно 212 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
мг (NO 3 ) 2
Нитрат магния. Растворяется в воде, примерно 72,7 гр на 100 мл при 25 o C.
В результате гидролиза, образуется кислая среда.
Al (НЕТ 3 ) 3
Нитрат алюминия. Растворяется в воде, примерно 78 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.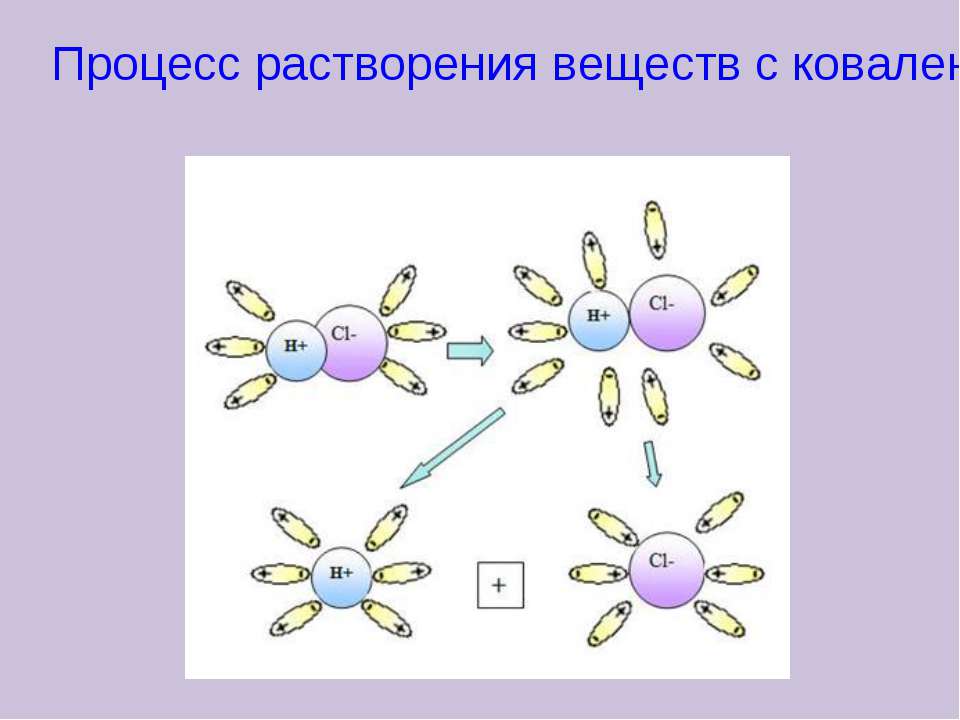
Mn (НЕТ 3 ) 2
Нитрат марганца.Хорошо растворяется в воде, примерно 140 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Zn (НЕТ 3 ) 2
Нитрат цинка. Хорошо растворяется в воде, примерно 130 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cr (НЕТ 3 ) 3
Нитрат хрома. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (НЕТ 3 ) 2
Нитрат железа (II). Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (НЕТ 3 ) 3
Нитрат железа (III). Хорошо растворяется в воде, примерно 160 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Co (NO 3 ) 2
Нитрат кобальта. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Ni (НЕТ 3 ) 2
Нитрат никеля. Хорошо растворяется в воде, примерно 98 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Pb (НЕТ 3 ) 2
Нитрат свинца.Растворяется в воде, примерно 56,5 гр на 100 мл при 25 o C.
В результате гидролиза, образуется кислая среда.
Cu (НЕТ 3 ) 2
Нитрат меди. Хорошо растворяется в воде, примерно 145 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Hg (NO 3 ) 2
Нитрат ртути. Растворим в водных водных растворах.
Растворим в водных водных растворах.
В результате гидролиза, образуется кислая среда.
AgNO 3
Нитрат серебра. Хорошо растворяется в воде, примерно 250 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
HI
Иодоводородная кислота. Сильный окислитель.
CsI
Иодид цезия. Хорошо растворяется в воде, примерно 90 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
руб.
Иодид рубидия.Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
КИ
Иодид калия. Хорошо растворяется в воде, примерно 148 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NaI
Иодид натрия. Хорошо растворяется в воде, примерно 184 гр на 100 мл при температуре 25 o C.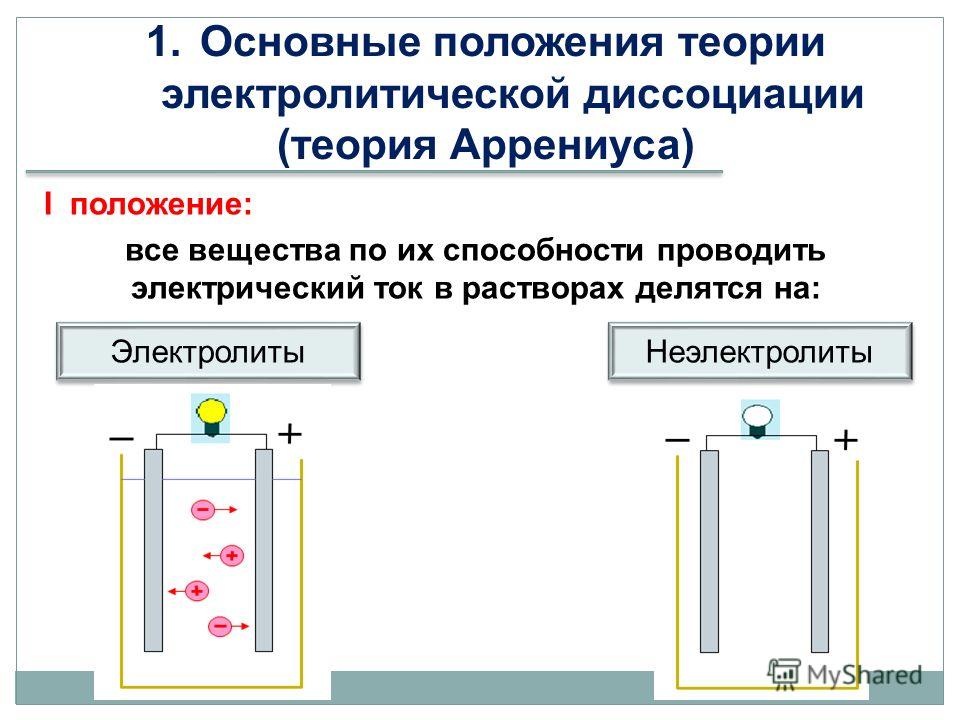
Диссоциирует, образует нейтральную среду.
LiI
Иодид лития. Хорошо растворяется в воде, примерно 167 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Бай 2
Иодид бария. Хорошо растворяется в воде, примерно 218 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
SrI 2
Иодид стронция. Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
CaI 2
Иодид кальция. Хорошо растворяется в воде, примерно 215 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NH 4 I
Иодид аммония. Хорошо растворяется в воде, примерно 176 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
MgI 2
Иодид магния.Хорошо растворяется в воде, примерно 142 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Али 3
Иодид алюминия. Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
МНИ 2
Иодид марганца. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
ЗНИ 2
Иодид цинка.Хорошо растворяется в воде, примерно 440 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
CrI 3
Иодид хрома. Плохо растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI 2
Иодид железа (II). Растворяется в воде.
В результате гидролиза, образуется кислая среда.
FeI 3
Иодид железа (III). Диспропорционирует при растворении в воде.
Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
CoI 2
Иодид кобальта. Хорошо растворяется в воде, примерно 210 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
NiI 2
Иодид никеля. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Пби 2
Иодид свинца. Плохо растворяется в воде, примерно 0,076 гр на 100 мл при 25 o C.
В результате гидролиза, образуется кислая среда.
CuI 2
Иодид меди. Диспропорционирует при растворении в воде.
В результате гидролиза, образуется кислая среда.
HgI 2
Иодид ртути. Не растворяется в воде.
AgI
Иодид серебра.Не растворяется в воде.
HBr
Бромоводородная кислота. Сильная одноосновная кислота.
CSBr
Бромид цезия. Хорошо растворяется в воде, примерно 110 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
руб.
Бромид рубидия. Хорошо растворяется в воде, примерно 114 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
КБр
Бромид калия. Растворяется в воде, примерно 68 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NaBr
Бромид натрия. Хорошо растворяется в воде, примерно 94 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
LiBr
Бромид лития. Хорошо растворяется в воде, примерно 170 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Ba (Br) 2
Бромид бария. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25 o C.
Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Sr (Br) 2
Бромид стронция. Хорошо растворяется в воде, примерно 107 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Ca (Br) 2
Бромид кальция.Хорошо растворяется в воде, примерно 153 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NH 4 Br
Бромид аммония. Хорошо растворяется в воде, примерно 78 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
Мг (Br) 2
Бромид магния. Хорошо растворяется в воде, примерно 103 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Al (Br) 3
Бромид алюминия. Хорошо растворяется в воде.
Хорошо растворяется в воде.
В результате гидролиза, образуется кислая среда.
Mn (Br) 2
Бромид марганца. Хорошо растворяется в воде, примерно 150 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Zn (Br) 2
Бромид цинка.Хорошо растворяется в воде, примерно 470 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cr (Br) 3
Бромид хрома. Растворяется в воде.
В результате гидролиза, образуется кислая среда.
Fe (Br) 2
Бромид железа (II). Хорошо растворяется в воде, примерно 120 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Fe (Br) 3
Бромид железа (III). Хорошо растворяется в воде, примерно 455 гр на 100 мл при температуре 25 o C.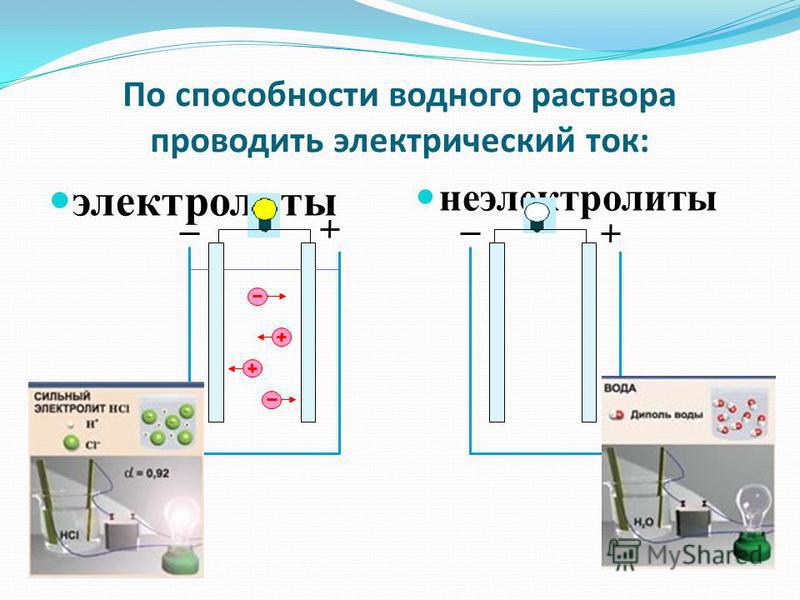
В результате гидролиза, образуется кислая среда.
Co (Br) 2
Бромид кобальта. Хорошо растворяется в воде, примерно 115 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Ni (Br) 2
Бромид никеля.Хорошо растворяется в воде, примерно 134 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Пб (Вр) 2
Бромид свинца. Плохо растворяется в воде, примерно 0,97 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Cu (Br) 2
Бромид меди. Хорошо растворяется в воде, примерно 127 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
Hg (Br) 2
Бромид ртути. Плохо растворяется в воде, примерно 0,61 гр на 100 мл при температуре 25 o C.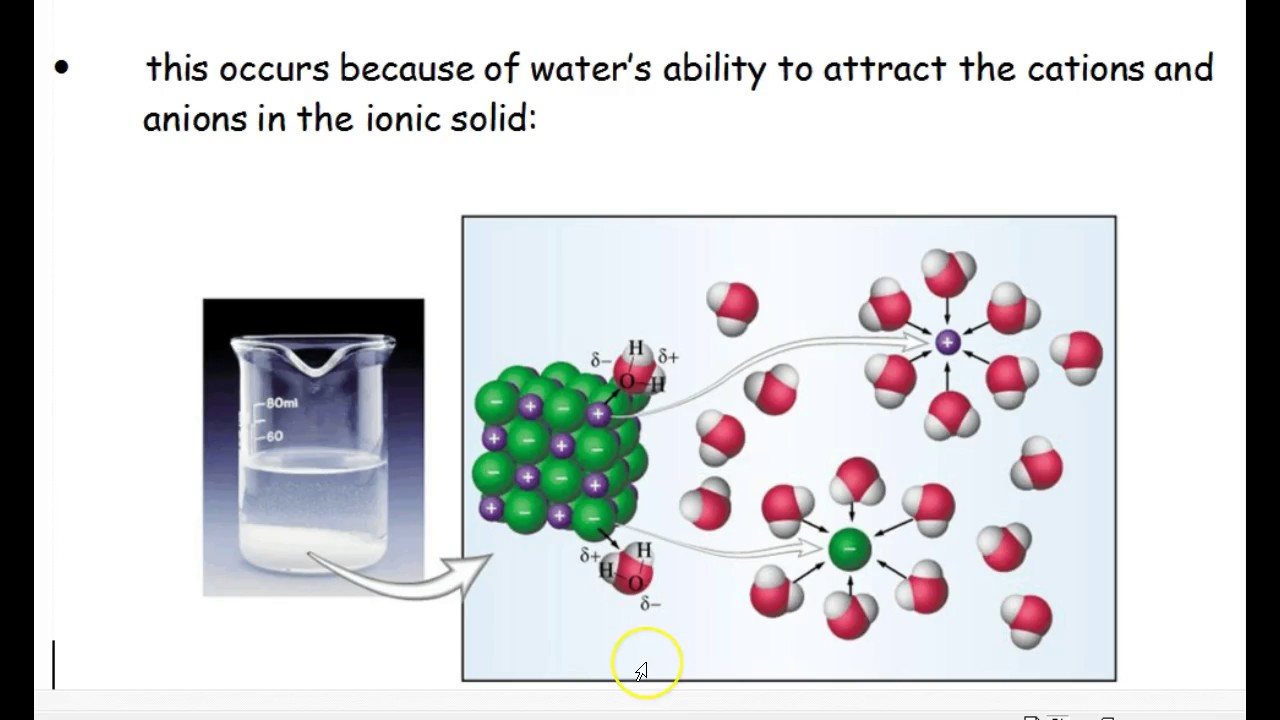
В результате гидролиза, образуется кислая среда.
AgBr
Бромид серебра. Не растворяется в воде.
HCl
Соляная кислота. Сильная одноосновная кислота.
CsCl
Хлорид цезия. Хорошо растворяется в воде, примерно 190 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
RbCl
Хлорид рубидия. Хорошо растворяется в воде, примерно 95 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
KCl
Хлорид калия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NaCl
Хлорид натрия. Растворяется в воде, примерно 36 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
LiCl
Хлорид лития. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25 o C.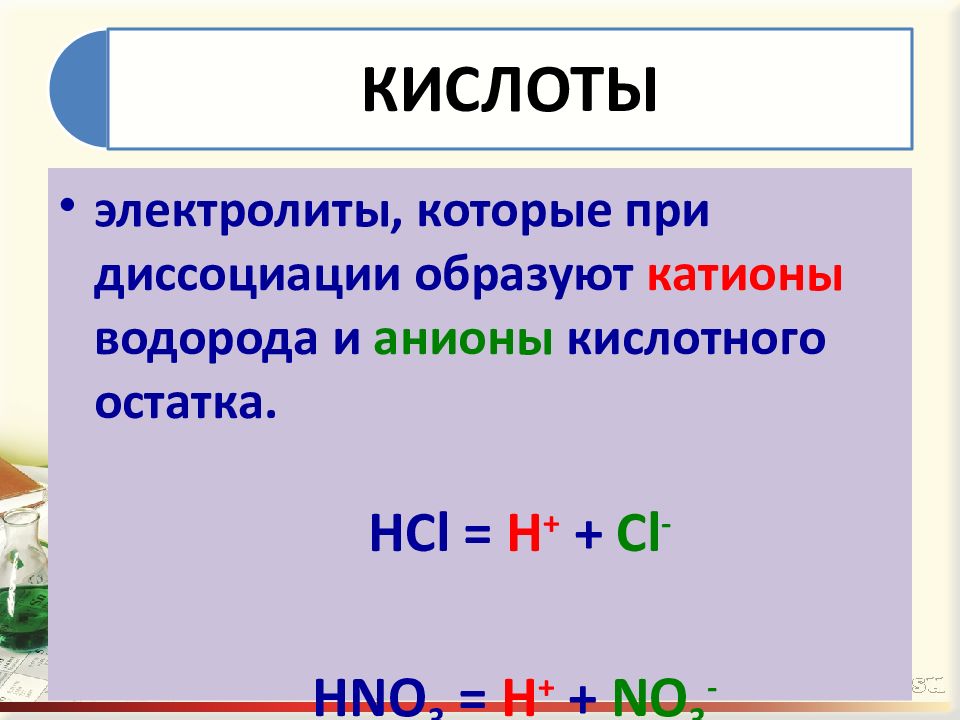
Диссоциирует, образует нейтральную среду.
BaCl 2
Хлорид бария. Растворяется в воде, примерно 37,4 гр на 100 мл при 25 o C.
Диссоциирует, образует нейтральную среду.
SrCl 2
Хлорид стронция.Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
CaCl 2
Хлорид кальция. Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
NH 4 Cl
Хлорид аммония. Растворяется в воде, примерно 39 гр на 100 мл при температуре 25 o C.
Диссоциирует, образует нейтральную среду.
MgCl 2
Хлорид магния. Хорошо растворяется в воде, примерно 55,5 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
AlCl 3
Хлорид алюминия. Растворяется в воде, примерно 45 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
MnCl 2
Хлорид марганца.Хорошо растворяется в воде, примерно 77 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
ZnCl 2
Хлорид цинка. Хорошо растворяется в воде, примерно 408 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
CrCl 3
Хлорид хрома. В воде растворим в восстановителей (Cr 2+ , Fe 2+ ).
В результате гидролиза, образуется кислая среда.
FeCl 2
Хлорид железа (II). Хорошо растворяется в воде, примерно 64 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
FeCl 3
Хлорид железа (IIШ). Хорошо растворяется в воде, примерно 99 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
CoCl 2
Хлорид кобальта. Хорошо растворяется в воде, примерно 56 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
NiCl 2
Хлорид никеля. Хорошо растворяется в воде, примерно 65 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.
PbCl 2
Хлорид свинца.Плохо растворяется в воде, примерно 1,08 гр на 100 мл при 25 o C.
В результате гидролиза, образуется кислая среда.
CuCl 2
Хлорид меди. Хорошо растворяется в воде, примерно 76 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется кислая среда.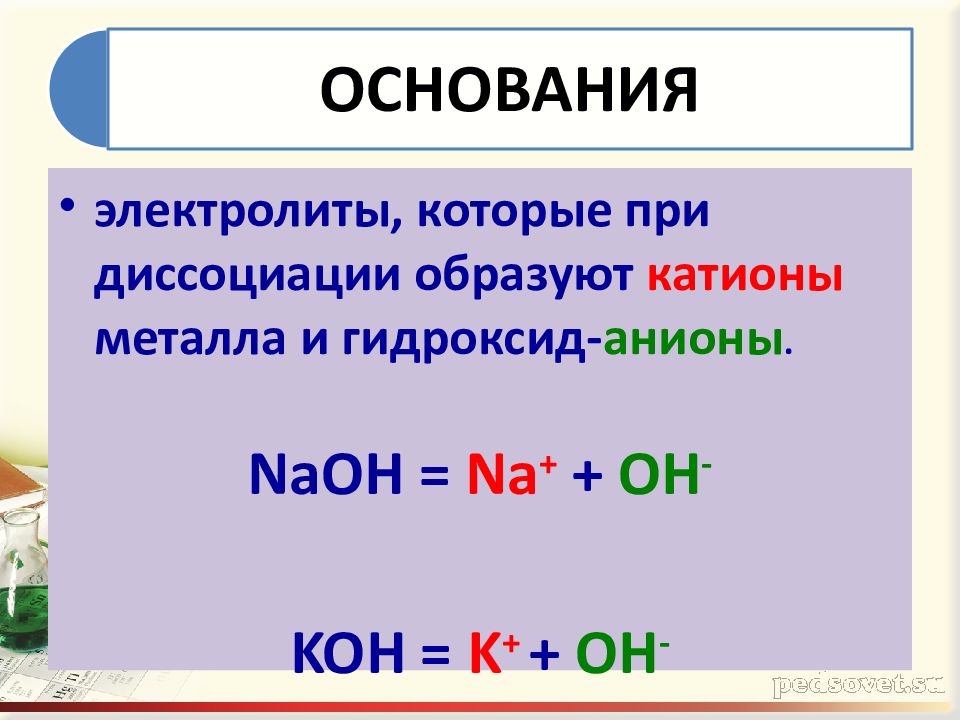
HgCl 2
Хлорид ртути. Не растворяется в воде.
AgCl
Хлорид серебра.Не растворяется в воде.
H 2 SO 3
Сернистая кислота. Неустойчивая двухосновная кислота средней силы.
CS 2 SO 3
Сульфит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
руб. 2 СО 3
Сульфит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
К 2 СО 3
Сульфит калия.Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Na 2 SO 3
Сульфит натрия. Растворяется в воде, примерно 28 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Li 2 SO 3
Сульфит лития. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaSO 3
Сульфит бария. Плохо растворяется в воде, примерно 0,02 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
СрСО 3
Сульфит стронция. Не растворяется в воде.
CaSO 3
Сульфит кальция. Не растворяется в воде.
(NH 4 ) 2 SO 3
Сульфит аммония.Растворяется в воде, примерно 65 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
MgSO 3
Сульфит магния. Плохо растворяется в воде, примерно 0,65 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Al 2 (SO 3 ) 3
Сульфит алюминия.
Гидролиз протекает практически полностью, оба продукта уходят из зоны реакции в виде осадка или газа.
MnSO 3
Сульфит марганца. Не растворяется в воде.
ZnSO 3
Сульфит цинка. Плохо растворяется в воде, примерно 0.16 гр на 100 мл при 25 o C.
Гидролиз протекает практически полностью, оба продукта уходят из зоны реакции в виде осадка или газа.
CrSO 3
Сульфит хрома. Не растворяется в воде.
FeSO 3
Сульфит железа (II).Плохо растворяется в воде.
Гидролиз протекает практически полностью, оба продукта уходят из зоны реакции в виде осадка или газа.
Fe 2 (SO 3 ) 3
Сульфит железа (III). Диспропорционирует при растворении в воде.
CoSO 3
Сульфит кобальта. Не растворяется в воде.
NiSO 3
Сульфит никеля. Не растворяется в воде.
Не растворяется в воде.
ПбСО 3
Сульфит свинца.Не растворяется в воде.
CuSO 3
Сульфит меди. Не растворяется в воде.
HgSO 3
Сульфит ртути. Не растворяется в воде.
Ag 2 SO 3
Сульфит серебра. Очень плохо растворяется в воде, примерно 0.00005255 гр на 100 мл при температуре 25 o C.
Гидролиз протекает практически полностью, оба продукта уходят из зоны реакции в виде осадка или газа.
H 3 PO 4
Ортофо́сфорная кислота (фо́сфорная кислота). Трёхосновная кислота средней силы.
CS 3 PO 4
Фосфат цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
руб 3 а / я 4
Фосфат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.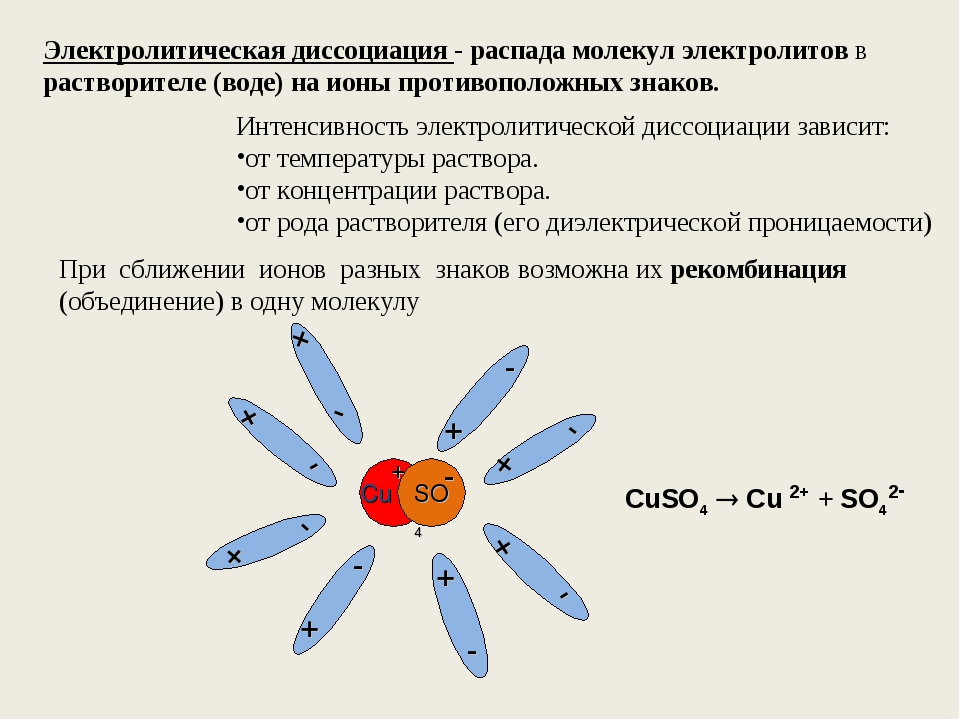
К 3 PO 4
Фосфат калия.Хорошо растворяется в воде, примерно 106 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Na 3 PO 4
Фосфат натрия. Растворяется в воде, примерно 14,5 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
Li 3 PO 4
Фосфат лития. Плохо растворяется в воде, примерно 0,037 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
Ba 3 (PO 4 ) 2
Фосфат бария. Не растворяется в воде.
Sr 3 (PO 4 ) 2
Фосфат стронция. Не растворяется в воде.
Ca 3 (PO 4 ) 2
Фосфат кальция. Не растворяется в воде.
(NH 4 ) 3 PO 4
Фосфат аммония. Растворяется в воде, примерно 22 гр на 100 мл при температуре 25 o C.
Растворяется в воде, примерно 22 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
мг 3 (PO 4 ) 2
Фосфат магния. Не растворяется в воде.
АлПО 4
Фосфат алюминия. Не растворяется в воде.
Mn 3 (PO 4 ) 2
Фосфат марганца. Не растворяется в воде.
Zn 3 (PO 4 ) 2
Фосфат цинка.Не растворяется в воде.
CrPO 4
Фосфат хрома. Не растворяется в воде.
Fe 3 (PO 4 ) 2
Фосфат железа (II). Не растворяется в воде.
FePO 4
Фосфат железа (III). Очень плохо растворяется в воде, примерно 0,67 гр на 100 мл при температуре 100 o C.
Гидролиз не протекает.
Co 3 (PO 4 ) 2
Фосфат кобальта. Не растворяется в воде.
Не растворяется в воде.
Ni 3 (PO 4 ) 2
Фосфат никеля. Не растворяется в воде.
Пб 3 (ПО 4 ) 2
Фосфат свинца. Не растворяется в воде.
Cu 3 (PO 4 ) 2
Фосфат меди. Не растворяется в воде.
Hg 3 (PO 4 ) 2
Фосфат ртути. Не растворяется в воде.
Ag 3 PO 4
Фосфат серебра. Не растворяется в воде.
ВЧ
Плавиковая кислота (фтороводородная кислота). Кислота средней силы.
CSF
Фторид цезия. Очень хорошо растворяется в воде, примерно 322 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
руб.
Фторид рубидия. Очень хорошо растворяется в воде, примерно 300 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
кФ
Фторид калия. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
NaF
Фторид натрия. Растворяется в воде, примерно 4,3 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
LiF
Фторид лития.Плохо растворяется в воде, примерно 0,13 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
BaF 2
Фторид бария. Плохо растворяется в воде, примерно 0,160 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
SrF 2
Фторид стронция. Плохо растворяется в воде, примерно 0,021 гр на 100 мл при 25 o C.
CaF 2
Фторид кальция. Не растворяется в воде.
NH 4 F
Фторид аммония. Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25 o C.
Хорошо растворяется в воде, примерно 84,5 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
MgF 2
Фторид магния. Очень плохо растворяется в воде, примерно 0,0078 гр на 100 мл при 25 o C.
AlF 3
Фторид алюминия.Плохо растворяется в воде, примерно 0,5 гр на 100 мл при температуре 25 o C.
MnF 2
Фторид марганца. Плохо растворяется в воде, примерно 1,06 гр на 100 мл при 25 o C.
ZnF 2
Фторид цинка. Плохо растворяется в воде, примерно 1,6 гр на 100 мл при температуре 25 o C.
CrF 3
Фторид хрома. Плохо растворяется в воде, примерно 4 гр на 100 мл при температуре 25 o C.
FeF 2
Фторид железа (II). Очень плохо растворяется в воде.
FeF 3
Фторид железа (III). Очень плохо растворяется в воде, примерно 0,091 гр на 100 мл при 25 o C.
Очень плохо растворяется в воде, примерно 0,091 гр на 100 мл при 25 o C.
CoF 2
Фторид кобальта. Плохо растворяется в воде, примерно 1,5 гр на 100 мл при температуре 25 o C.
NiF 2
Фторид никеля. Растворяется в воде, примерно 2,6 гр на 100 мл при 25 o C.
ПбФ 2
Фторид свинца. Плохо растворяется в воде, примерно 0,068 гр на 100 мл при 25 o C.
CuF 2
Фторид меди. Растворяется в воде, примерно 4,75 гр на 100 мл при температуре 25 o C.
При повышении температуры разлагается парами воды.
HgF 2
Фторид ртути.
Не существует в водной среде.
AgF
Фторид серебра.Хорошо растворяется в воде, примерно 180 гр на 100 мл при температуре 25 o C.
HNO 2
Азо́тистая кислота. Слабая одноосновная кислота.
ЦСНО 2
Нитрит цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
РБНО 2
Нитрит рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
КНО 2
Нитрит калия.Хорошо растворяется в воде, примерно 312 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
NaNO 2
Нитрит натрия. Растворяется в воде, примерно 84 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
LiNO 2
Нитрит лития. Хорошо растворяется в воде, примерно 105 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Ba (NO 2 ) 2
Нитрит бария. Растворяется в воде, примерно 74 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Sr (НЕТ 2 ) 2
Нитрит стронция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
Ca (НЕТ 2 ) 2
Нитрит кальция. Растворяется в воде, примерно 77 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
NH 4 НЕТ 2
Нитрит аммония. Растворяется в воде, примерно 200 гр на 100 мл при температуре 25 o C.
В результате гидролиза, образуется щелочная среда.
мг (NO 2 ) 2
Нитрит магния.Растворяется в воде.
В результате гидролиза, образуется слабощелочная среда.
Al (НЕТ 2 ) 3
Нитрит алюминия. Растворяется в воде, примерно 63,7 гр на 100 мл при 25 o C.
Mn (НЕТ 2 ) 2
Нитрит марганца. Растворяется в воде.
Раствор имеет нейтральную среду.
Zn (НЕТ 2 ) 2
Нитрит цинка. Растворяется в воде.
Раствор имеет нейтральную среду.
Cr (НЕТ 2 ) 3
Нитрит хрома.
Не существует в воде.
Fe (НЕТ 2 ) 2
Нитрит железа (II).
Растворяется в воде.
Fe (НЕТ 2 ) 3
Нитрит железа (III).
Не существует в воде.
Co (№ 2 ) 2
Нитрит кобальта.
Растворяется в воде.
Ni (НЕТ 2 ) 2
Нитрит никеля.
Растворяется в воде.
Pb (НЕТ 2 ) 2
Нитрит свинца.
Растворяется в воде.
Cu (НЕТ 2 ) 2
Нитрит меди.
Растворяется в воде.
Hg (NO 2 ) 2
Нитрит ртути.
Плохо растворяется в воде.
AgNO 2
Нитрит серебра.
Плохо растворяется в воде.
H 2 CO 3
Угольная кислота.
Cлабая двухосновная кислота.
CS 2 CO 3
Карбонат цезия. Растворяется в воде, примерно 75,5 гр на 100 мл при 20 температуре o C.
В результате гидролиза, образуется щелочная среда.
руб. 2 CO 3
Карбонат рубидия. Хорошо растворяется в воде, примерно 223 гр на 100 мл при температуре 20 o C.
В результате гидролиза, образуется щелочная среда.
К 2 CO 3
Карбонат калия. Хорошо растворяется в воде, примерно 112 гр на 100 мл при температуре 20 o C.
В результате гидролиза, образуется щелочная среда.
Na 2 CO 3
Карбонат натрия. Растворяется в воде, примерно 29,4 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
Li 2 CO 3
Карбонат лития. Растворяется в воде, примерно 1,27 гр на 100 мл при 25 o C.
В результате гидролиза, образуется щелочная среда.
BaCO 3
Карбонат бария.
Не растворяется в воде
SrCO 3
Карбонат стронция.
Не растворяется в воде
CaCO 3
Карбонат кальция.
Не растворяется в воде
(NH 4 ) 2 CO 3
Карбонат аммония. Хорошо растворяется в воде, примерно 100 гр на 100 мл при температуре 15 o C.
MgCO 3
Карбонат магния. Плохо растворяется в воде.
Al 2 (CO 3 ) 3
Карбонат алюминия.
Не существует в воде.
MnCO 3
Карбонат марганца.
Не растворяется в воде.
ZnCO 3
Карбонат цинка.
Не растворяется в воде.
Cr 2 (CO 3 ) 3
Карбонат хрома.
Не существует в воде.
FeCO 3
Карбонат железа (II).
Не растворяется в воде.
Fe 2 (CO 3 ) 3
Карбонат железа (III).
Не существует в воде.
CoCO 3
Карбонат кобальта.
Не растворяется в воде.
NiCO 3
Карбонат никеля.
Не растворяется в воде.
PbCO 3
Карбонат свинца.
Не растворяется в воде.
CuCO 3
Карбонат меди.
Не растворяется в воде.
HgCO 3
Карбонат ртути.
Не растворяется в воде.
Ag 2 CO 3
Карбонат серебра.
Не растворяется в воде.
H 2 S
Сероводородная кислота.
Cлабая, двухосновная кислота.
CS 2 S
Сульфид цезия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
руб. 2 S
Сульфид рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
К 2 Ю
Сульфид калия. Реагирует с водой.
В результате гидролиза, образуется щелочная среда.
Na 2 S
Сульфид натрия. Растворяется в воде, примерно 20 гр на 100 мл при температуре 20 o C.
В результате гидролиза, образуется щелочная среда.
Ли 2 S
Сульфид лития. Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
BaS
Сульфид бария. Растворяется в воде, примерно 9 гр на 100 мл при температуре 20 o C.
В результате гидролиза, образуется щелочная среда.
SrS
Сульфид стронция. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
CaS
Сульфид кальция. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
(NH 4 ) 2 S
Сульфид аммония.Хорошо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
мгS
Сульфид магния. Плохо растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Al 2 S 3
Сульфид алюминия.
Не существует в воде.
MnS
Сульфид марганца. Не растворяется в воде.
ZnS
Сульфид цинка. Не растворяется в воде.
Cr 2 S 3
Сульфид хрома.
Не существует в воде.
FeS
Сульфид железа (II). Не растворяется в воде.
Fe 2 S 3
Сульфид железа (III). Диспропорционирует при растворении в воде.
CoS
Сульфид кобальта. Не растворяется в воде.
NiS
Сульфид никеля. Не растворяется в воде.
ПБС
Сульфид свинца.Не растворяется в воде.
CuS
Сульфид меди. Не растворяется в воде.
рт. Ст.
Сульфид ртути.
Не существует в воде.
Ag 2 S
Сульфид серебра. Не растворяется в воде.
H 2 SiO 3
Метакремниевая кислота.
Очень слабая кислота.
Cs 2 SiO 3
Силикат цезия.
Не растворяется в воде.
руб 2 SiO 3
Силикат рубидия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
К 2 SiO 3
Силикат калия. Растворяется в воде.
В результате гидролиза, образуется щелочная среда.
Na 2 SiO 3
Силикат натрия. Растворяется в воде, примерно 22 гр на 100 мл при температуре 20 o C.
В результате гидролиза, образуется щелочная среда.
Li 2 SiO 3
Силикат лития.
Не растворяется в воде.
BaSiO 3
Силикат бария.
Не растворяется в воде.
SrSiO 3
Силикат стронция.
Не растворяется в воде.
CaSiO 3
Силикат кальция.
Не растворяется в воде.
(NH 4 ) 2 SiO 3
Силикат аммония.
Не существует в воде.
MgSiO 3
Силикат магния.
Не растворяется в воде.
Al 2 (SiO 3 ) 3
Силикат алюминия.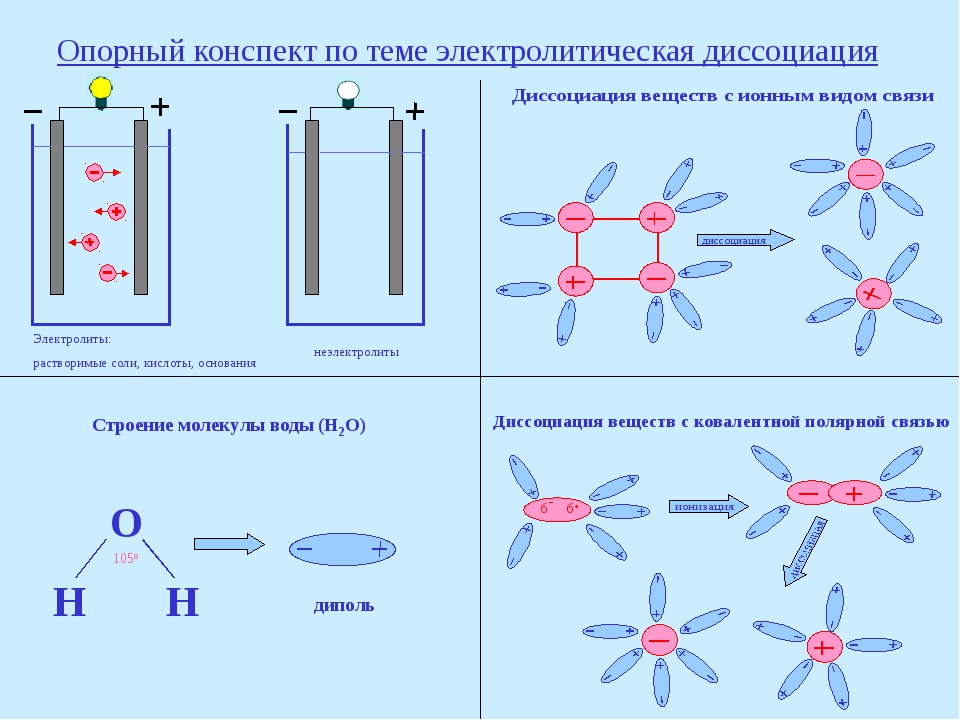
Не существует в воде.
MnSiO 3
Силикат марганца.
Не растворяется в воде.
ZnSiO 3
Силикат цинка.
Не растворяется в воде.
Cr 2 (SiO 3 ) 3
Силикат хрома.
Не существует в воде.
FeSiO 3
Силикат железа (II).
Не существует в воде.
Fe 2 (SiO 3 ) 3
Силикат железа (III).
Не существует в воде.
CoSiO 3
Силикат кобальта.
Не существует в воде.
NiSiO 3
Силикат никеля.
Не существует в воде.
ПбСиО 3
Силикат свинца.
Не растворяется в воде.
CuSiO 3
Силикат меди.
Не существует в воде.
HgSiO 3
Силикат ртути.
Не существует в воде.
Ag 2 SiO 3
Силикат серебра.
Не существует в воде.
Нахождение в форме части приведенного результата гидролиза.
Если соль находится в этой таблице, обозначенной цветом:
такая соль будет диссоциировать и не будет подвергаться гидролизу.
гидролиз пройдет по кислотному типу и рН будет <7 .
гидролиз пройдет по щелочному типу и рН при этом будет больше 7 .
требует анализа: соль или нерастворима, как большинство солей в этом секторе крови или разлагается при растворении в воде.Если соль растворима, то обычно гидролиз приводит к образованию нейтральной среды, когда рН = 7,0
Способность организма постоянство состава крови и других жидкостей происходит в результате функционирования буферных систем. В организме происходит поступает и в нем происходит множество веществ с кислотностью и щелочностью, но сохраняется способность концентрировать H + и OH — в постоянных пределах pH = 7,37 — 7,44 для крови. Снижение или увеличение этих событий может привести к смерти.
Снижение или увеличение этих событий может привести к смерти.
Буферные называемые растворы, обладающие способностью практически постоянное значение pH при добавлении количества кислот или щелочи, а также при разбавлении количества кислот или щелочи. Буферные системы состоят из слабого основания и его соли, образованной сильной кислотой. Или из слабой кислоты и ее соли, образованной сильным основанием.
При добавлении кислоты, взаимодействующей ионы водорода, при добавлении щелочи — ионы гидроксила. pH раствор изменится незначительно. Способность регулировать pH у буферных растворов регулируется буферной емкостью.
Буферную емкость выражают количество молей кислоты или щелочи, которое необходимо добавить к 1 литру буферного раствора для загрязнения pH раствор на единицу.
В каждой клетке организма работают разные буферные системы, поддерживающие постоянство внутренней среды.
Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры — это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно используют с ней. Такие процессы идут и на поверхности земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов.В результате гидролиза минералов — алюмосиликатов — происходит разрушение горных пород.
Известный нам малахит (Cu 2 (OH) 2 CO 2 ) — не что доходность, как продукт гидролиза природных карбонатов.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской водой слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод приблизительно 9, наиболее интенсивно протекает фотосинтез в морских растениях и наиболее быстро развиваются морские животные.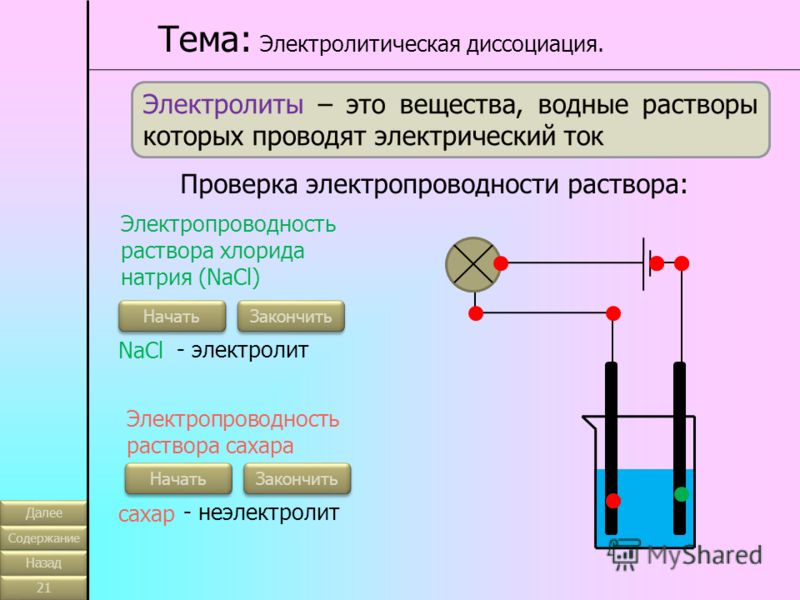 А если вспомнить состав рН крови млекопитающих, в том числе и человека, то вы сможете сделать вывод о единстве животного мира на Земле, но и сформулировать и некоторые гипотезы о происхождении жизни на планете.
А если вспомнить состав рН крови млекопитающих, в том числе и человека, то вы сможете сделать вывод о единстве животного мира на Земле, но и сформулировать и некоторые гипотезы о происхождении жизни на планете.
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 o С и выше происходит интенсивное использование указанных выше веществ с водяным паром.Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов.
Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая ткань и прочно соединяясь с ней, гидроксид алюминия легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
Без протравы качественной окраски тканей не получится.
Этот же процесс использует для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей Na 2 CO 3 , Na 3 PO 4 применения для очистки воды и уменьшения ее жесткости.
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза
Посредством гидролиза в промышленности из непищевого сырья (древесина, хлопковой шелухи, подсолнечной лузги, соломы) вырабатывается ряд ценных бумаг: этиловый спирт, белковые дрожжи, глюкоза, лед сухой (CO 2 ).
Электролитическая диссоциация — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И.
 Давыдова (Юдина).
Давыдова (Юдина).
Электрический ток — направленное движение заряженных частиц — электронов или сначала.
Электролиты — это вещества, растворы или расплавы (в ЕГЭ чаще речь о растворах), которые проводят электрический ток, то есть содержат заряженные частицы. Свободных электронов в растворе не бывает, носителями заряда являются ионы. Электрический ток проводят расплавы веществ с ионной кристаллической решеткой.
К электролитам отношения:
- Соли
- Кислоты
- Основания
Чем больше растворе заряженных частиц, тем лучше он проводит электрический ток, т.е. чем больше молекулы вещества диссоциирует, тем более сильным электролитом оно является.
Список сильных и слабых электролитов нужно знать наизусть!
Сильные электролиты (в растворах): 11
- Растворимые соли
FeCl 3 , CuSO 4 , K 2 CO 3 и т. д.
д.
8 растворимых гидроксидов: LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2 , Sr (OH) 2 , Ca (OH) 2 .
- Сильные кислоты
HI, HBr, HCl, H 2 SO 4 (разб) , HNO 3 , HClO 4 , HClO 3 , HMnO 4 , H 2 CrO 4
Слабые электролиты:
- Слабые основания
нерастворимые гидроксиды, NH 3 ∙ H 2 O, растворы аминов
- Слабые кислоты и кислоты средней силы
H 3 PO 4 , HF, H 2 SO 3 , H 2 CO 3 , H 2 S, H 2 SiO 3 , органические кислоты.
H 2 O — очень слабый электролит, диссоциирует ничтожно мало. Чистая дистиллированная вода не проводит ток.
Неэлектролиты: основные соединения, оксиды, вещества в молекулах, которые имеются только ковалентные неполярные или малополярные связи и т. д.
д.
Сила электролита определяет степень диссоциации. Рассмотрим соль А 2 В и кислоту Н 3 Х:
Диссоциация — всегда обратимый процесс.
Соли диссоциируют (обратимо распадаются на ионы) почти на 100%:
А 2 2А + + В 2-. Так как все молекулы распались на ионы, из 1 моль АВилось 1 моль В 2- и 2 моль А + , то есть три моль Оригина.
Многоосновные кислоты и основания диссоциируют ступенчато:
Н 3 Х ⇄ В + + В 2 Х —
H 2 X — ⇄ HX 2- + H +
HX 2- ⇄X 3- + H +
При этом каждая следующая ступень диссоциации протекает хуже предыдущей, т.к. присутсвует конкурирующий процесс — обратная реакция. Порядок примерно такой: Из 1 моль молекул слабой кислоты по первой ступени диссоциировало 0,05 моль, по второй — 0,0002 моль и по третьей — 0,00000001 моль. Итого образовалось чуть больше 0,1 моль Рекоменд.
Итого образовалось чуть больше 0,1 моль Рекоменд.
Очевидно, этот раствор этой кислоты проводит ток хуже, чем раствор соли.
Пара вопросов для тренировки:
1) Какие частицы образуются при диссоциации нитрата натрия
а) Na + , N +5 , O -2 ; б) Na + , NO 3 — в) Na, NO 2 , O 2 г) NaNO 2 , O 2
Решение: нитрат образован остаток азотной кислоты и катионом натрия.Уравнение его диссоциации: NaNO3 ⇄ Na + + NO 3 — . Ответ б).
2) В четырех пробирках находятся одномолярные растворы следующих веществ:
.а) H 3 PO 4 б) Na 2 SO 4 в) NaCl г) HBr
В какой пробирке больше всего он?
Решение: а) ортофосфорная кислота — средней силы, диссоциирует слабо, большая часть молекулы останутся в растворе молекулами.
9000 б) сульфат натрия — соль, диссоциирует полностью, из одного моль соль олучается три моль первым: Na 2 SO 4 ⇄ 2Na + + SO 4 2- .
в) хлорид натрия — соль, диссоциирует полностью, из одного моль соли образует два моль сначала: NaCl ⇄ Na + + Cl — .
г) бромоводородная кислота — сильная, но диссоциирует не полностью (в отличие от солей). В реакции HBr ⇄ H + + Br- из одного моль HBr образует меньше двух моль первонач.
Ответ б).
Ты нашел то, что искал? Поделись с друзьями!ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ • Большая российская энциклопедия
-
В книжной версии
Том 35.Москва, 2017, стр. 312
-
Скопировать библиографическую ссылку:
Авторы: Е. П. Агеев, Н. Н. Матушкина
П. Агеев, Н. Н. Матушкина
ЭЛЕКТРОЛИТИ́ЧЕСКАЯ ДИССОЦИАЦИЯ, частичный или полный распад вещества в растворе или расплаве на положительно и отрицательно заряженные частицы — ионы.Вещества, в растворе или расплаве в виде знаком, называются электролитами. Первые представления о строении растворов электролитов сформулированы в 1884 С. Аррениусом и включаются следующие положения. Во-первых, при растворении электролита не все молекулы диссоциируют на ионы, а лишь некоторая их доля α, названная степенью диссоциации. Если при Э. д. Одна молекула электролита образует ν это, то их раствор в растворе равна ναс (с — молекулы электролита), а мол недиссоциированных молекул (1-α) с.Общая доля частиц в растворе составляет (1-α) с + ναс = с [1 + α (ν-1)]. Выражение [1 + α (ν-1)] показывает, во сколько увеличиваются частицы в растворе за счёт Э. д. Это уравнение позволяет объяснить эксперим. данные по коллигативным (зависящим от количества) свойствам растворов. Во-второй, к процессу Э. д. применим закон действ масс. Пусть в объёме отчета V содержится 1 моль вещества MA, Э. д. которого происходит по схеме МА⇄М + + А — .Тогда равновесные частицы в растворе [M + ] = [A — ] = α / V, [MA] = (1-α) / V. Уравнение закона масс K = [M + ] [A — ] / [MA] = α 2 / [(1-α) V]. Т. к. молярная способность с = 1 / V, а т. н. разведение V = 1 / с, то K = α 2 с / (1-α). Обе формулы отражают взаимосвязь между K и α и представляют собой математич. выражение разбавления Оствальда (В. Оствальд, 1888), согласно которому константа Э.д. K не зависит от разбавления раствора, а зависит только от темп-ры и растворителя.
д. применим закон действ масс. Пусть в объёме отчета V содержится 1 моль вещества MA, Э. д. которого происходит по схеме МА⇄М + + А — .Тогда равновесные частицы в растворе [M + ] = [A — ] = α / V, [MA] = (1-α) / V. Уравнение закона масс K = [M + ] [A — ] / [MA] = α 2 / [(1-α) V]. Т. к. молярная способность с = 1 / V, а т. н. разведение V = 1 / с, то K = α 2 с / (1-α). Обе формулы отражают взаимосвязь между K и α и представляют собой математич. выражение разбавления Оствальда (В. Оствальд, 1888), согласно которому константа Э.д. K не зависит от разбавления раствора, а зависит только от темп-ры и растворителя.
В зависимости от величины α различают слабые и сильные электролиты. Вещества, у которых растворе с концентрацией которых 0,1 моль α <0,03, относят к слабым электролитам, у α> 0,3 — к сильным, при 0,03 <α <0,3 - к электролитам средней силы. Сильными электролитами являются мн. растворимые соли, некоторые кислоты и основания, самые слабые органические кислоты.кислот и оснований. Э. д. электролитов, молекулы которых могут распадаться на неск. Удобно, протекает по стадиям. При Э. д. многоосновных кислот легче отделяется первый протон, каждый последующий ион водорода отщепляется труднее, т. к. возрастает заряд аниона.
растворимые соли, некоторые кислоты и основания, самые слабые органические кислоты.кислот и оснований. Э. д. электролитов, молекулы которых могут распадаться на неск. Удобно, протекает по стадиям. При Э. д. многоосновных кислот легче отделяется первый протон, каждый последующий ион водорода отщепляется труднее, т. к. возрастает заряд аниона.
Ионная теория Э. д. Аррениуса позволила трактовать явления, связанные с ионными равновесиями, и легла в основу качественного химич. анализа.Недостатки теории состоят в игнорировании ион-дипольных, ион-ионных и диполь-дипольных взаимодействий. Попытка учёта этих взаимодействий привела к формированию совр. теорий растворов электролитов.
См. также Растворы (раздел Растворы электролитов), Электролитов растворы и Электролиты расплавленные.
Электролитическая диссоциация, электрические растворы, проводить электрический ток
Купить рН-метры, pH-метры в Санкт-Петербурге
В каталоге товаров / продукции рН-метры — pH метры Россия, карманные рН-метры, портативные рН-метры, стационарные рН-метры, рН-метры для пищевой промышленности, категории: рН-метр российского производства, карманные рН-метры, переносные рН-метры, стационарные рН-метры, рН-метры для пищевых продуктов. промышленность, ; портативные, стационарные лабораторные модели измерители водородного показателя (показателя pH), компактные карманные приборы pH-метры, автономные портативные pH-метры для оперативного определения кислотности или щелочности среды, лабораторные модели стационарные измерители водородного показателя (показателя pH),
промышленность, ; портативные, стационарные лабораторные модели измерители водородного показателя (показателя pH), компактные карманные приборы pH-метры, автономные портативные pH-метры для оперативного определения кислотности или щелочности среды, лабораторные модели стационарные измерители водородного показателя (показателя pH),
pH метры Россия
Подробнее… Купить pH метры производства Россия — pH метр российского производства в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93. Купить портативные стационарные pH-метры Россия в Санкт-Петербурге по выгодной цене. компактные модели рН-метров, приборы для измерения водородного показателя.карманные рН-метры
Подробнее … Купить карманные рН-метры — карманные рН-метры в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93.Легкие и удобные устройства предназначены для оперативного определения кислотности или щелочности среды / определения уровня pH среды в полевых условиях, когда использование более громоздких лабораторных «портативных рН-метров»; «Стационарных рН-метров» приборов зат . ..
..
рН-метры для пищевой промышленности
Подробнее … Приборы для анализа пищевых продуктов — купить рН-метры для пищевой промышленности — рН-метры для пищевой промышленности в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93.Универсальные измерительные приборы контроля качества продуктов питания применяются в различных лабораториях и производстве. Купить прибор в Санкт-Петербурге по выгодной цене. рН-метры. В каталоге ХИМСНАБ-СПБ представляет …Купить электроды для измерения pH, анализаторы pH-электроды для рН-метров
Выносные электроды проводимости лабораторных определений измерений в измерениях рН, окислительно-восстановительного потенциала, удельной электрической проводимости и температуры воды, водных растворов.Анализаторы состоят из измерительного преобразователя и комбинированных датчиков (первичных преобразователей), обеспечивающих измерение параметров водной среды. Измерительные приборы отличает высокую точность и точность измерений.
Измерительные приборы отличает высокую точность и точность измерений.
Купить электроды и датчики, электроды и датчики в Санкт-Петербурге
В каталоге товаров / продукции представлены электроды и датчики — Ион-селективные электроды, pH-электроды, электроды для измерения pH, датчики ОВП, редокс-электроды, датчики проводимости, датчики температуры, кислородные датчики, электроды вспомогательные (сравнение), категории: Ионоселективные электроды, pH-электроды, датчики ОВП, датчики проводимости, датчики температуры, кислородные датчики, вспомогательный электрод (сравнение),; Ион-селективные электроды, pH-электрод, датчики ph, электрод ph метра, электроды для измерения ph, измерительный электрод ph, рН-метрический электрод, измерение значения концентрации углерода, концентрация хорошего водорода, электроды датчики ОВП, редокс-электроды, измерение окислительно-восстановительного потенциала, многодиапазонные электроды и электроды, электроды, датчики проводимости, электрод сенсор датчик температуры, электрод сенсор датчик кислородный, лабораторные и промышленные электроды сравнение, электроды вспомогательные,Ион-селективные электроды
Подробнее. ..
Купить Ион-селективные электроды — Ионоселективные электроды в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного …
..
Купить Ион-селективные электроды — Ионоселективные электроды в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного …
pH-электроды, электроды для измерения pH
Подробнее… Купить pH-электроды (pH-электроды) лабораторные измерительные устройства, анализаторы жидкости, растворов, водных сред, используемых для получения точных и воспроизводимых показаний приборов, опредлеление кислотности или щелочности выраженной в виде pH. В комании ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93 можно приобрести рН-электроды для рН-метров, анализаторов воды предназначе …датчики ОВП, редокс-электроды
Подробнее… Индикаторные элементы для измерения окислительно-восстановительных потенциалов. В обратимых окислительно-восстановительных системах позволяют проводить определение концентрации компонентов. Специализированные электроды и датчики ОВП, редокс-электроды имеют особые электрохимические характеристики для потенциометрических измерений, регистрацию ОВП растворов. Измерительное оборудов …
В обратимых окислительно-восстановительных системах позволяют проводить определение концентрации компонентов. Специализированные электроды и датчики ОВП, редокс-электроды имеют особые электрохимические характеристики для потенциометрических измерений, регистрацию ОВП растворов. Измерительное оборудов …
датчики проводимости
Подробнее… Купить многодиапазонные датчики проводимости — датчики проводимости для кондуктометров, использующих выносной (сменный) электрод в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93. Купить датчик проводимости в Санкт-Петербурге по выгодной цене. Специализированные электроды и датчики, электроды и датчики с подключаемым кабелем используемым для определения проводимости и солесодержания в вод …кислородные датчики
Подробнее… Купить кислородные датчики — датчики кислорода для стационарных и портативных оксиметров в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93. Модели полярных датчиков кислорода применяемых в настольных и стандартных портативных приборах. Отдельные модели датчиков кислорода состоят из платинового катода, серебряного анода и фторопластовой мембраны. Конструкции датчика делаю …
Модели полярных датчиков кислорода применяемых в настольных и стандартных портативных приборах. Отдельные модели датчиков кислорода состоят из платинового катода, серебряного анода и фторопластовой мембраны. Конструкции датчика делаю …
электроды вспомогательные (сравнение)
Подробнее… Купить электроды вспомогательные (сравнение) — вспомогательный электрод (сравнение) в ХИМСНАБ-СПБ, контактный телефон + 7-812-337-18-93. Лабораторный вспомогательный или опорный электрод, заполненный концентрированным раствором КСl — электролит вторым по значению измерительного прибора «рН-метра». Данный тип электрода позволяет создать опорную точку, относитель … индикаторная бумага в ПОЛОСКАХ или индикаторная бумага в КАТУШКАХ.Подобрать по диапазону pH: 0 — 6 рН; 1 — 12 рН; 4,5 — 10 рН; 7-14 рН; 1 — 11 рН; 5,5 — 9 рН; 1 — 14 рН; 0-14 рН; 0 — 12 рН, также в каталоге ХИМСНАБ-СПБ. лабораторного оборудования и приборов, раздела измерительные приборы можно приобрести приборы для измерения водородного показателя pH: «РН-метры»; «Карманные рН-метры»; «Портативные рН-метры»; «Стационарные рН-метры» и «PH-электроды» Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категорий: химическиетивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качественно продукцию.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента. Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строго соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ».Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретенной продукцией и полученным результатом.
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ многолетний опыт работы на рынке химической продукции и лабораторного оборудования.

 карбоновые кислоты
карбоновые кислоты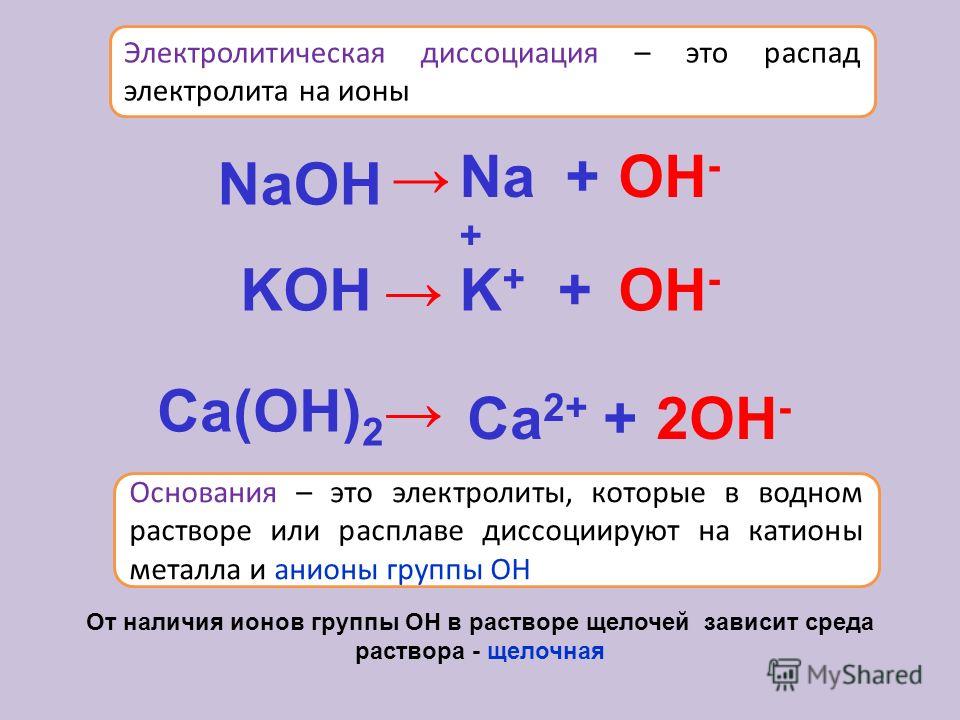 карбоновые кислоты
карбоновые кислоты