Изменение металлических и неметаллических свойств в таблице Менделеева
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).

Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

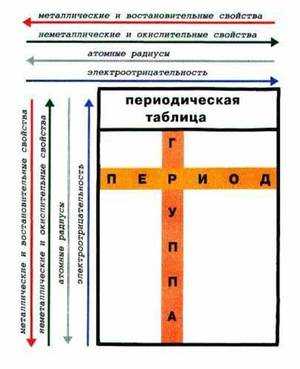
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
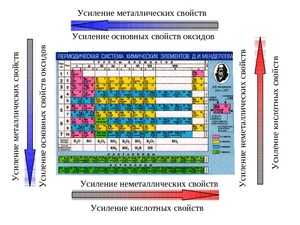
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
liveposts.ru
Зависимость свойств элементов от периодического изменения электронных структур атомов
Зависимость свойств элементов от периодического изменения электронных структур атомов
Рассмотрим зависимость свойств элементов от их положения в периодической системе. Свойства элементов зависят от числа валентных электронов, равную номеру группы в периодической таблице.
Элементы, имеющие завершены внешние энергетические уровни и содержат восемь электронов, наиболее устойчивыми. Именно этим объясняется химическая инертность гелия, неона и аргона: они вообще не вступают в химические реакции. Атомы всех других химических элементов стремятся отдать или присоединить электроны, чтобы их электронная оболочка оказалась устойчивой, при этом они превращаются в заряженные частицы.
Например, щелочной металл Натрий — элемент главной подгруппы I группы. Высокая химическая активность натрия объясняется наличием в его атомах единого валентного электрона. Теряя этот электрон, атом натрия превращается в положительно заряженный ион Na + с электронной конфигурацией инертного газа неона. Ионы Na + химически инертны. Чем больше число электронов находится на внешнем электронном слое, тем сложнее их отдавать, поэтому с увеличением числа электронов на внешнем уровне (в периодах) металлические свойства элементов уменьшаются. Химические элементы, которые обнаруживают металлические свойства, как правило, имеют на внешнем уровне от одного до трех электронов.
В атомах галогенов, образующих главную подгруппу VII группы, семь электронов на внешнем уровне. До завершения им не хватает только одного электрона, поэтому для них наиболее характерен процесс присоединения электрона. Атом хлора, например, присоединяя один электрон, превращается в ион Сl-, имеющим электронную конфигурацию инертного газа и является химически стойким. Атомы других неметаллических элементов, подобно атомов галогенов, стремятся завершить внешний энергетический уровень путем присоединения электронов. Чем больше электронов хватает до завершения электронного слоя, тем труднее их присоединять, следовательно, чем меньше электронов на внешнем уровне, тем слабее обнаружены неметаллические свойства. Химические элементы, которые проявляют неметаллические свойства, как правило, имеют на внешнем уровне от четырех до восьми электронов.
Таким образом, металлические свойства оговариваются способностью отдавать электроны, а неметаллические — способностью их присоединять. Соответственно изменяются и свойства простых веществ образованных этими элементами.
Металлические свойства тем больше и, соответственно, неметаллические свойства тем меньше, чем легче отдается электрон с внешнего энергетического уровня. Отдать электрон с внешнего энергетического уровня тем легче, чем больше атомный радиус, благодаря тому, что сила притяжения ядра и электронов уменьшается с ростом расстояния между ними. Следовательно, изменение металлических свойств химических элементов будет аналогична изменении их атомных радиусов. Поэтому в главных подгруппах металлические свойства с увеличением порядкового номера увеличиваются, а в периодах с увеличением порядкового номера металлические свойства уменьшаются. Неметаллические свойства, наоборот, в главных подгруппах с увеличением порядкового номера уменьшаются, а в периодах с увеличением порядкового номера увеличиваются.
Например, расположим химические элементы Al, S, Mg, Cl, Na в порядке увеличения неметаллических свойств. Приведены химические элементы находятся в третьем периоде. В периодах неметаллические свойства с увеличением порядкового номера увеличиваются. Следовательно, указанные химические элементы надо записать в порядке увеличения их порядковых номеров: Na, Mg, Al, S, Cl.
Рассмотрим взаимосвязь между положением химических элементов в периодической системе и свойствами оксидов и соответствующих гидроксидов, образующих эти химические элементы, на примере элементов третьего периода. К третьему периоду относятся химические элементы: Na, Mg, Al, Si, P, S, Cl, Ar. Эти элементы образуют высшие оксиды такого состава (инертный химический элемент Аргон оксида не образует): , , ,, , , .
Натрий оксид и магний оксид проявляют свойства основных оксидов, алюминий оксид является амфотерным оксидом, все оксиды (кремний (IV) оксид, фосфор (V) оксид, серы (VI) оксид, хлор (VII) оксид) проявляют свойства кислотных оксидов. Кроме того, в ряде — основные свойства ослабляются, а в ряде — — — кислотные свойства усиливаются.
Так же можно проанализировать характер изменения в периоде свойств гидроксидов, которые соответствуют высшим оксидам: , , , , , , .
Натрий гидроксид и магний гидроксид проявляют свойства оснований, алюминий гидроксид является амфотерным гидроксидом, все остальные гидроксиды проявляют свойства кислот: силикатный кислота, ортофосфатна кислота, серная кислота, хлоратна кислота. Кроме того, в ряде — основные свойства ослабляются, а в ряде — — — кислотные свойства усиливаются.
Итак, в ряде элементов определенного периода ослабляются свойства основных оксидов и соответствующих им гидроксидов, а кислотные свойства в том же направлении усиливаются. Переход от основных к кислотным оксидов, и, соответственно, от основ до кислот осуществляется в периоде через амфотерный оксид или гидроксид. Такая закономерность справедлива для второго и третьего периодов периодической системы. Для элементов больших периодов наблюдаются сложные закономерности.
При переходе от одного периода к другому конфигурация внешнего электронного слоя периодически повторяется, при этом повторяющиеся свойства химических элементов, их простых веществ и их соединений. Это и является главным объяснением смысла периодического закона Д. И. Менделеева.
xn—-7sbfhivhrke5c.xn--p1ai
Закономерности изменения кислотно-основных свойств оксидов
И гидроксисоединений
Кислотно-основные свойства оксидов и гидроксисоединений закономерно изменяются по периоду и подгруппе.
В составе гидроксисоединений всегда присутствует фрагмент
I II
Например:
; ; .
Кислотно-основные свойства вещества определяются типом химических связей I и II . Ионный тип химической связи I определяет её относительно легкую диссоциацию в растворе с образованием ОН—ионов
―Э― О Н → ―Э+1 + ОН—
Вещества с преимущественно ионной связью I проявляют основные свойства.
С увеличением электроотрицательности центрального атома (Э) ковалентность и прочность связи I возрастают. Одновременно связь II становится более полярной и менее прочной, это определяет её преимущественную диссоциацию в растворе с образованием ионов Н
―Э―О―Н ―Э―О— + Н+
Такие соединения проявляют кислотные свойства.
Соединения с прочными промежуточными по характеру – ионно-ковалентными связями I и II – проявляют амфотерные свойства.
С увеличением электроотрицательности центрального атома (Э) фрагмента ––Э––О––Н усиливаются кислотные и ослабляются основные свойства со-ответствующего гидроксисоединения в периоде в направлении слева направо и в подгруппе снизу вверх.
Сравним, например, свойства гидроксисоединений элементов III периода и IIA-подгруппы:
Be(OH)2
Амфотер-
ный гидроксид
NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4
Очень Средней Амфотерный Очень Средней Сильная Очень
сильное силы гидроксид слабая силы кислота сильнаяоснование основание кислота кислота кислота
Ca(OH)2 — увеличение электроотрицательности центрального
Сильное атома (Э)
основание — усиление кислотных свойств оксидов и гидроксисое-
Sr(OH)2 динений
Сильное — ослабление основных свойств оксидов и гидрокси-
основание соединений
Ba(OH)2 — усиление гидролиза по катиону
Сильное
основание
С увеличением степени окисления элемента (Э+n) возрастает его электроотрицательность и, следовательно, усиливаются кислотные и ослабляются основные свойства соответствующих оксидов и гидроксисоединений.
+2 +3 +6
Например: CrO Cr2O3 CrO3
Cr(OH)2 Cr(OH)3 H2CrO4
основные амфотерные кислотные
Таблица 7
Сравнительная характеристика свойств оксидов металлов и неметаллов
| Оксиды металлов | Оксиды неметаллов |
| Оксиды металлов в низших степенях окисления являются основными; некоторые реагируют с водой, образуя ОН— (водн.), например CaO, MgO Другие нерастворимы в воде, но реагируют с кислотами и с кислотными оксидами, например, Fe2O3, CuO Сильные основные оксиды, например, K2O, CaO, реагируют с амфотерными оксидами; некоторые оксиды металлов амфотерны, реагируют как с основными, так и с кислотными оксидами, например, ZnO, SnO, SnO 2, PbO, PbO2, Cr2O3, Al2O3. | Большинство являются кислотными; некоторые растворяются в воде, образуя растворы с высокой концентрацией водородных ионов, например, SO2 Макромолекулярные оксиды, например, (SiO2)m, (B2O3)n, не растворяются, но реагируют с основными и амфотерными оксидами, образуя соли Небольшое число несолеобразующих нейтральных, например, N2O, NO, F2O |
Генетическая связь между классами неорганических соединений
Основной
оксид
Металл Основание
Неметалл Кислотный Кислота
оксид
Гидролиз солей
Гидролиз солей – ионно-обменное взаимодействие солей с водой, сопровождающееся разложением соли. Гидролиз – реакция, обратная нейтрализации.
+ Н2О +
1. Соли, образованные сильной кислотой и сильным основанием (Na2SO4, KCl, CrNO3 и др.), гидролизу не подвергаются, их растворы нейтральны (рН=7).
2. Соли, образованные сильной кислотой и слабым основанием (NH4Cl, CuSO4, MgCl2 и др.), подвергаются гидролизу по катиону, среда в растворе кислая (рН<7).
Составим уравнения гидролиза NH4Cl:
NH4Cl + H2O NH4OH + HCl (молекулярное
(H++OH—) слабое. сильная. уравнение)
основание кислота
NH4+ + Cl– + H2O NH4OH + H+ + Cl– (полное ионное уравнение)
NH4+ + H2O NH4OH + H+ (краткое ионное уравнение)
В растворе увеличивается концентрация ионов Н+, следовательно, среда в растворе кислая (рН<7).
Процесс гидролиза равновесный, характеризуется константой гидролиза и степенью гидролиза:
, следовательно, равновесие сильно смещено влево, идет частичный гидролиз.
Степень гидролиза – это отношение молярной концентрации гидролизовавшейся соли к общей молярной концентрации соли в растворе.
h = Mгидр./Mo
Многозарядные катионы слабых оснований подвергаются гидролизу ступенчато:
Рассмотрим гидролиз CuSO4:
CuSO4 Cu2+ + SO42– (уравнение диссоциации)
H2O H+ + OH– (уравнение диссоциации воды)
1 стадия Cu2+ + H2O CuOH+ + H+ (краткое ионное уравнение)
2CuSO4 + 2H2O [CuOH]2SO4 + H2SO4 (молекулярное уравнение)
2 стадия CuOH+ + H2O Cu(OH)2 + H+ (краткое ионное уравнение)
[CuOH]2SO4 + 2H2O 2Cu(OH)2 + H2SO4 (молекулярное уравнение)
Вторая стадия гидролиза идет в гораздо меньшей степени, чем первая, т.е. «подавлена».
3. Соли, образованные сильным основанием и слабой кислотой (Na2CO3, K2S, Na3PO4 и др.), подвергаются гидролизу по аниону, среда в растворе щелочная (рН>7).
Рассмотрим гидролиз соли CH3COONa.
CH3COO–Na+ + H2O CH3COOH + NaOH (молекулярное уравнение)
(H+―OH–) слабая сильное
кислота основание
CH3COO– + Na+ + H2O CH3COOH + Na+ + OH– (полное ионное уравнение)
СH3COO– + H2O CH3COOH + OH– (краткое ионное уравнение)
В растворе увеличивается концентрация ОН– — ионов, следовательно, среда щелочная (рН>7).
4. Соли, образованные слабым основанием и слабой кислотой (NH4F, CH3COONH4 и др.), подвергаются гидролизу одновременно по катиону и аниону, среда в растворе близка к нейтральной (слабокислая или слабощелочная, рН≈7).
Например:
CH3COO–NH4+ + H2O CH3COOH + NH4OH (молекулярное уравнение)
(H+―OH–) слабая слабое
кислота основание
CH3COO– + NH4+ + H2O CH3COOH + NH4OH (ионное уравнение)
Некоторые соли подвергаются полному гидролизу, если образующиеся продукты – газы или плохо растворимые соединения.
Например:
Al2S3 + 6H2O 2Al(OH)3↓ + 3H2S↑
infopedia.su
Кислотно-основные свойства химических соединений, их изменение в группе и периоде
Как определить какими свойствами обладает вещество — кислотными или основными? Что такое кислота? И что есть основание?
Существует три подхода к определению кислот и оснований.
1) По определению Аррениуса:
кислоты в водных растворах диссоциирует на ионы водорода и анионы,
основания диссоциируют на гидроксид-ионы и катионы.
2) Теория Бренстеда–Лоури (протонная теория):
кислота — вещество, способное быть донором протонов,
основание – вещество, которое может присоединить (акцептировать) протон.
Аммиак, согласно теории Бренстеда -Лоури, является основанием: NH3 +H+ →NH4+
3) Электронная теория Льюиса (апротонная теория)
допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной.
Кислота — вещество, способное присоединять электронную пару,
основание – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары: NF3 (основание) и акцептора электронной пары BF3 (кислота) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
Теперь давайте рассмотрим, как происходит изменение кислотно-основных свойств некоторых соединений по группам и по периодам.
1) Бинарные соединения неметаллов с водородом
В группах сверху вниз (например, в ряду НF-HCl-HBr-HI) отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+ (т.к радиус ионов неметаллов увеличивается и, соответственно, увеличивается длина связи). В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается.
Метан не проявляет кислотно-основных свойств (и в воде не растворяется), раствор аммиака в воде дает щелочную среду, вода — нейтральное соединение, раствор фтороводорода в воде — слабая кислота (плавиковая).
2) Кислородосодержащие кислоты
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз:
himege.ru
Металлические и неметаллические свойства простых веществ

У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
| Номер периода | Символ элемента | Заряд ядра атома | Число электронных слоев | Число электронов на внешнем слое | Валентность в высших оксидах |
|---|---|---|---|---|---|
| 1 | — | — | — | — | — |
| 2 | C | 6+ | 2 | 4 | IV |
| 3 | Si | 14+ | 3 | 4 | IV |
| 4 | Ge | 32+ | 4 | 4 | IV |
| 5 | Sn | 50+ | 5 | 4 | IV |
| 6 | Pb | 82+ | 6 | 4 | IV |
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
Усиление металлических свойств в таблице менделеева
Усиление металлических свойств в таблице менделеева наблюдается с право на лево. В противоположном направлении возрастают неметаллические ионы.
Это связано с тем, что справа находятся элементы, электронные оболочки которых ближе к октету. Элементы с правой стороны периода редко выделяют свои электроны для образования металлической связи и, как правило, химических реакций.
Например, углерод является более выраженным неметаллием, чем его сосед в период бора, а азот даже имеет более яркие неметаллические свойства, чем углерод.
Слева направо ядерный заряд также увеличивается за этот период. В результате притяжение к сердечнику валентных электронов возрастает и их отталкивание затруднено.
Напротив, s-элементы в левой части таблицы имеют немного электронов на внешней оболочке и более низкий заряд ядра, что способствует образованию металлической связи. С понятным исключением из водорода и гелия (их оболочки близки к завершению или полны!), Все s-элементы — это металлы; p элементы могут быть либо металлами, либо неметаллами, в зависимости от того, находятся ли они на левой или правой стороне таблицы.
Как известно, элементы d и f имеют «резервные» электроны из «предпоследних» оболочек, что усложняет простой образ, типичный для s и p элементов. В общем случае d- и f-элементы обладают гораздо более вероятными металлическими свойствами.
Подавляющее число элементов — это металлы, и только 22 элемента классифицируются как неметаллы: H, B, C, Si, N, P, As, O, S, Se, Te и все галогены и инертные газы.
Некоторые элементы называются полуметаллами из-за того, что они могут проявлять только слабые металлические свойства.
Что такое полуметаллы? Если вы выбираете p элементов из периодической системы и записываете их в отдельный «блок» (это происходит в «длинной» форме таблицы), регулярность показана на рисунке 4-7. Левая нижняя часть блока содержит типичные металлы, правая верхняя часть содержит типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, иногда называют полуметаллами.
Полуметаллы имеют ковалентную кристаллическую решетку при металлической проводимости (электропроводность). Валентные электроны либо недостаточны для образования полной «октетной» ковалентной связи (как в боре), либо они недостаточно захвачены (как в пластинах или полонии) из-за больших размеров атома. Поэтому связывание в ковалентных кристаллах этих элементов имеет частичный металлический характер.
Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них представляет собой гораздо меньшую (хотя и не нулевую) электропроводность, объясненную слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
Если вы перемещаете вниз вдоль групп, свойства металла элементов улучшаются. Это связано с тем, что в группах ниже групп есть элементы, у которых уже есть много заполненных электронных лотков. Их внешние оболочки удаляются из ядра. Они отделены от ядра более толстой «оболочкой» от нижних электронных оболочек, а электроны внешних плоскостей слабее ослаблены.
xn--d1aca5absbidce4b.xn--p1ai
Основное свойство — гидроксид — Большая Энциклопедия Нефти и Газа, статья, страница 1
Основное свойство — гидроксид
Cтраница 1
Основные свойства гидроксидов от бора к таллию, как обычно, усиливаются. Если гидроксид бора чаще записывают в виде борной кислоты Н3ВО3, гидроксиды алюминия и галлия — амфотерные соединения, то Т1 ( ОН) 3 — основание, а ТЮН — сильное основание. [1]
Основные свойства гидроксидов одного и того же элемента в разных степенях окисления усиливаются с уменьшением степени окисления элемента. [2]
Основные свойства гидроксидов от Н3ВО3 к Т1 ( ОН) возрастают: Н3ВО3 — слабая, растворимая в воде кислота, Tl ( OH) растворим в воде, гидроксид щелочного характера. [3]
Основные свойства гидроксидов свинца ( II) и олова ( II) проявляются при взаимодействии с кислотами. Гидрок-сид свинца ( II) в водном растворе даже показывает слабо щелочную реакцию. [4]
Почему основные свойства гидроксида галлия выражены не сильнее, а слабее основных свойств гидроксида алюминия. [5]
Как изменяются основные свойства гидроксидов этих металлов по подгруппе сверху вниз. [6]
Как изменяются основные свойства гидроксидов элементов главной подгруппы второй группы периодической системы. [7]
При взаимодействии с кислотами проявляются основные свойства гидроксида цинка. [8]
Как видно, с увеличением радиуса усиливаются основные свойства гидроксида. [9]
Легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксида ослабевают, а кислотные усиливаются: Сг ( ОН) 3 — проявляет только основные свойства, Сг ( ОН) 3 — амфотерные, а Н2СгО4 — только кислотные. [10]
Сг ( ОН) 2, Сг ( ОН) 3 и Н2СгО4, то легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксида ослабевают, а кислотные усиливаются: Сг ( ОН) 2 — проявляет основные свойства, Сг ( ОН) 3 — амфотерные, а Н2СгО4 — кислотные. [11]
Сг ( ОН) 2, Сг ( ОН) 3 и Н2СгО4, то легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные усиливаются: Сг ( ОН) 2 проявляет основные свойства, Сг ( ОН) 3 — амфотерные, а Н2СгО4 — кислотные. [12]
Сг ( ОН) 2, Сг ( ОН) 3 и Н2СгО4, то легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксида ослабевают, а кислотные усиливаются: Сг ( ОН) 2 — проявляет основные свойства, Сг ( ОН) 3 — амфотерные, а Н2СгО4 — кислотные. [13]
Основные свойства гидроксидов увеличиваются от Ве ( ОН) 2 к Ва ОН) 2: Ве ( ОН) 2 и Mg ( OH) 2 — слабые основания, Ва ( ОН) 2 — щелочь. [14]
Основные свойства гидроксидов увеличиваются от Ве ( ОН) 2 к Ва ( ОН) 2: Ве ( ОН) 2 и Mg ( OH) 2-слабые основания, Ва ( ОН) 2-щелочь. [15]
Страницы: 1 2 3
www.ngpedia.ru
