Третий закон термодинамики, теория и примеры
Первое и второе начала термодинамики ни чего не говорят о том, как ведет себя термодинамическая система около абсолютного нуля температур. Поэтому их дополняют третьим законом (началом), который еще называют по имени открывателя теоремой Нернста (теоремой Нернста — Планка). Данная теорема была получена эмпирически.
Современную формулировку данной теоремы дал М. Планк. Данный закон термодинамики описывает поведение термодинамической системы при низких температурах.
Формулировки третьего закона термодинамики
В состоянии равновесия энтропия всех тел устремляется к нулю при приближении температуры тела (T) к абсолютному нулю температур и это не зависит от того, какие значения принимают другие параметры, характеризующие состояние системы. В математическом виде третье начало термодинамики записывают как:
где S – энтропия. Это формулировка Планка.
Иначе третье начало термодинамики формулируют так: При температуре близкой к абсолютному нулю в любом изотермическом процессе изменение энтропии системы равно нулю, и это не зависит от изменения любых других параметров системы. Сформулированное Планком третье начало термодинамики находится в соответствии с тем, как определяют энтропию в статистической физике:
где k – постоянная Больцмана; w – термодинамическая вероятность. Получается, что при T=0 K термодинамическая система находится в основном квантовом состоянии (если состояние невырожденное), при этом w=1, что означает состояние системы, реализуется при помощи единственного микрораспределения. Если w=1, то S=0.
О выполнении теоремы Нернста судят по поведению вещества около абсолютного нуля температур. Теорема Нернста математически не доказывается, ее подтверждают эмпирически.
Для того чтобы получить объяснение третьего закона термодинамики прибегают к квантовой механике. Используя третье начало термодинамики можно найти абсолютную величину энтропии, а не ее изменение, как при помощи второго начала. Так как в соответствии с третьим началом термодинамики изменение энтропии при T=0 K устремляется к конечному пределу, который не зависит от равновесного состояния системы:
где x – произвольный термодинамический параметр системы. В формулировке Нернста третье начало звучит так:
Примеры решения задач
ru.solverbook.com
Третий закон термодинамики
На основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанную трудность и получивший название принципа Нернста или третьего закона термодинамики. В формулировке Нернста он гласит: в любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии системы равно нулю, т. е.
DS (T=0) = 0, S = S0 = const, независимо от изменения любых других параметров состояния (например, объема, давления, напряженности внешнего силового поля и т. д.).
Основными положения тепловой теоремы Нернста:
При абсолютном нуле температуры свободная энергия равна теплоте процесса.
При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
Одной из формулировок третьего начала термодинамики является также постулат Планка:
Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
Закон Гесса
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути ее протекания:
Следствия из закона Гесса:
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
3. Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образовании продуктов реакции (–ΣEпрод). Отсюда
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
5. Энтальпия гидратации равна разности энтальпий растворения безводной соли и кристаллогидрата
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Закон Кирхгофа
Закон Кирхгофа гласит, что температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Уравнение Кирхгофа, являющееся следствием этого закона используется для расчёта тепловых эффектов при разных температурах.
Дифференциальная форма закона:
Интегральная форма закона:
где и — изобарная и изохорная теплоёмкости, — разность изобарных
теплоёмкостей продуктов реакции и исходных веществ, — разность изохорных
теплоёмкостей продуктов реакции и исходных веществ, а и — соответствующие тепловые эффекты.
Теплоемкость-количество теплоты, необходимое для повышения температуры вещества на 1 градус.
Истинная теплоемкость- количество теплоты(бесконечно малое), которое необходимо для бесконечно малого изменения температуры.
Если разница невелика, то можно принять и , соответственно интегральная форма уравнений примет следующий вид:
При большой разнице температур необходимо учитывать температурные зависимости теплоёмкостей: и
Для практических расчетов теплоемкость выражают в виде зависимости степенного ряда от температуры:
∆Cp=∆a+∆bT+∆cT2+∆c’T-2
Законы термодинамики и их описание :: SYL.ru
Законы термодинамики называют также ее началами. На самом деле начало термодинамики представляет собой не что иное, как совокупность тех или иных постулатов, которые лежат в основе соответствующего раздела молекулярной физики. Данные положения устанавливали в течение научных исследований. В то же время они были доказаны экспериментальным путем. Почему же законы термодинамики принимают за постулаты? Все дело в том, что таким образом термодинамику можно строить аксиоматическим путем.

Основные законы термодинамики
Немного о структуризации. Законы термодинамики разделяются на четыре группы, каждая из которых имеет определенный смысл. Итак, что могут поведать нам начала термодинамики?
Первое и второе

Первое начало расскажет о том, как применяется закон сохранения энергии по отношению к той или иной термодинамической системе. Второе начало выдвигает некоторые ограничения, которые применяются к направлениям термодинамических процессов. Более конкретно, они запрещают самопроизвольную передачу тепла, совершаемую от менее нагретого к более нагретому телу. Есть у второго закона термодинамики и альтернативное название: закон возрастания энтропии.
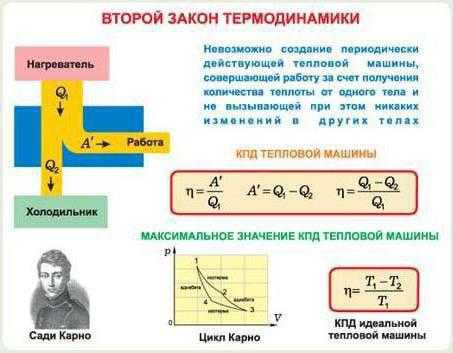
Третье и четвертое
Третий закон описывает поведение энтропии вблизи абсолютного температурного нуля. Есть еще одно начало, последнее. Оно носит название “нулевой закон термодинамики”. Смысл его заключается в том, что любая замкнутая система придет к состоянию термодинамического равновесия и из него выйти уже самостоятельно не сможет. При этом ее начальное состояние может быть любым.
Зачем нужны начала термодинамики?
Законы термодинамики были изучены для того, чтобы описывать макроскопические параметры тех или иных систем. При этом конкретные предложения, имеющие связь с микроскопическим устройством, не выдвигаются. Этот вопрос изучается отдельно, но уже другим ответвлением науки – статистической физикой. Законы термодинамики независимы друг от друга. Что это может означать? Это нужно понимать так, что ни одно начало термодинамики из другого вывести невозможно.
Первое начало термодинамики
Как известно, термодинамическая система характеризуется несколькими параметрами, в числе которых есть и внутренняя энергия (обозначается буквой U). Последняя формируется из кинетической энергии, которую имеют все частицы. Это может быть энергия поступательного, а также колебательного и вращательного движения. На этом моменте вспомним о том, что энергия может быть не только кинетической, но и потенциальной. Так вот, в случае идеальных газов потенциальной энергией пренебрегают. Именно поэтому внутренняя энергия U будет складываться исключительно из кинетической энергии движения молекул и зависеть от температуры.

Эта величина – внутренняя энергия – называется иными словами функцией состояния, поскольку она определяется состоянием термодинамической системы. В нашем случае она определяется температурой газа. Следует отметить, что внутренняя энергия не зависит от того, каким был переход в состояние. Допустим, что термодинамическая система совершает круговой процесс (цикл, как его называют в молекулярной физике). Иными словами, система, выйдя из начального состояния, подвергается определенным процессам, но в результате возвращается в первичное состояние. Тогда нетрудно догадаться, что изменение внутренней энергии будет равно 0.
Как изменяется внутренняя энергия?
Изменить внутреннюю энергию идеального газа можно двумя способами. Первый вариант – совершить работу. Второй – сообщить системе то или иное количество теплоты. Логично, что второй способ подразумевает не только сообщение теплоты, но и ее отнятие.
Формулировка первого начала термодинамики
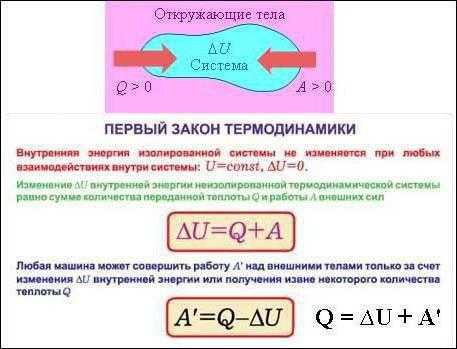
Их (формулировок) может быть несколько, так как все любят говорить по-разному. Но на самом деле суть остается той же. Она сводится к тому, что количество теплоты, которое было подведено к термодинамической системе, расходуется на совершение идеальным газом механической работы и изменение внутренней энергии. Если говорить о формуле или математической записи первого начала термодинамики, то она выглядит следующим образом: dQ = dU + dA.
— Все величины, которые входят в состав формулы, могут иметь разные знаки. Ничто не запрещает им быть отрицательными. Допустим, что к системе подводится количество теплоты Q. Тогда газ будет нагреваться. Возрастает температура, а значит, увеличивается и внутренняя энергия газа. То есть и Q, и U будут иметь положительные значения. Но если внутренняя энергия газа увеличивается, он начинает вести себя активнее, расширяться. Следовательно, работа также будет положительной. Можно сказать, что работу совершает сама система, газ.
— В случае если у системы забирают определенное количество теплоты, внутренняя энергия уменьшается, а газ сжимается. В таком случае можно говорить уже о том, что работу совершают над системой, а не она сама. Предположим опять, что некоторая термодинамическая система совершает цикл. В таком случае (как уже было сказано ранее) изменение внутренней энергии будет равно 0. Значит, работа, совершаемая газом или над ним, будет численно равна подведенной или отведенной к системе теплоте.
— Математическую запись этого следствия называют еще одной формулировкой первого начала термодинамики. Примерно она звучит следующим образом: “В природе невозможно существование двигателя первого рода, то есть, двигателя, который совершал бы работу, превосходящую полученную извне теплоту”.
Второе начало термодинамики
Нетрудно догадаться, что термодинамическое равновесие характерно для системы, в которой макроскопические величины остаются неизменными во времени. Это, конечно же, давление, объем и температура газа. Их неизменность может быть построена на нескольких условиях: на отсутствии теплопроводности, химических реакций, диффузии и других процессов. Если под действием внешних факторов система была выведена из термодинамического равновесия, она к нему со временем вернется. Но если эти факторы будут отсутствовать. Причем произойдет это самопроизвольно.

Мы пойдем немного другим путем, отличным от того, что рекомендуют многие учебники. Для начала ознакомимся со вторым началом термодинамики, а уже потом разберемся, что за величины в него входят, и что они обозначают. Итак, в замкнутой системе при наличии любых протекающих в ней процессов энтропия не убывает. Записывается второе начало термодинамики следующим образом: dS >(=) 0. Здесь знак > будет связан с необратимым процессом, а знак = — с обратимым.
Что же называется в термодинамике обратимым процессом? А это такой процесс, при котором система возвращается (спустя череду каких-то процессов) к своему первоначальному состоянию. Причем в этом случае ни в системе, ни в окружающей среде никаких изменений не остается. Иными словами, обратимый процесс — это такой процесс, для которого возможно возвращение в начальное состояние через промежуточные состояния, идентичные прямому процессу. В молекулярной физике таких процессов очень мало. Например, переход количества теплоты от более нагретого тела к менее нагретому будет необратимым. Аналогично и в случае диффузии двух веществ, а также распространения газа на весь объем.
Энтропия
Энтропия, имеющая место во втором законе термодинамики, равна изменению количества теплоты, деленному на температуру. Формула: dS = dQ/T. Она имеет определенные свойства.
www.syl.ru
Третий закон термодинамики. Применение законов термодинамики
Термодинамика является важным разделом физики. Можно смело утверждать, что ее достижения обусловили появление технологической эры и определили во многом ход человеческой истории за последние 300 лет. В статье рассматриваются первый, второй и третий законы термодинамики и их применение на практике.
Что такое термодинамика?
Прежде чем приводить формулировки законов термодинамики, разберемся, чем занимается этот раздел физики.
Слово «термодинамика» имеет греческое происхождение и означает «движение благодаря теплу». То есть этот раздел физики занимается изучением любых процессов, в результате которых тепловая энергия преобразуется в механическое движение и наоборот.
Основные законы термодинамики были сформулированы в середине XIX века. Наука «о движении и тепле» рассматривает поведение всей системы в целом, изучая изменение ее макроскопических параметров — температуры, давления и объема, и не обращая внимание на ее микроскопическое строение. Причем первый из них играет принципиальную роль в формулировке законов термодинамики в физике. Любопытно отметить, что выведены они исключительно из экспериментальных наблюдений.
Понятие о термодинамической системе

Под ним подразумевают любую группу атомов, молекул или других элементов, которые рассматриваются как единое целое. Все три закона формулируются для так называемой термодинамической системы. Примерами являются: атмосфера Земли, любой живой организм, газовая смесь в двигателе внутреннего сгорания и др.
Все системы в термодинамике относятся к одному из трех типов:
- Открытые. В них существует обмен как теплом, так и веществом с окружающей средой. Например, если в котелке на открытом огне готовится пища, то это яркий пример открытой системы, поскольку котелок получает энергию от внешней среды (костра), при этом он сам излучает энергию в виде тепла, а также из него испаряется вода (обмен веществом).
- Закрытые. В таких системах не существует обмена веществом со средой, хотя обмен энергией происходит. Возвращаясь к предыдущему случаю: если накрыть крышкой котелок, то можно получить систему закрытого типа.
- Изолированные. Это вид термодинамических систем, которые ни веществом, ни энергией не обмениваются с окружающим их пространством. Примером может служить термос, в котором находится горячий чай.
Термодинамическая температура

Под этим понятием подразумевают кинетическую энергию частиц, образующих окружающие тела, которая отражает скорость хаотического перемещения частиц. Чем она больше, тем выше температура. Соответственно, уменьшая кинетическую энергию системы, мы ее охлаждаем.
Под этим понятием подразумевают кинетическую энергию частиц, образующих окружающие тела, которая отражает скорость хаотического перемещения частиц. Чем она больше, тем выше температура. Соответственно, уменьшая кинетическую энергию системы, мы ее охлаждаем.
Термодинамическая температура выражается в СИ (Интернациональная система единиц измерений) в кельвинах (в честь британского ученого Уильяма Кельвина, который предложил впервые эту шкалу). Понимание первого, второго и третьего законов термодинамики невозможно без определения температуры.
Деление в один градус по шкале Кельвина соответствует также одному градусу по Цельсию. Перевод между этими единицами осуществляется по формуле: TK = TC + 273,15, где TK и TC — температуры в кельвинах и градусах Цельсия соответственно.
Особенностью шкалы Кельвина является то, что она не имеет отрицательных значений. Ноль в ней (TC = -273,15 oC) соответствует состоянию, когда тепловое движение частиц системы полностью отсутствует, они оказываются как бы «замороженными».
Сохранение энергии и 1 закон термодинамики

В 1824 году Никола Леонар Сади Карно, французский инженер и физик, выдвинул смелое предположение, которое не только обусловило развитие физики, но и стало важнейшим шагом для совершенствования технологий. Его можно сформулировать следующим образом: «Энергия не может быть создана или разрушена, она может быть лишь переведена из одного состояния в другое».
По сути фраза Сади Карно постулирует закон сохранения энергии, который лег в основу 1 закона термодинамики: «Всякий раз, когда система получает энергию извне, она переводит ее в другие формы, основными из которых являются тепловая и механическая».
Математическая формула для 1-го закона записывается так:
Q = ΔU + A,
здесь Q — количество теплоты, переданное окружающей средой системе, ΔU — изменение внутренней энергии этой системы, A — совершенная механическая работа.
Адиабатические процессы
Наглядным примером их является движение воздушных масс вдоль горных склонов. Такие массы обладают огромными размерами (километры и более), а воздух является прекрасным теплоизолятором. Отмеченные свойства позволяют рассматривать любые процессы с воздушными массами, которые происходят в течение короткого времени, как адиабатические. Когда воздух поднимается по горному склону, то его давление падает, он расширяется, то есть выполняет механическую работу, и, как следствие, охлаждается. Наоборот, движение воздушной массы вниз сопровождается увеличением давления в ней, она сжимается и за счет этого сильно нагревается.
Применение закона термодинамики, который рассмотрен в предыдущем подзаголовке, проще всего продемонстрировать на примере адиабатического процесса.
Согласно определению, в результате него не происходит обмен энергией с окружающей средой, то есть в уравнении выше Q = 0. Это приводит к следующему выражению: ΔU = -A. Знак минус здесь означает, что система совершает механическую работу за счет уменьшения собственной внутренней энергии. Следует напомнить, что внутренняя энергия находится в прямой зависимости от температуры системы.
Направление протекания тепловых процессов
Этим вопросом занимается 2-й закон термодинамики. Наверняка каждый замечал, что если привести в контакт два предмета с разной температурой, то холодный всегда будет нагреваться, а горячий охлаждаться. Отметим, что обратный процесс может происходить в рамках первого закона термодинамики, однако он никогда не реализуется на практике.
Причиной необратимости указанного процесса (и всех известных процессов во Вселенной) является переход системы в более вероятное состояние. В рассмотренном примере с контактом двух тел разной температуры наиболее вероятным состоянием будет то, при котором все частицы системы будут иметь одинаковую кинетическую энергию.
Второй закон термодинамики может быть сформулирован так: «Тепло спонтанно никогда не может быть передано от холодного тела к горячему». Если ввести понятие энтропии как меры беспорядка, тогда его можно представить в таком виде: «Любой термодинамический процесс протекает с увеличением энтропии».
Тепловая машина

Под этим термином понимают систему, которая благодаря подводу к ней внешней энергии может совершать механическую работу. Первые тепловые машины являлись паровыми и были изобретены в конце XVII века.
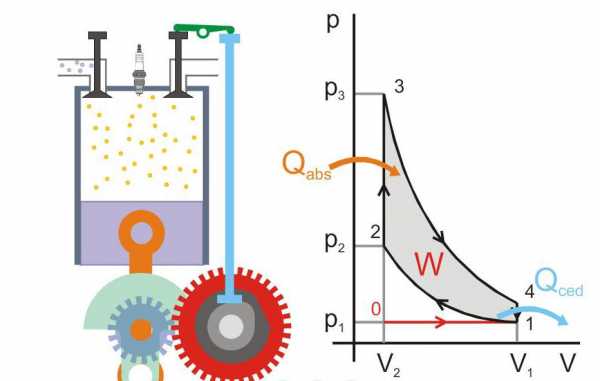
Второй закон термодинамики играет определяющую роль в определении их эффективности. Еще Сади Карно установил, что максимальный КПД этого устройства равен: КПД = (T2 — T1)/T2, здесь T2 и T1 — температуры нагревателя и холодильника. Механическая работа может быть совершена только тогда, когда существует поток теплоты от горячего тела к холодному, причем этот поток невозможно на 100% переводить в полезную энергию.
Ниже приведен рисунок, где изображен принцип работы тепловой машины (Qabs — переданное тепло машине, Qced — тепловые потери, W — полезная работа, P и V — давление и объем газа в поршне).
Абсолютный ноль и постулат Нернста
Наконец, перейдем к рассмотрению третьего закона термодинамики. Он также называется постулатом Нернста (фамилия немецкого физика, который впервые его сформулировал в начале XX века). Закон гласит: «С помощью конечного числа процессов нельзя достигнуть абсолютного нуля». То есть невозможно никаким способом полностью «заморозить» молекулы и атомы вещества. Причиной этого является постоянной существующий теплообмен с окружающей средой.

Один из полезных выводов, сделанных из третьего закона термодинамики, заключается в уменьшении энтропии при движении к абсолютному нулю. Это означает, что система стремится организоваться. Этот факт можно использовать, например, для перевода парамагнетиков в ферромагнитное состояние при охлаждении.
Любопытно отметить, что наименьшей температуры, которой удалось достигнуть в настоящее время, является значение 5·10−10 K (2003 год, лаборатория Массачусетского Технологического Института, США).
fb.ru
Третий закон термодинамики
1. Первый и второй законы термодинамики не позволяют определить значение S0 энтропии системы при абсолютном нуле температуры (T = 0°К). В связи с этим оказывается невозможным теоретический расчет абсолютных значений энтропии,изохорно-изотермного и изобарно-изотермного потенциалов системы, а также константы равновесия.
2. На основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанную трудность и получивший название принципа Нернста или третьего закона термодинамики. В формулировке Нернста он гласит: в любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии системы равно нулю, т. е.
DS (T=0) = 0, S = S0 = const,
независимо от изменения любых других параметров состояния (например, объема, давления, напряженности внешнего силового поля и т. д.). Иными словами, при абсолютном нуле температуры изотермический процесс является также и изоэнтропийным.
3. Из третьего закона термодинамики следует, что для всех тел при T = 0°К обращаются в нуль теплоемкости Сp и СV и термодинамический коэффициент расширяемости a. Из него также вытекает вывод о невозможности осуществления такого процесса, в результате которого тело охладилось бы до температуры T = 0°К (принцип недостижимости абсолютного нуля температуры).
4. Принцип Нернста был развит Планком, предположившим, что S0 = 0: при абсолютном нуле температуры энтропия системы равна нулю. Физическое истолкование принципа Нернста в формулировке Планка дается в статистической физике.
Условие S0 = 0 при T = 0°К является следствием квантового характера процессов, происходящих в любой системе при низких температурах, и выполняется только для систем находящихся при Т = 0°К в состоянии устойчивого, а не метастабильного равновесия. На основании гипотезы Планка можно определить абсолютные значения энтропии системы в произвольном равновесном состоянии.
www.examen.ru
Первый закон термодинамики простыми словами
Содержание:
Определение первого закона термодинамики
Простая формулировка первого закона термодинамики может звучать примерно так: изменение внутренней энергии той или иной системы возможно исключительно при внешнем воздействии. То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая. То есть на примере пословицы про рыбку и труд, можно представить, что рыбка и есть наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытащит из пруда) без нашего внешнего воздействия и участия (труда).
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировки сути данного закона:
- Энергия ни откуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).
- Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.
- Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.
- Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Формула первого закона термодинамики
Формулу первого закона термодинамики можно записать таким образом:
Q = ΔU + A
Количество теплоты Q, передаваемое системе равно суме изменения ее внутренней энергии ΔU и работы A.
Процессы первого закона термодинамики
Также первый закон термодинамики имеет свои нюансы в зависимости от проходящих термодинамических процессов, которые могут быть изохронными и изобарными, и ниже мы детально опишем о каждом из них.
Первый закон термодинамики для изохорного процесса
Изохорным процессом в термодинамике называют процесс, происходящий при постоянном объеме. То есть, если будь-то в газе или жидкости нагреть вещество в сосуде, произойдет изохорный процесс, так как объем вещества останется неизменным. Это условие имеет влияние и на первый закон термодинамики, проходящий при изохорном процессе.
В изохорном процессе объем V является константой, следовательно, газ работы не совершает A = 0
Из этого выходит следующая формула:
Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Первый закон термодинамики для изобарного процесса
Аналогично изобарным процессом называется термодинамический процесс, происходящий в системе при постоянном давлении и массе газа. Следовательно, в изобарном процессе (p = const) работа, совершаемая газом, выражается следующим уравнением первого закона термодинамики:
A = p (V2 – V1) = p ΔV.
Изобарный первый закон термодинамики дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
Применение первого закона термодинамики
Первый закон термодинамике имеет практическое применение к различным процессам в физике, например, позволяет вычислить идеальные параметры газа при разнообразных тепловых и механических процессах. Помимо сугубо практичного применение можно этому закону найти применение и философское ведь что ни говорите, но первый закон термодинамики является выражением одного из самых общих законов природы – закона сохранения энергии. Еще Еклезиаст писал, что ничто ни откуда не появляется и никуда не уходит, все пребывает вечно, постоянно трансформируясь, в этом и кроется вся суть первого закона термодинамики.
Первый закон термодинамики, видео
И в завершение нашей статьи вашему вниманию образовательное видео о первом законе термодинамике и внутренней энергии.
www.poznavayka.org
2.6. Третий закон термодинамики (тепловой закон Нернста)
2.6. Третий закон термодинамики (тепловой закон Нернста)
Как уже указывалось, первый и второй законы термодинамики были сформулированы как принципы невозможности двигателей первого и второго рода.
Третий закон термодинамики сформулирован как принцип невозможности достижения абсолютного нуля температур.
Рассматривая максимально возможные теплоту и работу химических реакций вблизи абсолютного нуля температуры, немецкий физик и физикохимик В. Нернст (1864–1941) заметил, что для конденсированных систем при T → 0 производные теплоты и работы по температуре становятся равными друг другу и также стремятся к нулю. Базируясь на этом, он своей теоремой (теорема Нернста) установил, что вблизи абсолютного нуля температуры значение всех теплоемкостей становится равным нулю и энтропии S всех веществ, находящихся в равновесном состоянии, становятся неизменными и равными между собой. Этот вывод, называемый тепловым законом Нернста, в дальнейшем подтвержден практикой расчетов и экспериментальными данными определения теплоемкостей. В дальнейшем М. Планк показал, что абсолютные значения энтропии при T → 0 для различных веществ не только равны друг другу, но и могут быть приняты равными нулю, т. е. для всех веществ при T → 0 имеем S 0 =0.
Из вышеуказанного рассуждения следует, что ни путем отвода тепла (т. е. охлаждением тела), ни путем совершения какой-либо работы вблизи абсолютного нуля понизить температуру тела невозможно. Этот вывод формулируется как весьма важный закон: абсолютный нуль температуры недостижим. Опыт показывает, что, говоря словами самого Нернста, «в соответствии с результатами квантовой теории для каждого твердого тела существует в окрестности абсолютного нуля некий температурный интервал, в котором само понятие температуры практически теряет смысл», или, проще говоря, в этом температурном интервале свойства тела (объём, тепловое расширение, сжимаемость и т. д.) не зависят от температуры. Это поле термической нечувствительности различно у разных тел; у алмаза, согласно Нернсту, оно простирается не менее чем на 40 градусов от абсолютного нуля.
energetika.in.ua
