Урок-лекция по теме «Виды химических связей. Типы кристаллических решеток» — СТРОЕНИЕ ВЕЩЕСТВА — ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс — поурочные разработки — разработки уроков — авторские уроки — план-конспект урока
Тема II. СТРОЕНИЕ ВЕЩЕСТВА
Урок 10. Урок-лекция по теме «Виды химических связей. Типы кристаллических решеток»
Цели урока: углубить и расширить знания о причинах возникновения разных видов химической связи и механизмах их образования; научить характеризовать химическую связи по определенному плану; дать более полное представление о всех типах кристаллических решеток; научить соотносить зависимость физических и химических свойств веществ от вида химической связи и типа кристаллической решетки.
Основные понятия: химическая связь; виды химической связи; ковалентная, ионная, механизмы образования связи: обменный, донорно-акцепторный; электроотрицательность, степень ионности, кристаллические решетки: атомные, ионные, молекулярные; дипольный момент; σ- и π-связи; кратность связи.
Оборудование: таблица «Химическая связь»; кодотранспорант «Шкала ЭО по Полингу»; модели кристаллических решеток; эбонитовая палочка; бюретка с водой, карточки-задания (для закрепления).
Ход урока
I. Организационный момент
Учитель сообщает учащимся результаты контрольной работы; делает анализ выполнения заданий, разбирает типичные ошибки; можно предложить учащимся сделать работу над ошибками.
II. Изучение нового материала
План изложения
1. Определение химической связи. Причины образования химической связи.
2. Ионная связь. Тип кристаллической решетки соединений с ионной связью. Физические свойства веществ.
3. Ковалентная связь. Механизмы образования ковалентной связи по МВС: а) обменный; б) донорно-акцепторный.
4. Разновидности ковалентной связи; а) неполярная; б) полярная.
5. σ- и π-связи. Кратность связи.
6. Типы кристаллических решеток соединений с ковалентной связью. Физические свойства веществ.
7. Понятия «полярность связи» и «полярность молекулы».
Вопрос. Какие виды химической связи известны? А какие типы кристаллических решеток?
Ответ. Известны ковалентная связь, ионная связь, металлическая связь, водородная связь. Типы кристаллических решеток — ионная, атомная, молекулярная.
Главными задачами урока являются выяснение причин возникновения различных видов химической связи и изучение механизмов образования связи.
Вопрос. Что такое химическая связь?
Ответ. Под химической связью понимаются электрические силы притяжения, удерживающие частицы друг около друга. Частицами могут быть атомы, ионы, молекулы.
Причиной образования химической связи между частицами является стремление системы к минимуму энергии. Энергия образующейся системы — химической связи — меньше энергии, которой обладают изолированные частицы. Идет выигрыш в энергии.
Среди частиц самые устойчивые те, у которых внешний энергетический уровень завершен. Благородные газы на внешнем энергетическом уровне имеют октет электронов, у Не — 2е—. Таким образом, атомы, имеющие на внешнем энергетическом уровне меньше 8 электронов, стремятся приобрести структуру инертных газов, т. е. иметь октет электронов на внешнем энергетическом уровне.
Образование такой устойчивости может идти несколькими способами и приводит к образованию соединений с разными видами химической связи: ковалентной, ионной, металлической, водородной.
Любая химическая связь образуется только тогда, когда сближение частиц (двух или более) приводит к понижению полной энергии системы. Определяющими являются энергия взаимодействия — Е и межъядерное расстояние — r.
Важнейшим фактором характеристики атома при образовании химической связи является его электроотрицательность (ЭО) — способность притягивать электроны.
Далее необходима работа с таблицей «Шкала ЭО по Полингу» (кодотранспорант). ЭО усиливается к концу периода, к концу группы главной подгруппы.
Определение типа связи:
— если атомы обладают одинаковой ЭО, возникает ковалентная связь;
— если атомы обладают ЭО разной, но не резко отличаются, разность в ЭО < 1,7 — возникает ковалентная полярная связь;
— если атомы обладают ЭО разной, резко отличаются, разность в ЭО > 1,7 — возникает ионная связь.
По шкале ЭО по Полингу можно определить степень ионности — полярность связи: чем больше разность в ЭО, тем больше степень ионности, тем полярнее связь.
|
Разность в ЭО |
Степень ионности, % |
|
0 |
0 |
|
0,5 |
6 |
|
1,0 |
22 |
|
1,5 |
44 |
|
2,0 |
63 |
|
2,5 |
79 |
|
3,0 |
89 |
Таким образом, при разности в ЭО больше, чем 1,7, возникает ионная связь.
Ионная связь — связь за счет электростатического притяжения противоположно заряженных частиц (катионов — положительно заряженных и анионов — отрицательно заряженных). Ионная связь возникает между атомами, резко отличающимися в ЭО — типичные металлы и типичные неметаллы. Рассмотрим механизм образования ионной связи в соединении NaCl.
Это соединение образовалось между атомом Na — типичный металл, ЭОNa = 0,9, и атомом Сl — типичный неметалл, ЭОCl = 3,2.
Разность в ЭО = 2,3, следовательно, возникает ионная связь.
При взаимодействии Na с Сl2:
2Na + Cl2 = 2NaCl
в результате окислительно-восстановительной реакции образуются катионы сильно электроположительного элемента (металла) и анионы сильно электроотрицательного элемента.
Наблюдается отдача одного s-электрона атома Na:
Возникает устойчивая частица с октетом электронов на внешнем энергетическом уровне: 1s 22s22p6 — Na+, катион натрия. Атом хлора присоединяет электрон на р-подуровень:
Возникает устойчивая частица, так же с октетом электронов на внешнем энергетическом уровне — аннон хлора. Между образовавшимися ионами возникают силы электростатического притяжения, которые будут удерживать их друг около друга, осуществляется тем самым ионная связь. Она характерна для бинарных, образованных металлами и неметаллами, а также более, сложных — трехэлементных — соединений: щелочи, соли. В этом случае катионы и анионы могут быть не только простыми, но и сложными.
Пример: катион аммония — NH4+; сульфат — анион SO42-; гидроксид — анион ОН—.
Катионы и анионы, взаимодействуя друг с другом, образуют вещества в твердом состоянии с ионной кристаллической решеткой. В пространстве катионы и анионы упорядоченно располагаются. Чем меньше размер иона и чем больше его заряд, тем сильнее его электростатическое поле и тем прочнее химическая связь.
Так, энергия кристаллической решетки LiF — 1004 кДж/моль, а у NaCl — 755 кДж/моль. Все вещества с ионной кристаллической решеткой малолетучие, твердые, тугоплавкие, проводят электрический ток в растворах и расплавах. Однако кристаллы с ионной связью — ионы — очень хрупкие, т.к. при незначительном сдвиге плоскостей в кристалле наблюдается близкое приближение одноименно заряженных ионов, которые, отталкиваясь друг от друга, вызывают разрыв, появляется трещина в кристалле.
При высоких температурах многие вещества с ионной связью, например галогениды, переходят в газообразные соединения. В газовой фазе могут находиться молекулы NaCl и их агрегаты (NaCl)2 с непрочными ковалентными связями, а также ионы Na+ и Сl—.
Следует знать, что соединений с ионной связью — ограниченное количество, чисто ионная связь в соединениях не существует. В этих случаях следует говорить о степени ионности. Чем она выше, тем связь более ионная.
По мере увеличения количества электронов на внешнем энергетическом уровне атома металла усиливается прочность их связи с ядром атома, уменьшается способность к образованию ионной связи. У алюминия с галогенами возникают ковалентные связи, однако под влиянием, например, полярных растворителей эти связи становятся ионными.
Ионная связь — крайний случай ковалентной полярной связи. Что же такое ковалентная связь?
Связь посредством общих электронных пар называется ковалентной. Она возникает в случае разности в ЭО меньше 1,7, приближающейся к нулю. Если атомы обладают одинаковой ЭО — возникает ковалентная неполярная связь; если атомы обладают разной ЭО — возникает ковалентная полярная связь.
Существует два механизма возникновения ковалентной связи: обменный и донорно-акцепторный. Для обменного механизма необходимы следующие условия:
1) взаимодействующие атомы должны иметь неспаренные электроны, характеризующиеся различными спиновыми квантовыми числами:
2) в системе должна находиться частица с низким запасом энергии, которая поглощала бы энергию, выделяющуюся при образовании химической связи, т. к. образование связи — эндотермический процесс:
Частица X может быть либо А либо В с низким запасом энергии. Получив энергию, она может сама участвовать в образовании химической связи.
Данный механизм образования химической связи объясним методом валентных связей (МВС).
Пример: образование молекулы водорода Н2:
атом водорода —
атом водорода —
радиус атома Н — rн = 0,053 нм
При образовании химической связи идет перекрывание АО (атомных орбиталей).
Если бы не было перекрывания орбиталей, то межъядерное расстояние было бы равно 2r = 0,053 х 2 = 0,106 (нм).
Однако в молекуле водорода это расстояние равно 0,074 нм, т.е. меньше. Следовательно, идет перекрывание орбиталей.
При сближении атомов водорода Н’ и Н» силы электростатического притяжения электрона атома Н’ к ядру атома Н» и электрона атома Н» к ядру атома Н’ будут возрастать, начнут притягиваться друг к другу. Одновременно будут возрастать силы отталкивания между одноименно заряженными ядрами атомов Н’ и Н». Это приводит к тому, что атомы могут сблизиться между собой настолько, что силы притяжения будут уравновешены полностью силами отталкивания и электронные облака начнут перекрываться между собой, что обеспечивает перемещение электрона одного атома Н’ в поле притяжения ядра атома Н» и наоборот, и каждый атом в какой-то момент будет иметь завершенный внешний энергетический уровень, как у благородных газов.
Связь, осуществленная за счет образования общих электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Разновидности ковалентной связи:
а) неполярная ковалентная связь возникает между атомами, обладающими одинаковой ЭО.
Пример: O
б) полярная ковалентная связь возникает между атомами, которые различаются не резко в ЭО.
Пример: НСl, NH3, Н2O и т. д. (если позволяет время урока в классах, где учащиеся воспринимают материал более осознанно, можно объяснить понятие «дипольный момент» для объяснения полярности связи).
Дипольный момент μ есть произведение длины диполя / (расстояние между двумя равными по величине и противоположными по знаку зарядов + q и -q) на абсолютную величину заряда: μ = lq.
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному.
Пример:
HF, μ = 6,4 · 10-30
НСl, μ = 3,5 · 10-30
НВr, μ = 2,6 · 10-30
HI, μ = 1,3 · 10-30
Наибольший дипольный момент у фтороводорода, где F обладает большей ЭО.
Молекула Н2O μ = 6,1 · 10—30.
Угловое строение молекулы
Молекула СO2,
Каждая связь полярна и μ = 9 · 10-30, однако молекула неполярна, μ = 0, т. к. связи С=0 расположены на одной прямой и компенсируют дипольные моменты друг друга. Почему такое строение в пространстве имеют молекулы СO2 и Н2O, это вопрос следующих уроков темы.
Из вышесказанного, следует различать понятия «полярность связи» и «полярность молекулы» в целом (опыт демонстрационный). В простых двухатомных молекулах дипольный момент и полярность связи равны, а в сложных соединениях Н2O, NH3, НСl, СO2 — не равны.
В случаях трудности понимания дипольного момента возможно объяснение полярности связи нахождением разности в ЭО атомов, образующих соединение, а затем сделать вывод, какая связь более полярна.
Пример: HF и HI
Полярнее связь в соединении HF, т. к. разность в ЭО 1,9 больше 0,4.
Полярная ковалентная связь есть промежуточная между ковалентной неполярной и ионной связью.
Кроме обменного механизма образования ковалентной связи возможен и донорно-акцепторный механизм.
Для осуществления такого механизма необходимы следующие условия:
1. В системе должны находиться две частицы. Одна — донор, имеющий неподеленную пару электронов. другая — акцептор, имеющий свободную орбиталь
Такие частицы образуются в результате обменного механизма, при перераспределении электронов.
Пример:
— свободная орбиталь, акцептор (Н+Сl)
— неподеленная пара электронов, донор (К+Н—)
2. В системе должна находиться частица, поглощающая энергию (как и при обменном механизме).
Пример: образование иона аммония.
[NН4]+; аммиак NH3, N +7.
1s22s22p3
— три связи образованы по обменному механизму: у атома азота есть неподеленная пара электронов 2s2, атом азота — донор, катион водорода — акцептор
Кратность связи соответствует числу общих электронных пар. Одинарная связь — одна общая электронная пара, двойная связь — две общих электронных пары, тройная — три общих электронных пары.
При осевом перекрывании орбиталей возникает прочная, неполяризуемая трудноразрываемая σ-связь (сигма-связь).
При осевом перекрывании s-орбиталей σ-связь s—s:
При осевом перекрывании р-орбиталей σ-связь р—р:
При осевом перекрывании s-орбитали и р-орбитали; σ-связь s—р:
В случае двойной или тройной связи кроме образования σ-связи (осевого перекрывания орбиталей) образуется и π-связь (пи-связь). В этом случае идет боковое перекрывание орбиталей.
π-связь
В случае двойной связи — одна σ-связь, другая π-связь; тройной связи — одна σ-связь и 2 π-связи.
В некоторых случаях возможно нахождение связи в динамическом состоянии, т. е. электронные облака «размазаны» между двумя, тремя, четырьмя и т.д. атомами, тогда кратность связи дробная, полуторная. В бензоле С6Н6 6е— — π-облако, связь полуторная, если одинарная связь имеет длина 0,154 нм, двойная связь — 0,134 нм, то в ароматическом кольце ее длина — 0,140 нм.
Все вещества с ковалентной связью как правило при обычных условиях могут быть жидкостями, газами, твердыми по агрегатному состоянию; низкоплавкие, летучие. Они могут образовывать два типа кристаллических решеток.
Атомные кристаллические решетки — в узлах кристаллической решетки — атомы, между которыми ковалентные связи.
Пример: алмаз, графит, бор, кремний,
SiC — карборунд; SiO2 — кварц; некоторые силициды, карбиды, оксиды: Аl2О3; Сr2O3; физические свойства веществ с атомной кристаллической решеткой — твердые, тугоплавкие, нелетучие, в воде нерастворимые.
Молекулярные кристаллические решетки — в узлах находятся молекулы, между которыми слабые силы межмолекулярного взаимодействия. Большинство веществ с такой решеткой — газыO2; N2; СO2; Сl2, жидкости — вода, спирт, кислоты, Вr2; твердые вещества — нафталин, I2, нефть, глюкоза, сахароза. Они обладают летучестью, хрупки в кристаллическом виде, имеют низкуюt ° кипения и t ° плавления. В зависимости от полярности молекул они могут быть растворимы в воде, диссоциировать, проводить электрический ток.
III. Обобщения и выводы по узловым вопросам темы
Таким образом, мы выяснили причины и механизмы образования ионной и ковалентной связи no МВС, а также отметили зависимость физических свойств веществ от вида химической связи, типа кристаллической решетки.
Учащимся можно показать демонстрационный опыт, подтверждающий способность поляризованных молекул ориентироваться в электрическом поле и перемещаться в область высокого напряжения.
Мехом натирается эбонитовая палочка, которая приближается к тонкой струе воды, вытекающей из бюретки. Струя притягивается к палочке. Струя бензола или эфира не притянется к наэлектризованной палочке.
IV. Закрепление
1. Определить вид химической связи в соединениях. Обосновать ответ:
ВаСl2; SO2; С2Н6; F2; КВr; I2.
2. В каком из указанных соединений наиболее полярная связь? Расположить соединения в порядке возрастания полярности:
HCl; F2; Н2O; NH3; H2S
3. В чем причина резкого отличия в физических свойствах СО2 и SiO2?
4. Как образуется σ-связь и π-связь?
Ответы на вопросы закрепления
1. Ионная связь: КВr; ВаСl2. Элементы, образующие соединения, резко отличаются в ЭО. Ковалентная полярная связь.
SO2; C2H6 — элементы, образующие соединения, отличаются в ЭО не резко. Ковалентная неполярная связь.
F2; I2 — элементы, образующие соединения, одинаковы по ЭО.
2. Наиболее полярная связь в соединении Н2O.
ЭОн = 2,1; Э0O = 3,5, разность в ЭО 3,5 — 2,1 = 1,4.
3. СO2 — ковалентная полярная связь: газ. Твердое вещество — молекулярная кристаллическая решетка, легкоплавкое, летучее;
SiO2 — ковалентная полярная связь, твердое вещество, тугоплавкое; атомная кристаллическая решетка.
4. σ-связь возникает при осевом перекрывании орбиталей, прочная, труднополяризуемая.
π-связь возникает при боковом перекрывании орбиталей, подвижная, легко поляризуемая, непрочная.
IV. Домашнее задание
1) § 6 с. 44-51. № 3
2) составить схемы образования химической связи в соединениях КН, NH3, HF; указать вид химической связи, механизм, образования, тип кристаллической решетки, физические свойства веществ, (домашнее задание выполнить на отдельном листе).
compendium.su
11 класс. Химия. Типы химической связи. Ковалентная. Ионная. Металлическая. Водородная. — Ковалентная и ионная связь.
Комментарии преподавателя
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: (на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд , а на атоме водорода — частичный положительный . Таким образом, молекула становится полярной:
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или отдачи электронов Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
В итоге образуются противоположно заряженные частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
После рассмотрения каждого вида связи следует перейти к их сравнительной характеристике.
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалент-ная неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалент-ная полярная. В случае, если электроны, участвую щие в образовании связи, принадлежат одному атому, то связь ионная.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
Все вышеперечисленные отличия в механизме образования связи объясняют различие в свойствах веществ с разными видами связей.
Источники
http://www.youtube.com/watch?v=FgG0reACjL4
http://interneturok.ru/ru/school/chemistry/11-klass
источник презентации — http://ppt4web.ru/khimija/khimicheskaja-svjaz1.html
www.kursoteka.ru
Урок химии на тему «Химическая связь», 11-й класс
Разделы: Химия
Цель урока и задачи:
Образовательная: выявление и оценка степени овладения системой знаний и комплексом навыков и умений о химической связи, готовности учащихся успешно применять полученные знания на практике, позволяющие обеспечить обратную связь и оперативную корректировку учебного процесса;
Развивающая: развитие критического мышления , самостоятельности и способности к рефлексии, обеспечение системности учения;
Воспитательная: воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Тип урока: — применение знаний по теме.
Оборудование: ПК, медиапроектор, STAR BOARD, у учителя- макеты кристаллических решеток, модели биополимеров: белков, ДНК, скотч, на каждом столе у учащихся – мини-лекция, фломастеры, листки чистой бумаги.
СХЕМА УРОКА
1. Стадия вызова — СОСТАВЛЕНИЕ КЛАСТЕРА ( ПУЧОК)
Задачи этой стадии:
- самостоятельное определение учащимися направлений в изучении темы, тех ее аспектов, которые хотелось бы обсудить и осмыслить;
- самостоятельная актуализация по теме и пробуждение познавательной активности;
на этой фазе работы заслушивается коллективное мнение, знание об этом понятии и выявляются остаточные знания.
На этом этапе не дается оценка знаний. Но кластер пока с доски не стирается.
Учитель ставит перед ребятами вопрос: « А соответствуют ли ваши представления научным понятиям?» и ставит учебную задачу.
2. СТАДИЯ ОСМЫСЛЕНИЯ
Учащимся предлагается новая информация, которую они должны отработать.
Задачи этой стадии:
- организация активной работы с информацией, увязать их уже с имеющимися знаниями
- активно отслеживать свое понимание (каждому)
Эта технология связана с текстом и письмом. Требования к тексту: 7-10 минут прочтения. Текст-это последовательность осмысленных высказываний, передающих информацию, объединенных общей темой, обладающих свойствами связности и целостности. Текст должен быть адаптирован, Читая текст, делать пометки на полях:
V – я знал
+ -не знал
— — понимал не так (думал по-другому)
? — не понял, хочу узнать больше.
Прочитав текст один раз, нужно вернуться к своим первоначальным предположениям, вспомнить, что сам ученик знал или предполагал по данной теме раньше, возможно, количество значков увеличится.
Далее в тетради , или на листке сформулировать эти значки словами в таблицу «ИНСЕРТ»
Для заполнения таблицы необходимо снова вернутся к тексту, таким образом, обеспечивается вдумчивое, внимательное чтение.
V |
+ |
— |
? |
Я знал, что… |
|
|
|
На этом этапе реализуется личностно-ориентированный подход по поводу содержания урока. ЭТО НЕ ПРОВЕРЯЕМО. Технологический прием « ИНСЕРТ» сделают зримым процесс накопления информации, путь от «старого» знания к « новому». При этом графу ? необходимо довести до конца. Возвращаемся снова к КЛАСТЕРУ. Большой потенциал данный прием имеет на стадии рефлексии – это исправление неверных предложений в « предварительном КЛАСТЕРЕ», заполнение иго на основе новой информации, установление причинно-следственных связей между отдельными смысловыми блоками ( работа может вестись индивидуально в группах, по всей теме или по отдельным смысловым блокам). Учитель спрашивает:»Что изменилось?»,стирает жестко КЛАСТЕР. Очень важным моментом является презентация «новых» КЛАСТЕРОВ- это и есть осмысление. Ошибаться не стыдно, исправлять – нормальный процесс.
3. СТАДИЯ РЕФЛЕКСИИ – ОСМЫСЛЕНИЕ
Вопрос |
Вариант ответа |
|||||
1.соотнесите |
1)хлорид калия |
Тип связи: |
||||
2.Между атомами каких элементов химическая связь будет иметь ионный характер? |
а) N и О |
б)Si и Cl |
в)Na и O |
г)P и Br |
||
3.Неполярная ковалентная связь наблюдается в следующем веществе |
А) углекислый газ |
Б) алмаз |
В) аммиак |
Г) хлороформ |
||
4. Какие из перечисленных признаков хар-ы для веществ с металлическим типом связи: |
А) 1,2,4 |
Б) 2,3,4 |
В)1,2,5 |
Г) 3,4,5 |
||
5. Соотнесите |
I. кремний |
|
А)ионная |
|||
САМОПРОВЕРКА
Вопрос |
Ответ |
1. |
1а, 2б, 3в, 4г, 5а, 6г |
2. |
В |
3. |
Б |
4. |
А |
5. |
I.4.в; II.3.а; III.2.б; IV.1.г. |
ПОДВЕДЕНИЕ ИТОГОВ : выяснить отношение учащихся прошедшему к семинару. Время 5 минут, участвуют все. Материал: листы бумаги всем участникам, фломастеры, скотч.
ПРОВЕДЕНИЕ:
Вопросы для подведения итогов работы обозначаются с помощью пальцев:
— большой палец – над темой я хотел(а) бы еще поработать
— указательный палец – здесь мне необходимы конкретные указания
— средний палей – мне здесь совсем не понравилось
— безымянный палец – психологическая атмосфера
— мизинец – мне здесь не хватало …
Ребята рисуют свои руки, обводя их контур, записывают вопросы возле каждого пальца и вписывают внутри контура свои вопросы. Затем листки вывешиваются – как бы « на выставке», и всем учащимся до общего обсуждения предоставляется время для знакомства и следующий урок начинается с обсуждения.
ДОМАШНЕЕ ЗАДАНИЕ:
обязательная часть: по задачнику работа
индивидуальная часть: познакомиться с результатами предыдущего урока, на основе самоконтроля и самопроверки поработать над ошибками дома.
Приложение
15.05.2010
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Решебник по «Химия 8 класс» Рабочая тетрадь Габриелян О.С. Сладков С.А
Тема 11. Металлическая химическая связь. Обобщение знаний о типах химической связи
Часть I
1. Связь между атом-ионами в металлах и сплавах за счёт обобществлённых внешних электронов называется металлической.
2. Схема образования металлической связи:
3. Заполните таблицу «Типы химической связи».
Часть II
1. Установите соответствие между типом химической связи и формулами веществ. Из букв, соответствующих правильным ответам, вы составите название первого металлического сплава, который использовал человек: бронза.
2. Из ряда формул веществ:
— выберите те, которые соответствуют электронной формуле вещества, представленной в общем виде.
3. Напишите формулы веществ, образованных элементами 2-го периода с помощью всех типов химической связи.
Запишите схемы образования веществ с ионной и ковалентной полярной химической связью.
4. Исключите «лишнее».
5. Верны ли следующие утверждения?
А. Природа любой химической связи электростатическая.
Б. В одном веществе может быть только один вид химической связи.
4) оба суждения неверны
6. Между атомами элементов с порядковыми номерами 11 и 9 образуется химическая связь:
1) ионная
7. Верны ли следующие суждения?
А. Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Б. Вещество кальций Са и нитрид кальция Ca3N2 образованы соответственно с помощью металлической и ковалентной неполярной связей.
4) оба суждения неверны
gdzkurokam.ru
«Типы химической связи» (11 класс)
Инфоурок › Химия › Презентации › Презентация по химии на тему : «Типы химической связи» (11 класс)
Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:
Типы химических связей
2 слайд Описание слайда:
Описание слайда:
Причиной образования химической связи является стремление системы к минимуму энергии: при её образовании, как правило, энергия выделяется, образующаяся система обладает меньшей энергией, чем изолированные атомы. Происходит уменьшение энергии на величину энергии связи(Есв.). Энергия связи (Есв.)- энергия, необходимая для разрушения этой связи.
3 слайд Описание слайда:
Описание слайда:
Химическая связь- взаимодействие между атомами, приводящее к образованию устойчивой системы- молекулы, иона, кристалла.
4 слайд Описание слайда:
Описание слайда:
Различают четыре типа химических связей: Ионная связь. Ковалентная связь. Металлическая связь. Водородная связь. Рис.1
5 слайд Описание слайда:
Описание слайда:
Выполните упражнение №1 Из предложенного списка распределите формулы веществ в таблице по соответствующим столбикам: PCl 5, CH 4 , Fe, O2, P2O5, HF, CsF, Cu2O, KCl, N2, P4, FeO ИОННАЯ СВЯЗЬ КОВАЛЕНТНАЯ СВЯЗЬ МЕТАЛЛИЧЕСКАЯ СВЯЗЬ ПОЛЯРНАЯ НЕПОЛЯРНАЯ
6 слайд Описание слайда:
Описание слайда:
Ионная связь это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам. + Na — Cl + Na — Cl + Na — Cl
7 слайд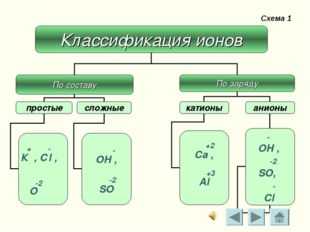 Описание слайда:
Описание слайда:
Схема 1 — ОН , -2 SO, — Cl
8 слайд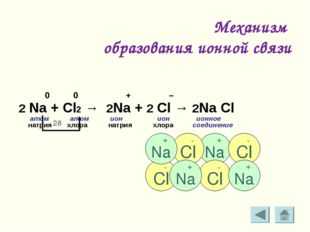 Описание слайда:
Описание слайда:
Механизм образования ионной связи 0 0 + – 2 Na + Cl2 → 2Na + 2 Cl → 2Na Cl атом атом ион ион ионное натрия хлора натрия хлора соединение 2ē + Na — Cl — Cl — Cl — Cl + Na + Na + Na
9 слайд Описание слайда:
Описание слайда:
Ковалентная связь это связь, возникает между атомами за счёт образования общих электронных пар. ē ē ē ē ē ē
10 слайд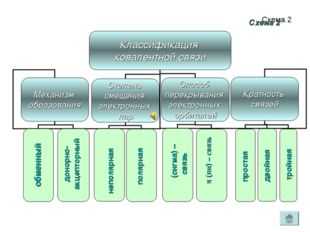 Описание слайда:
Описание слайда:
Схема 2 обменный донорно- акцепторный полярная неполярная σ (сигма) – связь π (пи) – связь простая двойная тройная Схема 2
11 слайд Описание слайда:
Описание слайда:
Обменный механизм образования ковалентной связи ☼ Действует, когда атомы образуют общие электронные пары за счёт объединения неспаренных электронов. Например: Н2 – водород Н• + •Н → Н ׃ Н или Н — Н ; НCl – хлороводород или соляная кислота Н• + • Cl → Н Cl или H – Cl ; 3. N2 – азот N • + • N → N N или N N. •• •• •• •• •• •• •• •• •• ••• • • • • ••• •• ••
12 слайд Описание слайда:
Описание слайда:
Донорно-акцепторный механизм образования ковалентной связи ☼ Действует между веществами донором и акцептором. Донор – вещество, у которого имеется свободная электронная пара. Акцептор – вещество, у которого имеется свободная орбиталь. Аммиак Соляная Ион аммония кислота (донор) (акцептор) Н Н N H .. — — І + H Cl □ → + [ ] — — — H H H H N •• + Cl
13 слайд Описание слайда:
Описание слайда:
Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов. Ряд электроотрицательности: F, O, N, C l, Br, S, C, P, Si НЕПОЛЯРНАЯ ковалентная связь – это связь, образованная между атомами с одинаковой электроотрицательностью. Например : H – H; Cl – Cl; N N. ПОЛЯРНАЯ ковалентная связь – это связь, образованная между атомами с разной электроотрицательностью. Например: H – Cl; H – S – H. ІІІ
14 слайд Описание слайда:
Описание слайда:
Кратность ковалентной связи ☼Зависит от числа общих электронных пар, связывающих атомы. Бывает: ПРОСТАЯ « — » — это одна σ-связь; ДВОЙНАЯ « » — это одна σ-связь и одна π-связь; 3. ТРОЙНАЯ « » — это одна σ-связь и две π- связи. ІІ ІІІ
15 слайд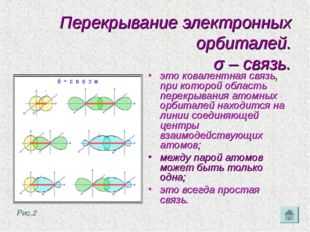 Описание слайда:
Описание слайда:
Перекрывание электронных орбиталей. σ – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей находится на линии соединяющей центры взаимодействующих атомов; между парой атомов может быть только одна; это всегда простая связь. Рис.2
16 слайд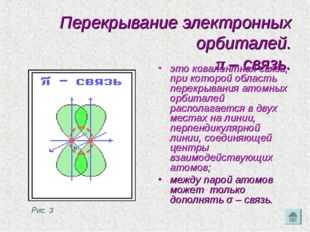 Описание слайда:
Описание слайда:
Перекрывание электронных орбиталей. π – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей располагается в двух местах на линии, перпендикулярной линии, соединяющей центры взаимодействующих атомов; между парой атомов может только дополнять σ – связь. Рис. 3
17 слайд Описание слайда:
Описание слайда:
Металлическая связь это связь, которую осуществляют относительно свободные электроны между ионами металлов в металлической решётке. n+ M n+ M n+ M n+ M n+ M n+ M n+ M n+ M — — — — — — — — — —
18 слайд Описание слайда:
Описание слайда:
Механизм образования металлической связи: 0 n+ М — nē = М Например: для элементов (металлов) Ι группы главной 0 1+ подгруппы М — 1ē = М ; для элементов (металлов) Ι Ι группы главной 0 2+ подгруппы М — 2ē = М .
19 слайд Описание слайда:
Описание слайда:
Водородная связь Межмолекулярная водородная связь – это связь между атомами водорода одной молекулы и сильноотрицательными элементами(O, N, F) другой молекулы. Н О — — — — Н О Н Н Н Н — — — — О Н — — — — О Н | | | | | | | |
20 слайд Описание слайда:
Описание слайда:
Водородная связь Внутримолекулярная водородная связь – эта связь возможна при наличии в одной молекуле и электроноакцепторной группы и электронодонорного атома. Например в молекуле ДНК: І І А-Т Г-Ц Г-Ц Т-А І І Рис.4

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДБ-264800
ВНИМАНИЮ ВСЕХ УЧИТЕЛЕЙ: согласно Федеральному закону N273-ФЗ «Об образовании в Российской Федерации» педагогическая деятельность требует от педагога наличия системы специальных знаний в области обучения и воспитания детей с ОВЗ. Поэтому для всех педагогов является актуальным повышение квалификации по этому направлению!Дистанционный курс «Обучающиеся с ОВЗ: Особенности организации учебной деятельности в соответствии с ФГОС» от проекта «Инфоурок» даёт Вам возможность привести свои знания в соответствие с требованиями закона и получить удостоверение о повышении квалификации установленного образца (72 часа).
Подать заявку на курс
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийinfourok.ru
Урок виды химической связи 11 класс
конспект открытого урока химии в 11 классе.Тема «Виды химической связи».
Цель урока: закрепить знания учащихся по видам химической связи.
Задачи урока:
повторить основные виды химической связи, свойства и механизм их образования;
развивать у учащихся умения и навыки в составлении схем образования различных видов химической связи;
воспитывать у учащихся организованность, самостоятельность, коммуникативные качества, умение обобщать знания и применять их на практике.
Тип урока: урок закрепления знаний.
Применяемые технологии: контрольно — корректирующая технология обучения, информационно-коммуникационная технология.
Оборудование: таблица «Виды химической связи», карточки с заданиями для индивидуальной работы (3 уровня), тестовые разноуровневые задания, интерактивная доска, мультимедиа проектор.
Формы учебной деятельности: фронтальная, работа в паре, индивидуальная, работа с учебником и доп. литературой.
Структура урока:
Организационный момент.
Повторение темы «Виды химической связи» (электронная презентация, подготовленная учащимися).
Работа в паре по карточкам.
Индивидуальная работа по выбору учащихся: устный контроль – беседа с учителем или с консультантом, проработка темы по учебнику или дополнительной литературе, выполнение тестовой работы, выполнение самостоятельной работы.
Подведение итогов урока, домашнее задание.
Ход урока.
1.Организационный момент. Постановка цели урока.
2. Повторение основных видов химической связи. Группа учащихся выступает с электронной презентацией «Виды химической связи». Используется медиа — проектор и интерактивная доска.
3. Работа в паре. Каждая пара учащихся получает карточку с заданием, которое выполняют совместно, например:
Карточка №1
1.Определите вид химической связи в веществах и составьте схемы образования связей для этих веществ: MgBr2, h3O, Na, Н2.
2.Определите межмолекулярную химическую связь для вещества (Ch4OH)n, отметьте особенности в свойствах этого вещества, в связи с данным видом химической связи.
4. Индивидуальная работа учащихся по их выбору.
Применение контрольно-корректирующей те
educontest.net
