Таблица растворимости солей, кислот и оснований в воде
Таблица растворимости солей, кислот и оснований – фундамент, без которого невозможно полноценное освоение химических знаний. Растворимость оснований и солей помогает в обучении не только школьникам, но и профессиональным людям. Создание многих продуктов жизнедеятельности не может обойтись без данных знаний.
Таблица растворимости кислот, солей и оснований в воде
Таблица растворимости солей и оснований в воде – это пособие, которое помогает в освоении химических основ. Разобраться с представленной ниже таблицей помогут следующие примечания.
- Р – указывает на растворимое вещество;
- Н – не растворимое вещество;
- М – вещество мало растворяется в водной среде;
- РК – вещество способно растворятся только при воздействии сильных органических кислот;
- Прочерк будет говорить о том, что такого существа не существует в природе;
- НК – не растворяется ни в кислотах , ни в воде;
- ? – вопросительный знак говорит о том, что на сегодняшний день нет точных сведений о растворении вещества.
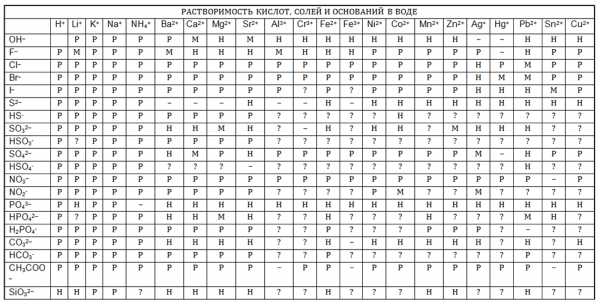 Таблица растворимости солей, кислот и оснований
Таблица растворимости солей, кислот и основанийЗачастую таблицу используют химики и школьники, студенты для проведения лабораторных исследований, в ходе которых необходимо установить условия протекания определённых реакций. По таблице получается обнаружить, как поведёт себя вещество в соляной или кислотной среде, возможно ли появление осадка. Осадок при проведении исследований и опытов говорит о необратимости реакции. Это существенный момент, который может повлиять на ходе всей лабораторной работы.
aquariumax.ru
Таблица растворимости солей, кислот, оснований в воде для ЕГЭ 2019 / Блог :: Бингоскул
- Блог
- →
- Таблица растворимости солей, кислот, оснований в воде для ЕГЭ 2019
Полная таблица растворимости солей, кислот и оснований
- По таблице можно определить, как поведёт себя вещество в соляной или кислотной среде, возможно ли появление осадка.
- Для того, чтобы проверить растворимость химического соединения в воде, составляем его из пересечения столбца и строки, и читаем символ на их пересечении.
- Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
- Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³).
- Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Решай с ответами:
Справочный материал для сдачи ЭГЭ и ОГЭ по химии:
Ряд активности металлов
Таблица Менделеева Д.И.

bingoschool.ru
Таблица растворимости кислот, солей и оснований
См. также материалы по теме: Растворы, Виды растворов, Растворимость.
Для того, чтобы проверить растворимость химического соединения в воде, составляем его из пересечения столбца и строки, и читаем символ на их пересечении.
Обозначения в таблице растворимости:
«пустая клетка» — это и есть вода, она в таблице одна
«-« — соединения не существует (выделено клетками желтого цвета)
«Р» — растворимо (обозначено клетками белого цвета)
«М» — малорастворимо (выделено клетками голубого цвета)
«Н» — нерастворимо (обозначено клетками красного цвета)
Как пользоваться таблицей растворимости солей, кислот и оснований в воде
Пример:
Выясним растворимость Ca(NO₃)2 в воде. Для этого найдем в таблице растворимости столбец Ca²⁺ и опустимся по нему до пересечения со строкой
| РАСТВОРИМОСТЬ КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ В ВОДЕ | |||||||||||||||||||||
| Ионы | H⁺ | Li⁺ | NH₄⁺ | K⁺ | Na⁺ | Ag⁺ | Ba²⁺ | Ca²⁺ | Mg²⁺ | Mn²⁺ | Zn²⁺ | Ni²⁺ | Sn²⁺ | Pb²⁺ | Cu²⁺ | Hg²⁺ | Hg₂²⁺ | Fe²⁺ | Fe³⁺ | Al³⁺ | Cr³⁺ |
| OH¯ | P | P | P | P | — | P | M | M | H | H | H | H | H | H | — | — | H | H | H | H | |
| NO₃¯ | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | — | P | P | P | P |
| F¯ | P | M | P | P | P | P | M | H | M | P | M | P | P | M | P | — | M | M | H | M | M |
| Cl¯ | P | P | P | P | P | P | P | P | P | P | P | P | M | P | P | H | P | P | P | P | |
| Br¯ | P | P | P | P | P | H | P | P | P | P | P | P | P | M | P | M | H | P | P | P | P |
| I¯ | P | P | P | P | P | H | P | P | P | P | P | P | P | H | — | H | H | H | — | P | P |
| S²¯ | P | P | P | P | P | H | — | — | — | H | H | H | H | H | H | H | H | H | H | — | — |
| SO₃²¯ | P | P | P | P | P | M | M | M | M | H | M | H | — | H | — | — | — | M | — | — | — |
| SO₄²¯ | P | P | P | P | P | M | H | M | P | P | P | P | P | H | P | P | M | P | P | P | P |
| CO₃²¯ | P | P | P | P | P | H | H | H | H | H | H | — | — | H | — | — | H | H | — | — | — |
| SiO₃²¯ | H | — | — | P | P | H | H | H | H | H | H | H | — | H | — | — | — | H | — | — | — |
| PO₄³¯ | P | H | P | P | P | H | H | H | H | H | H | H | H | H | H | H | H | H | H | H | |
| CH₃COO¯ | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | M | P | P | P | P |
Почему растворимость указывают таким «странным» способом (растворимо, малорастворимо, нерастворимо)? Дело в том, что на сегодняшний момент пока не существует четкого стандарта на обозначение качественных характеристик растворимости химических соединений. А вот количественные характеристики доступны и измеримы.
Примечание. Растворимость веществ сильно изменяется, в зависимости от температуры, давления, а также от наличия в растворе других веществ. Поэтому следует принять во внимание, что информация в таблице приведена для, так называемых, «нормальных условий»
Растворимость. Розчинність | Описание курса | Валентность. Валентністьprofmeter.com.ua
Кислоти, основания, соли основные свойства
|
Кислоты
H2SO4 — серная (сульфаты) HCl — соляная (хлориды) HNO3 — азотная (нитраты) H3PO4 — фосфорная (Фосфаты) H2SO3 -сернистая (сульфиты) H2S — сероводород (сульфиды) H2CO3 — угольная (карбонаты) H2SiO3 — кремниевая (силикаты) |
Основания NaOH — гидроксид натрия KOH — гидроксид калия Ca(OH)2 — гидроксид кальция Ba(OH)2 — гидроксид бария Mg(OH)2 — гидроксид магния Cu(OH)2 — гидроксид меди (II) Fe(OH)2 — гидроксид железа (II) Fe(OH)3 — гидроксид железа (III) Al(OH)3 — гидроксид алюминия |
Соли CuSO4 — сульфат меди (II) NaCl — хлориднатрия Fe(NO3)3 — нитрат железа (III) Ba3(PO4)3 -фосфат бария MgSO3 — сульфит магния FeS -сульфид железа (II) CaCO3 -карбонат кальция K2SiO3 -силикат калия Al2(SO4)3 -сульфат алюминия |
1. Кислоты реагируют
- с металлами, стоящими в ряду активностм левее водорода с выделением водорода (кроме азотной и концентрированной серной)
- с основными оксидами с образованием соли и воды
- с основаниями с образованием соли и воды
- с солями, образованными более слабыми кислотами с выпадением осадка или выделением газа
2. Азотная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а образуются различные соединения азота (NH4NO3, N2, N2O, NO, NO2) в зависимости от концентрации кислоты и активности металла.
3. Концентрированная серная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а выделяются различные соединения серы (H2S, S, SO2) в зависимости от активности металла.
4. Вытеснительный ряд кислот (по убыванию):
H2SO4 —> HCl и HNO3 —> H
5. Кислоты (кроме нерастворимой в воде кремниевой кислоты) изменяют окраску индикаторов: фиолетовый лакмус в кислотах краснеет, оранжевый метилоранж становится розовым.
6. Щелочи реагируют с кремнием, галогенами, кислотами, кислотными и амфотерными оксидами, амфотерными металлами и растворимыми солями, если выпадает осадок или выделяется газ аммиак.
7. Щелочи при нагревании не разлагаются, изменяют окраску индикаторов: фиолетовый лакмус в щелочах синеет, оранжевый метилоранж становится желтым, бесцветный фенолфталеин становится малиновым.
8. Нерастворимые основания реагируют с кислотами и разлагаются при нагревании на оксид металла и воду.
9. Амфотерные основания реагируют с кислотами, щелочами и разлагаются при нагревании.
10. Соли реагируют
-
со щелочами (если выпадает осадок или выделяется газ аммиак)
-
с кислотами, более сильными, чем та, которой образована соль
-
с другими растворимыми солями (если выпадает осадок)
-
с металлами (более активные вытесняют менее активные)
-
с галогенами (более активные галогены вытесняют менее активные и серу)
11. Нитраты разлагаются с выделением кислорода:
-
если металл стоит до Mg, образуется нитрит + кислород
-
если металл от Mg до Cu, образуется оксид металла + NO2 + O2
-
если металл стоит после Cu, образуется металл + NO2 + O2
-
нитрат аммония разлагается на N2O и H2O
12. Карбонаты щелочных металлов не разлагаются при нагревании
13. Карбонаты металлов II группы разлагаются на оксид металла и углекислый газ
Давайте порассуждаем вместе
1. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Na2CO3 + HCl 1) NaCl + CO2 + H2O Б) Na2CO3 + CO2 + H2O 2) NaHCO3 + HCl В) Na2CO3 + CaCl2 3) NaOH + NaHCO3 4) NaHCO3 5) NaCl + CaCO3
Ответ:
т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CO2 + H2O = NaHCO3
Na2CO3 + CaCl2 = 2NaCl + CaCO3
2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) H2SO4 + MgO 1) MgSO4 + H2O Б) H2SO4 + Mg(OH)2 2) MgSO4 + H2 В) Mg + H2S 3) MgS + H2O 4) MgH2 + S 5) MgS + H2
Ответ:
т.к. H2SO4 + MgO = MgSO4 + H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
Mg + H2S = MgS + H2
3. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Al2O3 + NaOH 1) NaAlO2 + H2O Б) Al2O3 + HCl 2) NaH2AlO3 В) Na2SO3 + CaCl2 3) AlCl3 + H2O 4) AlCl3 + H2 5) NaCl + CaSO3
Ответ:
т.к. Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Na2SO3 + CaCl2 = 2NaCl + CaSO3
dx-dy.ru
Таблица растворимости
Таблица растворимостиТаблица растворимости кислот, оснований и солей в воде
Назад в справочник
Ион |
H+ |
Li+ |
K+ |
Na+ |
NH4+ |
Mg2+ |
Ca2+ |
Ba2+ |
Sr2+ |
Al3+ |
Cr3+ |
Fe2+ |
Fe3+ |
Zn2+ |
Ag+ |
Pb2+ |
Cu2+ |
Hg+ |
Hg2+ |
Mn2+ |
Sn2+ |
Ni2+ |
Со2+ |
|
OH– |
|
Р |
Р |
Р |
Р |
Н |
М |
Р |
М |
Н |
Н |
Н |
Н |
Н |
– |
М |
Н |
– |
– |
Н |
Н |
М |
Н |
|
F– |
Р |
М |
Р |
Р |
Р |
М |
Н |
М |
М |
М |
Р |
М |
М |
Р |
Р |
М |
Р |
Г |
Г |
Р |
Р |
Р |
Р |
|
Cl– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Н |
М |
Р |
Н |
Р |
Р |
Г |
Р |
Р |
|
Br– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
М |
Р |
Н |
М |
Р |
Г |
Р |
Р |
|
I– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
– |
Р |
Н |
М |
– |
Н |
М |
Р |
М |
Р |
Р |
|
S2– |
Р |
Р |
Р |
Р |
Р |
Г |
Г |
Р |
Н |
Г |
Г |
Н |
Г |
Н |
Н |
Н |
Н |
– |
Н |
М |
Н |
Н |
М |
|
SO32– |
Р |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
– |
– |
Г |
– |
Н |
Н |
Н |
– |
– |
Н |
Н |
– |
Н |
Н |
|
SO42– |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Н |
М |
Р |
Р |
Р |
Р |
Р |
М |
М |
Р |
М |
Г |
Р |
Г |
Р |
Р |
|
PO43– |
Р |
М |
Р |
Р |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
Н |
Н |
Н |
Н |
Н |
Н |
|
CO32– |
Р |
Р |
Р |
Р |
Р |
М |
Н |
Н |
М |
– |
– |
Н |
– |
Н |
М |
Н |
Г |
Н |
– |
Н |
– |
Н |
Н |
|
SiO32– |
Н |
Н |
Р |
Р |
– |
Г |
Н |
Н |
Н |
Г |
Г |
Г |
Г |
Г |
– |
Г |
Г |
– |
– |
Г |
Г |
Г |
Г |
|
NO3– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Г |
Р |
Р |
Р |
Р |
Р |
|
AcO– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Г |
Р |
Р |
Г |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
|
CrO42– |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Н |
М |
Г |
Г |
Г |
Г |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Г |
Н |
Н |
|
ClO4– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Условные обозначения: АсО– – ацетат-ион СН3СОО–; Р – вещество растворимо (>1 г в 100 г воды), М – вещество малорастворимо (0,001–1 г в 100 г воды),
Н – вещество нерастворимо (<0,001 г в 100 г воды), Г – вещество подвергается сильному гидролизу, – – вещество не получено
Назад в справочник
www.sev-chem.narod.ru
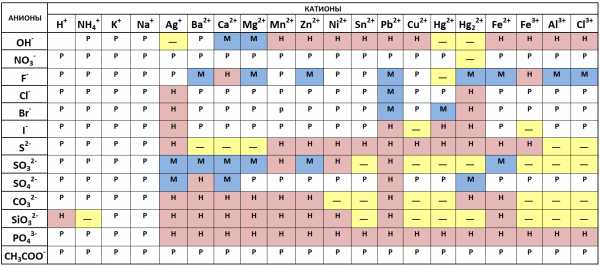
Таблица растворимости солей, кислот и оснований в воде
Растворимость – это способность одного вещества взаимодействовать с другими веществами, образуя при этом однородные растворы.
На сегодняшний день существует таблица способная помочь в определении растворимости химического соединения.
Чтобы пользоваться таблицей не обязательно иметь специальных навыков. Для определения растворимости какого-либо химического вещества, достаточно в таблице провести перпендикуляр от выбранного вещества начиная от крайней левой колонки до химического вещества в верхней колонке. Точка пересечения и укажет нам насколько растворимы выбранные вещества.
Рассмотрим на примере, как пользоваться таблицей растворимости солей, кислот и оснований:
В левой колонке выберем вещество Ba2+, проводим линию до 3-й колонки с веществом F—, на пересечении видим символы «РК». Это означает, что соединение нерастворимо в воде и растворяется только в сильных неорганических кислотах.
Таблица условных обозначений
| Р | растворимо в воде (больше 1 грамма вещества на 100 грамм воды) |
| М | малорастворимо в воде (от 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| Н | нерастворимо в воде, но хорошо растворимо в слабых кислотах (меньше 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| РК | нерастворимо в воде, но растворимо в сильных неорганических кислотах |
| НК | химическое вещество не растворимо ни в воде, ни в любых кислотах |
| Г | химическое вещество подвергается гидролизу |
| — | данные о растворимости химического вещества отсутствуют |
Таблица растворимости солей, кислот и оснований по химии
| Катионы | Анионы | |||||||||||
| OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- | ||
| H+ | Р | Р | Р | Р | Р | М | Р | — | Н | Р | Р | |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК | |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК | |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК | |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК | |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н | |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н | |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК | |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК | |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н | |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н | |
| Fe3+ | Н | Р | Р | Р | — | — | Р | Г | Н | Р | РК | |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н | |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н | |
| Cu2+ | Н | М | Р | Р | — | Н | Р | Н | Н | Р | Н | |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н | |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н | |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н | |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н | |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н | |
scibio.ru
Растворимость солей, кислот и оснований в воде при комнатной температуре (Таблица)
Справочная таблица растворимости солей, кислот и оснований в воде при комнатной температуре содержит справочный материал, необходимый для решения задач по общей и неорганической химии. Предназначено для школьников и студентов.
Смотрите также таблицу «растворимость веществ в воде при различной температуре»
|
КАТИОНЫ |
АНИОНЫ |
|||||||||||
|
Br− |
CH3COO− |
CN− |
CO32− |
Cl− |
F− |
I− |
NO3− |
OH− |
PO43− |
S2− |
SO42− |
|
|
Ag+ |
н |
м |
н |
н |
н |
р |
н |
р |
− |
н |
н |
м |
|
Al3+ |
р |
+ |
? |
− |
р |
м |
р |
р |
н |
н |
+ |
р |
|
Ba2+ |
р |
р |
р |
н |
р |
м |
р |
р |
р |
н |
р |
н |
|
Be2+ |
р |
+ |
? |
+ |
р |
р |
р |
р |
н |
н |
+ |
р |
|
Ca2+ |
р |
р |
р |
н |
р |
н |
р |
р |
м |
н |
м |
м |
|
Cd2+ |
р |
р |
м |
+ |
р |
р |
р |
р |
н |
н |
н |
р |
|
Co2+ |
р |
р |
н |
+ |
р |
р |
р |
р |
н |
н |
н |
р |
|
Cr3+ |
р |
+ |
н |
− |
р |
м |
н |
р |
н |
н |
+ |
р |
|
Cs+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
|
Cu2+ |
р |
р |
н |
+ |
р |
р |
− |
р |
н |
н |
н |
р |
|
Fe2+ |
р |
р |
н |
+ |
р |
м |
р |
р |
н |
н |
н |
р |
|
Fe3+ |
р |
− |
− |
− |
р |
н |
− |
р |
н |
н |
− |
р |
|
Hg2+ |
м |
р |
р |
− |
р |
+ |
н |
+ |
− |
н |
н |
+ |
|
Hg22+ |
н |
м |
− |
н |
н |
м |
н |
+ |
− |
н |
− |
н |
|
K+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
|
Li+ |
р |
р |
р |
р |
р |
н |
р |
р |
р |
м |
р |
р |
|
Mg2+ |
р |
р |
р |
м |
р |
н |
р |
р |
н |
н |
н |
р |
|
Mn2+ |
р |
р |
н |
+ |
р |
р |
р |
р |
н |
н |
н |
р |
|
NH4+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
− |
+ |
р |
|
Na+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
|
Ni2+ |
р |
р |
н |
+ |
р |
р |
р |
р |
н |
н |
н |
р |
|
Pb2+ |
м |
р |
н |
+ |
м |
м |
м |
р |
н |
н |
н |
н |
|
Rb+ |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
|
Sn2+ |
+ |
+ |
− |
− |
+ |
р |
м |
+ |
н |
н |
н |
р |
|
Sr2+ |
р |
р |
р |
н |
р |
н |
р |
р |
м |
н |
р |
н |
|
Tl+ |
м |
р |
р |
р |
м |
р |
н |
р |
р |
м |
н |
м |
|
Zn2+ |
р |
р |
н |
+ |
р |
м |
р |
р |
н |
н |
н |
p |
Обозначения:
р — хорошо растворимый, м — малорастворимый, н — практически нерастворимый, + — полностью реагирует с водой или не осаждается из водного раствора, − — не существует, ? — данные о растворимости отсутствуют.
infotables.ru
