Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
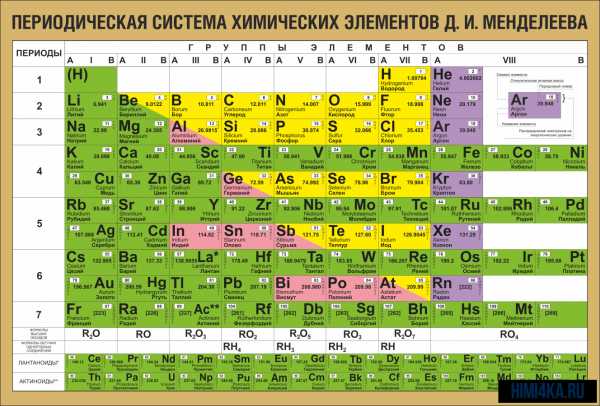 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
himi4ka.ru
Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
1) несолеобразующие
2) основные
3) кислотные
4) амфотерные
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
|
Оксид неметалла |
Оксид металла |
|
1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам |
1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
|
2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 |
2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов |
|
3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
scienceforyou.ru
|
пе ри од ы |
Р Я Д Ы |
группы химических элементов |
|||||||||||||||||||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||||||
| I | 1 |
|
|
||||||||||||||||||||||||||||||
| II |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
| III | 3 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
| IV | 4 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
| IV | 5 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
| V | 6 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
| V | 7 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
| VI | 8 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
| VI | 9 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
| VII | 10 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
| VII | 11 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
| 8 | 12 |
|
|
||||||||||||||||||||||||||||||
|
высшие оксиды |
R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 |
|||||||||||||||||||||||||
|
летучие водоро дные соедине ния |
RH4 | RH3 |
H2R |
RH |
|||||||||||||||||||||||||||||
infotables.ru
Таблица Менделеева, химические элементы
Таблица Менделеева — общепринятое графическое выражение Периодического закона, открытого Д.И. Менделеевым в 1869 г. Первоначальный вариант таблицы был разработан Менделеевым в 1869—1871 годах. За время существования было предложено более сотни вариантов её изображения, однако наиболее общепринятый вариант представляет собой двумерную таблицу в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Мы постарались описать основные химические элементы Таблицы Менделеева, для подробной информации о них переходите по соответствующей ссылке в таблице. Обращаем ваше внимание, что целью нашего сайта Занимательная химия не является описание химических элементов с научной точки зрения, мы больше сконцентрировались на интересных фактах, которые будут интересны даже детям, не углубляясь в непонятные термины и цифры. Однако, для каждого элемента приводится краткое описание химических свойств в простой и доступной форме.
| ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| 1 H водород |
2 He гелий |
||||||||
| 3 Li литий |
4 Be бериллий |
5 B бор |
6 С углерод |
7 N азот |
8 O кислород |
9 F фтор |
10 Ne неон |
||
| 11 Na натрий |
12 Mg магний |
13 Al алюминий |
14 Si кремний |
15 P фосфор |
16 S сера |
17 Cl хлор |
18 Ar аргон |
||
| 19 K калий |
20 Ca кальций |
21 Sc скандий |
22 Ti титан |
23 V ванадий |
24 Cr хром |
25 Mn марганец |
26 Fe железо |
27 Co кобальт |
28 Ni никель |
| 29 Cu медь |
30 Zn цинк |
31 Ga галлий |
32 Ge германий |
33 As мышьяк |
34 Se селен |
35 Br бром |
36 Kr криптон |
||
| 37 Rb рубидий |
38 Sr стронций |
39 Y иттрий |
40 Zr цирконий |
41 Nb ниобий |
42 Mo молибден |
43 Tc технеций |
44 Ru рутений |
45 Rh родий |
46 Pd палладий |
| 47 Ag серебро |
48 Cd кадмий |
49 In индий |
50 Sn олово |
51 Sb сурьма |
52 Te теллур |
53 I иод |
54 Xe ксенон |
||
| 55 Cs цезий |
56 Ba барий |
57 La лантан × |
72 Hf гафний |
73 Ta тантал |
74 W вольфрам |
75 Re рений |
76 Os осмий |
77 Ir иридий |
78 Pt платина |
| 79 Au золото |
80 Hg ртуть |
81 Tl таллий |
82 Pb свинец |
83 Bi висмут |
84 Po полоний |
85 At астат |
86 Rn радон |
||
| 87 Fr франций |
88 Ra радий |
89 Ac актиний ×× |
104 Rf резерфордий |
105 Db дубний |
106 Sg сиборгий |
107 Bh борий |
108 Hs хассий |
109 Mt мейтнерий |
110 Ds дармштадтий |
| 111 Rg рентгений |
112 Сn коперниций |
113 Nh нихоний |
114 Fl флеровий |
115 Mc московий |
116 Lv ливерморий |
117 Tn теннесин |
118 Og оганессон |
||
| 57 La лантан |
58 Ce церий |
59 Pr празеодим |
60 Nd неодим |
61 Pm прометий |
62 Sm самарий |
63 Eu европий |
64 Gd гадолиний |
65 Tb тербий |
66 Dy диспрозий |
67 Ho гольмий |
68 Er эрбий |
69 Tm тулий |
70 Yb иттербий |
71 Lu лютеций |
| 89 Ac актиний |
90 Th торий |
91 Pa протактиний |
92 U уран |
93 Np нептуний |
94 Pu плутоний |
95 Am америций |
96 Cm кюрий |
97 Bk берклий |
98 Cf калифорний |
99 Es эйнштейний |
100 Fm фермий |
101 Md менделевий |
102 No нобелий |
103 Lr лоуренсий |
Таблица Менделеева и её значение
Открытие Периодического закона стало важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях была создана стройная таблица Менделеева, на основе которой стало возможным обобщать, делать выводы и предвидеть открытие новых химических элементов.

Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Таблица Менделеева в хорошем качестве
Предлагаем вам скачать несколько вариантов таблицы Менделеева в хорошем качестве, которые можно распечатать на принтере большого формата, как в черно-белом так и в цветном вариантах.
www.alto-lab.ru
Как определить тип оксида? | CHEM-MIND.com
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
www.chem-mind.com
| ||||||||||||||||||||||
|
||||||||||||||||||||||
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
RO4 |
|||||||||||||||
Rh5 |
Rh4 |
h3R |
HR |
|||||||||||||||||||
Лантаноиды |
||||||||||||||||||||||
Актиноиды |
||||||||||||||||||||||
| ||||||||||||||||||||||
himik.pro
таблица Менделеева и алгоритм действий :: SYL.ru
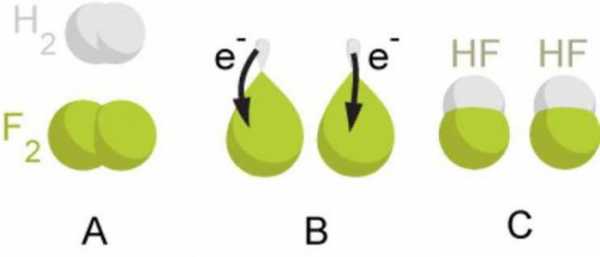
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.

Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Формула данного соединения имеет вид H2SO4. У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
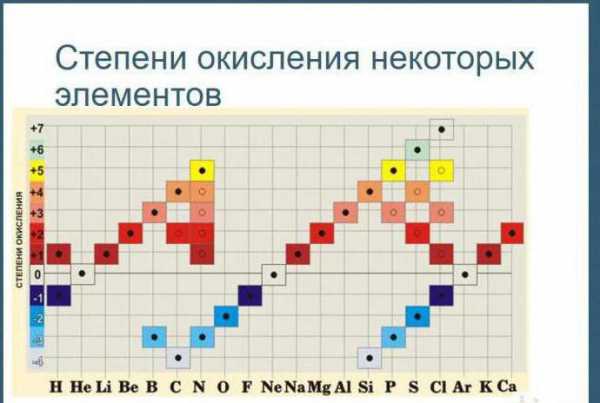
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
www.syl.ru
