Ответы@Mail.Ru: Свойства и состав метана?
Метан — простейший углеводород, бесцветный газ без запаха. Его химическая формула — Ch5. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа» . Основной компонент природных (77—99%), попутных нефтяных (31—90%), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ) .На 90–95% метан имеет биологическое происхождение. Травоядные копытные животные, такие как коровы и козы, испускают пятую часть годового выброса метана: его вырабатывают бактерии в их желудках. Другими важными источниками служат термиты, рис-сырец, болота, фильтрация естественного газа (это продукт прошлой жизни) и фотосинтез растений. Вулканы вносят в общий баланс метана на Земле менее 0,2%, но источником и этого газа могут быть организмы прошлых эпох. Промышленные выбросы метана незначительны. Таким образом, обнаружение метана на планете типа Земли указывает на наличие там жизни.
Метан образуется при термической переработке нефти и нефтепродуктов (10—57% по объёму) , коксовании и гидрировании каменного угля (24—34%). Лабораторные способы получения: сплавление ацетата натрия со щелочью, действие воды на метилмагнийиодид или на карбид алюминия.
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и калия) или безводного гидроксида натрия с уксусной кислотой. Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Свойства метана
Метан горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1м3. С воздухом образует взрывоопасные смеси. Особую опасность представляет метан, выделяющийся при подземной разработке месторождений полезных ископаемых в горные выработки, а также на угольных обогатительных и брикетных фабриках, на сортировочных установках. Так, при содержании в воздухе до 5–6% метан горит около источника тепла (температура воспламенения 650—750 °С) , от 5–6% до 14–16% взрывается, свыше 16% может гореть при притоке кислорода извне. Снижение при этом концентрации метана может привести к взрыву. Кроме того, значительное увеличение концентрации метана в воздухе бывает причиной удушья (например, концентрации метана 43% соответствует 12% O2).
Взрывное горение распространяется со скоростью 500—700 м/сек; давление газа при взрыве в замкнутом объёме равно 1 Мн/м2. После контакта с источником тепла воспламенение метана происходит с некоторым запаздыванием. На этом свойстве основано создание предохранительных взрывчатых веществ и взрывобезопасного электрооборудования. На объектах, опасных из-за присутствия метана (главным образом, угольные шахты) , вводится т. н. газовый режим.
При 150-200 °С и давлении 30-90 атм метан окисляется до муравьиной кислоты.
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
подробно
otvet.mail.ru
Плотность метана. Свойства газов метанового ряда Cnh3n+2
В таблице указана плотность метана при различных температурах, включая плотность этого газа при нормальных условиях (при 0°С). Также приведены его теплофизические свойства и характеристики других газов метанового ряда.
Представлены следующие теплофизические свойства газов метанового ряда: коэффициент теплопроводности λ, динамическая вязкость η, число Прандтля Pr, кинематическая вязкость ν, массовая удельная теплоемкость Cp, отношение теплоемкостей (показатель адиабаты) k, коэффициент температуропроводности a и плотность газов метанового ряда ρ. Свойства газов даны при нормальном атмосферном давлении в зависимости от температуры — в интервале от 0 до 600°С.
К газам метанового ряда относятся углеводороды с брутто-формулой CnH2n+2
Плотность газов метанового ряда при увеличении их температуры снижается из-за теплового расширения газа. Такой характер зависимости плотности от температуры свойственен и многим другим газам. Следует также отметить, что плотность газов метанового ряда растет по мере увеличения количества атомов углерода и водорода в молекуле газа (числа n в формуле CnH2n+2).
Наиболее легким газом из рассмотренных в таблице является метан — плотность метана при нормальных условиях равна 0,7168 кг/м3. Метан при нагревании расширяется и становиться менее плотным. Так, например при температуре 0°С и 600°С, плотность метана отличается приблизительно в 3 раза.
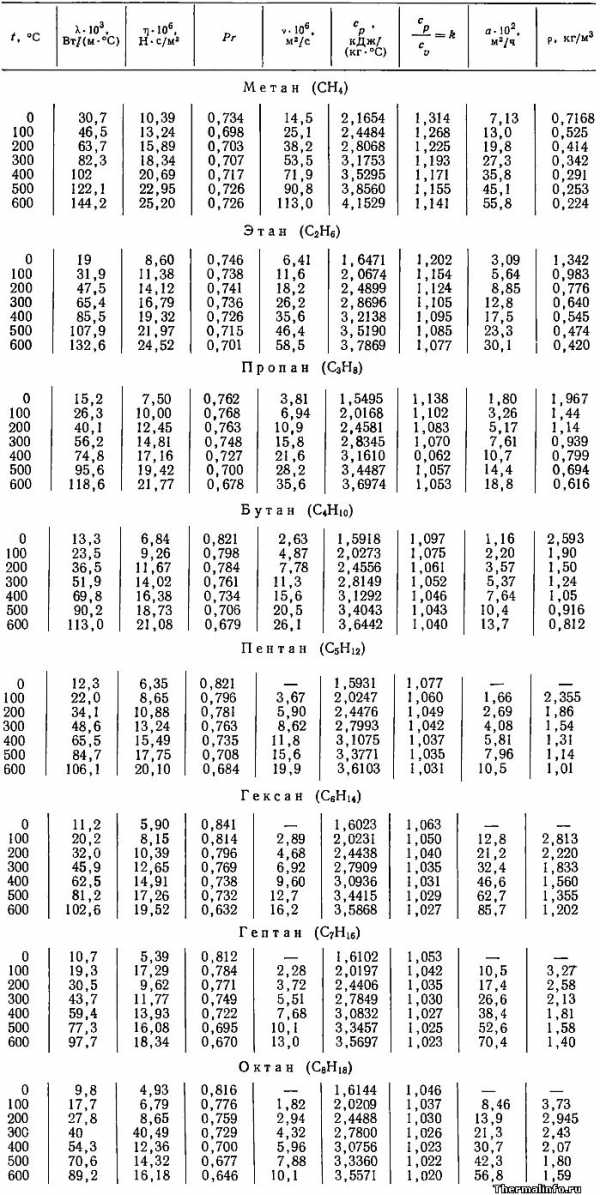
Теплопроводность газов метанового ряда снижается при увеличении числа n в формуле CnH2n+2. При нормальных условиях она изменяется в диапазоне от 0,0098 до 0,0307 Вт/(м·град). По данным в таблице следует, что наибольшей теплопроводностью обладает такой газ, как метан — его коэффициент теплопроводности, например при 0°С, равен 0,0307 Вт/(м·град).
Наименьшая теплопроводность (0,0098 Вт/(м·град) при 0°С) свойственна газу октану. Следует отметить, что при нагревании газов метанового ряда их теплопроводность увеличивается.
Удельная массовая теплоемкость газов, входящих в гомологический ряд метана при нагревании увеличивается. Также увеличивают свои значения такие их свойства, как вязкость и температуропроводность.
Источник:
Промышленные печи. Справочное руководство для расчетов и проектирования. 2–е издание, дополненное и переработанное, Казанцев Е.И. М., «Металлургия», 1975.- 368 с.
thermalinfo.ru
Химические свойства метана (Ch5) — КиберПедия
1. Взаимодействие с галогенами – реакция замещения.
2. Горение.
Ch5 + 2O2 à CO2 + h3O + Q
2C2H6 + O2 à 4CO2 + 6h3O + Q
3. Разложение.
4. Изомеризация.
Вопрос №23
Циклопарафины. Циклоалканы.
Циклоалканы (циклопарафины) – это насыщенные углеводороды, содержащие цикл из 3, 4, 5, 6 и более атомов углерода.
Физические свойства
Циклопропан и циклобутан при нормальных условиях – газы, а циклопентан и циклогексан – жидкости. Циклопарафины в воде практически не растворяются.
Применение
Из циклопарафинов практическое значение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды – в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и так далее. Циклопропан применяется для наркоза.
Вопрос №24
Непредельные углеводороды
Этиленовые углеводороды (Алкены)
Алкены – это нециклические УВ, в молекулах, которых два атома углерода находятся в состоянии sp2-гиридизации и связаны друг с другом двойной связью.
Строение молекулы этилена
C2h5
SP2-гибридизация, валентный угол = 120
l = 0,134 нм (длина связи)
В молекулах этилена между атомами углерода двойная связь π и σ. σ-связь образуется гибридными облаками. σ-связь образована p-электронами (непрочная связь).
Химические свойства
I. Реакции присоединения
1) Гидрирование
2) Присоединение галогенов
Ch3 = Ch3 + Br2 à Ch3Br – Ch3Br
1,2 дибромэтан
3) —————————-
Ch3 = Ch3 + HCl à Ch4 – Ch3Cl
4) Гидратация
Ch3 = Ch3 + HOH à Ch4 – Ch3OH
этилен этиловый спирт
II. Реакции окисления
1) Горение
C2h5 + 3O2 à 2CO2 = 2h3O
2) Окисление KMnO4 – обесцвечивание розового раствора
Ch3 = Ch3 + O + HOH à Ch3OH – Ch3OH
этиленгликоль
3) Частичное окисление
III. Полимеризация
Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счёт разрыва кратных связей, с образованием высокомолекулярного соединения полимера.
Вопрос №25
Диеновые углеводороды (Алкадиены)Диеновые УВ (алкадиены) – это УВ, в молекулах которых между атомами углерода имеются две двойные связи.
Ch3 = CH – CH = Ch3 1,3 бутадиен
2-метил-1,3 бутадиен или изопрен
Физические свойства
1,3 бутадиен – газ
2-метил-1,3 бутадиен или изопрен – жидкость
Химические свойства
Реакция присоединения галогенов
Ch3 = CH – CH = Ch3 + 2Br2 à Ch3Br – CHBr – CHBr – Ch3Br
1,2,3,4-тетрабромбутан
Получение
1. Из этиленового спирта
2h4C – Ch3OH à h3C = CH – CH = Ch3 + 2h3O + h3 (Реакция проходит при t = 425 С и в присутствии Al2O3 и ZnO)
2. Из бутана, предельных углеводородов
Ch4 = Ch3 – Ch3 = Ch4 à Ch3 = Ch3 – Ch3 = Ch3 +h3 (Реакция проходит при t = 560 – 620 С и в присутствии Al2O3 и Cr2O3)
Применение
Диены применяются в производстве каучуков.
Природный каучук
Каучуки – природные или синтетические продукты полимеризации некоторых диеновых углеводородов с сопряженными связями.
Его получают из млечного сока дерева гевея.
(C5H8)n – природный изопреновый каучук. В основе природного каучука находится изопрен. Каучук – это природный полимер. Макромолекулы натурального каучука состоят из остатков молекул изопрена. Полимеризацию изопрена можно отобразить следующим образом:
Природный каучук – стереорегулярное строение (цисизомерия).
Физические свойства:
1. Эластичность
2. Водогазонепроницаемость
3. Диэлектрик
4. Высокая износоустойчивость
5. Неустойчив к действию высоких и низких t
Химические свойства
Вулканизация каучука
При нагревании каучука с серой происходит образование дисульфидных связей
между макромолекулами каучука по месту разрыва некоторых двойных связей, при этом образуется резина («сшивание» линейных молекул).Чем больше серы, тем больше образуется дисульфидных связей. В результате этого процесса, который называется вулканизацией каучука, образуются мягкие или твёрдые резины.
Применение каучуков
Шины, обувь, ткани, ленты, ремни, трубки, строительные материалы, электротехника.
Вопрос №26
cyberpedia.su
Метан Википедия
| Метан | |
|---|---|
| Общие | |
| Хим. формула | CH₄ |
| Рац. формула | CH4 |
| Физические свойства | |
| Молярная масса | 16,04 г/моль |
| Плотность |
газ (0 °C) 0,7168 кг/м³; 0,6682 кг/м³ в стандартных условиях по ГОСТ 2939—63; жидкость (−164,6 °C) 415 кг/м³[1] |
| Термические свойства | |
| Т. плав. | -182,49 °C |
| Т. кип. | -161,58 °C |
| Т. свспл. | 537,8 °C |
| Пр. взрв. | 4,4-17,0 % |
| Химические свойства | |
| Растворимость в воде | 0,02 г/кг[2] |
| Классификация | |
| Рег. номер CAS | 74-82-8 |
| PubChem | 297 |
| Рег. номер EINECS | 200-812-7 |
| SMILES | |
| InChI | |
| RTECS | PA1490000 |
| ChEBI | 16183 |
| Номер ООН | 1971 |
| ChemSpider | 291 |
| Безопасность | |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Мета́н (лат. Methanum) — простейший по составу предельный углеводород, бесцветный газ (в нормальных
ru-wiki.ru
Метан — Википедия
Материал из Википедии — свободной энциклопедии
| Метан | |
| Общие | |
|---|---|
| Хим. формула |
CH₄ |
| Рац. формула |
CH4 |
| Физические свойства | |
| Молярная масса |
16,04 г/моль |
| Плотность |
газ (0 °C) 0,7168 кг/м³; 0,6682 кг/м³ в стандартных условиях по ГОСТ 2939—63; |
| Термические свойства | |
| Т. плав. |
-182,49 °C |
| Т. кип. |
-161,58 °C |
| Т. свспл. |
537,8 °C |
| Пр. взрв. |
4,4-17,0 % |
| Химические свойства | |
| Растворимость в воде |
0,02 г/кг[2] |
| Классификация | |
| Рег. номер CAS |
74-82-8 |
| PubChem |
297 |
|
200-812-7 |
|
| SMILES | |
| InChI | |
| RTECS |
PA1490000 |
| ChEBI |
16183 |
| Номер ООН |
1971 |
| ChemSpider |
291 |
| Безопасность | |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[3], химическая формула — CH4[4]. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[5]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[6].
Накапливаясь в закрытом помещении, метан становится взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики, и во многих случаях метан для лабораторий и промышленных производств поставляется без добавления одорантов.
Взрывоопасен при концентр
encyclopaedia.bid
Алканы ряда метана, их общая формула и химическое строение гомологов
Метан, химические свойства (горение, реакция замещения) и применение.
Алканы (предельные, насыщенные) – это нециклические углеводороды, в молекулах, которых атомы углерода связаны друг с другом только простыми (σ-связями). Алканы имеют общую формулу CnH2n+2, не присоединяют водород и другие элементы.
Природные источники алканов – нефть, природный газ.
Гомологический ряд алканов :
СН4 метан С6Н14 гексан
С2Н6 этан С7Н16 гептан
С3Н8 пропан С8Н18 октан
С4Н10 бутан С9Н20 нонан
С5Н12 пентан С10Н22 декан
Гомологами называются вещества сходные по свойствам, но различающиеся по строению молекул на одну или несколько групп — CH2-.
Изомерия алканов .
Изомеры – вещества, имеющие одинаковый состав молекул, но различное химическое строение. Например, существуют три изомера пентана С5Н12 :
CH3-CH2-CH2-CH2-CH3 н-пентан
CH3-CH-CH2-CH3 СН3
СН3 CH3-C-CH3
СН3
2-метилбутан 2,2-диметилпропан
Химические свойства .
1. Реакции замещения (галогенирование – идёт на свету)
СН4+Cl2 → CH3Cl+HCl
хлорметан
СН3Cl+Cl2 → CH2Cl2+HCl
дихлорметан
СН2Cl2+Cl2 → CHCl3+HCl
трихлорметан
СН3Cl+Cl2 → CCl4+HCl
тетрахлорметан
2. Горение
CH4 + 2O2 → CO2 +2H2O + Q
2C2H6 + 7O2 → 4CO2 + 6H2O + Q
3. Разложение.
СН4→ С+2Н2 (получение сажи и водорода)
2СН4→ С2Н2+3Н2 (получение ацетилена)
4. Изомеризация.
СН3-СН2-СН2-СН3 → СН3-СН-СН3
СН3
Применение алканов
Газообразные алканы используются в качестве ценного топлива. Алканы являются важным сырьём для получения разнообразных органических соединений – пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
biofile.ru
Метан — Экобаланс
Метан: происхождение и химические характеристики
Метан – это газ, имеющий органическую природу, лишенный запаха и цвета. CH4 – такова его химическая формула, а масса вещества меньше, чем масса воздуха. Растворение в воде протекает медленно. Говоря об органической природе метана, имеется в виду, что почти 95% случаев его появления носят естественную природу. К примеру, он выделяется при разложении остатков растений. Поэтому неудивительно, что многие его характеристики были изучены еще до Новой Эры, когда люди наблюдали пузырьки воздуха на поверхности стоячих водоемов. Данные пузырьки были именно метаном, выделяющимся в процессе гниения растений на дне болота.
Среди прочих естественных источников газа можно выделить:
- Домашний скот. Бактерии, живущие в их желудках, выделяют метан в процессе жизнедеятельности, причем его доля приходится на 20% всего атмосферного газа.
- Растения. Метан – неотъемлемое вещество, выделяющееся в процессе фотосинтеза.
- Насекомые. Наиболее активно выделяют метан термиты.
- Шахты. Под земной поверхностью постоянно происходит медленное разложение каменного угля, в процессе чего образуется метан.
- Нефтяные скважины. В нефти содержание этого газа просто огромно.
- Вулканы. Вероятно, там метан также образуется из-за того, что активно разлагаются доисторические органические материи.
- Океан. Глубоко под водой находятся трещины, через которые может сочиться метан.
- Горение лесных массивов.
- Промышленность. Несмотря на кажущуюся активность этих предприятий, их доля выбросов в общей массе мизерна.
Все перечисленные примеры наглядно подтверждают тот факт, что метан постоянно был в атмосфере, его появление не связано с началом активной деятельности человека. Именно поэтому присутствие метана на планете – это признак того, что на ней может быть жизнь или она была там когда-то.
Тем не менее, «натуральность» данного газа не говорит о том, что он не несет нам никакого вреда. Его пары, особенно при повышенной концентрации, вполне способны привести к смерти человека. На первых этапах развития горнодобывающей промышленности часто фиксировались взрывы или сильнейшие отравления шахтеров метаном. Если следить за информацией в СМИ, то эти события имеют место и в современном мире. Чтобы свести к минимуму вероятность метанового отравления, необходимо при первых его признаках оформить заказ на профессиональный анализ воздуха в помещении, при помощи которого удастся точно определить концентрацию.
Метан в современном мире
Газ широко используется в современном мире:
- Двигатели внутреннего сгорания достаточно часто функционируют на метане.
- Газ дает возможность производить многие медикаменты, среди которых антисептики и снотворные препараты.
- Метан – это основа формальдегида и метанола, при помощи которых делаются удобрения и многие иные вещества.
- Без метана невозможно сделать огнетушители и растворители.
- Синильная кислота – не просто яд, она находит и широкое практическое применение, а процесс ее производства основан на окислении метановой и аммиачной смеси.
Метан и его опасность для человеческого организма
Опасность метана кроется в следующих факторах:
- Взрывоопасность. Именно это свойство дало ему название «гремучего газа». Скопление метана, мельчайшая искорка – все это способно привести к разрушительному взрыву. Именно поэтому в местах, где фиксируются скопления или выбросы этого газа, нельзя курить, использовать открытые источники пламени. Но порой даже этих мер безопасности не хватает, газ продолжает забирать человеческие жизни.
- Нами уже было упомянуто свойство, согласно которому метан может накапливаться в шахтах. В основном его можно найти в пустотах между крупными пластами пород, а также пустотах, созданных шахтерами в процессе добычи. Чем активнее добыча – тем интенсивнее выбросы метана, а потому именно работник шахт чаще всего гибнут от этого газа.
- Взрывы – это еще не вся опасность, метан может вызывать и сильнейшие отравления. Вдыхание больших его объемов приводит к недостатку кислорода в крови, «звону» в ушах, ощущению «чугунной» головы. Повышение концентрации заставляет сердце биться чаще, человек чувствует общую слабость, страдает от тошноты, кожные покровы могут покраснеть. Самые серьезные последствия – это обмороки, бледность, конвульсии и даже летальные исходы.
- К сожалению, в чистом виде метан не пахнет, а потому обнаружить его трудно. «Метановый» аромат, который мы можем чувствовать, — это заслуга специальных отдушек, делающих его применение более безопасным и контролируемым.
- В шахтах, конечно, никакие отдушки к метану не добавляются. Еще с древних времен люди пользуются специальными способами, позволяющими зафиксировать его присутствие в воздухе. Первые шахтеры, к примеру, брали с собой канарейку. Если птичка переставала петь или даже умирала, то необходимо срочно удалиться из забоя.
- В 50-х годах минувшего века начали пользоваться особыми приборами, позволяющими точно установить процент метана в воздушной смеси. Тем не менее, опытные работники говорили, что канарейка – способ даже лучший, чем новомодные приборы. Конечно, современные устройства более чувствительны и компактны, порой они монтируются непосредственно в каски шахтеров, как и лампы. В шахтах обязательно установлены и стационарные датчики, постоянно передающие сведения специалистам. Опасные повышения заставляют немедленно отключать электричество и эвакуировать персонал. Сейчас также используются и специальные установки, способные локализовать детонации угольной пыли на самых ранних этапах. Перед тем, как начинается рабочая смена, количество метана в шахте снижается до предельно безопасных отметок.
Получается, что опасность метана для человека исходит сразу с двух сторон. Склонность к детонациям, отравляющий эффект, отсутствие запаха и цвета – все это делает «гремучий газ» невероятно опасным. Чтобы не столкнуться с его самыми худшими сторонами, стоит заранее заказать экологическую экспертизу, способную установить уровень метановой концентрации в воздухе.
Оцените статью:
[Всего голосов: 0 Средний: 0/5]ekobalans.ru
