24. Скорость гомогенной реакции. Средняя и истинная скорость реакции. Закон действия масс. Константа скорости реакции. Понятие о молекулярности и порядке реакции.
скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за еденицу времени. Скорость простой гомогенной реакции при постоянном объеме подчиняется действующих масс закону.
В химической кинетике различают среднюю и истинную (или
мгновенную) скорость реакции. Средняя скорость равняется отношению
изменения количества вещества в единице объёма, т. е. изменения
концентрации, к промежутку времени, в течение которого оно произошло:
Δn 1 Δn ΔC
υ=± ⋅ ; = ΔC; υ = ±
V Δτ V Δτ . (1)
Истинная скорость реакции в данный момент выражается изменением
концентрации, отнесенным к бесконечно малому промежутку времени, т.е.
производной концентрации по времени:
dC
υ=±
dτ . (2)
Закон действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
для реакции А+В2 АВ2 V=k[A][B2]
k — Константа скорости реакции, которая зависит от природы реагирующих веществ.
Молекулярность реакции, число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты.
Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции.
25. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Понятие об активных частицах и энергии активации. Уравнение Аррениуса.
Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант — Гоффа :
активные частицы – молекулы которые обладают энергией, что бы разорвать или ослабить связи в исходных частицах, и тем самым создать новые молекулы.
энергия активации – некоторая избыточная энергия, которой должны обладать молекулы для того что бы их столкновение привело к образованию нового вещества.Уравне́ние Арре́ниуса
k=ZPe ^ (-Ea/RT)
Z-чисто столкновений молекул. e=2,718…, P-стерический множитель
26. Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Особенность гетерогенных равновесий. Смешение истинного химического равновесия. Принцип Ле Шателье и примеры его применения.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:3H2 + N2 ⇌ 2NH3.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложениевзрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓ NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. k=ZPe ^ (-Ea/RT)
Выражение const гетерогенного равновесия отсутствуют активные массы, конденсированные (жидких, твёрдых) физ. постоянного состава.
Процесс перехода от одного равновесного состояния к новому равновесия назыв. смещение хим. равновесия.
Принцип Ле Шателье: Если на систему находящуюся в состояния хим. равновесия. оказать какое-либо воздействие, то равновесия сместится в таком направлении, что оказанное воздействие будет ослаблено.
Приведем пример реакции в газовой фазе:
2 NO2 (г) N2O4 (г)
бурый бесцв газ + 57 кДж
FeCl3+KSCN Fe(SKN)Cl2+HCl (Интенсивный цвет)
studfiles.net
Скорость химических реакций.
Поиск ЛекцийСКОРОСТЬ
ХИМИЧЕСКИХ РЕАКЦИЙ
Методические указания к лабораторной работе
По дисциплине »Химия» для студентов
КУРСК 2003
Составитель В.С. Аксенов
УДК 543
Рецензент
Доктор химических наук, профессор Ф.Ф. Ниязи
Скорость химических реакций: Методические указания к лабораторной работе по дисциплине »Химия» / Курск. гос. техн. ун-т; Сост. В.С.Аксенов. Курск, 2003. 20 с.
Излагаются методические материалы по изучению темы »Скорость химических реакций», расчету скоростей в химических реакциях и выполнению лабораторной работы.
Предназначены для студентов всех специальностей, изучающих общую химию
Табл. 2. Ил. 2.
Текст печатается в авторской редакции
ИД № 06430 от 10.12.01.
Подписано в печать . Формат 60х84 1/16. Печать офсетная.
Усл.печ.л. 1,16. Уч.-изд.л. 1,05. Тираж 50 экз. Заказ
Курский государственный технический университет.
Издательско-полиграфический центр Курского государственного технического университета. 305040 Курск, ул. 50 лет Октября, 94.
Контрольные вопросы по теме
1. Что такое скорость химической реакции? В каких единицах она измеряется?
2. Что такое истинная и средняя скорость реакции?
3. Что такое кинетическое уравнение реакции (закон действующих масс)?
4. Как записывается кинетическое уравнение для гомогенной реакции?
5. Каковы особенности гетерогенные реакций?
6. Что такое кинетический, диффузионный и смешанный контроль в гетерогенных реакциях?
7.Какие существуют формы записи для кинетических уравнений гетерогенных реакций?
8. Что такое константа скорости реакции? Какие условия проведения реакции влияют, а какие не влияют на величину константы скорости?
9. Как рассчитать изменение скорости реакции при повышении (понижении) концентрации газообразного или растворенного вещества?
10. Когда влияет давление на скорость химической реакции?
11. Как рассчитать изменение скорости реакции при повышении (понижении) давления в системе?
12. Как влияет температура на скорость химической реакции? Приведите уравнение Вант-Гоффа.
13. Что такое температурный коэффициент реакции?
14. Что такое катализ? На какие параметры процесса действует катализатор?
Скорость химических реакций.
Кинетика ― учение о скорости различных процессов, в том числе химических реакций. Одним из основных понятий в химической кинетике является скорость реакции.
Скоростью химической реакции V называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
В гомогенной системе реакционным пространством служит объем сосуда, в котором протекает взаимодействие, а количество вещества в единице объёма называется концентрацияС и выражается в моль/л
Поэтому с случае гомогенного процесса, протекающего при постоянном объёме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени.
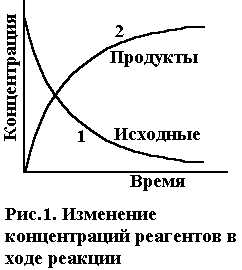 Обычно время τ выражается в сек, поэтому размерность скорости реакции как правило, моль/л·сек. При химическом взаимодействии концентрация каждого из исходных веществ уменьшается во времени (С2<С1, ΔС<0), а концентрация каждого из продуктов реакции возрастает (С2>С1, ΔС>0). Изменение концентраций исходных веществ и продуктов реакции во времени приведено на рис.1. В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость v равна отношению ΔС/Δτ (ΔС = С2-С1
, Δτ = τ2-τ1). Чтобы величина скорости была всегда положительной, перед дробью ставят знаки »±».
Обычно время τ выражается в сек, поэтому размерность скорости реакции как правило, моль/л·сек. При химическом взаимодействии концентрация каждого из исходных веществ уменьшается во времени (С2<С1, ΔС<0), а концентрация каждого из продуктов реакции возрастает (С2>С1, ΔС>0). Изменение концентраций исходных веществ и продуктов реакции во времени приведено на рис.1. В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость v равна отношению ΔС/Δτ (ΔС = С2-С1
, Δτ = τ2-τ1). Чтобы величина скорости была всегда положительной, перед дробью ставят знаки »±».
ΔС
V = ± —–—
Δτ
Истинная скорость химической реакции Vист определяется пределом, к которому стремится отношение ΔС/Δτ при τ→ 0, т.е. производной концентрации по времени:
dС
Vист = ± —–—
dτ
Зависимость скорости реакции от концентрации реагентов. Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходят тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени (рис.1, кривая 1) скорость реакции падает.
Количественно зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс, который в современной формулировке выглядит так:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции аА +bВ → mМ + nN
математическое выражение закона действующих масс имеет вид:
V = kСАа·СВb (1)
где V ― скорость реакции; САиСВ― концентрации реагентов А и В; а, b ― стехиометрические коэффициенты в уравнении реакции; k― коэффициент пропорциональности, называемый константой скорости химической реакции. Размерность константы скорости определяется величинами стехиометрических коэффициентов аи b и остается такой, чтобы скорость V имела размерность моль/л∙сек. Если нет точных данных, размерность k принимают сек―1. ПриСА = СВ= 1 моль/лk численно равнаV. Выражение (1) называют также кинетическим уравнением реакции.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Решение: Зная количества реагирующих веществ и объем системы, найдем молярные концентрации реагентов:
СА = 0,06/2 = 0.03 = 3·10―2моль/л; СВ = 0,02/2 = 0.01 = 10―2моль/л
Запишем выражение кинетического уравнения, связывающего скорость реакции с концентрациями реагирующих веществ:
V = kСА·СВ2
V6.10―7
Отсюда: k = ————— = ——————— = 0,2 л2/(моль) 2∙сек
СА·СВ2·3·10―2 (10―2)2
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно и ко всей реакции в целом.
Если в реакции участвуют два или более веществ, то скорость реакции может зависеть от концентрации только одного из них, участвующего в самой медленной стадии процесса и не зависеть от концентрации других.
Fе2О3(К) + 3СО(Г) → 2Fе + 3СО2(Г)
кинетическое уравнение может быть записано в виде: V = k∙С3СО∙S, где ССО ― молярная концентрация монооксида углеродаСО(Г), единственного газообразного компонента в реагирующих исходных веществах, S ― площадь поверхности, на которой идет реакция. Твердое вещество Fе2О3(К) в кинетическое уравнение не записывается. Скорости гетерогенных химических реакций имеют размерность моль/л∙сек∙м2
Однако в большинстве случаев площадь реакционной поверхности практически невозможно измерить и она непосредственно не фигурирует в кинетическом уравнении (законе действующих масс). Она
»запрятывается» в константу скорости k и это учитывается в размерности константы скорости.
Пример 2. Для реакции: Si(ТВ) + 2Н2О(Г)® SiО2(ТВ) + 2Н2(Г)напишите выражение для кинетического уравнения.
Решение: Данная реакция гетерогенная, протекает на границе раздела фаз. Из реагирующих веществ вода участвует в реакции в газообразной форме, перед ней коэффициент в уравнении равен 2 (…+ 2Н2О(Г)). Кремний (Si(ТВ)) ― твердое вещество, поэтому его концентрацию не учитываем в кинетическом уравнении. Следовательно, кинетическое уравнение (закон действующих масс) для данной реакции может иметь вид: V = k·С2Н2О. Размерность константы скорости в этом случае л/моль∙сек∙м2.
В процессе реакции уменьшается концентрация реагента в зоне реакции CS по сравнению с его концентрацией в в объеме CV из-за расхода реагента. Поэтому скорость гетерогенной химической реакции зависит от скорости подвода реагентов в зону химической реакции,
что является третьей особенностью этих реакций.
Наибольшее изменение концентрации реагента происходит в тонком слое около реакционной поверхности, называемом диффузионныом слоем. Перенос вещества здесь происходит в основном за счет диффузии.
Если скорость диффузии много больше скорости реакции (VД>> V), то реагенты без проблем подаются в реакционное пространство, к поверхности, все законы влияния концентрации на скорость, описанные выше, соблюдаются. Для таких случаев есть выражение «кинетический контроль реакции». Если скорости химической реакции и диффузии сопоставимы, имеет место смешанный контроль. И, наконец, когда скорость диффузии много меньше скорости реакции (VД<< V) то говорят о диффузионном контроле реакции.
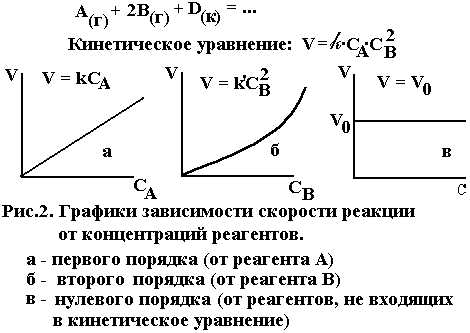 |
В этом случае может наблюдаться нулевой порядок реакции по всем реагентам. Это значит, что в координатах V ― C скорость не зависит от концентраций реагентов, а зависит от скорости диффузии, величины поверхности и температуры, которые не входят в кинетическое уравнение. Такое явление может иметь место при реакции на твердой поверхности в жидких средах с высокой вязкостью. Однако большинство гетерогенных реакций имеет порядок, отличающийся от нулевого, нередко дробный. На рис. 2 приведены графические формы возможных зависимостей скорости реакции от концентраций реагентов.
Зависимость скорости реакций от давления в системе. В тех случаях, когда среди реагирующих веществ имеются газы, скорость реакций зависит от давления в системе. При повышении давления пропорционально возрастает число молекул газа в единице объема, что эквивалентно повышению концентрации данного газа.
Пример 3. Как изменится скорость реакции 2NО + О2 → 2NО2 при уменьшении объема замкнутой системы в два раза при постоянной температуре?
Решение. Уменьшение объема в замкнутой системе эквивалентно пропорциональному увеличению давления, так как, согласно закону Менделеева-Клайперона РW = νRТ. (Здесь W― объем системы.)
Кинетическое уравнение данной реакции имеет вид: V = kС2NО·СО2
При уменьшении объема системы в два раза и связанным с этим повышении давления в два раза концентрации реагирующих веществ тоже повышаются в два раза: С’NО = 2СNО С’О2 = 2СО2
Новая скорость реакции:
V’ = kС’NО2·С’О2 = k(2СNО)2·(2СО2) = 8kСNО2·СО2 = 8V
Вывод. При уменьшении объема замкнутой системы в два раза при постоянной температуре скорость данной реакции повышается в 8 раз.
Зависимость константы скорости реакции от температуры. Большинство реакций ускоряется при нагревании. Температура действует непосредственно на константу скорости k. Пусть V1 ― скорость реакции при температуре Т1, а V2 ― скорость этой же реакции при температуре Т2 (Т1<Т2). В таком случае имеет место эмпирическое правило Вант-Гоффа.
где γ – температурный коэффициент, показывающий во сколько раз повысится скорость реакции при повышении температуры на 10 0С. Для большинства реакций при температурах, близких к комнатной, γ составляет величину 2-4.
Уравнение Вант-Гоффа широко используется, однако следует помнить, что оно эмпирическое приблизительное, его можно применять только для ориентировочных расчетов.
Пример 4. При 100 0С некоторая реакция заканчивается за 20 мин. Принимая температурный коэффициент скорости реакции γ = 3,5, рассчитайте, через какое время закончится реакция при 60 0С
Решение. Скорость реакции, как и скорость всякого процесса, обратно пропорциональна времени проведения процесса. Следовательно, V2/V1 = τ1/τ2. Пусть Т1, V1иτ1 ― параметры медленного (низкотемпературного) процесса, а Т2, V2иτ2 ― параметры высокотемпературного процесса. Подставляем имеющиеся данные в уравнение Вант-Гоффа:
V2/V1 = 3,5(100 ― 60)/10 = (3,5)4 = 150. Так как V2/V1 = τ1/τ2 = 150,
τ1/τ2 = τ1/20 τ1 = 150·20 = 3000 мин = 50 часов.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Как и при повышении температуры, при введении катализатора повышается константа скорости реакции. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом резко повышается
Лабораторная работа
»Скорость химических реакций»
Опыт 1. Зависимость скорости реакции от природы реагирующих
веществ.
Приготовьте прибор для измерения объема выделяющегося газа, который используется при определении эквивалента неизвестного металла методом вытеснения водорода. Заполните пробирку на 1/3 1 М уксусной кислотой. Опустите в пробирку 2 кусочка цинка и рассчитайте среднюю скорость выделения водорода, измерив объём газа, выделившегося за 5 минут.
По окончании опыта вылейте уксусную кислоту из пробирки, промойте цинк и высушите его фильтровальной бумагой. Проведите аналогичный опыт, налив в пробирку 1 М раствор соляной кислоты. Рассчитайте среднюю скорость реакции в этом случае.
Напишите уравнения реакций взаимодействия цинка с уксусной и соляной кислотами. Чем объяснить различную скорость выделения водорода в первом и во втором случаях?
Опыт 2. Зависимость скорости реакции от концентрации
реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой: Nа2S2О3 + Н2SО4 = Nа2SО4 + SО2 + Н2О + S↓
Признаком реакции является помутнение раствора вследствие выделения серы.
Приготовьте три склянки с пипетками, заполненные: первая ― 1 н. раствором Н2SО4, вторая ― 0,05 н. раствором Nа2S2О3 , третья ― водой. Приготовьте лист белой бумаги, с нанесенной на него жирной черной линией.
В пробирку, не содержащую на дне воды (вытряхнуть!), добавьте 4 капли тиосульфата натрия, 8 капель воды и, заметив время, 1 каплю серной кислоты. Каплю серной кислоты добавлять так, чтобы она не стекала по стенке, а падала прямо в раствор.
Зафиксируйте время помутнения раствора, при котором сквозь раствор не будет видна черная линия. Повторите опыт, добиваясь единообразной степени помутнения. После каждого опыта сразу же промывайте пробирку, так как адсорбирующаяся на стенках сера потом очень трудно отмывается.
Проделайте второй опыт, взяв 8 капель тиосульфата натрия, 4 капли воды и одну ― серной кислоты, а затем третий опыт, взяв 12 капель тиосульфата натрия и одну каплю серной кислоты. Результаты опытов внесите в таблицу 1.
Таблица 1
Рекомендуемые страницы:
poisk-ru.ru
Скорость химических реакций средняя — Справочник химика 21
Что называется скоростью химической реакции Что такое средняя и истинная скорость реакции [c.58]Как выражается средняя и истинная скорость химических реакций [c.53]
Одним из факторов, влияющих на скорость большинства гомогенных реакций, может быть концентрация реагирующих веществ. Стечением времени скорость химической реакции изменяется, так как изменяется концентрация реагирующих веществ. Обычно различают среднюю и истинную скорости реакции. Приближенно скорость химической реакции измеряется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени. При этом концентрацию принято выражать в молях на литр, а время — в минутах. Средней скоростью реакции называют отношение уменьшения концентрации исходного веи ества или увеличения концентрации продуктов реакции ко времени, в течение которого это увеличение или уменьшение произошло. Так, если концентрацию исходного вещества ко времени обозначить буквой Сг, а концентрацию ко времени 4 обозначить Са, то средняя скорость реакции будет выражаться уравнением [c.145]
Сравнение уравнения (IV,22) с уравнением (IV, 15) показывает, что энергия активации есть разность между средней энергией активных столкновений и средней энергией всех столкновений. Приведенное определение энергии активации является наиболее строгим в рамках применения молекулярно-кинетической теории к изучению скоростей химических реакций. Другое истолкование энергии активации будет дано при разборе теории активного комплекса. [c.132]
Это уравнение, получившее название уравнения Аррениуса, характеризует зависимость константы скорости химической реакции к от температуры Т. Величина Е имеет размерность энергии и носит название энергии активации. Энергию активации можно определить как тот избыток энергии по сравнению со средней энергией молекул при [c.43]
Обычно, хотя и не всегда, скорость химических реакций удваивается при увеличении температуры на 10 . Как можно объяснить это правило При 300° К увеличение температуры на 10° означает увеличение абсолютной температуры на 3% (10/300) и отсюда следует увеличение энергии молекулы на 3% (так как средняя энергия молекулы пропорциональна абсолютной температуре). Таким образом, при увеличении средней энергии молекулы на 3% вероятность разложения молекулы увеличивается на 100%. Отсюда можно заключить, что поскольку необходимым условием для химического превращения является наличие у молекулы определенного запаса энергии, то участвовать в реакции может не каждая молекула, а некоторая группа молекул. Этот вывод становится очевидным, если рассмотреть две типичные кривые равновесного распределения энергии для идентичных систем при двух [c.193]
Обобщенная трактовка хода процесса абсорбции, осложненного одновременной химической реакцией средней скорости, дается моделью, предложенной Хатта. Точное рещение в этом случае находится для необратимой химической реакции первого порядка. [c.255]
Цитируемая работа однако, еще раз демонстрирует недостатки рассматриваемого метода если средние диаметры пузырей не могут быть рассчитаны заранее или непосредственно измерены, то константы скорости химических реакций не могут быть определены с приемлемой точностью по данным о превращении в псевдоожиженном слое. [c.403]
Пример применения кинетических уравнений реакций первого порядка к радиоактивным процессам был приведен в 194. В теории радиоактивных процессов величину, отвечающую константе скорости химической реакции к, обозначают обычно через к=к и называют радиоактивной постоянной процесса. Применяют также и обратную ей величину 0=1Д, называемую средней продолжительностью жизни. Обычно скорость радиоактивного процесса характеризуют величиной периода полураспада т, которая связана [c.547]
Близкое согласие вычисленных и измеренных скоростей детонации можно рассматривать как доказательство правильности основной предпосылки гидродинамической теории детонации, согласно которой скорость химической реакции достаточно велика, чтобы обеспечить установление термодинамического равновесия во фронте детонационной полны. Отметим, что в случав богатых смесей, для которых расхождение между вычисленными и измеренными скоростями больше всего отличаются от среднего, Иост [55] в качестве одной нз вероятных причин расхождения указывает недостаточно большую скорость химической реакции, вследствие чего реакция в детона- [c.242]
Учение о скорости химических реакций называется химической кинетикой. Скорость реакции измеряют изменением концентрации реагирующих веществ в единицу времени. Средняя скорость реакции вычисляется по формуле [c.78]
Скорость процесса определяется скоростью химической реакции. Когда скорость процесса мала по сравнению со скоростью массообмена, двухпленочная теория не пригодна для объяснения механизма процесса и, следовательно, для расчета его средней скорости. Поэтому удобнее относить скорость процесса к единице объема реагирующей фазы, чем к единице поверхности раздела между фазами. [c.393]
Обозначения Т, Гщ, Го — температуры слоя, на входе в слой и начальная с, Сщ, Со — соответствующие значения концентрации реагента в газовой смеси в слое на входе и начальное ц — линейная скорость потока газовой смеси, отнесенная к полному сечению слоя W T, с) —скорость химической реакции АГа — адиабатический разогрев смеси при полной степени превращения I, L —текущая и общая длина слоя катализатора Я — эффективный коэффициент продольной теплопроводности слоя Сел — средняя объемная теплоемкость слоя катализатора Ср — средняя объемная теплоемкость реакционной смеси е — пористость слоя катализатора у = = Ср + Ссл D — эффективный коэффициент диффузии реагента в газовой смеси. Эта модель удовлетворительно описывает процессы в адиабатическом слое катализатора при таких предположениях градиенты температур внутри зерен катализатора незначительны химические процессы па внутренней поверхности зерен и диффузионные процессы внутри пористых зерен квазистационарны по отношению к процессам переноса в газовой фазе процессы межфазного тепло- и массообмена настолько интенсивны, что температура и. концентрация реагента в твердой и газовой фазе неразличимы. [c.100]
Энергия активации характеризует избыточную энергию реагирующих молекул над средней величиной энергии всех молекул системы при данной температуре. Чем больше энергия активации, тем меньше скорость химической реакции. [c.374]
Коэфс циент скорости химической реакции и его физический смысл. Определим статистические коэффициенты (константы) скорости химической реакции к как средние скорости (на единицу плотности реагирующих компонент) по всем доступным (динамически и энергетически) каналам столкновений. Усреднение должно быть проведено по скоростям и внутренним квантовым состояниям реагирующих компонент. Это значит, что в выражение для к должна входить в явном виде функция распределения реагентов и продуктов, что позволяет оценить к для неравновесных реакций [147,251,402,403]. [c.11]
Рассмотрим точку, принадлежащую первому потоку и находящуюся вблизи границ слоя смешения. Отклонение истинной скорости химической реакции от скорости, рассчитываемой по средним значениям [c.184]
В каждом из расчетов прослеживалась история 5 10 молекул, поэтому статистическая ошибка полученных результатов не превышала 1%. Во всех вариантах результаты расчетов выводились из памяти машины через определенный временной шаг (общее число шагов равнялось 40). Величина шага была выбрана таким образом, что система приходила в состояние равновесия примерно за 20 шагов. В дальнейшем величины, характеризующие систему, испытывали слабые статистические флюктуации. Таким образом, были получены результаты, характеризующие как кинетику перехода системы из начального состояния в равновесное, так и само равновесное состояние. Контроль равновесности системы производился независимо по значениям функций распределения молекул по скоростям, средней энергии молекул, вкладу поступательных степеней свободы молекул в /У-функцию Больцмана и константе скорости химической реакции. Все эти величины принимали свои равновесные значения практически одновременно. [c.210]
Второе издание сборника пополнено задачами по новому разделу программы средней школы Скорость химической реакции и химическое равновесие , а также задачами и упражнениями по другим темам. [c.3]
Правило Вант-Гоффа при повышении температуры на 10° скорость химической реакции чаш/г всего увеличивается в 2—4 раза (в среднем — в 3 раза). [c.60]
Большое внимание в последнее десятилетие уделялось взаимосвязи между скоростями химической реакции и диффузии. Дамкел-лер и особенно Франк-Каменецкий широко развили эту область. Последний различает микрокинетику (т. е. химическую кинетику) и макрокинетику (т. е. физический транспорт — перенос реаги-руюш их веществ). Следуя ван Кревелену мы должны учитывать при макрокинетическом анализе величины среднего моле1 улярного пробега, распределения вещества в гетерогенных системах (диффузия) и в реакторе в целом (перенос конвекцией). Укажем, что для получения сведений о химической кинетике мы все еще должны полностью полагаться на экспериментальные данные по каждой отдельной исследуемой реакции. [c.20]
При повышении температуры на каждые 10 °С скорость химических реакций возрастает в среднем в два — четыре раза, что можно выразить [c.92]
Очевидно, что скорость можно определить по изменению количества любого из реагирующих веществ или продуктов реакции. Средняя скорость химической реакции, определенная по веществу Ль за время 2 — 1 равна [c.237]
Различают среднюю и истинную скорости химической реакции. Допустим, что в момент времени ti концентрация вещества была i, а для момента Т2 — она стала q-Тогда средняя скорость реакции для интервала времени [c.111]
Как показывает последний пример, скорость химической реакции очень сильно возрастает при повышении температуры. Это связано с тем, что элементарный акт химической реакции протекает не прп всяком столкповептг реагирующих молекул реагируют только те молекулы активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молек л. Поэтому калсдая реакция характеризуется определенным энергетическим барьером для его преодоления необходима энергия активации — некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать [c.91]
Скорость реакции. Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени. Так как скорость реакции изменяется с течением времени, то разли-чаютсреднюю и истиннуюскорость реакции. Средней скоростью реакции Г за данный промежуток времени называется отнощение уменьшения [c.322]
Чем этот отрезок меньше, т. е. чем меньше величина Ат, и чем бллже на кривой KL точки тип одна к другой, тем средняя скорость будет ближе к истинной. Если брать изменение концентрации йС за бесконечно малый промежуток времени т, то получим следующее выражение для истинной скорости химической реакции в данный момент времени [c.131]
Обозначения Г, Г х, То — температуры слоя, на входе в слой и начальная с, Свх> Со соответствующие значения концентрации реагента в газовой смеси в слое, на входе и начальное и — линейная скорость потока газовой смеси, отнесенная к полному сечению слоя W T, с) — скорость химической реакции ДГад — адиабатический разогрев смеси при полной степени превращения I, L -текущая и общая длина слоя катализатора X — эффективный коэффициент продольной теплопроводности слоя — средняя обммная теплоемкость слоя катализатора Ср — средняя объемная теплоемкость реакционной смеси е -пористость слоя катализатора у = Ср + Сел D — эф ктивный коэффициент диффузии реагента в газовой смеси. [c.309]
Для экспериментального определения скорости химической реакции находят концентрацию г-го реагента в различные моменты вpeмeнj . По зависимости = () можно определить среднюю скорость г за промежуток времени от Ь до г [c.526]
Если и = onst и I7 = onst, то, как показано в [17], в скользящем режиме распределение тепла в слое зависит только от интегральных характеристик процесса интегральной скорости, интегральной положительной скорости, интегральной отрицательной скорости, среднего значения коэффициента теплопроводности Я, и среднего значения скорости химической реакции. Для случая, когда времена подачи газовой смеси в положительном и отрицательном направлениях одинаковы, удалось детально проанализировать стационарную задачу при протекании одной реакции. В дальнейшем удобно будет вести рассуждения в терминах степени превращения [c.110]Наиболее важным, однако, является вывод о том, что в гидравлическом контролируемом режиме число Нуссель-та Niiav нельзя рассматривать как коэффициент теплоотдачи. Было бы полностью неправильным рассматривать такой средний коэффициент теплоотдачи , как например, константа скорости химической реакции для выяснепия, контролируется ли эта реакция процессами переноса или кинетикой. В подобных случаях необходилю отдельно рассматривать процессы, происходящие в каждом из каналов. [c.87]
Энергией активации называют избыток энергии реагирующих молекул над средним значением энергии всех молекул реагирующей системы при данной температуре. Величина энергии активации оп-ред(шяется из уравнения (22. 19) на основании экспериментально найденной константы скорости реакции нри двух температурах. Чем выше энергия активации, тем меньше скорость химической реакции. При осуществлении химической реакции в присутствии по-ло/кительного катализатора энергии активации сни, кается, поэтому скорость реакцип увеличивается. Этнм и объясняется возможность понижения температуры процесса при осуществлении реакции и присутствии катализатора. [c.595]
Небольшие системы реакторов с мешалками непрерывного действия обычно применяют для изучения кинетики химических реакций. Денбиг и Пейдж [3] описывают проточный метод, использованный для исследования химических реакций, когда среднее время пребывания в сосуде составляло от 1 до 4000 секунд. Этот ]четод особенно ценен для исследования довольно быстрых реакций. Метод основан на измерении скорости химической реакции при различных скоростях потока жидкости в условиях стационарных режимов. [c.106]
Химическая кинетика изучает склрость и механизм протекания химических реакций, а также зависимость скорости от различных факторов. О скорости химических реакций судят по изменению концентраций реагирующих веществ в единицу времени. Скорость реакции изменяется во времени, что связано с изменением концентраций веществ в ходе реакции. Среднюю скорость реакции v в определенном промежутке времени рассчитывают по формуле [c.105]
Удельную скорость химической реакции определяют как количество вещества, реагирующее (или образующееся) в единицу времени в динице реакционного пространства п единице объема фи гомогенной или на единице поверхности раздела фаз при гетерогенной реакции. Размерность удельной скорости гомогенной реакции v моль/л-с, г/л-с, а удельной скорости гетерогенной реакции — моль/см -с, г/ м . При реагировании веществ, находя[цихся в од1 ой фазе (газовой или жидкой), среднюю скорость хим 1ческой реакции определяют как изменение концентрации с] одного из веществ во времени t u = A Mt (Дт — приращение времени, которому отвечает изменеше концентрации Дс). [c.86]
В принципе все физические свойства кристаллов зависят от их структуры и, следовательно, от дефектности решетки. Однако не все свойства в равной мере чувствительны к наличию дефектов. Обычно число равновесных дефектов относительно невелико, поэтому к мало чувствительным свойствам относятся все те, которые зависят только от средних значений молекулярных параметров частиц в решетке. Сюда относятся такие термодинамические свойства, как теплоемкость и энергия кристаллов. Более чувствительны к наличию дефектов оптические свойства кристаллов в области основной полосы поглощения. Высокочувствительны те физические свойства, которые практически полностью определяются наличием отдельных дефектов в кристаллической решетйе — диффузия в кристаллах, электропроводность примесных полупроводников, поглощение света вне основной полосы поглощения, люминесценция, некоторые магнитные свойства, скорость химических реакций в кристаллах. Для химии большое значение имеет равновесная нестехиометричность ионных кристаллов, возникающая в связи с появлением в решетке структурных дефектов. [c.271]
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизжнном объеме системы. При этом безразлично, о каком из участвующих в реакции веществе идет речь все они связаны между собой уравнением реакции, а потому по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентраций всех остальных. Обычно концентрацию выражают в моль/л, а время — в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна (1—0,6)/4 = 0,1 моль/(л-с). [c.63]
Зависимость скорости реакции от температуры. Температура очень сильно влияет на скорости химических реакций, и в лабораторном практикуме мы постоянно пользуемся нагревом или газовой горелкой, или электрообогревателями для ускорения тех или других химических процессов. Повышение температуры увеличивает число молекул, обладаюших энергией, достаточной для активных столкновений одновременно растет и среднее значение энергии молекул. [c.122]
Учение о скоростях химических реакций называется химической кинетикой. Скорость химической реакции определяется изменением концентраций реагирующих веществ в единицу времени. Если в какой-то момент концентрация какого-либо реагирующего вещества была Со (в моль/л), а спустя время 1 (в с) уменьшилась до (в моль/л), то в этом промежутке времени реагашя протекала со средней скоростью и (в моль/(л-с)] [c.161]
chem21.info
Скорость химических реакций — Наука и образование
Наблюдая химические реакции, вы, конечно, заметили, что требуется различное время, чтобы та или иная реакция завершилась. Так, при комнатной температуре и атмосферном давлении реакции нейтрализации кислот щелочами протекают практически мгновенно, а для появления на поверхности стального листа ржавчины (продукта взаимодействия железа с кислородом и водяными парами) необходимо много суток. Таким образом, идущие при одних и тех же условиях реакции могут резко отличаться по скорости. Следовательно, скорость химических реакций зависит от природы реагирующих веществ, т. е. от их химического состава и строения.
Как количественно характеризовать скорость химической реакции?
Вспомним, как в механике определяется скорость движущегося тела. Скорость механического движения измеряется длиной пути, которую тело проходит за единицу времени:
v = S/t , м/сек
где v – скорость движения, S – путь, пройденный телом, t – время, в течение которого этот путь пройден.
Заметим, что если тело движется равномерно, то v – скорость в любой момент в течение данного промежутка времени, т. е. истинная скорость движения. Но если тело движется неравномерно, то полученное по уравнению значение характеризует собой среднюю скорость движения.
Понятие о скорости химической реакции аналогично понятию о скорости движущегося тела.
Если в течение промежутка времени t концентрация одного из реагирующих веществ уменьшилась от с1 моль/л до с2 моль/л, то скорость реакции v в течение этого промежутка времени была:
v = c1 – с2 : t, моль/л · сек
или
v = ?c/t , моль/л · сек
где: ?с = с1 – с2
Таким образом, скорость реакции вычисляется путем деления разности концентраций одного из реагирующих веществ на промежуток времени, в течение которого произошло это изменение концентрации.
Пусть, например, начальная концентрация одного из веществ равнялась 0,024 моль/л, а концентрация его спустя 10 сек от начала реакции уменьшилась до 0,022 моль/л. Тогда средняя скорость реакции в течение этого промежутка времени была:
v = 0,024 – 0,022 : 10 = 0,0002 (моль/л · сек)
В большинстве случаев скорость химической реакции по мере ее течения изменяется. Тогда полученное по приведенному выше уравнению значение характеризует собою среднюю скорость реакции.
Зависимость скорости реакции от условий ее протекания
При горении веществ, например серы, в воздухе и в чистом кислороде идет одна и та же реакция. Природа реагирующих веществ и продуктов реакции в обоих случаях одна и та же. Но в чистом кислороде реакция идет гораздо быстрее, чем в воздухе.
Почему скорость реакции резко увеличивается при замене воздуха чистым кислородом?
Рассмотрим реакцию между водородом и парами йода:
H2 + I2 = 2HI
Опытным путем найдено, что ее скорость прямо пропорциональна произведению концентраций реагирующих веществ:
v = k [H2][I2]
где v –скорость реакции, k –коэффициент пропорциональности, называемый константой скорости реакции, [Н2], [I2] – концентрации водорода и йода в данный момент.?
Как объяснить эту зависимость теоретически? Чтобы произошла реакция, необходимо, чтобы молекулы водорода и йода столкнулись. Расчеты же показывают, что число столкновений в единицу времени в сосуде данного объема прямо пропорционально произведению концентрации молекул. Если реакция происходит в результате попарных столкновений молекул, то скорость ее пропорциональна произведению концентраций данных веществ:
v = k [A] [B]
где [A], [B] – концентрации реагирующих веществ в данный момент, k – константа скорости. Эта общая закономерность учения о скоростях химических реакций применима и к взаимодействиям между другими частицами – атомами или ионами.
Один из способов повышения концентрации был уже приведен. Ведь замена воздуха кислородом означает увеличение концентрации кислорода примерно в 5 раз. Вот почему так быстро идут реакции в чистом кислороде.
Концентрации газообразных веществ могут быть увеличены и другим способом – сжатием их. Поэтому многие реакции, в которых участвуют газы, проводят под повышенным давлением.
Перейдем теперь к рассмотрению скорости реакций, в которых участвуют вещества в твердом состоянии. Мы неоднократно встречались с такими реакциями: взаимодействием двух твердых веществ (сера и железо), твердого и газообразного веществ (горение твердых веществ в кислороде, хлоре), жидкого и твердого веществ (цинк и серная кислота). Для того чтобы эти реакции шли быстрее, мы предварительно измельчали твердые вещества. Почему же скорость реакции увеличивается при измельчении веществ?
Представим себе, например, ход реакции между газом и твердым веществом. Молекулы газа сталкиваются с поверхностью твердого вещества. Чем больше таких столкновений в единицу времени, тем скорее идет реакция. Ясно, что число столкновений растет как при повышении концентрации участвующего в реакции газа, так и при увеличении поверхности твердого тела. Скорость реакции прямо пропорциональна величине поверхности реагирующих веществ. Эта закономерность имеет большое значение для лабораторной практики. Очень велико ее значение и для химического производства.
Скорость реакции при повышении температуры
Мы неоднократно встречались еще с одним из способов увеличения скорости – если реакция не шла при комнатной температуре, мы нагревали реагирующие вещества. Проследим зависимость скорости реакции от температуры на примере взаимодействия водорода с кислородом. При комнатной температуре смесь этих двух газов может храниться годами. Образования воды не наблюдается, скорость реакции равна нулю. При 400° С реакция идет, но очень медленно – она заканчивается примерно через 80 суток, при 500° С – через 2 часа, а при 600° С – смесь газов взрывается.
Скорость реакций в большинстве случаев увеличивается в 2–4 раза при повышении температуры на каждые 10° С.
Чем же объясняется такое сильное влияние температуры на скорость реакций?
Мы знаем, что молекулы газов находятся в непрерывном движении и число столкновений молекул в секунду чрезвычайно велико. Если бы каждое столкновение приводило к реакции, то все реакции совершались бы мгновенно. В действительности же, как показывают расчеты, число «удачных» столкновений составляет лишь малую долю от их общего числа. В реакцию вступают только «активные» молекулы, те, которые в момент столкновения обладают энергией, не меньшей некоторой определенной для данной реакции величины, называемой энергией активации данной реакции. Доля таких молекул в общей их массе, как правило, невелика, но при повышении температуры резко возрастает.
scibio.ru
Cайт учителя химии Ващенко Н.Ю.
Глава 7. Скорость химической реакции.7.1. Влияние концентрации реагентов на скорость химической реакции.
7.2. Зависимость скорости химической реакции от температуры.
7.3. Влияние катализатора.
7.4. Упражнения.
Глава 7. Скорость химической реакции
7.1. Влияние концентрации реагентов на скорость химической реакции
Под скоростью химической реакции понимается изменение концентрации реагента (продукта) в единицу времени:
= (cкон – cнач)/(tкон – tнач).
Cкорость химической реакции находят, определяя концентрации реагентов через определенные промежутки времени. О концентрации реагента судят по какому-либо его внешнему признаку. Это может быть его окраска, поглощение им излучения в ультрафиолетовой или инфракрасной области, электропроводность раствора и т.д.
Скорость химической реакции зависит от целого ряда факторов, прежде всего от природы реагентов. Существуют реагенты, способные реагировать за доли секунды, например NaOH и HCl. Некоторые же реакции протекают годами, например процесс ржавления железа или превращение сульфата свинца (свинцовые белила) в картинах старых мастеров в сульфид свинца, что приводит к заметному потемнению таких картин.
Для того чтобы прошла химическая реакция, реагирующие частицы должны столкнуться. По количеству частиц, участвующих в элементарном акте, реакции делят на мономолекулярные (в элементарном акте участвует одна частица, например в реакциях разложения), бимолекулярные (2 частицы) и тримолекулярные (3 частицы). С увеличением количества частиц вероятность их столкновения в одной точке пространства стремительно уменьшается. Поэтому тримолекулярные реакции редки, а четырехмолекулярные реакции неизвестны.
Примером двухстадийной тримолекулярной реакции может служить взаимодействие водорода и йода в газообразной фазе. После образования активированного комплекса (Н2•I2) происходит его распад на h3 и 2I, за которым следует тримолекулярная реакция атомарного йода с водородом:
h3 + 2I = 2HI.
Однако допускают, что эта тримолекулярная реакция может быть представлена двумя бимолекулярными стадиями:
h3 + I = [h3I],
[h3I] + I = 2HI.
Скорость химической реакции зависит от концентраций реагентов: чем больше концентрация, тем, как правило, выше скорость реакции. Математическое выражение для скорости реакции определяется конкретными реагентами и условиями, при которых она протекает. Для реагентов А и В оно имеет вид:
= k[A]х[В]y,
где k – константа скорости реакции (некий коэффициент пропорциональности), постоянная при данной температуре для какой-либо реакции и зависящая от температуры, [А] и [В] – молярные концентрации реагентов А и В, х – порядок реакции по реагенту А, у – порядок реакции по реагенту В, (х + у) – суммарная степень влияния концентраций реагентов на скорость реакции (суммарный порядок реакции).
Известны химические реакции нулевого порядка, когда х + у = 0. В случае нулевого порядка скорость реакции не зависит от концентрации реагентов. В качестве примера можно привести реакцию гидрирования этилена на платине:
Cкорость данной реакции определяется поверхностью катализатора и не зависит от концентраций реагентов:
= k[C2h5]0[h3]0.
Встречаются химические реакции первого порядка (х + у = 1). К реакциям первого порядка относятся, как правило, процессы разложения. Известно небольшое число таких реакций. Например, разложение азометана в газовой фазе является реакцией первого порядка:


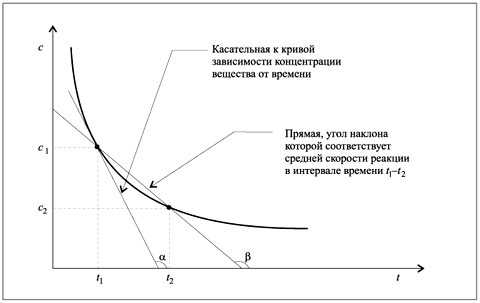
Рис. 7.1.
Определение истинной и средней скоростей химической реакции
с помощью графика зависимости концентрации
вещества от времени


Рис. 7.2.
Зависимость энергии реагирующих молекул
от координаты химической реакции
При малом числе активных молекул (обладающих энергией активации) число эффективных столкновений незначительно и реакция протекает медленно. Если представить себе в качестве промежуточной стадии не образование активированного комплекса, а полную диссоциацию молекул на атомы, то энергия активации окажется меньше энергии разрыва химических связей в молекулах исходных веществ (рис. 7.3).
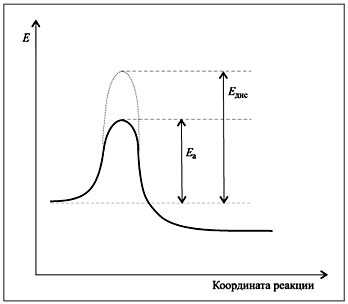
Рис. 7.3.
Качественное сопоставление энергий
активации и диссоциации химических связей
реагирующих молекул





himiknoginsk.ucoz.ru
Скорость реакции средняя — Справочник химика 21
Скорость реакции зависит от изменения концентрации реагирующих веществ в единицу времени. Поскольку скорость реакции изменяется во времени, то различают среднюю и истинную скорость реакции. Средней скоростью ре- [c.65]Расчет реактора вытеснения непрерывного действия (трубчатого или колонного типа) также основан на интегрировании по времени (или по длине реактора, что то же самое) ур-ний скорости реакции, средней степени полимеризации совместно с ур-ниями теплового баланса (ур-ниями скорости выделения и отвода тепла). Модель идеального вытеснения предполагает в первом приближении допущение, что среда в трубе движется подобно поршню. Перемешивание различных элементов среды в направлении движения потока отсутствует. Реальные аппараты описываются с помощью более сложных моделей, учитывающих радиальную и осевую диффузию и т. д. (см. Полимеризация в массе). [c.451]
В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость V равна отношению АС/А/ (АС = Сг — С1 А/ = 4 — 1)- Чтобы величина скорости была всегда положительной, перед дробью ставят знаки , V [c.114]
Скорость реакции, среднюю продолжительность жизни и длину кинетической цепи рассчитывают тем же методом, что и в случае моновиниловых мономеров, но значения кр и k в общем случае являются усредненными значениями констант скоростей для нескольких различных реакций роста или обрыва. Молекулярные веса также подчиняются обычным соотношениям, за исключением тех случаев, когда имеет место сшивание макромолекул. [c.42]
Реакторы с иммобилизованными клетками значительно различаются по принципу действия, а также по размеру и форме частиц. Поэтому возможность использования для определения объемной скорости реакции среднего содержания биомассы зависит от описываемой системы, но в общем Яов определяется уравнением (5.3) в случае, когда биомасса иммобилизуется в виде пленки, — уравнением (5.4) [c.182]
Задание 78. Предположим, что имеется некоторое количество пар данных (например, температура/скорость реакции, среднее значение pH воды в водоеме/год или номер телефона/фамилия) и необходимо упорядочить эти пары по первой величине (например, по номеру телефона) или по второй величине (например, по фамилии). Напишите для этого программу так, чтобы можно было выбрать один из вариантов, соответствующий характеру данных. [c.147]
Скорость реакции Средняя молекулярная масса Прочность на разрыв Эластичность [c.98]
Устойчивость латекса То же Размер частиц Поверхностное натяжение Скорость реакции Средняя молекулярная масса Разветвленность молекулярной цепи [c.98]
Полимеризацию нужно проводить при таких условиях, чтобы можно было легко регулировать концентрацию мономера, температуру и другие факторы, влияющие на скорость реакции, среднюю молекулярную массу продукта, его полидисперсность и др. [c.291]
Эмульсионный метод. Основным методом получения поливинилхлорида является водоэмульсионный метод, который на практике осуществляют в виде периодичного или непрерывного латексного способа. Для проведения полимеризации в эмульсии готовят реакционную смесь, состоящую из дистиллированной воды, содержащей эмульгатор, водорастворимый инициатор и стабилизатор в некоторых случаях применяют регуляторы pH среды и поверхностного натяжения. В готовую смесь вводят нужное количество мономера. На ход процесса полимеризации винилхлорида большое влияние оказывают примеси, содержащиеся в компонентах смеси в связи с этим все применяемые вещества подвергают тщательной очистке, а воду — обработке на ионообменной установке для обессоливания. В качестве эмульгаторов используют различные мыла (ализариновое, триэтаноламиновое), некаль, натриевые соли алифатических или ароматических сульфокислот. Количество введенного эмульгатора (обычно 0,1—0,5% от массы мономера) существенно влияет на скорость реакции, среднюю молекулярную массу полимера и на дисперсность латекса. [c.73]
Для большинства экзотермических процессов скорость увеличивается вначале (с возрастанием степени превращения) вследствие повышения температуры в системе, но снижается в конце (с уменьшением х) за счет расходования реагентов. При сравнительно малых степенях превращения средняя скорость реакции в аппарате идеального смешения всегда выше, чем в аппарате идеального вытеснения. Однако по достижении некоторого уровня х несколько большего, чем уровень, соответствующий максимуму скорости реакции, средние скорости для двух моделей реакторов становятся идентичными после превышения указанного уровня реактор идеального вытеснения становится предпочтительнее. [c.345]
В положении 1 появляется возможность перехода реакции в область высоких значений температуры. Дальнейшее увеличение Toa (положение 2) соответствует трем возможным температурным уровням и, соответственно, трем скоростям реакции. Средний температурный режим оказывается неустойчивым, поскольку любое [c.159]
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества вещества к единице объема называется концентрацией с, то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна [c.167]
Скорость реакции. Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени. Так как скорость реакции изменяется с течением времени, то различают среднюю и истинную скорость реакции. Средней скоростью реакции V за данный промежуток времени называется отношение уменьшения [c.322]
Скорость реакции Средняя молекулярная масса Разветвленность макромолекул Скорость реакции Разветвленность макромолекул Скорость реакции [c.344]
В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость [c.108]
Формула (5-3) определяет изменение во времени мгновенного значения константы скорости реакции. Среднее ее значение для установившегося (в среднем) процесса может быть выражено в виде [c.106]
Ван Зоонен показал, что температура мало влияет на скорость реакции. Средняя скорость реакции незначительно увеличивается также с уменьшением размера гранул или с увеличением объема пор катализатора. Эти факты находятся в согласии с теорией. Содержание кокса на катализаторе в этих опытах достигало 4% (масс.). [c.206]
Расчет таких величин, как скорость реакции, средний молекулярный вес образовавшегося полимера и распределение по молекулярным весам, основывается на четырех типах указанных выше реакций, а именно инициирование, рост, обрыв и передача. Такие, на первый взгляд различные, явления, как разветвление цепи (в структурном смысле), обрыв на мономере и ингибирование, в действительности не являются дополнительными типами реакций, а представляют собой следствия реакции передачи цепи. Разветвление цепи, например, может происходить при передаче цепи от радикала к полимерной молекуле с последующими реакциями роста и обрыва (уравнение 1.VIII) обрыв на мономере является результатом передачи цепи через мономер с образованием очень стабильного радикала, который не способен участвовать в реакции роста с такой же скоростью, как исходный полимерный радикал (см. стр. 66) ингибирование происходит при передаче цепи к молекуле ингибитора с образованием радикала, имеющего крайне низкую реакционную способность (см. гл, 6). [c.21]
Полученпе стереорегулярных пошмеров. Было обнаружено, что некоторые вещества, реагируя со свободными радикалами или ионами, прекращают рост данной макромолекулы, вызывая рост другой, либо совсем устраняют дальнейший рост любых макромолекул. Это дало возможность успешно вмешиваться в процессы возникновения и обрыва молекулярных цепей. Добавляя соответствзгющие вещества в иолимеризационную систему, стали регулировать общую скорость реакции, среднюю длину цепи и, как следствие, длпну молекул полимера. Это позволило также получить макромолекулы большей геометрической упорядоченности, обладающие совершенно новыми механическими п термическими свойствами. [c.335]
Взаимодействие цианид-иона с электрохимически генерированным катион-радикалом ТАА в ацетонитриле было исследовано спектроэлектрохимически в условиях осуществления реакции по второму порядку [87] в отсутствие добавок [86], которые ранее использовались для снижения кажущейся скорости реакции. Среднее значение константы составляет 2-10 Л МОЛь -с Ч В условиях псевдопервого порядка было получено значение к для реакции (3-51). Оцененное значение константы ( =2,7-10 Л МОЛь- -с-1) хорошо согласуется с результатами, наблюдаемыми в условиях протекания реакции по второму порядку. [c.120]
chem21.info
Химическая кинетика Понятие о скорости химической реакции
Химическая кинетика
Понятие о скорости химической реакции. Истинная (мгновенная) скорость реакции. Основные факторы, влияющие на скорость реакция. Химическая реакция как последовательность элементарных стадий. Закон действующих масс для элементарной стадии химической реакции. Константа скорости реакции. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Представление об энергии активации, энергетическом барьере и активированном комплексе. Катализ и ферменты. Значение химической кинетики в химии, биологии и сельском хозяйстве.
3.1. Скорость химической реакции
Химическая кинетика — раздел химии, изучающий скорость химических реакций, механизмы их протекания и факторы, влияющие на скорость.
Химическая кинетика подробно изучается в курсе физической химии. В этой главе рассматриваются только те представления и понятия, без которых нельзя правильно понять главы
«Химическое равновесие», «Энергетика химических реакций», а также многие свойства химических элементов и их соединений.
Все химические реакции, подобно физическим, биологическим, геологическим и любым другим природным процессам, протекают во времени. Химическая кинетика изучает и очень быстрые, такие, как взрывы, и очень медленные реакции, такие, как геохимическое формирование земных пород. Это возможно потому, что все химические реакции подчиняются общим законам.
Реакции делятся на гомогенные и гетерогенные. Гомогенные реакции протекают равномерно во всем объеме жидкого раствора или газовой смеси. Гетерогенные реакции осуществляются на поверхности твердого вещества, взаимодействующего с жидкостью или газом, или на поверхности жидкости, реагирующей с газом.
Чтобы понять, что такое скорость химической реакции, рассмотрим, например, газовую смесь, состоящую из равных объемов водорода и паров йода, помещенную при температуре 723,15 К(450 0С ) и давлении 101,3 кПа в герметично закрытый сосуд. Пары йода окрашивают смесь в фиолетовый цвет. Наблюдая за этой смесью, можно заметить ослабление фиолетовой
окраски, что свидетельствует о протекании гомогенной реакции:
Н2 + I2 = 2НI
бесцветный фиолетовый бесцветный
Интенсивность окраски смеси тем меньше, чем меньше содержащееся в ней количество йода. Следовательно, о скорости реакции можно судить по изменению количества вещества реагента или продукта реакции.
Скорость химической реакции это количество вещества реагента, вступившего в реакцию за единицу времени, или количество вещества продукта, образовавшегося за единицу времени, в единице объема при гомогенной реакции или на единице поверхности при гетерогенной реакции.
Отношение количества вещества (моль) к единице объема (л) — это не что иное, как молярная концентрация вещества, поэтому скорость гомогенной реакции обычно характеризуют изменением концентрации вещества-реагента или вещества-продукта за единицу времени при постоянном объеме системы. Установив зависимость интенсивности окраски от концентрации йода, можно проследить за изменением его концентрации во времени (рис. 3.1). Зная концентрации йода с1(I2) в момент времени t1и с2(I2) в момент времени t2, можно найти среднее значение скости реакции v по одному из реагентов, йоду, за отрезок времени дельта t = t2 – t1:
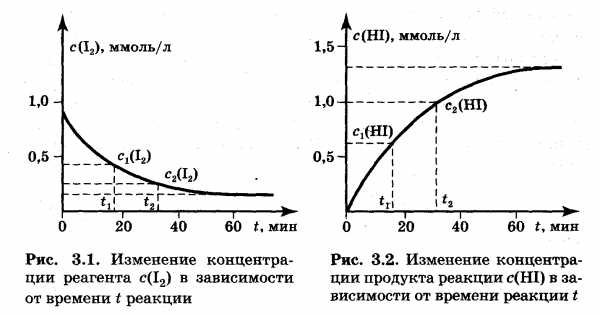
c2 (I2) – c1 (I2) дельта c(I2)
v (I2) = —————————— = ————
t2 – t1 дельта t
Так как по мере протекания реакции концентрации реагентов убывают, т. е. с2(I2) меньше, чем с1(I2) (см. рис. 3.1), то их разность дельта с(I2) отрицательная величина. Поэтому отношение дельта с(I2) / дельта t также оказывается отрицательной величиной (дельта t — величина всегда положительная). Чтобы средняя скорость реакции по реагенту имела положительное значение, это отношение в уравнении (3.1) взято со знаком минус.
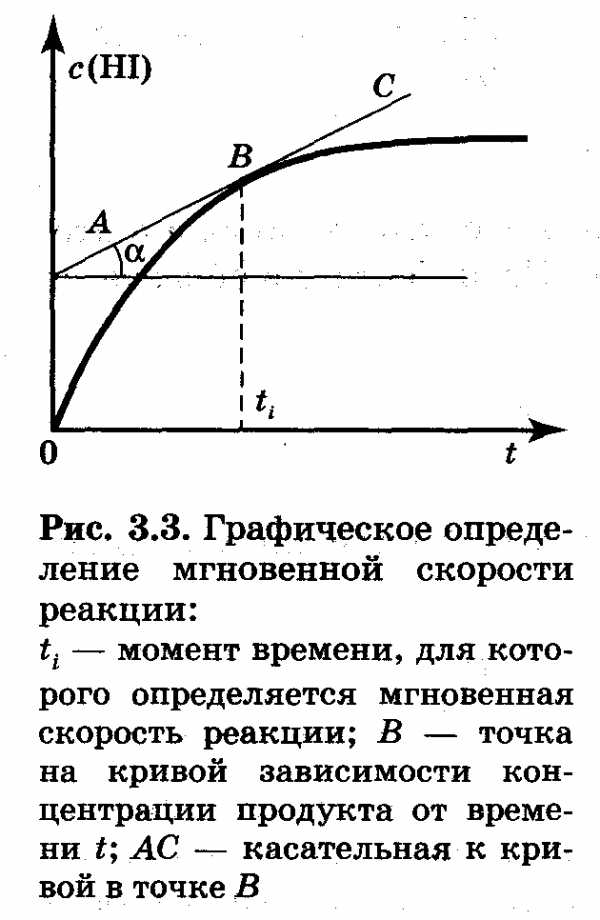
Если существует возможность следить за изменением концентрации продукта реакции йодоводорода (рис. 3.2), то среднюю скорость можно вычислить следующим образом:
c2 (HI) — c1(HI) дельта c(HI)
v(HI) = ———————— = —————
t2 — t1 дельта t
где с1(НI) и с2(НI) — концентрации продукта реакции моменты времени t1 и t2соответственно.
Из рис. 3.1 и 3.2 видно, что в начале реакции концентрации веществ изменяются быстро, затем эти изменения замедляются и, наконец, прекращаются совсем. (Неполное превращение йода и водорода в йодоводород и установление постоянных концентраций всех компонентов реакционной смеси объясняются достижением химического равновесия, которое будет рассмотрено в гл. 4.) Следовательно, среднее значение скорости зависит от того, в какой части кривой выбран промежуток времени дельта t = t2— t1и насколько он велик. Чем меньше дельта t, тем меньше различие между средней скоростью и истинным (мгновенным) значением скорости в данный момент времени. Мгновенное значение скорости v может быть вычислено как предел, к которому стремится средняя скорость при дельта t стремиться к 0, т. е. как первая производная от концентрации по времени. Истинная скорость по реагенту (йоду):
дельта c(I2) dc(I2)
v(I2) = lim ( — ——————) = — ————
t при дельта t стремиться к 0 dt
истинная скорость по продукту реакции (йодоводороду):
дельта c(НI) dc(НI)
v(НI) = lim (—————— ) = ——————
дельта t при дельта t стремиться к 0 dt
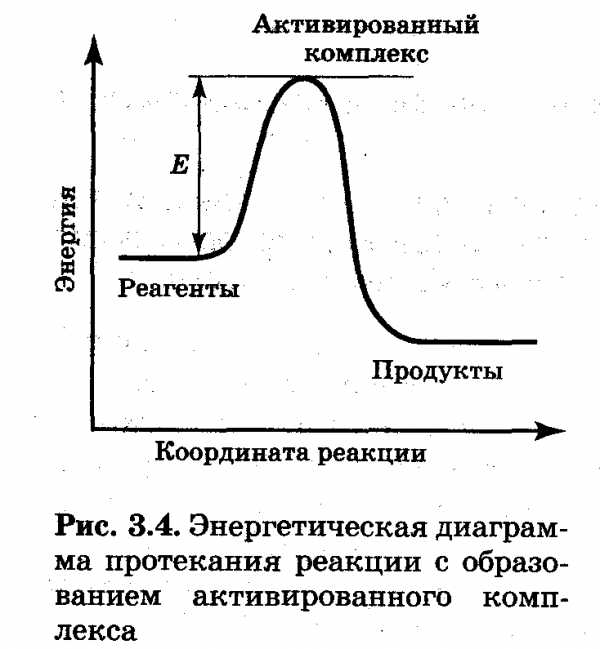
Графически, истинную скорость можно определить как тангенс угла наклона альфа касательной к кривой, изображающей зависимость скорости реакции от времени, при данном времени (рис. 3.3).
Главные факторы, определяющие скорость реакций, — это природа реагентов, наличие катализаторов, концентрации реагентов, температура.
Очень важным фактором является химическая природа реагентов. Именно из-за химического разнообразия веществ одни реакции идут медленно, а другие — очень быстро. Зависимости скоростей от природы реагентов — это специальная, очень обширная область физической химии и химической физики. Они не могут быть рассмотрены в этом учебнике. Зависимость скорости химической реакции от концентраций реагентов, температуры и наличия катализатора рассматривается в последующих разделах этой главы.
3.2. Закон действующих масс для элементарной стадии химической реакции.
В большинстве химических реакций превращение реагентов в продукты происходит не непосредственно, а через ряд промежуточных стадий, которые называют элементарными стадиями.
Механизмом химической реакции называют полную последовательность всех ее элементарных стадий.
Например, уравнение реакции синтеза йодоводорода
Н2+ I2 = 2НI
отражает лишь стехиометрию реакции, но не ее механизм. Экспериментальными исследованиями доказано, что она протекает в четыре стадии. Из них первая — это быстрая стадия диссоциации молекулы йода на свободные атомы.
Вторая стадия — взаимодействие молекулы водорода с атомом йода — также является быстрой. На этой стадии образуется промежуточное соединение Н2I.
Третья, медленная стадия проходит с образованием активированного комплекса.
Активированный комплекс — неустойчивое соединение нескольких частиц (молекул, атомов), которое возникает в какой-либо элементарной стадии в результате столкновения и взаимодействия этих частиц. (Менее прочные, чем в обычных стабильных молекулах, химические связи в активированном комплексе обозначены не сплошной чертой, а штрихами.) Четвертая стадия — распад неустойчивого активированного комплекса приводит к образованию продуктов данной элементарной стадии.
Чаще всего в элементарной стадии принимают участие две частицы (молекулы, атомы, ионы, радикалы), возможны стадии, состоящие в превращении одной частицы (например, распад или переход из одной изомерной формы в другую). Вероятность одновременного столкновения трех частиц мала, поэтому элементарные стадии с участием трех частиц редки, а с участием четырех и более частиц не известны.
Для любой элементарной стадии справедлив закон действующих масс, установленный в 1864—1867 гг. К. Гульдбергом и П. Вааге.
Скорость элементарной стадии химической реакции прямо пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции для этой элементарной стадии.
Для элементарной стадии, где реагентами, являются произвольные вещества А и В и которая описывается химическим уравнением со стехиометрическими коэффициентами а и Ь
Закон действующих масс можно описать следующим образом:
Коэффициент пропорциональности kназывают константой скорости химической реакции. Константа скорости численно равна скорости реакции, если концентрации всех реагирующих веществ равна 1 моль/л, и зависит от природы реагирующих веществ, температуры и присутствия катализатора.
Очень редки простые одностадийные реакции, механизм которых описывается их стехиометрическим уравнением. Для расчета скорости таких реакций можно использовать уравнение закона действующих масс, в которое входят стехиометрические коэффициенты реакции. Например, скорость одностадийной реакции
2NO2 = N2O4
Может быть рассчитана по уравнению:
Большинство химических реакций протекает в несколько элементарных стадий. Если одна из стадий протекает намного медленнее, чем другие, то она будет лимитирующей, определяющей скорость всей реакции в целом. В этом случае скорость суммарной реакции будет описываться уравнением закона действующих масс для лимитирующей стадии. Для реакции образования йодоводорода лимитирующей является медленная третья стадия
H2I + I = 2HI
Для нее закон действующих масс записывается так:
3.3. Зависимость скорости реакции от температуры
Скорость химической реакции с ростом температуры всегда увеличивается. При небольшом изменении температуры достаточно точным является правило Вант-Гоффа
Повышение температуры на каждые 100С увеличивает скорость реакции в 2-4 раза:
где vT— скорость реакция при исходной температуре Т;kT— константа скорости реакции при исходной температуре Т;
vT + дельта T— скорость реакции при повышенной температуре Т + дельта Т; kT + дельта T— константа скорости реакции при повышенной температуре Т + дельта Т; y — температурный коэффициент скорости реакции, принимающий значения от 2 до 4.
В широком интервале температур применимо уравнение Аррениуса:
где k— константа скорости реакции; А и Е — постоянные, е — основание натурального логарифма; R — универсальная газовая постоянная; Т — абсолютная температура.
Уравнение Аррениуса позволяет вычислить константу скорости реальных газовых реакций. Чтобы произошло взаимодействие частиц (молекул, атомов, радикалов), они должны столкнуться. За 1 с каждая молекула газа испытывает при нормальных условиях десятки миллионов столкновений. Казалось бы, все реакции в газах должны происходить мгновенно. На самом деле это не так, скорость реальных реакций в 1010 – 1029 раз меньше той, которую они должны были бы иметь, если бы все столкновения частиц приводили к их химическому взаимодействию.
Для химического взаимодействия необходимо не любое столкновение, а только геометрически удачное. Множитель А в уравнении Аррениуса характеризует число столкновений, в которых молекулы имеют нужную для взаимодействия взаимную ориентацию. Что такое геометрически удачное столкновение, можно представить себе, если рассмотреть еще раз третью стадию реакции синтеза йодоводорода (см. раздел 3.2). Удар свободного атома йода по тому атому водорода частицы Н2I, который не связан с атомом йода, геометрически удачен. В результате него образуется активированный комплекс.
Удары атома йода по другим атомам частицы Н2I не приводят к образованию активированного комплекса. Если происходит столкновение свободного атома йода, входящего в состав частицы Н2I, то последняя разрушается.
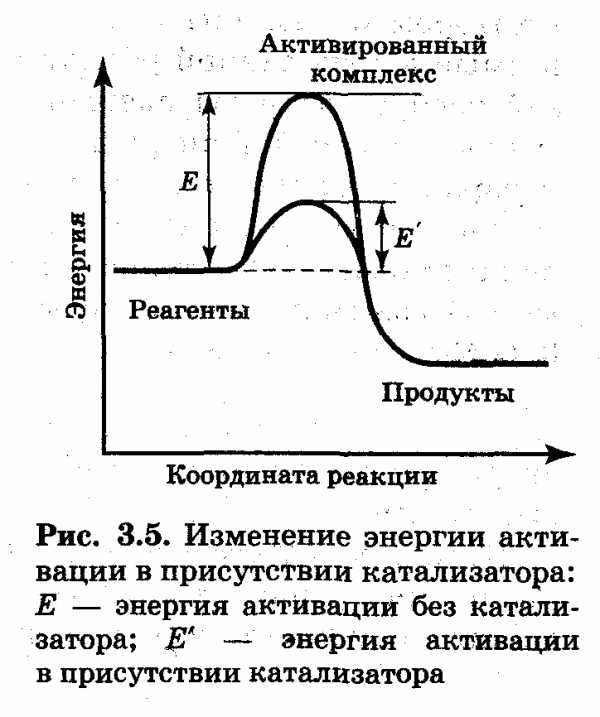
Однако не все геометрически удачные столкновения приводят к химическому взаимодействию столкнувшихся частиц. Даже при благоприятной взаимной ориентации они испытывают химическое превращение только в том случае, если кинетическая энергия столкновения достаточно велика. Чтобы столкнувшиеся молекулы могли образовывать активированный комплекс, кинетическая энергия столкновения должна равняться энергии активации или превышать ее.
Энергия активации — минимальная энергия реагентов, достаточная для того, чтобы они вступили в химическую реакцию.
Активированный комплекс представляет собой неустойчивое образование с максимальной потенциальной энергией, в котором ослаблены и удлинены химические связи, разрываемые в ходе данной реакции. Ослабление и удлинение связей требует затраты энергии. Эти затраты покрываются за счет кинетической энергии столкновения молекул реагентов, которая превращается в потенциальную энергию растяжения связей в активированном комплексе. Ход реакции можно иллюстрировать энергетической схемой, которую часто называют диаграммой преодоления энергетического барьера (рис. 3.4) Высота этого барьера Е — энергия активации. Множитель в уравнении Аррениуса равен доле столкновений, энергия которых при данной температуре превышает энергию активации.
Итак, для осуществления химического превращения молекулы должны столкнуться, имея нужную ориентацию и обладая достаточной кинетической энергией.
3.4. Катализ
Катализ играет огромную роль в биохимии и химическом производстве.
Катализ — это изменение скорости химических реакций под воздействием веществ, количество и природа которых после завершения реакции остаются такими же, как и после реакции.
Катализатор — нерасходуемый реагент, увеличивающий скорость реакции. В отличие от катализаторов ингибиторы — вещества, препятствующие протеканию реакции, они расходуются в ходе реакции. Катализ бывает гомогенным и гетерогенным. При гомогенном катализе катализатор вместе с реагентами образует раствор. Гетерогенный катализ происходит на поверхности твердого катализатора, а реагирующие вещества входят в состав газовой смеси или жидкого раствора.
Любые каталитические реакции обладают общими для них особенностями.
• Катализатор не оказывает влияния на глубину протекания реакции, т. е. на ее равновесие и константу равновесия (см. гл. 4). Он лишь ускоряет реакцию.
• Катализаторы по своему действию селективны, т. е. избирательны. Они ускоряют только одну или две-три из большого числа возможных реакций. Например, из этилового спирта можно получить следующие продукты: уксусный альдегид, этилуксусный эфир, бутадиен, ацетон, ацетилен, но каждая из реакций превращения этилового спирта проходит только в присутствии «своего» специфического катализатора.
• Ускоряющая роль катализатора объясняется тем, что активированный комплекс, образованный с участием катализатора, имеет более низкую энергию активизации, чем активированный комплекс, возникающий в отсутствие катализатора (рис. 3.5).
• Скорость реакции в присутствии катализатора пропорциональна концентрации (гомогенный катализ) или поверхности (гетерогенный катализ) катализатора.
Почти все биохимические реакции в клетках животных и растений проходят с участием ферментов.
Ферменты — белки, которые катализируют химические реакции в биологических системах.
Другое название ферментов — энзимы. В природе известны десятки тысяч ферментов. Строение многих из них сходно для растительных и животных клеток, для высших и простейших организмов. От прочих катализаторов они отличаются весьма сложным молекулярным строением, эффективностью, специфичностью и чувствительностью к внешним условиям.
Молекула фермента обычно представляет собой клубок из больших белковых цепей — глобулу. На поверхности глобулы или в особом углублении располагается сравнительно небольшой по размерам участок — активный центр, который выполняет две функции: распознавание и катализ. Распознавание субстрата — вещества, на которое способен воздействовать данный фермент, — осуществляется за счет точного соответствия между формами и размерами молекулы субстрата и активного центра, как у ключа в замке. Благодаря такому соответствию многие ферменты проявляют высокую специфичность — способность катализировать превращение только одного вещества. Подошедшая из раствора к глобуле фермента молекула субстрата связывается и ориентируется ферментом таким образом, чтобы активный центр мог осуществлять превращение субстрата. Эффективность, т. е. большая ускоряющая способность фермента объясняется тем, что фермент и субстрат образуют активированный комплекс с небольшой энергией активации. Благодаря этому скорости ферментативных реакций в 1О9—1О12 раз выше чем у обычных, неферментативных превращений. Часто для осуществления каталитического действия активного центра бывают необходимы коферменты – небольшие небелковые молекулы или катионы металлов калия, магния, марганца, меди, железа и никеля. Коферменты входят в состав образующегося в активном центре активированного комплекса с субстратом.
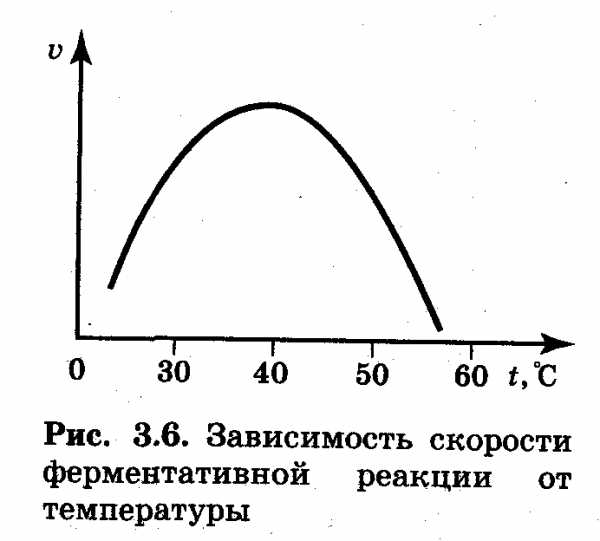
Действие ферментов в существенной степени зависит от состава раствора, в том числе от кислотности среды. Для каждого фермента существует оптимальная температура, при которой он в наибольшей степени проявляет свою каталитическую активность (рис.3.6). Вплоть до достижения этой температуры скорости ферментативных реакций возрастают в соответствии с уравнением Аррениуса. Причем числовое значение температурного коэффициента y для таких реакций может быть значительно большим, чем предсказываемое правилом Вант-Гоффа. Для большинства ферментов оптимальная температура находится в пределах от 40 до 50 °С. При более высоких температурах ферменты теряют свою активность, вследствие тепловой денатурации их белковая часть свертывается подобно тому, как свертывается при варке белок куриного яйца.
3.5. Значение химической кинетики.
Использование законов химической кинетики позволяет управлять скоростями реакций и повышать производительность химических аппаратов. Например, каталитические процессы составляют основу производства азотных удобрений, высокооктанового топлива для двигателей внутреннего сгорания, пестицидов, огромного числа других химических продуктов сельскохозяйственного и иного назначения. Более 80% химических реакций в химической промышленности проводят с использованием катализаторов.
Химическая кинетика объясняет механизмы огромного множества химических реакций, происходящих в живой клетке. Без согласования скоростей различных контролируемых ферментами биохимических реакций невозможна нормальная жизнедеятельность любой клетки. Поэтому методы генной инженерной и молекулярной биологии — это прежде всего методы управления скоростями биохимических реакций.
Некоторые кинетические закономерности проявляются в сельском хозяйстве. Например, ускорение роста растений с повышением температуры связано с тем, что с увеличением температуры возрастают скорости почти всех реакций. Разные культуры быстро развиваются при неодинаковых оптимальных температурах. В этом проявляется «настроенность» ферментативных систем растений на определенные температуры. Сельскохозяйственные продукты хранят при пониженных температурах, так как охлаждение замедляет нежелательные ферментативные процессы. Многие вещества, применяемые для протравливания семян или для консервирования, резко снижают жизнедеятельность микроорганизмов или совсем убивают их, выводя из строя их ферменты. Точно так же, вводя ингибиторы, можно воспрепятствовать действию микроорганизмов почвы, превращающих азотные удобрения в газообразный азот.
textarchive.ru
