СПИРТЫ | Энциклопедия Кругосвет
Содержание статьиСПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4
Соединения, в которых у одного атома углерода есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2® RCH=O + H2O
Спирты, содержащие три группы ОН у одного атома углерода , не существуют.
2. По типу атома углерода, с которым связана группа ОН, спирты делят на:
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1).
Рис. 1. СТРОЕНИЕ ВТОРИЧНЫХ СПИРТОВ
в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2).
Рис. 2. СТРОЕНИЕ ТРЕТИЧНЫХ СПИРТОВ
В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной.
У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите (рис. 3).
Рис. 3. СОЧЕТАНИЕ В СТРУКТУРЕ МНОГОАТОМНЫХ СПИРТОВ ПЕРВИЧНЫХ И ВТОРИЧНЫХ ОН-ГРУПП.
3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН
Непредельные спирты, у которых ОН-группа «примыкает» к двойной связи, т.е. связана с атомом углерода, участвующим одновременно в образовании двойной связи (например, виниловый спирт СН2=СН–ОН), крайне нестабильны и сразу же изомеризуются (см. ИЗОМЕРИЗАЦИЯ) в альдегиды или кетоны:
CH2=CH–OH ® CH3–CH=O
Номенклатура спиртов.
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
| СН3ОН | метиловый спирт |
| С2Н5ОН | этиловый спирт |
| (Н3С)2СНОН | изопропиловый спирт |
| С4Н9ОН | бутиловый спирт |
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы (рис. 4):
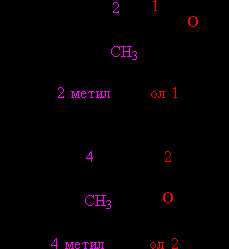
Рис. 4. СИСТЕМАТИЧЕСКИЕ НАЗВАНИЯ СПИРТОВ. Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСєС–СН2–ОН, глицерин HO–СH
Физические свойства спиртов.
Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также третичный бутанол (Н3С)3СОН – смешиваются с водой в любых соотношениях. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной, а при R, содержащем свыше 9 атомов углерода, практически исчезает.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.
Рис. 5. ВОДОРОДНЫЕ СВЯЗИ В СПИРТАХ (показаны пунктиром)
В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С, а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
1. Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2CH3OH + 2Na ® 2CH3OK + H2
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + H2O ® C2H5OH + КOH
Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую), кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
HO–CH2–CH2–OH + 2NaOH ® NaO–CH2–CH2–ONa + 2H2O
Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется.
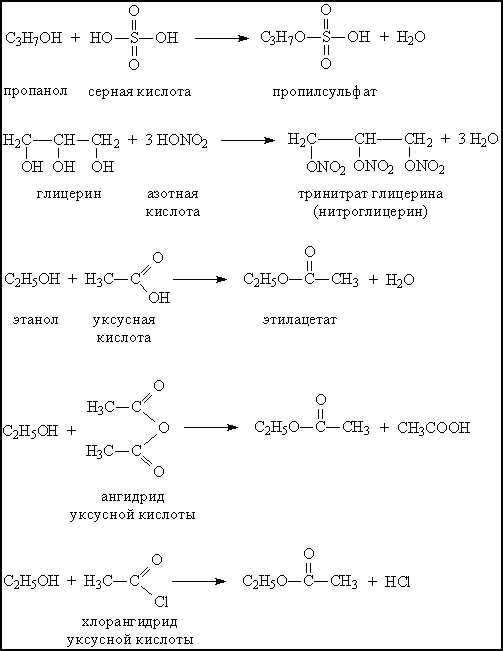
При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот (рис. 6).
При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны (рис.7)

Рис. 7. ОБРАЗОВАНИЕ АЛЬДЕГИДОВ И КЕТОНОВ ПРИ ОКИСЛЕНИИ СПИРТОВ
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула исходного спирта (рис.8).
Рис. 8. ВОССТАНОВЛЕНИЕ БУТАНОЛА
2. Реакции, протекающие по связи С–О.
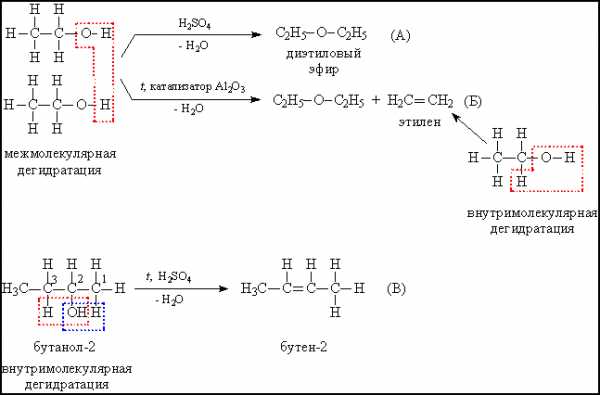
В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов (отщепление воды), при этом реакция может идти в двух направлениях:
а) межмолекулярная дегидратация с участием двух молекул спирта, при этом связи С–О у одной из молекул разрываются, в результате образуются простые эфиры – соединения, содержащие фрагмент R–О–R (рис. 9А).
б) при внутримолекулярной дегидратации образуются алкены — углеводороды с двойной связью. Часто оба процесса – образование простого эфира и алкена – протекают параллельно (рис. 9Б).
В случае вторичных спиртов при образовании алкена возможны два направления реакции (рис. 9В), преимущественное направление то, при котором в процессе конденсации отщепляется водород от наименее гидрогенизированного атома углерода (отмечен цифрой 3), т.е. окруженного меньшим количеством атомов водорода (в сравнении с атомом 1). Показанные на рис. 10 реакции используют для получения алкенов и простых эфиров.
Разрыв связи С–О в спиртах происходит также при замещении ОН-группы галогеном, или аминогруппой (рис. 10).

Рис. 10. ЗАМЕНА ОН-ГРУППЫ В СПИРТАХ ГАЛОГЕНОМ ИЛИ АМИНОГРУППОЙ
Реакции, показанные на рис. 10, используют для получения галогенуглеводородов и аминов.
Получение спиртов.
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению спиртов, например при гидролизе сложных эфиров и галогенуглеводородов (рис.11А и Б, соответственно), а также гидратацией алкенов – присоединением воды (рис.11В).
Рис. 11. ПОЛУЧЕНИЕ СПИРТОВ ГИДРОЛИЗОМ И ГИДРАТАЦИЕЙ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакция гидролиза алкенов (рис. 11, схема В) лежит в основе промышленного производства низших спиртов, содержащих до 4 атомов С.
Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии дрожжевых грибков и приводит к образованию этанола и СО2:
С6Н12О6
Брожением можно получить не более чем 15%-ный водный раствор спирта, поскольку при более высокой концентрации спирта дрожжевые грибки погибают. Растворы спирта более высокой концентрации получают перегонкой.
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20–30 МПа в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия:
СО + 2 Н2® Н3СОН
Если вместо гидролиза алкенов (рис. 11) проводить окисление, то образуются двухатомные спирты (рис. 12)
Рис. 12. ПОЛУЧЕНИЕ ДВУХАТОМНЫХ СПИРТОВ
Применение спиртов.
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений: альдегидов, кетонов, карбоновых кислот простых и сложных эфиров, применяемых в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов.
Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ (бутилацетата, бутилсалицилата и др.). В шампунях он используется как компонент, повышающий прозрачность растворов.
Бензиловый спирт С6Н5–CH2–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии — как душистое вещество.
Фенетиловый спирт С6Н5–CH2–CH2–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии.
Этиленгликоль HOCH2–CH2OH используют в производстве пластмасс и как антифриз (добавка, снижающая температуру замерзания водных растворов), кроме того, при изготовлении текстильных и типографских красок.
Диэтиленгликоль HOCH2–CH2OCH2–CH2OH используют для заполнения тормозных гидравлических приспособлений, а также в текстильной промышленности при отделке и крашении тканей.
Глицерин HOCH2–CH(OH)–CH2OH применяют для получения полиэфирных глифталевых смол, кроме того, он является компонентом многих косметических препаратов. Нитроглицерин (рис. 6) – основной компонент динамита, применяемого в горном деле и железнодорожном строительстве в качестве взрывчатого вещества.
Пентаэритрит (HOCH2)4С применяют для получения полиэфиров (пентафталевые смолы), в качестве отвердителя синтетических смол, как пластификатор поливинилхлорида, а также в производстве взрывчатого вещества тетранитропентаэритрита.
Многоатомные спирты ксилит НОСН2–(СНОH)3–CН2ОН и сорбит НОСН2– (СНОН)4–СН2OН имеют сладкий вкус, их используют вместо сахара в производстве кондитерских изделий для больных диабетом и людей страдающих от ожирения. Сорбит содержится в ягодах рябины и вишни.
Михаил Левицкий
www.krugosvet.ru
Спирты и органические кислоты
Спирты и органические кислоты — это органические соединения (углеродные соединения, производимые живыми организмами). Вино и пиво содержат этиловый спирт (этанол), но существует много других спиртов, которые в промышленности используются как растворители (жидкости, растворяющие другие вещества). Органические кислоты имеют свойства, характерные для кислот вообще: они окрашивают лакмус в красный цвет и при взаимодействии со щелочами образуют соли. Мыло — это соль, полученная при взаимодействии органической кислоты со щелочью — гидроксидом натрия.
Спирты
Спирты — органические соединения, содержащие углерод, водород и кислород. Спирты составляют гомологический ряд, т.е. группу соединений со сходными химическими свойствами. Кислород и водород образуют гидроксильную группу, которая определяет специфические свойства спиртов. Этиловый спирт (этанол) получают путем брожения или через реакцию этилена (см. статью «Органическая химия») с водяным паром (С2Н4 + Н2О = = С2Н5ОН). Этанол служит растворителем для красок, лаков и духов. В Бразилии его получают при брожении из сахарного тростника и используют как топливо. Во взрывчатых веществах используется другой спирт — глицерин.
Брожение
Брожение — химическая реакция, которую люди на протяжении тысячелетий используют для изготовления алкогольных напитков. И ныне брожение играет важную роль в производстве этанола. При брожении ферменты дрожжевого грибка (катализаторы, ускоряющие реакции в живых организмах) превращают глюкозу фруктов или зерен в этанол. При брожении сахара в виноградном соке получается вино; сидр делают из яблок, а виски — из злаков.
Органические кислоты
Уксусная кислота, придающая уксусу кислый вкус, и муравьиная кислота, жгучая жидкость муравьев, — это органические кислоты. Они относятся к группе карбоновых кислот. Другие представители этой группы — жирные кислоты — содержатся в животных жирах и растительных маслах. Кокосовое масло содержит жирные кислоты. Органические кислоты образуются при окислении спиртов, т.е. при добавлении к ним кислорода, сколько тысяч лет назад люди уже знали, что вино, содержащее этиловый спирт, при окислении превращается в уксус. Уксусная кислота используется в производстве полиэфирных синтетических волокон. В составе уксуса она используется для консервации продуктов. При реакции карбоновой кислоты со спиртом образуются так называемые сложные эфиры и вода. Эфиры придают цветам и плодам запах. Жиры и масла — это эфиры, состоящие из глицерина или гликоля (это спирты) и жирных кислот. Запахи, привлекающие насекомых к цветам, — это эфиры, соединения жирных кислот и спиртов.
Мыло и моющие средства
Моющее средство помогает воде смывать грязь. Мыло — одно из моющих средств. Есть моющие средства, не содержащие мыла. Моющие средства ослабляют притяжение между молекулами воды, и вода легче растекается по поверхности. Мыло делают из растительных масел, содержащих жирные кислоты. При нагревании масел в присутствии щелочи — гидроксида натрия — кислоты вступают в реакции со щелочью и образуют соли — мыло.
Молекулы мыла содержат ионы, расположенные па конце длинной молекулы. Заряженная сторона молекулы притягивается к воде, «хвост» — к жиру. Хвосты соединяются с частицами жира и образуют «мост» между водой и жиром. Благодаря связи с водой они способствуют отделению жира от поверхности. Не содержащие мыла моющие средства действуют таким же образом, и они не подвержены воздействию минералов в жесткой воде, в которой обычное мыло образует хлопья. Но они содержат фосфаты, способствующие избыточному росту растений в прудах и реках.
www.polnaja-jenciklopedija.ru
Спирты. Фенолы. Простые эфиры. — Электронный учебник K-tree
Свойства спиртов
Спирты — это органические соединения, имеющие функциональную группу OH-, присоединённую к насыщенному атому углерода (sp3). Соединения гидроксильной группы с sp2-гибридизацией разделяются на фенолы — с ароматическими углеводородами, и энолами — с алифатическими углеводородами.
Спирты можно рассматривать как производные воды. Физические и химические свойства спиртов обусловлены наличием гидроксильной группы. Высокая электроотрицательность кислорода вызывает полярность связи O-H, что позволяет спиртам образовывать водородные связи.
Водородная связь является причиной высокой температурой кипения и растворимостью в воде спиртов с низкой молекулярной массой. С ростом углеродного скелета, уменьшается растворимость спиртов в воде и увеличивается растворимость в органических соединениях. Физические свойства фенолов схожи с физическими свойствами спиртов.
Спирты разделяются на первичные, вторичные и третичные, согласно количеству углеводородных групп, присоединённых к атому углерода, связанному с группой OH.
Существует четыре типа реакции со спиртами: с кислотой и основанием, окисление и замещения.
Существует огромное количество различных способов получения спиртов из других соединений, но в промышленности наибольшее применение получили представленные ниже.
Из альдегидов и кетонов
Наилучшим способом приготовления спиртов являются реакции с реактивами Гриньяра (формула R-Mg-X и Ar-Mg-X). Группа Mg-X имеет слабый положительный заряд, группа R или Ar — слабый отрицательный. Вследствие разрыва пи-связи в карбонильной группе, углерод получает положительный заряд, кислород — отрицательный. Таким образом, группа Mg-X присоединяется к кислороду, группа R/Ar — к углероду. Образованное соединение обрабатывается слабым раствором соляной кислоты, в результате получается спирт и дигалогенированный магний.
Механизм получения спиртов из альдегидов и кетонов:
RR-C=O + Rδ--(Mg-X)δ+ → RR-C(-R)-O-Mg-X
RR-C(-R)-O-Mg-X + H+Cl— → RRR-C-OH + MgClX
Из монооксида углерода
Самые важные в промышленности спирты — это метанол и этанол. На данный момент, большое количество метанола производится каталитической редукцией монооксида углерода в присутствии водорода:
В присутствии Cu-ZnO-Cr2, O3 при температуре 250°C, 50-100 атм
CO + 2H2 → CH3OH
Этанол получают гидратацией этилена или ферментацией сахара из крахмала, ячменя или других зерновых культур:
В присутствии дрожжей:
C6H12O6 → 2CH3CH2OH + 2CO2
На сегодняшний день большая часть этанола производится каталитической гидратацией этилена кислотой. Серная кислота образует алкилсерную кислоту, которая затем разбавляется водой и нагревается, что вызывает процесс гидролиза:
C2H4 + H+[OSO3H]— → CH3CH2OSO3H
CH3CH2OSO3H + H2O → CH3CH2OH + H2SO4
Простые эфиры
Формула простого эфира (этера) — R-O-R и Ar-O-R. Атом кислорода, связывающий две карбоновые группы.
Электроотрицательность кислорода в молекулах эфиров создаёт дипольный момент, что повышает температуру кипения эфиров по сравнению с соответствующими алканами. Поскольку в эфирах кислород не соединён с атомом водрода, температура кипения спиртов значительно выше, чем температура кипения эфиров.
Эфиры, за исключением диметилового эфира и метилэтилового эфира, нерастворимы в воде. Так, например, диэтиловый эфир используется для отделения органических соединений из водных растворов, не реагируя с ионными соединениями.
Диэтиловый эфир используется в качестве растворителя нитроцелюлозы, которая используется в красках и взрывчатых веществах. Трет-бутилметиловый эфир используют для увеличения октанового числа.
Получение фенолов
Фенол получают реакцией нуклеофильного замещения молекулы хлорбензола (метод Доу). Процесс заключается в щелочном гидролизе при высоких температуре и давлении:
слабый раствор NaOH, 300°, 200 атм
C6H6Cl → C6H6O—Na+
HCl
C6H6O—Na+ → C6H6OH
Применение фенолов
Фенол и его производные имеют важное значение в промышленности, в частности, из фенолов получают лекарственные препараты, такие как аспирин и эпинефрин.
Первые препараты для дезинфекции были фенолами. Все фенолы обладают бактерицидными свойствами, которые усиливаются с каждой алкил-группой, присоединённой к кольцу. Лучшими бактерицидными свойствами обладают фенолы с шестью алкил-группами, например гексилрезорцин (1,3-диокси-4-н-гексилбензол, C12H18O2). Фенол является мерой для «силы» бактерицидного действия других препаратов.
Хлорфенолы повсеместно используются для обеззараживания, против бактерий и грибков. Например, пентахлорфенол — прекрасный фунгицид, сохраняющий дерево и защищающий его от термитов и влажности.
k-tree.ru
Органическая химия — Спирты
Содержание
а) Строение
б) Физические и химические свойства
в) Получение и применение
Дополнительная литература
3.Охрана окружающей среды
1.Стрение этилого спирта.
Этиловый спирт С8Н6О-бесцветная жидкость со своебразным законом, легче воды Р=0,8г/см, кипит при t-78,3 С, хорошо растворяется в воде и сам является растворителем многих неорганических и органических веществ. Зная молекулярную формулу спирта и валентность элементов, попытаемся изобразить его строение.
Напишим две структурные формулы.
Н Н Н Н
Н-С-О-С-Н (1) Н-С-С-О-Н
Н Н Н Н
Сопостовляя формулы, мы замечаем, что если справидлива первая из них, то в молекуле спирта все атомы водорода соеденены с молекулами углерода, и можно предполагать, что они одинаковы по свойствам. Если же истинна вторая формула, то один атом водорода в молекуле соединён с атомом углерода через кислород и он, по-всевидимому, будет отличаться от других водородных атомов. Оказывается, можно проверить опытом, одинаковы или различны по свойствам атомы в спирте.
Поместим в пробирку со спиртом (не содержащий воды) кусочек натрия. Начинается реакция, сопровождающаяся выделением газа. Нетрудно установить, что это водород. При помощи другого, более сложного опыта можно определить, сколько атомов водорода выделяется при реакции из каждой молекулы спирта. В колбу с мелкими кусочками натрия (рис.1) приливается по каплям из воронки определённое количество спирта Выделяющийся из спирта водород вытесняет воду из двугорлой склянки в цилиндр. Обьём вытесненной воды в цилиндре соответствует обьёму выделевшегося водорода .Опыт показывает, что из 0,1 моль спирта удаётся получить 1,12л. водорода. Это означает, что из 1 моль спирта натрий вытесняет 1,12л. т. е. 0,5 моль водорода.
Иначе говоря, из каждой молекулы спирта натрием вытесняется только один атом водорода. Формула (1) не даёт обьяснения такому факту. Согласно этой формуле все атомы водорода равноцены. Наоборот, формула (2) отражает наличие одного атома, находящегося в особом положении: он соединён с атомом углерода через кислород; можно заключать, что именно этот атом водорода связан менее прочно. Он и вытесняется натрием. Следовательно вторая из приведёных формул и будет структурной формулой этилого спирта. Чтобы подчеркнуть, что в молекуле спирта содержится гидроксильная чруппа-ОН, соединённая с углеводородным радикалом, молекулярную формулу этилового спирта часто пишут так :
СН3-СН2-ОН или С2Н5ОН
Очивидно, здесь мы снова встречаемся с влиянием атомов друг на друга. Чтобы понять сущность этого влияния, обратимся к электроному строению молекулы. Характер связей С-СuC-Н нам уже хорошо известен — это ковалентные q -связи. Атом О2 образует с атомом «H» и с углеводородным радикалом такие же связи, при этом его наружный электронный слой дополняется до октета .
Формула спирта в таком случае можно изобразить так :
Н Н
Н С С О Н
Н Н
Однако распределение электронной плотности в молекуле спирта не такое равномерное, как в углеродах. Связь О-Н полимерная, так как наибольшая электронная плотность её смещена к атому О2, как элементу более электроотрицательному. Атом «Н» оказывается как бы более свободным от электронов, менее связаным с молекулой и поэтому может сравнительно легко вытесняется натрием. Смещение электронной плотности можно показать в формуле следующим образом
Н Н
Н-С-С-О Н
Н Н
Атом кислорода образует ковалентные связи с другими атомами под некоторым углом друг к другу, а не по прямой линии. Вспомним, что в наружном электронном слое наряду с двумя спаренными S-электронами и двумя спаренными р-электронами имеются два неспареных р-электрона. Оси этих электронных облаков взаимно перпендикулярно. В направлении их и образуются ковалентные связи атома кислорода с другими атомами (фактически в следствии гибридизации и действия других факторов валентный угол несколько отклоняется от прямого). Мы знаем, что молекуле воды имеет подобное пространственное строение.
Гомологический ряд спиртов .
Этиловый спирт -один из членов гомологического ряда .
Другие спирты ряда имеют аналогичное химическое и электронное строение. Первый член ряда метиловый спирт .
Н
Н -С -О -Н
Н
Ближащий следующий гомолог этилого спирта пропиловый спирт.
Н Н Н
Н -С -С -С -О -Н
Н Н Н
В молекулах спиртов может содержаться не одна, а две и больше гидроксильных групп как мы уже видели на примере реакции с натрием и убедимся ещё далее, наличие гидроксильных групп в молекулах обусловливает характерные химических свойства спиртов, т. е. их химическую функцию.
Такие группы атомов называются функциональными группами.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединённых с углеводородным радикалом
Они могут расматриваться поэтому как производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы.
Спирты приведённого высше ряда можно считать производно предельных углеводоров, в молекулах которых один атом водорода заменён на гидроксильную группу. Это гомологический ряд предельных одноатомных спиртов. Общая формула веществ этого ряда СпН2п+ОН или R-OH .
Таблица № 1 Гомологический ряд предельных одноатомных спиртов.
Название спиртов | Формула | Температура кипения (t) |
Метиловый (метанол) Этиловый (этанол) Пропиловый (пропанол-1) Бутиловый (бутанол-1) Аниловый (пентанол-1) Гексиловый (гексанол-1) Гептиловый (гептанол-1) | СН3ОН С2Н5ОН С3Н7ОН С4Н9ОН С5Н11ОН С6Н13ОН Страницы: 1 2 3 4 |
www.55referatov.ru
Спирты Википедия
Модель молекулы простейшего спирта — метанолаСпирты́ (от лат. spiritus — дух; устар. алкого́ли, от араб. الكحول аль-кухуль — порошок[1]) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящимся в состоянии sp³-гибридизации) атомом углерода[2]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
В номенклатуре ИЮПАК для соединений, в которых гидроксильная группа связана с ненасыщенным (sp²-гибридным) атомом углерода, рекомендуются названия «енолы» (гидроксил связан с винильной C=C-связью)[3] и «фенолы» (гидроксил связан с бензольным или другим ароматическим циклом)[4].
Спирты представляют собой обширный и разнообразный класс соединений: они весьма распространены в природе и часто выполняют важные функции в живых организмах. Спирты являются важными соединениями с точки зрения органического синтеза, не только представляя интерес как целевые продукты, но и как промежуточные вещества, имеющие ряд уникальных химических свойств. Кроме того, спирты являются промышленно важными продуктами и находят широчайшее применение как в промышленности, так и в повседневных приложениях.
ru-wiki.ru
Реферат — Спирты — Органическая химия
1.Стрение этилого спирта.Этиловый спирт С8Н6О-бесцветная жидкость со своебразным за-
коном, легче воды Р=0,8г/см, кипит при t-78,3 С, хорошо раство-
ряется в воде и сам является растворителем многих неорганиче-
ских и органических веществ. Зная молекулярную формулу спирта
и валентность элементов, попытаемся изобразить его строение.
Напишим две структурные формулы.
Н Н Н Н
Н-С-О-С-Н (1) Н-С-С-О-Н
Н Н Н Н
Сопостовляя формулы,мы замечаем, что если справидлива первая из них, то в молекуле спирта все атомы водорода
соеденены с молекулами углерода, и можно предполагать,
что они одинаковы по свойствам. Если же истинна вторая
формула, то один атом водорода в молекуле соединён с атомом
углерода через кислород и он, по-всевидимому, будет отличаться
от других водородных атомов. Оказывается, можно проверить
опытом, одинаковы или различны по свойствам атомы в спирте.
Поместим в пробирку со спиртом (не содержащий воды)
кусочек натрия. Начинается реакция, сопровождающаяся выделением газа. Нетрудно установить, что это водород. При
помощи другого, более сложного опыта можно определить,
сколько атомов водорода выделяется при реакции из каждой
молекулы спирта. В колбу с мелкими кусочками натрия (рис.1)
приливается по каплям из воронки определённое количество спирта
Выделяющийся из спирта водород вытесняет воду из двугорлой
склянки в цилиндр. Обьём вытесненной воды в цилиндре
соответствует обьёму выделевшегося водорода.Опыт показывает,
что из 0,1 моль спирта удаётся получить 1,12л. водорода. Это
означает, что из 1 моль спирта натрий вытесняет 1,12л. т.е.
0,5 моль водорода.
Иначе говоря, из каждой молекулы спирта натрием вытесняется
Только один атом водорода. Формула (1) не даёт обьяснения
такому факту. Согласно этой формуле все атомы водорода равноцены. Наоборот, формула (2) отражает наличие одного атома,
находящегося в особом положении : он соединён с атомом углерода через кислород ; можно заключать, что именно этот
атом водорода связан менее прочно. Он и вытесняется натрием.
Следовательно вторая из приведёных формул и будет структурной
формулой этилого спирта. Чтобы подчеркнуть, что в молекуле
спирта содержится гидроксильная чруппа-ОН, соединённая с
углеводородным радикалом, молекулярную формулу этилового
спирта часто пишут так :
СН3-СН2-ОН или С2Н5ОН
Очивидно, здесь мы снова встречаемся с влиянием атомов друг
на друга. Чтобы понять сущность этого влияния, обратимся к
электроному строению молекулы. Характер связей С-СuC-Н нам
уже хорошо известен – это ковалентные q –связи. Атом О2 образует с атомом “H” и с углеводородным радикалом такие же
связи, при этом его наружный электронный слой дополняется до октета.
Формула спирта в таком случае можно изобразить так :
Н Н
Н С С О Н
Н Н
Однако распределение электронной плотности в молекуле спирта
не такое равномерное, как в углеродах. Связь О-Н полимерная,
так как наибольшая электронная плотность её смещена к атому
О2, как элементу более электроотрицательному. Атом “Н” оказывается как бы более свободным от электронов, менее
связаным с молекулой и поэтому может сравнительно легко
вытесняется натрием. Смещение электронной плотности можно
показать в формуле следующим образом
Н Н
Н-С-С-О Н
Н Н
О пространственном расположении атомов в молекуле спирта
дают представление модели, изображённые на (рисунки 2)
Как видим, атом кислорода образует ковалентные связи с
другими атомами под некоторым углом друг к другу, а не по
прямой линии. Вспомним, что в наружном электронном слое
наряду с двумя спаренными S-электронами и двумя спареными
р-электронами имеются два неспареных р-электрона. Оси этих
электронных облаков взаимно перпендикулярно. В направлении их и образуются ковалентные связи атома кислорода с другими
атомами (фактически в следствии гибридизации и действия других факторов валентный угол несколько отклоняется от
прямого). Мы знаем, что молекуле воды имеет подобное пространственное строение.
Гомологический ряд спиртов.
Этиловый спирт –один из членов гомологического ряда.
Другие спирты ряда имеют аналогичное химическое и электронное строение. Первый член ряда метиловый спирт.
Н
Н –С –О –Н
Н
Ближащий следующий гомолог этилого спирта пропиловый спирт.
Н Н Н
Н –С –С –С –О –Н
Н Н Н
В молекулах спиртов может содержаться не одна, а две и больше гидроксильных групп как мы уже видели на примере
реакции с натрием и убедимся ещё далее, наличие гидроксильных
групп в молекулах обусловливает характерные химических свойства спиртов, т.е. их химическую функцию.
Такие группы атомов называются функциональными группами.
Спиртами называются органические вещества, молекулы которых
содержат одну или несколько функциональных гидроксильных
групп, соединённых с углеводородным радикалом
Они могут расматриваться поэтому как производные углеводородов,
в молекулах которых один или несколько атомов водорода
заменены на гидроксильные группы.
Спирты приведённого высше ряда можно считать производно
предельных углеводоров, в молекулах которых один атом водорода заменён на гидроксильную группу. Это гомологический
ряд предельных одноатомных спиртов. Общая формула веществ
этого ряда СпН2п+ОН или R-OH.
Таблица №1 Гомологический ряд предельных одноатомных спиртов.
Название спиртов Формула Температуракипения (t)
Метиловый (метанол)Этиловый (этанол)Пропиловый (пропанол-1)Бутиловый (бутанол-1)Аниловый (пентанол-1)Гексиловый (гексанол-1)Гептиловый (гептанол-1) СН3ОНС2Н5ОНС3Н7ОНС4Н9ОНС5Н11ОНС6Н13ОНС7Н15ОН 64,778,397,2117,7137,8157,2176,3
Согласно систематической номеклатуре названия спиртов,
производится от названий спиртов, соответствующих углеводородов с добавлением суфикса -0^ ; цифрой указывают атом углерода при
котором находится гидроксильная группа. Нумерацию углеродных
атомов начинают с того конца, к которому ближе функциональная
группа.
Изомерия спиртов обуславливается как изомерией углеводородного
скелета, так и положением гидроксильной группы.
Химические свойства.
Спирты горят при поджигании, выделяет кислоту, например:
С2Н5ОН+3О2 -2СО+3Н2О+137
однако при горении у них наблюдаются и различия. Нальём по одному миллилитру разных спиртов в форфоровые чашки и подожжём жидкости. Заметим, что спирты –первые члены ряда –
легко воспламеняются синеватым почти не светящимся пламенем, и
после сгорания их остаётся чёрный налёт.
Взаимодействие этилого спирта с натрием.
2С2Н5ОН+2Na –2C2Н5Оna+h3
Продукт замещения водорода в э.с. называется этилатом натрия, он может быть выделен после реакции в твёрдом виде. Также реагируют
со щелочными металлами другие растворимые спирты образуя
соответствующие алкоголиенты.
Однако спирты к классу кислот не относятся, так как степень дисоциации их крайне незначительна, даже меньше чем у воды, их
растворы неизменяют окраску индикаторов.
Положение степени дисоциации спиртов по сравнению с водой можно
обьяснить влиянием углеводородного радикала : смещение радикалом
электронной плотности связи. 6 –0 в сторону атома кислород ведёт
к увиличению на последнем частичного отрицательного заряда вседствии чего он прочнее удерживает атом водорода.
Можно повысить стпень, если в молекулу ввести заместитель
притягивающий к себе электроны химической связи. Так, степнь
дисоциации если 2 –хлорэтанола ClCu2 –Ch3OH возрастает в несколько
раз по сравнению с этанолом (этиловым спиртом).
У спиртов может вступать не только гидроксильный атом водорода,
но и вся гидроксильная группа. Если в колбе с присоеденённым к ней холодильником нагревать этиловый спирт с галогеноводородной
кислотой, например с бромоводородной (для образования бромоводорода берут смесь бромида калия или бромида натрия с
серной кислотой), то через некоторое время можно заметить, что в
пробирке под слоем воды собирается тяжёлая жидкость–броэтан.
С2Н5ОН+НBr–С2Н5Br+h3O
Эта реакция тоже идёт с ионым расщиплением ковалентной связи С-О
Она напоминает нам реакцию оснований и этилового спирта, образуется бромистан.
При нагревании с концентрированной кислотой в качестве католизатора
спирты легко дигидратируются, т.е. отщепляет воду. Из этилового
спирта при этом образуется этилен.
Н Н
Н –С –С –Н –СН2=СН2+Н2О
Н ОН
Дигидрация последующих ломологов приводит к получению других
непредельных углеводородов.
Н Н Н
Н –С –С –С –Н СН3 –СН =СН2+Н2О
Н Н ОН
При несколько иных условиях дигидрация спиртов может, происходить с отщиплением молекулы воды не от каждой молекулы
спирта, а от двух молекул. Так, при более слабом нагревания этилового спирта с серной кислотой (не выше +140 С и при избытке
спирта) диэтиловый эфир.
С2Н5ОН+ОНС2Н5 –С2Н5 –О –С 2Н5+Н2О
Диэтиловый эфир –летучая, легко воспламеняющаяся жидкость, применяют в медицине в качестве наркоза. Он относится к классу простых эфиров–органических веществ, молекулы которых состоят из
двух углеводородных радикалов, соединёных посредственно атома
кислорода.
С диэтиловым эфиром мы встречались когда выяснили строение этилового спирта. Из двух возможных структур отвечающих формуле
С2Н6О, мы выбрали одну позволяющую понять свойства спирта. Другая не принетая нами формула хотя она также отвечает правилом
важности, выражает стрение диментилового эфира. Имея одну и эту же молекулярную формулу, эти вещества, следовательно, являются изомерами, принадлежат к различным классам органических соединений.
Физические свойства.
Вы, несомненно обратили внимание, что, в отличие от ранее рассматривавшихся предельных и непредельных углеводородов, в данном гамологическом ряду ней газообразных веществ, уже первый член ряда –метиловый спирт –жидкость. Как обьяснить такое повышение
температуры кипения веществ. Может тем, что при вступлении атома
кислорода в молекулу сильно возрастёт молекулярная масса вещества
Но у метилового спирта молекулярная масса –32, у пропана –44, однако и он представляет собой газообразное вещество. Тогда что же
удерживает молекулы метилового спирта, сами по себе довольно лёгкие, в жидком состоянии ?
В молекулах спирта, как мы выяснили, углеводородный радикал и атом кислорода не на одной прямой, а под некоторым углом друг к другу. У атома О2 имеются ещё свободные электронные пары. Поэтому он может взаимодействовать с атомом водорода другой молекуы, имеющий некоторый положительный заряд в результате
смещения электронов к атому кислороду (рис.3 а). Так между атомами возникает водородная связь, которая обозначается в формулах
точками :
Прочность водородной связи значительно меньше обычной ковалентной связи (примерно в десять раз). За счёт водородных связей молекулы спирта оказываются ассоциированными, как бы прилипли друг к другу. Поэтому на разрыв этих связей необходимо затратить дополнительную энергию, чтобы молекулы стали свободными и вещество преобрело летучесть. Это и является причиной более высокой температуры кипения всех спиртов по сравнению с соответствующими углеводородами. Теперь можно понять почему вода при такой небольшой молекулярной массе имеет необычно высокую температу кипения (рис.35).
Водородные связи могут установливаться и между молекулами спирта
и воды (рис.31в). Именно этим обьясняется растворимость спиртов в отличие от углеводородов, которые из-за малой полярности связей
С–Н не образуют с водой водородных связей и поэтому не растворяется в ней. норастворимость спиртов в воде (вспомним, что члены гамологических рядов при сходстве свойств имеют индивидуальные различия). Если в равные обьёмом воды в стаканчиках
мы прильём по одинаковому обьёму (например 5мл.), метилового,
пропилового, этилового, бутилового и аминового спиртов и перемешаем
жидкости, то заметим, что первые три спирта расворяются полностью
а бутиловый и особенно аминовый спирты в меньшей степени. Понижение растворимости можно обьяснить тем, что, чем больше углеводородный радикал в молекуле спирта, тем труднее гидроксильной группе удержать такую молекулу в растворе за счёт образования водородных связей (углеводороды в воде не растворимы)
Применение и получение спиртов.
Получение.
До начала 30-х годов 20 века его получали исключительно сбраживанием пищ углеводсодержащего сырья, и при обработки зерна
(рожь, ячмень, кукуруза, овёс, просо). В 30-е по 50-е годы было разработанно несколько способов синтеза Э.С. из химического сырья
например : лидрирования ацентальдецида и д.р.. Оси современных способов –односейадистная (прямая) гидраитация. Этилена
(CU2=CU2+h3O –C2H5OH), осуществляется на фосфорно-кислотном
католизаторе при 280-300 С и 7,2-8,3 Мн/м (72-83 кг/см ). Так, в США
в 1976 г. было выработано около 800 тыс. тонн этонола, в т.ч. 550 тыс. тонн прямой гидротацией (остальное сбраживание пищевого сырья). В других странах (СССР, Франция и др.) Э.С. получают также двухстадийной (сернокислотной гидраитацией этилена при :
75-80 С и 2,48 Мн/м/24,8 нес/м ) этилен взаимодействует с
концетрированой серной кислотой с образованием смеси моно и
диэнтилеульфатов [С2Н5OSO2ОН и (С2Н5О)2SO2], которые затем
гидрилизуясь при 100 С и 0,3-0,4 Мн/м дают Э.С. и Н2SO4.
В ряде стран Э.С. получают также сбраживанием продуктов гидролиза растительных материалов. Очистку технических Э.С.
проводят различными способами. Пищевой спирт-сырец, обычно освобождают от примесей (сивушные масла и др.) рекитификацией.
Слинтентичиский Э.С. очищают от этилового эфира, ацетальдегида и др. рекитификаций в присутствии щёлочи и гидрированием в паровой
фазе на никелевых католизаторах при 105 С и 0,52 Мн/м (5,2 кгс/см)
Спирт –рекитификат представляет собой асеотропную смесь Э.С. с
Водой (95,57% спирта t кипения 78,15 С. ). Для многих целей требуется обезвоженый, Т.Н. абсолютный, Э.С. Последний в промышленности готовят, воду в виде стройной азеотропной смеси вода-спирит-бензол (специальная добавка), а в лабороторных условиях-
химическом связыванием воды различными реагентами, окисью кальция, металлическим кальцием или магнием Э.С., предназначеный для технических и бытовых целей, иногда денантурируют.
Применение.
На многих производствах спирты применяются в качестве растворителей. В химической промышленности они используются для
различных синтезов. Метиловый спирт в больших количествах идёт на получение формальдегида, используемого в производстве пластмасс
уксусной кислоты и других органических веществ. В настоящее время
разрабатывается много новых технологических процессов на основе использования метилового спирта как исходного продукта, поэтому значение его в промышленном производстве нужных народному хозяйству, веществ и материалов будет всё более возрастать.
Перспективным считается использование метилового спирта в качестве
моторного топлива т.к. добавка его к бензину повышает актановое число горючей смеси и снижает образование вредных веществ в выхлопных газах.
Этиловый спирт в больших количествах идёт на производство синтетического каучука. Окислением спирта получают пищевую уксусную кислоту. Путём его дигидратации готовят диэтиловый (медицинский) эфир, с взаимодействием с хлороводородом получают хлорэтан, для местной анестозии. Спирт применяется при изготовлении
многих лекарств. В парфюмерии он идёт на изготовление духов и адеколонов.
Охрана окружающей среды.
Спирты оказывают негативное воздействие на организм. Особенно ядовит метиловый спирт. Самое незначительное количество его при
приёме внутрь разрушает зрительный нерв и вызывает необратимую
слепоту. 5-10 мл спирта вызывает сильное отравление организма, а 30 мл могут привести к смертельному исходу. Этиловый спирт-наркотик, при приёме внутрь он вследствие высокой растворимости быстро всасывает в кровь и сильно действует на организм. Под влиянием спиртного у человека ослабляется внимание затормаживается
реакция нарушается корреляция движения, появляется развязанность,
грубость в поведении и т.д., всё это делает его неприятным в обществе. Но вследствии употребления алкоголя ещё более опасны, т.к. у пьющего человека появляется привыкание, погубное пристрастие
к нему и в конце в концов он тяжело заболевает алкоголизмом. Спирт поражает слизистые оболочки желудочно-кишечного тракта, что
ведёт к возникновению гастрита язвенной болезни желудка, двенадцатой кишки. Печень, где должно происходить разрушение спирта, не справляясь с нагрузкой, начинает перерождаться в результате возможен цирроз. Проникая в головной мозг спирт отравляюще действует на нервные клетки, что проявляется в нарушении сознания, речи, умственных способностей, в появлении, тяжёлых психических растройств и ведёт к деградации личности. Особенно опасен алкоголь для молодых людей, так как в растущем организме интенсивно протекают процессы обмена веществ и они особенно чувствительны к алкоголическому воздействию. Поэтому у молодых быстрея, чем у взрослых, может появиться заболевание – алкоголизм.
Все виды спиртного должны быть полностью исключены из жизни молодёжи !!!
www.ronl.ru
Спирты Спирты органические вещества в которых
 Спирты.
Спирты.
 Спирты – органические вещества в которых углеводородный радикал связан с гидроксильной группой —ОН. R—ОН Общая формула предельных одноатомных спиртов – Сn. H 2 n+1 OH. Функциональная группа – группа атомов, которая определяет наиболее характерные свойства вещества и его принадлежность к определенному классу соединений.
Спирты – органические вещества в которых углеводородный радикал связан с гидроксильной группой —ОН. R—ОН Общая формула предельных одноатомных спиртов – Сn. H 2 n+1 OH. Функциональная группа – группа атомов, которая определяет наиболее характерные свойства вещества и его принадлежность к определенному классу соединений.
 Реакция фотосинтеза составляет основу цепочки природных взаимопревращений кислородсодержащих органических соединений: |
Реакция фотосинтеза составляет основу цепочки природных взаимопревращений кислородсодержащих органических соединений: |
 Глюкоза под действием ферментов превращается в этиловый спирт. Процесс – спиртовое брожение:
Глюкоза под действием ферментов превращается в этиловый спирт. Процесс – спиртовое брожение:
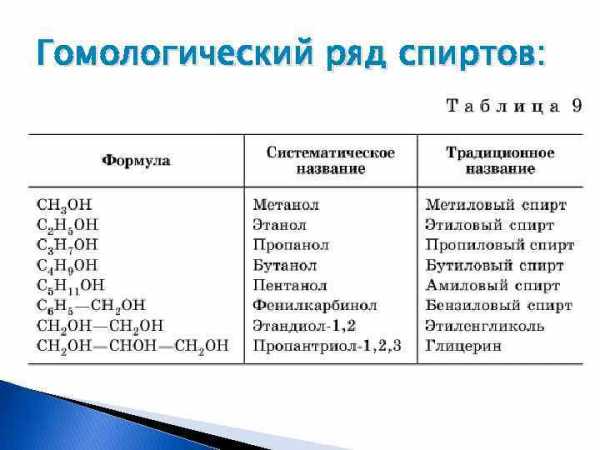 Гомологический ряд спиртов:
Гомологический ряд спиртов:
 Классификация спиртов По числу гидроксильных групп одноатомные CH -OH метиловый спирт 3 C 4 H 9 -OH бутиловый спирт многоатомные Двухатомные CH -OH 2 | CH 2 -OH Этиленгликоль, Этандиол -1, 2 Трехатомный CH 2 -CH-CH 2 | | | OH OH OH Пропантриол -1, 2, 3 (глицерин) Многоатомный CH 2 -CH-CH-CH 2 | | | OH OH OH Гексаол (Сорбит)
Классификация спиртов По числу гидроксильных групп одноатомные CH -OH метиловый спирт 3 C 4 H 9 -OH бутиловый спирт многоатомные Двухатомные CH -OH 2 | CH 2 -OH Этиленгликоль, Этандиол -1, 2 Трехатомный CH 2 -CH-CH 2 | | | OH OH OH Пропантриол -1, 2, 3 (глицерин) Многоатомный CH 2 -CH-CH-CH 2 | | | OH OH OH Гексаол (Сорбит)
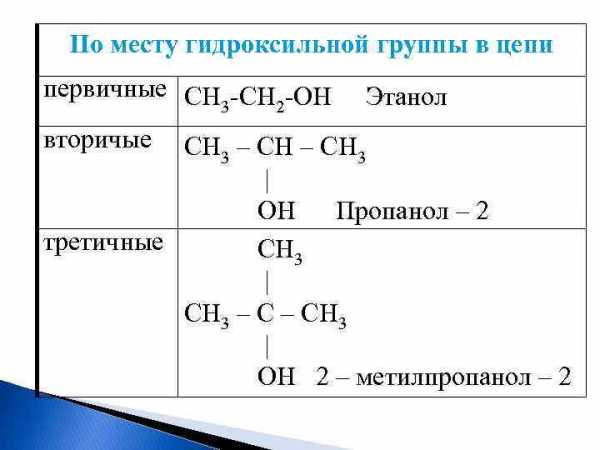 По месту гидроксильной группы в цепи первичные CH -OH 3 2 вторичые Этанол CH 3 – CH 3 | OH Пропанол – 2 третичные CH 3 | CH 3 – CH 3 | OH 2 – метилпропанол – 2
По месту гидроксильной группы в цепи первичные CH -OH 3 2 вторичые Этанол CH 3 – CH 3 | OH Пропанол – 2 третичные CH 3 | CH 3 – CH 3 | OH 2 – метилпропанол – 2
 Изомерия спиртов: 1. Изомерия углеродного скелета. CH 3 – CH 2 – OH бутанол – 1 CH 3 – CH 2 – OH 2 – метилпропанол – 1 | CH 3 2. Изомерия положения функциональной группы. CH 3 – CH 2 – OH бутанол – 1 CH 3 – CH 2 – CH 3 бутанол – 2 | OH 3. Межклассовая CH 3 – O – CH 3 Диметиловый эфир CH 3 – CH 2 – OH этиловый спирт
Изомерия спиртов: 1. Изомерия углеродного скелета. CH 3 – CH 2 – OH бутанол – 1 CH 3 – CH 2 – OH 2 – метилпропанол – 1 | CH 3 2. Изомерия положения функциональной группы. CH 3 – CH 2 – OH бутанол – 1 CH 3 – CH 2 – CH 3 бутанол – 2 | OH 3. Межклассовая CH 3 – O – CH 3 Диметиловый эфир CH 3 – CH 2 – OH этиловый спирт
 Химические свойства спиртов: 1) Горение: 2) Реакция дегидратации: А) внутримолекулярная дегидратация: Б) межмолекулярная дегидратация:
Химические свойства спиртов: 1) Горение: 2) Реакция дегидратации: А) внутримолекулярная дегидратация: Б) межмолекулярная дегидратация:
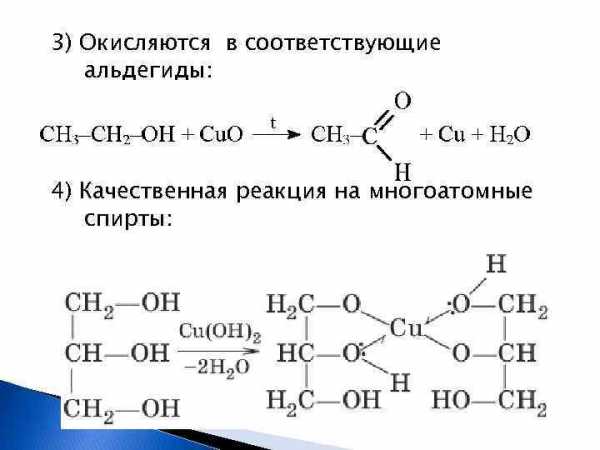 3) Окисляются в соответствующие альдегиды: 4) Качественная реакция на многоатомные спирты:
3) Окисляются в соответствующие альдегиды: 4) Качественная реакция на многоатомные спирты:
 Решаем задачу: Определите молекулярную формулу органического вещества, если в нем содержится 80% углерода и 20% водорода, а плотность его паров по воздуху равна 1, 034.
Решаем задачу: Определите молекулярную формулу органического вещества, если в нем содержится 80% углерода и 20% водорода, а плотность его паров по воздуху равна 1, 034.
 Домашнее задание: § 35, № 2, 5, с. 216
Домашнее задание: § 35, № 2, 5, с. 216
present5.com
