СПИРТЫ | Энциклопедия Кругосвет
Содержание статьиСПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4
Соединения, в которых у одного атома углерода есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2® RCH=O + H2O
Спирты, содержащие три группы ОН у одного атома углерода , не существуют.
2. По типу атома углерода, с которым связана группа ОН, спирты делят на:
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1).
Рис. 1. СТРОЕНИЕ ВТОРИЧНЫХ СПИРТОВ
в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2).
Рис. 2. СТРОЕНИЕ ТРЕТИЧНЫХ СПИРТОВ
В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной.
У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите (рис. 3).
Рис. 3. СОЧЕТАНИЕ В СТРУКТУРЕ МНОГОАТОМНЫХ СПИРТОВ ПЕРВИЧНЫХ И ВТОРИЧНЫХ ОН-ГРУПП.
3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН
Непредельные спирты, у которых ОН-группа «примыкает» к двойной связи, т.е. связана с атомом углерода, участвующим одновременно в образовании двойной связи (например, виниловый спирт СН2=СН–ОН), крайне нестабильны и сразу же изомеризуются (см. ИЗОМЕРИЗАЦИЯ) в альдегиды или кетоны:
CH2=CH–OH ® CH3–CH=O
Номенклатура спиртов.
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
| СН3ОН | метиловый спирт |
| С2Н5ОН | этиловый спирт |
| (Н3С)2СНОН | изопропиловый спирт |
| С4Н9ОН | бутиловый спирт |
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы (рис. 4):
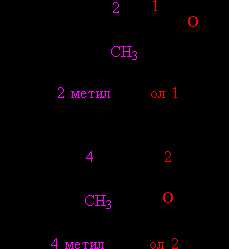
Рис. 4. СИСТЕМАТИЧЕСКИЕ НАЗВАНИЯ СПИРТОВ. Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСєС–СН
Физические свойства спиртов.
Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также третичный бутанол (Н3С)3СОН – смешиваются с водой в любых соотношениях. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной, а при R, содержащем свыше 9 атомов углерода, практически исчезает.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.
Рис. 5. ВОДОРОДНЫЕ СВЯЗИ В СПИРТАХ (показаны пунктиром)
В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С, а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
1. Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2CH3OH + 2Na ® 2CH3OK + H2
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + H2O ® C2H5OH + КOH
Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую), кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
HO–CH2–CH2–OH + 2NaOH ® NaO–CH2–CH2–ONa + 2H2O
Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется.
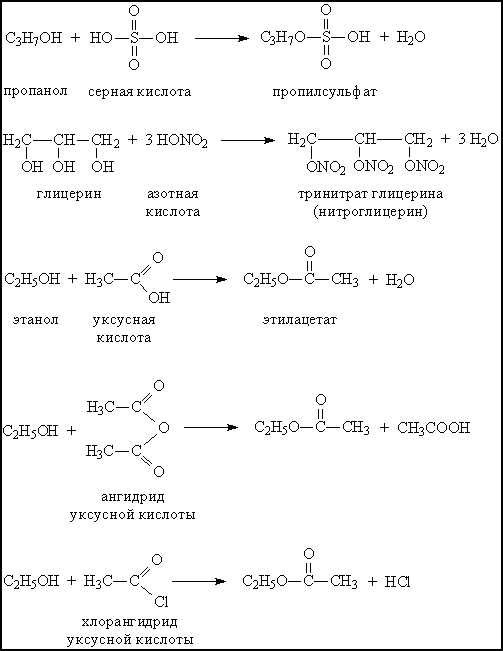
При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот (рис. 6).
При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны (рис.7)

Рис. 7. ОБРАЗОВАНИЕ АЛЬДЕГИДОВ И КЕТОНОВ ПРИ ОКИСЛЕНИИ СПИРТОВ
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула исходного спирта (рис.8).
Рис. 8. ВОССТАНОВЛЕНИЕ БУТАНОЛА
2. Реакции, протекающие по связи С–О.
В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов (отщепление воды), при этом реакция может идти в двух направлениях:
а) межмолекулярная дегидратация с участием двух молекул спирта, при этом связи С–О у одной из молекул разраваются, в результате образуются простые эфиры – соединения, содержащие фрагмент R–О–R (рис. 9А).
б) при внутримолекулярной дегидратации образуются алкены — углеводороды с двойной связью. Часто оба процесса – образование простого эфира и алкена – протекают параллельно (рис. 9Б).
В случае вторичных спиртов при образовании алкена возможны два направления реакции (рис. 9В), преимущественное направление то, при котором в процессе конденсации отщепляется водород от наименее гидрогенизированного атома углерода (отмечен цифрой 3), т.е. окруженного меньшим количеством атомов водорода (в сравнении с атомом 1). Показанные на рис. 10 реакции используют для получения алкенов и простых эфиров.

Разрыв связи С–О в спиртах происходит также при замещении ОН-группы галогеном, или аминогруппой (рис. 10).

Рис. 10. ЗАМЕНА ОН-ГРУППЫ В СПИРТАХ ГАЛОГЕНОМ ИЛИ АМИНОГРУППОЙ
Реакции, показанные на рис. 10, используют для получения галогенуглеводородов и аминов.
Получение спиртов.
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению спиртов, например при гидролизе сложных эфиров и галогенуглеводородов (рис.11А и Б, соответственно), а также гидратацией алкенов – присоединением воды (рис.11В).
Рис. 11. ПОЛУЧЕНИЕ СПИРТОВ ГИДРОЛИЗОМ И ГИДРАТАЦИЕЙ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакция гидролиза алкенов (рис. 11, схема В) лежит в основе промышленного производства низших спиртов, содержащих до 4 атомов С.
Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии дрожжевых грибков и приводит к образованию этанола и СО
С6Н12О6® 2С2Н5ОН + 2СО2
Брожением можно получить не более чем 15%-ный водный раствор спирта, поскольку при более высокой концентрации спирта дрожжевые грибки погибают. Растворы спирта более высокой концентрации получают перегонкой.
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20–30 МПа в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия:
СО + 2 Н2® Н3СОН
Если вместо гидролиза алкенов (рис. 11) проводить окисление, то образуются двухатомные спирты (рис. 12)
Рис. 12. ПОЛУЧЕНИЕ ДВУХАТОМНЫХ СПИРТОВ
Применение спиртов.
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений: альдегидов, кетонов, карбоновых кислот простых и сложных эфиров, применяемых в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов.
Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ (бутилацетата, бутилсалицилата и др.). В шампунях он используется как компонент, повышающий прозрачность растворов.
Бензиловый спирт С6Н5–CH2–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии — как душистое вещество.
Фенетиловый спирт С6Н5–CH2–CH2–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии.
Этиленгликоль HOCH2–CH2OH используют в производстве пластмасс и как антифриз (добавка, снижающая температуру замерзания водных растворов), кроме того, при изготовлении текстильных и типографских красок.
Диэтиленгликоль HOCH2–CH2OCH2–CH2OH используют для заполнения тормозных гидравлических приспособлений, а также в текстильной промышленности при отделке и крашении тканей.
Глицерин HOCH2–CH(OH)–CH2OH применяют для получения полиэфирных глифталевых смол, кроме того, он является компонентом многих косметических препаратов. Нитроглицерин (рис. 6) – основной компонент динамита, применяемого в горном деле и железнодорожном строительстве в качестве взрывчатого вещества.
Пентаэритрит (HOCH2)4С применяют для получения полиэфиров (пентафталевые смолы), в качестве отвердителя синтетических смол, как пластификатор поливинилхлорида, а также в производстве взрывчатого вещества тетранитропентаэритрита.
Многоатомные спирты ксилит НОСН2–(СНОH)3–CН2ОН и сорбит НОСН2– (СНОН)4–СН2OН имеют сладкий вкус, их используют вместо сахара в производстве кондитерских изделий для больных диабетом и людей страдающих от ожирения. Сорбит содержится в ягодах рябины и вишни.
Михаил Левицкий
www.krugosvet.ru
Спирты — химические свойства, классификация. Спирты — общая формула.
Следующий класс веществ, которые хотелось бы рассмотреть — это спирты. Это соединения, имеющие в составе группу -OH, связанную с атомом углерода. Такая группа одновалентна и из любого алкана можно сделать спирт, если поменять один из водородов на OH. Например, метану соответствует метиловый спирт, этану — этиловый и так далее. Также они сокращённо именуются с окончанием «ол»: метанол, этанол, пропанол.Метанол, этанол, пропанол
Начиная с пропанола, у спиртов появляется изомерия — помимо того, что сами алканы имеют изомеры, так ещё и гидроксильная группа может быть присоединена к разным атомам углерода. Например, названию «бутанол» соответствуют уже 4 различных по строению молекулы.
Четыре изомерных бутиловых спирта: н-бутанол, втор-бутанол, трет-бутанол, изобутанол.
Как видно, тот спирт, что сохраняет линейное строение, по аналогии с алканами называется «нормальным». Такие спирты также являются первичными, поскольку атом углерода, соединённый с гидроксильной группой, соединён напрямую только с одним атомом углерода. Существуют также вторичные и третичные спирты (две средних структуры на рисунке).
Спирты чем-то схожи в свойствах с водой: вода тоже содержит гидроксил (а так называется группа -OH), но связанную с атомом водорода (поэтому её можно назвать гидроксидом водорода, хотя никто так не делает). Благодаря гидроксильным группам молекулы оказываются более сильно связаны друг с другом (из-за водородных связей), поэтому даже низший спирт — метанол — представляет собой жидкость, хоть и довольно легко испаряющуюся. Жидкими являются почти все низшие спирты, вплоть до октанола. Опять же, здесь возникает сложность из-за большого количества изомеров.
Общая формула спиртов CnH2n+1OH.
Самый известный из спиртов — это этанол, он же этиловый спирт — тот самый, что содержится в алкогольных напитках. Он кипит при 78 и перегонкой его можно выделить из раствора, но концентрацию таким образом нельзя поднять выше 96% (что не мешает, однако, получать 100%-ый этанол другими способами, например, удаляя воду из 96%-ного при помощи осушителя). Наверняка все слышали про метанол, который по виду и запаху неотличим от этанола, но смертельно ядовит. Однако если не пробовать его на вкус, то метанол — отличный растворитель, а также топливо и полупродукт для множества химических процессов.
Поскольку метанол и этанол контролируются законом, то зачастую вместо них используют следующий спирт — пропанол. Причём н-пропанол встречается гораздо реже своего изомера — изопропанола, который часто используется как растворитель и обезжириватель (для спиртовок тоже подходит, если что). Он отличается запахом от метанола и этанола, более вязкий (особенно при низкой температуре) и кипит при немного более высокой температуре.
Бутанол и примеси более тяжёлых спиртов составляют основу сивушных масел — они в небольших количествах образуются при брожении и имеют неприятный тяжёлый запах. В остальном такие спирты используются преимущественно как реагенты для получения других соединений.
Функциональных групп в молекуле может быть несколько, в частности — спиртовых. Все рассматривавшиеся выше соединения называются одноатомными спиртами — по количеству гидроксильных групп. Существуют также двухатомный спирт этиленгликоль и трёхатомный спирт глицерин:
Этиленгликоль и глицерин
Они имеют свойства, аналогичные первичным спиртам, но ещё более выраженные: это густые жидкости с высокой температурой кипения (этиленгликоль используется как компонент теплоносителей в отоплении, а также как компонент антифризов «тосол»). И тот, и другой смешиваются с водой в любых пропорциях. В отличие от этиленгликоля, глицерин малотоксичен, а вдобавок ещё и имеет сладкий вкус (отсюда название: «гликос» — сладкий), из-за некоторого сходства в строении с углеводами, которые тоже формально являются спиртами. Это объясняет, в частности, почему углеводы (в том числе сахар) хорошо растворяются в воде.
Спирты похожи на алканы, в молекулу которых «встроили» атом кислорода. И действительно во многих учебниках пишут, что метанол можно получить неполным окислением метана. Для этого, правда, требуются совершенно особые условия, реализуемые только в промышленности: высокие давления, контроль температуры, использование катализаторов. Также его получают из т.н. «синтез-газа» — смеси монооксида углерода и водорода, а синтез-газ, в свою очередь, получают из метана и воды при высокой температуре.
Получение метанола из синтез-газа
Вообще метанол — крупнотоннажный продукт (в 2004 году его производство оценивалось в 32млн. тонн во всём мире), а промышленная химия обычно сильно отличается от лабораторной (сравните ректификационные колонны и лабораторный перегонный аппарат). В небольших количествах метанол образуется при сухой перегонке древесины, поэтому другое его название — древесный спирт.
Для получения этанола используют брожение: некоторые виды микроорганизмов могут превращать сахара, присутствующие в растительном материале (например, в пшенице или сахарном тростнике) в этанол, получая при этом энергию. Этанол затем отделяют ректификацией и используют, например, как добавку к автомобильному топливу (т.н. биотопливо). Таким образом производится порядка 60млн. тонн этанола в год (в основном в США и Бразилии). При таких масштабах и не хочется говорить о получении из нефтепродуктов, но всё-таки есть способ получения из этилена: углеводорода, в котором два атома углерода связаны не одной, а двойной связью. При определённых условиях эта связь может раскрываться, присоединяя молекулу воды. При этом образуется этанол; таким же образом могут быть получены другие спирты из соответствующих алкенов.
Реакция гидратация этилена
Метанол окисляется в формальдегид или муравьиную кислоту. Этанол, соответственно — в ацетальдегид или уксусную кислоту.
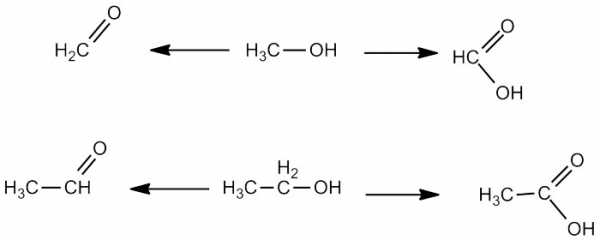
Чем и в каких условиях, а также о прочих реакциях спиртов будет описано в следующей статье.
Статистику по производству биоэтанола можно найти здесь: http://ethanolrfa.org/resources/industry/statistics/
chemiday.com
Спирты
.
Гидроксильная группа в одноатомных спиртах
Спирты — производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами (-OH). Гидроксильную группу связанную с sp 3-гибридизованим атомом Углерода называют спиртовой. Органические соединения с двумя гидроксильными группами называются диолы, с тремя — триолям и т. д. В украинском языке их также называют многоатомными спиртами.
1. История спирта
Этиловый спирт, точнее растительный хмельной напиток, который содержит, был известен человечеству с глубокой древности. Считается, что не менее, чем за 8000 лет до нашей эры люди изготавливали легкие спиртные напитки с фруктов и меда.
Впервые спирт с вина получили в 6-7 веках арабские химики, а первую бутылку крепкого алкоголя (прообраза современной водки) изготовил персидский алхимик Ар-Рази в 860 году.
В Европе этиловый спирт был получен из продуктов брожения в 11-12 веке в Италии.
В России спирт впервые попал в 1386 году, когда генуэзские посольство привезло его с собой под названием «аква вита» и презентовала царского двора.
В 1660 году английский химик и богослов Роберт Бойль впервые получил обезвоженный этиловый спирт, а также открыл его некоторые физические и химические свойства, в частности обнаружив способность этанола быть жарким топливом для горелок. Абсолютный (безводный) этиловый спирт был получен в 1796 году русским химиком Т.Е.Ловиц.
В 1842 году немецкий химик Якоб Генрих Вильгельм Шиль (1813-1889) открыл, что спирты образуют гомологический ряд, отличаясь на некоторую постоянную величину. Правда, он ошибся описав ее как C 2 H 2. Через два года, другой химик Шарль Жерар установил правильное гомологической соотношение CH 2 и предсказал формулу и свойства неизвестного в те годы пропилового спирта.
В 1850 году английский химик Александр Вильямсон, исследуя реакцию алкоголятов с етилйодидом, установил, что этиловый спирт является производным от воды с одним смещением водородом, экспериментально подтвердил формулу C 2 H 5 OH.
Впервые синтез этанола действием серной кислоты на этилен совершил в 1854 году французский химик Марселен Бертло.
Первое исследование метилового спирта был проведен в 1834 году французскими химиками Жаном-Батистом Дюма и Эженом Пелиго, они назвали его «метиловый или древесный спирт», так как он был обнаружен в продуктах сухой перегонки древесины. Синтез метанола с метилхлорида совершил французский химик Марселен Бертло в 1857 году. Им же впервые был открыт в 1855 году изопропиловый спирт, синтезированный действием на Пропен водной серной кислоты.
Впервые третичный спирт ( трет-бутанол, 2-метил-пропан-2-ол) синтезировал в 1863 году известный русский ученый А. М. Бутлеров, положив начало целой серии экспериментов в этом направлении.
Представитель двухатомных спиртов — этиленгликоль — впервые был синтезирован французским химиком А. Вюрца в 1856 году. Трехатомных спирт — глицерин — был обнаружен в природных жирах еще в 1783 году шведским химиком Карлом Шееле, однако его состав был открыт только в 1836 году, а синтез осуществлен с ацетона в 1873 году Шарлем Фриделем.
2. Классификация спиртов
Если в состав молекулы спирта входит одна гидроксильная группа, то такой спирт называют одноатомными, когда две — двухатомные и т. д. Спирты, молекулы которых содержат два и более гидроксильных групп, называют многоатомными. Если спирт происходит от насыщенного углеводорода, то его называют насыщенным, а когда от ненасыщенного, то ненасыщенным. В зависимости от типа атома, к которому присоединена гидроксильная группа спирты разделяют на первичные, вторичные и третичные.
Спирты, как углеводороды, образующие гомологические ряды. Каждый последующий член этого ряда отличается от предыдущего на гомологическую разность-CH 2 -.
Названия спиртов происходят от названий углеводородных радикалов, входящих в состав молекулы спиртов. Международные их названия образуются из названий соответствующих углеводородов с добавлением окончания ол. Например, CH 3-OH — метиловый спирт, или метанол; C 2 H 5-OH — этиловый спирт, или этанол и т. д.
Общая формула одноатомных насыщенных спиртов C n H 2n +1 OH или R-OH, где R — углеводородный радикал. В таблице приведен гомологический ряд насыщенных одноатомных спиртов.
Низшие спирты (с малым количеством атомов Углерода в молекуле) при обычной температуре являются летучими жидкостями, а выше, начиная с C 15 H 31-OH, — твердые вещества. Низшие спирты водой смещаются во всех соотношениях. С повышением молекулярной массы растворимость спиртов снижается. Все спирты легче воды. По мере увеличения молекулярной массы температура кипения спиртов повышается.
3. Гомологический ряд насыщенных неразветвленных одноатомных спиртов
| Углеводород, от которого происходит спирт | Формула углерода | Брутто-формула | Название спирта | Формула спирта | Брутто-формула |
|---|---|---|---|---|---|
| Метан | СН 4 | СН 4 | Метиловый спирт ( метанол) | СН 3-ОН | СН 3-ОН |
| Этан | СН 3-СН 3 | С 2 Н 6 | Этиловый спирт ( этанол) | СН 3-СН 2-ОН | С 2 Н 5-ОН |
| Пропан | СН 3-СН 2-СН 3 | С 3 Н 8 | Пропиловый спирт ( пропанол) | СН 3-СН 2-СН 2-ОН | С 3 Н 7-ОН |
| Бутан | СН 3-СН 2-СН 2-СН 3 | С 4 Н 10 | Бутиловый спирт ( бутанол) | СН 3-СН 2-СН 2-СН 2-ОН | С 4 Н 9-ОН |
| Пентан | СН 3-СН 2-СН 2-СН 2-СН 3 | С 5 Н 12 | Амиловый спирт (пентанол) | СН 3-СН 2-СН 2-СН 2-СН 2-ОН | С 5 Н 11-ОН |
| Гексан | СН 3-СН 2-СН 2-СН 2-СН 2-СН 3 | С 6 Н 14 | Гексиловий спирт (гексанол) | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-ОН | С 6 Н 13-ОН |
| Гептан | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 3 | С 7 Н 16 | Гептиловий спирт (гептанол) | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-ОН | С 7 Н 15-ОН |
| Октан | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 3 | С 8 Н 18 | Октиловий спирт (октанол) | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-ОН | С 8 Н 17-ОН |
| Нонана | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 3 | С 9 Н 20 | Нониловий спирт (нонанол) | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-ОН | С 9 Н 19-ОН |
| Декан | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 3 | С 10 Н 22 | Дециловом спирт (деканол) | СН 3-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-ОН | С 10 Н 21-ОН |
4. Природные спирты
К естественной спиртов относятся такие углеводы, как глюкоза, фруктроза, сахароза.
5. Реакции спиртов
5.1. Кислотно-основные свойства
Характерной химическим свойством спиртов является их способность взаимодействовать со щелочными металлами и замещать гидроксильные атомы водорода атомами металла с образованием веществ, которые называют алкоголятами. Например:
- 2C 2 H 5-OH + 2Na → 2C 2 H 5-ONa + H 2 ↑.
Другие атомы водорода, которые связаны непосредственно с Карбоном, в реакцию не вступают. На примере этих реакций ученые впервые встретились с явлением влияния одних атомов на другие в молекуле. Суть этого влияния можно показать на примере молекулы этилового спирта, электронное строение которой можно изобразить в следующем виде:
Гидроксильный атом Водорода занимает в молекуле особое положение. В отличие от других атомов Водорода, он не непосредственно связан с атомом Углерода, а через Кислород. Атом Кислорода, как активный элемент больше, чем Карбон, оттягивает к себе общую электронную пару. Вследствие этого гидроксильный атом Водорода слабее связан в молекуле, чем другие атомы Водорода, и более «подвижным», поэтому сравнительно легко вытесняется атомом металла. Реакции спиртов с металлами чем-то напоминают реакции кислот с металлами. В молекулах спиртов гидроксильные атомы Водорода значительно теснее связаны с Кислорода, чем в молекулах кислот. Поэтому спирты в отличие от кислот не диссоциируют в воде и ионов Водорода не образуют.
В спиртах могут замещаться не только гидроксильные атомы Водорода, но и вся гидроксильная группа. Например, при нагревании этилового спирта из бромоводнем образуется бромоетан:
5.2. Дегидратация
Для спиртов характерно также реакции дегидратации (отщепление воды). Так, при нагревании выше 160 С этилового спирта с избытком концентрированной серной кислоты как водоотнимающих средства от друга молекулы спирта отщепляется одна молекула воды и этиловый спирт превращается в этилен :
При слабом нагревании (около 140 С) смеси этилового спирта из серной кислотой при избытке спирта молекула воды отщепляется не от одной, а от двух молекул спирта, в результате чего образуется не этилен, а диэтиловый эфир :
5.3. Этерификация
Кроме того, для спиртов характерны также реакции взаимодействия с кислотами, в результате чего образуются сложные эфиры. При этом за счет гидроксильной группы кислоты и гидроксильного атома Водорода спирта образуется молекула воды, а за счет остатков молекул кислоты и спирта — молекулы сложного эфира. Например, при легком нагревании (не выше 100 C) этилового спирта из серной кислотой образуется сульфатноетиловий эфир или диетилсульфат:
Амиловый спирт C 5 H 11 OH — одноатомный насыщенный спирт.
5.4. Реакции окисления
C 2 H 5 OH + O 2 → CO 2 + H 2 O
6. Физические свойства
Простые алифатические спирты — бесцветные жидкости.
Запах: Метанол, этанол и н- пропанол имеют «классический» запах спирта. Запах бутанола приводит запах самогона. Амиловый и высшие спирты имеют гораздо сильнее, несколько сладковатый запах, сильный в октанол.
| Название | Другие названия | Формула | Температура кипения, С | Температура плавления, С | Плотность, г / см 3 при 20 С |
|---|---|---|---|---|---|
| Метиловый спирт | Метанол | CH 3 OH | 64,7 | -97,78 | 0,791 |
| Этиловый спирт | Этанол | C 2 H 5 OH | 78,3 | -114,65 | 0,790 |
| н-пропиловый спирт | ПРОНАН-1-ол | C 3 H 7 OH | 97,2 | -124,10 | 0,804 |
| Изопропиловый спирт | Пропан-2-ол, изопропанол | CH 3 CH (CH 3) OH | 82,5 | -87,95 | 0,786 |
| н-бутиловый спирт | Бутан-1-ол | C 4 H 9 OH | 117,8 | -88,64 | 0,808 |
| Изобутиловый спирт | 2-Метилпропан-1-ол | (СН 3) 2 СНСН 2 ОН | 108,0 | -101,97 | 0,802 |
| втор-бутиловый спирт | Бутан-2-ол | СН 3 СН 2 СН (ОН) СН 3 | 99,5 | -114,70 | 0,806 |
| трет-бутиловый спирт | 2-Метилпропан-2-ол | СН 3 СН 2 СН (ОН) СН 3 | 82,9 | 25,82 | 0,765 (40 C) |
| н-амиловый спирт | Пентан-1-ол | C 5 H 11 OH | 138,0 | -77,59 | 0,813 |
| н-Гексиловий спирт | Гексан-1-ол | C 6 H 13 OH | 157,1 | -47,40 | 0,822 |
| н-Гептиловий спирт | Гекптан-1-ол | C 7 H 15 OH | 176,3 | -32,80 | 0,824 |
| н-Октиловий спирт | Октан-1-ол | C 8 H 17 OH | 195,1 | -16,30 | 0,823 |
7. Применение
7.1. Экономическое значение и направления использования спиртов
Области применения спиртов многочисленные и разнообразные, особенно учитывая широкий спектр соединений, относящихся к этому классу. Вместе с тем, с промышленной точки зрения, только небольшая ряд спиртов вносит заметный вклад в глобальную мировую экономику.
В TOP 50 за 2002 год соединений, выпускаемых химической промышленностью США, из спиртов входят только метанол (14-е место) и этиленгликоль (29-е место). [1] В последующие 50 важнейших химических соединений, по данным 1999 роу, включены изопропиловый спирт, н- бутиловый спирт, синтетический этанол, пропиленгликоль, диэтиленгликоль, 2-етилгексанол, 1,4-бутандиол, сорбитол и глицерин. [1]
В мире наибольшее значение из спиртов имеют метиловый, этиловый, пропиловый, изопропиловый спирт, а также бутиловые, амиловые и высшие жирные спирты. Из циклических и ароматических спиртов: циклогексанол, 2-етилгексанол, фенилэтиловый и бензиловый спирты, из гликолей и полиолов: этиленгликоль, пропиленгликоль, диэтиленгликоль, глицерин, пентаэритрита.
Наиболее крупнотоннажными направлениям использования спиртов является (в произвольном порядке):
7.2. Применение спиртов в качестве топлива
Для топливных целей в данный момент используются в промышленных объемом три спирты: метанол, этанол и бутанол, что связано, прежде всего, с их коммерческой доступностью и возможностью массового производства из растительного сырья (кроме метанола). При этом возможно использование спиртов в виде топлива в чистом виде, а также в виде различных смесей с бензином или дизельным топливом [2], а также в качестве добавок (до 10%) с целью повышения октанового числа и снижения токсичности отработавших газов. [3] [4] Также отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля. [5]
Наиболее распространенным топливным спиртом является этанол. По оценкам экспертов, на 2009 год 80-90% всего производимого в мире этилового спирта было использовано именно в этих целях и составило 73,9 млрд литров (≈ 58 млн тонн). [6]
Основные причины, которые дали толчок активному изучению спиртов как альтернативного топлива, это [7] :
- рост цен на нефть и природный газ, а также полнота этих ресурсов в ближайшем будущем
- спирты обладают высокими эксплуатационными характеристиками, а продукты сгорания содержат меньше вредных веществ;
- спирты могут изготавливаться биохимическим методом из отходов пищевой, деревообрабатывающей и целлюлозно-бумажной промышленности, тем самым решая одновременно проблему утилизации.
Вместе с тем, массовое использование вышеуказанных спиртов в качестве моторного топлива, помимо чисто экономических причин, имеет ряд недостатков:
- метанол и этанол имеют по сравнению с бензином меньшую энергоэффективность и, соответственно, обеспечивают большие затраты;
- низкие температуры кипения спиртов могут быть причиной образования паровых пробок, что может существенно осложнить работу двигателя
- гигроскопичность спиртов, а также их растворимость в воде может привести к резкому снижению мощности при попадании влаги в топливную систему;
- спирты имеют существенно более высокие коррозионные характеристики по сравнению с углеводородами;
- относительно высокая скрытая теплота сгорания метанола и этанола может быть причиной проблемы при смешивании этих спиртов с воздухом и последующей транспортировки через впускной коллектор двигателя.
Примечания
- ↑ а б Chenier Ph. J. Survey of Industrial Chemistry. — Third Edition. — New York: Kluwer Academic / Plenum Publishers, 2002. — С. 17-18. —
nado.znate.ru
Спирты — Циклопедия
Органическая химия. Спирты // Елена Пономарева (10 класс. Знакомство с классом спиртов. Классификация, номенклатура, свойства, получение)Спирты — органические химические соединения, образованные из углеводородных радикалов и одной или нескольких гидроксильных групп (-OH). В зависимости от количества гидроксильных групп выделяются одноатомные (алкоголи), двухатомные (гликоли), трехатомные и многоатомные спирты. Спирты, содержащие бензольное ядро, называются ароматическими (например, фенол). Нижшие спирты — жидкости, высшие — твердые вещества. Спирты являются слабыми кислотами, могут образовывать соли (алкоголяты). Производными от спирта являются эфиры, жиры.
В общем обиходе чаще всего под словом «спирт» понимается этанол (CH3-CH2-OH), который получается при брожении сахара и является основой алкогольных напитков, также широко применяется в технике и медицине. В химической промышленности используются метанол, глицерин, фенол, этиленгликоль и другие спирты. Некоторые многоатомные спирты входят в состав заменителей сахара.
[править] Гомологический ряд насыщенных неразветвленных одноатомных спиртов
| Углеводород, от которого происходит спирт | Формула углеводорода | Брутто-формула | Название спирта | Формула спирта | Брутто-формула |
|---|---|---|---|---|---|
| Метан | СН4 | СН4 | Метиловый спирт (метанол) | СН3-ОН | СН3-ОН |
| Этан | СН3-СН3 | С2Н6 | Этиловый спирт (этанол) | СН3-СН2-ОН | С2Н5-ОН |
| Пропан | СН3-СН2-СН3 | С3Н8 | Пропиловый спирт (пропанол) | СН3-СН2-СН2-ОН | С3Н7-ОН |
| Бутан | СН3-СН2-СН2-СН3 | С4Н10 | Бутиловый спирт (бутанол) | СН3-СН2-СН2-СН2-ОН | С4Н9-ОН |
| Пентан | СН3-СН2-СН2-СН2-СН3 | С5Н12 | Амиловый спирт (пентанол) | СН3-СН2-СН2-СН2-СН2-ОН | С5Н11-ОН |
| Гексан | СН3-СН2-СН2-СН2-СН2-СН3 | С6Н14 | Гексиловый спирт (гексанол) | СН3-СН2-СН2-СН2-СН2-СН2-ОН | С6Н13-ОН |
| Гептан | СН3-СН2-СН2-СН2-СН2-СН2-СН3 | С7Н16 | Гептиловый спирт (гептанол) | СН3-СН2-СН2-СН2—СН2-СН2-СН2-ОН | С7Н15-ОН |
| Октан | СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3 | С8Н18 | Октиловый спирт (октанол) | СН3-СН2-СН2-СН2—СН2-СН2-СН2-СН2-ОН | С8Н17-ОН |
| Нонан | СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН3 | С9Н20 | Нониловый спирт (нонанол) | СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-ОН | С9Н19-ОН |
| Декан | СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН3 | С10Н22 | Дециловый спирт (деканол) | СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-ОН | С10Н21-ОН |
cyclowiki.org
Этанол — Википедия
Материал из Википедии — свободной энциклопедии
Это стабильная версия, отпатрулированная 7 января 2019.| Состояние | отпатрулирована |
| Этанол | |
|---|---|
| Общие | |
| Систематическое наименование |
Этанол |
| Традиционные названия | Этиловый спирт |
| Хим. формула | С2H5OH |
| Рац. формула | СH3СH2OH |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | |
ru.wikipedia.org
Гомологический ряд спиртов. Формулы и оба названия. Общая формула. Помогите пожалуйста:)
Спирты́ (устар. алкого́ли, англ. alcohols; от лат. spiritus — дух) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным атомом углерода (находящемся в состоянии sp³ гибридизации) [1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−OH. Если гидроксильная группа связана с двойной C=C связью, такие соединения называют енолы [2]. Если гидроксильная группа связана напрямую с бензольным кольцом, такие соединения называют фенолы [3]. Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами. Предельные одноатомные спирты Ch4OH МетанолДревесный спирт C2H5OHЭтанолВинный спирт C5h21OHПентан-1-олАмиловый спирт C16h43OHГексадекан-1-олЦетиловый спирт Предельные двух-, трех-, четырёхатомные спирты C2h5(OH)2Этан-1,2-диолЭтиленгликоль C3H5(OH)3Пропан-1,2,3-триолГлицерин C5H8(OH)42,2-бис (Гидроксиметил) пропан-1,3-диолПентаэритрит Предельные многоатомные спирты C5H7(OH)5Пентан-1,2,3,4,5-пентолКсилит C6H8(OH)6Гексан-1,2,3,4,5,6-гексолМаннит, Сорбит Непредельные алифатические спирты C3H5OHПроп-2-ен-1-олАллиловый спирт C10h27Oh4,7-диметилокта-2,7-диен-1-олГераниол C3h4OHПроп-2-ин-1-олПропаргиловый спирт Алициклические спирты C6H6(OH)6Циклогексан-1,2,3,4,5,6-гексолИнозит C10h29Oh3-(2-пропил) -5-метил-циклогексан-1-олМентол
Спирты-производные предельных или непредельных углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. Общая формула R-OH СН3-ОН метиловый спирт (метанол) С2Н5-ОН этиловый спирт-этанол
touch.otvet.mail.ru
1. Номенклатура и изомерия спиртов
СПИРТЫ
Спиртами называются производные углеводородов, содержащие одну или несколько групп —ОН, называемую гидроксильной группой или гидроксилом.
Спирты классифицируют:
1. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами), трехатомные (с тремя гидроксилами) и многоатомные.
Подобно предельным углеводородам, одноатомные спирты образуют закономерно построенный ряд гомологов:
Как и в других гомологических рядах, каждый член ряда спиртов отличается по составу от предыдущего и последующего членов на гомологическую разность (—СН2—).
2. В зависимости от того, при каком атоме углерода находится гидроксил, различают первичные, вторичные и третичные спирты. В молекулах первичных спиртов содержится группа —СН2ОН, связанная с одним радикалом или с атомом водорода у метанола (гидроксил при первичном атоме углерода). Для вторичных спиртов характерна группа >СНОН, связанная с двумя радикалами (гидроксил при вторичном атоме углерода). В молекулах третичных спиртов имеется группа >С—ОН, связанная с тремя радикалами (гидроксил при третичном атоме углерода). Обозначая радикал через R, можно написать формулы этих спиртов в общем виде:
В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется суффикс -ол. При наличии в соединении более старших функций гидроксильная группа обозначается префиксом гидрокси- (в русском языке часто используется префикс окси-). В качестве основной цепи выбирается наиболее длинная неразветвленная цепь углеродных атомов, в состав которой входит атом углерода, связанный с гидроксильной группой; если соединение является ненасыщенным, то в эту цепь включается также и кратная связь. Следует заметить, что при определении начала нумерации гидроксильная функция обычно имеет преимущество перед галогеном, двойной связью и алкилом, следовательно, нумерацию начинают с того конца цепи, ближе к которому расположена гидроксильная группа:
Простейшие спирты называют по радикалам, с которыми соединена гидроксильная группа: (СН3)2СНОН — изопропиловый спирт, (СН3)3СОН — трет-бутиловый спирт.
Часто употребляется рациональная номенклатура спиртов. Согласно этой номенклатуре, спирты рассматриваются как производные метилового спирта — карбинола:
Эта система удобна в тех случаях, когда название радикала является простым и легко конструируемым.
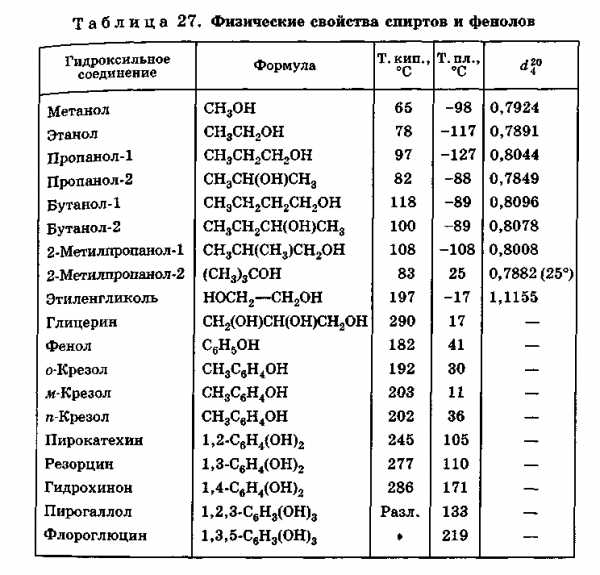
2. Физические свойства спиртов
Спирты имеют более высокие температуры кипения и значительно менее летучи, имеют более высокие температуры плавления и лучше растворимы в воде, чем соответствующие углеводороды; однако различие уменьшается с ростом молекулярной массы.
Разница в физических свойствах связана с высокой полярностью гидроксильной группы, которая приводит к ассоциации молекул спирта за счет водородной связи:
Таким образом, более высокие температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего требуется дополнительная энергия. С другой стороны, такого типа ассоциация приводит как бы к увеличению молекулярной массы, что естественно, обусловливает уменьшение летучести.
Спирты с низкой молекулярной массой хорошо растворимы в воде, это понятно, если учесть возможность образования водородных связей с молекулами воды (сама вода ассоциирована в очень большой степени). В метиловом спирте гидроксильная группа составляет почти половину массы молекулы; неудивительно поэтому, что метанол смешивается с водой во всех отношениях. По мере увеличения размера углеводородной цепи в спирте влияние гидроксильной группы на свойства спиртов уменьшается, соответственно понижается растворимость веществ в воде и увеличивается их растворимость в углеводородах. Физические свойства одноатомных спиртов с высокой молекулярной массой оказываются уже очень сходными со свойствами соответствующих углеводородов.
studfiles.net
