Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация. Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
Для объяснения геометрической конфигурации молекулы используется представление о гибридизации АО центрального атома. Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора – 2s12p2 и возбужденный атом углерода – 2s12p3. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. Например, в таких соединениях как BeCl2, BCl3,CCl4 должны быть неравноценные по энергии и направлению связи. Однако экспериментальные данные показывают, что в молекулах, содержащих центральные атомы с различными валентными орбиталями
(s, p, d), все связи равноценны. Для устранения этого противоречия Полинг и Слейтер предложили концепцию гибридизации
Основные положения концепции гибридизации:
1. Гибридные орбитали образуются из различных атомных орбиталей, не сильно отличающиеся по энергиям,
2. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
3. Гибридные орбитали одинаковы по форме электронного облака и по энергии.
4 По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
Следует отметить, что как физический процесс гибридизация орбиталей не существует. Метод гибридизации представляет собой удобную модель наглядного описания молекул.
Sp- гибридизация
sp–Гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s — и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180 о(рис.5).
Рис.5 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны, и обе связи имеют одинаковую длину.
sp2-гибридизация
В результате комбинации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу. Такова, например, конфигурация молекулы BF3 (рис.6):
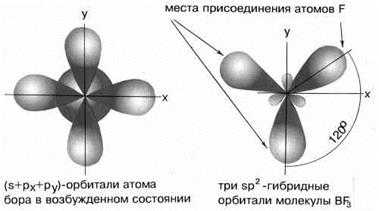
Рис.6sp2-гибридные орбитали
sp
sp3-Гибридизация характерна для соединений углерода. В результате комбинации одной s-орбитали и трех р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4 и др.(рис.7).
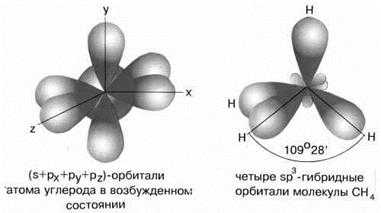
Рис.7 sp3-гибридные орбитали
Метод гибридизации объясняет геометрию молекулы аммиака. В результате комбинации одной 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 .Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о ,соответствующие тетраэдру(рис.8):
Рис.8 sp3— гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода H+ + ׃NH3 = NH4+ в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Гибридизация объясняет также отличие угла между связями О–Н в угловой молекуле воды. В результате комбинации одной 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp3, из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру (рнс.9):
Рис 9sp3—гибридизация в молекуле воды
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как [SiF6]4-, [Fe(CN)6]4-(рис.10). При этом молекула имеет конфигурацию октаэдра:
Рис. 10d2sp3-гибридизация в ионе [Fe(CN)6]4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом. Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
Делокализованная π-связь
По методу МВС электронная структура молекулы выглядит как набор различных валентных схем (метод локализованных пар). Но, как оказалось, нельзя объяснить экспериментальные данные о структуре многих молекул и ионов, оперируя только представлениями о локализованной связи. Исследования показывают, что всегда локализованными являются только σ-связи. При наличии π-связей может иметь место делокализация, при которой связующая электронная пара одновременно принадлежит более чем двум атомным ядрам. Например, экспериментально установлено,что молекула BF3 имеет плоскую треугольную форму(рис.6). Все три связи
B–F равноценны, однако величина межъядерного расстояния свидетельствует, что связь является промежуточной между одинарной и двойной. Объяснить эти факты можно следующим образом. У атома бора в результате комбинации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу, но остаётся неиспользованной свободная негибридизированная р-орбиталь, а атoмы фтора имеют неподелённые электронные пары. Поэтому имеется возможность образования π –связи по донорно- акцепторному механизму. Равноценность всех связей свидетельствует о делокализации π –связи между тремя атомами фтора.
Структурную формулу молекулы BF3 с учётом делокализации π- связи можно изобразить следующими образом (нелокализованную связь обозначена пунктиром):
Рис.11 Строение молекулы BF3
Нелокализованная π-связь обусловливает нецелочисленную кратность связи. В данном случае она равна 1 1 /3 поскольку между атомом бора и каждым из атомов фтора осуществляется одна σ–связь и 1 /3часть π-связи.
Точно также равноценность всех связей в ионе NO3–свидетельствует о делокализации π –связи и отрицательного заряда на все атомы кислорода. В плоском треугольном ионе NO3
—( sp2-гибридизация атома азота) делокализованныеπ-связи (изображены пунктирными линиями) равномерно распределяются между всеми атомами кислорода ( рис.12 )
Рис. 12 Структурная формула иона NO3— с учётом делокализации π- связи
Аналогично делокализованные π-связи равномерно распределяются между всеми атомами кислорода в анионах :PO43-(sp3-гибридизация атома фосфора→тетраэдр) ,SO42-(sp3-гибридизация атома серы→тетраэдр)(рис.13)
Рис.13Структурные формулы SO42- и PO43- с учётом делокализации
π-связи.
infopedia.su
Гибридизация орбиталей. Геометрические формы ковалентных молекул
⇐ ПредыдущаяСтр 15 из 115Следующая ⇒
Характеристиками геометрического строения молекулы являются: длины связей, валентные углы, торсионные (или диэдральные) углы.
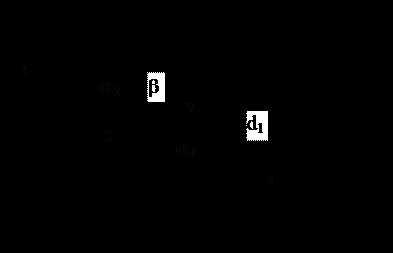 |
b – торсионный угол между плоскостями, проходящими через тройки атомов 1, 2, 3 и 2, 3, 4.
Линейная форма характерна для двухатомных молекул. Для предсказания пространственного строения многоатомной молекулы следует знать не только длину связи, но и значения валентных и тор-сионных углов.
Если молекула состоит из трех или более атомов, т.е. в ней присутствуют две или более химических связей, то между их направлениями образуются углы (вплоть до 1800), которые называются валентными углами (a).
Торсионный угол (b) – двугранный угол между двумя плоскостями, проходящими через какие-либо выделенные тройки атомов.
Примеры геометрии молекул представлены на рис. 4.11.
Рассмотрим влияние гибридизации на геометрическую форму молекул.
Если учесть, что р-орбитали направлены друг к другу под углом 900, следовало бы предложить, что связи в молекулах, например, Н2О, NH3 должны быть также направлены друг к другу под прямыми углами. Однако это не так. Более того, часто не оправдывается на опыте ожидаемая неравноценность связей, образованных за счет различных по форме орбиталей. Опытным путем установлено, что, если атом образует несколько однотипных связей за счет электронов разных энергетических подуровней, то эти связи оказываются энергетически равноценными.

(а) – линейная; (б) – треугольная; (в) – тетраэдрическая;
(г) – тригонально-бипирамидальная; (д) – октаэдрическая;
(е) – пентагонально-бипирамидальная
Квантовомеханическая теория строения атома не может объяснить этого факта, и для проведения теории в соответствие с экспериментом возникла гипотеза гибридизации орбиталей.
Согласно этой гипотезе, различные орбитали одного атома, участвующие в образовании s-связей, выравниваются по форме и энергии. Из нескольких различных орбиталей образуется такое же число гибридных орбиталей, имеющих одинаковую форму и одинаковую энергию. Гибрид-ные орбитали в пространстве вокруг ядра располагаются равномерно.
В гибридизации могут принимать участие орбитали различной формы. Рассмотрим лишь гибридизацию s- и p- атомных орбиталей. Орбиталь, возникающая при «выравнивании» s- и p- орбиталей, представляет собой неравноплечную «восьмерку» (рис. 4.12). Она в большей степени вытянута в одну сторону от ядра, чем в другую. Поскольку степень перекрывания валентных орбиталей в таком случае выше, химическая связь, образованная гибридной орбиталью, должна быть более прочной, чем образованная обычными s- и p- орбиталями.

Рис. 4.12. Форма sp-гибридной орбитали
В зависимости от количества взаимодействующих орбиталей в атоме в результате гибридизации образуется различное число гибрид-ных орбиталей. Следовательно, и формы молекул будут различны. Рассмотрим ряд простейших примеров.
При образовании молекул галогенидов бериллия, например, BeCl2, в образовании химических связей со стороны центрального атома принимают участие один s- и один p-электроны, появляющиеся при возбуждении атома:
Такое возбуждение оправдано, если выделяющаяся при последую-щем образовании химической связи энергия компенсирует затраты энер-гии на возбуждение атома (перескок s-электрона на p-орбиталь).
Наличие неспаренных электронов должно было бы обеспечить две связи атома бериллия с двумя атомами хлора (имеющими неспаренные 3p-электроны), однако эти связи были бы неравноценны.
При затрате небольшой энергии вместо исходных s- и p- орбиталей атома бериллия образуются две равноценные sp-орбитали. Гибридные sp-орбитали вытянуты (рис. 4.13, а) в противоположных друг другу направлениях (валентный угол 180О). Обе образующиеся связи энергети-чески равноценны.
Поскольку энергия, выделяющаяся при образовании связей Be – Cl, больше, чем сумма затрат энергии на возбуждение атома бериллия и гибридизацию его 2s- и 2p-орбиталей, образование молекулы BeCl2 энергетически выгодно.
Рассмотренный случай носит название sp-гибридизации. Молекулы, образованные с участием sp-гибридных орбиталей, линейны. Простейший пример подобного рода – линейная молекула ацетилена C2H2, образованная за счет sp-гибридных орбиталей атомов углерода (остальные p-орбитали атомов углерода участия в гиб-ридизации в данном случае не принимают, а образуют p-связи).
При гибридизации одной s- и двух p- орбиталей образуются три равноценные sp2-гибридные орбитали. Примером может служить обра-зование молекулы трихлорида бора. При возбуждении в атоме бора появляются три неспаренных электрона:
Орбитали, на которых расположены эти электроны, усредняются по форме и энергии, образуя три sp2-гибридные орбитали, располагаю-щиеся под углом 120О друг к другу (рис. 4.13, б). Этот угол является оптимальным: он обеспечивает максимальное взаимное удаление и минимальную энергию отталкивания трех гибридных орбиталей, следовательно, обеспечивает минимальную энергию системы.
Таким образом, молекулы, образованные за счет sp2-гибридных орбиталей, представляют собой правильный треугольник, в центре кото-рого находится центральный атом (в нашем случае — бор), а в вершинах – остальные атомы (хлора). Все три связи в молекуле равноценны.
Примеры молекул с sp2-гибридными орбиталями атома углерода – это органические вещества: этилен C2H4, бензол С6Н6 и др. (в этих случаях три орбитали атома углерода гибридизуются, а четвертая – участвует в образовании p-связи).
Если в образовании гибридных орбиталей принимают участие четыре орбитали (например, в молекуле метана CH4), имеет место sp3-гибридизация. Возбужденный атом углерода имеет 4 неспаренных электрона (один s- и три p-электрона):

Рис. 4.13. Схема расположения орбиталей при sp- (а), sp2— (б) и
sp3— гибридизации (в)
Если все четыре орбитали принимают участие в гибридизации, то четыре образовавшихся sp3-гибридные орбитали вследствие взаимного отталкивания ориентируются друг к другу под углом 109О28/ (рис. 4.9, в). При этом атом углерода занимает место в центре правильного тетраэдра, а в вершинах находятся его партнеры (в случае метана – атомы водорода).
В атоме азота на внешнем энергетическом уровне находятся пять электронов:
Современная квантовохимическая теория химической связи предполагает, что при образовании молекулы аммиака NH3 орбитали атома азота подвергаются sp3-гибридизации. В этом случае говорят о гибридизации не электронов, а орбиталей, поэтому она может наблюю-даться как в случае орбиталей, содержащих по одному электрону, так и в случае орбиталей, заселенных двумя электронами, либо вовсе свободных от них. Три атома водорода аммиака занимают три вершины образующегося тетраэдра из sp3-гибридных орбиталей. Четвертая вершина тетраэдра занята гибридным электронным облаком, не участвующим в образовании химической связи. Поскольку не все вершины тетраэдра идентичны, валентный угол в молекуле аммиака меньше тетраэдрического и равен 1070, т.е. молекула представляет собой слегка искаженный тетраэдр (тригональную пирамиду см. рис. 4.10, б).
В молекуле воды валентный угол Н–О–Н также близок к тетраэдрическому (104,50). Объясняют это тем, что орбитали атома кислорода подвергаются sр3-гибридизации, причем две sр3-гибридные орбитали перекрываются с s-орбиталями двух атомов водорода, а две заселены неподеленными электронными парами.
Энергетические характеристики связей в галогеноводородах показывают, что даже в этом случае орбитали атомов галогенов подвержены sp3-гибридизации, и связь образована s-орбиталью атома водорода и sр3-гибридной орбиталью атома галогена. Кажется, что нет необходимости применять теорию гибридизации для двухатомных моле-кул, но связь в галогеноводородах обладает большей прочностью, чем дает расчет для связи, образованной «чистой» р-орбиталью.
Примеры влияния неподеленных электронных пар центрального атома на геометрию молекулы рассмотрены также на рис. 4.14. и в табл. 4.3.
Таким образом, соответствие теории гибридизации эксперимен-тальным исследованиям (например, данным по энергетике химических связей) подтверждает важность самой концепции гибридизации. Гибридизацией определяется химическое и кристаллохимическое строение веществ, а, следовательно, и их химические свойства.

Рис. 4.14. Влияние неподеленных электронных пар (Е) центрального атома на пространственную конфигурацию молекул:
(а) – тетраэдр; (б) – тригональная пирамида; (в) – угловая форма;
(г) – тригональная бипирамида; (д) – искаженный тетраэдр; (е) – Т-форма; (ж) – линейная форма; (з) – октаэдр; (и) – тетрагональная пирамида; (к) – квадрат
Таблица 4.3
Число электронных пар центрального атома
и пространственная конфигурация молекул ABn
| Число электронных пар атома А | Расположение электронных пар | Число связывающих пар | Число неподеленных пар | Геометрическая форма и состав молекулы* | Примеры |
| Линейное | Линейная АВ2 | BeH2, BeCl2 | |||
| Треугольное | Плоский треугольник АВ3 Угловая АВ2Е | BF3 SnCl2 | |||
| Тетраэдрическое | Тетраэдр АВ4 Тригональная пирамида АВ3Е Угловая АВ2Е2 | CCl4, CH4 H3N, NF3 H2O, OF2 | |||
| Тригонально-бипира-мидальное | Тригональная бипирамида АВ5 Неправильный тетраэдр АВ4Е Т-образная АВ3Е2 Линейная АВ2Е3 | PCl5 SF4 ClF3 XeF2, IF | |||
| Октаэдрическое | Октаэдр АВ6 Квадратная пирамида АВ5Е Плоский квадрат АВ4Е2 | SF6, SiF IF5, SbF XeF4, ICl | |||
| Пентагонально-бипи-рамидальное | Пентагональная бипирамида АВ7 Неправильный октаэдр АВ6Е | IF7 XeF6 |
*E – неподеленная электронная пара.
Рекомендуемые страницы:
lektsia.com
объясните понятия «sp»,»sp2-«,»sp3-«гибридизация, приведите примеры
А вот еще один, очень наглядно:http://www.hybridation.ru/default.htm
Если же коротко:
Гибридизация орбиталей — концепция смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами. Гибридизация орбиталей очень полезна при объяснении формы молекулярных орбиталей и является интегральной частью теории валентных связей. Теория гибридизации была предложена американским химиком Лайнусом Полингом для объяснения структуры таких молекул как метан. Исторически применялась только для простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. Поэтому в настоящее время используется в основном в педагогических целях и в синтетической органической химии.
sp3-Гибридизация (характерна для алканов)
гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28′ . Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр
sp2-гибридизация (характерна для алкенов, диенов и аренов)
Три sp² орбиталиПроисходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp-гибридизация (характерна для алкинов)
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов
Подробнее, с рисунками в ссылке.
otvet.mail.ru
3.4 Геометрия молекул. Гибридизация атомных орбиталей
Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией).
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи;
2) число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация. Рассмотрим её на примере молекулы BeCl2.
Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой — за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).
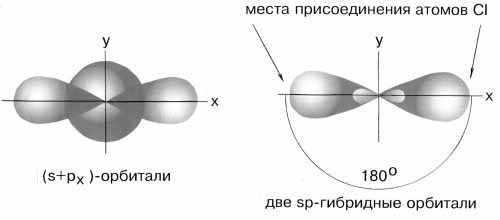
Рисунок 13 — sp-гибридизация валентных орбиталей бериллия
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул — независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Е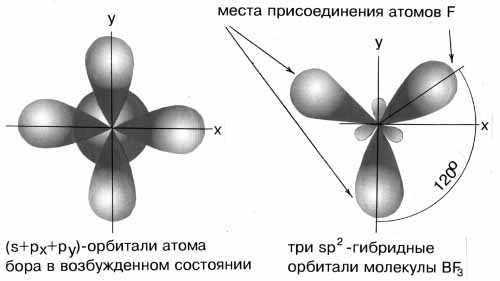 сли
валентная оболочка атома включает
электроны на однойs-орбитали
и двух
p-орбиталях,
то наблюдается sp2-гибридизация,
которая даёт несколько иную геометрию
молекулы. Примером может служить
sp2-гибридизация
бора при образовании молекулы BF3
(рисунок 14). Три sp2-гибридные
орбитали лежат в одной плоскости под
углом 120°. Они располагаются как можно
дальше друг от друга и молекула имеет
форму плоского треугольника.
сли
валентная оболочка атома включает
электроны на однойs-орбитали
и двух
p-орбиталях,
то наблюдается sp2-гибридизация,
которая даёт несколько иную геометрию
молекулы. Примером может служить
sp2-гибридизация
бора при образовании молекулы BF3
(рисунок 14). Три sp2-гибридные
орбитали лежат в одной плоскости под
углом 120°. Они располагаются как можно
дальше друг от друга и молекула имеет
форму плоского треугольника.
Рисунок 14 — sp2-гибридизация валентных орбиталей бора
Такую же форму будут иметь и молекулы BH3, H2C=CH2, C6H6 и т. д.
Наконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
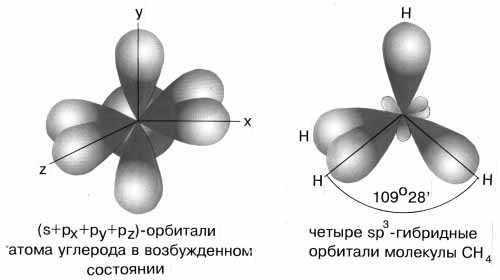
Рисунок 15 — sp3-гибридизация валентных орбиталей углерода
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28′.
Такой же тип гибридизации будет характерен для молекул CCl4, H3C–CH3.
Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
|
|
|
Рисунок 16 — Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4 |
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга.
Поэтому реально этот тетраэдр в молекулах NH3 и H2O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно.
При образовании иона аммония NH4+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28′.
Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28′, поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.
studfiles.net
Геометрия и свойства молекул, образующихся из возбужденного состояния атомов. Теория гибридизации.
В рассмотренных примерах химическая связь образуется электронами одного энергетического подуровня (р). В большинстве же случаев в образовании химической связи участвуют электроны различных подуровней. Рассмотрим, например, молекулу SiCl4. Атом Si имеет в невозбужденном состоянии два валентных электрона и, следовательно, может образовывать только две связи.
Предположим теперь, что один из 3s-электронов в результате возбуждения перешел на 3р-подуровень, теперь атом Si может образовать четыре связи, причем выигрыш в энергии при образовании связей превосходит незначительную энергию возбуждения. Поскольку теперь у атома Si в образовании связи могут участвовать три р-электрона и один s‑электрон, логично предположить, что связи в молекуле SiCl4 должны быть неравноценными.
Однако исследования показывают, что связи в SiСl4 совершенно одинаковы (имеют одну и ту же энергию и длину) и направлены симметрично к вершинам тетраэдра. Этот факт можно истолковать как гибридизацию, т.е. смешивание валентных орбиталей различных подуровней, в результате чего возникают четыре новые (гибридные) орбитали, промежуточные по форме и энергии. В данном случае в гибридизации участвует одна s- и три р‑орбитали, поэтому имеет место sр3-гибридизация и форма образующейся молекулы тетраэдрическая.
Основные положения теории гибридизации:
(Л.Полинг и Дж.Слейтер, 1931г.).
1. При гибридизации, т.е. смешивании валентных орбиталей различных подуровней, возникают новые (гибридные) орбитали, промежуточные по форме и энергии.
2. Число образующихся гибридных орбиталей всегда равно числу смешивающихся орбиталей.
3. Связи, возникающие путем перекрывания гибридных орбиталей, совершенно одинаковы (имеют одну и ту же энергию и длину) и направлены симметрично. Исходя из этого, образующиеся при этом молекулы неполярны или малополярны.
4. Гибридные электронные облака асимметричны (рис.), поэтому они могут образовывать только σ-связи; перекрывание орбиталей происходит в большей степени и химические связи обладают большей прочностью, чем связи, образованные за счет негибридных электронных орбиталей.
5. При образовании кратных связей, π- связи образуются за счет негибридных орбиталей.
6. Геометрическую форму молекулы определяют σ-связи.
7. Тип гибридизации определяется типом и количеством смешивающихся орбиталей (sp-, sp2-,sp3-,dsp2-,dsp3-, sp3d2—).
Рассмотрим образование химических связей в молекуле ВеF2:
В образовании связей участвуют 2s— и 2рх-орбитали возбужденного атома бериллия (рис. 6, а), которые должны перекрываться с соответствующими 2р-орбиталями атомов фтора. Из характера перекрывания следует, что связь, образованная 2рх-орбиталью бериллия, должна быть более прочной, чем связь, образованная его 2s-орбиталью. Направление образования первой связи строго определенное – вдоль оси х. Перекрывание 2s-орбитали не имеет преимущества в каком-либо направлении, поэтому угол между связями в молекуле ВеF2 может быть переменным.
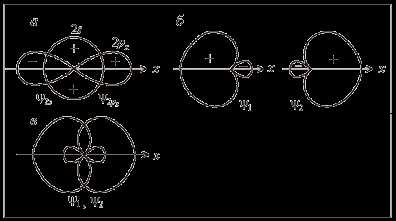
Рис. 6. Образование гибридных sp-орбиталей ψ1 и ψ2
(плюс и минус – знаки волновой функции)
Однако эти выводы противоречат экспериментальным данным, которые однозначно указывают, что угол между связями составляет 180° и они равноценны. Оказалось, что подобное несоответствие теории и эксперимента наблюдается там, где связи центрального атома образованы орбиталями разного типа симметрии (например, s и р; р и d; s, р и d).
Для объяснения такого несоответствия Л.Полинг и Дж.Слейтер разработали теорию гибридизации. Сущность ее состоит в том, что близкие по энергии валентные орбитали с различной симметрией преобразуются в такое же количество одинаковых гибридных орбиталей, каждая из которых представляет собой продукт смешения исходных орбиталей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание.
В нашем примере в гибридизации участвуют одна 2s— и одна 2р-орбиталь атома бериллия. Такой случай называется sp-гибридизацией. Гибридные орбитали представляют собой линейные комбинации исходных атомных орбиталей с учетом знаков их частей – «лопастей» (для 2s-функции общепринято выбирать знак плюс):
ψ1 = а1ψs + b1ψp (1)
ψ2 = а2ψs + b2ψp (2)
где a1, a2, b1, b2 – нормированные коэффициенты; в данном случае
a1 = a2 = –b1 = b2 = 1/√2.
На рис. 6, б показана форма sp-гибридных орбиталей, графически построенных согласно формулам (1) и (2). При смешении волновых функций с одинаковыми знаками они складываются, а с противоположными – вычитаются. Поэтому гибридные волновые функции сильно деформированы вдоль оси симметрии и ориентированы вдоль нее. Линейное расположение (рис. 6, в) обеспечивает их минимальное отталкивание и минимальную энергию системы.
Отсюда становится понятным угол между связями (Be–F), равный 180°, и равноценность связей (рис. 7).
Рис. 7. Орбитали молекулы BeF2
Гибридные орбитали ψ1 и ψ2 по энергии занимают промежуточное положение между исходными атомными орбиталями (s и p) (рис. 8). Суммарная энергия электронов на гибридных орбиталях даже несколько больше, чем на исходных. Несмотря на то, что на гибридизацию затрачивается энергия, лучшее перекрывание гибридных орбиталей по сравнению с исходными атомными не только компенсирует энергетические затраты, но и обеспечивает энергетический выигрыш. В противном случае гибридизация не происходит.
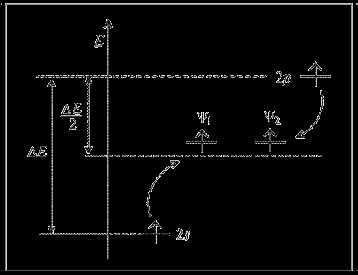
Рис. 8. Энергетическая диаграмма sp-гибридизации
sp-Гибридизация характерна для элементов II группы, но возможна и для атомов других элементов, образующих две s-связи с участием одной s— и одной р-орбиталей.
Участие в образовании связей одной s— и двух р-орбиталей центрального атома приводит к sp2-гибридизации. Гибридизация такого типа характерна для соединений элементов III группы.
Рассмотрим ее на примере молекулы ВF3. В возбужденном атоме бора при образовании связей происходит гибридизация трех орбиталей – 2s, 2рх, 2рz:
(Здесь у двух атомов фтора показаны только 2р-электроны, образующие связи.) Три гибридные орбитали (sp2)g в соответствии с принципом наименьшей энергии ориентируются так, чтобы отталкивание между ними было минимальным. Этому отвечают углы между осями гибридных орбиталей, равные 120° (рис. 9). Поэтому молекула ВF3 – плоская, связи в ней – равноценные, направленные по углам правильного треугольника.
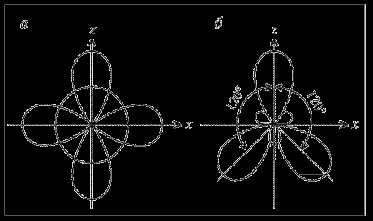
Рис. 9. sp2-Гибридизация: а – исходные 2s-, 2рx— и 2рz-орбитали;
б – гибридные 2(sp2)g-орбитали
sp3-Гибридизация, в которой участвуют s-орбиталь и все три p-орбитали, характерна для соединений элементов IV группы периодической системы, в частности для насыщенных углеводородов. Рассмотрим молекулу метана СН4.
В этом случае (при sp3-гибридизации) образуются четыре sp3-гибридные орбитали, направленные в пространстве по углам тетраэдра. Углы между осями гибридных орбиталей составляют 109,46° (рис. 10). Рассмотренный ранее ион аммония NH4+ также имеет тетраэдрическое строение благодаря sp3-гибридизации.
Рис. 10. Ориентация sp3-гибридных орбиталей в молекуле СН4
В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. При образовании комплексного иона [АlF6]3– происходит sp3d2-гибридизация, в которой участвуют вакантные d-орбитали:
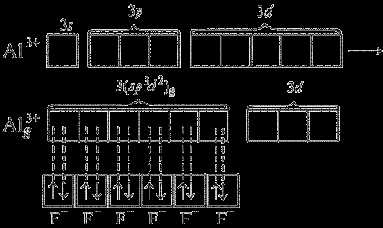
Такие шесть гибридных орбиталей направлены по углам октаэдра. Угол между связями 90° (рис. 11).
Рис. 11. Ориентация sp3d2— и d2sp3-гибридных орбиталей
В комплексном ионе [Fе(СN)6]4– в гибридизации участвуют «внутренние» d-орбитали предвнешнего квантового слоя. При возбуждении иона Fе2+, входящего в состав комплекса, происходит спаривание 3d-электронов и переход в гибридное валентное состояние:
Связи образуются в результате взаимодействия вакантных гибридных d2sp3-орбиталей иона *Feg2+и неподеленных пар электронов шести ионов СN–. Тип гибридизации – d2sp3. Геометрическая форма комплекса также октаэдрическая.
Гибридизация с участием d-орбиталей дает и другие структуры молекул и сложных ионов.
Таким образом, направленность валентности обусловлена ориентацией гибридных орбиталей в пространстве. В обобщенной форме это представлено в табл. 1.
Таблица 1
Пространственная конфигурация молекул и ионов
| Тип гибрдизации | Валентные углы, форма молекулы | Примеры |
| sp | 180° линейная | H–Be–H, HC≡CH |
| sp2 | 120° плоская тригональная | H2C=CH2, C6H6, BCl3 |
| sp3 | 109°28’ тетраэдрическая | [NH4]+, CH4, CCl4, H3C–CH3 |
| sp2d | 90° квадратная | [Ni(CN)4]2–, [PtCl4]2– |
| sp3d или dsp3 | 90°, 120° тригонально-бипирамидальная | PCl5 |
| d2sp3 или sp3d2 | 90° октаэдрическая | [Fe(CN)6]3–, [CoF6]3–, SF6 |
infopedia.su
|
ТОП 10: |
Ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями атомных электронных облаков (АО) в пространстве. Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью. Она возникает при перекрывании s-орбиталей, s- и p-орбиталей, р-, d-орбиталей, d- и s-орбиталей и т. д. (рис. 7) Связь, образованная перекрывание АО по обе стороны линии, соединяющей ядра взаимодействующих атомов, называется π-связью. Она возникает при перекрывании р – р-орбиталей, p – d-орбиталей, d – d-орбиталей, f – p-орбиталей и пр. (рис. 8). Гибридизация орбиталей — это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле. Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
На практике вначале экспериментально устанавливают геометрическую структуру молекулы, после чего описывают тип и форму атомных орбиталей, участвующих в её образовании. Например, пространственная структура молекул аммиака и воды близка к тетраэдрической, но угол между связями в молекуле воды равен 104,5˚, а в молекуле Nh4 – 107,3˚. Чем это можно объяснить?
9.Термодинамика, ее основные понятия: внутренняя энергия, температура, теплота, работа. Закон сохранения энергии. Первое начало термодинамики. Внутренняя энергия тела — это сумма кинетической энергии хаотического теплового движения частиц, составляющих тело, и потенциальной энергии их взаимодействия. Внутренняя энергия тела не зависит от его движения и его положения относительно других тел. Теплота Q есть форма передачи энергии от одного тела другому посредством соударения микрочастиц, составляющих тела является микрофизической характеристикой процесса передачи энергии. Если контакта между телами нет и нет никакого посредника для передачи кинетической энергии, следовательно нет соударений между микрочастицами тел и Q = 0. Работа А – это форма обмена энергией системы с окружающей средой посредством направленного движения макросистемы как целого. Например, газ в цилиндре под поршнем расширяется и совершает работу, поднимает груз на некоторую высоту. (рис. 35). Работа совершается за счет энергии нагревателя, передаваемой в форме теплоты. Газ совершает направленное движение, перемещая поршень с грузом, поэтому работа является макрофизической формой обмена энергией системы и окружающей среды. Первое начало термодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
В изохорном процессе газ работы не совершает, и ΔU = Q. В изобарном процессе A = pΔV = p (V2 – V1). В изотермическом процессе ΔU = 0, и A = Q; вся теплота, переданная телу, идет на работу над внешними телами. Графически работа равна площади под кривой процесса на плоскости p, V |
infopedia.su
Гибридизация
Химикам известно около двух миллионов соединений, содержащих углерод, и всего около ста тысяч соединений, безуглеродных соединений. У очень большой части углеродосодержащих соединений имеются атомы углерода, связанные с четырьмя другими атомами, и в этих случаях углы между связями оказываются поразительно близкими к тетраэдрическому углу $109^\circ 28’$, или приблизительно $109,5^\circ$. Как можно объяснить характерное тетраэдрическое расположение четырех атомов вокруг атома углерода, основываясь на представлениях об атомных орбиталях?
$sp^3$-Гибридизация
Рассмотрим простейший случай — молекулу метана $CH_4$. В основном состоянии газообразный атом углерода, как известно, обладает электронной конфигурацией $1s^2$; $2s^2$, $2p^2$, причем одна из $р$-орбиталей остается свободной, а две другие содержат по одному электрону. Таким образом, орбитали углерода могут принять на себя еще четыре электрона. Поэтому и не удивительно, что существует молекула $CH_4$, так как каждый из четырех атомов водорода может поставить по одному электрону на орбитали углерода, перекрываясь с ними своей $1s$-орбиталью. Но какие же углы между связями следует предсказать для образующейся при этом молекулы $CH_4$?
Три $p$-орбитали, направленные под прямыми углами друг к другу, должны образовывать три связи, также расположенные под прямыми углами друг к другу.
Если бы четвертый атом водорода перекрывался $2s$-орбиталью углерода (обладающей сферической симметрией), то он мог бы занимать любое положение относительно атома углерода. Ясно, что, поскольку три положения на трех взаимно перпендикулярных осях заняты тремя другими атомами водорода, четвертый атом водорода скорее всего должен быть расположен где-то со свободной стороны атома углерода. Допустим, что этот атом водорода занимает положение, равноудаленное от трех остальных атомов водорода, которые перекрываются своими орбиталями с $p$-орбиталями атома углерода. Тогда молекула метана должна была бы иметь форму треугольной пирамиды. Три атома водорода, перекрывающиеся с $p$-орбиталями углерода, дали бы три связи под углами $90^\circ$ друг к другу, образующие равностороннее основание пирамиды. Четвертый атом водорода, перекрывающийся с $s$-орбиталью углерода, занимал бы вершину этой пирамиды и все прилегающие к ней грани представляли собой равнобедренные треугольники. Все четыре связи $C-H$ имеют одинаковую длину, энергию, частоту колебаний, полярность и расположены под одинаковыми углами друг к другу. Если они действительно образованы в результате перекрывания орбиталей атома углерода и четырех атомов водорода, каждое такое перекрывание должно быть совершенно идентично с тремя остальными.
Тетраэдрическое связывание атома углерода может быть исследовано методами квантовой механики, но и в этом случае нет необходимости проводить вычисления, чтобы понять ход рассуждений и выводы, к которым они приводят. Задача заключается в том, чтобы найти наиболее устойчивый набор орбита- лей, на которых можно разместить восемь электронов (четыре валентных электрона углерода и четыре электрона от четырех атомов водорода), исходя из наличия одной $2s$-орбитали и трех $2p$-орбиталей у атома углерода. Согласно опытным данным, в результате образуется набор из четырех идентичных связей, тетраэдрически располагающихся в пространстве. Разумеется, к такому же выводу приводит и квантовомеханическое рассмотрение. Этот новый набор из четырех идентичных и тетраэдрически расположенных орбиталей называется гибридизованной формой исходных $2s-$ и $2p$-орбиталей или, иначе, $sp^3$-гибридизованными орбиталями. Гибридизация орбиталей типа $sp^3$ обнаруживается не только в случае атома углерода. Аналогичная гибридизация позволяет объяснить наблюдаемые на опыте свойства большинства соединений с четырехкоординираванными атомами кремния, германия, олова, свинца и многих других веществ. Отличие между поведением углерода, с одной стороны, и поведением хлора, серы и фосфора, с другой стороны, заключается в том, что при образовании $HCl$, $H_2S$ и $PH_3$ все частично незаполненные орбитали имеют одинаковую симметрию — во всех этих случаях речь идет о $p$-орбиталях. Однако образование четырех связей углеродом требует комбинации свойств симметрии $p$- и $s$-орбиталей. В результате возникает тетраэдрическая $sp^3$- гибридизация.
Рисунок 1. Пространственная направленность $sp^3$-гибридных атомных орбиталей
$sp^2$-Гибридизация
В молекуле этилена (этена) $H_2C=CH_2$ двойная связь $C=C$ состоит из одной $\sigma$-связи и одной $\pi$-связи. $\sigma$-Связь образуется боковым перекрыванием двух одинаково направленных р-орбиталей соседних атомов углерода, промотированных в состояние $1s^22s^2p^3$. Оставшиеся одна $2s$-орбиталь и две $2p$-орбитали дают три эквивалентные $sp^2$-гибридные орбитали, а если орбитали эквивалентны, они должны располагаться как можно дальше одна от другой, т.е. в одной плоскости под углом $120^\circ$.
Схема образования трех $sp^2$-гибридных орбиталей приведена на рис. 2, где при сложении $p$-орбитали рассматриваются как векторы.
Рисунок 2. Образование $sp^2$-гибридных атомных орбиталей
Таким образом, молекулы этилена является плоской и ее двойная связь имеет электронную конфигурацию $\sigma^2 \pi^2$. Структура молекулы этилена приведена ниже:
Рисунок 3.
Одним из экспериментальных доказательств именно такой структуры этилена является торсионная жесткость двойной связи, т.е. отсутствие свободного вращения вокруг $C=C$-связи. Это обусловлено тем, что при вращении одной метиленовой группы относительно другой уменьшается перекрывание $p$-орбиталей, т.е. ослабляется (а при повороте на $90^circ$ исчезает совсем) $\pi$-связь. В этилене энергия $\pi$-связи составляет $65 ккал/моль$ — это очень высокий барьер, препятствующий внутримолекулярному вращению.
$sp$-Гибридизация
Молекула ацетилена (этина) $HC \equiv CH$ еще более ненасыщена, чем этилен. Ее электронная структура описывается связыванием двух $sp$-гибридизированных атомов кглерода, каждый из которых имеет две перпендикулярные $p$-орбитали:
Рисунок 4.
$sp$-Гибридные $АО$ называются диагональными, они придают молекулам линейную форму.
spravochnick.ru
