Как составить формулы солей по химии
Вообще всё зависит от химического уравнения…. К примеру можешь взять основание NaOH и кислоту h4PO4 и получишь соль Na3PO4 и ещё вода будет (Н2О). Химическая формула солей состоит из мееталла и кислотного остатка.
мама моя химия что нечем больше голову забть что ли?… А вооще зайди на гуголь и задай запос
Разбирая химическую формулу соли, мы неприменно должны обнаружить по меньшей мери две части. Это катион и анион. Катион — составляющая частица соли, ион, имеющий положительный заряд. Анион — отрицательный. В качестве катиона могут выступать ионы металлов, ион аммония (Nh5+) и ион водорода (в кислых солях, например NaHCO3). Анионом могут быть известные нам кислотные остатки, ОН группа (в основных солях, например Са (ОН) Cl ), а также составные комплексные ионы (часто это применимо для амфотерных металлов, к примеру соль Na2[Zn(OH)4] ). Для составления формул необходимо знать заряды соответствующих ионов (это плюсик или минусик, с цифрой или без, который рисуется сверху справа у значка иона) . Далее руководствуемся правилом, что молекула соли всегда заряжена нейтрально, тоесть домножаем зарады катиона и аниона на соответствующие коэффициенты, чтобы в сумме они давали нуль. К примеру, имеем ионы Са2+ и РО4 3-, т. е. нужно домножить Са2+ на 3, а РО4 3- на 2. 3*2 + 2*(-3) = 0. Формула Са3(РО4)2.
Соли. Названия и классификация солей.
В предыдущих разделах постоянно встречались реакции, в которых образуются соли.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 4.6. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
Таблица 4-6. Построение названий солей.
|
Соль какой кислоты |
Кислот-ный остаток |
Валент-ность остатка |
Название солей |
Примеры |
|
Азотная HNO3 |
NO3 |
I |
нитраты |
Ca(NO3)2 нитрат кальция |
|
Кремниевая H2SiO3 |
SiO32 |
II |
силикаты |
|
|
Серная H2SO4 |
SO42 |
II |
сульфаты |
PbSO4 сульфат свинца |
|
Угольная H2CO3 |
CO32 |
II |
карбонаты |
Na2CO3карбонат натрия |
|
Фосфорная H 3PO4 |
PO43 |
III |
фосфаты |
AlPO4 фосфат алюминия |
|
Бромоводородная HBr |
Br |
I |
бромиды |
NaBr бромид натрия |
|
Иодоводородная HI |
I | I |
иодиды |
KI иодид калия |
|
Сероводородная H2S |
S2 |
II |
сульфиды |
FeS сульфид железа (II) |
|
Соляная HCl |
Cl |
I |
хлориды |
NH4Cl хлорид аммония |
|
Фтороводородная HF |
F |
I |
фториды |
CaF2 фторид кальция |
Из таблицы 4-6 видно, что названия кислородсодержащих солей имеют окончания «ат», а названия бескислородных солей – окончания «ид».
В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит».Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях.
Все соли разделяются на средние, кислые и основные.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
|
H2SO3 |
+ |
2 NaOH |
= |
Na2SO3 |
+ |
2 H2O |
|
|
|
|
|
сульфит натрия (средняя соль) |
|
|
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
|
H2SO3 |
+ |
NaOH |
= |
NaHSO3 |
+ |
H2O |
|
|
|
|
|
гидросульфит натрия (кислая соль) |
|
|
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
|
Mg(OH)2 |
+ |
2 HCl |
= |
MgCl2 |
+ |
2 H2O |
|
|
|
|
|
хлорид магния(средняя соль) |
|
|
|
Mg(OH)2 |
+ |
HCl |
= |
Mg(OH)Cl |
+ |
H2O |
|
|
|
|
|
гидроксохлорид магния(основная соль) |
|
|
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Однокислотные основания таких солей образовать не могут.
В таблице 4.6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 4.7).
Таблица 4.7. Международные, русские и традиционные названия некоторых важных солей.
|
Соль |
Международное название |
Русское название |
Традиционное название |
Применение |
|
Na2CO3 |
Карбонат натрия |
Натрий углекислый |
Сода |
В быту – как моющее и чистящее средство |
|
NaHCO3 |
Гидрокарбонат натрия |
Натрий углекислый кислый |
Питьевая сода |
Пищевой продукт: выпечка кондитерских изделий |
|
K2CO3 |
Карбонат калия |
Калий углекислый |
Поташ |
Применяется в технике |
|
Na2SO4 |
Сульфат натрия |
Натрий сернокислый |
Глауберова соль |
Лекарственное средство |
|
MgSO4 |
Сульфат магния |
Магний сернокислый |
Английская соль |
Лекарственное средство |
|
KclO3 |
Хлорат калия |
Калий хлорнова-токислый |
Бертолетова соль |
Применяется в зажигательных смесях для головок спичек |
Например, ни в коем случае нельзя путать соду Na2CO3 и питьевую соду NaHCO3. Если нечаянно использовать в пищу соду вместо питьевой соды, можно получить тяжелый химический ожог.
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода– вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.
Приведем строение и название основной соли, формула которой выглядит: [Fe(OH)2]2CO3 – дигидроксокарбонат железа (III). При рассмотрении структурной формулы такой соли становится ясно, что эта соль –продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:
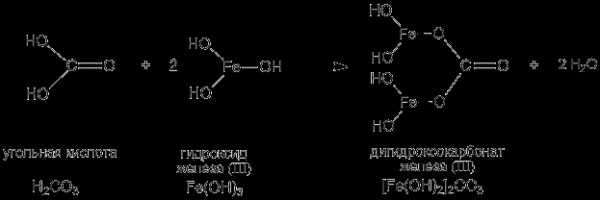
studfiles.net
Определение формулы неорганической соли | Задача по химии ЕГЭ
Приводится пример решения задачи, которая содержит две интересные особенности. Во-первых, основываясь на знаниях химических свойств веществ, требуется определить состав исходной соли. Во-вторых, необходимо учесть тот факт, что запись найденной формулы должна быть согласована с химическим смыслом.
Задача 2.10.
При прокаливании соли массой 12,8 г получили 7,2 г воды и 4,48 л (н.у.) бесцветного газа, который при обычных условиях реагирует только с литием и имеет относительную плотность по метану 1,75. Определите формулу соли.
Дано:
масса соли: m(соли) = 12,8 г;
масса воды: m(Н2О) = 7,2 г;
объем бесцветного газа (н.у.): V(газа) = 4,48 л;
относительная плотность газа по метану: D(СН4)= 1,75.
Найти: формулу исходной соли.
Решение:
Шаг 1. При прокаливании соли, очевидно, шла реакция разложения. Следовательно, в состав исходной соли входил водород и кислород. Для установления третьего элемента, образующего бесцветный газ определим его молярную массу:
М(неизвестного газа) = D(СН4) . М(СН4) = 1,75 . 16 = 28 г/моль.
Такое небольшое значение молярной массы значительно сокращает круг поиска. Кроме того, указание на низкую химическую активность газа позволяет предположить, что это — азот (N2). Предположение подтверждается возможностью химической реакции между азотом и литием при обычных условиях.
Обозначим формулу неизвестного вещества как НxOy Nz.
Шаг 2. В условии описана химическая реакция разложения исходной соли. Запишем ее схему:
НxOy Nz —> Н2О + N2
Шаг 3. По данным о продуктах разложения находим количество вещества атомов каждого из элементов в образце исходной соли.
а) определение количества вещества атомов азота:
б) определение количества вещества атомов водорода и кислорода будем вести по алгоритму:
Записываем соотношение количеств веществ атомов:
n(Н) : n(О) : n(N) = 0,8 : 0,4 : 0,4
Шаг 4. Находим простейшую формулу:
N(H):N(O):N(N) = 0,8 : 0,4 : 0,4
Выбираем наименьшее значение (в данном случае 0,4) и делим на него все 3 числа.
N(Н) : N(О) : N(N)= 2 : 1 : 1.
Получили набор наименьших целых чисел. Это позволяет нам записать простейшую формулу: Н2O1N1.
Шаг 5. Выявление истинной формулы.
Такая запись формулы не отражает химической сути вещества. Более того, по элементному составу невозможно однозначно отнести это вещество к какому-либо классу. С таким
элементным составом наиболее известны азотная (НNO3) и азотистая (HNO2) кислоты. Но в обоих случаях соотношение азота и водорода в формуле 1 : 1. В нашем же случае соотношение азота и водорода — 1 : 2 . Такому же элементному составу соответствуют аммонийные соли этих кислот. Нитрат аммония (NH4NO3) и нитрит аммония (NH4NO2). Соотношению атомов простейшей формуле соответствует истинная формула — (NH4NO2). В ней для придания химического смысла количество атомов удвоено по сравнению с простейшей формулой. Из записи (NH4NO2) видно, что искомое вещество – соль, состоящая из иона аммония (NН4)+ и кислотного остатка азотистой кислоты (NO2)–
Ответ:1 NH4NO2.
Большинство задач, в которых индексы в истинной формуле в несколько раз больше, чем в простейшей, содержат информацию об истинной молярной массе искомого вещества.
Она может быть выражена как напрямую, так и косвенно. Наиболее распространены данные об относительной плотности паров искомого вещества по известному газу. Но в некоторых
задачах тестов ЕГЭ такие данные отсутствуют, и необходимо путем комбинации атомов и увеличения индексов придать формуле химический смысл. В последней задаче наиболее рас-
распространенной ошибкой было отсутствие истинной формулы соли. В качестве ответа записывали простейшую формулу. Такая же ошибка присутствовала при решении задач с галогеналканами. Полученную простейшую формулу СН2F или СН2С1 в неизменном виде записывали в ответ, несмотря на то, что в данной записи валентность у углерода меньше 4.
В таких задачах разумно составлять структурную формулу и убедиться в реальном существовании вещества. Так в задачах с галогеналканами необходимо было индексы в СН2F или СН2С1 увеличивать в 2 раза и дигалогенэтан записать в виде ответа.
Комментарии:
1 Указанная в условии масса исходной соли не используется ни в данном варианте решения, ни в инструкции для проверяющих. Лишние, избыточные данные иногда встречаются в задачах тестов ЕГЭ.
buzani.ru
|
|
|
|||||||||
www.nscience.ru
Презентация по химии «Составление формул солей»
Презентация может быть использована на уроке химии в 8 классе по теме «Соли» для отработки навыков составления формул солей или первичного закрепления темы «Соли«, или для проверки умения составлять формулы и давать названия солям.
На первом слайде дается алгоритм составления формул солей.
На втором слайде в овальных фигурах записаны формулы кислот и оснований, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами кислот и оснований пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления.
На третьем слайде в прямоугольниках записаны формулы килотных и основных оксидов, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами оксидов пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления. Задания расположены в порядке усложнения.
На четвертом слайде дан алгоритм составления названий солей.
На пятом слайде даны формулы солей, которые ученик должен назвать. Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Соли – это сложные вещества, состоящие из атома металла и кислотного остатка.
Чтобы написать формулу соли по названию нужно:
1) написать на первом месте химический знак металла, на втором месте формулу кислотного остатка
2) проставить валентности металла и кислотного остатка
3) найти НОК, разделить НОК на валентности, получить индексы.
videouroki.net
Какая химическая формула у соли?
Какой соли? Если повареной — NaCl, соды — Na2CO3 питьевой соды — NaHCO3 и т. д. А вообще соли — это вещества, которые можно получить из основания и кислоты, например, Na2SO4
100% натрий хлор NaCl!!!
Соли чего? И какой кислоты? Соли соляной- NaCl, KCl, натрия и калия соответственно, серной NaSO4 и так далее.. . Простая бытовая соль имеет формулу NaCl но обычно имеет добавки йода иногда магния …
Na2SO4 — сульфат натрия
В составе любой соли — атомы металла и кислотные остатки. В составе кислой соли — дополнительно — незамещённые атомы водорода, а в составе основной — незамещённые гидроксогруппы. Если имелась в виду формула пищевой или поваренной соли, то это NaCl!
ПОВАРЕНА ТО NACI СОДА NANCO3 ПИТЬЕВАЯ СОДА NAHCO3 ИТД
ВОТ ПАЦАНЫ… круто кушать Натрий перемешанный в Хлоре !!!ахахах ))) 🙂
СОЛЕЙ МНОГО!!! ОЧЕНЬ ОЧЕНЬ МНОГО, ТАК ЧТО ПИШИ НАЗВАНИЕ!!!!
touch.otvet.mail.ru
Тренажер по химии 8 класс «Составление формул солей»
| А Тренажер «Составление формул солей» нионы кислотных остатков | Катионы металлов | |||||||||
| Na+ | K+ | Cu+ | Ca2+ | Mg2+ | Ba2+ | Cu2+ | Fe2+ | Fe3+ | Al3+ | |
| Cl— | 1. | 11. | ||||||||
| F— | 1 Na+F— | 2. | 12. | |||||||
| Br— | 3. | |||||||||
| I— | 4. | |||||||||
| S2- | 5. | |||||||||
| NO2— | 6. | |||||||||
| NO3— | 7. | |||||||||
| SO32- | 8. | |||||||||
| SO42- | 2 K+2SO42- | 9. | ||||||||
| SiO32- | 10. 6 Al3+2 (SiO3) 2-3 | |||||||||
| CO32- | ||||||||||
| PO43- | ||||||||||
1. Задание: Составьте формулы солей на пересечении линий, идущих, соответственно, от катиона и аниона.
Подсказка: на первое место в формуле соли ставим катион металла, на второе – анион. Над ионами указываем их заряды. Находим наименьшее общее кратное (НОК), делим его на заряд катиона металла – получаем индекс (число катионов металла). НОК делим на заряд аниона кислотного остатка – получаем индекс (число кислотных остатков). Если число кислотных остатков 2 или 3, то их берем в скобки.
K+ и SO42- :K+SO42-НОК=2 У калия 2:1=2, у сульфат-иона 2:2=1
2. Задание: Назовите формулы солей, обозначенных номерами.
Подсказка: при составлении названия соли записываем название кислотного остатка (таблица 5 с. 128) + название металла (в родительном падеже) + степень окисления металла (римская цифра в скобках для металлов с переменной степенью окисления).
Удачи! Учебник с. 126-132.
infourok.ru
