Азот, соединения азота
Азот, соединения азота
Азот – элемент V A группы главной подгруппы, значит, на внешнем энергетическом уровне у него 5 электронов. До завершения внешнего уровня ему не хватает 3 электрона, которые он может присоединить, в этом случае степень окисления его будет равна -3. Кроме этого, атом азота может и отдавать электроны и приобретать положительные степени окисления. Таким образом, для атома азота в соединениях возможны степени окисления от -3 до +5.
Рассмотрим соединения азота.
Например,
в аммиаке – NH3
– степень окисления азота -3; в оксиде азота (I) – N2O
– степень окисления азота +1; в оксиде азота (II) – NO
– степень окисления азота +2; в азотистой кислоте – HNO2
– степень окисления азота +3; в оксиде азота (IV) – NO2
– степень окисления азота +4; в азотной кислоте – HNO
Таким образом, если степень окисления азота -3, то он проявляет восстановительные свойства, если степень окисления +5, то азот проявляет окислительные свойства, а если у азота в соединении промежуточные степени окисления: +1, +2, +3, +4, то он может проявлять и окислительные, и восстановительные свойства.
Азот входит в состав воздуха, где его объёмная доля составляет 78%, он входит в состав земной коры и живых организмов. В космосе азот занимает по распространённости четвёртое место, вслед за водородом, гелием и кислородом.
Азот входит и в состав чилийской селитры – NaNO3 – это неорганическое вещество образовалось из остатков птичьего помёта в условиях сухого и жаркого климата. Широко распространена и калийная селитра – KNO3, встречающаяся в Индии.
Азот входит в состав всех белков, а белок просто необходим для жизни. Человек получает белок из растительной и животной пищи, а животные получают белок, в основном, из растений. А сами растения являются источником пополнения азота. Поэтому в природе постоянно происходит круговорот азота.
Так как азот входит в состав органических соединений, то он недоступен для растений. Но, в результате жизнедеятельности определённой группы бактэрий, органические соединения превращаются в неорганические – минеральные – это соли аммония и нитраты. И уже эти неорганические вещества усваиваются растениями. Затем растениями, которые усвоили азот, питаются животные и из растений получают необходимый белок.
Большую роль в фиксации азота играют клубеньковые бактерии, которые живут в клубеньках бобовых растений (клевера, гороха, люпина). Они усваивают атмосферный азот и превращают его в соединения, которые доступные растениям.
Кроме этого, соединения азота в почве пополняются за счёт грозовых ливней. Сначала из азота и кислорода образуется оксид азота (II), который под действием кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой в присутствии кислорода воздуха и получается азотная кислота. Кислота затем вступает во взаимодействие с соединениями натрия, кальция и калия, которые находятся в почве, и образует соли – селитры, которые нужны для питания растений.
Простое вещество азот состоит из двухатомных молекул – N2. В молекуле азота атомы связаны между собой тройной ковалентной неполярной связью. Эта связь очень прочная, поэтому азот является малоактивным веществом.
Азот является бесцветным газом, не имеет запаха и вкуса, немного легче воздуха. Не сжижается при обычной температуре, плохо растворим в воде, его температура плавления -210 0C, а температура кипения -196 0C.
В лаборатории азот получают разложением нитрита аммония при слабом нагревании.
Азот относительно инертен в химических реакциях. Он не реагирует ни с кислотами, ни с водой, ни со щелочами.
При обычных условиях азот реагирует только с литием. При этом образуется нитрид лития.
Литий повышает свою степень окисления с 0 до +1, а азот понижает с 0 до -3. Каждый атом алюминия отдает по 6 электронов молекуле азота, при этом литий является восстановителем, а азот окислителем.
С другими металлами азот реагирует только при высоких температурах.
Например, в реакции с магнием образуется нитрид магния. Магний изменяет свою степень окисления с 0 до +2, а азот понижает с 0 до -3. Каждый атом магния отдаёт по 3 электрона молекуле азота. Магний в реакции является восстановителем, а азот – окислителем.
При высоких температуре, давлении и в присутствии катализатора азот реагирует с водородом, образуя при этом аммиак. В этой реакции азот понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот является окислителем, а водород восстановителем.
Как видите, это реакция соединения, так как из двух простых веществ образуется одно сложное, реакция экзотермическая, так как протекает с выделением теплоты, обратимая, то есть идёт как в прямом, так и в обратном направлении, каталитическая, потому что в реакции присутствует катализатор – железо. Реакция является окислительно-восстановительной, потому что происходит изменение степеней окисления, реакция гомогенная, так как вступающие в химическую реакцию вещества и продукты реакции в одном агрегатном состоянии – газообразном.
При высокой температуре азот соединяется с кислородом, образуя оксид азота два.
В этой реакции азот повышает свою степень окисления с 0 до +2, а кислород понижает с 0 до -2. Азот является восстановителем, а кислород – окислителем.
Так как эта реакция идёт с изменением степеней окисления, то она является окислительно-восстановительной, это реакция соединения, потому что из двух простых веществ образуется одно сложное. Реакция обратимая, идёт в прямом и обратном направлении, эндотермическая, так как теплота поглощается, реакция некаталитическая, потому что не требует участия катализатора, является гомогенной, так как все вещества находятся в газообразном состоянии.
Следует отметить, что в реакциях с металлами и водородом азот проявляет окислительные свойства, а в реакциях с кислородом – восстановительные
Основная область применения азота – производство аммиака и азотной кислоты. Азот применяют также для создания инертной среды при сушке взрывчатых веществ, при хранении ценных произведений живописи и рукописей. Азотом раньше наполняли электрические лампы. Жидкий азот используют в охладительных системах.
В медицине чистый азот применяют в качестве инертной среды при лечении туберкулёза лёгких, а жидкий азот – при лечении заболеваний позвоночника и суставов.
В 1772 году английский учёный Резерфорд и шведский исследователь Шееле в экспериментах по сжиганию веществ обнаружили газ, не поддерживающий дыхание и горение. Позднее, в 1787 году, Лавуазье установил наличие в воздухе газа, не поддерживающего дыхания и горения. Он дал название этому газу «азот», означающее «безжизненный» (от латинского а – нет и зоэ – жизнь). В 1790 году Шапталь дал азоту другое название – нитрогениум – означающее «рождающий селитру».
Решим задачу. Определим массу соединения, которое образуется при нагревании металлического магния массой 7,2 г в азоте объёмом 10 л при нормальных условиях.
В условии задачи нам дана масса магния и объём азота. Найти необходимо массу образовавшегося соединения, то есть массу нитрида магния. Найдём количество вещества магния, для этого необходимо массу магния разделить на его молярную массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём количество вещества азота, для этого нужно объём азота разделить на молярный объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По уравнению реакции видно, что соотношение моль магния и азота составляет 3 : 1. Следовательно, количество вещества азота должно быть в три раза меньше количества вещества магния, то есть 0,1 моль. В результате вычислений мы получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в избытке, и количество вещества нитрида магния находим по магнию.
Получается, что количество вещества нитрида магния будет 0,1 моль, то есть 0,3 умножим на 1 и разделим на 3 и получится 0,1 моль. Найдём молярную массу нитрида магния. Для этого относительную атомную массу магния (24) умножим на 3 и прибавим относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль. Найдём массу этого вещества. Для этого следует количество вещества умножить на молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Таким образом масса нитрида магния будет равна десять г.
videouroki.net
СОЕДИНЕНИЯ АЗОТА
СОЕДИНЕНИЯ АЗОТА Органических азотистых соединений в нефтях в среднем не более 2–
3% и максимально (в высокосмолистых нефтях) до 10%. Большая часть азота концентрируется в тяжелых фракциях и в остаточных продуктах. Азотистые соединения нефти принято делить на основные и нейтральные.
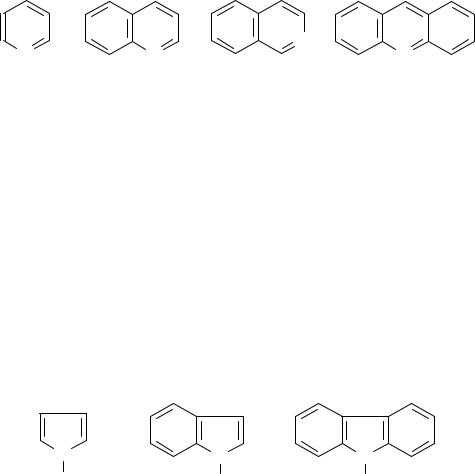
Вещества основного характера могут быть отделены от нефти обработкой слабой серной кислотой. Количество азотистых оснований составляет в среднем 30% от суммы всех соединений азота. При перегонке они попадают в дистилляты. Азотистые основания нефти представляют собой гетероциклические соединения с атомом азота в одном из колец, с общим числом колец от одного до трех. В основном они являются гомологами пиридина, хинолина, изохинолина, а также в меньшей степени акридина:
5 | 4 | 3 | 6 | 5 | 4 | 3 | 6 | 5 | 4 | 3 | 7 | 6 | 5 | 4 | 3 |
|
|
|
|
|
|
|
| ||||||||
6 | 1 2 | 7 | 8 | 1 | 2 | 7 | 8 | 1 | 2N | 8 | 9 | 10 | 1 | 2 | |
| N |
|
|
|
|
|
| N |
| ||||||
|
|
|
| N |
|
|
|
|
|
|
|
|
| ||
Пиридин |
| Хинолин |
| Изохинолин |
|
| Акридин |
|
| ||||||
В настоящее время установлено строение многих выделенных из нефти ближайших гомологов азотистых оснований этих классов. Пиридин и его гомологи – жидкости с резким запахом. Пиридин кипит при 115,26°С, является хорошим растворителем. Хинолин и изохинолин кипят при ~240°С. Изохинолин плавится при 25°С, а акридин – при 107°C.
Нейтральные вещества составляют большую часть (до 80%) азотистых соединений нефти и концентрируются в высокомолекулярной части нефтей. Строение и свойства их изучены мало. Можно считать доказанным наличие в некоторых нефтях гомологов пиррола, индола, карбазола:
N | N | N |
H | H | H |
Пиррол | Индол | Карбазол |
Азотистые соединения – как основные, так и нейтральные – достаточно термически стабильны, особенно в отсутствие кислорода, и не оказывают заметного влияния на эксплуатационные качества нефтепродуктов. Однако отмечено, что при хранении дизельных топлив и мазутов некоторые азотистые соединения вызывают усиленное смолообразование.
В 1934 г. Трейбс открыл наличие в нефтях порфиринов. В дальнейшем они были обнаружены во многих нефтях. Строение их показывает, что они близки к гемину (красящее вещество крови) и хлорофиллу.
CH =CH | Ch4 | Ch3=CH |
| CH | |
2 |
|
| 3 | ||
| CH |
| CH |
| |
|
|
| CH=Ch3 | ||
h4C | CH=Ch3 | h4C |
| ||
|
|
| |||
NH | N | N |
| N | |
|
| CH | |||
HC | CH | HC | Fe | ||
| |||||
N | HN | N |
| N | |
|
| ||||
|
|
| Ch4 | ||
h4C | Ch4 | h4C |
| ||
|
| ||||
| CH |
| CH |
| |
|
|
| Ch3 | ||
Ch3 | Ch3 | Ch3 |
| ||
|
| ||||
HCOO-CH | CH -COOH | HCOO-Ch3 |
| Ch3-COOH | |
2 |
|
|
| ||
| 2 |
|
|
| |
Прото-порфирин | Гем гемоглобина | ||||
В составе их молекулы имеется четыре пиррольных кольца. Порфирины весьма склонны к образованию комплексных соединений с металлами. В нефтях они находятся как в свободном состоянии, так и в виде комплексов с ванадием, никелем и железом.
Химические свойства азотсодержащих соединений а) Основные (щелочные) соединения
Пиридин можно рассматривать как бензол, в котором группа –СН=замещена атомом азота. И пиридин, и бензол имеют молекулы, представляющие собой практически правильный шестиугольник.
Наличие у атома азота неподеленной пары электронов приводит к тому, что пиридин (как и другие азотистые основания – хинолин, изохинолин, акридин) проявляют свойства третичных аминов. Прежде всего это свойства слабых оснований. В растворах они взаимодействуют с водой по основному
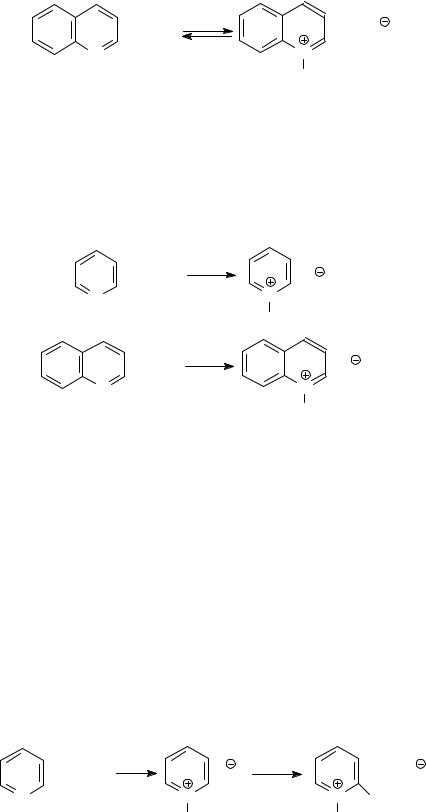
типу:
H
Гидроксид хинолиния
Концентрации гидроксильных ионов оказывается достаточно для образования гидроксидов целого ряда металлов: Fe3+, Co2+, Sn2+ и других.
Соединения легко образуют соли с кислотами, такими как соляная, бромоводородная, серная и другие:
N | N |
| H Бромид пиридиния |
+ HBr | Br |
N | N |
| H |
| Бромид хинолиния |
Соли хорошо кристаллизуются и используются для выделения и идентификации соединений азота. Интересно, что соли акридина в водных растворах имеют зеленую флуоресценцию, а при разбавлении вследствие гидролиза флуоресценция переходит в синюю, характерную для свободного акридина.
Как третичные амины, азотистые основания реагируют с галогеналкилами, образуя соответствующие соли, которые при нагревании изомеризуются в результате перехода заместителя от атома азота к атому углерода в положение 2 или 4 (но не 3):
+ С2H5I | I | to | I |
| |||
N | N | N | С2H5 |
|
| ||
| C2H5 | H |
|
| Йодид 1-этилпиридиния | Йодид 2-этилпиридиния | |
При обработке пероксидом водорода или пербензойной кислотой в уксуснокислой среде образуются оксиды азотистых соединений:
O
N-оксидхинолина
Пиридиновое ядро, присутствующее в молекулах всех указанных азотистых оснований, подвергается замещению электрофильными, нуклеофильными, радикальными реагентами. При этом нужно учитывать, что присутствие атома азота обедняет кольцо электронной плотностью вследствие его сильного положительного индукционного эффекта, причем особенно обедняются положения 2,4,6. Присутствие алкильных или других донорных заместителей облегчает реакции электрофильного замещения.
При нагревании пиридина в течение 24 часов с дымящей серной кислотой до 220-230°Св присутствии сульфата ртути образуетсяпиридин-3-
сульфокислота:
o | SO3H |
t |
|
+ HOSO3H | + H O |
| 2 |
N | N |
Вхинолиновых или акридиновых циклах, помимо пиридинового, присутствуют бензольные кольца, более активные в реакциях замещения. Поэтому реакции замещения протекают у этих соединений гораздо легче.
Вслучае хинолина индукционное влияние атома азота приводит к обеднению электронной плотностью положений 2,4 пиридинового и 5,7 – бензольного кольца. Поэтому электрофильные агенты атакуют прежде всего положения 8,6:
| h3SO4 | NO3 |
|
| + HNO3 | — h3O | |
N | N |
| N |
| H |
| NO2 |
| Нитрат хинолиния | 8-Нитрохинолин | |
|
|
| |
Общей реакцией азотистых соединений является их способность восстанавливаться водородом:
H | H |
+ 2[H] |
|
Zn+HCl | N |
N | |
| H |
Акридан | |
б) Нейтральные азотистые соединения
В этих соединениях присутствует пятичленное кольцо с атомом азота, находящимся в состоянии sp3-гибридизации,имеющим атом водорода. В
образовании ароматической электронной системы участвуют как 4 π-
электрона двух связей С=С, так и неподеленная пара электронов атома азота,
что приводит к формированию единого шестиэлектронного π-облака– ароматической структуры, подобной бензолу. В результате кольцо пиррола становится плоским, простые связи укорачиваются. Строение пиррольного кольца представлено на схеме (длина связи указана в ангстремах).
| 1,44 |
|
|
|
|
|
| Пиррол является |
| настолько слабой | кислотой, | что | ||||||||||||||||
| o |
|
| 1 | часто | рассматривается | как нейтральное соединение | (Кд= | ||||||||||||||||||||
109 |
|
|
| 3 | ||||||||||||||||||||||||
|
|
| , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
o |
|
| 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
o |
|
| 5,4×10 | -15 | ). |
| Соли пиррола | образуются | лишь | при | ||||||||||||||||||
110 |
|
|
|
|
|
|
| |||||||||||||||||||||
| 100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
| 2 | взаимодействии с активными восстановителями, например, | ||||||||||||||||||||||
|
|
|
| 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
| N |
| , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
| 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
| металлическим калием или реактивом Гриньяра. |
| |||||||||||||||||||||
| H |
|
|
|
| |||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
| При сплавлении пиррола с сухим гидроксидом калия также | ||||||||||||||||||||||
осуществляется замещение водорода и образование пирролкалия: |
| |||||||||||||||||||||||||||
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
| + K |
|
| 2 |
|
|
|
| + h3 ; |
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
| N |
|
|
|
|
|
|
|
|
|
| N |
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| H |
|
|
|
|
|
|
|
|
|
| K |
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| + KOH |
|
|
|
|
|
|
| + h3O |
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
| N |
|
|
|
|
|
|
|
|
|
| N |
|
|
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| H |
|
|
|
|
|
|
|
|
|
| K |
|
|
| ||||
Пирролкалий (но не сам пиррол!) реагирует с алкилгалогенидами, например, йодистым этилом, с образованием замещенных пирролов:

|
|
|
| + C2H5I |
|
|
|
|
|
|
| нагре- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| вание |
|
|
|
|
|
| |
|
|
|
|
| — KI |
|
|
|
|
|
|
|
| N | С2Н5 | |||
| N |
|
|
| N |
|
| |||||||||||
|
|
|
|
|
|
| ||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
| K |
|
|
|
| C2H5 |
|
| H |
| ||||||||
|
|
|
|
|
| 1-этилпиррол | 2-этилпиррол | |||||||||||
Основные свойства пиррола, являющегося формально вторичным амином, маскируются быстрой полимеризацией под действием кислот.
Интересной качественной реакцией пиррола является покраснение сосновой лучины, смоченной соляной кислотой, в присутствии паров пиррола. Предполагается, что это происходит вследствие полимеризации пиррола в кислой среде.
Пиррол легко восстанавливается водородом:
|
|
|
|
|
| [H] |
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Zn + Ch4COOH |
|
|
| 2,5-дигидропиррол |
|
|
|
|
|
|
| N | |||
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| H |
| |
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
| N |
|
| h3 (Pt) |
|
|
|
| ||
|
|
|
|
|
|
|
|
|
| |
| H |
|
|
| тетрагидропиррол, | |||||
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
|
| N | ||
|
|
|
|
|
|
|
| пирролидин | ||
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
| H |
| |
studfiles.net
Соединения азота
Тема: «Соединения азота»
Анализ содержания экспериментальной части программы по данной теме свидетельствует, что большинство продуктов реакций являются минеральными удобрениями. Утилизировать отходы можно по следующей схеме: продукты реакции сильно разбавить водой, кислые смеси нейтрализовать известковой водой до слабого окрашивания с фенолфталеином, затем растворы использовать в качестве подкормки комнатных растений или подкормки растений на пришкольном участке. Работы, в которых используют серную кислоту, соединения меди, снабжены указаниями по утилизации продуктов реакции.
Опыт №1. Получение азота взаимодействием хлорида аммония с нитритом натрия
Оборудование и реактивы: Хлорид аммония, нитрит натрия, водяная баня, плитка, колба Вюрца, капельная воронка, пробирки, кристаллизатор с водой, стеклянные и резиновые газоотводные трубки, шпатель.
Уравнения реакций: NH4 Cl + NaNO2 ®NH4 NO2 + NaCl,
NH4 NO2 ® 2 H2 O + N2 – при нагревании
Ход работы: На холоде готовят насыщенный раствор хлорида аммония (на 100 мл воды – 35 г. соли) и нитрита натрия (на 80 мл воды берут 50 г. соли). Колбу с газоотводной трубкой заполняют на 1/3 объема раствором хлорида аммония и закрывают пробкой с капельной воронкой, в которую наливают раствор нитрита натрия. Колбу нагревают на водяной бане и по каплям наливают раствор нитрита натрия к раствору хлорида аммония. Когда воздух из колбы будет вытеснен, азот собирают над водой в газометр, цилиндр или пробирку. Для равномерного выделения газа не стоит перегревать колбу и прибавлять слишком много нитрита натрия, иначе реакция идет очень бурно, происходит энергичное вспенивание. Если реакция будет идти бурно, то колбу опускают в холодную воду. Проверить качественной реакцией, что в пробирку собран азот. Для этого опускают в сосуд с азотом горящую лучинку. Она гаснет. Объясните, как отличить качественной реакцией азот от углекислого газа?
Техника безопасности : Проверить исправность, целостность шнура, вилки, электроплитки
Примечание : Смесь для получения азота можно использовать повторно.
Опыт №2. Растворение аммиака в воде
Оборудование и реактивы: U-образная трубка, трубка заполненная активированным углем, раствор фенолфталеина, вода, штатив с лапкой, спиртовка, спички, пробка, пробирка, хлорид аммония, гидроксид кальция, газоотводная трубка, ступка с пестиком, шпатель.
Ход работы: Собрать прибор согласно рис. 12.
Уравнения реакций: 2NH4 Cl + Ca(OH)2 ®CaCl2 +2NH3 +2H2 O (нагревание).
NH3 + H2 O®NH4 OH
Пробирку-реактор на 1/3 объема заполняют смесью равных порций сухих хлорида аммония и гидроксида кальция (предварительно тонко измельченных и перемешанных). В U-образную трубку наливают воду с добавлением нескольких капель фенолфталеина (воды, примерно, 1/5 высоты колена). U-образную трубку и пробирку соединяют резиновой трубкой, пробирку-реактор нагревают. О ходе реакции и выделения аммиака судят по изменению окраски воды в U-образной трубке, она становится малиновой. Избыток токсичного аммиака поглощается активированным углем в стеклянной трубке.
Техника безопасности. 1. Использовать трубку с активированным углем в целях избежания попадания аммиака в помещение. 2. Дно пробирки – реактора в лапке штатива несколько приподнято во избежание стекания капель воды, образующихся в результате реакции, и растрескивания пробирки.
Опыт №3. Синтез аммиака
Оборудование и реактивы: Штатив с лапкой, пробирка-реактор, пробка, газоотводная трубка, пробирка с водой, насыщенные растворы нитрита натрия и хлорида аммония, цинк гранулированный, серная кислота (1:5), железный порошок, вата, спиртовка, спички, фенолфталеин, стеклянная трубка, пипетка, вода, фарфоровая чашка, шпатель.
Ход работы: В сухую пробирку вставляют резиновый диск, вырезанный из пробки толщиной 0,3 см. Диск срезают на 1/3 его диаметра. На дно пробирки наливают пипеткой серную кислоту (1:5) и кладут несколько гранул цинка. На диск внутри пробирки помещают ватный тампон, смоченный смесью насыщенных растворов нитрита натрия и хлорида аммония. Пробирку закрывают пробкой с газоотводной трубкой. В горизонтальную часть трубки помещают катализатор – порошок восстановленного железа. Конец газоотводной трубки опускают в пробирку с небольшим количеством воды и 3–4 каплями фенолфталеина. Для начала реакции сильно нагревают железный порошок в газоотводной трубке. За это время выделяющийся по реакции цинка с серной кислотой водород вытеснит воздух из системы. Затем умеренно прогревают вату с растворами нитрита натрия и хлорида аммония и вновь прогревают железо. Это повторяется периодически до тех пор, пока вода в приемнике не окрасится в малиновый цвет. Выразить процессы уравнениями реакций.
Техника безопасности: При появлении интенсивной малиновой окраски газоотводную трубку вынимают из воды.
Утилизация: В пробирке-реакторе осталась смесь ZnSO4 и H2 SO4 . Переработка смеси описана в теме: «Теория электролитической диссоциации», опыт №1.
Опыт №4. Получение хлорида аммония
Вариант (а).
Оборудование и реактивы: U-образная трубка, пробка со стеклянной трубкой и влажным активированным углем, газоотводная трубка, пробка, вода, хлорид аммония (крист.), гидроксид кальция (крист.), соляная кислота (конц.), спиртовка, спички, ступка с пестиком, шпатель.
Ход работы : Смочить U-образную трубку концентрированной соляной кислотой. В пробирку поместить измельченную и перемешанную смесь равных частей кристаллических хлорида аммония и гидроксида кальция на 2/3 ее высоты. Герметично соединить все элементы прибора. Нагреть смесь веществ в пробирке. Идут следующие химические процессы:
2NH4 Cl + Ca(OH)2 ® 2NH4 OH + CaCl2 ; NH4 OH®NH3 + 2H2 O
Аммиак, попавший в U-образную трубку, взаимодействует с соляной кислотой. Появляется белый дым хлорида аммония. Нагревание прекращают.
HCl + NH3 ®NH4 Cl
Техника безопасности: 1. Мыть сосуды установки после охлаждения под тягой или на улице. 2. Пробирку-реактор закрепляют в лапке штатива так, чтобы дно располагалось выше отверстия.
Вариант (б).
Оборудование и реактивы: Два одинаковых цилиндра или стакана, две стеклянные пластинки, раствор аммиака (конц.), соляная кислота (конц.).
Ход работы : Один цилиндр или стакан ополаскивают концентрированным раствором аммиака, другой цилиндр – концентрированным раствором соляной кислоты. Обе емкости закрывают стеклянными пластинами, затем подносят отверстиями друг к другу, после чего убирают стеклянные пластины. Цилиндр заполняется белым дымом.
Техника безопасности: Цилиндры смачивать концентрированными растворами соляной кислоты и аммиака под тягой.
Опыт №5. Горение аммиака в кислороде
Вариант (а).
Оборудование и реактивы: Штатив с лапкой и кольцом, прокладки резиновые, круглодонная колба, пробка, патрубок с пробкой и двумя отверстиями в ней, спиртовка, спички, кислород, раствор аммиака (25%), лучина.
Ход работы : Колбу, заполняют на 1/5 объема концентрированным аммиаком, ставят на асбестовую сетку, закрывают пробкой с прямой газоотводной трубкой, зауженный конец которой проходит через пробку с патрубком (длина трубки 10–15 см). Колбу с концентрированным аммиаком слабо нагревают. Когда появляется запах аммиака, включают ток кислорода. Заполнение патрубка кислородом определяют тлеющей лучинкой, пламенем которой и поджигают аммиак. Он горит зеленоватым пламенем. Если прекратить подачу кислорода, то пламя аммиака гаснет. Пламя горящего аммиака может сбиваться слишком сильным током аммиака.
Техника безопасности: Смесь аммиака с кислородом – взрывоопасна. Не допускать сильного нагревания раствора аммиака в колбе и, таким образом, не допускать сильного тока аммиака.
Вариант (б).
Оборудование и реактивы: Химический стакан на 500 мл, пробирка круглодонная, штатив с лапкой, прокладки резиновые, пробки с изогнутой газоотводной трубкой, кислород, лучинки, хлорид аммония (кристал.), гидроксид кальция (кристал.), ступка с пестиком, шпатель.
Ход работы: Получают аммиак реакцией обмена (см. опыт 2). В химический стакан или стеклянную банку опустить на дно газоотводную трубку, по которой идет кислород и другую изогнутую трубку, подающую аммиак из пробирки-реактора. Поджигают аммиак горящей лучиной.
Техника безопасности: Пробирку-реактор расположить в штативе так, чтобы дно было выше отверстия.
Опыт №6. Получение азотной кислоты из нитратов
Оборудование и реактивы: Спиртовка, спички, пробирка Вюрца, химический стакан, лед, трубка с активированным углем, кристаллический нитрат натрия, концентрированная серная кислота, соединительная газоотводная трубка, пробирка-реактор, шпатель.
Ход работы: В пробирку–реактор с газоотводной трубкой помещают кристаллический нитрат натрия (примерно две ложечки для сжигания) и смачивают концентрированной серной кислотой. Пробирку соединяют короткой резиновой трубкой с сосудом Вюрца, которую помещают в стакан со льдом. В отросток пробирки Вюрца через резиновый шланг вставлена стеклянная трубка, заполненная активированным углем. При нагревании смеси концентрированной серной кислоты и кристаллического нитрата натрия в пробирке–реакторе получаются пары азотной кислоты, которые переходят в пробирку Вюрца. Там пары конденсируются и на дне накапливается безводная азотная кислота. Она имеет оранжевый цвет из-за растворенного в ней оксида азота (IV).
Техника безопасности: 1. Резиновые шланги использовать каждый раз новые, т. к. они разрушаются горячей азотной кислотой. 2. Не держать руками спиртовку под нагреваемой пробиркой-реактором. 3. Пробирка-реактор должна быть без дефектов. 4. Рекомендуется проводить опыт в реторте.
mirznanii.com
Соединения азота — Справочник химика 21
При сжигании некоторого соединения азота с водородом получено из 0 24 г вешества-0,27 г HjO и 168 мл азота (при 0°С и 101,3 кПа). Плотность пара азотсодержащего вещества по воздуху 1,1. Какова истинная формула вещества [c.16]Соединения азота расходуются в огромных количествах они используются в производстве минеральных удобрений, взрывчатых веществ и порохов, красителей и полупродуктов органического синтеза. Опасаясь нехватки природного сырья, химики начали изучать возможность использования азота воздуха. Этим вопросом занимался, в частности, немецкий химик Фриц Габер (1868—1934). Он выяснил, что азот вступает в реакцию с водородом при высоком давлении и высокой температуре в присутствии катализатора (железа), и поставил себе целью найти способ получения аммиака из азота воздуха и водорода. Превратить аммиак в нитраты было несложно. К 1908 г. Габер решил эту задачу. [c.141]
Какова молекулярная формула соединения азота с кислородом, если плотность этого газа ио водороду равна 15 а) N0 б) N2O в) NO2 [c.29]
Какие источники соединений азота были известны и использовались во второй половине XIX в. В связи с чем возникла и была решена в начале XX в. проблема связывания атмосферного азота В чем заключалась основная трудность решения этой проблемы, каковы свойства молекулярного азота [c.151]
Соединения фосфора из сточных вод извлекают с помощью коагуляции. Соединения азота удаляют методами отдувки, ионного обмена, электролиза, химическим или биологическим способом, Трехстадийная схема удаления соединений азота включает процессы аэрации, нитрификации и денитрификации. Б результате глубокой очистки содержание биогенных элементов снижается на 98—99%. [c.106]
Хотя воздух есть повсюду, в почве часто ощущается недостаток нитратов (наиболее распространенного типа соединений азота), который приходится восполнять, внося в почву органические или минеральные удобрения. [c.141]
Почти сразу же после начала первой мировой войны британский флот блокировал Германию, в результате чего в эту страну перестал поступать нитрат из Чили (наилучшее природное сырье). Между тем он был необходим для ведения войны, и вот немецкий химик Карл Бош (1874—1940) начинает работать над реакцией Габера, пытаясь создать промышленный способ получения аммиака, и к середине войны в Германии уже было налажено промышленное производство соединений азота. [c.141]
Сернистые соединения азота при гидролизе выделяют аммиак и образуют кислородные кислоты серы. Напротив, при гидролизе сульфидов фосфора наряду с кислородными кислотами фосфора образуется сероводород. О чем это говорит Какие можно сделать выводы о распределении электронных плотностей у N и Р [c.28]
Вследствие прочности молекулы N2 многие соединения азота эндо-термичны. Кроме того, энтропия их образования отрицательна (N2 — газ). Отсюда молекулярный азот химически малоактивен, а соединения азота термически малоустойчивы и относительно легко разлагаются прн нагревании. Поэтому азот на Земле находится главным образом в свободном состоянии. [c.345]
Гидрогенолиз азоторганических соединений. Азот в нефтяном сырье находится преимущественно в гетероциклах — в виде про — изв[c.205]
Сырье насосом 12 под давлением (4,7 МПа) подается на смешение с циркулирующим газом гидроочистки и избыточным водородсодержащим газом риформинга. Эта газосырьевая смесь подогревается в отдельной секции печи 16 (до 425 °С) и поступает в реактор гидроочистки 15. В реакторе на алюмо-кобальтмолибденовом катализаторе разрушаются присутствующие в сырье соединения серы, которые удаляются затем в виде сероводорода. Одновременно происходит очистка сырья от соединений азота и кислорода. [c.41]
Какие соединения азота получают путем непосредственного связывания (фиксации) атмосферного азота Привести реакции их получення и указать условия проведения реакций. [c.228]
Предупреждение взрывов соединений азота [c.93]
Какие соединения образует фосфор с водородом Указать способы нх получения. Сравнить их свойства со свойствами аналогичных соединений азота. [c.232]
Для предупреждения аварий, связанных со взрывом соединении азота, необходимо прежде всего исключить условия образования и накопления в аппаратуре взрывоопасных продуктов и их смесей (аммиака с кислородом, азотной кислоты с органическими продуктами, и т.д.). Необходимо соблюдать осторожность при транспортировке и переработке газовых смесей аммиака с окислами азота. Особые меры предосторожности должны приниматься при нитровании циклогексана азотной кислотой. Характерные аварии при нитровании углеводородов и рекомендации по повышению безопасности этого процесса даны в специальном разделе. [c.94]
Использование сернистого сырья вызывает необходимость его гидроочистки. Последние проекты предусматривают оснащение установок каталитического крекинга блоком гидроочистки, в котором соединения серы удаляются в виде сероводорода, а также происходит общее облагораживание сырья — очистка от соединений азота и кислорода. Содержание серы в сырье после гидроочистки снижается до 0,1—0,3 % (масс.). [c.37]
Получение аммиака в качестве побочного продукта на газовых заводах, а азотной кислоты из натриевой (чилийской) селитры не могло решить проблемы производства соединений азота в большом масштабе и имеет лишь историческое значение. [c.60]
РЕАКЦИИ ОЛЕФИНОВ С СОЕДИНЕНИЯМИ АЗОТА ТРЕХ- И ЧЕТЫРЕХОКИСЬ АЗОТА [c.376]
III-7, Реакция соединения азота и кислорода протекает при высоких температурах, В одном из промышленных процессов в реакцию проводят при [c.112]
Кинетика термического распада кислородных соединений азота и галогенов [c.156]
Обычно наблюдаемая степень удаления арота не превышает 30%, даже при высоких показателях по удалению серы. Прямая деструкция азотсодержащих соединений невозможна из-за высокой термической стабильности. Энергия разрыва связи С-КНг составляет 335,2 Дж/моль, т. е. практически равна энергии разрьта связи С-С. Удаление азота обязательно должно включать стадию насыщения кольца [36,40]. В результате расход водорода высок — 6-7 моль водорода на моль аммиака [37]. Для ускорения реакции деазотирования в катализаторе необходимы обе функции — гидрирования и гидрообессеривания [47], но они сильно зависят от типа соединений. Азотсодержащие соединения оказывают ингибирующее влияние на активные центры катализаторов гидрообессеривания, природа которых пока полностью не выяснена. В целом гидродеазотирование гетероциклических соединений азота изучено хуже, чем гидрообессеривание. Ясно, однако, что тип связи азота, так же как и связи серы, играет большую роль и определяет скорость деструктивного гидрирования азотсодержащих соединений. Например, алифатические амины значительно более реакционноспособны, чем ароматические. [c.56]
Впервые синтетический аммиак был использован во время первой мировой войны для производства взрывчатых веществ. Почти все взрывчатые вещества содержат соединения азота. До войны единственным источником связанного азота были залежи нитратов в Чили. Фиксация азота в форме аммиака дала Германии возможность продолжать войну, после того как английский флот отрезал ее от чилийских запасов. [c.521]
В каком из каждых двух примеров больше энтропия а) нераспечатанная колода карт или те же карты, разбросанные по столу б) собранный автомобиль или отдельные его части, необходимые для сборки в) диоксид углерода, вода, соединения азота и минеральные вещества или дерево, вырастающее из них [c.85]
Как влияет на неустойчивость соединений азота с длинными азотными цепями его атомов энергия связи молекулы N2 [c.340]
На основании реакций гидролиза соединений азота сделайте вывод о характере связей в них [c.28]
Предложите все возможные объяснения, почему при взаимодействии NO2 с водой не образуется кислота с тем же валентным соединением азота, а образуется смесь азотистой и азотной кислот. [c.28]
Органические соединения азота [c.6]
В настоящее время не существует единых международных норм на допустимое содержание в товарном газе сероводорода, диоксида углерода, сероорганических соединений, азота, воды, механических примесей и т.д. Величина допустимых концентраций этих веществ в газе в разных странах устанавливается в зависимости от уровня техники и технологии обработки газа и от объектов его использования. В России также пока не установлены нормы как на общее содержание серы, так и на содержание OS, Sj и других сернистых соединений в товарном газе, что вызывает затруднения при выборе технологических схем очистки газов от кислых компонентов. Требования, предъявляемые к содержанию сернистых соединений в газах, приведены в табл. 2.2, 2.3. [c.46]
Соединения азота (I), азота (И) и азота (IV). Для азота, как и дл ч хлора, характерны достаточ но устойчивые оксиды с нечетным числом электронов N0 и ЫОг- Их можю рассматривать как устойчивые вободные радикалы. Оба оксида — эндотермические соединения—их стандартные энтальпии ДЯ и энергии Гиббса образования АС/ имеют положительное знач ние. [c.359]
Помимо упомянутых компонентов, сухие газы каталитического крекинга содернсат большое количество (до 25% объемн.) неуглеводородных соединений (азот, углекислота, окись углерода, пары воды). Их не включают в материальный баланс процесса крекинга, но учитывают при расчете соответствующих аппаратов и определении мощности газовых компрессоров. Неуглеводородные компоненты, поступая в реактор вместе с циркулирующим катализатором, присоединяются к потоку продуктов реакции. [c.16]
В условиях каталитического крекинга на конверсию влияют все иоро-числонные выше факторы. Конверсия обычно определяется как разница между 100% и количеством остатка, кипящего выше 205° С в объемных процентах. Она является удобным показателем глубины крекинга как для пилотных, так и для промышленных установок. Тем не монее она пе определяет полностью влияние катализатора на исходное сырье. Первичные продукты реакции, кроме реакций деструкции, подвергаются под действием катализатора различным дополнительным реакциям, и остаток, кипящий выше бензина, не является таким же, каким он был в исходном сырье. В некоторых случаях, когда исходное сырье содержит относительно высокие концентрации соединений азота или тяжелых металлов, качество рециркулирующего продукта может быть заметно улучшено сравнительно с исходным Сырьем, благодаря тому, что значительная часть нежелательных соединений может быть удалена за первый проход над катализатором. Но тем не менее рециркулирующий продукт не является таким жо хорошим сырьем для получения бензина, как природная нефть. Это указывает на некоторую конверсию остатка, кипящего выше 205° С, хотя такая конверсия не отражается на величине конверсии, как было указано выше. [c.144]
Тщательная обработка серной кислотой или экстракция двуокисью серы с последующей мягкой сернокислотной обработкой удаляют ароматику и следы прочих вредных нримесей. Основной делью очистки является разрушение или удаление всех углеводородов нестабильного или ароматического характера, всех соединений кислорода и вообще всех веществ кислого характера, всех веществ, склонных к смолообразованию, всех соединений азота, поскольку они вызывают нестабильность цвета и большей части соединений серы, так как нри сгорании они образуют сернистый газ, вызывающий отложения на ламповых стеклах. [c.467]
В табл. VI, 1 приведены кинетические данные о распаде кислородных соединений азота и галогенов. Обращают на себя внимание высокие значения энергии активации и предэкспонен-циального множителя (последнее — для всех соединений, кроме N20). Первой открытой мономолекулярной реакцией была реакция распада пятиокиси азота, которая, по-видимому, пр1оте-кает по схеме [c.155]
Привести примеры соединений азота, в молекулах которых имеются связи, образованные по до-норно-акцепториому механизму. [c.228]
Из сказанного ясно, что условием образования водородной связи является высокая электроотрицательность атома, непосредственно связанного в молекуле с атомом водорода. Только при этом условии электронное облако атома водорода достаточно сильно смещается в сторону атома-партнера, а последний приобре тает высокий эффективный отрицательный заряд. Именно поэтому водородная связь характерна для соединений самых электроотри нательных элементов сильнее всего она проявляется у соединений фтора и кислорода, слабее — у соединений азота и еще слабее — у соединений хлора и серы. [c.155]
Энергия подородной связи значительно меньше энергии обычной ковалентной связи (150—400 кДж/моль). Она равна примерно 8 кДж/моль у соединений азота и достигает около 40 кДнмоль у соединений фтора. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т. е. их объединение в димеры (удвоергные молекулы) или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар. Именно ассоциация молекул, затрудняющая отрыв нх друг от друга, и служит причиной аномально высоких температур плавления н кипения таких веществ как фтороводород, вода, аммиак. Другие особенности этих веществ, обусловленные образованием водородных связей и ассоциацией молекул, будут рассмотрены ниже, при нзученни отделыгьгх соединений. [c.156]
А.зотная кислота — одно из важнейших соединений азота в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, слумсит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки, [c.414]
Изучение состава азотсодержащих веществ различных нефтей показало, что азот находится в них в виде соединений, обладающих основным, нейтральным или кислым характером. К числу азотистых соединений основного характера относятся пиперидин, пиридин и хинолин к нейтральным — бензпиррол, или индол, и карбазол 1 кислотным — пиррол и др. Реагируя со щелочными металлами, азотистые соединения образуют соответствующие соли. Особое место среди азотистых соединений нефтей занимают порфирины. Это комплексы из соединений азота с высокомолекулярными углеводородами, включающие металлы — ванадий и никель. Доказано наличие в нефтях кислых и основных порфиринов. В числе прочих азотистых соединений нефтей следует назвать аминокислоты и аммонийные соли. Они интересны как добавки, способные повышать адгезионные свойства битумов. [c.30]
Соединения азота в нефти, в отличие от соединений серы, обладают значительно большей термической устойчивостью и даже во вторичных процессах переработки нефти, как правило, не подвергаются разложению и не переходят в более легкие фракции. Поэтому в бензинах крекинга и риформинга азотистых соединений содержится так же мало, как и в бензинах прямой перегонки нефти [88]. Так, в бензине каталитического крекинга вакуумного газойля т уйма-зинской нефти — 0,02% азота, а в бензине прямой перегонки этой же нефти — 0,025%. Таким образом, в товарных автомобильных бензинах соединения азота или полностью отсутствуют или содержатся в очень малых количествах. [c.25]
Поскольку молярное отношение водорода к азоту (а следовательно, и отношение числа их атомов) в аммиаке составляет 1 0,667 = 3 2, аммиаку следовало бы приписать химическую формулу NjHj, N4Hg или высшее кратное первой из них. Такой результат должен был пошатнуть веру Дальтона в правило простоты, заставить его начать все сначала и отыскать правильный ход рассуждений. Однако его подвело низкое качество собственных экспериментальных данных. Полученное им первоначальное значение соединительного веса кислорода равнялось 6,5, и лишь в 1808 г. он изменил его до 7. Дэви довел это значение до 7,5, и наконец Пруст получил правильный соединительный вес кислорода-8 (основываясь на предположениях Дальтона). Дальтон отказывался верить этим результатам (поразительное упрямство для столь плохого экспериментатора ) и все проведенные здесь для соединений азота расчеты выполнял, пользуясь значением атомной массы азота 5 вместо 1. [c.283]
В этом соединении азот, обладавший в аммиаке неподеленной парой электронов, поставляет их на образование ковалентной связи с атомом В из BPj. Связь, образованная парой электронов одного атома (донора) при его взаимодействии с другим атомом (акцептором), называется донорно-акцеп-торной связью, или коорданационной ковалентной связью ее отличие от обычной ковалентной связи довольно условно, поскольку после того, как связь уже образована, она ничем не отличается от обычной ковалентной связи. [c.473]
Схема реакций гидрирования азотсодержащих соединений показывает, что оно идет с разложением молекулы гетеросоединения в результате разрыва связей углерод — азот и сопровождается образованием молекулы аммиака и соответствующего углеводорода. В этом смысле реакции азотсодержащих соединений сходны с реакциями гидрирования соединений серы. Существенное различие заключается в том, что соединения азота заметно более устойчивы в условиях гидрирования, разложение их наступает при более высоких температурах и давлениях. Так, многие серосодержащие соединения довольно легко разлагаются уже при температуре 280 °С и давлениях до 5 МПа разложение пиридина и хинолина наблюдается при температурах выше 350°С и давлениях 10—20 МПа. Нейтральные азотистые соединения более устойчивы, чем основные. Пиррол и его производные гидрируются при высоком давлении и температуре 400 °С, еще более устойчивы производные карбазола. С увеличением молекулярной массы устойчивость соединений азота надает, так что разложение высокомолекулярных соединений азота наблюдается уже при простом нагревании. Тем не менее для осуществления деазотирования в целом требуются более жесткие условия гидрогенизациоиного процесса. При проведении процесса в конкретных условиях глубина очистки от азотсодержащих соединений, как правило, меньше глубины обессеривания. [c.295]
chem21.info
Соединения азота — Знаешь как
Соединения азота люди умели получать давно. Ту же селитру приготовляли в особых сараях — селитряницах, но очень уж примитивным был этот способ. «Выделывают селитру из куч навоза, золы, помета, оскребков кож, крови, картофельной ботвы. Кучи эти два года поливают мочою и переворачивают, после чего на них образуется налет селитры»,— такое описание селитряного производства есть в одной старинной книге.
Источником соединений азота может служить и каменный уголь, в котором до 3% азота. Связанного азота! Этот азот стали выделять при коксовании углей, улавливая аммиачную фракцию и пропуская ее через серную кислоту.
Конечный продукт — сульфат аммония. Но и это, в общем-то, крохи. Трудно даже представить, какими путями развивалась бы наша цивилизация, не реши она во время проблему промышленно приемлемой фиксации атмосферного азота.
Впервые атмосферный азот связал еще Шееле. В 1775 г. он получил цианистый натрий, нагревая в атмосфере азота соду с углем:
Na2CО3 + 4С + N2 → 2NaCN + ЗСО.
В 1780 г. Пристли установил, что объем воздуха, заключенный в сосуде, перевернутом над водой, уменьшается, если через него пропускать электрическую искру, а вода приобретает свойства слабой кислоты. Этот эксперимент был, как мы знаем (Пристли этого не знал), моделью природного механизма фиксации азота. Четыре года спустя Кавендиш, пропуская электрический разряд через воздух, заключенный в стеклянной трубке со щелочью, обнаружил там селитру.
И хотя все эти эксперименты не могли в то время выйти за пределы лабораторий, в них виден прообраз промышленных способов фиксации азота — цианамидного и дугового, появившихся на рубеже XIX—XX вв. Цианамидный способ был запатентован в 1895 г. немецкими исследователями А. Франком и Н. Каро. По этому способу азот при нагревании с карбидом кальция связывался в цианамид кальция:
СаС2 + N2 → CaCN2 + С + 72 ккал,
В 1901 г. сын Франка, подав идею о том, что цианамид кальция может служить хорошим удобрением, по существу, положил начало производству этого вещества. Росту индустрии связанного азота способствовало появление дешевой электроэнергии. Наиболее перспективным способом фиксации атмосферного азота в конце XIX в. считался дуговой, при помощи электрического разряда.
Вскоре после строительства Ниагарской электростанции американцы неподалеку пустили (в 1902 г.) первый дуговой завод. Через три года в Норвегии вступила в строй дуговая установка, разработанная теоретиком и специалистом по изучению северного сияния X. Биркеландом и инженером-практиком С. Эйде. Заводы подобного типа получили широкое распространение; селитру, которую они выпускали, называли норвежской. Однако расход электроэнергии при этом процессе был чрезвычайно велик и составлял до 70 тыс. киловатт/час на тонну связанного азота, причем только 3% этой энергии использовалось непосредственно на фиксацию.
Через аммиак
Перечисленные выше способы фиксации азота были лишь подходами к методу, появившемуся незадолго до первой мировой войны. Это о нем американский популяризатор науки Э. Слоссон заметил, перефразируя Гейне: «Всегда говорилось, что англичане господствуют на море, а французы — на суше, немцам же остается только воздух. К этой шутке немцы отнеслись как будто бы серьезно и принялись использовать воздушное царство для нападения на англичан и французов… Кайзер… обладал целым флотом цеппелинов и таким способом фиксации азота, который не был известен никакой другой нации. Цеппелины разрывались, как мешки с воздухом, но заводы, фиксирующие азот, продолжали работать и сделали Германию независимой от Чили не только в годы войны, но и в мирное время»… Речь идет о синтезе аммиака — основном процессе современной индустрии связанного азота.
Слоссон был не совсем прав, говоря о том, что способ фиксации азота в аммиак не был известен нигде, кроме Германии. Теоретические основы этого процесса были заложены французскими и английскими учеными. Еще в 1784 г. знаменитый К. Бертолле установил состав аммиака и высказал мысль о химическом равновесии реакций синтеза и разложения этого вещества. Через пять лет англичанином У. Остином была предпринята первая попытка синтеза Nh4 из азота и водорода. И, наконец, французский химик А. Ле Шателье, отчетливо сформулировав принцип подвижного равновесия, первым синтезировал аммиак. При этом он применил высокое давление и катализаторы — губчатую платину и железо. В 1901 г. Ле Ш ателье запатентовал этот способ. Исследования по синтезу аммиака в начале века проводили также Э. Перман и Г. Аткинс в Англии. В своих экспериментах эти исследователи в качестве катализаторов применяли различные металлы, в частности медь, никель и кобальт…
Но наладить синтез аммиака из водорода и азота в промышленных масштабах впервые удалось, действительно, в Германии. В этом заслуга известного химика Фрица Га-бера. В 1918 г. он был удостоен Нобелевской премии по химии.
Технология производства Nh4, разработанная немецким ученым, очень сильно отличалась от других производств того времени. Здесь впервые был применен принцип замкнутого цикла с непрерывно действующей аппаратурой и утилизацией энергии. Окончательную разработку технологии синтеза аммиака завершил коллега и друг Габера К. Бош, который в 1931 г. также был удостоен Нобелевской премии — за развитие методов химического синтеза при высоких давлениях.
Вы читаете, статья на тему соединения азота
znaesh-kak.com
Соединения азота с водородом.
Пространственная структура молекулы NH3 близка к тетраэдрической, так как атом азота предоставляет для связывания с водородом не чистые р-орбитали, а sp3-гибридные орбитали. При этом неподеленная электронная пара тоже находится на sp3-гибридной орбитали. Благодаря неподеленной электронной пары, молекула аммиака проявляет оснóвные свойства, образуя с катионом водорода ковалентную связь по донорно-акцепторному механизму, в результате чего возникает комплексный ион – катион аммония, в котором катион водорода Н+ — комплексообразователь, а молекула NH3 – лиганд
Н+□ + :NH3 = [NH4]+
При обычных условиях аммиак – газ (Ткип. == -330С). Вследствие полярности молекулы и ее способности образовывать водородные связи аммиак хорошо растворяется в воде. При растворении в воде аммиак взаимодействует с ней, образуя слабое основание – гидрат аммиака NH3*Н2О, диссоциирующее с образованием иона аммония:
NH3 + H2O ↔ NH3*H2O ↔ NH4+ + OH—
Аммиачная вода имеет запах аммиака и называется нашатырным спиртом.
С сильными кислотами аммиак образует соли аммония:
2NH3 + H2SO4 = (NH4)2SO4 NH3 + H+ = NH4+
При нагревании щелочного раствора гидрата аммиака из него улетучивается аммиак, что определяется посинением универсальной индикаторной бумажки, помещенной над раствором:
NH4Cl + NaOH = NaCl + NH3*H2O = NH3↑ + H2O + NaCl
Эта реакция является качественной реакцией на катион NH4+ и на присутствие аммиака в системе.
Соли аммония термически неустойчивы и разлагаются при нагревании:
NH4Cl = NH3↑ + HCl↑
В тех случаях, когда анион аммонийной соли содержит окислитель, при высокой температуре происходит реакция внутримолекулярного окисления-восстановления, в которой атом азота аммония, имеющий степень окисления -3, выступает восстановителем:
NH4NO3 = N2O + 2H2O
(NH4)2Cr2O7 = 2N2 + Cr2O3 + 4H2O
Аммиак не горит на воздухе, но сгорает в чистом кислороде:
4NH3 + 5O2 = 4NO + 6H2O
Продуктом окисления аммиака другими окислителями является азот:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Получение аммиака.
В лаборатории аммиак получают действием щелочи на соли аммония при нагревании:
NH4Cl + NaOH = NaCl + NH3*H2O = NH3↑ + H2O + NaCl
В промышленности аммиак синтезируют из азота воздуха. Реакция синтеза аммиака из азота и водорода – обратимая, гомогенная, экзотермическая реакция, в результате которой происходит уменьшение объемов газообразных веществ, так как из 4-х объемов газовой смеси образуется 2 объема аммиака:
N2 + 3H2 ↔ 2NH3 +Q
Для увеличения выхода конечного продукта в данной системе, в соответствии с принципом Ле Шателье, следует понизить температуру, увеличит давление и систематически удалять аммиак из зоны реакции.
Кислородные соединения азота.
Азот образует с кислородом следующие оксиды: N2O, NO, N2O3, NO2, N2O5. Непосредственным окислением молекулярного азота получается лишь один NO. Другие оксиды образуются при восстановлении или окислении NO. На воздухе NO практически мгновенно окисляется до NO2:
N2 + O2 ↔ 2NO 2NO + O2 = 2NO2
Оксиды N2O и NO – несолеобразующие оксиды. Остальные оксиды азота – кислотные. При поглощении водой оксида N2O3 образуется азотистая кислота, при взаимодействии N2O5c водой образуется азотная кислота:
N2O3 + H2O = 2HNO2 N2O5 + H2O = 2HNO3
Оксид азота (IV) NO2 является смешанным оксидом, так как при его растворении образуется сразу две кислоты – HNO2 и HNO3:
2NO2 + H2O ↔ HNO2 + HNO3
Это реакция диспропорционирования.
При растворении NO2 в щелочах образуются соответствующие соли – нитриты и нитраты:
2NO2 + 2KOH = KNO2 + KNO3 + H2O
В окислительно-восстановительных реакциях оксиды азота (за исключением N2O5) могут быть и окислителями и восстановителями, так как содержат атомы азота в промежуточных степенях окисления:
2NO + O2 = 2NO2 4NO + CH4 = 2N2 + CO2 + 2H2O
4NO2 + O2 + 2H2O = 4HNO3 NO2 + SO2 = NO + SO3
Окислительно-восстановительная двойственность NO2 проявляется и при взаимодействии его с водой (см. выше).
Азотистая кислота
Малоустойчивая, слабая кислота.
HNO2 ↔ H+ + NO2—
Соли этой кислоты – нитриты гидролизуются в водном растворе по аниону, создавая щелочную среду:
NO2— + H-OH ↔ HNO2 + OH— NaNO2 + H-OH ↔ HNO2 + NaOH
В окислительно-восстановительных реакциях нитриты выступают или окислителями, или восстановителями в зависимости от свойств второго реагента:
2KNO2(ok-ль) + 2KI + 2H2SO4 = I2 + 2NO + 2K2SO4 + 2H2O
5KNO2(в—ль) + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Азотная кислота.
В молекуле HNO3 степень окисления атома азота +5, а его валентность равна IV. Атом азота может образовывать только четыре ковалентные связи (три за счет неспаренных р-электронов по обменному механизму и одну за счет неподеленной электронной пары по донорно-акцепторному механизму).
HNO3 = H+ + NO3—
Соли азотной кислоты – нитраты – хорошо растворимы в воде и не подвергаются гидролизу по аниону.
В окислительно-восстановительных реакциях соли азотной кислоты и сама кислота являются только окислителями. Причем окислительная активность азотной кислоты намного выше активности солей и зависит от концентрации кислоты в растворе. Азот в степени окисления +5, входящий в состав азотной кислоты, является настолько сильным окислителем в сравнении с катионом водородом, что среди продуктов восстановления азотной кислоты никогда не выделяется водород. Как правило, при окислении неметаллов и малоактивных металлов азотной кислотой выделяется ее устойчивые оксиды: NO2 (если кислота концентрированная) и NO (если кислота разбавленная):
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2 + 2H2O
8HNO3(разб.) + 3Сu = 3Cu(NO3)2 + 2NO + 4H2O
В зависимости от активности восстановителей и концентрации самой кислоты могут образовываться и другие продукты: NH4+, N2, N2O
10HNO3(разб.) + 4Zn = 4Zn(NO3)2 + N2O + 5H2O
12HNO3(разб.) + 5Сa = 5Ca(NO3)2 + N2 + 6H2O
10HNO3(оч.разб.) +4Zn = NH4NO3 + 4Zn(NO3)2 + 3H2O
Очень сильным окислителем является смесь концентрированных кислот HNO3+HCl (в объемном соотношении 1:3), называемая царской водкой. Эта смесь кислот способна растворять «благородные» металлы:
Au + HNO3 + 3HCl = AuCl3 + NO↑ + 2H2O
Соли азотной кислоты – нитраты — термически неустойчивы из-за внутримолекулярных окислительно-восстановительных превращений, в которых окислителем выступает N+5, а восстановителем – О-2. Нитраты разлагаются на кислород и соединение, состав которого зависит от природы катиона металла, входящего в состав соли. Когда в состав соли входят катионы щелочного или щелочноземельного металла, т.е. очень активных металлов, стоящих в ряду активности от Li до Mg включительно, то процесс идет до образования нитритов и кислорода:
2NaNO3 → 2NaNO2 + O2 (при нагревании)
Если в состав соли входит катион металла средней активности от Al до Cu включительно, процесс разложения идет до оксида металла, оксида азота(IV) и кислорода:
2Cu(NO3)2 = 2CuO + 4NO2 + O2(при нагревании)
Особое положение занимает нитрат аммония, при термическом разложении которого образуется N2O:
NH4NO3 = N2O + 2H2O
Вследствие сильных окислительных свойств нитритов и нитратов эти соединения чрезвычайно токсичны для организма человека, так как окисляют гемоглобин, вследствие чего он теряет способность переносить кислород из легких в ткани.
Получение азотной кислоты.
В промышленности азотную кислоту получают из аммиака путем его каталитического окисления до оксида азота(II). Полученный оксид азота окисляют до NO2, затем поглощают водой в присутствии кислорода под давлением:
4NH3 + 5O2 = 4NO + 6H2O 2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
Таким образом получают азотную кислоту с концентрацией 65%.
Азотная кислота – один из важнейших продуктов в химической промышленности. Около 75% производимой кислоты используется для получения минеральных удобрений. Кроме того, она расходуется на получение взрывчатых веществ, ракетного топлива и различных органических нитросоединений.
Азотные удобрения содержат азот в качестве основного питательного элемента для растений. Основные виды азотных удобрений: NaNO3 – чилийская селитра, KNO3 – калийная селитра, NH4NO3 –аммонийная селитра, NH3 – жидкий аммиак, CO(NH2)2 – мочевина. Растения усваивают азот в форме нитрат-аниона, поэтому аммиак, катион аммония и мочевина должны быть предварительно окислены почвенными бактериями в анион NO3—. При избыточной концентрации нитратов в почве овощи быстро развиваются и созревают, но не успевают перерабатывать нитраты и накапливают их, что наносит большой вред человеку и ускоряет гниение овощей при хранении.
Вопросы для контроля
1. Какие элементы составляют главную подгруппу пятой группы? Каковы закономерности изменения свойств элементов сверху вниз?
2. Какова электронная формула элементов подгруппы азота? Какие валентности и степени окисления характерны для них в соединениях?
3. Охарактеризуйте: а) характерные валентности; б) характерные степени окисления азота. Приведите примеры соединений с различными степенями окисления азота.
4. Какой тип химической связи в молекуле азота?
5. Каковы важнейшие формулы кислотных оксидов элементов подгруппы азота и соответствующих им гидроксидов вам известны?
6. Какие оксиды азота вам известны? Дайте им названия. Укажите валентность и степень окисления азота в каждом оксиде. Какой оксид азота применяется в медицине для наркоза?
7. Опишите физические и химические свойства азотной кислоты.
Задачи и упражнения для самостоятельной работы
1. Смешали 5 г аммиака и 5 г хлороводорода. Что оказалось в избытке и какова масса этого избытка?
2. Вычислить объемы (при н.у.) азота и водорода, необходимые для получения 17 г аммиака.
3. На реакцию с 50 мл раствора сульфата аммония израсходовано 30 мл 2 М раствора хлорида бария. Вычислить молярность раствора сульфата аммония. Сколько граммов сульфата аммония содержалось в 1 л раствора?
4. Соединением 3,648 г Mg с азотом получено 5,048 г нитрида магния. Найдите его формулу.
5. Составьте уравнения реакции азотной кислоты с оксидом железа (III), гидроксидом цинка, карбонатом кальция. Сколько молей азотной кислоты расходуется на реакции с 10 г каждого из этих соединений?
6. Составьте уравнения реакций окисления свинца и серебра разбавленной азотной кислотой, зная, что свинец окисляется до Pb+2, а серебро – до Ag+.
7. Составьте уравнение реакции окисления кобальта концентрированной азотной кислотой, принимая во внимание, что образуется соль трехвалентного кобальта.
8. Сернистая кислота H2SO3 окисляется азотной кислотой до серной кислоты H2SO4. При этом азотная кислота восстанавливается до оксида азота (II). Составьте уравнение реакции.
9. Сколько литров и молей аммиака требуется для получения 6,3 кг азотной кислоты, считая потери в производстве равными 5%?
10. Какой объем 1 М раствора гидроксида натрия требуется для нейтрализации 50 мл 2 м раствора азотной кислоты?
11. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выделяется бурый газ и газ, образующий с известковой водой Са(ОН)2 белый осадок. Напишите уравнения реакций.
12. Какова массовая доля каждой из образующихся солей, если через 300 г 5,6%-го раствора гидроксида калия пропустили 5,6 л оксида азота (IV)?
Глава X. Фосфор
Электронная конфигурация фосфора 1s22s22p63s23p3. В отличие от азота, фосфор имеет во внешнем слое свободные d-орбитали и поэтому образуют соединения, в которых проявляет валентность V. Фосфор существует в природе только в связанном состоянии, причем в основном в виде фосфатов, где он имеет степень окисления +5. Кроме этого существуют соединения, в которых фосфор проявляет и другие возможные степени окисления: -3 и +3. Элементарный фосфор имеет три аллотропные модификации, различающиеся кристаллической структурой: белый, красный, черный. Наиболее реакционноспособным является белый фосфор, который неустойчив уже при обычных условиях. В темноте белый фосфор светится, так как его окисление кислородом воздуха сопровождается свечением.
Фосфор как неметалл взаимодействует с активными Ме, проявляя свойства окислителя и образуя фосфиды:
3Mg + 2P = Mg3P2 3Ca + 2P = Ca3P2
Фосфиды – соли очень слабой кислоты фосфина РН3, поэтому они легко разлагаются кислотами и даже водой с образованием газообразного фосфина:
Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑
В реакциях с галогенами, кислородом и серой фосфор проявляет наиболее для него характерные свойства восстановителя. При избытке окислителя образуются соединения фосфора (V), а при недостатке – соединения фосфора (III):
2P + 3Cl2 = 2PCl3 (хлорид фосфора III)
2P + 5Cl2 = 2PCl5 (хлорид фосфора V)
При окислении фосфора концентрированными азотной или серной кислотами образуется ортофосфорная кислота:
P + 5HNO3(конц.) = H3PO4 + 5NO2↑ + H2O
2P + 5H2SO4(конц.) = 2H3PO4 + 5SO2↑+2H2O
infopedia.su
Кислородные соединения азота
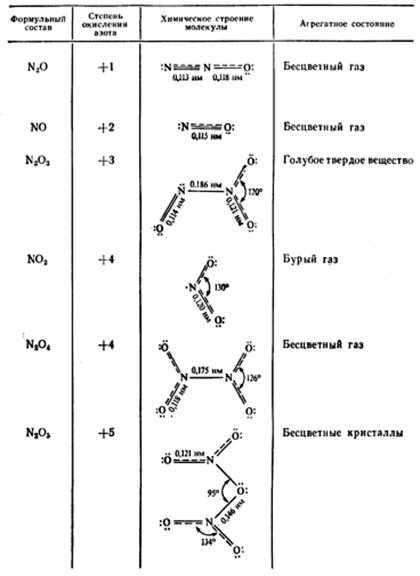
В кислородных соединениях азот проявляет степень окисления от +1 до +5.
N2O ; NO ; N2O3 ; NO2 ; N2O4 ; N2O5
Оксиды N2O и NO – несолеобразующие, остальные солеобразующие.
Оксид азота (I) и оксид азота (II) – бесцветные газы, оксид азота (III) – синяя жидкость, (IV) – бурый газ, (V) – прозрачные бесцветные кристаллы.
Кроме N2O, все они чрезвычайно ядовиты. Закись азота N2O обладает весьма своеобразным физиологическим действием, за которые ее часто называют веселящим газом. Вот как описывают действия закиси азота английский химик Хэмфри Дэви, который с помощью этого газа устраивал специальные сеансы: «Одни джентльмены прыгали по столам и стульям, у других развязывались языки, третьи обнаружили чрезвычайную склонность к потасовке». Вдыхание N2O вызывает потерю болевых ощущений и поэтому применяется в медицине как анестезирующее средство.
Метод валентных связей (МВС) предполагает в молекулеN2O наличие ионов N+ и N–
sp-гибридизация
+N
–N
O
За счет sp-гибридизации ион N+ дает 2σ связи: одну с N– и другую с атомом кислорода. Эти связи направлены под углом 180º друг к другу и молекула N2O линейна. Структуру молекулы определяет направленность σ связей. Оставшиеся у N+ два p-электрона образуют еще по одной π-связи: одну с ионом N– и другую с атомом кислорода. Отсюда N2O имеет строение
σ σ
: N– = N+ = O :
· · · ·
Склонность NO2 к димеризации – следствие нечетного числа электронов в молекуле (парамагнитна).
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
N2O3 взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2, которая существует только в разбавленных растворах, так как легко разлагается
2HNO2 = N2O3 + H2O.
HNO2 может быть более сильным восстановителем, чем HNO3, о чём свидетельствуют значения стандартных электродных потенциалов.
HNO3 + 2 Н+ + 2е = HNO2 + Н2О Е0 = + 0,93 В
HNO2 + Н+ + 1е = NO + H2O Е0 = + 1,10 В
HNO2 + 1e = NO + H+ Е0 = +1,085 В
Ее соли нитриты – устойчивы. HNO2 – кислота средней силы (К ≈ 5 · 10–4). Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO+ и OH–.
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
Сильные окислители переводят NO2– в NO3–.
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
Сильные восстановители обычно восстанавливают HNO2 до NO.
2NaNO2 + 2KI + 2H2SO4 = Na2SO4 +2NO + I2 + K2SO4 +2H2O
Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
3HNO2 = HNO3 + 2NO + H2O
Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2N–NO – канцерогенных веществ.
Важнейшее соединение азота – HNO3
Азотная кислота – важнейший продукт основной химической промышленности. Идет на приготовление взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон и др. материалов.
HNO3 – бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
N2 + O2 → 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения
4HNO3 = 4NO2 + 2H2O + O2
HNO3 – очень опасное вещество.
Важнейшее химическое свойство HNO3 состоит в том, что она является сильным окислителем и поэтому взаимодействует почти со всеми металлами кроме Au, Pt, Rh, Ir, Ti, Ta, металлы Al, Fe, Co, Ni и Cr она «пассивирует». Кислота же в зависимости от концентрации и активности металла может восстанавливаться до соединений:
+4 +3 +2 +1 0 -3 -3
NO2 → HNO2 → NO → N2O → N2 → NH3 (NH4NO3)
и также образуется соль азотной кислоты.
Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода. При действии HNO3 на активные металлы может получаться водород. Однако атомарный водород в момент выделения обладает сильными восстановительными свойствами, а азотная кислота – сильный окислитель. Поэтому водород окисляется до воды.
Свойства концентрированной и разбавленной HNO3
1) Действие концентрированной HNO3 на малоактивные металлы (Cu, Hg, Ag)
Cu + 4 HNO3 = Cu(NO3)2 + 2NO2 ↑ + 2H2O
2) Действие разбавленной HNO3 на малоактивные металлы
3Cu + 8 HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
3) Действие концентрированной кислоты на активные металлы
4Ca + 10HNO3 = 4Ca(NO3)2 + N2O↑ + 5H2O
4) Действие разбавленной HNO3 на активные металлы
4Ca + 10 HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
Одна из наиболее сильных кислот, характерны все реакции кислот: реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами. Специфичное свойство – ярко выраженная окислительная. В зависимости от условий (концентрации, природы восстановителя, температуры)HNO3 может принимать от 1 до 8 электронов.
Ряд соединений N с различными степенями окисления восстанавливаются до различных продуктов:
NH3 ; N2H4 ; NH2OH ; N2O ; NO ; N2O3 ; NO2 ; N2O5
NO3– + 2H+ + 1e = NO2 + H2O
NO3– + 4H+ + 3e = NO + 2H2O
2NO3– +10H+ + 8e = N2O + 5H2O
2NO3– +12H+ + 10e = N2 + 6H2O
NO3– + 10H+ + 8e = NH4– + 3H2O
Образование продуктов зависит от концентрации азотной кислоты. Чем выше концентрация, тем менее глубоко она восстанавливается. Реагирует со всеми металлами, кроме Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях с Fe, Cr, Al, которых она пассивирует, но при очень сильном нагревании реагирует с этими металлами.
Большинство неметаллов и сложных веществ восстанавливается HNO3 до NO (реже NO2).
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
S + 2HNO3 = H2SO4 + 2NO
3C + 4HNO3 = 3CO2 + 4NO + 2H2O
ZnS + 8HNO3 k = ZnSO4 + 8NO2 + 4H2O
6HCl + 2HNO3 k =3Cl2 + 2NO + 4H2O
Запись окислительно-восстановительной реакции с участием HNO3 обычно условна, т.к. образуется смесь азотсодержащих соединений, а указывают тот продукт восстановления, который образовался в большем количестве.
Золото и платиновые металлы растворяются в «царской водке» – смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты, которая обладает сильнейшим окислительным свойством, растворяет «царя металлов» – золото.
Au + HNO3 +4HCl = H[AuCl4] + NO↑ + 2H2O
HNO3 – сильная одноосновная кислота, образует только средние соли -нитраты, которые получают действием ее на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
При нагревании нитраты разлагаются; нитраты щелочных металлов превращаются в нитриты и выделяется кислород.
2KNO3 = 2KNO2 + O2
Состав других продуктов зависит от положения металла в ряду стандартных электродых потенциалов (РСЭП).
Левее Mg = MeNO2 + O2до магния
Me = Mg – Cu = MeO + NO2 + O2 правее магния.
правее Cu = Me + NO2 + O2 менее активных металлов
Нитраты аммония разлагаются
NH4NO3 → N2O + 2H2O
NH4NO3 → N2 + NO + 2H2O
Нитриты не разлагаются, кроме NH4NO2
NH4NO2 → N2 + 2H2O
Получение азотной кислоты
t
В лабораторных условиях – KNO3тв + H2SO4k = KHSO4 + HNO3 ↑
В промышленности: аммиачный или контактный способ.
Каталитическое окисление в контактном аппарате (катализатор – платинородиевые сетки)
t,k
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 2NO + O2 → 2NO2при обычной t и повышенном P ≈ 600 – 1100 кПа
3)4NO2 + O2 + 2H2O → 4HNO3 ω (50 – 60%)
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
