3. Типы гибридизации орбиталей атомов углерода (sp3-, sp2-, sp- гибритизация).
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р) с образованием новых атомных орбиталей, называемых гибридными орбиталями.
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон
Sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
|
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
|
sp |
2 |
Линейная |
BeF2, CO2, NO2+ | |
|
sp2 |
3 |
Треугольная |
BF3, NO3—, CO32- | |
|
sp3 |
4 |
Тетраэдрическая |
CH4, ClO4—, SO42-, NH4+ | |
|
dsp2 |
4 |
Плоскоквадратная |
Ni(CO)4, [PdCl4] 2- | |
|
sp3d |
5 |
Гексаэдрическая |
PCl5, AsF5 | |
|
sp3d2, d2sp3 |
6 |
Октаэдрическая |
SF6, Fe(CN)63-, CoF63- |
4. Электровалентная, ковалентная, донорно-акцепторная, водородная связи. Электронное строение σ и π связи.
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной.
Ковалентная связь-химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой.
Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов.
Водородная связь-это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами
σ связь-это первая и более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющий центры атомов.
σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи.
π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер
Электроны π и σ связи теряют свою принадлежность к определенному атому.
Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения.
Длина связи-это расстояние между центрами связанных атомов.
Валентный угол-это угол между двумя связями, имеющий общий атом.
Энергия связи-энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
5.
Ионная связь (электровалентная)—
очень прочная химическая связь,
образующаяся между атомами с большой
разностью электроотрицательностей,
при которой общая электронная пара
переходит преимущественно к атому с
большей электроотрицательностью.
Ковалентная
связь – возникает за счет обобществления
электронной пары посредством обменного
механизма, когда каждый из взаимодействующих
атомов поставляет по одному электрону.
Донорно акцепторная связь (координационная
связь) химическая связь между двумя
атомами или группой атомов, осуществляемая
за счет неподеленной пары электронов
одного атома (донора) и свободной орбитали
другого атома (акцептора).пример Nh5
Для возникновения
водородных связей важно, чтобы в молекулах
вещества были атомы водорода, связанные
с небольшими, но электроотрицательными
атомами, например: O, N, F. Это создает
заметный частичный положительный заряд
на атомах водорода. С другой стороны,
важно, чтобы у электроотрицательных
атомов были неподеленные электронные
пары. Когда обедненный электронами атом
водорода одной молекулы (акцептор)
взаимодействует с неподеленной
электронной парой на атоме N, O или F
другой молекулы (донор), то возникает
связь, похожая на полярную ковалентную.
При
образовании ковалентной связи в молекулах
органических соединений общая электронная
пара заселяет связывающие молекулярные
орбитали, имеющие более низкую энергию.
В зависимости от формы МО – σ-МО или
π-МО – образующиеся связи относят к σ-
или p-типу.
σ-Связь
– ковалентная связь, образованная при
перекрывании s-, p- и гибридных АО вдоль
оси, соединяющей ядра связываемых атомов
(т. е. при осевом перекрывании АО) .
π-Связь
– ковалентная связь, возникающая при
боковом перекрывании негибридных р-АО.
Такое перекрывание происходит вне
прямой, соединяющей ядра атомов.
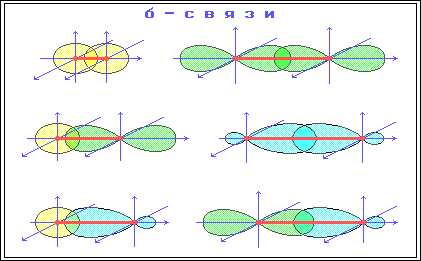
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии)*.
Однако до сих пор сохраняются и широко применяются (особенно в медицине) тривиальные (обыденные) и полутривиальные названия, использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях могут отражаться природные источники и способы получения, особо заметные свойства и области применения. Например, лактоза (молочный сахар) выделена из молока (от лат. lactum — молоко), пальмитиновая кислота — из пальмового масла, пировиноградная кислота получена при пиролизе виноградной кислоты, в названии глицерина отражен его сладкий вкус (от греч. glykys — сладкий).
Тривиальные названия особенно часто имеют природные соединения — аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных.
Рациональная номенклатура предельных углеводородов
В отличие от тривиальной названия основываются на строении молекул. Названия сложных структур состовляют из названия блоков те радикалов связанных с основным навиболее важным узлом молекулы по этой номенклатуре алканы рассматриваются как производные метана у которого атомы водорода замещены соответствующими радикалами. Выбор метанового углерода произвольный поэтому 1 соедин может иметь неск названий.по этой номенклатуре алкены рассматривают как производные этилена а алкины-ацетилена.
7. Гомология органических соединений или закон гомологов — состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только.
Изомеры- соединения имеющие одинаковый состав но разное строение и свойства.
8. Нуклеофильные и электрофильные реагенты. Участвующие в замещения реакциях реагенты подразделяются на нуклеофильные и электрофильные. Нуклеофильные реагенты, или нуклеофилы, предоставляют свою паруэлектронов на образование новой связи и вытесняют из молекулы RX уходящую группу (X) с парой электронов, образовывавшей старую связь, например:
(где R — органический радикал).
К нуклеофилам относятся отрицательно заряженные ионы (Hal—, ОН—, CN—, NO2—, OR—, RS—, NH2—, RCOO— и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н2О, Nh4, R3N, R2S, R3P, ROH, RCOOH), и металлоорганич. соединения R — Me с достаточно поляризованной связью С — Me+, т. е. способные быть донорами карбанионов R—. Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН—, Н2О), алкоголиз (RO—, ROH), ацидолиз (RCOO—, RСООН), аминирование (NH—2, NH3, RNH2 и др.), цианирование (CN—) и т. д.
Электрофильные реагенты, или электрофилы, при образовании новой связи служат акцепторами пары электронов и вытесняют уходящую группу в виде положительно заряженной частицы. К электрофилам относятся положительно заряженные ионы (например, Н+, NO2+), нейтральные молекулы с электронным дефицитом, например SO3, и сильно поляризованные молекулы (СН3СОО—Br+ и др.), причём поляризация особенно эффективно достигаетсякомплексообразованием с коэффициентами Льюиса (Hal+ — Hal— · А, R+ — Cl— · A, RCO+ — Cl— · А, где A= A1C13, SbCl5, BF3 и др.). К реакциям с участием электрофилов (электрофильное замещение) относятся важнейшие реакцииароматических углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя — Крафтса):
(E+ = Hal+, NO+2, RCO+, R+ и др.)
В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов — в алифатическом (чаще всего в ряду металлоорганических соединений).
53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика)
Реакции широко используются для получения спиртов.при присоединении к формальдегиду реактива гриньяра(R-MgX) образуется первичный спирт, другим альдегидом вторичные, а кетонам тритичные спирты
studfiles.net
Типы гибридизации
Химия Типы гибридизации просмотров — 1627
Чаще всего встречаются гибридизации sp, sp2, sp3 и sp3d2. Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества.
sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º (рис. 22).
Рис. 22. Схема sp-гибридизации
При sp-гибридизации образуются линейные трехатомные молекулы типа АВ2, где А – центральный атом, у которого происходит гибридизация, а В – присоединенные атомы, у которых гибридизация не происходит. Такие молекулы образуются атомами бериллия, магния, а также атомами углерода в ацетилене (С2Н2) и в углекислом газе (СО2).
Пример 5.Объясните химическую связь в молекулах ВеН2 и ВеF2 и строение этих молекул.
Решение. Атомы бериллия в нормальном состоянии не образуют химических связей, т.к. не имеют неспаренных электронов (2s2). В возбужденном состоянии (2s12p1) электроны находятся на разных орбиталях, в связи с этим при образовании связей происходит sp-гибридизация по схеме, приведенной на рис. 22. К двум гибридным орбиталям присоединяются два атома водорода или фтора, как показано на рис. 23.
1) 2)
Рис. 23. Схема образования молекул ВеН2 (1) и ВеF2 (2)
Образующиеся молекулы – линейные, валентный угол 180º.
Пример 6. По экспериментальным данным молекула СО2 – линейная, причём, обе связи углерода с кислородом одинаковы по длине (0,116 нм) и энергии (800 кДж/моль). Как объясняются эти данные?
Решение. Эти данные о молекуле диоксида углерода объясняет следующая модель ее образования.
Атом углерода образует связи в возбужденном состоянии, при котором он имеет четыре неспаренных электрона: 2s12p3. При образовании связей происходит sp-гибридизация орбиталей. Гибридные орбитали направлены по прямой линии в противоположные стороны от ядра атома, а оставшиеся две чистые (негибридные) p-орбитали располагаются перпендикулярно друг к другу и к гибридным орбиталям. Все орбитали (гибридные и негибридные) содержат по одному неспаренному электрону.
Каждый атом кислорода, имеющий два неспаренных электрона на двух взаимно перпендикулярных p-орбиталях, присоединяется к атому углерода s-связью и p-связью: s-связь образуется с участием гибридной орбитали углерода, а p-связь образуется перекрыванием чистых p-орбиталей атомов углерода и кислорода. Образование связей в молекуле СО2 показано на рис. 24.
Рис. 24. Схема образования молекулы СО2
Кратность связи, равная двум, объясняет большую прочность связи, а sp-гибридизация – линейное строение молекулы.
Смешивание одной s- и двух p-орбиталей принято называть sp2-гибридизацией. При этой гибридизации получаются три равноценные q-орбитали, расположенные в одной плоскости под углом 120º (рис. 25).
Рис. 25. Схема sp2-гибридизации
Образующиеся при этой гибридизации молекулы типа АВ3 имеют форму плоского правильного треугольника с атомами А в центре и атомами В в его вершинах. Такая гибридизация происходит в атомах бора и других элементов третьей группы и в атомах углерода в молекуле С2Н4 и в ионе СО32-.
Пример 7.Объясните образование химических связей в молекуле ВН3 и ее строение.
Решение. Экспериментальные исследования свидетельствуют о том, что в молекуле ВН3 все три связи В–Н расположены в одной плоскости, углы между связями равны 120º. Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s12p2) и он образует связи sp2-гибридными орбиталями. Схема молекулы ВН3 приведена на рис. 26.
Рис. 26. Схема образования молекулы ВН3
В случае если в гибридизации принимают участие одна s- и три p-орбитали (sp3-гибридизация), то в результате образуются четыре гибридные орбитали, направленне к вершинам тетраэдра, ᴛ.ᴇ. ориентированные под углами 109º28¢ (~109,5º) друг к другу. Образующиеся молекулы имеют тетраэдрическое строение. Гибридизацией этого типа объясняется строение предельных углеводородов, соединений углерода с галогенами, многих соединений кремния, катиона аммония NH4+ и др. Классическим примером этой гибридизации является молекула метана CH4 (рис. 27)
Рис. 27. Схема образования химических связей в молекуле СН4
В случае если в гибридизации принимают участие одна s-, три p- и две d-орбитали (sp3d2— гибридизация), то возникают шесть гибридных орбиталей, напрвленных к вершинам октаэдра, ᴛ.ᴇ. ориентированных под углами 90º друг к другу. Образующиеся молекулы имеют октаэдрическое строение. Гибридизацией этого типа объясняется строение соединений серы, селена и теллура с галогенами, к примеру SF6 и SeF6, и многих комплексных ионов: [SiF6]2–, [Fe(CN)6]3– и т.д. На рис. 28 показано образование молекулы гексафторида серы.
Рис. 28. Схема молекулы SF6
Химические связи с участием гибридных орбиталей отличаются большой прочностью. В случае если энергию s-связи, образованную «чистыми» s-орбиталями, принять за единицу, то энергия связи при sp-гибридизации будет равна 1,43, при sp2-гибридизации 1,99, при sp3-гибридизации 2,00, а при sp3d2-гибридизации 2,92. Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Кроме рассмотренных типов гибридизации, в химических соединениях встречаются гибридизации sp2d, sp3d, sp3d3, sp3d3 и другие. При sp2d-гибридизации молекулы и ионы имеют квадратную форму, при sp3d-гибридизации – форму тригональной бипирамиды и при sp3d3-гибридизации – пентагональной бипирамиды. Другие типы гибридизации встречаются редко.
Пример 8.Приведены уравнения двух похожих реакций:
1) CF4 + 2HF = H2CF6; 2) SiF4 + 2HF = H2SiF6
Какая из них невозможна с точки зрения образования химических связей?
Решение. Для образования H2CF6 необходима sp3d2-гибридизация, но в атоме углерода валентные электроны находятся на втором энергетическом уровне, на котором нет d-орбиталей. По этой причине первая реакция в принципе невозможна. Вторая реакция возможна, так как sp3d2-гибридизация у кремния возможна.
Читайте также
Таблица 2. Тип гибридизации Геометрия молекул Валентные углы Примеры sp Линейная 1800 Beh3, CO2, C2h3, BO2- sp2 Тригональная 1200 Alh4, AlF3, SO3,CO22-, NO3- sp3 Тетраэдрическая 109,50 Sih5, CCl4, Nh5+, SO42- sp3d Тригональная бипирамидальная 900 и 1200 PF5, AsF5, PCl5, sp3d2 … [читать подробенее]
Таблица 2. Тип гибридизации Геометрия молекул Валентные углы Примеры sp Линейная 1800 Beh3, CO2, C2h3, BO2- sp2 Тригональная 1200 Alh4, AlF3, SO3,CO22-, NO3- sp3 Тетраэдрическая 109,50 Sih5, CCl4, Nh5+, SO42- sp3d Тригональная бипирамидальная 900 и 1200 PF5, AsF5, PCl5, sp3d2 … [читать подробенее]
sp3 – гибридизация Все четыре валентные орбитали участвуют в гибридизации. Валентный угол 109о28’ (тетраэдр). Атомы углерода образуют только простые (&… [читать подробенее]
Периодический закон и периодическая система химических элементов Менделеева в строении атома. Физический смысл периодического закона. Структура периодической системы. Период, группа, подгруппа Основной закон химии — Периодический закон был открыт в 1869 году в то… [читать подробенее]
Чаще всего встречаются гибридизации sp, sp2, sp3 и sp3d2. Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества. sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на… [читать подробенее]
oplib.ru
3.4 Геометрия молекул. Гибридизация атомных орбиталей
Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией).
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи;
2) число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация. Рассмотрим её на примере молекулы BeCl2.
Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой — за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).
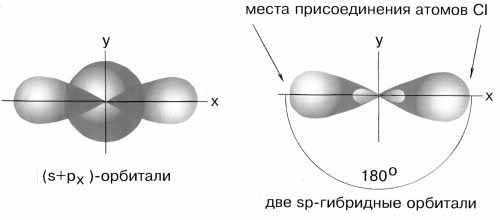
Рисунок 13 — sp-гибридизация валентных орбиталей бериллия
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул — независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Е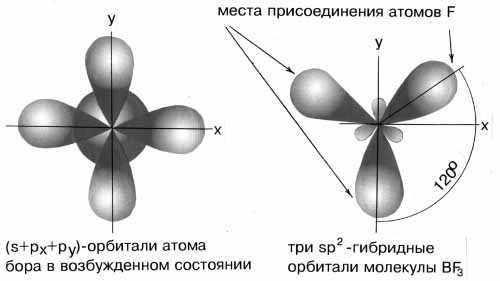 сли
валентная оболочка атома включает
электроны на однойs-орбитали
и двух
p-орбиталях,
то наблюдается sp2-гибридизация,
которая даёт несколько иную геометрию
молекулы. Примером может служить
sp2-гибридизация
бора при образовании молекулы BF3
(рисунок 14). Три sp2-гибридные
орбитали лежат в одной плоскости под
углом 120°. Они располагаются как можно
дальше друг от друга и молекула имеет
форму плоского треугольника.
сли
валентная оболочка атома включает
электроны на однойs-орбитали
и двух
p-орбиталях,
то наблюдается sp2-гибридизация,
которая даёт несколько иную геометрию
молекулы. Примером может служить
sp2-гибридизация
бора при образовании молекулы BF3
(рисунок 14). Три sp2-гибридные
орбитали лежат в одной плоскости под
углом 120°. Они располагаются как можно
дальше друг от друга и молекула имеет
форму плоского треугольника.
Рисунок 14 — sp2-гибридизация валентных орбиталей бора
Такую же форму будут иметь и молекулы BH3, H2C=CH2, C6H6 и т. д.
Наконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
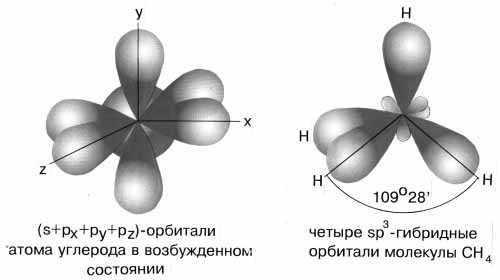
Рисунок 15 — sp3-гибридизация валентных орбиталей углерода
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28′.
Такой же тип гибридизации будет характерен для молекул CCl4, H3C–CH3.
Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
|
|
|
Рисунок 16 — Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4 |
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга.
Поэтому реально этот тетраэдр в молекулах NH3 и H2O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно.
При образовании иона аммония NH4+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28′.
Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28′, поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.
studfiles.net
3.3.4. Теория гибридизации и оэпво
451. Появление теории гибридизации было вызвано необходимостью объяснить геометрию многоатомных молекул. Основные положения: число гибридных орбиталей всегда равно числу атомных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий: 1) хорошее перекрывание гибридизуемых электронных орбиталей; 2) небольшая разница в энергиях атомных орбиталей, участвующих в гибридизации. Гибридизация всегда сопровождается изменением формы электронного облака.
|
Тип гибридизации орбиталей центрального атома |
Геометрическая модель гибридных орбиталей |
Пример |
|
sp sp2 sp3 sp3d sp3d2 sp3d3 |
Прямая линия Плоский треугольник Тетраэдр Тригональная бипирамида Октаэдр Пентагональная бипирамида |
СО2 BF3 H2O PCl5 SF6 ClF7 |
452. Пространственное положение гибридных орбиталей определяется строением валентной оболочки центрального атома (количество неспаренных электронов, участвующих в связи и количество несвязывающих электронных пар)
|
Тип гибридизации орбиталей центрального атома |
Геометрическая модель гибридных орбиталей |
Пример |
|
sp sp2 sp3 sp3d2 |
Прямая линия (угол 1800) Плоский треугольник(угол 1200) Тетраэдр(угол 1090) Октаэдр(угол 900) |
СО2 BF3 H2O SF6 |
453. Гибридное облако всегда асимметрично: имеет большую вытянутость по одну сторону ядра, чем по другую. Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных облаков. О гибридизации судят по строению валентной оболочки центрального атома (количество неспаренных электронов, участвующих в связи и количество несвязывающих электронных пар) и по валентным углам в молекуле.
454.
-
Анион
Структурная формула
Тип гибридизации
Геометрия аниона
СО32-
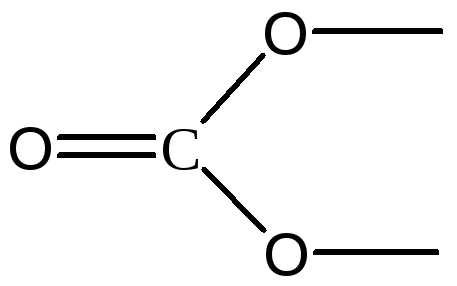
sp2
Треугольник
SО42-

sp3
Тетраэдр
NО3—
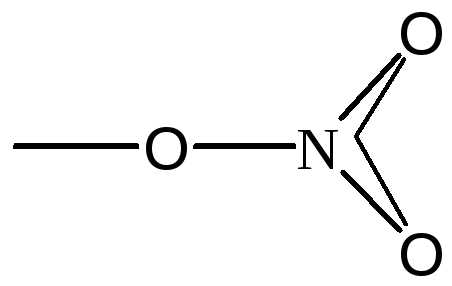
sp2
Треугольник
455. В молекуле СОCl2 у центрального атома углерода в образовании связей участвуют все четыре электрона, но три из них образуют σ-связи, а один π-связь. Согласно теории гибридизации, электроны, образующие π-связь не принимают участие в гибридизации, поэтому гибридных АО не четыре а три.
456. а) Чем больше несвязывающих электронных пар, тем меньше валентный угол ( CH4 -нет несвязывающих пар, NH3 — 1 пара, H2O — 2 несвязывающих пары). б) Чем больше электроотрицательность партнера центрального атома, тем сильнее влияние несвязывающей электронной пары и тем меньше валентный угол (ЭО(Cl)>ЭО(Br)>ЭО(I). в) Чем дальше от ядра валентные орбитали, тем сильнее влияние несвязывающей электронной пары и тем меньше валентный угол ra(N)< ra(P)< ra(As)< ra(Sb).
457. Форма молекул и ионов зависит от типа гибридизации центрального атома и от строения его валентного слоя. Если валентная оболочка центрального атома не содержит неподеленных электронных пар, то частица будет иметь правильную геометрическую форму (СН4 — тетраэдр, SF6 — октаэдр). Если неподеленные электронные пары присутствуют, то у частицы будет незавершенная геометрическая форма (NH3 — незавершенный тетраэдр), либо искаженная форма (Н2О — искаженная линейная структура).
458.
|
Поделен.эл.пары |
Неподел.эл.пары |
Тип гибридизации |
Расположение эл. пар |
Геометрич. форма молекулы |
примеры |
|
4 |
0 |
sp3 |
Тетраэдрическое |
Тетраэдр |
CH4, NH4+ |
|
3 |
1 |
sp3 |
Тетраэдрическое |
Тригон. Пирамида |
NH3, PF3 |
|
2 |
2 |
sp3 |
Тетраэдрическое |
Угловая |
H2S, H2O |
|
5 |
0 |
sp3d |
Тригональное бипирамидальное |
Тригон. бипирамида |
PCl5 |
|
4 |
1 |
sp3d |
Тригональное бипирамидальное |
Неправ. Тетраэдр |
TeCl4 |
|
3 |
2 |
sp3d |
Тригональное бипирамидальное |
Т-образная |
ClF3 |
|
6 |
0 |
sp3d2 |
октаэдрическое |
Октаэдр |
SF5 |
|
5 |
1 |
sp3d2 |
октаэдрическое |
Квадратн. Пирамида |
IF5 |
|
4 |
2 |
sp3d2 |
октаэдрическое |
Плоский квадрат |
ICl4—, XeF4 |
459.
|
СО2 и SO2: В молекуле СО2 у центрального атома sp-гибридизация, а в молекуле SO2 за счет одной неподеленной электронной пары у атома серы sp2-гибридизация. Поэтому СО2 – линейная молекула, а SO2 – имеет угловую форму. |
|
BCl3 и NCl3 В молекуле BCl3 у центрального атома sp2-гибридизация, а в молекуле NCl3 за счет одной неподеленной электронной пары у атома азота sp3-гибридизация. Поэтому BCl3 – плоская треугольная молекула, а NCl3 – имеет форму пирамиды. |
|
CF4 и XeF4 В молекуле СF4 у центрального атома sp3-гибридизация, а в молекуле XeF4 за счет неподеленных пар у атома ксенона sp3d2-гибридизация. Поэтому СF4 – тетраэдрическая молекула, а XeF4 – имеет форму октаэдра. |
460. а) В молекуле BF3 центральный атом имеет sp2-гибридизацию, в то время как в ионе BF4— у атома бора sp3-гибридизация. Поэтому при переходе от молекулы к иону форма меняется от плоского треугольника к тетраэдру. б) В молекуле NH3 у атома азота sp3-гибридизация, однако одна гибридизованная орбиталь содержит неподеленную электронную пару, из-за чего углы в тетраэдре искажены. В катионе NH4+ — гибридизованные орбитали не содержат неподеленных электронных пар, т.е. тетраэдр не искажен. в) Подобно этому, в молекуле воды Н2О у атома кислорода sp3-гибридизация, однако на двух гибридных орбиталях имеются электронные пары, из-за чего углы тетраэдра искажены очень сильно. Менее искажены углы в Н3О+, т.к. в этом катионе только одна гибридная орбиталь содержит неподеленные электронные пары.
461. Явление, называемое поляризацией химической связи, представляет собой деформацию электронной оболочки под действием сильного электромагнитного поля соседнего атома. Полярность связи тем выше, чем больше разница в электроотрицательности атомов, образующих связь: ЭО(Н) = 2,1.
|
ЭО(элемента) |
Разница ׀ЭО(Н)-ЭО(элемента)׀ |
Смещение электронного облака |
Место по увеличению полярности |
|
(N) = 3.0 |
0.9 |
К азоту |
2 |
|
(S) = 2.5 |
0.4 |
К сере |
1 |
|
(Li) = 1.0 |
1.1 |
К водороду |
3 |
|
(O) = 3.5 |
1.4 |
К кислороду |
4 |
|
(I) = 0.133 |
1.967 |
К водороду |
5 |
462. Ковалентная полярная связь характеризуется направленностью, насыщаемостью и поляризуемостью. Насыщаемость ковалентной связи — вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискрентных частиц с определенной структурой (Н2О, NH3, FeCl2). Направленность ковалентной связи — поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают σ-, π-, δ-связи. Сигма-связь осуществляется при перекрывании облаков вдоль линии соединения атомов. Пи-связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов. Дельта-связь образуется при перекрывании всех четырех лопастей d-электронных облаков, расположенных в параллельных плоскостях. Например, в молекуле азота одна сигма и две пи-связи N≡N. Поляризуемость ковалентной связи — свойство характеризует способность становится полярной в результате действия на молекулу внешнего электрического поля. Например, в молекуле HCl связь под действием внешнего поля поляризуется и может даже разорваться.
463. Электрический момент диполя μ представляет собой произведение длины диполя l на значение электрического заряда q: μ = l*q. Т.е. его величина зависит от расстояния между концами диполя и зарядом на полюсах диполя. Электрический момент диполя измеряется в Кл.м. Экспериментально определяется спектроскопическими методами. Если известны дипольные моменты связей в молекуле, то общий дипольный момент молекулы рассчитывается как векторная сумма моментов связей. Так, например, дипольный момент симметричной молекулы СО2 равен нулю, несмотря на то, что связи С=О имеют сильно полярный характер, а угловая молекула воды Н2О имеет дипольный момент отличный от нуля.
464. При поляризации связи молекула приобретает электрический дипольный момент, т.е. получается диполь, на полюсах которого образуются заряды, которые называются эффективными. Этот заряд δ можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы НCl составляет δН = +0.18, а на атоме хлора = -0.18 абсолютного заряда электрона. Можно сказать, что связь в молекуле HCl имеет на 18% ионный характер, т.е. полярна. Эффективный заряд совпадет со степенью окисления по знаку, но не совпадает по значению.
465. Электроотрицательность характеризует способность атома в соединении оттягивать на себя электронную плотность. ЭО определяется экспериментально как относительная безразмерная величина. Если разница в ЭО двух атомов больше или равна 2.1, то связь между ними можно считать ионной:
-
Соединение
Разность электроотрицательностей элементов
Связь
NaCl
3-0.9 = 2.1
Ионная
MgCl2
3-1.2 = 1.8
Близка к ионной
AlCl3
3-1.5 = 1.5
Близка к ионной
SiCl4
3-1.8 = 1.2
Полярная
PCl3
3-2.1 = 0.9
Полярная
SCl4
3-2.5 = 0.5
Слабо полярная
Cl2
3-3 = 0
Неполярная
466. Образование ионной связи характеризуется очень сильным смещением электронной плотности к одному из атомов. 100%-я ионная связь не может быть образована, т.к. не может быть полного перехода электронов от одного атома к другому. В наиболее ионных соединениях доля ковалентности не превышает 10%. Наиболее ионным соединением является FrF, т.к. разница в электроотрицательностях этих элементов максимальна.
467. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь. Поляризуемостью иона называется способность его электронной оболочки деформироваться под действием электромагнитного поля атома, с которым образована химическая связь. Чем больше заряд иона и меньше его радиус, тем больше его поляризующее действие и меньше поляризуемость. Соответственно, чем меньше заряд иона и больше его радиус, тем меньше его поляризующее действие и больше поляризуемость. Радиус Ве меньше радиуса Ва, поэтому Ве2+ имеет большую поляризующую способность. Радиус алюминия больше радиуса железа, поэтому Fe2+ имеет большую поляризуемость. Радиус атома калия больше радиуса атома серебра и, кроме того, катион серебра имеет 18-электронный внешний слой (что также усиливает поляризующее действие), поэтому Ag+ поляризует связь больше. Радиус аниона фтора меньше, чем анион иода, соответственно, поляризуемость иода выше. Ион Те2- крупнее иона S2-, следовательно ион теллура поляризуется сильнее.
468. Из катионов наибольшим поляризующим действием, как известно, обладает водород. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь, т.е. делать связь менее устойчивой. Из-за того, что водород сильнее деформирует связь, чем катион любого металла, кислоты разрушаются легче (при меньшей температуре), чем соответствующие соли.
469. Поскольку радиус катиона кадмия меньше радиуса катиона кальция, катион кадмия имеет более сильное поляризующее действие. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь, т.е. делать связь менее устойчивой. Из-за того, что кадмий сильнее деформирует связь, чем кальций, соли кадмия разрушаются легче (при меньшей температуре), чем соответствующие соли кальция.
470. Fe, Cu, Pb — это вещества с металлической связью. Металлическая связь отличается от ковалентной тем, что в случае металлической связи часть электронов способна свободно перемещаться по всему объему куска металла. Кроме того при образовании металлической связи атомы не связаны друг с другом локализованными двухэлектронными связями. Способность металлов проводить электричество и тепло есть следствие именно наличия электронов, легко перемещающихся в металле. Пластичность металлов объясняется способностью металлической решетки деформироваться при механическом воздействии без разрыва связей. При повышении температуры возбуждаются электроны с глубинных слоев атомов металлов, в результате вакантных орбиталей для свободного перемещения электронов становится меньше — уменьшается электропроводность.
studfiles.net
Гибридизация (химия) — это… Что такое Гибридизация (химия)?
Модель молекулы метана, образованной sp3-гибридными орбиталямиГибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации
 Схема гибридизации атомных орбиталей атома углерода
Схема гибридизации атомных орбиталей атома углерода
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л.Полинг развил теорию изогнутой химической связи, учитывающую кулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей.[1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
- «Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались»[2].
Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра».[2]
Виды гибридизации
sp-гибридизация
sp-гибридизацияПроисходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация
sp2-гибридизацияПроисходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизация
sp3-гибридизацияПроисходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28′, что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[3].
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная | BeF2, CO2, NO2+ | |
| sp2 | 3 | Треугольная | BF3, NO3—, CO32- | |
| sp3 | 4 | Тетраэдрическая | CH4, ClO4—, SO42-, NH4+ | |
| dsp2 | 4 | Плоскоквадратная | Ni(CO)4, XeF4 | |
| sp3d | 5 | Гексаэдрическая | PCl5, AsF5 | |
| sp3d2 | 6 | Октаэдрическая | SF6, Fe(CN)63-, CoF63- |
Ссылки
Литература
- Паулинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М.: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — 278 с.
См. также
Примечания
- ↑ Под редакцией Р. Х. Фрейдлиной. Теоретическая органическая химия. — пер. с англ. канд. хим. наук Ю.Г.Бунделем. — М.: Издательство иностранной литературы, 1963. — Т. 1. — С. 11. — 365 с.
- ↑ 1 2 Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — С. 18-19. — 278 с.
- ↑ Здесь A — центральный атом, X — гибридные связывающие орбитали
dic.academic.ru
Лекции по химии: sp– гибридизация
sp2 – гибридизация.
Три различные атомные орбитали (АО), комбинируясь друг с другом, образуют 3 одинаковые гибридные орбитали. Получаются три равноценные гибриды, расположенные под углом в 120˚ относительно центра координат. В качестве примера можно привести молекулы Ga, Zn, Te с галогенами и также бора.
| ||||||
 |
Образуются три равноценные орбитали. Образуют правильный треугольник.
В молекуле органических соединений, например в этилене, — sp2 гибридизация.
sp3 – гибридизация
Гибридизация одной s и трех p – орбиталей характерна для углерода, Si и германия. Гибридные sp3 орбитали на ¼ имеют характер s – орбитали и на ¾ — p – орбитали, поэтому у них более вытянутая форма, чем у sp2 – орбиталей, и от центра атома они расходятся под углами 109˚ к вертикали тетраэдра.
Подобный тип гибридизации имеется в атомах С- углерода, азота в NH4+; TiCl4 и др. Из органических веществ в этане, метане (CH4).
Рассмотрим также молекулу воды. При её образовании происходит sp3 – гибридизация атомных орбиталей кислорода. Именно поэтому валентный угол в НОН равен 104˚, т.е. ближе к 109˚, чем к 90˚. Отличие от 109˚ можно понять, если учесть неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды.
В молекуле воды только четыре из восьми электронов, занимающих гибридные sp3 орбитали атома кислорода образуют связи О – Н, а две электронные пары остаются неподеленными, т.е. принадлежат только атому кислорода.
Также можете прочитать:
lech-ximiya.blogspot.com
Гибридизация атомных орбиталей
Американский ученый Л. Полинг выдвинул идею о гибридизации атомных орбиталей. Согласно этой идее, если у атома, вступающего в химическую связь, имеются разные атомные орбитали (АО) (s-, p-, d- или f-АО), то в процессе образования химической связи происходит гибридизация АО. Т.е. из разных АО образуются одинаковые (эквивалентные) АО. У атома гибридизуются орбитали, которые имеют близкие значения энергий. Идея о гибридизации АО – это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических соединений. Форма гибридной АО отличается от формы исходных АО (рис. 4.3).
Рис. 4.3. Атомная sp-гибридная орбиталь
В гибридной АО электронная плотность смещается в одну сторону от ядра. При взаимодействии гибридной орбитали с АО другого атома происходит перекрывание в области максимальной электронной плотности, что приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
Если в химическую связь вступает атом, у которого на внешнем валентном уровне имеются один s- и один p-электроны, то у данного атома в процессе образования связи происходит sp-гибридизация АО (рис. 4.4).
Рис. 4.4. Схема sp-гибридизации
Если у атома, вступающего в химическую связь, на внешней оболочке имеются один s- и два p-электрона, то помимо sp-гибридизации может происходить sp2-гибридизация АО этого атома (рис. 4.5).
Рис. 4.5. Схема sp2-гибридизации
У атома, имеющего на внешней оболочке один s- и три р-электрона, при химическом взаимодействии помимо sp- и sp2-гибридизации, может происходит sp3-гибридизация этих АО (рис. 4.6).
Рис. 4.6. Схема sp3-гибридизации
Возможны также более сложные виды гибридизации с участием d-орбиталей атомов (табл. 4.3).
Как видно из рис 4.4-4.6, гибридные облака в пространстве располагаются симметрично относительно друг друга, что уменьшает их взаимное отталкивание и соответственно понижает энергию молекул.
Таблица 4.3
Пространственная конфигурация некоторых соединений
| Тип гибридизации центрального атома | Конфигурация молекулы | Угол между связями, град | Примеры соединений |
| sp | Линейная | SnCl2, BeF2 | |
| sp2, dp2, sd2 | Плоская тригональная | BCl3, AlF3 | |
| sp3, sd3 | Тетраэдр | 109°28′ | CH4, SiH4 |
| dsp2 | Плоский квадрат | [PdBr4]– | |
| dsp3 | Тригональная бипирамида | PF5 | |
| d2sp3 | Октаэдр | SF6, [SbCl6]– | |
| d4sp3 | Додекаэдр | [Mo(CN)8]4– |
4.1.4.2. Образование σ-, π- и δ-связей
В зависимости от направления перекрывания электронных облаков образуются s-, p- и δ-связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется s-связью. Сигма-связь может возникать при перекрывании двух s-орбиталей (рис. 4.7), s- и p-орбиталей, p-орбиталей между собой, d-орбиталей, а также d- и s-орбиталей, d- и p-орбиталей, а также перекрыванием гибридных орбиталей с другими видами орбиталей и между собой. Сигма-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
Рис. 4.7. Перекрывание атомных орбиталей при образовании σ-связей
Связь, образованная перекрыванием негибридных р- и d-АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р-р-орбиталей, р-d – орбиталей, d—d-орбиталей (рис. 4.8), а также f-p-, f-d- и f-f-орбиталей.
Рис. 4.8.Перекрывание атомных орбиталей при образовании π-связей
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью (рис. 4.9).
Соответственно, s-элементы могут образовывать только σ-связи, p-элементы – σ- и π-связи, d-элементы σ-, π-, и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
Рис. 4.9.Направление перекрывания атомных d-орбиталей при образовании δ-связей
Похожие статьи:
poznayka.org
