Современный катализ
Количество просмотров публикации Современный катализ — 2205
Катализ – ускорение химической реакции в присутствии веществ – катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав конечных продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном – газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах, предпочтительное образование определенных продуктов из ряда возможных. Каталитические процессы являются основой многих химико-технологических процессов, к примеру, производства серной кислоты, некоторых полимеров, аммиака. Большинство процессов, происходящих в живых организмах, также являются каталитическими (ферментативными).
Хорошо известна реакция между кислородом и водородом, приводящая к образованию воды:
2Н2 + О2 → 2Н2О.
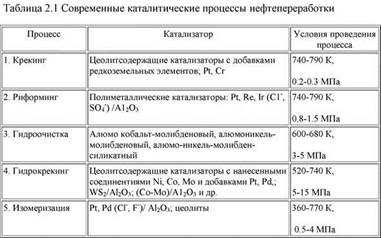
Смесь двух объёмов газообразного водорода и одного объёма кислорода, называемая гремучим газом, способна реагировать со взрывом и выделением большого количества тепла. При этом реакция протекает настолько медленно, что даже после месячной выдержки данной смеси вряд ли удастся обнаружить хоть какое-нибудь количество воды. Скорость реакции повышается при нагревании реакционной смеси или при воздействии на нее электромагнитного излучения. Аналогичное действие оказывает и введение катализатора. Катализатор помогает преодолеть энергетический барьер, препятствующий началу реакции. Катализ еще со времен шведского химика Берцелиуса (1779–1848) имеет исключительно важное значение для химических превращений.
Некоторые промышленные химические процессы проводятся в газовой форме при наличии твердых катализаторов, однако на практике чаще всего реализуются жидкофазные каталитические процессы. В последние десятилетия не менее 20% всей промышленной химической продукции производят каталитическим способом, причем 80% из них – с участием гетерогенного катализа.
К довольно эффективным катализаторам можно отнести ионообменные смолы, металлоорганические соединения, мембранные катализаторы. Каталитическим свойством обладают многие химические элементы периодической системы, но важнейшую роль играют металлы платиновой группы и редкоземельные металлы. .
Новые катализаторы позволяют уменьшить в химических превращениях не только температуру, но и давление. К примеру, разработанный в нашей стране катализатор дал возможность синтезировать метанол при давлении 50 атм и температуре 260–290°С, в то время как раньше такой синтез проводился при давлении до 1000 атм и температуре 300–400°С. С участием катализатора скорость некоторых реакций увеличивается в 10 млрд раз.
Каталитические процессы можно классифицировать с учетом их физической и химической природы. В гетерогенном катализе
referatwork.ru
Понятие о катализаторе | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Попав на царапину или ранку, пероксид водорода разлагается намного интенсивнее (сильно пузырится, «шипит»). Кислород в момент выделения обладает сильными дезинфицирующими свойствами. Вместе с пеной из ранки удаляется загрязнение. Это происходит потому, что кровь содержит особые вещества, которые ускоряют разложение пероксида водорода. В 1835 г. шведский химик И. Берцелиус установил, что в присутствии определенных веществ скорость некоторых химических реакций существенно возрастает. Для таких веществ он ввел термин «катализатор» (греч. katalysis — «ослабление», «разрушение»).
Катализаторы — вещества, которые ускоряют химические реакции, но не входят в состав их продуктов.
Ферменты — биологические катализаторы, они ускоряют химические реакции в живых организмах.
Разложение пероксида водорода могут ускорять многие вещества. Среди них — оксид марганца (IV) — один из продуктов разложения перманганата калия. Щепотка этого соединения ускоряет разложение все новых и новых порций пероксида водорода. Сам оксид марганца (IV) при этом не расходуется и не входит в состав продуктов реакции (рис. 18.6).
| Рис. 18.5. Схема получения кислорода разложением пероксида водорода и собирания кислорода вытеснением воздуха |
| Рис. 18.6. Каталитическое разложение пероксида водорода |
Кислород немного тяжелее воздуха. Поэтому его можно собрать вытеснением воздуха в сосуд, размещенный отверстием вверх (рис. 18.5).
Катализаторы играют важную роль в жизни человека. Ферменты принимают участие в регуляции биохимических процессов. С давних времен ферментативные процессы применяют в хлебопечении, сыроварении, виноделии, пивоварении, кожевничестве и т. п.И сейчас ферменты применяют в промышленности: при переработке сахара, получении синтетических антибиотиков и белков. В моющие средства добавляют ферменты, которые ускоряют расщепление загрязнений белковой природы. Универсальные стиральные порошки для эффективного удаления пятен от пота, крови, пищевых продуктов и других белковых загрязнений содержат биодобавки и ферменты (их еще называют «энзимы»). Материал с сайта http://worldofschool.ru
| Рис. 18.7. Изготовление сыра невозможно без применения ферментов |
| Рис. 18.8. Схема очистки автомобильных выхлопных газов |
Важная черта современной практической химии — осуществление процессов с использованием катализаторов. Без них, например, невозможно превратить растительное масло в маргарин.
Каталитические методы очищения газообразных отходов промышленных предприятий применяют для удаления разнообразных токсичных соединений.
Также катализаторы нужны для очистки автомобильных выхлопных газов (рис. 18.8).
На этой странице материал по темам:-
Катализаторы в жизни человека
Хто увів поняття про каталізатори
Наблюдение и эксперименты химии
Сообщение краткое о катализаторах
Краткий доклад катализаторы по химии
-
Назови вещества, в которые превращаются составляющие автомобильных выхлопных газов после каталитической очистки.
-
Есть ли среди продуктов каталитической очистки выхлопных газов ядовитые вещества?
-
Оцени значение катализаторов в жизни человека.
worldofschool.ru
1. Значение и области применения катализаторов в жизни человека. Разработка наноразмерных кобальтовых катализаторов гидрирования
Похожие главы из других работ:
Адипиновая кислота
2. ОБЛАСТИ ПРИМЕНЕНИЯ АДИПИНОВОЙ КИСЛОТЫ
Адипиновая кислота — сырье в производстве полигексаметиленадипинмида (~ 90% производимой кислоты), её эфиров, полиуретанов; пищевая добавка (придает кислый вкус, в частности, в производстве безалкогольных напитков)…Ацетилен
ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
Ацетилен используют: — для сварки и резки металлов, — как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа), — в производстве взрывчатых веществ (см…
Двухупаковочные полиуретановые лакокрасочные материалы
6. Области применения и фирмы-производители
Эмаль УР-1-206 предназначена для антикоррозионной защиты внутренних поверхностей резервуаров, цистерн, хранилищ под светлые нефтепродукты, насосного и емкостного оборудования…
Классификация покрытий по функциональным свойствам и способу нанесения
4.2 Области применения наплавки
Наплавку концентрированными источниками теплоты применяют для восстановления изношенных поверхностей, покрытия при этом, как правило, дают высокий экономический эффект…
Нанотехнологии. История развития
3. Области применения нанотехнологий
…
Окислительно-восстановительные реакции
Окислительно- восстановительные реакции в природе, промышленности и жизни человека
Все процессы в живой природе сопровождаются превращением энергии и ее переходами из одной формы в другую. В течение одного дня взрослый человек потребляет примерно 10 млн. Дж энергии…
Очистка воды гиперфильтрацией
Области применения гиперфильтрации
Разделение жидких смесей — одна из трудных проблем химической технологии. Даже если сосредоточить внимание только на растворах электролитов, круг систем, разделение которых представляет собой важную народнохозяйственную задачу, очень широк…
Проектирование установки гидроочистки гача применительно к предприятию ООО «Лукойл-ВНП»
3.3 Новое в области катализаторов в зарубежной и отечественной промышленности
Развитие технологии гидроочистки различных нефтяных фракций, гидрокрекинга тяжелых видов сырья с получением топлив и гидро-изомеризации связано с успешной эксплуатацией катализаторов [4,5]. Одной из важных проблем…
Технология производства эпоксидных смол
2. Области применения
Благодаря своим уникальным свойствам эпоксидные смолы нашли широкое применение в промышленности…
Формалиновое производство
1. Свойства и области применения формальдегида
Свойства формальдегида Систематическое наименование метаналь, формальдегид Химическая формула HCHO Молярная масса 30,03 г/моль Физические свойства Состояние (станд. усл.) бесцветный газ Плотность 1…
Фосфорная кислота и фосфаты
1.3 Возможности и области практического применения
…
Химия элементов IБ группы
2.7 Области применения
В 1737 г. немецкий ученый И. Шульце впервые обнаружил светочувствительность нитрата серебра…
Циклоалканы – органические соединения
Применение, значение для человека
Циклоалканы широко распространены в природе, они входят в состав нефти. В нефтехимической промышленности нафтены являются источником получения ароматических углеводородов путем каталитического крекинга…
Экономическая оценка эффективности применения композитов Ф-4СФ/полианилин в качестве рН-индикаторов
1.1 Классификация индикаторов и области их применения
Индикатор — прибор, устройство, информационная система, вещество — объект, отображающий изменение какого-либо параметра контролируемого процесса или состояния объекта в форме…
Эфирные масла
3. Области применения эфирных масел
Области применения эфирных масел: — пищевые ароматизаторы; — медицинские препараты, лекарственные средства — компоненты парфюмерных и косметических средств; — ароматерапия; а также как растворители и др. 4…
him.bobrodobro.ru
Реферат Катализатор
скачатьРеферат на тему:
План:
-
Введение
- 1 Катализаторы в химии
- 2 Катализаторы в автомобилях Источники
Введение

Схема протекания реакции с катализатором
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
1. Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
2. Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
Источники
- ↑ 123 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru.
wreferat.baza-referat.ru
|
Обратная связь ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса — ваш вокал Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими Целительная привычка Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Тренинг уверенности в себе Вкуснейший «Салат из свеклы с чесноком» Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Как слышать голос Бога Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека — Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д. Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу. Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар. |
Отмеченные особенности явлений катализа, а именно то, что катализатор ускоряет химические превращения без расхода энергии и практически без расхода самого вещества катализатора, и делают катализ чрезвычайно ценным средством осуществления химических превращений в промышленности. Остановимся кратко лишь на некоторых каталитических промышленных процессах. Хотя явления катализа очень широко распространены в природе и человеку пришлось уже давно с ними столкнуться, широкое использование катализа в промышленности началось только в текущем столетии. Каталитические процессы используются для производства водорода, служащего сырьем для синтеза аммиака и ряда других производств химической технологии. Наиболее дешевым источником водорода является природный газ. Первая стадия получения водорода включает взаимодействие метана с водяным паром при частичном добавлении кислорода или воздуха при температуре 1130-1270 К. В качестве катализатора используется никель, нанесенный на термостойкие носители. В результате этой реакции наряду с водородом образуется в значительном количестве оксид углерода. Путем взаимодействия оксида углерода с водяным паром при более низких температурах с использованием оксидных катализаторов удается окислить СО до СО2, при этом образуется водород. До последнего времени в качестве катализатора для осуществления этой реакции применялся Fe3O4 с добавками оксида хрома. Такой катализатор достаточно активен только при температурах выше 670 К. При этой температуре равновесие реакции даже при избытке водяного пара значительно смещено влево и конечная реакционная смесь содержит значительное количество оксида углерода, присутствие которого резко снижает активность катализаторов синтеза аммиака. Для удаления остатков СО необходимо было применять сложную промывку газовой смеси аммиачным раствором Сu2О под давлением. За последние годы был и найдены новые катализаторы взаимодействия оксида углерода с водяным паром, содержащие медь в форме различных шпинелей или других оксидных соединений. Такие катализаторы обеспечивают высокую скорость превращения оксида углерода уже при температуре 450-560 К. Благодаря этому, конечное содержание оксида углерода может быть снижено до десятых долей процента, а сложная операция отмывки заменена более простым процессом превращения остатка оксида углерода в безвредный для катализаторов, в том числе и при синтезе аммиака, метан: Этот процесс осуществляется также каталитически с помощью никелевых катализаторов. Таким образом, разработка более активного катализатора позволила существенно упростить технологическую схему. В качестве еще одного примера можно привести каталитические процессы нефтепереработки. В 1920-е годы переработка нефти ограничивалась ректификацией и разложением при нагревании до высоких температур, так называемым термическим крекингом, без применения катализаторов. Только в конце 1930-х годов были сделаны первые попытки использовать для переработки нефти каталитические процессы. Изобретатель каталитического крекинг а французский инженер Гудри в докладе на II Международном конгрессе по катализу обратил внимание на то, что в обзоре Американского института нефти о состоянии и перспективах промышленности нефтепереработки, опубликованном в 1935 г., ни разу не упоминается слово «катализ», а через несколько лет каталитические методы вызвали коренное преобразование этой отрасли промышленности. Эффективность применения катализа оказалась столь значительной, что за несколько лет в нефтеперерабатывающей промышленности произошла подлинная техническая революция, позволившая на основе применения катализаторов резко повысить как выход, так и качество получаемых моторных топлив, В настоящее время свыше 80% нефти перерабатывается с использованием каталитического крекинга, риформинга, гидрогенолиза сернистых соединений, гидрокрекинга и других каталитических процессов. В табл. 2.1 приведены важнейшие современные каталитические процессы нефтепереработки.
|
megapredmet.ru
Роль катализатора в химической реакции
Home / Публикации / Статьи / ТЕОРИЯ ХИМИЧЕСКИХ РЕАКЦИЙ / Роль катализатора в химической реакции
Существующее до сих пор определение катализатора (Катализаторами называют вещества, увеличивающие скорость реакции. Катализатор проводит реакцию по пути, требующему меньшей энергии активации) не объясняет явление, а только регистрирует внешнее событие. Наше определение помогает понять природу химических реакций и химической связи, физический смысл явления катализа.
Условно катализаторы можно разбить на две группы.
К первой группе относятся вещества, которые в условиях реакции дают значительно больше активных частиц ведущих цепной процесс. Наглядные примеры щелочной и кислотный гидролиз сложных эфиров.
Ко второй группе относятся катализаторы, увеличивающие концентрацию промежуточного соединения. Эти катализаторы образуют комплекс с обеими исходными насыщенными молекулами и электронная изомеризация протекает через промежуточное образование химических связей с катализатором.
AB + K → ABK
ABK + CD → ABKCD
ABKCD → AC + BD + K
где AB и CD являются реагирующими веществами.
Ускорение реакции (каталитическое действие вещества) может быть объяснено следующим образом. В отсутствии катализатора промежуточным соединением реакции является AB-CD, тогда как в присутствии катализатора — AB-K-CD. Скорость реакции в обоих случаях пропорциональна концентрации промежуточного соединения. Соотношение же между AB-CD (без катализатора) и AB-K-CD будет определяться энергией связи AB-CD и AB-K-CD.
Энергия связи обеих молекул с катализатором гораздо выше, чем их энергия связи друг с другом, поэтому концентрация промежуточных соединений с катализатором гораздо выше, следовательно, выше и скорость реакции.
Такой механизм действия катализатора типичен для биологических систем, в которых катализаторами обычно являются ферменты (энзимы), объединяющие вступающие в реакции молекулы в своих центрах.
Роль химической активации также возрастает с выигрышем энергии в ходе реакции, которая также идет на разрыв слабых связей, что позволяет понять физический смысл правил Семенова — Поляни.
Т.О., механизмы действия катализатора это :
- увеличение концентрации активных частиц в реакционной смеси;
- образование промежуточных соединений с обоими из реагентов реакции;
- химическая активация.
Как правило, в каталитической реакции присутствуют несколько механизмов.
itchem.ru
Роль катализатора — Стоимость владения автомобилем — Честная экономия топлива. Фильтры-катализаторы Eco-cars Professional Russia
Важнейшее влияние на состав отработавших газов автомобильных двигателей оказывает качество топливо-воздушной смеси, поступающей в цилиндры двигателя внутреннего сгорания. Состав смести характеризует коэффициент избытка воздуха «лямбда» (в технической литературе его еще можно встретить как коэффициент «альфа»). Коэффициент избытка воздуха — это отношение реального количества воздуха в смести к теоретически необходимому — тому, что соответствует полному сгоранию. Идеальный случай, когда лямбда =1, это означает, что смесь состоит из 15 частей воздуха и 1 части бензина (углеводородного топлива), последнее сгорает полностью и при этом образуется всего два компонента — углекислый газ (СО2) и водяной пар (Н2О). При полном сгорании углеводородного топлива(бензина) концентрация СО2 будет максимальна.
При обогащении смеси, т.е. при увеличении в ней содержание топлива (лямбда меньше 1), при ее воспламенении в связи с недостатком кислорода образуются продукты неполного сгорания углеводородного топлива (бензина) — оксид углерода (СО) и несгоревшие углеводороды (СН).
Обеднение смеси (лямбда более 1) первоначально приведет к понижению концентрации СО и СН в отработавших газах, при значении лябмда = 1,1 содержание СО и СН минимизируется. Последующее обеднение топливо-воздушной смеси, несмотря на избыток кислорода, ухудшает сгорание топлива, появляются задержки воспламенения, двигатель теряет устойчивую работу, в связи с чем в выхлопных газах доля продуктов неполного сгорания, особенно СН, увеличивается. На практике же идеального процесса сгорания углеводородного топлива не бывает, поскольку незначительная часть углеводородного топлива оседает на стенках камеры сгорания, да и по самому объему камеры сгорания смесь однородно не перемешивается. Максимальную мощность двигателя обеспечивает богатая топливная смесь, а наибольшая экономичность проявляется при бедной топливо-воздушной смеси.
Для снижения выбросов вредных веществ с отработавшими газами в окружающую среду на двигатели устанавливаются выпускные коллекторы с каталитическими нейтрализаторами (катоколлекторы, катализаторы). Они, в свою очередь, обеспечивают доокисление (дожигание) оксида углерода, углеводородов, углекислого газа, т.е. в нейтрализаторах протекает процесс преобразования вредных соединений до безвредных. На двигателях, имеющих нейтрализаторы отработавших газов, концентрация вредных веществ значительно ниже концентрации вредных веществ двигателей без нейтрализаторов отработавших газов.
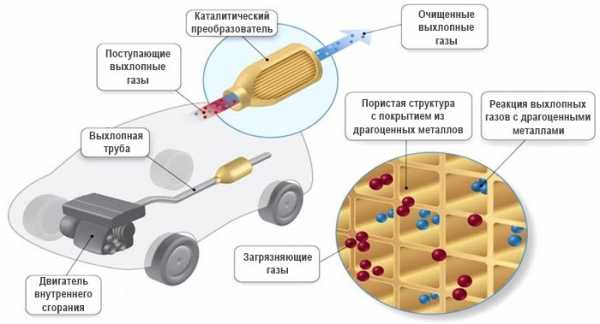
Каталитический нейтрализатор расположен либо на приемной трубе, либо сразу после нее. Внутри корпуса каталитического нейтрализатора находится керамическая сотовая конструкция. Соты нужны для того, чтобы увеличить площадь контакта выхлопных газов с поверхностью, на которую нанесен тонкий слой сплава редкоземельных металлов (чаще всего платиноиридиевый сплав). Недороревшие остатки (СО, СН, NO), касаясь поверхности каталитического слоя, окисляются до конца кислородом, присутствующим также в выхлопных газах.

В результате реакции выделяется тепло, разогревающее катализатор, и тем самым, активизируется реакция окисления. В конечном итоге на выходе из исправного катализатора выхлопные газы содержат в основном N2 и СО2.
В каталитических преобразователях автомобилей обычно применяются катализаторы двух типов: восстанавливающий и окислительный. И те, и другие представляют собой керамическую структуру, на которую нанесен металлический катализатор — платина, родий и/или палладий.
eco-cars.pro