Разложение перманганата калия. Свойства солей марганцевой кислоты
Окислительно-восстановительные процессы лежат в основе важнейших явлений живой и неживой природы: горения, разложения сложных веществ, синтеза органических соединений. Перманганат калия, свойства которого мы изучим в нашей статье, относится к наиболее сильным окислителям, применяемым в лабораторных и промышленных условиях. Его окислительные способности зависят от степени окисления атома, которая меняется в ходе реакции. Рассмотрим это на конкретных примерах химических процессов, происходящих с участием молекул KMnO4.

Характеристика вещества
Рассматриваемое нами соединение (перманганат калия) является одним из наиболее применяемых в промышленности веществ – соединений марганца. Соль представлена кристаллами в виде правильных призм темно-фиолетового цвета. Она хорошо растворяется в воде и образует раствор малинового цвета, обладающий прекрасными бактерицидными характеристиками. Поэтому вещество нашло широкое применение как в медицине, так и в быту в качестве бактерицидного средства. Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
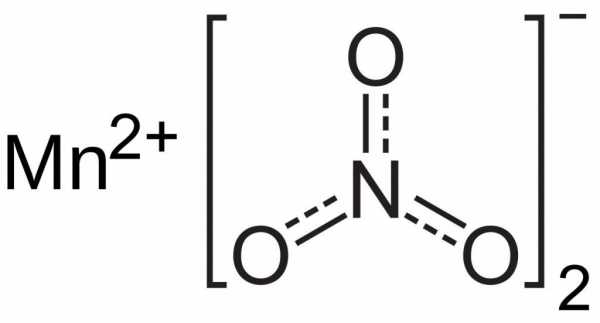
Опыты с марганцовкой
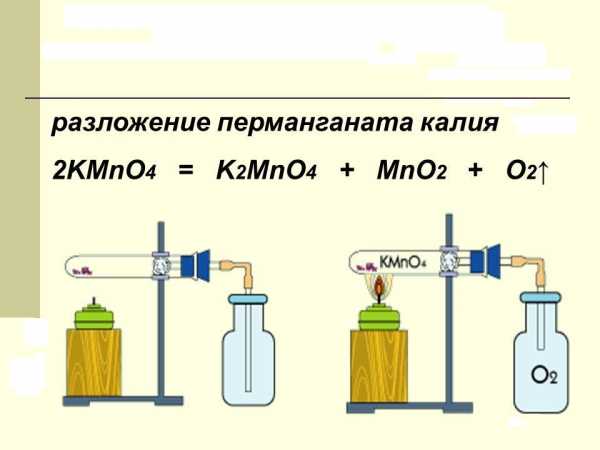
Вещество, в быту называемое марганцовкой, при нагревании разлагается. В продуктах реакции обнаруживается свободный кислород, двуокись марганца и новая соль – K2MnO4. В лаборатории этот процесс проводят для получения чистого кислорода. Химическое уравнение разложения перманганата калия можно представить так:
2KMnO4 = K2MnO4 + MnO2 + O2.
Сухое вещество, представляющее собой фиолетовые кристаллы в виде правильных призм, нагревают до температуры +200 °C. Катион марганца, находящийся в составе соли, имеет степень окисления, равную +7. Она снижается в продуктах реакции до величин +6 и +4 соответственно.
Окисление этилена
Газообразные углеводороды, относящиеся к различным классам органических соединений, имеют как одинарные, так и кратные связи между атомами углерода в составе своих молекул. Как определить присутствие пи-связей, лежащих в основе непредельного характера органического соединения? Для этого проводят химические опыты, пропуская исследуемое вещество (например, этен или ацетилен) через фиолетовый раствор перманганата калия. Наблюдается его обесцвечивание, так как непредельная связь разрушается. Молекула этилена окисляется и из непредельного углеводорода превращается в двухатомный предельный спирт – этиленгликоль. Данная реакция является качественной на наличие двойных или тройных связей.
Особенности химических проявлений KMnO4
Если степени окисления реагентов и продуктов реакции изменяются, значит происходит реакция окисления-восстановления. В ее основе лежит явление перемещения электронов от одних атомов к другим. Как и в случае с разложением перманганата калия, так и в других реакциях, вещество проявляет ярко выраженные свойства окислителя. Например, в подкисленном растворе сернистокислого натрия и перманганата калия образуется сульфаты натрия, калия и марганца, а также вода:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H20.
В этом случае ион серы является восстановителем, а марганец, входящий в сложный анион MnO4—, проявляет свойства окислителя. Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Влияние среды на протекание химической реакции
В зависимости от концентрации ионов водорода или гидроксильных групп различают кислый, щелочной или нейтральный характер раствора, в котором происходит окислительно-восстановительная реакция. Например, при избыточном содержании катионов водорода, ион марганца со степенью окисления +7 в перманганате калия понижает ее до +2. В щелочной среде, при высокой концентрации гидроксильных групп, сульфит натрия, взаимодействуя с перманганатом калия, окисляется до сульфата. Ион марганца со степенью окисления +7 переходит в катион с зарядом +6, находящийся в составе K2MnO4, раствор которого имеет зеленую окраску. В нейтральной среде сульфит натрия и перманганат калия реагируют между собой, при этом осаждается двуокись марганца. Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.

Применение солей марганцевой кислоты
Реакция разложения перманганата калия при нагревании и другие окислительно-восстановительные процессы, проходящие с участием солей марганцевой кислоты, часто используются в промышленности. Например, окисление многих органических соединений, выделение газообразного хлора из соляной кислоты, превращение солей двухвалентного железа в трехвалентное. В сельском хозяйстве раствор KMnO4 применяют для предпосевной обработки семян и почвы, в медицине им обрабатывают поверхность ран, дезинфицируют воспаленные слизистые оболочки носовой полости, используют для обеззараживания предметов личной гигиены.
В нашей статье мы не только подробно изучили процесс разложения перманганата калия, но также рассмотрели его окислительные свойства и применение в быту и промышленности.
fb.ru
Химик.ПРО — Реакции перманганат калия
Как влияет величина рН раствора на состав продуктов восстановления перманганата калия (KMnO4)? Приведите примеры соответствующих окислительно-восстановительных реакций перманганата калия. В какой среде окислительные свойства указанного окислителя выражены наиболее сильно?
Решение задачи
Среда (рН раствора) в которой протекает реакция, оказывает влияние на степень окисления атомов и, поэтому, окислительно-восстановительный процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов.

перманганат калия
Итак, перманганат-ионы (MnO4—), которые придают раствору малиновую окраску:
- в кислой среде (pH < 7) восстанавливаются до катионов Mn2+, раствор становится бесцветным
Пример реакции перманганата калия
- в нейтральной среде (pH = 7) восстанавливаются до MnO2, выпадает осадок бурого цвета
Пример реакции перманганата калия:
- в щелочной среде (pH > 7) восстанавливаются до манганат-ионов MnO42-, раствор приобретает зеленую окраску
Пример реакции перманганата калия:
Ответ:
окислительные свойства перманганата калия выражены наиболее сильно в кислой среде.
himik.pro
Перманганат калия. Задачи 1099 — 1100
Задача 1099.
Написать уравнение реакции термического разложения перманганата калия. К какому типу окислительно-восстановительных превращений относится эта реакция?
Решение:
Уравнение реакции имеет вид:
2КMnO 4 К2MnO4 + MnO2↓ + O2↑
Здесь марганец уменьшает свою степень окисления от +7 до +6 (является окислителем), а кислород увеличивает сою степень окисления от -2 до 0 (является восстановителем). Реакции, при которых одна составная часть сложного вещества служит окислителем (Mn), а другая – восстановителем (О), называется внутримолекулярной реакцией окисления-восстановления.
Приготовление раствора, содержащего смесь из комбинации ионов
Задача 1100.
Можно ли приготовить раствор, который содержал бы одновременно Sn2+ и Hg2+; Sn2+ и Fe3+; SO32- и MnO4–; Cr2O72- и SO42-? Указать, какие комбинации ионов невозможны и почему.
Решение:
а) В Sn2+ атом элемента находится в своей промежуточной степени окисления, поэтому ион Sn2+ будет проявлять восстановительные свойства. В Hg
Таким образом, приготовить раствор, который содержал бы одновременно Sn2+ и Hg2+ нельзя, так как будет протекать окислительно-восстановительный процесс.
б) В Sn2+ атом элемента находится в своей промежуточной степени окисления, поэтому ион Sn2+ будет проявлять восстановительные свойства. В Fe3+ атом элемента железа находится в своей высшей степени окисления, поэтому ион Fe3+ будет проявлять только окислительные свойства. Уравнения полуреакций процесса окисления-восстановления:
Таким образом, приготовить раствор, который содержал бы одновременно Sn2+ и Fe3+ нельзя, так как будет протекать окислительно-восстановительный процесс.
в) В SO32- атом элемента серы находится в своей промежуточной степени окисления, поэтому ион SO32- будет проявлять восстановительные свойства. В MnO4– атом элемента марганца находится в своей высшей степени окисления, поэтому ион MnO4– будет проявлять только окислительные свойства. Уравнения полуреакций процесса окисления-восстановления:
Таким образом, приготовить раствор, который содержал бы одновременно SO32- и MnO4–; нельзя, так как будет протекать окислительно-восстановительный процесс.
г) В Cr2O72- атом элемента хрома находится в своей высшей степени окисления, поэтому ион Cr2O72- будет проявлять окислительные свойства. В SO42- атом элемента серы находится в своей высшей степени окисления, поэтому ион SO42- будет проявлять только окислительные свойства.
Так как в растворе присутствуют ионы Cr2O72- и SO42-, которые оба проявляют окислительные свойства, то приготовит раствор с одновременным содержанием этих ионов возможно.
Ответ: г.
buzani.ru
ЛР_4 — Окислительно-восстановительные реакции
С этим файлом связано 58 файл(ов). Среди них: Лекция № 14_Si,SiO2,h3SiO3,Sn,Pb.doc, 1-Карточки_Кинетика химических реакций.doc, Химия БПП_Вариант 11.doc, Общая химия_Вариант 01.DOC.doc, Лекция № 13_Элементы IV группы_C,CO,CO2,MeCO3.doc, Вопросы к коллоквиуму по общей химии_ГЧ-I.doc, Химия БПП_Вариант 10.doc, Общая химия_Вариант 10.DOC.doc, Окончание Лекции № 15_Алюминий и его соединения…doc, Общая химия_Вариант 14.DOC.doc и ещё 48 файл(а).
Показать все связанные файлы
Лабораторная работа № 5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степени окисления.
Степень окисления (СтО) – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов.
Степень окисления может быть положительной, отрицательной или нулевой. Атомы одного и того же элемента в разных соединениях проявляют различные степени окисления.
Степень окисления показывает, сколько электронов смещено от атома данного элемента (положительная степень окисления) или к атому данного элемента (отрицательная степень окисления). Смещение электронов происходит к наиболее электроотрицательному элементу.
Нулевую степень окисления имеют атомы в молекулах простых веществ (образованных атомами одного элемента). В них элементы имеют абсолютно одинаковые электроотрицательности и электроны не смещаются ни к одному из атомов.
Правила определения степени окисления
1. Существуют элементы, проявляющие во всех молекулах сложных веществ постоянную степень окисления:
– Элементы І группы главной подгруппы (щелочные металлы): Li+, Na+, K+, Rb+, Cs+, а также Ag+;
– Водород Н+ (кроме гидридов металлов )
– Элементы ІІ группы главной подгруппы (щелочно-земельные металлы): Be+2, Mg+2, Ca+2, Sr+2, Ba+2; а также Zn+2;
– Элементы ІІІ группы главной подгруппы: B+3, Al+3;
– Кислород О-2, кроме пероксидов (,,), надпероксидов , озонидов и фторида кислорода.
2. Высшая степень окисления элемента равна номеру группы элемента (N) в таблице Менделеева. СтОmax = N:
Cl+7(VII гр.), S+6(VI гр.), N+5(V гр.), Mn+7(VII гр.), Cu+2(II гр.).
Низшая степень окисления элемента равна: СтОmin = N – 8:
Cl–(VII гр.), S–2(VI гр.), N–3(V гр.), C–4(IV гр.).
3. Степени окисления элементов в сложных веществах определяются, исходя из правила: сумма степеней окисления всех атомов в молекуле равна нулю, в ионе – заряду иона.
Пример: В молекуле дихромата калия K2Cr2O7 степени окисления калия и кислорода постоянны: К+, О 2; степень окисления хрома является переменной, ее необходимо определить.
Так как сумма всех степеней окисления в молекуле равна нулю, можно составить уравнение, обозначив степень окисления хрома за х:
2(+1) + 2х + 7(-2) = 0,
откуда х = 6.
Степень окисления хрома равна +6:
Окисление – процесс отдачи электронов атомом, молекулой или ионом.
Частицы, отдающие электроны – восстановители.
В процессе окисления степень окисления восстановителя повышается.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом.
Частицы, принимающие электроны – окислители.
В процессе восстановления степень окисления окислителя понижается.
Процесс передачи электронов от восстановителя к окислителю подчиняется правилу электронного баланса: число электронов отданных восстановителем всегда равно числу электронов принятых окислителем.
Существует два метода составления уравнений окислительно-восстановительных реакций: метод электронного баланса и метод полуреакций (ионно-электронный метод).
Метод электронного баланса
1. Записать схему реакции, которую требуется уравнять:
KMnO4 + KJ + H2SO4 → J2 + MnSO4 + K2SO4 + H2O
2. Определить степени окисления всех атомов, участвующих в реакции. Выявить элементы, меняющие степень окисления:
3. Составить схему электронного баланса, подставляя в нее то количество атомов окислителя и восстановителя, которое имеется в исходной реакции.
Число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. Найти наименьшее общее кратное для числа электронов и дополнительные множители, которые становятся коэффициентами при окислителе и восстановителе:
4. Расставить коэффициенты перед окислителем и восстановителем в левой части, перед восстановленной и окисленной формами в правой части схемы (необходимо учитывать удвоенное число атомов в схеме электронного баланса):
2KMnO4 + 10KJ + H2SO4 → 5J2 + 2MnSO4 + K2SO4 + H2O
5. Уравнять атомы металлов, не меняющих степень окисления.
В левой части 12 атомов K, следовательно, в правой части перед K2SO4, содержащим 2 атома K, ставится коэффициент 6:
2KMnO4 + 10KJ + H2SO4 → 5J2 + 2MnSO4 + 6K2SO4 + H2O
6. Уравнять кислотные остатки.
В правой части 8 ионов , поэтому перед H2SO4 ставится коэффициент 8:
2KMnO4 + 10KJ + 8H2SO4 → 5J2 + 2MnSO4 + 6K2SO4 + H2O
7. Уравнять атомы водорода.
В левой части 16 атомов водорода, поэтому перед H2O необходимо поставить коэффициент 8:
2KMnO4 + 10KJ + 8H2SO4 → 5J2 + 2MnSO4 + 6K2SO4 + 8H2O
8. Проверить правильность подбора коэффициентов, подсчитав число атомов кислорода в обеих частях уравнения:
В левой части: 2·4 + 8·4 = 40. В правой части: 2·4 + 6·4 + 8 = 40. Коэффициенты расставлены верно.
Метод полуреакций (ионно-электронный метод)
Этот метод применяют при составлении уравнений окислительно-восстановительных реакций, протекающих в растворе. При этом рассматривают не отдельные атомы, а ионы или молекулы в том виде, в каком они существуют в растворе: неэлектролиты, слабые электролиты и малорастворимые вещества записывают в молекулярном виде, а сильные электролиты – в виде ионов.
В исходных ионах или молекулах может быть избыток или недостаток атомов кислорода по сравнению с образовавшимися частицами. Перенос этих атомов осуществляется при помощи катионов водорода , гидроксид-ионов или молекул воды Н2О (в зависимости от характера среды, в которой протекает данная реакция).
Схемы составления полуреакций
ОВР в кислой среде
В растворе присутствуют ионы Н+ и молекулы Н2О
Избыток кислорода в левой части уравнения связывается катионами Н+ с образованием молекул воды:
,
где n – число атомов кислорода, которые исходная частица отдает или принимает; m – число атомов кислорода, оставшихся в исходной частице.
Недостаток кислорода в левой части уравнения восполняют молекулы воды, оставляя катионы водорода:
Чтобы уравнять суммарные заряды в обеих частях полуреакции, в левой ее части добавляют или отнимают соответствующее количество электронов.
Пример 1:
ОВР в щелочной среде
В растворе присутствуют ионы ОН–и молекулы Н2О
Избыток кислорода в левой части уравнения связывается молекулами воды с образованием гидроксид-ионов:
Недостаток кислорода в левой части уравнения восполняют гидроксид-ионы, оставляя молекулы воды:
Пример 2:
ОВР в нейтральной среде
В растворе присутствуют только молекулы Н2О
Избыток и недостаток кислорода регулируется молекулами воды с образованием гидроксид-ионов и катионов водорода:
Пример 3:
Если в исходных и конечных частицах нет атомов кислорода, то заряды до и после реакции уравниваются только за счет перехода электронов:
Алгоритм уравнивания ОВР методом полуреакций
1. Записать схему реакции, которую требуется уравнять:
Na2SO3 + KJO3 + H2SO4 → Na2SO4 + J2 + K2SO4 + H2O
2. Определить степени окисления всех атомов, участвующих в реакции. Найти элементы, меняющие степень окисления и определить, в состав каких молекул или ионов они входят:
3. Определить характер среды и составить схемы полуреакций окисления и восстановления. Определить число электронов, участвующих в полуреакциях. Для них найти наименьшее общее кратное и дополнительные множители (коэффициенты) для каждой полуреакции:
Среда кислая, т.к. одно из исходных веществ – серная кислота.
4. Сложить уравнения полуреакций с учетом дополнительных множителей и получить сокращенное ионное уравнение реакции. Электроны при этом сокращаются:
Одинаковые ионы в левой и правой частях можно сократить:
5. Каждый ион дополнить таким количеством соответствующих противоионов, чтобы в сумме они образовали нейтральные молекулы веществ из уравниваемой реакции.
Число противоионов, добавленных в левой и правой частях, должно быть одинаковым. Недостающие ионы необходимо прибавить отдельно:
В правой части не хватает ионов и , их необходимо добавить отдельно:
6. Составить молекулярное уравнение, объединив соответствующие ионы в молекулы, и расставить в нем коэффициенты:
2KJO3 +5Na2SO3 + H2SO4 = J2 + 5Na2SO4 + K2SO4 + H2O
Типы окислительно-восстановительных реакций
1.Межмолекулярные – ОВР, в которых окислитель и восстановитель находятся в разных молекулах:
В данной реакции 2 молекулы азотной кислоты идут на восстановление до NO, а еще 6 – на связывание трех ионов меди. Поэтому общий коэффициент перед азотной кислотой равен 8:
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
2.Внутримолекулярные – ОВР, в которых окислитель и восстановитель находятся в одной молекуле.
3. Реакции диспропорционирования – ОВР, в которых окислителем и восстановителем является одна и та же частица.
а) Дисмутация – одна часть атомов восстанавливается, а другая часть тех же атомов окисляется:
б) Коммутация – разные вещества, содержащие атомы одного элемента в разных степенях окисления, превращаются в одно и то же вещество:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы:
Познакомиться с типами окислительно-восстановительных реакций. Изучить окислительно-восстановительные свойства некоторых веществ. Освоить методы уравнивания ОВР.
Оборудование и реактивы:
Растворы: йода J2 (спиртовый), сульфита натрия Na2SO3 (0,5н), дихромата калия K2Cr2O7 (0,5н), серной кислоты H2SO4 (2н), сульфата марганца(II) (0,5н), пероксида водорода H2O2 (3 %), перманганата калия KMnO4 (0,5н), гидроксида калия KOH (2н). Дихромат аммония (NH4)2Cr2O7 (тв.). Перманганат калия KMnO4 (тв.). Серная кислота H2SO4 (конц.). Вода.
Асбестированная сетка. Фарфоровая чашка. Пипетка. Стеклянная палочка. Спиртовка. Спички. Пробирки.
Восстановительные свойства сульфитов
В первую пробирку налить 1 мл водного раствора йода.
Во вторую налить 1 мл раствора дихромата калия и подкислить несколькими каплями разбавленной серной кислоты.
В каждую пробирку добавить по 1 мл раствора сульфита натрия. Отметить изменение окраски раствора в обеих пробирках.
Запись результатов опыта:
1. Расставить коэффициенты методом полуреакций:
а) Na2SO3 + J2 + H2O → Na2SO4 + HJ
б) Na2SO3+K2Cr2O7+H2SO4→Na2SO4+Cr2(SO4)3+K2SO4+H2O
2. Записать наблюдаемые явления.
3. Какая частица выполняет роль окислителя в каждом случае?
Окислительно-восстановительные свойства пероксида водорода и соединений марганца
В первую пробирку налить 1 мл раствора перманганата калия и подкислить его несколькими каплями разбавленной серной кислоты.
Во второй пробирке ионообменной реакцией получить нерастворимый гидроксид марганца(II).
В каждую пробирку добавить по 1 мл раствора пероксида водорода.
Отметить наблюдаемые изменения.
Запись результатов опыта:
1. Написать реакцию образования гидроксида марганца в ионной и молекулярной формах.
2. Расставить коэффициенты методом электронного баланса. Обозначить окислители и восстановители:
а) H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
б) Mn(OH)2 + H2O2 → MnO2 + H2O
3. Написать реакцию разложения пероксида водорода, катализатором для которой является образующийся диоксид марганца. При этом образуется два вещества, в которых кислород проявляет степени окисления -2 и 0.
4. Почему пероксид водорода способен проявлять и окислительные, и восстановительные свойства?
5. Какие свойства – окислительные или восстановительные – могут проявлять соединения марганца KMnO4, MnO2 и Mn(OH)2? Ответ пояснить.
Влияние рН среды на окислительную способность перманганат-иона
В три пробирки налить по 1 мл раствора перманганата калия.
В первую добавить несколько капель разбавленной серной кислоты.
Вторую оставить без изменений.
В третью добавить несколько капель раствора гидроксида калия.
В каждую пробирку добавить по 1 мл раствора сульфита натрия. Отметить различные признаки реакции во всех пробирках.
Запись результатов опыта:
1. Расставить коэффициенты методом полуреакций:
а) Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
б) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
в) Na2SO3 + KMnO4 + KOH → Na2SO4 + K2MnO4 + H2O
2. Описать наблюдаемые явления в каждой пробирке.
3. В какой среде восстановление перманганат-иона протекает наиболее полно? Как рН среды влияет на окислительные способности окислителей?
Типы окислительно-восстановительных реакций
а) Взаимодействие перманганата калия с сульфатом марганца
В пробирку налить 1 мл раствора перманганата калия и добавить 1 мл раствора сульфата марганца.
Что наблюдается?
б) Взаимодействие йода с раствором щелочи
В пробирку налить 1 мл раствора йода. Прилить равный объем раствора гидроксида калия. Отметить изменение окраски.
в) Термическое разложение дихромата аммония («Вулкан»). ДЕМОНСТРАЦИОННЫЙ.
Проводить под тягой или в хорошо проветриваемом помещении!
На асбестированную сетку насыпать небольшую горку порошка дихромата аммония. Спичкой поджечь вершину горки до начала разложения соли. Что наблюдается?
Образовавшуюся рыхлую массу оксида хрома по окончании опыта собрать для дальнейшего использования.
Запись результатов опыта:
1. Расставить коэффициенты методом электронного баланса:
а) MnSO4 + KMnO4 + H2O → MnO2 + K2SO4 + H2SO4
б) J2 + KOH → KJ + KJO + H2O
в) (NH4)2Cr2O7 → N2 + Cr2O3 + H2O
2. Записать наблюдаемые явления в каждом случае.
3. Определить тип каждой из проделанных реакций.
Действие сильных окислителей на органические вещества. ДЕМОНСТРАЦИОННЫЙ
В фарфоровую чашку внести один микрошпатель кристаллического перманганата калия. Добавить несколько капель концентрированной серной кислоты до образования зеленой жидкости оксида марганца(VII).
В полученную жидкость обмакнуть стеклянную палочку. Коснуться палочкой фитиля спиртовки – спиртовка загорается (оксид марганца(VII) очень энергично реагирует со спиртом и тот возгорается).
В чашку с зеленой жидкостью добавить воды. О наличии каких ионов говорит цвет полученного раствора?
Запись результатов опыта:
1. Написать уравнения реакций, протекающих без изменения степеней окисления элементов:
а) Взаимодействия перманганата калия с концентрированной серной кислотой;
б) Разложения неустойчивой марганцевой кислоты.
2. Расставить коэффициенты методом электронного баланса:
Mn2O7 + C2H5OH → MnO2 + CO2 + H2O
3. Написать реакцию взаимодействия Mn2O7 с водой.
4. Записать все наблюдаемые явления.
перейти в каталог файлов
uhimik.ru
Овр разложение перманганата калия
К какому типу ОВР относится разложение перманганата калия помогите, пожалуйста
Внутримолекулярные, но разложение так просто быть не может, его нужно окислить как бы, тогда сменит степень окисления
3 Характерные с.о. кислорода и окислительно-восстановительные свойства некоторых его соединений Классификация ОВР.Окислительные свойства перманганата калия KMnO4 в кислой, нейтральной и щелочной средах.
Помогите с химией! ОВР
Cu(NO3)2*3h3O=Cu(OH)2+HNO3+O2
Na2SO3=Na2O+SO2
KMno4=K2O+MnO2
KCr(SO4)2 + NaOH = Na2SO4+KCr(OH)2
Реакции разложения.Реакции с участием перманганата калия в качестве окислителя. При взаимодействии перманганата калия с восстановителем образуются различные продукты восстановления в зависимости от pH среды.
Ну дык конечно K3[Cr(OH)6]. Только это все равно не ОВР.
Дык у татьяны ивановой в щелочи гидроксид хрома амфотерный стопудова раствориться и будет Na3[Cr(OH)6].
Реакция.
KCr(SO4)2 + 6NaOH = KNaSO4 + Na2SO4 + Na3[Cr(OH)6]
И такки да именно Na3[Cr(OH)6] а не K3[Cr(OH)6] ибо трехкратному избытку калия по сравнению с хромом там неоткуда взяться.
А сульфит при разложении не даст таки оксид натрия точно.
То есть или пойдет (если восстановительная атмосфера)
2Na2SO3 -> 2Na2S + 3O2
Или скорее всего (эту реакцию лично я считаю правильной! )
4Na2SO3 -> Na2S + 3Na2SO4
Помогите, пожалуйста с химией!!! Делаю лабораторный журнал, половину реакций не знаю(((
Помогите с химией опытом
Химия. Органика
1) присоединение брома к этилену в водном растворе
2) нагревание муравьиной кислоты
3) щелочной гидролиз галогенпроизводного алкана
4) окисление стирола перманганатом калия в кислой среде
Слайд 9 Представим процессы ОВР Е величество ОВР Восстановление Процессы Окисление Окислитель Участники Восстановителькислородсодержащих веществ путем их разложения при нагревании. а разложение перманганата калия 2KMnO 4 K 2 MnO 4 MnO 2 O 2 .
В качестве топлива для турбины раньше использовали смесь перекиси водорода с перманганатом калия. Возможно ли это дома?
Один весёлый мальчег на этои деле потерял 2 пальца правой руки и глаз.
Не советую.
Пример 9.Реакция разложения бихромата аммонияПример 12.Рассчитайте энергию Гиббса и константу равновесия реакции восстановления перманганата калия сульфатом железа II .
Что за хрень для газовой турбины газ, для паровой пар, зачем перекись?
Что тебе кажется?
Вспомни Николу Тесла: он черпал энергию «из эфира, что нас окружает». Вот это скорее возможно.
Чего-то вы, товарищ, путаете. И перекись и перманганат — окислители. Кого окислять будем?
Слава богу, что перекись, которую дома можно достать — 3% раствор. А то бы точно без рук, ног и головы остался!
А насчёт топлива для «турбины» — не слышала. Какой интересно, турбины? ТРД? Вряд ли.
Кроме того, сторго говоря перекись — не топливо, но она, разлагаясь, выделяет значительную энергию, а перманганат — сильный катализатор этого процесса.
Так что такая смесь храниться не будет — разлагается со взрывом.
Но в принципе, наперное можно какой-то реактивный двигатель сконструировать, где в камеру раздельно эти ингредиенты подавать. Только перманганат — твёрдый, а это неудобно.
И ещё раз, а турбина-то зачем? В турбореактивном двигателе она турбокомпрессор крутит,
воздух подаёт. А для разложения перекиси водорода воздух не нужен.
В окислительно-восстановительных реакциях перманганаты являются сильными окислителями.При нагревании перманганат калия разлагается эта реакция применяется для получения кислорода в лабораторных условиях
Действительно, это окислители и вот почему.
перекись водорода Н2О2 не стабильное соединение даже при не сильном нагреве (даже при комнатной температуре) и на свету (обратите внимание всегда в коричневой бутылке) получаем Н20 и О2.
пермангонат калия KMnO4 тоже сравнительно нестабильное, разлагется при на греве и на свету на KMnO2 (возможно KMnO3 не помню, а валентности и ОВР считать не хочется, всетаки скорее всего KMnO2) и О2.
Понятно что окислять нечего, лучше возьми «серебрянки» и пермангонат калия, смешай и зажги, вот это бенгальский огонь будет красивый, с маргонцовкой многое красиво горит, сера например (все проверено и даже больше) .
Кстати у селитры (мона взять в деревне у бабушки, она им огород удобряет, для растений богат азотом, для роста) реакция проходит аналогично как и у марганцовки, поетому и является одном из ингридиентов черного пороха (селитра, сера, уголь (можно растолочь недогоревшие угольки и наверное подойдет активированный) пропорции не помню) без серы тоже работает но чуть менее эффектно
Странно, что в учебнике так (как в вопросе) написано, в моем учебнике по химии (8 лет назад в школе такого не писали и опыта такого не проводили)
Здесь кусок переписал.. .смотри что получилось.. .
Термодинамический расчет термо-каталитического разложения гидразина и водных растворов перекиси водорода:
http://www.engineer.bmstu.ru/res/dorofeev/lec/gl_23/l23.htm
Химические реакции и понятие о равновесном составе гетерогенной смеси. Основы термодинамического расчета:
http://www.engineer.bmstu.ru/res/dorofeev/lec/gl_16/l16.htm
… и многое другое по основной ссылке:
http://www.engineer.bmstu.ru/res/dorofeev/MAIN.HTM
Целая книга. (Основы теории тепловых ракетных двигателей)
Думаю будет очень интересна.
Про пермангонат калия в ней ничего не нашел, про перекись водорода есть.
А вот еще ресурс:
http://www.polarcom.ru/%7Evvtsv/s_doc14.htm
Мдааа. . Пришлось мне над этим вопросо посидеть.. .
Нет ничего невозможного (особенно группе людей с общим интересом) , только станки нужны и руки, и голова, а кусок стали и дюроалюминия и другие более дефицитные материалы и вещества.
Что за тип реакции? (обмен соединение, разложение, замещение или др.) ОВР или не ОВР, с выделением энергии или без?
1 разложение
2 замещение думаю
3 разложение а потом соединение
Разложение перманганата калия при нагревании Классификация реакций. Разгорание тлеющей лучины свидетельствует от том, что происходит выделение кислорода 2KMnO4 ?t K2MnO4 MnO2 O2? Оглавление.
1-разложение, кажется с выделением энергии
2-обмен
3-соединение
www.mozh-centr.ru
Составление уравнений окислительно-восстановительных реакций
Разделы: Химия, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (1,2 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока: продолжить формирование понятий «степень окисления», «окислитель», «восстановитель», «окислительно-восстановительные реакции», «метод электронного баланса»; познакомить учащихся с заданиями ЕГЭ, рассматривающих данные вопросы; познакомить учащихся с особенностями протекания окислительно-восстановительных реакций в различных средах.
Образовательные задачи:
- повторить основные понятия об окислении и восстановлении, степени окисления, окислителях и восстановителях, рассмотреть сущность окислительно-восстановительных реакций;
- выработать умения по составлению уравнений химических реакций, протекающих в различных средах методом электронного баланса.
Развивающие задачи:
- способствовать формированию и развитию познавательного интереса учащихся к предмету;
- способствовать развитию речи учащихся;
- формирование умения анализировать, сопоставлять, и обобщать знания по теме;
- способствовать овладению учащимися всеми видами памяти.
Воспитательные задачи:
- воспитание осознанной потребности в знаниях;
- совершенствовать умение выслушивать мнение каждого члена коллектива, делать самостоятельные выводы;
- развитие любознательности.
Тип урока: комбинированный (словесно-наглядно-практический).
Место данного урока в теме: шестой урок в теме «Окислительно-восстановительные реакции» в разделе «Химия в задачах» при изучении элективного курса «Химия-11кл».
Методическое оснащение урока:
1. Материально-техническая база:
- кабинет химии, персональный компьютер, мультимедийный проектор.
2. Дидактическое обеспечение:
- рабочая тетрадь учащихся;
- презентация в PowerPoint ;
- материалы для контроля знаний учащихся.
План урока:
- Актуализация знаний;
- Объяснение новой темы;
- Закрепление изученного материала;
- Запись домашнего задания.
Ход урока
1. Актуализация знаний.
1.1 Беседа по материалам прошлых уроков.
Вопросы к беседе:
- Какие реакции называются окислительно- восстановительными?
- Что такое окисление?
- Какой процесс называется восстановлением?
- Как называются вещества, отдающие электроны?
- Как называются вещества, принимающие электроны?
- Что такое «степень окисления»?
- Что происходит со степенью окисления элемента в процессе его восстановления?
- Что происходит со степенью окисления элемента в процессе его окисления?
- Как классифицируются ОВР?
- Назовите сильные окислители и восстановители
- Какие элементы в ПС имеют постоянные степени окисления и какие конкретно?
Учитель: окислительно-восстановительные реакции и вся теория, которую мы с вами повторили и обобщили, имеют место в заданиях ЕГЭ( А27, В2, С1). Давайте решим задания ЕГЭ, и вы убедитесь, что теоретическая основа, которую мы с вами закладываем на наших уроках сейчас, помогут вам в будущем ответить на вопросы изучаемой темы при сдаче ЕГЭ.
Итак, внимание на экран: работа с заданиями слайдов 3-4
Используются задания из вариантов ЕГЭ, разработанных сотрудниками ФИПИ.
Самостоятельная работа : каждый ученик выполняет отдельно на листке и сами проверяют (слайд 5)
Ответьте, пожалуйста, на следующий вопрос: какой элемент по окислительным свойствам стоит на втором месте после фтора? (кислород, и далее, галогены. Причем, окислительные свойства галогенов уменьшаются от хлора к иоду).
Важно так же знать, что помимо кислорода сильными окислительными свойствами обладают соединения, в которых есть кислород. Мы с вами сегодня знакомимся с сильнейшим окислителем - перманганатом калия, формула которого: KMnO4
Объяснение нового материала.
Перманганат калия является сильным окислителем за счет иона MnO42-, в котором марганец находится в высшей степени окисления +7. Именно поэтому марганец может только восстанавливаться в результате ОВР. И восстанавливаться до конкретных продуктов. (слайд 10)
Наша с вами задача сегодня научиться предугадывать продукты ОВР, в которых принимает участие KMnO4.
Рассмотрим сначала восстановление перманганата калия в кислой среде.
(слайд 11)
KMnO4 + KI + H2SO4 ->
Существует алгоритм по составлению таких реакций. Давайте им воспользуемся:
Сначала проставляют степени окисления элементов. Затем рассуждают, какие элементы и как будут изменять степень окисления. Воспользуемся схемой. Так как реакция протекает в кислой среде, ион MnO42- будет переходить в ион Mn2+, понижая степень окисления. Значит, нужно найти элемент, который способен повысить степень окисления. Таким ионом является ион I—. Составляем электронный баланс. И далее записываем продукты данной реакции и расставляем коэффициенты. Напоминаю вам о том, что стехиометрические коэффициенты, которые вы получили в электронном балансе, должны иметь место в реакции!
Далее рассмотрим восстановление перманганата калия в нейтральной и щелочной средах (по этапам, используя алгоритм). (слайды 12, 13)
KMnO4 + K2SO3 + H2O ->
KMnO4 + K2SO3 + KOH ->
Дихромат калия является сильным окислителем за счет иона Cr2O72-, в котором хром находится в высшей степени окисления +6. Именно поэтому хром может только восстанавливаться в результате ОВР. И восстанавливаться до конкретных продуктов. (слайд 14)
Рассмотрим восстановление дихромата калия в кислой среде (слайд 15)
K2Cr2O7 + FeSO4 +H2SO4 ->
Восстановление хромата калия в нейтральной среде (слайд 17)
K2CrO4 +H2S + H2O ->
Кислородные кислоты галогенов и их соли восстанавливаются до галогеноводородов или галогенидов металлов (слайд 18 )
KCIO3 + KOH + MnO2 -> K2M nO4 + KCI +H2O
Галогенид — ионы (CI— , Br —, I— ) всегда являются только восстановителями и окисляются до галогенов (слайд 19)
HBr + H2SO4 ->Br2 +SO2 +H2O
H2O2 ( перекись водорода ) является сильным окислителем (слайд 20)
PbS +H2O2 -> PbSO4 + H2O
H2O2 ( перекись водорода ) является восстановителем (слайд 21 )
KMnO4 + H2O2 + H2SO4 -> MnSO4 + K2SO4 + O2 + H2O
Рассмотрим пример окисление органических веществ (слайд 22)
(C8) H10 + KMnO4 + H2SO4 -> (C7) H6O2 + CO2 + MnSO4 + K2SO4 + H2O
Решаем самостоятельно предложенное уравнение реакции. (слайд 23)
C2H5OH + K2Cr2O7 + H2SO4 ->
Учащиеся на доске и в тетрадях пишут уравнение реакции и самостоятельно расставляют коэффициенты методом электронного баланса.
А теперь, ребята, когда теоретический материал позади, давайте включим в работу визуальную память. Для этого я вам предлагаю посмотреть реакции восстановления перманганата калия в различных средах.
Учитель демонстрирует реакции взаимодействия растворов KMnO4 и K2SO3 в нейтральной, кислой и щелочной средах.
Итоги и выводы.
Мы познакомились с особенностями протекания окислительно-восстановительных реакций в различных средах.
Вспомнили, как расставлять коэффициенты методом электронного баланса.
Научились записывать продукты окислительно-восстановительных реакций с участием перманганата калия, дихромата калия, кислородными кислотами галогенов, галогенид ионами, перекисью водорода, окисление органических веществ
Задание на дом.
Допишите уравнение реакции и расставьте коэффициенты с помощью метода электронного баланса:
Cr2O3+KNO3+KOH ->
xn--i1abbnckbmcl9fb.xn--p1ai
Лекция № 14. Окислительно-восстановительные реакции
Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления элементов (С.О.).
Степень окисления — это формальный заряд, рассчитанный в предположении, что электроны, участвующие в образовании химических связей, полностью смещены к партнеру с большей электроотрицательностью, т.е. все химические связи рассматриваются как ионные.
Формально окислительно-восстановительную реакцию можно рассматривать как реакцию, идущую с переносом электронов от одних атомов к другим. Элемент, атомы которого отдают электроны, увеличивая свою степень окисления, называется восстановителем, а процесс увеличения степени окисления называется окислением. Элемент, атомы которого присоединяют электроны, понижая степень окисления, называется окислителем. Процесс понижения степени окисления называется восстановлением.
Например, взаимодействие олова с хлором идет с образованием хлорида олова(IV) — SnCl4, содержащего ковалентные полярные связи Sn®Cl, в которых электронная плотность смещена от атома олова к более электроотрицательному атому хлора. Поэтому степень окисления хлора в данном соединении равна -1, а С.О. олова равна +4.
Sn0 + 2Cl02 = Sn+4Cl-14
Формально можно считать, что атом олова отдает четыре электрона, являясь восстановителем:
Sn0 — 4е— ® Sn+4 (окисление)
Атом хлора присоединяет один электрон и выступает в роли окислителя:
Cl0 + 1е— ® Cl-1 (восстановление)
Различают четыре типа окислительно-восстановительных реакций (ОВР):
1. Межмолекулярные ОВР, к которым относится рассмотренная выше реакция окисления олова хлором.
2. Внутримолекулярные ОВР, к которым относятся реакции разложения, например, разложение оксида ртути.
2Hg+2O-2 = 2Hg + O2
3. Реакции диспропорционирования, в которых в качестве окислителя и восстановителя выступают атомы одного и того же элемента в одной и той же степени окисления.
Cl02 + 2KOH = KCl-1 + KCl+1O + H2O
4. Реакции контрдиспропорционирования, обратные реакциям диспропорционирования.
5KI-1 + KI+5O3 + 3H2SO4 = 3I02 + 3K2SO4 + 3H2O
Существуют два метода подбора коэффициентов в уравнениях ОВР: метод электронного баланса и метод электронно-ионного баланса (метод полуреакций).
В основе метода электронного баланса лежит принцип равенства числа электронов, отданных восстановителем, и числа электронов, присоединенных окислителем. Подбор коэффициентов по данному методу целесообразно вести по следующему алгоритму:
1. Определить элементы, изменившие степени окисления.
2. Составить схемы процесса окисления и восстановления и привести их в соответствие с принципом электронного баланса.
3. Определить опорные коэффициенты и выставить их в уравнение реакции. При этом у веществ, выполняющих двойную функцию опорные коэффициенты не ставят.
4. Уравнять число атомов элементов, не изменивших степень окисления (кроме водорода и кислорода), в следующем порядке: в кислой и нейтральной среде уравниваются атомы металлов, затем кислотные остатки; в щелочной среде — наоборот.
5. Уравнять атомы водорода.
6. Проверить правильность подбора коэффициентов по числу атомов кислорода.
Рассмотрим действие алгоритма на конкретных примерах.
Пример № 1.
KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O
Расставим С.О. элементов:
KMn+7O4 + NaN+3O2 + H2SO4 ® Mn+2SO4 + NaN+5O3 + K2SO4 + H2O
При этом атом марганца является окислителем, понижая степень окисления от +2 до + 7 (процесс восстановления)
Mn+7 + 5е— ® Mn+2,
а атом азота повышает степень окисления от +3 до +5 (процесс окисления)
N+3 — 2е— ® N+5
Чтобы уравнять числа электронов, участвующих в процессах окисления и восстановления (привести схемы окисления и восстановления в соответствие с принципом электронного баланса), определим наименьшее общее кратное (10) и разделим его на число электронов каждого процесса:
Mn+7 + 5е— ® Mn+2 ½ 2
N+3 — 2е— ® N+5 ½ 5
Полученные числа позволяют определить опорные коэффициенты, от которых будут зависеть остальные коэффициенты в уравнении реакции.
2KMnO4 + 5NaNO2 + H2SO4 ® 2MnSO4 + 5NaNO3 + K2SO4 + H2O
Далее, в соответствии с алгоритмом (кислая среда), уравняем число атомов металлов, не изменивших степени окисления (натрий и калий):
2KMnO4 + 5NaNO2 + H2SO4 ® 2MnSO4 + 5NaNO3 + K2SO4 + H2O,
а затем число кислотных остатков (сульфат-анионы):
2KMnO4 + 5NaNO2 + 3H2SO4 ® 2MnSO4 + 5NaNO3 + K2SO4 + H2O
Затем уравняем число атомов водорода и проверим правильность подбора коэффициентов по кислороду:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
21 О 21 О
Пример № 2.
CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O
Определим элементы, изменившие степень окисления, составим схемы процессов окисления и восстановления и приведем их в соответствие с принципом электронного баланса.
Cr+3Cl3 + Br02 + KOH ® K2Cr+6O4 + KBr-1 + KCl + H2O
Cr+3 — 3е— ® Cr+6 ½ 2
Br02 + 2е— ® 2Br-1 ½ 3
Выставим опорные коэффициенты в уравнение реакции, обращая внимание на то, что они не всегда совпадают с числами, полученными по принципу электронного баланса, так как последние показывают число атомов, а не молекул или формульных единиц.
2Cr+3Cl3 + 3Br02 + KOH ® 2K2Cr+6O4 + 6KBr-1 + KCl + H2O
Реакция идет в щелочной среде, поэтому далее уравниваются кислотные остатки (хлорид-анионы):
2Cr+3Cl3 + 3Br02 + KOH ® 2K2Cr+6O4 + 6KBr-1 + 6KCl + H2O,
а затем числа атомов металлов, не изменивших степени окисления, в данном случае калия:
2Cr+3Cl3 + 3Br02 + 16KOH ® 2K2Cr+6O4 + 6KBr-1 + 6KCl + H2O
И наконец, уравниваем число атомов водорода, проверяем правильность подбора коэффициентов по кислороду:
2Cr+3Cl3 + 3Br02 + 16KOH = 2K2Cr+6O4 + 6KBr-1 + 6KCl + 8H2O
16 О 16 О
Пример № 3.
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO
Особенностью данной реакции является то, что изменяют степени окисления три элемента, причем два из них (восстановители) входят в состав одного вещества — сульфида мышьяка(III).
As+32S-23 + HN+5O3 + H2O ® H3As+5O4 + H2S+6O4 + N+2O
В этом случае схема процесса окисления составляется целиком на молекулу восстановителя:
As+32S-23 — 28е— ® 2As+5 + 3S+6
Окислителем в данной реакции является атом азота азотной кислоты, присоединяющий два электрона и снижающий степень окисления от +5 до +3.
N+5 + 3е— ® N+2
Приведем схемы в соответствие с принципом электронного баланса и выставим опорные коэффициенты в уравнении реакции:
As+32S-23 — 28е— ® 2As+5 + 3S+5 ½ 3
N+5 + 3е— ® N+2½ 28
3As2S3 + 28HNO3 + 4H2O ® 6H3AsO4 + 9H2SO4 + 28NO
В данной реакции нет кислотных остатков, элементы которых не изменяют степень окисления, также нет атомов металлов, поэтому далее уравняем число атомов водорода и проверим правильность подбора коэффициентов по кислороду:
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO
Пример № 4.
Cl20 + KOH ® KCl-1 + KCl+5O3 + H2O
Эта реакция относится к реакциям диспропорционирования, особенностью которых, как уже отмечалось, является то, что степень окисления изменяет атом одного элемента. При этом часть атомов выступает в роли окислителя, а часть — в роли восстановителя.
Cl0 + 1e— ® Cl-1 ½ 5
Cl0 — 5e— ® Cl+5 ½ 1
При выставлении опорных коэффициентов в правой части уравнения необходимо ориентироваться по степеням окисления элемента. В качестве опорного коэффициента в левой части уравнения используется сумма опорных коэффициентов правой части.
3Cl2 + KOH ® 5KCl + KClO3 + H2O
Далее по алгоритму:
3Cl2 + 6KOH ® 5KCl + KClO3 + H2O
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Пример № 5.
CH3COH + KMnO4 + H2SO4 ® CH3COOH + MnSO4 + K2SO4 + H2O
Особенностью органических соединений является то, что для них степени окисления элементов не определяют. При составлении схем электронного баланса в данном случае руководствуются следующими правилами:
· присоединение атома кислорода тождественно потере молекулой двух электронов;
· отщепление атома кислорода тождественно присоединению двух электронов;
· присоединение атома водорода тождественно присоединению одного электрона;
· отщепление атома водорода тождественно потере одного электрона.
CH3COH + [O] — 2e— ® CH3COOH ½ 5
Мn+7 + 5e— ® Mn2+ ½ 2
Далее по алгоритму:
5CH3COH + 2KMnO4 + H2SO4 ® 5CH3COOH + 2MnSO4 + K2SO4 + H2O
5CH3COH + 2KMnO4 + 3H2SO4 ® 5CH3COOH + 2MnSO4 + K2SO4 + H2O
5CH3COH + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + K2SO4 + H2O
Недостатком метода электронного баланса является использование в уравнениях несуществующих реально частиц (Mn+7, N+5 и т.д.). Этого недостатка лишен метод электронно-ионного баланса, в котором в схемах процессов окисления и восстановления допускается использование только реальных частиц. Этот метод более адекватно отражает процессы, протекающие в растворах.
Пример № 6.
KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O
Схема процесса восстановления перманганат-аниона (см. пример № 1) теперь будет выглядеть следующим образом:
MnO4— + 8H+ + 5е— ® Mn2+ + 4H2O
Окисление нитрит-аниона описывается следующим уравнением:
NO2— + H2O — 2е— ® NO3— + 2H+
В соответствии с принципом электронного баланса первое уравнение необходимо умножить на 2, а второе — на 5.
MnO4— + 8H+ + 5е— ® Mn2+ + 4H2O ½ 2
NO2— + H2O — 2е— ® NO3— + 2H+ ½ 5
Суммирование уравнений и сокращение общих частиц, находящихся в левой и правой частях, дает сокращенное ионное уравнение окислительно-восстановительной реакции:
2MnO4— + 16H+ + 5NO2— + 5H2O ® 2Mn2+ + 8H2O + 5NO3— + 10H+;
2MnO4— + 5NO2— + 6H+ = 2Mn2+ + 5NO3— + 3H2O
Литература: [1] c. 255 — 263; [2] с. 317 — 326; [3] с. 206 — 210
Лекция № 15. Электродные потенциалы. Химические источники тока. Электролиз
Электродным потенциалом называется разность потенциалов, возникающая на поверхности металлической пластинки, погруженной в раствор соли данного металла. В зависимости от активности металла возможны два механизма возникновения скачка потенциала на поверхности металлического электрода.
Для активных металлов наблюдается обратимый переход катионов в раствор, обуславливающий возникновение отрицательного заряда на поверхности пластинки, притягивающей катионы из раствора с образованием двойного электрического слоя, переход через который сопровождается скачком потенциала (Dj).
Для малоактивных металлов причиной возникновения скачка потенциала является адсорбция катионов металла из раствора на поверхности металлической пластинки с образованием двойного электрического слоя за счет притяжения из раствора анионов соли.
Измерить абсолютное значение скачка потенциала на поверхности металлической пластинки экспериментально невозможно, поэтому определяют или рассчитывают величину электродного потенциала относительно стандартного водородного электрода, потенциал которого принят за ноль. Водородный электрод представляет собой платиновую пластину, покрытую мелким платиновым порошком (платиновой чернью), погруженную в раствор серной кислоты с активностью катионов водорода 1 моль/л при температуре 298К (25 °С). На пластину подается газообразный водород под давлением 101,325 кПа. Адсорбирующийся на поверхности платины водород способен передавать электроны катионам водорода, вследствие чего на поверхности электрода устанавливается равновесие аналогичное равновесным процессам, возникающим на поверхности металлических электродов:
2H+ + 2e— H2
Схема строения водородного электрода
Электродный потенциал, определенный в стандартных условиях (p = 101,325 кПа, Т = 298К, а(Н+) = 1 моль/л), называется стандартным (E°). Стандартные электродные потенциалы можно найти в соответствующих справочных таблицах. Рассчитать величину электродного потенциала в условиях, отличающихся от стандартных, позволяет уравнение Нернста:
,
где F — постоянная Фарадея (96500 А×с), R — универсальная газовая постоянная, n — число электронов, участвующих в процессе, [Mn+] — равновесная концентрация катионов металла.
При 25 °С уравнение примет следующий вид:
По аналогии с электродным потенциалом определяется окислительно-восстановительный потенциал — разность потенциалов, возникающая на поверхности гладкой платиновой пластины, погруженной в раствор, содержащий окисленную и восстановленную форму вещества. Расчет окислительно-восстановительного потенциала также выполняется на основании уравнения Нернста:
,
где E0 — стандартный окислительно-восстановительный потенциал, [Ox], [Red] — равновесные концентрации окисленной и восстановленной форм. Например, для пары MnO4—/Mn2+, связанной уравнением
MnO4— + 8H+ + 5e— ® Mn2+ + 4H2O
Зная величины окислительно-восстановительных потенциалов, можно определить направление протекания окислительно-восстановительной реакции. Для этого пользуются следующим правилом: окислителем является та пара, у которой потенциал больше.
Определим, например, направление следующей реакции:
?
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2(SO4)3 + H2O
Для этого выделим две пары частиц, находящихся в окисленной и восстановленной форме, и найдем в справочнике их стандартные окислительно-восстановительные потенциалы:
MnO4— + 8H+ + 5e— ® Mn2+ + 4H2O, E0 = 1,51В
Fe3+ + e— ® Fe2+, E0 = 0,77 В
Поскольку у первой пары потенциал больше, она и будет выступать в качестве окислителя, т.е. реакция будет протекать в следующем направлении:
KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + H2O
Химические источники тока. Как уже отмечалось, окислительно-восстановительная реакция, сопровождается переносом электронов от восстановителя к окислителю. Если разделить процессы окисления и восстановления в пространстве, можно получить направленный поток электронов, т.е. электрический ток. Устройства, в которых энергия окислительно-восстановительной реакции преобразуется в энергию электрического тока, называются химическими источниками тока или гальваническими элементами. Рассмотрим принцип действия гальванического элемента на примере элемента Даниэля-Якоби, который представляет собой замкнутые в одну цепь цинковый и медный электроды.
Электрод, изготовленный из более активного металла (металл, имеющий более низкий потенциал), всегда будет анодом. В данном случае на цинковом аноде идет процесс окисления цинка:
Zn ® Zn2+ + 2e—
На медном катоде идет восстановление катионов меди:
Cu2+ + 2e— ® Cu0
Электроны, перемещаясь по внешней цепи, совершают полезную работу. Чтобы цепь была замкнута, растворы соединены солевым мостиком (обычно раствор агар-агара, содержащий сульфат калия). Рассчитать ЭДС, которую развивает элемент, можно по величине электродных потенциалов:
ЭДС = Екатода — Еанода
В стандартных условий E0(Cu2+/Cu) = 0,34 В; E0(Zn2+/Zn) = -0,76 В, поэтому:
ЭДС = 0,34 В — (-0,76 В) = 1,10 В
Таким образом, в гальваническом элементе энергия самопроизвольно протекающей окислительно-восстановительной реакции преобразуется в энергию электрического тока.
Электролиз. При пропускании электрического тока через раствор или расплав электролита можно провести окислительно-восстановительные реакции, не идущие самопроизвольно. Данный процесс называется электролизом. Процессы, протекающие на электродах при электролизе, зависят как от природы электролита, так и от среды, в которой он находится. При электролизе расплава на катоде идет процесс восстановления катиона электролита, а на аноде — окисление его аниона. Например, электролиз расплава хлорида натрия описывается следующими уравнениями:
Катодный процесс: Na+ + e— ® Na
Анодный процесс: 2Cl— — 2e— ® Cl2
Суммарно 2NaCl = 2Na + Cl2
При электролизе водных растворов в электродных процессах могут принимать участие молекулы воды.
Катодный процесс: 2H2O + 2e— ® H2 + 2OH— или 2H+ + 2e— ® H2
Анодный процесс: 2H2O — 4e— ® O2 + 4H+ или 4OH— — 4e— ® O2 + 2H2O
Фактически при электролизе водных растворов наблюдается конкуренция между электродными процессами. Выбор между ними можно сделать на основании следующих правил:
1. Если металл стоит в ряду стандартных электродных потенциалов правее водорода, на катоде восстанавливается металл.
2. Если металл стоит в ряду стандартных электродных потенциалов левее алюминия (включительно), на катоде восстанавливается водород.
3. Если металл в ряду стандартных электродных потенциалов стоит между алюминием и водородом, на катоде идет параллельно восстановление металла и водорода.
4. Если электролит содержит анионы кислородсодержащих кислот или фторид-анион, на аноде окисляется вода. Во всех остальных случаях на аноде окисляется анион электролита.
Применение данных правил рассмотрим на конкретных примерах.
Пример №1. Электролиз водного раствора хлорида натрия.
NaCl = Na+ + Cl—
Катодный процесс: 2H+ + 2e— ® H2
Анодный процесс: 2Cl— — 2e— ® Cl2
Суммарно 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Пример №2. Электролиз водного раствора нитрата натрия.
NaNO3 = Na+ + NO3—
Катодный процесс: 2H2O + 2e— ® H2 + 2OH—
Анодный процесс: 2H2O — 4e— ® O2 + 4H+
Суммарно 2H2O = O2 + 2H2
Пример №3. Электролиз водного раствора сульфата меди.
CuSO4 = Cu2+ + SO42-
Катодный процесс: Cu2+ + 2e— ® Cu
Анодный процесс: 2H2O — 4e— ® O2 + 4H+
Суммарно 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2
В рассмотренных примерах считалось, что электроды изготовлены из инертного материла и участия в процессе электролиза не принимают. В том случае, когда материал электродов, точнее анода, не инертен, он может подвергаться окислению.
Пример №4. Электролиз водного раствора сульфата меди с медным анодом.
Катодный процесс: Cu2+ + 2e— ® Cu
Анодный процесс: Cu — 2e— ® Cu2+
Суммарный процесс сводится к переносу материала анода (медь) на катод.
Количественно электролиз описывается законами Фарадея:
· Масса вещества, образующегося при электролизе, прямо пропорциональна количеству электричества (заряду), прошедшему через раствор.
· Равные количества электричества приводят к превращению эквивалентных количеств разных веществ.
,
где Э — молярная масса эквивалента (эквивалентная масса), I — сила тока, t — время. Заряд, необходимый для электрохимического превращения одного моля эквивалента, равен 96500 Кл (А×с) и называется постоянной Фарадея (F).
Литература: [1] с. 263 — 293; [2] с. 326 — 360; [3] с. 214 — 216
Похожие статьи:
poznayka.org
