Смещение химического равновесия. Принцип Ле-Шателье
Состояние равновесия для обратимой реакции может длиться неограниченно долгое время (без вмешательства извне). Но если на такую систему оказать внешнее воздействие (изменить температуру, давление или концентрацию конечных либо исходных веществ), то состояние равновесия нарушится. Скорость одной из реакций станет больше по сравнению со скоростью другой. С течением времени система вновь займет равновесное состояние, но новые равновесные концентрации исходных и конечных веществ будут отличаться от первоначальных. В этом случае говорят о смещении химического равновесия в ту или иную сторону.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то это значит, что химическое равновесие сместилось вправо. Если же, наоборот, становится больше скорость обратной реакции, это значит, что химическое равновесие сместилось влево.
При смещении равновесия вправо происходит уменьшение равновесных концентрацийисходных веществ и увеличениеравновесных концентраций конечных веществ по сравнению с первоначальными равновесными концентрациями. Соответственно, при этом возрастает и выход продуктов реакции.
Смещение химического равновесия влево вызывает возрастание равновесных концентраций исходных веществ и уменьшение равновесных концентраций конечных продуктов, выход которых при этом уменьшится.
Направление смещения химического равновесия определяется с помощью принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие»
.Например, при увеличении концентрации исходных веществ возрастает скорость прямой реакции и равновесие смещается вправо. При уменьшении концентрации исходных веществ, наоборот, возрастает скорость обратной реакции, а химическое равновесие смещается влево.
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, инаоборот).
Следует подчеркнуть, что увеличение температуры, как правило, увеличивает скорость и прямой, и обратной реакции, но при этом скорость эндотермической реакции возрастает в большей степени, чем скорость экзотермической реакции. Соответственно, при охлаждениисистемы скорости прямой и обратной реакций уменьшаются, но тоже не в одинаковой степени: для экзотермической реакции существенно меньше, чем для эндотермической.
Изменение давления влияет на смещение химического равновесия только при выполнении двух условий:
необходимо, чтобы хоть одно из веществ, участвующих в реакции, находилось в газообразном состоянии, например:
t
СаСО3(т) СаО(т)+ СО2(г)— изменение давления влияет насмещение равновесия.
СН3СООН(ж.) + С2Н5ОН(ж.)СН3СООС2Н5(ж.)+ Н2О(ж.)– изменениедавления не влияет на смещение химического равновесия, т.к. ни одно из исходных или конечных веществ не находится в газообразном состоянии;
если в газообразном состоянии находятся несколько веществ, необходимо, чтобы число молекул газа в левой части уравнения такой реакции не было равно числу молекулгаза в правой части уравнения, например:
t,каt
2SO2(г)+O2(г)2SO3(г)– изменение давления влияет на смещение равновесия
I2(г)+ Н2(г)2НI(г)– изменение давления не влияет на смещение равновесия
При выполнении этих двух условий увеличение давления приводит к смещению равновесия в сторону реакции, протекание которой уменьшает число молекул газа в системе. В нашем примере (каталитическое горение SO2) это будет прямая реакция.
Уменьшение давления, наоборот, смещает равновесие в сторону реакции, идущей с образованием большего числа молекул газа. В нашем примере это будет обратная реакция.
Увеличение давления вызывает уменьшение объема системы, а значит, и увеличение молярных концентраций газообразных веществ. В результате скорость прямой и обратной реакций увеличивается, но не в одинаковой степени. Понижение же давления по аналогичной схеме приводит к уменьшению скоростей прямой и обратной реакций. Но при этом скорость реакции, в сторону которой смещается равновесие, уменьшается в меньшей степени.
Катализатор не влияет на смещение равновесия, т.к. он в одинаковой степени ускоряет (или замедляет) как прямую, так и обратную реакцию. В его присутствии химическое равновесие только быстрее (или медленнее) устанавливается.
Если на систему оказывают воздействие сразу несколько факторов одновременно, то каждый из них действует независимо от других. Например, при синтезе аммиака
t,kat
N2(газ)+ 3H2(газ)2NH3(газ)
реакцию осуществляют при нагревании и в присутствии катализатора для увеличения ее скорости.Но при этом воздействие температуры приводит к тому, что равновесие реакции смещается влево, в сторону обратной эндотермической реакции. Это вызываетуменьшение выхода NH 3. Чтобы компенсировать данноенежелательное действие температуры и увеличитьвыход аммиака, одновременно в системе повышают давление,которое смещает равновесие реакции вправо, т.е. в сторону образования меньшего числа молекул газа.
При этом опытным путем подбирают наиболее оптимальные условия осуществленияреакции (температуру, давление), при которых она протекала бы с достаточно большой скоростью и давала экономическирентабельный выход конечного продукта.
Принцип Ле-Шателье аналогичным образом используется в химической промышленности при производстве большого числа различных веществ, имеющих огромное значение для народного хозяйства.
Принцип Ле-Шательеприменим не только к обратимым химическим реакциям, но и к различным другим равновесным процессам: физическим, физико-химическим, биологическим.
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе различных биохимических показателей, включающих в себя концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесным, т.к. оно не приложимо к открытым системам.
Организм человека, как любая живая система, постоянно обменивается с окружающей средой различными веществами: потребляет продукты питания и выделяет продукты их окисления и распада. Следовательно, для организма характерно стационарное состояние, определяемое как постоянство его параметров при постоянной скорости обмена с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд равновесных состояний, связанных между собой процессами релаксации. В состоянии равновесия концентрации веществ, участвующих в реакции, поддерживаются за счёт восполнения извне исходных и удаления наружу конечных продуктов. Изменение их содержания в организме не приводит, в отличие от закрытых систем, к новому термодинамическому равновесию. Система возвращается в первоначальное состояние. Таким образом, поддерживается относительное динамическое постоянство состава и свойств внутренней среды организма, обусловливающее устойчивость его физиологических функций. Данное свойство живой системы называется иначе гомеостазом.
В ходе жизнедеятельности организма, находящегося в стационарном состоянии, в отличие от закрытой равновесной системы, происходит увеличение энтропии. Однако, наряду с этим, одновременно протекает и обратный процесс – уменьшение энтропии за счёт потребления из окружающей среды питательных веществ с низким значением энтропии (например, высокомолекулярных соединений – белков, полисахаридов, углеводов и др.) и выделения в среду продуктов распада. Согласно положению И.Р.Пригожина, суммарное производство энтропии для организма, находящегося в стационарном состоянии, стремится к минимуму.
Большой вклад в развитие неравновесной термодинамики внес И. Р. Пригожий, лауреат Нобелевской премии 1977 г., который утверждал, что «в любой неравновесной системе существуют локальные участки, находящиеся в равновесном состоянии. В классической термодинамике равновесие относится ко всей системе, а в неравновесной — только к ее отдельным частям».
Установлено, что энтропия в таких системах возрастает в период эмбриогенеза, при процессах регенерации и росте злокачественных новообразований.
studfiles.net
Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
Состояние химического равновесия существует при строго определенных условиях: концентрации, температуре, давлении. При изменении одного из этих условий равновесие нарушается вследствие неодинакового изменения скоростей прямой и обратной реакций. Переход из одного равновесного состояния в другое называется сдвигом или смещением положения равновесия. Если скорость прямой реакции становится больше скорости обратной реакции, равновесие смещается вправо. Если скорость прямой реакции становится меньше, чем скорость обратной, то равновесие смещается влево. С течением времени в системе устанавливается новое химическое равновесие, которое характеризуется равенством скоростей и новыми равновесными концентрациями
всех веществ в системе.
и новыми равновесными концентрациями
всех веществ в системе.Направление смещения равновесия определяется принципом Ле Шателье:
Применительно к трем основным типам внешнего воздействия – изменению концентрации, давления и температуры – принцип Ле Шателье трактуется следующим образом.
1. При увеличении концентрации одного из реагирующих веществ равновесие смещается в направлении той реакции, по которой это вещество расходуется; при уменьшении концентрации одного из реагирующих веществ равновесие смещается в сторону образования этого вещества.
2. При изменении температуры изменяются как прямая, так и обратная реакции, но в разной степени. Для выяснения влияния температуры на химическое равновесие необходимо знать знак теплового эффекта реакции.При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической.
3. При увеличении давления равновесие смещается в сторону уменьшения числа молей газа, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания числа молей газов, т.е. в сторону увеличения давления. Если реакция протекает без изменения числа молей газообразных веществ, то давление не влияет на положение равновесия в этой системе.
1.2. Экспериментальная часть
1.2.1. Зависимость скорости реакции от концентрации реагирующих веществ
Для наблюдения зависимости скорости
реакции от концентрации реагирующих
веществ используем реакцию взаимодействия
раствора иодата калия
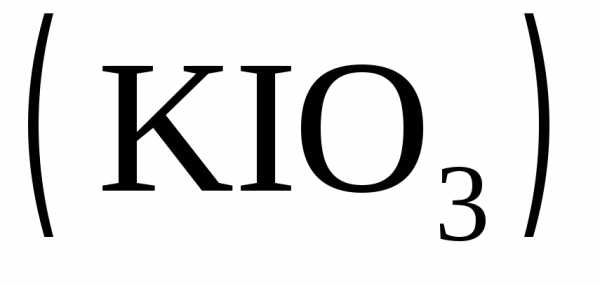 с раствором сульфита натрия
с раствором сульфита натрия в присутствии серной кислоты и крахмала
(индикатора на свободный иод). Процесс
взаимодействия протекает в несколько
стадий. Суммарное уравнение реакции
имеет вид
в присутствии серной кислоты и крахмала
(индикатора на свободный иод). Процесс
взаимодействия протекает в несколько
стадий. Суммарное уравнение реакции
имеет вид
,
или в ионной форме
.
Считая началом реакции момент сливания растворов реагентов, а концом – момент выделения свободного иода (появление синей окраски), можно установить время реакции (τ) по секундомеру и определить относительную скорость реакции как 1/τ. Изменяя концентрацию раствора одного из реагентов, можно установить зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре.
Для выполнения опыта используйте
растворы: раствор А (0,002 н раствор
иодата калия), раствор Б (0,02 н
раствор сульфита натрия, содержащий в
500 мл 0,02 н раствора
 50 мл 2 н раствора серной кислоты и
50 мл
50 мл 2 н раствора серной кислоты и
50 мл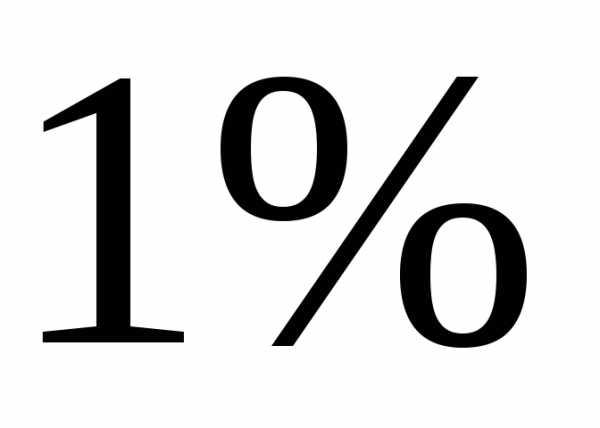 -ного
раствора крахмала).Реакция проводится
при постоянной температуре (комнатной),
постоянной концентрации иодата калия
(раствор А) и переменной концентрации
сульфита натрия (табл. 1.1, раствор Б).
-ного
раствора крахмала).Реакция проводится
при постоянной температуре (комнатной),
постоянной концентрации иодата калия
(раствор А) и переменной концентрации
сульфита натрия (табл. 1.1, раствор Б).
Порядок выполнения опыта. Приготовьте, используя мерный цилиндр и пронумерованные химические стаканы, раствор Б пяти различных концентраций согласно табл. 1..
Возьмите 2 пробирки, в одну из них внесите пипеткой 20 капель раствора А, в другую из стакана №1 – 20 капель раствора Б (первый вариант концентрации). Быстро слейте растворы и одновременно включите секундомер (в процессе опыта пробирку не встряхивайте). В момент появления синего окрашивания выключите секундомер. Данные внесите в табл. 1.. Затем в том же порядке выполните 2, 3, 4 и 5–й варианты опыта. Для каждого варианта рассчитайте относительную скорость процесса (1/τ, с–1) и занесите в табл. 1..
|
Таблица 1. | |||||
|
Номер стакана |
Объём, мл |
Относительная концентрация раствора Б (нормальность) |
Время , с |
Относительная скорость реакции | |
|
Раствор Б |
Дистил. вода | ||||
|
1 |
10 |
0 |
0,02 | ||
|
2 |
10 |
5 |
0,0133 | ||
|
3 |
10 |
10 |
0,01 | ||
|
4 |
10 |
15 |
0,008 | ||
|
5 |
10 |
20 |
0,0066 | ||
При оформлении анализа результатов опыта выполните следующиезадания и ответьте на вопросы.
1. Начертите график зависимости скорости реакции от концентрации реагирующих веществ, откладывая по оси абсцисс относительную концентрацию раствора сульфита натрия, по оси ординат – относительную скорость реакции.
2. Объясните, почему при повышении концентрации сульфита натрия изменяется (увеличивается или уменьшается) скорость исследуемой реакции? С чем это связано?
3. Какой кинетический закон устанавливает зависимость скорости реакции от концентрации реагирующих веществ? Запишите его выражение для исследуемой реакции. Подтверждает ли полученный в опыте результат выполнение этого закона для исследуемой реакции?
4. Сделайте общий вывод о влиянии концентрации на скорость реакции.
studfiles.net
Химическое равновесие. Принцип Ле-Шателье
Химическое равновесие присуще обратимым реакциям и не характерно для необратимых химических реакций.
Часто, при осуществлении химического процесса, исходные реагирующие вещества полностью переходят в продукты реакции. Например:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
Невозможно получить металлическую медь, проводя реакцию в обратном направлении, т.к. данная реакция необратима. В таких процессах реагенты полностью переходят в продукты, т.е. реакция протекает до конца.
Но основная часть химических реакций обратима, т.е. вероятно параллельное протекание реакции в прямом и обратном направлениях. Иначе говоря, реагенты лишь частично переходят в продукты и реакционная система будет состоять как из реагентов, так и из продуктов. Система в данном случае находится в состоянии химического равновесия.
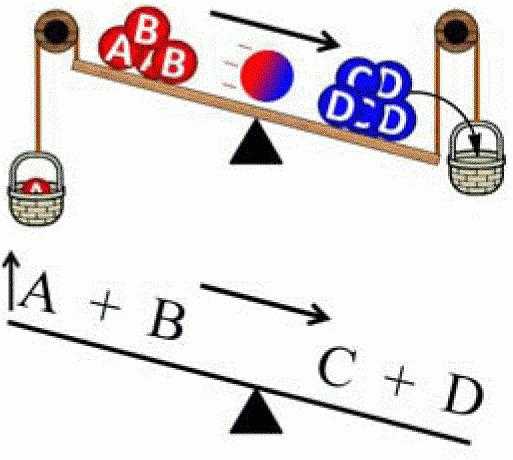
При обратимых процессах, вначале прямая реакция имеет максимальную скорость, которая постепенно снижается, в связи с уменьшением количества реагентов. Обратная реакция, наоборот, вначале имеет минимальную скорость, которая увеличивается по мере накапливания продуктов. В конце концов, наступает момент, когда скорости обоих реакций становятся равными – система приходит в состояние равновесия. При наступлении состояния равновесия, концентрации компонентов остаются неизменными, но химическая реакция при этом не прекращается. Т.о. химическое равновесие – это динамичное (подвижное) состояние. Для наглядности, приведем следующий рисунок:
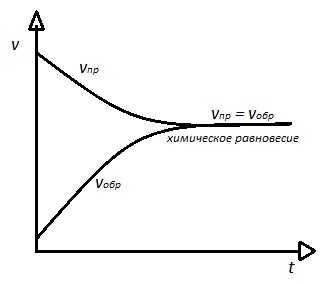 химическое равновесие
химическое равновесиеДопустим, протекает некая обратимая химическая реакция:
а А + b В = с С + d D
тогда, исходя из закона действующих масс, запишем выражения для скорости прямой υ1 и обратной υ2 реакций:
υ1 = k1·[A]a·[B]b
υ2 = k2·[C]c·[D]d
В состоянии химического равновесия, скорости прямой и обратной реакции равны, т.е.:
υ1 = υ2
k1·[A]a·[B]b = k2·[C]c·[D]d
получаем
К = k1/ k2 = [C]c·[D]d ̸ [A]a·[B]b
Где К = k1/ k2 – константа равновесия.
Для любого обратимого процесса, при заданных условиях k является величиной постоянной. Она не зависит от концентраций веществ, т.к. при изменении количества одного из веществ, количества других компонентов также меняются.
При изменении условий протекания химического процесса, возможно смещение равновесия.
Факторы, влияющие на смещение равновесия:
- изменение концентраций реагентов или продуктов,
- изменение давления,
- изменение температуры,
- внесение катализатора в реакционную среду.
Принцип Ле-Шателье
Все вышеперечисленные факторы влияют на смещение химического равновесия, которое подчиняется принципу Ле-Шателье: если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению. Т.е. равновесие стремится к смещению в направлении, приводящему к уменьшению влияния воздействия, которое привело к нарушению состояния равновесия.
Итак, рассмотрим отдельно влияние каждого их факторов на состояние равновесия.
Влияние изменения концентраций реагентов или продуктов покажем на примере процесса Габера:
N2(г) + 3H2(г) = 2NH3(г)
Если в равновесную систему, состоящую из N2(г), H2(г) и NH3(г), добавить, например, азот, то равновесие должно сместиться в направлении, которое способствовало бы уменьшению количества водорода в сторону его исходного значения, т.е. в направлении образования дополнительного количества аммиака (вправо). При этом одновременно произойдет и уменьшение количества водорода. При добавлении в систему водорода, также произойдет смещение равновесия в сторону образования нового количества аммиака (вправо). Тогда как внесение в равновесную систему аммиака, согласно принципу Ле-Шателье, вызовет смещение равновесия в сторону того процесса, который благоприятен для образования исходных веществ (влево), т.е. концентрация аммиака должна уменьшится посредством разложения некоторого его количества на азот и водород.
Уменьшение концентрации одного из компонентов, сместит равновесное состояние системы в сторону образования этого компонента.
Влияние изменения давления имеет смысл, если в исследуемом процессе принимают участие газообразные компоненты и при этом имеет место изменение общего числа молекул. Если общее число молекул в системе остается постоянным, то изменение давления не влияет на ее равновесие, например:
I2(г) + H2(г) = 2HI(г)
Если полное давление равновесной системы увеличивать посредством уменьшения ее объема, то равновесие сместится в сторону уменьшения объема. Т.е. в сторону уменьшения числа молей газа в системе. В реакции:
N2(г) + 3H2(г) = 2NH3(г)
из 4 молеул газа (1 N2(г) и 3 H2(г)) образуется 2 молекулы газа (2 NH3(г)), т.е. давление в системе уменьшается. Вследствие чего, рост давления будет способствовать образованию дополнительного количества аммиака, т.е. равновесие сместится в сторону его образования (вправо).
Если температура системы постоянна, то изменение полного давления системы не приведет к изменению константы равновесия К.
Изменение температуры системы влияет не только на смещение ее равновесия, но также и на константу равновесия К. Если равновесной системе, при постоянном давлении, сообщать дополнительную теплоту, то равновесие сместится в сторону поглощения теплоты. Рассмотрим экзотермическую реакцию:
N2(г) + 3H2(г) = 2NH3(г) + 22 ккал
Итак, как видно, прямая реакция протекает с выделением теплоты, а обратная – с поглощением. При увеличении температуры, равновесие этой реакции смещается в сторону реакции разложения аммиака (влево), т.к. она является эндотермической и ослабляет внешнее воздействие – повышение температуры. Напротив, охлаждение приводит к смещению равновесия в направлении синтеза аммиака (вправо), т.к. реакция является экзотермической и противодействует охлаждению.
Таким образом, рост температуры благоприятствует смещению химического равновесия в сторону эндотермической реакции, а падение температуры – в направлении экзотермического процесса. Константы равновесия всех экзотермических процессов при росте температуры уменьшаются, а эндотермических процессов – увеличиваются.
Внесение катализатора в систему приводит к тому, что скорости как прямой, так и обратной реакций увеличиваются. Изменяется скорость приближения к состоянию равновесия, но k при этом не меняется.
Принцип Ле-Шателье также применим к таким реакциям, в которых компоненты находятся в различных фазовых состояниях, т.е. к гетерогенным реакциям. Тогда речь будет идти о гетерогенном равновесии, например:
CaCO3(тв) → CaO(тв) + CO2(г)
В этой реакции газ и два твердых вещества находятся между собой в равновесии, и «концентрации» твердых компонентов остаются неизменными. Обычно «концентрации» твердых и жидких компонентов включаются в значение К, что позволяет не учитывать их при написании выражения для константы равновесия:
К = [CO2]
Это выражение показывает нам, что не важно, какое количество CaCO3(тв) и CaO(тв) содержится в равновесной системе, пока в ней присутствует хотя бы незначительное количество любого из этих веществ.
zadachi-po-khimii.ru
10)Необратимые и обратимые реакции. Химическое равновесие. Константа равновесия. Принцип Ле-Шателье. Смещение равновесий, примеры.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3h3 + N2 ⇌ 2Nh4.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + h3SO4 → 2HClO2 + BaSO4↓
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
Принцип Ле Шателье — Брауна
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3h3↔2Nh4 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. N2 + 3h3 2Nh4 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования Nh4, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:давление, МПа 0,1 10 20 30 60 100
объемная доля Nh4, % 0,4 26 36 46 66 80
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина — скорость химической реакции.
Скорость реакции — это величина, показывающая как изменяется концентрация одного из веществ в единицу времени.
Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,химические реакции при высоких температурах протекают быстрее, чем при низких температурах
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза.
Зависимость скорости реакции от температуры определяется правилом Вант — Гоффа :
Правило Вант — Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
2.Влияние катализатора. Катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Влияние, оказываемое катализаторами на химические реакции, называется катализом.По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать:
гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь;
гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз).
3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
Из кинетического уравнения уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
studfiles.net
Смещение химического равновесия. Принцип Ле-Шателье
Состояние равновесия для обратимой реакции может длиться неограниченно долгое время (без вмешательства извне). Но если на такую систему оказать внешнее воздействие (изменить температуру, давление или концентрацию конечных либо исходных веществ), то состояние равновесия нарушится. Скорость одной из реакций станет больше по сравнению со скоростью другой. С течением времени система вновь займет равновесное состояние, но новые равновесные концентрации исходных и конечных веществ будут отличаться от первоначальных. В этом случае говорят о смещении химического равновесия в ту или иную сторону.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то это значит, что химическое равновесие сместилось вправо. Если же, наоборот, становится больше скорость обратной реакции, это значит, что химическое равновесие сместилось влево.
При смещении равновесия вправо происходит уменьшение равновесных концентраций исходных веществ и увеличение равновесных концентраций конечных веществ по сравнению с первоначальными равновесными концентрациями. Соответственно, при этом возрастает и выход продуктов реакции.
Смещение химического равновесия влево вызывает возрастание равновесных концентраций исходных веществ и уменьшение равновесных концентраций конечных продуктов, выход которых при этом уменьшится.
Направление смещения химического равновесия определяется с помощью принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
Например, при увеличении концентрации исходных веществ возрастает скорость прямой реакции и равновесие смещается вправо. При уменьшении концентрации исходных веществ, наоборот, возрастает скорость обратной реакции, а химическое равновесие смещается влево.
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, и наоборот).
Следует подчеркнуть, что увеличение температуры, как правило, увеличивает скорость и прямой, и обратной реакции, но при этом скорость эндотермической реакции возрастает в большей степени, чем скорость экзотермической реакции. Соответственно, при охлаждении системы скорости прямой и обратной реакций уменьшаются, но тоже не в одинаковой степени: для экзотермической реакции существенно меньше, чем для эндотермической.
Изменение давления влияет на смещение химического равновесия только при выполнении двух условий:
необходимо, чтобы хоть одно из веществ, участвующих в реакции, находилось в газообразном состоянии, например:
t
СаСО3(т) СаО(т)+ СО2(г)— изменение давления влияет на смещение равновесия.
СН3СООН(ж.) + С2Н5ОН(ж.)СН3СООС2Н5(ж.)+ Н2О(ж.)– изменение давления не влияет на смещение химического равновесия, т.к. ни одно из исходных или конечных веществ не находится в газообразном состоянии;
если в газообразном состоянии находятся несколько веществ, необходимо, чтобы число молекул газа в левой части уравнения такой реакции не было равно числу молекул газа в правой части уравнения, например:
t,каt
2SO2(г)+O2(г)2SO3(г)– изменение давления влияет на смещение равновесия
I2(г)+ Н2(г)2НI(г)– изменение давления не влияет на смещение равновесия
При выполнении этих двух условий увеличение давления приводит к смещению равновесия в сторону реакции, протекание которой уменьшает число молекул газа в системе. В нашем примере (каталитическое горение SO2) это будет прямая реакция.
Уменьшение давления, наоборот, смещает равновесие в сторону реакции, идущей с образованием большего числа молекул газа. В нашем примере это будет обратная реакция.
Увеличение давления вызывает уменьшение объема системы, а значит, и увеличение молярных концентраций газообразных веществ. В результате скорость прямой и обратной реакций увеличивается, но не в одинаковой степени. Понижение же давления по аналогичной схеме приводит к уменьшению скоростей прямой и обратной реакций. Но при этом скорость реакции, в сторону которой смещается равновесие, уменьшается в меньшей степени.
Катализатор не влияет на смещение равновесия, т.к. он в одинаковой степени ускоряет (или замедляет) как прямую, так и обратную реакцию. В его присутствии химическое равновесие только быстрее (или медленнее) устанавливается.
Если на систему оказывают воздействие сразу несколько факторов одновременно, то каждый из них действует независимо от других. Например, при синтезе аммиака
t,kat
N2(газ)+ 3H2(газ)2NH3(газ)
реакцию осуществляют при нагревании и в присутствии катализатора для увеличения ее скорости. Но при этом воздействие температуры приводит к тому, что равновесие реакции смещается влево, в сторону обратной эндотермической реакции. Это вызывает уменьшение выхода NH3. Чтобы компенсировать данное нежелательное действие температуры и увеличить выход аммиака, одновременно в системе повышают давление, которое смещает равновесие реакции вправо, т.е. в сторону образования меньшего числа молекул газа.
При этом опытным путем подбирают наиболее оптимальные условия осуществления реакции (температуру, давление), при которых она протекала бы с достаточно большой скоростью и давала экономически рентабельный выход конечного продукта.
Принцип Ле-Шателье аналогичным образом используется в химической промышленности при производстве большого числа различных веществ, имеющих огромное значение для народного хозяйства.
Принцип Ле-Шателье применим не только к обратимым химическим реакциям, но и к различным другим равновесным процессам: физическим, физико-химическим, биологическим.
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе различных биохимических показателей, включающих в себя концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесным, т.к. оно не приложимо к открытым системам.
Организм человека, как любая живая система, постоянно обменивается с окружающей средой различными веществами: потребляет продукты питания и выделяет продукты их окисления и распада. Следовательно, для организма характерно стационарное состояние, определяемое как постоянство его параметров при постоянной скорости обмена с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд равновесных состояний, связанных между собой процессами релаксации. В состоянии равновесия концентрации веществ, участвующих в реакции, поддерживаются за счёт восполнения извне исходных и удаления наружу конечных продуктов. Изменение их содержания в организме не приводит, в отличие от закрытых систем, к новому термодинамическому равновесию. Система возвращается в первоначальное состояние. Таким образом, поддерживается относительное динамическое постоянство состава и свойств внутренней среды организма, обусловливающее устойчивость его физиологических функций. Данное свойство живой системы называется иначегомеостазом.
В ходе жизнедеятельности организма, находящегося в стационарном состоянии, в отличие от закрытой равновесной системы, происходит увеличение энтропии. Однако, наряду с этим, одновременно протекает и обратный процесс – уменьшение энтропии за счёт потребления из окружающей среды питательных веществ с низким значением энтропии (например, высокомолекулярных соединений – белков, полисахаридов, углеводов и др.) и выделения в среду продуктов распада. Согласно положению И.Р.Пригожина, суммарное производство энтропии для организма, находящегося в стационарном состоянии, стремится к минимуму.
Большой вклад в развитие неравновесной термодинамики внес И. Р. Пригожий, лауреат Нобелевской премии 1977 г., который утверждал, что «в любой неравновесной системе существуют локальные участки, находящиеся в равновесном состоянии. В классической термодинамике равновесие относится ко всей системе, а в неравновесной — только к ее отдельным частям».
Установлено, что энтропия в таких системах возрастает в период эмбриогенеза, при процессах регенерации и росте злокачественных новообразований.
studfiles.net
3.2. Смещение химического равновесия (принцип Ле Шателье)
Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса, так как характеризуется минимальным запасом внутренней энергии системы (G min) (рисунок 5).
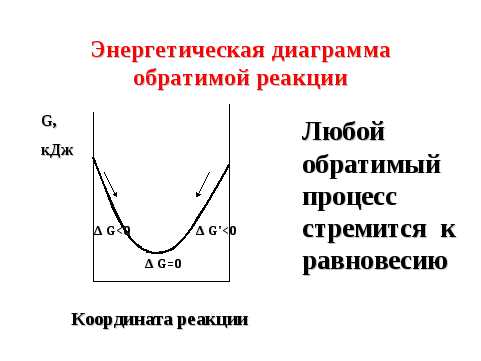
Рисунок 5 — Энергетическая диаграмма обратимой реакции
Таким образом, любой обратимый процесс стремится к равновесию. В 1884 г. французский физико-химик и металлург Ле Шателье сформулировал общий закон смещения химического равновесия.
Принцип Ле Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие».
Этот принцип позволяет предсказать качественные изменения в равновесной системе при изменении условий.
Частные случаи принципа Ле Шателье
1) Повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры — в сторону экзотермической реакции.
Рассмотрим влияние температуры на равновесие обратимой биохимической реакции
Hb + O2HbO2, ΔrН = – 10 кДж.
При повышении температуры равновесие смешается влево (кровь отдает кислород тканям), при понижении температуры равновесие смещается вправо (кровь обогащается кислородом).
2) При повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления — в сторону их большего количества. Изменение давления не влияет на смещение химического равновесия, если: (а) в реакции не участвуют газы; (б) реакция протекает без изменения количества газообразных веществ. Например,
N2 + O22NO.
Используя данный принцип, можно рассмотреть влияние давления на равновесие обратимой реакции окисления гемоглобина в оксигемоглобин.
Венозная кровь поступает в легкие, где испытывает повышенное давлении кислорода О2. В результате равновесие смещается вправо (кровь насыщается кислородом). Артериальная кровь, поступающая в ткани, оказывается при пониженном давлении кислорода, в результате чего равновесие смещается влево (кровь отдает кислород тканям).
3) При увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая протекает с убылью этого вещества (и наоборот).
Например, при увеличении содержания гемоглобина в крови равновесие смещается вправо (ткани обогащаются кислородом). При недостатке гемоглобина (анемия) равновесие смещается влево (больной страдает от кислородной недостаточности).
3.3. Равновесие в биологических средах
Важнейшей биологической средой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия. Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия).
К важнейшим протолитическим равновесиям относится диссоциация воды, протекающая по уравнению:
H2OH+ + OH—
Вода – очень слабый электролит; при комнатной температуре из 5 млн. молекул воды только одна молекула диссоциирует на ионы. Поскольку молярная концентрация молекул воды значительно превышает молярную концентрацию ионов ([H2O] >>[H+]) , то можно считать, что концентрация молекул воды является величиной постоянной ([H2O] = const). Применив закон действующих масс, напишем выражение для концентрационной константы равновесия рассматриваемого процесса:
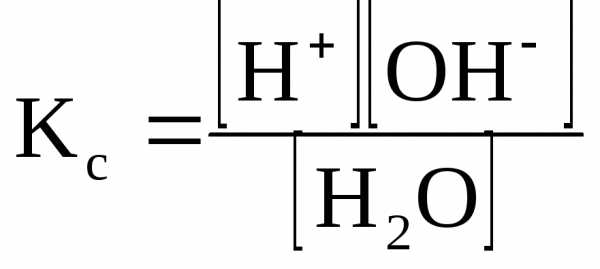
Умножив левую и правую части уравнения на [H2O], получим уравнение
Кс [H2O] = [H+][OH—],
где Kс [H2O] = Kw
Kw — ионное произведение воды; эта величина является константой равновесия, описывающей обратимую диссоциацию воды. При стандартной температуре (t = 25oC) Кw = [H+][OH—] = 10-14.
Для воды и водных растворов:
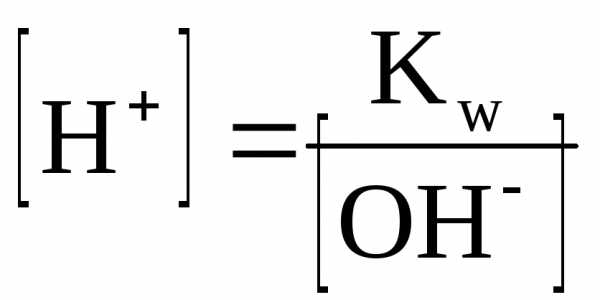
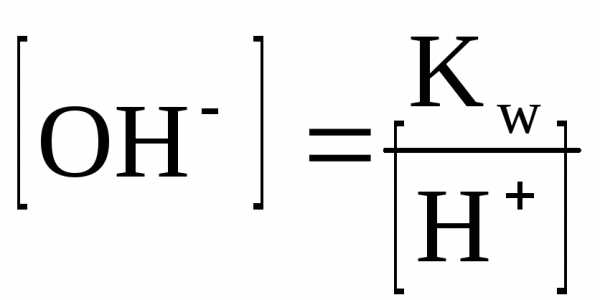
Не менее важным является протолитическое равновесие, устанавливающееся при диссоциации слабых кислот и оснований.
Уксусная кислота является слабым электролитом. Ее диссоциация протекает обратимо по уравнению:
CH3COOHCH3COO— + H+
Константа равновесия, описывающая данный обратимый процесс обозначается Ka и называется константой кислотности:
Аммоний гидроксид является слабым электролитом. Его диссоциация протекает обратимо по уравнению:
NH4OHNH4+ + OH—
Константа равновесия, описывающая данный обратимый процесс обозначается Kb и называется константой основности:
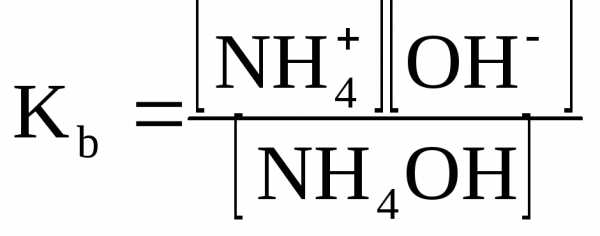
Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах.
К протолитическим равновесиям, играющим важную биологическую роль, относятся реакции гидролитического разложения веществ. Гидролиз солей — это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора. Гидролизу подвергаются растворимые соли, в состав которых входят катионы слабых оснований или анионы слабых кислот.
studfiles.net
Принцип Ле Шателье описывает характер влияния на состояние химического равновесия температуры, концентраций компонентов системы и…
давления
Вант Гофф открыл приближенную закономерность влиянии на скорость реакции…
температуры
20. Реакционная способность веществ зависит от их состава, влияния внешних факторов и …
состава ядра атома
Концепции геологии
Экзогенными геодинамическими процессами являю ген…
выветривание, деятельность подземных вод, лавины, работа ветра
2. Укажите составные части литосферы:
1. ерхний твердый слой мантии и земная кора
3. Одним из источников тепловой энергии внутренних частей Земли является:
1. улканическая деятельность
Эндогенными геодинамическими процессами являются…
1. ектонические движения, землетрясения, вулканизм, метаморфизм
Достаточно точные данные о возрасте Земли получают…
1. результате анализа вулканических газов
Влияние внутренних процессов па эволюцию геологических структур Земли в настоящее время объясняет…
гипотеза глобальной тектоники литосферных плит
7. Геодинамические процессы, связанные с внутренней динамикой Земли, называют …
эндогенными эндотермическими
Геодинамические процессы, связанные с внешней динамикой Земли, называются…
эндогенными
Современные концепции развития геосферных оболочек построены на основе…
теории биохимической эволюции
10. Экзогенным геодинамическим процессом является:
вулканизм
11. Одной из внутренних геосферных оболочек Земли является:
мантия
12. Одной из внутренних геосферных оболочек Земли является:
земная кора
13. Одной из внутренних геосферных оболочек Земли является:
внутреннее ядро
14. Одной из внутренних геосферных оболочек Земли является:
внешнее ядро
15. Следствием эндогенной геодинамической активности Земли являются:
вулканы
16. Следствием эндогенной геодинамической активности Земли являю гея:
землетрясения
17. Следствием эндогенной геодинамической активности Земли являются:
гейзеры
18. Экзогенным геодинамическим фактором является:
тектоническое движение
19. Следствием экзогенной геодинамической активности Земли являются:
вулканы
20. Экзогенным геодинамическим фактором является:
вулканическая деятельность
3-net.ru
