Урок 25. Соли – HIMI4KA
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.

Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).

Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.

Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
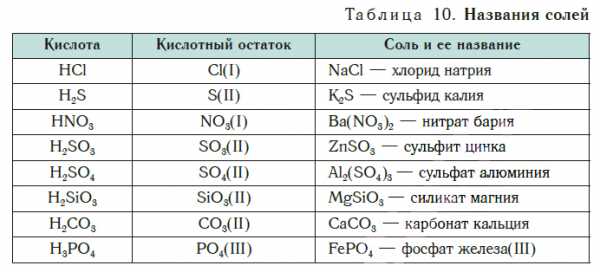
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Соли. Получение и химические свойства.
Рассмотрим важнейшие способы получения солей.
Реакция нейтрализации. Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например:
|
H2SO4 |
+ |
2 KOH |
= |
K2SO4 |
+ |
2 H2O |
|
сульфат калия |
2. Реакция кислот с основными оксидами. Фактически, это вариант реакции нейтрализации. Например:
|
H2SO4 |
+ |
CuO |
= |
CuSO4 |
+ |
H2O |
|
|
|
|
|
сульфат меди |
|
|
3. Реакция оснований с кислотными оксидами. Это также вариант реакции нейтрализации:
|
Ca(OH)2 |
+ |
CO2 |
= |
CaCO3↓ | + |
H2O |
|
|
|
|
|
карбонат кальция |
|
|
4. Реакция основных и кислотных оксидов между собой:
|
CaO |
+ |
SO3 |
= |
CaSO4 |
|
|
|
|
|
сульфат кальция |
5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
|
H2S |
+ |
CuCl2 |
= |
CuS↓ (осадок) | + |
2 HCl |
|
|
|
|
|
сульфид меди |
|
|
6. Реакция оснований с солями. Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например:
| 3 NaOH |
+ |
FeCl3 |
= |
Fe(OH)3↓ |
+ |
3 NaCl |
|
|
|
|
|
(осадок) |
|
хлорид натрия |
7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
|
AgNO3 |
+ |
KCl |
= |
AgCl↓ (осадок) |
+ |
KNO3 |
|
|
|
|
|
хлорид серебра |
| нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl + K+ + Br
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8. Реакция металлов с кислотами. Соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 4-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли:
|
Fe |
+ |
H2SO4(разб.) |
= |
FeSO4 |
+ |
H2 |
|
|
|
|
|
сульфат железа II |
|
|
9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл «сгорает» в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый «дым»:
|
2 K |
+ |
Cl2 |
= |
2 KCl |
|
|
|
|
|
хлорид калия |
10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активности
|
Zn |
+ |
CuSO4 |
= |
Cu |
+ |
ZnSO4 |
|
|
|
|
|
порошок меди |
|
сульфат цинка |
Рассмотрим химические свойства солей.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
1. Окислительно-восстановительные реакции солей.
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
А) Реакции за счет иона металла.
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл:
|
Hg2+SO4 |
+ |
Sn0 |
= |
Hg0 |
+ |
Sn2+SO4 |
|
соль менее активного металла (окислитель) |
|
более активный металл (восстановитель) |
|
|
|
|
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее (см. параграф 8.3), являются более активными.
Б) Реакции за счет кислотного остатка.
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда –многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
|
Na2S–2 |
+ |
Br20 |
= |
S0 |
+ |
2 NaBr–1 |
|
соль сероводородной кислоты |
|
|
|
сера |
|
|
|
2 KI–1 |
+ |
H2O2–1 |
+ |
H2SO4 |
= |
I20 |
+ |
K2SO4 |
+ |
2 H2O–2 | |||||
|
соль иодоводородной кислоты |
|
|
|
|
|
иод |
|
|
|
| |||||
|
2 KMn+7O4 |
+ |
16 HCl–1 |
= |
5 Cl20 |
+ |
2 KCl |
+ |
2 Mn+2Cl2 |
+ |
8 H2O |
|
соль марганцевой кислоты |
|
|
|
|
|
|
|
хлорид марганца |
|
|
|
2 Pb(N+5O3–2)2 |
= |
2 PbO |
+ |
4 N+4O2 |
+ |
O20 |
|
соль азотной кислоты |
при нагревании |
|
|
|
|
|
2. Обменные реакции солей.
Такие реакции могут происходить, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. При проведении обменных реакций берут растворы солей. Общим требованием для таких реакций является образование малорастворимого продукта, который удаляется из раствора в виде осадка. Например:
а) CuSO4 + H2S = CuS↓ (осадок) + H2SO4
AgNO3 + HCl = AgCl↓ (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3↓ (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2↓ (осадок) + K2SO4
в) BaCl2 + K2SO4 = BaSO4↓ (осадок) + 2 KCl
CaCl2 + Na2CO3 = CaCO3↓ (осадок) + 2 NaCl
Если хотя бы один продукт таких обменных реакций не уходит из сферы реакции в виде осадка (иногда – в виде газа), то при смешивании растворов образуется только смесь ионов, на которые при растворении распадаются исходная соль и реагент. Таким образом, обменная реакция произойти не может.
studfiles.net
примеры, состав, названия и химические свойства
Когда слышишь слово «соль», то первая ассоциация, конечно же, поваренная, без которой любое блюдо покажется невкусным. Но ведь это не единственное вещество, которое относится к классу химических веществ соли. Примеры, состав и химические свойства солей вы сможете найти в этой статье, а также научитесь правильно составлять название любой из них. Прежде чем продолжить, давайте договоримся, в этой статье мы рассмотрим только неорганические средние соли (полученные при реакции неорганических кислот с полным замещением водорода).
Определение и химический состав
Одно из определений соли звучит так:
- Это бинарное соединение (т. е. состоящее из двух частей), в состав которого входят ионы металлов и кислотный остаток. То есть это вещество, получившееся в результате реакции кислоты и гидроксида (оксида) любого металла.

Есть еще одно определение:
- Это соединение, представляющее собой продукт полного или частичного замещения ионов водорода кислоты ионами металла (подходит для средних, основных и кислых).
Оба определение правильные, но не отражают всю суть процесса получения соли.
Классификация солей
Рассматривая различных представителей класса солей, можно заметить, что они бывают:
- Кислородсодержащими (соли серной, азотной, кремниевой и других кислот, в состав кислотного остатка которых входит кислород и еще один неметалл).
- Бескислородными, т. е. соли, образованные при реакции кислоты, кислотный остаток которой не содержит кислород, — соляная, бромоводородная, сероводородная и другие.
По количеству замещенных водородов:
- Одноосновные: соляная, азотная, иодоводородная и другие. В состав кислоты входит один ион водорода.
- Двухосновные: два иона водорода замещены ионами металлов при образовании соли. Примеры: серная, сернистая, сероводородная и другие.
- Трехосновные: в составе кислоты три иона водорода замещены металлическими ионами: фосфорная.
Есть и другие типы классификаций по составу и свойствам, но мы не станем их разбирать, так как цель статьи немного другая.
Учимся называть правильно
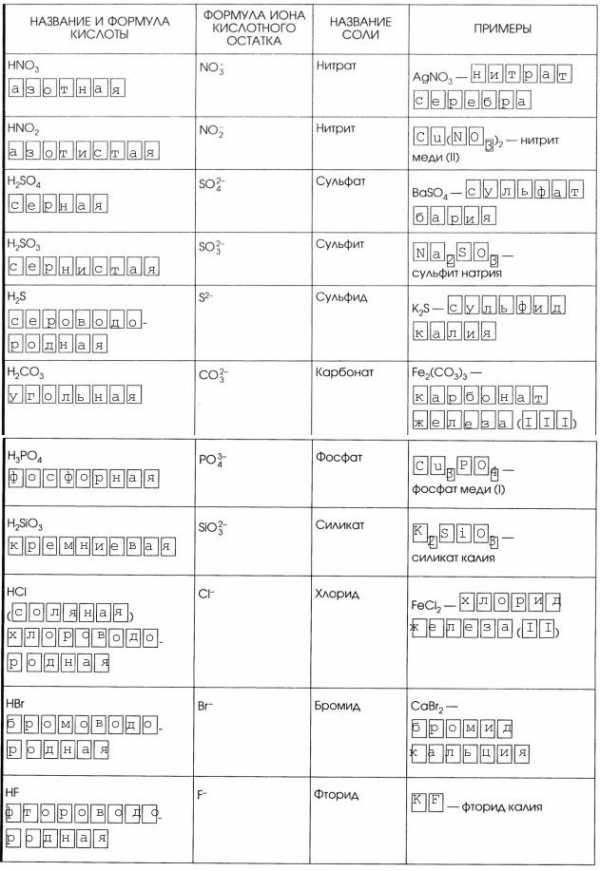
У любого вещества есть название, которое понятно только жителям определенного региона, его еще называют тривиальным. Поваренная соль — пример разговорного названия, по международной номенклатуре оно будет называться уже по-другому. Но в разговоре абсолютно любой человек, знакомый с номенклатурой названий, без проблем поймет, что речь идет о веществе с химической формулой NaCl. Эта соль является производной от соляной кислоты, а соли ее называют хлоридами, то есть называется она хлорид натрия. Нужно просто выучить названия солей, приведенных ниже в таблице, а затем добавить название металла, образовавшего соль.
Но так просто составляется название, если у металла неизменная валентность. А теперь рассмотрим соль (пример с названием), у которой металл с переменной валентностью — FeCl3. Вещество называется хлорид железа трехвалентного. Именно такое название правильное!
| Формула кислоты | Название кислоты | Кислотный остаток (формула) | Номенклатурное название | Пример и тривиальное название |
| HCl | соляная | Cl— | хлорид | NaCl (поваренная соль, каменная соль) |
| HI | иодоводородная | I— | иодид | NaI |
| HF | фтороводородная | F— | фторид | NaF |
| HBr | бромоводородная | Br— | бромид | NaBr |
| H2SO3 | сернистая | SO32- | сульфит | Na2SO3 |
| H2SO4 | серная | SO42- | сульфат | CaSO4 (ангидрит) |
| HClO | хлорноватистая | ClO— | гипохлорит | NaClO |
| HClO2 | хлористая | ClO2— | хлорит | NaClO2 |
| HClO3 | хлорноватая | ClO3— | хлорат | NaClO3 |
| HClO4 | хлорная | ClO4— | перхлорат | NaClO4 |
| H2CO3 | угольная | CO32- | карбонат | CaCO3 (известняк, мел, мрамор) |
| HNO3 | азотная | NO3— | нитрат | AgNO3 (ляпис) |
| HNO2 | азотистая | NO2— | нитрит | KNO2 |
| H3PO4 | фосфорная | PO43- | фосфат | AlPO4 |
| H2SiO3 | кремниевая | SiO32- | силикат | Na2SiO3 (жидкое стекло) |
| HMnO4 | марганцовая | MnO4— | перманганат | KMnO4 (марганцовка) |
| H2CrO4 | хромовая | CrO42- | хромат | CaCrO4 |
| H2S | сероводородная | S- | сульфид | HgS (киноварь) |
Химические свойства
Как класс, соли по своим химическим свойствам характеризуются тем, что могут взаимодействовать со щелочами, кислотами, солями и более активными металлами:
1. При взаимодействии со щелочами в растворе обязательным условием реакции является выпадение в осадок одного из получаемых веществ.
2. При взаимодействии с кислотами реакция проходит, если образуется летучая кислота, нерастворимая кислота или нерастворимая соль. Примеры:
- К летучим кислотам относится угольная, так как она легко распадается на воду и углекислый газ: MgCO3 + 2HCl = MgCl2 + H2O + CO2.
- Нерастворимая кислота — кремниевая, образуется в результате реакции силиката с другой кислотой.
- Одним из признаков химической реакции является выпадение осадка. Какие соли выпадают в осадок, можно посмотреть в таблице растворимости.
3. Взаимодействие солей между собой происходит только в случае связывания ионов, т. е. одна из образовавшихся солей выпадает в осадок.
4. Чтобы определить, пойдет ли реакция между металлом и солью, нужно обратиться к таблице напряжения металлов (иногда ее еще называют рядом активности).
Только более активные металлы (расположенные левее) могут вытеснять из соли металл. Примером является реакция железного гвоздя с медным купоросом:
CuSO4 + Fe= Cu + FeSO4

Такие реакции свойственны большинству представителей класса солей. Но есть и более специфические реакции в химии, свойства соли индивидуальные отражающие, например разложение при накаливании или образование кристаллогидратов. Каждая соль индивидуальна и по-своему необычна.
fb.ru
Соли (химия)
Соли — вещества, в состав молекул которых входят кислотные остатки ( анионы), соединенные с катионами различного происхождения ( атомы металлов, металловидную группы, как NH + 4 , И проч.). Образуются соли результате реакции нейтрализации кислот, или основ. Как правило, соли являются кристаллическими веществами. Простейший пример соли — поваренная соль, химическая формула которого — NaCl.
1. Названия
Существует несколько способов образования названий солей. Проще создавать названия солей, как и кислот, от международных названий кислотных остатков. При этом названия солей кислородных кислот, когда кислотообразующих элемент имеет высшую валентность, оканчивающиеся на-ат. Например:
- KNO 3 — нитрат калия (сернокислый калий)
- CaSO 4 — сульфат кальция (сернокислый кальций),
- Na 3 PO 4 — фосфат натрия (фосфорнокислый натрий),
- BaCO 3 — карбонат бария (углекислый барий),
- Na 2 SiO 3 — силикат натрия (кремнекислый натрий) и т. д.
Названия солей бескислородных кислот имеют окончание-ид или-ид. Например: MgCl 2 — хлорид магния, KJ — йодид калия, NaBr — бромид натрия, Na 2 S — сульфид натрия и т. д.
Если металл, входящий в состав соли, проявляет разную валентность и образует с тем же кислотным остатком несколько солей, то для их распознавания необходимо указывать число кислотных остатков в молекуле соли, или валентность металла. Когда кислотный остаток одновалентный, то обычно указывают число кислотных остатков путем добавления к названию аниона префикса из греческих числительных. Например: CuCl — монохлорид меди, CuCl 2 — дихлорид меди и т. д.
Когда кислотный остаток двух-или трехвалентный, тогда указывают валентность металла, обозначая ее римской цифрой в скобках после названия металла. Например: Cu 2 SO 4 — сульфат меди (I), CuSO 4 — сульфат меди (II), Fe 2 (SO 4) 3 — сульфат железа (III) и т. д.
В названиях кислых солей добавляют приставку гидро-или дигидро-. Например: NaHSO 4 — гидросульфат натрия, NaH 2 PO 4 — дигидрофосфат натрия, CaHPO 4 — фосфат кальция, Ca (H 2 PO 4) 2 — дигидрофосфат кальция и т. д.
Названия основных солей образуют из названия кислотного остатка и слова гидроксид или дигидроксид. Например: AlOHSO 4 — сульфат-гидроксид алюминия, Al (OH) 2 CH 3 COO — ацетат-дигидроксид алюминия, Cu 2 (OH) 2 CO 3 — карбонат-дигидроксид меди (II) и т. д.
Кроме того, некоторые соли имеют еще свои особые названия: Na 2 CO 3 — сода, K 2 CO 3 — поташ, AgNO 3 — ляпис, NaNO 3 — чилийская селитра, Cu 2 (OH) 2 СО 3 — малахит и др..
2. Способы добывания
1. При замещении атомов Водорода в молекулах кислот на атомы металлов:
- 2Fe + 6HCl = 2FeCl 3 + 3H 2
- 2C 3 H 5 (COOH) 3 + 3CuO = [C 3 H 5 (COO)] 2 Cu 3 + 3H 2 O
2. При обмене гидроксильных групп в молекулах основ на кислотные остатки молекул кислот. Суть этой реакции состоит в обмене атомов водорода в молекуле кислоты на атомы металла молекулы основания (с такой же вероятностью происходит обмен гидроксильных групп молекул основ на кислотные остатки молекул кислот), в результате чего образуются соль и вода ( реакция нейтрализации):
- HCl + NaOH = NaCl + H 2 O
- CH 3 COOH + NaOH = CH 3 COONa + H 2 O
3. При взаимодействии кислот с основными оксидами:
- 2HCl + CuO = CuCl 2 + H 2 O
4. При взаимодействии кислот с амфотерными оксидами:
- 3H 2 SO 4 + Al 2 O 3 = Al 2 (SO 4) 3 + 3H 2 O
5. При взаимодействии кислот с солями:
- 3H 2 SO 4 + Ca 3 (PO 4) 2 = 2H 3 PO 4 + 3CaSO 4 ↓
6. При взаимодействии кислот с металлами:
- 2HCl + Zn = ZnCl 2 + H 2 ↑
7. При взаимодействии оснований с кислотными оксидами:
- 2KOH + CO 2 = K 2 CO 3 + H 2 O
8. При взаимодействии оснований с солями:
- 2NaOH + CuCl 2 = 2NaCl + Cu (OH) 2 ↓
9. При взаимодействии основных оксидов с кислотными:
10. При взаимодействии солей:
- K 2 SO 4 + BaCl 2 = 2KCl + BaSO 4 ↓
11. При взаимодействии солей с металлами:
- CuSO 4 + Zn = ZnSO 4 + Cu
12. При взаимодействии металлов с неметаллами:
Существуют и другие способы получения солей.
Не каждым из перечисленных способов можно получить любую соль. Кислые соли образуются обычно при взаимодействии нормальной соли с одноименным кислотой. Например:
- BaCO 3 + H 2 CO 3 (СО 2 + Н 2 О) = Ba (HCO 3) 2
- Ca 3 (PO 4) 2 + H 3 PO 4 = 3CaHPO 4
Основные соли образуются чаще при взаимодействии соли с относительно небольшими количествами щелочи. Например:
- CuCl 2 + NaOH = Cu (OH) Cl ↓ + NaCl
- AlCl 3 + NaOH = Al (OH) Cl 2 ↓ + NaCl
- AlCl 3 + 2NaOH = Al (OH) 2 Cl ↓ + 2NaCl
3. Классификация
Есть несколько способов классификации солей:
3.1. Средние (нормальные) соли
Если все кислотные атомы водорода в молекулах кислот обменены или замещены на атомы металлов или все гидроксильные группы в молекулах основ обменены на кислотные остатки молекул кислот, такие соли называются нормальными, или средними, или просто солями. Например,
- CH 3 COOH + Mg (OH) 3 = Mg (CH 3 COO) 2 + 2H 2 O
- Н 2 SO 4 + Mg = MgSO 4 + H 2
Исходя из теории электролитической диссоциации, солями называются сложные вещества, которые в водном растворе диссоциирует на катионы металлов и анионы кислотных остатков. Нормальные соли никаких других катионов и других анионов не образуют:
- KCl (aq) K + (Aq) + Cl — (Aq)
- Al 2 (SO 4) 3 (aq) 2 Al 3 + (Aq) + 3 SO 2 — 4 (Aq)
3.2. Кислые соли
Если только часть кислотных атомов водорода молекул кислот обменена или замещена на атомы металлов, такие соли называют кислыми, или гидросолямы. Например:
- NaOH + H 2 SO 4 = NaHSO 4 + H 2 O
- Ca (OH) 2 + H 3 PO 4 = CaHPO 4 + 2H 2 O
Кислые соли в водном растворе диссоциируют на катионы металлов, катионы водорода и анионы кислотных остатков. Таким образом, кислая соль будто одновременно является и солью, так как при диссоциации она образует катионы металлов, и кислотой, поскольку одновременно образует и катионы водорода:
- NaHSO 4 (aq) Na + (Aq) + H + (Aq) + SO 2 — 4 (Aq)
- CaHPO 4 (aq) Ca 2 + (Aq) + H + (Aq) + PO 3 — 4 (Aq)
Ионы водорода кислой соли при взаимодействии ее с основой тоже могут обмениваться на ионы металла из образованием нормальной соли и воды:
- NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O
3.3. Основные соли
Если только часть гидроксильных групп в молекулах основ обменена на кислотные остатки молекул кислот, то такие соли называют основными:
- Cu (OH) 2 + HCl = Cu (OH) Cl ↓ + H 2 O
- Fe (OH) 3 + H 2 CO 3 = Fe (OH) CO 3 ↓ + 2H 2 O
- 2Cu (OH) 2 + H 2 CO 3 = Cu 2 (OH) 2 CO 3 ↓ + 2H 2 O
Основные соли в водном растворе диссоциируют на катионы металла и анионы гидроксила и кислотные остатки. Таким образом, основная соль будто одновременно является и солью, поскольку она образует при диссоциации анионы кислотных остатков, и основой, потому образует и гидроксид-анионы:
- Cu (OH) Cl Cu 2 + (Aq) + OH — (Aq) + Cl — (Aq)
- Fe (OH) CO 3 Fe 3 + (Aq) + OH — (Aq) + CO 2 — 3 (Aq)
Обе эти соли в воде практически нерастворимы, но растворимый их часть распадается, по приведенным уравнениям. Ионы гидроксила основной соли при взаимодействии ее с кислотой тоже могут обмениваться на кислотные остатки с образованием нормальной соли
- Cu (OH) Cl + HCl = CuCl 2 + Н 2 О
4. Структурные формулы
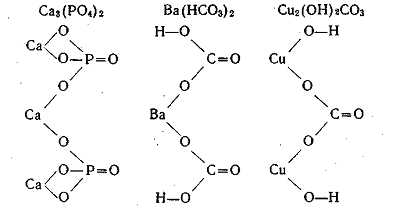
При структурном изображении формул солей выходят из формул соответствующих кислот или оснований, заменяя в них кислотные атомы водорода на атомы металла или гидроксильные группы основ на кислотные остатки. Для примера приведем структурные формулы фосфата кальция, гидрокарбоната бария и основного карбоната меди:
5. Свойства
Все соли представляют собой твердые кристаллические вещества. По отношению к нагреву некоторые соли достаточно устойчивыми. Например: NaCl, KCl, Na 2 SO 4 и т.д.. Эти соли можно нагревать до температуры их плавления и даже кипения, и не разлагаются. Другие же соли неустойчивы и при нагревании разлагаются, не плавясь. Например:
По растворимости в воде соли делятся на хорошо растворимые, малорастворимые и практически нерастворимые. Хорошо растворимыми являются все соли азотной и ацетатной кислот, а также почти все соли натрия, калия и аммония. К практически нерастворимых солей относятся хлорид серебра AgCl, сульфат бария BaSO 4, все силикаты (за исключением NaSiO 3 и K 2 SiO 3) и др..
Химические свойства солей определяются их отношением к кислот, основ, металлов и других солей.
1. Соли могут взаимодействовать с кислотами только в том случае, когда реагирующая кислота сильнее той, от которой происходит данная соль. Например:
- FeS + 2HCl = FeCl 2 + H 2 S ↑
- Na 2 SiO 3 + Н 2 SO 4 = Na 2 SO 4 + H 2 SiO 3 ↓
2. Соли могут взаимодействовать с лугами, когда в результате реакции образуется нерастворимое основание или нерастворимая соль. Например:
- FeCl 3 + 3NaOH = 3NaCl + Fe (OH) 3 ↓
- K 2 CO 3 + Ba (OH) 2 = 2KOH + BaCO 3 ↓
3. Растворы солей могут взаимодействовать с металлами, когда данный металл в электрохимическом ряду напряжений стоит левее металла соли. Например:
- CuSO 4 + Fe = FeSO 4 + Cu
- HgCl 2 + Cu = CuCl 2 + Hg
4. Много солей в растворах могут взаимодействовать друг с другом, когда одна из солей, образующегося в результате реакции, является нерастворимой. Например:
- Na 2 CO 3 + CaCl 2 = 2NaCl + CaCO 3 ↓
- FeSO 4 + BaCl 2 = FeCl 2 + BaSO 4 ↓
См.. также
Источники
- Ф. А. Деркач «Химия» Л. 1968
- Глоссарий терминов по химии / / Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им .. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — М.: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
nado.znate.ru
Примеры солей: химические свойства, получение
Ни один процесс в мире не возможен без вмешательства химических соединений, которые, реагируя между собой, создают основу для благоприятных условий. Все элементы и вещества в химии классифицируются в соответствии со строением и функциями, которые они выполняют. Основными являются кислоты и основания. При их взаимодействии образуются растворимые и нерастворимые соли.
Примеры кислот, солей
Кислота – сложное вещество, которое в своем составе содержит один или более атомов водорода и кислотный остаток. Отличительным свойством таких соединений является способность заменить водород металлом или каким-либо положительным ионом, в результате чего происходит образование соответствующей соли. Практически все кислоты, за исключением некоторых (H2SiO3 – кремниевая кислота), растворимы в воде, причем сильные, такие как HCl (соляная), HNO3 ( азотная), H2SO4 ( серная), полностью распадаются на ионы. А слабые (например, HNO2 – азотистая, H2SO3 – сернистая) – частично. Их водородный показатель (pH), определяющий активность ионов водорода в растворе, меньше 7.
Соль – сложное вещество, состоящее чаще всего из катиона металла и аниона кислотного остатка. Обычно она получается при реагировании кислот и оснований. В результате такого взаимодействия еще выделяется вода. В качестве катионов соли могут служить, например, катионы NH4+. Они, так же как и кислоты, могут растворяться в воде с различной степенью растворимости.
Примеры солей в химии: СаСО3 – карбонат кальция, NaCl – хлорид натрия, NH4Cl – хлорид аммония, K2SO4 – сульфат калия и другие.

Классификация солей
В зависимости от количества замещения катионов водородов выделяют следующие категории солей:
- Средние – соли, в которых катионы водороды заменяются полностью на катионы металлов или другие ионы. Такими примерами солей в химии могут послужить самые обычные вещества, которые встречаются чаще всего – KCl, K3PO4.
- Кислые – вещества, в которых катионы водорода замещаются другими ионами не полностью. Примерами могут послужить гидрокарбонат натрия (NaHCO3) и гидроортофосфат калия (K2HPO4).
- Основные – соли, в которых кислотные остатки не до конца замещаются гидроксогруппой при избытке основания или недостатке кислоты. К таким веществам относится MgOHCl.
- Комплексные соли: Na[Al(OH)4], K2[Zn(OH)4].
В зависимости от количества присутствующих в составе соли катионов и анионов различают:
- Простые – соли, имеющие в составе один вида катиона и аниона. Примеры солей: NaCl, K2CO3, Mg(NO3)2.
- Двойные – соли, которые состоят из пары типов положительно заряженных ионов. К таким относится сульфат алюминия-калия.
- Смешанные – соли, в которых присутствует два вида аниона. Примеры солей: Са(OCl)Cl.

Получение солей
Эти вещества получаются главным образом при реагировании щелочи с кислотой, в результате чего образуется вода: LiOH + HCl = LiCl + H2O.
При взаимодействии кислотного и основного оксидов также образуются соли: СаО + SO3 = CaSO4.
Они же получаются при вступлении в реакцию кислоты и металла, который стоит до водорода в электрохимическом ряду напряжений. Как правило, это сопровождается выделением газа: H2SO4 + Li = Li2SO4 + H2.
При взаимодействии оснований (кислот) с кислотными (основными) оксидами образуются соответствующие соли: 2KOH + SO2 = K2SO3 + H2O; 2HCl + CaO = CaCl2 + H2O.
Основные реакции солей
При взаимодействии соли и кислоты получается другая соль и новая кислота (условием такой реакции является то, что в результате должен выпасть осадок или выделиться газ): HCl + AgNO3 = HNO3 + AgCl.
При реагировании двух разных растворимых солей получают: CaCl2 + Na2CO3 = CaCO3 + 2NaCl.
Некоторые плохо растворимые в воде соли обладают способностью разлагаться на соответствующие продукты реакции при нагревании: СаСО3 = СаО + СО2.
Некоторые соли могут подвергаться гидролизу: обратимо (если это соль сильного основания и слабой кислоты (CaCO3) или сильной кислоты и слабого основания (CuCl2)) и необратимо (соль слабой кислоты и слабого основания (Ag2S)). Соли сильных оснований и сильных кислот (KCl) не гидролизуются.
Они также могут диссоциировать на ионы: частично или полностью, в зависимости от состава.
fb.ru
Формулы солей: принципы составления | Студенческая жизнь
 Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой h4PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте h4PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (h3SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.

Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(Nh4)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
life-students.ru
Тема 21. Соли. | 8 класс
Часть I
1. Признаки солей:
— сложные вещества;
— состоят из положительных ионов металла и отрицательных ионов кислотного остатка.
2. Способ образования названий солей.
3. Дополните таблицу «Кислоты».
4.
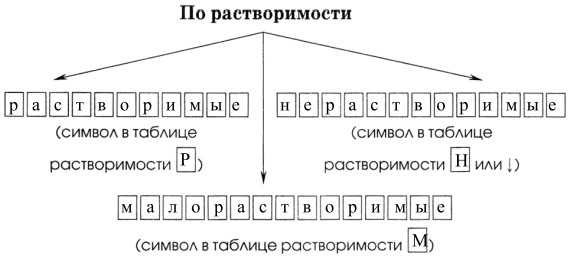
5.
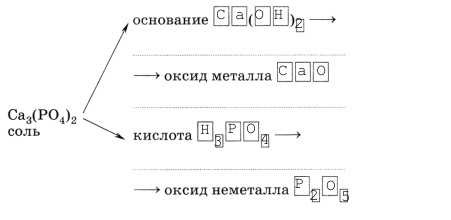
6. Каждой соли кислородсодержащей кислоты соответствуют основание и кислота, а также оксиды металла и неметалла:
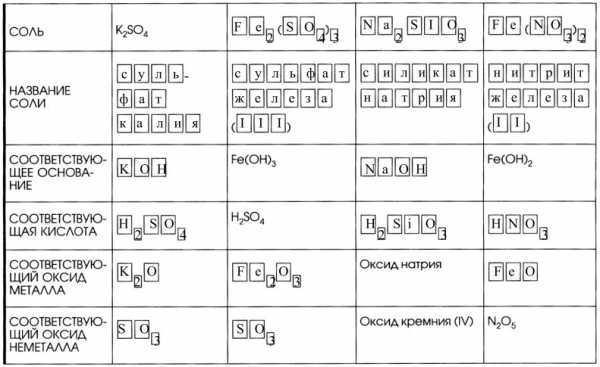
7. Дополните таблицу «Соли и соответствующие им гидроксиды и оксиды».
Часть II
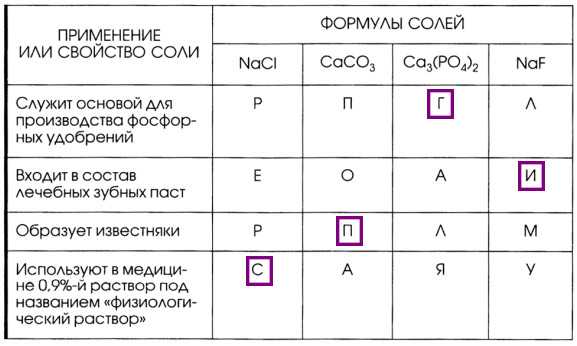
1. Поиграйте в «крестики — нолики». Покажите выигрышный путь, который составляют формулы солей.
Разделите все приведённые выше соли на растворимые и нерастворимые. Напишите их названия.
2. Составьте формулы солей по названиям.
1) Фосфаты натрия, кальция, алюминия:
3) Сульфиты калия, бария, цинка:
2) Нитраты меди (II), железа (III), серебра:
3. Расставьте заряды ионов в следующих соединениях и степени окисления химических элементов.
4. Установите соответствие между формулой соли и её названием.

5. Установите соответствие между формулой соли и её применением или свойством. Из букв, указывающих правильный ответ, вы составите название одного из самых древних связующих материалов на основе сульфата кальция: гипс.
6. Запишите формулы солей и соответствующих им гидроксидов (кислот и оснований), оксидов и простых веществ.

Для каждого варианта составьте формулы бинарных соединений, которые могут быть образованы простыми веществами. Напишите их названия.
7. Вычислите количество вещества, которое составляют 222 кг хлорида кальция. Сколько ионов каждого вида будет содержать это количество? Какова массовая доля хлора в соли?

8. Придумайте условие задачи по теме «Соли». Запишите решение.
Дана соль CuCl2 массой 270 г, найти количество вещества этой соли.
superhimik.ru
