Использование и применение фосфора
Одним из наиболее важных биогенных элементов признан именно фосфор. Его отсутствие делает невозможным жизнедеятельность многих живых организмов, в том числе и человеческого, поскольку он содержится в белках, фосфолипидах, и многих других органических соединениях, среди которых АТФ и ДНК. Одновременно с этим неорганика фосфора является богатой разнообразными молекулами. Участвует в образовании свыше 200 минералов, из которых наиболее приоритетными являются фосфорит и апатит.

Фосфором называется химический элемент, название которого с древнегреческого означает «светоносный». В периодической системе Менделеева фосфор занял место в 15-й группе третьего периода. Он относится к группе химических элементов под названием пниктогены.
Существует несколько версий открытия данного элемента. Наиболее раннее упоминание о существовании фосфора можно найти в алхимических записях, которые датируются 12 веком. Само название элемента в подобных работах отсутствует, однако, можно встретить сведения о получении неизвестного «светящегося» вещества.
По официально версии фосфор был открыт в 1669 году обанкротившимся торговым купцом, пытающимся найти философский камень. Произошло это случайно во время многократного прокаливания мочи человека, в результате чего было образовано вещество, от которого исходил яркий свет.
Получение фосфора
Современные ученые владеют многими методами, посредством которых можно синтезировать фосфор. Наиболее популярным считается его восстановление из минералов, в составе которых он содержится. Как правило, таковыми являются апатиты или фосфориты, взаимодействующие с коксом и кремнеземом в достаточно высоких температурных условиях (порядка 1600 0 С). Производство фосфора, в данном случае, осуществляется в специальных печах.
В природе данный химический элемент широко распространен. Фосфор обладает очень сильной химической активностью, в связи с чем не встречается в свободном состоянии. Он содержится в земной коре и воде, однако к наиболее крупным его запасам во всем мире относятся морские фосфориты наряду с продуктами их выветривания. Ученые считают, что последние имеют океаническое происхождение.
Так, фосфаты формировались путем разных органических и неорганических процессов на протяжении очень продолжительного времени в прибрежных регионах пояса пассатов. Фосфаты аккумулировались из внешней среды, что привело к многократному увеличению концентрации фосфоритов в месторождении.
Сегодня наиболее крупные такие месторождения находятся на территории Марокко, а также Западной Сахары, Америки, Китая, Туниса, Казахстана. Пальма первенства в этом принадлежит именно Марокко – на долю этой страны приходится 70% от всех запасов фосфатов в мире. Но, не смотря на это, среди стран-производителей фосфора Марокко расположилась на втором месте, пропустив вперед США. По данным на 2002 г. в мире из года в год добывается порядка 135 млн. тонн данного вещества.
Стоит отметить, что не все месторождения данного вещества могут называться промышленными. Таковыми принято считать только те, из 1 га которых можно получить фосфатную породу в количестве минимум 6000 тонн и более. Добыча фосфата осуществляется в открытых карьерах с применением скребковых экскаваторов. Первым делом происходит очистка от песчаных наносов и пустых пород, после чего и начинается извлечение фосфатной руды, путь которой к обогатительным фабрикам пролегает по стальным трубам. Стоит сказать, что таким образом руда может преодолевать расстояния в несколько километров.
В морской воде вид данного вещества несколько отличается от других мест его нахождения. Так в водной среде фосфор представлен ортофосфат-анионом, концентрация которого, в среднем, насчитывает около 0,07 мг3/л. Общий океанический объем фосфора составляет 9,8*1010 тонн.
Применение фосфора
| Вещества | Область применения |
|---|---|
| Белый фосфор | Получение красного фосфора, зажигательных и дымообразующих веществ, в металлургии. |
| Красный фосфор | В производстве спичек: P+KCLO3+S+MnO2+Fe2O3 |
| P2O5 | Получение фосфорной кислоты |
| H3PO4 | Получение фосфорных солей и удобрений |
|
Ca3(PO4)2,Ca(H2PO4)2; Ca(H2PO4)2+2CaSO4H2O, CaHPO4,(NH4)2HPO4,NH4H2PO4 |
Используются в качестве фосфорных удобрений в сельском хозяйстве |
Сфер человеческой деятельности, в которых применяется фосфор и его соединения, колоссальное множество. Это связано, прежде всего, с тем, что как само вещество, так и его соединения, принимают очень важное, неотъемлемое, участие в биологических процессах живых организмов.
Кроме этого, с участием данного химического элемента осуществляется производство такого очень известного предмета, которым пользуется каждый человек, как спички. С его участием изготавливаются взрывчатые соединения, зажигательные бомбы, некоторые виды топлива, смазочные материалы. Использование фосфора уместно для производства антикоррозионных материалов, при производстве ламп накаливания, в качестве средства для снижения жесткости воды, а также для поглощения газов. Кроме этого, фосфор является распространенным веществом, применяемым в сельском хозяйстве в качестве материала для удобрения почвы. Также он является активным участником химических синтезов во время производства различных веществ.
Ну и ко всему стоит добавить, что фосфор – это жизненно необходимый элемент, на котором основывается синтез ДНК, РНК и фосфолипидов
mining-prom.ru
61. Фосфор. Получение фосфора. Кристаллические модификации фосфора. Соединения фосфора с металлами и неметаллами. Фосфин. Строение, свойства, получение и применение.
Фосфор(от
греч. phosphoros — светоносный; лат. Phosphorus) P,
химический элемент V группы периодической
системы; атомный номер 15, атомная масса
30,97376. Имеет один устойчивыйнуклид31P.
Эффективное сечение захвата
тепловыхнейтронов18
• 10-30м2. Конфигурация
внеш. электронной оболочкиатома3s23p3; степени
окисления-3, +3 и +5; энергия
последовательной ионизации при переходе
от Р0до P5+(эВ): 10,486,
19,76, 30,163, 51,36, 65,02; сродство к электрону
0,6 эВ;электроотрицательностьпо
Полингу 2,10;атомный
радиус0,134 нм,ионные
радиусы(в скобках указаны
координационные числа) 0,186 нм для P
Среднее содержание фосфора в земной коре 0,105% по массе, в водеморей и океанов 0,07 мг/л. Известно около 200 фосфорныхминералов. все они представляют собой фосфаты. Из них важнейший —апатит, который является основойфосфоритов. Практическое значение имеют также монацит CePO4, ксенотим YPO4, амблигонит LiAlPO4(F, ОН), трифилин Li(Fe, Mn)PO4, торбернит Cu(UO2)2(PO4)2• 12H2O, отунит Ca(UO2)2(PO4)2x x 10H2O, вивианит Fe3(PO4)2• 8H2O, пироморфит Рb5(РО4)3С1, бирюза СuА16(РО4)4(ОН)8• 5Н2О.
Свойства.
Известно св. 10 модификаций фосфора, из них важнейшие — белый, красный и черный фосфор (технический белый фосфор называют желтым фосфором). Единой системы обозначений модификаций фосфора нет. Некоторые свойства важнейших модификаций сопоставлены в табл. Термодинамически устойчив при нормальных условиях кристаллический черный фосфор (P I). Белый и красный фосфор метастабильны, но вследствие малой скорости превращения могут практически неограниченное время сохраняться при нормальных условиях.Соединения фосфора с неметаллами
Фосфор и водород в виде простых веществ практически не взаимодействуют. Водородные производные фосфора получают косвенным путем, например:
Са3Р2+ 6НСl = 3СаСl2+ 2РН3
Фосфин
РН3представляет собой бесцветный
сильнотоксичный газ с запахом гнилой
рыбы. Молекулу фосфина можно рассматривать
как молекулу аммиака. Однако угол между
связями Н-Р-Н значительно меньше, чем у
аммиака. Это означает уменьшение доли
участия s-облаков в образовании гибридных
связей в случае фосфина. Связи фосфора
с водородом менее прочны, чем связи
азота с водородом. Донорные свойства у
фосфина выражены слабее, чем у аммиака.
Малая полярность молекулы фосфина, и
слабая активность акцептировать протон
приводят к отсутствию водородных связей
не только в жидком и твердом состояниях,
но и с молекулами воды в растворах, а
также к малой стойкости иона фосфония
РН
РН4I + КОН = РН3 + КI + Н2О
Фосфин и соли фосфония являются сильными восстановителями. На воздухе фосфин сгорает до фосфорной кислоты:
РН3 + 2О2 = Н3РО4
При разложении фосфидов активных металлов кислотами одновременно с фосфином образуется в качестве примеси дифосфин Р 2Н4. Дифосфин — бесцветная летучая жидкость, по структуре молекул аналогична гидразину, но фосфин не проявляет основных свойств. На воздухе самовоспламеняется, при хранении на свету и при нагревании разлагается. В продуктах его распада присутствуют фосфор, фосфин и аморфное вещество желтого цвета. Этот продукт получил название твердого фосфористого водорода, и ему приписывается формула Р12Н6.
С галогенами фосфор образует три- и пентагалогениды. Эти производные фосфора известны для всех аналогов, но практически важны соединения хлора. РГ3и РГ5токсичны, получают непосредственно из простых веществ.
РГ3— устойчивые экзотермические соединения; РF3— бесцветный газ, РСl3и РВr3— бесцветные жидкости, а РI3 — красные кристаллы. В твердом состоянии все тригалогениды образуют кристаллы с молекулярной структурой. РГ3
РI3 + 3Н2О = 3НI + Н3РО3
Известны оба нитрида фосфора, отвечающие трех- и пятиковалентному состояниям: РN и Р2N5. В обоих соединениях азот трехвалентен. Оба нитрида химически инертны, устойчивы к действию воды, кислот и щелочей.
Расплавленный фосфор хорошо растворяет серу, но химическое взаимодействие наступает при высокой температуре. Из сульфидов фосфора лучше изучены Р4S3, Р4S7, Р4S10. Указанные сульфиды могут быть перекристализованы в расплаве нафталина и выделены в виде желтых кристаллов. При нагревании сульфиды воспламеняются и сгорают с образованием Р2О5и SО2. Водой все они медленно разлагаются с выделением сероводорода и образованием кислородных кислот фосфора.
Соединения фосфора с металлами
С активными металлами фосфор образует солеобразные фосфиды, подчиняющиеся правилам классической валентности. р-Металлы, а также металлы подгруппы цинка дают и нормальные, и анионоизбыточные фосфиды. Большинство из этих соединений проявляют полупроводниковые свойства, т.е. доминирующая связь в них — ковалентная. Отличие азота от фосфора, обусловленное размерным и энергетическим факторами, наиболее характерно проявляется при взаимодействии этих элементов с переходными металлами. Для азота при взаимодействии с последними главным является образование металлоподобных нитридов. Фосфор также образует металлоподобные фосфиды. Многие фосфиды, особенно с преимущественно ковалентной связью, тугоплавки. Так, АlР плавится при 2197 град.С, а фосфид галлия имеет температуру плавления 1577 град.С. Фосфиды щелочных и щелочно-земельных металлов легко разлагаются водой с выделением фосфина. Многие фосфиды являются не только полупроводниками (АlР, GаР, InР), но и ферромагнетиками, например СоР и Fе3Р.
Фосфи́н(фосфористый водород, гидрид фосфора, по номенклатуре IUPAC — фосфан РН3) — бесцветный, очень ядовитый, довольно неустойчивый газ со специфическим запахом гнилой рыбы.
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v(dPH= 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем уаммиака. Водородная связь между молекулами PH3практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
Проявляет сильные восстановительные свойства:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+(аналогичноаммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Как и сам фосфин, так и его соли являются сильными восстановителями.
Получают фосфин при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Возможен синтез непосредственно из элементов:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кистоты:
или её восстановление:
studfiles.net
Фосфор и его соединения
Фосфор и его соединения
Реферат
Содержание
Введение
Глава I. Фосфор как элемент и как простое вещество
1.1. Фосфор в природе
1.2. Физические свойства
1.3. Химические свойства
1.4. Получение
1.5. Применение
Глава II. Соединения фосфора
2.1. Оксиды
2.2. Кислоты и их соли
2.3. Фосфин
Глава III. Фосфорные удобрения
Заключение
Библиографический список
Введение
Фосфор (лат. Phosphorus) P – химический элемент V группы периодической системы Менделеева атомный номер 15, атомная масса 30,973762(4). Рассмотрим строение атома фосфора. На наружном энергетическом уровне атома фосфора находятся пять электронов. Графически это выглядит так:1s 2 2s 2 2p 6 3s 2 3p 3 3d 0
В 1699 г. гамбургский алхимик X. Бранд в поисках «философского камня», якобы способного превратить неблагородные металлы в золото, при выпаривании мочи с углём и песком выделил белое воскообразное вещество, способное светиться.
Название «фосфор» происходит от греч. «phos» – свет и «phoros» – несущий. В России термин «фосфор» введён в 1746 г. М.В. Ломоносовым.
К основным соединениям фосфора относят оксиды, кислоты и их соли (фосфаты, дигидрофосфаты, гидрофосфаты, фосфиды, фосфиты).
Очень много веществ, содержащих фосфор, содержатся в удобрениях. Такие удобрения называют фосфорными.
Глава I Фосфор как элемент и как простое вещество
1.1 Фосфор в природе
Фосфор относится к числу распространенных элементов. Общее содержание в земной коре составляет около 0,08%. Вследствие лёгкой окисляемости фосфор в природе встречается только в виде соединений. Главными минералами фосфора являются фосфориты и апатиты, из последних наиболее распространён фторапатит 3Ca3 (PO4 )2 • CaF2 . Фосфориты широко распространены на Урале, в Поволжье, Сибири, Казахстане, Эстонии, Беларуси. Самые большие залежи апатитов находятся на Кольском полуострове.
Фосфор – необходимый элемент живых организмов. Он присутствует в костях, мышцах, в мозговой ткани и нервах. Из фосфора построены молекулы АТФ – аденозинтрифосфорной кислоты (АТФ – собиратель и носитель энергии). В организме взрослого человека содержится в среднем около 4,5 кг фосфора, в основном в соединении с кальцием.
Фосфор содержится также в растениях.
Природный фосфор состоит лишь из одного стабильного изотопа 31 Р. В наши дни известно шесть радиоактивных изотопов фосфора.
1.2 Физические свойства
Фосфор имеет несколько аллотропных модификаций – белый, красный, чёрный, коричневый, фиолетовый фосфор и др. Первые три из названных наиболее изучены.
Белый фосфор – бесцветное, с желтоватым оттенком кристаллическое вещество, светящееся в темноте. Его плотность 1,83 г/см3 . Не растворяется в воде, хорошо растворяется в сероуглероде. Имеет характерный чесночный запах. Температура плавления 44°С, температура самовоспламенения 40°С. Чтобы защитить белый фосфор от окисления, его хранят под водой в темноте (на свету идёт превращение в красный фосфор). На холоде белый фосфор хрупок, при температурах выше 15°С становится мягким и режется ножом.
Молекулы белого фосфора имеют кристаллическую решётку, в узлах которой находятся молекулы Р4 , имеющие форму тетраэдра.
Каждый атом фосфора связан тремя σ-связями с другими тремя атомами.
Белый фосфор ядовит и даёт труднозаживающие ожоги.
Красный фосфор – порошкообразное вещество тёмно-красного цвета без запаха, в воде и сероуглероде не растворяется, не светится. Температура воспламенения 260°С, плотность 2,3 г/см3 . Красный фосфор представляет собой смесь нескольких аллотропных модификаций, отличающихся цветом (от алого до фиолетового). Свойства красного фосфора зависят от условий его получения. Не ядовит.
Чёрный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Плотность 2,7 г/см3 .
Красный и чёрный фосфоры имеют атомную кристаллическую решётку.
1.3 Химические свойства
Фосфор – неметалл. В соединениях он обычно проявляет степень окисления +5, реже – +3 и –3 (только в фосфидах).
Реакции с белым фосфором идут легче, чем с красным.
I. Взаимодействие с простыми веществами.
1. Взаимодействие с галогенами:
2P + 3Cl2 = 2PCl3 (хлорид фосфора (III)),
PCl3 + Cl2 = PCl5 (хлорид фосфора (V)).
2. Взаимодействие с нематаллами:
2P + 3S = P2 S3 (сульфид фосфора (III).
3. Взаимодействие с металлами:
2P + 3Ca = Ca3 P2 (фосфид кальция).
4. Взаимодействие с кислородом:
4P + 5O2 = 2P2 O5 (оксид фосфора (V), фосфорный ангидрид).
II. Взаимодействие со сложными веществами.
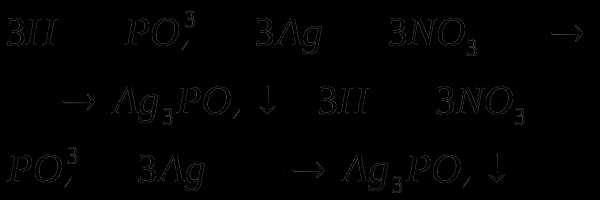
3P + 5HNO3 + 2H2 O = 3H3 PO4 + 5NO↑.
1.4 Получение
Фосфор получают из измельченных фосфоритов и апатитов, последние смешиваются с углем и песком и прокаливаются в печах при 1500°С:
2Ca3 (PO4 )2 + 10C + 6SiO2
6CaSiO3 + P4 ↑ + 10CO↑.Фосфор выделяется в виде паров, которые конденсируются в приёмнике под водой, при этом образуется белый фосфор.
При нагревании до 250-300°С без доступа воздуха белый фосфор превращается в красный.
Чёрный фосфор получается при длительном нагревании белого фосфора при очень большом давлении (200°С и 1200 МПа).
1.5 Применение
Красный фосфор применяется при изготовлении спичек (см. рисунок). Он входит в состав смеси, наносимой на боковую поверхность спичечного коробка. Основным компонентом состава головки спички является бертолетова соль KClO3 . От трения головки спички о намазку коробка частицы фосфора на воздухе воспламеняются. В результате реакции окисления фосфора выделяется тепло, приводящее к разложению бертолетовой соли.
KClO3
KCl + .Образующийся кислород способствует воспламенению головки спички.
Фосфор используют в металлургии. Он применяется для получения проводников и входит в состав некоторых металлических материалов, например оловянных бронз.
Также фосфор используют при производстве фосфорной кислоты и ядохимикатов (дихлофос, хлорофос и др.).
Белый фосфор используют для создания дымовых завес, так как при его горении образуется белый дым.
Глава II . Соединения фосфора
2.1 Оксиды
Фосфор образует несколько оксидов. Важнейшими из них являются оксид фосфора (V) P4 O10 и оксид фосфора (III) P4 O6 . Часто их формулы пишут в упрощённом виде – P2 O5 и P2 O3 . В структуре этих оксидов сохраняется тетраэдрическое расположение атомов фосфора.
Оксид фосфора (III) P4 O6 – воскообразная кристаллическая масса, плавящаяся при 22,5°С и превращающаяся при этом в бесцветную жидкость. Ядовит.
При растворении в холодной воде образует фосфористую кислоту:
P4 O6 + 6H2 O = 4H3 PO3 ,
а при реакции со щелочами – соответствующие соли (фосфиты).
Сильный восстановитель. При взаимодействии с кислородом окисляется до Р4 О10 .
Оксид фосфора (III) получается окислением белого фосфора при недостатке кислорода.
Оксид фосфора (V) P4 O10 – белый кристаллический порошок. Температура возгонки 36°С. Имеет несколько модификаций, одна из которых (так называемая летучая) имеет состав Р4 О10 . Кристаллическая решётка этой модификации слагается из молекул Р4 О10 , связанных между собой слабыми межмолекулярными силами, легко разрывающимися при нагревании. Отсюда и летучесть этой разновидности. Другие модификации полимерны. Они образованы бесконечными слоями тетраэдров РО4 .
При взаимодействии Р4 О10 с водой образуется фосфорная кислота:
P4 O10 + 6H2 O = 4H3 PO4 .
Будучи кислотным оксидом, Р4 О10 вступает в реакции с основными оксидами и гидроксидами.
Образуется при высокотемпературном окислении фосфора в избытке кислорода (сухого воздуха).
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратируюшего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием её ангидрида:
4HClO4 + P4 O10 = (HPO3 )4 + 2Cl2 O7 .
2.2 Кислоты и их соли
а) Фосфористая кислота H3 PO3 . Безводная фосфористая кислота Н3 РО3 образует кристаллы плотностью 1,65 г/см3 , плавящиеся при 74°С.
Структурная формула:
.При нагревании безводной Н3 РО3 происходит реакция диспропорционирования (самоокисления-самовосстановления):
4H3 PO3 = PH3 ↑ + 3H3 PO4 .
Соли фосфористой кислоты – фосфиты . Например, K3 PO3 (фосфит калия) или Mg3 (PO3 )2 (фосфит магния).
Фосфористую кислоту Н3 РО3 получают растворением в воде оксида фосфора (III) или гидролизом хлорида фосфора (III) РCl3 :
РCl3 + 3H2 O = H3 PO3 + 3HCl↑.
б) Фосфорная кислота (ортофосфорная кислота ) H3 PO4 .
Безводная фосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35°С. С водой фосфорная кислота образует растворы любых концентраций.
mirznanii.com
Реферат на тему «Фосфор»
Распространенность в природе
Массовая доля фосфора в земной коре составляет 0,08%. Важнейшими минералами фосфора, встречающимися в природе, являются фторапатит Ca5(PO4)3F и фосфорит Ca3(PO4)2.
Свойства
Фосфор образует несколько аллотропных модификаций, которые заметно различаются по свойствам. Белый фосфор — мягкое кристаллическое вещество. Состоит из молекул P4. Плавится при температуре 44,1°С. Очень хорошо растворим в сероуглероде CS2. Черезвычайно ядовит и легко загорается.
При нагревании белого фосфора образуется Красный фосфор. Он представляет собой смесь нескольких модификаций, которые имеют различную длину молекул. Цвет красного фосфора в зависимости от способа и условий получения может меняться от светло-красного до фиолетового и темно-коричневого. Температура его плавления 585-600°.
Черный фосфор — наиболее устойчивая модификация. По внешнему виду он похож на графит. В отличие от белого фосфора красный и черный фосфор не растворяются в сероуглероде, они не ядовиты и не огнеопасны.
Фосфор химически более активен, чем азот. Химическая активность фосфора зависит от аллотропной модификации, в которой он находится. Так, наиболее активен белый фосфор, а наимнее активен черный фосфор.
В уравнениях химических реакций белый фосфор обычно записывают формулой P4, которая соответствует составу его молекул. Красная и черная модификации фосфора обычно записываются формулой P. Этот же символ используют, если модификация неизвестна или может быть любой.
1. Взаимодействие с простыми веществами — неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V), например: 2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5
2. Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P = Mg3P2
Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфин PH3 по химическим свойствам похож на аммиак NH3.
3. Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует:
0 -3 +1
P4+ 3NaOH + 3H2O = PH3+ 3NaH2PO2
Получение. Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов и фторапатитов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора.
В качестве восстановителя соединений фосфора используют кокс (углерод). Для связывания соединений кальция в реакционную систему добавляют кварцевый песок SiO2. Процесс проводят в электопечах (производство относят к электротермическим). Реакция протекает по уравнению: 2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 + 10CO
Продукт реакции — белый фосфор. Из-за наличия примесей технический фосфор имеет желтый цвет, поэтому в промышленности его называют желтым фосфором.
Фосфорные удобрения
Фосфор, так же как и азот, является важным элементом для обеспечения роста и жизнедеятельности растений. Растения извлекают фосфор из почвы, поэтому его запасы необходимо восполнять, периодически добавляя фосфорные удобрения. Фосфорные удобрения производят из фосфата кальция, который входит в состав природных фосфоритов и фторапатитов.
Простейшее фосфорное удобрение — фосфоритная мука представляет собой перемолотый фосфорит Ca3(PO4)2. Это удобрение труднорастворимо, оно может усваиваться растениями только на кислых почвах.
Действием серной кислоты на фосфат кальция получают простой суперфосфат, основным компонентом которого является дигидрофосфат кальция Ca(H2PO4)2. Это — растворимое вещество, и оно хорошо усваивается растениями. Метод получения простого суперфосфата основан на реакции Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Кроме основного компонента суперфосфат содержит до 50% сульфата кальция, который является балластом. Для повышения содержания фосфора в удобрении проводят обработку фосфорита фосфорной кислотой: Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Получаемое удобрение называется двойным суперфосфатом. Еще одно фосфорное удобрение с высоким содержанием фосфора — преципитат CaHPO4·2H2O.
Высококонцентрированные фосфорные удобрения приготавливают на основе суперфосфорной кислоты — смеси полифосфорных кислот H4P2O7, H5P3O10, H6P4O13 и др. Эти кислоты образуются при нагреавнии фосфорной кислоты H3PO4 в вакууме.
При взаимодействии полифосфорных кислот с аммиаком образуются полифосфаты аммония, которые используются как комплексные азотно-фосфорные удобрения.
Вместе с азотом фосфор входит в состав некоторых других комплексных удобрений, например аммофоса Nh5h3PO4 и диаммофоса (Nh5)2HPO4.
referati-besplatno.ru
Природные соединения и получение фосфора

План:
| Введение……………………………………………………………………………. | 3 |
| История развития фосфора………………………………………………………… | 3 |
| Природные соединения и получение фосфора…………………………………… | 4 |
| Химические свойства……………………………………………………………… | 4 |
| Аллотропные изменения…………………………………………………………… | 5 |
| а) белый…………………………………………………………………………….. | 6 |
| б) красный………………………………………………………………………….. | 7 |
| в) черный……………………………………………………………………………. | 7 |
| Оксиды фосфора…………………………………………………………………… | 7 |
| Ортофосфорная кислота…………………………………………………………… | 9 |
| Ортофосфаты………………………………………………………………………. | 11 |
| Фосфор в организме человека…………………………………………………….. | 11 |
| Спички………………………………………………………………………………. | 12 |
| Фосфорные удобрения…………………………………………………………….. | 12 |
| Заключение…………………………………………………………………………. | 14 |
| 1. Значение фосфора……………………………………………………………….. | 14 |
| 2. Применение фосфора…………………………………………………………… | 15 |
| Список используемой литературы………………………………………………… | 17 |
Введение
Пятая группа Периодической системы включает два типических элемента азот и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими элементами наблюдается значительное различие в свойствах.
В состоянии простых веществ азот – газ, а фосфор – твердое вещество. Эти два вещества получили большую область применения, хотя когда азот впервые был выделен из воздуха его посчитали вредным газом, а на продаже фосфора удавалось заработать большое количество денег (в фосфоре ценили его способность светится в темноте).
История открытия фосфора
По иронии судьбы фосфор открывался несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль (XII век) открыл фосфор при перегонке мочи в смеси с глиной, известью и углем. Однако датой открытия фосфора считается 1669 год. Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать «первичную материю», считавшейся основой философского камня, Бранд заинтересовался человеческой мочей.
Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он вновь дистиллировал и получил тяжелое красное «уринное масло», которое перегонялось с образованием твердого остатка. Нагревая последний, без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившего в темноте. Бранд назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Несколько лет «рецепт приготовления» фосфора хранился в строжайшем секрете и был известен лишь нескольким алхимикам. В третий раз фосфор открыл Р.Бойль в 1680 году.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца (PbO), поваренной солью (NaCl), поташом (K2CO3) и углем (C). Лишь 1777 году К.В.Шееле заработал способ получения фосфора из рога и костей животных.
Природные соединения и получение фосфора
По распространенности в земной коре фосфор опережает азот, серу и хлор. В отличие от азота фосфор, из-за большой химической активности встречается в природе только в виде соединений. Наиболее важные минералы фосфора — апатит Са5Х(РО4)3 (Х — фтор, реже хлор и гидрооксильная группа) и фосфорит основой которого является Са3(РО4)2. Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся в районе гор Каратау, в Московской, Калужской, Брянской областях и в других местах. Фосфор входит в состав некоторых белковых веществ, содержащихся в генеративных органах растений, в нервных и костных тканях организмов животных и человека. Особенно богаты фосфором мозговые клетки.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C3CaSiO3+5CO+P2.
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Химические свойства
Электронная конфигурация атома фосфора
1S22S22P63S23P33d0
Наружный электронный слой содержит 5 электронов. Наличием трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность фосфора равна 3.
Но на третьем энергетическом уровне имеются вакантные ячейки d-орбиталей, поэтому при переходе в возбужденное состояние 3S-электроны будут разъединяться, переходить на d подуровень, что приводит к образованию 5-ти неспаренных элементов.
Таким образом, валентность фосфора в возбужденном состоянии равна 5.
В соединениях фосфор обычно проявляет степень окисления +5, реже +3, -3.
1. Реакции с кислородом:
4P0 + 5O2 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 2P2+3O3)
2. С галогенами и серой:
2P0 + 3Cl2 2P+3Cl3
P0 + 5S P2+5S5
(галогениды фосфора легко разлагаются водой, например:
PCl3 + 3H2O H3PO3 + 3HCl
PCl5 + 4H2O H3PO4 + 5HCl)
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O 3H3P+5O4 + 5N+2O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления — 3:
2P0 + 3Mg Mg3P2-3
(фосфид магния легко разлагается водой Mg3P2 + 6H2O 3Mg(OH)2 + 2PH3(фосфин))
3Li + P Li3P-3
5. Со щелочью:
4P + 3NaOH + 3H2O PH3 + 3NaH2PO2
В реакциях (1,2,3) — фосфор выступает как восстановитель, в реакции (4) — как окислитель; реакция (5) — пример реакции диспропорционирования.
Фосфор может быть как восстановителем, так и окислителем.
Аллотропные изменения
В свободном состоянии фосфор образует несколько аллотропных видоизменений. Это объясняется тем, что атомы фосфора способны, взаимно соединяясь, образовывать кристаллические решетки различного типа.
Таблица 1
Физические свойства фосфора
| Аллотропная модификация | Плотность, г/см3 | tпл, 0C | Tкип, 0C | Внешний вид и характерные признаки |
| Белый | 1,73 | 44,1 | 280,5 | Белый кристаллический порошок, ядовит, самовозгорается на воздухе. При 280—300°С переходит в красный |
| Красный | 2,3 | 590 | Возгоняется около 400°С | Красный кристаллический или аморфный порошок, неядовит. При 220°С и 12 108 Па переходит в черный фосфор. Загорается на воздухе только при поджигании |
| Черный | 2,7 | При нагревании переходит в красный фосфор | Графитоподобная структура. При нормальных условиях — полупроводник, под давлением проводит электрический ток как металл | |
Белая модификация фосфора, получающаяся при конденсации паров, имеет молекулярную кристаллическую решетку, в узлах которой дислоцированы молекулы Р4 (рис.1). Из-за слабости межмолекулярных сил белый фосфор летуч, легкоплавок, режется ножом и растворяется в неполярных растворителях, например в сероуглероде. Белый фосфор весьма реакционноспособное вещество. Он энергично взаимодействует с кислородом, галогенами, серой и металлами. Окисление фосфора на воздухе сопровождается разогреванием и свечением. Поэтому белый фосфор хранят под водой, с которой он не реагирует. Белый фосфор очень токсичен.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Техника безопасности. В производстве фосфора и его соединений требуется соблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд. Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком. Обоженную кожу следует промыть раствором KmnO4 или CuSO4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO4.
При длительном хранении, а также при нагревании белый фосфор переходит в красную модификацию (впервые его получили лишь 1847 году). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до темно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, и по сравнению с белым фосфором они менее реакционноспособны и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов и ламп накаливания, используется в спичечном производстве.
Наиболее стабильной модификацией фосфора является черный фосфор. Его получают аллотропным превращением белого фосфора при t=2200C и повышенным давлением. По внешнему виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется в белый фосфор.
Оксид фосфора (V)
| Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора. | |
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t0пл.= 5700С, t0кип.= 6000C, = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
Ортофосфорная кислота. Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорная кислота Н3РО4 (Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,350С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:
НО ОН
Р
О ОН
В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
Ортофосфорная кислота затем отфильтровывается и концентрируется упариванием.
2. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу ортофосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Физические свойства. Ортофосфорная кислота — твердое, бесцветное, кристаллическое вещество, хорошо растворимое в воде.
Химические свойства ортофосфорной кислоты представлены в табл.2:
Таблица 2
Химические свойства ортофосфорной кислоты
| Общие с другими кислотами | Специфические |
| 1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато:
Легче всего идет диссоциация по первой ступени и труднее всего – по третьей 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода:
3. Реагирует с основными оксидами:
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
5. Реагирует с солями слабых кислот:
|
двуфосфорная кислота
2. При действии раствора нитрата серебра (I) появляется желтый осадок: желтый осадок 3. Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ. При разложении АТФ выделяется большое количество энергии. |
Ортофосфаты. Ортофосфорная кислота образует три ряда солей. Если обозначить атомы металлов буквами Me, то можно изобразить в общем виде состав ее солей (табл.3).
Таблица 3
Химические формулы ортофосфатов, содержащих металлы
| одновалентные | двухвалентные | трехвалентные |
| Ме3РО4 | Ортофосфаты Ме3(РО4)2 | Ме3РО4 |
| Ме2НРО4 | Гидроортофосфаты МеНРО4 | Ме2(НРО4)3 |
| МеН2РО4 | Дигидроортофосфаты Ме(Н2РО4)2 | Ме(Н2РО4)3 |
Вместо одновалентного металла в состав молекул ортофосфатов может входить группа аммония: (NH4)3PO4 — ортофосфат аммония;
(NH4)2HPO4—гидроортофосфат аммония; NH4H2PO4 – дигидро-ортофосфат аммония.
Ортофосфаты и гидроортофосфаты кальция и аммония широко используют в качестве удобрений, ортофосфат и гидроортофосфат натрия — для осаждения из воды солей кальция.
Фосфор в организме человека
В теле человека массой 70 кг. Содержится около 780 г. фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденизинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,51. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO2, KСlO3, BaCrO4) и восстановители (S, Sb2S3). При трении от зажигательной поверхности смесь, нанесенная на спичку, воспламеняется:
Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Фосфорные удобрения
Минеральные удобрения – источник различных питательных элементов для растений и свойств почвы, в первую очередь азота, фосфора и калия, а затем кальция, магния, серы, железа.
Фосфор входит в состав многих органических соединений в растениях. Фосфорное питание регулирует рост и развитие растений.
Сырьем для производства фосфорных удобрений, фосфора и всех фосфорных соединений служат апатитовые и фосфоритовые руды. Состав апатитов чаще всего выражается формулой Са5(РО4)3F (фторапатит). Фосфориты отличаются от фторапатитов тем, что в них вместо ионов F— содержатся ионы ОН— или 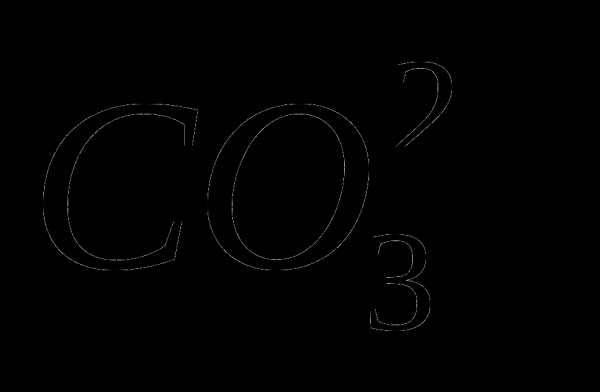 . Фосфориты обычно содержат больше примесей, чем фторапатит.
. Фосфориты обычно содержат больше примесей, чем фторапатит.
В дореволюционной России были известны и разрабатывались лишь маломощные месторождения фосфоритов низкого качества. Поэтому событием огромного народнохозяйственного значения было открытие в 20-х годах месторождения апатита на Кольском полуострове в Хибинах. Здесь построена крупная обогатительная фабрика, которая разделяет добываемую горную породу на концентрат с высоким содержанием фосфора и примеси – «нефелиновые хвосты», используемые для производства алюминия, соды, поташа и цемента.
Мощные месторождения фосфоритов открыты в Южном Казахстане, в горах Каратау.
Самое дешевое фосфорное удобрение – это тонко измельченный фосфорит – фосфоритная мука. Фосфор содержится в ней в виде нерастворимого в воде фосфата кальция Са3(РО4)2. Поэтому фосфориты усваиваются не всеми растениями и не на всех почвах. Основную массу добываемых фосфорных руд перерабатывают химическими методами в вещества, доступные всем растениям на любой почве. Это водорастворимые фосфаты кальция:
Двойной суперфосфат (цвет и внешний вид сходен с простым суперфосфатом – серый мелкозернистый порошок).
Получается при действии на природный фосфат фосфорной кислоты:
По сравнению с простым суперфосфатом он не содержит СаSО4 и является значительно концентрированным удобрением (содержит до 50% Р2О5).
Преципитат – содержит 35-40% Р2О5.
Получается при нейтрализации фосфорной кислоты раствором гидроксида кальция:
Применяется на кислых почвах.
Аммофос – сложное удобрение, содержащее азот (до 15% N) и фосфор (до 58% Р2О5) в виде NH4H2PO4 и (NH4)2HPO4. Получается при нейтрализации фосфорной кислоты аммиаком.
Раньше в течение более 100 лет в качестве фосфорного удобрения широко использовали так называемый простой суперфосфат, который образуется при действии серной кислоты на природный фосфат кальция:
В этом случае в реакцию с фосфатом кальция вступает относительно меньше серной кислоты, чем при получении из него фосфорной кислоты. Получается смесь дигидрофосфата кальция и сульфата кальция. Это удобрение с массовой долей Р2О5 не выше 20%. Сейчас простой суперфосфат производится в сравнительно небольших масштабах на ранее построенных заводах.
Примеры фосфорных удобрений даны в табл.4.
Таблица 4
Удобрения, содержащие фосфор
| Название удобрения | Химический состав |
| Простые | |
| Суперфосфат двойной |
|
| Суперфосфат простой |
|
| Фосфоритная мука |
|
| Костяная мука |
|
| Преципитат |
|
| Шлак мартеновский печей | Сложный состав. Содержит P,Ca, Si, C, Fe и др. элементы |
| Комплексные | |
| Аммофос |
|
| Аммофоска |
|
| Нитроаммофос |
|
Заключение
Значение фосфора
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей — семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману1, известному геохимику, назвать фосфор «элементом мысли». Весьма отрицательно (заболевание животных рахитом, малокровие, и др.) сказывается на состоянии организма понижение содержания в рационе питания соединений фосфора или введение их в неусвояемой форме.
Применение фосфора
Применяют ортофосфорную кислоту в настоящее время довольно широко. Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структурированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
Список использованной литературы:
Ф.Г.Фельдман, Г.Е.Рудзитис. ХИМИЯ. Учебник для 9 класса общеобразовательных учреждений. – М., 5-е издание, ПРОСВЕЩЕНИЕ, 1997.
ХИМИЯ. Справочные материалы. Под ред.Ю.Д.Третьякова, — М., ПРОСВЕЩЕНИЕ, 1984.
ХИМИЯ. Справочник школьника, — М., 1995.
ХИМИЯ. Энциклопедия для детей. Том 17, АВАНТА, 2000.
Везер В.-Дж., Фосфор и его соединения, пер. с англ., — М., 1963.
Интернет: /nsm/chemistry/
1 Ферсман Александр Евгеньевич [27.10 (8.11).1883, Петербург, — 20.5.1945, Сочи], советский геохимик и минералог, академик АН СССР (1919). Ученик В. И. Вернадского.
refdb.ru
Фосфор и его соединения
Фосфор
15P 1s22s22p63s23p3
Ar = 30,9738
Один устойчивый изотоп 31Р, ЭО = 2,1
Кларк фосфора в земной коре 10,5 • 10-2 % по массе.
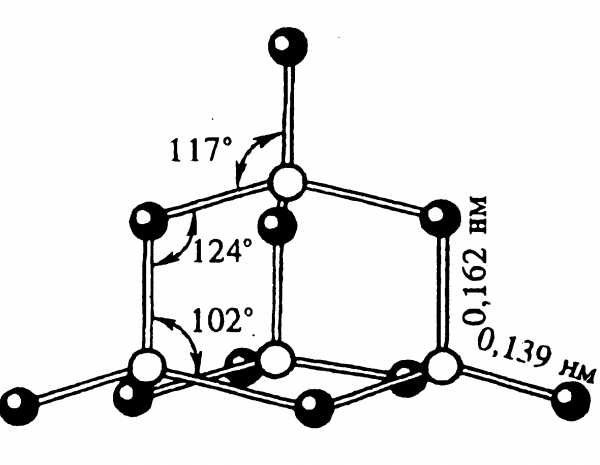
Наиболее важные минералы фосфора — апатит Са5(РO4)3Х (Х-фтор, реже хлор и гидроксильная группа) и фосфорит, основой которого является Са3(РO4)2
P-3 |
P0 |
P+3 |
P+5 |
PH3 фосфин |
аллотропные модификации |
Р2О3, (Р4О6)димер кислотный оксид |
Р2О5, (Р4О10)димер кислотный оксид |
МеxРy фосфиды |
фосфористые кислотыты: НРО2 мета-; Н3РО3 орто-. Соли-фосфиты |
фосфорные кислоты: НРО3 мета-; Н3РО4 орто-. Соли-фосфаты |
Свободный фосфор. Аллотропные модификации.
Имеет молекулярное строение. Во всех фазовых состояниях содержит тетраэдрические молекулы Р4.
При обычной температуре — твердое вещество, нерастворимо в Н2О. Хорошо растворяется в сероуглероде. Очень ядовит.
Химически активен, светится в темноте.
Неорганический полимер (-Р-Р-Р-Р)n. Открытые цепи и циклы.
Твердое вещество, нерастворимо в Н2О и в сероуглероде. Не ядовит.
Химически малоактивен. Не светится в темноте.
Неорганический полимер. Сходен с графитом, но практически негорюч. Обладает электро- и теп лопроводностью.
Химические свойства и получение фосфора
Наибольшей химической активностью отличается белый фосфор, который окисляется кислородом воздуха уже при обычной температуре, что сопровождается выделением энергии в виде тепла и света. Возможно самовоспламенение фосфора на воздухе.
Красный фосфор проявляет те же химические свойства, что и белый, но реакции протекают с малыми скоростями.
Черный фосфор отличается низкой химической активностью.
Восстановительная функция фосфора проявляется в реакциях:
а) с простыми веществами, образованными более электроотрицательными неметаллами. При наличии избытка окислителя образуются соединения фосфора (V), при недостатке — соединения фосфора (III):
4Р + 5О2 = 2Р2О5; 4Р + 3О2 = 2Р2О3
2Р + 5Сl2 = 2PCl2; 2Р + ЗСl2 = 2РСl3
2Р + 5S = P2S5; 2Р + 3S = P2S3
б) со сложными веществами — сильными окислителями:
Р + 5HNО3(конц.) = Н3РО4 + 5NО2 + Н2О
ЗР + 5HNО3(разб.) + 2Н2О = ЗН3РО4 + 5NO
2Р + 5H2SО4(конц.) = 2Н3РО4 + 5SО2 + 2Н2О
8Р+ 10NО2 = 4P2О5 + 5N2
1. Окислительная функция фосфора проявляется только в реакциях с активными металлами:
2Р + ЗСа = Са3Р2 фосфид кальция
Р + 3Na = Na3P фосфид натрия
2. С водородом фосфор при обычных условиях непосредственно не взаимодействует.
3. Диспропорционирование в щелочных растворах
4Р + ЗКОН + 3Н2О = RH3↑ + ЗКН2PО2 гипофосфит калия
8Р + ЗВа(ОН)2 + 6Н2О = 2PH3↑ + ЗВа(Н2PО2)2гипофосфит бария
Получение фосфора
Основным сырьем служат природные минералы, содержащие Са3(РО4)2 методом вакуум-термического восстановления получают фосфор в газообразном состоянии по реакции:
Са3(РО4)2 + 5С + 3SiО2 = 2P↑ + 5СО↑ + 3CaSiО3↓
Фосфин РН3
Аналог аммиака. При обычной температуре — бесцветный газ с характерным чесночным запахом, крайне ядовит. В отличие от аммиака, малорастворим в воде. Образует неустойчивые гидраты РН3 • Н2О. Катион фосфония РН4+ почти отсутствует в нейтральных водных растворах.
РН3 не может быть получен прямым синтезом из простых веществ.
Косвенные способы получения:
1. Взаимодействие фосфидов металлов с водой и кислотами:
Са3Р2 + 6Н2О = ЗСа(ОН)2 + 2РН3↑
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3↑
2. Разложение солей фосфония
PH4I → HI + РН3
3. Взаимодействие фосфора со щелочами (см. выше)
РН3 — очень сильный восстановитель (сильнее, чем NH3). При Т ~ 150°С происходит его самовозгорание, иногда со взрывом. Образуется фосфорная кислота:
РН3 + 2О2 = Н3РО4
С сильными безводными кислотами фосфин образует соли:
РН3 + HI = PH4I йодид фосфония
Фосфиды МеxРy
Являются продуктами взаимодействия фосфора с металлами. Фосфиды щелочных и щелочноземельных Me имеют ионное строение, характерное для солей, но они очень неустойчивы, легко подвергаются необратимому гидролизу с образованием РН3 (см. выше).
examchemistry.com
Получение фосфора | khimie.ru
Получение фосфора.
Фосфор получают в основном восстановлением пентаоксида фосфора Р2О5 углем при высокой температуре:
Р2О5 + 5С = 5СО + 2Р
Отгоняемый фосфор собирают под водой. Для удаления механических примесей его продавливают в расплавленном состоянии через пористые каменные плиты или через мягкую кожу или же перегоняют еще раз из железных реторт. Фосфор обычно поступает в продажу в виде палочек, толщиной в палец, которые хранят под водой.
Исходным продуктом для технического получения фосфора служит трехзамещенный фосфат кальция Са3(РО4)2 (или гидроксилапатит) в форме фосфорита или в форме костяной золы. Трехзамещенгщй фосфат кальция нагревают в смеси с кварцевым песком SiO2 и углем в электрической печи. SiO2 вытесняет Р2О5, которая затем восстанавливается углем:
Са3(РО4)2 + 3SiO2 → 3CaSiO3 + P2O5
P2O5 + 5C → 5CO + 2P
Са3(РО4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
Принцип мотода был предложен уже в 1806 г. Велером. Но так как этот способ требует, высокой температуры (свыше 1300 ºС), то он стал технически осуществимым лишь при использовании электрической печи.
В настоящее время этим способом производят значительные количества фосфора (в Германии до второй мировой войны ежегодно около 20000 т). Большую часть получаемого таким образом фосфора сразу же сжигают до Р2О5, который затем перерабатывают на фосфорные удобрения.
В настоящее время очень редко применяют процесс Пелетье, основные принципы, которого были предложены Шееле. По этому методу костяную золу сначала переводят в однозамещенный фосфат кальция, действуя на нее серной кислотой средней концентрации.
Са3(РО4)2 + 2H2SO4 + 4H2O → 2CaSO4∙2H2O + Ca(H2PO4)2
а затем, тщательно смешав однозамещенный фосфат с древесным углом или с порсшкообразным коксом, его нагревают выше 1000 °С в шамотовых ретортах.
3Са(Н3РО4)2 + 10С = Са3(РО4)2 + 10СО + 4Р + 6Н2О
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru