Плотность платины и ее свойства в интервале от 25°С до температуры плавления
Плотность платины при температуре от 25 до 1769°С
Среди благородных металлов платина занимает особое место. Из сугубо драгоценного металла она превратилась в особенный промышленный материал, который по комплексу своих свойств может служить удобной основой для уникальных композиционных материалов.
По величине плотности платину можно отнести к группе самых тяжелых металлов. Плотность платины при 20°С составляет 21450 кг/м3, то есть выше, чем у таких тугоплавких металлов, как тантал (16600 кг/м3) и вольфрам (19300 кг/м3), и лишь немногим ниже, чем у самого «тяжелого» металла — осмия (22500 кг/м3).
Плотность платины, как и других металлов, зависит от температуры. При ее повышении плотность платины снижается и вблизи от температуры плавления становится равной 20320 кг/м3 (при 2000 К).
Температура плавления платины составляет 1769°С. Жидкая платина имеет еще меньшую плотность, по сравнению с металлом в твердом состоянии. Плотность платины в жидком состоянии при температуре плавления равна 19200 кг/м
| T, K | t, °С | ρ, кг/м3 | T, K | t, °С | ρ, кг/м3 |
|---|---|---|---|---|---|
| 298 | 25 | 21470 | 1000 | 727 | 21020 |
| 400 | 127 | 21410 | 1200 | 927 | 20880 |
| 500 | 227 | 21350 | 1400 | 1127 | 20740 |
| 600 | 327 | 21280 | 1600 | 1327 | 20600 |
| 700 | 427 | 21220 | 1800 | 1527 | 20460 |
| 800 | 527 | 21160 | 2000 | 1727 | 20320 |
| 900 | 627 | 21090 | 2042 | 1769 | 19200 |
Теплофизические свойства платины при различных температурах
Теплофизические свойства платины (удельная теплоемкость, теплопроводность, температуропроводность, удельное электрическое сопротивление) представлены в таблице при различных температурах в интервале от 27 до 1769°С.
Удельная теплоемкость платины при комнатной температуре равна 132,6 Дж/(кг·град). Теплоемкость платины изучена достаточно хорошо — она в сильной мере зависит от чистоты этого драгоценного металла. Следует отметить, что при нагревании удельная теплоемкость платины возрастает. Теплоемкость жидкой платины при температуре плавления составляет 179 Дж/(кг·град).
Теплопроводность платины при 20°С имеет значение 69,7 Вт/(м·град). Это значение близко величине теплопроводности железа и некоторых марок углеродистой стали. С ростом температуры коэффициент теплопроводности платины возрастает и достигает максимума при температуре около 1400 К. При дальнейшем нагреве теплопроводность платины начинает снижаться.
Температуропроводность платины при 300 К равна 25,2·10-6 м2/с. При росте температуры коэффициент температуропроводности платины растет. Эта температурная зависимость имеет слабый максимум в области 1400 К с последующим снижением (подобно кривой теплопроводности).
Удельное электрическое сопротивление платины при 27°С составляет 10,81·10-8 Ом·м. Платина является стандартным термометрическим материалом, и зависимость ее удельного электросопротивления от температуры хорошо изучена — сопротивление платины монотонно увеличивается при нагревании.
| T, K | t, °С | Cp, Дж/(кг·град) | λ, Вт/(м·град) | a·106, м2/c | ρ·108, Ом·м |
|---|---|---|---|---|---|
| 300 | 27 | 132,6 | 71,7 | 25,2 | 10,81 |
| 400 | 127 | 135,8 | 71,8 | 24,7 | 14,6 |
| 500 | 227 | 138,4 | 72,6 | 24,5 | 18,23 |
| 600 | 327 | 141,2 | 73,3 | 24,4 | 21,85 |
| 700 | 427 | 143,8 | 74,5 | 24,4 | 25,28 |
| 800 | 527 | 146,6 | 75,7 | 24,4 | 28,7 |
| 900 | 627 | 148,7 | 77,4 | 24,6 | |
| 1000 | 727 | 151,9 | 79,2 | 24,8 | 35,1 |
| 1200 | 927 | 157,3 | 85,4 | 26 | 40,89 |
| 1400 | 1127 | 162,9 | 89,9 | 26,6 | 46,69 |
| 1600 | 1327 | 168,3 | 89,1 | 25,7 | 51,8 |
| 1800 | 1527 | 173,6 | 86,7 | 24,4 | 56,52 |
| 2000 | 1727 | 179 | 81,5 | 22,2 | — |
| 2042 | 1769 | 178,1 | — | — | — |
Источники:
- Васильева Е. В. и др. Платина, ее сплавы и композиционные материалы. М.: Металлургия, 1980. — 289 с.
- Зиновьев В. Е. Теплофизические свойства металлов при высоких температурах.
thermalinfo.ru
состав, общая информация и какого цвета платина
Очень многие считают, что платина и белое золото это одно и тоже. Но это совсем не так — это самостоятельный и очень дорогой благородный металл. Долгое время она незаслуженно оставалась в тени, но получив широкое распространение — началась платиновая эра.
По теме: состав белого золота
Название «платина» появилось из-за внешнего сходства этого металла с серебром. Серебро происходит от испанского «plata». Поэтому новый металл получил название «platina», что переводится дословно как «серебришко» или же «маленькое серебро».
Платина – это металл серебристо-белого цвета, немного сероватого оттенка. В природе встречается в рудных месторождениях и в самородном состоянии. Это самый прочный из всех драгоценных металлов, имеет очень высокую плотность — 21,45 грамм на куб.см, например плотность золота всего лишь19,3 грамм на куб.см.
Обладает следующими свойствами:
- очень трудно поцарапать;
- высокаякоррозийная устойчивость;
- высокая температура плавления;
- стойко переносит химические реагенты.
Удивительная история
Доказан факт, что еще 3 тысячи лет назад древние египтяне применяли ее для изготовления драгоценностей. Также ее высоко ценили племена инков, но потом история платины разворачивалась очень нехарактерно для такого дорогого благородного металла.
В XVI веке испанские путешественники, которые побывали в Южной Америке, обнаружили очень необычный металл, напоминавший с виду серебро. После проведенных опытов, он оказался очень тугоплавким, из-за чего был признан непригодным. Поэтому в те времена она ценилась в 2 раза дешевле серебра.
Ситуация изменилась, после того как ювелиры обнаружили ее способность сплавляться с золотом. Платину сплавляли с золотом и получали ювелирные украшения с меньшим содержанием золота, что давало выгоду. Обнаружить подделку было невозможно, т.к. платина тяжелее, в отличие от серебра. При смешивании платины с серебром получался металл, соответствующий золоту по плотности. Однако по прошествии длительного времени этот секрет был раскрыт. Король Испании запретил ввоз платины в страну, а все запасы были утоплены в море. Данный указ был отменен только в 1778 году.
В конце XVIII века платина стала широко применяться ювелирами как самостоятельный элемент. Известен факт, что Людовик XVI объявил ее единственным металлом достойным королей.
В 1821 году на Урале были найдены платиновые россыпи. И здесь не обошлось без курьеза: серебристые зёрна местные охотники долго использовали вместо дроби.
В XIX веке 95% от общего количества платины, которая добывалась во всем мире – приходилось на долю Россию. А первые русские платиновые изделия (чайная ложка и кольцо) были преподнесены в дар царю Александру I.

Интересные факты
- Очень редкий металл. Она встречается в 30 раз реже золота.
- Добыча платины очень сложное занятие. Для того, чтобы добыть одну унцию (31,1 грамм), необходимо переработать больше 10 тонн руды. Для сравнения, чтобы получить унцию золота нужно всего лишь 3 тонны руды.
- На данный момент стоимость одной унции дороже на 270$ унции золота. Было время когда разница в стоимости достигала 1000 $.
- В производстве ювелирных драгоценностей платина в отличие от золота применяется в практически чистом виде.
- Обручальное кольцо из платины будет ощущаться гораздо более массивнымпо сравнению с золотым при одинаковом размере.
- На вопрос, какого цвета платина? Существует распространенный ответ: как белое золото. К сожалению, многие люди считают платину синонимом белого золота. Но это абсолютно не так. Золото – это не самостоятельный металл, а сплав золота с небольшим количеством белых металлов, например с серебром, палладием или даже с самой платиной.
- За всю свою историю она никогда не использовалась в форме денег. Некоторые монетные дома все-таки производили монеты из платины, но они были созданы специально для коллекционеров и никогда не использовались в обиходе.
- По последним данным мировой спрос на платину значительно превышает предложение.
- В настоящее время крупнейшим добытчиком платины является ЮАР
Применение платины
У многих людей платина ассоциируется только с ювелирными изделиями. Но кроме широкого использования в ювелирной промышленности они имеет и другие варианты использования.
В медицине для больных стенокардией применяются платино-иридиевые электроды поддерживающие сердечную деятельность пациентов. В онкологии для уменьшения опухолей применяется специальный комплекс платины. В отличие от других металлов, благодаря своей чистоте, не содержит аллергенных примесей и тем самым не раздражает кожу.
Изготовление эталонов в России невозможно без платины. Например, эталон килограмма — это платино-иридиевый цилиндр, высота и диаметр которого равны 39 мм. Он был изготовлен в 1883 г и хранитсяв Санкт-Петербурге. В повседневной жизни используется в зеркалах. Зеркало с платиновым покрытием с теневой стороны прозрачное, а с освещенной отражает как обыкновенное зеркало.Подобные зеркала в основном используются в казино и в полиции для скрытого наблюдения.
www.jeland.ru
обозначение, основные свойства и где содержится
 Среди всех благородных металлов платина занимает особое место и ее стоимость выше в сравнении с золотом и серебром. Дело в том, что добыча этого вещества является довольно трудоемким процессом, да и встречается оно нечасто. Более высокая стоимость Platinum объясняется хотя бы тем фактом, что для получения одной унции приходится обработать около 10 тонн породы. В свою очередь, для создания аналогичного количества золота затрачивается порядка 3 т руды.
Среди всех благородных металлов платина занимает особое место и ее стоимость выше в сравнении с золотом и серебром. Дело в том, что добыча этого вещества является довольно трудоемким процессом, да и встречается оно нечасто. Более высокая стоимость Platinum объясняется хотя бы тем фактом, что для получения одной унции приходится обработать около 10 тонн породы. В свою очередь, для создания аналогичного количества золота затрачивается порядка 3 т руды.
Еще до нашей эры люди знали о металле платина, например, древние египтяне применяли его для изготовления украшений. Достаточно широко он использовался и индейцами племени инков, но постепенно был подзабыт. Новейшая история добычи и обработки платины берет начало в период освоения Америки испанскими конкистадорами.
Однако должного внимание металлу первое время не уделялось, о чем свидетельствует даже его название — в переводе с испанского слово оно означает «маленькое серебро». Часто оно вовсе считалось несозревшим золотом и выбрасывалась. Это довольно тугоплавкий металл, обладающий высоким показателем плотности, что существенно затрудняло его обработку.
 Но после обнаружения одной уникальной способности ситуация изменилась — платина и золото легко сплавляются. Первыми этой особенностью воспользовались ювелиры, начав добавлять ее в золото: изготовленные из нового сплава украшения отличались более низкой стоимостью. При этом высокая плотность металла способствовала увеличению веса готового изделия, но это с лихвой компенсировалось добавлением серебра, что никак не влияло на оттенок.
Но после обнаружения одной уникальной способности ситуация изменилась — платина и золото легко сплавляются. Первыми этой особенностью воспользовались ювелиры, начав добавлять ее в золото: изготовленные из нового сплава украшения отличались более низкой стоимостью. При этом высокая плотность металла способствовала увеличению веса готового изделия, но это с лихвой компенсировалось добавлением серебра, что никак не влияло на оттенок.
Также рекомендуем прочитать:
Длительное время отличить такие украшения от обычных не удавалось. Когда это все же произошло, то в Европу некоторое время даже запретили ввоз платины. Самостоятельным химическим элементом Platinum была признана лишь в XVIII столетии, когда ученые смогли тщательно изучить свойства металла.
Первые месторождения платины на территории России были обнаружены близ Екатеринбурга в 1819 году. Спустя пять лет новые залежи нашли в Нижнетагильском округе и они быть столь обширны, что Россия в короткие сроки заняла лидирующее положение по добыче металла.
Физические и химические свойства
Мнение о том, что платина представляет собой белое золото, все еще встречается среди обывателей. На самом же деле это самостоятельный химический элемент, обладающий уникальными свойствами. Сначала о том, как обозначается платина — Platinum или Pt. В таблице химических элементов Менделеева это один из самых тяжелых металлов. Уступил пальму первенства он лишь осмию и иридию, которые также принадлежат к веществам платиновой группы.

Среди свойств металла стоит отметить наиболее уникальные:
- При нагреве до температуры ниже 200 градусов не подвержен окислению и не вступает в химическое взаимодействие с другими веществами.
- Показатели твердости и плотности выше в сравнении с золотом и тем более серебром.
- Отличается высокой пластичностью и хорошо поддается ковке.
- Обладает отличной электропроводимостью.
- Не взаимодействует с кислотами, кроме царской водки.
- Имеет высокую температуру плавления, равную 1768,3 градуса.
Металл в чистом виде практически не встречается в природе и если говорить о том, из чего состоит платина, то чаще всего это сплавы с родием, палладием, железом, иридием и некоторыми другими веществами.
Скорость окисления зависит от давления кислорода и скорости его поступления к поверхности металла. Так как чаще всего он добывается в виде сплавов, то наличие в них других веществ замедляет этот процесс.
Наиболее распространенными оксидами являются:
 PtO — вещество имеет темно-серый оттенок.
PtO — вещество имеет темно-серый оттенок.- PtO2 — оксид коричневого цвета.
- PtO3 — красно-коричневое вещество.
Удельное сопротивление платины сравнительно мало, но по показателю проводимости электрического тока она уступает алюминию, серебру, а также меди. При этом во время нагрева показатель удельного сопротивления возрастает, а удельной проводимости соответственно снижается. Ученые объясняют этот факт тем, что при увеличении температуры частицы, входящие в состав платины, начинают двигаться хаотично и в результате затрудняется прохождение тока.
В промышленности активно используется способность платины ускорять различные химические реакции, что делает ее отличным катализатором.
Область применения
В медицине соединения металла, в основном амминопластинаты, используются при лечении различных форм онкологических недугов. Первым таким препаратом стал циспластин, но в настоящее время наибольшую популярность имеют оксалиплатин и карбоплатин. Использование металла в технике существенно шире. Если говорить о том, где содержится платина, то можно отметить основные направления:
- Особые виды зеркал для лазерной техники.
- Лабораторную посуду, отличающуюся высокой химической стойкостью.
- Гальванопокрытия.
- В химической отрасли применяется в роли катализатора.
- Нагревательные элементы печей.
Примерно с середины XVIII века в России платина выполняла монетарную функцию. Именно в Российской Империи были изготовлены первые платиновые монеты, а произошло это в 1828 году. В настоящее время некоторые государства продолжают чеканить монеты различного достоинства, но чаще всего используются они для инвестирования. Также следует сказать и о ювелирной промышленности, которая ежегодно потребляет порядка 50 тонн металла. Наибольшей популярностью украшения из платины пользуются в Японии.
kamen.guru
какая температура плавления, плотность и как выглядит?
Платина относится к благородным металлам. Химики называют ее царицей платиноидов, т.е. самым ценным из благородных металлов. Платина – химический элемент под номером 78, один из самых тяжелых металлов (плотность платины составляет приблизительно 21 г/см³), обладающий высокой пластичностью и большой химической устойчивостью.
Высокая инертность платины, а также ее способность служить в качестве электропроводника и катализатора химических реакций сделали этот металл ценным сырьем для множества отраслей деятельности – ее применяют для изготовления технических устройств, в медицинской практике, и, конечно, в ювелирном деле.
Что такое платина?
Элемент платина (Pt) имеет молярную массу, равную 195 г/моль при радиусе атома в 139 пм. Металл плавится при температуре 1768,3 °C, а начинает закипать при 3825 °C. Химический элемент платина может принимать различные степени окисления (валентности) – чаще всего это значения +2, +4, +6. Реже (в реакциях с катализаторами или особыми условиями) платина принимает валентности +1 и +3. Малая инертность и высокая плотность металла делают его трудно поддающимся окислению, коррозии и различного рода повреждениям.
 Добыча платины – относительно молодая отрасль. Если ценность золота была известна людям с древних времен, то неказистые слитки платины в природном варианте никого не интересовали. Добывали этот металл до XVIII века в основном в Америке, где его стоимость была даже ниже, чем у серебра. В Старом Свете какое-то время добыча платины была даже под запретом, т.к. этот металл при сплавлении с золотом, позволял подпольным ювелирам отливать поддельные монеты, неотличимые по весу от настоящих.
Добыча платины – относительно молодая отрасль. Если ценность золота была известна людям с древних времен, то неказистые слитки платины в природном варианте никого не интересовали. Добывали этот металл до XVIII века в основном в Америке, где его стоимость была даже ниже, чем у серебра. В Старом Свете какое-то время добыча платины была даже под запретом, т.к. этот металл при сплавлении с золотом, позволял подпольным ювелирам отливать поддельные монеты, неотличимые по весу от настоящих.
На сегодняшний день добыча платины широко распространена, и лидерами в этой отрасти являются ЮАР, Россия и Зимбабве. Большие запасы также обнаружены в США и Канаде. Добыча платины в России ведется такими компаниями, как «Норильский никель», «Амур» и другими крупными промышленными предприятиями.
Многим наверняка известно широкое применение платины для изготовления украшений, а также высокая стоимость таких изделий относительно золота. Но как выглядит платина и чем она отличается от других благородных металлов? Цвет платины такой же белый и блестящий, как у серебра. Однако при сравнении серебряного и платинового слитков можно заметить, что блеск платины гораздо более сдержанный и приглушенный, а в цвете прослеживается сероватый подтон.
 В России, платина использовалась для чеканки монет, которые находились в обороте в середине XIX века. Однако довольно скоро выпуск таких монет прекратился и неиспользованные запасы платины были проданы Англии, которая, никогда не добывая этого металла, в один момент заняла место монополиста по его обработке и продаже. Сейчас платиновые монеты выпускаются в различных странах банками, и такие изделия являются инвестиционными, т.е. не включены в оборот.
В России, платина использовалась для чеканки монет, которые находились в обороте в середине XIX века. Однако довольно скоро выпуск таких монет прекратился и неиспользованные запасы платины были проданы Англии, которая, никогда не добывая этого металла, в один момент заняла место монополиста по его обработке и продаже. Сейчас платиновые монеты выпускаются в различных странах банками, и такие изделия являются инвестиционными, т.е. не включены в оборот.
Платина или белое золото?
Нередко в обиходе путаются понятия «платина» и «белое золото». Многие считают, что белым золотом и называют платину, однако это неверно. Так что такое белое золото и чем оно отличается? Мы выяснили, что платина – это самостоятельный металл, существующий в природе в виде слитков и обладающий собственными уникальными свойствами.
 Белое золото же – это сплав обычного золота с другими металлами. Состав сплава может меняться, однако главным образом такая смесь металлов содержит в себе более половины чистого золота, серебро, медь и родий. Может туда добавляться и платина, т.к. она отлично сплавляется с золотом.
Белое золото же – это сплав обычного золота с другими металлами. Состав сплава может меняться, однако главным образом такая смесь металлов содержит в себе более половины чистого золота, серебро, медь и родий. Может туда добавляться и платина, т.к. она отлично сплавляется с золотом.
Внешне платина и белое золото действительно похожи. Если на белое золото был нанесен слой родия, то цвет сплава может быть и неотличим от платины. Но иногда в нем проглядывается желтоватый оттенок, который и выдает различие.
Также платина обычно имеет более приглушенный блеск, однако это не всегда можно различить на первый взгляд.
Отличить платину от золота можно несколькими способами:
- Чтобы различить платину и белое золото, следует сравнить изделия по весу. При одинаковом объеме платина будет тяжелее драгоценного сплава из-за своей высокой плотности. Также, по ощущениям, украшения всегда будут несколько массивнее, чем на вид. Проверить свои предположения можно, измерив объем украшения при помощи погружения в воду, и затем измерив их вес. Полученная плотность и подскажет результаты проверки.
-
Также можно капнуть на изделие йодом. Лучше проводить эту манипуляцию на скрытой, внутренней стороне украшения, чтобы ненароком не испортить.
 Если оставить каплю на платиновом изделии, а затем стереть, то на украшении не должно остаться следов. Правда, этот метод может не сработать при сравнении с родированными украшениями, т.к. родий также не реагирует с йодом.
Если оставить каплю на платиновом изделии, а затем стереть, то на украшении не должно остаться следов. Правда, этот метод может не сработать при сравнении с родированными украшениями, т.к. родий также не реагирует с йодом. - Еще можно проверить украшения при помощи аммиака. При воздействии этого химического вещества практически все драгоценные металлы чернеют, но не платина. Из-за своей низкой инертности она не вступает в реакцию с аммиаком и на ней не должно оставаться следов от его воздействия.
- Можно проверить украшение и при помощи нагрева. При нагревании нельзя добиться той температуры, при которой платина начала бы деформироваться. Украшение также не должно поменять свой цвет, в отличие от золота, которое при нагреве играет красными отблесками. Однако этот эксперимент также достаточно расплывчат в плане полученных результатов. Лучше всего при наличии сомнений в подлинности состава украшения отнести его к ювелиру, где тот произведет оценку.
Как ухаживать за украшениями из платины?
По сравнению с белым золотом, платина обладает некоторыми преимуществами. Как уже упоминалось, она трудно плавится, практически не царапается, не реагирует с агрессивными растворами, почти не тускнеет, и, помимо прочего, гипоаллергенна. Платиновые украшения долговечны и практичны при ежедневной носке. Именно платине отдают предпочтение при создании фамильных ценностей и выборе обручальных колец.
 Несмотря на то, что платина обладает рядом преимуществ, к ней все же стоит относиться аккуратно, как и к другим ювелирным украшениям, для поддержания внешнего вида. Прежде всего, следует хранить платиновые украшения отдельно, т.к. из-за их высокой плотности они могут оцарапать или повредить другие металлы.
Несмотря на то, что платина обладает рядом преимуществ, к ней все же стоит относиться аккуратно, как и к другим ювелирным украшениям, для поддержания внешнего вида. Прежде всего, следует хранить платиновые украшения отдельно, т.к. из-за их высокой плотности они могут оцарапать или повредить другие металлы.
Платиновые украшения подходят для ежедневной носки, однако их все равно нужно время от времени чистить, чтобы в них не скапливалась грязь и бактерии. Производите чистку при помощи концентрированного мыльного раствора. Украшение можно оставить в нем на несколько часов или даже на ночь, а затем вынуть и протереть мягкой ветошью.
Не используйте жестких щеток для чистки и сильных отбеливателей – это может изменить цвет металла и опасно для драгоценных камней в изделии.
Раз или два в год украшения нужно отдавать на чистку в ювелирную мастерскую, т.к. в деталях изделия (в гравировке или декоративных украшениях) может скапливаться грязь. Чистка проводится специальными ультразвуковыми приборами, так что украшение не повредится.
 В заключение следует отметить, что, несмотря на дороговизну и редкость платины, украшения из нее обладают даже большими преимуществами, чем украшения из традиционных материалов – золота и серебра. Кольца из платины могут служить хоть целую вечность при осторожном обращении. Кроме того, платина незаменима при обрамлении драгоценных камней прозрачных, нейтральных и холодных оттенков – их цвета заиграют всеми оттенками в благородной белой оправе.
В заключение следует отметить, что, несмотря на дороговизну и редкость платины, украшения из нее обладают даже большими преимуществами, чем украшения из традиционных материалов – золота и серебра. Кольца из платины могут служить хоть целую вечность при осторожном обращении. Кроме того, платина незаменима при обрамлении драгоценных камней прозрачных, нейтральных и холодных оттенков – их цвета заиграют всеми оттенками в благородной белой оправе.
gems-and-jewels.ru
Физические и химические свойства платины
 Платина является блестящим серебристо-белым металлом. Она относится к 10 группе элементов периодической системы Д.И. Менделеева.
Платина является блестящим серебристо-белым металлом. Она относится к 10 группе элементов периодической системы Д.И. Менделеева.
Драгоценный металл платина и его физические свойства
Мы объединили в специальную таблицу все основные характеристики, определяющие физические свойства платины. Чтобы было удобнее сравнивать, мы добавили в таблицу также ключевые свойства золота, серебра и металлов платиновой группы.
«Платиновые» плотность и твёрдость
Платина обладает большой плотностью и является одним из самых тяжелых драгоценных металлов, уступая лишь осмию и иридию. Изделия из платины немного тяжелее золотых и более чем в два раза тяжелее серебряных изделий такого же объёма.
Что касается твёрдости как еще одного важного свойстве этого драгоценного металла, платина тверже и устойчивее к механическим воздействиям, чем золото и серебро. Именно поэтому для изготовления ювелирных украшений может использоваться практически чистая платина, в то время как в золотые и серебряные сплавы для придания прочности добавляется значительное количество легирующих материалов.
Насколько легко расплавить платину?
Долгое время люди не могли использовать платину по причине ее высокой температуры плавления. Первым, кому удалось получить расплав платины, был величайший французский ученый Антуан Лавуазье. В апреле 1782 года, применив сконструированный им аппарат для подачи горящего кислорода, Лавуазье расплавил крошечный кусочек платины, помещенный в древесный уголь. Это событие поразило ученый мир. Вскоре опыт был повторен на специальном заседании Академии наук в Париже. Именно туда, несмотря на большие сложности и денежные затраты, был перевезен аппарат Лавуазье.
При этом историческом событии присутствовали Бенджамин Франклин, живший в то время в Париже как представитель революционного правительства Соединенных Штатов, и некий граф ду Норд. Под этим вымышленным именем скрывался… сын Екатерины Великой, будущий российский царь Павел I, который путешествовал инкогнито. На следующий день после опыта, Франклин писал своему другу Джозефу Пристли (которого сейчас считают основоположником современной химии):
«Вчера граф ду Норд был в Академии наук, когда демонстрировались различные эксперименты для его увеселения: один из них проводил месье Лавуазье, показывая, что самое сильное пламя получается в древесном угле, на который направлена струя дефлогистицированного воздуха. При температуре, полученной таким образом, он расплавил платину в огне, который был во много раз мощнее, чем огонь, полученный от самого сильного зажигательного зеркала».

Заключительный абзац письма от Бенджамина Франклина, написанного 7 июня 1782 года, на следующий день после эффектной демонстрации плавки платины.
Другие физические свойства платины
Платина отличается хорошей ковкостью, пластичностью, высокой прочностью на разрыв. Обладает относительно низкой тепло- и электропроводимостью, и одним из самых низких коэффициентов расширения среди металлов.
При нагревании до красного каления активно испаряется.
Драгоценный металл платина: химические свойства
Платина относится к благородным металлам – она не окисляется и не подвержена коррозии. Является одним из самых инертных металлов, не взаимодействует с какими-либо органическими и минеральными кислотами, щелочами. В обычных условиях растворяется только в «царской водке» (смеси концентрированных азотной и соляной кислот) и в жидком броме. Медленно растворяется в горячей серной кислоте.
При нагревании способность платины к взаимодействию с другими веществами значительно увеличивается.
Важнейшим химическим свойством платины (и металлов платиновой группы) является способность выступать в качестве катализатора реакций.
ВСЕ ЮВЕЛИРНЫЕ МЕТАЛЛЫ: КАТАЛОГ | ЮВЕЛИРНЫЕ МЕТАЛЛЫ — СПРАВОЧНИК
Все о платине | Все о золоте | Все о серебре | Палладий
Платиновые сплавы и их пробы | Почему изделия из платины дороже золотых? | Применение платины — ювелирное и промышленное | Как определить платина или нет?
Поделитесь статьей с друзьями
Работы дизайнеров из каталога ЮВЕЛИРУМ
juvelirum.ru
Платина: свойства, применение и инвестиции
Платина тяжелый, тугоплавкий драгоценный металл серебристо — белого цвета, плотность 21,45 г/см3, температура плавления 1773,5 °C, температура кипения — 4410 °C. По твердости превосходит золото и серебро. Обозначается символом Pt. Название происходит от испанского слова plata – «cеребро»; platina – уменьшительная форма, буквально «маленькое серебро» или «серебришко».
Платина легко поддается обработке давлением (ковке, прокатке, волочению). Отличается повышенной химической стойкостью: растворяется только в горячей «царской водке», цианистом калии и расплавленных щелочах. В отдельности ни одна из кислот на этот металл не воздействует. Платина не окисляется на воздухе даже при сильном накаливании, а при остывании сохраняет свой естественный цвет.
Платина один из наиболее редких элементов, ее средняя концентрация в земной коре 5• 10 -7 % по массе. Встречается в самородном виде, в виде сплавов и соединений. До XVIII века в Европе платина была неизвестна. В 1748 году испанский математик и мореплаватель А. де Ульоа первым привез на европейский континент образцы самородной платины, найденной в Перу. Итальянский химик Джилиус Скалигер в 1735 году открыл неразложимость платины и таким образом доказал, что она является независимым химическим элементом. Впервые в чистом виде из руд платина была получена английским химиком У. Волластоном в 1803 году.
СВОЙСТВА ПЛАТИНЫ
Физические свойства платины. Кристаллизуется в гранецентрированные кубические решетки. При воздействии на растворы солей восстановителями металл может быть получен в виде “черни”, обладающей высокой дисперсностью.
Платина способна абсорбировать на поверхности некоторые газы, особенно водород и кислород. Склонность к абсорбции значительно возрастает у металла, находящегося в тонкодисперсном и коллоидном состоянии. Сильно поглощает кислород платиновая чернь: 100 объемов кислорода на один объем платиновой черни.
Характеристика платины:
— цвет серовато — белый, блестящий;
— радиус атома, нм 0.138;
— параметры кристаллической решетки при 20 °С, нм а = 0.392;
— плотность при 20 °С, кг/дм3 21.45;
— температура плавления, °С 1773,5;
— температура кипения, °С 4410;
— удельная теплоемкость, Дж/(моль/К) 25.9;
— теплопроводность при 25 °С, Вт/(м•К) 74.1;
— удельное электросопротивление при 0 °С, мкОм•см 9.85;
— твердость по Бринеллю, МПа 390 — 420;
— модуль упругости, ГПа 173.
Химические свойства платины. Полноценно реагирует только с горячей царской водкой:
3Pt + 4HNO3 + 18HCl = 3H2 [PtCl6] + 4NO + 8H2O.
Крайне медленно протекает растворение ее в нагретой до определенной температуры серной кислоте и в броме.
При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов):
Pt + 2Cl2 + 2NaCl = Na2 [PtCl6].
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: черный PtO, коричневый PtO2, красновато-коричневый PtO3, Pt2O3 и Pt3O4.
Металлическая платина токсического действия на организм человека не оказывает, однако, примеси, содержащиеся в платиновой черни (в первую очередь, теллур), ядовиты и при попадании в желудочно-кишечный тракт возникают: некрозы участков слизистой ЖКТ, зернистая дистрофия гепатоцитов, набухание эпителия извитых канальцев почки, а также “общая интоксикация”.
Целебные свойства платины. Наночастицы металла способны беспрепятственно проникать непосредственно в клетки тела и положительно воздействовать на процессы жизнедеятельности. Наиглавнейшей функцией платины по праву считается уничтожение свободных радикалов, замедляя, таким образом, процесс преждевременного старения. Платина также входит в состав некоторых препаратов, применяющихся для лечения онкологических заболеваний.
Магические свойства платины. По своим магическим свойствам это металл светлый и чистый, не несущий в себе никакого зла, не хранящий, в отличие от золота, негативную память. Платина имеет четкую связь с космосом. Миссия платины – нести людям добро и мудрость, озарение души и просветление ума. Изделие из платины следует сделать своим талисманом медперсоналу, а также людям тех профессий, где центральное место занимает проявление чуткости к окружающим. Украшения из редкого металла способны увеличить во сто крат всё то позитивное, что есть в человеке, а отрицательное нейтрализовать. Они обострят интуицию, укажут своему хозяину правильный путь и защитят от негативных внешних влияний, разрушающих его энергетическую оболочку.
ИСТОРИЯ ПЛАТИНЫ В РОССИИ
В России платина была впервые найдена на Урале, в Верх-Исетском округе, в 1819 году. При промывке золотоносных пород в золоте заметили белые блестящие зерна, которые не растворялись даже в самых сильных кислотах.
В 1823 году В.В. Любарский, Берг-пробирер лаборатории Петербургского горного корпуса, исследовал эти зерна и установил, что загадочный «сибирский металл принадлежит к особому роду сырой платины, содержащей знатное количество иридия и осмия».
В 1824 году на Урале были открыты чисто платиновые россыпи. Эти месторождения были исключительно богаты и сразу же вывели Россию на первое место в мире по добыче платины.
В 1826 году, выдающийся инженер своего времени, П.Г. Соболевский вместе с В.В. Любарским разработал простой и надежный способ получения ковкой платины.
21 марта 1827 года в конференц-зале Петербургского горного кадетского корпуса на многолюдном торжественном собрании Ученого комитета по горной и соляной части были показаны изготовленные новым методом первые изделия из русской платины – проволока, чаши, тигли, медали, слиток весом в 6 фунтов.
С 1828 года в России стали выпускать платиновые монеты 3-, 6- и 12-рублевого достоинства.
В 1843 году добыли уже 3500 кг платины. Это сказалось на цене, платина стала дешевле.
1845 году по специальному указу, из-за боязни подделки и ввоза платиновых монет из-за границы, вся платиновая монета в шестимесячный срок была изъята из обращения.
В 1867 году царский указ упразднил государственную монополию на платину и разрешил беспошлинный вывоз ее за границу. Воспользовавшись благоприятной конъюнктурой, Англия скупила все запасы этого металла – более 16 тонн.
Перед первой мировой войной добыча платины в России составляла 90…95% от мировой добычи.
В мае 1918 года был создан Институт по изучению платины, влившийся позже в Институт общей и неорганической химии АН СССР, носящий ныне имя академика Н.С. Курнакова.
Добыча платины
Чистая платина в природе встречается очень редко. Основная форма нахождения ее в руде — это собственные минералы, которых известно около 90. Минерал поликсен содержит 80…88% Pt и 9…10% Fe; купроплатина – 65…73% Pt, 12…17% Fe и 7,7…14% Cu; в никелистую платину входят также железо, медь и никель. Известны природные сплавы платины только с палладием или только с иридием. Есть еще и немногочисленные минералы – соединения платины с серой, мышьяком, сурьмой.
Промышленное использование технически возможно и экономически целесообразно, если руды содержат платиновые металлы:
— в коренных собственно месторождениях от 2 — 5 г/т до единиц кг/т;
— в коренных комплексных — от десятых долей до сотен (изредка тысяч) г/т;
— в россыпных месторождениях — от десятков мг/м3 до сотен г/м3.
Значительные скопления руды в виде месторождений встречаются очень редко.
Добыча руды ведется открытым и подземным способами. Открытым способом разрабатывается большинство россыпных и часть коренных месторождений. Подземный способ добычи является основным при разработке коренных месторождений; иногда он используется для отработки богатых погребенных россыпей.
После мокрого обогащения руды получают шлих «сырой» — концентрат с 70 — 90% минералов металлов. Такой концентрат отправляется на аффинаж. Обогащение комплексных сульфидных руд осуществляется флотацией с последующей многооперационной пирометаллургической, электрохимической переработкой.
Основная часть месторождений платины (более 90 %) заключена в недрах пяти стран. К ним относятся ЮАР, США, Россия, Зимбабве, Китай.
В 2008 году в мире было добыто 200 тонн платины. Лидерами добычи были: ЮАР — 153,0 тонны, Россия — 25,0 тонн, Канада — 7,2 тонны, Зимбабве — 5,6 тонны, США — 3,7 тонны, Колумбия — 1,7 тонны.
Лидером добычи платины в России является ГМК «Норильский никель». Самые крупные самородки платины, демонстрируемые на выставке Алмазного фонда СССР, весят 5918,4 и 7860,5 грамм.
Разведанные мировые запасы металлов платиновой группы составляют около 80 000 тонн и распределены, в основном, между ЮАР (87,5 %), Россией (8,3 %) и США (2,5 %).
Производство платины
С приисков сырая платина поступает на аффинажный завод. Здесь ее подвергают длительному нагреву в фарфоровых котлах с царской водкой. В результате почти вся платина и палладий, частично родий, иридий, рутений и основная масса неблагородных металлов переходят в раствор.
Платина в растворе находится в виде двух комплексов:
H2[PtCl6] – большая часть и
(NO)2[PtCl6].
Добавляя в раствор HCl, разрушают комплекс (NO)2[PtCl6], чтобы вся платина превратилась в комплекс H2 [PtCl6].
Далее присутствующие в растворе иридий, палладий, родий переводят в соединения, не осаждаемые хлористым аммонием, а затем раствор «доводят», прогревая его с кислотами (серной или щавелевой) или (по способу Черняева) с раствором сахара.
Теперь можно вводить нашатырь и осаждать платину в виде хлорплатината аммония. Раствор хлористого аммония вводят на холоду. При этом основная часть платины в виде мелких ярко — желтых кристаллов (NH4)2 [PtCl6] выпадает в осадок. Осадок дополнительно очищают раствором нашатыря и сушат. Сухой осадок помещают в печь. После нескольких часов прокаливания при 800…1000°C получают губчатую платину в виде спекшегося порошка серо — стального цвета.
Полученную губку измельчают и еще раз промывают соляной кислотой и водой. Затем ее плавят в кислородно — водородном пламени или в высокочастотной печи. Так получают платиновые слитки.
Когда платину добывают из сульфидных медно-никелевых руд, в которых ее содержание не превышает нескольких граммов на тонну руды, источником платины и ее аналогов служат шламы цехов электролиза меди и никеля. Шламы обогащают обжигом, вторичным электролизом и другими способами. В полученных концентратах содержание платины и ее извечных спутников – платиноидов – достигает 60%, и их можно извлекать из концентратов тем же путем, что и из сырой платины.
ПРИМЕНЕНИЕ ПЛАТИНЫ
За последние 20…25 лет спрос на платину увеличился в несколько раз и продолжает расти. До второй мировой войны более 50% платины использовалось в ювелирном деле. Сейчас около 90% потребляемой платины используется в промышленности и науке. Растет применение платины и в медицине.
Кислотостойкость, термостойкость и постоянство свойств при прокаливании, сделали платину совершенно незаменимой в производстве лабораторного оборудования. Из платины делают: тигли, чашки, стаканы, ложечки, лопатки, шпатели, наконечники, фильтры, электроды. Платиновой посудой пользуются при особо точных и ответственных аналитических операциях.
Применение платины в технике
Важнейшими областями применения платины стали химическая и нефтеперерабатывающая промышленность. В качестве катализаторов различных реакций сейчас используется около половины всей потребляемой платины.
Платина – лучший катализатор реакции окисления аммиака до окиси азота NO в одном из главных процессов производства азотной кислоты.
Платиновые катализаторы используют при синтезе витаминов и некоторых фармацевтических препаратов.
Платиновые катализаторы ускоряют многие другие практически важные реакции: гидрирование жиров, циклических и ароматических углеводородов, олефинов, альдегидов, ацетилена, кетонов, окисление SO2 в SO3 в сернокислотном производстве.
С помощью платиновых катализаторов на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти.
Автомобильная промышленность использует каталитические свойства этого металла – для дожигания и обезвреживания выхлопных газов.
Платина незаменима для современной электротехники, автоматики и телемеханики, радиотехники и точного приборостроения. Из нее делают электроды топливных элементов.
Из сплава платины с родием делают фильеры для производства стеклянного волокна.
Платина и ее сплавы в химическом машиностроении служат превосходным коррозионностойким материалом. Аппаратура для получения многих особо чистых веществ и различных фторсодержащих соединений изнутри покрыта платиной, а иногда и целиком сделана из нее.
Платина и ее сплавы также применяются для изготовления:
— специальных зеркал для лазерной техники;
— нагревательных элементов печей сопротивления;
— анодных штанг для защиты от коррозии корпусов подводных лодок;
— нерастворимых анодов в гальванотехнике;
— гальванические покрытия;
— постоянных магнитов с высокой коэрцитивной силой и остаточной намагниченностью (сплав платина — кобальт ПлК-78).
— электродов для получения перхлоратов, перборатов, перкарбонатов, пероксодвусерной кислоты (фактически, использование платины обуславливает все мировое производство перекиси водорода).
Применение платины в медицине
Незначительная часть платины идет в медицинскую промышленность. Из платины и ее сплавов изготавливают хирургические инструменты, которые, не окисляясь, стерилизуются в пламени спиртовой горелки. Сплавы платины с палладием, серебром, медью, цинком, никелем служат отличным материалом для зубных протезов.
Инертность платины к любым соединениям, ее электропроводимость и неаллергенность позволяют активно использовать ее в биомедицине как компонент электростимуляторов, катетеров и другого медицинского оборудования.
Определенные платиновые комплексы используются в химиотерапии и показывают хорошую деятельность антиопухоли для небольшого количества опухолей.
Применение платины в ювелирнрм деле
Ежегодно мировая ювелирная промышленность потребляет около 50 тонн платины. Большинство платиновых ювелирных предметов торговли содержат 95% чистой платины. В ней минимум примесей, поэтому она настолько чистая, что не тускнеет, не меняет цвет и сохраняет блеск на долгие годы.
Яркий блеск платины лучше всего отражает истинное сияние бриллиантов, является прекрасной оправой для драгоценных камней и сочетается с натуральными желтыми оттенками золота. Благодаря чистоте она не раздражает кожу, так как в отличие от некоторых других металлов не содержит аллергенных примесей.
Самой важной чертой платины является прочность. Ювелирные изделия из серебра и золота могут износиться, и их придется отдавать в ремонт, чтобы заменить износившуюся часть новым металлом. Изделия из платины не изнашиваются, они практически неподвластны времени.
ИНВЕСТИЦИИ В ПЛАТИНУ
Редкость платины и высокий спрос на нее делают этот металл привлекательным для инвестирования. Инвестиции в платину – мощный финансовый инструмент, который при умелом использовании может существенно увеличить Ваш капитал. Это дорогой статусный металл, который при этом широко используется в промышленности. Именно нарастающая потребность в платине – основная причина уверенного роста цен на нее.
Платина является биржевым товаром: она торгуется на Лондонской бирже металлов и Нью-Йоркской фондовой бирже. Помимо платины с немедленной поставкой, существуют фьючерсные контракты. Цены указываются в тройских унциях.
Платина с точки зрения инвестирования представляет собой определенную альтернативу сбережениям средств в той или иной валюте. В России инвестирование в драгоценные металлы, в т. ч. в платину, своим клиентам предлагает целый ряд банков — Сбербанк, НОМОС-Банк, СМП Банк и др. Возможно совершение операций с физическими слитками и с использованием обезличенных металлических счетов. Для осуществления таких операций для своих клиентов банкам по российскому законодательству требуется особая лицензия.
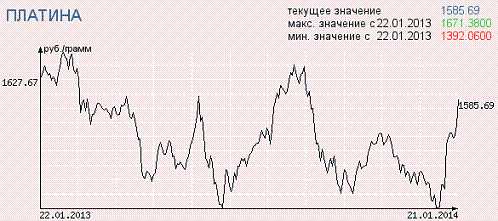
График изменения цены на платину в течении 2013 года. Цена на платину в рублях за грамм рассчитывается Центральным банком России ежедневно.
Открытие обезличенных металлических счетов (ОМС).
ОМС может быть открыт как путём внесения на этот счёт физического металла (слитков), так и путём приобретения у банка обезличенного металла за наличные рубли или путём списания средств с текущего счёта или счёта по вкладу. Исходя из срока функционирования ОМС, различают текущие и депозитные счета.
ОМС до востребования (текущие). Доход формируется исходя из роста курсовой стоимости драгоценного металла на счете. Вкладчик может как снимать средства, так и пополнять счет. При таком варианте у него есть возможность маневрировать и управлять своим доходом, но это требует определенных аналитических навыков.
ОМС срочные (депозитные). Срок хранения сбережений на депозитном ОМС фиксирован, он оговаривается при открытии счета и варьируется у различных банков. Доход формируется за счет процентов, которые начисляются в граммах драгметалла и динамики котировок драгоценных металлов на мировых рынках за этот период. Может получиться так, что в срок истечения договора цены на рынке изменятся в неблагоприятную сторону, и это может принести Вам убытки.
Банки взыскивают с клиентов комиссионные вознаграждения за отдельные операции по счету, а именно:
— за зачисление драгоценного металла на счет при физической поставке слитков;
— за выдачу драгоценного металла с обезличенного металлического счета в физической форме;
— доход, полученный от изменений котировок драгметалла, облагается НДФЛ по ставке 13%, ответственность по декларированию и уплате налога ложиться на инвестора.
Самым серьезным недостатком данного инструмента инвестирования и в то же время большим риском для инвестора является отсутствие обязательного страхования ОМС. Этот факт требует особо тщательно выбирать банк для ведения ОМС.
Покупка драгоценных монет.
Налоговое законодательство РФ причисляет платиновые монеты РФ и СССР к памятным, поэтому при покупке этих монет необходимо заплатить НДС, который составит 18 % от стоимости монеты. Доход от вложений в драгоценные монеты исчисляется как разница между ценой первоначальной покупки монет у банка и ценой их последующей продажи банку.
В Советском Союзе выпуск памятных юбилейных монет из платины производился в период с 1977 по 1991 годы. В России платиновые монеты выпускались с 1992 по 1996 год. Платиновые монеты выпускаются и другими государствами.
Стоит отметить, что платиновые монеты являются большой редкостью, их достаточно сложно найти в продаже, не говоря уже о возможности их перепродажи в отделении банков.
Покупка мерных слитков.
Крупнейшие банки России разрабатывают и утверждают свои правила купли-продажи мерных слитков. Эти правила более детально описывают требования по соответствию мерных слитков стандартам допустимости их загрязнения, а также чистоте и целостности сопровождающей их документации. Перед покупкой слитков необходимо внимательно изучить эти правила.
Если Вы не планируете выносить купленный у банка слиток из сертифицированного хранилища, а желаете передать его на хранение этому же банку, оформив металлический счет ответственного хранения, то законодательство позволяет не уплачивать сумму НДС от покупки.
Многие эксперты считают, что платина это как раз тот инвестиционный инструмент, которому можно доверять и иметь 10 — 15% платины в своем инвестиционном портфеле из драгоценных металлов будет совсем не лишним. Но только сам инвестор решает, может ли этот вид драгоценного металла быть полезен ему или нет.

mir-fin.ru
Платина — Мегаэнциклопедия Кирилла и Мефодия — статья
Пла́тина (лат. Platinum, испанское platina, уменьшительное от plata — серебро), Pt, читается «платина», химический элемент с атомным номером 78, атомная масса 195, 083. Платина состоит из четырех стабильных изотопов 194Pt (32, 9%), 195Pt (33, 8%), 196Pt (25, 2%), 198Pt (7, 2%) и двух слабо радиоактивных 190Pt (0, 013 %, период полураспада Т1/2 = 6, 9·1011 лет), 192Pt (0, 78 %, Т1/2 = 1015лет). Относится к платиновым металлам и располагается в 6 периоде, в VIIIB группе периодической системы элементов. Входит в триаду платина, осмий, иридий. Конфигурация двух внешних электронных слоев 5s2p6d96s1. Степени окисления 0, +2, +3, +4, +6 и редко +5 (валентности 0, II, III, IV, V, VI). Наиболее характерна степень окисления +4.Радиус атома 0, 138 нм, ионный радиус иона Pt2+ — 0, 074 (координационное число 4), Pt2+ — 0, 094 (6), Pt4+ — 0, 0765 (6), Pt5+ — 0.071 нм (6). Энергии ионизации Pt0 — Pt+ — Pt2+ — Pt3+ равны 9, 0, 18, 56, 23, 6 эВ. Электроотрицательность по Полингу 2, 2.
Платина известна человечеству с древнейших времен. Изделия, содержащие платину, найдены при раскопках древнеегипетских гробниц и древнеиндейских поселений в Колумбии. Первое описание платины в Европе сделал А. де Ульолоа, который участвовал во французской экспедиции в 1736 с целью определения длины экватора. В его записях упоминается благородный металл platina, найденный в колумбийских золотых рудниках.
В 1741 южноамериканские образцы металла были доставлены в Европу, где сначала платину рассматривали как «белое золото». В середине 18 века была установлена элементарная природа платины. В настоящее время «белым золотом» называют сплавы золота и платины. Расплавить чистую платину удалось в 1783 А. Л. Лавуазье .Производство платины в виде порошка началось в 1805 англичанином У. Х. Волластоном из южноамериканской руды.В настоящее время платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir3+ и Pd2+. Последующим добавлением хлорида аммония выделяют (NH4)2PtCl6. Высушенный осадок прокаливают при 800–1000°C:(NH4)2PtCl6 = N2 + 6HCl + Pt + H2.
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении платиновых растворов химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
Платина — один из наиболее редких элементов, ее содержание в земной коре 5·10–7% по массе. Она встречается в природе в сульфидных, медно-никелевых и медно-молибденовых рудах, в виде самородков и самородных сплавов с иридием или палладием. Минералы платины: PtAs2 (сперрилит), PtS (куперит), (Pt, Pd, Ni)S (брэггит).
Платина — тугоплавкий тяжелый (плотность при 20°C 21, 45 г/см3) серебристо-белый металл. Имеет кубическую гранецентрированную решетку, a = 0, 392 нм. Температура плавления 1769°C, кипения 4170°C. Проявляет свойства парамагнетика. Металлическая платина хорошо поддается прокату и сварке. В ряду стандартных потенциалов платина расположена правее водорода и с неокисляющими кислотами и водой не реагирует.
По химическим свойствам платина похожа на палладий, но проявляет большую химическую устойчивость. Реагирует только с горячей царской водкой:3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
Платина медленно растворяется в горячей серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов):Pt + 2Cl2 + 2NaCl = Na2[PtCl6].
При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объем поглощаемого водорода меньше и способность его отдавать при нагревании у платины меньше.
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: черный PtO, коричневый PtO2, красновато-коричневый PtO3, а также Pt2O3 и Pt3O4.
Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлорплатинатов, например:
Na2PtCl4 + 2NaOH = 4NaCl + Pt(OH)2Ї,
Na2PtCl6 + 4NaOH = 6NaCl + Pt(OH)4Ї.
Эти гидроксиды проявляют амфотерные свойства:
Pt(OH)2 + 2NaOH = Na2[Pt(OH)4],
Pt(OH)2 +4HCl = H2[PtCl4] + 2H2O,
Pt(OH)4 + 6HCl = H2[PtCl6] + 4H2O,
Pt(OH)4 + 2NaOH = Na2[Pt(OH)6].
Гексафторид PtF6 — один из сильнейших окислителей, способный окислить молекулы кислорода, ксенона или NO:
O2 + PtF6 = O2+[PtF6]–.
C обнаруженного Н. Бартлеттом взаимодействия между Хе и PtF6, приводящего к образованию XePtF6, началась химия инертных газов. PtF6 получают фторированием платины при 1000 °C под давлением.Фторирование платины при нормальным давлении и температуре 350-400 °C дает фторид Pt(IV):
Pt + 2F2 = PtF4
Фториды платины гигроскопичны и разлагаются водой.
Тетрахлорид платины (IV) с водой образует гидраты PtCl4·nH2O, где n = 1, 4, 5 и 7. Растворением PtCl4 в соляной кислоте получают платинохлористоводородные кислоты H[PtCl5] и H2[PtCl6].
Синтезированы такие галогениды платины как PtBr4, PtCl2, PtCl2·2PtCl3, PtBr2 и PtI2.
Для платины характерно образование комплексных соединений состава [PtХ4]2– и [PtX6]2–. Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.Основное применение платина, ее сплавы и соединения находят в автомобилестроении (30-65%), в качестве катализатора для дожигания выхлопных газов автомобилей. 7-12% платины используется в нефтеперерабатывающей промышленности и органическом синтезе (в процессах гидрирования углеводородов), 7-13% — в электротехнике и электронике, 3-17% — в стекольной и керамической промышленности, 2-35% — для изготовления зубных протезов и ювелирных изделий.
Все соединения платины — сильные окислители. И требуют осторожного обращения.
- Аналитическая химия платиновых металлов. М, 1972.
- Ливингстон С. Химия рутения, родия, палладия, осмия, иридия, платины / Пер. с англ. М., 1978.
- Платина, ее сплавы и композиционные материалы. М., 1980.
- Ливингстон С. Химия рутения, родия, палладия, осмия, иридия, платины. М., 1978.
- Платина, ее сплавы и композиционные материалы. М., 1980.
- Додин Д. А. Платина России. — СПб.: ВНИИОкеангеология, 2004.
- Дмитриев В. А. Высокотемпературное разрушение платиновых металлов и сплавов. — М.: Руда и металлы (РиМ), 2003.
- Аналитическая химия металлов платиновой группы. — М.: Едиториал УРСС, 2003.
megabook.ru
