Основные положения органической химии | АЛХИМИК
Органическая химия – это химия углеводородов и их производных.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н. Например: СН4, С2Н6, С6Н6 и т.д.
Производные УВ – это продукты замещения атомов «Н» в молекулах УВ на другие или группы атомов. Например:
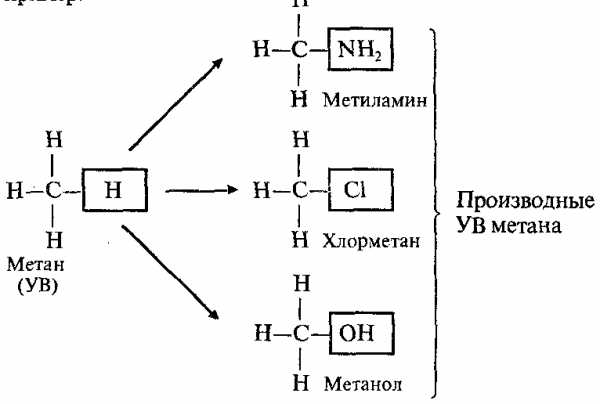

Название «органическая химия» появилось в начале XIX в., когда было установлено, что углеродсодержащие вещества являются основой растительных и животных организмов.
До 20-х годов XIX в. многие ученые считали, что органические вещества нельзя получить в лаборатории из неорганических веществ, что они образуются только в живой природе при участии особой «жизненной силы». Учение о «жизненной силе» называется

 А.М. Бутлеров
А.М. БутлеровЭто учение просуществовало недолго, потому что уже в начале и середине XIX в. были синтезированы многие органические вещества:
1828 г. – Велер синтезирует мочевину CO(NH2)2, которая является одним из продуктов, образующихся в организме;
1850-е гг. – Бертло синтезирует жиры;
1861 г. – Бутлеров синтезировал один из углеводов.
Сейчас известно более 10 млн органических веществ; многие из них не существуют в природе, а получены в лаборатории. Промышленный синтез различных органических веществ является одним из основных направлений химической промышленности.
Кроме С и Н, в состав многих органических веществ входят следующие элементы: O, N, S, P, Cl, Br и др.
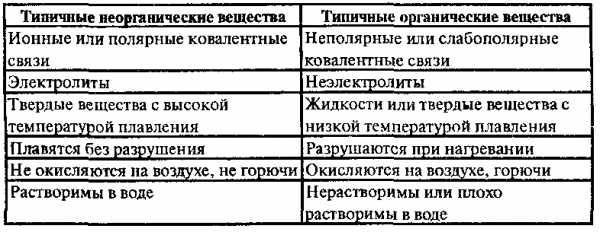
Принципиального различия между органическими и неорганическими веществами нет. Однако типичные органические вещества имеют ряд свойств, которые отличают их от типичных неорганических веществ. Это объясняется различием в характере химической связи:

Основные положения теории химического строения органических соединений
Эту теорию разработал русский ученый А.М. Бутлеров (1858 – 1861).
I положение. Атомы в молекулах органических веществ соединяются друг с другом в определенной последовательности согласно их валентности.
Последовательность соединения атомов в молекуле называется химическим строением (структурой).
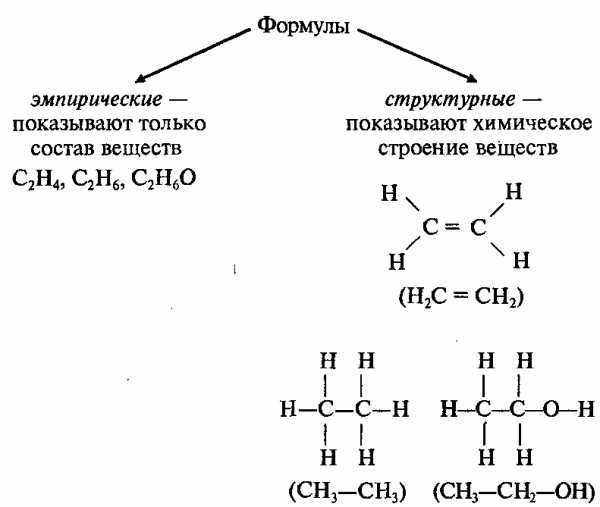
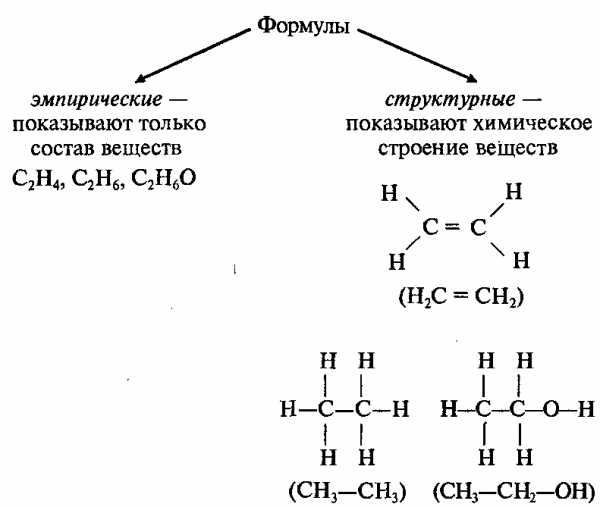
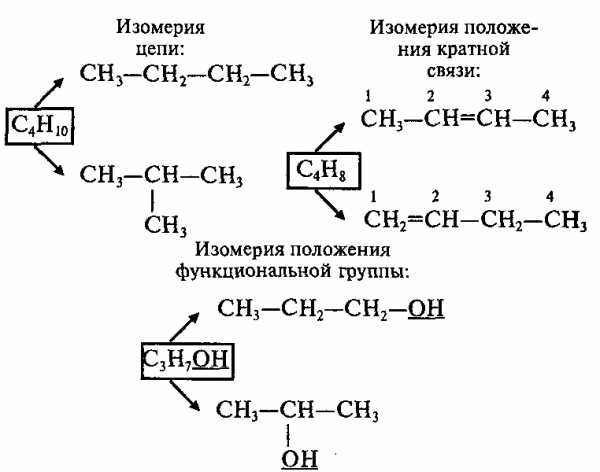
В органических соединениях атомы углерода могут соединяться друг с другом, образуя цепи (углеродный скелет). В зависимости от наличия тех или иных атомов углерода цепи бывают:
а) прямые (неразветвленные) – содержат два первичных атома углерода (крайние в цепи), остальные атомы – вторичные; например:
б) разветвленные – содержат хотя бы один третичный или хотя бы один четвертичный атом углерода; например:
в) замкнутые (циклы) – не содержат первичных атомов углерода; например:
II положение. Свойства веществ зависят не только от состава, но и от строения их молекул.
Например, существуют 2 различных вещества, которые имеют одинаковый состав, выражаемый эмпирической формулой С2Н6О:
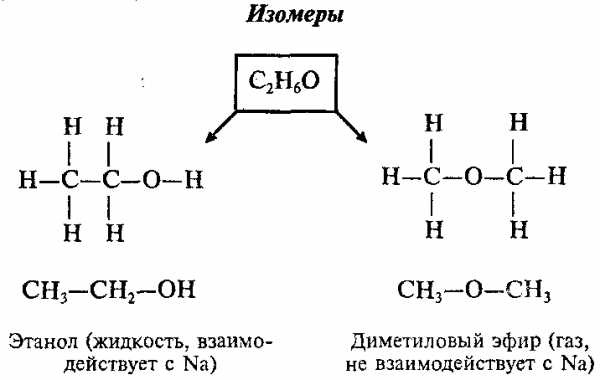
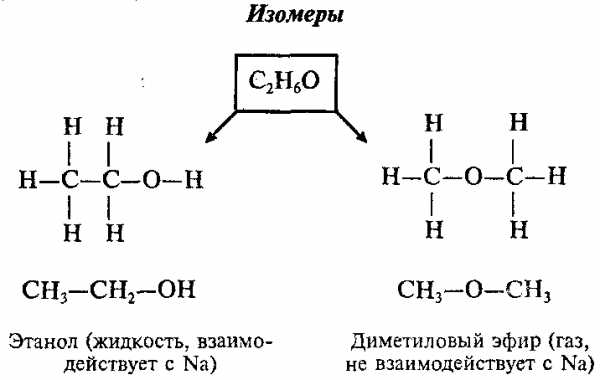
Изомеры – это вещества, которые имеют одинаковый состав, но разное строение молекул и различные свойства.
Изомерия – явление существования изомеров.
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает; например:
С4Н10 – 2 изомера,
С10Н22 – 75 изомеров.
Типы изомерии
1. Структурная изомерия

2. Пространственная изомерия (геометрическая изомерия, цис-транс-изомерия)
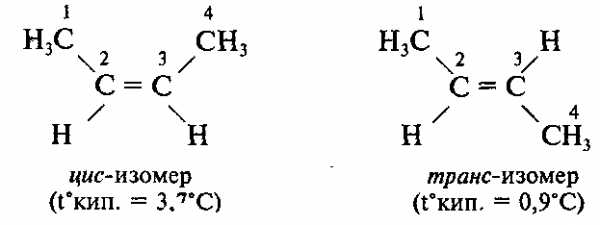
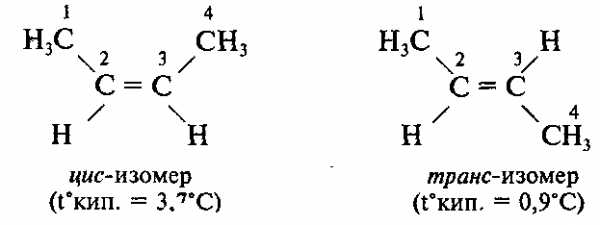
Порядок соединения атомов в этих изомерах одинаковый, но расположение атомов в пространстве различно.
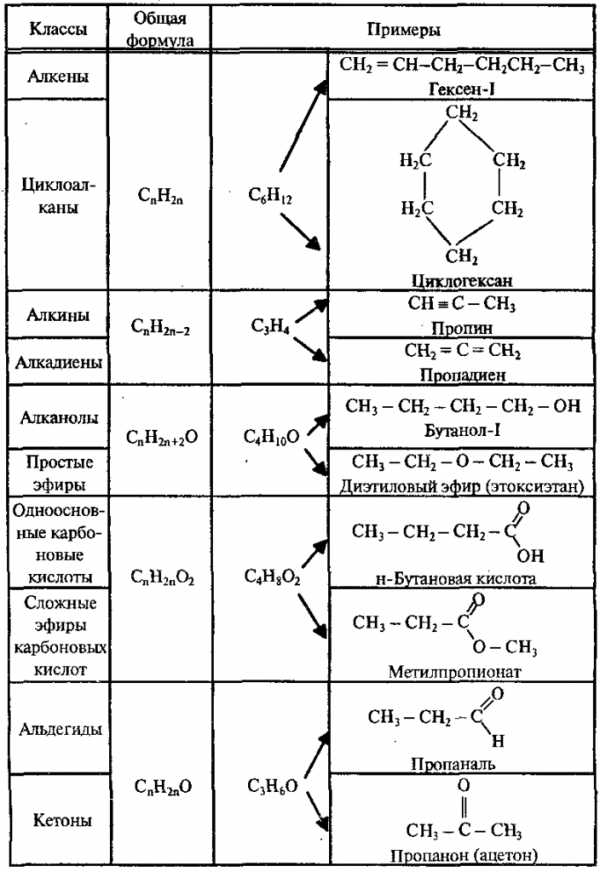
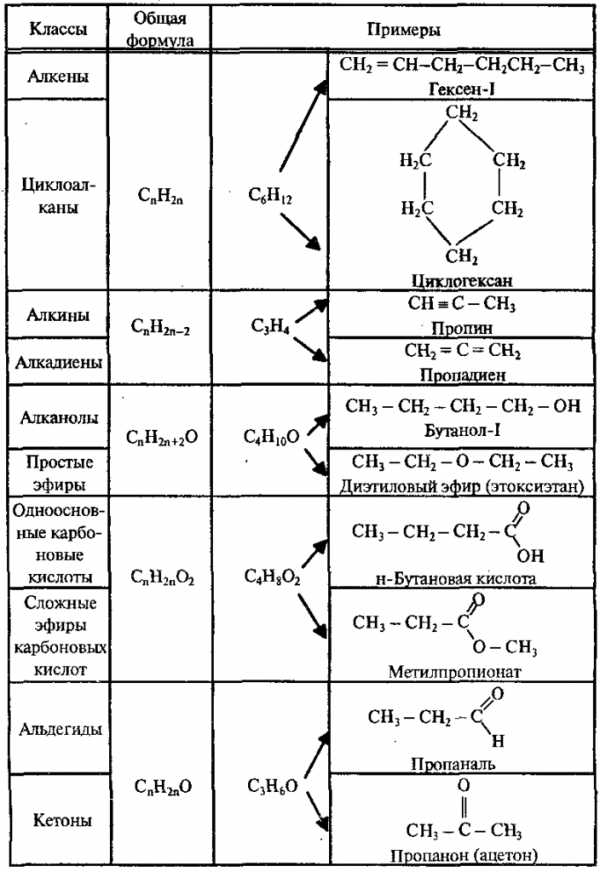
3. Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических соединений:
III положение. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
Рассмотрим, например, влияние ОН-группы на подвижность атомов «Н» в цикле бензола:
В бензольном ядре замещается один атом водорода.
При наличии группы – ОН в бензольном ядре замещаются три атома водорода.
С другой стороны, углеводородный радикал влияет на подвижность атома водорода в ОН-группе:
Если группа – ОН связана с бензольным кольцом, атом водорода в ней является подвижным и может замещаться на атом металла при взаимодействии со щелочью.
Если группа – ОН связана с алкильным радикалом, подвижность атома водорода в ней невелика, и он не может замещаться на металл при действии щелочи.
Гомологический ряд. Гомологи
Гомологический ряд – это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу СН2. Сходные по химическим свойствам соединения, образующие гомологический ряд, называются гомологами. Группа СН2 называется гомологической разностью.
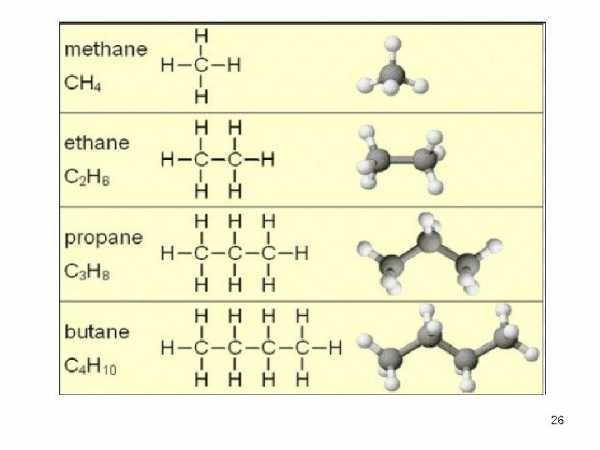
Например: СН4, С2Н6, С3Н8, С4Н10 …CnH2n+2.
Состав всех членов гомологического ряда может быть выражен общей формулой.
Классификация органических веществ
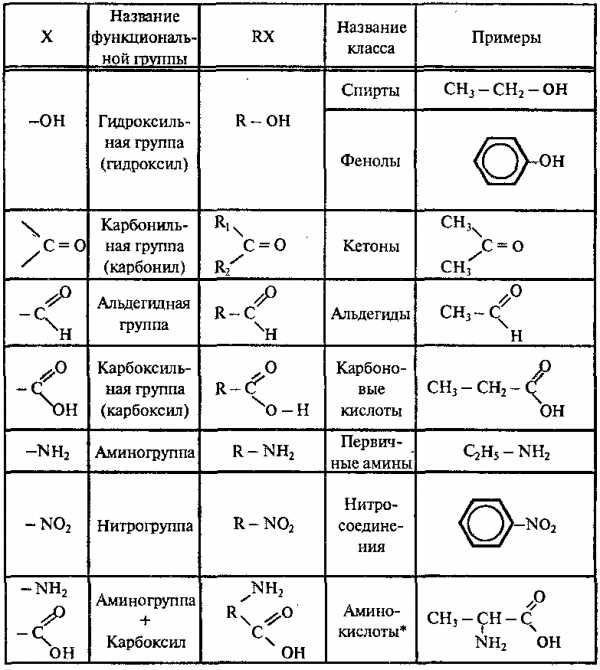
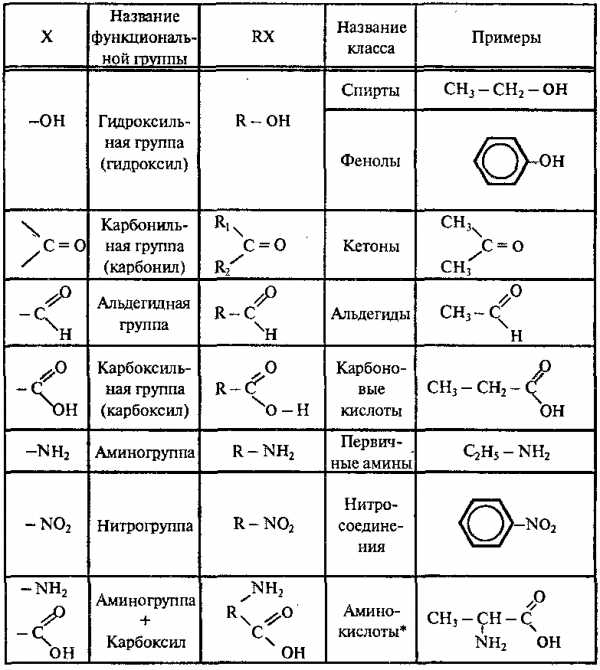
Большинство органических соединений можно представить формулой: R – X, где R – углеводородный радикал; Х – функциональная группа.

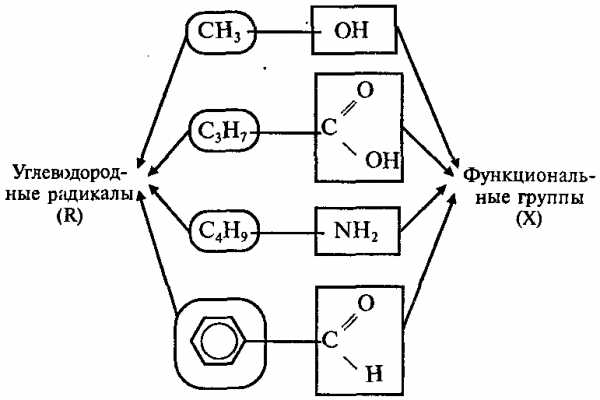
Функциональные группы – это группы атомов, которые определяют наиболее характерные химические свойства органических соединений. Углеводородные радикалы – остатки УВ, связанные с функциональными группами.
1. Классификация органических веществ по строению углеводородного радикала (R)


2. Классификация органических веществ по функциональным группам (Х)
Типы органических реакций
1. Реакции присоединения
2. Реакции замещения
3. Реакции отщепления
4. Реакции разложения
5. Реакции изомеризации
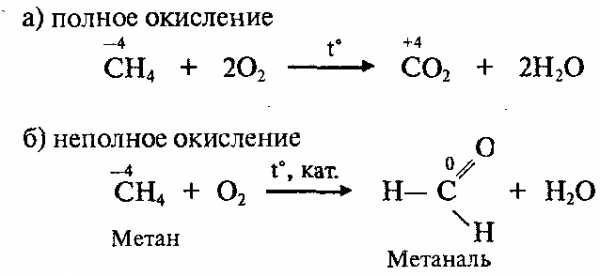
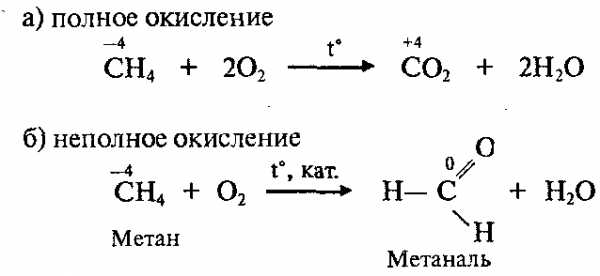
6. Реакции окисления
Читайте также
Похожее
al-himik.ru
Основные понятия и законы органической химиии
Трудно представить прогресс в какой бы то ни было области хозяйства без химии – в частности, без органической химии. Все сферы хозяйства связаны с современной химической наукой и технологией.
Органическая химия изучает вещества, содержащие в своем составе углерод, за исключением окиси углерода, углекислого газа и солей угольной кислоты (эти соединения по свойствам ближе к неорганическим соединениям).
Как наука органическая химия до середины XVIII века не существовала. К тому времени различали три вида химии: химию животных, растительную и минеральную. Химия животных изучала вещества, входящие в состав животных организмов; растительная – вещества, входящие в состав растений; минеральная – вещества, входящие в состав неживой природы. Этот принцип, однако, не позволял отделить органические вещества от неорганических. Например, янтарная кислота относилась к группе минеральных веществ, так как ее получали перегонкой ископаемого янтаря, поташ входил в группу растительных веществ, а фосфат кальция – в группу животных веществ, так как их получали прокаливанием соответственно растительных (древесина) и животных (кости) материалов.
В первой половине XIX века было предложено выделить соединения углерода в самостоятельную химическую дисциплину – органическую химию.
Среди ученых в то время господствовало виталистическое мировоззрение, согласно которому органические соединения образуются только в живом организме под влиянием особой, сверхъестественной «жизненной силы». Это означало, что получить органические вещества путем синтеза из неорганических невозможно, что между органическими и неорганическими соединениями лежит непреодолимая пропасть. Витализм настолько укрепился в умах ученых, что долгое время не предпринималось никаких попыток синтеза органических веществ. Однако витализм был опровергнут практикой, химическим экспериментом.
В 1828 г. немецкий химик Вёлер, работая с циановокислым аммонием, случайно получил мочевину
O
II
Nh3–C–Nh3.
В 1854 г. француз Бертло синтезировал вещества, относящиеся к жирам, а в 1861 г. русский ученый Бутлеров синтезировал вещества, относящиеся к классу сахаров. Это были тяжелые удары по виталистической теории, окончательно разбивающие убеждение о невозможности синтеза органических соединений.
Эти и другие достижения химиков требовали теоретического объяснения и обобщения возможных путей синтеза органических соединений и связи их свойств со строением.
Исторически первой теорией органической химии стала теория радикалов (Ж.Дюма, Ю.Либих, И.Берцелиус). По мнению авторов, многие превращения органических соединений протекают так, что некоторые группы атомов (радикалы), не изменяясь, переходят из одного органического соединения в другое. Однако, вскоре было установлено, что в органических радикалах атомы водорода могут замещаться даже на такие отличные от водорода по химической природе атомы, как атомы хлора, и при этом тип химического соединения сохраняется.
Теорию радикалов сменила более совершенная и охватывающая больший экспериментальный материал теория типов (О.Лоран, Ш.Жерар, Ж.Дюма). Теория типов классифицировала органические вещества по типам превращений. К типу водорода относили углеводороды, к типу хлороводорода – галогенопроизводные, к типу воды – спирты, эфиры, кислоты и их ангидриды, к типу аммиака – амины. Однако накапливающийся огромный экспериментальный материал уже не укладывался в известные типы и, кроме того, теория типов не могла предсказать существование и пути синтеза новых органических соединений. Развитие науки требовало создания новой, более прогрессивной теории, для рождения которой уже существовали некоторые предпосылки: установлена четырехвалентность углерода (А.Кекуле и А.Кольбе, 1857 год), показана способность атома углерода образовывать цепочки атомов (А.Кекуле и А.Купер, 1857 год).
Решающая роль в создании теории строения органических соединений принадлежит великому русскому ученому Александру Михайловичу Бутлерову. 19 сентября 1861 года на 36-м съезде немецких естествоиспытателей А.М.Бутлеров обнародовал ее в докладе «О химическом строении вещества».
Основные положения теории химического строения А.М.Бутлерова можно свести к следующему.
1. Все атомы в молекуле органического соединения связаны друг с другом в определенной последовательности в соответствии с их валентностью. Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. Например, составу вещества С2Н6О отвечают два разных соединения: диметиловый эфир (СН3–О–СН3) и этиловый спирт (С2Н5ОН).
2. Свойства веществ зависят от их химического строения. Химическое строение – это определенный порядок в чередовании атомов в молекуле, во взаимодействии и взаимном влиянии атомов друг на друга – как соседних, так и через другие атомы. В результате каждое вещество имеет свои особые физические и химические свойства. Например, диметиловый эфир – это газ без запаха, нерастворимый в воде, t°пл. = -138°C, t°кип. = 23,6°C; этиловый спирт – жидкость с запахом, растворимая в воде, t°пл. = -114,5°C, t°кип. = 78,3°C.
Данное положение теории строения органических веществ объяснило явление изомерии, широко распространенное в органической химии. Приведенная пара соединений – диметиловый эфир и этиловый спирт – один из примеров, иллюстрирующих явление изомерии.
3. Изучение свойств веществ позволяет определить их химическое строение, а химическое строение веществ определяет их физические и химические свойства.
4. Атомы углерода способны соединятся между собой, образовывая углеродные цепи различного вида. Они могут быть как открытыми, так и замкнутыми (циклическими), как прямыми, так и разветвленными. В зависимости от числа связей, затрачиваемых атомами углерода на соединение друг с другом, цепи могут быть насыщенными (с одинарными связями) или ненасыщенными (с двойными и тройными связями).
5. Каждое органическое соединение имеет одну определенную формулу строения или структурную формулу, которую строят, основываясь на положении о четырехвалентном углероде и способности его атомов образовывать цепи и циклы. Строение молекулы как реального объекта можно изучить экспериментально химическими и физическими методами.
А.М.Бутлеров не ограничился теоретическими объяснениями своей теории строения органических соединений. Он провел ряд экспериментов, подтвердив предсказания теории получением изобутана, трет. бутилового спирта и т.д. Это дало возможность А.М.Бутлерову заявить в 1864 году, что имеющиеся факты позволяют ручаться за возможность синтетического получения любого органического вещества.
В дальнейшем развитии и обосновании теории строения органических соединений большую роль сыграли последователи Бутлерова — В.В.Марковников, Е.Е.Вагнер, Н.Д.Зелинский, А.Н.Несмеянов и др.
Современный период развития органической химии в области теории характеризуется все возрастающим проникновением методов квантовой механики в органическую химию. С их помощью решаются вопросы о причинах тех или иных проявлений взаимного влияния атомов в молекулах. В области развития органического синтеза современный период характеризуется значительными успехами в получении многочисленных органических соединений, в число которых входят природные вещества — антибиотики, разнообразные лекарственные соединения, многочисленные высокомолекулярные соединения. Органическая химия глубоко проникла в сферу физиологии. Так, с химической точки зрения изучена гормональная функция организма, механизм передачи нервных импульсов. Ученые вплотную подошли к разрешению вопроса о строении и синтезе белка.
Органическая химия как самостоятельная наука продолжает существовать и интенсивно развиваться. Это объясняется следующими причинами:
1. Многообразием органических соединений, обусловленным тем, что углерод в отличие от других элементов способен соединяться друг с другом, давая длинные цепочки (изомеры). В настоящее время известно около 6 млн. органических соединений, в то время как неорганических — только около 700 тысяч.
2. Сложностью молекул органических веществ, содержащих до 10 тысяч атомов (например, природные биополимеры — белки, углеводы).
3. Специфичностью свойств органических соединений по сравнению с неорганическими (неустойчивостью при сравнительно невысоких температурах, низкой – до 300°С – температурой плавления, горючестью).
4. Медленно идущими реакциями между органическими веществами по сравнению с реакциями, характерными для неорганических веществ, образованием побочных продуктов, спецификой выделения получающихся веществ и технологическим оборудованием.
5. Огромным практическим значением органических соединений. Они — наша пища и одежда, топливо, разнообразные лекарственные препараты, многочисленные полимерные материалы и т.д.
Классификация органических соединений
Огромное количество органических соединений классифицируют с учетом строения углеродной цепи (углеродного скелета) и наличия в молекуле функциональных групп.
На схеме представлена классификация органических соединений в зависимости от строения углеродной цепи.
Органические соединения
¯
¯
Ациклические (алифатические)
(соединения с открытой цепью)
Циклические
(соединения с замкнутой цепью)
¯
¯
¯
¯
Насыщенные (предельные)
Ненасыщенные (непредельные)
Карбоциклические (цикл состоит только из атомов углерода)
Гетероциклические (цикл состоит из атомов углерода и других элементов)
¯
¯
Алициклические (алифатические циклические)
Ароматические
Простейшими представителями ациклических соединений являются алифатические углеводороды — соединения, содержащие только атомы углерода и водорода. Алифатические углеводороды могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины).
Простейшим представителем алициклических углеводородов служит циклопропан, содержащий цикл из трех углеродных атомов.
Ароматический ряд объединяет ароматические углеводороды — бензол, нафталин, антрацен и т.д., а также их производные.
Гетероциклические соединения могут содержать в цикле, кроме атомов углерода, один или несколько атомов других элементов — гетероатомов (кислород, азот, серу и др.).
В каждом представленном ряду органические соединения делятся на классы в зависимости от состава и строения. Наиболее простым классом органических соединений являются углеводороды. При замене атомов водорода в углеводородах на другие атомы или группы атомов (функциональные группы) образуются другие классы органических соединений данного ряда.
Функциональная группа — атом или группа атомов, устанавливающие принадлежность соединения к классам органических соединений и определяющие главнейшие направления его химических превращений.
Соединения с одной функциональной группой называются монофункциональными (метанол СН3–ОН), с несколькими одинаковыми функциональными группами — полифункциональными (глицерин
СН2–
I
OH СН–
I
OH СН2),
I
OH
с несколькими разными функциональными группами — гетерофункциональными (молочная кислота
СН3–
СН–СООН).
I
OH
Соединения каждого класса составляют гомологические ряды. Гомологический ряд – это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2– групп (гомологическая разность).
Основные классы органических соединений следующие:
I. Углеводороды (R–H).
II. Галогенопроизводные (R–Hlg).
III. Спирты (R–OH).
O
//
IV. Эфиры простые и сложные (R–O–R’, R–C ).
\
OR’
O
//
V. Карбонильные соединения (альдегиды и кетоны) (R–C
\
H
O
II
, R–C–R).
O
//
VI. Карбоновые кислоты R–C ).
\
OH
R
I
VII. Амины (R–Nh3, NH, R–N–R’).
I I
R’ R’’
VIII. Нитросоединения (R–NO2).
IX. Сульфокислоты (R–SO3H).
Число известных классов органических соединений не ограничивается перечисленными, оно велико и с развитием науки все время увеличивается.
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращений функциональных групп без изменения углеродного скелета.
Классификация реакций органических соединений по характеру химических превращений
Органические соединения способны к разнообразным химическим превращениям, которые могут проходить как без изменения углеродного скелета, так и с таковым. Большинство реакций проходит без изменения углеродного скелета.
I. Реакции без изменения углеродного скелета
К реакциям без изменения углеродного скелета относятся следующие:
1) замещения: RH + Br2 ® RBr + HBr,
2) присоединения: Ch3=Ch3 + Br2 ® Ch3Br – Ch3Br,
3) отщепления (элиминирования): Ch4–Ch3–Cl ® Ch3=Ch3 + HCl,
C2H5ONa
4) изомеризации: Ch4–Ch3–CєСH
––––––®
¬––––––
Ch4–CєС–Ch4
Na
Реакции замещения характерны для всех классов органических соединений. Замещаться могут атомы водорода или атомы любого другого элемента, кроме углерода.
Реакции присоединения характерны для соединений с кратными связями, которые могут быть между атомами углерода, углерода и кислорода, углерода и азота и т. д., а также для соединений, содержащих атомы со свободными электронными парами или вакантными орбиталями.
К реакциям элиминирования способны соединения, содержащие электроотрицательные группировки. Легко отщепляются такие вещества, как вода, галогеноводороды, аммиак.
К реакциям изомеризации без изменения углеродного скелета особенно склонны непредельные соединения и их производные.
II. Реакции с изменением углеродного скелета
К этому типу превращений органических соединений относятся следующие реакции:
1) удлинения цепи,
2) укорачивания цепи,
3) изомеризации цепи,
4) циклизации,
5) раскрытия цикла,
6) сжатия и расширения цикла.
Химические реакции проходят с образованием различных промежуточных продуктов. Путь, по которому осуществляется переход от исходных веществ к конечным продуктам, называется механизмом реакции. В зависимости от механизма реакции они делятся на радикальные и ионные. Ковалентные связи между атомами А и В могут разрываться таким образом, что электронная пара или делится между атомами А и В, или передается одному из атомов. В первом случае частицы А и В, получив по одному электрону, становятся свободными радикалами. Происходит гомолитическое расщепление:
А : В ® А• + •В
Во втором случае электронная пара переходит к одной из частиц и образуются два разноименных иона. Поскольку образующиеся ионы имеют различные электронные структуры, этот тип разрыва связи называется гетеролитическим расщеплением:
А : В ® А+ + :В-
Положительный ион в реакциях будет стремиться присоединить к себе электрон, т. е. будет вести себя как электрофильная частица. Отрицательный ион – так называемая, нуклеофильная частица будет атаковать центры с избыточными положительными зарядами.
Изучение условий и методов проведения, а также механизмов реакций органических соединений составляет основное содержание данного курса органической химии.
Вопросы номенклатуры органических соединений, как правило, излагаются во всех учебниках органической химии, поэтому мы сознательно опускаем рассмотрение этого материала, обращая внимание на то, что во всех случаях написания уравнений реакций исходные и образующиеся соединения снабжаются соответствующими названиями. Эти названия со знанием основ номенклатуры позволят каждому самостоятельно решить вопросы, связанные с номенклатурой органических соединений.
Изучение органической химии начинают по обыкновению с алифатического ряда и с наиболее простого класса веществ – углеводородов.
www.examen.ru
| 1. Наиболее характерные химические свойства органических соединений в большей степени определяются: | |
| а) строением углеродной цепи | б) числом атомов углерода в цепи |
| в) функциональной группой | г) ациклическим или карбоциклическим строением органических соединений |
| 2. Какой вид наиболее характерен для органических веществ: | |
| б) металлические | |
| г) ковалентные | |
| 3. В каком ряду все вещества являются между собой гомологами: | |
| а) СН4, С3Н8, С4Н8 | б) С2Н6, С4Н10, С6Н14 |
| в) СН4, С4Н10, С7Н8 | г) С2Н4, С4Н10, С8Н18 |
| 4. Укажите величину заряда метильного радикала — СН3: | |
| 5. Укажите суммарное число электронов в радикале, полученном при отрыве атома водорода от молекулы С2Н6: | |
| 6. Большинство органических веществ легкоплавки, так как не имеют кристаллическую решетку: | |
| б) металлическую | |
| г) молекулярную | |
| 7. Укажите формулу гомолога вещества состава С6Н6: | |
| 8. Для изомеров одинаковы: | |
| а) значения молярных масс | б) физические свойства |
| в) структурные формулы молекул | г) только качественный состав |
| 9. При симметричном (гомолитическом) разрыве ковалентной связи образуются: | |
| а) радикал и катион | б) катион и анион |
| в) два радикала | г) четыре электронейтральные частицы |
| 10. Какая группа атомов не относится к функциональной группе: | |
himiy88.blogspot.com
Основные теоретические положения органической химии. Насыщенные (предельные) углеводороды (стр. 1 из 5)
С.Ю. Елисеев
Общие представления
По способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе. Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S, N, P, As, Si, Ge, Sn, Pb, B, Ti и другие элементы.
Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями.
Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов.
Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические.
К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200-200000 углеродных атомов и молекулярным весом порядка 104-106 у.е.
Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами.
Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С — связи (339 КДж) — весьма устойчивы.
Области применения
Лекарственные вещества.
Высокомолекулярные органические соединения: синтетические смолы и органическое стекло; пластические массы (пластмассы) и синтетические волокна; синтетический каучук.
Красящие вещества (красители).
Гербициды (вещества, уничтожающие сорняки).
Инсектициды и фунгициды (вещества, уничтожающие, соответственно насекомых и грибы).
Дефолианты (вещества, ускоряющие опадение листьев; применение их укоряет созревание хлопчатника и облегчает машинную уборку).
Десиканты (соединения, способствующие высушиванию растений на корню).
Витамины (сложные физиологически активные органические вещества, отсутствие которых в пище человека или животных ведет к нарушению нормальных функций организма).
Ферменты (сложные органические соединения, являющиеся биологическими катализаторами, вызывающими процессы брожения, расщепления жиров, белков и т.п.)
Консерванты (органические вещества, предохраняющие от закисания и порчи вина, соки, варенья, маринады и другие пищевые продукты).
Органическая химия достигла огромных успехов в изучении состава и переработке каменного угля, нефти и природного газа; таким образом, она тесно связана с угольной, нефтяной и газовой отраслями промышленности, обеспечивающими с одной стороны, получение различных видов топлива, с другой – сырьем различные производства. Так, каменный уголь используют не только как топливо, путем переработки из него добывают необходимый для металлургии кокс, а так же светильный газ и каменноугольный деготь. Последний, свою очередь служит источником для получения многочисленных органических соединений, необходимых для синтеза ВМС, красителей, лекарственных и взрывчатых веществ и т.п. Из нефти путем её перегонки получают различные виды горючего, смазочные материалы и другие ценные продукты. Природный газ, особенно попутный нефтяной газ, также представляет собой ценное химическое сырье и топливо, используемое как в промышленности, так и в быту.
Теория химического строения
Создана в 1858-1861 г.г. в русским химиком А. М. Бутлеровым.
Основные положения теории химического строения:
Молекулы веществ — представляют собой реально существующие материальные частицы, обладающие определенным химическим строением. Т.е. атомы, образующие их, соединяются друг с другом в определенной, характерной для каждого вещества последовательности и взаимно влияют друг на друга.
Строение молекул вещества познаваемо и может быть установлено путем изучения свойств вещества, продуктов его превращений, а также путем его разложения и синтеза.
Свойства вещества определяются его качественным и количественным составом и химическим строением его молекул. Вещества, имеющие одинаковые состав и молекулярный вес, но различное строение, отличаются по своим свойствам; в этом заключается явление изомерии.
Взаимное влияние атомов, образующих молекулу, определяет реакционную способность каждого из них; химический характер одних и тех же атомов в различных молекулах зависит от того, с какими атомами они связаны в данной молекуле.
Углерод в органических соединениях, как правило, четырехвалентен; атомы его способны соединяться не только с другими атомами, но и друг с другом, образуя цепи; последние могут замыкаться с образованием циклов. Это свойство углерода и явление изомерии и обуславливают многообразие органических веществ.
В развитии и обосновании теории химического строения большую роль сыграли русские химики – ученики и последователи А.М. Бутлерова: В.В. Марковников, А.М. Зайцев, Е.Е. Вагнер, Н.Д. Зелинский, М.И. Коновалов, А.Е. Фаворский и др.
Электронное строение органических соединений
Характер связей в органических соединениях
Для молекул органических соединений наиболее характерны ковалентные связи. Как известно, атом углерода имеет четыре валентных электрона. В соответствии с его положением в периодической системе элементов (2 период, I группа, порядковый номер 6) углерод прочно удерживает электроны в своем внешнем слое и в то же время не склонен отнимать электроны у других атомов. Поэтому связь атомов углерода с атомами различных элементов и друг с другом осуществляется путем образования обобщенных пар, т.е. при помощи ковалентных связей. Электронные структурные формулы, например, простейших углеводородов – метана и этана – имеют следующий вид (для сравнения рядом с ними приведены обычные структурные формулы):
Н Н Н Н Н Н
. . ½ . . . . ½½
Н : C : Н Н¾C¾Н Н : C : C : Н Н¾C¾C¾Н
. . ½ . . . . ½½
Н Н Н Н Н Н
Рис. 1 Электронная и обычная структурные формулы метана и этана.
Атом углерода, как правило, образует четыре ковалентные связи, т.к. только в этом случае у него создается устойчивый восьмиэлектронный внешний слой. Этим объясняется то, что в большинстве случаев валентность углерода равна четырем. В молекуле метана углерод образует ковалентные связи с четырьмя атомами водорода, у каждого из которых создается устойчивый двухэлектронный слой. В молекуле этана одна из электронных пар осуществляет ковалентную связь между двумя углеродными атомами.
Из сопоставления электронных формул метан и этана с обычными структурными формулами следует, что каждая простая связь между атомами осуществляется одной обобщенной электронной парой. Соответственно в веществах с кратными связями двойная связь возникает вследствие образования соединяющимися атомами двух, а тройная – трех обобщенных электронных пар. Электронные структуры и обычные структурные формулы, например, этилена и ацетилена имеют вид:
Н Н
. . . . Н Н
C::C >C = C< Н : C:::C : Н H¾C º C¾H
. . . . Н Н
Н Н
Н2С = СН2 НС º СН
Рис. 2. Электронная и обычная структурные формулы метана и этана.
Состояние валентных электронов в атоме углерода
Из курса неорганической химии известно, что электронная структура невозбужденного атома углерода может быть выражена формулой 1s22s22p2, т.е. во втором (внешнем) электронном слое у него два спаренных (с противоположными спинами) s- электрона и только два неспаренных p-электрона, которые могут участвовать в образовании ковалентных связей. Следовательно, углерод должен был бы проявлять валентность, равную двум, однако в большинстве своих соединений он четырехвалентен – образует четыре ковалентные связи. Это объясняется тем, что при затрате некоторой энергии происходит «расспаривание» 2s- электронов: один из них переводится на свободную орбиту подуровня 2p, и атом переходит в возбужденное состояние (2s22p2 2s12p3), или графически:
нормальное состояние возбужденное состояние
Таким образом, у атома углерода, участвующего в образовании четырех ковалентных связей, во внешнем электронном слое, как было показано ранее, четыре валентных электрона. Состояние их не одинаково. Один из них (s- электрон), двигаясь вокруг ядра образует шаровое облако (рис.3), подобное облаку электрона в атоме водорода (s-состояние электрона). Облака трех других электронов (p- электроны) имеют форму объемных восьмерок (гантелей) с «перетяжкой» в области ядра и ориентированных в трех взаимно перпендикулярных направлениях (p- состояния электрона).
mirznanii.com
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ. НАСЫЩЕННЫЕ (ПРЕДЕЛЬНЫЕ) УГЛЕВОДОРОДЫ
Описание презентации ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ. НАСЫЩЕННЫЕ (ПРЕДЕЛЬНЫЕ) УГЛЕВОДОРОДЫ по слайдам
 ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ. НАСЫЩЕННЫЕ (ПРЕДЕЛЬНЫЕ) УГЛЕВОДОРОДЫ Лекция 1.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ. НАСЫЩЕННЫЕ (ПРЕДЕЛЬНЫЕ) УГЛЕВОДОРОДЫ Лекция 1.
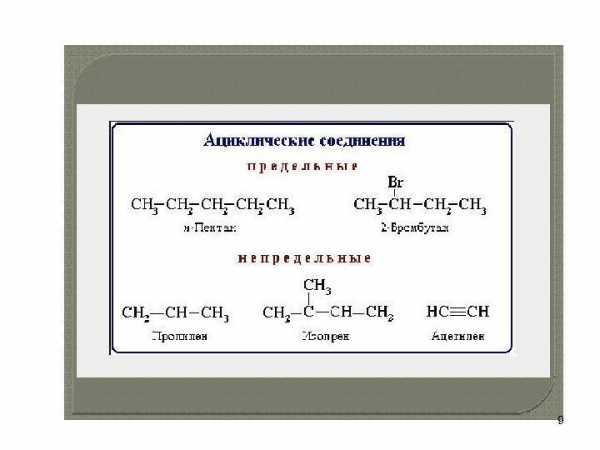
 Основу органических соединений • составляет незамкнутая (открытая) или замкнутая цепь углеродных атомов • одно или несколько звеньев цепи может быть заменено на атомы, отличные от углерода, — так называемые гетероатомы, чаще всего О, N, S. По структуре органических соединений подразделяют на • алифатические соединения — углеводороды и их производные, имеющие открытую углеродную цепь; • карбоциклические соединения с замкнутой углеродной цепью • гетероциклические соединения.
Основу органических соединений • составляет незамкнутая (открытая) или замкнутая цепь углеродных атомов • одно или несколько звеньев цепи может быть заменено на атомы, отличные от углерода, — так называемые гетероатомы, чаще всего О, N, S. По структуре органических соединений подразделяют на • алифатические соединения — углеводороды и их производные, имеющие открытую углеродную цепь; • карбоциклические соединения с замкнутой углеродной цепью • гетероциклические соединения.
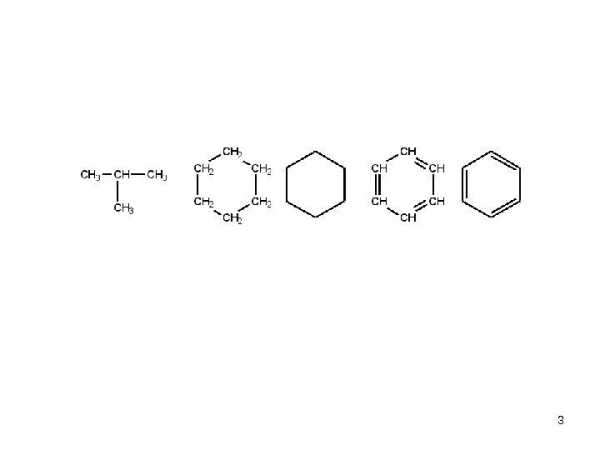
 • алифатические соединения
• алифатические соединения
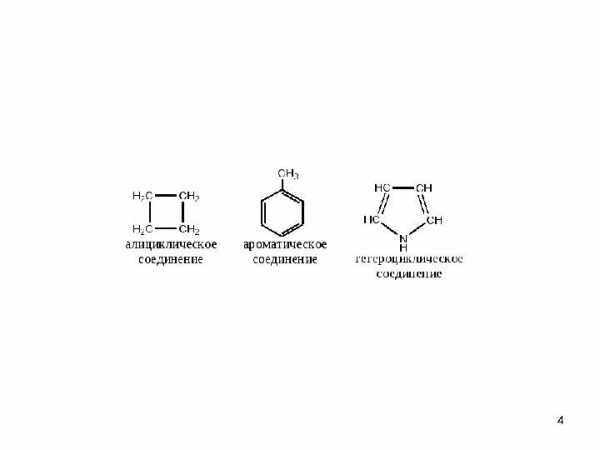
 • карбоциклические соединения
• карбоциклические соединения
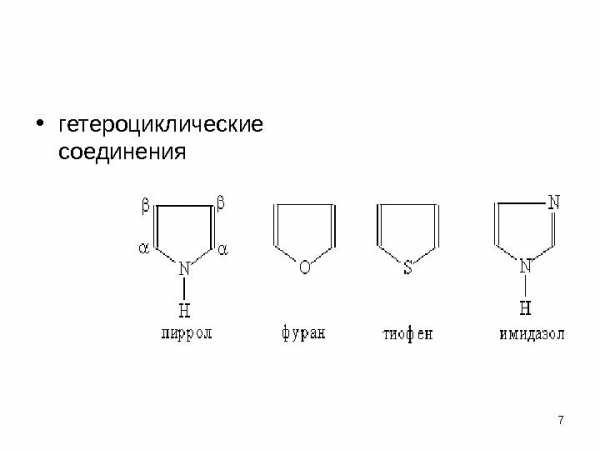 • гетероциклические соединения
• гетероциклические соединения
 • Углеводороды и их производные, не содержащие кратных связей, относятся к насыщенным соединениям, с кратными связями — к ненасыщенным.
• Углеводороды и их производные, не содержащие кратных связей, относятся к насыщенным соединениям, с кратными связями — к ненасыщенным.

 От каждого углеводорода • путем замены атомов водорода на различные функциональные группы • может быть образован так называемый генетический ряд, например • этан — этилхлорид — этанол — ацетальдегид — уксусная кислота. • В зависимости от типа функциональной группы органические соединения разделяются на классы: • углеводороды RH (функциональная группа отсутствует) • их галогензамещенные RHal, • спирты R-OH, • альдегиды R-CH=O, • кетоны R 2 C=O, • карбоновые кислоты. R-C=O-OH,
От каждого углеводорода • путем замены атомов водорода на различные функциональные группы • может быть образован так называемый генетический ряд, например • этан — этилхлорид — этанол — ацетальдегид — уксусная кислота. • В зависимости от типа функциональной группы органические соединения разделяются на классы: • углеводороды RH (функциональная группа отсутствует) • их галогензамещенные RHal, • спирты R-OH, • альдегиды R-CH=O, • кетоны R 2 C=O, • карбоновые кислоты. R-C=O-OH,
 • первичные, вторичные и третичные амины R-NH 2, R 2 NH и R 3 N • нитросоединения R-NO 2; • тиолы (меркаптаны) RSH • сульфиды R 2 S и др.
• первичные, вторичные и третичные амины R-NH 2, R 2 NH и R 3 N • нитросоединения R-NO 2; • тиолы (меркаптаны) RSH • сульфиды R 2 S и др.
 • Соединения, в молекулах которых кроме атомов С и Н и атомов-органогенов (Hal, О, N, S) содержатся атомы других элементов, образующих связи с углеродом, относятся к элементоорганическим соединениям
• Соединения, в молекулах которых кроме атомов С и Н и атомов-органогенов (Hal, О, N, S) содержатся атомы других элементов, образующих связи с углеродом, относятся к элементоорганическим соединениям
 • К функциональным группам относят также кратные углерод-углеродные связи. Группы органических соединений однотипной структуры с одинаковыми функциональными группами, отличающимися друг от друга по количеству групп СН 2 в углеродной цепи, составляют гомологический ряд.
• К функциональным группам относят также кратные углерод-углеродные связи. Группы органических соединений однотипной структуры с одинаковыми функциональными группами, отличающимися друг от друга по количеству групп СН 2 в углеродной цепи, составляют гомологический ряд.
 Общие представления • По способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе • Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. • В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S , N , P , As , Si , Ge , Sn , Pb , B , Ti и другие элементы.
Общие представления • По способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе • Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. • В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S , N , P , As , Si , Ge , Sn , Pb , B , Ti и другие элементы.
 • Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями. • Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов.
• Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями. • Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов.
 • Законы химии управляют поведением как неорганических, так и органических веществ. • Органические соединения имеют ряд отличительных особенностей. • большинство неорганических соединений – тугоплавкие вещества • для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; • большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические.
• Законы химии управляют поведением как неорганических, так и органических веществ. • Органические соединения имеют ряд отличительных особенностей. • большинство неорганических соединений – тугоплавкие вещества • для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; • большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические.
 • К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200 -200000 углеродных атомов. • Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами. • Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С — связи (339 КДж) — весьма устойчивы.
• К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200 -200000 углеродных атомов. • Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами. • Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С — связи (339 КДж) — весьма устойчивы.
 Теория химического строения • Создана в 1858 -1861 г. г. в русским химиком А. М. Бутлеровым. • Основные положения теории химического строения: • Молекулы веществ — представляют собой реально существующие материальные частицы, обладающие определенным химическим строением. Т. е. атомы, образующие их, соединяются друг с другом в определенной, характерной для каждого вещества последовательности и взаимно влияют друг на друга. • Строение молекул вещества познаваемо и может быть установлено путем изучения свойств вещества, продуктов его превращений, а также путем его разложения и синтеза.
Теория химического строения • Создана в 1858 -1861 г. г. в русским химиком А. М. Бутлеровым. • Основные положения теории химического строения: • Молекулы веществ — представляют собой реально существующие материальные частицы, обладающие определенным химическим строением. Т. е. атомы, образующие их, соединяются друг с другом в определенной, характерной для каждого вещества последовательности и взаимно влияют друг на друга. • Строение молекул вещества познаваемо и может быть установлено путем изучения свойств вещества, продуктов его превращений, а также путем его разложения и синтеза.
 • Свойства вещества определяются его качественным и количественным составом и химическим строением его молекул. Вещества, имеющие одинаковые состав и молекулярный вес, но различное строение, отличаются по своим свойствам; в этом заключается явление изомерии. • Взаимное влияние атомов, образующих молекулу, определяет реакционную способность каждого из них ; химический характер одних и тех же атомов в различных молекулах зависит от того, с какими атомами они связаны в данной молекуле.
• Свойства вещества определяются его качественным и количественным составом и химическим строением его молекул. Вещества, имеющие одинаковые состав и молекулярный вес, но различное строение, отличаются по своим свойствам; в этом заключается явление изомерии. • Взаимное влияние атомов, образующих молекулу, определяет реакционную способность каждого из них ; химический характер одних и тех же атомов в различных молекулах зависит от того, с какими атомами они связаны в данной молекуле.
 • Углерод в органических соединениях, как правило, четырехвалентен ; атомы его способны соединяться не только с другими атомами, но и друг с другом, образуя цепи; последние могут замыкаться с образованием циклов. Это свойство углерода и явление изомерии и обуславливают многообразие органических веществ. В развитии и обосновании теории химического строения большую роль сыграли русские химики – ученики и последователи А. М. Бутлерова: В. В. Марковников, А. М. Зайцев, Е. Е. Вагнер, Н. Д. Зелинский, М. И. Коновалов, А. Е. Фаворский и др.
• Углерод в органических соединениях, как правило, четырехвалентен ; атомы его способны соединяться не только с другими атомами, но и друг с другом, образуя цепи; последние могут замыкаться с образованием циклов. Это свойство углерода и явление изомерии и обуславливают многообразие органических веществ. В развитии и обосновании теории химического строения большую роль сыграли русские химики – ученики и последователи А. М. Бутлерова: В. В. Марковников, А. М. Зайцев, Е. Е. Вагнер, Н. Д. Зелинский, М. И. Коновалов, А. Е. Фаворский и др.
 Электронное строение органических соединений • Характер связей в органических соединениях • Для молекул органических соединений наиболее характерны ковалентные связи. Как известно, атом углерода имеет четыре валентных электрона. • В соответствии с его положением в периодической системе элементов (2 период, 1 группа, порядковый номер 6) углерод прочно удерживает электроны в своем внешнем слое и в то же время не склонен отнимать электроны у других атомов. Поэтому связь атомов углерода с атомами различных элементов и друг с другом осуществляется путем образования обобщенных пар , т. е. при помощи ковалентных связей.
Электронное строение органических соединений • Характер связей в органических соединениях • Для молекул органических соединений наиболее характерны ковалентные связи. Как известно, атом углерода имеет четыре валентных электрона. • В соответствии с его положением в периодической системе элементов (2 период, 1 группа, порядковый номер 6) углерод прочно удерживает электроны в своем внешнем слое и в то же время не склонен отнимать электроны у других атомов. Поэтому связь атомов углерода с атомами различных элементов и друг с другом осуществляется путем образования обобщенных пар , т. е. при помощи ковалентных связей.
 Атом углерода, как правило, образует четыре ковалентные связи • , т. к. только в этом случае у него создается устойчивый восьмиэлектронный внешний слой. Этим объясняется то, что в большинстве случаев валентность углерода равна четырем. В молекуле метана углерод образует ковалентные связи с четырьмя атомами водорода, у каждого из которых создается устойчивый двухэлектронный слой. В молекуле этана одна из электронных пар осуществляет ковалентную связь между двумя углеродными атомами.
Атом углерода, как правило, образует четыре ковалентные связи • , т. к. только в этом случае у него создается устойчивый восьмиэлектронный внешний слой. Этим объясняется то, что в большинстве случаев валентность углерода равна четырем. В молекуле метана углерод образует ковалентные связи с четырьмя атомами водорода, у каждого из которых создается устойчивый двухэлектронный слой. В молекуле этана одна из электронных пар осуществляет ковалентную связь между двумя углеродными атомами.
 • каждая простая связь между атомами осуществляется одной обобщенной электронной парой. • веществах с кратными связями двойная связь возникает вследствие образования соединяющимися атомами двух, а тройная – трех обобщенных электронных пар.
• каждая простая связь между атомами осуществляется одной обобщенной электронной парой. • веществах с кратными связями двойная связь возникает вследствие образования соединяющимися атомами двух, а тройная – трех обобщенных электронных пар.

 Состояние валентных электронов в атоме углерода • электронная структура невозбужденного атома углерода может быть выражена формулой • 1 s 2 2 p 2, • во втором (внешнем) электронном слое у него два спаренных (с противоположными спинами) s — электрона и только два неспаренных p -электрона, которые могут участвовать в образовании ковалентных связей.
Состояние валентных электронов в атоме углерода • электронная структура невозбужденного атома углерода может быть выражена формулой • 1 s 2 2 p 2, • во втором (внешнем) электронном слое у него два спаренных (с противоположными спинами) s — электрона и только два неспаренных p -электрона, которые могут участвовать в образовании ковалентных связей.
 • углерод должен был бы проявлять валентность, равную двум, но в большинстве своих соединений он четырехвалентен – образует четыре ковалентные связи. • Это объясняется тем, что при затрате некоторой энергии происходит «распаривание» 2 s — электронов: один из них переводится на свободную орбиту подуровня 2 p , и атом переходит в возбужденное состояние
• углерод должен был бы проявлять валентность, равную двум, но в большинстве своих соединений он четырехвалентен – образует четыре ковалентные связи. • Это объясняется тем, что при затрате некоторой энергии происходит «распаривание» 2 s — электронов: один из них переводится на свободную орбиту подуровня 2 p , и атом переходит в возбужденное состояние
 • у атома углерода, участвующего в образовании четырех ковалентных связей, во внешнем электронном слое, четыре валентных электрона. • Состояние их не одинаково. Один из них ( s — электрон), двигаясь вокруг ядра образует шаровое облако, подобное облаку электрона в атоме водорода ( s -состояние электрона).
• у атома углерода, участвующего в образовании четырех ковалентных связей, во внешнем электронном слое, четыре валентных электрона. • Состояние их не одинаково. Один из них ( s — электрон), двигаясь вокруг ядра образует шаровое облако, подобное облаку электрона в атоме водорода ( s -состояние электрона).
 • Облака трех других электронов ( p — электроны) имеют форму объемных восьмерок (гантелей) с «перетяжкой» в области ядра и ориентированных в трех взаимно перпендикулярных направлениях ( p — состояния электрона)
• Облака трех других электронов ( p — электроны) имеют форму объемных восьмерок (гантелей) с «перетяжкой» в области ядра и ориентированных в трех взаимно перпендикулярных направлениях ( p — состояния электрона)
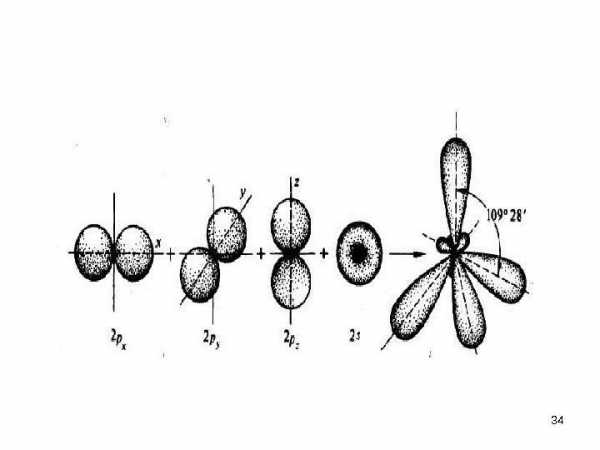
 • Когда углерод, проявляя валентность четыре, соединяется простыми (ординарными) связями с четырьмя другими атомами, электронная плотность облаков всех четырех валентных электронов перераспределяются. Происходит гибридизация одного s — состояния и трех p — состояний электронов.
• Когда углерод, проявляя валентность четыре, соединяется простыми (ординарными) связями с четырьмя другими атомами, электронная плотность облаков всех четырех валентных электронов перераспределяются. Происходит гибридизация одного s — состояния и трех p — состояний электронов.
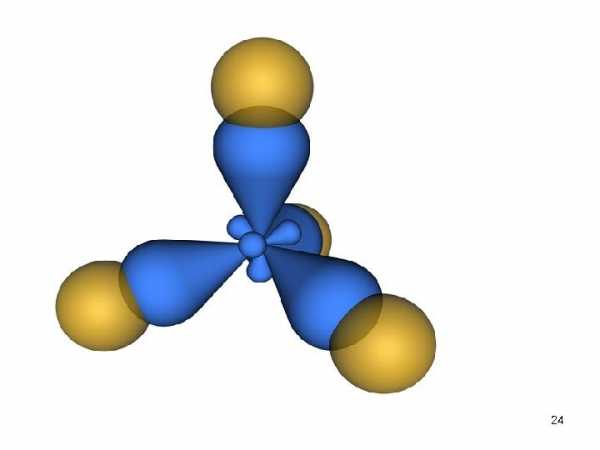
 • В результате во внешнем электронном слое связанного углеродного атома возникают четыре одинаковых гибридных состояния. Занимая эти состояния, валентные электроны образуют гибридные облака , имеющие вид деформированной восьмерки, большая часть которой направлена от ядра по линии связи с другим атомом.
• В результате во внешнем электронном слое связанного углеродного атома возникают четыре одинаковых гибридных состояния. Занимая эти состояния, валентные электроны образуют гибридные облака , имеющие вид деформированной восьмерки, большая часть которой направлена от ядра по линии связи с другим атомом.
 • Такое состояние валентных электронов атома углерода называют sp 3 — гибридизацией (первое валентное состояние углерода). Все четыре гибридных облака имеют определенную направленность в пространстве под углом 109 о 28′ друг к другу, что соответствует о тетраэдрической направленности связей атома углерода.
• Такое состояние валентных электронов атома углерода называют sp 3 — гибридизацией (первое валентное состояние углерода). Все четыре гибридных облака имеют определенную направленность в пространстве под углом 109 о 28′ друг к другу, что соответствует о тетраэдрической направленности связей атома углерода.
 Образование простых связей • простая ковалентная связь между атомами образуется парой обобщенных электронов. • Образование этой пары в заключается во взаимном перекрывании облаков электронов, осуществляющих связь; перекрывание происходит при сближении атомов на определенное расстояние. • Между этими атомами на прямой, соединяющей их центры, возникает наибольшая электронная плотность (область максимального перекрывания облаков). К этой области повышенной плотности отрицательного заряда притягиваются положительно заряженные ядра атомов, следствием чего и является возникновение химической c вязи.
Образование простых связей • простая ковалентная связь между атомами образуется парой обобщенных электронов. • Образование этой пары в заключается во взаимном перекрывании облаков электронов, осуществляющих связь; перекрывание происходит при сближении атомов на определенное расстояние. • Между этими атомами на прямой, соединяющей их центры, возникает наибольшая электронная плотность (область максимального перекрывания облаков). К этой области повышенной плотности отрицательного заряда притягиваются положительно заряженные ядра атомов, следствием чего и является возникновение химической c вязи.
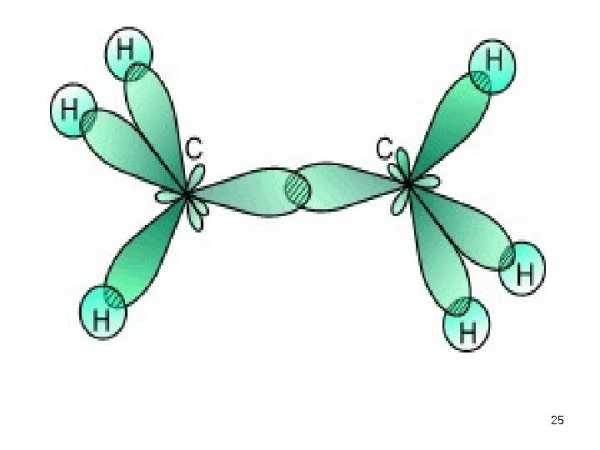
 Простая связь • между атомами водорода и углерода H — C (или H : C ) является следствием перекрывания шарообразного облака электрона атома водорода и гибридного облака одного из валентных электронов атома углерода. • Простая связь между двумя углеродными атомами C — C (или C : C ) осуществляется вследствие перекрывания двух гибридных облаков углеродных атомов.
Простая связь • между атомами водорода и углерода H — C (или H : C ) является следствием перекрывания шарообразного облака электрона атома водорода и гибридного облака одного из валентных электронов атома углерода. • Простая связь между двумя углеродными атомами C — C (или C : C ) осуществляется вследствие перекрывания двух гибридных облаков углеродных атомов.
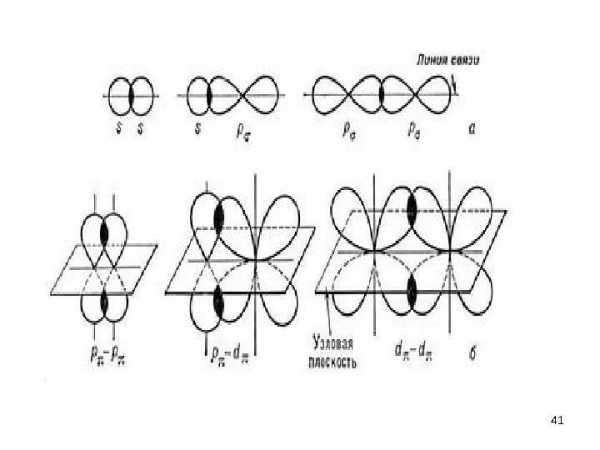
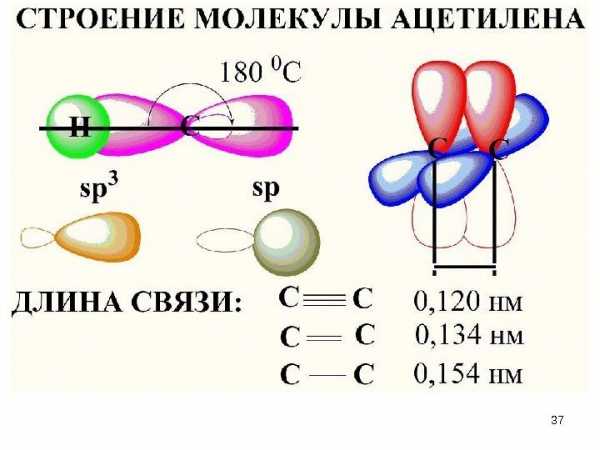
 • Связи указанного типа, в которых максимальное перекрывание электронных облаков осуществляется на линии между центрами атомов, называются -связями, а электроны, участвующие в их образовании, — электронами. • Каждая ковалентная связь характеризуется определенным расстоянием между ядрами соединенных атомов. Это расстояние называется межъядерным расстоянием , или длиной связи. Длина простой связи C — C составляет 1, 54 А (0, 154 нм).
• Связи указанного типа, в которых максимальное перекрывание электронных облаков осуществляется на линии между центрами атомов, называются -связями, а электроны, участвующие в их образовании, — электронами. • Каждая ковалентная связь характеризуется определенным расстоянием между ядрами соединенных атомов. Это расстояние называется межъядерным расстоянием , или длиной связи. Длина простой связи C — C составляет 1, 54 А (0, 154 нм).
present5.com
Органическая химия Основные положения органической химии
Тест. Ng 15 по теме Основные положения органической химии 442 9.2. Электронные эффекты заместителей в органических соединениях 445 9.3, Предельные углеводороды (алканы) 448 9.4. Понятие о циклоалкаиах 464 9.5. Непредельные углеводороды. Алкены (этиленовые УВ) 466 9.6. Диеновые углеводороды (алкадиены). Каучуки 477 9.7. Алкины (ацетиленовые УВ) 485 Тест № 16 по теме Предельные и непредельные углеводороды 495 [c.725]Основные положения органической химии. Углеводороды [c.426]
Раздел 9. Основные положения органической химии. Углеводороды 426 [c.725]
ГЛАВА 8. ОСНОВНЫЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ [c.218]
В учебнике в краткой, нетрадиционной форме освещены основные положения органической химии. Изложению фактического материала предшествует краткое описание номенклатуры органических соединеиий, теории химической связи, классификации реагентов и реакций. Классы органических соединений рассмотрены сначала по реакционной способности, а затем по способам синтеза. При этом большое внимание уделено выявлению связи между химическим поведением н электронным строением реагентов. [c.4]
Основные положения органической химии [c.427]
Если основные положения теории химического строения только были развиты и получили глубокое обоснование и ясную формулировку , то это наводит на мысль, что кто-то, до А. М. Бутлерова, уже создал теорию химического строения, а Бутлеров только развил ее и глубоко обосновал. Это неверная мысль, она находится в полном противоречии с оценкой значения трудов Бутлерова, данной великим русским химиком Д. И. Менделеевым, который считал, что нанравление ученых трудов Александра Михайловича не составляет продолжения или развития идей его предшественников, а принадлежит ему самому. В химии существует бутлеровская школа и бутлеровское направление (Д. И. Менделеев. Соч., т. 15. Изд. АН СССР, 1949, стр. 295). А. М. Бутлеров вывел органическую химию из тупика, из неловкого положения, в котором она находилась, и создал принципиально новую, покоящуюся на материалистических принципах теорию химического строения и тем самым сделал органическую химию настоящей наукой, дающей перспективу, силу ориентировки в многочисленных и сложных исследованиях химиков. [c.403]
Технологические процессы получения пленкообразующих веществ многочисленны и разнообразны. Необходимой предпосылкой для их понимания и управления ими является знание механизма и кинетики соответствующих реакций синтеза. В связи с этим авторы сделали попытку уделить особое внимание рассмотрению основных химических и кинетических закономерностей и механизмов реакций синтеза полимеров и пленкообразующих веществ, постоянно подчеркивая их тесную взаимосвязь и подчиненность основным положениям органической химии, химии высокомолекулярных соединений и физической химии. [c.7]
Автору удалось в очень сжатой, но в то же время весьма доступной форме изложить те основные положения органической химии, которые необходимо уяснить каждому, начинающему работать в области синтеза, исследования, переработки или применения полимеров. [c.5]
ОСНОВНЫЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ. УГЛЕВОДОРОДЫ [c.453]
РАДИКАЛОВ ТЕОРИЯ — одна из первых основных теорий органической химии, согласно которой органические соединения состоят wi сложных положительно или отрицательно заряженных групп атомов — радикалов, способных соединяться как между собой, так и с другими элементами за счет противоположных зарядов. По Р. т. такие сложные радикалы переходят из одного соединения в другое, не изменяясь они способны также существовать в свободном состоянии, подобно атомам элементов. Р. т., развиваясь, подвергалась существенным изменениям и осложнениям, однако она оставила большой след в истории органической химии. Некоторые ее положения сохранили свое значение и в современной науке. [c.208]
Строение можно изучать химическими методами — второе важнейшее положение Бутлерова — также не потеряло своего значения в наши дни. Изучение строения органических соединений — природных и синтетических — было и остается основной задачей органической химии. При этом, как и во времена А. М. Бутлерова, мы пользуемся методами химического анализа и синтеза. Однако наряду с ними в наше время широко применяются физические методы определения строения — разные виды спектроскопии, ядерный магнитный резонанс, масс-спектрометрия, определение дипольных моментов, рентгенография, электронография. Значение этих методов ныне столь велико, что, дополняя Бутлерова, в наше время мы можем сказать строение можно изучать химическими и физическими методами. [c.31]
Авторы знакомят нас на современном уровне с общими закономерностями й положениями органической химии, с логикой этой науки. Фундамент книги составляет тщательно отобранный фактический материал, обсуждение которого выявляет основные теоретические положения органической химии, проходящие красной нитью через весь учебник. [c.5]
Весьма вероятно, что математизация науки вообще и биологии в частности приведет к тому, что в скором будущем любой специалист-биолог должен будет уметь легко оперировать довольно сложными физико-химическими и математическими интерпретациями основных процессов органической химии. Изучение современных теоретических положений органической химии, безусловно, должно способствовать этому [c.3]
Изучая реакции определенного типа, в которых в реагирующие молекулы вводятся различные заместители, можно получить значительные сведения о механизме реакции. Например, можно исследовать кинетику гидролиза метилбензоата, в котором в орто-, мета- и пара-положениях находятся различные атомы или группы, такие, как С1, СНз, N0. . Изучение влияния этих заместителей на скорость, предэкспоненциальный множитель и энергию активации способствует более глубокому пониманию молекулярного механизма. Эта проблема составляет предмет физической органической химии и в данной работе рассматривается в основном с кинетических позиций. Заместители оказывают влияние на скорость химических реакций частично за счет изменения в молекуле электронной плотности. Определенному типу реакции благоприятствует увеличение электронной плотности у реакционного центра. В этих случаях скорость реакции возрастает обычно за счет уменьшения энергии активации. Примером может служить реакция пиридина с иодистым метилом [c.250]
Уровень развития науки в первой половине 40-х годов XX в. обусловил временный отказ химиков от глубоко обоснованного изучения характера такой связи и переход к детализации и расширению области применения установленных Хьюзом и Инголдом (в 1935 г.) качественных зависимостей кинетических характеристик реакций замещения от механизма этих реакций. Однако такой реалистический подход к решению одного из основных вопросов органической химии превратился со временем в психологический барьер для более глубокого рассмотрения структурно-кинетических закономерностей. Тем не менее даже столь эмпирическое рассмотрение проблемы создало предпосылки для более глубокого ее изучения во второй половине 40-х —начале 50-х годов XX в. (Эванс, Хьюз, Инголд, Уотерс). Однако приближенный характер изучения механизмов реакций не позволил химикам сделать определенные заключения о природе связи между строением органических молекул и скоростями их взаимодействий. Поэтому не удивительно, что к началу 50-х годов XX в. стал отчетливо заметен переход химиков от попыток использования положения теории абсолютных скоростей реакций (нача- [c.139]
Позвольте мне остановиться несколько подробнее, чем это мог сделать А. П. Теренин, на бутлеровской теории строения, которая до сих пор является единственной и основной теорией органической химии, ее незыблемым фундаментом, и в своем современном аспекте самым неразрывным образом связана с теми основными положениями, которые были выдвинуты ее творцом. 19 сентября этого года исполнится 90 лет с того дня, когда А. М. Бутлеров на 36-м съезде немецких врачей и естествоиспытателей сделал доклад О химическом строении веществ . Основные положения этого доклада открыли новую эру развития органической химии, продолжающуюся и в наши дни,и являются близкими и понятными для нас. [c.72]
Основное содержание книги — рассмотрение в достаточно компактной форме всех основных экспериментально установленных и теоретически обоснованных положений органической химии, необходимых для инженеров-химиков-технологов — выпускников технического укиверситета. Основная цель пособия — помочь и максимально облегчить постижение основ этой интереснейшей науки — органической химии. [c.10]
В Приложение книги вынесены вопросы для семинарских занятий, на которых рассматриваются основные теоретические положения органической химии, механизмы химических реакций, номенклатура и изомерия, а также специальные разделы лекционного курса (кремнийорганические соединения, ПАВ, полимерные материалы и их приме-нёйие в строительстве) и др. Там же приведены краткие сведения о справочной и ре ративной литературе по органической химии и литературе по использованию органических продуктов в строительстве и производстве строительных материалов, рекомендации по приготовлению реактивов для лабораторных работ, правила номенклатуры органических соединений и другой справочный материал. [c.4]
ХИМИЧЕСКОГО СТРОЕНИЯ ТЕОРИЯ — основная теория органической химии, представляющая систему положений, главным нз которых является закономерность в зависимости свойств органических соединений от их хими 1еского строения, т. е. от последовательности связен между атомами в молекулах соедииений. Основные положения теории [c.274]
Понятие структуры в химии ирименяется к таким системам, как атом, молекула, молекулярныГ комплекс и макротело. Однако основным структурным объектом химии является все же молекула, рассматриваемая в са.мом широком смысле этого слова как единая квантово-механическая система, в том числе, следовательно, и любая гигантская молекула, например монокристалл. Структура макротел становится в связи с этим своего рода производным объектом от структуры молекулы. Что же касается структуры атома, то таковая скорее (. тносится к ( mi.ui4( ki m объекта.м или, во всяком случае, занимает в химии иодчиненное положение ио отношению к структуре молекул. Поэтому то, что обычно называют структурной химией, является в сущности учением о структуре молекул более того, преимущественно учением о структуре органических молекул, ибо структурная неорганическая химия, появившаяся относительно недавно, представлена совери1енно особым разделом науки химией тве .)дого тела. [c.77]
Методы и теоретические положения органической химии наиболее эффективно применимы для изучения равновесия, реакционной способности и биологических функций молекул, находящихся в высокосольватированном состоянии. В этой главе рассмотрены конформационные свойства полисахаридов (в основном в растворах) и кратко описаны некоторые достижения в области определения конформации полисахаридов методом рентгеноструктурного анализа. [c.282]
В XVII—XVIII вв. широкое признание среди ученых получила теория горючего начала—флогистона, сформулированная немецким химиком и врачом Г. Шталем. Несмотря на ошибочность основных положений, теория флогистона (объяснявшая процессы горения выделением из горящего тела особого невесомого вещества) сыграла в истории науки положительную роль, так как способствовала развитию экспериментального направления в химии. Опровержение этой теории связано с работами М. В. Ломоносова и А. Лавуазье, открывших в науке основные законы сохранения энергии и вещества, справедливые и для биологических объектов. Кроме того, А. Лавуазье показал, что при дыхании, как и при горении органических веществ, поглощается кислород и выделяется углекислый газ. [c.16]
В ней изложены основные теоретические положения органической химии в их историческом развитии и систематически рассмотрены на современном уровне знаний все важнейшие классы органических соединений. Из индивидуальных предстарителей этих классов более подробно описаны соединения, имеющие практическое, теоретическое или историческое значение. [c.2]
chem21.info
Основные положения органической химии Углеводороды
Тест. Ng 15 по теме Основные положения органической химии 442 9.2. Электронные эффекты заместителей в органических соединениях 445 9.3, Предельные углеводороды (алканы) 448 9.4. Понятие о циклоалкаиах 464 9.5. Непредельные углеводороды. Алкены (этиленовые УВ) 466 9.6. Диеновые углеводороды (алкадиены). Каучуки 477 9.7. Алкины (ацетиленовые УВ) 485 Тест № 16 по теме Предельные и непредельные углеводороды 495 [c.725]Основные положения органической химии. Углеводороды [c.426]
Раздел 9. Основные положения органической химии. Углеводороды 426 [c.725]
ОСНОВНЫЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ. УГЛЕВОДОРОДЫ [c.453]
Еще 10—12 лет назад основным источником ароматических углеводородов являлась каменноугольная смола, получаемая при сухой перегонке каменного угля. Если в начале XIX в. сухая перегонка каменного угля велась исключительно с целью получения светильного газа и кокса, нужного для черной металлургии, а каменноугольная смола являлась отбросом, не находившим сбыта, то вскоре после того как в 1842 г. Николаем Николаевичем Зининым был открыт метод превращения ароматических нитросоединений в аминосоединения и был синтезирован анилин, положение резко изменилось. Этим открытием русского ученого было положено начало развитию анилинокрасочной промышленности, и многие заводы стали легко находить сбыт каменноугольной смолы, испытывая при этом затруднения со сбытом кокса. Непрерывный рост анилинокрасочной промышленности, а за ней и возникновение фармацевтической и других отраслей промышленности органической химии повысили спрос на ароматические углеводороды до небывалого уровня. Общеизвестно, например, какое значение имеет для оборонной промышленности толуол Во время первой мировой войны 1914—1918 гг. обе воюющие стороны испытывали большой недостаток в толуоле, который, правда, применялся и в мирное время в качестве растворителя, а также для синтеза красящих и фармацевтических препаратов и т. п., однако во время войны он требовался в несоизмеримо больших количествах. Насколько резко возрастает потребность в толуоле во время войны, можно судить по данным, относящимся к войне 1914—1918 гг. [c.7]
Теория электролитической диссоциации заложила основу ионной теории строения солей и других электролитов. Открытие электрона, явившееся логическим завершением установленных Фарадеем количественных законов электролиза, было следующей предпосылкой для создания теории электровалентности. Наиболее характерным химическим актом стало представляться образование катионов и анионов, связанных простым электростатическим притяжением. Катионы получаются из атомов металлов, потерявших электроны, захваченные другими атомами, образующими анионы. Наиболее полно и последовательно это представление было использовано Косселем (1917 г.) в применении к соединениям и процессам неорганической химии. Однако и Косселю было ясно, что неполярные (или гомеополярные) вещества (например, двухатомные молекулы таких элементов, как водород или азот, углеводороды и др.) следует рассматривать с других позиций. Этот другой подход был развит к 1916 г. Льюисом, однако вследствие разразившейся в то время первой мировой войны его теория не сразу стала повсеместно известной. Основное положение теории Льюиса, сохранившееся незыблемым для громадного большинства органических веществ, — образование химической связи в неионно построенных соединениях (так называемой ковалентной связи) за счет пары электронов, выделяемых по одному каждым из связываемых атомов. Таким образом, обычным формулам соответствуют следующие льюисовские формулы [c.20]
Преимущество нового метода по сравнению с методами синтетической органической химии заключается в его универсальности по этому методу можно получать очень много дейтерированных соединений, в том числе и таких, способы приготовления которых в литературе до сих пор еще не описаны. Далее сопоставление методов приготовления одних и тех же дейтерированных углеводородов синтезом или дейтерообменом показывает, что второй метод относительно проще первого. Наконец следует отметить, что, исходя из особенностей реакционной способности углеводородов в основных и кислых средах и учитывая данные по кинетике изотопного обмена неравноценных атомов водорода в молекуле углеводорода в присутствии катализатора или без него, а также варьируя другие условия осуществления обменной реакции, удается замеп1ать на дейтерий только часть атомов водорода и вводить дейтерий в определенные положения в молекуле углеводорода. [c.33]
Теория строения в органической химии возникла и развивалась на основе представления о тетраэдрическом строении углеродного атома. Она получила мощный стимул для своего развития в электронной теории валентности, основные положения которой рассматривались в гл. 5. Теперь можно выражать строение большого числа органических соединений с помощью простых схем, описывающих связи-, они легко могут быть преобразованы в трехмерные модели, отвечающие разнообразию молекулярных свойств. Однако существует большое число соединений, для которых обычная структурная теория не-дает исчерпывающего описания, поскольку используемые структуры не отражают в достаточной мере действительного строения молекул. В ряду таких соединений особое место занимают ароматические углеводороды, или арены, и в частности бензол СбНб, который заслуживает наибольшего внимания. Несмотря на то что эти соединения напоминают полиены в том отношении, что они содержат меньше 2п 2) п атомов водорода на атом углерода, их химическая устойчивость приближается к устойчивости алканов. [c.207]
Материал этой главы является основным и наиболее трудным в курсе органической химии. Трудности усугубляются также тем, что вопросы темы излагаются до изучения метана и других предельных углеводородов, примерами которых обычно иллюстрируют положения теории строения органических соединений. Для изложения этого материала до рассмотрения метана и его гомологов необходимо хорошее предварительное ознакомление учащихся с метаном и другими предельными углеводородами. В противном случае изложение теории А. М. Бутле-. рова превратится в догматическую констатацию основных положений без углубления их рассмотрением конкретных примеров органических соединений. При слабой подготовке учащихся, очевидно, лучше изложить этот материал после изучения метана и его гомологического ряда. [c.38]
П рямым развитием классич. теории химич. строения следует считать теорию электронных смещений (см. Индукционный эффект, Индуктомерный эффект, Мезомерия). Особенно большое значение имела теория электронных смещений для истолкования физич. смысла основных положений и частных правил, относящихся к взаимному влиянию атомов. Другой путь развития классич. X. с. т. наметился после возникновения квантовой химии. Ее методы сводятся к тому, что электронное строение молекул рассчитывается в тех или иных приближениях при помощи уравнений квантовой механики, а полученные данные о распределении электронов коррелируются со свойствами органич. частиц (молекул, радикалов, ионов) нли их структурных элементов. И нри таком методе представления о взаимном влиянии атомов приобретают более глубокий смысл. Напр., согласно одному из правил Марковникова, замещение по связям С—Н в предельных углеводородах идет в метиленовых группах легче, чем в метильных. Расчеты методом молекулярных орбит (К. Сандорфи, 1955) показали, что в пропане на связь С—Н в метиленово группе из общего а-электронного облака приходится 1,907, а на связь С—Н метильной группе 1,921 а-электрона. Отсюда очевидный вывод, что замещение в предельных углеводородах идет легче всего по связи С—Н с меньшим а-электронным зарядом. Квантово-химич. теории электронного строения органических соединений — теории количественные и в этом их преимущество как перед классической теорией химического строения, так и перед теорией электронных смещений. [c.330]
В 1863 г. в статье О различных объяснениях некоторых случаев изомерии А. М. Бутлеров дал решение самой трудной проблемы того времени — объяснил явление изомерии. Эта работа обратила на себя внимание химиков и привела к тому, что, нанример, Кекуле, еще в 1863 году в 1-ом выпуске 2-го тома своего учебника широко использовавший сложные типы, во 2-ом выпуске того же тома (1864) почти полностью отказался от них. Особенно большое значение для победы идей теории химического строения имели экспериментальные работы А. М. Бутлерова. В 1864 году он получил триметилкарбинол и истолковал в духе теории химического строения изомерию спиртов СпНзп+ ОН. В том же году он предсказал существование изомерии среди предельных углеводородов, что противоречило взглядам Вюрца и Шорлеммера, а в 1865 г.— существование изобутилена. В этом же году он сообщил о получении предсказанных им трех высших гомологов триметилкарбинола, в 1866 году — о получении изобутана, а в 1867 году — изобутилена. Теория химического строения, таким образом, нашла блестящее опытное подтверждение и со второй половины 60-х годов превратилась в господствующую теорию органической химии химики устремились к исследованию химичес1 ого строения многочисленных уже известных веществ и к получению новых, предсказанных теорией химического строения. В то же время в развитие ее основных положений были высказаны плодотворные [c.5]
Г. Д. И. изложил всю органическую химию на основе теории пределов, даже не упомянув о теории строения. Всякое упоминание о теории строения отсутствует и во 2-м издании Органической химии 1863 г. (см. т. VIII, стр. 37 и далее). В ч. 1 Основ химии , которая писалась в 1868 г., Д. И. высказывает ту мысль, что образование предельных углеводородов можно объяснить как связью, существующей между атомами углерода (т. е. теорией строения), так и представляя возможность существования группы метила СН , способной заменять водород (т. XIII, стр. 541). Д. И. считает, что гипотеза о взаимном совокуплении атомов (так он передает основную идею теории строения) равнозначна с допущением остатка СН , способного заменять Н. Большинство химиков применяет первый способ выражения, хотя последний ведет к тем же результатам и имеет то преимущество, что довольствуется одним допущением (замены СН и И), тогда как первое воззрение требует двух допущений (четырех сродств углерода и способности его удерживать другие атомы углерода) . Наоборот, последнее воззрение не вдается в гипотезу, а понятие об остатке считает как средство выражения и обобщения, поэтому предпочтительно удерживается теми, кто боится вдаваться в область гипотез, много раз изменявшихся в историческом движении науки. Последователи того учения, которое старается подвести все данные к предположению о четырехатомности углерода, имеют в свое оправдание историю наук, показывающую, что гипотезы, хотя бы даже оказавшиеся впоследствии неверными, дают повод и составляют побудительную причину дальнейшей разработки предмета (т. XIII, стр. 542). Однако, по мнению Д. И., уже в случае непредельных углеводородов вопрос об их с т р о е н и и поставлен последователями названного учения на столь сомнительную почву, что более вредит ему, чем приносит пользу, а в применении к другим элементам, например азоту, это учение еще более страдает отсутствием строгости (там жо). И Д. И. ссылается на то, что существуют факты, ослабляющие, а иногда и уничтожающие многие основные положения этого учения (там же). К таким фактам Д. И. относил прежде всего факты, свидетельствующие о переменной атомности (валентности) у элементов. [c.712]
Последние три года, предшествовавшие Великой Октябрьской революции в России, С. В. Лебедев был так сильно загружен педагогической работой, что на самостоятельные научные исследования почти совсем не оставалось ни сил, ни свободного времени. Теперь материальное положение Сергея Васильевича Лебедева стало прочным, но он не чувствовал удовлетворенности. Кафедры химии в обоих институтах были не основными, студентам были далеки интересы научных исследований в области органической химии. Сергей Васильевич не имел возможности отобрать из числа оканчивающих студентов хороших помощников и учеников для развития научных исследований. Ассистенты на кафедрах были полностью загружены педагогической работой. В этот период исследования велись медленно и в очень небольшом объеме. Результаты изучения процессов полимеризации за эти годы были сообщены Сергеем Васильевичем Химическому обществу. Кроме уже упоминавшегося сообщения о полимеризации ацетиленовых углеводородов, 15 мая 1914 г. он сделал также предварительное сообщение о полимеризации фе-нилбутадиена-1,3. Напряженная работа в течение года сильно утомляла Сергея Васильевича, не отличавшегося хорошим здоровьем. Для восстановления работоспосбно-сти ему требовалось полностью выключиться из рабочей обстановки на 2—3 летних месяца. [c.51]
chem21.info
