Органические вещества клетки
Существует 4 класса органических веществ, входящих в состав клеток: белки, жиры, углеводы и нуклеиновые кислоты.
Биополимеры
Биологические полимеры – высокомолекулярные органические соединения, молекулы которых состоят из большого числа повторяющихся звеньев – мономеров. К биополимерам относятся белки (состоят из аминокислот), нуклеиновые кислоты (состоят из нуклеотидов), полисахариды и их производные (состоят из моносахаридов).
По форме биополимеров могут быть линейными (белки, нуклеиновые кислоты, целлюлоза) или ветвящимися (гликоген, крахмал).
Свойства биополимеров 1. Кооперативность
Тесная взаимосвязь всех функциональных групп, то есть взаимодействие одних групп полимера изменяет характер взаимодействия других его групп. Например, связывание кислорода белком эритроцитов крови – гемоглобином.
2. Способность образовывать интерполимерные комплексы
Такие комплексы могут возникать как между отдельными частями молекулы, так и между разными молекулами. Благодаря образованию комплексов осуществляются биосинтез белков, нуклеиновых кислот, регуляция обмена веществ и другие биологические процессы.
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Углеводы
Углеводы — органические вещества, в состав которых входят углерод, кислород и водород. Образуются в процессе фотосинтеза из воды и углекислого газа. Различают — моносахариды (состоят из одной молекулы) (глюкоза, рибоза и т.д.), дисахариды — соединение двух молекул (сахароза, мальтоза) и полисахариды — в их состав входит много молекул сахара (крахмал, гликоген, клетчатка, пектин, инулин, хитин).
Функции углеводов
1. Входят в состав многих органических веществ (рибоза — в состав РНК, АТФ, ФАД, НАД, НАДФ, дезоксирибоза — в состав ДНК)
2. Глюкоза — является источником энергии (окисляется при дыхании)
3. Многие углеводы являются запасными веществами — крахмал у растений, гликоген — у грибов и животных
4. Входят в состав многих компонентов клеток и тканей (гликокаликс, гепарин, кликопротеины, пектины, полисахариды, гемицеллюлоза, хитин, муреин, тейхоевые кислоты)
5. Защитная — в составе гликокаликса участвует в процессе клеточного распознавания, входят в состав иммуноглобулинов, входят в состав камеди (выделяется при повреждении стволов) и в состав клеточной стенки многих организмов
Белки
Белки — это органические вещества-полимеры, мономерами которых являются аминокислоты (гемоглобин, альбумин, коллаген, эластин и многие другие).
Белки имеют 4 структуры
Первичная — линейная последовательность аминокислот, соединенная в полипептиднуй цепь
Вторичная — спираль, состоящая из двух цепей, соединенных водородными связями
Третичная — глобула или фибриллярная структура (уложенные слои или суперскрученная спираль). Ионные, водородные, ковалентные (дисульфидные мостики), гидрофобные взаимодействия между составными частями
Четвертичная — несколько глобул или микрофибриллы, соединенные силами межмолекулярного притяжения
Бывают: собственно белки и ферменты.
Ферменты — биологические катализаторы, не только ускоряют, но и осуществляют большиснтво реакций в живых организмах.
Ферменты – это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулами, которые вступают в реакцию. Ферменты отличаются от химических катализаторов высокой степенью специфичности, то есть фермент катализирует только одну реакцию или действует только на один тип связи. Скорость ферментативных реакций зависит от многих факторов – природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т.д.
Классификация ферментов 1. Оксидоредуктазы
Окислительно-восстановительные реакции: перенос атомов водорода (Н) и кислорода (О) или электронов от одного вещества к другому, при этом окисляется первый и восстанавливается второй. Участвуют во всех процессах биологического окисления.
2. Трансферазы
Перенос группы атомов (метильной, ацильной, фосфатной или аминогруппы) от одного вещества к другому. Например, перенос остатков фосфорной кислоты от АТФ на глюкозу или фруктозу под действием фототрансфераз.
3. Гидролазы
Реакции расщепления сложных органических соединений на более простые путем присоединения молекул воды в месте разрыва химической связи (гидролиз). Например, амилаза (гидролизует крахмал), липаза (расщепляет жиры), трипсин (расщепляет белки) и др.
4. Лиазы
Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, C-O, C-S. Например, декарбоксилаза отщепляет карбоксильную группу.
5. Изомеразы
Внутримолекулярные перестройки, превращение одного изомера в другой (изомеризация).
6. Лигазы (синтетазы)
Реакции соединения двух молекул с образованием новых связей с использованием энергии АТФ. Например, фермент валин-т-РНК-синтеза, под действием которого образуется комплекс валин-т-РНК.
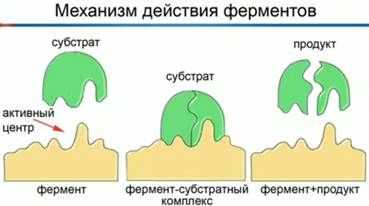
На рисунке представлен механизм действия фермента. В молекуле каждого фермента имеется активный центр – это один или более участков, в которых происходит катализ за счет тесного контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа), или отдельная аминокислота. Активный центр может формироваться связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами или кофакторами. Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (комплементарности) друг другу.
Молекула фермента изменяет глобулярную форму молекулы субстрата. Молекула субстрата, присоединяясь к ферменту, тоже в определенных пределах изменяет свою конфигурацию для увеличения реакционности функциональных групп центра.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Функции белков
1. Ферментативная — ускоряют, а в большинстве случаев осуществляют биохимические реакции в организме
2. Структурная — входят в состав всех мембран, являются компонентом соединительной ткани (костей, хрящей, сухожилий, кожи, волос, ногтей), входят в состав слизистых секретов (мукопротеины). Из белков состоят капсиды вирусов. Входят в состав каружного скелета насекомых.
3. Двигательная — из белков состоят микротрубочки (тубулин), двигательный аппарат жгутиков, актин и миозин — сократительные белки мышц.
4. Транспортная — транспорт через мембрану и внутри клетки, а также белки крови (гемоглобин переносит кислород, гемоцианин переносит кислород в крови беспозвоночных, сывороточный альбумин переносит жирные кислоты, глобулины переносят ионы металлов и гормоны)
5. Защитная — белки иммунитета (интерфероны), белки крови (предотвращают кровопотерю), антиоксиданты (гасят активные формы кислорода)
6. Рецепторная — белки гликокаликса (отвечают за клеточную совместимость), светочувствительные ферменты сетчатки глаза, фитохром у растений (реагирует на изменение длины светового дня)
7. Запасающая — белок-ферритин запасает железо в печени, селезенке, миоглобин запасает кислород в мышцах позвоночных
8. Питательная — белки — источники аминокислот
9. Регуляторная — многие гормоны являются белками (инсулин, соматотропин, пролактин, глюкагон)
10. Антибиотическая — многие антибиотики (противомикробные препараты) являются белками (грамицидин S, актиномицин)
11. Токсическая — многие токсины (опасные для живых организмов вещества) являются белками — ботулинический токсин, столбнячный, холерный, токсины грибов и пчел
Нуклеиновые кислоты: ДНК и РНК
В 1953 г. английские ученые Дж. Уотсон и Ф. Крик предложили модель пространственной струк- туры ДНК. Они показали, что ДНК состоит из двух полинуклеотидных цепей, спирально закрученных одна вокруг другой. Двойная спираль стабилизирована водородными свя- зями между азотистыми основаниями разных цепей так, что против аденина одной цепи всегда стоит ти- мин другой, а гуанина — цитозин. Многократное повторение этих связей придает большую устойчивость двойной спирали ДНК. При опреде- ленных условиях (действие кислот, щелочей, нагревание и т. п.) происходит денатурация ДНК — разрыв водородных связей между компле- ментарными азотистыми основани- ями. Денатурированная ДНК может восстановить двуспиральное строение благодаря установлению водородных связей между комплементарными нуклеотидами — этот процесс называется ренатурацией.
Строение ДНК:
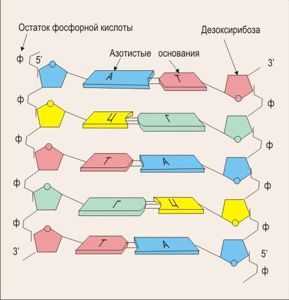
ДНК составляют 4 типа азотистых оснований : А (аденин), Т (тимин), Г (гуанин) и Ц (цитозин).
Нуклеотиды соединяются по принципу комплементарности: А=Т, ГΞЦ
Функции ДНК:
1. Хранение генетической информации
2. Репликация ДНК
3. Синтез РНК
Строение РНК:
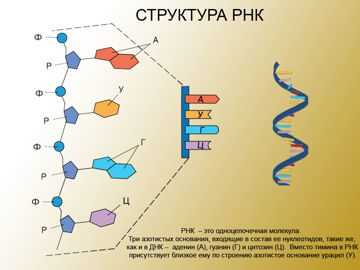
РНК бывает:
1. Рибосомальной (входит в состав рибосом)
2. Транспортной (приносит аминокислоты к рибосомам во время синтеза белка)
3. Информационной (передает информацию о первичной структуре белка на рибосомы)
Принцип комплементарности – избирательное соединение нуклеотидов; свойство, которое лежит в основе образования новых молекул ДНК на базе исходной. Против аденина одной цепи всегда располагается тимин другой цепи, против гуанина – цитозин и наоборот. Таким образом, пары нуклеотидов аденин и тимин, а также гуанин и цитозин строго соответствуют друг другу и являются дополнительными (пространственное взаимное соответствие), или комплементарными.
Образование полимера РНК происходит так же, как и у ДНК. Молекула РНК синтезируется на одной из цепочек ДНК-матрицы по принципу комплементарности. Например, против Г молекулы ДНК становится Ц молекулы РНК, против Ц молекулы ДНК – Г молекулы РНК, против Т молекулы ДНК – А молекулы РНК, а против А молекулы ДНК – У молекулы РНК (вместо тимина РНК несет урацил).
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Правило Чаргаффа: у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гауниловых – числу цитидиловых.
Первое правило: А/Т = Г/Ц = 1.
Второе правило: А + Г = Ц + Т.
Третье правило: А + Ц = Г + Т.
Чаргафф не смог полностью объяснить свои правила, основанные на результатах тщательной аналитической работы с различными образцами ДНК. Однако уже в 1953 г. Это сделали молодые ученые Д. Уотсон и Ф. Крик. Они создали структурную модель молекулы ДНК.
Кириленко А. А. Биология. ЕГЭ. Раздел «Молекулярная биология». Теория, тренировочные задания. 2017.
Липиды
Липиды — жироподобные органические вещества, нерастворимые в воде, но растворимые в неполярных органических растворителях (бензоле, бензине и т.д.).
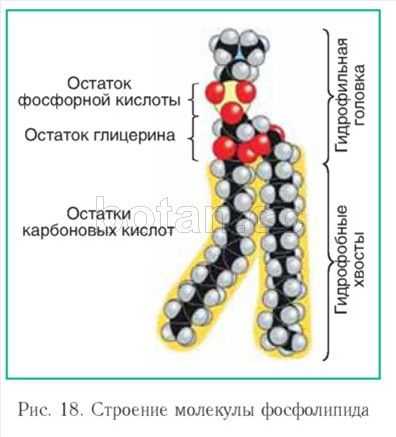
Состоят из глицерина и жирных кислот, при этом глицериновые головки являются гидрофильными, а углеводородные хвосты — гидрофобными. Таким образом, образуется в мембране билипидный слой, через который диффундирует вода и другие вещества.
Строение липидов:
Функции липидов:
1. Энергетическая — при окислении липидов выделяется много энергии
2. Резервная — жиры являются запасным веществом и в ходе окисления жиров выделяется вода, которая очень важны, например, для жителей пустыни
3. Структурная — из фосфолипидов состоят мембраны всех живых организмов, гликолипиды участвуют в межклеточных контактах в тканях животных, сфинголипиды обеспечивают электрическую изоляцию аксона, создавая условия для быстрого прохождения импульса, пчелы из воска строят соты
4. Защитная — термоизоляция и амортизация, воски являются водоотталкивающими веществами у растений, гликолипиды участвуют в распознавании токсинов
5. Регуляторная — некоторые гормоны — липиды (тестостерон, прогестерон, кортизон), существуют жирорастворимые витамины (A, D, E, K), гибберелины — регуляторы роста растений
Разнообразие липидов
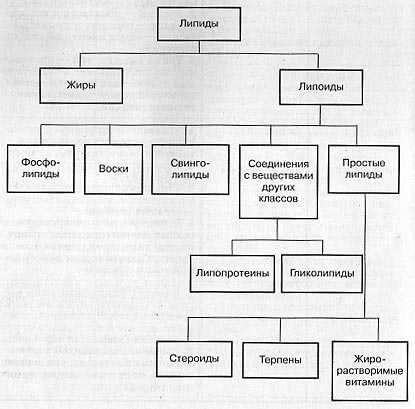
Фосфолипиды — содержат остаток фосфорной кислоты, входят в состав клеточных мембран.
Гликолипиды — соединения липидов с углеводами. Являются составной частью тканей мозга и нервных волокон.
Липопротеиды — комплексные соединения разнообразных белков с жирами.
Стероиды — важные компоненты половых гормонов, витамина Д.
Воска — выполняют защитную функцию: у млекопитающих — смазывают кожу и волосы, у птиц — придают перьям водоотталкивающие свойства, у растений — предотвращают чрезмерное испарение воды.
АТФ
Аденозинтрифосфорная кислота (АТФ) — нуклеотид, в состав которого входит азотистое основание аденин, углевод рибоза и три остатка фосфорной кислоты. Молекула АТФ является универсальным химическим аккумулятором энергии в клетках. Остатки фосфорной кислоты связаны макроэргичными связями. Когда от АТФ отщепляется один остаток фосфорной кислоты, образуется АДФ — аденозиндифосфорная кислота и выделяется 40 кДж энергии
cleverpenguin.ru
Органические вещества. Аминокислоты. Белки
Химия Органические вещества. Аминокислоты. Белки просмотров — 505
Органические вещества. В состав живых организмов, кроме неорганических, входят также разнообразные органические вещества. Органические вещества живых существ образованы, прежде всего, четырьмя химическими элементами, называемыми биогенными: углеродом, водородом, кислородом и азотом. В составе белков к этим элементам прибавляется сера, а в нуклеиновых кислотах – фосфор.
Многообразие органических веществ в значительной степени определяется углеродом. Этот элемент благодаря уникальным свойствам составляет химическую основу жизни. Он может образовывать ковалентные связи со многими атомами и их группами, образуя цепочки, кольца, составляющие скелет различных по составу, строению, длине и форме органических молекул. Из них в свою очередь, образуются сложные химические соединения, различающиеся по строению и функциям. Основная причина разнообразия органических молекул — ϶ᴛᴏ не столько отличие составляющих их атомов, сколько различный порядок их размещения в молекуле.
Понятие о биополимерах. В живом организме органические вещества представлены либо небольшими, с относительно низкой молекулярной массой молекулами, либо крупными макромолекулами. К низкомолекулярным соединениям относятся аминокислоты, сахара, органические кислоты, спирты, витамины и др.
Белки, полисахариды и нуклеиновые кислоты в большинстве своем являются структурами с большой молекулярной массой. По этой причине их называют макромолекулами (от греч. макрос – большой). Так, молекулярная масса большинства белков составляет от 5000 до 1 000000. [BЭ18] Высокомолекулярные органические соединения – белки, нуклеиновые кислоты, полисахариды, молекулы которых состоят из большого количества одинаковых или разных по химическому строению повторяющихся звеньев, называются биополимерами(от греч. биос – жизнь и полис – многочисленный). Простые молекулы, из остатков которых состоят биополимеры, называются мономерами. Мономерами белков являются аминокислоты, полисахаридов – моносахариды, нуклеиновых кислот – нуклеотиды. Макромолекулы составляют около 90 % сухой массы клетки.
В этой главе рассмотрены все три класса макромолекул и их мономерные звенья. К рассмотрению добавлены липиды — молекулы, как правило, значительно более мелкие, чем биополимеры, но также выполняющие функции в организме. [VV19]
Особую группу органических веществ составляют биологически активные вещества: ферменты, гормоны, витамины и др. Οʜᴎ разнообразны по строению; влияют на обмен веществ и превращение энергии.
В клетках различных групп организмов содержание определенных органических соединений разное. К примеру, в клетках животных преобладают белки и жиры, а в клетках растений — углеводы. При этом в различных клетках определенные органические соединения выполняют схожие функции.
Белки. В живых организмах среди макромолекул по своему функциональному значению ведущая роль принадлежат белкам. Белки во многих организмах преобладают и количественно. Так, в организме животных они составляют 40–50 %, в организме растений – 20 – 35 % их сухой массы. Белки — ϶ᴛᴏ гетерополимеры, мономерами которых являются аминокислоты.
Аминокислоты – «кирпичики» белковых молекул. Аминокислоты – органические соединения, содержащие одновременно аминогруппу (–NН), для которой характерны основные свойства, и карбоксильную группу (–СООН) с кислотными свойствами. Аминогруппа и карбоксильная группы связаны с одним и тем же атомом углерода (рис. ). По этому признаку все аминокислоты сходны между собой. У большей части белокобразующих аминокислот имеется одна карбоксильная группа и одна аминогруппа; эти аминокислоты называются нейтральными.
Часть молекулы, называемой радикалом (R) у разных аминокислот имеет различное строение (рис. ). Радикал у разных аминокислот может быть неполярным или полярным (заряженным или незаряженным), гидрофобным или гидрофильным, что и придает белкам определенные свойства. Помимо нейтральных, существуют основные аминокислоты — с более чем одной аминогруппой, а также кислые аминокислоты — с более чем одной карбоксильной группой. Наличие дополнительной амино- или гидроксильной группы оказывает влияние на свойства радикала. Все свойства радикалов аминокислот играют определяющую роль в формировании пространственной структуры белка.
Общее число известных аминокислот около 200, а в образовании природных белков принимает участие только 20 видовт. Такие аминокислоты называются белокобразующими (таблица 2; в таблице приведены полное и сокращенное названия аминокислот, не для запоминания).
Таблица 2. Основные аминокислоты и их сокращенное обозначение[VV20]
| Название аминокислоты | Символ | Название аминокислоты | Символ |
| Аланин Аргинин Аспарагин Аспарагиновая кислота Валин Гистидин Глицин Глутамин Глутаминовая кислота Изолейцин | Ала Арг Асн Асп Вал Гис Гли Глн Глу Иле | Лейцин Лизин Метионин Пролин Серин Тирозин Треонин Триптофан Фенилаланин Цистеин | Лей Лиз Мет Про Сер Тир Тре Три Фен Цис |
Растения и бактерии могут синтезировать все необходимые им аминокислоты из первичных продуктов фотосинтеза. Человек и животные не способны синтезировать все аминокислоты, в связи с этим так называемые незаменимые аминокислоты они должны получать в готовом виде вместе с пищей.
Незаменимыми аминокислотами для человека являются: лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофаниметионин; для детей незаменимыми являются также аргинини гистидин. Белки пищи, содержащие все незаменимые аминокислоты, называются полноценными, в отличие от неполноценных, в которых отсутствуют те или иные незаменимые аминокислоты.
Наличие в одной аминокислоте и основной, и кислотной групп обусловливает их амфотерность и высокую реактивность. Аминогруппа
(–NH2) одной аминокислоты способна взаимодействовать с карбоксильной группой (–СООН) другой аминокислоты с выделением молекулы воды. Образующаяся при этом молекула представляет собой дипептид (рис. ), а связь –СО—NН– принято называть пептидной. На одном конце молекулы дипептида находится свободная аминогруппа, а на другом карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. В случае если таким образом соединяется много аминокислот (более десяти), то образуется длинная цепь – полипептид.
Пептиды играют важную роль в организме. Многие олиго- и полипептиды являются гормонами, антибиотиками, токсинами.
К олигопептидам относятся, к примеру, гормоны гипофиза окситоцин и вазопрессин, а также брадикинин (пептид боли) и некоторые опиаты («естественные наркотики» человека), выполняющие функцию обезболивания. Регулярное[VV21] употребление Употребление наркотиков очень опасно, оно разрушает опиатную систему организма, в связи с этим наркоман без дозы наркотиков испытывает сильную боль — «ломку». К олигопептидам относятся некоторые антибиотики, например, грамицидин S.
Гормоны (инсулин, адренокортикотропный гормон и др.), антибиотики (грамицидин А), токсины (дифтерийный токсин) также являются полипептидами.
Полипептидные цепи бывают очень длинными и включают самые различные комбинации аминокислот. Полипептиды, в молекулу которых входит от 50 до нескольких тысяч аминокислотных остатков с молекулярной массой свыше 6000[BЭ22] , называются белками.
Каждый конкретный белок характеризуется строго постоянным составом и последовательностью аминокислотных остатков.
Уровни организации белковой молекулы. Молекулы белков могут принимать различные пространственные формы – конформации, которые представляют собой четыре уровня их организации (рис.)
Цепочка из множества аминокислотных остатков, соединенных пептидными связями представляет собой первичную структуру белковой молекулы. Это наиболее важная структура, так как она определяет его форму, свойства и функции. На основе первичной структуры создаются другие виды структур. Именно эта структура закодирована в молекуле ДНК. Каждый индивидуальный белок организма имеет уникальную первичную структуру. Все молекулы конкретного индивидуального[VV23] белка (к примеру, альбумина) имеют одинаковое чередование аминокислотных остатков, отличающее альбумин от любого другого индивидуального белка. Многообразие первичной структуры определяется составом, количеством и порядком следования аминокислотных остатков в полипептидной цепи.
Вторичная структура белков возникает в результате образования водородных связей между атомом водорода NH-групп и атомом кислорода CO-групп разных аминокислотных остатков полипептидной цепи. Полипептидная цепь при этом закручивается в спираль. Хотя водородные связи слабые, но благодаря значительному количеству они обеспечивают стабильность этой структуры. Полностью спиральную конфигурацию имеют молекулы белка кератина. Это структурный белок волос, шерсти, когтей, перьев и рогов; он входит в состав наружного слоя кожи позвоночных. Помимо кератина спиральная вторичная структура характерна для фибриллярных (нитевидных) белков, таких как миозин, фибриноген, коллаген.
Вторичная структура белка, помимо спирали, может быть представлена складчатым слоем. В складчатом слое несколько полипептидных цепей (или участков одной полипептидной цепи) лежат параллельно, образуя плоскую конфигурацию, сложенную наподобие гармошки (рис. б6). Вторичную структуру в форме складчатого слоя имеет, к примеру, белок фиброин, составляющий основную массу шелкового волокна, выделяемого шелкоотделительными железами гусеницы шелкопряда при сплетении коконов.
Третичная структура создается S—S связями («дисульфидными мостиками») между остатками цистеина (аминокислота͵ содержащая серу), а также водородными, ионными и другими[VV24] взаимодействиями. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Третичную структуру имеют такие белки, как миоглобин[VV25] (белок, находящийся в мышцах; принимает участие в создании запасов кислорода), трипсин (фермент, расщепляющий белки в кишечнике).
В некоторых случаях несколько полипептидных цепей с третичной структурой объединяются в единый комплекс, при этом образуется четвертичная структура. В ней белковые субъединицы не связаны ковалентно, а прочность обеспечивается взаимодействием слабых межмолекулярных сил. К примеру, четвертичная структура характерна для белка гемоглобина, состоящего их четырех белковых субъединиц и небелковой части — гема.
s1. Что такое белки? 2. Каково строение белков? 3. Что такое аминокислоты? 4. Каким образом аминокислоты соединяются в полипептидную цепь? 5. Какие уровни структурной организации белков существуют? 6.Какие химические связи обусловливают различные уровни структурной организации белковых молекул? 7.Имеется три вида аминокислот А.В.С. Сколько вариантов полипептидных цепей, состоящих из пяти аминокислот, можно построить? Будут ли полипептиды обладать одинаковыми свойствами?
oplib.ru
Органические вещества клетки
Углево́ды (сахара, сахариды) — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира
Липи́ды — широкая группа органических соединений, включающая жирные кислоты, а также их производные.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицеринаи одноосновных жирных кислот; входят в класс липидов.
Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
Нуклеи́новаякисло́та — высокомолекулярное органическое соединение, биополимер (полинуклеотид), образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Дезоксирибонуклеи́новая кислота́ (ДНК ) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов.
Рибонуклеи́новаякисло́та (РНК ) — одна из трёх основных макромолекул, которые содержатся в клетках всех живых организмов. РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Аденозинтрифосфа́т (АТФ) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Полимеры — это органические соединения, входящие в состав клеток живых организмов и продуктов их жизнедеятельности. Свойства биополимеров зависят от строения их молекул: от числа и разнообразия мономерных звеньев, образующих полимер.
Мономеры – простое вещество, составляющая полимера
Аминокисло́ты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Служат строительным материалом для синтеза белков.
Ферменты — обычно белковые молекулыили молекулы РНК или их комплексы, ускоряющие химические реакции в живыхсистемах.
Нуклеотиды – структурные элементы нуклеиновых кислот.
Репликация –метод удвоения ДНК, при котором генетический материал, который хранится в ДНК, удваивается и делится между дочерними клетками.
Фотосинтез — процесс образования органических веществ из углекислого газа и воды на свету при участии фотосинтетических пигментов
Световая фаза —этап фотосинтеза, в течение которого за счёт энергии света образуются богатые энергией соединения АТФ и молекулы — носители энергии.
Темновая фаза – с участием АТФ и НАДФН происходит восстановление CO2 до глюкозы (C6H12O6). Хотя свет не требуется для осуществления данного процесса, он участвует в его регуляции.
Трансляция — процесс синтеза белка из аминокислот на матрице иРНК, осуществляемый рибосомой.
Транскри́пция — процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК.
Пластический обмен или Анаболизм — совокупность химических процессов, составляющих одну из сторон обмена веществ в организме, направленных на образование клеток и тканей.
Энергетический обмен или Катаболизм — процесс разложения на более простые веществаили окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в видеАТФ.
Метаболи́зм или обмен веществ — наборхимических реакций, которые возникают в живом организме для поддержания жизни.
Кодо́н — единица генетического кода, тройка нуклеотидных остатков в ДНК или РНК, обычно кодирующих включение одной аминокислоты.
Антикодо́н — триплетнуклеотидов. Спариваясь с кодоном матричной РНК (мРНК), обеспечивает правильную расстановку каждой аминокислоты при биосинтезе белка.
biofile.ru
Органические вещества — углеводы, белки, липиды, нуклеиновые кислоты, АТФ
Углеводы — это органические соединения, в состав которых входят углерод, водород и кислород. Углеводы делятся на моно-, ди- и полисахариды.
Моносахариды — простые сахара, состоящие из 3 и более атомов С. Моносахариды: глюкоза, рибоза и дезоксирибоза. Не гидролизуются, могут кристаллизоваться, растворимы в воде, имеют сладкий вкус
Полисахариды образуются в результате полимеризации моносахаридов. При этом утрачивают способность к кристаллизации, сладкий вкус. Пример — крахмал, гликоген, целлюлоза.
Функции:
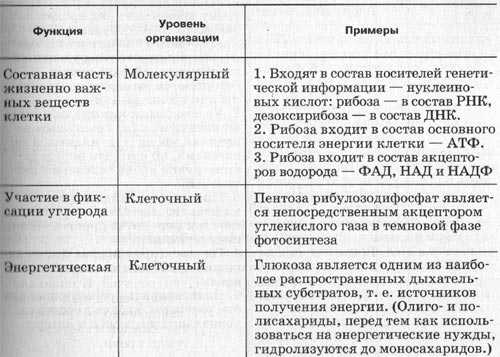
1. Энергетическая — это основной источник энергии в клетке (1 грамм=17,6 кДж)
2. структурная-входят в состав оболочек растительных клеток (целлюлоза) и животных клеток
3. источник для синтеза других соединений
4. запасающая (гликоген — у животных клеток, крахмал — у растительных)
5. соединительная
Липиды — сложные соединения глицерина и жирных кислот. Нерастворимы в воде, только в органических растворителях. Различают простые и сложные липиды.
Функции липидов:
1. структурная — основа, для всех мембран клетки
2. энергетическая (1 г=37,6 кДж)
3. запасающая
4. теплоизоляционная
5. источник внутриклеточной воды
АТФ — единое универсальное энергоемкое вещество в клетках растений, животных и микроорганизмов. С помощью АТФ осуществляется накопление и транспорт энергии в клетке. В состав АТФ входят: азотистое основание–адеин, углевод рибоза и три остатка фосфорной кислоты. Фосфатные группы соединены между собой с помощью макроэргических связей. Функции АТФ — перенос энергии.
Белки являются преобладающим веществом во всех живых организмов. Белок — полимер, мономером которого являютсяаминокислоты (20). Аминокислоты соединяются в белковой молекуле с помощью пептидных связей, образующихся между аминогруппой одной аминокислоты и карбоксильной группой другой. Каждая клетка имеет уникальный набор белков.
Различают несколько уровней организации белковой молекулы. Первичная структура-последовательность аминокислот, соединенных пептидной связью. Эта структура определяет специфичность белка. Во вторичной структуре молекула имеет вид спирали, ее устойчивость обеспечивается водородными связями. Третичная структура формируется в результате преобразования спирали в трехмерную шаровидную форму — глобулу. Четвертичная возникает при объединении несколько молекул белков в единый комплекс. Функциональная активность белков проявляется во 2,3,или 3-ой структуре.
Структура белков изменяется под влиянием различных химических веществ (кислоты, щелочи, спирта и других) и физических факторов (высокой и низкой t,излучения), ферментов. Если при этих изменениях сохраняется первичная структура, процесс обратим и называется денатурация. Разрушение первичной структуры называется коагуляцией (необратимый процесс разрушения белка)
Функции белков
1. структурная
2. каталитическая
3. сократительная (белки актин и миозин в мышечных волокнах)
4. транспортная (гемоглобин)
5. регуляторная (инсулин)
6. сигнальная
7. защитная
8. энергетическая (1 г=17,2 кДж)
Виды нуклеиновых кислот. Нуклеиновые кислоты — фосфорсодержащие биополимеры живых организмов, обеспечивающие хранение и передачу наследственной информации. Они были открыты в 1869 г. швейцарским биохимиком Ф. Мишером в ядрах лейкоцитов, сперматозоидов лосося. Впоследствии нуклеиновые кислоты обнаружили во всех растительных и животных клетках, вирусах, бактериях и грибах.
В природе существует два вида нуклеиновых кислот — дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Различие в названиях объясняется тем, что молекула ДНК содержит пятиуглеродный сахар дезоксирибозу, а молекула РНК — рибозу.
ДНК находится преимущественно в хромосомах клеточного ядра (99% всей ДНК клетки), а также в митохондриях и хлоропластах. РНК входит в состав рибосом; молекулы РНК содержатся также в цитоплазме, матриксе пластид и митохондрий.
Нуклеотиды — структурные компоненты нуклеиновых кислот. Нуклеиновые кислоты представляют собой биополимеры, мономерами которых являются нуклеотиды.
Нуклеотиды — сложные вещества. В состав каждого нуклеотида входит азотистое основание, пятиуглеродный сахар (рибоза или дезоксирибоза) и остаток фосфорной кислоты.
Существует пять основных азотистых оснований: аденин, гуанин, урацил, тимин и цитозин.
ДНК. Молекула ДНК состоит из двух полинуклеотидных, спирально закрученных относительно друг друга цепочек.
В состав нуклеотидов молекулы ДНК входят четыре вида азотистых оснований: аденин, гуанин, тимин и цитоцин. В полинуклеотидной цепочке соседние нуклеотиды связаны между собой ковалентными связями.
Полинуклеотидная цепь ДНК закручена в виде спирали наподобие винтовой лестницы и соединена с другой, комплементарной ей цепью с помощью водородных связей, образующихся между аденином и тимином (две связи), а также гуанином и цитозином (три связи). Нуклеотиды А и Т, Г и Ц называются комплементарными.
В результате у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гуаниловых — числу цитидиловых. Благодаря этому свойству последовательность нуклеотидов в одной цепи определяет их последовательность в другой. Такая способность к избирательному соединению нуклеотидов называется комплемен-тарностью, и это свойство лежит в основе образования новых молекул ДНК на базе исходной молекулы (репликации, т. е. удвоения).
При изменении условий ДНК, подобно белкам, может подвергаться денатурации, которая называется плавлением. При постепенном возврате к нормальным условиям ДНК ренатурирует.
Функцией ДНК является хранение, передача и воспроизведение в ряду поколений генетической информации. В ДНК любой клетки закодирована информация обо всех белках данного организма, о том, какие белки, в какой последовательности и в каком количестве будут синтезироваться. Последовательность аминокислот в белках записана в ДНК так называемым генетическим (триплетным) кодом.
Основным свойством ДНК является ее способность к репликации.
Репликация — это процесс самоудвоения молекул ДНК, происходящий под контролем ферментов. Репликация осуществляется перед каждым делением ядра. Начинается она с того, что спираль ДНК временно раскручивается под действием фермента ДНК-полимеразы. На каждой из цепей, образовавшихся после разрыва водородных связей, по принципу комплементарности синтезируется дочерняя цепь ДНК. Материалом для синтеза служат свободные нуклеотиды, которые есть в ядре
Таким образом, каждая полинуклеотидная цепь выполняет роль матрицы для новой комплементарной цепи (поэтому процесс удвоения молекул ДНК относится к реакциям матричного синтеза). В результате получается две молекулы ДНК, у каждой из которых ‘ одна цепь остается от родительской молекулы (половина), а другая — вновь синтезированная. Причем одна новая цепь синтезируются сплошной, а вторая — сначала в виде коротких фрагментов, которые затем сшиваются в длинную цепь специальным ферментом — ДНК-лигазой. В результате репликации две новые молекулы ДНК представляют собой точную копию исходной молекулы.
Биологический смысл репликации заключается в точной передаче наследственной информации от материнской клетки к дочерним, что и происходит при делении соматических клеток.
РНК. Строение молекул РНК во многом сходно со строением молекул ДНК. Однако имеется и ряд существенных отличий. В молекуле РНК вместо дезоксирибозы в состав нуклеотидов входит рибоза, вместо тимидилового нуклеотида (Т) — уридиловый (У). Главное отличие от ДНК состоит в том, что молекула РНК представляет собой одну цепь. Однако ее нуклеотиды способны образовывать водородные связи между собой (например, в молекулах тРНК, рРНК), но в этом случае речь идет о внутрицепочечном соединении комплементарных нуклеотидов. Цепочки РНК значительно короче ДНК.
В клетке существует несколько видов РНК, которые различаются по величине молекул, структуре, расположению в клетке и функциям:
1. Информационная (матричная) РНК (иРНК) — переносит генетическую информацию с ДНК на рибосомы
2. Рибосомная РНК (рРНК) — входит в состав рибосом
3. 3. Транспортная РНК (тРНК) — переносит аминокислоты к рибосомам во время синтеза белка
biofile.ru
Органические вещества клетки: нуклеиновые кислоты
Нуклеиновые кислоты
Подобно белкам, нуклеиновые кислоты являются гетерополимерами. Их мономеры нуклеотиды, из которых слагаются молекулы нуклеиновых кислот, резко отличны от аминокислот. Существует 2 типа нуклеиновых кислот: ДНК (дезоксирибонуклеиновая) и РНК (рибонуклеиновая кислота).
АТФ — аденозинтрифосфорная кислота, нуклеотид, состоящий из азотистого основания аденина, углевода рибозы и трех молекул фосфорной кислоты.
Структура неустойчива, под влиянием ферментов переходит в АДФ – аденозиндифосфорную кислоту (отщепляется одна молекула фосфорной кислоты) с выделением 40 кДж энергии. АТФ — единый источник энергии для всех клеточных реакций. Ее превращение происходит по такой схеме:
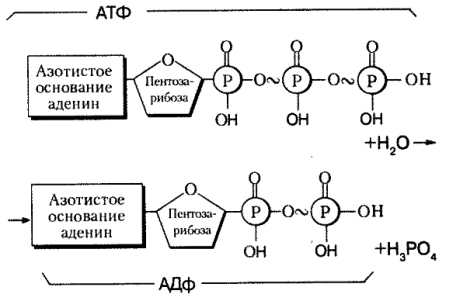
Остановимся более подробно на значении нуклеиновых кислот, которые в клетке выполняют очень важные функции. Особенности химического строения нуклеиновых кислот обеспечивают возможность хранения, переноса и передачи по наследству дочерним клеткам информации о структуре белковых молекул, которые синтезируются в каждой ткани на определенном этане индивидуального развития.
Поскольку большинство свойств в организме обусловлено белками, то понятно, что стабильность нуклеиновых кислот — важнейшее условие жизнедеятельности клеток и целых организмов. Любые изменения строения нуклеиновых кислот влекут за собой изменения структуры клеток или активности физиологических процессов в них, влияя, таким образом, на жизнеспособность. Изучение структуры нуклеиновых кислот, которую впервые установили американский биолог Уотсон и английский физик Крик, имеет исключительно важное значение для понимания наследования признаков у организмов и закономерностей функционирования, как отдельных клеток, так и клеточных систем — тканей и органов.
Исследованиями биохимиков установлено, что и биосинтез белков в живых организмах осуществляется под контролем нуклеиновых кислот.
Таким образом, нуклеиновые кислоты обеспечивают устойчивое сохранение наследственной информации и контролируют образование соответствующих им белков-ферментов, а белки-ферменты определяют основные особенности обмена веществ клетки. Все это очень важно для поддержания химической стабильности организмов, имеет решающее значение для существования жизни на Земле.
Первичная структура молекул нуклеиновых кислот
Нуклеиновые кислоты — самые крупные из молекул, образуемые живыми организмами. Они являются биополимерами, состоящими из мономеров — нуклеотидов.
В зависимости от вида пятиуглеродного сахара (пентозы), различают два типа нуклеиновых кислот:
- дезоксирибонуклеиновые кислоты (сокращенно ДНК) — молекула ДНК содержит пятиуглеродный сахар — дезоксирибозу.
- рибонуклеиновые кислоты (сокращенно РНК) — молекула РНК содержит пятиуглеродный сахар — рибозу.
Есть различия и в азотистых основаниях, входящих в состав нуклеотидов ДНК и РНК: Нуклеотиды ДНК: А — аденин, Г — гуанин, Ц — цитозин, Т — тимин Нуклеотиды РНК: А — аденин, Г — гуанин, Ц — цитозин, У — урацил.
Вторичная структура молекул ДНК и РНК
Вторичная структура — это форма молекул нуклеиновых кислот. Пространственная структура молекулы ДНК была смоделирована американскими учеными Джеймсом Уотсоном и Френсисом Криком в 1953 г. Дезоксирибонуклеиновая кислота (ДНК) — состоит из двух спирально закрученных цепей, которые по всей длине соединены друг с другом водородными связями. Такую структуру (свойственную только молекулам ДНК), называют двойной спиралью. Рибонуклеиновая кислота (РНК) — линейный полимер, состоящий из одной цепи нуклеотидов.
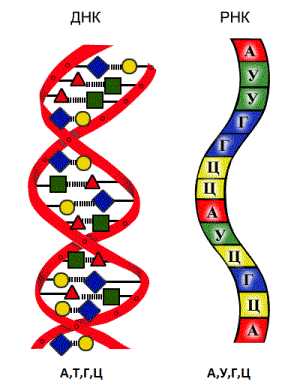
Исключение составляют вирусы, у которых встречаются одноцепочечные ДНК и двухцепочечные РНК. Подробнее о ДНК и РНК будет рассказано в разделе «Хранение и предача генетической информации. Генетический код».
bio-learn.com
Химическая организация клетки
Введение.
Клетка – элементарная единица жизни на Земле. Она обладает всеми признаками живого организма: растет, размножается, обменивается с окружающей средой веществами и энергией, реагирует на внешние раздражители.
Начало биологической эволюции связано с появлением на Земле клеточных форм жизни.
Одноклеточные организмы представляют собой существующие отдельно друг от друга клетки. Тело всех многоклеточных – животных и растений – построено из большего или меньшего числа клеток, которые являются своего рода блоками, составляющими сложный организм. Независимо от того, представляет ли собой клетка целостную живую систему – отдельный организм или составляет лишь его часть, она наделена набором признаков и свойств, общим для всех клеток.
Цель: изучить элементарную единицу строения живых организмов – клетку.
Основные задачи:
Познакомиться с неорганическими и органическими веществами клетки.
Рассмотреть обмен веществ и преобразование энергии в клетке.
Изучить клеточную теорию строения организмов.
Химический состав клетки.
В клетках обнаружено около 60 элементов периодической системы Менделеева, встречающихся и в неживой природе. Это одно из доказательств общности живой и неживой природы. В живых организмах наиболее распространены водород, кислород, углерод и азот, которые составляют около 98% массы клеток. Такое обусловлено особенностями химических свойств водорода, кислорода, углерода и азота, вследствие чего они оказались наиболее подходящими для образования молекул, выполняющих биологические функции. Эти четыре элемента способны образовывать очень прочные ковалентные связи посредством спаривания электронов, принадлежащих двум атомам. Ковалентно связанные атомы углерода могут формировать каркасы бесчисленного множества различных органических молекул. Поскольку атомы углерода легко образуют ковалентные связи с кислородом, водородом, азотом, а также с серой, органические молекулы достигают исключительной сложности и разнообразия строения.
Кроме четырех основных элементов в клетке в заметных количествах (10ые и 100ые доли процента) содержатся железо, калий, натрий, кальций, магний, хлор, фосфор и сера. Все остальные элементы (цинк, медь, йод, фтор, кобальт, марганец и др.) находятся в клетке в очень малых количествах и поэтому называются микроэлементами.
Химические элементы входят в состав неорганических и органических соединений. К неорганическим соединениям относятся вода, минеральные соли, диоксид углерода, кислоты и основания. Органические соединения – это белки, нуклеиновые кислоты, углеводы, жиры (липиды) и липоиды. Кроме кислорода, водорода, углерода и азота в их состав могут входить другие элементы. Некоторые белки содержат серу. Составной частью нуклеиновых кислот является фосфор. Молекула гемоглобина включает железо, магний участвует в построении молекулы хлорофилла. Микроэлементы, несмотря на крайне низкое содержание в живых организмах, играют важную роль в процессах жизнедеятельности. Йод входит в состав гормона щитовидной железы – тироксина, кобальт – в состав витамина В12. гормон островковой части поджелудочной железы – инсулин – содержит цинк. У некоторых рыб место железа в молекулах пигментов, переносящих кислород, занимает медь.
Неорганические вещества.
Вода.
Н2О – самое распространенное соединение в живых организмах. Содержание ее в разных клетках колеблется в довольно широких пределах: от 10% в эмали зубов до 98% в теле медузы, но среднем она составляет около 80% массы тела. Исключительно важная роль воды в обеспечении процессов жизнедеятельности обусловлена ее физико-химическими свойствами. Полярность молекул и способность образовывать водородные связи делают воду хорошим растворителем для огромного количества веществ. Большинство химических реакций, протекающих в клетке, может происходить только в водном растворе. Вода участвует и во многих химических превращениях.
Общее число водородных связей между молекулами воды изменяется в зависимости от t°. При t° таяния льда разрушается примерно 15% водородных связей, при t° 40°С – половина. При переходе в газообразное состояние разрушаются все водородные связи. Этим объясняется высокая удельная теплоемкость воды. При изменении t° внешней среды вода поглощает или выделяет теплоту вследствие разрыва или новообразования водородных связей. Таким путем колебания t° внутри клетки оказываются меньшими, чем в окружающей среде. Высокая теплота испарения лежит в основе эффективного механизма теплоотдачи у растений и животных.
Вода как растворитель принимает участие в явлениях осмоса, играющего важную роль в жизнедеятельности клетки организма. Осмосом называют проникновение молекул растворителя через полупроницаемую мембрану в раствор какого-либо вещества. Полупроницаемыми называются мембраны, которые пропускают молекулы растворителя, но не пропускают молекулы (или ионы) растворенного вещества. Следовательно, осмос – односторонняя диффузия молекул воды в направлении раствора.
Минеральные соли.
Большая часть неорганических в-в клетки находится в виде солей в диссоциированном, либо в твердом состоянии. Концентрация катионов и анионов в клетке и в окружающей ее среде неодинакова. В клетке содержится довольно много К и очень много Nа. Во внеклеточной среде, например в плазме крови, в морской воде, наоборот, много натрия и мало калия. Раздражимость клетки зависит от соотношения концентраций ионов Na+, K+, Ca2+, Mg2+. В тканях многоклеточных животных К входит в состав многоклеточного вещества, обеспечивающего сцепленность клеток и упорядоченное их расположение. От концентрации солей в большой мере зависят осмотическое давление в клетке и ее буферные свойства. Буферностью называется способность клетки поддерживать слабощелочную реакцию ее содержимого на постоянном уровне. Буферность внутри клетки обеспечивается главным образом ионами Н2РО4 и НРО42-. Во внеклеточных жидкостях и в крови роль буфера играют Н2СО3 и НСО3—. Анионы связывают ионы Н и гидроксид-ионы (ОН—), благодаря чему реакция внутри клетки внеклеточных жидкостей практически не меняется. Нерастворимые минеральные соли (например, фосфорнокислый Са) обеспечивает прочность костной ткани позвоночных и раковин моллюсков.
Органические вещества клетки.
Белки.
Среди органических веществ клетки белки стоят на первом месте как по количеству (10 – 12% от общей массы клетки), так и по значению. Белки представляют собой высокомолекулярные полимеры (с молекулярной массой от 6000 до 1 млн. и выше), мономерами которых являются аминокислоты. Живыми организмами используется 20 аминокислот, хотя их существует значительно больше. В состав любой аминокислоты входит аминогруппа (-NH2), обладающая основными свойствами, и карбоксильная группа (-СООН), имеющая кислотные свойства. Две аминокислоты соединяются в одну молекулу путем установления связи HN-CO с выделением молекулы воды. Связь между аминогруппой одной аминокислоты и карбоксилом другой называется пептидной. Белки представляют собой полипептиды, содержащие десятки и сотни аминокислот. Молекулы различных белков отличаются друг от друга молекулярной массой, числом, составом аминокислот и последовательностью расположения их в полипептидной цепи. Понятно поэтому, что белки отличаются огромным разнообразием, их количество у всех видов живых организмов оценивается числом 1010 – 1012.
Цепь аминокислотных звеньев, соединенных ковалентно пептидными связями в определенной последовательности, называется первичной структурой белка. В клетках белки имеют вид спирально закрученных волокон или шариков (глобул). Это объясняется тем, что в природном белке полипептидная цепочка уложена строго определенным образом в зависимости от химического строения входящих в ее состав аминокислот.
Вначале полипептидная цепь сворачивается в спираль. Между атомами соседних витков возникает притяжение и образуются водородные связи, в частности, между NH- и СО- группами, расположенными на соседних витках. Цепочка аминокислот, закрученная в виде спирали, образует вторичную структуру белка. В результате дальнейшей укладки спирали возникает специфичная для каждого белка конфигурация, называемая третичной структурой. Третичная структура обусловлена действием сил сцепления между гидрофобными радикалами, имеющимися у некоторых аминокислот, и ковалентными связями между SH- группами аминокислоты цистеина (S-S- связи). Количество аминокислот гидрофобными радикалами и цистеина, а также порядок их расположения в полипептидной цепочке специфичны для каждого белка. Следовательно, особенности третичной структуры белка определяются его первичной структурой. Биологическую активность белок проявляет только в виде третичной структуры. Поэтому замена даже одной аминокислоты в полипептидной цепочке может привести к изменению конфигурации белка и к снижению или утрате его биологической активности.
В некоторых случаях белковые молекулы объединяются друг с другом и могут выполнять свою функцию только в виде комплексов. Так, гемоглобин – это комплекс из четырех молекул и только в такой форме способен присоединять и транспортировать О. подобные агрегаты представляют собой четвертичную структуру белка.
По своему составу белки делятся на два основных класса – простые и сложные. Простые белки состоят только из аминокислот нуклеиновые кислоты (нуклеотиды), липиды (липопротеиды), Ме (металлопротеиды), Р (фосфопротеиды).
Функции белков в клетке чрезвычайно многообразны. Одна из важнейших – строительная функция: белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внутриклеточных структур. Исключительно важное значение имеет ферментативная (каталитическая) роль белков. Ферменты ускоряют химические реакции, протекающие в клетке, в 10ки и 100ни миллионов раз. Двигательная функция обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движений, к которым способны клетки и организмы: мерцание ресничек и биение жгутиков у простейших, сокращение мышц у животных, движение листьев у растений и др. Транспортная функция белков заключается в присоединении химических элементов (например, гемоглобин присоединяет О) или биологически активных веществ (гормонов) и переносе их к тканям и органам тела. Защитная функция выражается в форме выработки особых белков, называемых антителами, в ответ на проникновение в организм чужеродных белков или клеток. Антитела связывают и обезвреживают чужеродные вещества. Белки играют немаловажную роль как источники энергии. При полном расщеплении 1г. белков выделяется 17,6 кДж (~4,2 ккал).
Углеводы.
Углеводы, или сахариды – органические вещества с общей формулой (СН2О)n. У большинства углеводов число атомов Н вдвое больше числа атомов О, как в молекулах воды. Поэтому эти вещества и были названы углеводами.
В живой клетке углеводы находятся в количествах, не превышающих 1-2, иногда 5% (в печени, в мышцах). Наиболее богаты углеводами растительные клетки, где их содержание достигает в некоторых случаях 90% от массы сухого вещества (семена, клубни картофеля и т.д.).
coolreferat.com
2.3.2. Органические вещества клетки. Углеводы, липиды.
2.3.2. Органические вещества клетки. Углеводы, липиды.
Углеводы.
Общая формула Сn (h3O)n: углеводы содержат в своем составе только три химических элемента.
Таблица. Сравнение классов углеводов.

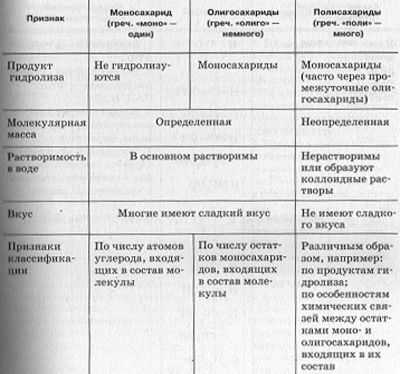
Растворимые в воде углеводы.
Моносахариды:
глюкоза – основной источник энергии для клеточного дыхания;
фруктоза – составная часть нектара цветов и фруктовых соков;
рибоза и дезоксирибоза – структурные элементы нуклеотидов, являющихся мономерами РНК и ДНК.
Дисахариды:
сахароза (глюкоза + фруктоза) – основной продукт фотосинтеза, транспортируемый в растениях;
лактоза (глюкоза + галактоза) – входит в состав молока млекопитающих;
мальтоза (глюкоза + глюкоза) – источник энергии в прорастающих семенах.
Функции растворимых углеводов:
- транспортная,
- защитная,
- сигнальная,
- энергетическая.
Нерастворимые углеводы
полимерные:
крахмал,
гликоген,
целлюлоза,
хитин.
Функции полимерных углеводов:
- структурная,
- запасающая,
- энергетическая,
- защитная.
Крахмал состоит из разветвленных спирализованных молекул, образующих запасные вещества в тканях растений.
Целлюлоза – полимер, образованный остатками глюкозы, состоящими из нескольких прямых параллельных цепей, соединенных водородными связями. Такая структура препятствует проникновению воды и обеспечивает устойчивость целлюлозных оболочек растительных клеток.
Хитин состоит из аминопроизводных глюкозы. Основной структурный элемент покровов членистоногих и клеточных стенок грибов.
Гликоген – запасное вещество животной клетки.
Таблица. Наиболее распространенные углеводы.




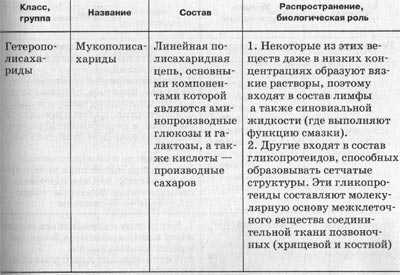
Таблиица.Основные функции углеводов.



Липиды.
Липиды – сложные эфиры жирных кислот и глицерина. Нерастворимы в воде, но растворимы в неполярных растворителях. Присутствуют во всех клетках. Липиды состоят из атомов водорода, кислорода и углерода.
Функции липидов:
Запасающая – жиры, откладываются в запас в тканях позвоночных животных.
Энергетическая – половина энергии, потребляемой клетками позвоночных животных в состоянии покоя, образуется в результате окисления жиров. Жиры используются и как источник воды. Энергетический эффект от расщепления 1 г жира – 39 кДж, что в два раза больше энергетического эффекта от расщепления 1 г глюкозы или белка.
Защитная – подкожный жировой слой защищает организм от механических повреждений.
Структурная – фосфолипиды входят в состав клеточных мембран.
Теплоизоляционная – подкожный жир помогает сохранить тепло.
Электроизоляционная – миелин, выделяемый клетками Шванна (образуют оболочки нервных волокон), изолирует некоторые нейроны, что во много раз ускоряет передачу нервных импульсов.
Питательная – некоторые липидоподобные вещества способствуют наращиванию мышечной массы, поддержанию тонуса организма.
Смазывающая – воски покрывают кожу, шерсть, перья и предохраняют их от воды. Восковым налетом покрыты листья многих растений, воск используется в строительстве пчелиных сот.
Гормональная – гормон надпочечников – кортизон и половые гормоны имеют липидную природу.
Таблица. Основные функции липидов.


ТЕМАТИЧЕСКИЕ ЗАДАНИЯ
Часть А
А1. Мономером полисахаридов может быть:
1) аминокислота
2) глюкоза
3) нуклеотид
4) целлюлоза
А2. В клетках животных запасным углеводом является:
1) целлюлоза
2) крахмал
3) хитин
4) гликоген
А3. Больше всего энергии выделится при расщеплении:
1) 10 г белка
2) 10 г глюкозы
3) 10 г жира
4) 10 г аминокислоты
А4. Какую из функций липиды не выполняют?
1) энергетическую
2)каталитическую
3) изоляционную
4) запасающую
А5. Липиды можно растворить в:
1) воде
2) растворе поваренной соли
3) соляной кислоте
4) ацетоне
Часть В
В1. Выберите особенности строения углеводов
1) состоят из остатков аминокислот
2) состоят из остатков глюкозы
3) состоят из атомов водорода, углерода и кислорода
4) некоторые молекулы имеют разветвленную структуру
5) состоят из остатков жирных кислот и глицерина
6) состоят из нуклеотидов
В2. Выберите функции, которые углеводы выполняют в организме
1) каталитическая
2) транспортная
3) сигнальная
4)строительная
5) защитная
6) энергетическая
ВЗ. Выберите функции, которые липиды выполняют в клетке
1) структурная
2) энергетическая
3) запасающая
4) ферментативная
5) сигнальная
6) транспортная
В4. Соотнесите группу химических соединений с их ролью в клетке:
|
РОЛЬ СОЕДИНЕНИЯ В КЛЕТКЕ |
СОЕДИНЕНИЕ |
|
|
|
Часть С
С1. Почему в организме не накапливается глюкоза, а накапливается крахмал и гликоген?
biology100.ru
