Окислительно-восстановительные реакции | СТУДЕНТОРИЙ
Смотрите также Окислительно-восстановительное равновесие
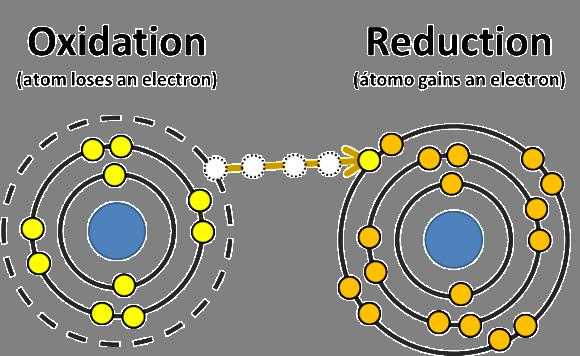
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся присоединением или отдачей электронов, или перераспределением электронной плотности на атомах (изменение степени окисления).
Стадии ОВР
Окисление – отдача электронов атомами, молекулами или ионами. В результате степень окисления повышается. Восстановители отдают электроны.
Восстановление – присоединение электронов. В результате степень окисления понижается. Окислители принимают электроны.
ОВР – сопряженный процесс: если есть восстановление, то есть и окисление.
Правила ОВР
Эквивалентный обмен электронов и атомный баланс.
Кислая среда
В кислой среде высвобождающиеся оксид-ионы связываются с протонами в молекулы воды; недостающие оксид-ионы поставляются молекулами воды, тогда из них высвобождаются протоны.
Там, где не хватает атомов кислорода, пишем столько молекул воды, сколько не хватает оксид-ионов.
Пример. Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
1. Определяем степень окисления: сера в сульфите калия имеет степень окисления +4, марганец в перманганате калия имеет степень окисления +7, серная кислота – среда протекания реакции.
Мараганец в высшей степени окисления – окислитель, следовательно, сульфит калия восстановитель.
Примечание: +4 – промежуточная степень окисления для серы, поэтому она может выступать как восстановителем, так и окислителем. С сильными окислителями (перманганат, дихромат) сульфит является восстановителем (окисляется до сульфата), с сильными восстановителями (галогенидами, халькогенидами) сульфит окислитель (восстанавливается до серы или сульфида).
Сера из степени окисления +4 переходит в +6 – сульфит окисляется до сульфата. Марганец из степени окисления +7 переходит в +2 (кислая среда) – перманганат ион восстанавливается до Mn 2+.
2. Составляем полуреакции. Уравниваем марганец: Из перманганата высвобождаются 4 оксид-иона, которые связываются ионами водорода (кислая среда) в молекулы воды. Таким образом, 4 оксид-иона связываются с 8 протонами в 4 молекулы воды.
Другими словами, в правой части уравнения не хватает 4 кислорода, поэтому пишем 4 молекулы воды, в левой части уравнения – 8 протонов.
Семь минус два – плюс пять электронов. Можно уравнивать по общему заряду: в левой части уравнения восемь протонов минус один перманганат = 7+, в правой части марганец с зарядом 2+, вода электронейтральна. Семь минус два – плюс пять электронов. Все уравнено.
Уравниваем серу: недостающий оксид-ион в левой части уравнения поставляется молекулой воды, из которой впоследствии высвобожается два протона в правую часть.
Слева заряд 2-, справа 0 (-2+2). Минус два электрона.
3. Суммарное уравнение электронного баланса. Умножаем верхнюю полуреакцию на 2, нижнюю на 5.
Сокращаем протоноы и воду.
4. Итоговое уравнение реакции: Сульфат ионы связываются с ионами калия и марганца.
Щелочная среда
В щелочной среде высвобождающиеся оксид-ионы связываются молекулами воды, образуя гидроксид-ионы (OH– группы). Недостающие оксид-ионы поставляются гидроксо-группами, которых надо брать в два раза больше.
Там, где не хватает оксид-ионов пишем гидроксо-групп в 2 раза больше, чем не хватает, с другой стороны – воду.
Пример. Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
Определяем степень окисления:
Висмут (III) с сильными окислителями (например, Cl2) в щелочной среде проявляет восстановительные свойства (окисляется до висмута V):
Так как в левой части уравнения не хватает 3 кислородов для баланса, то пишем 6 гидроксо-групп, а справа – 3 воды.
Итоговое уравнение реакции:
Нейтральная среда
В нейтральной среде высвобождающиеся оксид-ионы связываются молекулами воды с образованием гидроксид-ионов (OH– групп). Недостающие оксид-ионы поставляются молекулами воды. Из них высвобождаются ионы H+.
Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
1. Определяем степень окисления: сера в персульфате калия имеет степень окисления +7 (является окислителем, т.к. высшая степень окисления), бром в бромиде калия имеет степень окисления -1 (является восстановителем, т.к. низшая степень окисления), вода – среда протекания реакции.
Сера из степени окисления +7 переходит в +6 – персульфат восстанавливается до сульфата. Бром из степени окисления -1 переходит в 0 – бромид ион окисляется до брома.
2. Составляем полуреакции. Уравниваем серу (коэффициент 2 перед сульфатом). Кислород уравнен.
В левой части заряд 2-, в правой части заряд 4-, присоединено 2 электрона, значит пишем +2
Уравниваем бром (коэффициент 2 перед бромид-ионом). В левой части заряд 2-, в правой части заряд 0, отдано 2 электрона, значит пишем –2
3. Суммарное уравнение электронного баланса.
4. Итоговое уравнение реакции: Сульфат ионы связываются с ионами калия в сульфат калия, коэффициент 2 перед KBr и перед K2SO4. Вода оказалась не нужна – заключаем в квадратные скобки.
Классификация ОВР
- Окислитель и восстановитель – разные вещества
- Самоокислители, самовосстановители (диспропорционирование, дисмутация). Элемент в промежуточной степени окисления.
- Окислитель или восстановитель – среда для прохождения процесса
- Внутримолекулярное окисление-восстановление. В состав одного и того же вещества входят окислитель и восстановитель.
Твердофазные, высокотемпературные реакции.
Количесвеннная характеристика ОВР
Стандартный окислительно-восстановительный потенциал, E0 – электродный потенциал относительно стандартного водородного потенциала. Больше об окислительно-восстановительном равновесии.
Для прохождения ОВР необходимо, чтобы разность потенциалов была больше нуля, то есть потенциал окислителя должен быть больше потенциала восстановителя:
,
Например:

Чем ниже потенциал, тем сильнее восстановитель; чем выше потенциал, тем сильнее окислитель.
Окислительные свойства сильнее в кислой среде, восстановительные – в щелочной.
studentoriy.ru
Окислительно-восстановительные реакции — это… Что такое Окислительно-восстановительные реакции?
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т.е. восстановлением, другая — с отдачей электронов, т.е. окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- 2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
- NH4NO3 → N2O + 2H2O
Примеры
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полуреакции:
1) Окисление:
2) Восстановление:
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
См. также
Ссылки
dic.academic.ru
Окислительно-восстановительная реакция — это… Что такое Окислительно-восстановительная реакция?
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель — e− ↔ сопряжённый окислитель.
Виды окислительно-восстановительных реакций
- межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- Н2S + Cl2 —> S + 2HCl
- внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- NH4NO3 —> N2O + 2 H2O
- диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления:
- M+N —> M+(N-x) + M+(N+x)
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
1) Окисление:
2) Восстановление:
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
- Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
- Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
См. также
Ссылки
- Окислительно-восстановительные реакции в органической химии [1], [2]
Wikimedia Foundation. 2010.
dic.academic.ru
Примеры окислительно-восстановительных реакций с решением. ОВР: схемы
Прежде чем приводить примеры окислительно-восстановительных реакций с решением, выделим основные определения, связанные с данными превращениями.
Те атомы или ионы, которые в ходе взаимодействия меняют степень окисления с понижением (принимают электроны), называют окислителями. Среди веществ, обладающих такими свойствами, можно отметить сильные неорганические кислоты: серную, соляную, азотную.
Окислитель
Также к сильным окислителям относятся перманганаты и хроматы щелочных металлов.
Окислитель принимает то количество электронов в ходе реакции, которое необходимо ему до завершения энергетического уровня (установления завершенной конфигурации).

Восстановитель
Любая схема окислительно-восстановительной реакции предполагает выявление восстановителя. К нему относят ионы или нейтральные атомы, способные повышать в ходе взаимодействия показатель степени окисления (отдают электроны иным атомам).
В качестве типичных восстановителей можно привести атомы металлов.
Процессы в ОВР
Чем еще характеризуются ОВР? Окислительно-восстановительные реакции характеризуются изменением степеней окисления у исходных веществ.
Окисление предполагает процесс отдачи отрицательных частиц. Восстановление предполагает принятие их от других атомов (ионов).
Алгоритм разбора
Примеры окислительно-восстановительных реакций с решением предлагаются в различных справочных материалах, предназначенных для подготовки старшеклассников к выпускным испытаниям по химии.
Для того чтобы успешно справиться с предлагаемые в ОГЭ и ЕГЭ заданиями, важно владеть алгоритмом составления и разбора окислительно-восстановительных процессов.
- В первую очередь проставляют зарядовые величины у всех элементов в веществах, предложенных в схеме.
- Выписываются атомы (ионы) из левой части реакции, которые в ходе взаимодействия, поменяли показатели.
- При повышении степени окисления используется знак «-», а при понижении «+».
- Между отданными и принятыми электронами определяется наименьшее общее кратное (число, на которое они делятся без остатка).
- При делении НОК на электроны, получаем стереохимические коэффициенты.
- Расставляем их перед формулами в уравнение.
Первый пример из ОГЭ
В девятом классе далеко не все школьники знают, как решать окислительно-восстановительные реакции. Именно поэтому они допускают множество ошибок, не получают высоких баллов за ОГЭ. Алгоритм действий приведен выше, теперь попробуем отработать его на конкретных примерах.
Особенность заданий, касающихся расстановки коэффициентов в предложенной реакции, выданных выпускникам основной ступени обучения, в том, что и левая, и правая части уравнения даны.
Это существенно упрощает задачу, так как не нужно самостоятельно придумывать продукты взаимодействия, подбирать недостающие исходные вещества.
Например, предлагается с помощью электронного баланса выявить коэффициенты в реакции:
CuO+Fe=FeO+Cu
На первый взгляд, в данной реакции не требуются стереохимические коэффициенты. Но, для того, чтобы подтвердить свою точку зрения, необходимо у всех элементов зарядовые числа.
В бинарных соединениях, к которым относится оксид меди (2) и оксид железа (2), сумма степеней окисления равна нулю, учитывая, что у кислорода она -2, у меди и железа данный показатель +2. Простые вещества не отдают (не принимают) электроны, поэтому для них характерна нулевая величина степени окисления.
Составим электронный баланс, показав знаком «+» и «-» количество принятых и отданных в ходе взаимодействия электронов.
Cu2++2e=Cu0;
Fe0-2e=Fe2+.
Так как количество принятых и отданных в ходе взаимодействия электронов одинаково, нет смысла находить наименьшее общее кратное, определять стереохимические коэффициенты, ставить их в предложенную схему взаимодействия.
Для того чтобы получить за задание максимальный балл, необходимо не только записать примеры окислительно-восстановительных реакций с решением, но и выписать отдельно формулу окислителя (CuO) и восстановителя (Fe).

Второй пример с ОГЭ
Приведем еще примеры окислительно-восстановительных реакций с решением, которые могут встретиться девятиклассникам, выбравшим химию в качестве выпускного экзамена.
Допустим, предлагается расставить коэффициенты в уравнении:
Na+HCl=NaCl+H2.
Для того чтобы справиться с поставленной задачей, сначала важно определить у каждого простого и сложного вещества показатели степеней окисления. У натрия и водорода они будут равны нулю, так как они являются простыми веществами.
В соляной кислоте водород имеют положительную, а хлор — отрицательную степень окисления. После расстановки коэффициентов получим реакцию с коэффициентами.
Как дополнить окислительно-восстановительные реакции? Примеры с решением, встречающиеся на ЕГЭ (11 класс), предполагают дополнение пропусков, а также расстановку коэффициентов.
Например, нужно электронным балансом дополнить реакцию:
H2S+ HMnO4= S+ MnO2 +…
Определите восстановитель и окислитель в предложенной схеме.
Как научиться составлять окислительно-восстановительные реакции? Образец предполагает использование определенного алгоритма.
Сначала во всех веществах, данных по условию задачи, необходимо поставить степени окисления.
Далее нужно проанализировать, какое вещество может стать неизвестным продуктом в данном процессе. Поскольку в здесь присутствует окислитель (в его роли выступает марганец), восстановитель (им является сера), в искомом продукте не меняются степени окисления, следовательно, это вода.
Рассуждая о том, как правильно решать окислительно-восстановительные реакции, отметим, что следующим этапом будет составление электронного соотношения:
Mn+7 принимает 3 e= Mn+4;
S-2 отдает 2e= S0.
Катион марганца является восстановителем, а анион серы – типичный окислитель. Поскольку наименьшим кратным между принятыми и отданными электронами будет 6, получаем коэффициенты: 2, 3.
Последним этапом будет постановка коэффициентов в исходное уравнение.
3H2S+ 2HMnO4= 3S+ 2MnO2+ 4H2O.

Второй образец ОВР в ЕГЭ
Как правильно составить окислительно-восстановительные реакции? Примеры с решением помогут отработать алгоритм действий.
Предлагается методом электронного баланса заполнить пропуски в реакции:
PH3+ HMnO4 = MnO2 +…+…
Расставляем у всех элементов степени окисления. В данном процессе окислительные свойства проявляются марганцем, входящим в состав марганцовой кислоты, а восстановителем должен быть фосфор, меняя свою степень окисления на положительную в фосфорной кислоте.
Согласно сделанному предположению, получаем схему реакции, затем составляем уравнение электронного баланса.
P-3 отдает 8 e и превращается в P+5;
Mn+7 принимает 3e, переходя в Mn+4.
НОК будет 24, поэтому у фосфора должен присутствовать стереометрический коэффициент 3, а у марганца -8.
Ставим коэффициенты в полученный процесс, получаем:
3 PH3+ 8 HMnO4= 8 MnO2+ 4H2O+ 3 H3PO4.

Третий пример из ЕГЭ
Путем электронно-ионного баланса нужно составить реакцию, указать восстановитель и окислитель.
KMnO4+ MnSO4+…= MnO2 +…+ h3SO4.
По алгоритму расставляем у каждого элемента степени окисления. Далее определяем те вещества, что пропущены в правой и левой частях процесса. Здесь дан восстановитель и окислитель, поэтому в пропущенных соединениях степени окисления не меняются. Упущенным продуктом станет вода, а исходным соединением – сульфат калия. Получаем схему реакции, для которой составим электронный баланс.
Mn+2-2 e= Mn+4 3 восстановитель;
Mn+7+3e= Mn+4 2 окислитель.
Записываем коэффициенты в уравнение, суммируя атомы марганца в правой части процесса, так как он относится к процессу диспропорционирования.
2KMnO4+ 3MnSO4+ 2H2O= 5MnO2+ K 2SO4+ 2H2SO4.
Заключение
Окислительно-восстановительные реакции имеют особое значение для функционирования живых организмов. Примерами ОВР являются процессы гниения, брожения, нервной деятельности, дыхания, обмена веществ.
Окисление и восстановление актуальны для металлургической и химической промышленности, благодаря таким процессам можно восстанавливать металлы из их соединений, защищать от химической коррозии, подвергать обработке.
Для составления окислительно-восстановительного процесса в органической или неорганической химии необходимо использовать определенный алгоритм действий. Сначала в предложенной схеме расставляют степени окисления, потом определяют те элементы, которые повысили (понизили) показатель, записывают электронный баланс.
Далее между принятыми и отданными электронами необходимо определить наименьшее кратное, вычислить математическим путем коэффициенты.
При соблюдении последовательности действий, предложенной выше, можно без проблем справиться с заданиями, предлагаемыми в тестах.
Помимо метода электронного баланса, расстановка коэффициентов возможна также путем составления полуреакций.
fb.ru
Окислительно-восстановительные реакции — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Окисли́тельно-восстанови́тельные реа́кции, также редокс (англ. redox, от reduction-oxidation — восстановление-окисление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Историческая справка
Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого горючего вещества), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения к началу XIX века, химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
- <math>\mathsf{Fe + 2HCl \rightarrow FeCl_2 + H_2\uparrow}</math>
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
- <math> \mathsf{\stackrel{0}{\mbox {Zn}} + \stackrel{0}{\mbox {Cl}}_{2} \rightarrow \stackrel{+2}{\mbox {Zn}} \stackrel{-1}{\mbox {Cl}}_{2}} </math>
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степени окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
- окислитель +e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
- восстановитель -e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- <math>\mathsf{H_2S + Cl_2 \rightarrow S + 2HCl}</math>
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- <math>\mathsf{2H_2O \rightarrow 2H_2 + O_2}</math>
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
- <math>\mathsf{H_2O + Cl_2 \rightarrow HCl + HOCl}</math>
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
- <math>\mathsf{SO_2 + 2H_2S \rightarrow 3S + 2H_2O}</math>
Примеры
Окислительно-восстановительная реакция между водородом и фтором
- <math> \mathsf{ \stackrel{0}{\mbox {H}}_{2} + \stackrel{0}{\mbox {F}}_{2} \rightarrow 2\stackrel{+1}{\mbox {H}} \stackrel{-1}{\mbox {F}}}</math>
Разделяется на две полу-реакции:
1) Окисление:
- <math> \mathsf{{\mbox {H}}_{2}^{0} — 2{\mbox {e}}^{-} \rightarrow 2 {\mbox {H}}^{+}} </math>
2) Восстановление:
- <math> \mathsf{{\mbox {F}}_{2}^{0} + 2{\mbox {e}}^{-} \rightarrow 2 {\mbox {F}}^{-}} </math>
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
- <math> \mathsf{{\mbox {H}}_{2}^{0} — 2{\mbox {e}}^{-} \rightarrow 2 {\mbox {H}}^{+}} </math>
- <math> \mathsf{{\mbox {S}}^{2-} — 2{\mbox {e}}^{-} \rightarrow {\mbox {S}}^{0} \downarrow} </math>
- <math> \mathsf{{\mbox {Al}}^{0} — 3{\mbox {e}}^{-} \rightarrow {\mbox {Al}}^{3+}} </math>
- <math> \mathsf{{\mbox {Fe}}^{2+} — {\mbox {e}}^{-} \rightarrow {\mbox {Fe}}^{3+}} </math>
- <math> \mathsf{2{\mbox {Hal}}^{-} — 2{\mbox {e}}^{-} \rightarrow {\mbox {Hal}}_{2}^{0}} </math>
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
- <math> \mathsf{{\mbox {O}}_{2}^{0} + 4{\mbox {e}}^{-} \rightarrow 2{\mbox {O}}^{2-}} </math>
- <math> \mathsf{{\mbox {Mn}}^{7+} + 5{\mbox {e}}^{-} \rightarrow {\mbox {Mn}}^{2+}} </math>
- <math> \mathsf{{\mbox {Mn}}^{4+} + 2{\mbox {e}}^{-} \rightarrow {\mbox {Mn}}^{2+}} </math>
- <math> \mathsf{{\mbox {Cr}}^{6+} + 6{\mbox {e}}^{-} \rightarrow {\mbox {Cr}}^{0}} </math>
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
См. также
Напишите отзыв о статье «Окислительно-восстановительные реакции»
Примечания
- ↑ В этом, как и во многих других случаях водород рассматривают как помещенный в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. Т.е. валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется ввиду в т.ч. и валентности.
- ↑ [www.chemfive.ru/news/19_ovr_metodom_polureakcij/2013-07-10-19 ОВР методом полуреакций]. Химия и химическая технология в жизни (10.07.2013).
Литература
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
Ссылки
- [www.chemport.ru/chemical_encyclopedia_article_2534.html Окислительно-восстановительные реакции в органической химии]
- [www.chem-astu.ru/science/redox/ Составление уравнений окислительно-восстановительных реакций онлайн]
- [www.youtube.com/watch?v=9-oT4qfFau0&list=PLLrNs_8cKAo2WSnSQN9Q7EnqxmztiTZ4T&index=9 Учебный фильм «Окислительно-восстановительные реакции»]
Отрывок, характеризующий Окислительно-восстановительные реакции
Они вошли в изящно, заново, богато отделанную столовую. Всё, от салфеток до серебра, фаянса и хрусталя, носило на себе тот особенный отпечаток новизны, который бывает в хозяйстве молодых супругов. В середине ужина князь Андрей облокотился и, как человек, давно имеющий что нибудь на сердце и вдруг решающийся высказаться, с выражением нервного раздражения, в каком Пьер никогда еще не видал своего приятеля, начал говорить:– Никогда, никогда не женись, мой друг; вот тебе мой совет: не женись до тех пор, пока ты не скажешь себе, что ты сделал всё, что мог, и до тех пор, пока ты не перестанешь любить ту женщину, какую ты выбрал, пока ты не увидишь ее ясно; а то ты ошибешься жестоко и непоправимо. Женись стариком, никуда негодным… А то пропадет всё, что в тебе есть хорошего и высокого. Всё истратится по мелочам. Да, да, да! Не смотри на меня с таким удивлением. Ежели ты ждешь от себя чего нибудь впереди, то на каждом шагу ты будешь чувствовать, что для тебя всё кончено, всё закрыто, кроме гостиной, где ты будешь стоять на одной доске с придворным лакеем и идиотом… Да что!…
Он энергически махнул рукой.
Пьер снял очки, отчего лицо его изменилось, еще более выказывая доброту, и удивленно глядел на друга.
– Моя жена, – продолжал князь Андрей, – прекрасная женщина. Это одна из тех редких женщин, с которою можно быть покойным за свою честь; но, Боже мой, чего бы я не дал теперь, чтобы не быть женатым! Это я тебе одному и первому говорю, потому что я люблю тебя.
Князь Андрей, говоря это, был еще менее похож, чем прежде, на того Болконского, который развалившись сидел в креслах Анны Павловны и сквозь зубы, щурясь, говорил французские фразы. Его сухое лицо всё дрожало нервическим оживлением каждого мускула; глаза, в которых прежде казался потушенным огонь жизни, теперь блестели лучистым, ярким блеском. Видно было, что чем безжизненнее казался он в обыкновенное время, тем энергичнее был он в эти минуты почти болезненного раздражения.
– Ты не понимаешь, отчего я это говорю, – продолжал он. – Ведь это целая история жизни. Ты говоришь, Бонапарте и его карьера, – сказал он, хотя Пьер и не говорил про Бонапарте. – Ты говоришь Бонапарте; но Бонапарте, когда он работал, шаг за шагом шел к цели, он был свободен, у него ничего не было, кроме его цели, – и он достиг ее. Но свяжи себя с женщиной – и как скованный колодник, теряешь всякую свободу. И всё, что есть в тебе надежд и сил, всё только тяготит и раскаянием мучает тебя. Гостиные, сплетни, балы, тщеславие, ничтожество – вот заколдованный круг, из которого я не могу выйти. Я теперь отправляюсь на войну, на величайшую войну, какая только бывала, а я ничего не знаю и никуда не гожусь. Je suis tres aimable et tres caustique, [Я очень мил и очень едок,] – продолжал князь Андрей, – и у Анны Павловны меня слушают. И это глупое общество, без которого не может жить моя жена, и эти женщины… Ежели бы ты только мог знать, что это такое toutes les femmes distinguees [все эти женщины хорошего общества] и вообще женщины! Отец мой прав. Эгоизм, тщеславие, тупоумие, ничтожество во всем – вот женщины, когда показываются все так, как они есть. Посмотришь на них в свете, кажется, что что то есть, а ничего, ничего, ничего! Да, не женись, душа моя, не женись, – кончил князь Андрей.
– Мне смешно, – сказал Пьер, – что вы себя, вы себя считаете неспособным, свою жизнь – испорченною жизнью. У вас всё, всё впереди. И вы…
Он не сказал, что вы , но уже тон его показывал, как высоко ценит он друга и как много ждет от него в будущем.
«Как он может это говорить!» думал Пьер. Пьер считал князя Андрея образцом всех совершенств именно оттого, что князь Андрей в высшей степени соединял все те качества, которых не было у Пьера и которые ближе всего можно выразить понятием – силы воли. Пьер всегда удивлялся способности князя Андрея спокойного обращения со всякого рода людьми, его необыкновенной памяти, начитанности (он всё читал, всё знал, обо всем имел понятие) и больше всего его способности работать и учиться. Ежели часто Пьера поражало в Андрее отсутствие способности мечтательного философствования (к чему особенно был склонен Пьер), то и в этом он видел не недостаток, а силу.
В самых лучших, дружеских и простых отношениях лесть или похвала необходимы, как подмазка необходима для колес, чтоб они ехали.
– Je suis un homme fini, [Я человек конченный,] – сказал князь Андрей. – Что обо мне говорить? Давай говорить о тебе, – сказал он, помолчав и улыбнувшись своим утешительным мыслям.
Улыбка эта в то же мгновение отразилась на лице Пьера.
– А обо мне что говорить? – сказал Пьер, распуская свой рот в беззаботную, веселую улыбку. – Что я такое? Je suis un batard [Я незаконный сын!] – И он вдруг багрово покраснел. Видно было, что он сделал большое усилие, чтобы сказать это. – Sans nom, sans fortune… [Без имени, без состояния…] И что ж, право… – Но он не сказал, что право . – Я cвободен пока, и мне хорошо. Я только никак не знаю, что мне начать. Я хотел серьезно посоветоваться с вами.
Князь Андрей добрыми глазами смотрел на него. Но во взгляде его, дружеском, ласковом, всё таки выражалось сознание своего превосходства.
– Ты мне дорог, особенно потому, что ты один живой человек среди всего нашего света. Тебе хорошо. Выбери, что хочешь; это всё равно. Ты везде будешь хорош, но одно: перестань ты ездить к этим Курагиным, вести эту жизнь. Так это не идет тебе: все эти кутежи, и гусарство, и всё…
– Que voulez vous, mon cher, – сказал Пьер, пожимая плечами, – les femmes, mon cher, les femmes! [Что вы хотите, дорогой мой, женщины, дорогой мой, женщины!]
– Не понимаю, – отвечал Андрей. – Les femmes comme il faut, [Порядочные женщины,] это другое дело; но les femmes Курагина, les femmes et le vin, [женщины Курагина, женщины и вино,] не понимаю!
Пьер жил y князя Василия Курагина и участвовал в разгульной жизни его сына Анатоля, того самого, которого для исправления собирались женить на сестре князя Андрея.
– Знаете что, – сказал Пьер, как будто ему пришла неожиданно счастливая мысль, – серьезно, я давно это думал. С этою жизнью я ничего не могу ни решить, ни обдумать. Голова болит, денег нет. Нынче он меня звал, я не поеду.
– Дай мне честное слово, что ты не будешь ездить?
– Честное слово!
Уже был второй час ночи, когда Пьер вышел oт своего друга. Ночь была июньская, петербургская, бессумрачная ночь. Пьер сел в извозчичью коляску с намерением ехать домой. Но чем ближе он подъезжал, тем более он чувствовал невозможность заснуть в эту ночь, походившую более на вечер или на утро. Далеко было видно по пустым улицам. Дорогой Пьер вспомнил, что у Анатоля Курагина нынче вечером должно было собраться обычное игорное общество, после которого обыкновенно шла попойка, кончавшаяся одним из любимых увеселений Пьера.
«Хорошо бы было поехать к Курагину», подумал он.
Но тотчас же он вспомнил данное князю Андрею честное слово не бывать у Курагина. Но тотчас же, как это бывает с людьми, называемыми бесхарактерными, ему так страстно захотелось еще раз испытать эту столь знакомую ему беспутную жизнь, что он решился ехать. И тотчас же ему пришла в голову мысль, что данное слово ничего не значит, потому что еще прежде, чем князю Андрею, он дал также князю Анатолю слово быть у него; наконец, он подумал, что все эти честные слова – такие условные вещи, не имеющие никакого определенного смысла, особенно ежели сообразить, что, может быть, завтра же или он умрет или случится с ним что нибудь такое необыкновенное, что не будет уже ни честного, ни бесчестного. Такого рода рассуждения, уничтожая все его решения и предположения, часто приходили к Пьеру. Он поехал к Курагину.
Подъехав к крыльцу большого дома у конно гвардейских казарм, в которых жил Анатоль, он поднялся на освещенное крыльцо, на лестницу, и вошел в отворенную дверь. В передней никого не было; валялись пустые бутылки, плащи, калоши; пахло вином, слышался дальний говор и крик.
Игра и ужин уже кончились, но гости еще не разъезжались. Пьер скинул плащ и вошел в первую комнату, где стояли остатки ужина и один лакей, думая, что его никто не видит, допивал тайком недопитые стаканы. Из третьей комнаты слышались возня, хохот, крики знакомых голосов и рев медведя.
Человек восемь молодых людей толпились озабоченно около открытого окна. Трое возились с молодым медведем, которого один таскал на цепи, пугая им другого.
– Держу за Стивенса сто! – кричал один.
– Смотри не поддерживать! – кричал другой.
– Я за Долохова! – кричал третий. – Разними, Курагин.
– Ну, бросьте Мишку, тут пари.
– Одним духом, иначе проиграно, – кричал четвертый.
– Яков, давай бутылку, Яков! – кричал сам хозяин, высокий красавец, стоявший посреди толпы в одной тонкой рубашке, раскрытой на средине груди. – Стойте, господа. Вот он Петруша, милый друг, – обратился он к Пьеру.
Другой голос невысокого человека, с ясными голубыми глазами, особенно поражавший среди этих всех пьяных голосов своим трезвым выражением, закричал от окна: «Иди сюда – разойми пари!» Это был Долохов, семеновский офицер, известный игрок и бретёр, живший вместе с Анатолем. Пьер улыбался, весело глядя вокруг себя.
wiki-org.ru
Задачи к разделу Окислительно-восстановительные реакции
В данном разделе собраны задачи по теме Окислительно-восстановительные реакции. Приведены примеры задач на составление уравнений реакций, нахождение окислительно-восстановительного потенциал, и константы равновесия ОВР и другие.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S = H2SO4 + NO + H2O.
Показать решение »
Решение.
Простые вещества, атомы которых не могут отдать электрон, а могут только присоединить его в реакциях являются только окислителями. Из простых веществ только окислителем может быть фтор F2, атомы которого имеют наивысшую электроотрицательность. В сложных соединениях – если атом, входящий в состав этого соединения (и меняющий степень окисления) находится в своей наивысшей степени окисления, то данное соединение будет обладать только окислительными свойствами.
Из предложенного списка соединений, нет веществ, которые обладали бы только окислительными свойствами, т.к. все они находятся в промежуточной степени окисления.
Наиболее сильный окислитель из них – Cl2, но в реакциях с более электроотрицательными атомами будет проявлять восстановительные свойства.
N-3H3, C+2O, S+4O2, K2Mn+6O4, Сl02, HN+3O2
HNO3 + H2S = H2SO4 + NO + H2O.
Составим электронные уравнения:
N+5 +3e— = N+2 | 8 окислитель
S-2 — 8e— = S+6 | 3 восстановитель
Сложим два уравнения
8N+5 +3S-2— = 8N+2 + 3S+6
Подставим коэффициенты в молекулярное уравнение:
8HNO3 +3H2S = 3H2SO4 + 8NO + 4H2O.
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
Показать решение »
Решение.
HN+3O2 — Степень окисления азота в азотистой кислоте равна +3 (промежуточная степень окисления). Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
а) HNO2 + Br2 + H2O = 2HBr + HNO3
N+3 – 2 e = N+5 | 1 восстановитель
Br20 + 2 e = 2Br— | 1 окислитель
N+3 + Br2 = N+5 + 2Br—
б) HNO2 + 2HI = I2 + 2NO + 2H2O
N+3 + e = N+2 | 1 окислитель
2I— — 2 e = I2 | 1 восстановитель
N+3 + 2I— = N+2 + I2
в) 5HNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5HNO3 + K2SO4 + 3H2O
N+3 – 2 e = N+5 | 5 восстановитель
Mn+7 + 5 e = Mn+2 | 2 окислитель
5N+3 + 2Mn+7 = 5N+5 + 2Mn+2
Задача 3. Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
Показать решение »
Решение.
Хлор может проявлять степени окисления от -1 до +7.
Соединения, содержащие хлор в его высшей степени окисления, могут быть только окислителями, т.е. могут только принимать электроны.
Соединения, содержащие хлор в его низшей степени окисления, могут быть только восстановителями, т.е. могут только отдавать электроны.
Соединения, содержащие хлор в его промежуточной степени окисления, могут быть как восстановителями, так и окислителями, т.е. могут отдавать, так и принимать электроны.
H+1Сl-1, Cl02, H+1Cl+3O2-2 , H+1Cl+5O3-2 , Cl2+7O7-2
Таким образом, в данном ряду
Только окислитель — Cl2O7
Только восстановитель – HСl
Могут быть как окислителем, так и восстановителем — Cl2, HClO2 , HClO3
КСlO3 → КС1 + КСlO4.
Составим электронные уравнения
Cl+5 +6e— = Cl— | 2 | 1 окислитель
Cl+5 -2e— = Cl+7 | 6 | 3 восстановитель
Расставим коэффициенты
4Cl+5 = Cl— + 3Cl+7
4КСlO3 → КС1 + 3КСlO4.
Задача 4. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
а) KNO3 = KNO2 + O2;
б) Mq+ N2 = Mq3N2;
в) KClO3 = KCl + O2.
Показать решение »
Решение.
В реакциях внутримолекулярного окисления-восстановления перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы)
а) 2KNO3 = 2KNO2 + O2 — внутримолекулярная ОВР
N+5 +2e— = N+3 | 2 окислитель
2O-2 -4e— = O20 | 1 восстановитель
2N+5 + 2O-2 = 2N+3 + O20
б) 3Mq + N2 = Mq3N2 — межмолекулярная ОВР
N2 +6e— = 2N-3 | 2 | 1 окислитель
Mg0 -2e— = Mg+2 | 6 | 3 восстановитель
N2 + 3Mg0 = 2N-3 + 3Mg+2
в) 2KClO3 = 2KCl + 3O2 — внутримолекулярная ОВР
Cl+5 +6e— = Cl— | 4 | 2 окислитель
2O-2 -4e— = O20 | 6 | 3 восстановитель
2Cl+5+ 6O-2 = 2Cl— + 3O20
Задача 5. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) Cl2 + KOH = KCl + KClO3 + H2O;
б) KClO3 = KCl + KClO4 .
Показать решение »
Решение.
В реакциях диспропорционирования окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления.
а) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O;
Cl20 +2e— = 2Cl— | 10| 5 окислитель
Cl20 -10e— = 2Cl+5 | 2 | 1 восстановитель
5Cl20 + Cl20 = 10Cl— + 2Cl+5
3Cl20 = 5Cl— + Cl+5
б) 4KClO3 = KCl + 3KClO4
Cl+5 +6e— = Cl— | 2 | 1 окислитель
Cl+5 -2e— = Cl+7 | 6 | 3 восстановитель
4Cl+5 = Cl— + 3Cl+7
Задача 6. Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
KMnO4 + KNO2 + H2SO4 = K2SO4 + MnSO4 + KNO3 + H2O
Показать решение »
Решение.
Составим полуреакции:
MnO4— + 8H+ +5e— = Mn2+ + 4H2O | 2 окислитель
NO2— + H2O — 2e— = NO3— + 2H+ | 5 восстановитель
Сложим две полуреакции, умножив каждую на соответствующий коэффициент:
2MnO4— + 16H+ + 5NO2—+ 5H2O = 2Mn2+ + 8H2O + 5NO3— + 10H+
После сокращения идентичных членов, получаем ионное уравнение:
2MnO4— + 6H+ + 5NO2— = 2Mn2+ + 3H2O + 5NO3—
Подставим коэффициенты в молекулярное уравнение и уравняем его правую и левую части:
2KMnO4 + 5KNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5KNO3 + 3H2O
Задача 7. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O
Zn + H2SO4(конц) = ZnSO4 + SO2 + H2O
Показать решение »
Решение.
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Составим электронные уравнения
Zn0 – 2 e = Zn2+ | 8 | 4 | восстановитель
N+5 + 8 e = N3- | 2 | 1 | окислитель
4Zn0 + N+5 = 4Zn2+ + N3-
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O
Составим электронные уравнения
Zn0 – 2 e = Zn2+ | 2 | 1 восстановитель
S+6 + 2 e = S+4 | 2 | 1 окислитель
Zn0 + S+6 = Zn2+ + S+4
Задача 8. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F— -2e— = F2, E0 = 2,85 В
б) 2Сl— -2e— = Cl2, E0 = 1,36 В
в) 2Br— -2e— = Br2, E0 = 1,06 В
г) 2I— -2e— = I2, E0 = 0,54 В
Стандартный окислительно-восстановительный потенциал системы
Cr2O72- + 14H+ + 6e— = 2Cr3+ + 7H2O равен E0 =1,33 В
Показать решение »
Решение.
Для определения возможности протекания ОВР в прямом направлении необходимо найти ЭДС гальванического элемента:
ЭДС = Е0ок — Е0восст
Если найденная величина ЭДС > 0, то данная реакция возможна.
Итак, определим, можно ли K2Cr2O7 использовать в качестве окислителя в следующих гальванических элементах:
F2|F— || Cr2O72-|Cr3+ E = 1,33 – 2,85 = -1,52 В
Cl2|Cl— || Cr2O72-|Cr3+ E = 1,33 – 1,36 = -0,03 В
Br2|Br— || Cr2O72-|Cr3+ E = 1,33 – 1,06 = +0,27 В
I2|I— || Cr2O72-|Cr3+ E = 1,33 – 0,54 = +0,79 В
Таким образом, в качестве окислителя дихромат калия можно использовать только для процессов:
2Br— -2e— = Br2 и 2I— -2e— = I
Задача 9. Вычислите окислительно-восстановительный потенциал для системы
MnO4— + 8H+ +5e— = Mn2+ + 4H2O
Если С(MnO4—)=10-5 М, С(Mn2+)=10-2 М, С(H+)=0,2 М.
Показать решение »
Решение.
Окислительно-восстановительный потенциал рассчитывают по уравнению Нернста:
E = E° + (0,059/n)lg(Cок/Cвос)
В приведенной системе в окисленной форме находятся MnO4— и H+, а в восстановленной форме — Mn2+, поэтому:
E = 1,51 + (0,059/5)lg(10-5*0,2/10-2) = 1,46 В
Задача 10. Рассчитайте для стандартных условий константу равновесия окислительно-восстановительной реакции:
2KMnO4 + 5HBr + 3H2SO4 = 2MnSO4 + 5HBrO + K2SO4 + 3H2O
Показать решение »
Решение.
Константа равновесия K окислительно-восстановительной реакции связана с окислительно-восстановительными потенциалами соотношением:
lgK = (E10 -E20 )n/0,059
Определим, какие ионы в данной реакции являются окислителем и восстановителем:
MnO4— + 8H+ +5e— = Mn2+ + 4H2O | 2 окислитель
Br— + H2O — 2e— = HBrO + H+ | 5 восстановитель
Общее число электронов, принимающих участие в ОВР n = 10
E10 (окислителя) = 1,51 В
E20 (восстановителя) = 1,33 В
Подставим данные в соотношение для К:
lgK = (1,51 — 1,33 )10/0,059
lgK = 30,51
K = 3,22*1030
zadachi-po-khimii.ru
Окислительно-восстановительные реакции
Министерство образования и науки Российской Федерации
Национальный исследовательский ядерный университет «МИФИ»
Балаковский инженерно-технологический институт
Методические указания к выполнению лабораторной работы
по курсу «Химия» для студентов технических
специальностей и направлений,
по курсу «Общая и неорганическая химия» для студентов
направления ХМТН всех форм обучения
Балаково 2015
Цель работы: ознакомиться с особенностями окислительно-восстано-вительных процессов, установить влияние различных факторов на скорость протекания процессов.
Основные понятия
Окислительно-восстановительными реакциями называются реакции, в которых происходит изменение степени окисления атомов или ионов реагирующих веществ, т.е. происходит переход электронов от одних атомов к другим. В окислительно-восстановительных реакциях протекают одновременно два взаимно-связанных процесса: окисление и восстановление.
Вещества, отдающие электроны в процессе химической реакции, называются восстановителями, сам процесс отдачи электронов атомом, молекулой или ионом – окисление, при этом происходит увеличение степени окисления:
Ca0 – 2e → Ca+2, 2Br-1 – 2e → Br20
Вещества, присоединяющие электроны в процессе химической реакции, называются окислителями, сам процесс присоединения электронов атомом, молекулой или ионом – восстановление, при этом происходит понижение степени окисления:
S+4 + 2e → S+2, Cl20 + 2e → 2Cl-1
Уравнения, которые выражают процессы окисления и восстановления называются электронными уравнениями.
Степенью окисления называется условное число (со знаком + или -), показывающее распределение электронной плотности в данной молекуле, т.е. условный заряд атомов в молекуле, вызванный смещением электронной плотности в сторону атомов с большей электроотрицательностью. При этом количество оттянутых от атома электронных пар соответствует его положительной степени окисления, а количество притянутых к атому электронных пар — отрицательной степени окисления.
Алгебраическая сумма всех степеней окисления атомов, входящих в соединение, всегда равна нулю, т. e. молекулы в целом электронейтральны.
+1 -1 +1 -2 +1 +7 -2 +1 +6 -2 +1+5-2 +1+6 -2
H2O2, H2O, KMnO4, K2Cr 2O7, HNO3 , H2SO4
У молекул с неполярным типом химической связи электронная плотность распределена равномерно между атомами и их степень окисления равна нулю, например: О20, N20, С0, Na0.
Высшей степенью окисления элемента называется наибольшее значение степени окисления, которое может принимать данный элемент, низшей степенью окисления элемента – наименьшее значение. Остальные степени окисления называются промежуточными.
Окислительно-восстановительные свойства атомов зависят от ряда факторов и, прежде всего, от величины степени окисления: если элемент находится в высшей степени окисления, то он может быть только окислителем; если в низшей степени окисления, то – восстановителем; если в промежуточной степени окисления, то может проявлять окислительно- восстановительную двойственность.
S-2 S0 S+6
низшая ст. окисл. промеж. ст. окисл. высшая ст.окисл.
S-2 – 2e → S0 S0 + 2e → S-2 ок-ль S+6 + 2e → S+4
S-2 – 6e → S+4 S0 – 4e → S+4 восст. S+6 + 6e → S0
S-2 – 8e → S+6 S-0 – 6e → S+6 S+6 + 8e → S-2
восстановитель окисл.-восстан. окислитель
двойственность
Окислительно-восстановительные свойства атомов связаны с положением элемента в периодической таблице Д.И. Менделеева. Простые вещества – неметаллы обладают большими окислительными свойствами, а металлы – большими восстановительными свойствами. С уменьшением радиуса атома или иона увеличивается прочность связи электрона с ядром, что приводит к ослаблению восстановительной и усилению окислительной способности. В периодах с увеличением порядкового номера радиус атомов уменьшается, т.е. происходит ослабление восстановительных и усиление окислительных свойств. В главных подгруппах наблюдается усиление восстановительных свойств элементов в направлении сверху вниз. У элементов побочных групп незначительный рост радиуса при значительном увеличении заряда ядра приводит не к увеличению, а к уменьшению восстановительных свойств, т.е. к ослаблению активности металла.
К важнейшим окислителям относятся соединения, имеющие в своем составе металлы и неметаллы в высшей степени окисления (H2SO4, HNO3 , KCIO3, K2Cr2O7, KMnO4 и др.)
К важнейшим восстановителям относятся соединения, имеющие в своем составе неметаллы в низшей степени окисления (HI, KI, HCl, H2S и др.), металлы (Mg, Zn и др.), водород.
Вещества, содержащие атомы в промежуточных степенях окисления (SO2, H2SO3, HNO3, и др.), способны как повышать, так и понижать степень окисления, т.е. могут выполнять роль или окислителя или восстановителя в зависимости от свойства другого вещества, участвующего в реакции.
В пероксиде водорода Н2О2 степень окисления атомов кислорода равна –1. В соответствии со сказанным выше, это соединение может играть роль окислителя: Н2О2 + 2е + 2Н+ = 2Н2О
или роль восстановителя: Н2О2 –2е = О2 + 2Н+
Для составления уравнений реакций окисления-восстановления, при-меняют метод электронного баланса или ионно-электронный метод (метод полуреакций). Коэффициенты в уравнениях окислительно-восстановитель-ных реакций подбирают с таким расчетом, чтобы наступил баланс по электронам, т.е. число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
При использовании метода электронного баланса осуществляется следующая последовательность операций.
1. Составляют схему окислительно-восстановительной реакции и находят атомы, изменяющие степени окисления в результате реакции.
+6 -2 +3 0
K2Cr2O7 +Na2S +H2SO4→ Cr2(SO4)2 +S + K2SO4 + Na2SO4 +H2O
2. Составляют электронные уравнения процессов окисления и восстановления, соблюдая законы сохранения числа атомов и зарядов в каждой полуреакции.
2Cr+6 + 6e →2Cr+3 1 восстановление
6
S-2 – 2e→S0 3 окисление
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть.
Ставят основные коэффициенты в уравнение перед окислителем и восстановителем и продуктами окисления и восстановления.
K2Cr2O7 +3Na2S +H2SO4 →Cr2(SO4)2 +3S + K2SO4 + Na2SO4 +H2O
Уравнивают продукты, не изменившие степени окисления своих атомов в следующей последовательности:
а) катионы металлов;
б) анионы кислотных остатков;
в) катионы водорода;
г) кислород (по нему проверяется баланс)
K2Cr2O7 +3Na2S +7H2SO4= Cr2(SO4)2 +3S + K2SO4 + Na2SO4 +7H2O
Если молекула окислителя или восстановителя расходуется также на связывание получающихся веществ, например, для реакции:
0 +5 +2 +2
Cu + HNO3 + HNO3 → Cu(NO3)2 + NO + Н2О
Cu0 – 2e → Cu+2 3 восстановитель
6
N+5 + 3e → N+2 2 окислитель
прежде всего, рассчитывают коэффициенты для окислителя и восстановителя и продуктов окисления и восстановления.
0 +5 +2 +2
3Cu + 2HNO3 + HNO3 → 3Cu(NO3)2 + 2NO+ Н2О
восстано- окисли- продукт продукт
витель тель окисления восстановления
Затем определяют то дополнительное количество молей кислоты, которое было израсходовано на образование соли Cu(NO3)2:
3Cu + 2HNO3 + 6HNO3 → 3Cu(NO3)2 + 2NO+ 4Н2О
на образование
соли
Окончательная запись уравнения:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO+ 4Н2О
Ионно-электронный метод используется для подбора коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водном растворе при участии сильных электролитов. Он складывается из следующих этапов:
Записывают уравнение реакции в молекулярном и ионном виде:
KMnO4 +KI +H2SO4 → MnSO4 +I2+K2SO4 + H2O
К+ + MnO4— + К+ + I— + 2H+ + SO4-2 → Mn+2 + SO4-2 + I20 +2 К+ + SO4-2 + H2O
2. Записывают формулы ионов и молекул, которые принимают участие в реакции в качестве восстановителя или окислителя в ионном виде:
MnO4— + I— + H+ → Mn+2 +I20 +H20
3. Составляют электронные уравнения полуреакций, подбирают дополнительные множители:
MnO4— +5e +8H+ → Mn+2 + 4 H20 2 восстановление
10
2I— + 2e → I20 5 окисление
Если исходный ион или молекула содержит больше атомов кислорода, чем продукт реакции, то избыток атомов кислорода в кислой среде связывается ионами H+ в молекулы воды; в нейтральной или щелочной среде – молекулами воды в гидроксильные группы ОН—.
Если исходный ион или молекула содержит меньше атомов кислорода, чем продукт реакции, то недостаток атомов кислорода в кислой и нейтральной среде компенсируется за счет молекул воды; в щелочной среде – за счет гидроксильных групп ОН—.
4. Составляют ионное уравнение реакции, суммируя уравнения полуреакций:
2MnO4— +10I— + 16H+ → 2Mn+2 +5I20 +8H20
5. Переносят коэффициенты в молекулярное уравнение, подбирают коэффициенты для веществ, отсутствующих в ионном уравнении и проводят проверку (обычно по числу атомов кислорода)
2KMnO4 +10KI +8H2SO4= 2MnSO4 + 5I2 + 6K2SO4 + 8Н2О
По механизму протекания процессов окислительно-восстановитель-ные реакции делятся на следующие виды: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосста-новления).
Межмолекулярные окислительно-восстановительные реакции
В этом случае окислитель и восстановитель входят в состав молекул различных веществ.
+6 +2 +3 +4
2CrO3 + 3MnO → Cr2O3 +3MnO2
2Cr+6 + 6e =2Cr+3 1 окислитель
6
Mn+2 – 2e = Mn+4 3 восстановитель
Внутримолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель входят в состав молекулы одного и того же вещества, но это атомы различных химических элементов.
-3 +6 0 +3
(NH4)2Cr2O7 → N2+ Cr2O3 + 4H2O
2N-3– 6e = N2 1 восстановитель
6
2Cr+6 + 6e =2Cr+3 1 окислитель
Реакции диспропорционирования (самоокисления-самовосстановления)
Они сопровождаются одновременным увеличением и уменьшением окисления степени окисления атомов одного и того же элемента.
+4 +6 -2
2K2SO3 → 3 K2SO4+ K2S
S+4 – 2e = S+6 3 восстановитель
6
S+4 + 6e = S-2 1 окислитель
На окислительно-восстановительные реакции влияют следующие факторы:
Среда
В зависимости от того, в какой среде протекает реакция, образуются различные продукты окисления или восстановления:
a)нейтральная среда
+7 +3 +4 +5
2KMnO4 + 3NaNO2+ H2O → 2MnO2 + 3NaNO3 +2KOH
Mn+7 + 3e → Mn+2 2
6
N+3 –2e → N+5 3
studfiles.net
