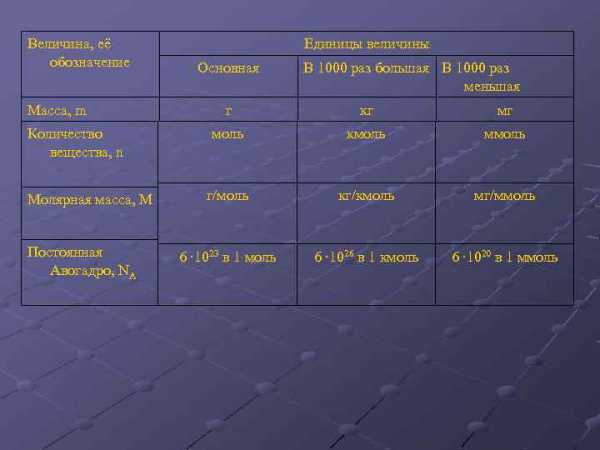
1.3.3. Моль, молярная масса, молярный объем
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12С.
Учитывая, что значение абсолютной атомной массы для углерода равно m(C) = 1,99·1026 кг, можно рассчитать число атомов углерода NА, содержащееся в 0,012 кг углерода.
Моль
любого вещества содержит одно и то же
число частиц этого вещества (структурных
единиц). Число структурных
единиц, содержащихся в веществе
количеством один моль равно 6,02·10
Например, один моль меди содержит 6,02·1023 атомов меди (Cu), а один моль водорода (H2) – 6,02·1023 молекул водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н2О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н2О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·10 23 молекул воды (соответственно 2·6,02·1023 атомов водорода и 6,02·1023 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная массу вещества и его химическую формулу, а значит и значение его молярной массы, можно определить количество вещества и, наоборот, зная количество вещества, можно определить его массу. Для подобных расчетов следует пользоваться формулами:
ν = m / M,
m = ν · M,
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na2SO4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na2SO4, представляющую собой сумму округленных значений относительных атомных масс:
2) численно равное ей значение молярной массы вещества:
М(Na2SO4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При нормальных условиях (н.у.), т.е. при давлении р, равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной 273,15 К (0С), один моль различных газов и паров занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
Vмол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (Vмол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · Vмол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; Vмол = 22,4 л/моль.
И, наоборот, зная объем (V) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
ν = V /Vмол.
studfiles.net
Урок 8. Химическое количество вещества и моль – HIMI4KA
В уроке 8 «Химическое количество вещества и моль» из курса «Химия для чайников» выясним, что такое химическое количество вещества; рассмотрим моль в качестве единицы количества вещества, а также познакомимся с постоянной Авогадро. Напоминаю, что в прошлом уроке «Относительная молекулярная и относительная формульная массы» мы научились вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выяснили что такое массовая доля и привели формулу для ее вычисления.

Любое чистое вещество имеет свою химическую формулу, т. е. характеризуется определенным качественным и количественным составом.
Если необходима какая-то порция твердого вещества, то для этого следует взять нужную его массу, т. е. взвесить вещество (рис. 43). Нужный объем жидкого вещества обычно отмеряют с помощью мензурки или мерного цилиндра (рис. 44). Для отбора необходимой порции (объема) газообразных веществ применяют специальные емкости — газометры (рис. 45).


Следовательно, объем и масса — это величины, характеризующие данную порцию вещества.
Химическое количество вещества
В жизни мы часто не различаем понятия «масса» и «количество». А это разные понятия. Когда вы говорите: «Я купил 2 кг груш», то здесь речь идет о массе груш. Но если вы говорите: «Я купил 10 груш», то в этом случае речь идет о количестве груш. Массу вещества измеряют в граммах, килограммах, тоннах, а количество — в штуках.
Груши можно пересчитать поштучно, а если это, например, зерна? Тут уже посчитать каждое зернышко даже в небольшой емкости сложно. Поэтому зерно обычно продают мешками, т. е. определенными порциями. В каждой такой порции — мешке (если они равны по массе и все зерна одинаковы) — будет находиться практически одно и то же число зерен. Подобным образом продают многие товары. Например, яйца — десятками, спички — спичечными коробками, в каждом из которых находится по 45 спичек (рис. 46).
В химической практике, помимо массы или объема, необходимо знать число структурных единиц (атомов, молекул, формульных единиц), которые содержатся в данной порции вещества, поскольку именно они участвуют в химических реакциях. Поэтому в химии, как и в других естественных науках, используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физическая величина называется количеством вещества или, как следует называть ее при химических расчетах, — химическое количество вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Другими словами, химическое количество вещества — это порция данного вещества, содержащая определенное число его структурных единиц. Химическое количество вещества обозначают латинской буквой n. Это одна из семи основных физических величин Международной системы единиц (СИ).
Моль — единица химического количества вещества
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается, как и полное, — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется, так же, как и другие сокращенные единицы величин: 3 кг, 5 л, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три килограмма, пять литров, восемь молей.
На заметку. Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале ХХ в. Автор этого термина известный немецкий химик и физик Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
Число (N) атомов в порции углерода массой 0,012 кг легко определить, зная массу одного атома углерода (19,94·10-27 кг):
Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная:
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:
Единица в числителе дроби (1/моль) заменяет название структурной единицы.
Если структурной единицей вещества (например, меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023молекул. Если структурными единицами веществ немолекулярного строения (например, NaCl или CuSO4) являются их формульные единицы, то в порциях этих веществ количеством 1 моль содержатся по 6,02·1023формульных единиц.
На заметку. Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Поверхность Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023 песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов, формульных единиц) N(Х) в этой порции:
если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N(Х) молекул.
Отсюда:
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
Пример 1. Определите число молекул, содержащихся в серной кислоте химическим количеством 3 моль.
Спойлер

[свернуть]
Пример 2. Рассчитайте химическое количество CuSO4 в порции, содержащей 36,12·1023 формульных единиц (ФЕ).
Спойлер

[свернуть]
Краткие выводы урока:
- Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
- Моль — единица химического количества вещества, т. е. такое его количество, которое содержит 6,02·1023 структурных единиц.
Надеюсь урок 8 «Химическое количество вещества и моль» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
«Моль – единица количества вещества. Молярная масса». 8-й класс
Разделы: Химия
Цель: Познакомить учащихся с понятиями «количество вещества», «молярная масса» дать представление о постоянной Авогадро. Показать взаимосвязь количества вещества, числа частиц и постоянной Авогадро, а также взаимосвязь молярной массы, массы и количества вещества. Научить производить расчёты.
Тип урока: урок изучения и первичного закрепления новых знаний.
Ход урока
I. Организационный момент
II. Проверка д/з по теме: «Типы химических реакций»
III. Изучение нового материала
1. Количество вещества – моль
Вещества вступают в реакцию в строго определённых соотношениях. Например, чтобы получить вещество вода нужно взять столько водорода и кислорода, чтобы на каждые две молекулы водорода приходилась одна молекула кислорода:
2Н2 + O2 = 2Н2О
Чтобы получить вещество сульфид железа, нужно взять столько железа и серы, чтобы на каждый атом железа приходился один атом серы.
Fe + S = FeS
Чтобы получить вещество оксид фосфора, нужно взять столько молекул фосфора и кислорода, чтобы на четыре молекулы фосфора приходилось пять молекул кислорода.
4P + 5O2 = 2P2O 5
Определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооружённым глазом. Для определения числа структурных единиц (атомов, молекул) в химии применяют особую величину – количество вещества (v – ню). Единицей количества вещества является моль.
- Моль – это количество вещества, которое содержит столько структурных частиц (атомов, молекул), сколько атомов содержится в 12 г углерода.
Экспериментально установлено, что 12 г углерода содержит 6·1023 атомов. Значит один моль любого вещества, независимо от его агрегатного состояния содержит одинаковое число частиц – 6· 1023 .
- 1 моль кислорода (O2) содержит 6·1023 молекул.
- 1 моль водорода (Н2) содержит 6·1023 молекул.
- 1 моль железа (Fe) содержит 6·1023 молекул.
Задание: Используя полученную информацию, ответьте на вопросы:
а) сколько атомов кислорода содержится в 1 моле кислорода?
– 6·1023·2 = 12· 1023 атомов.
б) сколько атомов водорода и кислорода содержится в 1 моле воды (Н2O)?
– 6·1023·2 = 12· 1023 атомов водорода и 6·1023 атомов кислорода.
Число 6·1023 названо постоянной Авогадро в честь итальянского учёного 19 века и обозначается NА. Единицы измерения атомы/моль или молекулы/моль.
2. Решение задач на нахождение количества вещества
Часто нужно знать, сколько частиц вещества содержится в определённом количестве вещества. Или же найти количество вещества по известному числу молекул. Эти расчёты можно сделать по формуле:
где N – число молекул, NА – постоянная Авогадро, v – количество вещества. Из этой формулы можно выразить количество вещества.
Задача 1. Сколько атомов содержится в 2 молях серы?
N = 2·6·1023 = 12·1023 атомов.
Задача 2. Сколько атомов содержится в 0,5 молях железа?
N = 0,5·6·1023 = 3·1023 атомов.
Задача 3. Сколько молекул содержится в 5 молях углекислого газа?
N = 5·6·1023 = 30·1023 молекул.
Задача 4. Какое количество вещества составляет 12·1023 молекул этого вещества?
v = 12·1023/ 6·1023 = 2 моль.
Задача 5. Какое количество вещества составляет 0,6·1023 молекул этого вещества?
v = 0,6·1023/ 6·1023 = 0,1 моль.
Задача 6. Какое количество вещества составляет 3·1023 молекул этого вещества?
v = 3·1023/ 6·1023 = 0,5 моль.
3. Молярная масса
Для химических реакций нужно учитывать количество вещества в молях.
В: Но как на практике отмерить 2, или 2,5 моль вещества? В каких единицах лучше всего измерять массу веществ?
Для удобства в химии используют молярную массу.
Молярная масса – это масса одного моля вещества.
Обозначается – М. Измеряется в г/моль.
Молярная масса равна отношению массы вещества к соответствующему количеству вещества.
где М – молярная масса вещества, v – количество вещества, т – масса вещества.
Молярная масса – величина постоянная. Численное значение молярной массы соответствует значению относительной атомной или относительной молекулярной массы.
В: Как можно найти значения относительной атомной или относительной молекулярной массы?
Мr (S) = 32; M (S) = 32 г/моль – что соответствует 1 молю серы
Мr (Н2О) = 18; М (Н2О) = 18 г/моль – что соответствует 1 молю воды.
Следует отличать понятия «моль молекул» и «моль атомов». Например, Н2 В: Сколько молей атомов кислорода и водорода содержится в одном моле молекулы воды? В одном моле молекулы воды содержится два моля атомов водорода и один моль атомов кислорода. |
4. Решение задач на нахождение массы вещества
Задача 7. Определить массу 0,5 моль железа.
m = 0,5·56 = 28 г
Задача 8. Определить массу 0,25 моль меди
m = 0,25·64 = 16 г
Задача 9. Определить массу 2 моль углекислого газа (СO2)
m = 2·44 = 88 г
Задача 10. Сколько молей оксида меди – CuО составляют 160 г оксида меди?
v = 160 / 80 = 8 моль
Задача 11. Сколько молей воды соответствуют 30 г воды
v =30/18 = 1,66 моль
Задача 12. Сколько молей магния соответствует его 40 граммам?
v = 40 /24 = 1,66 моль
IV. Закрепление
Фронтальный опрос:
- Что такое количество вещества?
- Чему равен 1 моль любого вещества?
- Что такое молярная масса?
- Отличается ли понятия «моль молекул» и «моль атомов»?
- Объясните на примере молекулы аммиака NН3.
- Зачем необходимо знать формулы при решении задач?
Задачи:
- Сколько молекул содержится в 180 граммах воды?
- Сколько молекул составляет 80 г углекислого газа?
V. Домашнее задание
Изучить текст параграфа, составить две задачи: на нахождение количества вещества; на нахождение массы вещества.
Литература:
- Гара Н.Н. Химия. Уроки в 8 классе: пособие для учителя. _ М.: Просвещение, 2009.
- Рудзитес Г.Е., Фельдман Ф.Г. Химия. 8 класс.: Учебник для общеобразовательных учебных учреждений – М.: Просвещение, 2009.
xn--i1abbnckbmcl9fb.xn--p1ai
Cайт учителя химии Ващенко Н.Ю.
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро.
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана Ch5 определяется следующим образом:
Мr(Ch5) = Ar(C) + 4 Ar(H) = 12+4 =16
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.

Пример
Вычислить массы метана Ch5 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(CH
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m(CH
4) = 2 моль • 16 г/моль = 32 г;m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(Ch5) = n(С2Н6), но m(Ch5) < m(С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
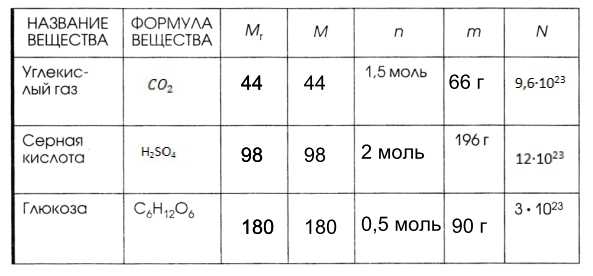
Образцы решения задач

ТРЕНАЖЁРЫ
Интерактивны тесты
Задания для закрепления
Задача 2. Вычислите массу 24,08 *1023 молекул серной кислоты h3SO4?
Задача 3. Определите число атомов в 56 г железа Fe?
himiknoginsk.ucoz.ru
Количество вещества — Википедия
Материал из Википедии — свободной энциклопедии
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы)[1]. Единица измерения количества вещества в Международной системе единиц (СИ) и в системе СГС — моль[2].
Применение
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул в единицах «штука», их измеряют в молях. Фактическое количество единиц «штука» в 1 моле вещества называется числом Авогадро (NA = 6,022140857(74)·1023 «штука»/моль[3]).
Количество вещества обозначается латинской n{\displaystyle n} (эн) и не рекомендуется обозначать греческой буквой ν{\displaystyle \nu } (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов[4]. Однако в школьном курсе широко используется именно греческая буква ν{\displaystyle \nu } (ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: n=m/M{\displaystyle n=m/M}, где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро, количество газообразного вещества можно также определить на основании его объёма: n{\displaystyle n} = V / Vm, где V — объём газа при нормальных условиях, а Vm — молярный объём газа при тех же условиях, равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
- n=mM=NNA=VVm{\displaystyle n={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m}}}}
Примечания
- ↑ Количество вещества. Большой энциклопедический политехнический словарь (2004). Проверено 31 января 2014.
- ↑ Деньгуб В. М., Смирнов В. Г. Единицы величин. Словарь-справочник. — М.: Издательство стандартов, 1990. — С. 85. — 240 с. — ISBN 5-7050-0118-5.
- ↑ Avogadro constant (англ.). Physical Measurement Laboratory. National Institute of Standards and Technology. Проверено 7 февраля 2017.
- ↑ 5B+4,5h3 → B5H9, Δh398∘=+62,8 kJ{\displaystyle {\mathsf {5B+4{,}5H_{2}\ {\xrightarrow {}}\ B_{5}H_{9}}},~\Delta H_{298}^{\circ }=+62{,}8~\mathrm {kJ} }
Когда теплота реакции записывается так, как это сделано в данном уравнении, подразумевается, что она выражена в килоджоулях на стехиометрическую единицу («моль») реакции по записанному уравнению. В рассматриваемом случае теплота реакции равна 62,8 кДж на моль (+62,8 кДж · моль−1) B5H9 (газообразного), но составляет только 12,56 кДж на моль израсходованного бора (твёрдого кристаллического) или 62,8 кДж на каждые 4,5 моля газообразного водорода. Теплоты реакций всегда табулируются в расчете на моль образующегося соединения.
wiki2.red
Тема 14. Количество вещества. Молярная масса.
Часть I
1. Единицей количества вещества является моль. Обозначается n или ню.
2. Моль — это также количество вещества, в котором содержится молекул или частиц вещества. Это число называется числом Авогадро и обозначается Nа.
3. Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mr или Ar.
4. Масса 1 моль вещества называется молярной массой — M. Она измеряется в г/моль и численно равна Mr вещества.
5. Количество вещества — это величина, равная отношению массы вещества к его молярной массе:
n = m/M => m = n• M.
6. Число частиц вещества равно произведению числа Авогадро на количество вещества:
N = n •Na => n = N/Na.
7. Дополните таблицу, делая необходимые вычисления.
Часть II
1. Впишите пропущенные числа.
1) Ar(Na)=23 => 23 г натрия содержат атомов Na.
2) Мг(02)=32 => 32 г кислорода содержат молекул 02.
3) Мг (СО) = 28 => 28 г угарного газа содержат молекул СО.
2. Установите соответствие между названием величины и её условным обозначением.
3. Впишите пропущенные названия веществ, частиц вещества, числа и единицы измерения.
1) 1 моль вещества Н2 содержит молекул.
2) молекул углекислого газа С02 составляют количество вещества, равное 0,5 моль.
3) 64 г вещества О2 составляют количество вещества, равное 2 моль.
4) 0,5 моль серной кислоты H2S04 составляют массу вещества, равную 49 г.
4. Запишите формулу, по которой можно рассчитать молярную массу вещества, если известно его количество и масса.
М = m•N
5. Запишите формулу, по которой можно рассчитать массу вещества, если известно число структурных частиц данного вещества.
m = N•M/Na
6. Какие величины можно рассчитать, если известно количество вещества?
Массу, число частиц.
7. Сколько молекул содержится в 180 г воды? Решите задачу двумя способами.
8. Придумайте условие задачи, используя величины из задания 2. Найти массу воды химическим количеством 10 моль. Решите её любым способом.
superhimik.ru
Количество вещества. Моль
Проведем химическую реакцию, протекающую при взаимодействии алюминия с йодом: 2Аl + 3I2 = 2АlI3.
Из уравнения реакции следует, что
1) алюминий и йод реагируют между собой, образуя новое вещество – йодид алюминия;
2) в реакцию вступают атомы алюминия и молекулы йода;
3) отношение числа вступивших в реакцию формульных единиц (в данном случае — атомов) алюминия к числу вступивших в реакцию молекул йода равно 2 к 3, то есть
N(Al) : N(I2) = 2 : 3.
Если для проведения реакции мы возьмем, например, 1.1020 атомов алюминия, то, для того, чтобы все они прореагировали, потребуется 1,5.1020 молекул йода. И наоборот, если у нас есть 90000 молекул йода, то в этом случае, чтобы все они прореагировали, нужно взять 60000 атомов алюминия. Если мы возьмем исходные вещества в другом соотношении, то одно из них останется непрореагировавшим. В таком случае говорят, что это вещество было взято в избытке.
Как отмерять взятые для реакции вещества, чтобы они прореагировали без остатка?
Очевидно, что отмерять вещества следует по числу атомов, молекул (для молекулярных веществ) или формульных единиц (для немолекулярных веществ). Обобщенно атомы, молекулы (реальные частицы), формульные единицы (выделенные нами » частицы» ) и другие составные части вещества называют структурными элементами. Число таких структурных элементов в порции вещества является физической величиной, называемой количество вещества. В нашем случае роль структурных элементов выполняют частицы – атомы алюминия и молекулы йода.
|
Количество вещества – физическая величина, равная числу структурных элементов, составляющих систему. |
Роль систем в нашем случае выполняют порции реагирующих веществ – алюминия и йода.
Количество вещества как физическая величина обычно характеризует только такие системы, структурные элементы которых в той или иной степени одинаковые. Примеры таких структурных элементов: атомы одного химического элемента, молекулы или формульные единицы одного вещества, а также заведомо неразличимые частицы – электроны, протоны, нейтроны и другие подобные им микрочастицы.
Обозначается количество вещества латинской буквой n, а если эта буква уже » занята» , то греческой буквой ν .
Количество вещества – одна из основных физических величин, поэтому ее единица измерений выбирается произвольно – только из соображений удобства.
Что же удобно выбрать за единицу измерений этой величины? Естественно, штуку. Но поштучно пересчитать молекулы в химической практике невозможно, зато вещество можно взвесить, то есть определить его массу. Следовательно, за единицу измерений количества вещества следует принять порцию из определенного и всегда одинакового числа частиц, достаточно большую, чтобы ее легко можно было взвесить на обычных весах.
Такая единица измерений получила название моль, а величина, показывающая массу одного моля вещества – молярная масса. Молярная масса вещества Б обозначается МБ, или М(Б). Таким образом, единица измерений количества вещества [n] = 1 моль, а единица измерений молярной массы [МБ] = 1 г/моль.
Физическая величина, показывающая, сколько частиц содержится в одном моле вещества, называется постоянной Авогадро и обозначается NA. Единица измерений этой величины – » штуки в моле» , но, так как физики штуку единицей измерений не считают, то получается
[NA] = , или [NA] = моль– 1.
Значение постоянной Авогадро выбрано таким образом, чтобы числовое значение молярной массы любого вещества было равно числовому значению молекулярной массы, то есть
{M(Б)} = {Mr(Б)}
NA = 6,02.1023 моль– 1
Числовое значение постоянной Авогадро {NA} называется числом Авогадро.
Таким образом
|
Моль – порция из {NA} частиц. |
В Международной системе единиц определение моля формулируется несколько иначе.
|
Моль – единица измерений количества вещества, равная количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 12 граммах углерода-12. |
Но так как в 12 г углерода-12 содержится {NA} штук атомов углерода, оба эти определения не противоречат друг другу.
Применяются кратные и дольные единицы, производные от моля: 1 кмоль = 1000 моль, 1 ммоль = 0,001 моль и так далее.
Слово » моль» как обозначение единицы измерений не склоняется (5 моль; 0,25 моль), а в качестве названия единицы измерений (в тексте и устной речи) склоняется как существительное мужского рода (четверть моля, пятью молями, двух молей и тому подобное).
Число частиц в моле вещества (число Авогадро) очень велико, поэтому количество макрообъектов в молях обычно не измеряют, ведь даже звезд в Метагалактике всего лишь порядка одного моля.
Теперь запишем формально не строгое, но понятное определение количества вещества:
|
Количество вещества – то же, что и число частиц, но измеряется не в штуках, а в молях (то есть, порциями по 6,02.1023 штук). |
|
Алюминий – Al – легкий пластичный металл. Как и все металлы – немолекулярное вещество. Алюминий сравнительно дешев и широко используется. Самая близкая любому человеку область его применения – многочисленные бытовые предметы: от кастрюль до фольги. Из измельченного до состояния пудры алюминия изготавливают » серебряную» краску. В некоторых странах, например в Венгрии, из алюминиевых сплавов делают монеты. Крупнейшими потребителями алюминия являются авиационная промышленность, машиностроение и строительство, не говоря уже о том, что большая часть электрических проводов (от линий электропередач до проводов в вашей квартире) делается из алюминия. Но так было не всегда. В течение некоторого времени после открытия (середина XIX века), алюминий был очень дорогим металлом, т. к. способы получения чистого алюминия были в то время слишком сложны. В те годы алюминиевые столовые приборы считались предметом роскоши.Йод – I2. В быту с йодом в чистом виде вам сталкиваться не приходится. Это черно-фиолетовые кристаллы с металлическим блеском, очень мало растворимые в воде, зато хорошо растворимые в спирте. Именно спиртовой раствор йода, используемый в медицине, в быту и называют просто » йодом» . Йод извлекают из морской воды, его накапливают некоторые морские водоросли. В микроколичествах это вещество необходимо человеку для правильного функционирования щитовидной и паращитовидной желез. Он используется в медицине и быту как дезинфицирующее средство. Йод и его пары ядовиты. Пары йода раздражают слизистые оболочки, поэтому при частом воздействии возможны воспаления слизистых и кожные дерматиты. |
ЧИСЛО ЧАСТИЦ, КОЛИЧЕСТВО ВЕЩЕСТВА, МОЛЬ, СТРУКТУРНЫЙ ЭЛЕМЕНТ, ИЗБЫТОК ВЕЩЕСТВА В РЕАКЦИИ.
1.Используя округленные значения атомных масс элементов, определите молярные массы следующих веществ: O2, O3, Cl2, HCl, CO2, H3PO4, NaCl, Ba(OH)2, Fe2(SO4)3, Ca3(PO4)2.
2.Сколько молекул содержится в а) 1 г водорода H2, б) 1 г кислорода O2, в) 76,8 кг серы S8, г) 9,8 мг серной кислоты H2SO4? 3.Определите массу а) 6,02.1022 атомов железа; б) 2,107.1025 молекул диоксида углерода СО2; в) 9,03.1022 формульных единиц CuSO4; г) 1,204.1024 электронов.
4.Каково количество вещества атомов кислорода в 3,5 моль газообразного кислорода?
5.Каково количество вещества атомов а) кальция, б) фосфора, в) кислорода в 1,5 моль Са3(РО4)2?
6.Определите массу водорода, содержащегося в 3,01.1024 молекул метана СН4.
7.Определите количество вещества атомов хлора, содержащегося в 1,204.1023 молекул пентахлорида фосфора PCl5.
znaew.ru
