МОЛЬ ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА В КОТОРОМ
 МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙ 1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА.
МОЛЬ – ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ 6 ∙ 1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА.
 N = NA∙ n , где N – число молекул NA – постоянная Авогадро, молек. /моль n – количество вещества, моль Следовательно, n = N / NA и NA = N / n
N = NA∙ n , где N – число молекул NA – постоянная Авогадро, молек. /моль n – количество вещества, моль Следовательно, n = N / NA и NA = N / n
 МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль.
МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль.
 1 моль Fe весит 56 г М(Fe) = 56 г/моль 1 моль S весит 32 г M(S) = 32 г/моль 1 моль Na Cl весит 59 г M(Na. Cl) = 59 г/моль 1 моль Cu. SO 4 весит 160 г M(Cu. SO 4) = 160 г/моль
1 моль Fe весит 56 г М(Fe) = 56 г/моль 1 моль S весит 32 г M(S) = 32 г/моль 1 моль Na Cl весит 59 г M(Na. Cl) = 59 г/моль 1 моль Cu. SO 4 весит 160 г M(Cu. SO 4) = 160 г/моль
 n=m/M и, следовательно, m = n ∙M и M = m/n
n=m/M и, следовательно, m = n ∙M и M = m/n
 Задача 1. Найти массу 24 ∙ 1023 молекул озона. Задача 2. Сколько молекул содержится в 111 г гидроксида кальция Ca(OH)2?
Задача 1. Найти массу 24 ∙ 1023 молекул озона. Задача 2. Сколько молекул содержится в 111 г гидроксида кальция Ca(OH)2?
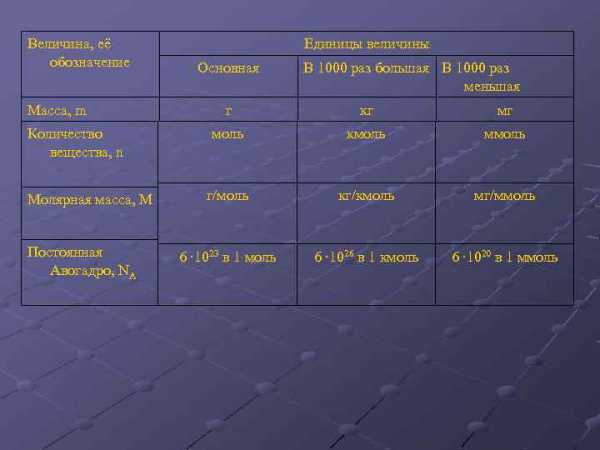 Величина, её обозначение Масса, m Количество вещества, n Молярная масса, М Постоянная Авогадро, NA Единицы величины Основная В 1000 раз большая В 1000 раз меньшая г кг мг моль кмоль ммоль г/моль кг/кмоль мг/ммоль 6 ∙ 1023 в 1 моль 6 ∙ 1026 в 1 кмоль 6 ∙ 1020 в 1 ммоль
Величина, её обозначение Масса, m Количество вещества, n Молярная масса, М Постоянная Авогадро, NA Единицы величины Основная В 1000 раз большая В 1000 раз меньшая г кг мг моль кмоль ммоль г/моль кг/кмоль мг/ммоль 6 ∙ 1023 в 1 моль 6 ∙ 1026 в 1 кмоль 6 ∙ 1020 в 1 ммоль
 1. Сколько молекул кислорода содержится в 2 моль его? Какую массу будет иметь это количество кислорода? 2. Какую массу имеют 5 кмоль водорода? Сколько молекул водорода содержится в этом его количестве? 3. Сколько весят 3∙ 1020 молекул воды?
1. Сколько молекул кислорода содержится в 2 моль его? Какую массу будет иметь это количество кислорода? 2. Какую массу имеют 5 кмоль водорода? Сколько молекул водорода содержится в этом его количестве? 3. Сколько весят 3∙ 1020 молекул воды?
present5.com
Количество вещества, моль, страница 1
Количество вещества, моль
Известно, что для изучения окружающего мира недостаточно лишь наблюдать и описывать объекты. Важно еще характеризовать их количественно, т.е. какими величинами. Порцию воды, например, можно характеризовать количественно, измерив ее объем в литрах или массу в граммах. Но для химика наряду с этим важно еще знать число структурных частиц (атомов, молекул или ионов), которые содержатся в этой порции вещества, поскольку именно они будут вступать в химическое взаимодействие. Вот почему в химии и смежных с ней науках используют физическую величину — количество вещества.
Количество веществ — это физическое величина, определяемая числом структурных частиц (атомов, молекул, ионов и др.), содержащихся в данной порции вещества.
Моль — единица количества вещества (в СИ). Она обозначается латинской буквой п (ен) или греческом V (ню), поскольку буквой п (ен) сказывается также и число атомов. За единицу количества вещества принято моль.
Количество вещества можно измерять не только в молях. Единица количества вещества, которое в 1000 раз больше моль, называется киломоль — кмоль (1 кмоль содержит 1000 моль), а единица количества вещества, которое в 1000 раз меньше моль, называется миллимоль — ммоль (1 моль содержит 1000 ммоль).
Моль — это такое количество вещества, которое содержит столько частиц (атомов, молекул, ионов и др.)., Сколько содержится атомов в Карбоне массой 0,012 кг (12 г). Следовательно, масса 1 моль углерода равна 12 г. А сколько в этой порции углерода количеством вещества 1 моль содержится атомов углерода?
Число Авогадро 6,02-1023 показывает число частиц, содержащихся в 1 моль любого вещества независимо от ее агрегатного состояния. Если бы мы смогли измерить всю воду Мирового океана стаканами, то получили бы почти 7 — 1014 стаканов. Хотя это число само по себе огромное, но оно составляет всего одну миллиардную часть постоянной Авогадро!
Другой пример. Число маковых зернышек, равной 6 • 1023, имеет массу 1013 т. Этой массой маковых зернышек можно было бы покрыть всю поверхность Земли слоем в 1 м. Еще пример. Пустыня Сахара содержит менее трех моль мельчайших песчинок.
Следовательно, 1 моль любого вещества содержит NA частиц, то есть 6 • 1023. Например, 1 моль меди — это 6 • 1023 атомов Ку-пруму Cu; 1 моль кислорода — 6 • 1023 молекул 02 или 12 • 1023 атомов кислорода; 1 моль поваренной соли NaCl — 6 • 1023 формульных единиц NaCl.
ВЫВОДЫ
Количество вещества — это физическая величина, определяемая числом структурных частиц, содержащихся в данной порции вещества.
Моль — это единица количества вещества.
Один моль любого вещества содержит 6,02 • 1023 структурных частиц (формульных единиц).
Другие статьи из раздела
Углеводы. Свойства и функции углеводов
Углеводы — главным образом, природные вещества, большая часть которых имеет состав, отвечающий формуле Cm(Н2О)n, где m, n > 3, отсюда и название. Некоторые углеводы, в том числе обычный сахар (сахароза), сладкие на вкус, поэтому второе их название — сахара. Углеводы делятся на моно-, ди- и полисахариды. Ди- и полисахариды при полном гидролизе дают моносахариды, которые уже далее не гидролизуются. Моносахариды. Моносахариды — …
Независимый директор «ФосАгро» Джеймс Роджерс приобрел 2000 ГДР компании
«Газпром нефть» стала официальным партнером Jaguar Land Rover Россия
himkniga.com
Количество вещества — это… Что такое Количество вещества?
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
Применение
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях. Фактическое количество единиц вещества в 1 моле называется числом Авогадро (N A = 6,022 141 79(30)·1023 моль−1) (правильнее — постоянная Авогадро, так как в отличие от числа эта величина имеет единицы измерения).
Количество вещества обозначается латинской n (эн) и не рекомендуется обозначать греческой буквой (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов. Однако в школьном курсе широко используется именно греческая буква (ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: , где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: = V / Vm, где V — объём газа (при нормальных условиях), Vm — молярный объём газа при Н. У., равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
| В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |
dal.academic.ru
Количество вещества — это… Что такое Количество вещества?
Количество вещества
— физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.Применение
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях. Фактическое количество единиц вещества в 1 моле называется числом Авогадро (NA = 6,022 141 79(30)·1023 моль−1) (правильнее — постоянная Авогадро, так как в отличие от числа эта величина имеет единицы измерения).
Количество вещества обозначается латинской n (эн) и не рекомендуется обозначать греческой буквой (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов. Однако в школьном курсе широко используется именно греческая буква (ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: , где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: = V / Vm, где V — объём газа (при нормальных условиях), Vm — молярный объём газа при Н. У., равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
| В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |
dik.academic.ru
Количество вещества — Традиция
Материал из свободной русской энциклопедии «Традиция»
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ (система единиц) — моль.
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют не зависимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода. Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их меряют в молях. Фактическое количество единиц вещества в 1 моле называется число Авогадро (Na = 6,022 141 79(30)×1023 моль-1).
Количество вещества обозначается греческой буквой \(\nu\)(ню) или, упрощённо, латинской n (эн). Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: \(\nu = m / M\) где m — масса вещества, M — молярная масса вещества. Молярная масса — это суммарная масса одного моля молекул данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: \(\nu\) = V / Vm — где V — объём газа (при нормальных условиях), Vm — молярный объём газа при Н. У., равный 22.4 л/моль.
br:Kementad danvez eo:Materikvanto hu:Anyagmennyiség lv:Vielas daudzums nn:Stoffmengd
traditio.wiki
Количество вещества — это… Что такое Количество вещества?
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
Применение
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях. Фактическое количество единиц вещества в 1 моле называется числом Авогадро (NA = 6,022 141 79(30)·1023 моль−1) (правильнее — постоянная Авогадро, так как в отличие от числа эта величина имеет единицы измерения).
Количество вещества обозначается латинской n (эн) и не рекомендуется обозначать греческой буквой (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов. Однако в школьном курсе широко используется именно греческая буква (ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: , где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: = V / Vm, где V — объём газа (при нормальных условиях), Vm — молярный объём газа при Н. У., равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
| В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 13 мая 2011. |
xzsad.academic.ru
Количество вещества — Википедия РУ
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул в единицах «штука», их измеряют в молях. Фактическое количество единиц «штука» в 1 моле вещества называется числом Авогадро (NA = 6,022140857(74)·1023 «штука»/моль[3]).
Количество вещества обозначается латинской n{\displaystyle n} (эн) и не рекомендуется обозначать греческой буквой ν{\displaystyle \nu } (ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов[4]. Однако в школьном курсе широко используется именно греческая буква ν{\displaystyle \nu } (ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: n=m/M{\displaystyle n=m/M} , где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро, количество газообразного вещества можно также определить на основании его объёма: n{\displaystyle n} = V / Vm, где V — объём газа при нормальных условиях, а Vm — молярный объём газа при тех же условиях, равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
- n=mM=NNA=VVm{\displaystyle n={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m}}}}
http-wikipediya.ru
