Готовимся к углубленному изучению химии : 5.7 Гидролиз солей
5.7. Гидролиз солей Гидролиз солей — это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.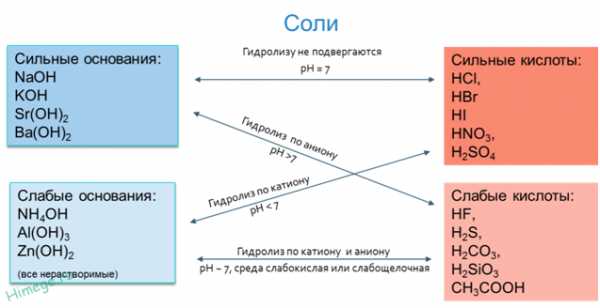 Гидролиз – процесс обратимый для
большинства солей. В состоянии равновесия только небольшая часть ионов соли
гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h).
Степень гидролиза равна отношению
числа гидролизованных молекул соли к общему числу растворенных молекул:
где n – число молекул соли,
подвергшихся гидролизу; N – общее число
растворенных молекул соли.
Если рассматривать соль как продукт
нейтрализации основания кислотой, то можно разделить соли на четыре группы, для
каждой из которых гидролиз будет протекать по-своему.
Гидролиз – процесс обратимый для
большинства солей. В состоянии равновесия только небольшая часть ионов соли
гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h).
Степень гидролиза равна отношению
числа гидролизованных молекул соли к общему числу растворенных молекул:
где n – число молекул соли,
подвергшихся гидролизу; N – общее число
растворенных молекул соли.
Если рассматривать соль как продукт
нейтрализации основания кислотой, то можно разделить соли на четыре группы, для
каждой из которых гидролиз будет протекать по-своему.
 1). Гидролиз не
возможен
Соль, образованная
сильным основанием и сильной кислотой (KBr, NaCl, NaNO
1). Гидролиз не
возможен
Соль, образованная
сильным основанием и сильной кислотой (KBr, NaCl, NaNOFe2+ + 2Cl— + H+ + OH— <=> FeOH+ + 2Cl— + Н+ В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 (раствор приобретает кислую реакцию). 3). Гидролиз по аниону (в реакцию с водой вступает только анион) Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3 , Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН— и другие ионы. K2SiO3 + НОH <=>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH—<=> НSiO3— + 2K+ + ОН— рН таких растворов > 7 (раствор приобретает щелочную реакцию). 4). Совместный гидролиз (в реакцию с водой вступает и катион и анион) Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Al
| Ход рассуждений | |||||
1. Определяем силу
электролита – основания и кислоты, которыми образована рассматриваемая соль.
Помните! Гидролиз
всегда протекает по слабому электролиту, сильный электролит находится в
растворе в виде ионов, которые не связываются водой.
|
Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3) | ||||
| 2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли: |
2Na+ + CO32- |
||||
| 3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды | 2Na+ + CO32- + H+OH— ↔ (HCO3)— + 2Na+ + OH— В продуктах реакции присутствуют ионы ОН—, следовательно, среда щелочная pH>7 | ||||
| 4. Записываем молекулярное гидролиза | Na2CO3 + HOH ↔ NaHCO3 + NaOH |
NaCl, KI, Rb2SO4, Ba(ClO4)2, K2CO3, KCN, K2SO3, FeCl3, NH4Cl, CuCl2, (NH4)2CO3.
Решение:
Гидролиз по катиону не идет, если катион образует сильное основание (щелочь).
Это: щелочные, щелочноземельные металлы, серебро.
Li+, Na+, K+, Rb+, Cs+, Ca2+, Sr2+, Ba2+, Ag+.
Гидролиз по аниону не идет, если анион —
кислотный остаток сильной кислоты.
Это: галогеноводороды (кроме HF), серная,
азотная, хлорная кислоты.
HCl, HBr, HI, H2SO4, HNO3,
HClO4.
Отсюда:
1. Соли NaCl, KI, Rb2
2. Соли K2CO3, KCN, K2SO3, образованы сильным основанием и слабыми кислотами. Гидролиз по аниону.
3. Соли FeCl3, NH4Cl, CuCl2, образованы слабым (малорастворимым) основанием и сильной кислотой. Гидролиз по катиону.
4. (NH4)2CO3. Образован слабым основанием и слабой кислотой. Гидролиз по катиону и аниону. _____________________________________________________________ 2. Установите соответствие между названием соли и отношением ее к гидролизу.
|
ФОРМУЛА
СОЛИ А) (Nh5)2CO3 Б) Nh5Cl В) Na2CO3 Г) NaNO2 |
ТИП
ГИДРОЛИЗА 1)по катиону 2) по аниону 3)по катиону и аниону |
Уравнения гидролиза соли по второй ступени (гидролиз протекает в меньшей степени):
В растворе появляется избыток ионов ОН—, среда щелочная, pH>7. _____________________________________________________________
Na2SiO3 , AlCl3, K2S. 2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III) 3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ:
Сульфид Калия — K2S, Бромид алюминия — AlBr3, Хлорид лития – LiCl, Фосфат натрия — Na3PO4, Сульфат калия — K2SO4, Хлорид цинка — ZnCl2, Сульфит натрия — Na2SO3, Cульфат аммония — (NH4)2SO4, Бромид бария — BaBr2 . 4. Установить соответствие между названием соли и типом гидролиза её в водном растворе
| Название соли | Тип гидролиза |
| 1) Нитрат меди (II) | |
| 2) Карбонат аммония | |
| 3) Хлорид железа (II) | В) по катиону и аниону |
| 4) Силикат калия |
9. Составьте молекулярные и ионные уравнения гидролиза солей
. Растворы каких солей имеют рН< 7.10. Составьте молекулярные и ионные уравнения гидролиза солей
Какова значение рН (больше или меньше 7) в растворах каждой из этих солей. В растворах каких солей лакмус имеет синий цвет?
ВИДЕО ОПЫТ
| 1. Между какими ионами в водном растворе нет химического взаимодействия: | |
| а) все ответы верны | б) CO32- и H+ |
| 2. Какие уравнения реакций, схемы которых приведены ниже, описываются одинаковым сокращенным ионным уравнением: | |
| 3. Какое сокращенное ионное уравнение отвечает взаимодействию водных растворов гидрокарбоната калия и гидрокарбоната калия: | |
| а)CO32- + 2H+ → H2O + CO2 | б) HCO3— + OH— → CO32- + H2O |
| г)KHCO3 + OH— → K+ + CO32- +H2O | |
| 4. Какие пары ионов, формулы которых приведены ниже, можно использовать при составлении молекулярных уравнений, которым отвечает сокращенное ионное СО32- + 2Н+ → Н2О + СО2: | |
| 5. В какой реакции из приведенных ниже ионных схем выделяется газ: | |
| в) НСО3— + ОН— → | г) Са2+ + СО32- → |
| 6. Каким реактивом можно различить растворы карбоната калия и хлорида калия: | |
| 7. Нейтрализация какой кислоты и основания отражается сокращенным ионным уравнением Ме(ОН)х + хН+ → Мех+ + хН2О: | |
| а) сильная кислота и сильное основание | б) слабая кислота и сильное основание |
| в) слабое основание и сильная кислота | г) оба электролита слабые |
| 8. С каким веществом сульфид калия реагирует согласно сокращенному ионному уравнению S2- + Cu2+ → CuS↓: | |
| 9. Взаимодействие каких веществ описывается сокращенным ионным уравнением СО32- + 2Н+ → Н2О+ СО2: | |
| а) BaCO3 и CH3COOH | |
| в) (NH4)2CO3 и HNO3 | г) NaHCO3 и H2SO4 |
| 10. В водных растворах каких солей лакмус красный: | |
Ответы:
himiy88.blogspot.com
4.4. Гидролиз
Гидролиз– процесс разложения химических соединений в результате реакции с водой. Гидролиз соли – это реакция, обратная процессу образования соли путем нейтрализации кислоты основанием:
нейтрализация
НА + МОНМА + Н2О.
кислота основание гидролиз соль вода
Гидролизуются только соли, содержащие в своем составе ионы слабых электролитов: слабой кислоты или слабого основания.
Правила составления уравнений гидролиза следующие:
1. Записывают уравнение диссоциации соли.
2. Определяют ион слабого электролита, который может гидролизоваться. Ионов сильных кислот и оснований сравнительно немного, наиболее распространенные следует запомнить: анионы NO3,SO4,Cl,Br,I,ClO4, катионыNa+,K+и других щелочныхметаллов, а также Ba2+ и Sr2+. Перечисленные ионы не гидролизуются! Все остальные ионы, за редким исключением, образуют слабые электролиты и гидролизуются.
3. Составляют ионное уравнение гидролиза по схеме:
ион слабого электролита + вода слабый электролит + ион,
оставшийся от молекулы воды.
4. Записывают молекулярное уравнение гидролиза, добавляя к ионам противоионы.
В зависимости от состава соли различают следующие типы гидролиза:
Гидролиз соли, образованной сильным основанием и слабой кислотой.Гидролизуется анион слабой кислоты.
А+ Н2ОНА + ОН. (4.19)
В растворе появляются ионы ОН, поэтому среда – щелочная, рН > 7.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания.
М++ Н2ОМОН + Н+.
В растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону
М++ А+ Н2О → МОН + НА.
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Количественные характеристики гидролизаконстанта и степень гидролиза. В большинстве случаев константа гидролизаKh не превышает 10–3и гидролиз солей, образованных одним слабым электролитом, протекает в малой степени. Гидролиз многозарядных ионов в основном проходит по первой ступени. От значения константы гидролиза зависит рН раствора соли.
Степенью гидролиза (аналогично степени диссоциации) называют отношение числа гидролизованных ионов к общему числу ионов слабого электролита в растворе.
Вычисление количественных характеристик гидролиза производится в зависимости от того, как образована соль:
Соль образована одним слабым электролитом. Константа гидролиза
, (4.20)
где Kh1– константа гидролиза по первой ступени,Kw– ионное произведение воды, при 298 KKW = 1014;Kdn– константа диссоциации продукта гидролиза.
Константы диссоциации гидроксокомплексов металлов называют ступенчатыми константами нестойкости, их значения даны в справочнике в таблице констант нестойкости гидроксокомплексов (прил.2).
Степень гидролиза связана с константой гидролиза уравнением
,
где С– концентрация гидролизующегося иона, моль/кг.
В растворах солей, гидролизующихся по аниону, среда щелочная (см. уравнение (67)) и расчет рН ведут по формуле:
.
В растворах солей, гидролизующихся по катиону, среда кислая, согласно уравнению (4.19), и расчет рН ведут по формуле
.
Соль образована двумя слабыми электролитами. Константа гидролиза
, (4.21)
где KосниKк– константы диссоциации основания и кислоты, образующих соль. Формула (4.21) служит для расчета константы гидролиза по табличным значениям констант диссоциации.
Степень гидролиза
.
Отношение концентраций ионов Н+и ОНв растворе соли определяется относительной силой кислоты и основания:
где KкиKосн– константы диссоциации слабых кислоты и основания, которыми образована соль.
Таким образом, при 298 К (KW= 1014):

или
.
Константа и степень гидролиза у соли, образованной двумя слабыми электролитами, значительно выше, чем у солей, образованных одним слабым электролитом.
Пример 17.составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Решение. Напишем уравнение диссоциации соли:FeSO4Fe2++SO42. Определим сильный и слабый электролиты. ИонуFe2+соответствует слабое основаниеFe(OH)2, ионуSO42– сильная кислотаH2SO4. Следовательно, гидролиз идет по катиону.
Составим ионное уравнение гидролиза (по первой ступени): Fe2++HOHFeOH++H+. В ходе гидролиза образуются ионыH+, среда кислая.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
2 FeSO4 + 2H2O (FeOH)2SO4 + H2SO4.
Пример 18.составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. Напишем уравнение диссоциации соли:K2CO3K++CO32. Определим сильный и слабый электролиты. ИонуK+соответствует сильное основаниеKOH, ионуCO32– слабая кислотаH2CO3. Следовательно, гидролиз идет по аниону.
Составим ионное уравнение гидролиза (по первой ступени): CO32+HOHHCO3+OH. В ходе гидролиза образуются ионыOH, среда в растворе щелочная.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
K2CO3 + H2O KHCO3 + KOH.
Пример 19.составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония.
Решение. Напишем уравнение диссоциации соли: NH4NO2 NH4++NO2. Определим сильный и слабый электролит. ИонуNH4+соответствует слабое основаниеNH4OH, ионуNO2– слабая кислотаHNO2. Следовательно, гидролиз идет как по катиону, так и по аниону. Составим ионное уравнение гидролиза:
NH4+ + NO2 + HOH NH4OH + HNO2.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
NH4NO2 + H2O NH4OH + HNO2.
Пример 20.Вычислить рН раствора сульфата аммония концентрацией 0,1 моль/л.
Решение. Составим ионное уравнение гидролиза:NH4++H2ONH4OH+H+. Значение константы диссоциации гидроксида аммонияKd= 1,76105. Вычислим константу гидролиза
Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO42NH4++SO42,
Вычислим концентрацию ионов
и
рН = –lg[H+] = –lg(1,066105) = 4,97.
Пример 21.вычислить степень гидролиза карбоната натрия в растворе с рН = 12.
Решение. Составим ионное уравнение гидролиза: CO32 + + H2O HCO3 + OH. Вторая константа диссоциации угольной кислоты Kd2 = 4,691011. Первая константа гидролиза по уравнению (4.20)
Из формулы найдем концентрацию карбонат-иона
,
где [OH] = 10pOH= 10(14-12)= 102.
Вычислим степень гидролиза
Задание XII. Составить молекулярные и ионные уравнения гидролиза, указать характер среды.
|
544. (NH4)2S 545. (NH4)2SO3 546. (NH4)3PO4 547. (ZnOH)2SO4 548. Al(NO3)3 549. Al2(SO4)3 550. Al2S3 551. AlCl3 552. Be(NO3)2 553. Ca(NO3)2 554. CdCl2 555. CH3COONH4 556. CoCl2 557. Cr(NO3)3 558. Cr2(SO4)3 559. CrCl3 560. Cs2SO4 561. CsF 562. CuSO4 563. Fe2(SO4)3 564. FeCl3 565. FeBr3 566. Ga(NO3)3 |
567. HCOOK 568. HCOONH4 569. K2SiO3 570. K2SO3 571. K3AsO4 572. KClO4 573. KCN 574. KH2AsO4 575. KHCO3 576. KMnO4 577. LiCN 578. MgCl2 579. MgSO4 580. MnCl2 581. Na2CO3 582. Na2HAsO4 583. Na2S 584. Na2SiO3 585. Na2WO4 586. Na3PO4 587. NaAlO2 588. NaCl 589. NaClO4 |
590. NaCN 591. NaH2PO4 592. NaHCO3 593. NaI 594. NaNO2 595. NH4Cl 596. NH4CNS 597. NH4HCO3 598. NH4NO2 599. NiSO4 600. Pb(CH3COO)2 601. Pb(NO3)2 602. PtCl4 603. Rb2S 604. Rb3PO4 605. Rb3SbO4 606. SbCl3 607. SnCl2 608. SnBr2 609. SnSO4 610. SrSO3 611. Zn(CH3COO)2 612. ZnBr2 |
Задание XIII. Написать в молекулярном и ионном виде реакции взаимоусиления гидролиза
613. Ацетат меди + сульфит лития.
614. Ацетат свинца + карбонат натрия.
615. Ацетат цинка + сульфит натрия.
616. Нитрат алюминия + карбонат натрия.
617. Нитрат висмута + сульфид калия.
618. Нитрат железа (III) + сульфид рубидия.
619. Нитрат свинца + карбонат стронция.
620. Нитрат серебра + карбонат натрия.
621. Нитрат хрома (III) + сульфид калия.
622. Сульфат алюминия + сульфид натрия.
623. Сульфат бария + сульфит цезия.
624. Сульфат кобальта + карбонат калия.
625. Сульфат олова + карбонат цезия.
626. Формиат алюминия + карбонат натрия.
627. Формиат меди + сульфит лития.
628. Формиат цинка + сульфид лития.
629. Фторид алюминия + карбонат калия.
630. Хлорид железа (II) + сульфид натрия.
631. Хлорид магния + сульфит рубидия.
632. Хлорид марганца + сульфит натрия.
633. Хлорид никеля + карбонат цезия.
Задание XIV. Найти неизвестные величины в предложенных задачах, дополнив табл.4.8.
Таблица 4.8
|
Номер задачи |
Электролит |
Концентрация раствора |
рН |
|
Плотность раствора, г/см3 |
|
634 |
Na2SO3 |
0,008 М |
? |
? |
— |
|
635 |
Pb(NO3)2 |
? |
5,25 |
? |
— |
|
636 |
Na2CO3 |
0,006 н. |
? |
? |
— |
|
637 |
Na2C2O4 |
0,02 М |
? |
? |
— |
|
638 |
Na3PO4 |
0,02 М |
? |
? |
— |
|
639 |
C6H5ONa |
? |
? |
5 % |
— |
|
640 |
Na2S |
0,03 М |
? |
? |
— |
|
641 |
(NH4)2SO4 |
? |
5,48 |
? |
— |
|
642 |
NaNO2 |
0,02 н. |
? |
? |
— |
|
643 |
K2C2O4 |
0,008 М |
? |
? |
— |
|
644 |
C6H5OK |
? |
? |
0,02 % |
— |
|
645 |
K2HPO4 |
? |
7,5 |
? |
— |
|
646 |
[NH3OН]Cl |
? |
5,5 |
? |
— |
|
647 |
Na2S |
0,01 М |
? |
? |
— |
|
648 |
ZnSO4 |
2 % |
? |
? |
1,019 |
|
649 |
Na2CO3 |
? |
11,2 |
? |
— |
|
650 |
(CH3COO)2Ba |
0,005 М |
? |
? |
— |
Окончание табл.4.8
|
Номер задачи |
Электролит |
Концентрация раствора |
рН |
|
Плотность раствора, г/см3 |
|
651 |
Na3PO4 |
0,03 н. |
? |
? |
— |
|
652 |
CdSO4 |
3 % |
? |
? |
1,028 |
|
653 |
KCN |
0,02 М |
? |
? |
— |
|
654 |
CuSO4 |
0,1 М |
? |
? |
— |
|
655 |
ZnCl2 |
? |
5,84 |
? |
— |
|
656 |
Na2C2O4 |
0,02 М |
? |
? |
— |
|
657 |
K2HPO4 |
0,03 М |
? |
? |
— |
|
658 |
HCOONa |
0,02 М |
? |
? |
— |
|
659 |
Na2CO3 |
? |
? |
0,5 % |
— |
|
660 |
CdSO4 |
? |
5,6 |
? |
— |
|
661 |
NaBO2 |
1 г/л |
? |
? |
— |
|
662 |
NaNO2 |
5 % |
? |
? |
1,01 |
|
663 |
NH4Cl |
? |
5,48 |
? |
— |
|
664 |
ZnCl2 |
2 % |
? |
? |
1,016 |
|
665 |
CH3COONa |
0,01 М |
? |
? |
— |
|
666 |
HCOONa |
1 % |
? |
? |
1,03 |
|
667 |
NH4Cl |
% |
5,63 |
? |
1,02 |
|
668 |
KCN |
0,002 н. |
? |
? |
— |
|
669 |
C6H5OK |
0,2 М |
? |
? |
— |
|
670 |
HCOOK |
1 мол. % |
? |
? |
1,02 |
|
671 |
CH3COONa |
? |
8,72 |
? |
— |
|
672 |
NH4Cl |
? |
5,41 |
? |
— |
|
673 |
C6H5ONa |
? |
? |
5,6 % |
— |
|
674 |
HCOONa |
0,01 н. |
? |
? |
— |
|
675 |
NH4CN |
? |
9,175 |
? |
— |
|
676 |
CH3COONH4 |
? |
? |
0,563 % |
— |
|
677 |
CrCl3 |
2 % |
? |
? |
1,014 |
|
678 |
Na2Se |
11,36 % |
? |
? |
1,1 |
|
679 |
Na2SiO3 |
1 г/л |
? |
? |
— |
|
680 |
Na3BO3 |
1 г/л |
? |
? |
— |
|
681 |
K2GeO3 |
18,22 % |
? |
? |
1,1 |
|
682 |
NaBrO |
1 М |
? |
? |
— |
|
683 |
CoCl2 |
2,6 % |
? |
? |
1,02 |
studfiles.net
Ответы@Mail.Ru: Гидролиз солей, помогите, срочно!
<a rel=»nofollow» href=»http://hob-inf.narod.ru/chem/hydr.html» target=»_blank»>http://hob-inf.narod.ru/chem/hydr.html</a> <a rel=»nofollow» href=»http://himege.ru/gidroliz-solej/» target=»_blank»>http://himege.ru/gidroliz-solej/</a> Решение: Степень гидролиза соли тем больше, чем слабее кислота или основание, образовавшие эту соль. Приведем ряд анионов и катионов, соответствующие уменьшению силы кислот и оснований их образующих. Анионы: F- > NO2− > Ch4COO− > SO32− > ClO− > CN− > CO32− > PO43− > S2− > SiO44− Катионы: Cd2+ > Mg2+ > Mn2+ > Fe2+ > Co2+ > Ni2+ > Nh5+ > Cu2+ > Pb2+ > Zn2+ > Al2+ > Cr 2+> Fe2+ Чем правее в этих рядах расположен ион, тем с большей силой идет гидролиз образованной им соли, т. е. его основание или кислота слабее, чем у стоящих слева от него. NaCN и NaClO – это соли, образованные сильным основанием и слабой кислотой. В ряду анионов CN− стоит правее ClO−, таким образом, NaCN в большей степени подвергается гидролизу, чем NaClO. Составим ионно-молекулярное и молекулярное уравнения гидролиза цианида натрия NaCN. Цианид натрия NaCN – соль слабой кислотой HCN и сильного основания NaOH. При растворении в воде молекулы NaCN диссоциируют на катионы Na+ и анионы CN−. Катионы Na+ не могут связывать ионы OH- воды, так как NaOH – это сильный электролит. Анионы CN− связывают ионы H+ воды, образуя молекулы слабого электролита HCN. Соль гидролизируется по аниону. Ионно-молекулярное уравнение гидролиза следующее: CN- + H+OH- = HCN + OH- В молекулярной форме уравнение гидролиза следующее: NaCN+ h3O = HCN + NaOH В результате гидролиза в растворе появляется некоторый избыток ионов OH-, поэтому раствор NaCN имеет щелочную реакцию (pH >7). Составьте молекулярное и ионно-молекулярное уравнение реакции гидролиза соли CuCl2 .Решение: Хлорид меди – соль слабого многокислотного основания Cu(OH)2 и сильной кислоты HCl . В данном случае катионы Cu2+ связывают гидроксильные ионы воды, образуя катионы основной соли CuOH+. Образование молекул Сu(OH)2 не происходит, так как ионы CuOH+ диссоциируют гораздо треднее, чем молекулы Cu(OH)2.В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза: Cu2+ + h3O ⇄ CuOH+ + H+или в молекулярной форме: CuCl2 + h3O ⇄CuOHCl + HCl
1) NaCN + h3O = NaOH + HCN . Na(+) + CN(-) + HOH = Na(+) + OH(-) + HCN . CN(-) + HOH = OH(-) + HCN .II. CuCl2 + h3O = CuOHCl + HCl . Cu(+2) + 2Cl(-) + HOH = CuOH(+) + 2Cl (-) + H(+) . Cu(+2) + HOH = CuOH(-) + H(+) III. (Nh5)2S + 2h3O = 2Nh5OH + h3S . 2Nh5(+) + S(-2) + 2HOH = 2Nh5OH + h3S IY Соли, образованные сильной кислотой и сильным основанием, не гидролизуются .
touch.otvet.mail.ru
Составьте молекулярные и ионные уравнения гидролиза солей Mn(NO3)2, К2SiO3? SrSO4.
ПЕРВЫЙ ВОПРОС Везде буду записывать гидролиз соли только по первой ступени, потому как полный гидролиз соли протекает лишь в тех случаях, когда гидролиз необратим. Соль Mn(NO3)2 образована слабым основанием и сильной кислотой. Гидролиз такой соли идет по катиону. Mn(NO3)2 + НОН ↔ MnОНNO3 + HNO3 – первая ступень гидролиза Mn(2+) + HOH ↔ MnОН (+) + H(+) (pH < 7 – среда кислая) Соль К2SiO3 образована сильным основанием и слабой кислотой. Гидролиз такой соли идет по аниону. К2SiO3 + НОН ↔ КНSiO3 + КОН – первая ступень гидролиза SiO3(2-) + НОН ↔ НSiO3(-) + ОН (-) (pH > 7 – среда щелочная) При гидролизе в горячей воде протекает вторая ступень гидролиза. Гидролиз силиката калия по второй ступени – необратимый процесс, протекающий с выпадением в осадок метакремниевой кислоты. КНSiO3 + НОН → Н2SiO3↓ + КОН – вторая ступень гидролиза НSiO3(-) + НОН → Н2SiO3↓ + ОН (-) (pH > 7 – среда щелочная) Суммарное уравнение гидролиза К2SiO3 + НОН → Н2SiO3↓ + 2КОН SiO3(2-) + НОН → Н2SiO3↓ + 2ОН (-) (pH > 7 – среда щелочная) Соль SrSO4 образована сильным основанием и сильной кислотой. Гидролиз таких солей не протекает. Теоретически реакция среды таких солей рН = 7 – среда нейтральная, фактически реакцию среды определяют по константам диссоциации основания Sr(OH)2 и кислоты h3SO4. Кd(Sr(OH)2) = 1,5*10^(–1) Кd1(Н2SO4) = 1,0*10^3 Кd1(Н2SO4) > Кd(Sr(OH)2) – среда слабокислая рН ≤ 7 ВТОРОЙ ВОПРОС Ацетат натрия – соль образованная слабой кислотой Ch4COOН и сильным основанием NaOH. В водном растворе ацетат натрия подвергнется гидролизу по аниону. Ch4COONa + НОН ↔ Ch4COOH + NaOH Ch4COO(-) + HOH ↔ Ch4COOH + OH(-) (pH > 7 – среда щелочная) Константа гидролиза соли, образованной слабой кислотой и сильным основанием. Kh = Kw/Kd(кислоты) Kw = 10^(-14) – ионное произведение воды Kd(Ch4COOH) = 1,8*10^(-5) – константа диссоциации уксусной кислоты Тогда константа гидролиза ацетата натрия Kh = 10^(-14)/1,8*10^(-5) = 5,56*10^(-10) Гидроксильный показатель раствора рОН = 14 – рН = 14 – 8 = 6 [OH(-)] = 10^(-pOH) = 10^(-6) Степень гидролиза ацетата натрия α = Kh/[OH(-)] = 5,56*10^(-10)/10^(-6) = 5,56*10^(-4) Молярную концентрацию раствора ацетата натрия можно найти по одной из двух формул См (Ch4COONa) = Kh/α^2 = 5,56*10^(-10)/(5,56*10^(-4))^2 = 1,8*10^(-3) = 0,0018 моль/л Или См (Ch4COONa) = [OH(-)]/α = 10^(-6)/(5,56*10^(-4)) = 1,8*10^(-3) = 0,0018 моль/л Есть готовая формула для вычисления рН соли, гидролизуемой по аниону. рН = 7 + 0,5lgCм (соли) + 0,5рКd(кислоты) Показатель константы диссоциации кислоты. рКd(кислоты) = — lgКd(кислоты) = — lg1,8*10^(-5) = 5 — lg1,8 = 4,74 8 = 7 + 0,5lgCм (соли) + 0,5*4,74 lgCм (соли) = — 2,74 Cм (соли) = 10^(-2,74) = 0,0018 моль/л
K2SiO3+h3O=KOH+KHSiO3 pH>7 дальше сама, Викусь!
touch.otvet.mail.ru
Гидролиз
Гидролиз- обменная реакция соли с водой (сольволиз водой).При этом исходное вещество разрушается водой, с образованием новых веществ.
Так как гидролиз является реакцией ионного обмена, то его движущей силой является образование слабого электролита (выпадение осадка или(и)выделение газа). Важно помнить, что реакция гидролиза является реакцией обратимой(в большинстве случаев), но также существует необратимый гидролиз(протекает до конца, исходного вещества в растворе не будет). Гидролиз- процесс эндотермический (при повышении температуры возрастает и скорость гидролиза, и выход продуктов гидролиза).
Как видно из определения, что гидролиз обменная реакция, то можно предположить, что к металлу идет OH—группа (+ возможный кислотный остаток, если образуется основная соль (при гидролизе соли, образованной сильной кислотой и слабым многокислотным основанием)), а к кислотному остатку идет протон водорода H+ (+ возможный ион металла и ион водорода, с образованием кислой соли, если гидролизуется соль, образованная слабой многоосновной кислотой)).
Существует 4 типа гидролиза:
1. Соль, образованная сильным основанием и сильной кислотой. Так как уже было указанно выше гидролиз- реакция ионного обмена, и она протекает лишь в случае образования слабого электролита. Как описанной выше, к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+, но ни сильное основание, ни сильная кислота не являются слабыми электролитами, следовательно гидролиз в данном случае не идёт:
NaCl+HOH≠NaOH+HCl
Реакция среды близка к нейтральной: pH≈7
2. Соль образованна слабым основанием и сильной кислотой. Как указанно выше:к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+. Например:
NH4Cl+HOH↔NH4OH+HCl
NH4++Cl—+HOH↔NH4OH+H++Cl—
NH4++HOH↔NH4OH+H+
Как видно из примера-гидролиз идёт по катиону, реакция среды –кислая pH< 7.При написании уравнений гидролиза для солей, образованных сильной кислотой и слабым многокислотным основанием, то в правой части следует писать основную соль, так как гидролиз идёт только по первой ступени:
FeCl2+HOH↔FeOHCl+HCl
Fe2++2Cl—+HOH↔FeO++H++2Cl—
Fe2++HOH↔FeOH++H+
3. Соль образованна слабой кислотой и сильным основанием.Как указанно выше: к металлу идёт OH— группа, а к кислотному остатку идет протон водорода H+Например:
CH3COONa+HOH↔NaOH+CH3COOH
СH3COO—+Na++HOH↔Na++CH3COOH+OH—
СH3COO—+HOH↔+CH3COOH+OH—
Гидролиз идёт по аниону, реакция среды- щелочная, pH>7.При написании уравнений гидролиза соли, образованной слабой многоосновной кислотой и сильным основанием, в правой части следует писать образование кислой соли, гидролиз идёт по 1 ступени. Например:
Na2CO3+HOH↔NaOH+NaHCO3
2Na++CO32-+HOH↔HCO3—+2Na++OH—
CO32-+HOH↔HCO3—+OH—
4. Соль образованна слабым основанием и слабой кислотой. Это единственный случай, когда гидролиз идёт до конца, является необратимым(до полного расходования исходной соли).Например:
СH3COONH4+HOH↔NH4OH+CH3COOH
Это единственный случай, когда гидролиз идёт до конца. Гидролиз идёт и по аниону, и по катиону, реакцию среды предугадать сложно, но она близка к нейтральной: pH≈7.
Также существует константа гидролиза, рассмотрим ее на примере ацетатного иона, обозначив его Ac—. Как видно из примеров выше уксусная(этановая) кислота является слабой кислотой, а, следовательно, ее соли гидролизуются по схеме:
Ac—+HOH↔HAc+OH—
Найдём константу равновесия для этой системы:
Зная ионное произведение воды , мы можем через него выразить концентрацию [OH]—,
Подставляя это выражение в уравнение для константы гидролиза, мы получаем:
Подставляя константу ионизации воды в уравнение, мы получаем:
Но константа диссоциации кислоты(на примере хлороводородной кислоты) равна:
Где [H3O+] представляет собой гидратированный протон водорода: [H+].Аналогично и для уксусной кислоты, как в примере. Подставляя значение для константы диссоциации кислоты в уравнение константы гидролиза, мы получаем:
Как следует из примера, если соль образованна слабым основанием, то в знаменателе будет стоять константа диссоциации основания, вычисляемая по тому же признаку что и константа диссоциации кислоты. Если соль образованна слабым основанием и слабой кислотой, то в знаменателе будет стоять произведение констант диссоциаций кислоты и основания.
Степень гидролиза.
Так же есть еще одна величина, характеризующая гидролиз- степень гидролиза-α.Которая равна отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли Степень гидролиза зависит от концентрации соли, температуры раствора. Она увеличивается при разбавлении раствора соли и при увеличении температуры раствора. Напомним, что больше разбавлен раствор, тем меньше молярная концентрация исходной соли; а степень гидролиза возрастает при повышении температуры, так как гидролиз- процесс эндотермический, как было указанно выше.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Как следует из уравнения степени гидролиза и типов гидролиза: при необратимом гидролизе α≈1.
Степень гидролиза и константа гидролиза взаимосвязаны через уравнение Оствальда (Вильгельм Фридрих Оствальд-закон разбавления Оствальда,выведен в 1888 году).Закон разбавления показывает, что степень диссоциации электролита зависит от его концентрации и константы диссоциации. Примем начальную концентрацию вещества за C0, а продиссоциировавшую часть вещества- за γ, напомним, схему диссоциации вещества в растворе:
AB↔A++B—
Тогда закон Оствальда можно выразить следующим образом:
Напомним, что в уравнение стоят концентрации в момент равновесия. Но если вещество малодиссоциировавшее, то (1-γ)→1, что приводит уравнение Оствальда в вид: Kд=γ2C0.
Аналогично связанна степень гидролиза с его константой:
В подавляющем большинстве случаев используется именно эта формула. Но при необходимости, можно выразить степень гидролиза через такую формулу:
Особые случаи гидролиза:
1) Гидролиз гидридов (соединений водорода с элементами (тут мы рассмотрим только металлы 1 и 2 групп и метам), где водород проявляетстепень окисления -1):
NaH+HOH→NaOH+H2↑
CaH2+2HOH→ Ca(OH)2+2H2↑
CH4+HOH→CO+3H2↑
Реакция с метаном- один из промышленных способов получения водорода.
2) Гидролиз пероксидов. Пероксиды щелочных и щелочноземельных металлов разлагаются водой, с образованием соответствующего гидроксида и пероксида водорода (или кислорода):
Na2O2+2H2O→2NaOH+H2O2
Na2 O2+2H2O→2NaOH+O2↑
3) Гидролиз нитридов.
Ca3N2+6HOH→3Ca(OH)2+2NH3↑
4) Гидролиз фосфидов.
K3P+3HOH→3KOH+PH3↑
Выделяющийся газ PH3-фосфин, очень ядовит, поражает нервную систему. Так же способен к самовозгоранию при контакте с кислородом. Гуляли когда-нибудь ночью по болоту или ходили мимо кладбищ? Видели редкие всплески огней- «блуждающие огни», появляются, так как горит фосфин.
5) Гидролиз карбидов. Здесь будут приведены две реакции имеющие практическое применение, так как с их помощью получаются 1 члены гомологического ряда алканов (реакция 1) и алкинов (реакция 2):
Al4C3+12HOH→4Al(OH)3+3CH4↑(реакция 1)
СaC2+2HOH→Ca(OH)2+2C2H2↑(реакция 2, продукт – ацителен, по UPAС этин)
6) Гидролиз силицидов. В результате этой реакции образуется 1 представитель гомологического ряда силанов (всего их 8) SiH4 — мономерный ковалентный гидрид.
Mg2 Si+4HOH→2Mg(OH)2+SiH4
7) Гидролиз галогенидов фосфора. Здесь будут рассмотрены хлориды фосфора 3 и 5, являющиеся хлорангидридами фосфористой и фосфорной кислот соответственно:
PCl3+3H2O=H3PO3+3HCl
PCl5+4H2O=H3PO4+5HCl
8) Гидролиз органических веществ.Жиры гидролизуются, с образованием глицерина (C3H5(OH)3) и карбоновой кислоты(пример предельной карбоновой кислоты) (CnH(2n+1)COOH)
Сложные эфиры:
СH3COOCH3+H2O↔CH3COOH+CH3OH
Алкоголята:
C2H5ONa+H2O↔C2H5OH+NaOH
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например, в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды — на моносахариды (например, на глюкозу).
При гидролизе жиров в присутствии щелочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицина и жирных кислот.
Задачи
1) Степень диссоциации а уксусной кислоты в 0,1 М растворе при 18 °С равна 1,4·10–2. Рассчитайте константу диссоциации кислоты Кд.(подсказка- используйте уравнение Оствальда.)
2) Какую массу гидрида кальция нужно растворить в воде, чтобы выделившемся газом восстановить до железа 6,96г оксида железа(II,III)?
3) Напишите уравнение реакции Fe2(SO4)3 + Na2CO3 + H2O
4) Рассчитайте степень, константу гидролиза соли Na2SO3 для концентрации См = 0,03 М, учитывая только 1-ю ступень гидролиза. (Константу диссоциации сернистой кислоты принять равной 6,3∙10-8)
Решения:
a) Подставим данные задачи в закон разбавления Оствальда:
b) Kд = [a2/(1 – a)]·[C] = (1,4·10–2)·0,1/(1 – 0,014) = 1,99·10–5
Ответ. Кд = 1,99·10–5.
c) Fe3O4+4H2→4H2O+3Fe
CaH2+HOH→Ca(OH)2+2H2↑
Находим количество молей оксида железа(II,III), оно равно отношению массы данного вещества к его молярной массе, получаем 0,03(моль).По УХР находим, что моли гидрида кальция равны 0,06(моль).Значит масса гидрида кальция равна 2,52(грамма).
Ответ: 2,52(грамма).
d) Fe2(SO4 )3 +3Na2CO3 +3H2 O→3СO2↑+2Fe(OH)3↓+3Na2 SO4
e) Сульфит натрия подвергается гидролизу по аниону, реакция среды раствора соли щелочная (рН > 7):
SO32- + H2O <—> OH— + HSO3—
Константа гидролиза (уравнение смотрите выше )равна : 10-14 / 6,3*10-8 = 1,58*10-7
Степень гидролиза рассчитывается по формуле α2/(1 — α) = Кh/С0.
Итак, α = (Кh/С0)1/2 = (1,58*10-7 / 0,03)1/2 = 2,3*10-3
Ответ: Kh=1,58*10-7 ;α =2,3*10-3
Автор статьи: Каштанов Артём Денисович
Редактор: Харламова Галина Николаевна
www.teslalab.ru
Гидролиз.
Сольволиз – это обменное взаимодействие растворенного вещества с растворителем, приводящее к изменению концентрации катионов и анионов растворителя. Гидролиз – такой частный случай сольволиза, когда в роли растворителя выступает вода. Гидролиз бинарного соединения идет необратимо. Например:
(1) PCl5 + 4 H2O = 5 HCl + H3PO4 и далее – протолиз продуктов:
HCl + H2O = Cl— + H3O+ , pH 7
H3PO4 + H2O H2PO4— + H3O+ , pH 7
Итак, наблюдается рост концентрации катионов оксония H3O+ с одновременным уменьшением концентрации OH—.
Такое поведение характерно и для других соединений неметаллов с галогенами:
(2) SiBr4 + (x + 2) H2O = 4 HBr + SiO2. x H2O(т)
HBr + H2O = Br— + H3O+ , pH 7
(3) BCl3 + 3 H2O = 3 HCl + B(OH)3(т)
HCl + H2O = Cl— + H3O+ , pH 7
(4) SCl2O2 + 2 H2O = 2 HCl + H2SO4
HCl + H2O = Cl— + H3O+ , pH 7 H2SO4 + 2 H2O = SO42- + 2 H3O+ , pH 7
Другие примеры – бинарные соединения металлов (нитриды, карбиды, силициды и другие):
(5) Li3N + 4 H2O = 3 LiOH + NH3. H2O
LiOH = Li+ + OH—, pH > 7
NH3. H2O + H2O NH4+ + OH— + H2O , pH > 7
(6) CaC2 + 2 H2O = Ca(OH)2 + C2H2(г)
Ca(OH)2 = Ca2+ + 2 OH—, pH > 7
Здесь также налицо изменение концентрации катионов и анионов воды (растет концентрация OH—, падает концентрация H3O+).
При гидролизе не меняются степени окисления атомов элементов, входящих в состав соединения. Например, по-разному гидролизуются фторид азота:
(7) N+IIIF3-I + 2 H2O = HN+IIIO2 + 3 HF-I
HNO2 + H2O NO2— + H3O+ , pH 7
HF + H2O F— + H3O+ , pH 7
и нитрид трихлора:
(8) Cl3+IN-III + 4 H2O = N-III H3. H2O + 3 HCl+IO
NH3. H2O + HClO = NH4ClO (нейтрализация)
HClO + H2O ClO— + H3O+ , pH 7
Гидролиз солей чаще всего идет обратимо и может быть рассмотрен схематически следующим образом: сначала при растворении солей (соединений с ионной кристаллической решеткой) в воде нацело идет диссоциация на катионы и анионы:
MA = M+ + A—,
а затем – гидратация ионов с получением M+(р) и A— (р). После этого те из гидратированных ионов, которые являются протолитами, вступают в протолитическую реакцию с водой.
Анионы часто ведут себя как основания:
A— + H2O ?? HA + OH— , pH > 7
Равновесие в этом случае описывается константой основности Kо, которую можно рассчитать, зная константу кислотности соответствующей сопряженной пары HA / A— по формуле:
Kо = Kв / Kк
Гидратированные катионы металлов в водном растворе практически всегда проявляют свойства кислот:
M+ . H2O + H2O MOH + H3O+ , pH 7
Равновесие в такой системе описывается константой кислотности Kк сопряженной пары M+ . H2O / MOH.
Среди распространенных анионов не являются протолитами Cl—, Br—, I—, NO3—, ClO4—, SO42-, ClO3—, MnO4— и некоторые другие.
Среди гидратированных катионов металлов не являются протолитами Li+, Na+, K+, Rb+, Cs+, Ca2+, Sr2+, Ba2+, Tl+ и некоторые другие.
Для иллюстрации изложенного могут быть приведены примеры:
(9) KNO3 = K+ + NO3—
(катион калия — непротолит, нитрат-ион — непротолит)
K+ + H2O ? ; NO3— + H2O ? ; pH = 7, гидролиз не идет.
(10) KNO2 = K+ + NO2—
(катион калия — непротолит, нитрит-ион — протолит)
K+ + H2O ?; NO2— + H2O HNO2 + OH —; pH > 7
(11) BaCl2 = Ba2+ + 2 Cl—
(катион бария — непротолит, хлорид-ион — непротолит)
Ba2+ + H2O ?; Cl— + H2O ? ; pH = 7, гидролиз не идет.
(12) BeCl2 = Be2+ + 2 Cl—
(катион бериллия — протолит, хлорид-ион — непротолит)
Be2+ . H2O + H2O ? BeOH+ + H3O+ , pH 7
Cl— + H2O ?
lib.repetitors.eu
Гидролиз в химии
Гидролиз и его виды
Выделяют два вида гидролиза: гидролиз солей и гидролиз солеобразных бинарных соединений (фосфидов, сульфидов, карбидов, галогенидов некоторых металлов и неметаллов).
Рассмотрим процесс гидролиза на примере: возьмем три пробирки в которых находятся растворы следующих солей – карбоната натрия (Na2CO3 ), хлорида алюминия (AlCl3) и хлорида натрия (NaCl) одинаковой концентрации, бесцветные. Внесем в каждую из пробирок по одной капле универсального индикатора. Цвет раствора в каждой пробирке изменится. Так, в пробирке с Na2CO3 станет голубым, что свидетельствует о наличии щелочной среды (рН>7), в пробирке с AlCl3 появится розовая окраска (кислая среда, рН<7), а в пробирке с NaCl раствор станет желто-зеленого цвета (нейтральная среда, рН=7). Изменение окраски растворов связано с явлением гидролиза – соль прореагировала с водой.
Гидролиз солей
Рассмотрим гидролиз первой из солей – карбоната натрия:
Na2CO3 ↔ 2Na+ + CO32- (подчеркиванием выделяем слабый компонент)
CO32- + HOH ↔ HCO3— + OH— — уравнение гидролиза в ионном виде
Наличие гидроксид иона указывает на щелочной характер среды. Гидролиз – обратимый процесс.
Na2CO3 + HOH ↔ NaHCO3 + NaOH – молекулярное уравнение гидролиза (1-я ступень)
HCO3— + HOH ↔ CO2↑ + H2O + OH—
NaHCO3 + HOH ↔ CO2↑ + H2O + NaOH (2-я ступень гидролиза)
Гидролиз протекает всегда в очень незначительной степени и по первой ступени, вторая и и последующие ступени возможны теоретически.
Рассмотрим гидролиз хлорида алюминия:
AlCl3 ↔ Al3+ +3Cl—
Al3+ + HOH ↔ AlOH2+ + H+ (1-я ступень гидролиза)
Наличие Н+ иона свидетельствует о наличии кислой среды.
AlOH2+ + HOH ↔ Al(OH)2+ + H+ (2-я ступень гидролиза)
Al(OH)2+ + HOH ↔ Al(OH)3 ↓ + H+ (3-я ступень гидролиза)
AlCl3 + HOH ↔ Al(OH)3 ↓ + HCl
Рассмотрим гидролиз хлорида натрия:
NaCl ↔ Na+ + Cl—
Слабого иона нет, следовательно, гидролиз невозможен и среда будет нейтральной.
Гидролизу подвергаются соли образованные сильным основанием и слабой кислотой ( Na2SiO3, K2SO3, K2S), слабым основанием и сильной кислотой ( Zn(NO3)2, CuCl2, CuSO4).
Если соль образована слабым основанием и слабой кислотой, то гидролиз протекает и по катиону и по аниону. В этом случае заранее определить среду весьма сложно. Например:
CH3COONH4 ↔ CH3COO— + NH4+
CH3COO— + HOH ↔ CH3COOH + OH—
NH4+ + HOH ↔ NH3 × H2O+ H+
Если соль образована сильным основанием и сильной кислотой – гидролиза не происходит.
Гидролиз солеобразных бинарных соединений
Как правило, гидролиз таких соединений протекает необратимо. Карбиды, нидриды, фосфиды, сульфиды при взаимодействии с водой образуют гидроксиды металлов и углеводороды, аммиак, фосфин, сероводород, соответственно.
CaC2 (карбид кальция) + 2H2O → Ca(OH)2 ↓ + C2H2
Mg3N2 (нитрид магния) + 6H2O → 3 Mg(OH)2 ↓ + 2 NH3 ↑
Константа и степень гидролиза
CH3COONa ↔ CH3COO— + Na+
CH3COO— + HOH ↔ CH3COOH + OH—
При протекании гидролиза устанавливается химическое равновесие. Согласно закону действующих масс можно записать константу равновесия:
[H2O] — фактически постоянная величина, следовательно K[H2O] – также постоянная величина, которую называют константой гидролиза и обозначают [H2O].
[OH][H] = КW (ионное произведение воды)
= Kдисс (константа диссоциации кислоты), следовательно
КГ =КW (ионное произведение воды) / Kдисс (константа диссоциации слабого компонента).
Чем выше значение константы гидролиза, тем в большей степени он протекает.
h – степень гидролиза – отношение числа молекул, подвергшихся гидролизу к общему числу растворенных молекул.
Примеры решения задач
ru.solverbook.com
