Пояснения к схеме «Синтез АТФ в митохондрии клетки» — Мегаобучалка
Превращение веществ и энергии в процессе диссимиляции включает в себя следующие этапы:
I этап — подготовительный: сложные органические вещества под действием пищеварительных ферментов распадаются на простые, при этом выделяется только тепловая энергия.
Белки -» аминокислоты
Жиры —> глицерин и жирные кислоты
Крахмал —> глюкоза
II этап — гликолиз (бескислородный): осуществляется в гиалоплазме, с мембранами не связан; в нем участвуют ферменты; расщеплению подвергается глюкоза:
60% теплота
С6Н1206 -> 2С3Н403 + 2Н + Q
40% на синтез 2АДФ + 2Ф -» 2АТФ + 2 НАД.Н
глюкоза пировиноградная кислота
IIIэтап — кислородный: осуществляется в митохондриях, связан с матриксом митохондрий и внутренней мембраной, в нем участвуют ферменты, расщеплению подвергается пировиноградная кислота
СО2 (диоксид углерода) выделяется из митохондрий в окружающую среду. Атом водорода включается в цепь реакций, конечный результат которых — синтез АТФ. Эти реакции идут в такой последовательности:
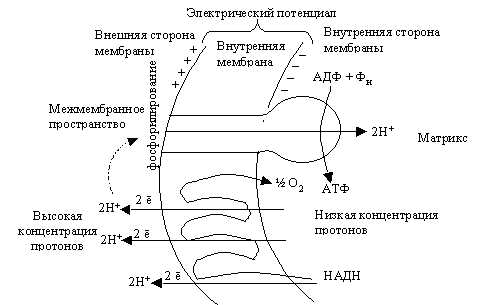
1. Атом водорода Н с помощью ферментов-переносчиков поступает во внутреннюю мембрану митохондрии, образующую кристы, где он окисляется:
Н – ё -> Н+
2. Протон Н+ (катион водорода) выносится переносчиками на наружную поверхность мембраны крист. Для протонов эта мембрана, так же как и наружная мембрана митохондрии, непроницаема, поэтому они накапливаются в меж-мембранном пространстве, образуя протонный резервуар.
3. Электроны водорода е переносятся на внутреннюю поверхность мембраны крист и тут же присоединяются к кислороду с помощью фермента оксидазы, образуя отрицательно заряженный активный кислород (анион):
О2 + 2 е -> О2
4. Катионы и анионы по обе стороны мембраны создают разноименно заряженное электрическое поле, и когда разность потенциалов достигнет 200 мВ, начинает действовать протонный канал. Он возникает в молекулах ферментов АТФ-синтетаз, которые встроены во внутреннюю мембрану, образующую кристы. 5 . Через протонный канал протоны Н+ устремляются внутрь митохондрии, создавая высокий уровень энергии, большая часть которой идет на синтез АТФ из АДФ и Ф (АДФ + Ф -> АТФ), а сами протоны Н+ взаимодействуют с активным кислородом, образуя воду и молекулярный О2:
4Н+ + 202— -> 2Н20 + 02
Таким образом, О2, поступающий в митохондрии в процессе дыхания организма, необходим для присоединения протонов Н+, При его отсутствии весь процесс в митохондриях прекращается, так как электронно-транспортная цепь перестает функционировать. Общая реакция III этапа:
2С3Н403 + 6О2 + 36АДФ + З6Ф -> 6СО2 + 36АТФ + 42Н2О
В результате расщепления одной молекулы глюкозы образуются 38 молекул АТФ: на II этапе — 2 АТФ и на III этапе — 36 АТФ. Образовавшиеся молекулы АТФ выходят за пределы митохондрии и участвуют во всех процессах клетки, где необходима энергия. Расщепляясь, АТФ отдает энергию (одна фосфатная связь заключает 40 кДж) и в виде АДФ и Ф (фосфата) возвращается в митохондрии.
megaobuchalka.ru
Митохондрия как органелла синтеза АТФ
О строении митохондрий мы уже вели с вами разговор. Мембраны митохондрий состоят из белков (65–70 % сухой массы) и фосфолипидов и имеют полное соответствие со структурой универсальной мембраны.
На внешней мембране митохондрий расположены ферменты гликолиза, в матриксе – ферменты цикла Кребса и ферменты, катализирующие окисление жирных кислот. Из размещения ферментов можно заключить, что основная функция митохондрий – преобразование энергии сложных органических веществ в энергию макроэргических связей АТФ. Однако, если все реакции фотосинтеза, главным образом, сосредоточены в хлоропластах, то разные этапы процесса дыхания происходят в разных частях клетки: в гиалоплазме, на эндоплазматическом ретикулуме, в ядрах, митохондриях. В связи с этим мембраны митохондрий легко проницаемы для большей части малых молекул и ионов. Например, пировиноградная кислота, образующаяся при разрушении глюкозы в гиалоплазме, легко проходит в митохондрию, где разрушается до СО 2 и воды в цикле Кребса.
В клетках зеленых растений обычно меньше митохондрий, чем в клетках животных, так как синтез АТФ идет и в хлоропластах.
Митохондрия, как и хлоропласт, является органеллой, имеющей все свойства живой материи для обмена веществ и энергией, движения, роста, размножения, раздражения, адаптации и т. д. Митохондрии могут размножаться делением с помощью перетяжки, и образуется из инициальных частиц. Инициальная частица образуется из митохондрий: мембрана митохондрий выпячивается, образуется «почка», которая затем отделяется. Инициальная частица быстро растет, а ее внутренняя мембрана образует маленькие складочки, расположенные перпендикулярно поверхности частицы. На этой стадии образования их уже называют промитохондриями. Промитохондрии быстро увеличиваются в объеме, складки внутренней мембраны дифференцируют в кристы. На этом формирование митохондрий заканчивается.
Как и хлоропласты митохондрии двигаются. Они собираются обычно в той части клетки, где в данное время требуется больше энергии. Например, при поглощении воды корневым волоскам митохондрии подходят к его поверхности, при делении ядра – к ядру.
В зеленых клетках растений митохондрии размещаются около хлоропластов. На поверхности хлоропластов иногда образуются выпячивания, с помощью которых хлоропласты могут соединяться с митохондриями. Это говорит о том, что в зеленых клетках растений фотосинтез и дыхание происходят согласованно.
В строении митохондрий и хлоропластов много общего. Так, обе органеллы окружены двумя мембранами, причем за счет выпячивания внутренней мембраны в матриксе в митохондриях образуют кристы, а в хлоропластах – тилакоиды стромы.
Как уже отмечалось, хлоропласты – это потомки сине-зеленых водорослей, которые в начале эволюции внедрились в гетеротрофные клетки. Митохондрии, в свою очередь, подобны некоторым примитивным бактериям.
Таким образом, в митохондриях имеется все предпосылки как структурные, так и функциональные, для осуществления процессов, связанных с запасанием энергии.
Окислительное фосфорилирование. На протяжении более чем 30 лет многочисленные исследования были направлены на выявление механизма, с помощью которого энергия, которая выделяется при переносе электронов, используется на синтез АТФ (фосфорилирование АДФ).
Были предложены за этот период три гипотезы: химического и конформационного сопряжений и хемоосмотическая гипотеза. Наибольшее распространение получила последняя, которую предложил в 1961 г. Митчелл. В отличие от двух первых эта гипотеза постулирует, что свободная энергия, которая образуется ОВ реакциями цепи переноса электронов, используется не для генерации высокоэнергетического соединения или высокоэнергетической конформации молекулы, а идет на образование высокоэнергетического состояния в форме электрохимического градиента ионов Н+ на внутренней митохондриальной мембране. В соответствии с теорией Митчелла протоны проходят из митохондриального матрикса во внешнее митохондриальное пространство, тогда как электроны от НАДН идут на ЭТЦ, встроенную в митохондриальную мембрану. Каждая пара электронов пересекает мембрану три раза, когда передается с одного переносчика к другому и в конечном счете к О 2 (рис 3.8).
 |
| Рис. 3.8. Образование АТФ в митохондриях (хемиосмотическая теория) |
Перенос каждой пары ē по цепи от НАДН до О2 приводит к переходу через митохондриальную мембрану шести протонов. В результате возникает электрохимический потенциал Н+ на внутренней мембране. Запасенная таким образом энергия используется для синтеза АТФ при обратном транспорте протонов через АТФ-азный комплекс.
Мембрана выполняет сопрягающую функцию: связывает два процесса – транспорт электронов и синтез АТФ. Каждое нарушение, вызывающее остановку транспорта электронов или увеличение проницаемости мембраны для протонов, приводит к нарушению синтеза АТФ и выделению освобождающейся в виде энергии тепла.
Таким образом, физиологический смысл транспорта электронов заключается в образовании электрохимического потенциала, который приводит к синтезу АТФ.
Процесс фосфорилирования АДФ с образованием АТФ, сопряженный с транспортом электронов от дыхательного субстрата к кислороду воздуха, получил название окислительного фосфорилирования. Суммарное уравнение этого процесса можно записать так:
НАДН + Н+ + 3АДФ + 3Ф + 1/2О2 →
НАД+ + 3АТФ + 4Н2О.
Похожие статьи:
poznayka.org
10. Митохондрии. Атф.
Митохондрии — микроскопические двумембранные полуавтономные органоиды общего назначения, обеспечивающие клетку энергией, получаемой благодаря процессам окисления и запасаемой в виде фосфатных связей АТФ. Митохондрии также участвуют в биосинтезе стероидов, окислении жирных кислот и синтезе нуклеиновых кислот. Присутствуют во всех эукариотических клетках. В прокариотических клетках митохондрий нет, их функцию выполняют мезосомы — впячивания наружной цитоплазматической мембраны внутрь клетки.Митохондрии могут иметь эллиптическую, сферическую, палочковидную, нитевидную и др. формы, которые могут изменяться в течение определенного времени. Количество митохондрий в клетках, выполняющих различные функции, варьирует в широких пределах — от 50 и достигая в наиболее активных клетках 500-5000. Их больше там, где интенсивны синтетические процессы (печень) или велики затраты энергии (мышечные клетки). В клетках печени (гепатоцитах) их число составляет 800. а занимаемый ими объем равен примерно 20% объема цитоплазмы. Размеры митохондрий составляют от 0,2 до 1-2 мкм в диаметре и от 2 до 5-7 (10) мкм в длину. На светооптическом уровне митохондрии выявляются в цитоплазме специальными методами и имеют вид мелких зерен и нитей (что обусловило их название — от греч. mitos — нить и chondros — зерно).
В цитоплазме митохондрии могут располагаться диффузно, однако обычно они сосредоточены в участках максимального потребления энергии, например, вблизи ионных насосов, сократимых элементов (миофибрилл) органелл движения (аксонем спермия, ресничек), компонентов синтетического аппарата (цистерн ЭПС). Согласно одной из гипотез, все митохондрии клетки связаны друг с другом и образуют трехмерную сеть.
Митохондрия окружена двумя мембранами — наружной и внутренней, разделенных межмембранным пространством, и содержат митохондриальный матрикс, в который обращены складки внутренней мембраны — кристы.
Наружная митохондриальная мембрана гладкая, по химическому составу сходна с наружной цитоплазматической мембраной и обладает высокой проницаемостью для молекул массой до 10 килодальтон, проникающих из цитозоля в межмембранное пространство. По своему составу она похожа на плазмалемму, 25% составляют белки, 75% липиды. Среди липидов присутствует холестерол. Наружная мембранаа содержит много молекул специализированных транспортных белков (например, поринов), которые формируют широкие гидрофильные каналы и обеспечивают ее высокую проницаемость, а также небольшое количество ферментных систем. На ней находятся рецепторы, распознающие белки, которые переносятся через обе митохондриальные мембраны в особых точках их контакта — зонах слипания.
Внутренняя мембрана имеет выросты внутрь — гребни или кристы, делящие матрикс митохондрии на отсеки. Кристы увеличивают площадь поверхности внутренней мембраны. Таким образом, внутреняя митохондриальная мембрана по площади превосходит наружную. Кристы расположены перпендикулярно или продольно длине митохондрии. Кристы по форме могут быть везикулярные, тубулярные или ламеллярные.
Химический состав внутренней мембраны митохондрий сходен с мембранами прокариот (например, в ней присутствует особый липид — кардиодипин и отсутствует холестерол). Во внутренней митохондриальной мембране преобладают белки, составляющие 75%. Во внутреннюю мембрану встроены белки трех типов (а) белки электрон-транспортной цепи (дыхательной цепи) — НАД’Н-дегидрогеназа и ФАД’Н дегидрогеназа — и другие транспортные белки, (б) грибовидные тельца АТФ-синтетазы (головки которых обращены в сторону матрикса) и (в) часть ферментов цикла Кребса (сукцинатдегидрогеназа). Внутренняя митохондриальная мембрана отличается чрезвычайно низкой проницаемостью, транспорт веществ осуществляется через контактные сайты. Низкая проницаемость внутренней мембраны для мелких ионов из-за высокого содержания фосфолипида
Митохондрии — полуавтономные органоиды клетки, т.к. содержат собственную ДНК, полуавтономную систему репликации, транскрипции и собственный белоксинтезируюший аппарат — полуавтономную систему трансляции (рибосомы 70S типа и т-РНК). Благодаря этому митохондрии синтезируют часть собственных белков. Митохондрии могут делиться независимо от деления клетки. Если из клетки удалить все митохондрии, то новые в ней не появятся. Согласно теории эндосимбиоза митохондрии произошли от аэробных прокариотических клеток, которые попали в клетку хозяина, но не переварились, вступили на путь глубокого симбиоза и постепенно, утратив автономность, превратились в митохондрии.
Митохондрии — полуавтономные органоиды, что выражается следующими признаками:
1) наличие собственного генетического материала (нити ДНК), что позволяет осуществлять синтез белка, а также позволяет самостоятельно делиться независимо от клетки;
2) наличие двойной мембраны;
3) пластиды и митохондрии способны синтезировать АТФ (для хлоропластов источник энергии — свет, в митохондриях АТФ образуется в результате окисления органических веществ).
Функции митохондрий:
1) Энергетическая — синтез АТФ (отсюда эти органоиды и получили название «энергетических станций клетки»):
При аэробном дыхание на кристах происходит окислительное фосфорилирование (образование АТФ из АДФ и неорганического фосфата за счет энергии, освободившейся при окислении органических веществ) и перенос электронов по электрон-транспортной цепи. На внутренней мембране митохондрии расположены ферменты, участвующие в клеточном дыхании;
2) участие в биосинтезе многих соединений (в митохондриях синтезируются некоторые аминокислоты, стероиды (стероидогенез), синтезируется часть собственных белков), а также накопление ионов (Са2+), гликопротеидов, белков, липидов;
3) окисление жирных кислот;
4) генетическая — синтез нуклеиновых кислот (идут процессы репликации и транскрипции). Митохондриальная ДНК обеспечивает цитоплазматическую наследственность.
АТФ
АТФ была открыта в 1929 году немецким химиком Ломанном. В 1935 году Владимир Энгельгардт обратил внимание на то, что мышечные сокращения невозможны без наличия АТФ. В период с 1939 под 1941 г. лауреат Нобелевской премии Фриц Липман доказал, что основным источником энергии для метаболической реакции является АТФ, и ввел в обращение термин «энергетически богатые фосфатные связи». Кардинальные изменения в изучении действия АТФ на организм произошли в середине 70-х годов, когда было обнаружено наличие специфических рецепторов на наружной поверхности клеточных мембран, чувствительных к молекуле АТФ. С тех пор интенсивно изучается триггерное (регуляторное) действие АТФ на различные функции организма
Аденозинтрифосфорная кислота (АТФ, аденинтрифосфорная кислота) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной сзязью с 5′-углеродом рибозы, к которой последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз фосфоэфирных связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + H2O → AДФ + H3PO4 + энергия
АТФ + H2O → AМФ + H4P2O7 + энергия
Высвобождённая энергия используется в разнообразных процессах, протекающих с затратой энергии
функции
1)Главная — энергетическая. АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов.
2) синтез нуклеиновых кислот.
3) регуляция множества биохимических процессов. АТФ, присоединяясь к регуляторным центрам ферментов, усиливает или подавляет их активность.
непосредственный предшественник синтеза циклоаденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
медиатор в синапсах
пути синтеза:
В организме АТФ синтезируется из АДФ, используя энергию окисляющихся веществ:
АДФ + H3PO4 + энергия → AТФ + H2O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование. Основная масса АТФ образуется на мембранах в митохондриях путём окислительного фосфорилирования ферментом H-зависимой АТФ-синтетазой. Субстратное фосфорилирование АДФ не требует участия мембран, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
studfiles.net
10. Митохондрии. Атф.
Митохондрии — микроскопические двумембранные полуавтономные органоиды общего назначения, обеспечивающие клетку энергией, получаемой благодаря процессам окисления и запасаемой в виде фосфатных связей АТФ. Митохондрии также участвуют в биосинтезе стероидов, окислении жирных кислот и синтезе нуклеиновых кислот. Присутствуют во всех эукариотических клетках. В прокариотических клетках митохондрий нет, их функцию выполняют мезосомы — впячивания наружной цитоплазматической мембраны внутрь клетки.
Митохондрии могут иметь эллиптическую, сферическую, палочковидную, нитевидную и др. формы, которые могут изменяться в течение определенного времени. Количество митохондрий в клетках, выполняющих различные функции, варьирует в широких пределах — от 50 и достигая в наиболее активных клетках 500-5000. Их больше там, где интенсивны синтетические процессы (печень) или велики затраты энергии (мышечные клетки). В клетках печени (гепатоцитах) их число составляет 800. а занимаемый ими объем равен примерно 20% объема цитоплазмы. Размеры митохондрий составляют от 0,2 до 1-2 мкм в диаметре и от 2 до 5-7 (10) мкм в длину. На светооптическом уровне митохондрии выявляются в цитоплазме специальными методами и имеют вид мелких зерен и нитей (что обусловило их название — от греч. mitos — нить и chondros — зерно).
В цитоплазме митохондрии могут располагаться диффузно, однако обычно они сосредоточены в участках максимального потребления энергии, например, вблизи ионных насосов, сократимых элементов (миофибрилл) органелл движения (аксонем спермия, ресничек), компонентов синтетического аппарата (цистерн ЭПС). Согласно одной из гипотез, все митохондрии клетки связаны друг с другом и образуют трехмерную сеть.
Митохондрия окружена двумя мембранами — наружной и внутренней, разделенных межмембранным пространством, и содержат митохондриальный матрикс, в который обращены складки внутренней мембраны — кристы.
Наружная митохондриальная мембрана гладкая, по химическому составу сходна с наружной цитоплазматической мембраной и обладает высокой проницаемостью для молекул массой до 10 килодальтон, проникающих из цитозоля в межмембранное пространство. По своему составу она похожа на плазмалемму, 25% составляют белки, 75% липиды. Среди липидов присутствует холестерол. Наружная мембранаа содержит много молекул специализированных транспортных белков (например, поринов), которые формируют широкие гидрофильные каналы и обеспечивают ее высокую проницаемость, а также небольшое количество ферментных систем. На ней находятся рецепторы, распознающие белки, которые переносятся через обе митохондриальные мембраны в особых точках их контакта — зонах слипания.
Внутренняя мембрана имеет выросты внутрь — гребни или кристы, делящие матрикс митохондрии на отсеки. Кристы увеличивают площадь поверхности внутренней мембраны. Таким образом, внутреняя митохондриальная мембрана по площади превосходит наружную. Кристы расположены перпендикулярно или продольно длине митохондрии. Кристы по форме могут быть везикулярные, тубулярные или ламеллярные.
Химический состав внутренней мембраны митохондрий сходен с мембранами прокариот (например, в ней присутствует особый липид — кардиодипин и отсутствует холестерол). Во внутренней митохондриальной мембране преобладают белки, составляющие 75%. Во внутреннюю мембрану встроены белки трех типов (а) белки электрон-транспортной цепи (дыхательной цепи) — НАД’Н-дегидрогеназа и ФАД’Н дегидрогеназа — и другие транспортные белки, (б) грибовидные тельца АТФ-синтетазы (головки которых обращены в сторону матрикса) и (в) часть ферментов цикла Кребса (сукцинатдегидрогеназа). Внутренняя митохондриальная мембрана отличается чрезвычайно низкой проницаемостью, транспорт веществ осуществляется через контактные сайты. Низкая проницаемость внутренней мембраны для мелких ионов из-за высокого содержания фосфолипида
Митохондрии — полуавтономные органоиды клетки, т.к. содержат собственную ДНК, полуавтономную систему репликации, транскрипции и собственный белоксинтезируюший аппарат — полуавтономную систему трансляции (рибосомы 70S типа и т-РНК). Благодаря этому митохондрии синтезируют часть собственных белков. Митохондрии могут делиться независимо от деления клетки. Если из клетки удалить все митохондрии, то новые в ней не появятся. Согласно теории эндосимбиоза митохондрии произошли от аэробных прокариотических клеток, которые попали в клетку хозяина, но не переварились, вступили на путь глубокого симбиоза и постепенно, утратив автономность, превратились в митохондрии.
Митохондрии — полуавтономные органоиды, что выражается следующими признаками:
1) наличие собственного генетического материала (нити ДНК), что позволяет осуществлять синтез белка, а также позволяет самостоятельно делиться независимо от клетки;
2) наличие двойной мембраны;
3) пластиды и митохондрии способны синтезировать АТФ (для хлоропластов источник энергии — свет, в митохондриях АТФ образуется в результате окисления органических веществ).
Функции митохондрий:
1) Энергетическая — синтез АТФ (отсюда эти органоиды и получили название «энергетических станций клетки»):
При аэробном дыхание на кристах происходит окислительное фосфорилирование (образование АТФ из АДФ и неорганического фосфата за счет энергии, освободившейся при окислении органических веществ) и перенос электронов по электрон-транспортной цепи. На внутренней мембране митохондрии расположены ферменты, участвующие в клеточном дыхании;
2) участие в биосинтезе многих соединений (в митохондриях синтезируются некоторые аминокислоты, стероиды (стероидогенез), синтезируется часть собственных белков), а также накопление ионов (Са2+), гликопротеидов, белков, липидов;
3) окисление жирных кислот;
4) генетическая — синтез нуклеиновых кислот (идут процессы репликации и транскрипции). Митохондриальная ДНК обеспечивает цитоплазматическую наследственность.
АТФ
АТФ была открыта в 1929 году немецким химиком Ломанном. В 1935 году Владимир Энгельгардт обратил внимание на то, что мышечные сокращения невозможны без наличия АТФ. В период с 1939 под 1941 г. лауреат Нобелевской премии Фриц Липман доказал, что основным источником энергии для метаболической реакции является АТФ, и ввел в обращение термин «энергетически богатые фосфатные связи». Кардинальные изменения в изучении действия АТФ на организм произошли в середине 70-х годов, когда было обнаружено наличие специфических рецепторов на наружной поверхности клеточных мембран, чувствительных к молекуле АТФ. С тех пор интенсивно изучается триггерное (регуляторное) действие АТФ на различные функции организма
Аденозинтрифосфорная кислота (АТФ, аденинтрифосфорная кислота) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной сзязью с 5′-углеродом рибозы, к которой последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз фосфоэфирных связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + H2O → AДФ + H3PO4 + энергия
АТФ + H2O → AМФ + H4P2O7 + энергия
Высвобождённая энергия используется в разнообразных процессах, протекающих с затратой энергии
функции
1)Главная — энергетическая. АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов.
2) синтез нуклеиновых кислот.
3) регуляция множества биохимических процессов. АТФ, присоединяясь к регуляторным центрам ферментов, усиливает или подавляет их активность.
непосредственный предшественник синтеза циклоаденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
медиатор в синапсах
пути синтеза:
В организме АТФ синтезируется из АДФ, используя энергию окисляющихся веществ:
АДФ + H3PO4 + энергия → AТФ + H2O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование. Основная масса АТФ образуется на мембранах в митохондриях путём окислительного фосфорилирования ферментом H-зависимой АТФ-синтетазой. Субстратное фосфорилирование АДФ не требует участия мембран, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
studfiles.net
10. Митохондрии. Атф.
Митохондрии — микроскопические двумембранные полуавтономные органоиды общего назначения, обеспечивающие клетку энергией, получаемой благодаря процессам окисления и запасаемой в виде фосфатных связей АТФ. Митохондрии также участвуют в биосинтезе стероидов, окислении жирных кислот и синтезе нуклеиновых кислот. Присутствуют во всех эукариотических клетках. В прокариотических клетках митохондрий нет, их функцию выполняют мезосомы — впячивания наружной цитоплазматической мембраны внутрь клетки.
Митохондрии могут иметь эллиптическую, сферическую, палочковидную, нитевидную и др. формы, которые могут изменяться в течение определенного времени. Количество митохондрий в клетках, выполняющих различные функции, варьирует в широких пределах — от 50 и достигая в наиболее активных клетках 500-5000. Их больше там, где интенсивны синтетические процессы (печень) или велики затраты энергии (мышечные клетки). В клетках печени (гепатоцитах) их число составляет 800. а занимаемый ими объем равен примерно 20% объема цитоплазмы. Размеры митохондрий составляют от 0,2 до 1-2 мкм в диаметре и от 2 до 5-7 (10) мкм в длину. На светооптическом уровне митохондрии выявляются в цитоплазме специальными методами и имеют вид мелких зерен и нитей (что обусловило их название — от греч. mitos — нить и chondros — зерно).
В цитоплазме митохондрии могут располагаться диффузно, однако обычно они сосредоточены в участках максимального потребления энергии, например, вблизи ионных насосов, сократимых элементов (миофибрилл) органелл движения (аксонем спермия, ресничек), компонентов синтетического аппарата (цистерн ЭПС). Согласно одной из гипотез, все митохондрии клетки связаны друг с другом и образуют трехмерную сеть.
Митохондрия окружена двумя мембранами — наружной и внутренней, разделенных межмембранным пространством, и содержат митохондриальный матрикс, в который обращены складки внутренней мембраны — кристы.
Наружная митохондриальная мембрана гладкая, по химическому составу сходна с наружной цитоплазматической мембраной и обладает высокой проницаемостью для молекул массой до 10 килодальтон, проникающих из цитозоля в межмембранное пространство. По своему составу она похожа на плазмалемму, 25% составляют белки, 75% липиды. Среди липидов присутствует холестерол. Наружная мембранаа содержит много молекул специализированных транспортных белков (например, поринов), которые формируют широкие гидрофильные каналы и обеспечивают ее высокую проницаемость, а также небольшое количество ферментных систем. На ней находятся рецепторы, распознающие белки, которые переносятся через обе митохондриальные мембраны в особых точках их контакта — зонах слипания.
Внутренняя мембрана имеет выросты внутрь — гребни или кристы, делящие матрикс митохондрии на отсеки. Кристы увеличивают площадь поверхности внутренней мембраны. Таким образом, внутреняя митохондриальная мембрана по площади превосходит наружную. Кристы расположены перпендикулярно или продольно длине митохондрии. Кристы по форме могут быть везикулярные, тубулярные или ламеллярные.
Химический состав внутренней мембраны митохондрий сходен с мембранами прокариот (например, в ней присутствует особый липид — кардиодипин и отсутствует холестерол). Во внутренней митохондриальной мембране преобладают белки, составляющие 75%. Во внутреннюю мембрану встроены белки трех типов (а) белки электрон-транспортной цепи (дыхательной цепи) — НАД’Н-дегидрогеназа и ФАД’Н дегидрогеназа — и другие транспортные белки, (б) грибовидные тельца АТФ-синтетазы (головки которых обращены в сторону матрикса) и (в) часть ферментов цикла Кребса (сукцинатдегидрогеназа). Внутренняя митохондриальная мембрана отличается чрезвычайно низкой проницаемостью, транспорт веществ осуществляется через контактные сайты. Низкая проницаемость внутренней мембраны для мелких ионов из-за высокого содержания фосфолипида
Митохондрии — полуавтономные органоиды клетки, т.к. содержат собственную ДНК, полуавтономную систему репликации, транскрипции и собственный белоксинтезируюший аппарат — полуавтономную систему трансляции (рибосомы 70S типа и т-РНК). Благодаря этому митохондрии синтезируют часть собственных белков. Митохондрии могут делиться независимо от деления клетки. Если из клетки удалить все митохондрии, то новые в ней не появятся. Согласно теории эндосимбиоза митохондрии произошли от аэробных прокариотических клеток, которые попали в клетку хозяина, но не переварились, вступили на путь глубокого симбиоза и постепенно, утратив автономность, превратились в митохондрии.
Митохондрии — полуавтономные органоиды, что выражается следующими признаками:
1) наличие собственного генетического материала (нити ДНК), что позволяет осуществлять синтез белка, а также позволяет самостоятельно делиться независимо от клетки;
2) наличие двойной мембраны;
3) пластиды и митохондрии способны синтезировать АТФ (для хлоропластов источник энергии — свет, в митохондриях АТФ образуется в результате окисления органических веществ).
Функции митохондрий:
1) Энергетическая — синтез АТФ (отсюда эти органоиды и получили название «энергетических станций клетки»):
При аэробном дыхание на кристах происходит окислительное фосфорилирование (образование АТФ из АДФ и неорганического фосфата за счет энергии, освободившейся при окислении органических веществ) и перенос электронов по электрон-транспортной цепи. На внутренней мембране митохондрии расположены ферменты, участвующие в клеточном дыхании;
2) участие в биосинтезе многих соединений (в митохондриях синтезируются некоторые аминокислоты, стероиды (стероидогенез), синтезируется часть собственных белков), а также накопление ионов (Са2+), гликопротеидов, белков, липидов;
3) окисление жирных кислот;
4) генетическая — синтез нуклеиновых кислот (идут процессы репликации и транскрипции). Митохондриальная ДНК обеспечивает цитоплазматическую наследственность.
АТФ
АТФ была открыта в 1929 году немецким химиком Ломанном. В 1935 году Владимир Энгельгардт обратил внимание на то, что мышечные сокращения невозможны без наличия АТФ. В период с 1939 под 1941 г. лауреат Нобелевской премии Фриц Липман доказал, что основным источником энергии для метаболической реакции является АТФ, и ввел в обращение термин «энергетически богатые фосфатные связи». Кардинальные изменения в изучении действия АТФ на организм произошли в середине 70-х годов, когда было обнаружено наличие специфических рецепторов на наружной поверхности клеточных мембран, чувствительных к молекуле АТФ. С тех пор интенсивно изучается триггерное (регуляторное) действие АТФ на различные функции организма
Аденозинтрифосфорная кислота (АТФ, аденинтрифосфорная кислота) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной сзязью с 5′-углеродом рибозы, к которой последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз фосфоэфирных связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + h3O → AДФ + h4PO4 + энергия
АТФ + h3O → AМФ + h5P2O7 + энергия
Высвобождённая энергия используется в разнообразных процессах, протекающих с затратой энергии
функции
1)Главная — энергетическая. АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов.
2) синтез нуклеиновых кислот.
3) регуляция множества биохимических процессов. АТФ, присоединяясь к регуляторным центрам ферментов, усиливает или подавляет их активность.
4) непосредственный предшественник синтеза циклоаденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
5) медиатор в синапсах
пути синтеза:
В организме АТФ синтезируется из АДФ, используя энергию окисляющихся веществ:
АДФ + h4PO4 + энергия → AТФ + h3O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование. Основная масса АТФ образуется на мембранах в митохондриях путём окислительного фосфорилирования ферментом H-зависимой АТФ-синтетазой. Субстратное фосфорилирование АДФ не требует участия мембран, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
studfiles.net
Синтез АТФ
Анаэробный синтез АТФ: субстратное фосфорилирование, синтез АТФ из фосфокреатина, аденилаткиназная реакция
АТФ (аденозинтрифосфат): молекула, обеспечивающая энергией живые клетки
Рис. 10.1. Строение аденозинтрифосфата (АТФ)Молекулы АТФ жизненно необходимы. АТФ служит источником энергии, необходимой для сокращения мышц, проведения нервного импульса, протекания многих биохимических реакций и т.п. В покое расходуется 28 г (1 унция) АТФ в минуту, что эквивалентно 1,4 кг (3 фунта) в час, а при физической нагрузке расход АТФ достигает 0,5 кг в минуту! АТФ состоит из аденина, рибозы и трех фосфатных групп, которые называются а-, β- и у-фосфатными группами (рис. 10.1). Гидролиз высокоэнергетических фосфоангидридных связей между β- и у-атомами фосфора или между а- и β-атомами фосфора высвобождает энергию, необходимую для проведения биохимических реакций, т.е. для поддержания жизни организма.
Самый энергетически выгодный метод синтеза АТФ — это аэробное окислительное фосфорилирование. Однако АТФ может также образоваться в анаэробных условиях, хотя и с меньшей эффективностью. Существует три способа анаэробного синтеза АТФ: субстратное фосфорилирование, образование АТФ из фосфокреатина и в результате аденилаткиназной реакции. Хотя анаэробный синтез АТФ и не так энергетически выгоден, способность синтезировать АТФ в бескислородной среде может иметь жизненно важное значение.
Синтез АТФ путем субстратного фосфорилирования
На рис. 10.2 показано, что АТФ образуется в процессе гликолиза в ходе фосфоглицераткиназной и пируваткиназной реакций, а также в цикле Кребса в ходе реакции, катализируемой ферментом сукцинил-КоА-синтетазой с участием нуклеозидцифосфаткиназы (рис. 10.3). Примечание: для этих реакций кислород не требуется.
-
Рис. 10.2. Образование АТФ в ходе гликолиза путем субстратного фосфорилирования
-
Рис. 10.3. В цикле Кребса путем субстратного фосфорилирования образуется ГТФ, который затем под действием нуклеозиддифосфаткиназы превращается в АТФ
Получение АТФ из фосфокреатина
Фосфокреатин — это «аварийный запас» высокоэнергетического фосфата, который можно использовать для быстрого образования АТФ, необходимого для сокращения мышц в анаэробных условиях. Этот интенсивный механизм синтеза АТФ может в экстренных ситуациях спасти жизнь; однако запасы фосфокреатина расходуются очень быстро, всего за несколько секунд.
В периоды покоя, когда молекул АТФ много, креатинкиназа фосфорилирует креатин с образованием фосфокреатина. Особенно важна роль этой реакции в мышцах. Если вдруг требуется сделать резкий рывок, фосфокреатин фосфорилирует АДФ до АТФ, необходимого для сокращения мышц (рис. 10.4) По этой причине фосфокреатин еще называют «фосфаген».
Рис. 10.4. Образование АТФ из фосфокреатина при физической нагрузке и синтез фосфокреатина из креатина в период покояКреатин выводится в форме креатинина
Креатин — это аминокислота, не входящая в состав белков. Креатин синтезируется из аргинина и выводится с мочой в форме креатинина. Уровень креатинина в крови и клиренс креатинина используются для оценки скорости клубочковой фильтрации при нарушении работы почек. Примечание: не путайте креатин, креатинин и карнитин.
Прием креатина повышает работоспособность
Эргогенные средства — это вещества, которые повышают скорость, силу или выносливость спортсмена. Многие из них опасны и запрещены к использованию. Мнения противоречивы, тем не менее многие ученые сходятся на том, что креатин — единственное эргогенное средство, для которого научно доказано его свойство повышать работоспособность как при спринтерских, так и при продолжительных нагрузках.
Образование АТФ из АДФ под действием аденилаткиназы
После того как АТФ гидролизуется для высвобождения энергии, необходимой для сокращения мышц, в клетках образуется и накапливается АДФ. Но АДФ тоже содержит энергоемкую а-фосфоангидридную связь (рис. 10.1). Природа изобретательна: эта энергия становится доступной после того, как в анаэробных условиях две молекулы АДФ под действием аденилаткиназы образуют АТФ (рис. 10.5) (раньше фермент аденилаткиназу называли миокиназой).
Рис. 10.5. Образование АТФ из двух молекул АДФ в процессе аденилаткиназной реакцииАэробный синтез АТФ
Синтез АТФ в дыхательной цепи путем окислительного фосфорилирования
Митохондрия
Рис. 11.1. Схема строения митохондрииМитохондрия — это органелла, по размеру сопоставимая с бактериальной клеткой. Примечательно, что у митохондрии есть две мембраны. Наружная мембрана пронизана молекулами порина. Порины образуют каналы, по которым через мембрану могут проходить молекулы с массой менее 10 кДа. Внутренняя мембрана ПРАКТИЧЕСКИ непроницаема; она образует впячивания — кристы. Через внутреннюю мембрану свободно проходят только небольшие молекулы — вроде Н20 и NH3. Лишь немногие другие молекулы с помощью белков-переносчиков и челночных систем способны преодолеть этот барьер.
Считается, что митохондрия — пример эндосимбиоза. Внутренняя мембрана митохондрии с заключенным в ней содержимым когда-то была древней анаэробной бактерией, которая проникла в примитивную клетку на ранних этапах эволюции. Сохранились и следы прошлого: так, митохондрия имеет свою собственную ДНК (мтДНК), кодирующую 37 генов. 24 из них участвуют в трансляции мтДНК, остальные кодируют белки дыхательной цепи. Примечательно, что только 13 из всех белков митохондриальной дыхательной цепи (а всего их более 85) закодированы в мтДНК. Остальные кодирует ядерная ДНК, и они транспортируются в митохондрию из цитоплазмы.
Дыхательная цепь
Рис. 11.2. Транспорт электронов в дыхательной цепи. На схеме показан поток электронов от промежуточных метаболитов цикла Кребса (малата и сукцината) к кислороду по цепи переноса электронов, через комплексы I, II, III, IVДыхательная цепь — эффективный путь получения АТФ с использованием НАДН и ФАДН2, которые образуются в процессе окисления метаболического «топлива» [прежде всего углеводов и жирных кислот]. Дыхательная цепь состоит из пяти комплексов — I, II, III, IV и сложного комплекса грибовидной формы (комплекс V). Грибовидный «мультикомплекс» состоит из субъединиц F1 (субъединица «один») и F0 (субъединица «О», связывает олигомицин). Некоторые из комплексов дыхательной цепи содержат цитохромы, которые транспортируют электроны по цепи: комплекс III содержит цитохром b, а комплекс IV — цитохром а/аЗ. Кроме того, в транспорте электронов принимают участие убихинон (кофермент Q10) и цитохром С. Все комплексы дыхательной цепи расположены во внутренней мембране митохондрий. Комплексы I, III и IV не только переносят электроны, но также выполняют функцию молекулярных протонных насосов: они «выкачивают» протоны из матрикса в межмембранное пространство. Внутренняя мембрана непроницаема, в частности, она непроницаема для протонов, поэтому они возвращаются в матрикс только одним путем — через протонный канал комплекса F1/F0, который в этот момент синтезирует АТФ.
Поток электронов упрощенно показан на рис.
Патологии митохондрий
Существуют различные нарушения дыхательной цепи. Многие из них наследственно передаются по материнской линии, поскольку все митохондрии зиготы происходят из митохондрий яйцеклетки. При делении клетки тысячи молекул мтДНК случайным образом распределяются между дочерними клетками, поэтому разные ткани могут содержать как нормальные, так и мутантные молекулы мтДНК (это состояние называется гетероплазмией). Вследствие этого клиническая картина при таких патологиях очень изменчива. Мутации в ядерных генах, кодирующих белки дыхательной цепи, передаются по аутосомному типу и обычно вызывают более тяжелые нарушения.
Атрофия зрительного нерва Лебера
Атрофия зрительного нерва Лебера вызывается мутацией участка митохондриальной ДНК, который кодирует одну из субъединиц комплекса I. От этого нарушения дыхательной цепи митохондрий сильнее всего страдает, по-видимому, зрительный нерв. Болезнь проявляется во взрослом возрасте и приводит к потере зрения.
Митохондриальная энцефаломиопатия, лактацидоз и инсультоподобные эпизоды (синдром MELAS)
Причина синдрома MELAS — мутация гена мтДНК, кодирующего лейциновую транспортную РНК митохондрий. Эта мутация влияет на трансляцию мтДНК, и поэтому при синдроме MELAS нарушена структура всех комплексов дыхательной цепи, кроме комплекса II, который полностью кодируется ядерным геномом.
Болезнь Ли
Болезнь Ли — дегенеративное заболевание центральной нервной системы с характерными патологическими изменениями. Обычно развивается в раннем возрасте. Заболевание генетически гетерогенно: чаще всего причиной болезни являются мутации участков ядерных геномов, кодирующих компоненты дыхательной цепи, однако в некоторых случаях болезнь Ли развивается из-за мутаций митохондриальных генов. При болезни Ли может быть нарушена активность АТФ-синтетазы (комплекса V) или комплексов I, II, III, IV. При некоторых формах болезни Ли имеют место нарушения активности пируватдегидрогеназного комплекса.
Недостаточность пируватдегидрогеназного комплекса приводит к повышению в крови концентраций пирувата, лактата и аланина. У некоторых больных наблюдается улучшение состояния при приеме липоевой кислоты или тиамина (коферментов пируватдегидрогеназного комплекса). С ограниченным успехом применяется лечение кетогенной низкоуглеводной диетой. (Кетоновые тела легко проходят гематоэнцефалический барьер, и при их катаболизме образуется ацетил-КоА независимо от пируватдегирогеназного комплекса.)
Биосинтез АТФ путем окислительного фосфорилирования (часть I)
Биосинтез АТФ в дыхательной цепи, в котором принимает участие как поток электронов (е-), так и поток протонов (Н+), происходит путем окислительного фосфорилирования. Дыхательная цепь состоит из четырех комплексов (I, II, III, IV) и структуры грибовидной формы — АТФ-синтаза с субъединицами F0/F1 или комплекса V, который синтезирует АТФ из АДФ и неорганического фосфата (Фн). Ниже будет рассмотрено, как создается поток электронов и протонов в дыхательной цепи: первый начинается от комплекса I, второй — от комплекса II.
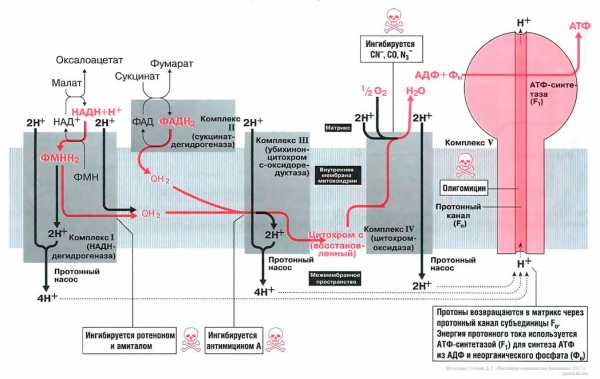
Комплекс I
Поток электронов начинается от НАДН. Энергия для синтеза АТФ возникает благодаря разделению зарядов в комплексе I, которое вызывает движение электронов (электрический ток) и протонов (протонный ток). Молекулярный насос комплекса I выкачивает четыре протона в межмембранное пространство. Другие комплексы (III и VI) тоже выкачивают протоны в межмембранное пространство, и образуется электрохимический градиент протонов; в конечном итоге все эти протоны возвращаются обратно через протонный канал АТФ-синтазы (см. ниже). В комплексе I электроны переносятся с НАДН на убихинон (кофермент Q). Два электрона и два протона восстанавливают убихинон до убихинола (Qh3), и убихинол движется в толще мембраны к комплексу III.
Комплекс II
Поток протонов начинается от ФАДН2. Комплекс II содержит ФАД в виде простетических групп нескольких дегидрогеназ (например, сукцинатдегидрогеназы). Этот ФАД восстанавливается до ФАДН2. Далее комплекс II передает электроны убихинону (Q) для последующего переноса электронов к комплексу III. Примечание, комплекс II не выкачивает протоны.
Комплекс III
В роли донора электронов выступает убихинол Qh3, который при этом окисляется до убихинона Q и в этом виде может возвращаться обратно и принимать следующую пару электронов и протонов. Убихинол передает электроны на цитохром, который транспортирует их в комплекс IV. Протонный насос комплекса III выбрасывает 4 протона в межмембранное пространство.
Комплекс IV
Электроны, поступившие от цитохрома с, передаются кислороду, и кислород полностью восстанавливается с образованием воды. Комплекс IV выбрасывает в межмембранное пространство только 2 протона.
АТФ-синтаза (комплекс V)
Этот комплекс состоит из «ножки гриба» — субъединицы F0, содержащей протонный канал, и из «выпуклой части» — АТФ-синтазы (или F1). Субъединица F0 получила свое название благодаря тому, что она ингибируется олигомицином, а субъединица F1 была первой открытой и выделенной «фракцией» среди всех элементов дыхательной цепи. Поток протонов проходит через протонный канал и запускает молекулярный двигатель, который заставляет АДФ и Фн реагировать друг с другом, образуя молекулы АТФ.
Чтобы синтезировать одну молекулу АТФ и транспортировать ее в цитозоль, требуется 4 протона. При окислении 1 молекулы НАДН+ высвобождается 10 протонов, энергия которых достаточно для образования 2,5 молекул АТФ. При окислении 1 молекулы ФАДН2 высвобождается 6 протонов, энергии которых достаточно для синтеза 1,5 молекул АТФ[1].
Утечка электронов приводит к образованию активных форм кислорода
Примерно 2% электронов высвобождаются из дыхательной цепи и связываются непосредственно с кислородом, образуя активные формы кислорода (АФК). Если работа дыхательной цепи нарушена, АФК образуются в большем количестве. Эти вещества повреждают митохондрии, вызывая все большие нарушения дыхательной цепи. Возникает порочный круг, и в результате из-за накопления различных повреждений под действием АФК происходит старение клетки.
Дыхательные яды
Вещества, которые ингибируют образование АТФ, потенциально токсичны для организма.
Амитал и ротенон блокируют транспорт электронов в комплексе I. Ротенон выделяют из корней растения деррис (Derris scandens) и нередко используют в качестве природного пестицида. Он малотоксичен для человека, поскольку плохо всасывается в желудочно-кишечном тракте. Однако ротенон ядовит для рыб, так как быстро всасывается через жабры. К тому же при долговременном воздействии ротенон опасен и для человека, так как вызывает развитие болезни Паркинсона.
Антимицин блокирует транспорт электронов в комплексе III.
Цианиды(CN-), угарный газ (СО) и азиды (N3-) ингибируют комплекс IV. Поэтому при отравлении цианидом блокируются аэробные метаболические процессы, несмотря на то что кровь достаточно насыщена кислородом. Из-за остановки аэробного метаболизма венозная кровь принимает цвет артериальной крови. Кроме того, наблюдается гипервентиляция, поскольку из-за накопления молочной кислоты стимулируется дыхательный центр.
Олигомицин блокирует протонный канал (F0 в комплексе V) и не дает протонам возвращаться в матрикс. Поэтому АТФ-синтаза (F1) теряет способность синтезировать АТФ.
Биосинтез АТФ путем окислительного фосфорилирования (часть II)
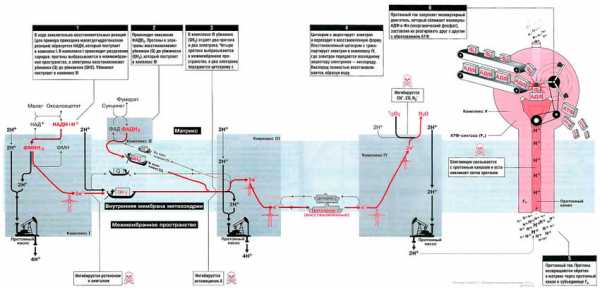
На рис. 13.1 показан поток электронов и протонов в дыхательной цепи. Электроны и протоны от НАДН+ через комплекс I и от ФАДН2 через комплекс II передаются комплексу III. Затем электроны транспортируются в комплекс IV, где они присоединяются к кислороду. В это время протоны выкачиваются протонными насосами из матрикса в межмембранное пространство и возвращаются обратно в матрикс через протонный канал F0-субъединицы АТФ-синтазы (комплекс V). Поток протонов (протонный ток) включает молекулярным двигатель — F1-субъединицу АТФ-синтазного комплекса, и она располагает молекулы АДФ и Фн таким образом, что они объединяются в молекулы АТФ.
Источники
- ↑ В отечественных учебниках биохимии принято считать эти значения равными «3» и «2» соответственно, т.е. при окислении 1 молекулы НАДН образуется 3 молекулы АТФ, а при окислении ФАДН2 — 2 молекулы АТФ, что отражает теоретический максимум синтеза АТФ.
sportguardian.ru
Синтез атф в митохондрии клетки
Синтез АТФ в митохондрии клеткиПревращение веществ и энергии в процессе диссимиляции проходит в три этапа.
1 этап. Подготовительный: сложные органические вещества под действием пищеварительных ферментов распадаются на простые, при этом выделяется только тепловая энергия. Белки расщепляются до аминокислот, жиры до глицерина и жирных кислот, крахмал до глюкозы.
2 этап. Гликолиз (бескислородный): происходит в цитоплазме, ферменты в нем не участвуют. Глюкоза расщепляется до молочной кислоты, при этом 40% выделившейся энергии идет на синтез АТФ.
3 этап. Гидролиз (Кислородный): осуществляется в митохондриях. Процесс происходит в матриксе и на внутренних мембранах. Процесс ферментативный. Расщеплению подвергается молочная кислота. Диоксид углерода выделяется из митохондрии в окружающую среду. Атом водорода (Н) включается в цепь ферментативных реакций в результате которых синтезируется АТФ. Реакции протекают в следующей последовательности:
1. Атом водорода с помощью ферментов переносчиков поступает во внутреннюю мембрану митохондрий, образующую кристы, где и окисляется.
2. Протон водорода выносится переносчиками на наружную поверхность мембраны крист. Для протонов эта мембрана непроницаема, поэтому она накапливаются в межмембранном пространстве, образуя протонный резервуар.
3. Электроны водорода переносятся на внутреннюю поверхность мембраны крист и тут же присоединяются к кислороду с помощью фермента оксидазы, образуя отрицательно заряженный активный кислород.
4. Разноименно заряженные ионы по обе стороны мембраны создают электрическое поле, и когда разность потенциалов достигает 200 мВ, начитает действовать протонный канал. Он возникает в молекулах ферментов АТФ-синтетазы, которые встроены во внутреннюю мембрану, образующую кристы.
5. Через протонный канал протоны водорода устремляются внутрь митохондрии, воздавая высокий уровень энергии, большая часть который идет на синтез АТФ, а протоны, взаимодействуя с активным кислородом, образуют воду и молекулярный кислород. Таким образом, кислород, поступающий в митохондрии в процессе дыхания, необходим для присоединения протонов водорода. При его отсутствии весь процесс в митохондриях прекращается, так как перестает функционировать электронно-транспортная цепь. Общая формула реакций третьего этапа:
Всего в процессе расщепления молекулы глюкозы образуется 38 молекул АТФ.
mognovse.ru
