Концентрация обозначения — Справочник химика 21
Количественное обозначение реакции среды можно упростить, если принять за основу так называемый водородный показатель pH, определяемый как десятичный логарифм концентрации водородных ионов, взятый с обратным знаком pH = —Ig [Н+]. Тогда [c.189]В работах [277, 278] принята только одна форма выражения молярной концентрации с(Х), но она более подходит для обозначения общей или аналитической концентрации, в то время как равновесная молярная концентрация, как отмечалось в гл. 1, должна иметь другое обозначение. Как и выше, сохраним для равновесной молярной концентрации обозначение в квадратных скобках [X]. [c.112]
Чтобы до некоторой степени облегчить трудоемкий аналитический расчет многокомпонентной ректификации и получить основные результаты возможно более простым путем, имеет смысл в первом приближении принять, что относительные летучести компонентов и величины мольных потоков флегмы и паров сохраняются постоянными по всей высоте секций колонны. Это позволяет опустить нижние индексы в обозначениях жидких и паровых потоков и представить уравнение концентраций, папример, укрепляющей секции в форме
Строчные буквы — концентрации веществ, обозначенных соответствующими заглавными буквами). [c.80]
Измеряемые и регулируемые параметры 1 — температура Р — давление С — расход С — концентрация. Обозначения приборов Я—показывающий Сг—сигнализирующий С—самопишущий И — интегрирующий Яз—изодромный [c.691]При поверке прежде всего вычисляют цену деления шкалы обоих ареометров. Для этого находят разность значений плотности (концентрации), обозначенных на двух соседних основных (циф-.ровых) штрихах шкалы, и делят разность на число делений, заключенных между этими штрихами. Кроме того, определяют все прочие характеристики ареометров, указанные на шкалах, и заносят их в протокол поверки. [c.568]
Далее обозначения ppm и % соответствуют массовым концентрациям, обозначения ppm об. и % об. — объемным. [c.6]
Если ввести для молярных концентраций обозначения Xq, Xq, у и j k для Ao.Aq. с и АоС соответственно, то для реакций (А) и (В) мы можем написать закон действующих масс в виде [c.65]
Здесь концентрация вещества уменьшается и в анодном, и в катодном пространствах. Сохраняя прежние обозначения, теперь можно написать [c.108]
Верхний индекс у обозначения предельных концентраций указывает ту ОПК, по которой они берутся. Так, в рассматриваемом случае, когда определяется минимальное флегмовое число, при котором из дистиллята исчезает -й комнонент, необходимо пользоваться граничными концентрациями ОПК ,, не содержащей (/ — — 1)-го компонента. [c.360]
X — характерная технологическая переменная (температура, концентрация, мольная доля) y — характерный основной размер (длина, объем, время) а — обозначение фазы, отличной от
Решение сформулированной выше задачи оптимизации удобнее провести в два этапа. Иа первом этапе можно определить, как должна изменяться концентрация х , реагента, 4 но длине реактора для того, чтобы обеспечить максимум выражения (VII,312), которое с учетом обозначений (VII,315) может быть записано как [c.370]
Принятые обозначения а —диаметр молекулы, см AI — относительная молекулярная масса N = 6,023-—число Авогадро С А — мольная концентрация вещества А, моль/дм Na = = N a-10 — число молекул вещества А в 1 см системы к — = RIN = 1,38-10 эрг/К — постоянная Больцмана Е — энергия активации. [c.220]
Во многих промышленных процессах с участием органических веществ проходят побочные реакции, в результате которых образуются нежелательные продукты. Из этого следует, что примеси и инертные вещества после превышения некоторой допустимой их концентрации необходимо удалять из рециркуляционного потока. Для исключения возможности накопления этих нежелательных веществ в системе после каждого цикла нужно отводить по крайней мере такое их количество, которое за то же время вводится в систему или образуется в результате превращения. Величина потока выводимых из системы примесей определяется на основании балансных расчетов. На рис. 1Х-62 такой поток обозначен как отходящий газ . [c.410]
Такой способ деления реакционной зоны на части, в которых условия проведения процесса различны, называется секционированием аппарата. На рис. 1Х-74 нанесена кривая равновесных концентраций аммиака в зависимости от температуры (р = 300 ат). Газы поступают в реактор из теплообменника при температуре 450°С. Реагируя в первой секции реактора (первый слой катализатора), газы нагреваются в результате выделения теплоты реакции в условиях, близких к адиабатическим реакционная смесь почти достигает состояния равновесия, обозначенного точкой Л (/ 635 °С). После прохождения через первый слой катализатора газы снова охлаждаются до температуры 450°С. Во второй секции, где происходит дальнейшее превращение, реакционная смесь приближается к состоянию равновесия, соответствующего точке В на кривой. В дальнейших этапах проведения процесса достигаются состояния, близкие к точкам С, О и Е. Как следует из рис. 1Х-74, высота слоев катализатора в направлении движения потока возрастает, поскольку скорость превращения уменьшается очень быстро.
П-26. Взаимодействие между формальдегидом (Ф) и я-фенолсульфонатом натрия М) протекает через восемь промежуточных реакций второго порядка (табл. 20). Используются обозначения, указанные в оригинальной литературе . Найти концентрации всех компонентов по истечении 60 мин, если исходные концентрации Ф и М составляют 0.1 кмоль м , а концентрации других компонентов равны нулю. [c.88]
В котором обозначения констант соответствуют приведенным на стр. 85. При постоянной концентрации протонов [Н» ] экспериментально было доказано, что записанная ниже дробь тоже является постоянной величиной [c.87]
Составы идеального раствора и его насыщенного пара различны, т. е. уфх. В данном случае легко найти связь между у я X. Ъ самом деле, концентрация второго компонента в паре у=р 1р. Подставив в это выражение значения р из уравнения (VI, 10а) и значение р из уравнения ( Ч, 11) и введя обозначение рур —а, получим [c.189]
Однако значения pH, основанные на аналитической концентрации ионов водорода, нельзя использовать в точных исследовательских работах, поскольку термодинамические свойства растворов зависят не от аналитической концентрации, а от активности находящихся в растворе ионов. Поэтому в настоящее время под термином pH принято понимать логарифм активности водородных ионов, взятый с обратным знаком (вместо pH в некоторых работах использовано обозначение рНд)
В этих уравнениях, согласно принятым нами обозначениям, а, л и у — стационарные концентрации компонентов А, X и V в реакторе соответственно V — объем жидкости в нем и и — объемная скорость потока. Так как скорость продукта на выходе из аппарата равна их, а скорость поступления свежего реагента должна быть равна и(а + х+у), то выход [c.111]
Принималось, что на всех стадиях протекают реакции первого порядка. Скорости реакции 1 и 2 пропорциональны концентрации компонента А, а скорости реакций 3 и 4 — концентрации компонента X. Употребляющиеся в дальнейшем обозначения имеют следующий смысл а, х, у, — стационарные концентрации компонентов А, X, У в первом смесителе а, х, у — эти же концентрации во втором смесителе G — массовая скорость V и V — объем газа в первом и втором смесителях Ма — количество компонента А, моль. [c.305]
ПДКпр (ДОК) — предельно допустимая концентрация (допустимое остаточное количество) химического соединения в продуктах питания, мг/кг В книге приняты также следующие обозначения и сокращения а—растворимость соединения в воде, г/л верхний индекс — температ)ра, °С при его отсутствии предполагается, что она равна 0°С М — молекулярная масса вещества [c.10]
При кристаллизации растворов Н2304, состав которых соответствует эвтектическим точкам В, В, Р и Н, образуется смесь двух твердых фаз. Для растворов, соответствующих по концентрации обозначенным на диаграмме особым точкам, характерно то, что состав выпадающей твердой фазы и состав жидкости одинаковы. Для всех остальных концентраций кислоты температура начала кристаллизации отличается от температуры начала плавления кристаллов. [c.15]
Исходя из уравнений линий концентраций нижней и верхней секций колонны и введя обозначения х и у для координат точкж их пересечения, можно записать [c.173]
Таких уравнений можно написать столько, сколько имеется в системе компонентов. Второй нижний индекс у обозначения концентраций в данном случае опущен для того, чтобы подчеркнуть, что эти уравнения пересчета псевдоконцентраций могут применяться для любой тарелки. Из выражений (V.23) и (VIII.109) непосредственно вытекает, что сумма псевдоконцентраций также равна единице [c.413]
Имея 1 пиду, что Ри,2 — = Ра1— ра сы. рио. 11.1), И ввсдя обозначение Ри,т для среднелогарифмического парциального давления комнонента и> и обозначение для сроднологарифмического значения его концевых концентраций [c.66]
Исходя из уравнений кривых концентраций верхней и нижней секций колонны и вводя обозначения Х и у1 для коордниат их точки пересечения, имеем [c.187]
Верхний индекс у обозначения граничных концентраций указывает ту ОПК, по которой онп берутся. Так, в рассматриваемом случае, когда определяется минимальное паровое число, при котором из остатка исчезает j-ii компонепт, пеобходимо пользоваться граничными концентрациями OHKj ), ио содержащий (/ —1,)-го компонеита- [c.347]
С принятыми в динамическом программировании обозначениями реакторы нумеруются в направлении, обратном применяемому в технологическо схеме. Состояние главного потока характеризуется концентрацией, пропорциональной расходу. Температура и время [c.347]
У денствптелыгостп стандартное состояние но может быть состоянием прп бесконечном ра. шеденни, так как оно должно представлять собой определенное термодинамическое состояние с фиксированным составом. Мы понимаем иод бесконечным разведением такое состояние системы, в котором взаимодействие между частицами растворенного вещества пренебрежимо мало, и в реальном стандартном состоянии система будет иметь, следовательно, некоторый состав, отвечающий этому идеальному условию. На практике чаще всего для обозначения концентрации пользуются молярностями, а за стандартное состояние обычно выбирается гипотетический одномолярный раствор , т. е. 1 М раствор, в котором взаимодействие растворенного вещества и растворителя равно нулю.
На рис. XVII. точкп, обозначенные кружком, относятся к изотерме Фрейндлиха, которая при 0 = 0,665 и 0 = 0,86 соответствует сложной изотерме Ленгмюра. В диапазоне концентраций (Л)/Л 2,1 от 0,5 до 8 обе изотермы имеют максимальное расхождение па 8% и среднее расхождение приблизительно на 2%, что указывает па хорошее соответствие, которое может быть достигнуто между ппмп. Подбором других параметров можно было бы установить соответствие и для болие низких давлений. [c.539]
Структурное застывание нефтяных продуктов вызывается образованием в них при охлаждении твердой фазы, частицы которой, достигнув известной концентрации, связываются между собой и образуют структуру, иммобилизующую всю массу продукта. Веществами, способными выделяться из нефтей и нефтяных продуктов описанным выше образом, являются содержащиеся в них кристаллизующиеся парафиновые углеводороды. Природа этих веществ была объяснена еще в двадцатых годах В. С. Твер-ципым [21], Б. Г. Тычининым [22], Л. Г. Гурвичем [23], Н. Д. Граменицким [24], Гольде [25] и другими исследователями и далее подтверждена многочисленными последующими работами. Здесь следует только уточнить, что термин парафины нужно понимать в данном случае не как обозначение углеводородов ряда алканов, а как наименование твердых, способных кристаллизоваться углеводородов нефти, в число которых могут входить, не только собственно парафиновые углеводороды, но и твердые кристаллические нафтеновые и ароматические углеводороды. Общим для этих углеводородов является их способность выделяться в тех или иных кристаллических формах из раствора в нефтяных продуктах при охлаждении. [c.14]
Для изотермических участков реактора уравнение (V,36), харак-7еризующее связь между концентрациями исходного реагента А и продукта реакции Р, в обозначениях функционала (V,44) имеет вид [c.230]
Тогда, пользуясь этими и ранее введенными обозначениями, рассчитаем концентрацию этила[1етата в исходной смеси [c.255]
По уравнениям (IX,38), (1Х,39) и (1Х,40) находим fe =2,l см/сек k = = 0,035 см1сек а = 2,91 см (в этом примере символом обозначен коэффициент массоотдачи в газовой фазе, в котором движущая сила выражена в единицах концентрации, в отличие от кд, для которого она выражается в единицах парциального давления). [c.201]
chem21.info
Концентрация — Как в химии обозначается концентрация? — 22 ответа
Как обозначается
В разделе Естественные науки на вопрос Как в химии обозначается концентрация? заданный автором Ирина Носова лучший ответ это Значок — С
Ответ от 22 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: Как в химии обозначается концентрация?
Ответ от Mr.Freeman[гуру]Концентрация
Кроме долей компонентов в смеси или растворе для количественной характеристики состава системы используется величина, которая называется концентрация компонента, или просто концентрация.
Концентрация компонента Б – отношение количества вещества компонента Б к объему системы.
Единица измерений концентрации [сБ] = 1 моль/м3, но чаще – 1 моль/л. В последнем случае концентрация компонента Б показывает, какое количество вещества этого компонента содержится в 1 литре раствора. Например, при концентрации 0,25 моль/л в одном литре раствора содержится четверть моля растворенного вещества.
В химии часто используется специальная терминология для обозначения концентраций. Так раствор с концентрацией компонента 1 моль/л называется одномолярным раствором этого вещества и обозначается 1М. » 1М раствор КОН в h30″ читается: » одномолярный раствор гидроксида калия в воде». В обозначении молярности раствора применяются десятичные приставки, например:
0,1М раствор – децимолярный раствор;
0,01М раствор – сантимолярный раствор;
0,001М раствор – миллимолярный раствор;
0,2М раствор – двудецимолярный раствор;
0,05М раствор – пятисантимолярный раствор;
0,025М раствор – двадцатипятимиллимолярный раствор.
Последняя запись, например, означает, что в 1 л раствора содержится 0,025 моль растворенного вещества.
Ответ от White Rabbit[гуру]
Что значит как обозначается? В уравнениях, что ли?
Как хотите конечно.
Но чаще всего — двумя способами — бувой «с» или химическим символом в квадратных скобках:
c(Ag+) = [Ag+]
Ответ от VOA[гуру]
Концентрация обозначается латинской буквой С. Размерность чаще всего:
мол. %(мольные проценты) , масс. %(массовые проценты) , об. %(обьемные проценты) , моль/м^3, ат/см^3 (чаще в физике).
Ответ от Павел[гуру]
Вопрос к целому разделу о выражении химических концентраций, ибо их много)) )
Массовая доля — w%, размерность — %
Объемная доля — fi%, размерность — %
Мольная доля — Х%, размерность — %
Молярная концентрация (молярность) — M, Сm, C, c, […], размерность — моль/л
Моляльная концентрация (моляльность) — m, размерность — моль/кг
Нормальная концентрация (нормальность, молярная концентрация эквивалента) — N, Cn, размерность — моль-экв. /л, экв. /л
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Концентрация растворов на Википедии
Посмотрите статью на википедии про Концентрация растворов
Таблица математических символов на Википедии
Посмотрите статью на википедии про Таблица математических символов
Ответить на вопрос:
22oa.ru
Обозначение концентрации растворов и их прописывание
Свойства растворов зависят от соотношения между количествами их составных частей, то есть от концентрации, под которой понимают количество лекарственного средства, растворенного в определенном количестве растворителя. Концентрацию растворов выражают различными единицами: весовыми процентами, молярностью, нормальностью, моляльностью и т. п.
В рецептах концентрацию растворов обозначают следующими способами:
1. Указывают концентрацию лекарственного вещества в процентах (которая показывает весовое количество растворенного вещества в граммах в 100 мл раствора).
Rp.: Solutionis Kalii iodidi 2 % 200 ml
Da. Signa.
2.Указывают количества лекарственного вещества и растворителя.
Rp.: Kalii iodidi 4,0
Aquae purificatae 200 ml
Misce. Da. Signa.
3. Указывают количество лекарственного вещества и общий объем раствора, который достигается добавлением прописанного растворителя (обозначается с помощью лат. ad — до).
Rp.: Kalii iodidi 4,0
Aquae purificatae ad 200 ml
Misce. Da. Signa.
4. Указывают отношение количества прописанного лекарственного вещества к общему количеству получаемого раствора с помощью лат. ех — из.
Rp.: Solutionis Kalii iodidi ex 4,0 — 200 ml
Da. Signa.
Несмотря на разные способы прописывания растворов калия йоди-да, его объем равен 200 мл, количество лекарственного вещества составляет 4,0 г.
5. Указывают степень разведения лекарственного вещества, например, 1:1000, 1:5000, 1:10000 и объем этого раствора.
Rp.: Solutionis Furacilini (1:5000) — 200 ml
Da. Signa.
Из всех приведенных способов чаще всего применяется способ обозначения концентрации раствора в процентах.
Водные растворы
При приготовлении водных растворов и других жидких лекарственных форм нужно точно придерживаться правил, приведенных выше. Приготовление растворов. Для приготовления жидких лекарственных форм используют лекарственные средства фармакопейного качества. Если лекарственное вещество в ГФ указано в кристаллическом и обезвоженном виде, то используют вещество в кристаллическом виде. В зависимости от свойств лекарственных веществ, их растворимости, устойчивости и назначения растворов различают несколько способов их приготовления.
Растворы с легкорастворимыми лекарственными веществами. Растворение подавляющего большинства твердых веществ носит самопроизвольный характер, особенно в тех случаях, когда в прописанных растворах концентрация лекарственных веществ далека от предела растворимости.
При расчете количества воды очищенной учитывают процентное содержание лекарственного вещества (или суммы веществ). Если растворы готовят в концентрации до 3 %, то воды, берут по объему столько, сколько прописано раствора в рецепте, так как при растворении небольшое количество лекарственного вещества существенно не изменяет объем раствора. Например:
Rp.: Solutionis Analgini 2 % — 150 ml
Da. Signa. По 1 столовой ложке 3 раза в день
Микстура-раствор с хорошо растворимым сильнодействующим лекарственным веществом, выписанным в количестве до 3 %.
Если в растворах для внутреннего применения прописаны ядовитые и сильнодействующие вещества, то прежде всего обращают внимание на правильность их дозировки.
Расчет: Анальгина 3,0 г
2,0 — 100 мл
х — 150 мл
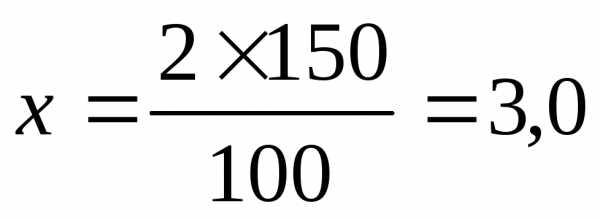
Воды очищенной 200 мл
Проверка доз: Объем раствора — 150 мл
число приемов — 150 : 15 = 10
л.р.д. 3,0 : 10 = 0,3 г
в.р.д. = 1,0 г
л.с.д. 0,3 * 3 = 0,9 г
в.с.д. = 3,0 г
Дозы не завышены
В подставку отмеривают 150 мл воды очищенной. Отвешивают 3,0 г анальгина, высыпают в подставку и растворяют. Процеживают во флакон для отпуска. Укупоривают и оформляют.
Растворы в концентрации выше 3 % готовят в мерной посуде или рассчитывают количество воды с помощью коэффициентов увеличения объема (см. приложение 2 к приказу МЗ Украины М 197 от 07.09.93 г.).
Коэффициент увеличения объема (мл/г) показывает прирост объема раствора (мл) при растворении 1,0 г вещества при 20 °С.
Rp.: Solutionis Magnesii sulfatis 20 % — 150 ml
Da. Signa. По 1 столовой ложке 3 раза в день
Микстура-раствор с хорошо растворимым лекарственным веществом магния сульфатом (кристаллогидрат), выписанным в количестве свыше 3 % . Измельчать магния сульфат предварительно не требуется, так как он легко растворим в воде.
Технология раствора с использованием мерной посуды. В мерный цилиндр помещают примерно 80 мл воды очищенной. На ВР-100 отвешивают 30,0 г магния сульфата, высыпают в цилиндр и перемешивают до полного растворения с помощью стеклянной палочки. Затем доводят раствор до объема 150 мл. Процеживают в заранее подобранный флакон и соответственно оформляют к отпуску.
ППК
Дата № рецепта
Magnesii sulfatis 30,0
Aquae purificatae ad 150 ml
Vобщ. = 150 ml
Приготовил: (подпись)
Проверил: (подпись)
Технология раствора с использованием коэффициента увеличения объема (КУО). Для магния сульфата КУО равен 0,50.
Расчет: Магния сульфата 30,0 г
Воды очищенной 150 мл — (30,0*0,50) = 135 мл В подставку отмеривают 135 мл воды очищенной, в которой растворяют 30,0 г магния сульфата, процеживают во флакон для отпуска и оформляют.
ППК
Дата № рецепта
Aquae purificatae 135 ml
Magnesii sulfatis 30,0
Vобщ.= 150 ml
Приготовил: (подпись)
Проверил: (подпись)
Исключением из этого правила является раствор натрия тиосульфата 60 %-ный, применяемый для лечения чесотки.
Rp.: Solutionis Natrii thiosulfatis 60 % — 100 ml
D.S. Наружное (раствор № 1)
Пропись этого раствора — авторская, поэтому его готовят по массе (60,0 г + 40,0 г) = 100,0 г. Если необходимо приготовить 100 мл раствора в массо-объемной концентрации, следует произвести определенные расчеты. 100,0 г 60 %-ного раствора натрия тиосульфата занимает объем 73,5 мл, поэтому для приготовления 100 мл раствора следует взять натрия тиосульфата 81,63 г:
60,0 -73 5 мл
х — 100 мл
В мерной посуде в части воды растворяют 81,63 г натрия тиосульфата и объем раствора доводят водой до 100 мл (или готовят с учетом КУО натрия тиосульфата: 100 — (81,63 · 0,51) = 58 мл).
Запрещается готовить раствор путем растворения 60,0 г натрия тиосульфата и доведением полученного раствора до объема 100 мл, так как массо-объемная концентрация лекарственного вещества в растворе составит только 46,37 % .
Особые случаи приготовления растворов. Эта группа растворов достаточно обширна. Приготовление каждого из них имеет свои особенности.
Растворы с медленно растворимыми лекарственными веществами. Медленная растворимость лекарственных веществ в воде может быть обусловлена различными факторами: прочностью кристаллической решетки, малой скоростью диффузии тяжелых ионов или относительно плохой смачиваемостью лекарственного вещества растворителем. Для ускорения растворения используют дополнительные технологические приемы: растворение в горячем растворителе или измельчение в ступке.
К медленно растворяющимся в холодной воде относятся термостойкие лекарственные вещества: кислота борная, натрия тетрабо-рат, квасцы алюмокалиевые, кофеин, кальция глюконат, меди сульфат, этакридина лактат, фурацилин и др.
Rp.: Solutionis Acidi borici 2 % — 200 ml
Da. Signa. Для полоскания полости рта
1,0 г кислоты борной растворяется в 25 мл холодной воды и в 4 мл кипящей воды, поэтому ее растворяют в горячей воде при взбалтывании. Мерным цилиндром отмеривают 200 мл горячей воды, переливают в подставку и растворяют при перемешивании 4,0 г кислоты борной. Раствор после охлаждения процеживают во флакон для отпуска.
Rp.: Solutionis Cupri sulfatis 3 % — 200 ml
Da. Signa. Для спринцеваний
Раствор для наружного применения с медленно растворимым крупнокристаллическим лекарственным веществом. Растворимость меди сульфата в воде хорошая 1:3. Однако, вследствие плохой смачиваемости водой кристаллов (вещество крупнокристаллическое) растворение ускоряют растиранием в ступке с водой.
В подставку отмеривают 200 мл воды. В ступку помещают 6,0 г меди сульфата и растворяют при растирании с частью воды, затем добавляют оставшуюся воду. Раствор предназначен для спринцевания, поэтому его фильтруют во флакон для отпуска. Флакон укупоривают и оформляют к отпуску.
Rp.: Solutionis Furacilini (1:5000) — 250 ml
Da. Signa. Для полоскания
Раствор для наружного применения с малорастворимым в воде (1:4200) веществом. Растворы фурацилина готовят на изотоническом растворе натрия хлорида (0,9 %), усиливающем фармакологическое действие фурацилина.
В колбу из термостойкого стекла отмеривают 250 мл воды очищенной, добавляют 2,25 г натрия хлорида и 0,05 г фурацилина (отвешенного с учетом правил для красящих веществ). Содержимое нагревают в колбе до полного растворения фурацилина и процеживают во флакон для отпуска. Оформляют к отпуску.
Растворы кодеина. Кодеин медленно и малорастворим в холодной воде очищенной (1:150), растворим в горячей (1:17), легкорастворим в 90 % спирте (1:2,5), в разведенных кислотах, поэтому приготовление его растворов имеет свои особенности. Например, при приготовлении 100 мл 1 %-ного раствора кодеина 1,0 г вещества растворяют в 3 мл 95 % этилового спирта (в мерном цилиндре или колбе) путем легкого взбалтывания. Спиртовой раствор разбавляют водой очищенной до получения объема 100 мл. При необходимости процеживают. Полученный раствор можно хранить в течение 10 дней.
Растворы кальция глюконата. Кальция глюконат трудно и медленно растворяется в холодной воде (1:50), легко — в кипящей (1:5), практически не растворим в этиловом спирте. Растворы готовят 5—10 %-ной концентрации, применяя особые технологические приемы, так как при нагревании он может образовывать устойчивые пересыщенные растворы. Для очистки растворов кальция глюконата добавляют активированный уголь в количестве 3—5 % от массы вещества.
Rp.: Solutionis Calcii gluconatis 5 % — 100 ml
Da. Signa. По 1 чайной ложке 2—3 раза в день перед едой
В колбу из термостойкого стекла помещают 5,0 г кальция глюконата, добавляют 97,5 мл воды очищенной и нагревают до полного растворения вещества. К раствору добавляют 0,25 г измельченного активированного угля (1 таблетку карболена) и кипятят на слабом огне в течение 10 минут, несколько раз взбалтывая содержимое колбы.
Раствор фильтруют горячим через бумажный фильтр. После охлаждения (20 °С) полученный раствор доводят до объема 100 мл, проверяют на прозрачность (раствор должен быть бесцветным) и переливают во флакон, который укупоривают и оформляют к отпуску.
Растворы ртути дихлорида. Применяется как сильное антисептическое средство в виде 0,1 %-ного раствора на кожу и 0,1—0,2 %-ного раствора на слизистые оболочки. Сулема медленно растворяется в холодной воде (1:18,5), при нагревании ее растворимость повышается (1:3).
Rp.: Solutionis Hydrargyri dichloridi (1:1000) — 200 ml
Da. Signa. Для дезинфекции кожи
Раствор для наружного применения с особо ядовитым медленно растворимым в воде веществом. Обращают внимание на оформление рецепта и лекарственного препарата.
В подставку отмеривают 200 мл теплой очищенной воды, растворяют 0,2 г ртути дихлорида (сулемы), отвешенной по правилам отвешивания ядовитых лекарственных веществ, подкрашивают раствором эозина (1 %) и процеживают сквозь вату во флакон для отпуска. Укупоривают, опечатывают сургучной печатью, приклеивают этикетки «Яд» (с изображением черепа со скрещенными костями), «Обращаться с осторожностью», «0,1 % раствор ртути дихлорида». На сигнатуре делают отметку о том, что раствор подкрашен эозином.
При приготовлении растворов очень малой концентрации ртути дихлорид лучше растворить вначале в пробирке в небольшом количестве воды (при нагревании), а при приготовлении более концентрированных растворов, предназначенных для дезинфекции, рекомендуется добавлять равное количество натрия хлорида. Добавление натрия хлорида несколько снижает дезинфицирующие свойства раствора, но при этом исчезает кислая реакция раствора и предупреждается выпадение основных солей, которые могут образовываться в результате гидролиза ртути дихлорида.
В аптеках для ускорения работы часто пользуются концентрированным раствором ртути дихлорида (1:10), который содержит одинаковое количество вещества, натрия хлорида и эозина. Раствор можно готовить также путем растворения таблеток, которые выпускаются массой по 0,5 и 1,0 г, содержат смесь равных количеств ртути дихлорида и натрия хлорида, подкрашенных эозином. В ГФ X имеется пропись таблеток для приготовления растворов сулемы для наружного применения следующего состава:
Ртути дихлорида 0,5 или 1,0 г
Натрия хлорида 0,5 или 1,0 г
Эозина — достаточное количество
Концентрированный раствор и таблетки ртути дихлорида также должны храниться в шкафу для ядовитых веществ. Растворы фенола.
Rp.: Solutionis Phenoli puri 2 % — 100 ml
Da. Signa. Для промывания
Раствор для наружного применения с пахучим лекарственным веществом. Фенол кристаллический (кислота карболовая) очень медленно растворяется в воде. Для удобства приготовления его водных растворов исходят из жидкого фенола (Phenolum purum liquefaction), который готовится путем добавления к 100,0 г фенола, расплавленного на водяной бане, 10 мл воды. Исходя из этого, жидкого фенола берут на 10 % больше, чем кристаллического. По приведенному рецепту для приготовления раствора отмеривают 97,8 мл воды и добавляют 2,2 мл жидкого фенола.
Фенол в чистом виде или в растворах с концентрацией выше 5 % отпускают с этикетками «Обращаться с осторожностью», «Кислота карболовая».
Растворы с лекарственными средствами — сильными окислителями. Серебра нитрат и калия перманганат — сильные окислители. Они легко разрушаются в присутствии органических веществ, в частности, при фильтровании растворов. Кроме того, фильтровальная бумага значительно адсорбирует ионы серебра (до 3 мг на 1,0 г бумаги). Поэтому окислители лучше растворять в предварительно профильтрованной или процеженной воде, а при необходимости фильтровать через стеклянный фильтр № 1 или № 2. Установлено, что разрушение окислителей снижается с уменьшением концентрации растворов (до 5 %) и особенно, если фильтр и вату предварительно промыть горячей водой, то концентрация существенно не изменяется.
Rp.: Solutionis Kalii permanganatis 0,1 % — 300 ml
Da. Signa. Для промывания ран
В предварительно подготовленный флакон для отпуска оранжевого стекла отмеривают 300 мл свежеперегнанной профильтрованной воды очищенной и растворяют в ней 0,3 г калия перманганата, осторожно отвешенного на ВР-1 на кружочке пергаментной бумаги (красящее вещество; пыль калия перманганата раздражает носоглотку). После полного растворения вещества раствор оформляют к отпуску в темном флаконе (во избежание активации процесса восстановления).
Важное условие получения устойчивых растворов — применение доброкачественной воды очищенной, не содержащей органических веществ. Необходимо применять только свежеперегнанную воду. Вода, хранившаяся более суток, часто оказывается загрязненной микроорганизмами и продуктами их жизнедеятельности, обладающими восстановительной способностью.
Если калия перманганат прописан в виде концентрированного раствора (3, 4, 5 %), то для ускорения растворения его осторожно растирают в ступке с частью теплой процеженной очищенной воды, а затем добавляют остальное количество растворителя.
Rp.: Argenti nitratis 0,12 г
Aquae purificatae 200 ml
Da in vitro nigro
Signa. По 1 столовой ложке 3 раза в день перед едой
Микстура — раствор с легко разлагающимся ядовитыми лекарственным веществом. Необходимо проверить разовую и суточную дозы.
Во флакон для отпуска темного стекла отмеривают 200 мл профильтрованной воды очищенной и растворяют в ней 0,12 г серебра нитрата. В случае загрязнения раствор профильтровывают через стеклянный фильтр № 1. При отсутствии стеклянного фильтра можно процедить раствор через ватный тампон, тщательно промытый горячей водой. Растворы серебра нитрата отпускают в опечатанном виде с этикеткой «Обращаться с осторожностью». Отпуск растворов с концентрацией выше 2 % производится только в руки врача или по его доверенности. При приготовлении соблюдают все правила работы с ядовитыми веществами. Оформляют сигнатурой (с надписью «Для внутреннего употребления»).
Растворы с лекарственными веществами, образующими растворимые соли. Растворы йода. Кристаллический йод растворим в воде 1:5000. Для медицинских целей применяются растворы йода с концентрацией не менее 1 %. Для получения более концентрированных растворов используют способность йода образовывать легкорастворимые комплексные соединения с калия или натрия йоди-дами (образуются периодиды). Наиболее распространенные в медицинской практике растворы Люголя: 5 % -ный — для внутреннего и 1 %-ный — для наружного применения (табл. 16).
Если в рецепте калия иодид не указан то его добавляют в двойном количестве по отношению к массе прописанного йода.
Состав водных растворов Люголя (мануальные прописи)
-
Наименование
Количество вещества, г
Для внутреннего применения
Для наружного применения
Йода кристаллического
1,0
1,0
Калия йодида
2,0
2,0
Воды очищенной
До 20 мл
До 100 мл
В аптеках наиболее часто готовят водный и глицериновый растворы Люголя. Водные растворы применяют внутрь по 5—10 капель на молоке для лечения и профилактики эндемического зоба и других заболеваний, а также наружно для смазывания слизистой оболочки глотки, гортани; глицериновые растворы йода применяют только наружно.
Rp.: Solutionis Lugoli 20 ml
Da. Signa. По 7 капель З раза в день после еды на молоке
Йод — сильнодействующее вещество. В ГФ X приведены высшая разовая и суточная дозы для 5 % -ного спиртового раствора йода в каплях. В таблице капель приведены данные только для 5 % -ного спиртового раствора йода (1,0 г — 49 кап.; 1 мл — 48 кап.). Поскольку в рецепте выписан водный раствор йода, необходимо найти соотношение между количеством капель в водном и спиртовом растворах йода.
1 г 5 % спирт, р-ра йода – 49 капель
1 г 5% водн. р-ра йода – 20 капель
20 кап. 5%воднр.райода соответствует 49 кап. 5%спиртр.райода
1 кап. 5%водн_ р.ра йода — х кап. 5%спиртр.райода
1 кап. 5%воднррайода — 2,45 кап. 5%спирт. р.райода
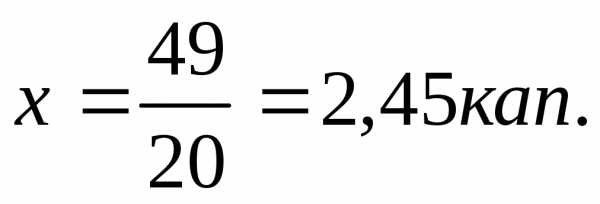
Исходя из этого соотношения проверяют дозы:
л.р.д.: 7 · 2,45 = 17,5 кап. 5% спирт, р-ра иода
л.с.д.: 17,5 · 3 = 51,45 кап.5 % спирт, р-ра иода
в.р.д. — 20 кап.;
в.с.д. — 60 кап.
Дозы не завышены
Расчет: Йода 1,0
Калия йодида 2,0
Воды очищенной с учетом КУО йода в р-ре калия йодида = 0,23
КУОкалия йодида = 0,25
20 — (0,23 + 0,25 • 2) = 19,3 мл.
В данном случае коэффициент увеличения объема можно не учитывать, так как на объем 20 мл допустимое отклонение составляет ± 4 %.
Отвешивают 2,0 г калия йодида, помещают во флакон для отпуска и растворяют приблизительно в 2 мл воды очищенной (растворимость 1:0,75), предварительно отмеренной во флакон для отпуска (20 мл). На кружочке пергаментной бумаги отвешивают 1,0 г йода и высыпают в подставку. Вследствие летучести йода и способности его паров действовать на металл (призмы и коромысло весов) взвешивание должно производиться по возможности быстро. Чашки весов после отвешивания йода вытирают ватой, смоченной крепким спиртом (для удаления остатков йода, пары которого ядовиты). После полного растворения кристаллического йода в концентрированном растворе калия йодида добавляют весь растворитель и при необходимости раствор процеживают через небольшой ватный тампон во флакон для отпуска из оранжевого стекла, укупоривают резиновой или полиэтиленовой пробкой.
Растворы осарсола. Осарсол — препарат мышьяка. Очень малорастворим в воде, легко — в растворе натрия гидрокарбоната. В данном случае в результате реакции нейтрализации образуется водорастворимая соль осарсола. Если натрия гидрокарбонат в рецепте не указан, то его добавляют из расчета 0,61 г на 1,0 г осарсола.
Rp.: Osarsoli 1,5
Iodi 0,06
Kalii iodidi 0,3
Natrii hydrocarbonatis 4,0
Glycerini 15,0
Aquae purificatae 15 ml
Misce. Da. Signa. Для влагалищных тампонов
Натрия гидрокарбонат растворяют в воде и к раствору добавляют осарсол при постоянном взбалтывании (соблюдая правила работы с ядовитыми веществами). Калия йодид растворяют в нескольких каплях воды, исходя из его растворимости (1 : 0,75). В концентрированном растворе калия йодида растворяют йод, добавляют глицерин и затем раствор осарсола. Оформляют к отпуску в соответствии с правилами.
Растворы с лекарственными веществами, взаимно ухудшающими растворимость. Известно, что растворение твердых веществ может сопровождаться химическим изменением с образованием новых веществ.
Rp.: Natrii benzoatis 4,0
Solutionis Calcii chloridi 5 % — 150 ml
Misce. Da. Signa. По 1 столовой ложке 3 раза в день
В процессе приготовления микстуры по общим правилам образуется осадок плохо растворимого в воде кальция бензоата. Поэтому готовят данный лекарственный препарат раздельно в двух подставках, смешивая рассчитанные количества воды и концентрированных растворов, после чего оба раствора сливают во флакон для отпуска — получается прозрачный раствор.
studfiles.net
Урок 15. Моляльность и молярность – HIMI4KA
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.

Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (Nh5)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Обозначение — концентрация — Большая Энциклопедия Нефти и Газа, статья, страница 3
Обозначение — концентрация
Cтраница 3
Следует по учебнику хорошо ознакомиться с принятыми способами выражений и обозначений концентраций. Ниже приведена лишь краткая их сводка. [31]
Этот способ обозначения концентрации имеет ряд преимуществ перед другими способами обозначения концентрации растворов. [32]
Множественность параметров распределения частиц в пылевом облаке предполагает разнообразия способов обозначения воздушных концентраций: концентрация на основе массы, количественная концентрация, концентрация поверхностных областей и концентрация, выраженная размерными категориями. Таким образом, может быть построено множество показателей воздействия, и при этом необходимо дать оценку токсикологической значимости каждого из них. Современные стандарты медицины труда отражают эту множественность. Для асбеста стандарты основаны на количественном определении концентрации волокнистых частиц определенного геометрического размера. Для кремния и угля стандарты основаны на определении массы вдыхаемых частиц. Также были разработаны стандарты для оценки воздействия смесей частиц с содержанием кварца. На данный момент стандартов, основанных на поверхностно-активных характеристиках частиц, не существует. [33]
Аналитические расчеты, которые необходимо производить при переходе от одного способа обозначения концентрации к другому, продолжительны и для этой цели целесообразнее применять графические методы, особенно, когда приходится иметь дело с большим количеством пересчетов. [35]
Здесь приведен состав раствора в двойных молях для знакомства с такой формой обозначения концентрации. [36]
Что понимается под концентрацией алмазов в круге я какая условность допускается в обозначении концентраций алмазов. [38]
В литературе по физике твердого тела эта схема используется редко, и для обозначения концентрации часто используют символ N с соответствующим индексом, указывающим, к чему относится концентрация. [39]
Выразив через х долю уменьшения концентрации кислорода за время т, подставив принятые ранее обозначения концентраций компонентов ( стр. [40]
Выразив через х долю уменьшения концентрации кислорода за время т и подставив принятые ранее обозначения концентраций компонентов ( стр. [41]
В нем в круглые скобки взяты активности ( дальше круглые скобки будем использовать для обозначения активности, квадратные — для обозначения концентрации), а индекс eq указывает, что они относятся к моменту равновесия. [42]
На рис. VI-23 представлена схема промывки, на которой каждый из п последовательных слоев осадка изображен в виде квадрата с обозначением концентрации растворимого вещества в промывной жидкости c i и в жидкости в порах осадка c i, расход промывной жидкости и объем жидкости в порах осадка одинаковы для всех слоев. [44]
Страницы: 1 2 3 4
www.ngpedia.ru
Концентрация различные обозначения — Справочник химика 21
Состав раствора М, выраженный в различных обозначениях концентраций [c.21]Для коэффициентов активности используются различные обозначения в зависимости от способа выражения концентрации в уравнении для активности а [c.119]
Как известно, процент растворения обладает большой качественной и количественной специфичностью. Суш ественную роль играет природа растворяемого вещества и растворителя. Одно и то же вещество в разной степени растворимо в различных растворителях. Сходные отношения имеют место и нри растворении разных веществ в одном и том же растворителе. Специфичность процесса растворения вынуждает вводить необходимое для практических целей понятие о растворимости вещества в том или другом растворителе. Растворимость вещества принято определять как концентрацию раствора, насыщенного при данных условиях. В фармацевтической практике при составлении различных таблиц растворимости и других справочных пособий растворимость вещества чаще всего обозначают в виде отношения количества растворенного вещества к количеству насыщенного раствора, которое можно из него приготовить. Обычно это отношение приводится к 1 части по массе растворимого вещества (например, 1 3, 1 150, 1 1320 и т. д.). В других случаях растворимость определяется предельным количеством вещества, растворимым в 100 частях растворителя (например, 0,04 1,3 129). Приведенные в скобках обозначения показывают, что в 100 частях растворителя соответственно растворяется 0,04 1,3 и 129 г вещества). Очень часто растворимость обозначают процентной концентрацией насыщенного раствора. При практическом использовании справочных пособий, в том числе таблиц растворимости, необходимо ясно представлять себе, какой именно способ обозначения растворимости принят в данном источнике. [c.149]
Массовый коэффициент ослабления играет очень важную роль в количественном анализе. Как возбуждающее первичное излучение, так и флуоресцентное излучение ослабляются в пробе. Для того чтобы связать наблюдаемую интенсивность флуоресценции с концентрацией, необходимо учитьшать это ослабление. Поскольку массовый коэффициент ослабления очень велик для рентгеновского излучения малой энергии (длинноволнового), точное определение легких элементов представляет большую сложность в РФС. В табл. 8.3-4 указаны массовые коэффициенты ослабления для некоторых элементов при различной энергии рентгеновского излучения, соответствующей характеристическим рентгеновским линиям. Обозначение К-Ьз,2, используемое в табл. 8.3-4, относится к линии Ка (см. с. 65). [c.63]
Такой способ деления реакционной зоны на части, в которых условия проведения процесса различны, называется секционированием аппарата. На рис. 1Х-74 нанесена кривая равновесных концентраций аммиака в зависимости от температуры (р = 300 ат). Газы поступают в реактор из теплообменника при температуре 450°С. Реагируя в первой секции реактора (первый слой катализатора), газы нагреваются в результате выделения теплоты реакции в условиях, близких к адиабатическим реакционная смесь почти достигает состояния равновесия, обозначенного точкой Л (/ 635 °С). После прохождения через первый слой катализатора газы снова охлаждаются до температуры 450°С. Во второй секции, где происходит дальнейшее превращение, реакционная смесь приближается к состоянию равновесия, соответствующего точке В на кривой. В дальнейших этапах проведения процесса достигаются состояния, близкие к точкам С, О и Е. Как следует из рис. 1Х-74, высота слоев катализатора в направлении движения потока возрастает, поскольку скорость превращения уменьшается очень быстро. [c.424]
Составы идеального раствора и его насыщенного пара различны, т. е. уфх. В данном случае легко найти связь между у я X. Ъ самом деле, концентрация второго компонента в паре у=р 1р. Подставив в это выражение значения р из уравнения (VI, 10а) и значение р из уравнения ( Ч, 11) и введя обозначение рур —а, получим [c.189]
На рис. 18 приведены результаты расчетов [2] разделения метано-водородной фракции при минус 158 °С с различной концентрацией водорода. В расчетах принято, что при дросселировании жидкого метана давление его снижается от первоначального, обозначенного на рисунке, до 0,13 МПа перепад температуры на холодном конце холодильника составляет 3 °С, потери холода через изоляцию равны 836 кДж на 1000 м исходного газа. Газ с содержанием 60% Нз следует предварительно охладить с использованием аммиачной холодильной установки, что, естественно, усложняет установку газоразделения. [c.48]
Концентрацию этанола в водно-спиртовых растворах принято называть крепостью. Крепость выражают в объемных процентах при 20° С и определяют ее при помощи стеклянных или металлических спиртомеров. Металлический спиртомер (рис. 36) представляет собой латунный, полый, позолоченный ареометр. К нижней части шара припаяна пластинка с расширением на конце, служащая грузом. На верхней части шара установлен стержень со шкалой, на которой нанесено 10 делений. Каждое деление разбито на 10 частей. Под нулем стоит цифра 100. К спиртомеру приложен комплект позолоченных гирек (см. рис. 36). Все восемь гирек имеют номер спиртомера и вписаны в его паспорт. Масса гирек различна. Гирьки имеют условные цифровые обозначения 20, 30, 40,…, 90. Масса их уменьшается с увеличением цифрового обозначения. Металлическим спиртомером замеряют крепость спирта в пределах от 33 до 99,9 объемн. % [c.152]
Значения АН, AS и АО реакции зависят не только от природы реагирующих веществ, но и от их агрегатного состояния ti концентраций. Для получения сравнимых данных, характеризующих различные реакции, сопоставляют стандартные из.ченения энтальпии ДН,, энтропии AS и энергии Гиббса АО , т.е. такие их изменения, которые происходят, когда все вещества, участвующие в реакции (как исходные, так и образующиеся), находятся в стандартных состояниях, нижний индекс в приведенных обозначениях указывает абсолютную температуру, при которой осуществляется процесс. [c.30]
Используемые в дальнейшем изложении и расчетах обозначения концентраций вещества А в веществе В, выраженных различными способами, приведены в таблице 1,9, а в таблице 1.10 представлены формулы для пересчета концентраций вещества А в жидкой фазе. Формулы справедливы и для газовой фазы с заменой обозначения х на у . В формулах таблицы 1.10. М , М , обозначают мольные массы веществ А, В и их смеси, кг/моль, при этом мольная масса смеси определяется по правилу аддитивности (например, по жидкой фазе [c.55]
При использовании ступенчатых фильтров к одной линии относится несколько гомологических концентраций. Их можно легко пересчитать по отношению величин пропускания ступенек фильтра. Если имеет место равенство интенсивностей линий для различных ступенек фильтра, то это отмечено в таблицах римскими цифрами после обозначения длины волны. [c.647]
Соотношения между различными способами обозначения концентраций О. В. выражаются следующими формулами [c.18]
Одним из упрощающих предположений модели является равномерное мгновенное (по сравнению с продолжительностью расчетных интервалов времени) перемешивание всех примесей. Тогда, принимая во внимание различный физический смысл введенных обозначений и концентрации этих примесей в водохранилищах [c.376]
Термодинамические величины, относящиеся к биохимическим реакциям, рассматриваются несколько иначе, чем в случае обычных реакций. Как правило, пренебрегают тем, что реагирующие вещества и продукты реакции существуют в виде смесей разнообразных молекулярных форм, соответствующих разным степеням ионизации и комплексо-образования, и используют один символ для обозначения суммарной концентрации различных форм вещества. Например, реакцию гидролитического превращения аденозинтрифосфата (рис. 7.3) в аденозинди-фосфат и неорганический фосфат обычно изображают так [c.223]
Гораздо больший интерес представляет количественный способ выражения концентрации растворов. Учитывая то, что количества растворенного вещества и растворителя могут измеряться в единицах массы или объема, а также в молях и что растворы представляют интерес не только для химии, но и для физики, нетрудно понять, почему существует столько различных способов описания их концентрации. Один из наиболее простых методов выражения концентрации основан на указании процентного состава раствора. Состав может определяться в весовых или объемных процентных долях, что делает понятными такие, например, обозначения, как 10вес.%или 10об.%. Чаще всего указывают состав в весовых процентах. Например, нетрудно подсчитать, что в 100 г 10 вес.%-ного раствора сахара в воде содержится 10 г сахара и 90 г воды. Для растворов спирта нередко применяется выражение состава в процентах веса к объему. [c.203]
А — логарифм коэффициента активности В — концентрация электролитов 1 тз. 2 — обозначения электролитов а, б, в, г — различные коэффициенты активности и концентрации электролитов (см. текст) [c.97]
В табл. Н.7 приведены некоторые данные [361] по величинам зацеплений, определенные различными методами. В табл. Н.7 имеются такие обозначения V — вязкость, Т2 — поперечное время релаксации из данных ЯМР, Е — модуль Юнга, 2 релаксационный модуль, соответствующий области каучукоподобного состояния, О — модуль сдвига, / — податливость при сдвиге, / — упругая податливость при сдвиге, /»—-податливость потерь при сдвиге, с — концентрация раствора, б — фазовый угол между напряжением и деформацией, V — объемная. доля полимера. О — упругий модуль сдвига, 0(/) — псевдоравновесный модуль сдвига, О—податливость при растяжении, АЯ — энергия образования зацеплений, Н—спектр времен релаксации при сдвиге. [c.205]
Работу следует начинать с установки осветителя. Для этого готовят два эталонных раствора с различными концентрациями, вставляют столбики в пазы, имеющиеся на пластинке 7, укрепленной перпендикулярно кювет-ному столику, и вдвигают их до упора. Обе кюветы наполняют окрашенным раствором одной и той же концентрации и, поставив столбики в самое верхнее положение, вставляют кюветы в прибор, вдвигая их сбоку в пазы, имеющиеся на кюветном столике прибора 75 при этом следует обращать внимание на обозначения, имеющиеся на кюветах (левая и правая). Опускают столбики в кюветы, вращая винты 8, и устанавливают оба на одной и той же высоте (например, ка деление 20). Одев кожух 9 и включив лампу прибора через трансформатор, наблюдают освещенность полей окуляра, уравнивая ее поворотом патрона лампы 10 вокруг оси. После того как уравняют таким образом освещенность полей окуляра по раствору одной концентрации, делают ту же сам чо проверку установки лампы по раствору другой концентрацни, наполнив им обе кюветы и установив оба столбика опять на одной и той же высоте. Смену раствора в кюветах и любую другую операцию, требующую выдвижения кювет из прибора или столбиков из пазов, в которых они к р е п л е н ы, н е о б х о д и м о производить только при поднятых вверх до отказа столбиках. [c.75]На рис. 3 приведен график, характеризующий зависимость глубины окисления указанных образцов от концентрации различных сераорганических соединений, выраженной содержанием серы. На ломаной а обозначен минимум, соответствующий сумме фракций, в которых последней является фракция с п о= 1,56 и содержанием серы 0,52%. Дальнейшее прибавление узких содержащих серу фракций влечет за собой последовательное, но неравномерное увеличение окисляемости образцов. Так, например, окисляемость сравнительно мало изменяется при прибавлении узких фракций с п 1,55 1,59 но очень быстро меняется при прибав- [c.498]
Величина, обозначенная в уравнении (39) через [Р], представляет собой сумму концентраций различных — протонированных и непротонированных — фЬрм красителя, не связанного с металлом [c.85]
В зависимости от принятых единиц концентрации константа т выражается различными величинами. Для обозначения единиц концентрации будем писать эту константу с двумя индексами, из которых первый относится к единицам концентрации газовой фазы, а второй—к единицам концентрации жидкой фазы. Так, величина означает, что концентрация газа выражена в мольных долях у, а концентрация жидкости—в мольных долях х. Если концентрации обеих фаз выражены в величинах С (кмоль1м ) или С кг1м , будем ограничиваться одним индексом, т. е. писать тс или т — Таким образом, можно написать [c.23]
В зависимости от области применения моторные масла подразделяют иа группы (табл. 54). При этом маслам для карбюраторных двигателей присваивают индекс 1, а для дизелей — 2. Уии-версалы1ые масла, предназначенные для использования как в дизелях, так и в карбюраторных двигателях одного уровня форсирования, индекса в обозначении не имеют. Масла различных групп отличаются концентрацией и эффективностыо введешых присадок. [c.174]
Изотерма сорбции определяет (при различных концентрациях) равновесное отношение доли сорбированного растворенного вещества к доле, оставшейся в подвижной фазе. Равновесие зависит от температуры в случае адсорбционно11 и ионообменной (или лигандообменной) хроматографии при повышении температуры равновесие обычно смещается в сторону подвижной фазы. Отношение равновесных концентраций вещества в неподвижной и подвижной фазах называют коэффициентом распределения К. Отношением количеств (а не концентраций) между двумя фазами определяется величтш к. В колоночной жидкостной хроматографии для обозначения этой величины использовали термин «коэффициент емкости», а в последнее время «фактор удерживания» к. Это важнейший параметр, от которого зависит степень удерживания. Величины Кик пропорциональны (коэффициентом пропорциональности является фазовое отношение). (См. более подробное обсуждение в разд. III, Б. 2.) [c.146]
Различные рассмотренные фазовые равновесия и переходы в системах полимер — растворитель можно изобразить схематически, как это показано на рис. 30. Процесс 1 представляет собой обычное плавление или кристаллизацию полимеров, сопровождаемую конфор-мационными изменениями. При этом аморфная фаза III может содержать или не содержать растворитель, но состояние I всегда будет соответствовать чистой кристаллической фазе. Переход этой категории был рассмотрен на стр. 47 и 56. Образование изотропного разбавленного раствора П, в котором молекулы сохраняют конформационные характеристики кристаллического состояния /, обозначено как процесс 2. Его можно также рассматривать как обычное растворение, но с сохранением молекулярной конформации, в отличие от процесса 1. Обратный процесс представляет собой образование чистой упорядоченной фазы из разбавленного раствора анизотропных молекул. Переход спираль — клубок обозначен как процесс 3. Разбавленная тактоидная фаза / образуется из разбавленной изотропной фазы в результате процесса 2 при незначительном увеличении концентрации полимера. [c.74]
В отсутствие равновесия в термодинамической системе протекают различные процессы, интенсивность которых характеризуется плотностями потоков экстенсивных величин (потоков массы, теплоты, заряда, энтропии и т. д.). Плотность потока — это количество вещества, заряда и т. д., переносимое за единицу времени через единицу площади в нормальном к ней направлении. При небольшом отклонении от равновесия поток любой величины пропорционален всем движущим силам (градиентам интенсивных параметров или обобщенных сил Х ) — градиенту давления, концентрации, температуры, электрического потенциала и т. д. 7/ = ЪаисХ),. Величины этого уравнения называются феноменологическими кинетическими коэффициентами. Суммирование без указания его пределов проводится, согласно принятым в математике обозначениям, по всем величинам с повторяющимся индексом, т. е. по всем обобщенным силам. [c.612]
В, образуя твердый раствор, обозначенный 5в(а) (твердый раствор на основе структуры компонента В) в пределах концентраций от нуля (точка В) до точки gl. Таким образом, точки и й ] определяют собой предельные концентрации твердых растворов. Однофазные дивариантные области твердых растворов 5д(в) и 5в(д> на диаграмме заштрихованы. В пределах концентраций между точками g и твердые растворы между компонентами А и В не образуются (разрыв непрерывности), т. е. чистые компоненты не обладают способностью к взаимной растворимости в таких соотношениях. В области kgglk также устойчивы только твердые растворы (поскольку в системе, представленной данной диаграммой, компоненты во всех случаях выпадают не в чистом виде из двухкомпонентных расплавов, а в виде твердых растворов), но их составы, которые выражаются точками бинодальных кривых gk и g k лежат левее точки g или правее точки Нужно также подчеркнуть, что в отличие от системы с непрерывным рядом твердых растворов в рассматриваемой системе существует не один, а два различных твердых раствора различного структурного типа один 5д(В) на основе структуры компонента А и другой 5в(Л) на основе структуры компонента В. [c.232]
Химический состав сталей соответствует стандартам, обозначаемым для различных стран-производителей следующим образом ГОСТ — Россия (или СССР) А181 — США В.8. — Великобритания А.Г.К.О.К. — Франция ВШ — Германия (ФРГ) 818 — Швеция, М82 — Венгрия С8К — Чехия (Чехословакия). Для обозначения химического (марочного) состава сталей согласно отечественной классификации используется цифровое и буквенное обозначение. Каждому из легирующих элементов присвоена определенная буква русского алфавита X — Сг Н — N1 М — Мо Г — Мп Ю — А1 Ф — С — 81 Т — Т1 Д — Си Б — КЬ А — N. За буквой, обозначающей химический элемент, следует одно- или двузначное целое число, соответствующее концентрации легирующего элемента в массовых %. Первая цифра аббревиатуры, обозначающей марку стали, соответствует концентрации углерода в сотых долях масс. %. [c.183]
Здесь X — переносчик водорода трифосфопиридиннуклеотид (ТПН) l — углекислый газ остальные символы — различные сахаристые вещества, причем буква С используется как вместо химического символа, так и для обозначения концентрации. Реакции (III—V) считаются обратимыми и для них используются условия химического равновесия. Выразив все концентрации, кроме Сз и Сб дри помощи этих условий и приняв за постоянные некоторые концентрации, для которых получаются очень низкие степени, Чернавская и Чернавский приходят к следующей приближенной системе кинетических уравнений [c.445]
chem21.info
Обозначение — концентрация — Большая Энциклопедия Нефти и Газа, статья, страница 1
Обозначение — концентрация
Cтраница 1
Обозначение концентрации, стоящее в левой части уравнения, не имеет индекса, поскольку в качестве вещества можно взять любое, в силу того что изменение концентрации всех реагентов связано между собой стехиометрическим соотношением. [1]
Обозначения концентраций в % объемн. [3]
Обозначение концентрации, стоящее в левой части уравнения, не снабжено индексом, поскольку в качестве вещества можно взять любое, в силу того, что изменение концентрации всех реагентов связано между собой стехиометрическим соотношением. [4]
Обозначение концентрации, стоящее в левой части уравнения, не имеет индекса, поскольку в качестве вещества можно взять любое, в силу того, что изменение концентрации всех реагентов связано между собой стехиометрическим соотношением. [5]
Обозначения концентраций в % объемн. [7]
Обозначение концентрации алмазов условное, так как при100 % — ной концентрации собственно алмазы занимают 25 % объема, а остальные 75 % объема приходятся на связку и наполнитель. [8]
Для обозначения концентрации применяется следующее правило. Выражение соляная кислота ( 1 3) означает, что в 2 см3 воды растворен 1 см3 соляной кислоты. Указание концентрации растворов твердых реактивов в процентах означает безводное количество данного вещества в граммах, содержащееся в 100см3 раствора. [9]
Для обозначения концентрации газов ( например, при подмешивании их к воздуху) принято несколько выражений. [10]
Относительно обозначения концентраций перекиси водорода в объемных процентах см. Chem. По чистоте различают технические сорта и сорта, применяемые для медицинских целей и в химических лабораториях. [11]
При обозначении концентрации допускается вместо С вписывать изображение химическую формулу измеряемого или регулируемого вещества. [12]
Этот способ обозначения концентрации имеет ряд преимуществ перед другими способами обозначения концентрации растворов. [13]
Итак, вместо обозначения концентрации водородных ионов числом 10 с тем или иным отрицательным показателем степени Соран-сен предложил выражать концентрацию водородных ионов просто показателем степени, отбрасывая стоящий перед ним знак минус. [14]
Страницы: 1 2 3 4
www.ngpedia.ru
